PEMANFAATAN KITOSAN DARI CANGKANG
BEKICOT (Achatina fulica) SEBAGAI PENGAWET
IKAN KEMBUNG (Rastrelliger sp) DAN IKAN LELE
(Clarias batrachus)
SKRIPSI
Oleh
100405009
SARI WAHYU WARYANI
DEPARTEMEN TEKNIK KIMIA
FAKULTAS TEKNIK
PEMANFAATAN KITOSAN DARI CANGKANG
BEKICOT (Achatina fulica) SEBAGAI PENGAWET
IKAN KEMBUNG (Rastrelliger sp) DAN IKAN LELE
(Clarias batrachus)
SKRIPSI
Oleh
100405009
SARI WAHYU WARYANI
SKRIPSI INI DIAJUKAN UNTUK MELENGKAPI SEBAGIAN
PERSYARATAN MENJADI SARJANA TEKNIK
DEPARTEMEN TEKNIK KIMIA
FAKULTAS TEKNIK
PERNYATAAN KEASLIAN SKRIPSI
Saya menyatakan dengan sesungguhnya bahwa skripsi dengan judul :
PEMANFAATAN KITOSAN DARI CANGKANG BEKICOT (Achatina fulica) SEBAGAI PENGAWET IKAN KEMBUNG (Rastrelliger sp) DAN IKAN LELE
(Clarias batrachus)
Yang dibuat untuk melengkapi sebagian persyaratan menjadi Sarjana Teknik pada
Departemen Teknik Kimia, Fakultas Teknik, Universitas Sumatera Utara, sejauh
yang saya ketahui bukan merupakan tiruan atau duplikasi dari skripsi yang sudah
dipublikasikan dan atau pernah dipakai untuk mendapatkan gelar kesarjanaan di
lingkungan Universitas Sumatera Utara maupun di Perguruan Tinggi atau instansi
manapun, kecuali bagian yang sumber informasinya dicantumkan sebagaimana
mestinya.
Medan, Februari 2015
PRAKATA
Segala puji syukur penulis hadiahkan kehadirat Allah SWT atas segala rahmat dan
karunia-Nya sehingga skripsi ini dapat diselesaikan. Tulisan ini merupakan skripsi
dengan judul “Pemanfaatan Kitosan Dari Cangkang Bekicot (Achatina Fulica) Sebagai Pengawet Ikan Kembung (Rastrelliger Sp) dan Ikan Lele (Clarias Batrachus)” berdasarkan hasil penelitian yang penulis lakukan di Departemen Teknik Kimia, Fakultas Teknik, Universitas Sumatera Utara
Skripsi ini merupakan salah satu syarat untuk mendapatkan gelar sarjana teknik.
Hasil penelitian ini:
• Penelitian ini membantu pengolahan limbah cangkang bekicot (Achatina Fulica) sehingga mengurangi pencemaran terhadap lingkungan.
• Penelitian ini memberikan sumbangan ilmu pengetahuan tentang alternatif pengawet alami, yaitu kitosan.
• Penelitian ini pernah dipublikasikan dalam Jurnal Teknik Kimia USU dengan judul “Pemanfaatan Kitosan Dari Cangkang Bekicot (Achatina Fulica) Sebagai Pengawetan Ikan Kembung (Rastrelliger Sp) dan Ikan Lele (Clarias Batrachus)”. Selama melakukan penelitian sampai penulisan skripsi ini, penulis banyak mendapat
pengarahan dan bimbingan dari dosen pembimbing penulis. Untuk itu secara khusus
penulis mengucapkan terimakasih dan penghargaan yang sebesar – besarnya kepada
ibu Farida Hanum, ST, MT.
Penulis menyadari bahwa skripsi ini masih jauh dari sempurna, oleh karena itu
penulis mengharapkan saran dan masukan demi kesempurnaan skripsi ini. Semoga
skripsi ini memberikan manfaat bagi pengembangan ilmu pengetahuan.
Medan, Februari 2015
Penulis,
DEDIKASI
Penulis mendedikasikan skripsi ini kepada :
1. Kedua orang tua penulis Ayahanda Anwar Achmad dan Ibunda Sri Mulyani
yang sangat banyak memberikan dukungan moril maupun bantuan materil
bagi penulis dalam segala hal.
2. Keluarga yang telah membantu penulis dalam menyelesaikan penelitian dan
penulisan skripsi ini.
3. Ibu Farida, ST, MT. yang telah membimbing penulis dalam menyelesaikan
penelitian dan penulisan skripsi ini.
4. Staf Pengajar Fakultas Teknik Departemen Teknik Kimia Universitas
Sumatera Utara Medan.
5. Para pegawai administrasi Departemen Teknik Kimia, Fakultas Teknik,
Universitas Sumatera Utara.
6. Partner penelitian, Rika Silvia yang telah bekerja sama dalam memberikan
pengarahan skripsi ini.
7. Kak Nila Sartika Simanjuntak, Kak Sri Widya Astuti, dan Kelvin Hadinatan
yang telah membantu mulai dari mengarahkan sebelum penelitian hingga
selesai penelitian dan penulisan skripsi.
8. Sahabat-sahabat terbaik di Teknik Kimia, khususnya semua stambuk 2010
RIWAYAT HIDUP PENULIS
Nama : Sari Wahyu Waryani
Nim : 100405009
Tempat/ tgl lahir : Medan, 14 Oktober 1992
Nama orang tua : Anwar Achmad
Alamat orang tua : Jl. Cempaka G. Teratai No.1 Medan
Helvetia 20125
Asal sekolah
•
SD Swasta PAB Medan tahun 1998 – 2004•
SMP Negeri 40 Medan tahun 2004 – 2007•
SMA Swasta Kartika I-2 Medan tahun 2007 - 2010 Beasiswa yang pernah diperoleh :•
Bidik Misi 2010 – 2014 Pengalaman organisasi/ kerja :•
Covalen Studi Grup (CSG) 2012-2013 sebagai anggota Bidang Dakwah•
Himatek periode 2013 – 2014 sebagai anggota Bidang Bakat dan Minat•
Asisten Lab. Proses Industri Kimia 2013 - 2015Artikel yang telah dipublikasi dalam jurnal/ pertemuan ilmiah:
ABSTRAK
Penggunaan senyawa anti mikroba yang tepat dapat memperpanjang umur simpan suatu produk serta menjamin keamanan produk. Untuk itu dibutuhkan bahan sebagai anti mikroba yang alami supaya tidak membahayakan bagi kesehatan. Penggunaan kitosan untuk menghambat aktivitas mikroba pada ikan kembung (Rastrelliger sp) dan ikan lele (Clarias batrachus) diuji efektivitasnya. Pada penelitian ini kitosan yang digunakan sebagai anti mikrobia diekstraksi dari cangkang rajungan bekicot (Achatina fullica). Kitin dan kitosan yang berhasil diekstraksi dikarakteristik hasilnya meliputi pengujian kadar air, kadar abu, dan Derajat Deasetilasi. Kitosan setelah dikarakteristik, digunakan sebagai anti mikrobia ikan kembung (Rastrelliger sp) dan ikan lele (Clarias batrachus). Kitosan dilarutkan dalam asam asetat 1% dengan konsentrasi kitosan bervariasi 1%, 1,5%, 2%, dan 2,5%. Lama waktu penyimpanan ikan bervariasi 0 jam, 10 jam, 15 jam, 20 jam, dan 25 jam. Hasil penelitian kitosan berbentuk serbuk, kadar air 5,07%, kadar abu 1,8% serta derajat deasetilasi yakni sebesar 75,13%. Berdasarkan hasil analisa, hasilnya menunjukkan bahwa konsentrasi kitosan maksimum pada ikan kembung (Rastrelliger sp) dan ikan lele adalah 1,5% (Clarias batrachus) dan perlakuan dengan cara perendaman merupakan perlakuan yang terbaik. Penggunaan larutan kitosan pada ikan kembung (Rastrelliger sp) bertahan 20 jam sedangkan ikan lele (Clarias batrachus) bertahan 15 jam.
ABSTRACT
The use of appropriate anti-microbial compounds can extend the shelf life of a product as well as ensure the safety of the product. That requires a material that is naturally anti-microbial so as not harmful to health. The use of chitosan to inhibit microbial activity on mackerel (Rastrelliger sp) and catfish (Clarias batrachus) to test it's effectiveness. In this research chitosan that used as an anti-microbial extracted from the shells of snail (Achatina Fulica). Chitin and chitosan that were successfully extracted were characterized it's results includes moisture content testing, ash content, and Degrees of deacetylation. Characterized chitosan, were used as an anti-microbial mackerel (Rastrelliger sp) and catfish (Clarias batrachus). Chitosan was dissolved in 1% acetic acid with varying concentrations of chitosan as 1%, 1.5%, 2%, and 2.5%. The storage time of fish varies from 0 hours, 10 hours, 15 hours, 20 hours, and 25 hours. The results of research chitosan form as granules / powder, 5,07% moisture content, ash content 1,8% and the degree of deacetylation which amounted to 75,13%. Based on the analysis, the results showed that the maximum concentration of chitosan on mackerel (Rastrelliger sp) and catfish (Clarias batrachus) is 1,5% and treatment by means of immersion is the best treatment. The use of chitosan solution on mackerel (Rastrelliger sp) survived 20 hours while catfish (Clarias batrachus) survived 15 hours.
DAFTAR ISI
Halaman
PERNYATAAN KEASLIAN SKRIPSI i
PENGESAHAN ii
PRAKATA iii
DEDIKASI iv
RIWAYAT HIDUP PENULIS v
ABSTRAK vi
ABSTRACT vii
DAFTAR ISI viii
DAFTAR GAMBAR xi
DAFTAR TABEL xii
DAFTAR LAMPIRAN xiii
DAFTAR SINGKATAN xiv
DAFTAR SIMBOL xv
BAB I PENDAHULUAN 1
1.1 LATAR BELAKANG 1
1.2 PERUMUSAN MASALAH 3
1.3 TUJUAN PENELITIAN 3
1.4 MANFAAT PENELITIAN 4
1.5 RUANG LINGKUP PENELITIAN 4
BAB II TINJAUAN PUSTAKA 5
2.1 CANGKANG BEKICOT (Achatina fulica) 5
2.2 KITIN DAN KITOSAN 6
2.3 PROSES ISOLASI KITIN DAN KITOSAN 8
2.4 FAKTOR YANG MEMPENGARUHI KITOSAN 11
2.5 PEMBUSUKAN IKAN 12
2.5.1 Tanda-Tanda Kerusakan yang Terjadi Pada Ikan 13
2.5.2 Faktor Lain yang Berperan dalam Pembusukan (Perubahan yang
Bersifat Enzimatis, Mikrobiologis maupun Fisis) 13
2.5.3 Parameter Fisika Ikan Pada Kesegaran Ikan 14
2.5.4.1 Perubahan pre rigor mortis 16
2.5.4.2 Perubahan rigor mortis 16
2.5.4.3 Perubahan post rigor 17
2.5.5 Upaya Pengendalian Pertumbuhan Bakteri 18
2.6 PENGAWETAN IKAN 19
2.6.1 Bakteri 20
2.6.1.1 Pengertian Bakteri 20
2.6.1.2 Sumber Pencemar 21
2.6.2 Faktor-Faktor Yang Mempengaruhi Pertumbuhan Bakteri 21
2.6.3 Mekanisme Kerja Pengawet Atau Antimikroba 23
2.7 ANALISA EKONOMI 25
BAB III METODOLOGI PERCOBAAN 27
3.1 LOKASI DAN WAKTU PENELITIAN 27
3.2 BAHAN DAN PERALATAN 27
3.2.1 Bahan Penelitian 27
3.2.2 Peralatan Penelitian 27
3.3 PROSEDUR PENELITIAN 28
3.3.1 Persiapan Sampel 28
3.3.2 Pembuatan Kitin 28
3.3.2.1 Deproteinasi 28
3.3.2.2 Demineralisasi 28
3.3.3 Deasetilasi 28
3.3.4 Karakterisasi Kitosan 28
3.3.4.1 Analisa Kadar Air 28
3.3.4.2 Analisa Kadar Abu 29
3.3.4.3 Analisa Derajat Deasetilasi 29
3.3.5 Pemanfaatan Kitosan Sebagai Pengawetan Ikan 30
3.3.6 Analisa Ikan Segar 30
3.3.6.1 Analisa pH 30
3.3.6.2 AnalisaTotal Volatile Bases (TVB) 30
3.4 FLOWCHART PENELITIAN 31
3.4.2 Pembuatan Kitin 32
3.4.2.1 Deproteinasi 32
3.4.2.2 Demineralisasi 33
3.4.3 Deasetilasi 34
3.4.4 Karakterisasi Kitosan 35
3.4.3.1 Analisa Kadar Air 35 3.4.3.2 Analisa Kadar Abu 35 3.4.5 Proses Pengawetan Ikan 36
3.4.6 Analisa Ikan Segar 36
3.4.6.1 Analisa pH 36
3.4.6.2 AnalisaTotal Volatile Bases (TVB) 37
BAB IV HASIL DAN PEMBAHASAN 38
4.1 KARAKTERISASI KITOSAN 38
4.2 KARAKTERISASI IKAN HASIL PENGAWETAN 39
4.2.1 Analisa TVB (Total Volatile Base) 39 4.2.1.1 Perubahan TVB pada Ikan Kembung 40 4.2.1.2 Perubahan TVB pada Ikan Lele 42
4.2.2 Derajat Keasaman (pH) 43
4.2.2.1 Perubahan pH pada Ikan Kembung 44 4.2.2.2 Perubahan pH pada Ikan Lele 45
4.2.3 Uji Organoleptik 46
4.2.3.1 Perubahan organoleptik pada Ikan Kembung 47 4.2.3.2 Perubahan organoleptik pada Ikan Lele 48
BAB V KESIMPULAN DAN SARAN 50
5.1 KESIMPULAN 50
5.2 SARAN 50
DAFTAR PUSTAKA 51
DAFTAR
GAMBAR
Halaman
Gambar 2.1 Anatomi Bekicot (Achatina fulica) 6
Gambar 2.2 Struktur Kimia Kitin 6
Gambar 2.3 Struktur Kimia Kitosan 7
Gambar 2.4 Reaksi Deproteinasi 9
Gambar 2.5 Reaksi Demineralisasi 9
Gambar 2.6 Reaksi Deasetilisasi Kitin Menjadi Kitosan 10
Gambar 3.1 Flowchart Persiapan Sampel 31
Gambar 3.2 Flowchart Deproteinasi 32
Gambar 3.3 Flowchart Demineralisasi 33
Gambar 3.4 Flowchart Deasetilasi 34
Gambar 3.5 Flowchart Analisa Kadar Air 35
Gambar 3.6 Flowchart Analisa Kadar Abu 35
Gambar 3.7 Flowchart Proses Pengawetan Ikan 36
Gambar 3.8 Flowchart Analisa pH pada ikan segar 36
Gambar 3.9 Flowchart Analisa Total Volatile Bases (TVB) pada Ikan Segar 37 Gambar 4.1 Perubahan nilai TVB pada ikan kembung (Rastrelliger sp) dengan
Direndam dan Disemprot 40
Gambar 4.2 Perubahan nilai TVB pada ikan lele (Clarias batrachus) dengan
Direndam dan Disemprot 42
Gambar 4.3 Perubahan nilai pH pada ikan kembung (Rastrelliger sp) dengan
Direndam dan Disemprot 44
Gambar 4.4 Perubahan nilai pH pada ikan lele (Clarias batrachus) dengan
Direndam dan Disemprot 45
Gambar 4.5 Perubahan nilai organoleptik pada ikan kembung (Rastrelliger sp) dengan Direndam dan Disemprot 47
DAFTAR
TABEL
Halaman
Tabel 1.1 Penelitian - Penelitian Sebelumnya 2
Tabel 2.1 Beberapa Organisme yang Mengandung Kitin 5
Tabel 2.2 Syarat – Syarat Kitosan komersil 8
Tabel 2.3 Kriteria Ikan Segar dan Ikan busuk 15
Tabel 4.1 Perbandingan Parameter Standar Mutu Kitosan dengan Hasil
Penelitian 38
DAFTAR LAMPIRAN
Halaman
LAMPIRAN 1 DATA PENELITIAN 56
1.1 Contoh Lembar Penilaian Organoleptik Ikan Segar 56
1.2 Data Penilaian Organoleptik Ikan Segar (Ikan Kembung) Sebelum
Pengawetan 58
1.3 Data Penilaian Organoleptik Ikan Segar (Ikan Lele) Sebelum Pengawetan 61
1.4 Data Analisa pH dan TVB pada Ikan Segar Sebelum Pengawetan 63
1.5 Data Analisa pH dan TVB pada Ikan Segar 64
1.6 Data Penilaian Organoleptik Ikan Segar (Ikan Kembung) dengan
Perlakuan Direndam 65
1.7 Data Penilaian Organoleptik Ikan Segar (Ikan Kembung) dengan
Perlakuan Disemprot 68
1.8 Data Penilaian Organoleptik Ikan Segar (Ikan Lele) dengan Perlakuan
Direndam 71
1.9 Data Penilaian Organoleptik Ikan Segar (Ikan Lele) dengan Perlakuan
Disemprot 74
1.10 Hasil Uji Analisa FT-IR 77
1.11 Perhitungan Derajat Deasetilasi Kitosan dari Cangkang Bekicot 78
LAMPIRAN 2 CONTOH PERHITUNGAN
2.1 Kadar Air 79
2.2 Kadar Abu 79
2.3 Derajat Deasetilasi 79
2.4 Analisa TVB-N 80
LAMPIRAN 3 DOKUMENTASI
3.1 Persiapan Sampel 81
3.2 Pembuatan Kitin 81
3.3 Karakterisasi Kitosan 82
DAFTAR SINGKATAN
SK Surat Keputusan
Menkes Menteri Kesehatan
RI Republik Indonesia
FDA Food and Drugs Administration
TVB-N Total Volatile Base - Nitrogen
pH Power of Hydrogen
ATP Adenosin Trifosfat
RNA RiboseNucleic Acid
DNA Deoxyribo Nucleic Acid
FT-IR Fourier Transform – InfraRedSpectroscopy
DAFTAR SIMBOL
Simbol Keterangan Dimensi
B Berat sampel Gram
B1 Berat (sampel + cawan) sebelum dikeringkan Gram
B2 Berat (sampel + cawan) setelah dikeringkan Gram
VHCl Titrasi sampel ml
Vblanko Titrasi blanko ml
BAB I
PENDAHULUAN
1.1 LATAR BELAKANG
Ikan merupakan produk pangan yang sangat mudah rusak. Pembusukan ikan
terjadi setelah ikan ditangkap atau mati. Pada kondisi suhu tropik, ikan membusuk
dalam waktu 12-20 jam tergantung spesies, alat atau cara penangkapan. Pendinginan
akan memperpanjang masa simpan ikan. Pada suhu 15-20oC, ikan dapat disimpan
hingga sekitar 2 hari, pada suhu 5oC tahan selama 5-6 hari, sedangkan pada suhu 0oC
dapat mencapai 9-14 hari, tergantung spesies ikan [1].
Penggunaan formalin sebagai pengawet bahan pangan diduga karena tingkat
kesadaran produsennya akan kesehatan masyarakat masih sangat rendah, disamping
mereka tidak mempunyai pengetahuan yang memadai mengenai bahaya bahan kimia
terlarang tersebut. Formalin sangat mudah dijumpai di pasar bebas dengan harga
yang murah. Baik formalin maupun boraks merupakan bahan kimia yang sangat
berbahaya bagi kesehatan manusia [48]. Salah satu alternatif pengganti formalin
sebagai pengawet makanan adalah penggunaan kitosan yang lebih aman dan tidak
berefek negatif terhadap kesehatan tubuh. Kitosan dapat berfungsi sebagai bahan
pengawet karena mempunyai sifat anti bakteri [2;49].
Sesuai SK Menkes RI No. 722 th 1988 tentang Bahan Tambahan Makanan,
yang dimaksud bahan pengawet adalah bahan tambahan makanan yang mencegah
atau menghambat fermentasi pengasaman atau peruraian lain terhadap makanan yang
disebabkan oleh mikroorganisme. Menurut Food and Drugs Administration (FDA), keamanan suatu pengawet makanan harus mempertimbangkan jumlah yang mungkin
dikonsumsi dalam produk makanan atau jumlah zat yang akan terbentuk dalam
makanan dari penggunaan pengawet [3].
Adapun beberapa hasil penelitian kitosan, dan aplikasinya dapat dilihat pada
Tabel 1.1 Penelitian – Penelitian Sebelumnya
Referensi/Judul Hasil
Mahatmanti, dkk., 2011/Sintesis kitosan dan pemanfaatannya sebagai anti mikrobia ikan segar. [1]
1. Kitosan dapat dimanfaatkan sebagai anti mikrobia ikan segar. 2. Hasil uji mikroba menunjukkan
bahwa perlakuan dengan menggunakan larutan kitosan 1% pada ikan nila selama 10 jam (A1B1) yaitu sebesar 38.104 Sel/
mL adalah kondisi paling optimum. Swastawati, dkk., 2008/Pemanfaatan limbah
kulit udang menjadi “edible coating” untuk mengurangi pencemaran lingkungan. [4]
1. Kitosan mampu menghambat laju pertumbuhan bakteri sehingga dapat digunakan sebagai alternatif pengawet alami pada ikan layang pindang.
2. Pemanfaatan kulit udang menjadi “edible coating” kitosan bukan saja memberikan nilai tambah pada usaha pengolahan udang, akan tetapi juga dapat menanggulangi masalah pencemaran lingkungan yang ditimbulkan, terutama masalah bau yang dikeluarkan serta estetika lingkungan yang kurang bagus.
Sedjati, dkk., 2007/Studi penggunaan khitosan sebagai anti bakteri pada ikan teri (stolephorus heterolobus) asin kering selama penyimpanan suhu kamar. [5]
1. Larutan khitosan pada proses pengolahan ikan teri asin kering terbukti berfungsi sebagai anti bakteri.
2. Konsentrasi khitosan yang efektif untuk menekan pertumbuhan bakteri secara signifikan pada ikan teri asin kering selama penyimpanan suhu kamar, yaitu 0,5%.
Kusumaningsih, dkk., 2004/Pembuatan Kitosan dari Kitin Cangkang Bekicot (Achatina fulica). [24]
Hasil yang diperoleh dari penelitian yang telah dilakukan, diperoleh kitin cangkang bekicot yang dapat digunakan sebagai bahan dasar pembuatan kitosan dengan kadar rendemen kitosan sebesar 6,95%.
Alak, 2012/The Effect of Chitosan Prepared in Different Solvents on the Quality Parameters of Brown Trout Fillets (Salmo trutta fario). [7]
Cangkang bekicot (Achatina fullica) mengandung zat kitin sekitar 70% - 80% sedangkan dalam udang terdapat kitin sebanyak 15% - 20% dan rajungan 20% - 30%
[8].
Adanya penemuan formalin sebagai bahan pengawet pada ikan menimbulkan
citra yang buruk pada produk tersebut. Formalin ini selain digunakan sebagai bahan
pengawet juga untuk menghindari adanya belatung. Formalin ini tentu akan
merugikan konsumen karena berbahaya dan bersifat karsinogenik. Hal ini juga
merugikan produsen yang tidak menggunakan formalin karena konsumen jadi
enggan untuk membeli ikan. Kitosan sebagai bahan pengawet alami juga diketahui
dapat menghindari adanya belatung dan lalat pada ikan [9].
Oleh karena itu, peneliti memilih cangkang bekicot (Achatina fullica)
mengandung zat kitin lebih tinggi, dan kitosan diharapkan mampu memberikan
solusi bagi para pengolah ikan sehingga ikan yang mereka hasilkan akan lebih awet
dan aman untuk dikonsumsi.
1.2 PERUMUSAN MASALAH
Perumusan masalah dalam penelitian ini adalah sejauh mana proses pengawetan
ikan dengan pemanfaatan kitosan dari cangkang bekicot (Achatina fullica).
1.3 TUJUAN PENELITIAN
Adapun yang menjadi tujuan dari penelitian ini adalah:
1. Mengetahui kitosan sebagai alternatif pengawet yang alami sehingga tidak
membahayakan bagi kesehatan serta tidak merusak kualitas produk.
2. Mengetahui kondisi yang optimal pada konsentrasi kitosan dan waktu
penyimpanan sebagai pengawet yang dapat memperpanjang masa simpan ikan
segar.
3. Mengetahui bagaimana cara pemberian larutan kitosan terbaik sebagai
1.4 MANFAAT PENELITIAN
Manfaat dari penelitian ini antara lain:
1. Memberikan pengetahuan mengenai pemanfaatan limbah cangkang bekicot
menjadi bahan baku pembuatan kitosan dan aplikasinya dalam pengawetan ikan.
2. Memperoleh informasi mengenai pengaruh konsentrasi kitosan khususnya
terhadap proses pengawetan ikan.
3. Memberikan informasi bagi industri pengekspor ikan yang ingin menggunakan
kitosan sebagai pengawet.
4. Memberikan alternatif pengawet yang lebih alami atau lebih aman bagi
kesehatan.
1.5 RUANG LINGKUP PENELITIAN
Penelitian ini akan dilaksanakan di Laboratorium Proses Industri Kimia,
Departemen Teknik Kimia, Fakultas Teknik, Universitas Sumatera Utara, Medan.
Penelitian ini direncanakan memiliki ruang lingkup dan batasan sebagai
berikut:
1. Persiapan sampel yaitu cangkang bekicot.
2. Pembuatan Kitin.
3. Deasetilasi kitin menjadi kitosan.
4. Karakterisasi kitosan
5. Proses pengawetan ikan dengan kitosan [10]
Reaksi dilangsungkan dengan memvariasikan beberapa variabel seperti berikut :
- Konsentrasi kitosan : 1%; 1,5%; 2% dan 2,5%
- Waktu Penyimpanan : 10 jam, 15 jam, 20 jam dan 25 jam
- Cara pemberian larutan pengawetan ikan : direndam dan disemprot
- Jenis ikan yang diawetkan adalah ikan kembung (Rastrelliger sp) dan ikan lele (Clarias batrachus).
Analisis yang dilakukan pada kitosan adalah :
1. Analisa uji FTIR 3. Analisa kadar abu
2. Analisa kadar air 4. Derajat Deasetilasi
Analisis yang dilakukan pada ikan adalah :
BAB II
TINJAUAN PUSTAKA
2.1 CANGKANG BEKICOT (Achatina fulica)
Bekicot (Achatina fullica) merupakan hama bagi persawahan yang sering dimanfaatkan masyarakat sebagai pakan ternak, seperti itik. Bekicot menurut
jenisnya dapat dibedakan menjadi empat yakni; Achatina variegata, Achatina fullica, Helix pomatia dan Helix aspersa sedangkan dua jenis terakhir tidak ditemukan di Indonesia. Di Indonesia potensi bekicot rata - rata meningkat sebesar 7,4 persen per
tahun. Selain digunakan sebagai pakan ternak cangkangnya dapat digunakan sebagai
hiasan seperti gantungan kunci, tetapi tidak jarang cangkang bekicot di buang begitu
saja dan dibiarkan membusuk yang akhirnya akan menimbulkan dampak negatif bagi
lingkungan. Salah satu alternatif upaya pemanfaatan limbah cangkang bekicot agar
memiliki nilai dan daya guna limbah cangkang bekicot menjadi produk yang bernilai
ekonomis tinggi adalah pengolahan menjadi kitin dan kitosan [11].
Berikut akan dijelaskan beberapa organisme yang mengandung kitin, dapat dilihat
pada tabel berikut :
Tabel 2.1 Beberapa organisme yang mengandung kitin [8],[12].
Organisme Kitin (%) Organisme Kitin (%)
Snail 70-80 Pieris (butterfly) 64.0
Cancer (crab) 72.1 Bombyx (silk worm) 44.2
Carcinus (crab) 64.2 Galleria (wax worm) 33.7
Paralithodes (king crab) 35.0 Mollusks:
Callinectes (blue crab) 14.0 clam 6.1
Crangon and Pandalus (shrimp) 17–40 shell oysters 3.6
Alaska shrimp 28.0 squid pen 41.0
Nephro (lobster) 69.8 krill, deproteinized shells 40.2
Homarus (lobster) 60–75 Fungi:
Lepas (goose barnacle) 58.3 Aspergillus niger 42.0
Insects: Penicillium notatum 18.5
Periplaneta (cockroach) 2.0 Penicillium chrysogenum 20.1
Blatella (cockroach) 18.4 Saccharomyces cerevisiae 2.9
Coleoptera (ladybird) 27–35 Mucor rouxii 44.5
Adapun anatomi bekicot (Achatina fulica), dapat dilihat pada gambar berikut :
Gambar 2.1 Anatomi Bekicot (Achatina fulica) [13]
2.2 KITIN DAN KITOSAN
Kata kitin berasal dari bahasa Yunani, khiton yang berarti baju dari besi karena
sesuai dengan fungsinya sebagai jaket pelindung untuk hewan-hewan golongan
invertebrata. Kitin merupakan bagian konstituen organik yang sangat penting pada
kerangka hewan golongan arthropoda, molusca, nematoda, crustasea, beberapa kelas
serangga dan jamur [14].
Kitin merupakan senyawa penyusun rangka, terdiri atas satuan Asetil
Glukosamin yang berikatan (1 4) beta, seperti yang terlihat pada berikut :
Gambar 2.2 Struktur Kimia Kitin [16]
Menurut Cahyaningrum [15], kitin berbentuk kristal berwarna putih, tidak
encer dan pekat, alkohol dan pelarut organik lainnya yang bersifat polikationik. Kitin
merupakan polimer (1 4) -2-asetamido-2-deoksi-ß-Dglukosamin yang dapat
dicerna oleh manusia, sedangkan kitosan merupakan kitin yang dihilangkan gugus
asetilnya dengan menggunakan basa kuat. Kitosan memiliki lebih banyak kandungan
nitrogen dari pada kitin. Gugus amina dan hidroksil di dalam kitosan menjadikan
kitosan bersifat lebih aktif dan bersifat polikationik. Sifat tersebut dapat
dimanfaatkan sebagai koagulan logam berat [16].
Adapun struktur kimia kitosan, dapat dilihat pada gambar berikut :
Gambar 2.3 Struktur Kimia Kitosan [16]
Kitosan merupakan senyawa yang tidak larut dalam air, larutan basa kuat,
H2SO4, tetapi sedikit larut dalam HCl, HNO3, dan 0,5% H3PO4. Kitosan juga tidak
larut dalam beberapa pelarut organik seperti alkohol, tetapi kitosan larut dengan baik
dalam asam format berkonsentrasi (0,2-100) %. Kitosan tidak beracun dan memiliki
berat molekul sekitar 1,2 x 105 gram/mol, bergantung pada degradasi yang terjadi
selama proses deasetilasi.
Kitosan telah banyak dimanfaatkan dalam beragam industri, antara lain sebagai
agen penstabil rasa dalam industri makanan, bahan aditif untuk shampo dan
kosmetik, bahan anti bakteri, adsorben untuk penghilang logam berat dan pemurnian
air. Kitosan memiliki gugus amina, adanya unsur N menjadikan kitosan bersifat
sangat reaktif dan bersifat basa [17].
Kitosan adalah senyawa biopolimer yang diturunkan dari kitin, yaitu senyawa
dengan struktur homopolimer P-(1-4) Nacetyl- D-glucosamine. Kitin terdapat secara
luas pada hewan-hewan invetebrata di laut, serangga, jamur dan juga ragi. Umumnya
cangkang dari hewan laut mengandung 30-40% protein, 30-50% kalsium karbonat
dan kalsium fosfat, dan 20-30% kitin. Kitin terdapat pada hampir semua hewan laut
Kitin dan kitosan mempunyai struktur kimia yang sama. Kitin terdiri dari rantai
lurus asetil-glukosamin, sedangkan kitosan diperoleh melalui pemutusan gugus asetil
(CH3-CO). Proses pemutusan ini disebut dengan deasetilasi. Perbedaan utama antara
kitin dengan kitosan adalah kadungan asetil dari polimernya. Kitosan adalah turunan
kitin yang paling banyak kegunaannya [18].
Kitosan merupakan produk dari proses deasetilasi kitin yang memiliki sifat
unik. Penampilan fungsional kitosan ditentukan oleh sifat dan kimiawinya. Seperti
halnya dengan polisakarida lain, kitosan memiliki kerangka gula, tetapi dengan sifat
yang unik karena polimer ini memiliki gugus amin bermuatan positif. Sifat
fleksibilitas kitosan membantu daya gunanya di dalam berbagai produk. Sifat
reologis ini juga menjadikannya sensitif terhadap perubahan pH dan kekuatan ion
[19]. Adapun syarat-syarat kitosan yang telah disesuaikan untuk kitosan, dapat
dilihat pada tabel berikut :
Tabel 2.2 Syarat – syarat kitosan komersil (Protan Laboratories) dalam [20]
Parameter Nilai
Ukuran partikel Serpihan sampai serbuk
Kadar air ≤ 10%
Kadar abu ≤ 2%
Kadar nitrogen ≤ 5%
Warna Larutan Jernih
Derajat deasetilasi ≥ 70%
Viskositas (cps)
Rendah
Sedang
Tinggi
Ekstra tinggi
< 200 cps
200 – 799 cps
800 – 2000 cps
> 2000 cps
2.3 PROSES ISOLASI KITIN DAN KITOSAN
Isolasi kitin dilakukan secara bertahap. Tahap awal dimulai dengan pemisahan
protein dengan larutan basa, yang disebut dengan tahap deproteinasi. Deproteinasi
prosesnya tergantung pada konsentrasi NaOH yang digunakan, diperkirakan
reaksinya sebagai berikut [21].
Gambar 2.4 Reaksi Deproteinasi [21]
Tahap kedua yaitu demineralisasi. Tahap demineralisasi bertujuan untuk
memisahkan mineral organik yang terikat pada bahan dasar, yaitu CaCO3 sebagai
mineral utama dan Ca(PO4)2 dalam jumlah minor. Proses pemisahan diperkirakan
terjadi menurut reaksi berikut [21].
Tranformasi kitin menjadi kitosan disebut tahap deasetilasi, yaitu dengan
memberikan perlakuan dengan basa berkonsentrasi tinggi. Reaksi deasetilasi
bertujuan untuk memutuskan gugus asetil yang terikat pada nitrogen dalam struktur
senyawa kitin untuk memperbesar persentase gugus amina pada kitosan, adapun
reaksi yang terjadi adalah sebagai berikut [21].
2.4 FAKTOR YANG MEMPENGARUHI PRODUKSI KITOSAN
Faktor – faktor yang mempengaruhi pengolahan karakteristik fisikokimia
kitosan adalah :
1. Suhu deasetilasi
Suhu yang lebih tinggi cenderung meningkatkan derajat deasetilasi tetapi
mengurangi molekul ukuran. Ada hubungan substansial linier antara temperatur
(diplot sepanjang absis sebagai 1/T dalam K) dan tingkat deasetilasi (diplot
logaritmis sepanjang ordinat).
2. Waktu deasetilasi dan Konsentrasi Alkali
Wu dan Bough menyatakan deasetilasi yang berlangsung cepat sekitar 68%
selama 1 jam yang pertama dalam 50% larutan NaOH pada suhu 100oC. Namun,
reaksi berlangsung secara bertahap setelah mencapai sekitar 78% dalam 5 jam.
Dengan demikian, perlakuan alkali di atas 2 jam deasetilasi kitin secara signifikan
dapat merusak rantai molekul. Dalam sebuah studi konsentrasi dengan 35, 40, dan
50% NaOH sebagai konsentrasi alkali menurun, tingkat penurunan baik viskositas
dan distribusi berat molekul juga melambat. Dahan et al, menyinggung bahwa
kitosan deasetilasi selama 5 menit dengan 50% NaOH pada 145-150oC memiliki
viskositas yang lebih tinggi (1,7-16,4 kali lipat) dan berat molekul (1,1-1,8 kali lipat)
daripada kitosan deasetilasi selama 15 menit. Demikian pula, penurunan viskositas
dengan peningkatan waktu reaksi ditunjukkan dan dikonfirmasi.
3. Pengaruh Kondisi Pengolahan Aplikasi Isolasi Kitin
Kondisi pengolahan aplikasi isolasi kitosan terutama mempengaruhi viskositas
produk daripada properti lainnya. Madhavan Nair (1974) melaporkan bahwa
penggunaan HCl pada konsentrasi di atas 1,25 N terpengaruh viskositas produk
kitosan akhir. Selain itu, kitosan viskositas cenderung menurun dengan
meningkatnya waktu demineralisasi. Di sisi lain, Bough et al. menemukan bahwa
dengan deproteinisasi 3% NaOH, dan pemutusan langkah demineralisasi dalam
persiapan kitin, menurunkan viskositas sampel kitosan. Dimana Moorjani et al,
menunjukkan bahwa tidak diinginkan untuk pemutih pada setiap tahap sejak
4. Atmosfir
Banyak ilmuwan telah sepakat bahwa akses bebas oksigen ke kitin selama
deasetilasi memiliki efek merendahkan besar pada kitosan. Deasetilasi di hadapan
nitrogen yang dihasilkan kitosan viskositas yang lebih tinggi dan distribusi berat
molekul daripada di udara. Namun, sedikit perbedaan dalam komposisi nitrogen dan
abu diamati.
5. Perbandingan dari Kitin untuk Larutan Alkali
Moorjani et al. menekankan bahwa perbandingan antara padatan kitin dengan
larutan alkali memainkan peran penting dalam menentukan kualitas kitosan,
berdasarkan penentuan viskositas. Melaporkan perbandingan antara padatan kitin
dengan larutan alkali berkisar dari 1:10 sampai 1:100 secara basah, dan 1:4 secara
kering atau ketika pemanasan kering digunakan.
6. Ukuran Partikel
Ukuran partikel kitosan produksi telah memicu laporan kontroversial di
efeknya pada kualitas kitosan. Beberapa setuju bahwa ukuran partikel kecil lebih
baik daripada ukuran partikel besar. Menurut Bough et al, ukuran partikel (1 mm)
hasil yang lebih kecil dalam produk kitosan dari kedua viskositas yang lebih tinggi
dan berat molekul daripada ukuran partikel yang lebih besar (di atas 2-6,4 mm).
Ukuran partikel yang lebih besar membutuhkan waktu yang lebih lama
pembengkakan sehingga tingkat deasetilasi lebih lambat. Namun, Lusena dan Rose
menunjukkan bahwa ukuran partikel kitin dalam kisaran 20-80 mesh (0,841-0,177
mm) tidak berpengaruh pada tingkat deasetilasi dan viskositas solusi kitosan [22].
2.5 PEMBUSUKAN IKAN
Pembusukan ikan segar dan tinggi rusaknya terutama disebabkan oleh
sejumlah besar non-protein nitrogen (seperti asam amino bebas), basa volatil
nitrogen (ammonia, creatine, taurine, uric acid, carnosine dan histamine) yang mendukung pertumbuhan bakteri. Ikan juga memiliki suatu netral pH untuk sedikit
asam dan kelembaban tinggi konten yang mendukung pertumbuhan berbagai
mikroba ditambah dengan poikilothermic alam mereka. Pembusukan ikan dasarnya dapat dikaitkan dengan tiga faktor utama yaitu : mikroba, enzim atau pembusukan
sebagai penyebab utama kerusakan ikan. Mikroflora awal pada permukaan ikan
secara langsung berkaitan dengan lingkungan perairan sekitarnya sementara flora
bakteri dalam saluran pencernaan sesuai dengan jenis kondisi ikan [23].
2.5.1 Tanda-Tanda Kerusakan yang Terjadi Pada Ikan
Kerusakan pada ikan terutama disebabkan oleh pertumbuhan bakteri
pembusuk. Tanda-tanda kerusakan yang disebabkan oleh pertumbuhan bakteri pada
ikan yang belum diolah meliputi :
a. Pembentukan lendir pada permukaan ikan.
b. Bau busuk karena terbentuknya amonia, H2S dan senyawa – senyawa berbau
busuk lainnya.
c. Perubahan warna, yaitu warna kulit dan daging ikan menjadi kusam atau pucat.
d. Peruhahan tekstur, yaitu daging ikan akan berkurang kekenyalannya.
e. Ketengikan karena terjadi pemecahan dan oksidasi lemak ikan [6].
2.5.2 Faktor Lain yang Berperan dalam Pembusukan (Perubahan yang Bersifat
Enzimatis, Mikrobiologis maupun Fisis)
a. Enzimatis
Di dalam tubuh ikan terutama alat pencernaan terdapat beberapa enzim.
Selama ikan masih hidup enzim masih bisa diatur kegiatannya sesuai dengan
fungsinya masing-masing. Pada ikan yang mati fungsi enzim tidak bekerja lagi,
sehingga akan terjadi peristiwa otolisis yaitu perubahan di dalam tubuh ikan yang
disebabkan oleh aktifitas enzim. Pada suasana agak asam dan suhu 37˚C enzim aktif
sekali bekerja.
b. Mikrobiologis
Pembusukan olah mikrobiologis ini disebabkan karena kesalahan pengolahan
dan penanganan yang mengakibatkan luka mekanis pada ikan sehingga
memungkinkan bakteri lebih mudah masuk ke dalam tubuh ikan.
c. Fisis
Hal ini disebabkan karena kesalahan dalam penyimpanan pada suhu kamar
d. Peristiwa Oksidasi Lemak
Daging ikan umumnya mengandung lemak berkisar antara 10-20% dioksidasi
oleh oksigen dari udara akibatnya ikan menjadi bau dan tengik [6].
2.5.3 Parameter Fisika Ikan Pada Kesegaran Ikan
Dalam menentukan kesegaran ikan ada beberapa parameter, yaitu :
1. Tampak Luar
Ikan yang masih segar mempunyai kenampakan cerah, tidak suram. Keadaan
ini terjadi karena belum banyak perubahan biokimia yang terjadi.
2. Kelenturan daging
Ikan segar dagingnya cukup lentur. Apabila daging ikan dibengkokkan, maka
setelah dilepas segera akan kembali lagi ke bentuknya semula.
3. Keadaan Mata
Parameter ini merupakan yang paling mudah untuk dilihat. Perubahan
kesegaran ikan akan menyebabkan perubahan yang nyata pada kecerahan matanya.
4. Keadaan daging
Keadaan daging menentukan sekali kualitasnya. Ikan yang masih baik
kesegarannya, dagingnya kenyal jika ditekan dengan jari maka bekasnya akan segera
kembali. Pada permukaan tubuhnya belum terdapat lendir yang menyebabkan
kenampakan ikan menjadi suram atau kusam dan tidak menarik.
5. Keadaan insang dan sisik
Warna insang dapat digunakan sebagai tanda apakah ikan masih keadaan segar
atau tidak segar lagi. Pada ikan yang masih segar, warna insangnya masih cerah.
Sebaliknya, ikan yang sudah tidak segar warna insangnya menjadi coklat gelap. Sisik
ikan juga merupakan tanda kesegaran ikan. Jika ikan bersisik, maka pada ikan yang
Berikut akan dijelaskan kriteria-kriteria ikan segar dan ikan busuk, dapat
[image:32.595.115.518.140.751.2]dilihat pada tabel berikut :
Tabel 2.3 Kriteria Ikan Segar dan Ikan Busuk [30]
Parameter Ikan Segar Ikan Busuk
Mata Cemerlang, kornea bening, pupil hitam, mata cembung
Redup, tenggelam, pupil mata kelabu, tertutup lendir Insang Warna merah sampai merah tua,
cemerlang, tidak berbau
Warna pucat atau gelap, keabuan atau berlendir, bau busuk atau kotor
Lendir
Terdapat lendir alami menutupi ikan yang baunya khas menurut jenis ikan, rupa lendir cemerlang seperti lendir ikan hidup, bening
Berubah kekuningan dengan bau tidak enak atau
lendirnya sudah menghilang, berwarna putih
susu atau lendir pekat Kulit Cemerlang, belum pudar, warna
asli kontras
Rada pudar, bila pengesan mata kurang baik maka kulitnya retak dan mengering
Sisik Melekat kuat, mengilap dengan tanda warna khusus tertutup lendir yang jernih
Banyak yang lepas, tanda warna khusus memudar dan lambat laun menghilang Daging Sayatan daging cerah dan elastis,
bila ditekan tidak ada bekas jari
Lunak, tekstur berubah, bila ditekan ada bekasnya, daging telah kehilangan elastisitasnya
Rongga Perut Bersih dan bebas dari bau yang menusuk, tekstur dinding perut kompak, elastis tanpa ada diskolorisasi dengan bau segar yang karakteristik
Lunak, tekstur berubah, bila ditekan ada bekasnya, daging telah kehilangan elastisitasnya
Darah Darah sepanjang tulang belakang segar, merah, konsistensi normal
Darah sepanjang tulang belakang berwarna gelap, sering diikuti bau
Sayatan Bila ikan dibelah, daging melekat kuat pada tulang terutama pada rusuknya
Bila dibelah, daging mudah dilepas, otot lisis telah berjalan, tulang rusuk menonjol keluar
Bau Segar dan menyenangkan seperti air laut atau rumput laut, tidak ada bau yang tidak enak
Mulai dengan bau yang tidak enak, makin kuat menusuk lalu timbul bau busuk yang khusus dan menusuk hidung
Kondisi Bebas dari parasit apapun, tanpa luka atau kerusakan pada bagian ikan
Banyak terdapat parasit, badannya banyak luka atau patah
2.5.4 Kemunduran Mutu Ikan
Peristiwa post mortem adalah salah satu indikasi kemunduran mutu pada ikan. Ikan akan mengalami pengkerutan pada bagian daging akibat tidak adanya rangka
yang mampu menyangga bagian daging serta kontraksi otot yang terjadi pada daging.
Proses perubahan pada fillet ikan tersebut terjadi karena aktivitas enzim dan mikroorganisme. Kedua hal tersebut menyebabkan tingkat kesegaran ikan menurun.
Penurunan tingkat kesegaran ikan terlihat dengan adanya perubahan fisik,
kimia dan organoleptik pada ikan. Semua proses perubahan ini akhirnya mengarah
ke pembusukan. Urutan proses perubahan tersebut meliputi perubahan pre rigor, rigor mortis, aktivitas enzim, akivitas mikroba dan oksidasi [31].
2.5.4.1 Perubahan pre rigor mortis
Fase pre rigor ditandai dengan lendir yang terlepas dari kelenjar dibawah kulit di sekeliling tubuh ikan. Kondisi daging ikan pada fase ini lembut dan lunak, dan
secara kimiawi ditandai dengan penurunan jumlah ATP dan kreatin fosfat. Sirkulasi
darah berhenti pada awal kematian ikan dan menyebabkan habisnya aliran oksigen
didalam jaringan [31].
2.5.4.2 Perubahan rigor mortis
Fase rigor mortis ditandai dengan keadaaan otot yang kaku dan keras. Hilangnya kelenturan daging ikan berhubungan dengan terbentuknya aktomiosin
pada awal fase rigor. Pembentukan aktomiosin ini berlangsung lambat pada tahap awal dan kemudian menjadi cepat pada tahap selanjutnya. Pada fase rigor mortis, sumber energi atau ATP akan berkurang akibat aktivitas enzim ATPase yang dikuti
oleh perubahan glikogen menjadi asam laktat. Perubahan glikogen pada daging ikan
menyebabkan penurunan nilai pH. Perubahan glikogen menjadi asam laktat terjadi
pada proses glikolisis.
Kandungan glikogen yang tinggi dapat memperlambat proses glikolisis pada
daging ikan sehingga dapat menunda datangnya proses rigor mortis. Pada fase rigor mortis, nilai pH daging ikan akan mengalami penurun menjadi 6,2-6,6 dari pH mula-mula 6,9-7,2. Tinggi rendahnya pH awal ikan sangat tergantung pada jumlah
pada daging ikan disebabkan oleh protein, asam laktat, asam fosfat, TMAO dan
basa-basa menguap. Nilai pH daging ikan akan terus naik mendekati netral setelah fase
rigor mortis berakhir [31].
2.5.4.3 Perubahan post rigor
Fase post rigor ditandai dengan mulai melunaknya otot ikan secara bertahap.
Fase post rigor merupakan permulaan dari proses pembusukan yang meliputi
autolisis dan pembusukan oleh bakteri. Proses autolisis adalah terjadinya penguraian
daging ikan sebagai akibat dari aktivitas enzim dalam tubuh ikan. Proses penguraian
jaringan secara enzimatis (autolisis) ini berjalan dengan sendirinya setelah ikan mati.
Enzim yang berperan pada tahap ini antara lain enzim katepsin (dalam daging),
enzim tripsin, kemotripsin, dan pepsin (dalam organ pencernaan), serta enzim dari
mikroorganisme yang ada pada tubuh ikan. Enzim-enzim yang dapat menguraikan
protein (proteolitik) berperan penting dalam proses kemunduran mutu ikan.
Proses autolisis tidak dapat dihentikan walaupun dalam suhu yang sangat
rendah. Proses ini dimulai bersamaan dengan menurunnya pH. Protein dipecah
menjadi molekul-molekul yang lebih sederhana yang menyebabkan peningkatan
dehidrasi protein. Protein terpecah menjadi protease, lalu pecah menjadi pepton,
polipeptida dan akhirnya menjadi asam amino. Hidrolisis lemak juga terjadi pada
proses autolisis yang menghasilkan asam lemak bebas dan gliserol. Penguraian
protein dan lemak karena proses autolisis menyebabkan perubahan rasa, tekstur dan
penampakan ikan.
Senyawa yang terbentuk selama proses autolisis disukai oleh bakteri
pembusuk. Tahap akhir proses autolisis adalah berlangsungnya perombakan oleh
bakteri. Pertumbuhan bakteri yang makin cepat membuat proses kerusakan juga
berjalan semakin cepat. Kerusakan yang terjadi pada tubuh ikan karena serangan
bakteri lebih parah daripada kerusakan yang disebabkan oleh enzim. Penguraian oleh
bakteri berlangsung secara intensif setelah fase rigor mortis berakhir, yaitu setelah daging mengendur dan celah-celah serat-seratnya terisi cairan.
Aktivitas bakteri dapat mengakibatkan terjadinya kerusakan asam-asam amino,
seperti asam glutamat, asam aspartat, lisin, histidin, dan arginin. Asam -asam amino
Senyawa-senyawa seperti asam amino, glukosa, lipida, trimetilamin oksida dan urea
dapat diubah oleh bakteri menjadi produk yang dapat digunakan sebagai indikator
pembusukan. Jenis bakteri yang umum ditemukan pada ikan antara lain
Pseudomona, Achrombacter dan Flavobacterium.
Proses perubahan pada ikan dapat juga terjadi karena proses oksidasi lemak
sehingga timbul aroma tengik yang tidak diinginkan dan perubahan rupa serta warna
daging ke arah coklat kusam. Aroma tengik ini dapat menurunkan mutu dan daya
jualnya [31].
2.5.5 Upaya Pengendalian Pertumbuhan Bakteri
Pengawetan pada hakikatnya merupakan salah satu usaha untuk mengurangi
atau menghilangkan bakteri yang tergolong patogen dan penghasil racun pada bahan
makanan, ada empat macam metode utama dalam pengawetan bahan pangan
terhadap kebusukan karena kerja mikroorganisme, yaitu:
a. Perusakan mikroorganisme dengan panas atau radiasi ion dan perlindungan dari
perencanaan selanjutnya dengan pengemasan secara efektif.
b. Penghambatan pertumbuhan mikroorganisme dalam bahan pangan berkadar air
normal dengan pendinginan, penambahan bahan pengawet kimia (termasuk
pengasapan dan perendaman dalam larutan garam) atau antibiotika, pengasaman,
penyimpanan dengan gas dan lain-lain.
c. Penghambatan pertumbuhan mikroorganisme dengan mengurangi kadar air,
dengan demikian juga penurunan aktivitas air dengan cara pengeringan,
pembekuan (suhu rendah juga mempengaruhi pertumbuhan mikroorganisme),
pemberian garam, gula, pengentalan dan lain-lain.
d. Menghilangkan mikroorganisme, misalnya penyaringan secara steril.
Pengawet ada dua yaitu pengawet kimia dan pengawet alami yang berfungsi
membantu mempertahankan bahan makanan dari serangan mikroorganisme
pembusuk bakteri dengan cara menghambat, mencegah, menghentikan proses
pembusukan, fermentasi, pengasaman atau kerusakan komponen lain dari bahan
pangan.
1. Pengawet Kimia
• Asam benzoat dan garamnya
• Asam sorbat 2. Pengawet Alami
• Buah picung
• Lengkuas
• Kunyit
• Gambir
• Kitosan
• Biji kepayang [6]
2.6 PENGAWETAN IKAN
Penanganan ikan segar merupakan salah satu bagian penting dari mata rantai
industri perikanan karena dapat mempengaruhi mutu. Baik buruknya penanganan
ikan segar akan mempengaruhi mutu ikan sebagai bahan makanan atau sebagai
bahan mentah untuk proses pengolahan lebih lanjut.
Dengan kandungan air cukup tinggi tubuh ikan merupakan media yang cocok
untuk kehidupan bakteri pembusuk atau mikroorganisme yang lain, sehingga ikan
sangat cepat mengalami proses pembusukan. Kondisi ini sangat merugikan karena
dengan kondisi demikian banyak ikan tidak dapat dimanfaatkan dan terpaksa harus
dibuang, terutama pada saat produksi melimpah. Oleh karena itu, untuk mencegah
proses pembusukan perlu dikembangkan berbagai cara pengawetan dan pengolahan
yang cepat dan cermat agar sebagian ikan yang diproduksi dapat dimanfaatkan.
Pengawetan merupakan usaha manusia untuk mempertinggi daya tahan dan
daya simpan ikan dengan tujuan agar kualitas ikan dapat dipertahankan tetap dalam
kondisi baik.
Cara-cara pengawetan dan pengolahan pada pascapanen perikanan dilakukan
berdasarkan pertimbangan sebagai berikut :
1. Tubuh ikan mengandung protein dan air cukup tinggi, sehingga merupakan media
yang baik bagi pertumbuhan bakteri pembusuk dan mikroorganisme yang lain.
2. Produksi ikan bersifat musiman, terutama ikan laut. Dengan kondisi demikian
pada suatu saat produksi ikan sangat melimpah sedangkan pada saat lain sangat
mampu memproses ikan dengan cepat dan cermat terutama pada saat produksi
sedang melimpah.
3. Kebutuhan manusia akan ikan tidak pernah mengenal musim. Setiap saat manusia
dapat membutuhkan ikan. Dengan dikembangkannya cara-cara pengawetan dan
pengolahan yang cepat dan cermat, daya tahan dan daya simpan ikan dapat lebih
lama sehingga dapat memenuhi kebutuhan manusia setiap saat.
Proses pengolahan dan pengawetan ikan dapat dilakukan dengan berbagai cara
seperti :
a. Menggunakan suhu tinggi.
b. Menggunakan suhu rendah.
c. Mengurangi kadar air.
d. Menggunakan zat antiseptik [32].
2.6.1 Bakteri
2.6.1.1 Pengertian Bakteri
Bakteri adalah mikroorganisme bersel tunggal yang tidak terlihat oleh mata,
tetapi dengan bantuan mikroskop, mikroorganisme tersebut akan nampak. Bahan –
bahan makanan yang biasanya mudah tercemar bakteri antara lain meliputi kue – kue
yang mengandung saus, susu, daging cincang dan daging panggang, ikan, unggas
yang diperdagangkan. Bakteri merupakan salah satu kelompok jasad renik yang
sangat penting yang berhubungan dengan bahan pangan, jenis bakteri beraneka
ragam, terdapat secara kosmopolit yaitu secara luas di alam bebas, dan berhubungan
dengan air, udara, tanah, hewan dan tumbuh - tumbuhan. Sebagian bakteri dalam
bahan pangan dapat menguntungkan, misalnya untuk kelangsungan proses
fermentasi, sedangkan sebagian lainnya dapat merugikan karena dapat menyebabkan
gangguan kesehatan (patogenik) [6].
2.6.1.2 Sumber Pencemar
Bakteri merupakan kelompok organisme yang sangat omnivora (memakan
segalanya). Mereka mampu melaksanakan proses-proses metabolisme dengan
memanfatkan segala macam sumber bahan makanan, mulai substrat anorganik
secara amitosis dengan membelah menjadi dua bagian (pembelahan biner). Waktu di
antara dua pembelahan sel disebut generation time dan inti berlainan untuk tiap jenis
bakteri, bervariasi antara 20 menit sampai 15 jam. Bakteri dalam bahan makanan
yang perlu diperhatikan adalah :
a. Bakteri yang dapat menyebabkan penyakit disebut pathogen atau bakteri penyakit
atau “food borne illness”.
b. Bakteri yang dapat menyebabkan pembusukan bahan makanan.
c. Bakteri yang digunakan untuk produksi makanan [6]
2.6.2 Faktor-Faktor Yang Mempengaruhi Pertumbuhan Bakteri
Pertumbuhan bakteri pada pangan dipengaruhi oleh berbagai faktor dan setiap
bakteri membutuhkan kondisi pertumbuhan yang berbeda, oleh karena itu jenis dan
jumlah bakeri yang dapat tumbuh kemudian menjadi dominan pada setiap pangan
juga berbeda, tergantung dari jenis pangan tersebut. Beberapa faktor yang
mempengaruhi pertumbuhan bakteri meliputi :
a. Kandungan gizi
Seperti halnya makhluk hidup lainnya, bakteri juga membutuhkan zat gizi
untuk pertumbuhannya, bahan makanan yang akan menjadi sumber energi dan
menyediakan unsur-unsur kimia dasar untuk pertumbuhan sel.
b. Waktu
Waktu antara masing-masing pembelahan sel berbeda-beda, tergantung dari
spesies dan lingkungannya, tapi untuk kebanyakan bakteri berkisar antara 10 - 60
menit.
c. Suhu
Suhu merupakan faktor fisika yang sangat penting pengaruhnya terhadap
pertumbuhan dan kegiatan bakteri. Berdasarkan pada kisaran suhu pertumbuhannya,
bakteri dapat dikelompokkan menjadi tiga yaitu:
1) Psikrofil
Suhu pertumbuhan minimum -5 oC – 0 oC, pertumbuhan optimum 5 oC – 15
o
C, suhu maksimum 15 oC – 20 oC.
2) Mesofil
3) Termofil
Suhu pertumbuhan minimum 25 oC – 45 oC, pertumbuhan optimal 45 oC – 55
o
C, suhu pertumbuhan maksimumnya 60 oC- 80 oC.
d. Nilai pH
Kebanyakan mikroorganisme tumbuh pada pH netral sekitar pH 5,0-8,0. Pada
pH dibawah 5,0 dan diatas 8,5 bakteri tidak dapat tumbuh dengan baik.
e. Aktivitas air
Aktivitas air menunjukkan jumlah air di dalam pangan yang dapat digunakan oleh
bakteri untuk pertumbuhannya. Bakteri mempunyai kebutuhan aktivitas air yang
berbeda-beda untuk pertumbuhannya. Aktivitas air berperan dalam metabolik dalam
sel dan merupakan alat pengangkut zat-zat gizi.
f. Ketersediaan oksigen
Bakteri mempunyai kebutuhan oksigen yang berbeda-beda untuk
pertumbuhannya. Beberapa kelompok bakteri dapat dibedakan sabagai berikut:
1) Organisme aerobik, dimana tersedianya oksigen dan penggunaannya
dibutuhkan untuk pertumbuhan.
2) Organisme anaerobik, tidak dapat tumbuh dengan adanya oksigen ini dan
bahkan oksigen ini dapat merupakan racun bagi organisme tersebut.
3) Organisme anaerobik fakultatif, dimana oksigen akan digunakan apabila
tersedianya, apabila oksigen tidak tersedia organisme akan tetap tumbuh dalam
keadaan anaerobik.
4) Organisme mikro aerofilik, yaitu mikroorganisme yang lebih dapat tumbuh
pada kadar oksigen yang lebih rendah daripada kadar oksigen dalam atmosfer.
Pengawet adalah bahan tambahan pangan yang dapat mencegah atau
menghambat fermentasi, pengasaman atau penguraian dan perusakan lainnya
terhadap pangan yang disebabkan oleh mikroorganisme. Kerusakan tersebut dapat
disebabkan oleh fungi, bakteri dan mikroba lainnya. Pertumbuhan bakteri dicegah
atau dihambat tergantung dari jumlah pengawet yang ditambahkan [6].
2.6.3 Mekanisme Kerja Pengawet Atau Antimikroba
Mekanisme zat antimikroba dalam membunuh atau menghambat pertumbuhan
1. Merusak dinding sel bakteri sehingga mengakibatkan lisis atau menghambat
pembentukan dinding sel pada sel yang sedang tumbuh.
2. Mengubah permeabilitas membran sitoplasma yang menyebabkan kebocoran
nutrient dari dalam sel, misalnya yang disebabkan oleh senyawa fenolik.
3. Menyebabkan denaturasi sel, misalnya oleh alkohol.
4. Menghambat kerja enzim di dalam sel.
Keefektifan penghambatan merupakan salah satu kriteria pemilihan suatu
senyawa antimikroba untuk diaplikasikan sebagai bahan pengawet bahan pangan.
Semakin kuat penghambatannya semakin efektif digunakan. Kerusakan yag
ditimbulkan komponen antimikroba dapat bersifat mikrosidal (kerusakan tetap) atau
mikrostatik (kerusakan sementara yang dapat kembali). Suatu komponen akan
bersifat mikrosidal atau mikrostatik tergantung pada konsentrasi dan kultur yang
digunakan.
Mekanisme penghambatan mikroorganisme oleh senyawa antimikroba dapat
disebabkan oleh beberapa faktor, antara lain:
1. Gangguan pada senyawa penyusun dinding sel.
2. Peningkatan permeabilitas membran sel yang dapat menyebabkan kehilangan
komponen penyusun sel.
3. Penginaktivasi enzim.
4. Destruksi atau kerusakan fungsi material genetik.
a. Menggangu pembentukan dinding sel
Mekanisme ini disebabkan karena adanya akumulasi komponen lipofilat yang
terdapat pada dinding atau membran sel sehingga menyebabkan perubahan
komposisi penyusun dinding sel. Terjadinya akumulasi senyawa antimikroba
dipengaruhi oleh bentuk tak terdisosiasi. Pada konsentrasi rendah molekul-molekul
phenol yang terdapat pada minyak thyme kebanyakan berbentuk tak terdisosiasi, lebih hidrofobik, dapat mengikat daerah hidrofobik membran protein dan dapat larut
pada fase lipid dari membran bakteri.
Beberapa laporan juga meyebutkan bahwa efek penghambatan senyawa
antimikroba lebih efektif terhadap bakteri Gram positif daripada dengan bakteri gram
negatif. Hal ini disebabkan perbedaan komponen penyusun dinding sel kedua
lapisan peptidoglikan, selebihnya adalah asam teikoat, sedangkan bakteri gram
negatif komponen dinding selnya mengandung 5 - 20 % peptidoglikan selebihnya
terdiri dari protein, lipopolisakarida, dan lipoprotein.
b. Bereaksi dengan membran sel
Komponen bioaktif dapat mengganggu dan mempengaruhi integritas membran
sitoplasma, yang dapat mengakibatkan kebocoran materi intraseluler, seperti
senyawa phenol dapat mengakibatkan lisis sel dan meyebabkan deaturasi protein, menghambat pembentukan protein sitoplasma dan asam nukleat, dan menghambat
ikatan ATP-ase pada membran sel.
c. Menginaktivasi enzim
Mekanisme yang terjadi menunjukkan bahwa kerja enzim akan terganggu
dalam mempertahankan kelangsungan aktivitas mikroba sehingga mengakibatkan
enzim memerlukan energi yang besar untuk mempertahankan kelangsungan
aktivitasnya. Akibatnya energi yang dibutuhkan untuk pertumbuhan menjadi
berkurang sehingga aktivitas mikroba menjadi terhambat atau jika kondisi ini
berlangsung lama akan mengakibatkan pertumbuhan mikroba terhenti (inaktif).
Efek senyawa antimikroba dapat menghambat kerja enzim jika mempunyai spesifitas
yang sama antara ikatan komplek yang menyusun struktur enzim dengan komponen
senyawa antimikroba.
d. Menginaktivasi fungsi material genetik
Komponen bioaktif dapat mengganggu pembentukan asam nukleat (RNA dan
DNA), menyebabkan terganggunya transfer informasi genetik yang selanjutnya akan
menginaktivasi atau merusak materi genetik sehingga terganggunya proses
pembelahan sel untuk pembiakan [33].
2.7 ANALISA EKONOMI
Kitosan merupakan biopolimer yang banyak digunakan di berbagai industri
kimia antara lain sebagai koagulan dalam pengolahan limbah air, bahan pelembab,
pelapis benih yang akan ditanam, adsorben ion logam, bidang farmasi, pelarut lemak,
dan pengawet makanan. Kitosan mempunyai bentuk mirip dengan selulosa dan
bakteri disebabkan kitosan memiliki polikation bermuatan positif yang mampu
menghambat pertumbuhan bakteri dan kapang.
Produksi kitosan dengan bahan baku Cangkang bekicot dilakukan dengan
tahapan sebagai beikut:
1. Persiapan sampel yaitu cangkang bekicot.
2. Ekstraksi Kitin (Demineralisasi, Deproteinasi)
3. Deasetilasi kitin menjadi kitosan
4. Karakterisasi kitosan
Kitosan yang di dapat kemudian diaplikasikan sebagai bahan pengawet ikan.
Bahan pengawet adalah senyawa yang mampu menghambat dan menghentikan
proses fermentasi, pengasaman atau bentuk kerusakan lainnya atau bahan yang dapat
memberikan perlindungan bahan pangan dari pembusukan.
Berikut merupakan rincian biaya pembuatan larutan pengawet kitosan yang
telah dilakukan selama penelitian dengan basis bahan baku cangkang 50 gr dan
diperkirakan akan menghasilkan kitosan 10 gr..
Biaya ekstraksi kitin Rp 7.000,-
Deasetilasi Rp 12.000,-
Analisa Rp 75.000,-
Rp 94.000,-
Dari rincian biaya yang telah dilakukan di atas maka total biaya yang
diperlukan untuk produksi kitosan dengan bahan baku cangkang bekicot adalah Rp
94.000,-.
Harga kitosan di pasaran, khususnya kota medan sekitar 550.000,-/kg. Dengan
demikian kitosan untuk 1 gr memiliki harga 550/g. Oleh karena itu, hasil ekstraksi
cangkang bekicot sebanyak 50 gr memperoleh kitosan sebesar 10 gr, sehingga harga
jual hasil ekstraksi cangkang bekicot sebesar 5.500,-. Jika dibandingkan harga
penjualan kitosan dengan biaya pengeluaran untuk menghasilkan kitosan belum
mendapatkan keuntungan. Hal ini disebabkan pembuatan kitosan ini masih dalam
BAB III
METODOLOGI PENELITIAN
3.1 LOKASI DAN WAKTU PENELITIAN
Penelitian dilakukan di Laboratorium Proses Industri Kimia Departemen
Teknik Kimia, Fakultas Teknik, Universitas Sumatera Utara, Medan. Penelitian ini
dilakukan selama lebih kurang 3 bulan.
3.2 BAHAN DAN PERALATAN
3.2.1 Bahan Penelitian
Pada penelitian ini bahan yang digunakan antara lain:
1. Cangkang Bekicot (Achatina fulica) sebagai bahan pembuatan kitosan.
2. Ikan Kembung (Rastrelliger sp) dan Ikan Lele (Clarias batrachus) sebagai bahan yang digunakan dalam pengawetan.
3. Natrium Hidroksida (NaOH)
4. Asam Klorida (HCl)
5. Asam Asetat (CH3COOH)
6. Aquadest (H2O)
7. Trichloroacetic Acid (TCA) 8. Asam Borat (H3BO3)
9. Kalium Karbonat (K2CO3)
3.2.2 Peralatan Penelitian
Pada penelitian ini peralatan yang digunakan antara lain:
1. Stirrer 9. Hot Plate 17. Termometer
2. Erlenmeyer 10. FTIR
3. Beaker Glass 11. Ayakan 50 mesh
4. Gelas Ukur 12. Cawan conway
5. Labu leher tiga 13. Cawan porselen
6. Ball Mill 14. furnace
7. Oven 15. Desikator
3.3 PROSEDUR PENELITIAN
3.3.1 Persiapan Sampel
Cangkang bekicot dicuci dengan air hingga bersih, kemudian dikeringkan di
bawah sinar matahari. Cangkang yang telah bersih dihaluskan untuk mendapatkan
ukuran maksimum dari ayakan 50 mesh [24].
3.3.2 Pembuatan Kitin
3.3.2.1 Deproteinasi
Ke dalam labu alas bulat 250 ml yang berisi serbuk cangkang bekicot
ditambahkan larutan NaOH 3,5% dengan perbandingan 10:1 (v/b), kemudian
dipanaskan sambil diaduk dengan pengaduk magnetik selama 2 jam pada temperatur
65 oC. Setelah dingin, disaring dan dinetralkan dengan aquadest. Padatan yang diperoleh dikeringkan dalam oven 60 oC hingga kering [24].
3.3.2.2 Demineralisasi
Serbuk cangkang bekicot hasil deproteinasi ditambah larutan HCl 1 N dengan
perbandingan 15:1 (v/b) dalam labu alas bulat 500 ml dan direfluks pada suhu 40 oC
selama 30 menit, kemudian didinginkan. Setelah dingin, disaring dan padatan
dinetralkan dengan aquadest, kemudian dikeringkan dalam oven 60 oC [24].
3.3.3 Deasetilasi
Menambahkan NaOH 60% dengan perbandingan 20:1 (v/b) dan merefluksnya
pada suhu 100 – 140 oC selama 1 jam. Setelah dingin disaring dan padatan yang
diperoleh dinetralkan dengan akuades. Padatan kemudian dikeringkan dalam oven
pada suhu 80 oC selama 24 jam dan kitosan siap dianalisis. Kitosan yang diperoleh
diidentifikasi menggunakan instrumen spektrofotometer inframerah [24].
3.3.4 Karakterisasi Kitosan
3.3.4.1 Analisa Kadar Air
Penentuan kadar air didasarkan pada perbedaan berat contoh sebelum dan
sesudah dikeringkan. Mula-mula cawan kosong yang akan digunakan dikeringkan
selama 30 menit dalam desikator, setelah dingin beratnya ditimbang. Sampel
sebanyak 5 gram ditimbang dan dimasukkan kedalam cawan kemudian dikeringkan
dalam oven selama 6 jam pada suhu 100 oC sampai 102 oC. Cawan kemudian
didinginkan dalam desikator selama 30 menit dan setelah dingin ditimbang kembali
[5]. Persentase kadar air (berat basah) dapat dihitung dengan rumus:
Kadar air (%) = �1−�2
� x 100 % [25] Dimana : B = Berat sampel (gram)
B1 = Berat (sampel + cawan) sebelum dikeringkan (gram)
B2 = Berat (sampel + cawan) setelah dikeringkan (gram)
3.3.4.2 Analisa Kadar Abu
Cawan kosong dipanaskan dalam oven didinginkan dalam desikator selama 30
menit dan ditimbang beratnya. Sampel ditimbang sebanyak 5 gram, dan diletakkan
dalam cawan, kemudian dimasukkan dalam furnace. Pengabuan dilakukan dalam dua tahap yaitu pada suhu 450 oC dan pada suhu 550 oC, pengabuan dilakukan sekitar 2-3
jam. Cawan kemudian didiinginkan dalam desikator, setelah dingin cawan kemudian
ditimbang [5]. Persentase kadar abu dapat dihitung dengan rumus:
Kadar abu (%) = ����� ��� (�)
����� ������ (�) x 100 % [25]
3.3.4.3 Analisa Derajat Deasetilasi
Pengukuran derajat deasetilasi berdasarkan kurva yang tergambar oleh
spektrofotometer. Puncak tertinggi (P0) dan puncak terendah (P) dicatat dan diukur
dengan garis dasar yang dipilih. Nisbah absorbansi dihitung dengan rumus:
� =��� ��
� � 100% [26]
Keterangan �0 = Jarak antara garis dasar dengan garis singgung antara dua puncak
tertinggi dengan panjang gelombang 1655 cm-1 atau 3450 cm-1.
P = Jarak antara garis dasar dengan lembah terendah dengan panjang
gelombang 1655cm-1 atau 3450 cm-1.
Perbandingan absorbansi pada 1655 cm-1 dengan absorbansi 3450 cm-1
absorbansi pada puncak yang berhubungan, nilai persen N-deasetilasi dapat dihitung
dengan rumus:
% N - deasetilasi = �1− � 1655 � 1
�3450 � 1,33� x 100% [26] Keterangan :
A1655 = Absorbansi pada panjang gelombang 1655 cm-1
A3450 = Absorbansi pada panjang gelombang 3450 cm-1
1,33 = Konstanta untuk derajat deasetilasi yang sempurna.
3.3.5 Pemanfaatan Kitosan Sebagai Pengawet Ikan
Untuk mencari optimalisasi kitosan sebagai bahan pengawet ikan dengan cara
melarutkan kitosan (w/v) kedalam asam asetat 1% (v/v). Sampel ikan masing-masing
direndam atau disemprot dalam larutan kitosan dengan konsentrasi yang bervariasi
dengan perbandingan 1 kg ikan/1 L larutan kitosan, lalu didiamkan pada suhu
ruangan [1].
3.3.6 Analisa Ikan Segar
3.3.6.1 Analisa pH
Penentuan pH dapat dilakukan dengan menggunakan pH meter. Sampel yang
telah dirajang kecil-kecil sebanyak 10 g ditimbang dan dihomogenkan (diblender)
dengan 20 mL aquades selama 1 menit. Dituangkan ke dalam beaker glass 100 ml, kemudian diukur pHnya [27].
3.3.6.2 Analisa Total Volatile Bases (TVB)
Uji TVB-N dilakukan berdasarkan SNI-01-4495-1998. Sampel ikan yang telah
dihaluskan ditimbang sebanyak 2 g. Kemudian sampel dimasukkan ke dalam blender
dan ditambah 75 ml larutan TCA 7% dan dihaluskan kembali selama 1 menit.
Selanjutnya sampel disaring dan diuji kadar TVB-Nnya. 1 ml (H3BO3) 1%
dimasukkan ke dalam inner chamber cawan conway, kemudian filtrat sampel
dimasukkan ke bagian luar cawan conway. Selanjutnya, cawan conway ditutup, lalu
ditambahkan 1 ml larutan K2CO3 jenuh pada bagian luar. Bagi blanko, filtrat diganti
dengan larutan TCA 5%. Inkubasi sampel pada suhu 35oC selama 2 jam. Setelah
dengan HCl 0,02 N sampai berwarna merah muda seperti pada blanko. Hasil titrasi
dicatat dan dimasukkan dengan perhitungan [28].
TVB (mgN%) = (VSampel- Vblanko) x N HCl x 14,007 x 100 [28]
Berat sampel
Dimana:
VSampel = titrasi sampel (ml)
Vblanko = titrasi blanko (ml)
N HCl = normalitas HCl
14,007 = berat atom nitrogen
3.4 FLOWCHART PENELITIAN
[image:47.595.132.477.120.583.2]3.4.1 Persiapan Sampel
Gambar 3.1 Flowchart Persiapan Sampel
Cangkang Bekicot dicuci bersih dengan air hingga bersih
Lalu dijemur di bawah sinar matahari selama 8-12 jam
Selesai Mulai
3.4.2 Pembuatan Kitin
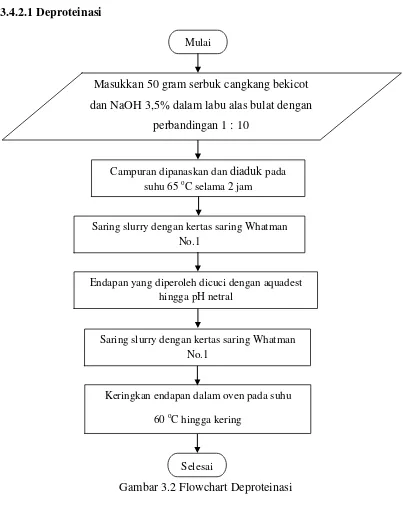
[image:48.595.113.516.101.617.2]3.4.2.1 Deproteinasi
Gambar 3.2 Flowchart Deproteinasi
Mulai
Masukkan 50 gram serbuk cangkang bekicot
dan NaOH 3,5% dalam labu alas bulat dengan
perbandingan 1 : 10
Campuran dipanaskan dan diaduk pada suhu 65 oC selama 2 jam
Saring slurry dengan kertas saring Whatman No.1
Endapan yang diperoleh dicuci dengan aquadest hingga pH netral
Keringkan endapan dalam oven pada suhu
60 oC hingga kering
Selesai
3.4.2.2 Demineralisasi
Gambar 3.3 Flowchart Demineralisasi
Endapan yang diperoleh dicuci dengan aquadest hingga pH netral
Keringkan dalam oven pada suhu
60 oC hingga kering
Selesai Mulai
Serbuk cangkang bekicot hasil deproteinasi dan
HCl 1 N dalam labu alas bulat dengan
perbandingan 1 : 15
Campuran dipanaskan dan diaduk pada suhu 40 oC selama 30 menit
Saring slurry dengan kertas saring Whatman No.1
3.4.3 Deasetilasi
Gambar 3.4 Flowchart Deasetilasi
Mulai
Masukkan 10 gram kitin dan NaOH 60% ke
dalam labu alas bulat dengan perbandingan 1 : 20
Campuran dipanaskan dan diaduk pada suhu 140 oC selama 1 jam
Endapan yang diperoleh dicuci dengan aquadest
hingga pH netral
Kitosan dikeringkan di dalam oven pada suhu 80
o
C hingga kering
Apakah berat sudah konstan?
Ya
Tidak
Selesai
Saring slurry dengan kertas saring Whatman No.1
3.4.4 Karakterisasi Kitosan
3.4.4.1 Analisa Kadar Air
Gambar 3.5 Flowchart Analisa Kadar Air
3.4.4.2 Analisa Kadar Abu
Gambar 3.6 Flowchart Analisa Kadar Abu
Mulai
Sampel ditimbang sebanyak 5 gram
Sampel diletakkan di cawan porselin
Dikeringkan dengan oven pada suhu 100-102
o
C selama 6 jam.
Didinginkan dalam desikator selama 30 menit
Diulangi hingga berat konstan
Selesai
Mulai
Sampel ditimbang sebanyak 5 gram
Sampel dimasukkan ke dalam cawan porselin
Sampel dipanaskan dalam furnace hingga suhu 450-550 oC selama 2-3 jam
3.4.5 Proses Pengawetan Ikan
Gambar 3.7 Flowchart Proses Pengawetan Ikan
3.4.6 Analisa Ikan Segar
3.4.6.1 Analisa pH
Gambar 3.8 Flowchart Analisa pH pada Ikan Segar
Mulai
Kitosan (w/v) dilarutkan kedalam asam
asetat 1% (v/v)
Sampel ikan kemudian ditimbang
Sampel ikan direndam atau disemprot dalam larutan kitosan 0,5%, 1,5% dan 2,5% dengan perbandingan 1:1 lalu didiamkan selama
beberapa 5 jam, 10 jam dan 15 jam pada suhu ruangan
Selesai
Mulai
Sampel ikan dirajang kecil-kecil lalu ditimbang sebanyak 10gram
Lalu diblender dengan menambahkan 20 ml aquades selama 1 menit
Ditua

![Tabel 2.1 Beberapa organisme yang mengandung kitin [8],[12].](https://thumb-ap.123doks.com/thumbv2/123dok/171719.12800/22.595.113.545.464.722/tabel-beberapa-organisme-yang-mengandung-kitin.webp)
![Gambar 2.1 Anatomi Bekicot (Achatina fulica) [13]](https://thumb-ap.123doks.com/thumbv2/123dok/171719.12800/23.595.221.426.525.663/gambar-anatomi-bekicot-achatina-fulica.webp)
![Gambar 2.3 Struktur Kimia Kitosan [16]](https://thumb-ap.123doks.com/thumbv2/123dok/171719.12800/24.595.181.447.263.356/gambar-struktur-kimia-kitosan.webp)
![Tabel 2.2 Syarat – syarat kitosan komersil (Protan Laboratories) dalam [20]](https://thumb-ap.123doks.com/thumbv2/123dok/171719.12800/25.595.195.450.375.625/tabel-syarat-syarat-kitosan-komersil-protan-laboratories-dalam.webp)
![Gambar 2.4 Reaksi Deproteinasi [21]](https://thumb-ap.123doks.com/thumbv2/123dok/171719.12800/26.595.155.485.580.727/gambar-reaksi-deproteinasi.webp)
![Gambar 2.6 Reaksi Deasetilasi Kitin Menjadi Kitosan [21]](https://thumb-ap.123doks.com/thumbv2/123dok/171719.12800/27.595.169.474.195.618/gambar-reaksi-deasetilasi-kitin-menjadi-kitosan.webp)
![Tabel 2.3 Kriteria Ikan Segar dan Ikan Busuk [30]](https://thumb-ap.123doks.com/thumbv2/123dok/171719.12800/32.595.115.518.140.751/tabel-kriteria-ikan-segar-ikan-busuk.webp)