STUDI PENDAHULUAN PEMBUATAN DAN KARAKTERISASI NANOKATALIS NixMoyFe1-x-yO3±δ SERTA UJI AKTIVITAS PADA
KONVERSI (CO2 + H2)
(Skripsi)
Oleh
Muhammad Subari
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS LAMPUNG
ABSTRAK
STUDI PENDAHULUAN PEMBUATAN DAN KARAKTERISASI NANOKATALIS NixMoyFe(1-x-y)O3±δ SERTA UJI AKTIVITAS PADA
KONVERSI (CO2 + H2)
Oleh
Muhammad Subari
Telah dilakukan pembuatan dan karakterisasi nanokatalis NixMoyFe(1-x-y)O4 (x =
0,4 dan y = 0,1 – 0,3) dengan menggunakan metode sol-gel, sonikasi secara simultan dan freeze-dry dari bahan Fe-nitrat, Ni-nitrat dan Ammonium Heptamolibdat serta putih telur dalam medium aquades. Proses karakterisasi katalis meliputi analisis fase Kristal menggunakan difraksi sinar-X (XRD), jumlah situs asam menggunakan metode Gravimetri dan jenis situs asam menggunakan Spektrofotometri Infra Merah (FTIR), analisis morfologi permukaan menggunakan Scanning Electron Microscope (SEM) dan Metode Debye-Scherrer. Selanjutnya dilakukan uji aktivitas katalitik terhadap konversi gas CO2 + H2 pada
rentang suhu 200 – 400oC dan hasil konversi dianalisis menggunakan kromatografi gas yang telah terintegrasi spektrometri massa (GC-MS). Hasil analisis fasa kristalin menggunakan difraksisinar-X (XRD) menunjukkan bahwa fasa kristalin paling dominan adalah NiMoO4, dan FeMoO4. Hasil analisis
keasaman menggunakan metode Gravimetri menunjukan katalis Ni0.4Mo0.1Fe0.5O4
memiliki nilai keasaman tertinggi yaitu 0,895 mmol piridin/g katalis. Hasil analisis keasaman katalis NiyMoxFe(1-x-y)O4 menggunakan metode
spektrofotometri inframerah menunjukkan bahwa intensitas relatif situs asam Lewis dan Brӧnsted-Lowry adalah sama. Morfologi permukaan katalis NixMoyFe(1-x-y)O4 yang dipreparasi belum homogen. Hasil perhitungan dengan
menggunakan metode Debye-Scherrer, ukuran butiran katalis katalis Ni0.4Mo0.1Fe0.5O4, Ni0.4Mo0.2Fe0.4O4, dan Ni0.4Mo0.3Fe0.3O4 masing-masing adalah
53,64nm, 47,66 nm dan 43,22 nm. Hasil uji aktivitas katalis Ni0,4Mo0,1Fe0,5O4
terhadap konversi (CO2 + H2) pada suhu 400 oC menunjukkan bahwa katalis
Ni0,4Mo0,1Fe0,5O4 aktif terhadap pembentukan etanol, propanol, dan butanol
ABSTRACT
PRELIMINARY STUDY ON SYNTHESIS AND CHARACTERIZATION OF NixMoyFe(1-x-y)O4 NANOCATALYSTS AND ACTIVITY TEST FOR
CONVERSION OF CO2 AND H2 INTO ALCOHOL
By
Muhammad Subari
In this study, synthesis of NixMoyFe(1-x-y)O4 (x = 0,4 dan y = 0,1 – 0,3) was
conducted using the combination of sol-gel, ultrasound agitation and freeze-dry method. The raw materials used are Fe-nitrate, Ni-nitrate and Ammonium Heptamolybdate dissolved in white egg solution. The catalysts were characterized by X-Ray Diffraction (XRD), gravimetry and infrared (IR) spectroscopy, Scanning Electron Microscope (SEM) and Debye-Scherrer Method. The activity test for CO2 and H2 conversion was carried out at temperature range of 200 –
400oC, then, the results were analyzed by Gas Chromatography-Mass Spectrometry (GC-MS). XRD analysis revealed that the nanocatalysts consist of some crystalline phases, with the majority phases are NiMoO4 and FeMoO4. By
using gravimetry method, the acidity of Ni0.4Mo0.1Fe0.5O4 was obtained to be
0,895 mmol pyridine/gr catalyst which is higher than those of the others. The IR spectroscopy method showed that the nanocatalyst has both Lewis and Brӧnsted Lowry acid properties. The surface morphology of nanocatalysts is not homogen. The size of nanocatalysts which was calculated by Debye-Scherrer method showed that the size of Ni0.4Mo0.1Fe0.5O4, Ni0.4Mo0.2Fe0.4O4, and
Ni0.4Mo0.3Fe0.3O4 are 53.64 nm, 47.66 nm and 43.22 nm, respectively. The
activity test of Ni0,4Mo0,1Fe0,5O4 in CO2 and H2 conversion at 400 oC showed that
nanocatalyst Ni0,4Mo0,1Fe0,5O4 was active to produce ethanol, propanol, and
RIWAYAT HIDUP
Penulis dilahirkan di Lampung Tengah pada tanggal 27 Maret 1991, anak pertama dari 4 bersaudara, yang merupakan buah hati dari pasangan ayahanda Hidayatulloh dan Ibunda Rusyati, Alm.
Penulis menyelesaikan pendidikan Pendidikan Sekolah Dasar di SD Negeri 06 Gunung Waras Lampung Tengah pada tahun 2002, dan Sekolah Lanjutan Tingkat Pertama di MTs Al Hidayah Tanjung Jaya Lampung Tengah pada tahun 2005. Pendidikan Sekolah Menengah Atas di MA Al Fatah Natar Lampung pada tahun 2008. Penulis diterima sebagai mahasiswa Jurusan Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Lampung pada tahun 2008 melalui jalur Seleksi Nasional Masuk Perguruan Tinggi Negeri (SNMPTN).
“KONVERSI SELULOSA MENGGUNAKAN KATALIS NiFe2O4 ”, yang
PERSEMBAHAN
Segala puji hanya milik Alloh SWT yang telah memberikan begitu banyak
nikmat yang tak terhingga sehingga kita tidak bisa menghitung banyaknya
nikmat.
Sholawat serta salam selalu kita curahkan kepada Nabi kita, Tauladan kita,
Muhammad R
osululloh S.A.W. Semoga kita semua mendapatkan syafa’atnya di
hari kiamat nanti. Amin
Ayahanda terhebat Hidayatulloh dan Ibunda luar biasa Almarhumah Rusyati
yang senantiasa membimbingku, mendoakanku, mendukungku, memotivasiku
dan membahagiakan kalian adalah tujuan utamaku.
Adik-adikku tersayang
Aini Rizkiana, S.Pd, Ihsan Udin, dan Ilyas Habibulloh yang selalu menemani
dan menjadi penyemangat di siklus pendewasaanku.
Kakek , Nenek dan Paman-Pamanku yang telah menempaku dalam
mendewasakanku, terima kasih.
Sahabat dan teman-teman terbaik di Pondok Pesantren Modern Annida.
Segenap keluarga besarku yang senantiasa mendoakan keberhasilanku,
Almamater tercinta kimia FMIPA UNILA
Ya Alloh, karuniakan kebaikan bagi hamba dalam beragama, yang
merupakan kunci kehormatan bagi hamba. Karuniakan kebaikan di
dunia, yang merupakan tempat hamba menjalani hidup. Karuniakan
kebaikan akhirat bagi hamba, yang merupakan tempat hamba
kembali. Jadikan kehidupan hamba senantiasa lebih baik. Jadikan
kematian hamba sebagai kebebasan dari segala keburukan.
Ya Alloh, jadikan umur terbaik hamba di penghujungnya, jadikan
amal terbaik di penutupnya, jadikan hari-hari terbaik saat hamba
bertemu dengan-Mu.
Ya Alloh, Hamba memohon kepada-Mu, kehidupan yang jembar,
kematian yang normal, dan tempat kembali yang tidak menyedihkan
dan terhindar dari prahara.
Ya Alloh, hamba memohon kepada-Mu permintaan terbaik, doa
terbaik, kesuksesan terbaik, ilmu terbaik, kehidupan terbaik, kematian
terbaik. Kuatkanlah hamba, beratkanlah timbagan kebajikan,
realisasikan keimanan hamba, tinggikan derajat hamba, terima sholat
hamba, ampuni dosa-dosa hamba, dan hamba memohon surga yang
tertinggi.
Ya Alloh, jangan pernah Engkau tinggalkan dosa, melainkan Engkau
ampuni. Tidak ada kegalauan kecuali Engkau berikan jalan keluar,
tidak ada hutang kecuali Engkau penuhi, dan tidak ada satu
kebutuhan dunia dan akhirat kecuali Engkau penuhi, Wahai Tuhan
“
Kombinasi keyakinan dan penyerahan diri kepada Allah adalah obat mujarab
dari putus asa. Tidak mungkin, orang yang yakin dan tawakal akan putus asa.
”
“
Percaya diri bukan sekedar dianggap hebat, namun memang sudah hebat
sejak lahir. Hanya saja persepsi diri kita yang menghalangi kehebatan kita
masing-masing. Percaya diri bukan sekedar dianggap hebat, namun memang
sudah hebat sejak lahir. Hanya saja persepsi diri kita yang menghalangi
kehebatan kita masing-masing.
”
“Jika sore tiba, janganlah tunggu waktu pagi, jika pagi tiba, janganlah tunggu
waktu sore. Manfaatkan masa sehatmu sebelum tiba masa sakitmu dan
manfaatkan masa hidupmu sebelum tiba ajalmu.
”
—
Ibnu Umar, Putra Umar
bin Khattab
“
Orang berpikiran besar, tidak akan terganggu atau terhentikan oleh
masalah-masalah kecil.
”
“Apabila hamba itu meninggalkan berdoa kepada kedua orang tuanya, niscaya
SANWACANA
Segala Puji hanyalah milik Alloh SWT yang telah memberikan banyak nikmat, sehingga penulis dapat menyelesaikan skripsi dengan judul ” STUDI
PENDAHULUAN PEMBUATAN DAN KARAKTERISASI
NANOKATALIS NixMoyFe1-x-yO3±δ SERTA UJI AKTIVITAS PADA KONVERSI (CO2 + H2)”.
Dalam Pelaksanaan dan penulisan skripsi ini pastinya tidak terlepas dari kendala dan kesulitan. Namun, dengan kehendak Alloh SWT maka skripsi ini dapat terselesaikan. Tentunya kami juga ingin memberikan apresiasi yang setinggi-tingginya kepada nama-nama yang akan kami coba sebutkan satu per satu.
1. Bapak Dr. Rudy T.M Situmeang, M.Sc. selaku pembimbing utama yang telah banyak membimbing penulis, memberikan banyak ilmu pengetahuan, arahan, saran dan kritik dengan rasa sabar yang begitu besar selama penyusunan skripsi ini.
3. Bapak Prof. Dr. John Hendri, M.S selaku Pembahas yang telah banyak memberikan banyak ilmu pengetahuan serta saran dan motivasi..
4. Almarhumah Ibu Dra. Fifi Martasih, M.Si selaku Pembimbing Akademik yang telah memberikan motivasi dan arahan selama masa kuliah.
5. Bapak Dr. Eng. Dwi Suripto Yuwono, selaku Ketua Jurusan Kimia Fakultas Matematika Ilmu Pengetahuan Alam Universitas Lampung.
6. Bapak Prof. Suharso, Ph.D selaku Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Lampung.
7. Seluruh dosen dan staf administrasi di Jurusan Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Lampung yang telah memberikan banyak ilmu pengetahuan dan motivasi sehingga penulis dapat menyelesaikan skripsi ini.
8. Keluargaku tersayang, Bapak, Ibu, Aini Rizkiana, S.Pd, Ihsan Udin, Ilyas Habibulloh, yang telah memberikan kasih sayang, perhatian, motivasi, pengorbanan, dan dukungan sepenuh hati baik materi maupun spiritual yang
sangat penulis butuhkan serta do’a tulus ikhlas yang tak henti-hentinya demi
kelancaran dan kesuksesan penulis dalam menuntut ilmu.
9. Sahabat-sahabat ku Yusuf Rahim, S.T, Burhanudin Robbani, di satu sisi kalian sebagai teman dan di sisi lain kalian adalah inspirator.
11.Teman-Teman Seperjuangan satu periode ini: Kak Mitra Septanto, S.Si, Kak Septian, S.Si, Kak Hery, S.Si, Muhamad Amin,S.Si, Tb didi Supriadi, S.Si, Idrus Sapto Wandiro, S.Si, Eko Wijianto, S.Si, Ahmad Ruzki, S.Si, Rizki Amalia, S.Si, dan Dani Setiawan Terima kasih banyak untuk kalian.
12.Teman-teman Laboratorium Biomassa Universitas Lampung: Mba reni, mba diah, mba tri, Kak gunadi, Kak rio, Raffel Stevano, S.Si serta paman terima kasih atas dukungan, bantuan, saran, dan diskusi.
13.Catalyst crew: Kak Mitra, Kak Septian, Kiki, Dani, terima kasih banyak atas diskusinya.
14.Teman-teman kimia angkatan ’07,’09, ’10, ‘11 FMIPA Unila, terima kasih atas segala dukungannya.
15.Ustad Eka Prasetiawan, Lc , Ustad Wahyudi, S.Pd.I, Danys Aditya, S.Pd, Angga Widodo, S.E, terima kasih banyak atas kepercayaan yang telah kalian berikan dan terima kasih banyak karena telah menerima saya sebagai keluarga besar PPM Annida.
16.Semua pihak yang telah membantu dan mendukung penulis dalam penyusunan skripsi ini.
Semoga Alloh SWT membalas kebaikan kalian semua. Amin Allohuma amin. Bandarlampung, Desember 2014
ii
DAFTAR ISI
Halaman
LEMBAR PENGESAHAN ………. i
DAFTAR ISI ………... ii
DAFTAR TABEL ……… iv
DAFTAR GAMBAR ………. v
I. PENDAHULUAN ………. 1
A. Latar Belakang ………. 1
B. Tujuan Penelitian ……….. 4
C. Manfaat Penelitian ……… 4
II. TINJAUAN PUSTAKA ……….. 5
A. Katalis... 5
B. Nanokatalis... ……… 8
E. Spinel Ferite ………...…….. 10
G. Karakterisasi Katalis ……….. 11
Analisis Struktur Kristal ……….. 11
Keasaman Katalis ……… 14
Analisis Morfologi Permukaan Katalis ……… 17
E. Reaksi Hidrogenasi CO2... 20
H. Analisis Produk ……… 22
III. METODELOGI PENELITIAN………. 24
A. Tempat dan Waktu Penelitian ……….. 24
B. Alat dan Bahan ………. 24
C. Prosedur Penelitian ……….. 25
iii
Karakterisasi Katalis ………. 25
Analisis Struktur Katalis ……….. 25
Analisis Keasaman Katalis ……….. 26
Analisis Morfologi Permukaan Katalis ……… 27
Uji Aktifitas Katalis ……….. 27
Analisis Produk Dengan Kromatografi Gas……….. 28
IV. HASIL DAN PEMBAHASAN………... …. 30
A. Preparasi Nanokatalis ... 30
B. Karakterisasi Nanokatalis ... 34
1. Analisis Struktur Kristal... 34
2. Analisis Keasaman Katalis ... 37
3. Analisis Morfologi Permukaan Katalis……… 43
C. Uji Aktivitas Katalis... 46
V. SIMPULAN DAN SARAN………. 56
A. Simpulan... 56
B. Saran……….. 57
DAFTAR PUSTAKA ……… 58
iv
DAFTAR TABEL
Tabel Halaman
1. Sifat-sifat fisika dan kimia dari CO2... ... 19
2. Hasil pencocokan puncak-puncak representatif... ... 36
3. Fase kristal yang terdapat pada nanokatalis... .... 35
4. Jumlah situs asam tiap 1 g nanokatalis... ... 38
5. Data serapan panjang gelombang IR NiMoFe 0,1... ... 39
6. Data serapan panjang gelombang IR NiMoFe 0,2... ... 41
7. Data serapan panjang gelombang IR NiMoFe 0,3... ... 42
8. Data standar GCMS senyawa alkohol... ... 47
v
DAFTAR GAMBAR
Gambar Halaman
1. Struktur Kristal Spinel Ferite ... 10
2. Mekanisme difraksi pada suatu bidang kristal ... 12
3.Difraktogram nanokristal MoO3 ... 13
4.Difraktogram standar MoO3 PDF 47-1320 (PCPDFwin, 1997) ... 13
5.Skema instrumentasi FTIR ... 15
6.Contoh spektra FTIR dalam penentuan jenis situs asam ... 16
7.Skema Kerja dari SEM ... 18
8.Mikrograf SEM dari NiCoFe2O4 ... 18
9.Model Koordinasi antara CO2 dengan Logam ... 21
10.Skema alat kromatografi gas ... 22
11. Kromatogram etanol... .. 23
12.Skema reaktor katalitik ... 28
13. Gel prekursor... ... 30
14. Prekursor setelah freeze-dry... ... 31
15. Serbuk katalis setelah proses kalsinasi... ... 33
16. Difraktogram nanokatalis Ni0,4MoxFe0,6-xO4... ... 34
17.Pencocokkan pola difraksi antara nanokatalis... ... 37
18. Spektra IR nanokatalis NiMoFe 0,1... ... 39
19. Spektra IR nanokatalis NiMoFe 0,2... ... 40
v
21. Mikrograf NiMoFe 0,1... ... 44
22. Mikrograf NiMoFe 0,2.... ... 44
23. Mikrograf nanowire NiMoO4.. ... 45
24. Mikrograf nanokatalis NiMoFe 0,3... ... 46
25. Kromatogram standar alkohol... ... 48
26. Kromatogram hasil uji aktivitas pada suhu 200 oC... ... 49
27. Kromatogram hasil uji aktivitas pada suhu 300 oC... ... 50
28. Kromatogram hasil uji aktivitas pada suhu 400 oC... ... 51
29. Spektrum hasil uji untuk puncak 1... ... 52
30. Spektrum standar etanol... ... 52
31. Spektrum hasil uji aktivitas untuk puncak 2... ... 53
32. Spektrum standar propanol... ... 53
33. Spektrum hasil uji aktivitas untuk puncak 3.. ... 54
1
I. PENDAHULUAN
A.Latar Belakang
Pada saat ini pemanasan global yang merupakan dampak dari berbagai aktifitas manusia sudah menjadi masalah yang serius. Efek dari pemanasan global ini mengakibatkan naiknya suhu bumi, naiknya permukaan laut, cuaca tidak menentu, dan berbagai bencana alam (Winarso, 2013). Semua efek pemanasan global ini terjadi karena adanya gas rumahkaca yang diemisikan ke atmosfer, salah satunya adalah CO2. Emisi gas CO2 terus meningkat. Pada tahun 2001, Indonesia berada
pada peringkat 21 yaitu sebesar 74 juta metrik ton dan 59% dari emisi tersebut dihasilkan dari bahan bakar berbasis karbon cair, 19% dari bahan bakar padat dan 15% dari bahan bakar gas (Marland et al., 2004). Selanjutnya, pada tahun 2005 menurut laporan dari World Resources Institute, Indonesia merupakan negara ke 15 terbesar dalam emisi gas rumahkaca dengan jumlah 503 Megaton CO2
ekuivalen dengan 1,5% dari jumlah total gas rumahkaca dunia (Baumert et al., 2005). Emisi CO2 ini diperkirakan akan terus meningkat dan menimbulkan
dampak negatif yang lebih besar terhadap lingkungan jika tidak segera ditanggulangi. Salah satu penanggulangan emisi gas CO2 tersebut adalah
2
Upaya yang telah dilakukan dalam pemanfaatan gas CO2 adalah konversi CO2
menjadi metana (Mohamed et al., 2010), hidrokarbon rantai panjang lainnya (Zhanghuai dan Yuan, 2000), metanol (Guo et al. 2011), etanol (Hussain et al., 2009) dan alkohol rantai panjang lainnya. Sebagian besar pengembangan konversi CO2 tersebut bertujuan untuk membuat bahan bakar terbarukan yang diharapkan
tidak hanya mengurangi emisi CO2 tetapi juga mengurangi penggunaan bahan
bakar fosil.
Konversi CO2 yang telah dikembangkan merupakan konversi katalitik. Produk
konversi CO2 sangat bergantung pada katalis yang digunakan. Sebagai contoh,
metanol dihasilkan dari hidrogenasi CO2 sebagai produk utama jika digunakan
katalis berbasis Cu, khususnya Cu/ZnO/ZrO dimana logam-logam ini berfungsi sebagai oksidator (Hussain et al.,2009). Dengan demikian, pemilihan katalis yang tepat akan mengarahkan reaksi ke arah produk utama yang diinginkan (Srinivas et
al., 2009). Lebih jauh lagi, katalis yang digunakan untuk hidrogenasi CO2 harus
dapat melakukan reaksi FT (Fischer Tropsch) yang diawali dengan RWGS
(Reverse Water Gas Shift) untuk mengubah CO2 menjadi CO (Weatherbee, 1984).
Katalis berbasis Molibdenum (Mo) dapat menjalani reaksi FT dan RWGS yaitu pada reaksi reduksi CO2 menjadi metana (Liu et al., 2003). Selain itu katalis
berbasis Molibdenum telah banyak digunakan sebagai katalis seperti hidrogenasi CO2 menjadi metanol (Shao et al., 2001), oksidasi metanol (Perez et al.,2011),
3
Upaya lain yang potensial untuk meningkatkan konversi CO2 + H2 adalah
menggunakan nanokatalis. Katalis yang berukuran nanometer dapat diperoleh dengan menggunakan agen pembuat gel yang tepat pada metode sol-gel. Protein putih telur (albumin) telah banyak digunakan sebagai agen pembuat gel, foaming, dan memiliki sifat pengemulsi. Hal ini dikarenakan kelarutannya dalam air dan kemampuannya dalam berikatan dengan ion logam dalam larutan (Bagheri et.al., 2012). Nanokatalis memiliki aktivitas yang lebih baik sebagai katalis karena material nanokatalis memiliki luas permukaan yang luas dan rasio-rasio atom yang tersebar secara merata pada permukaannya. Sifat ini menguntungkan untuk transfer massa di dalam pori-pori dan juga menyumbangkan antar muka yang besar untuk reaksi-reaksi adsorpsi dan katalitik (Widegren et al., 2003). Menurut El-Kherbawi (2010), katalis dengan berbagai macam campuran oksida logam dalam suatu sistem katalis mempunyai keaktifan yang lebih tinggi jika dibandingkan dengan logam tunggal itu sendiri.
Pada penelitian sebelumnya, Septanto (2012) telah berhasil melakukan konversi CO2/H2 dengan katalis NiCoFe2O4 sebagai hasil pengembangan lebih lanjut dari
penambahan logam Co pada struktur katalis NiFe2O4. Katalis yang diperoleh
masih memiliki kekurangan, dimana belum memberikan kristalin yang homogen dan hanya salah satu varian (FNCo 02) dari tiga varian yang memiliki ukuran nano (85 nm). Reaksi konversi CO2/H2 dilakukan pada rentang suhu 200 – 400oC
4
Berdasarkan penjelasan di atas dan mengacu pada penelitian sebelumnya, maka katalis NiFe2O4 akan dikembangkan lebih lanjut dengan penambahan logam Mo
ke dalam struktur katalis NiFe2O4 serta merubah ukuran partikelnya ke dalam
skala nano, dengan harapan dapat meningkatkan aktivitas katalis NiFe2O4 dalam
mengkonversi CO2. Pada penelitian ini akan dilakukan pembuatan nanokatalis
NixMoyFe(1-x-y)O3±δ( x= 0,4; y = 0,1-0,3) dengan metode sol-gel, sonikasi secara
simultan dan freeze-dry, serta uji aktivitas katalitiknya terhadap reaksi konversi (CO2 + H2) pada rentang suhu 200 – 400oC dan tekanan 1 atm.
B.Tujuan Penelitian
Mendapatkan dan menguji keaktifan nanokatalis Ni0,4MoxFe(1-x)O3±δ terhadap
konversi (CO2+H2) pada rentang suhu 200 – 400 oC dan melihat pengaruh
penambahan logam Mo dalam aktivitas katalitiknya.
C. Manfaat Penelitian
Memberi gambaran tentang penggunaan nanokatalis Ni0,4MoxFe(1-x)O3±δ pada
5
II. TINJAUAN PUSTAKA
A.Katalis
Katalis merupakan zat yang mampu meningkatkan laju suatu reaksi kimia agar reaksi tersebut dapat berjalan lebih cepat. Dalam suatu reaksi sebenarnya katalis ikut terlibat, tetapi pada akhir reaksi terbentuk kembali seperti bentuknya semula. Dengan demikian, katalis tidak memberikan tambahan energi pada sistem dan secara termodinamika tidak dapat mempengaruhi keseimbangan. Katalis mempercepat reaksi dengan cara menurunkan energi aktivasi reaksi. Penurunan energi aktivasi tersebut terjadi sebagai akibat dari interaksi antara katalis dan reaktan. Katalis menyediakan situs-situs aktif yang berperan dalam proses reaksi. Situs-situs aktif ini dapat berasal dari logam-logam yang terdeposit pada pengemban atau dapat pula berasal dari pengemban sendiri. Logam-logam tersebut umumnya adalah logam-logam transisi yang menyediakan orbital d kosong atau elektron tunggal yang akan disumbangkan pada molekul reaktan sehingga terbentuk ikatan baru dengan kekuatan ikatan tertentu (Campbell, 1998).
6
Walaupun banyak keuntungan dari katalis logam homogen, kekurangannya adalah
pada proses pemisahan dari campuran terkadang juga menghambat
penggunaannya dalam industri. Katalis Heterogen menghasilkan kemudahan
dalam pemisahan dan penggunaan ulang katalis dari suatu campuran. Laporan
terakhir mengungkapkan bahwa katalis berukuran nanometer merupakan katalis
yang efisien dan dapat dengan mudah dipisahkan dari campuran reaksi (Yoon et
al., 2003; Stevens et.al., 2005; Stevens et.al., 2005). Tingginya luas permukaan
terhadap perbandingan volume dari nanopartikel logam oksida memainkan
peranan penting dari kemampuan katalis tersebut (Bell, 2003).
Dalam katalis heterogen, reaktan dan katalis berada dalam fasa yang berbeda. Dalam katalis heterogen, zat padat yang bertindak sebagai katalis dapat mengikat sejumlah gas atau cairan pada permukaannya berdasarkan adsorspsi. Saat ini, proses katalitik heterogen dibagi menjadi dua kelompok besar, reaksi-reaksi reduksi-oksidasi (redoks), dan reaksi-reaksi asam-basa. Reaksi-reaksi redoks meliputi reaksi-reaksi dimana katalis mempengaruhi pemecahan ikatan secara homolitik pada molekul-molekul reaktan menghasilkan elektron tak berpasangan, dan kemudian membentuk ikatan secara homolitik dengan katalis melibatkan elektron dari katalis. Sedangkan reaksi-reaksi asam-basa meliputi reaksi-reaksi dimana reaktan membentuk ikatan heterolitik dengan katalis melalui penggunaan pasangan elektron bebas dari katalis atau reaktan (Li, 2005).
7
kontak katalis didasarkan pada proses adsorpsi – desorpsi. Akibat terjadinya adsorpsi kimia, aktivitas molekul mengalami perubahan. Atom yang teradsorpsi menjadi lebih reaktif dibandingkan molekul bebasnya, karena mengalami pemutusan ikatan kovalen atau ikatan hidrogen. Proses adsorpsi menyebabkan berkurangnya energi bebas (G) sistem sehingga entropi (S) juga berkurang. Berdasarkan persamaan 1,
∆G = ∆H–T . ∆S (1)
maka dapat dikatakan bahwa proses adsorpsi tersebut adalah eksotermik (Adamson, 1990).
8
B. Nanokatalis
Nanosains dan nanoteknologi adalah sintesis, karakterisasi, eksplorasi dan eksploitasi dari material berukuran-nano. Material ini terkarakterisasi oleh ukuran dimensinya yaitu nanometer (1 nm = 10-9 m). Yang termasuk nanostruktur adalah
clusters, quantum dots, nanokristal, nanowires, dan nanotubes ( Rao et al., 2004; Rao and Cheetham, 2001). Material nanopartikel telah banyak menarik peneliti karena material nanopartikel menunjukkan sifat fisika dan kimia yang sangat berbeda dari bulk materialnya, seperti kekuatan mekanik, elektronik, magnetik, kestabilan termal, katalitik dan optik (Mahaleh et al., 2008; Deraz et al., 2009).
Nanokatalis sendiri adalah nanopartikel yang memiliki peran sebagaimana mestinya katalis yaitu mempercepat suatu reaksi tanpa ikut serta dalam hasil reaksi. Keunggulan nanokatalis adalah aktivitas yang lebih baik sebagai katalis karena material nanokatalis memiliki permukaan yang luas dan rasio-rasio atom yang tersebar secara merata pada permukaannya. Sifat ini menguntungkan untuk transfer massa di dalam pori-pori dan juga menyumbangkan antar muka yang besar untuk reaksi-reaksi adsorpsi dan katalitik (Widegren et al., 2003).
9
menangani pencemaran lingkungan (Sietsma et al., 2007). Salah satu nanokatalis tersebut adalah katalis berjenis spinel ferite.
Banyak metode yang telah dikembangkan untuk sintesis nanokatalis, Berbagai metode dari pembuatan nanokatalis spinel ferrite seperti ball milling, metode keramik dengan pembakaran (Khedr et al., 2006), koopresipitasi (Khedr et al., 2006; Silva et al., 2004; Zi et al., 2009), reverse micelles (Calero-Ddelc and Rinaldi, 2007), metode hidrotermal (Zhao et al., 2007), polymeric precursor (Gharagozlou, 2009), sol-gel (Gul and Masqood, 2008), microemulsions (Pillai and Shah,1996), laser ablation (Zhang and Lan, 2008), metode poliol (Baldi et
al., 2007), metode sonokimia (Shafi et al., 2007), dan metode aerosol (Singhai et al., 2005).Dari beberapa metode sintesis tersebut, dalam penelitian ini digunakan metode sol-gel untuk mendapatkan nanokatalis NiMoFe2O4. Metode sol-gel ini
dipilih karena secara luas telah digunakan dalam sintesis katalis berpendukung logam. Selain itu metode ini memiliki banyak keunggulan seperti dispersi yang tinggi dari spesi aktif yang tersebar secara homogen pada permukaan katalis, tekstur porinya memberikan kemudahan difusi dari reaktan untuk masuk ke dalam situs aktif (Lecloux and Pirard, 1998), luas permukaan yang cukup tinggi, peningkatan stabilitas termal, serta kemudahannya dalam memasukkan satu atau dua logam aktif sekaligus dalam prekursor katalis (Lambert and Gonzalez, 1998). Dengan alasan ini diharapkan keunggulan dari metode sol-gel ini dapat diterapkan pada katalis spinel ferite NiMoFe2O4 dalam uji aktivitasnya terhadap konversi gas
10
B.Spinel Ferite
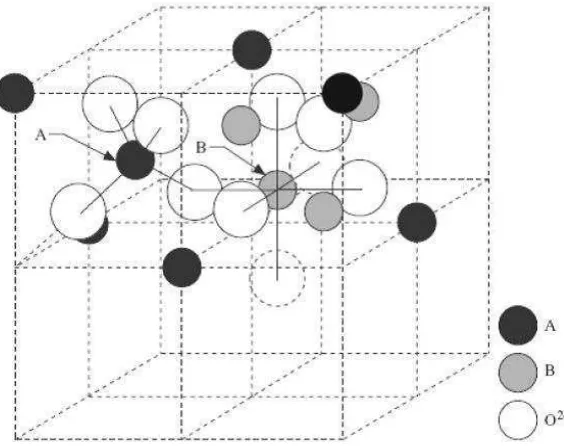
Spinel ferite adalah katalis yang memiliki rumus umum AB2O4 dimana A adalah
[image:30.595.174.456.350.573.2]kation-kation bervalensi 2 seperti Fe, Ni, Mo, dll., yang menempati posisi tetrahedral dalam struktu kristalnya dan B adalah kation-kation bervalensi 3 seperti Fe, Mn, Cr dll., yang menempati posisi oktahedral dalam struktur kristalnya, serta terdistribusi pada lattice fcc yang terbentuk oleh ion O 2-(Kasapoglu et al., 2007 ; Almeida et al., 2008 ; Iftimie et al., 2006). Gambar 1 berikut adalah struktur kristal spinel ferite.
Gambar 1. Struktur Kristal Spinel Ferite ( Zhang, 2006)
11
Salah satu spinel ferite yang telah banyak digunakan sebagai katalis adalah nikel ferite (NiFe2O4). Nikel ferite ini memiliki struktur spinel terbalik (inverse) yang
mana setengah dari ion Fe mengisi pada posisi tetrahedral (posisi A) dan sisanya menempati posisi pada oktahedral (posisi B) hal ini dapat dituliskan dengan rumus (Fe3+1.0)[Ni2+1.0Fe3+1.0]O2-4 (Kasapoglu et al., 2007 ; Maensiri et al., 2007).
NiFe2O4 telah banyak digunkan sebagai katalis untuk benzoilasi toluene dengan
benzil klorida dan kemampuan sebagai sensor gas klorin pada konsentrasi rendah (Ramankutty and Sugunan, 2001 ; Reddy et al., 1999 ; Iftimie et al., 2006) untuk reaksi hidrogenasi (CO2 + H2) menjadi senyawa alkohol (Situmeang et al., 2010).
C.Karakterisasi Katalis
Karakterisasi adalah hal yang sangat penting dalam bidang katalisis. Beberapa metode seperti difraksi, spektroskopi, dan mikroskopi memberikan kemudahan dalam menyelidiki sifat-sifat suatu katalis, sehingga diharapkan kita dapat mendapatkan pemahaman yang lebih baik tentang katalis agar kita dapat meningkatkan atau mendesain suatu katalis yang memiliki aktivitas yang lebih baik (Chorkendorf and Niemantsverdriet, 2003).
1. Analisis Struktur Kristal
Keberadaan atau terbentuknya katalis NiMoFe2O4 dalam bentuk amorf dan kristal
12
dengan sampel yang telah diketahui, maka identitas dari sampel yang tidak diketahui itu dapat diketahui (Skoog dan Leary, 1992).
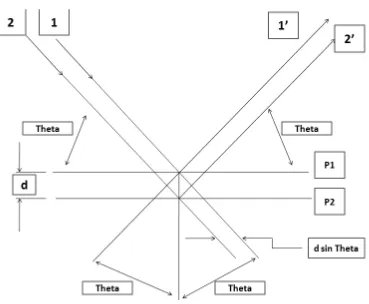
Dari Gambar 2, dua sinar datang yaitu sinar 1 dan 2 menghasilkan sudut (theta). Sebuah hasil pencerminan maksimum dari planes akan menghasilkan gelombang
yaitu 1’ dan 2’ dalam satu fase. Perbedaan dari panjang dari 1 terhadap 1’ dan 2
terhadap 2’ kemudian diintegralkan dari panjang gelombang (Lambda) dan kita
dapat menggambarkan hubungan matematik hukum Bragg (Scintag Inc., 1999).
n
d.sin 2
[image:32.595.135.504.393.697.2]Gambar 2 berikut merupakan mekanisme sinar datang dan sinar refleksi dari sinar-X pada suatu bidang kristal.
13
Dari Gambar 2 diatas, akan didapatkan difraktogram XRD. Gambar 3 berikut adalah contoh difraktogram XRD MoO3 yang disintesis menggunakan metode
[image:33.595.123.501.183.393.2]hydrotermal (Peng, 2011).
Gambar 3. Difraktogram nanokristal MoO3 (Peng, 2011)
Difraktogram di atas diinterpretasikan melalui pencocokan dengan difraktogram standar. Gambar 4 berikut adalah difraktogram standar yang digunakan dalam pencocokan difraktogram di atas.
[image:33.595.125.500.553.683.2]14
Dari Gambar 5 di atas, puncak-puncak yang mewakili MoO3terdapat pada 2θ
12,850o; 25,860o ;dan 39,050o.
2. Keasaman Katalis
Dalam penelitian ini untuk menentukan sifat keasaman yang terdapat pada katalis NiMoFe2O4 dilakukan análisis keasaman, yang meliputi penentuan jumlah situs
asam dan jenis situs asam. Penentuan jumlah situs asam memberikan informasi tentang banyaknya situs asam yang terkandung pada katalis, yang pada umumnya berbanding lurus dengan situs aktif pada katalis yang menentukan keaktifan suatu katalis. Sedangkan penentuan jenis situs asam memberikan informasi tentang situs asam yang terkandung pada katalis apakah asam Lewis atau asam Brӧ nsted-Lowry, yang pada umunya berkaitan dengan interaksi ikatan yang terjadi antara katalis dan reaktan.
15
Sedangkan untuk penetuan jenis situs asam yang terkandung dalam katalis dapat ditentukan menggunakan spektroskopi infra merah (FTIR) dari katalis yang telah mengadsorpsi basa adsorbat (Seddigi, 2003). Spektroskopi inframerah adalah metode analisis yang didasarkan pada absorpsi radiasi inframerah oleh sampel yang akan menghasilkan perubahan keadaan vibrasi dan rotasi sampel. Frekuensi yang diabsorpsi tergantung pada frekuensi vibrasi dari molekul (karakteristik). Intensitas absorpsi bergantung pada seberapa efektif energi foton inframerah dipindahkan ke molekul, yang dipengaruhi oleh perubahan momen dipol yang terjadi akibat vibrasi molekul (Åmand and Tullin, 1999)
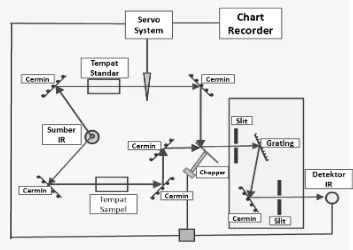
[image:35.595.137.490.471.721.2]Instrumen FTIR menggunakan sistem yang disebut dengan interferometer untuk mengumpulkan spektrum. Interferometer terdiri atas sumber radiasi, pemisah berkas, dua buah cermin, laser dan detektor. Skema lengkap dari instrumentasi FTIR ditunjukan pada Gambar 5.
16
[image:36.595.120.507.177.418.2]Gambar 6 berikut adalah contoh spektra FTIR dalam analisis penentuan jenis situs asam dalam katalis.
Gambar 6. Contoh spektra FTIR dalam penentuan jenis situs asam (Septanto, 2012)
Spektra yang dihasilkan dari FTIR, jenis situs asam (Brӧnsted-Lowry atau Lewis) yang terdapat pada katalis dapat diketahui melalui puncak-puncak serapan yang dihasilkan dari interaksi basa adsorbat dengan situs-situs asam tersebut. Pada penggunaan piridin sebagai basa adsorbat, situs asam Brӧnsted-Lowry akan ditandai dengan puncak serapan pada bilangan-bilangan gelombang 1485 – 1500, ~1620, dan ~1640 cm-1. Sedangkan untuk situs asam Lewis ditandai dengan
puncak-puncak serapan pada bilangan-bilangan gelombang 1447 – 1460, 1488 –
17
3. Analisis Morfologi Permukaan Katalis
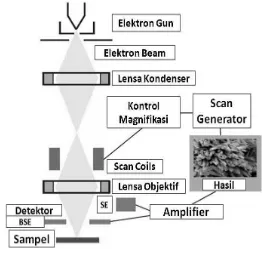
Interaksi antara gas dan permukaan material dan reaksi-reaksi pada permukaan material memiliki peran yang sangat penting dalam bidang katalisis. Siklus awal katalsis diawali dengan adsorpsi molekul reaktan pada permukaan katalis. Oleh karena itu kita perlu untuk mempelajari morfologi permukaan dari katalis (Chorkendorff and Niemantsverdriet, 2003). Untuk mempelajari morfologi permukaan katalis dapat menggunakan instrumentasi Scanning Electron
Microscopy (SEM) (Ertl et al., 2000).
SEM merupakan metode untuk menggambarkan permukaan suatu bahan dengan resolusi yang tinggi. Resolusi yang tinggi pada SEM dihasilkan dari penggunaan elektron dalam menggambarkan permukaan bahan. Resolusi yang dihasilkan juga jauh lebih tinggi dibandingkan dengan mikroskop cahaya (0,1 – 0,2 nm untuk SEM dan 200 nm untuk mikroskop cahaya) (Hanke, 2001).
18
[image:38.595.175.437.117.376.2]Skema kerja dari SEM ditunjukkan dalam Gambar 7 berikut.
Gambar 7. Skema kerja dari SEM
[image:38.595.239.387.599.726.2]Gambar yang dihasilkan SEM, dibentuk dari elektron sekunder yang dipantulkan sampel pada peristiwa penembakan berkas elektron dari alat. Permukaan yang lebih tinggi akan memberikan warna yang lebih cerah daripada permukaan yang lebih rendah, ini diakibatkan oleh lebih banyaknya elektron sekunder yang dibebaskan menuju detektor (Ertl et al., 2000). Gambar 8 berikut ini adalah contoh mikrograf SEM untuk NiCoFe2O4.
19
Dari Gambar 8 di atas, dapat dilihat bahwa bahan katalis yang dipreparasi
memberikan bentuk kristalin yang homogen dan berukuran nano, 0,1m (± 85
nm). Pada latar tampak seperti butiran, dan lebih ke depan tampak seperti
gumpalan atau aglomer dari butiran kristal dengan ukuran 2 m, serta tampak
bentuk silinder atau tabung memanjang dengan ukuran penampang 0,1 m. Molekul yang teraglomerasi ini tersusun atas partikel-partikel yang lebih kecil, dimana partikel-partikel kecil ini saling meresap satu sama lain membentuk partikel yang lebih besar(Septanto, 2012).
D.Reaksi Hidrogenasi CO2
CO2 merupakan molekul linear yang simetris, dengan panjang ikatan C – O
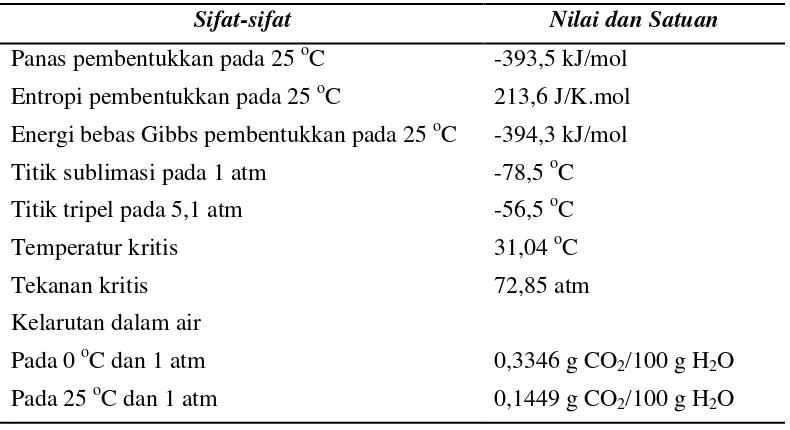
[image:39.595.108.503.489.704.2]sebesar 1,16 Å (Volpin and Kolomnikov, 1972). Beberapa sifat-sifat fisika dan kimia dari CO2 dirangkum dalam Tabel 1 berikut.
Tabel 1. Sifat-sifat fisika dan kimia dari CO2 (Song et al., 2002)
Sifat-sifat Nilai dan Satuan
Panas pembentukkan pada 25 oC -393,5 kJ/mol Entropi pembentukkan pada 25 oC 213,6 J/K.mol Energi bebas Gibbs pembentukkan pada 25 oC -394,3 kJ/mol Titik sublimasi pada 1 atm -78,5 oC Titik tripel pada 5,1 atm -56,5 oC
Temperatur kritis 31,04 oC
Tekanan kritis 72,85 atm
Kelarutan dalam air Pada 0 oC dan 1 atm Pada 25 oC dan 1 atm
0,3346 g CO2/100 g H2O
20
Dari Tabel 1 di atas, panas pembentukkan (H0) dan energi bebas Gibbs
pembentukkan (G0) dari CO
2 adalah dua sifat penting. Nilai-nilai tersebut secara
luas digunakan untuk memperkirakan panas pembentukkan dan energi bebas Gibbs standar dari berbagai reaksi (Indala, 2004). Salah satu reaksi tersebut adalah reaksi hidrogenasi katalitik CO2.
Hidrogenasi katalitik CO2 merupakan gabungan dua taha pereaksi yaitu
pergeseran terbalik air dan gas (RWGS) dan reaksi sintesis Fischer-Tropsch (Joo and Jung, 2003). Reaksi pergeseran terbalik air dan gas (RWGS) adalah reaksi antara CO2 dengan H2 untuk menghasilkan CO dan H2O. Konversi CO2 menjadi
CO ini memainkan peran yang sangat penting dalam hidrogenasi CO2, karena
kestabilan CO2 tidak memungkinkan untuk melakukan hidrogenasi secara
langsung (Joo, 1999), akibatnya sejumlah energi harus diberikan untuk mendorong reaksi ke arah yang diinginkan (Creutz and Fujita, 2000). Persamaan reaksi untuk RWGS adalah sebagai berikut :
O H CO H CO katalis 2 2
2 H 41kJ mol, G 29kJ mol
0
0
CO yang dihasilkan dari RWGS kemudian mengalami reaksi hidrogenasi melalui reaksi sintesis Fischer-Tropsch. Produk yang dihasilkan dapat berupa parafin-parafin linear, α-olefin, ataupun hidrokarbon yang mengandung oksigen seperti alkohol dan eter (Bakhtiariet al., 2008).
Karbon dioksida mampu menjalani reaksi hidrogenasi katalitik karena CO2 dapat
21
melalui donasi elektron dari logam ke orbital karbon dengan membentuk turunan asam logam. Dan ketiga melalui pembentukkan kompleks-π melalui ikatan ganda C = O. Ketiga model koordinasi tersebut ditunjukkan pada Gambar 9 berikut.
M O C O M
C O O M O C O
I II III
Gambar 9. Model koordinasi antara CO2 dengan logam
(I) melalui donasi elektron bebas oksigen ke orbital kosong dari logam (II) melalui donasi elektron dari logam ke orbital karbon
(III) melalui pembentukkan kompleks-π melalui ikatan ganda C = O
Dari ketiga model koordinasi di atas, model II dan III adalah model yang paling disukai. Model pertama hanya akan terjadi jika senyawa logam merupakan asam Lewis yang kuat (Volpin and Kolomnikov, 1972).
E.AnalisisProduk
Produk konversi CO2 pada umumnya merupakan senyawa organik yang bersifat
mudah menguap (volatil), produk tersebut dapat berupa parafin-parafin linear, α -olefin, ataupun hidrokarbon yang mengandung oksigen seperti alkohol dan eter (Bakhtiariet al., 2008). Namun dalam penelitian ini produk utama yang diharapkan adalah senyawa alkohol, sehingga untuk mengidentifikasi produk tersebut maka perlu dilakukannya analisis produk konversi CO2, salah satu
metode identifikasi yang umum digunakan adalah kromatografi gas.
Dengan metode ini, produk alkohol hasil konversi CO2 dapat dipisahkan antara
22
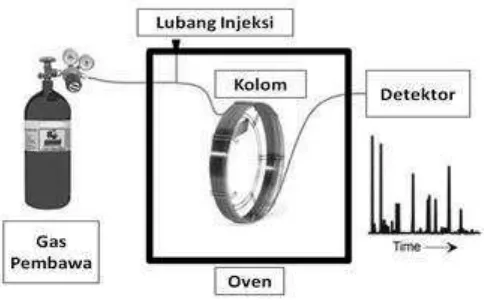
[image:42.595.195.437.236.386.2]Perbedaan waktu retensi ini akibat adanya interaksi antara sampel dengan kolom dalam proses pemisahan. Pemisahan sampel menjadi komponen-komponen tunggalnya oleh kolom kromatografi gas dapat dijelaskan melalui konsep yang sangat sederhana seperti ditunjukkan dalam Gambar 10 (McNair and Miller, 1997). Berikut ini adalah skema dari alat Kromatografi Gas :
Gambar 10. Skema alat Kromatografi Gas
23
[image:43.595.193.435.165.312.2]serangkaian proses analisis maka diperoleh suatu kromatogram seperti Gambar 11.
Gambar 11. Kromatogram etanol (Septanto, 2012)
Kromatogram di atas adalah hasil analisis kromatografi gas dari uji katalitik (CO2+H2) oleh katalis FNCo 03. Pada kromatogram hasil uji aktivitas pada suhu
24
III. METODOLOGI PENELITIAN
A. Tempat dan Waktu Penelitian
Penelitian ini telah dilakukan di Laboratorium Biomassa Terpadu Universitas Lampung. Analisis Difraksi Sinar-X dan morfologi permukaan dilakukan di Laboratorium Pusat Teknologi Bahan Industri Nuklir (PTBIN) Batan Serpong, analisis keasaman dilakukan di Laboratorium Biomassa Universitas Lampung. Uji aktivitas katalis dilakukan di Laboratorium Biomassa Universitas Lampung, dan analisis hasil uji aktivitas dilakukan di Laboratorium Kimia FMIPA Universitas Islam Negeri Jakarta. Penelitian ini dilakukan dari bulan April 2013 sampai dengan bulan Juli 2013.
B. Alat dan Bahan
Peralatan yang digunakan dalam penelitian ini antara lain, pengaduk magnetik,
furnace Lenton 3508, neraca analitik, freeze-dry, difraktometer sinar-X, Scanning Electron Microscopy (SEM) JEOL JSM-6510la, Fourier Transform Infra Red
(FTIR) Varian 2000 , reaktor katalitik, Kromatografi Gas (KG) GC Shimadazu
QP2010 dengan detektor FID, desikator dan peralatan gelas laboratorium.
25
Ammonium Heptamolibdat (Merck, 99%) (NH4)6Mo7O24.4H2O, piridin (J.T.
Baker), C5H5N, putih telur, gas argon (Bumi Waras 99,95%), gas hidrogen (BOC
99,99%), gas CO2 (BOC 99,99%), dan akuades/bides.
C. Prosedur Kerja
1. Pembuatan Nanokatalis
Pembuatan nanokatalis NixMoyFe1-x-yO3±σ (variabel x = 0,4; y = 0,1-0,3) dilakukan dengan cara melarutkan 120 mL putih telur dalam 80 mL aquades. Larutan kemudian diaduk menggunakan pengaduk magnet pada suhu ruang sampai diperoleh larutan yang homogen. Kemudian ke dalam larutan putih telur ditambahkan 1,8604 g Ni(NO3)2.6H2O, 3,2308 g Fe(NO3)3.9H2O, dan 2,0537 g
(NH4)6Mo7O24.4H2O (untuk y = 0,1) secara perlahan-lahan. Kemudian campuran
diaduk menggunakan pengaduk magnet yang disertai dengan sonikasi secara simultan pada suhu ruang sampai diperoleh larutan yang homogen. Setelah itu campuran homogen dipanaskan menggunakan hot plate pada suhu 80oC sampai terbentuk gel prekursor Ni0,4 Mo0,1Fe0,5O4. Setelah itu, gel prekursor dikeringkan
berdasarkan pengeringan pada suhu rendah dengan menggunakan freeze-dry. Selanjutnya, padatan kering Ni0,4 Mo0,1Fe0,5O4 dikalsinasi secara bertahap dengan
kenaikan 1 oC/menit dimulai dari suhu 120 oC ditahan selama 2 jam, 350 oC 3 jam, dan 600 oC 3 jam. Perlakuan yang sama juga dilakukan untuk sintesis
26
2. Karakterisasi Katalis a. Analisis Struktur Kristal
Analisis struktur kristal dilakukan menggunakan instrumentasi difraksi sinar-X. Prosedur analisis ini disesuaikan dengan penelitian yang telah dilakukan oleh Maiti et al., (1973). Analisis dilakukan menggunakan radiasi CuKα (1,5425 Å), tabung sinar-X dioperasikan pada 40 kV dan 200 mA. Rentang difraksi yang diukur (2θ) dalam rentang 15 – 70o, dengan scan step size 0,05o/menit. Puncak-puncak yang terdapat pada difraktogram kemudian diidentifikasi menggunakan metode Search Match dengan standar file data yang terdapat dalam program PCPDF-win 1997 (Drbohlavova et al., 2009).
b. Analisis Keasaman Katalis
Penentuan jumlah situs asam pada katalis dilakukan secara gravimetri (ASTM, 2005) melalui kemisorpsi basa piridin. 0,2 g katalis ditimbang, dimasukkan ke dalam wadah dan diletakkan di dalam desikator bersama basa piridin. Desikator di tutup selama 24 jam untuk memberikan waktu katalis mengadsorpsi basa piridin. Setelah 24 jam, sampel katalis dikeluarkan dan dibiarkan di tempat terbuka selama 2 jam. Kemudian sampel katalis ditimbang. Selanjutnya jumlah situs asam yang terdapat pada katalis ditentukan menggunakan persamaan berikut.
Dimana, w1 = Berat wadah kosong
w2 = Berat wadah + cuplikan
w3 = Berat wadah + cuplikan yang telah mengadsorpsi piridin
27
Penentuan jenis situs asam katalis, dilakukan secara kualitatif menggunakan spektroskopi inframerah. Sampel katalis yang dianalisis dicampur dengan KBr kemudian dimasukkan ke dalam vessel sampel, lalu dilakukan pengukuran. Kemudian dilakukan analisis dari spektra yang didapat pada daerah bilangan gelombang 1200 – 2100 cm-1 (Rodiansono dkk, 2007).
c. Analisis Morfologi Permukaan Katalis
Analisis morfologi permukaan katalis dilakukan menggunakan Scanning Electron
Microscopy (SEM). 0,25 g sampel katalis yang akan dianalisis ditempatkan pada wadah sampel yang mengandung sticking tape tembaga, kemudian sampel dilapisi lapisan tipis emas atau bahan yang besifat konduktor lainnya (Drbohlavova et al., 2009). Kemudian sampel tersebut diberikan berkas elektron. Berkas elektron akan dipantulkan oleh sampel untuk kemudian ditangkap detektor membentuk foto (Hanke, 2001).
3. Uji Aktivitas Katalis
28
Keterangan :
[image:48.595.189.441.85.239.2]1 – 3 = regulator (flowmeter), 4 – 6 = pengatur aliran gas, 7 = wadah pencampur, 8 – 9 = penghubung swagelock, 10 = termokopel, 11 = wadah katalis, 12 = furnace, 13 = valve, 14 = wadah penampung.
Gambar 11. Skema reaktor katalitik.
Sampel katalis sebanyak 20 mg ditempatkan pada tabung reaktor. Kemudian katalis dipanaskan sampai suhu reaksi, suhu kemudian dipertahankan selama 45 menit. Kemudian dialirkan gas CO2, H2 dan Ar dengan perbandingan CO2 : H2 = 1
: 3, dan laju aliran total CO2, H2 dan Ar adalah 50 mL/menit atau setara 3 L/jam,
reaksi kemudian dibiarkan selama 45 menit. Variasi suhu yang dilakukan adalah 200 oC, 300 oC dan 400 oC. Hasil katalisis yang keluar dari tabung reaktor kemudian ditampung dalam wadah penampung. Hasil dari uji aktivitas ini selanjutnya dianalisis menggunakan Kromatografi Gas.
4. Analisis Produk dengan Kromatografi Gas
Sebanyak 5 μL hasil dari uji aktivitas diinjeksikan ke dalam instrumentasi kromatografi gas. Instrumentasi kromatografi gas diatur dengan parameter-parameter sebagai berikut :
29
Detektor : FID
Suhu : 210oC (injektor) dan 50oC (kolom)
V. SIMPULAN DAN SARAN
A. Simpulan
Berdasarkan data-data yang didapat dari penelitian ini maka dapat diambil kesimpulan bahwa :
1. Katalis yang disintesis menggunakan metode sol-gel , sonikasi secara simultan, dan freeze-dry dengan putih telur adalah NiMoFe2O4.
2. Berdasarkan hasil analisis difraksi sinar-X (XRD) menunjukkan bahwa terbentuk fasa kristalin NiMoO4 , Fe2(MoO4)3 , FeMoO4 , Mo4O11 , dan
NiFe2O4. Fase NiMoO4 dan FeMoO4 adalah fase paling dominan dan fase
NiFe2O4 adalah fase yang paling sedikit.
3. Berdasarkan hasil analisis FTIR , situs asam Lewis (1455 cm-1) dan situs asam Brönsted-Lowry (1545 cm-1) pada permukaan nanokatalis masing- masing memiliki intensitas relatif yang sama.
4. Hasil analisis menggunakan SEM menunjukkan bahwa nanokatalis Ni0,4MoxFe1-xO4 memiliki morfologi permukaan yang tidak seragam.
5. Selanjutnya dengan menggunakan metode Debye-Scherrer, maka didapatkan ukuran butiran nanokatalis Ni0,4Mo0,1Fe0,5O4,
Ni0,4Mo0,2Fe0,4O4, dan Ni0,4Mo0,3Fe0,3O4 masing-masing adalah 53,64 nm,
57
6. Secara umum nanokatalis Ni0,4Mo0,1Fe0,5O4 aktif dalam konversi CO2/H2
pada suhu 400 oC menjadi etanol, propanol, dan butanol dengan konsentrasi masing-masing 61,49%; 18,89%; dan 19,61%.
B. Saran
Berdasarkan penelitian yang telah dilakukan, maka untuk penelitian selanjutnya perlu disarankan :
1. Logam Mo yang digunakan memiliki waktu pelarutan yang cukup lama, sebaiknya menggunakan jenis logam selain Mo dalam metode sol-gel untuk mendapatkan katalis berukuran nano dengan sifat-sifat katalis yang lebih baik.
2. Melakukan variasi perbandingan laju alir CO2 dan H2 pada uji aktivitas
katalis.
DAFTAR PUSTAKA
Almeida, J. M. A., C. T. Meneses, A. S. de Menezes, R. F. Jardim, and J. M. Sasaki. 2008. Synthesis and Characterization of NiMn2O4
Nanoparticles Using Gelatin as Organic Precursor. Journal of Magnetism and Magnetic Materials,320 : 304 - 307.
ASTM D4824-03. 2005. Test Method for Determination of Catalyst Acidity by Ammonia Chemisortption. Annual Book of ASTM.
Bakhtiari, M., F. Khorasheh, A. Zamanian, A. Nakhaeipour, and M. Irani. 2008. Preparation, Evaluation and Characterization of Monolithic Catalysts For Fischer-Tropsch Synthesis. Petroleum & Coal, 50 : 56 - 61.
Baumert, Kavin A.2005. Navigating The Numbers,Greenhouse Gas Data And International Climate Policy. World Resources Institute.
Bayliss, P.. 1976. X-ray Diffraction Powder Data. Department of Geology, University of Calgary. Canada, 335.
Bell A.T.2003. Science,299 : 1688
Berry, S., Rice, A and John, R.1980. Physical Chemistry. John Wiley and Sons. Cabrera, I. M., M. L. Granados, P. Terreros, and J. L. G. Fierro. 1998. CO2
Hydrogenation Over Pd-Modified Methanol Synthesis Catalysts. Catalysis Today, 45: 251 - 256.
Campbell, I. M. 1988. Catalyst at Surface. New York, USA: Chapman and Hall. Campanati, M., G. Fonsari, A. Vaccari. 2003. Fundamentals in The Preparation of
Heterogeneous Catalyst. Catalysis Today, 77: 299 – 314.
Calero-DdelC V. L. and C. Rinaldi. 2007. Synthesis and magnetic characterization of cobalt-substituted ferrite (CoxFe3−xO4)
nanoparticles. Journal of Magnetism and Magnetic Materials, 314 : 60–67
56
Creutz, C. and E. Fujita. 2000. Carbon Management: Implications for R&D in the Chemical Sciences and Technology: A Workshop Report to the Chemical Sciences Roundtable. Washington D. C. : The National Academies Press.
Drbohlavova, J., R. Hrdy, V. Adam, R. Kizek, O. Schneeweiss, and J. Hubalek. 2009. Preparation and Properties of Various Magnetic Nanoparticles. Sensors, 9: 2352 - 2362.
Duguet, E. 2000. Introduction to Hybrid Organic-Inorganic Materials. University Bordeaoux,12 – 15.
El-Kherbawi, M. A. 2010. Physical and Catalytic Properties of Solids Produced from Solid-solid interactions between NiO andFe2O3 System Doped
with Ag2O. Journal of American Science, 10: 6.
Ertl, G., H. Knözinger, and J. Weitkamp. 2000. Handbook of Heterogeneous Catalysis Vol. 3. New York : Wiley-VCH GmbH & Co.
Gharagozlou,M. 2009. Synthesis, Characterization and Influence of Calcinations Temperature on Magnetic Properties of Nanocrystalline Spinel Co-ferrite Prepared by Polymeric Precursor Method. Journal of Alloys and Compounds, 486 : 660 – 665.
Guo, Xiaoming, Dongsen Mao, Guanzhong Lu, Song Wang, Guisheng Wu. 2011. CO2 Hydrogenation to Methanol Over Cu/ZnO/ZrO2 Catalysts Prepared via A Route of Solid-state Reaction. Catalysis Communications, 12: 1095-1098
Hanke, L. D. 2001. Handbook of Analytical Methods for Materials. Plymouth: Materials Evaluation and Engineering Inc.
Hussain, S, Tajammul, M. Hasib-ur-rahman. 2009. Nano Catalyst for CO2 Conversion to Hydrocarbons. Journal of Nano Systems and Technology, 1(1): 1-9
Iftimie, N., E. Rezlescu, P. D. Popa, and N. Rezlescu. 2006. Gas Sensitivity of Nanocrystalline Nickel Ferrite. Journal of Optoelectronics and Advanced Materials. 8 : 1016 - 1018.
57
Ismunandar. 2006. Padatan Oksida Logam: Struktur, Sintesis, dan Sifat-sifatnya. Bandung : Penerbit ITB 8 - 23.
Joo, O. S. 1999. Camere Process for Carbon Dioxide Hydrogenation to Form Methanol. Catalysis Laboratory. Seoul : Korea Institute of Science and Technology. 686 - 689.
Kasapoglu, N., A. Baykal, M. S. Toprak, Y. Koseoglu, and H. Bayrakdar. 2007. Synthesis and Characterization of NiFe2O4 Nano-Octahedrons by
EDTA-Assisted Hydrothermal Method. Turkey Journal of Chemistry 31 : 659 - 666.
Khedr, M. H., A. A Omar, and S. A. Abdel-Moaty. 2006. Reduction of carbon dioxide into carbon by freshly reduced CoFe2O4 nanoparticles.
Materials Scince and Engineering A, 432 : 26 – 33.
Kim, K. D., S. S. Kim, Y. H. Choa and H. T. Kim. 2007. Formation and Surface Modification of Fe3O4 Nanoparticles by Co-precipitation and Sol-gel Method. Journal of industrial engineering chemistry. 13:1137-1141. Lambert C. K., and R. D. Gonzalez. 1998. The importance of measuring the metal
content of supported metal catalysts prepared by the sol-gel method. Appled Catalysis A : General, 172 : 233 – 239.
Lecloux, A. J., and J. P. Pirarad. 1998. High-Temperature Catalyst Through Sol-Gel Synthesis. Journal of Non-Crystalline Solids, 225 : 146 - 152. Li, Z. 2005. Novel Solid Basa Catalyst for Michael Additions: Synthesis,
Characterization and Application. Berlin: Mathematisch-Narurwissenschaftlichen Fakultät I. Humboldt-Universität.
Ma, Xinbin, Jinlong Gong, Shengping Wang, Ning Gao, Dali Wang, Xia Yang, and Fei He. 2004. Reactivity and surface properties of silica supported molybdenum oxide catalysts for the transesterification of dimethyl oxalate with phenol. School of Chemical Engineering and Technology, Tianjin University, Tianjin 300072, China
Maensiri, S., C. Masingboon, B. Bonochom, and S. Seraphin. 2007. A simple route to synthesize nickel ferrite (NiFe2O4) nanoparticles using egg
white. Journal of scriptamat. 56: 797 - 800.
58
Marland, Gregg, Tom Boden, Bob Andres. 2004.
http://cdiac.esd.ornl.gov/trends/emis/top2000.tot. Oak Ridge National
Laboratory. University of North Dakota
McNair, H. M., and J. M. Miller. 1997. Basic Gas Chromatography. John Wiley & Sons, Inc. Canada, 1 – 14.
Mohamed, A.R., Z. Zakaria, and M.M.D. Zulkali. 2010. Catalytic Hidrogenation of Carbon Dioxide Doped Nickel Oxide Catalysts. World Applied Sciences Journal, 8 (4): 490-495
Mohanraj, V. J., and Y. Chen. 2006. Nanoparticles – A Review. Tropical Journal of Pharmaceutical Research, 5: 561 - 573.
More, R. M., T. J. Shinde, N. D. Choudhari, and P. N. Vasambekar. 2005. Effect on Temperature on X-ray, IR and Magnetic Properties of Nickel Ferrite Prepared by Oxalate co-precipitation method. Journal of Materials Science : Materials in Electronics. 16: 721.
Nanda K.K, A. Maisel, F.E. Kruis, H. Fissan, and S. Strappert. 2003. Higher surface energy of free nanoparticles, Physical Review Letters. 91 : 106102
Olah, G. A., A. Goeppert, and G. K Surya Prakash. 2009. Chemical Recycling of Carbon Dioxidde to Methanol and Dimethyl Ether : From Greenhouse Gas to Renewable, Environmentally Carbon Neutral Fuels and Synthetic Hydrocarbons. Journal of Organic Chemistry, 74B : 487 - 498.
Park, K., S. Seo, H. Shim and D. Kim. 2012. Electrochemical performance of NixCo1-xMoO4 (0 ≤ x ≤ 1) nanowire anodes for lithium-ion batteries. Nanoscale Research Letters, 7:35
Parry, E. P. 1963. An Infrared Study of Pyridine Adsorbed on Acidic Solids. Characterization of Surface Acidity. Journal of Catalysis. 2 : 371 - 379.
Perego,C., and P. Villa. 1997. Catalyst Preparation Methods. Catalysis Today. 34 : 281 - 305.
Peng, Zhao. 2011. Preparation and Characterization and Reducing Properties of MoO3 Nano-Fibers. Nanofibers - Production, Properties and Functional Applications
59
Pinna, F. 1998. Supported Metal Catalyst Preparation. Catalysis Today, 41: 129 - 137.
Qi, W,H, and M.P. Wang. 2002. Size effects on the cohesive energy of nanoparticles, Journal of Material Science Letters, 21: 1743-1745. Ramankutty, C.G. and S. Sugunan. 2001. Surface properties and catalytic activity
of ferospinel of Nickel, Cobalt, and Coper, prepared by soft chemical methods. Applied Catalyst A, 218: 39 - 51.
Rao, C.N.R, A. Muller and A.K. Cheetham. 2004.Eds. Chemistry of nanomaterials. Weinheim : Wiley-VCH
Rao, C.N.R., and A.K. Cheetham. 2001. Science and Technology of Nanomaterials. Journal of Materials Chemistry,11: 2887
Reddy, C.V.G., S.V. Manorama and V.J. Rao. 1999. Semiconducting Gas Sensor for Chlorine Based on Inverse Spinel Nickel Ferrite. Sensors Actuators B: Chemical, 55: 90 - 95.
Riedel, T., M. Claeys, H. Schulz, G. Schaub, S. S. Nam, K. W. Jun, M. J. Choi, G. Kishan, K. W. Lee. 1999. Comparative Study of FTS with H2/CO and
H2/CO2 Syngas Using Fe and Co Catalysts. Applied Catalyst A, 186:
201 - 213.
Rodiansono, W., Trisunaryanti, dan Triyono. 2007. Pembuatan, Karakterisasi dan Uji Aktifitas Katalis NiMo/Z dan NiMo/Z-Nb2O5 pada Reaksi
Hidrorengkah Fraksi Sampah Plastik Menjadi Fraksi Bensin. Berkala MIPA, 17: 44 - 54.
Rood, D. 2007. The Troubleshooting and Maintenance Guide for Gas Chromatographers, Fourth Eddition. Weinheim : Willey-VCH Verlag GmbH &Co. KgaA
Sakurai, S., S. Sasaki, M. Okube, H. Ohara, T. Toyoda. 2008. Physica B, 403 3589-3595.
Seddigi, Z. S. 2003. Acidic Properties of HZSM-5 Using Acetonylacetone, TPD Ammonia, and FTIR of Adsorbed Pyridine. The Arabian Journal for Science and Engineering. 27: 149 – 156.
Septanto, Mitra. 2012. Studi Pendahuluan Pembuatan Dan Karakterisasi Nanokatalis NiyCoxFe(1-x-y)O4 Serta Uji Aktivitas Pada Konversi (Co2+
60
Sietsma, J. R. A., J. D. Meeldijk, J. P. den Breejen, M. Versluijs-Helder, A. J. van Dillen, P. E. de Jongh, and K. P. de Jong. 2007. The Preparation of Supported NiO and Co3O4 Nanoparticles by the Nitric Oxide
Controlled Thermal Decomposition of Nitrates. Angewandte Chemie International Edition, 46: 4547 - 4549.
Silva, J. B. , W. De Brito, and N. D. S.Mohallem. 2004. Influence of heat treatment on cobalt ferrite ceramic powders. Materials Science and Engineering B, 112(2-3): 182–187,
Situmeang, R., R. Supriyanto, Sukmawibowo, Fitri J., and Sarah A. 2010. Fe 1-xNixO3±ᵹ Catalyst For Converting CO2/H2 To Alcohols Compounds.
Proceedings of The International Conference on Materials Science and Technology : 173 - 179.
Skoog, D. A. dan J. J. Leary. 1992. Principle of Instrument Analysis 4th Ed. Saunders College Pub.
Soderlind, F. 2008. Colloidal Synthesis of Metal Oxide Nanocrystals and Thin Films. Sweden: Linkoping University.
Song, C., S. T. Srimat, S. Murata, W. Pan, L. Sun, A. W. Scaroni, and J. N. Armor. 2002. Effects of Pressure on CO2 Reforming of CH4 over
Ni/Na-Y and Ni/Al2O3 Catalysts. ACS Symposium Series, 809,
Conversion and Utilization, 258 - 274.
Srinivas, S., R. K. Malik, S. M. Mahajani. 2009. Fischer-Tropsch Synthesis Using Bio-Syngas and CO2. Department of Chemical Engineering. Indian
Institute of Technology Bombay, 66 - 71.
Stevens P D, Li G, Fan J, Yen M and Gao Y.2005. Recycling of homogeneous Pd catalysts using superparamagnetic nanopartlcles as novel soluble supports for Suzuki Heck, and Sonogashira cross-coupling reactions.
Chemical Communication, 4435-4437
Stevens P D, Fan J, Gardimalla H.M.R, Yen M and Gao Y. 2005.
Superparamagnetic nanoparticle-supported catalysis of Suzuki cross-coupling reactions. Organic Letters, 7:2085
Stoltze, P. 2000. Introduction to Heterogeneous Catalysis. Department of Chemistry and Applied Engineering Science: Aalborg University. Swoboda, A. R., and G. W. Kunze. 2006. Infrared Study of Pyridine Adsorbed on
61
Tanabe, K., 1981. Solid Acid and Base Catalyst in Catalysis Science and Technology. John R. Anderson and Michael Boudart Vol. 2. Springer-Link. Berlin, p. 231 - 273.
Volpin, M. E., and I. S. Kolomnikov. 1972. Reactions of Carbon Dioxide with Transition Metal Compounds. Moscow: Institute of Organo-Element Compounds.
Widegren, J. A., Finke, R. G., and J. Mol. 2003. Preparation of a multifunctional core-shell nanocatalyst and its characterization by HRTEM. Catalyst A: Chemistry, 191: 187.
Williams, R. H., E. D. Larson, H. Jin. 2006. F-T Liquids Production from Coal and Coal + Biomassa with CO2 Capture and Alternative Storage
Options : Aquifer CO2 Storage vs CO2-Enhanced Oil Recovery.
Princeton: Princeton Environmental Institute, Princeton University1 - 24.
Winarso, Paulus Agus. 2013. Akibat Pemanasan Global[Online]. Tersedia :
http://www.drn.go.id/download/Paparan-PemanasanGlobal(Paulus).pdf [18 Februari 2013]
Xiang, Minglin, Debao Li, Huijie Qie, Wenhuai Li, Bing Zhong, Yuhan Sun. 2006. Mixed Alcohol Synthesis from Carbon Monoxide
Hydrogenation over Potassium Promoted β-Mo2C Catalyst. Fuel, 86:
1298–1303.
Zhang, L. 2006. Ferrite for UHF applications. USA: The Ohio State University
Group Inorganic Materials Science
Zhanghuai, Suo, Kou Yuan. 2000. Synthesis of Light Hydrocarbons from Carbon Dioxide and Hydrogen over Fe/ZrO2 or Fe/TiO2 Catalyst. Journal of Natural Gas Chemistry, 9(4): 283-290
Zhiqiang, W., H. Qiao, H. Yang, C. Zhang, and X. Yan. 2009. Characterization of NiO Nanoparticles by Anodic Arc Plasma Method. Journal of Alloys and Compounds. 479: 855 - 858.