ABSTRACT
ANTIOXIDANT ACTIVITY OF FLAVONOIDS COMPOUND
FROM ROOTBARK OF ARA (Ficus racemosa, L)
B y IRWAN SUDARMANTO
This study was conducted to isolate and identificate flavonoids compound which has antioxidant activity from 105 g rootbarks powder of Ara by ethanol
70% using maceration method for 4 days then fractinated with nonpolar to polar
solvent. Qualitative test by Mg/HCl showed that flavonoids were in chloroform fraction and ethyl acetate fraction. . Separation technique has been conducted in order to find composition of FC and FE by High Performance Thin Layer Chromatography (HPTLC) using eluen hexana : ethyl acetate : methanol (6:3:2) for FC and hexana : ethyl acetate : methanol (6:4:4) for FE. Spraying of TLC᾽spots by cythroboric showed that FC consist of 3 flavonoids and FE has 1 flavonoid. Antioxidant assay with DPPH 0.2% indicated that 1 flavonoid in FC has antioxidant activity but only 1 spot of 5 spots showing antioxidant activity in FE was flavonoid. Isolation process has been done to get flavonoid with antioxidant activity from FC using coloum chromatography by same eluen as HPTLC that produce FC1 about 12 mg of yellow chrystale. Purity test
ABSTRAK
AKTIVITAS ANTIOKSIDAN SENYAWA FLAVONOID DARI
AKAR TANAMAN ARA (Ficus racemosa, L)
Oleh IRWAN SUDARMANTO
Penelitian ini bertujuan untuk mengisolasi dan mengidentifikasi senyawa flavonoid yang bersifat sebagai antioksidan dari kulit akar tanaman Ara (Ficus racemosa, Linn) menggunakan etanol 70% dengan metode maserasi dan dilanjutkan dengan proses fraksinasi. Uji kualitatif menunjukkan bahwa flavonoid terdapat pada fraksi kloroform (FC) dan etil asetat (FE). Untuk memisahkan kedua fraksi tersebut dari
komponen penyusunnya dilakukan pengembangan pada KLT GF254
dengan eluen terpilih yaitu heksana : etil asetat : metanol (6 : 3 : 2) untuk FC dan heksana : etil asetat : metanol (6 : 4 : 4) untuk FE. Penyemprotan pereaksi sitroborat pada bercak KLT mengindikasikan terdapat 3 jenis flavonoid dalam FC dan 1 jenis dalam FE. Potensi antioksidan yang dipantau secara kualitatif dengan larutan DPPH 0,2 % menunjukkan 1 bercak yang positif antioksidan pada FC adalah flavonoid sedangkan 5 bercak pada FE yang bersifat positif antioksidan hanya 1 yang merupakan flavonoid. Selanjutnya dilakukan isolasi senyawa flavonoid yang bersifat antioksidan terhadap FC menggunakan kromatografi kolom yang menghasilkan 12 mg kristal kuning yang setelah dikarakterisasi menggunakan spektroskopi UV menunjukkan peak pada 255 nm dan 370 nm dan dengan spektroskopi 1H-NMR menunjukkan bahwa senyawa yang berperan sebagai antioksidan tersebut adalah kuersetin
dengan nilai IC50 yang terukur dengan metode DPPH assay adalah 1,66 ppm.
AKTIVITAS ANTIOKSIDAN SENYAWA FLAVONOID DARI AKAR
TANAMAN ARA (Ficus racemosa, L)
Oleh :
IRWAN SUDARMANTO
Tesis
Sebagai Salah Satu Syarat Untuk Mencapai Gelar MAGISTER SAINS
Pada Jurusan Kimia
Fakultas Matematika dan Ilmu PengetahuanAlam
PROGRAM PASCA SARJANA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS LAMPUNG
AKTIVITAS ANTIOKSIDAN SENYAWA FLAVONOID DARI AKAR
TANAMAN ARA (Ficus racemosa, L)
(Tesis)
Oleh :
IRWAN SUDARMANTO
PROGRAM PASCA SARJANA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS LAMPUNG
v v DAFTAR GAMBAR
Gambar Halaman
1. Tanaman Ara (Ficus racemosa, Linn) dan akar tanaman Ara ... 10
2. Struktur umum senyawa flavonoid... ... 11
3. Alur biosintesis beberapa senyawa flavonoid... ... 12
4. Reaksi peredaman radikal bebas DPPH oleh antioksidan... .... 17
5. Struktur penyusun senyawa flavonoid... ... 23
6. Langkah optimasi mendapatkan pelarut untuk ekstraksi terlihat bahwa ekstrak dengan etanol 70% lebih kental dan warnanya lebih pekat... 33
7. Uji reaksi warna (Mg/HCl) yang menunjukkan positif flavonoid pada A). Fraksi heksana B). Fraksi kloroform (kuning) C). Fraksi etil asetat (coklat kemerahan) D). Fraksi butanol E). Fraksi etil asetat (coklat kemerahan)... 35
8. Kromatogram lapis tipis fraksi kloroform menggunakan silika GF 254, eluen heksana : etil asetat : metanol (6 : 3 : 2). A). Dilihat pada sinar tampak B). Dilihat di bawah sinar UV 254 C). Dilihat di bawah sinar UV 366... 39
9. Kromatogram lapis tipis fraksi etil asetat menggunakan silika GF 254, eluen heksana : etil asetat : metanol (6 : 4 : 4). A). Dilihat pada sinar tampak B). Dilihat di bawah sinar UV 254 dan C). Dilihat di bawah sinar UV 366... 40
11. Kromatogram lapis tipis fraksi kloroform menggunakan silika GF 254,
eluen heksana : etil asetat : metanol (6 : 3 : 2). A) tanpa perlakuan dengan sitroborat B). Setelah disemprot sitroborat I). Dilihat pada sinar tampak II). Dilihat di bawah UV 254 dan III). Dilihat di bawah UV 366... 43
12. Senyawa hasil kromatografi kolom dari fraksi kloroform dengan eluen heksana : etil asetat : metanol (6 : 3 : 2) A). Disemprot dengan sitroborat B). Tanpa perlakuan dengan sitroborat. I). Dilihat pada sinar tampak II). Dilihat di bawah UV 254 dan III). Dilihat di bawah UV 366... 46
13. Senyawa hasil kromatografi kolom dari fraksi etil asetat dengan eluen heksana : etil asetat : metanol (6 : 4 : 4) A). Disemprot dengan sitroborat B). Tanpa perlakuan dengan sitroborat. I). Dilihat pada sinar tampak II). Dilihat di bawah UV 254 dan III). Dilihat di bawah UV 366... ... 47
14. Senyawa hasil kromatografi kolom dari fraksi kloroform dengan eluen heksana : etil asetat : metanol (6 : 3 : 2)... 52
15. Hasil Uji Kemurnian Senyawa Uji FC1 dengan Plat KLT... 53
16. Spektra UV-VIS senyawa FC1 dengan pelarut metanol... 54
17. Spektra UV-VIS senyawa standar flavonol dan analognya dengan pelarut metanol... 54
18. Posisi proton pada cincin A,B dan C yang akan terdeteksi spektroskopi
1
H-NMR berdasarkan geseran kimianya... 55
19. Spektrum 1H-NMR senyawa FC1 (dalam DMSO)... 57
20. Spektrum 1H- NMR senyawa FC1 (dalam DMSO)... 59
21. Perkiraan struktur senyawa FC1 hasil isolasi...
22. Kromatogram senyawa FC1 (A) dibandingkan dengan standar kuersetin 61
DAFTAR LAMPIRAN
Lampiran Halaman
1. Proses pembuatan ekstrak uji dari simplisia... 70
2. Proses fraksinasi flavonoid... 71
3. Alur identifikasi struktur dan uji antioksidan senyawa flavonoid... 72
4. Proses penyiapan sampel... 73
5. Proses maserasi sampel uji... 73
6. Fraksi yang diperoleh dari proses partisi dengan corong pisah... 74
7. Proses kromatografi kolom pada fraksi kloroform, tanda panah menunjukkan senyawa FC1(warna kuning) mulai turun ke bawah... 74
8. Skema pembuatan larutan standar DPPH 50 ppm... 75
9. Hasil optimasi panjang gelombang maksimum larutan DPPH dalam metanol... 75 10. Contoh perhitungan dan pengukuran absorbansi fraksi kloroform + DPPH untuk menghitung IC50... 76
11. Contoh perhitungan dan pengukuran absorbansi fraksi etil asetat + DPPH untuk menghitung IC50... 77
12. Contoh perhitungan dan pengukuran absorbansi Vitamin C + DPPH untuk menghitung IC50... 78
13. Contoh perhitungan dan pengukuran absorbansi standar kuersetin + DPPH untuk menghitung IC50... 79
14. Pembuatan berbagai pereaksi yang digunakan... 80
ii
DAFTAR TABEL
Tabel Halaman
1. Penggunaan empiris tanaman Ara untuk tujuan pengobatan.... ... 8
2. Aktivitas farmakologi tanaman Ara yang telah diteliti dan dilaporkan. 9
3. Perbandingan keunggulan HPTLC dibandingkan KLT konvensional.. 21
4. Jenis pereaksi semprot dan flavonoid yang terdeteksi... 22
5. Rentangan serapan spektrum UV -VIS pada flavonoid....'... 24
6. Nilai IC50 dan potensi antioksidannya... 34
7. Hasil pengukuran IC50 fraksi etil asetat menggunakan spektroskopi UV-VIS...
49
8. Hasil pengukuran IC50 fraksi kloroform menggunakan spektroskopi UV-VIS...
50
9. Hasil pengukuran IC50 dari vitamin C dengan spektroskopi UV-VIS... 50
10. Perbandingan hasil spektroskopi 1 H-NMR senyawa uji FC1 dengan senyawa kuersetin referensi dari literatur...
60
KATA PENGANTAR
Bismillahirrahmanirrahim,
Puji dan syukur penulis panjatkan ke hadirat Allah SWT yang telah
melimpahkan rahmat dan hidayah-Nya. Shalawat semoga tercurah selalu kepada
Nabi Muhammmad SAW. Terima kasih atas kesempatan yang diberikan
sehingga penulis dapat menyelesaikan Tesis yang berjudul ”Aktivitas Antioksidan Senyawa Flavonoid Dari Akar Tanaman Ara (Ficus racemosa, L)”,sebagai salah satu syarat kelulusan pendidikan Magister Kimia pada Fakultas
Matematika dan Ilmu Pengetahuan Alam, Universitas Lampung.
Ruang lingkup penelitian dalam Tesis berikut adalah kimia organik yang
meliputi aspek ekstraksi, identifikasi dan uji bioaktivitas senyawa uji. Pemilihan
sampel uji didasarkan pada terbatasnya literatur ilmiah tentang penggunaan akar
Ara untuk tujuan pengobatan dan untuk memanfaatkan keanekaragaman hayati
Indonesia.
Bersama terselesaikannya tesis ini, penulis sampaikan ucapan terima kasih
kepada :
1. Ibu Prof. Dr. Tati Suhartati, M.S. selaku pembimbing utama tesis
dan pembimbing akademik atas semua saran, motivasi dan
bimbingannya selama penulis menjadi mahasiswa S2 dan berhasil
2. Ibu Dr. Noviany, M.Si. selaku pembimbing kedua atas bimbingan
dan sarannya yang sangat bermanfaat mulai dari usul penelitian
hingga selesainya tesis ini.
3. Bapak Dr.Eng Suripto Dwi Yuwono, M.T. sebagai penguji dan
pembahas tesis yang selalu membimbing penulis mulai dari usul
penelitian hingga terselesaikannya tesis ini.
4. Bapak Prof. Sutopo Hadi, M.Sc., Ph.D selaku kepala Prodi Pasca
Sarjana Jurusan Kimia, Fakultas MIPA, Universitas Lampung.
5. Bapak Prof. Dr. Sudjarwo, M.S. selaku kepala Program Pasca
Sarjana, Universitas Lampung.
6. Bapak Prof. Suharso, Ph.D. selaku Dekan Fakultas MIPA
Universitas Lampung.
7. Teman – teman di laboratorium kimia organik : mbak Mirfat, mas
Jun, mbak Wiwit dan semua adik angkatan yang tidak dapat penulis
sebutkan satu persatu.
8. Segenap dosen, karyawan dan staf Prodi Kimia Fakultas MIPA
Unila.
9. Sahabat – sahabat angkatan 2013/2014 terutama grup kimia organik
: bu Ning, bu Tati, Devi, Reni, Diah dan Viki yang selalu berbagi
keceriaan dan pengalaman.
10. Mas Heri, Mbak Prapti dan segenap keluarga yang selalu membantu
11. Semua pihak yang terlibat baik langsung maupun tidak langsung dalam penyelesaian tesis ini.
Dalam penulisan tesis ini masih banyak kekurangan yang terjadi. Kritik dan saran sangat diharapkan penulis
untuk perbaikan dalam penelitian selanjutnya. Semoga tesis ini dapat memberikan manfaat. Amin.
Bandar Lampung, Oktober 2015
Penulis
Tiada suatu bencanapun yang menimpa di bumi dan (tidak pula) pada dirimu sendiri melainkan telah tertulis dalam
kitab (Lauhul Mahfudz) sebelum Kami menciptakannya. Sesungguhnya yang demikian itu adalah mudah bagi Allah. (Kami jelaskan yang demikian itu) supaya kamu tidak berduka cita
terhadap apa yang luput dari kamu dan supaya kamu jangan terlalu gembira terhadap apa yang di berikan- Nya kepadamu. Dan Allah tidak menyukai setiap orang yang sombong dan
RIWAYAT HIDUP
Penulis merupakan anak sulung dari empat bersaudara putra pasangan Bapak Sarana
dan Ibu Sarinah yang dilahirkan di Yogyakarta pada 21 Juni 1979.
Pendidikan formal dimulai pada tahun 1985 saat masuk Sekolah Dasar (SD) di SDN
Ciruas III. Sekolah Menengah Pertama (SMP) di SMPN 1 Ciruas pada tahun 1991 dan
Sekolah Menengah Umum (SMU) 1 Serang pada tahun 1994. Pada tahun 1997, penulis
terdaftar sebagai mahasiswa fakultas farmasi Universitas Gadjah Mada (UGM) melalui jalur
UMPTN dan lulus pada tahun 2002, selanjutnya menyelesaikan profesi farmasis di tempat
yang sama pada tahun 2003.
Pengalaman kerja diperoleh saat menjadi mahasiswa ketika menjadi supervisor di
CV. Calista Natural Laboratoris yang menangani produksi jamu dan sediaan simplisia untuk
obat pada tahun 2002-2003. Selanjutnya menangani PT. Tunas Lestari Nusantara
(Yogyakarta) sebagai manajer produksi dan kultivasi tanaman holtikultura untuk sediaan obat
tradisional pada tahun 2003. Pada tahun 2004-2005 menjadi manajer produksi di PT. Muji
Prasojo (Surabaya) yang bergerak di bidang Agribisnis. Pada tahun 2006 menetap di
Lampung dan bekerja sebagai penanggung jawab distribusi obat dan alat kesehatan di
PT. Kimia Farma,Tbk. Di sela kegiatan, penulis bekerja sebagai praktisi pada apotik dan
i
DAFTAR ISI
Halaman
DAFTAR TABEL...………...….. iv
DAFTAR GAMBAR.………...………..…... v
DAFTAR LAMPIRAN... vii
I. PENDAHULUAN... A. Latar Belakang... 1
B. Tujuan Penelitian... 5
C. Rumusan Masalah... 6
D. Batasan Masalah... 6
E. Hipotesis... 6
II. TINJAUAN PUSTAKA... 7
A. Ficus racemosa, L... 7
1. Taksonomi... 7
2. Habitat dan Morfologi... 7
3. Efek Farmakologi... 8
4. Akar Tanaman Ara... 10
B. Flavonoid... 10
1. Pengertian Umum... 10
2. Efek Farmakologi... 12
C. Radikal Bebas... 13
1. Pengertian Umum... 13
2. Senyawa Penangkap Radikal Bebas/Antioksidan... 15
ii
D. Isolasi dan Identifikasi Senyawa Flavonoid... 17
1. Aspek Umum... 17
2. Isolasi Senyawa Flavonoid... 18
3. Pemisahan Senyawa dengan KLT... 19
a. Prinsip Kerja KLT... 19
b. High Performance Thin Layer Chromatography (HPTLC)... 20
4. Pemisahan Senyawa Dengan Kromatografi Kolom... 21
E. Identifikasi Senyawa Flavonoid... 22
1. Pereaksi Semprot... 22
2. Spektroskopi UV-VIS... 23
F. Penentuan Struktur... 24
1. Spektroskopi Infra Merah... 24
2. Spektroskopi NMR... 25
a. Spektroskopi 13C-NMR... 25
b. Spektroskopi 1H-NMR... 26
3. Spektroskopi Massa... 26
III. METODOLOGI PENELITIAN... 27
A. Sampel Uji Penelitian... 27
B. Bahan ... 27
C. Peralatan... 27
D. Waktu Dan Tempat Penelitian... 28
E. Cara Kerja... 28
1. Uji Pendahuluan... 28
2. Ekstraksi Senyawa Flavonoid…... 29
a. Uji Kualitatif Flavonoid... 30
b. Uji Total Flavonoid ... …… 30
4. Kromatografi Kolom... 32
5. Penentuan Struktur Flavonoid... 32
6. Uji Aktivitas Antioksidan... 33
a. Uji Kualitatif... 33
b. Uji Potensi Antioksidan (IC50)... 33
IV. HASIL DAN PEMBAHASAN... 35
A. Maserasi Sampel Uji... 35
B. Pemilihan Eluen... 37
C. Identifikasi Senyawa Flavonoid Dalam Ekstrak... 40
1. Kualitatif... 40
2. Uji Kuantitatif... 44
D. Uji Aktivitas Antioksidan Ekstrak... 44
1. Uji Kualitatif... 44
2. Uji Kuantitatif... 48
E. Isolasi, Identifikasi dan Uji Aktivitas Antioksidan Senyawa FC1... 51
1. Isolasi... 51
2. Identifikasi Senyawa FC1... 53
a. Uji Kemurnian... 53
b. Spektroskopi UV…... 53
c. Spektroskopi 1 H-NMR... 55
d. Uji KLT Senyawa FC1... 61
F. Uji Aktivitas Antioksidan... 61
V. SIMPULAN DAN SARAN... 63
A. Simpulan... 63
B. Saran... 63
I. PENDAHULUAN
A. Latar Belakang
Upaya untuk menginventarisasi kandungan aktif dari tanaman terus
menerus dilakukan dan menjadi perhatian khusus para peneliti. Kandungan aktif
dimaksud biasa disebut sebagai metabolit sekunder yaitu zat non esensial dalam
organisme yang diperlukan untuk tujuan-tujuan tertentu seperti untuk pertahanan
terhadap jamur, mikroba, sinar UV atau fungsi lain seperti untuk menarik mangsa
dan untuk tujuan penyerbukan. Metabolit sekunder dibedakan berdasarkan sifat
kimia, struktur maupun asal-usul biogenesisnya.
Salah satu metabolit sekunder yang sangat intensif diteliti adalah flavonoid,
yaitu senyawa polifenol yang memiliki berat molekul rendah dengan struktur
umum berupa benzena pirena yang diklasifikasikan dalam flavon, flavonol,
flavanon, isoflavon, antosianin dan katekin (Cook et al., 1996). Bagi tanaman,
flavonoid berfungsi sebagai pertahanan terhadap serangan mikroba, panas, sinar
UV dan keadaan ekstrim lainnya (Dicosmo, 1984). Flavonoid juga penting untuk
menarik serangga dan organisme lain yang penting dalam proses penyerbukan dan
2
Perkembangan selanjutnya menjadi lebih menarik karena ternyata senyawa
ini memiliki aktivitas farmakologi yang berguna bagi manusia. Penelitian tentang
senyawa-senyawa flavonoid menjadi sangat penting dan urgen dalam rangka
mencari senyawa baru yang memiliki potensi kuat sebagai anti bakteri, anti virus,
antioksidan, anti diabetes, anti radang, anti kanker dan anti hiperlipidemia
(Neldawati et al., 2013; Nakamura et al., 2003).
Salah satu aktivitas biologi flavonoid yang sangat penting adalah
kemampuannya sebagai antioksidan karena dapat menghambat proses oksidatif
yang merusak jaringan hidup dan mengganggu kesetimbangan homeostasis dalam
tubuh mahluk hidup, terutama manusia. (Dreosti, 2002; Sathishkumar et al., 2008).
Hampir semua penyakit degeneratif diawali dengan adanya gangguan yang dipicu
oleh kehadiran spesies radikal bebas.
Keadaan menjadi semakin buruk karena keberadaan radikal bebas makin
bertambah, baik dalam besaran maupun sebarannya. Banyak aktivitas manusia
yang menghasilkan spesies radikal bebas seperti transportasi dan industri, belum
lagi pola hidup dan pola makan manusia saat ini yang tidak diimbangi dengan
gaya hidup sehat. Dalam laporan yang diterbitkan WHO pada tahun 2012 ada 4
jenis penyakit yang saat ini menjadi pembunuh terbesar manusia yaitu diabetes,
stroke, penyakit jantung dan kanker dimana keempatnya termasuk dalam penyakit
3
Salah satu tanaman yang menjadi sumber flavonoid adalah genus Ficus
yang memiliki 750 – 800 spesies di seluruh dunia (Jander et al., 2008; Baby, J et
al., 2011). Di negara-negara Timur tengah, spesies Ficus yang biasa dikonsumsi
adalah Ficus carica, Linn yang terbukti memiliki kandungan flavonoid tinggi
terutama pada bagian buahnya (Solomon et al., 2006) dan ini pula yang menjadi
jawaban mengapa penduduk di negara-negara tersebut relatif sehat walaupun
kebiasaan mereka adalah mengkonsumsi daging panggang yang banyak
mengandung radikal bebas dan iklim yang relatif ekstrem (Vinson, 1999).
Adapun spesies Ficus yang tumbuh alami di Indonesia adalah Ficus
racemosa, Linn yang biasa dikenal sebagai Loa atau Ara. Pemanfaatan spesies ini
di negara kita masih sangat terbatas dan umumnya hanya digunakan sebagai
anakan bonsai. Sedangkan penelitian ilmiah masih sebatas pada pemanfaatan
buahnya seperti yang dilakukan oleh Netty et al. (2009) yang meneliti kandungan
nutrisi buah ini dan Trinil et al. (2013) yang memanfaatkan buah ini sebagai agen
preservasi untuk motilitas spermatozoa kambing.
Di negara-negara semenanjung India, Ficus racemosa, Linn merupakan
tanaman yang sangat umum dipakai untuk keperluan pengobatan dan menjadi
ikon dalam indeks pengobatan India sejak zaman pra sejarah (Paarakh, 2009),
sehingga penelitian ilmiah pada spesies tanaman ini sangat masif terutama uji
4
Dari uraian di atas, penulis tertarik untuk meneliti kandungan flavonoid
dalam bagian akar tanaman ini. Ada beberapa alasan mengapa akar menjadi fokus
penelitian. Pertama, menurut Dicosmo (1984) pembentukan flavonoid terjadi di
dalam bagian tanaman ini yang diperkuat dengan penelitian Srivastava (2013)
yang menunjukkan konsentrasi flavonoid pada berbagai varietas banyak terdapat
pada bagian ini. Kedua, penelitian ilmiah pada bagian akar ini masih relatif sedikit
bahkan di India sekalipun. Penelitian yang pernah dilakukan adalah uji anti
mikroba oleh Goyal (2013) sedangkan skrining kandungan aktif yang telah
dipublikasikan Krishna et al. (2011) menunjukkan bahwa bagian akar ini
mengandung flavonoid namun belum diidentifikasi jenis dan strukturnya.
Menurut Dicosmo (1984) perbedaan habitat suatu spesies dapat
mengakibatkan perbedaan pada kandungan metabolit sekunder (flavonoid) baik
distribusi, jumlah maupun jenisnya. Hal tersebut juga telah dibuktikan, salah
satunya oleh Oguzhan (2011) yang meneliti kandungan buah Ficus di Turki
dengan melibatkan 76 buah dari tempat yang berbeda yang menunjukkan adanya
kecenderungan perbedaan kandungan zat aktif yang terbentuk.
Secara umum, masalah yang sering timbul dalam penelitian untuk
memperoleh senyawa-senyawa aktif dari alam adalah bagaimana menetapkan
prosedur isolasi yang tepat, cara identifikasi yang cepat dan uji bioaktifitas yang
representatif. Dalam kaitannya dengan senyawa flavonoid yang harus diketahui
5
terhadap pengaruh luar seperti cahaya, oksidasi, panas dan bahan kimia (Kitao et
al., 1994). Oleh karena itu, perlu dilakukan studi dan uji pendahuluan sebelum
penelitian utama dilakukan.
Penentuan struktur senyawa flavonoid menurut Mabry et al. dilakukan
menggunakan spektroskopi UV-VIS, IR dan 1H-NMR. Selanjutnya senyawa
flavonoid yang diperoleh tersebut diuji potensi antioksidannya menggunakan
metode DPPH assay yaitu metode yang dapat mengukur kemampuan suatu senyawa untuk bereaksi dengan radikal bebas dari 2,2 difenil- 1- pikrilhidrazil
(DPPH). Parameter yang diperolah berupa IC50, yaitu konsentrasi flavonoid yang
diperlukan untuk menginaktivasi DPPH sebesar 50%. Metode ini valid untuk
mengukur kemampuan antioksidan senyawa-senyawa dari alam (Kumar et al.,
2013).
B. Tujuan Penelitian
1. Memberikan informasi tentang jenis senyawa flavonoid yang terdapat
dalam akar tanaman Ara.
2. Memberikan alternatif dalam penggunaan senyawa flavonoid sebagai anti
6
C. Rumusan Masalah
Menentukan apakah akar tanaman Ara yang ada di Indonesia (Tanggamus)
mengandung senyawa-senyawa flavonoid dan apakah senyawa tersebut memiliki
efek antioksidan.
D. Batasan Masalah
1. Penelitian dilakukan pada bagian akar tanaman Ara.
2. Penelitian hanya menguji senyawa-senyawa flavonoid.
3. Bioaktivitas senyawa uji difokuskan pada efek antioksidan.
E. Hipotesis
Akar tanaman Ara (Ficus racemosa, Linn) mengandung senyawa flavonoid
II. TINJAUAN PUSTAKA
A. Ficus racemosa, Linn 1. Taksonomi
Berikut adalah taksonomi tanaman Ara (Shikhsarthi et al., 2011).
Kingdom : Plantae
Subkingdom : Tracheobionata
Superdivisi : Spermathophyta
Divisi : Magnoliophyta
Kelas : Magnoliopsida
Subkelas : Hamamelididae
Ordo : Urticales
FamilI : Moraceae
Genus
Spesies
: Ficus
: Ficus racemosa, Linn atau Ficus
glomerata, Roxb
2. Habitat dan Morfologi
Ficus racemosa, Linn termasuk dalam genus ficus yang terdiri dari 750-800
spesies yang memiliki manfaat medis dan telah digunakan secara empiris untuk
pengobatan berbagai penyakit (Shiksharti et al., 2011). Tanaman ini merupakan
8
Biasanya tumbuh di hutan tropis dan dekat dengan air (Joseph et al., 2011).
Habitat terbaik pada ketinggian sekitar 1200 m di atas permukaan laut. Tinggi
tanaman dapat mencapai 12 m (Paarakh, 2009).
3. Efek Farmakologi
Dalam sistem pengobatan tradisional India, semua bagian tanaman ini dapat
digunakan sebagai obat (Shikhsarthi et al., 2011). Beberapa kegunaan empiris
yang pernah dilaporkan disajikan dalam Tabel 1.
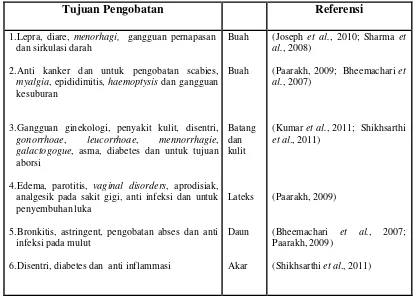
Tabel 1. Penggunaan empiris tanaman Ara untuk tujuan pengobatan
Tujuan Pengobatan Referensi
1.Lepra, diare, menorhagi, gangguan pernapasan dan sirkulasi darah
2.Anti kanker dan untuk pengobatan scabies, myalgia, epididimitis, haemoptysis dan gangguan kesuburan
3.Gangguan ginekologi, penyakit kulit, disentri, gonorrhoae, leucorrhoae, mennorrhagie, galactogogue, asma, diabetes dan untuk tujuan aborsi
4.Edema, parotitis, vaginal disorders, aprodisiak, analgesik pada sakit gigi, anti infeksi dan untuk penyembuhan luka
5.Bronkitis, astringent, pengobatan abses dan anti infeksi pada mulut
9
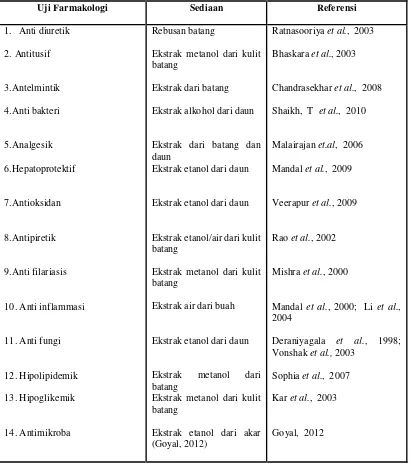
Uji farmakologis tanaman Ara yang pernah diteliti dan dilaporkan adalah
seperti ditunjukkan Tabel 2.
Tabel 2. Aktivitas farmakologi tanaman Ara yang telah diteliti dan dilaporkan
10
4. Akar Tanaman Ara
Akar tanaman Ara berwarna kecoklatan, panjang dan memiliki rasa dan bau
yang khas. Bentuknya relatif tak beraturan seperti terlihat pada Gambar 1. Menurut Krishna et al. (2011), akar mengandung glikosida, flavonoid dan
senyawa fenolik lain.
Gambar 1. Tanaman Ara (Ficus racemosa, Linn) dan akar tanaman Ara (Ficus racemosa, Linn)
B. Flavonoid
1. Pengertian Umum
Istilah flavonoid diberikan untuk senyawa-senyawa fenol yang berasal dari
flavon, yaitu nama dari salah satu jenis flavonoid yang paling banyak jumlah dan
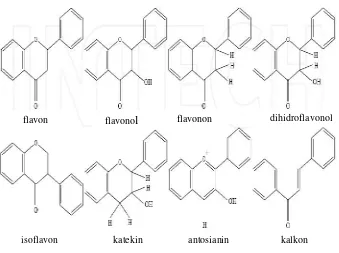
sebarannya. Senyawa flavon ini mempunyai kerangka 2 fenil kromon. Struktur
senyawa ini memiliki kerangka C6-C3-C6. Pengelompokan golongan flavonoid
didasarkan pada pola substitusi pada kedua cincin aromatik dan pola yang berbeda
pada C3 menjadi flavon, flavonol, flavanon, antosianidin, katekin dan kalkon.
11
flavon flavonol flavonon dihidroflavonol
isoflavon katekin antosianin kalkon
Gambar 2. Struktur umum senyawa flavonoid
Flavonoid merupakan metabolit sekunder yang paling banyak jumlahnya
yaitu sekitar 5-10% total metabolit sekunder. Senyawa ini terdapat dalam tanaman
terutama yang berpembuluh (kecuali alga). Diperkirakan 2% dari karbon yang
difotosintesis tumbuhan akan menjadi flavonoid dengan struktur dan fungsi yang
berbeda. Flavonoid terdapat dalam semua bagian tanaman seperti buah, biji, akar,
batang, kayu batang, daun dan bunga (Markham, 1998).
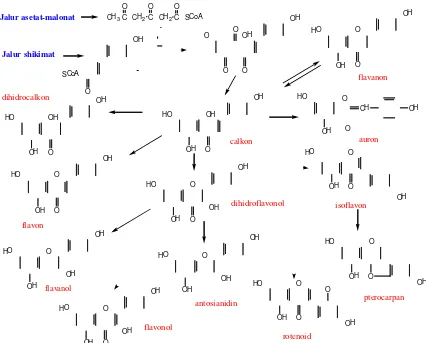
Di alam, keberadaan flavonoid umumnya tidak tunggal karena adanya
pengaruh air, panas matahari dan enzim maka strukturnya cepat berubah bentuk
dan seringkali terdapat pada suatu kesetimbangan. Hal ini bisa kita pahami bila
12
Gambar 3. Alur biosintesis beberapa senyawa flavonoid (Mabry et al., 1970)
2. Efek Farmakologi
Flavonoid memiliki aktivitas biologi seperti sebagai anti bakteri, anti
kolesterol, anti hiperlipidemia, anti virus, anti diabetes, anti radang, anti kanker
(Neldawati et al., 2013; Nakamura et al., 2003). Flavonoid juga dapat berlaku
sebagai antioksidan karena sifatnya sebagai akseptor yang baik terhadap radikal
bebas, yaitu suatu spesies yang memiliki satu atau lebih elektron tak berpasangan
dalam orbitalnya seperti hidroksi radikal dan superoksida yang biasa disebut
13
Efek antioksidan senyawa flavonoid disebabkan oleh adanya penangkapan
radikal bebas melalui donor proton hidrogen dari gugus hidroksil flavonoid (Amic
et al., 2003). Aktivitas antioksidan pada flavonoid terutama dipengaruhi
substitusi gugus hidroksi pada posisi orto dan para terhadap gugus OH dan OR
(Pratiwi, 2006).
C. Radikal bebas 1. Pengertian Umum
Secara terminologi, pengertian oksidan dan radikal bebas seringkali dianggap
sama. Aktivitas keduanya menghasilkan akibat yang serupa walaupun prosesnya
berbeda. Namun secara kimia, keduanya adalah berbeda karena istilah oksidan
dimaksudkan untuk spesies kimia yang bisa menerima elektron, yaitu senyawa
yang dapat menarik elektron seperti halnya Fe3+ yang dapat menarik elektron
sehingga menjadi Fe2+ sedangkan radikal bebas adalah suatu bahan kimia baik
berupa atom maupun molekul yang memiliki elektron tidak berpasangan pada
lapisan luarnya (Droge, 2002).
Pada proses metabolisme normal, tubuh memproduksi radikal bebas. Atom
atau molekul dengan elektron bebas ini dapat digunakan untuk menghasilkan
tenaga dan beberapa fungsi fisiologis seperti kemampuan untuk membunuh virus
14
Namun karena mempunyai tenaga yang sangat tinggi dan kecenderungan
untuk berikatan dengan elektron dari substrat lain, zat ini akan merusak jaringan
normal terutama jika jumlahnya terlalu banyak. Radikal bebas dapat mengganggu
produksi DNA, lapisan lipid pada dinding sel, mempengaruhi pembuluh darah,
dan produksi prostaglandin (Droge, 2002).
Radikal bebas juga dijumpai pada lingkungan, beberapa logam (misalnya
besi dan tembaga), asap rokok, polusi udara, obat, bahan beracun, makanan dalam
kemasan, bahan aditif dan sinar ultraviolet dari matahari maupun radiasi.
Radikal bebas dapat terbentuk in vivo dan in vitro dengan cara :
a. Pemecahan satu molekul normal secara homolitik. Proses ini jarang terjadi
pada sistem biologi karena memerlukan tenaga yang tinggi dari sinar
ultraviolet, panas dan radiasi ion.
b. Kehilangan satu elektron dari molekul normal.
c. Penambahan elektron pada molekul normal.
Radikal bebas terpenting dalam tubuh adalah radikal derivat dari oksigen
yang disebut kelompok oksigen reaktif (reactive oxygen species/ROS), termasuk
oksigen triplet (3O2), tunggal (singlet/1O2), anion superoksida (O2.-), radikal
hidroksil (-OH), nitrit oksida (NO-), peroksi nitrit (ONOO-), asam hipoklorit
(HOCl), hidrogen peroksida (H2O2), radikal alkoksi (LO-), dan radikal peroksil
(LO-2). Radikal bebas yang mengandung karbon (CCl3-) yang berasal dari oksidasi
15
Radikal yang mengandung hidrogen hasil dari penyerangan atom H (H-).
Bentuk lain adalah radikal yang mengandung sulfur yang diproduksi pada
oksidasi glutation menjadi radikal tiol (R-S-), radikal yang mengandung nitrogen
juga ditemukan seperti radikal fenildiazin (Araujo et al., 1998).
ROS dapat menginduksi kerusakan oksidatif berbagai makromolekul seperti
asam lemak tak jenuh dalam membran sel, karbohidrat, protein dan DNA yang
mengganggu kesetimbangan homeostasis. Radikal bebas dapat menyebabkan
berbagai penyakit di antaranya arterosklerosis, diabetes, alzheimer, parkinson dan
penurunan kekebalan tubuh (Amic et al., 2003).
2. Senyawa Penangkap Radikal Bebas/Antioksidan
Antioksidan merupakan suatu senyawa yang dapat menginaktifkan radikal
bebas yang dihasilkan oleh berbagai proses normal tubuh, radiasi matahari, asap
rokok, asap kendaraan bermotor dan faktor-faktor lain (Osawa et al., 1992).
Berdasarkan mekanisme kerjanya, antioksidan dibagi menjadi 3 yaitu antioksidan
primer, sekunder dan tersier. Antioksidan primer bekerja dengan cara mencegah
pembentukan senyawa radikal bebas yang terbentuk menjadi molekul yang kurang
aktif, termasuk di dalamnya adalah sistem antioksidan tubuh. Antioksidan
sekunder bekerja dengan cara mendonorkan proton pada spesies radikal bebas
sehingga terbentuk senyawa yang bersifat netral yang umumnya merupakan
16
Sedangkan antioksidan tersier bekerja dengan cara memperbaiki kerusakan
yang ditimbulkan oleh radikal bebas.
Sejatinya, tubuh mempunyai mekanisme sendiri dalam upaya mereduksi
efek berbahaya dari radikal bebas (oksidan) yang terbentuk karena proses
fisiologis, namun karena faktor tertentu seperti penurunan fungsi organ penghasil
antioksidan endogen, malnutrisi dan usia maka mutlak diperlukan antioksidan dari
luar (eksogen). Antioksidan endogen misalnya enzim superoksida, katalase dan
glutation peroksidase sedangkan antioksidan eksogen seperti vitamin A, vitamin E,
betakaroten dan flavonoid.
3. Pengukuran Potensi Suatu Antioksidan
Potensi antioksidan dapat diukur dengan berbagai metode. Salah satu
metode yang tepat dan valid untuk menetapkan aktivitas antioksidan senyawa-
senyawa alam adalah dengan DPPH assay (Kumar et al., 2013). Parameter yang
diperoleh adalah IC50, yaitu banyaknya konsentrasi senyawa flavonoid yang
diperlukan untuk menghambat aktivitas radikal bebas DPPH sebesar 50 %
(Molyneux, 2004; Mosquera et al., 2007) dengan ketentuan makin kecil nilai IC50
yang diperoleh maka efektifitas antioksidannya makin tinggi. Untuk kontrol
positif, digunakan asam askorbat atau senyawa antioksidan lain. Mekanisme
penangkapan radikal bebas (DPPH) oleh suatu senyawa uji ditandai oleh adanya
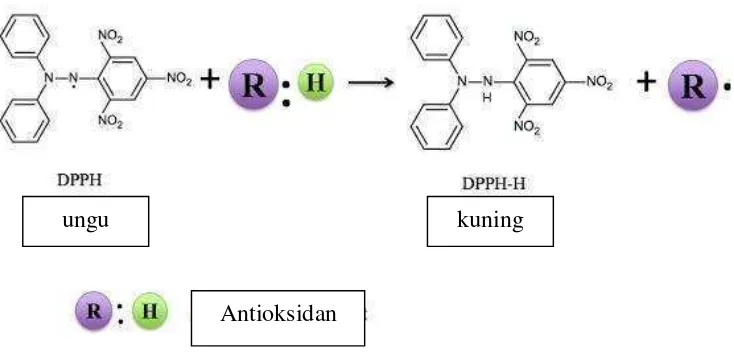
perubahan warna larutan DPPH karena proses reduksi dari ungu menjadi kuning
17
ungu kuning
Antioksidan
Gambar 4. Reaksi peredaman radikal bebas DPPH oleh antioksidan (Molyneux, 2004)
D. Isolasi dan Identifikasi Senyawa Flavonoid 1. Aspek Umum
Isolasi merupakan proses untuk memisahkan senyawa aktif dari komponen
lain yang tidak diinginkan. Istilah isolasi ini kemudian berkembang menjadi
ekstraksi yaitu metode untuk menarik komponen aktif dari suatu bahan
berdasarkan prinsip perpindahan massa komponen zat ke dalam pelarut yang
dimulai dari lapisan antar muka kemudian berdifusi masuk kedalam pelarut
(Harborne, 1987).
Untuk ekstraksi bahan alam, tidak ada metode yang benar-benar baku dan
bisa diterapkan untuk semua kasus, karena banyak variabel yang berpengaruh
18
Oleh karena itu, harus ada modifikasi pada metode yang digunakan dan
standarisasi pada bahan yang akan diekstraksi. Menurut Satishkumar et al. (2008),
faktor-faktor yang berpengaruh dalam ekstraksi senyawa flavonoid adalah waktu
ekstraksi, suhu, jenis dan komposisi pelarut serta perbandingan pelarut terhadap
bahan yang akan diekstraksi.
2. Isolasi Senyawa Flavonoid
Metode ekstraksi untuk senyawa flavonoid yang sederhana namun
memberikan hasil yang baik adalah maserasi (Turkmen et al., 2006), yaitu dengan
melakukan perendaman bahan lalu dilanjutkan dengan pemisahan menggunakan
Kromatografi Lapis Tipis (KLT). Metode ini walaupun sederhana namun dapat
diandalkan dan dapat memberikan hasil yang sepadan dibandingkan metode lain
yang lebih rumit (Yaxin et al., 2005; Svetlana et al., 2013).
Metode maserasi cocok untuk mengekstraksi senyawa flavonoid mengingat
karakteristiknya yang cenderung mudah teroksidasi dan tidak tahan panas bila
dilakukan dengan metode lain seperti refluks dan destilasi. Prinsip metode ini
adalah adanya perbedaan gradien tekanan antara bagian dalam sel dan luar sel
sehingga akan terjadi pembengkakan dan pemecahan membran serta dinding sel
sehingga akan terjadi difusi bahan aktif yang akan masuk/tertarik kedalam sistem
pelarut yang digunakan. Proses ini biasanya berlangsung antara 1- 3 hari bahkan
dalam Farmakope disebutkan bahwa proses maserasi bisa berlangsung sampai 10
19
3. Pemisahan Senyawa Dengan KLT a. Prinsip Kerja KLT
Pemisahan bahan aktif dilakukan dengan 2 tahap, yaitu skrining fitokimia
melalui fraksinasi dan dilanjutkan dengan pemisahan untuk tujuan pemurnian.
Fraksinasi merupakan proses yang didasarkan pada adanya perbedaan kelarutan
bahan uji terhadap pelarut yang digunakan.
Tahap fraksinasi diawali dengan pelarut non polar lalu dilanjutkan secara
bertahap dengan pelarut yang lebih polar (Harborne, 1987). Jenis pelarut dipilih
berdasarkan sifat bahan aktif yang akan diisolasi. Untuk senyawa flavonoid,
fraksinasi diawali dengan heksana dan diakhiri dengan pelarut polar. Metode
pemisahan yang umum digunakan untuk bahan alam di antaranya adalah
kromatografi seperti kromatografi kertas, kromatografi kolom, kromatografi cair
kinerja tinggi dan kromatografi gas. Tiap metode memiliki kelemahan dan
kelebihan masing-masing dan tidak ada metode yang diklaim paling baik.
Secara umum, untuk senyawa-senyawa yang berada pada rentang polar
sampai semi polar (seperti senyawa flavonoid), KLT cocok digunakan dan
efektifitas pemisahan diperoleh dengan melakukan penetapan komposisi fase
gerak sedemikian rupa sehingga diperoleh hasil pemisahan yang sempurna
20
Prinsip KLT adalah adanya interaksi senyawa uji terhadap fase diam
(adsorben) atau terhadap fase gerak (eluen) yang digunakan. Fase diamnya terikat
pada suatu lempeng kaca, plastik atau aluminium. Bahannya berupa alumina,
selulosa, diatomae atau silika (SiO2). Jenis yang paling banyak digunakan adalah
silika gel. Senyawa uji akan naik mengikuti fase gerak sesuai dengan kemampuan
interaksinya terhadap adsorben. Makin kuat interaksinya, maka dia akan sedikit
bergerak (berinteraksi kuat dengan adsorben) sehingga memiliki jarak rambat
yang rendah. Sebaliknya, jika senyawa uji memiliki interaksi yang lebih besar
dengan fase gerak maka dia akan mempunyai jarak rambat yang lebih jauh.
Pemilihan pelarut sebagai fase gerak merupakan faktor penentu berhasil
tidaknya suatu matriks campuran dapat dipisahkan dari komponen penyusunnya
dengan sempurna (Sastrohamidjojo, 1991). Data kualitatif yang diperoleh dari
KLT adalah Rf (Retardation factor), yaitu :
Rf = jarak rambat senyawa Jarak perambatan
Suatu senyawa uji dianggap identik bila memiliki harga Rf yang sama/mirip
dengan harga Rf suatu senyawa standar pada perlakuan yang sama.
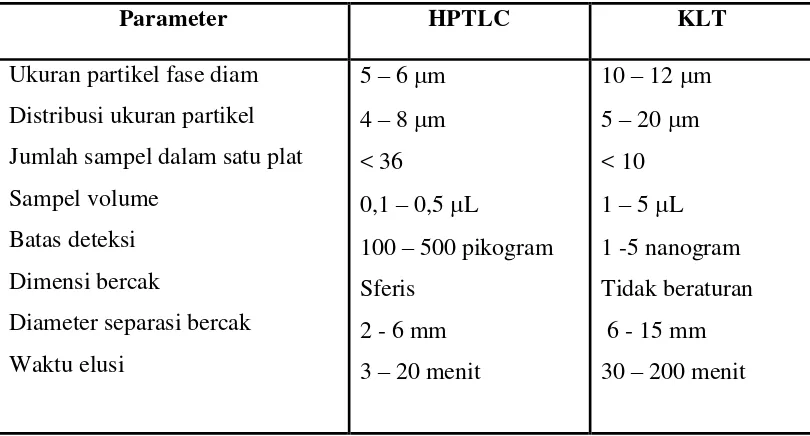
b. High Performance Thin Layer Chromatography (HPTLC)
Untuk meningkatkan kapasitas dan selektifitas KLT maka dikembangkan
fase diam KLT dengan ukuran partikel yang sangat kecil dan diintegrasikan
dengan penotol otomatis, chamber otomatis dan perangkat visualisasi yang
21
Tujuan utamanya adalah meningkatkan separasi bercak senyawa sehingga
pola kromatogram yang terbentuk dapat digunakan sebagai sidik jari bagi suatu
matriks senyawa uji. Penggunaan HPTLC kini makin banyak digunakan karena
prosesnya cepat dan limit deteksinya tinggi. Keunggulan HPTLC dibandingkan
dengan KLT konvensional dirangkum dalam Tabel 3.
Tabel 3. Perbandingan keunggulan HPTLC dibandingkan KLT konvensional (Wagner et al., 1996).
4. Pemisahan Senyawa Dengan Kromatografi Kolom
Prinsip utama kromatografi kolom hampir sama dengan KLT, perbedaan
terletak pada jumlah fase diam dan fase gerak yang digunakan. Pada kromatografi
kolom fase diam yang dipakai tergantung pada panjang dan besar kolom yang
digunakan, begitu juga fase geraknya tergantung pada jumlah senyawa yang akan
22
Oleh karena itu kromatografi kolom efektif untuk tujuan kuantitatif artinya
dapat digunakan untuk isolasi senyawa dalam jumlah besar.
E. Identifikasi Senyawa Flavonoid 1. Pereaksi Semprot
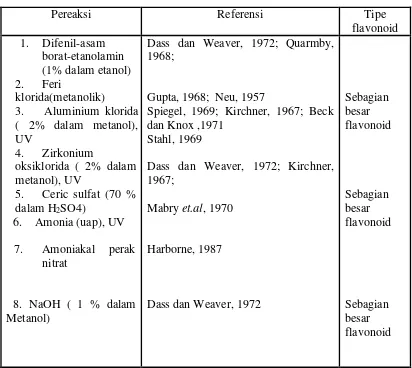
Identifikasi awal senyawa golongan flavonoid dapat dilakukan dengan
berbagai cara di antaranya adalah menggunakan pereaksi semprot pada lempeng
KLT seperti terlihat pada Tabel 4 berikut (Harborne, 1987).
Tabel 4. Jenis pereaksi semprot dan flavonoid yang terdeteksi (Harborne, 1987)
23
2. Spektroskopi UV -VIS
Cara lain yang dipakai untuk identifikasi senyawa flavonoid adalah
menggunakan spektroskopi UV-VIS yang saat ini umum digunakan karena
sifatnya yang tidak destruktif. Prinsip utama metode ini adalah mendeteksi
adanya serapan gelombang UV-VIS pada cincin aromatis terkonjugasi dari
struktur flavonoid yang menyebabkan pita pada dua daerah yang berbeda yaitu
300-560 nm (pita I) dan 230-295 nm (pita II). Hal ini tejadi karena struktur umum
flavonoid terdiri dari dua kerangka gugus kromofor yaitu cincin benzoil (pita II)
dan cincin sinamoil (pita I) seperti terlihat pada Gambar 5.
5 '
6 ' 4 '
8
O 1 ' 3 ' 1
7
2 2 '
6 3
5 4
O
O
O
PITA II (240 -280 nm) Kromofor Benzoil
PITA I (300 -550 nm) Kromofor Sinamoil
24
Adapun interpretasi dari panjang gelombang UV -VIS yang terdeteksi akan
terlihat seperti pada Tabel 5 (Markham, 1998).
Tabel 5. Rentangan serapan spektrum UV -VIS pada flavonoid (Markham, 1998)
Pita II Pita II Jenis flavonoid
Penentuan struktur flavonoid secara umum dapat ditentukan dengan
menginterpretasi spektrum dari spektroskopi IR, MS, 1H-NMR dan 13C-NMR
yang diolah sedemikian rupa hingga diperoleh struktur yang sebenarnya dan
dapat ditentukan jenis dan golongannya. Berikut jenis spektroskopi yang dapat
digunakan untuk menentukan struktur suatu flavonoid.
1. Spektroskopi Infra Merah (IR)
Prinsip dari spektroskopi ini didasarkan pada adanya vibrasi atom pada
suatu molekul. Vibrasi terjadi pada ikatan antar atom berupa uluran, bengkokan
dan guntingan yang terjadi karena adanya interaksi dengan gelombang infra
25
Frekuensi vibrasi ini khas dan spesifik untuk tiap ikatan atom dan sesuai
dengan panjang gelombang IR yang diserap. Panjang gelombang IR berada pada
rentang 625cm-1- 4000cm-1.
Area pada 625cm-1 -1300cm-1 merupakan sidik jari (finger print) dari setiap
senyawa dan menunjukkan kekhasan yang tinggi (Sastrohamidjojo, 1991).
Spektroskopi IR terutama digunakan untuk mengetahui gugus-gugus fungsional
suatu senyawa (Silverstein, 1991).
2. Spektroskopi NMR
Interpretasi dari NMR akan menghasilkan kerangka utama suatu senyawa.
Tantangan menggunakan spektroskopi ini adalah karakteristiknya yang
memerlukan bahan yang cukup banyak yaitu antara 5-50 mg, sehingga cukup
menyulitkan untuk isolat bahan aktif yang berada pada kisaran g
(Sastrohamidjojo, 1991; Silverstein, 1991).
a. Spektroskopi 13 C-NMR
Spektroskopi 13 C-NMR dapat memberikan informasi tentang posisi dan
jumlah atom karbon (C) dalam suatu molekul. Hal tersebut diperoleh dengan
mengolah data tentang pergeseran kimia (), nilai integral dan pola splitting dari
26
b. Spektroskopi 1 H-NMR
Jenis spektroskopi ini dapat mengungkapkan keberadaan proton (H) baik
posisi relatif terhadap proton sekitar dan jumlahnya dalam suatu molekul.
Informasi tersebut merupakan interpretasi dari pola splitting, coupling, nilai
integral spin dan pergeseran kimia yang terjadi (Silverstein, 1991).
3. Spektroskopi Massa
Spektroskopi jenis ini akan memberikan gambaran umum suatu molekul.
Data yang diperoleh berupa fragmentasi hasil penembakan molekul oleh elektron
III. METODOLOGI PENELITIAN
Metodologi penelitian meliputi aspek- aspek yang berkaitan dengan
preparasi sampel, bahan, alat dan prosedur kerja yang dilakukan, yaitu :
A. Sampel Uji Penelitian
Tanaman Ara diperoleh dari daerah Tanggamus yang diambil pada bulan
Agustus 2014 berupa akar keras yang terdapat di dalam tanah. Diambil 5 kg lalu
dikeringkan dengan diangin-anginkan dan terlindung dari cahaya matahari secara
langsung selanjutnya dipisahkan kulit dari bagian batang dan digiling menjadi
serbuk kemudian diayak dengan ukuran ayakan 65 mesh.
B. Bahan Penelitian
Aquades, heksana, kloroform, etil asetat, butanol, metanol, etanol 70%,
serbuk magnesium, serbuk DPPH, serbuk Natrium asetat anhidrat, serbuk AlCl3,
pereaksi sitroborat, serbuk silika, plat KLT GF254 dan DMSO.
C. Peralatan
Timbangan, oven, seperangkat alat gelas, lampu UV, spektroskopi UV -VIS,
spektrofotometer 1H-NMR, corong pisah, rotary evaporator, mikropipet dan
28
D. Waktu dan Tempat Penelitian Penelitian dilakukan di :
1. Laboratorium Kimia Organik, Fakultas MIPA, Universitas Lampung.
2. Laboratorium Teranokoko, Balai Besar Pengawas Obat dan Makanan di
Bandar Lampung untuk pengujian HPTLC.
3. Laboratorium Kimia Analitik Universitas Malahayati di Bandar
Lampung untuk uji aktivitas antioksidan.
4. Pengujian 1 H-NMR di Laboratorium Kimia Institut Teknologi Bandung,
Bandung.
Waktu penelitian dilakukan pada bulan Januari sampai Juni 2015.
E. Cara Kerja
Isolasi senyawa flavonoid dilakukan dengan metode maserasi dilanjutkan
dengan KLT. Jenis KLT yang digunakan adalah KLT GF254 yang telah diaktivasi
dengan pemanasan dalam oven pada suhu 100oC (Sastrohamidjojo, 1991).
1. Uji Pendahuluan
Sejumlah 1,0 g serbuk bahan ditambah 100 mL air panas (80oC), aduk dan
didiamkan selama 5 menit dan saring. Filtrat digunakan sebagai larutan uji.
Ditambahkan 5 mg serbuk magnesium dalam 5 mL larutan uji, 1 mL asam klorida
29
Terbentuknya warna kuning hingga merah jingga pada lapisan amil alkohol
menunjukkan adanya senyawa flavonoid (Harborne et al., 1987).
2. Ekstraksi Senyawa Flavonoid
Sejumlah 105 g serbuk kering akar tanaman Ara diekstraksi secara maserasi
menggunakan heksana sampai diperoleh filtrat jernih. Ampas dikeringkan
kemudian diekstraksi dengan etanol 70% berkali-kali hingga diperoleh filtrat jenih.
Masing-masing ekstrak dipekatkan dengan penguap vakum putar sehingga
diperoleh ekstrak kental (Adam et al., 2002; Fan et al., 2006). Selanjutnya yang
digunakan untuk penelitian adalah ekstrak etanol. Bagan isolasi simplisia tersebut
seperti terlihat pada Lampiran 1.
Ekstrak etanol pekat kemudian diekstraksi dengan heksana lalu dikumpulkan
dan dipekatkan sehingga diperoleh ekstrak kental heksana (Fraksi A). Fraksi air kemudian diekstraksi dengan kloroform selanjutnya dikumpulkan dan dipekatkan
hingga diperoleh fraksi kloroform pekat (Fraksi B). Fraksi air diekstraksi kembali dengan etil asetat selanjutnya dikumpulkan dan dipekatkan hingga diperoleh
fraksi kental etil asetat (Fraksi C). Fraksi air diekstraksi kembali menggunakan butanol selanjutnya dikumpulkan dan dipekatkan hingga diperoleh ekstrak butanol
30
a. Uji Kualitatif Flavonoid
Masing-masing fraksi (A, B, C dan D) diverifikasi kandungan flavonoidnya
dengan mengambil sejumlah 10 mg fraksi kental di atas dan diuji seperti prosedur
pada uji pendahuluan.
b. Uji Total Flavonoid
Uji kuantitatif dilakukan untuk mempertegas keberadaan senyawa flavonoid
dalam fraksi di atas, karena bila hasilnya nol berarti bisa saja hasil positif pada uji
kualitatif di atas bersifat bias/palsu.
Uji kuantitatif dinyatakan sebagai jumlah flavonoid total menggunakan
metode yang diperkenalkan oleh Chang et al. (2002). Metode ini menetapkan
flavonoid sebagai senyawa kuersetin sehingga dalam perlakuannya menggunakan
kuersetin sebagai baku pembanding.
Prosedurnya adalah sebagai berikut : Sebanyak 5 mg kuersetin ditimbang dan
dilarutkan dalam 10 mL metanol sebagai larutan stok (500g/mL) lalu diencerkan
sedemikian rupa sehingga diperoleh konsentrasi larutan 40 – 120 g/mL. Ambil
0,5 mL larutan lalu tambahkan 1,5 mL metanol; 0,1 mL AlCl3 10%; 0,1 mL Na
asetat anhidrat 1M dan 2,8 mL aquades. Inkubasi selama 30 menit lalu ukur
31
Sampel uji ekstrak kloroform dengan konsentrasi 1000 g/mL dan ekstrak etil
asetat 1000 g/mL dilarutkan dalam metanol. Tambahkan 0,1 mL AlCl3 10 %;
0,1 mL Na asetat anhidrat 1M dan 2,8 mL aquades. Inkubasi selama 30 menit lalu
ukur absorbansinya pada 415 nm.
Kadar flavonoid total dilakukan dengan mengukur absorbansi senyawa uji
lalu diekstrapolasikan menggunakan persamaan regresi linear serangkaian seri
kadar kuersetin standar yang telah diukur absorbansinya sehingga kadar total
flavonoid sampel ditentukan sebagai kadar kuersetin (mg QE/100 g bahan ).
3. Identifikasi Senyawa Flavonoid
Proses KLT dilakukan pada fraksi yang positif mengandung flavonoid
dengan prosedur berikut :
Cairan pengembang : Dilakukan proses optimasi
Jarak rambat : 10 cm
Pengembangan : Menaik
Penotolan : Bentuk garis
Pendeteksi : Sinar UV 254/366
Bercak pada KLT yang terbentuk selanjutnya disemprot dengan pereaksi
sitroborat. Bercak positif flavonoid ditandai dengan warna kuning yang berpendar
32
4. Kromatografi Kolom
Isolasi dilakukan dengan menggunakan kromatografi kolom gravitasi.
Langkah pertama diawali dengan melakukan impregnasi ekstrak pekat
menggunakan eluen yang akan dipakai berupa penambahan silika gel dengan
komposisi berat ekstrak dan silika gel (1 : 10). Impregnasi dilakukan agar
komponen ekstrak terdistribusi merata dalam silika sehingga proses kromatografi
kolom akan lebih teratur dan terkontrol. Eluen yang digunakan sama dengan
eluen pada proses KLT yang diperoleh dengan cara optimasi. Hasil elusi
ditampung dalam vial – vial berukuran 15 mL dan keberadaan senyawa yang
tereluen dikontrol dengan melakukan penotolan pada plat KLT. Untuk vial yang
memberikan bercak yang sama dapat digabungkan satu sama lain.
5. Penentuan Struktur Flavonoid
Penentuan struktur flavonoid dilakukan dengan menginterpretasi data-data
dari spektroskopi 1H-NMR terhadap senyawa uji yang diperoleh dari
kromatografi kolom. Penentuan struktur difokuskan pada senyawa yang memiliki
indikasi antioksidan yaitu dengan melihat pola kromatogram pada plat KLT yang
33
6. Uji Aktivitas Antioksidan a. Uji Kualitatif
Sebelum diuji potensi antioksidannya, plat KLT disemprot dengan larutan
DPPH 0,2%. Positif antioksidan ditandai dengan perubahan warna larutan DPPH
pada bercak KLT dari biru menjadi kuning setelah 30 menit.
b. Uji Potensi Antioksidan (IC50)
Potensi antioksidan dilakukan dengan tahap berikut :
i). Pembuatan larutan DPPH
Larutan pereaksi adalah DPPH dalam metanol yang selalu dibuat baru dan
dijaga pada suhu rendah dan terlindung dari cahaya. Larutan DPPH dibuat pada
konsentrasi yang memberi serapan pada angka sekitar 1,0 yaitu pada konsentrasi
50-100 M (Molyneux, 2004).
ii). Pembuatan seri konsentrasi larutan uji
Ditimbang 5 mg senyawa uji lalu dilarutkan dalam metanol sehingga
diperoleh konsentrasi 10, 20, 30, 40 dan 50 ppm. Selanjutnya tambahkan DPPH
50 g/mL dengan perbandingan volume yang sama (1:1) pada setiap seri
konsentrasi dan diinkubasi selama 30 menit pada suhu 37oC. Absorbansi diukur
pada 515 - 517 nm tergantung pada maksimal hasil optimasi. Untuk kontrol
positif digunakan larutan vitamin C dengan kadar 2, 5, 7, 10 dan 50 ppm dan
34
Nilai absorbansi yang diperoleh kemudian dikonversi menjadi nilai IC50
dengan cara membuat persamaan garis regresi linear, y = bx + a dengan ketentuan y = daya hambat terhadap DPPH dan x= kadar senyawa uji.
Prosentase daya
hambat dihitung dengan persamaan berikut :
% daya hambat = 1 – Absorbansi senyawa uji /Absorbansi DPPH x 100 %
Nilai IC50 merupakan hasil ekstrapolasi dari persamaan y = bx + a di atas. Nilai ini menggambarkan kadar suatu senyawa yang dapat menonaktifkan
separuh dari kekuatan radikal bebas DPPH. Interpretasi dari IC50 seperti pada
Tabel 6 berikut.
Tabel 6. Nilai IC50 dan potensi antioksidannya (Molyneux, 2004)
Kriteria Nilai IC50
Sangat kuat < 50 ppm
Kuat 50 – 100 ppm
Sedang 101 – 250 ppm
Lemah 251 – 500 ppm
V. SIMPULAN DAN SARAN
A. Simpulan
Berdasarkan pembahasan hasil penelitian dapat disimpulkan bahwa :
1. Kulit akar tanaman Ara (Ficus racemosa, L) mengandung 3 senyawa flavonoid
(fraksi kloroform) dan 1 senyawa flavonoid (fraksi etil asetat).
2. Aktivitas antioksidan IC50 fraksi kloroform adalah 2,67 ppm sedangkan IC50 fraksi
etil asetat tidak dapat diukur.
3. Senyawa flavonoid yang bersifat sebagai antioksidan adalah FC1 (dalam fraksi
kloroform) sedangkan dalam fraksi etil asetat adalah senyawa FE.
4. Senyawa FC1 adalah suatu kuersetin dengan IC50 sebesar 1,66 ppm yang
menunjukkan bahwa senyawa ini sangat kuat sebagai antioksidan.
B. Saran
Saran yang berkaitan dengan penelitian ini adalah sebagai berikut :
1. Perlu penelitian lebih lanjut untuk mengetahui aktivitas biologi lain dari senyawa-
senyawa flavonoid pada kulit akar tanaman Ara.
2. Tingginya potensi antioksidan dari fraksi etil asetat memerlukan penelitian lanjutan
64
DAFTAR PUSTAKA
Adam, J.H., Ramian, O and Wilcok, C.C. 2002. Phytochemical Screening of Flavonoid in Three Hybrids of Napenthes and the Putative Parental Species from Sarawak and Sabah. J.Biol Sci. 2(9): 623-625.
Araujo, V., Arnal, C and Boronat, M. 1998. Oxidant-Anti Oxidant Imbalance in Blood of Children with Juvenile Rheumatoid Arthritis. Bio Factor. 8:55- 59.
Amic, D., Dusanka, D.A., Beslo, D., and Trinastjia. 2003. Structure-Radical Scavenging Activity Relationship of Flavonoid. Croatia.Chem.Acta . 76: 55-61.
Bheemachari, J., Ashok, K., Joshi, N.H., Suresh, D.K. and Gupta, V.R.M. 2007. Anti Diarrhoeal Evaluation of Ficus racemosa, Linn Latex. Acta Pharmaceutica Sciencia. 49: 133-138.
Chandrashekhar, C.H., Latha, K.P., Vagdevi, K.M and Vaidya, V.P. 2008. Anthelmintic Activity of Crude Extract of Ficus racemosa, Linn. Int.J Green Pharm 2: 100-103.
Chang, C.C., Yang, M.H., Wen, H.M and Chern, J.C. 2002. Estimation of Total Flavonoid Content in Propolis by Two Complementary Colorimetric Methods. J Food Drug Anal. 10(3): 178-182.
Cook, N.C and Samman. 1996. Flavonoid: Chemistry, Metabolism, Cardioprotektif Effect and Dietary Sources. Nutritional Biochemistry.J .7: 66-76
65
Dicosmo, F. and Towers, G.H.N. 1984. Stress and Secondary Metabolism in Culture Plant Cells In Phytochemical Adaption to Stress. Plenum Publishing Co.Toronto. pp 15-50
Dreosti, I.E. 2002. Antioxidant Polyphenol in Tea, Cocoa and Wine. Nutrition. 16: 692-694
Droge, W. 2002 Free Radicals in the Physiological Control of Cell Function. Physiol Rev. 82:47-95.
Goyal, P.K. 2013. Antimicrobial Activity of Ethanolic Root Extract of Ficus racemosa, Linn. International Journal of Chem.Tech Research. 4(4): 1765-1769.
Guorong, F., Jinyong, P and Wu, Y. 2006. Preparative Separation and Isolation of Three Flavonoid and Three Phloroglucinol Derivative from Hypericum japonicum, Thumb using High Speed Countercurrent Chromathogrphy by Stepwise Increasing the Flow Rate of the Mobilphase. J liq chrom Tech. 29: 1619-1632.
Harborne, J.B. 1987. Metode Fitokimia. Terbitan ke II. Terjemahan Kosasih Padmawinata. Penerbit ITB. Bandung. Hal 15-50
He, G.X., Ping, X.H., He, C.Q., Hui, R., Yue, W.Z and Lonseny, T. 2005. Optimization of Condition for Supercritical Fluid Extraction of Flavonoid from Hops (Humulus lupulus, L). J.Zheijang Univ.Sci. 6B (10): 999-1004.
Heim, K.E., Tagliaferro, A.R and Bobilya, D.J. 2002. Flavonoid antioxidant : Chemistry, Metabolism and Structure–Activity Relationship. J.Nutr Biochem. 10 : 572-584.
66 Diabetic Rats. J.Etnopharmacol. 4: 105-108.
Kumar, G.S.S., Seethalakshmi, P.G., Bhuvanesh, N and Kumaresan, S. 2013. Studies on The Synthesis,Structural Characterization,Antimicrobial and DPPH Radical Scavenging Activity of The Co-crystals Caffeine : Cinnamic acid and Caffeine Eosin dehydrate. J.Mol.Struct 1050 hal 88- 96.
Kitao, S and Sekine. 1994. D-Glucosyl Transfer to Phenolic Compounds by Sucrose phosphorylase from Leuconostoc mesenteroides and Production of α arbutin. J.Biosci.Biotech.Biochem: 25-30
Krishna, M., Upendra, K., Mayank, P and Megha, S. 2011. Exploration of Preliminary Phytochemical Studies of Roots of Ficus racemosa ,Linn. Marmara Pharmaceutical Journal 15: 80-83.
Li, R.W., Leach, D.N., Myers, S.P., Lin, G.D., Leach, G.J and Waterman, P.G. 2004. A New Anti Inflammatory Glucosides from Ficus racemosa,Linn. Planta.Med 70: 421-426.
Mandal, S.C., Naity, T.K., Das, J., Saba, B.P and Pal, M. 2000. Anti inflammatory Evaluation of Ficus racemosa,Linn Leave Extract. J.Etnopharmacol.72: 87-92.
Markham, K.R. 1998. Cara Mengidentifikasi Flavonoid. Terjemah Kosasih Padmawinata. Penerbit ITB. Bandung. Hal 25-40
Mabry, T.J., Markham, K.R and Thomas, M.B. 1970. The Systematic Identification of Flavonoids. Springer-Verlag, New York Inc. New York. pp 20-60
67
Miller, A.L. 1996. Antioxidant Flavonoid : Structure, Function and Clinic Usage. J.Alt.Med.Rev : 1 : 201- 204.
Mishra, V., Khan, N.U and Singhal, K.C. 2005. Potential Antifilarial Activity of Fruit Extract of Ficus racemosa, Linn Against Setaria cervi in vitro. Indian J.Exp.Biol.43: 346-350
Molyneux, P. 2004. The Use of the Stable Free Radical Diphenyl picrylhidrazyl (DPPH) for Estimating Antioxidant Activity. Songklanakarin Journal of Science and Technology 26(2): 211-219.
Mosquero, O.M., Correa, Y.M., Buitrago, D.C and Nino, J. 2007. Antioxidant Activity of Twenty Five from Colombian Biodiversity. Memorias do instituto oswaldo cruz.102(5): 631-634.
Nakamura, Y., Watanabe, S., Miyake, N., Kohno, N and Osawa, T. 2003. Dihydrochalcones: Evaluation as Novel Radical Scavenging Antioxidant. J.Agri Food Chem 51 : 3309-3332.
Neldawati, Ratnawulan dan Gusnedi. 2013. Analisis Nilai Absorbansi Dalam Penentuan Kadar Flavonoid Untuk Berbagai Jenis Daun Tanaman Obat.Pillar of Physics 2 : 76-83.
Netty, A., Zuhelmi, Z., Hafrizal, S dan Jaswandi. 2009. Studi Nutrisi Buah Ara (Ficus Racemosa, L) untuk Pakan Ikan. Jurnal Natur Indonesia. 12(1) 54- 60.
Norman, F., Sulistyo, J dan Nazir, N. 2013. Sintesis Enzimatis Flavonoid Glikosida dari Gambir (Uncaria gambir) Menggunakan Enzim CGT-ase dari Bacillus Licheniformis. Prosiding Semirata FMIPA Unila.
Oguzhan, C and Aytekin, P. 2011. Elsevier : Scientia Horticulturae :
Phytochemical and Antioxidant Properties from The Eastern
Mediterranean Turkey. 128. pp 473-478.
Osawa, T., Katsuzak., Hagiwara and Shibamoto, T. 1992. A Novel Antioxidant Isolated from Young Green Barley Leaves. Journal of Agricultural and Food Chemistry. 40: 1135-1140.
Paarakh, P.M. 2009. Ficus Racemosa Linn : An Overview. Nat Prod Radiance. 8: 84-90.
Pratiwi. 2006. Nilai Peroksida dan Aktivitas Anti Radikal Bebas DPPH Ekstrak Metanol Knema laurina. Majalah Farmasi Indonesia. 17 (1): 32-36 Qiu, Y.K. 2000. 1H-NMR Spectra of Common Flavonoid. J.Shenyang.Pharm.
68 Terjemah Kosasih Padmawinata. Penerbit ITB. Bandung. Hal 20-60
Sastrohamidjojo, H. 1991. Spektroskopi. Liberty, Jogjakarta. Hal 36-50
Sathishkumar, T., Baskar, R., Shanmugam, S., Rajasekaran, P., Sadasivam, S and Manikandan, V. 2008. Optimization of Flavonoid Extraction from The Leaves of Tabernamontana heyneana, Wall, using L16 Orthogonal Design. J.Nature and Science 6(3) : 15-20
Shaikh, T., Rub, R., Bhise, K., Pimprikar, R.B and Sufiyan, A. 2010. Antibacerial Activity of Ficus racemosa,Linn Leaves on Actinomyces viscosus. 2: 41-44.
Sharma, S.K dan Gupta, V.K. 2008. In Vitro Antioxidant Studies of Ficus Racemosa,Linn Root. Pharmacognosy Magazine . 4: 70-74.
Shiksharthi, A.R and Mittal, S. 2011. Ficus racemosa,Linn: Phytochemistry, Traditional Uses and Pharmacological Properties: A Review. International Journal of Recent Advances in Pharmaceutical Resarch.4 : 6-15
Silverstein, R.M. 1991. Penyelidikan Spektroskopik Senyawa Organik, Edisi IV : Diterjemahkan oleh Hartomo. Erlangga. Jakarta. Hal 10-37
Solomon, A., Golubowicz, S., Yablowicz, Z., Grossman, S., Bergman, M., Gottlieb, H., Atlman, A., Kerem, Z and Flaishman, M.A. 2006. Antioxydan Activities and Anthocyanin Content of Fresh Fruit Common of Fig (Ficus carica, Linn). J.Agric.Food.Chem. 54: 7717-7723.
69
Sri, H.W.S. 2003. Isolasi dan Identifikasi Favonoid pada Daun Katu (Sauropus androdynus,(L).Merr. Makara Sains 7(2) : 51-64
Trinil, S., Lalu, A.Z., Sutiman, B.S dan Sri, W. 2013. Prospek Sari Buah Tin Local (Ficus glomerata, Robx) Sebagai Agen Preservasi Motilitas Spermatozoa Kambing. Jurnal Kedokteran Hewan . 7(1) : 20-24
Turkmen, N., Sari, F and Velioglu,Y.S. 2006. Effect of Extraction Solvent on Concentration and Antioxidant Activity of Black and Black Mate Tea Polyphenol Determined by Ferrous Tartrate and Folin-Ciocalteu Methods. J.Food Chem. 99: 835-841.
Vasudha, B., Sharma, A., Ghanshyam and Singla, M.L. 2014. Coupling of chromatographic analyses with pretreatment for the determination of bioactive compounds in Emblica officinales. J.Anal. Methods. 6: 410-418
Veerapur, V.P., Prabakhar, K.R and Parihar, V.K. 2009. Ficus racemosa,Linn Stem Bark: A Potent Antioxidant and A Probable Natural Protector. Evid Based Complement Alter Med. 6: 317-324.
Vinson, J.A. 1999. The Functional Food Properties of Figs. Cereal Food World. 4: 82-87. Chromatography Atlas. Springer. Second Edition. Munich. pp 20-78
Yaqin, X., Zhang, R and Fu, H. 2005. Studies on The Optimal Process to Extract Flavonoid from Red-raspberry Fruits. Nature and Science. 3(2) : 43-46.