15
ISOLASI SENYAWA GOLONGAN FLAVONOID
SEBAGAI ANTIOKSIDAN DARI DAUN DANDANG
GENDIS (
Clinacanthus nutans
)
SRI AGUSTINA
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2011
15
ABSTRAK
SRI AGUSTINA. Isolasi Senyawa Golongan Flavonoid sebagai Antioksidan dari
Daun Dandang Gendis (
Clinacanthus nutans
). Dibimbing oleh DUDI TOHIR dan
GUSTINI SYAHBIRIN.
Daun dandang gendis (
Clinacanthus nutans
) memiliki kemampuan
antioksidan. Tujuan penelitian ini ialah memperoleh ekstrak flavonoid daun
dandang gendis yang memberikan aktivitas antioksidan yang tinggi. Aktivitas
antioksidan ditentukan menggunakan metode 1,1-difenil-2-pikril-hidrazil. Hasil
penelitian menunjukkan bahwa ekstrak etilasetat memiliki aktivitas antioksidan
dengan nilai IC
50sebesar 178.40mg L
-1. Ekstrak etilasetat kemudian difraksionasi
menggunakan kromatografi lapis tipis preparatif dengan eluen
n
-butanol:asam
asetat:air (4:1:5) dan menghasilkan 3 fraksi. Fraksi teraktif ialah fraksi 2 dengan
nilai IC
50sebesar 52.93 mg L
-1, tetapi lebih rendah dari butil hidroksi toluena
(IC
5016.71 mg L
-1). Uji golongan flavonoid menunjukkan bahwa senyawa pada
fraksi 2 adalah flavonol dan flavon. Spektrum ultraviolet-tampak fraksi 2 dalam
pelarut metanol menunjukkan serapan maksimum pita 1 pada 332 nm dan pita 2
pada 274 nm. Pergeseran batokromik pada pelarut MeOH+NaOMe dan
MeOH+AlCl
3-HCl mengindikasikan adanya substituen 4'-OH dan 5-OH. Adanya
puncak baru dalam pita 2 pada 326.5 nm menunjukkan adanya substituen 7-OH.
ABSTRACT
SRI AGUSTINA. Isolation of Flavonoids as Antioxidant from Dandang Gendis
(
Clinacanthus nutans
) Leaves. Supervised by DUDI TOHIR and GUSTINI
SYAHBIRIN.
The leaves of dandang gendis (
Clinacanthus nutans
) exhibit antioxidant
activity. The objective of this study is to investigate the highest antioxidant
activity from flavonoid extract of the leaves. Antioxidant activities were
determined by radical scavenging assay using 1,1-diphenyl-1-pycryl-hydrazyl
radical. The result showed that ethyl acetate extract had antioxidant activity with
IC
50value of 178.40 mg L
-1. The ethyl acetate extract was fractionated further
using preparative thin layer chromatography with eluent of
n
-buthanol:acetic acid:
water (4:1:5) and produced 3 fractions. The most active fraction was fraction 2
with IC
50value of 52.93 mg L
-1, which was lower than that of butylated hydroxy
toluene (IC
5016.71 mg L
-1). Flavonoid assay of fraction 2 showed that it
contained flavonol and flavon. The ultraviolet-visible spectrum of fraction 2 in
methanol solvent showed a maximum absorption at 332 in band 1 and 274 nm in
band 2. In MeOH+MeONa and MeOH+AlCl
3-HCl solvents there was a
bathochromic shift, indicated the presence of 4'-OH and 5-OH. The new peak at
326.5 nm showed the presence of 7-OH substituent.
15
ISOLASI SENYAWA GOLONGAN FLAVONOID
SEBAGAI ANTIOKSIDAN DARI DAUN DANDANG
GENDIS (
Clinacanthus nutans
)
SRI AGUSTINA
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2011
15
Judul : Isolasi Senyawa Golongan Flavonoid sebagai Antioksidan dari Daun
Dandang Gendis (
Clinacanthus nutans
)
Nama : Sri Agustina
NIM : G44062261
Menyetujui
Pembimbing I,
Pembimbing II,
Drs. Dudi Tohir, MS
Dr. Gustini Syahbirin, MS
NIP 19571104 198903 1 001
NIP 19600819 198903 2 001
Mengetahui
Ketua Departemen,
Prof. Dr. Ir. Tun Tedja Irawadi, MS
NIP 195012271976032002
15
PRAKATA
Puji dan syukur ke hadirat Allah SWT atas segala rahmat dan karunia-Nya,
sehingga penulis dapat menyelesaikan karya ilmiah yang berjudul “Isolasi
Senyawa Golongan Flavonoid Sebagai Antioksidan dari Daun Dadang Gendis
(
Clinacanthus nutans
)” yang dilaksanakan sejak bulan Juni 2010 di Laboratorium
Kimia Organik Departemen Kimia FMIPA IPB.
Penulis mengucapkan terima kasih kepada Drs. Dudi Tohir, MS dan Dr.
Gustini Syahbirin, MS selaku pembimbing yang telah memberikan pengarahan
dan bimbingannya kepada penulis. Penulis juga mengucapkan terima kasih
kepada orang tua, Bapak Ace Supriatin dan Ibu Suratmi atas didikan, doa, dan
kasih sayangnya yang tiada terkira, serta untuk seluruh keluarga besar di rumah,
terima kasih atas dukungan dan dorongannya.
Penulis juga mengucapkan terima kasih kepada Bapak Sabur, Mba Nia, Ibu
Yeni Karmila, dan Ibu Siti Robiah, atas bantuan yang diberikan. Tak lupa,
ungkapan terima kasih penulis kepada seluruh rekan peneliti di Laboratorium
Kimia Organik (Wulan, Ela, Arif, Saki, Farid, Tifah, Dinda, Risal, Muti, Lia, Teh
Dian, Kak Akbar), serta teman-teman Kimia 43 atas bantuan, motivasi, diskusi,
dan kebersamaan selama penulis menempuh studi dan menjalankan penelitian.
Semoga karya ilmiah ini dapat bermanfaat.
Bogor, Februari 2011
15
RIWAYAT HIDUP
Penulis dilahirkan di Bogor pada tanggal 17 Agustus 1988 dari Bapak Ace
Supriatin dan Ibu Suratmi. Penulis merupakan anak kedua dari dua bersaudara.
Penulis menyelesaikan studi di SMAN 3 Bogor pada tahun 2006. Pada tahun yang
sama penulis diterima di Institut Pertanian Bogor (IPB) melalui jalur Undangan
Seleksi Masuk IPB (USMI). Tahun 2007 penulis diterima pada Program Studi
Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam.
Penulis pernah menjadi pengajar Kimia di bimbingan belajar Avogadro
pada tahun 2008/2009 dan bimbingan belajar ERC pada tahun 2010, dan pernah
menjadi asisten praktikum mata kuliah Kimia Dasar pada tahun 2008/2009, Kimia
Pangan D3 Analisis Kimia tahun 2010, Kimia Organik Layanan tahun 2008,
Kimia Organik D3 Analisis Kimia tahun 2010, Praktikum Kimia Organik
Berbasis Kompetensi tahun 2010, dan Kimia TPB Alih Tahun tahun 2010. Penulis
juga berkesempatan melaksanakan kegiatan praktik lapangan di PT Novell
Pharmaceutical Lab, Bogor pada tahun 2009.
15
DAFTAR ISI
Halaman
DAFTAR TABEL ... vi
DAFTAR GAMBAR ... vi
DAFTAR LAMPIRAN ... vii
PENDAHULUAN ... 1
TINJAUAN PUSTAKA
Dandang Gendis ... 1
Antioksidan ... 2
Metode DPPH ... 2
Flavonoid ... 2
BAHAN DAN METODE
Bahan dan Alat ... 3
Kadar Air ... 3
Isolasi Flavonoid ... 3
Uji Aktivitas Antioksidan ... 3
Analisis Flavonoid ... 3
Uji Fitokimia ... 4
Uji Golongan Flavonoid ... 4
HASIL DAN PEMBAHASAN
Kadar air ... 4
Isolasi Senyawa Golongan Flavonoid ... 5
Uji Aktivitas Antioksidan ... 5
Golongan Flavonoid Fraksi Aktif ... 5
Uji Fitokimia dan Golongan Flavonoid ... 7
SIMPULAN DAN SARAN ... 8
Simpulan ... 8
Saran ... 8
DAFTAR PUSTAKA ... 8
15
DAFTAR TABEL
Halaman
1 Uji kualitatif golongan flavonoid ... 2
2 Rentang serapan spektrum UV-tampak senyawa flavonoid ... 3
3 Aktivitas antioksidan ... 5
4 Uji fitokimia ekstrak etanol ... 7
5 Uji golongan flavonoid ekstrak etanol, ekstrak etil asetat, dan F2 ... 7
DAFTAR GAMBAR
Halaman
1 Daun dandang gendis ... 1
2 Struktur DPPH: radikal bebas (a) bentuk tereduksi (b) ... 2
3 Struktur flavonoid ... 2
4 Noda pemisahan di bawah lampu UV 254 nm: KLT (a), KLT preparatif
dengan eluen BAA (b). ... 5
5 Spektrum F2 dalam pelarut metanol ... 6
6 Spektrum F2 dengan penambahan pereaksi geser NaOCH
3dan NaOCH
3setelah 5 menit ... 6
7 Spektrum F2 setelah penambahan pereaksi AlCl
3dan AlCl
3/HCl ... 6
8 Spektrum F2 setelah penambahan pereaksi NaOMe, NaOMe 5 menit, dan
H
3BO
3... 7
9 Kromatogram 2 arah F2 dengan eluen BAA dan BEA ... 7
DAFTAR LAMPIRAN
Halaman
1 Diagram alir penelitian ... 11
2 Kadar air serbuk daun dandang gendis ... 12
3 Rendemen hasil ekstraksi ... 12
4 Hasil uji aktivitas antioksidan ... 13
5 Pergeseran panjang gelombang pada fraksi 2 setelah penambahan pereaksi
geser ... 17
15
PENDAHULUAN
Negara Indonesia memiliki keanekaragaman hayati yang kaya. Sekitar 40 000 spesies tumbuhan ditemukan di Indonesia dan 180 di antaranya berpotensi sebagai tanaman obat (Bermawi & Kristina 2003). Salah satu tanaman yang lazim digunakan sebagai obat tradisional adalah dandang gendis (Clinacanthus nutans). Dandang gendis merupakan tanaman semak belukar yang sering dijadikan tanaman pagar dan dikenal oleh masyarakat sebagai obat kencing manis, susah buang air kecil, dan disenteri. Beberapa penelitian yang telah dilakukan menunjukkan bahwa ekstrak dandang gendis berpotensi sebagai antikanker (Sofyan 2008), larvasida Aedes aegypti
(Andriani 2008), antivirus Herpes simplex
(Yoosook et al. 1999; Thongchai et al. 2008), dan antioksidan (Pannangpetch et al. 2007; Akbar 2010).
Ekstraksi pendahuluan daun dandang gendis dengan berbagai pelarut menunjukkan kandungan alkaloid, flavonoid, dan terpenoid (Suharty 2004). Flavonoid yang terkandung dalam ekstrak daun dandang gendis dapat menghambat aktivitas radikal bebas. Radikal bebas diketahui memiliki reaktivitas yang tinggi sehingga dapat memicu reaksi berantai dalam sel. Hal ini dapat merusak sel dan akan menyebabkan munculnya berbagai penyakit seperti inflamasi, penyakit kardiovaskular, kanker, dan penuaan dini. Aktivitas radikal tersebut dapat dihambat oleh kerja antioksidan.
Potensi ekstrak daun dandang gendis sebagai antioksidan telah diteliti oleh Akbar (2010) yang menunjukkan aktivitas antioksidan dengan nilai konsentrasi hambat 50% (IC50) sebesar 48.42 mg L-1. Ekstrak
daun dandang gendis dapat berpotensi sebagai antioksidan karena mengandung senyawa flavonoid. Penelitian ini bertujuan mengisolasi senyawa flavonoid, uji aktivitas antioksidan, dan analisis senyawa golongan flavonoid yang terkandung dalam daun dandang gendis menggunakan spektrofotometer UV-tampak.
TINJAUAN PUSTAKA
Dandang Gendis
Dandang gendis (Gambar 1) adalah tumbuhan semak belukar berbentuk perdu yang memiliki ciri fisik antara lain batang yang beruas, berwarna hijau, dan tegak
dengan tinggi kurang lebih 2.5 m. Daunnya mempunyai bentuk tunggal dan berhadapan satu sama lain dengan panjang daun berkisar 8–12 cm, sedangkan lebar 4–6 cm. Daun tersebut berbentuk tulang menyirip dan berwarna hijau. Tanaman ini memiliki bunga yang tumbuh di ketiak daun dan di ujung batang. Mahkota daun berbentuk tabung dengan panjang 2–3 cm. Warnanya merah muda. Buah yang dihasilkan tanaman yang termasuk famili Acanthaceae ini berwarna cokelat dengan bentuk bulat memanjang (Kristio 2007).
Gambar 1 Daun dandang gendis.
Secara taksonomi dandang gendis diklasifikasikan dalam kerajaan Plantae, divisi Spermatophyta, sub divisi Angiospermae, famili Acanthaceae, genus Clinacanthus, dan spesies Clinacanthus nutans. Masyarakat Indonesia mengenal dandang gendis sebagai obat kencing manis (diabetes melitus), susah buang air kecil, dan disenteri. Selain itu, beberapa penelitian menunjukkan bahwa ekstrak daun dandang gendis berpotensi sebagai antioksidan (Pannangpetch et al. 2007; Akbar 2010), larvasida terhadap Aedes aegypti (Andriani 2008), antikanker (Sofyan 2008), dan antiradang (Wanikiat et al. 2008). Daun dandang gendis memiliki aktivitas antivirus yang tidak terlalu kuat terhadap HSV1 (Thongchai et al. 2008) dan HSV2 (Yoosook et al. 1999).
Senyawa yang terkandung dalam daun dandang gendis di antaranya C-glikosilflavon, viteksin, isoviteksin, shaftosida, isomolupentin, 7-O-ß-glukopiranosida, orientin, 5 senyawa yang mengandung sulfur (Teshima et al. 1997), 132-hidroksi-(132-R )-faeofitin b, 132-hidroksi-(132-S)-faeofitin a, 132-hidroksi-(132-R)-faeofitin a (Sakdarat et al. 2009), serta campuran 9 serebrosida dan monoasilmonogalaktosilgliserol(Tuntiwachutt tikul et al. 2004).
2
Antioksidan
Antioksidan alami mampu melindungi tubuh terhadap kerusakan yang disebabkan oleh spesies oksigen reaktif, mampu menghambat terjadinya penyakit degeneratif, serta mampu menghambat peroksidase lipid pada makanan (Sunarni 2005). Senyawa flavonoid diketahui mampu berperan menangkap radikal bebas atau sebagai antioksidan alami (Amic et al. 2003).
Aktivitas antioksidan dari suatu bahan alam dapat diuji dengan berbagai metode di antaranya kemampuan mereduksi ion feri (FRAP), 1,1-difenil-2-pikrilhidrazil (DPPH), dan kapasitas mereduksi kupri (CUPRAC). Aktivitas antioksidan ekstrak daun dandang gendis dengan metode DPPH cukup kuat, yang ditunjukkan dengan nilai IC50 sebesar
110.40 µg mL-1 (Pannangpetch et al. 2007). Berdasarkan Akbar (2010), ekstrak teraktif daun dandang gendis berpotensi sebagai antioksidan dengan nilai IC50 sebesar 48.42
mg L-1. Nilai IC50 yang kurang dari 200 ppm
menunjukkan aktivitas antioksidan yang kuat (Hanani et al. 2005).
Metode DPPH
Salah satu metode yang dapat menunjukkan aktivitas antioksidan dari senyawa alam adalah metode DPPH. 1,1-difenil-2-pikrilhidrazil (Gambar 2a) tergolong radikal bebas stabil. Delokalisasi elektron pada molekul DPPH akan memberikan warna ungu yang dicirikan dengan pita serapan pada 520 nm. Ketika DPPH ditambahkan ke dalam senyawa yang dapat memberikan atom hidrogen, DPPH akan berubah warna menjadi kuning muda, yakni warna bentuk tereduksinya, difenilpikrilhidrazin (Gambar 2b) (Molyneux 2004).
(a) (b)
Gambar 2 Struktur DPPH: radikal bebas (a) bentuk tereduksi (b).
Salah satu senyawa yang dapat memberikan atom hidrogen kepada molekul DPPH adalah flavonoid. Radikal bebas DPPH
akan ditangkap oleh senyawa flavonoid, dan flavonoid akan teroksidasi menghasilkan bentuk radikal yang lebih stabil, yaitu radikal dengan kereaktifan rendah. Flavonoid mendonorkan radikal hidrogen dari cincin aromatiknya untuk mengurangi radikal bebas yang bersifat toksik menghasilkan radikal flavonoid yang terstabilkan resonans dan membuatnya tidak toksik (Amic et al. 2003).
Flavonoid
Flavonoid merupakan salah satu metabolit sekunder. Keberadaannya dalam daun kemungkinan dipengaruhi oleh adanya proses fotosintesis sehingga daun muda belum terlalu banyak mengandung flavonoid (Markham 1988). Senyawa flavonoid mempunyai struktur C6-C3-C6. Tiap bagian C6 merupakan cincin benzena yang dihubungkan oleh atom C3 yang merupakan rantai alifatik, seperti ditunjukkan pada Gambar 3. Penggolongan jenis flavonoid didasarkan pada sifat kelarutan dan reaksi warna (Tabel 1).
Gambar 3 Struktur flavonoid.
Tabel 1 Uji kualitatif golongan flavonoid (Harborne 1987)
Pereaksi Golongan flavonoid
Warna hasil reaksi CH3COONa Antosianidin Merah
FeCl3 Antosianidin Biru
Na2CO3 Antosianidin Ungu, biru,
hijau CH3COOPb Kalkon Auron Flavon Jingga Merah Jingga– krem NaOH 0,1 N Kalkon, auron Flavonol, flavon Merah– ungu Kuning H2SO4 pekat Flavon Flavonol Kalkon Kuning Kuning, Jingga– krem Merah
3
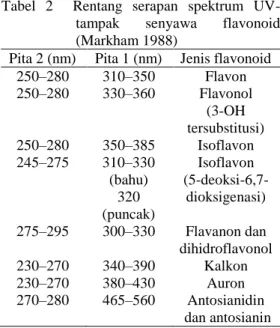
Flavonoid mengandung sistem aromatik terkonjugasi dan karena itu, menunjukkan pita serapan kuat pada daerah spektrum UV-tampak (Harborne 1987). Spektrum khas flavonoid terdiri atas dua panjang gelombang maksimum: 240–285 nm (pita 2) dan 300–550 nm (pita 1). Rentang serapan spektrum UV-tampak senyawa flavonoid ditunjukkan pada Tabel 2 (Markham 1988).
Tabel 2 Rentang serapan spektrum UV- tampak senyawa flavonoid (Markham 1988)
Pita 2 (nm) Pita 1 (nm) Jenis flavonoid 250–280 310–350 Flavon 250–280 330–360 Flavonol (3-OH tersubstitusi) 250–280 350–385 Isoflavon 245–275 310–330 (bahu) 320 (puncak) Isoflavon (5-deoksi-6,7-dioksigenasi) 275–295 300–330 Flavanon dan dihidroflavonol 230–270 340–390 Kalkon 230–270 380–430 Auron 270–280 465–560 Antosianidin dan antosianin
BAHAN DAN METODE
Bahan dan Alat
Bahan-bahan yang digunakan adalah serbuk daun dandang gendis dari daerah Batuhulung Bogor, etanol 70%, NH4OH,
H2SO4 2 M, FeCl3 1%, metanol, etanol 98%,
anhidrida asetat, amil alkohol, serbuk Mg, HCl pekat, HCl 2 N, CH3COONa, Na2CO3,
CH3COOPb, H2SO4 pekat, Butil Hidroksi
Toluena (BHT), n-heksana, etil asetat, DPPH,
n-butanol, asam asetat, NaOCH3, AlCl3,
H3BO3,pereaksi Mayer, Wagner, DragendoRf
, dan Lieberman-Buchard,.
Alat-alat yang digunakan adalah peralatan kaca yang biasa digunakan di laboratorium, kromatografi lapis tipis preparatif (KLT preparatif), pelat KLT, penguap putar, dan spektrofotometer UV-1700 PharmaSpec.
Kadar Air
Diagram alir penelitian ditunjukkan pada Lampiran 1. Cawan porselen dikeringkan pada suhu 105 °C selama 3 jam, kemudian
didinginkan dalam eksikator dan ditimbang bobot keringnya. Serbuk dandang gendis ditimbang teliti sebanyak 3 g dalam cawan tersebut kemudian dipanaskan dalam oven pada suhu 105 °C selama 3 jam. Setelah itu, didinginkan dan ditimbang. Pemanasan dan penimbangan dilakukan sampai bobotnya konstan.
Isolasi Flavonoid (Markham 1988)
Serbuk daun dandang gendis direndam dengan etanol 70% selama 24 jam pada suhu kamar. Ekstrak yang diperoleh disaring dan ampasnya direndam kembali dengan etanol 70%. Filtratnya dipekatkan dengan penguap putar.
Ekstrak etanol daun dandang gendis dipartisi dengan n-heksana, kemudian dihidrolisis dengan HCl 2 N pada suhu 100 °C selama 60 menit. Ekstrak daun dandang gendis terhidrolisis dipartisi dengan etil asetat. Fraksi etil asetat dikumpulkan dan dipekatkan dengan penguap putar, lalu difraksionasi dengan KLT preparatif. Eluen yang digunakan adalah campuran n-butanol: air:asam asetat (BAA) (4:5:1). Noda pemisahan dideteksi di bawah lampu UV 254 nm. Setiap fraksi dikerok, dilarutkan dengan etanol 70%, kemudian dipekatkan dan diuji aktivitas antioksidan. Fraksi teraktif dianalisis dengan spektrofotometer UV-tampak dan diuji kemurniannya menggunakan KLT dua dimensi dengan eluen BAA dan n-butanol: etanol:air (BEA) (4:1:2).
Uji Aktivitas Antioksidan (Blois 1958)
Larutan ekstrak dibuat dengan konsentrasi 10, 30, 50, dan 70 mg L-1. Sebanyak 4.5 mL larutan ekstrak dimasukkan ke dalam tabung reaksi dan ditambahkan 1.5 mL larutan DPPH 0.1 mM dalam etanol. Campuran diinkubasi pada suhu 37 °C selama 30 menit, lalu diukur serapannya pada panjang gelombang 515 nm. BHT dengan konsentrasi 2, 4, 6, dan 8 mg L-1 digunakan sebagai kontrol positif. Kemudian nilai IC50 dihitung menggunakan rumus
persamaan regresi.
Analisis Flavonoid (Markham 1988)
Sebanyak 0.1 mg fraksi teraktif ekstrak daun dandang gendis dilarutkan dengan 10 mL metanol. Identifikasi flavonoid dengan spektrum UV-tampak dilakukan dengan menambahkan pereaksi geser AlCl3,
4
campuran CH3COONa dengan H3BO3, dan
NaOCH3. Data pergeseran pita serapan
sebelum dan sesudah ditambahkan pereaksi geser menentukan jenis senyawa golongan flavonoid.
Uji Fitokimia (Harborne 1987)
Alkaloid
Sebanyak 0.1 g ekstrak dilarutkan dalam 10 mL CHCl3 dan 4 tetes NH4OH. Larutan
disaring dan filtratnya dimasukkan ke dalam tabung reaksi tertutup. Ekstrak CHCl3 dalam
tabung reaksi dikocok dengan 10 tetes H2SO4
2 M dan lapisan asamnya dipisahkan ke dalam tabung reaksi yang lain. Lapisan asam ini diteteskan pada lempeng tetes dan ditambahkan pereaksi Mayer, Wagner, dan DragendoRf yang akan menimbulkan endapan berturut-turut berwarna putih, cokelat, dan merah jingga jika terdapat alkaloid.
Saponin
Sebanyak 0.1 g ekstrak ditambahkan 10 mL air panas dan dididihkan selama 5 menit. Setelah itu, disaring dan filtratnya digunakan untuk pengujian. Filtrat dimasukkan ke dalam tabung reaksi tertutup kemudian dikocok selama 10 detik dan didiamkan selama 10 menit. Adanya saponin ditunjukkan dengan terbentuknya buih yang stabil.
Triterpenoid dan Steroid
Sebanyak 0,1 g ekstrak dilarutkan dengan 25 mL etanol panas (50 °C). Larutan disaring dalam pinggan porselen dan diuapkan sampai kering. Residu ditambahkan eter dan ekstrak eter dipindahkan ke dalam lempeng tetes. Kemudian ditambahkan 3 tetes anhidrida asetat dan 1 tetes H2SO4 pekat (uji
Lieberman-Buchard). Warna merah atau ungu menunjukkan kandungan triterpenoid, sedangkan warna hijau atau biru menunjukkan kandungan steroid.
Tanin
Sebanyak 0.1 g ekstrak ditambahkan 10 mL air panas, dididihkan selama 5 menit, dan disaring. Sebagian filtrat yang diperoleh ditambahkan larutan FeCl3 1%. Hasil positif
ditunjukkan oleh warna hijau kehitaman.
Flavonoid
Sebanyak 0.1 g ekstrak ditambahkan 10 mL air panas dan dididihkan selama 5 menit. Setelah itu, disaring dan filtratnya digunakan untuk pengujian. Filtrat dimasukkan ke dalam
tabung reaksi lalu ditambahkan 0.5 g serbuk Mg, 1 mL HCl pekat, dan 1 mL amil alkohol, dan dikocok kuat. Uji positif flavonoid menghasilkan warna kuning atau jingga pada lapisan amilalkohol.
Uji Golongan Flavonoid (Harborne 1987)
Sebanyak 0.5 g ekstrak dilarutkan dengan 10 mL metanol-HCl 1 N (1:1) dan dipanaskan pada suhu 95 °C selama 1 jam. Setelah itu, didinginkan dan disaring, lalu filtratnya diekstraksi dengan etil asetat.
Antosianidin
Sebanyak 1 mL ekstrak etil asetat ditambahkan 3 tetes CH3COONa lalu diamati,
kemudian ditambahkan 3 tetes FeCl3 dan
diamati lagi. Antosianidin dengan CH3COONa memberikan warna merah atau
ungu dan bila ditambahkan FeCl3 menjadi
biru.
Sebanyak 1 mL ekstrak etil asetat ditambahkan Na2CO3 lalu diamati.
Antosianidin memberikan warna ungu, biru, atau hijau.
Flavon, Kalkon, Auron, dan Flavonol Sebanyak 1 mL ekstrak etil asetat ditambahkan 3 tetes CH3COOPb lalu diamati
warnanya. Flavon memberikan warna jingga hingga krem, kalkon memberikan warna jingga tua, dan auron memberikan warna merah.
Sebanyak 1 mL ekstrak etil asetat ditambah 3 tetes NaOH 0,1 N lalu diamati warnanya. Flavon memberikan warna kuning, flavonol memberikan warna kuning, jingga hingga krem, dan kalkon memberikan warna krem hingga merah tua.
HASIL DAN PEMBAHASAN
Kadar Air
Penentuan kadar air dilakukan dengan metode gravimetri evolusi tidak langsung. Bobot air dihitung setelah proses pengeringan dengan suhu 105 °C pada periode waktu tertentu sampai diperoleh bobot yang konstan. Menurut Harjadi (1993), air yang terikat secara fisik dapat dihilangkan dengan pemanasan pada suhu 100–105 °C. Salah satu kegunaan penentuan kadar air adalah untuk mengetahui ketahanan suatu bahan dalam penyimpanan.
5
Sampel yang digunakan dalam penelitian ini adalah serbuk daun dandang gendis. Kadar airnya diperoleh sebesar 9.74% (Lampiran 2). Menurut Winarno (1997), sampel dapat disimpan dalam jangka waktu lama jika memiliki kadar air di bawah 10%. Nilai kadar air yang diperoleh kurang dari 10%. Hal ini menunjukkan bahwa sampel memiliki masa simpan yang relatif lama.
Isolasi Senyawa Golongan Flavonoid
Tahap pertama dalam isolasi senyawa golongan flavonoid adalah maserasi sampel dengan pelarut etanol 70%. Etanol 70% digunakan karena flavonoid bersifat polar, dengan sejumlah gugus hidroksil, baik yang terikat ataupun yang tidak terikat gula (Markham 1988). Selain itu, berdasarkan Macari et al. (2006), aktivitas antioksidan tanaman obat dalam etanol 70% lebih tinggi dibandingkan dengan beberapa pelarut lainnya. Maserasi dilakukan berulang kali sampai filtrat tidak berwarna hijau lagi, sehingga dapat dianggap semua senyawa yang berbobot molekul rendah telah terekstraksi (Harborne 1987). Filtrat yang diperoleh dipekatkan dengan penguap putar sehingga diperoleh ekstrak kasar etanol. Rendemen yang dihasilkan dari 200.04 g serbuk daun dandang gendis yang dimaserasi adalah 31.24 % (Lampiran 3).
Ekstrak daun dandang gendis kemudian dipartisi cair-cair menggunakan pelarut n -heksana untuk menghilangkan kandungan lemak. Tahapan selanjutnya adalah hidrolisis-asam terhadap ekstrak bebas-lemak. Hidrolisis bertujuan memutus gula dari aglikon flavonoid. Hasil hidrolisis kemudian dipartisi dengan etil asetat untuk memisahkan aglikon flavonoid dengan gulanya. Aglikon flavonoid akan berada dalam fraksi etil asetat dan gula dalam fraksi air (Markham 1988). Pemisahan aglikon flavonoid dilakukan dengan KLT preparatif menggunakan eluen BAA dengan nisbah 4:1:5 (Markham 1988). Noda pemisahan diamati di bawah lampu UV 254 nm, dan diperoleh 3 noda (Gambar 4). Nilai Rf untuk fraksi 1, 2, dan 3 berturut-turut adalah 0.25, 0.52, dan 0.85. Setiap fraksi dikerok, kemudian dilarutkan dengan etanol hingga jumlah setiap fraksi mencukupi untuk analisis kualitatif, uji aktivitas antioksidan, dan analisis senyawa golongan flavonoid.
(a) (b)
Gambar 4 Noda pemisahan di bawah lampu UV 254 nm: KLT (a), KLT preparatif dengan eluen BAA (b).
Uji Aktivitas Antioksidan
Uji aktivitas antioksidan ekstrak etil asetat dan ketiga fraksi hasil KLT preparatif dilakukan dengan metode DPPH (Lampiran 4). Metode ini dipilih karena mudah digunakan, cepat, dan cukup teliti (Prakash 2001). Aktivitas antioksidan metode DPPH dinyatakan dengan nilai IC50, yakni
konsentrasi sampel yang mampu menghambat aktivitas DPPH sebesar 50%.
Ekstrak etil asetat memiliki aktivitas antioksidan dengan nilai IC50 sebesar 178.40
mg L-1. Fraksi 2 (F2) hasil KLT preparatif menunjukkan nilai IC50 yang paling kecil,
yakni 52.93 mg L-1. Semakin kecil nilai IC50,
semakin tinggi pula aktivitas antioksidan (Molyneux 2004). Fraksi 1 (F1) dan fraksi 3 (F3) memiliki aktivitas antioksidan yang kecil. Nilai IC50 cukup besar yakni 43932.07
mg L-1 dan 9226.48 mg L-1. Menurut Hanani
et al. (2005), suatu senyawa dikatakan
memiliki aktivitas antioksidan yang tinggi jika memiliki nilai IC50 kurang dari 200 mg L -1. Namun, jika dibandingkan dengan BHT
sebagai kontrol positif, aktivitas antioksidan F2 masih lebih rendah. Nilai IC50 untuk BHT
sebesar 16.71 mg L-1 (Tabel 3).
Tabel 3 Aktivitas antioksidan Larutan uji IC50 (mg L-1)
BHT 16.71 Ekstrak etil asetat 178.40
F1 43932.07 F2 52.93 F3 9226.48
Golongan Flavonoid Fraksi Aktif
Analisis F2 sebagai fraksi teraktif dari ekstrak daun dandang gendis dilakukan
F3 Rf 0.85 F2 Rf 0.52 F1 Rf 0.25
6
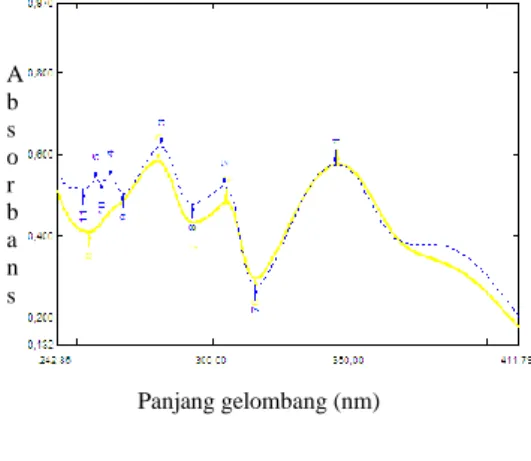
dengan merekam spektrum UV-tampak. Identifikasi senyawa golongan flavonoid didasarkan pada perubahan panjang gelombang setelah ditambahkan pereaksi geser (Lampiran 5). Spektrum UV-tampak F2 dalam pelarut metanol (Gambar 5) menunjukkan serapan maksimum pita 1 pada panjang gelombang 332 nm dan pita 2 pada panjang gelombang 274 nm.
Gambar 5 Spektrum F2 dalam pelarut metanol.
Berdasarkan puncak serapan pada pita 1 dan 2, F2 diduga merupakan senyawa flavonoid golongan flavon atau flavonol. Menurut Markham (1988), flavon dan flavonol memiliki serapan maksimum pita 2 di 250–280 nm. Sementara untuk pita 1, flavon memiliki serapan maksimum pada 310 –350 nm dan flavonol pada 330–360 nm. Pita 1 berasal dari cincin B dan C, dan pita 2 berasal dari konjugasi pada cincin A.
Penambahan pereaksi geser NaOCH3 pada
F2 menyebabkan pergeseran batokromik sebesar 64 nm pada pita 1 (Gambar 6). Markham (1988) melaporkan bahwa pergeseran serapan maksimum sebesar 45–65 nm dengan kekuatan serapan yang tidak menurun menunjukkan adanya gugus hidroksil di C-4'. Karena itu, dapat disimpulkan bahwa senyawa flavonoid pada F2 memiliki gugus hidroksil pada C-4'. Selain itu, terbentuk pita baru pada 326.5 nm yang menunjukkan adanya gugus hidroksil di posisi C-7. Menurut Markham (1988), pita serapan baru pada 320–335 nm muncul jika terdapat gugus hidroksil pada C-7.
Gambar 6 Spektrum F2 dengan penambahan pereaksi geser NaOCH3 dan
NaOCH3 setelah 5 menit.
Tidak terdapatnya gugus hidroksil di C-3 ditunjukkan dengan tidak adanya pergeseran batokromik pada pita 1 sejauh 50–60 nm (Markham 1988) pada spektrum AlCl3/HCl
(Gambar 7). Tidak adanya gugus hidroksil pada C-3 manunjukkan bahwa F2 merupakan senyawa flavonoid golongan flavon. Pergeseran batokromik sejauh 17 nm pada pita 1 menunjukkan adanya gugus hidroksil di posisi C-5. Penambahan AlCl3 akan
membentuk kompleks dengan gugus hidroksil di C-5 dan gugus karbonil sehingga terjadi geseran batokromik. Tidak terbentuknya kompleks antara AlCl3 dengan gugus o
-dihidroksi pada cincin B menyebabkan tidak teramati geseran hipsokromik yang diakibatkan penguraian kompleks tersebut ketika ditambahkan HCl (Markham 1988).
Gambar 7 Spektrum F2 setelah penambahan pereaksi AlCl3 dan AlCl3/HCl. A b s o r b a n s Panjang gelombang (nm) A b s o r b a n s Panjang gelombang (nm) A b s o r b a n s Panjang gelombang (nm) AlCl3 AlCl3/HCl NaOCH3
7
Penambahan pereaksi CH3COONa
menyebabkan pergeseran batokromik sejauh 8.5 nm (Gambar 8) pada pita 2 yang menunjukkan adanya gugus hidroksil di C-7. Berdasarkan Markham (1988), intensitas yang tidak menurun menunjukkan tidak adanya gugus yang peka terhadap basa, seperti 6,7-diOH; 7,8-diOH dan 3',4'-diOH. Pada spektrum dengan penambahan H3BO3
(Gambar 8), tidak terjadi pergeseran batokromik yang menunjukkan tidak adanya gugus o-diOH pada cincin A dan B. Pergeseran batokromik sejauh 12 sampai 36 nm pada pita 1 akan terjadi jika ada gugus tersebut (Markham 1988).
Gambar 8 Spektrum F2 setelah penambahan pereaksi NaOMe, NaOMe 5 menit, dan H3BO3.
KLT 2 arah dilakukan untuk menguji tingkat kemurnian F2. Dibandingkan dengan KLT 2 arah yang dilakukan Akbar (2010) yang menunjukkan dua berkas noda, hasil KLT 2 arah dengan eluen BAA dan BEA
(Gambar 9) lebih baik karena hanya menunjukkan satu noda tunggal. Karena itu, dapat ditarik simpulan bahwa F2 merupakan senyawa flavonoid golongan flavon.
Gambar 9 Kromatogram 2 arah F2 dengan eluen BAA dan BEA.
Uji Fitokimia dan Golongan Flavonoid
Uji fitokimia dilakukan terhadap ekstrak etanol (Tabel 4), sedangkan uji golongan flavonoid dilakukan terhadap ekstrak etanol, ekstrak etil asetat, dan F2 (Tabel 5).
Tabel 4 Uji fitokimia ekstrak etanol
Golongan senyawa Hasil uji
Alkaloid +++ Saponin + Flavonoid +++ Steroid + Triterpenoid - Tanin - Keterangan:
(+) menunjukkan intensitas warna, (-) menunjukkan tidak terdapat senyawa tersebut dalam ekstrak etanol.
Keterangan : (-) Tidak terdeteksi adanya senyawa golongan flavonoid.
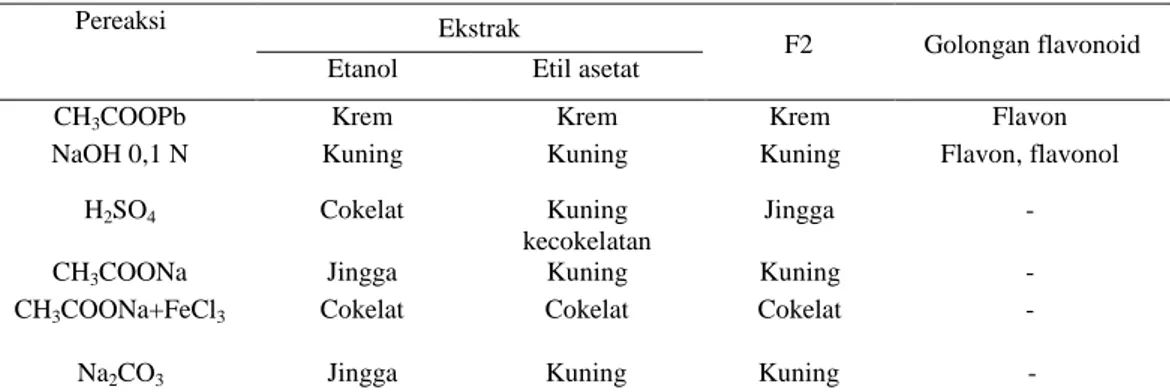
Hasil uji fitokimia menunjukkan bahwa ekstrak etanol daun dandang gendis mengandung senyawa tanin, steroid, flavonoid, dan saponin (Tabel 4). Uji golongan flavonoid terhadap ekstrak etanol,
ekstrak etil asetat, dan F2 menunjukkan senyawa flavon atau flavonol. Berdasarkan hasil identifikasi dengan sinar UV-tampak, dapat disimpulkan bahwa senyawa aktif antioksidan yang terkandung dalam daun
Pereaksi Ekstrak
F2 Golongan flavonoid
Etanol Etil asetat
CH3COOPb Krem Krem Krem Flavon
NaOH 0,1 N Kuning Kuning Kuning Flavon, flavonol H2SO4 Cokelat Kuning
kecokelatan
Jingga -
CH3COONa Jingga Kuning Kuning -
CH3COONa+FeCl3 Cokelat Cokelat Cokelat -
Na2CO3 Jingga Kuning Kuning -
Tabel 5 Uji golongan flavonoid ekstrak etanol, etil asetat dan F2
CH3COONa CH3COONa 5 menit H3BO3 A b s o r b a n s Panjang gelombang (nm) Eluen 1 BAA Eluen 2 BEA
8
dandang gendis adalah flavon dengan gugus hidroksil yang terletak pada 4', 5, dan C-7 (Gambar 10). O O OH HO OH
Gambar 10 Struktur senyawa flavonoid hipotesis F2.
SIMPULAN DAN SARAN
Simpulan
Ekstrak etil asetat daun dandang gendis memiliki aktivitas antioksidan. Fraksi 2 menunjukkan aktivitas antioksidan tertinggi dibandingkan dengan 2 fraksi lainnya dengan nilai IC50 sebesar 52.93 mg L-1. Hasil uji
golongan flavonoid, dan spektrum UV-tampak memperlihatkan bahwa fraksi 2 dihipotesiskan adalah senyawa flavonoid golongan flavon dengan gugus hidroksil yang terletak pada C-4', C-5, dan C-7.
Saran
Perlu diadakan analisis lebih lanjut dengan spektrometer inframerah, resonans magnetik inti 1H, 13C, dan spektrometer massa untuk mengidentifikasi senyawa pasti dalam fraksi 2.
DAFTAR PUSTAKA
Akbar HR. 2010. Isolasi dan identifikasi golongan flavonoid daun dandang gendis (Clinachantus nutans) berpotensi sebagai antioksidan [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Amic D, Beslo D, Trinajstic N, Davidovic. 2003. Structure-radical scavenging activity relationship of flavonoids.
Croatia Chem Acta 76:55-61.
Andriani A. 2008. Uji potensi larvasida fraksi ekstrak daun dandang gendis terhadap larva instar III nyamuk Aedes aegypti
[skripsi]. Bogor: Fakultas Matematika
dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Bermawi N, Kristina NN. 2003. Penyimpanan
in vitro tanaman obat potensial.
Perkembangan Teknol TRO 15:51-60.
Blois MS. 1958. Antioxidant determinations by the use of stable free radical. Nature
181: 1199-1200.
Harborne JB. 1987. Metode Fitokimia. Padmawinata K, Soediro I, penerjemah; Niksolihin S, editor. Bandung: ITB. Terjemahan dari:
Phytochemical Methods.
Hanani E, Abdul M, Ryany S. 2005. Identifikasi senyawa antioksidan dalam
Callyspongia sp dari Kepulauan
Seribu. Maj Ilmu Kefarmasian 2:127-133.
Harjadi W. 1993. Ilmu Kimia Analitik Dasar. Jakarta: Gramedia Pustaka Utama.
Kristio 2007. Tanaman obat Indonesia. http:// toiusd. Multiply. com/ journal? &page_start=160. [23 Mar 2010]
Macari PdAT, Portela CN, Polhit AM. 2006. Antioxidant, cytotoxic, and UVB-absorbing activity of Maynetus guyanensis Klotzch (Celastraceae) bark extract. Acta Amazonica 36:513-518.
Markham KR. 1988. Cara Mengidentifikasi
Flavonoid. Padmawinata K,
penerjemah. Bandung: ITB. Terjemahan dari: Techniques of Flavonoid of Identification.
Molyneux P. 2004. The use of stable free radical diphenylpicryl-hydrazyl (DPPH) for estimazing antioxidant activity. Songklanakarin J Sci Technol
26:211-219.
Pannangpetch et al. 2007. Antioxidant activity and protective effect against oxidative hemolysis of Clinachantus
nutans (Burm.f) Lindau.
Songklanakarin J Sci Technol 29:1-9.
Prakash A. 2001. Antioxidant activity.
Medallion Laboratories Analytical
9
Sakdarat S, Shuyprom A, Pientong C, Ekalaksananan T, Thongcai S. 2009. Bioactive constituent from the leaves
of Clinachantus nutans Lindau.
Bioanorg Med Chem 17:1857-1860.
Sofyan D. 2008 Inhibisi fraksi aktif daun dandang gendis (Clinachantus nutans) pada pertumbuhan Saccharomyes
cerevisiae sebagai uji potensi
antikanker [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Suharty NS. 2004. Isolasi terpenoid dari daun
Clinachantus nutans. http: //digilib. itb.ac.id/go.php?id= jbptitbpp-gdl-s2-2004-nengsrisuh-1734 & width=300. [23 Mar 2010]
Sunarni T. 2005. Aktivitas antioksidan penangkap radikal bebas beberapa kecambah dari biji tanaman familia Papilionaceae. J Farm Indones 2:53-61.
Teshima I et al. 1997. Sulfur-containing glucosides from Clinacanthus nutans.
Phytochemistry 48:831-835.
Thongcai S et al. 2008. Anti-herpes simplex virus type 1 activity of crude ethyl acetate extract derived from leaves of Clinacanthus nutans Lindau. J Sci Technol 27:318-326.
Tuntiwachwuttikul P, Pootaeng-on Y, Phansa P, Taylor WS. 2004. Cerebrosides and a monoacylmonogalactosylglycerol from Clinachanthus nutans. Chem Pharm Bull 52: 27-32.
Wanikiat et al. 2008. The anti-inflammatory effects and the inhibition of neutrophil responsiveness by Barleria lupulina
and Clinachantus nutans extract. J
Ethnopharmacology 116: 234-244.
Winarno FG. 1997. Kimia Pangan dan Gizi. Jakarta: Gramedia.
Yoosook C, Panpisutchai Y, Chaichana S, Santisuk T, Reutrakul V. 1999. Evaluation of anti-HSV-2 activities of
Barleria lupulina and Clinacanthus
11
LAMPIRAN
11
15
Lampiran 1 Diagram alir penelitian
Fraksionasi(KLTp)
Partisi dengan etil asetat HidrolisisHCl Serbuk daun dandang gendis
Penetapan kadar air
Ekstraksi dengan etanol 70%
Residu Ekstrak etanol
Partisi dengan n-heksana
Fraksi n-heksana Fraksi etanol
Fraksi etanolterhidrolisis
Uji golongan flavonoid
dan antioksidan Fraksi etil asetat Fraksi etanol
Fraksi 1 Fraksi 2 Fraksi 3
Senyawa golongan flavonoid Uji antioksidan
Analisis flavonoid dengan Spektrofotometer UV-tampak Fraksi teraktif