UJI SD BIOLINE SEBAGAI DIAGNOSTIK ALTERNATIF
MALARIA FALCIPARUM, VIVAX DAN MIX INFEKSI
T E S I S
Oleh
HARURIKSON LUMBAN TOBING 097111019
PROGRAM MAGISTER KLINIK-SPESIALIS PATOLOGI KLINIK FAKULTAS KEDOKTERAN UNIVERSITAS SUMATERA UTARA/
RUMAH SAKIT UMUM PUSAT H. ADAM MALIK MEDAN
UJI SD BIOLINE SEBAGAI DIAGNOSTIK ALTERNATIF
MALARIA FALCIPARUM, VIVAX DAN MIXED INFECTION
T E S I S
Diajukan Sebagai Salah Satu Syarat
untuk memperoleh Gelar Magister Kedokteran Bidang Patologi Klinik
Pada Fakultas Kedokteran Universitas Sumatera Utara
Oleh
HARURIKSON LUMBAN TOBING 097111019
PROGRAM MAGISTER KLINIK-SPESIALIS PATOLOGI KLINIK FAKULTAS KEDOKTERAN UNIVERSITAS SUMATERA UTARA/
Judul Penelitian : Uji SD Bioline sebagai Diagnostik Alternatif
Malaria Falciparum, Vivax dan Mix Infeksi
Nama Mahsiswa : Harurikson Lumban Tobing
Nomor Induk Mahsiswa : 097111019
Program Magister : Magister Kedokteran Klinik
Konsentrasi : Patologi Klinik
Menyetujui Komisi Pembimbing :
Pembimbing I
(dr. Muzahar DMM SpPK (K)
Pembimbing II
(dr Endang H.Gani,DTM&H Sp.Par (K)
Disahkan Oleh:
Ketua Departemen Patologi Klinik FK-USU/RSUP H.Adam malik Medan
Ketua Program Studi Departemen Patologi Klinik FK-USU/ RSUP H.Adam malik Medan
NIP. 194910111979011001
(Prof.dr.Adi Koesoema Aman, SpPK-KH)
NIP. 19487111979032001
Telah diuji pada
Tanggal : 21 Agustus 2014
PANITIA PENGUJI TESIS
Ketua : Prof. dr. Adi Koesoema Aman, SpPK-KH __________
Anggota : 1. Prof. DR. dr. Ratna Akbari Ganie, SpPK-KH __________
2. Prof. dr. Herman Hariman, PhD,SpPK-KH __________
3. Prof. dr. Burhanuddin Nasution, SpPK-KN __________
4. dr. Ricke Loesnihari, MKed(Clin.Path), SpPK-K __________
5. dr. Muzahar DMM, SpPK-K __________
KATA PENGANTAR
Puji dan syukur atas segala Kasih dan Anugerah Allah Yang Maha
Kuasa, sehingga saya dapat mengikuti dan menyelesaikan Program
Pendidikan Dokter Spesialis Patologi Klinik Fakultas Kedokteran Universitas
Sumatera Utara dan dapat menyelesaikan karya tulis (tesis) ini yang berjudul
Uji SD Bioline Sebagai Diagnostik Alternatif Malaria Falciparum, Vivax dan Mix Infeksi.
1.
Selama saya mengikuti pendidikan dan selama proses penyelesaian
penelitian untuk karya tulis ini, saya telah mendapat bimbingan, petunjuk,
bantuan dan pengarahan serta dorongan baik materil dan moril dari berbagai
pihak sehingga saya dapat menyelesaikan pendidikan dan karya tulis ini.
Untuk semua itu perkenankanlah saya menyampaikan rasa hormat dan
terimakasih saya yang tidak terhingga kepada :
2.
Yth, Dr. Muzahar, DMM, SpPK-K, sebagai pembimbing saya yang telah banyak memberikan bimbingan, petunjuk, pengarahan, bantuan dan
dorongan selama dalam pendidikan dan proses penyusunan sampai
selesainya tesis ini. Saya mengucapkan terimakasih, kiranya Allah Yang
Maha Kuasa membalas semua kebaikannya.
Yth, dr Endang H.Gani,DTM&H Sp.ParK sebagai pembimbing II saya dari Departemen Parasitologi FK USU yang sudah memberikan ,
petunjuk, pengarahan dan bantuan, mulai dari penyusunan proposal,
3.
4.
Yth, Prof. Dr. Adi Koesoema Aman SpPK-KH,FISH Ketua Departemen Patologi Klinik Fakultas Kedokteran Universitas Sumatera Utara/RSUP
H. Adam Malik Medan, yang telah menerima dan memberikan
kesempatan kepada saya sebagai peserta Program Pendidikan
Dokter Spesialis Patologi Klinik dan telah memberikan bimbingan dan
pengarahan selama saya mengikuti pendidikan.
5.
Yth, Prof. Dr. Herman Hariman PhD, SpPK-KH,FISH sebagai Sekretaris Departemen Patologi Klinik Fakultas Kedokteran Universitas
Sumatera Utara , yang sudah memberikan bimbingan dan dorongan selama saya menjalani pendidikan. Hormat dan terimakasih yang tak
terhingga saya ucapkan
6.
Yth, Prof. DR. Dr. Ratna Akbari Ganie SpPK-KH,FISH sebagai Ketua Program Studi di Departemen Patologi Klinik Fakultas Kedokteran
Universitas Sumatera Utara, yang telah banyak membimbing,
mengarahkan dan memotivasi baik selama saya mengikuti pendidikan
hingga selesainya tesis ini.
7.
Yth, Dr. Ricke Loesnihari SpPK-K, sebagai Sekretaris Program Studi di Departemen Patologi Klinik Fakultas Kedokteran Universitas Sumatera
Utara, yang telah banyak memberikan bimbingan dan petunjuk selama
saya mengikuti pendidikan.
Yth, Prof. Dr. Burhanuddin Nasution SpPK-KN,KGEH, yang banyak memberikan bimbingan dan pengarahan selama pendidikan dan
8. Yth, Dr. Gino Tan PhD, SpPK-KH, Dr. Zulfikar Lubis SpPK-K, Dr. Ozar Sanuddin SpPK-K, Dr Tapisari Tambunan SpPK-KH, Dr. Farida Siregar SpPK, dr. Ulfah Mahidin, SpPK, dr. Chairul Rahmah, SpPK, dr. Lina SpPK dan Dr. Nelly Elfrida Samosir SpPK, yang telah banyak memberikan bimbingan, nasehat, arahan dan dukungan selama
saya mengikuti pendidikan dan hingga selesainya tesis ini. Hormat dan
terimakasih saya ucapkan . Begitu juga kepada guru-guru yang telah
mendahului kita yaitu Alm.Prof. Dr .E N Kosasih SpPK-KH , Alm.Prof. Dr. Iman Sukiman SpPK-KH, Alm. Dr. R. Ardjuna M. Burhan DMM, SpPK-K,
9. Yth, Prof.DR Syafrudin Mkes, DR dr Arlinda Mkes,yang telah memberikan bimbingan, arahan dan bimbingan di bidang statistik
selama saya memulai penelitian sampai selesainya tesis saya,
terimakasih banyak saya ucapkan
Alm. Irfan Abdullah SpPK-KH, Alm. Dr. Paulus Sembiring SpPK-K, Alm. Dr. Hendra Lumanauw SpPK-K saya tidak melupakan semua jasanya dalam pendidikan ini.
10.
11.
Yth. Marwati Hondo sebagai Kepala Puskesmas Pulau Tello, DR dr Umar Zein DTM&H SpPD KPTI, dr Sunna Hutagalung MS, Sahat Siregar yang telah memberikan bimbingan, arahan dan bimbingan selama saya penelitian di Puskesmas Pulau Tello Kabupaten Nias
Selatan.
semua pihak yang tidak dapat saya sebutkan satu-persatu yang telah
memberikan bantuan dan kerjasama yang baik selama saya mengikuti
pendidikan.
12. Ucapan terimakasih juga kepada Dekan Fakultas Kedokteran Universitas Sumatera Utara, Rektor Universitas Sumatera Utara, Direktur rumah Sakit umum Pusat H. Adam Malik yang telah memberikan kesempatan dan menerima saya untuk mengikuti Program
Pendidikan Dokter Spesialis Patologi Klinik.
13. Terimakasih yang setulus-tulusnya saya sampaikan kepada kedua
orangtua saya, Ayahanda tercinta Alm. Togar N.Lumban Tobing dan Ibunda Arta Saida Tampubolon yang telah melahirkan, mengasuh, mendidik
14.
dan setiap saat selalu bersedia memberikan dukungan moril
maupun materil. Kiranya Allah Yang Maha Kuasa membalas semua budi
baik dan kasih sayangnya. Begitu juga kepada Bapak dan Ibu mertua
saya yang juga telah banyak memberikan bantuan moril maupun materil
kepada saya dan keluarga. Juga kepada Abang, Kakak ,dan Adik yang
tidak henti-hentinya memberikan semangat selama saya mengikuti
pendidikan.
Akhirnya terimakasih yang tak terhingga saya sampaikan kepada Istri
tercinta Free Agustina P.Sinaga.Psi, MKes yang telah mendampingi saya dengan penuh pengertian, perhatian, memberikan dorongan dan
pengorbanan selama saya mengikuti pendidikan sampai saya dapat
yang telah banyak kehilangan perhatian dan kasih sayang selama saya
mengikuti pendidikan, semoga ini semua dapat menjadi motivasi dalam
mencapai cita-cita kalian.
15. Kepada berbagai pihak lain yang tidak dapat saya sebutkan satu persatu
pada kesempatan ini saya ucapkan terimakasih yang setulus-tulusnya.
Ijinkan saya menyampaikan permohonan maaf kepada semua pihak
yang terkait atas segala kekurangan dan kesalahan selama saya
mengikuti pendidikan Dokter Spesialis Patologi Klinik dan dalam
penulisan tesis ini.
Akhir kata, semoga tesis ini bermanfaat bagi kita semua, memberikan
sumbangan yang berharga bagi perkembangan dunia ilmu kedokteran.
Semoga Tuhan Yang Maha Kuasa memberkati kita semua.
Medan, Agustus 2014
Penulis,
DAFTAR ISI
2.3. Prinsip Transmisi Malaria ... 11
2.4. Diagnosis Malaria ... 12
2.4.1. Pemeriksaan Mikroskopik (Metode Konvensional) .... 13
2.4.2. Quantitative Buffy Coat (QBC) Malaria ... 14
2.4.5. PCR (Polymerase Chain Reactions) ... 15
2.4.6. Immunochromatographic Test (ICT) ... 15
2.5. Kerangka Konsep ... 18
BAB 3. METODE PENELITIAN ... 19
3.1 Metode Penelitian ... 19
3.2 Tempat dan Waktu Penelitian ... 19
3.3 Populasi dan Sampel Penelitian ... 19
3.3.1 Populasi Penelitian ... 19
3.3.2 Sampel Penelitian ... 19
3.3.3. Cara Pengambilan Sampel Penelitian ... 20
3.3.4. Besar Sampel ... 20
3.4. Kriteria Penelitian ... 20
3.4.1. Kriteria Inklusi ... 20
3.4.2. Kriteria Eksklusi ... 20
3.5. Ethical Clearance dan Informed Consent ... 21
3.6. Material dan Metode SD Bioline ... 21
3.6.1. Pengambilan dan Penyimpanan Specimen ... 21
3.6.2. Bahan yang diperlukan ... 22
3.6.3. Anamnese dan Pemeriksaan Fisik ... 23
3.6.4. Pemantapan Kualitas ... 24
3.7. Batasan Operasional ... 25
3.8. Analisis Data Statistik ... 27
3.9. Perkiraan Biaya Penelitian ... 28
3.10.Jadwal Penelitian ... 28
BAB 4. HASIL PENELITIAN ... 29
BAB 6. KESIMPULAN DAN SARAN ... 35
6.1 Kesimpulan ... 35
6.2 Saran ... 35
DAFTAR PUSTAKA ... 36
DAFTAR TABEL
Tabel 3.1. Perkiraan Biaya Penelitian ... 28
Tabel 3.2. Jadwal Penelitian ... 28
Tabel 4.1. Karakteristik Sampel ... 29
Tabel 4.2. Perbandingan Uji SD Bioline dengan Mikroskop P.f ... 30
Tabel 4.3. Perbandingan Uji SD Bioline dengan Mikroskop P.v ... 30
DAFTAR GAMBAR
DAFTAR LAMPIRAN
Lampiran 1. Lembar Penjelasan kepada Calon Subjek Penelitian
Lampiran 2. Data Pasien
Lampiran 3. Lembar Persetujuan setelah Penjelasan
Lampiran 4. Ethical Clearance
Lampiran 5. Data Penelitian
DAFTAR SINGKATAN
AO : Acridine Orange
API : Annual Parasite Incidence
BB : Berat Badan
CDC : Center for Disease Control and Prevention
cm : Centimeter
DNA : Deoxyribonucleic Acid
HPA : High Prevalensi Area
HRP : Histidine Rich Protein
ICT : Immunochromatographic Test
kg : Kilogram
Mab : Monoclonal antibody
mm : Millimeter
NTB : Nusa Tenggara Barat
PCR : Polymerase Chain Reaction
PfHRPII : Plasmodium falciparum Histidine Rich Protein-II
pLDH : plasmodium Lactate Dehydrogenase
PMI : Palang Merah Indonesia
PR : Parasite Rate
QBC : Quantitative Buffy Coat
RDT : Rapid Diagnostic Test
RES : Reticulo Endothelial System
RIA : Radio Immuno Assay
SPSS : Statistical Package for Social Science
WHO : World health Organization
SD : Standard Diagnostik
ABSTRAK
UJI SD BIOLINE SEBAGAI DIAGNOSTIK ALTERNATIF MALARIA FALCIPARUM, VIVAX DAN MIX INFEKSI
Lumbantobing H1, Muzahar1, Gani E2.
1 Departemen Patologi Klinik, FK USU/ RSUP H.Adam Malik Medan 2 Departemen Parasitologi, FK Universitas Sumatera Utara Medan
Latar belakang: Malaria merupakan penyakit infeksi parasit dengan angka morbiditas dan mortalitas yang tinggi di Indonesia dan di negara tropis maupun subtropis di dunia sampai saat ini. Diagnosis dan terapi cepat merupakan hal mendasar untuk menghentikan transmisi penyakit malaria. Diagnosis malaria berdasarkan penemuan parasit dalam tetes darah tebal dan tipis masih menjadi masalah di daerah endemik karena keterbatasan peralatan dan tergantung ketrampilan petugas. Sebaliknya uji SD Bioline Malaria dapat mendeteksi Plasmodium secara spesifik, cepat dan tidak memerlukan ketrampilan khusus.
Tujuan : Untuk mengetahui kualitas hasil pemeriksaan Uji SD Bioline Malaria dalam menegakkan diagnosis infeksi malaria falciparum,vivax, dan mix infection didaerah endemik malaria.
Bahan dan Cara: Sembilan puluh delapan sampel darah dari pasien suspek malaria di Puskesmas Pulau Tello,Kabupaten Nias Selatan Propinsi Sumatera Utara diperiksa menggunakan uji SD Bioline malaria dengan Mikroskop. Penelitian dilakukan di Puskesmas Telo Kecamatan Pulau-pulau Batu Kabupaten Nias Selatan bekerja sama dengan Departemaen Patologi Klinik FK USU/RSU H.Adam Malik Medan. Sensitivitas dan spesifitas di Uji dengan tes Mc.Nemar’.
Hasil: Perbandingan uji SD Bioline Malaria dengan mikroskop P.falciparum,vivax dan mix infecsion mempunyai sensitivitas 97%, spesifisitas 100%. NPP 100%. NPN 99%.
Simpulan: Uji SD Bioline Malaria memiliki sensitivitas dan spesifisitas cukup tinggi dapat dijadikan diagnostik alternatif malaria falciparum, vivax dan mix infeksi.
ABSTRACT
SD BIOLINE TEST AS AN ALTERNATIVE DIAGNOSTIC FOR MALARIA FALCIPARUM, VIVAX AND MIXED INFECTION
Lumbantobing H1, Muzahar1, Gani E2.
Clinical Pathology Departement of Medicine Faculty USU/H. Adam Malik Hospital, Medan.
Department Parasitology of Medicine Faculty USU, Medan
Background: Malaria is a parasitic disease with high morbidity and mortality rates in Indonesia and other tropical and sub tropical countries even through these days. Rapid diagnosis and prompt treatment are essential to control the transmission of the disease. Malaria diagnosis by detecting the parasites from thick blood film in endemic areas remains to be a problem by the lack of available means and is highly dependent on the examiner’s skill. Alternatively, the SD Bioline Malaria test is able to detect Plasmodium specifically, with rapid result and no special skills required.
Objective: To determine the SD Bioline Malaria test quality of results in the diagnosis of falciparum malaria, vivax malaria, and mixed malaria infection in an endemic area.
Materials & Methods: 98 blood samples were drawn from suspected malaria patients from the local public health service (puskesmas) of Pulau Tello, Nias Selatan regency, Sumatera Utara province. The blood samples were analyzed by the SD Bioline Malaria test and microscopic examination. The study was done at Puskesmas Telo of Pulau-pulau Batu district Nias Selatan in collaboration with Clinical Pathology department of FK USU/H. Adam Malik hospital Medan. The Mc.Nemar’ test was used to determine the sensitivity and specificity of both methods.
Results: The SD Bioline Malaria test showed a sensitivity of 97%, a specificity of 100%, NPP 100%, and NPN 99% for the diagnosis of falciparum malaria, vivax malaria, and mixed malaria infection compared with microscopic examination.
Conclusion: The SD Bioline Malaria test has high sensitivity and high specificity in malaria diagnosis, thus may be applied as an alternative test for the detection of falciparum malaria, vivax malaria, and mixed malaria infection.
ABSTRAK
UJI SD BIOLINE SEBAGAI DIAGNOSTIK ALTERNATIF MALARIA FALCIPARUM, VIVAX DAN MIX INFEKSI
Lumbantobing H1, Muzahar1, Gani E2.
1 Departemen Patologi Klinik, FK USU/ RSUP H.Adam Malik Medan 2 Departemen Parasitologi, FK Universitas Sumatera Utara Medan
Latar belakang: Malaria merupakan penyakit infeksi parasit dengan angka morbiditas dan mortalitas yang tinggi di Indonesia dan di negara tropis maupun subtropis di dunia sampai saat ini. Diagnosis dan terapi cepat merupakan hal mendasar untuk menghentikan transmisi penyakit malaria. Diagnosis malaria berdasarkan penemuan parasit dalam tetes darah tebal dan tipis masih menjadi masalah di daerah endemik karena keterbatasan peralatan dan tergantung ketrampilan petugas. Sebaliknya uji SD Bioline Malaria dapat mendeteksi Plasmodium secara spesifik, cepat dan tidak memerlukan ketrampilan khusus.
Tujuan : Untuk mengetahui kualitas hasil pemeriksaan Uji SD Bioline Malaria dalam menegakkan diagnosis infeksi malaria falciparum,vivax, dan mix infection didaerah endemik malaria.
Bahan dan Cara: Sembilan puluh delapan sampel darah dari pasien suspek malaria di Puskesmas Pulau Tello,Kabupaten Nias Selatan Propinsi Sumatera Utara diperiksa menggunakan uji SD Bioline malaria dengan Mikroskop. Penelitian dilakukan di Puskesmas Telo Kecamatan Pulau-pulau Batu Kabupaten Nias Selatan bekerja sama dengan Departemaen Patologi Klinik FK USU/RSU H.Adam Malik Medan. Sensitivitas dan spesifitas di Uji dengan tes Mc.Nemar’.
Hasil: Perbandingan uji SD Bioline Malaria dengan mikroskop P.falciparum,vivax dan mix infecsion mempunyai sensitivitas 97%, spesifisitas 100%. NPP 100%. NPN 99%.
Simpulan: Uji SD Bioline Malaria memiliki sensitivitas dan spesifisitas cukup tinggi dapat dijadikan diagnostik alternatif malaria falciparum, vivax dan mix infeksi.
ABSTRACT
SD BIOLINE TEST AS AN ALTERNATIVE DIAGNOSTIC FOR MALARIA FALCIPARUM, VIVAX AND MIXED INFECTION
Lumbantobing H1, Muzahar1, Gani E2.
Clinical Pathology Departement of Medicine Faculty USU/H. Adam Malik Hospital, Medan.
Department Parasitology of Medicine Faculty USU, Medan
Background: Malaria is a parasitic disease with high morbidity and mortality rates in Indonesia and other tropical and sub tropical countries even through these days. Rapid diagnosis and prompt treatment are essential to control the transmission of the disease. Malaria diagnosis by detecting the parasites from thick blood film in endemic areas remains to be a problem by the lack of available means and is highly dependent on the examiner’s skill. Alternatively, the SD Bioline Malaria test is able to detect Plasmodium specifically, with rapid result and no special skills required.
Objective: To determine the SD Bioline Malaria test quality of results in the diagnosis of falciparum malaria, vivax malaria, and mixed malaria infection in an endemic area.
Materials & Methods: 98 blood samples were drawn from suspected malaria patients from the local public health service (puskesmas) of Pulau Tello, Nias Selatan regency, Sumatera Utara province. The blood samples were analyzed by the SD Bioline Malaria test and microscopic examination. The study was done at Puskesmas Telo of Pulau-pulau Batu district Nias Selatan in collaboration with Clinical Pathology department of FK USU/H. Adam Malik hospital Medan. The Mc.Nemar’ test was used to determine the sensitivity and specificity of both methods.
Results: The SD Bioline Malaria test showed a sensitivity of 97%, a specificity of 100%, NPP 100%, and NPN 99% for the diagnosis of falciparum malaria, vivax malaria, and mixed malaria infection compared with microscopic examination.
Conclusion: The SD Bioline Malaria test has high sensitivity and high specificity in malaria diagnosis, thus may be applied as an alternative test for the detection of falciparum malaria, vivax malaria, and mixed malaria infection.
BAB 1 PENDAHULUAN
1.1. Latar Belakang
Malaria merupakan penyakit infeksi parasit yang sangat penting di
dunia dan masih merupakan problem kesehatan masyarakat secara global
dan memerlukan perhatian yang khusus. Bersama dengan tuberkulosis dan
infeksi HIV/AIDS, Malaria meupakan penyakit infeksi yang ketiga terbanyak.
Di Indonesia, malaria merupakan penyakit infeksi menular yang masih
menjadi masalah kesehatan masyarakat karena Indonesia adalah negara
tropis. Penyakit ini disebabkan oleh protozoa yang bernama Plasmodium
yang ditularkan melalui gigitan nyamuk Anopheles betina.Terdapat empat
spesies Plasmodium yang diketahui dapat menyebabkan penyakit malaria
pada manusia, yaitu Plasmodium vivax, penyakitnya disebut malaria tertiana.
Malaria ini ditandai dengan munculnya demam pada hari ke tiga (48 jam).
Plasmodium ovale yang ditandai demam muncul pada hari ke tiga (50 jam).
Plasmodium malariae menyebabkan malaria kuartana yang ditandai demam
muncul tiap empat hari (72 jam). Sedangkan Plasmodium falciparum
mengakibatkan malaria falsiparum. Jenis malaria terakhir ini paling serius
bahkan bisa berakhir dengan kematian. Disamping itu, gejala yang
ditimbulkannya dapat menurunkan produktivitas penderitanya.
1,2
Studi terbaru telah menemukan suatu spesies Plasmodium baru yang
bisa menginfeksi manusia. Spesies Plasmodium yang kelima ini dikenali
hidup (aseksual) terpendek didalam hati selain itu juga menyerang semua
bentuk sel darah merah sehingga dapat menyebabkan komplikasi yang
berat/fatal, karena itu malaria falciparum diperlukan diagnosis yang cepat dan
tepat agar penatalaksanaannya dapat segera diberikan.
SD BIOLINE Malaria Antigen P.f/Pan terdiri dari membran strip, yang
disalut ulang dengan 1 monoklonal antibody dan 1 poliklonal antibody
berbentuk dua garis yang terpisah pada permukaan kit tes. Monoklonal
antibody pertama (test line P.f) spesifik terhadap HRP2 P.falciparum, dan
poliklonal antibody kedua (test line P.Pan) spesifik terhadap lactate
dehidrogenase spesies plasmodium(falciparum,vivax,ovale,malariae
pertama(garis tes 1). Poliklonal antibody pan spesifik untuk laktat
dehidrogenase spesies Plasmodium tidak memiliki reaktivitas silang dengan
laktat dehidrogenase manusia, karena antibody ini (untuk laktat
dehidrogenase Plasmodium falciparum dan P.vivax) di adsorbsi ke laktat
dehidrogenase manusia. Sehingga, SD BIOLINE Malaria Antigen P.f/Pan
didisain untuk mendiagnosa Plasmodium falciparum dan spesies Plasmodium
yang lain secara terpisah.
1,2
Berdasarkan Data Situasi Umum Malaria Dinkes Propinsi Sumatera
Utara (2010), jumlah penduduk 13.518.337 jiwa, Jumlah kabupaten/kota ada
33 dengan 533 Puskesmas, Jumlah daerah endemis malaria dijumpai 17
kabupaten/kota dengan jumlah penduduk 8.198.463 jiwa dengan 327
puskesmas sedangkan desa endemis malaria ada 185 desa dengan jumlah
penduduk 5.202.414 jiwa
46
Menurut Sumber Dinas Kesehatan Propinsi Sumatera Utara jenis
malaria di kabupaten Madina endemis malaria falciparum, Kabupaten
Labuhan Batu Utara endemis malaria vivax sedangkan Kabupaten Nias
Selatan dijumpai kedua jenis malaria yaitu malaria falciparum dan malaria
vivax.
Kabupaten Nias selatan merupakan pemekaran dari kabupaten Nias
yang berada dibagian selatan Pulau Nias dan merupakan bagian dari Propinsi
Sumatera Utara. Malaria merupakan penyakit utama di kabupaten Nias
selatan. Besarnya Annual Malaria Incidence (AMI) diseluruh kabupaten Nias
Selatan sangat berfluktuatif. Pada tahun 2005 terjadi peningkatan AMI yang
melebihi tahun sebelumnya yaitu 105 ‰ dan 7,36% kasus malaria klinis yang
diperiksa darah, diperoleh angka Slide Positivity Rate (SPR) sebesar 11,46%
sehingga dapat dikategorikan sebagai High Incidence Area (HIA).
Kabupaten Nias Selatan adalah salah satu wilayah Indonesia yang
mempunyai kasus malaria cukup tinggi. Apalagi semenjak terjadinya bencana
gempa bumi dan tsunami pada bulan maret 2005. Bencana ini menyebabkan
terjadinya wabah (outbreak) dan munculnya daerah-daerah endemik. Hal ini
terjadi akibat banyaknya terbentuk cekungan-cekungan kolam, dan parit yang
bercampur dengan air laut yang masuk saat bencana gempa bumi dan
tsunami sehingga menjadi tempat perindukan nyamuk malaria. (Depkes
Berdasarkan data sepuluh besar penyakit di kabupaten Nias Selatan
tahun 2010 yang diperoleh dari sumber Dinas kesehatan Kabupaten Nias
Selatan bahwa penyakit yang paling banyak dijumpai adalah malaria klinis
sebanyak 42.626 kasus.
Bendezu,et.al.(2010), melakukan penelitian didaerah endemik
Peruvian Amazon Peru terhadap 332 orang suspek malaria dengan umur
16-32 tahun memakai Tes Rapid ParascreenTM dibandingkan dengan Mikroskop
untuk P.falciparum didapatkan nilai Sensitivitas 53,5%, Spesifisitas 98,7%,
untuk non P.falciparum didapatkan nilai Sensitivitas 77,1%, Spesifisitas
97,6%, Sedangkan tes ParascreenTM dibandingkan dengan PCR untuk
P.falciparum, Sensitivitas 81,8%, Spesifisitas 99,1%, non P.falciparum
Sensitivitas 77,1%, Spesifisitas 99,2%.
Nur Afiah.dkk.(2009),melakukan penelitian didaerah endemik
Halmahera Tengah terhadap 240 orang suspek malaria dengan Tes
Paracheck Pf dengan Mikroskop didapatkan nilai Sensitivitas 88% dan
Spesifisitas 66,6%.
3
Ginting Jenny.dkk.(2008),melakukan penelitian terhadap 104 orang
suspek malaria semua golongan umur di puskesmas dan RSU Penyabungan
dengan membandingkan tes Parascreen dengan Pewarnaan Giemsa
didapatkan nilai Sensitivitas 76,47%, Spesifisitas 100%.
4
Ima Arum L.dkk.(2006),melakukan penelitian terhadap 604 orang
suspek malaria dengan tes rapid Immunokromatografi dibandingkan dengan
pemeriksaan Mikroskopis didapatkan nilai Sensitivitas 100%, Spesifisitas
Diagnosis cepat dan akurat dengan mendeteksi parasit Plasmodium
dalam darah penderita sehingga dapat ditangani segera.7,8,9, Hal ini
merupakan tantangan laboratorium diseluruh negara agar diagnosis malaria
dapat ditegakkan sesegera mungkin12. Sebagai baku emas, pewarnaan
Giemsa pada apusan darah dan pemeriksaan dibawah mikroskop sering
digunakan karena biayanya yang relatif murah,tetapi pemeriksaan ini memiliki
beberapa keterbatasan seperti membutuhkan tenaga laboratorium yang
trampil dan hasil diperoleh dalam waktu yang lama (time consuming), serta
tidak jarang mendapatkan hasil positif dan negatif palsu.13.14.15 WHO juga
sudah mengakui akan kebutuhan alat diagnostik non mikroskopis untuk
mengatasi kelemahan ini.16 Beberapa metoda untuk diagnosis malaria
falsiparum telah berkembang dalam mendeteksi proses penyakit ini. Telah di
temukan metoda imunologik yang sangat baik dan sederhana untuk diagnosis
malaria yaitu Tes Rapid Immunokromatografi dan sudah dikenal beberapa
tahun ini.
Teknologi baru sangat perlu untuk memperhatikan kemampuan
Sensitivitas dan Specifisitas dari alat ini. maka dianjurkan untuk
menggunakan Rapid Test dengan kemampuan minimal Sensitivitas 95% dan
Spesifisitas 95%. Hal yang penting lainnya adalah penyimpanan RDT ini
sebaiknya dalam lemari es tetapi tidak dalam freezer pendingin.
17,18
19
Karena keterbatasan perangkat diagnostik mikroskopis malaria di
daerah-daerah endemik malaria di Indonesia, maka dibutuhkan alat
penunjang diagnostik RDT yang sederhana, tapi mempunyai kualitas yang Dengan
adanya kendala diatas maka dipandang perlu adanya metode pemeriksaan
baik, sehingga mampu mendiagnosis infeksi malaria falciparum, vivax, dan
mix infection (infeksi campuran). Maka dilakukanlah penelitian ini dengan
melakukan uji diagnostik menggunakan RDT SD malaria terhadap
pasien-pasien yang suspek malaria di daerah endemik malaria falciparum, vivax, dan
mix infection (infeksi campuran)
1.2. Rumusan Masalah
Berdasarkan latar belakang yang telah diuraikan di atas, maka dapat
dirumuskan permasalahan sebagai berikut:
Apakah alat penunjang uji SD Bioline malaria mempunyai kualitas yang
baik?
1.3. Hipotesa Penelitian
Sensitivitas dan Spesifitas pemeriksaan SD Bioline terhadap
pasien malaria falciparum, vivax dan mix infeksi adalah baik.
1.4. Tujuan Penelitian 1.4.1. Tujuan Umum
Untuk mengetahui kualitas hasil pemeriksaan SD Bioline dalam
mendiagnosis infeksi malaria falciparum, vivax, dan mix infeksi di daerah
endemik malaria.
1.4.2. Tujuan Khusus
Untuk mengetahui Sensitivitas dan Spesifisitas pemeriksaan SD
Bioline dalam menegakkan diagnosis infeksi malaria falciparum, vivax, dan
1.5. Manfaat Penelitian
Dengan diketahuinya kualitas pemeriksaan SD Bioline dalam
menegakkan diagnosis infeksi malaria falciparum, vivax, dan mix infeksi,
maka SD Bioline dapat digunakan secara luas sebagai alat penunjang
diagnostik infeksi malaria falciaprum, vivax, dan mix infeksi di daerah-daerah
endemik malaria di Indonesia yang belum mempunyai perangkat diagnostik
BAB 2
TINJAUAN KEPUSTAKAAN 2.1. Malaria
2.1.1. Definisi
Malaria merupakan infeksi protozoa genus Plasmodium yang dapat
menjadi serius dan menjadi salah satu masalah besar kesehatan dunia.20,21
Setiap tahun hampir 10% dari seluruh populasi dunia menderita malaria. Dari
jumlah itu sebanyak 500 juta penderita dengan gejala klinis dan diantaranya
menimbulkan 1-3 juta kematian yang tersebar di lebih dari 90 negara.22
Penyakit ini ditandai dengan adanya dingin/ menggigil, demam,berkeringat,
dapat menimbulkan komplikasi serebral, anemia berat, gastroenteritis,
hipoglikemia, edema paru, icterik dengan bilirubin ≥ 3mg/dl, gagal ginjal dan
kematian. Malaria juga ancaman bagi pelancong yang mengunjungi daerah
endemik malaria.
Di Indonesia sendiri angka kejadian malaria meningkat semenjak
terjadinya krisis moneter di tahun 1997. Di Pulau Jawa misalnya, angka
kejadian parasit tahunan (Annual Parasite Incidence rate- API) meningkat dari
0,1 ke 0,8 infeksi per 1000 orang antara tahun 1996 dan 2000. Pada tahun
2002 angka ini meningkat lagi hampir 70%.
23
24 Disamping melalui gigitan
nyamuk Anopeles, malaria juga dapat ditularkan melalui placenta dan
transfusi darah dari donor yang terinfeksi malaria. Pada tahun 2001
ditemukan 5 kasus malaria falsiparum pada penderita hemodialisis regular di
Rumah Sakit Dr.Pirngadi Medan yang pernah mendapat transfusi darah, dan
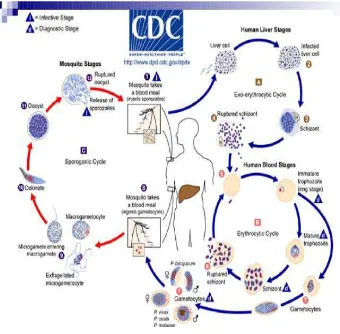
2.2. Siklus Hidup Parasit Malaria
Dalam siklus hidupnya Plasmodium mempunyai dua hospes yaitu
manusia dan nyamuk. Siklus aseksual yang berlangsung pada manusia
disebut skizogoni dan siklus seksual yang membentuk sporozoit terjadi
didalam nyamuk disebut sporogoni .
2.2.1. Siklus Aseksual
26
Sporozoit dari kelenjar ludah nyamuk Anopheles betina masuk dalam
darah manusia melalui tusukan nyamuk tersebut. Dalam waktu tiga puluh
menit sporozoit tersebut memasuki sel-sel parenkim hati dan dimulainya
siklus eksoeritrositik. Didalam sel parenkim hati, parasit tumbuh menjadi
skizon dan berkembang menjadi merozoit. Sel parenkim hati yang
mengandung parasit pecah dan merozoit keluar dengan bebas berada dalam
plasma darah sebagian mengalami fagositosis. Oleh karena prosesnya
terjadi sebelum memasuki eritrosit maka disebut siklus pre-eritrositik.atau
ekso-eritrositik. Siklus eritrositik dimulai saat merozoit masuk sel-sel darah
merah. Parasit tampak sebagai kromatin kecil, dikelilingi oleh sitoplasma dan
mulai membentuk tropozoit. Tropozoit muda berkembang menjadi tropozoit
matang, kemudian sitoplasma semakin kompak/padat dan inti atau kromatin
membelah diri menjadi beberapa merozoit(skizon muda) dan membelah diri
lagi menjadi lebih banyak merozoit (skizon matang) kemudian eritrosit pecah
mengeluarkan merozoit, pigmen dan sisa sel keluar dan bebas berada dalam
plasma darah, Merozoit dapat masuk sel darah merah lainnya lagi untuk
dari beberapa tropozoit matang tidak membelah diri menjadi merozoit
melainkan gametosit.
2.2.2. Siklus Seksual 26
Siklus seksual terjadi dalam tubuh nyamuk.Gametosit yang ada di
darah tidak di cerna oleh sel-sel tubuh lain. Pada gamet jantan, kromatin
membagi menjadi 6-8 inti yang bergerak kepinggir parasit. Di pinggir ini
beberapa filament dibentuk seperti cambuk dan bergerak aktif disebut
mikrogamet. Pembuahan terjadi karena masuknya mikrogamet kedalam
makrogamet untuk membentuk zigot. Zigot berubah bentuk seperti cacing
pendek disebut ookinet yang dapat menembus lapisan epitel dan membrane
basal dinding lambung nyamuk. Ditempat ini ookinet membesar dan disebut
ookista. Didalam ookista dibentuk ribuan sporozoit dan beberapa sporozoit
menembus kelenjar ludah nyamuk dan bila nyamuk menggigit/menusuk
manusia memungkinkan sporozoit masuk kedalam darah dan mulailah siklus
Gambar 2.1. Skema Siklus Hidup Plasmodium (Farmedia CD-ROM)
2.3. Prinsip Transmisi Malaria
Malaria menyebar dari seorang ke orang lain melalui gigitan nyamuk
Anopheles betina. Nyamuk ini terinfeksi dengan bentuk seksual parasit yaitu
gametosit, ketika menghisap darah manusia yang terinfeksi malaria.
Gametosit berkembang dalam tubuh nyamuk selama 6 -12 hari, setelah itu
nyamuk ini akan dapat menginfeksi manusia sehat bila ia menghisap
darahnya. Intensitas transmisi malaria di suatu daerah adalah kecepatan
inokulasi parasit malaria di suatu daerah tersebut. Keadaan ini menunjukkan
angka annual entomological inoculation rate (EIR), yaitu jumlah rata-rata
selama periode satu tahun. Angka EIR ini menentukan seberapa besar
perluasan dan epidemiologi malaria serta pola klinis penyakit secara lokal.
Pada daerah dengan transmisi rendah dengan angka EIR ≤ 0,01 yang
terdapat didaerah zone seperti temperate zone seperti Caucasus dan Central
Asia dimana transmisi malaria sedikit dan terbatas. Diantara kedua daerah
ekstrim ini, ada daerah dengan musim yang tidak stabil seperti daerah Asia
dan Amerika Latin dengan EIR ≤ 10 dan selalu berkisar antara 1 -2, dan
situasi dengan musim yang stabil didaerah Afrika Barat dengan EIR antara 10
– 100. Proporsi nyamuk yang terinfeksi secara lokal berhubungan dengan
jumlah manusia yang terinfeksi di daerah tersebut. Oleh karena itu, dengan
mengurangi jumlah orang yang terinfeksi di suatu daerah, akan menurunkan
tingkat transmisi malaria didaerah tersebut, dan juga menurunkan angka
prevalensi dan insidensi secara lokal.27
2.4. Diagnosis Malaria
Diagnosis malaria dapat dilakukan secara mikroskopis dan non
mikroskopis. Uji mikroskopis dapat dilihat secara langsung dibawah
mikroskop, seperti pemeriksaan darah tepi, Quantitative Buffy Coat (QBC)
yang memakai Acridine Orange (AO). Sedangkan uji non mikroskopis
berguna untuk mengidentifikasi antigen parasit atau antibodi antiplasmodial
atau produksi metabolik parasit, seperti uji Polimerase Chain Reaction (PCR),
Enzime Linked Immunosorbent Assay (ELISA), Radio Immuno Assay (RIA),
Indirect Hemaglutination, Deoxyribonucleic Acid (DNA) dan Rapid Diagnostic
Test (RDT).
42,43
Hingga saat ini diagnosis malaria gold standard dilakukan dengan cara
konvensional yaitu dengan membuat sediaan darah tebal dan tipis yang
dipulas dengan pewarnaan Giemsa dan diperiksa di bawah mikroskop
cahaya.16, 31 Hasil pemeriksaan negatif tidak selalu berarti tidak mengidap
penyakit malaria ataupun mereka yang tinggal di daerah hipoendemis,
sebaiknya di ulang setiap 4 – 6 jam untuk menegakkan diagnosis. Pada
sediaan darah tebal, kemungkinan menjumpai parasit lebih besar karena
darah yang diambil 3 tetes, dibanding pada sediaan darah tipis,yang hanya 1
tetes. Sediaan darah tipis berguna untuk melihat morfologi parasit sekaligus
menentukan spesies parasit.
2.4.1. Pemeriksaan Mikroskopik (Metode Konvensional) 9
Saat ini diagnosis malaria masih dilakukan dengan menggunakan
metode konvensional yaitu dengan pewarnaan Giemsa yang dikembangkan
oleh Ross sejak tahun 1903. Ada 2 cara untuk pembuatan preparat:
45
1. Preparat darah tebal, dengan menggunakan 3 tetesan darah dan dengan
preparat ini lebih banyak kemungkinan menemukan 20 kali lebih cepat
ditemukannya parasit dari pada preparat darah tipis.
2. Preparat darah tipis, lebih tepat untuk mengkonfirmasi spesies parasit
selain itu juga dapat melihat perubahan bentuk eritrosit. Jadi dengan
preparat ini dapat membedakan ke4 spesies plasmodium.
Metode konvensional ini memerlukan biaya yang relatip murah tetapi
membutuhkan waktu cukup lama untuk proses pewarnaan dan untuk
Keuntungannya: dapat menghitung kepadatan parasit sehingga dapat
diketahui berat ringannya infeksi.
2.4.2 Quantitative Buffy Coat (QBC) Malaria 41
Metode ini merupakan cara tes diagnostik cepat untuk deteksi parasit
malaria dengan cara stratifikasi sentrifugal, darah yang diambil pada tabung
kapiler akan membentuk stratifikasi (lapisan) yang disebut “Buffy Coat” dan
parasit malaria terkonsentrasi pada lapisan ini. Pemeriksaan ini berdasar
pada DNA dan RNA parasit dengan pengecatan acridine orange kemudian
dilihat dengan mikroskop fluorescence dimana nucleus terlihat hijau dan
sitoplasma terlihat merah.
46,47
Metode ini ditemukan oleh Wardlaw dan Levine tahun.1983, dikatakan
10 kali lebih sensitif daripada metode konvensional oleh karena darah yang
digunakan sampel 55-56ul bila dibandingkan metode konvensional yang
hanya menggunakan 0,1 - 0,25 ul. Sensitifitas metode ini berkisar 89 -92%
dan spesifitasnya 83,3%.
Metode ini menggunakan fasilitas laboratorium yang lebih lengkap oleh
karena harus ada centrifus dan mikroskop fluorescence yang kebanyakan
tidak didapatkan pada laboratorium daerah.
2.4.3. Metode Kawamoto
Metode ini dikembangkan tahun 1991 oleh Kawamoto, dengan
menggunakan sediaan darah tebal dan tipis seperti pada pulasan
konvensional kemudian diwarnai dengan acridine orange (1-2 tetes) dan
dilihat dibawah mikroskop cahaya biasa dengan menyisipkan interference
filter dibawah kondensor mikroskop dan memakai cahaya halogen atau sinar
matahari sehingga menghasilkan mikroskop fluorescence.
Dibanding dengan cara konvensional metode ini lebih cepat, tetapi
masih tetap menggunakan mikroskop walau lebih sederhana bila
dibandingkan dengan metode QBC. Sensitifitasnya 69,8% dan spesifisitasnya
81,05%.
2.4.4. Diagnosis Serologik
Dengan metode ini dapat mendeteksi antibodi maupun antigen
malaria, ELISA merupakan metode yang dapat digunakan pada diagnosis
serologik ini dengan mendeteksi antigen pada malaria. Metode ini
memerlukan waktu relatif lama sekitar 2-4 jam selain itu juga memerlukan
sarana laboratorium yang lengkap.
48
2.4.5. PCR (Polymerase Chain Reactions)
Metode ini menggunakan teknik biologi molekuler dan dapat
mendeteksi DNA malaria melalui reaksi berantai polymerase dan
visualisasinya menggunakan elektroforesis serta pembacaannya dibawah
iluminasi sinar ultra violet, metode ini menggunakan peralatan (thermal
Cycler) dan reagens yang mahal dengan waktu yang dibutuhkan sekitar 4 jam
dan memerlukan ketrampilan yang memadai.
48
2.4.6. Immunochromatographic Test (ICT)
Immunokromatografi Tes merupakan salah satu Rapid Diagnostik Tes.
Uji ini berdasarkan deteksi antigen yang dikeluarkan oleh parasit malaria,
yaitu PfHRP II. Pada eritrosit yang terinfeksi plasmodium akan terbentuk knob
yaitu knob positif dan negatif. Sintesa PfHRP II di mulai pada saat berbentuk
cincin dan berlanjut hingga stadium trofozoit. Ada tiga HRP yang dibuat oleh
P.falciparum pada saat menginfeksi eritrosit yang dinamakan dengan PfHRP
I,II dan III. PfHRP I hanya diekspresikan pada knob positif pada membrane
eritrosit yang terinfeksi sehingga jumlahnya sedikit. PfHRP II diekspresikan
pada kedua knob positif dan negatif dan jumlahnya sangat banyak, dan
merupakan antigen pertama yang digunakan untuk RDT. Rangkaian DNA
telah membuktikan bahwa PfHRP II mengandung 35% histidin dan juga
kandungan alanin dan aspartat yang relatif tinggi masing – masing 40% dan
12%. PfHRP III merupakan protein yang paling sedikit di produksi oleh
P.falsiparum di bandingkan dengan PfHRP I dan PfHRP II. Rangkaian DNA
menunjukkan PfHRP III mengandung 30% histidin dan 29% alanin.
Immunokromatografi Tes umumnya digunakan dalam bentuk uji strip
yang mengandung antibodi monoclonal yang langsung pada antigen parasit.
Prinsip Immunokromatografi Tes adalah mendeteksi antigen yang di
keluarkan oleh plasmodium, dan selanjutnya akan terjadi reaksi kompleks
antigen-antibodi pada bahan nitroselulose acetat dimana kompleks tersebut
diberi Monoklonal antibodi (Mab) yang berlabel zat warna (Coloidal gold)
sebagai penanda, sehingga muncul suatu tanda berupa garis yang
menyatakan hasil positif untuk P.falciparum, infeksi campuran atau
negatif.
35,12,36
17,12
Immunokromatografi tes merupakan uji yang cepat, mudah dilakukan
dan tidak memerlukan laboratorium khusus, seperti sentrifus dan mikroskop.
Cara kerja alat ini yaitu dengan menggunakan pipa kapiler yang tersedia ,
darah diambil dengan menusuk ujung jari dan pastikan bahwa pipa kapiler
telah terisi penuh darah. Darah ditaruh pada daerah ungu yang ada pada alat,
dilakukan dengan cara memegang pipa kapiler secara vertikal dan tekan
ujungnya perlahan-lahan. Kemudian diteteskan reagensia. Dalam 5 menit
hasil sudah dapat dibaca. Garis paling atas (garis pertama) merupakan garis
control. Garis dibawah garis control merupakan garis uji untuk plasmodium
nonfalciparum. Bila hasil uji (+)/(−) untuk P,falciparum maka garis control dan
garis terbawah akan berwarna merah muda.
Kelemahan ICT ini antara lain:
12,38
1. Sensitivitas biasanya mencapai > 90% pada level parasitemia > 100/µL
darah, tetapi akan menurun pada parasitemia yang rendah, orang –
orang yang tidak imun dan yang sudah pernah mendapat terapi
profilaksis malaria.
2. Hasil positif palsu dapat terjadi karena beberapa factor antara lain yaitu
adanya resisten obat dan reaksi silang dengan autoantibodi seperti
Rheumatoid factor.
3. Reaksi silang dengan jenis plasmodia yang lain, yang dapat terjadi
pada 1/3 pasien.
4. Harga alat mahal bila dibandingkan dengan pewarnaan Giemsa juga
2.5. Kerangka Konsep
PENDERITA MALARIA
MIKROSKOP
SD BIOLINE
P.falcipa rum
(+)
P.vivax P.f +(P.v P.o, P.m)
P.falcipa rum
P.vivax P.f+(P.v,
P.o,P.m)
BAB 3
METODE PENELITIAN
3.1. Metode Penelitian
Penelitian ini dilakukan dengan pendekatan cross-sectional (potong
lintang).
3.2. Tempat dan Waktu Penelitian
Penelitian dilakukan di Departemen Patologi Klinik FK USU/ RSUP
H.Adam Malik Medan dan Puskesmas Pulau Tello Kecamatan Pulau-Pulau
Batu Kabupaten Nias Selatan, mulai Juli sampai dengan September 2012.
3.3. Populasi dan Sampel Penelitian 3.3.1. Populasi Penelitian
Populasi penelitian adalah pasien malaria yang berkunjung ke
Puskesmas Pulau Tello kecamatan Pulau-Pulau Batu Kabupaten Nias
Selatan.
3.3.2. Sampel Penelitian
Pasien dengan diagnosa Malaria Klinis dan yang diambil adalah
semua golongan umur. Seluruh peserta yang ikut dalam penelitian ini
diberikan informed-consent dan telah mendapat penjelasan tentang prosedur
penelitian dan kemungkinan efek yang kurang menyenangkan yang mungkin
3.3.3. Cara Pengambilan Sampel Penelitian
Pengambilan sampel dilakukan secara konsekutif terhadap semua
populasi terjangkau yang memenuhi kriteria penelitian
3.3.4. Besar Sampel
Untuk uji diagnostik digunakan rumus besar sampel
n = (Zα √2P(1- P) + Z β√P1(1- P1) + P2(1- P2)
(P1 – P2)
2
P = ( P1 – P2)/2
2
α = tingkat kemaknaan
P = 0,5 Zα = 1,96 Zβ = 0,842 P1 = 0,90 P2= 0,80
= 98
3.4. Kriteria Penelitian 3.4.1. Kriteria Inklusi
Setiap pasien yang datang dengan satu keluhan atau lebih seperti:
1. Demam ≥ 37,50
2. Pucat
C
3. Mencret
4. Sakit kepala
3.4.2. Kriteria Eksklusi
1. Riwayat makan obat anti malaria satu minggu sebelumnya
2. Penderita yang tidak bersedia diperiksa atau tidak mau mengikuti
3.5. Ethical Clearance dan Informed Consent
Ethical clearance diperoleh dari Komite Penelitian Bidang kesehatan
Fakultas Kedokteran Universitas Sumatera Utara Medan. Inform consent
diminta secara tertulis dari subjek penelitian yang menyatakan bersedia ikut
dalam penelitian setelah mendapat penjelasan mengenai maksud dan tujuan
dari penelitian ini. Ethical Clearance diperoleh dari Komite Penelitian Bidang
Kesehatan Fakultas kedokteran Universitas Sumatera Utara dengan Nomor:
213/KOMET/FKUSU/2012.
3.6. Material dan Metode
3.6.1. Pengambilan dan penyimpanan specimen SD Bioline
1. Ambil darah, tampung dalam tabung darah (yang mengandung
EDTA/sitrat/heparin) dengan venipuncture.
2. Jika darah tidak langsung digunakan, simpan pada suhu 2-80
3. Sampel yang disimpan simpan pada suhu 2-8
C. untuk
penyimpanan lebih dari 3 hari,sebaiknya darah dibekukan. Darah yang
telah disimpan harus dikondisikan dahulu pada suhu kamar sebelum
digunakan. Penggunaan sampel yang disimpan lebih dari tiga hari dapat
menimbulkan reaksi non spesifik.
0
Pengambilan dengan Lancet
C harus digunakan
maksimal dalam waktu tiga hari.
1. Bersihkan daerah yang akan diambil darah dengan alcohol swab
2. Goyangkan ujung jari dan tusuk dengan lancet steril yang telah tersedia
4. Ambil pipet kapiler yang tersedia,goyangkan tabung secara perlahan,
celupkan ujung pipet yang terbuka kedalam tabung kemudian ambil darah
dengan mengatur tekanan dalam pipet kapiler sampai batas garis
berwarna hitam pada pipet kapiler.
Prosedur Pemeriksaan
1. Kondisikan seluruh komponen kit dan specimen pada suhu kamar
sebelum digunakan.
2. Keluarkan kaset tes dari foil, letakkan pada permukaan yang datar dan
kering
3. Bersihkan ujung jari dan tusuk jari dengan lancet
4. Dengan Loop sekali pakai yang telah disediakan, celupkan ujung bulat
loop (capillary tube) kedalam specimen darah (5 ul) dan dengan hati-hati
tempatkan ujung bulat tersebut kedalam sampel well.
5. Tambahkan 4 tetes assay diluents kedalam assay diluents well.
6. Baca hasil dalam waktu 15- 30 menit.
Peringatan : Jangan baca hasil setelah 30 menit karena dapat memberi hasil
palsu.
3.6.2. Bahan yang Diperlukan
• Slide/kaca sediaan (Object Glass)
• Lancet steril, digunakan hanya untuk 1x pakai.
• Kapas, jika tidak tersedia kapas, dapat digunakan bahan halus.
• Alkohol 70%, Lebih baik lagi jika menggunakan swab alcohol siap
• Larutan buffer (pH 7.2)
• Larutan Giemsa
• Kertas lakmus untuk mengukur pH
3.6.3. Anamnese dan Pemeriksaan Fisik
Anamnese dilakukan dengan wawancara berpedoman pada daftar
pertanyaan pada status dan keterangan yang ada pada status. Pemeriksaan
fisik dilakukan pada posisi penderita berbaring kemudian periksa pembesaran
limpa dan anemia, Seluruh data dan hasil pemeriksaan dicatat dalam status
khusus penelitian.
Cara membuat sediaan darah tebal
• Sampel darah 3 tetes diletakkan diatas kaca objek yang bersih, ujung
object glass kedua ditempelkan pada ketiga tetes darah tebal, darah
dibuat homogen dengan cara memutar ujung object glass searah
jarum jam, sehingga terbentuk bulatan dengan diameter 1cm
• Biarkan kering, lalu dihemolisa.
• Diwarnai dengan larutan Giemsa 10%, dan biarkan 20 menit.
• Cuci dengan air mengalir, kemudian dikeringkan.
• Hasil pulasan dilihat dibawah mikroskop cahaya dengan pembesaran
100.
Cara membuat sediaan darah tipis
• Sampel darah 1 tetes diletakkan diatas kaca objek yang bersih.
45
• Hapus dengan kaca objek lain dengan menggunakan sisi kaca objek
• Ujung kaca objek penghapus diletakkan didepan darah kemudian
ditarik kearah darah tersebut hingga menyebar pada sudut kedua kaca
objek.
• Dengan membentuk sudut 45 derajat, kaca objek penghapus segera
didorong kedepan dengan perlahan-lahan tanpa berhenti, sehingga
didapatkan sediaan hapus (seperti bentuk lidah)
• Biarkan kering.
• Fiksasi dengan methanol 1-2 menit, kemudian warnai dengan larutan
Giemsa 10% selama 20 menit.
• Cuci dengan air mengalir kemudian dikeringkan.
• Hasil pulasan dilihat dibawah mikroskop cahaya dengan pembesaran
100
Sediaan dikatakan positf bila dijumpai asexsual dan sexual
Prosedur Pemeriksaan SD Bioline
• Negatif : Muncul satu garis “C” pada jendela hasil
• Positif P.f : Muncul dua garis “P.f” garis tes dan “C” garis control.
• Pan Positif (P.v,P.m, P.o) : Muncul dua garis (“Pan” garis tes dan`”C”
garis control) pada jendela hasil
• Mix infeksi P.f dan P.v ( atau P.m, Po)
Muncul tiga garis ( “P.f”, “Pan” garis tes dan “C” garis control) pada
jendela hasil. Invalid : Tidak muncul garis “C” pada jendela hasil.
3.6.4. Pemantapan Kualitas
dilakukan pemeriksaan harus dipersiapkan alat-alat yang dipakai serta masa
kadaluarsa.
Pemantapan kualitas penting untuk mencegah terjadinya kesalahan
dalam pemeriksaan. Untuk itu sebelum melakukan pemeriksaan perlu
dilakukan persiapan yang cukup untuk menghindari kesalahan dalam
pemeriksaan. Prosedur yang harus diperhatikan diantaranya adalah dimulai
dari preanalitik, analitik dan post analitik.
Pemeriksaan yang baik apabila test tersebut memenuhi syarat teliti
(precision), akurat (accuracy) dengan batas nilai yang dikeluarkan oleh
pabriknya (ada nilai targetnya), ketepatan merupakan prasyarat dari ketelitian.
Pemantapan mutu dilakukan untuk menjamin dan mendapatkan hasil
pemeriksaan yang baik. Sebelum melakukan pembacaan slide penelitian
terlebih dahulu dilakukan pembacaan slide konrol..Kontrol kualitas dilakukan
untuk mendapatkan nilai pemeriksaan yang baik.
3.7. Batasan Operasional
• Mix infeksi adalah Muncul tiga garis (P.f, Pan garis tes dan C garis
control) pada jendela hasil, mengindikasikan adanya infeksi campuran
dari P.f dan P.v(atau P.m,P.o)
Sensitivitas adalah kemampuan parameter pemeriksaan untuk
mendeteksi suatu penyakit. Sensitivitas merupakan proporsi subjek
yang sakit dengan hasil uji diagnostik positif (positif benar)
dibandingkan seluruh subyek yang sakit (positif benar+negative semu).
Spesifisitas adalah kemampuan parameter pemeriksaan untuk
menentukan bahwa subyek tidak sakit. Spesifisitas merupakan
proporsi subyek tidak sakit. Spesifisitas merupakan proporsi subyek
sehat yang memberikan hasil uji diagnostik negative (negatif benar)
dibandingkan dengan seluruh subyek yang tidak sakit (negatif benar+
positif semu). Pada table 2x2, spesifisitas = d : (b+d).
Positive Predictive Value (PPV) adalah probabilitas seseorang
benar-benar menderita penyakit bila hasil uji diagnostiknya positif. PPV
merupakan perbandingan antara subyek dengan hasil uji positif benar
dengan positif benar+ positif semu. Pada table 2x2, PPV= a: (a+b).
51
Negative Predictive Value (NPV) adalah probabilitas seseorang tidak
menderita penyakit bila hasil ujinya negative.Pada table 2x2,
NPV = d : ( c+d).
51
51
Prevalens adalah proporsi kasus dalam suatu populasi pada suatu
saat.
Likelihood Ratio adalah besarnya kemungkinan subyek yang sakit
untuk mendapatkan hasil uji diagnostic tertentu dibagi kemungkinan
subyek tidak sakit akan mendapat hasil yang sama.
51
Likelihood Ratio Positif adalah perbandingan antara proporsi subyek
yang sakit yang member hasil uji positif dengan proporsi subyek yang
sehat yang memberi hasil uji positif dengan proporsi subyek yang
sehat yang member hasil uji positif. Pada table 2x2, likelihood ratio
Likelihood Ratio Negatif adalah perbandingan antara proporsi subyek
sakit dengan hasil uji negative dengan subyek sehat yang member
hasil uji negative. Pada table 2x2, likelihood rationegatif= c/(a+c) :
d/(b+d) = (1-sensitivitas): spesifisitas.51
3.8. Analisis Data Statistik51
Data pemeriksaan SD Bioline dan Mikroskop yang telah terkumpul
ditabulasi dan dimasukkan kedalam table 2x2 dimana jika dijumpai parasit
malaria dimasukkan kategori positif dan jika tidak dijumpai parasit malaria
masuk kategori negative. Hasil positif benar dimasukkan dalam sel a, hasil
positif semu dalam sel b, hasil negative semu dalam sel c dan hasil negative
benar dalam sel d. Kemudian dilakukan perhitungan untuk mencari
sensitivitas, spesifisitas, PPV, NPV, prevalens dan likelihood ratio.
Mikroskop Positif Negatif
SD Bioline Malaria Positif a B
Negatif c D
Rumus perhitungan:
Sensitivitas = a : (a+c)
Spesifisitas = d : (b+d)
Positif predictive value = a : (a+b)
Negatif predictive value = d : (c+d)
Prevalens = (a+c) : (a+b+c+d)
Likehood ratio positif = sensitivitas:(1-spesifisitas)=a/(a+c):b/(b+d)
3.9. Perkiraan Biaya Penelitian
Tabel 3.1. Perkiraan Biaya Penelitian
No Keterangan Jumlah
1
Pengadaan alat tulis
BAB 4
HASIL PENELITIAN
4.1. Hasil Penelitian
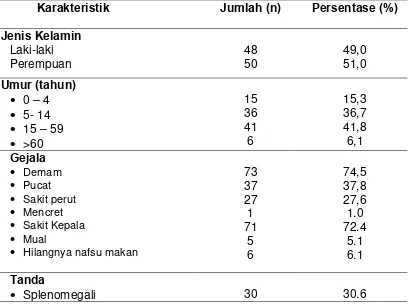
Jumlah sampel dalam penelitian ini 98 orang. Jumlah perempuan 50
pasien (51%) lebih banyak dari pada laki-laki 48 orang (49%). Gejala
terbanyak adalah Demam yaitu 73 orang (74,5%) dan Sakit kepala yaitu 71
pasien (72,4%). Splenomegali ditemukan pada 30 pasien (30,6%).(Tabel 1)
Tabel 4.1. Karakteristik Sampel
Tabel 4.2. Perbandingan Uji SD Bioline dengan Mikroskop P.f
Pada penelitian ini setelah diuji statistik didapatkan nilai sensitivitas
97%, nilai spesifisitas 100%, nilai prediksi positif 100%, nilai prediksi negatif
99% dan prevalensi 33%.
Tabel 4.3. Perbandingan Uji SD Bioline dengan Mikroskop P.v Mikroskop P.v
Pada penelitian ini setelah diuji statistik didapatkan nilai sensitivitas
100%, nilai spesifisitas 97%, nilai prediksi positif 91%, nilai prediksi negatif
100% dan prevalensi 21%.
Pada penelitian ini setelah diuji statistik didapatkan nilai sensitivitas
97%, nilai spesifisitas 100%, nilai prediksi positif 100%, nilai prediksi negatif
BAB 5 PEMBAHASAN
Pada penelitian ini terlihat jumlah penderita malaria lebih banyak
perempuan yaitu 51% dibandingkan dengan laki-laki sebesar 49%. Dari
sebaran umur relatif tidak merata, terbanyak adalah kelompok umur 15 – 59
tahun yaitu 41,8% dan 5 – 14 tahun yaitu 36,7%. Dari penelitian Marletta di
Nias (Sumatera Utara) kasus malaria tertinggi pada usia 5 – 14 tahun.
Perbedaan angka kesakitan malaria pada laki-laki dan perempuan atau
berbagai golongan umur disebabkan beberapa faktor seperti pekerjaan,
pendidikan,perumahan, migrasi penduduk dan kekebalan.
Diagnosis malaria ditetapkan berdasarkan anamnesis, gejal klinis dan
hasil laboratorium. Baku emas pemeriksaan laboratorium malaria adalah
temuan parasit pada pemeriksaan mikroskopis (hapusan darah tebal dan
tipis). Pemeriksaan ini mempunyai banyak kelemahan, yaitu memerlukan
ketersediaan mikroskop cahaya memadai dan tenaga pemeriksa yang
trampil.
8
Berdasarkan hasil evaluasi Program Pemantapan Mutu Eksternal
Laboratorium Kesehatan, dari 19 laboratorium di Nusa Tenggara barat (NTB)
yang dinilai (evaluasi) menggunakan sediaan positif malaria, hanya 79%
teknisi laboratorium yang dapat membaca preparat dengan benar.
Pada penelitian ini telah dilakukan pemeriksaan dengan RDT Standard
Diagnostik Malaria dan Mikroskop terhadap 98 sampel yang memenuhi
kriteria malaria secara klinis. Pada pemeriksaan mikroskopis diperoleh
Plasmodium vivax 21 sampel, Plasmodium falciparum 32 sampel, sementara
sampel tanpa infeksi Plasmodium sebanyak 28 dan mix infection non
falciparum 17 sampel.
Pada penelitian ini, Uji SD Bioline dibandingkan dengan pemeriksaan
mikroskopis, dan diperoleh sensitivitas 100%, spesifisitas 97%, Nilai prediksi
positif 91%, dan nilai prediksi negative 100%.
Uji SD Bioline merupakan salah satu uji diagnostik cepat malaria yang
memiliki kemampuan untuk mengetahui Plasmodium falciparum, Plasmodium
vivax dan mix infeksion. Plasmodium dalam sirkulasi darah. Berbeda dengan
uji Imunokromatografi lain yang hanya mampu mengetahui Plasmodium
falciparum saja dan Plasmodium falciparum dan Plasmodium vivax. ParaSight
F (Becton Dickinson Advanced Diagnostic, Franklin lakes, N.J) dan IC.
Plasmodium falciparum (Amrad-ICT, Sydney, Australia) adalah contoh uji
imunokromatografi yang hanya mampu mengetahui Plasmodium falciparum.
OneMed Optimal (flow Inc, Portland, Oregon), ICT Plasmodium
falciparum/Plasmodium vivax (ICT pf/pv). Amrad-ICT dapat mengetahui
Plasmodium falciparum dan panmalaria.
Berdasarkan penelitian ini, diperoleh hasil bahwa uji SD Bioline dari
laboratorium Patologi Klinik FK USU/RSH.Adam Malik medan Sumatera
Utara mempunyai sensitivitas 100%, spesifisitas 97%, nilai prediksi positif
91%, nilai prediksi negatif 100%. Penelitian serupah pernah dilakukan oleh
Ima Arum L dan Purwanto AP, diperoleh hasil bahwa uji Imunokromatografi
dari laboratorium Hepatitis NTB mempunyai sensitivitas 100%, spesifisitas
Di Maesod Thailand, Chansuda Wonggsrichanalai, Iraeema, Arevalo
dkk menggunakan uji Now® ICT pf/pv dan menemukan sensitivitas dan
spesifisitas untuk Plasmodium falciparum masing-masing 100% dan 96,2%;
sensitivitas dan spesifisitas untuk plasmodium vivax adalah 87,3% dan
97,7%. Farces, Zhong dkk menguji Binax Now®
Penelitian Tjitra dkk, dengan menggunakan ICT pf dan pv didapatkan
sensitivitas 95%, spesifisitas 89,6%, nilai prediksi positif 96,2% dan nilai
prediksi negatif 88,1%. Agustini dan Widayanti pada penelitian yang
menggunakan NOW® ICT pf/pv diperoleh sensitivitas 97%, spesifisitas 100%,
nilai prediksi positif 100% dan nilai prediksi negatif 88,6%. Sensitivitas dan
spesifisitas tinggi yang diperoleh dalam penelitian ini tidak mengejutkan
mengingat prinsip kerja alat yang menggunakan antibodi monoklonal dalam
mendeteksi PfHRP II dan hasil ini juga sama dengan penelitian-penelitian
sebelumnya yang membandingkan Imunokromatografi dengan pemeriksaan
mikroskopis.
ICT dibandingkan dengan
PCR dan menemukan sensitivitas 94% untuk Plasmodium falciparum dan
84% untuk panmalaria.
Setelah dilakukan uji mikroskopis dan uji SD Bioline terhadap 98
sampel, diperoleh hasil negatif pada pemeriksaan mikroskopis dan uji SD
Bioline. Menurunnya sensitivitas uji SD Bioline dipengaruhi jenis parasit dan
BAB 6
KESIMPULAN DAN SARAN
6.1. Kesimpulan
Pada penelitian ini disimpulkan bahwa uji SD Bioline memiliki
sensitivitas dan spesifisitas yang cukup tinggi sehingga dapat dijadikan
diagnostik alternatif malaria falciparum, malaria vivax dan mix infeksi.
6.2. Saran
1. Bagi petugas kesehatan perlu adanya skrining malaria pada ibu hamil
dan saat melakukan donor darah baik di PMI maupun di UTD secara
efektif dan efisien dengan menggunakan uji SD Bioline malaria.
2. Bagi masyarakat umum dapat menggunakan uji SD Bioline malaria
dalam mendeteksi secara dini penyakit malaria yang lebih efektif dan
efisien.
3. Bagi penelitian selanjutnya bisa dilakukan dengan pemeriksaan
DAFTAR PUSTAKA
1. Making a difference” The Wold Health Report 1999.Health Millions
1999,25(4),pp.3-5
2. Wolf J.E.” Treatment and prevention of malaria: an update”. Hospital
Physician, Desember 2002, pp. 15-22.
3. Bendezu,J. Angel,R.Tanilu,G.et al, Field Evaluation of a Rapid
Diagnostic test (ParascreenTM
4. Nur Afiah, Windarwati, hardjoeno. Perbandingan Tes Rapid
Imunokromatografi dan Tes Mikroskopis dalam mendiagnosis malaria
didaerah Endemik Halmahera Tengah. The Indonesian Journal of
Medical Science Volume1.No.5. July.2009.P.275-280.
) for Malaria diagnosis in the Peruvian
Amazon.Malaria Journal 2010:9:154.
5. Ima Arum,L. Purwanto,AP.Arfi,S.dkk. Uji Diagnostik Plasmodium
Malaria Menggunakan Metode Imunokromatografi Diperbandingkan
dengan Pemeriksaan Mikroskopis. Indonesian Journal of Clinical
Pathology and Medical Laboratory, Vol.12,No.3.Juli 2006: 118-122.
6. Ginting J. Uji Parascreen Sebagai Diagnostik Alternatif Malaria
Falciparum,Ilmu Kesehatan Anak,USU,2008.
7. Shujatullah F, Malik A,Khan HM, Malik A. Comparisson Of Different
diagnostic Techniques in Plasmodium Falciparum Cerebral Malaria, J
8. Khan SA, Anwar M, Hussain S, Qureshi AH, Ahmad M, Afzal AS.
Comparison Of Optimal Malaria Test with Light Microscopis for the
Diagnosis Of Malaria,JPMA,2004: 54:404
9. Jelinek T, Grobusch MP, SchWenke S, Steidi S, Sonneburg FV, Noth
Durft HD,dkk, Sensitivity and Specificity of Dipstic Test For Rapid
Diagnosis Of Malaria In Non Imune Travelers, J.Clin.Microbiol 1999:
37:721 – 3.
10. Bell D,dkk, Diagnosis Of Malaria In a Remote Area Of The Philippines.
Comparison Of Tecniques and Their acceptance By Health Workers
and The Community.Bull.WHO 2001: 79 (10): 933-41.
11. Arai M, Ishii A, Matsuoka H. Laboratory Evaluation Of the ICT Malria
pf/p.v. ImmunoCromatographic Test for Detecting The Pan Malarial
Antigen Using Rodent Malaria Model, Am.J.Trop.Med.Hyg.2004; 70(2):
139 – 43.
12. Moody A.Rapid Diagnostic Tests For Malaria Parasites.Clin.Microbiol
Rev 2002; 15: 66- 78.
13. Tjitra E.Suprianto S, Dyer M, Currie BJ, Anstey NM. Field Evaluation Of
The ICT malaria pf/pv Immunochromatograpic Test For Detection Of
Plasmodium Falciparum and Plasmodium Vivax In Patients With A
Presumptive Clinical Diagnosis Of Malaria In Eastern Indonesia. J. Clin
Microbiol 1999: 37:2412 – 7.
14. Palmer CJ, Lindo JF, Klaskala , Kaminssky R, Quesada JA, Baum
MK,dkk. Evaluation Of The Optimal Test For Rapid Diagnosis Of
15. Richter J, Harms G, Muller – Stiper I, Gobels K, haussinger D.
Performance Of An Immunochromotographic Test For The Rapid
Diagnosis Of Malaria. Parasitol Res,2004; 92 (6): 518 – 9.
16. Richardson DC, Ciach M, Zhing KJY, Crandall I, Kain KC, Evaluation
Of The Macromed Dipstick Assay Versus PCR For Diagnosis Of
Plasmodium Falciparum malaria in Returned Travelers, J.Clin.Microbiol
2002; 40: 4528
17. Mya MM, Saxena RK,Evaluation Of Developed Plasmodium Falciparum
Malaria Diagnostic Technique.IE(I).Journal.ID 2004; 85:58-62.
18. Kakkilaya BS.Rapid Diagnosis Of Malaria. Lab.Medicine Aug.2012:
8(34):602- 8.Diunduh dari URL: site.com/
Malaria/rdts.htm.
19. DEPKES RI. Pedoman Penatalaksanaan Kasus Malaria di Indonesia
GEBRAK MALARIA, Dirjen Pengendalian Penyakit dan Penyehatan
Lingkungan,2010.
20. Greenwood B, Mutabingwa T, Malaria in 2012. Nature 415 (6872); 670-
2, 2012.Human TNF-α ELISA Kit For The Quantitative determination of
Human Tumour Necrosis Factor alpha (TNF-α) Concentrations in
serum, Plasma, Cell Culture Supernatant, and Other biological Fluids.
Available fom http://
21. Winstanley P.Modern Chemo Therapeutic Options For malaria the
Lancet Infectious Disease,2001; 1 (4): 242 – 50.
23. Zein U: Two Cases of Severe Travelers Falciparum Malria With
Improved Conditions After Administration Of Oral Quinines, Acta Medica
Indonesiania,2002; 3 (XXXIV): 111- 4.
24. Barcus MJ.Laihad F, Sururi M,Sismadi P.Marwoto H.Bangs MJ.Baird
JK. Epidemic Malria in the Menoreh Hills Of Central
Java.Am.J.Trop.Med,Hyg,2002,66(33): 287 – 92.
25. Zein U, Lubis HR: Malaria Falsiparum pada penderita gagal Ginjal
Terminal dengan Hemodialisis Reguler,2001, Annual Meeting
Nephrology, Medan.
26. Nugroho A, Wagey MT.Siklus Hidup Plasmodium Malaria.Dalam:
Harijanto PN (Editor) malaria, Epidemiologi, Patogenesis, Manifestasi
Klinis & Penanganan, Penerbit EGC, Jakarta,2000; 38 – 53.
27. WHO: Guidelines For The Treatment Of Malaria, Geneva,2006
28. CDC: Human Host and Malaria,National Center For Infectious diseases,
Division Of Parasitic Diseases. available from
http://WWW.CDC.gov/malaria/biology/human host/2012
29. Wiser,MF.Biochemistry Of Plasmodium 2012,Tulane University,
Available from http:/
30. Schineder EL, Carlson HK, Chang HH. Heme detoxification in
P.falciparum, The Malaria Lab.University Of California, Barkeley,
Available.http:/WWW.cchem.barkeley.edu/mmargrp/research/Malaria/hr
p.html.2012.
31. Tjitra E, Suprianto S, Dyer ME,Currie BJ, Anstey NM.Detection Of
antigens after Chloroquine Treatment Outcome in Eastem
Indonesia.Am.J.Trop.Med,Hyg,2001: 65(5):593-8
32. Mabey D,Peding RW, Ushanowski A, Perkins MD.Diagnostic For The
Depeloping World Nature Rev Microbiol 2004:2:231-40.
33. Jenson HB, Penyunting Nelson Text Book Of Pediatrics.Edisi
ke.18.Philadelpia: Saunders:2007.h.1477 – 84.
34. Rampengan T. Malaria, Dalam:Poorwo Soedarmo SS, Gama H,
Hadinegoro SR, Penyunting.Buku ajar Ilmu Kesehatan Anak Infeksi dan
Penyakit Tropis. Edisi Ke1. Jakarta: Balai Penerbit FKUI:2002.h.442-71.
35. Desrinawati.Perbandingan Hasil Pemeriksaan Metoda
Immunochromatographi Test (ICT) dengan Pewarnaan Giemsa Pada
Infeksi Malaria Falciparum.Sari Pediatri.2002;4(3):1-13.
36. Howard RJ, Uni S.Aikawa M,Aley SB, Leech JH,Liew AM,dkk. Secretion
Of A Malarial Histidine-Rich Protein (PfHRP II) From Plasmodium
Falciparum- Infected Erytrocytes.J.Cell Biol 2006:103:1296-77.
37. Eldirdieri S.A,Tag E.H.M,Gilani M.G,Al Sharieef.dkk.The Use Of Rapid
Diagnostic Test (ParacheckPf) In An Area Of Low Malaria
Transmission, Khartoum,Sudan.Sudanese Journal Of Public Health;
2007.Vol.2(2).pp 89-94
38. Daily JP.Malaria dalam: Gershon AA, Hotez PJ, Katz SL,
Penyunting.Krugman.s Infectious diseases of Children. Edisi ke 11.
Philadelpia: Mosby; 2004.h.193 -215.