TUPAIA JAVANICA
SEBAGAI MEDIA ISOLASI DAN DETEKSI
VIRUS HEPATITIS B
RICKY
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
Primer Hepatosit Tupaia javanica Sebagai Media Isolasi dan Deteksi Virus Hepatitis B adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, April 2013
Isolasi dan Deteksi Virus Hepatitis B. Dibimbing oleh RETNO DAMAYANTI SOEJODONO dan JOKO PAMUNGKAS.
Infeksi virus Hepatitis B telah menjadi salah satu permasalahan kesehatan di berbagai penjuru dunia. Lingkup inang virus yang spesifik menjadi salah satu kendala dalam penelitian virus ini. Kemampuan kultur primer hepatosit Tupaia belangeri sebagai media infeksi memberikan alternatif model in vitro dalam mempelajari infeksi virus Hepatitis B. Penelitian ini mengembangkan kultur primer hepatosit Tupaia javanica asal Indonesia sebagai salah satu model in vitro untuk media isolasi dan perbanyakan serta deteksi virus Hepatitis B asal manusia dan satwa primata secara in vitro. Analisa real time PCR menunjukkan virus Hepatitis B asal manusia dan satwa primata dapat menginfeksi dan bereplikasi pada kultur primer hepatosit Tupaia javanica. Hasil ini menunjukkan kultur primer hepatosit Tupaia javanica dapat digunakan sebagai model in vitro dalam mempelajari infeksi virus hepatitis B.
Hepatitis B Virus Isolation and Detection. Under direction of RETNO DAMAYANTI SOEJODONO and JOKO PAMUNGKAS.
Human hepatitis B virus is a major health problem worldwide which have a very narrow host range. The susceptibility of Tupaia belangeri hepatocytes primary culture has been used as an alternative in vitro model for studying hepatitis B virus infection. In this research, we proposed the usage of T. javanica hepatocytes primary culture as an in vitro model to isolate and detect hepatitis B virus from human and Hylobates moloch. Both in vitro infection of the hepatitis B virus in T. javanica hepatocytes primary culture show viral DNA replication in Real Time PCR. The result suggest that T. javanica may become a useful model for studying hepatitis B virus infecton
© Hak Cipta Milik IPB, Tahun 2013
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
VIRUS HEPATITIS B
RICKY
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Bioteknologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
Nama : Ricky
NRP : P051100231
Disetujui oleh Komisi Pembimbing
Prof. Dr. drh. Retno D. Soejoedono, M.S
Ketua Anggota
Dr. Drh. Joko Pamungkas, MSc
Diketahui oleh
Ketua Program Studi Dekan Sekolah Pascasarjana Bioteknologi
Prof. Dr. Ir. Suharsono, DEA Dr. Ir. Dahrul Syah, M.ScAgr
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia dan rahmat-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Maret 2012 sampai bulan Desember 2012 ini ialah pengembangan kultur primer hepatosit Tupaia javanica sebagai media isolasi dan deteksi virus hepatitis B.
Terima kasih penulis ucapkan kepada Ibu Prof. Dr. drh. Retno Damayanti Soejoedono, M.S selaku Ketua Komisi Pembimbing, Bapak Dr. Drh. Joko Pamungkas, MSc selaku Anggota Komisi Pembimbing dan Kepala Pusat Studi Satwa Primata PSSP-LPPM IPB serta Bapak Prof. Dr. Ir. Suharsono, DEA sebagai Ketua Program Studi Bioteknologi. Ungkapan terima kasih juga disampaikan kepada Pusat Studi Satwa Primata yang telah mendanai penelitian ini. Di samping itu, penghargaan penulis sampaikan kepada Ibu Dr. Drh. Diah Iskandriati, Ibu Silmi Mariya S.Si., M.Si. beserta staf laboratorium Mikrobiologi dan Imunologi, Bapak Uus Saepuloh, S.Si, M.Biomed beserta staf laboratorium bioteknologi yang telah membantu selama pengumpulan data. Ungkapan terima kasih juga disampaikan kepada ayah, ibu, serta seluruh keluarga, atas segala doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
Bogor, April 2013
Halaman
DAFTAR ISI x
DAFTAR GAMBAR xi
DAFTAR TABEL xi
PENDAHULUAN 1
Latar Belakang 1
Tujuan 2
TINJAUAN PUSTAKA 3
Virus Hepatitis B 3
Tupaia sp 4
Kultur Primer 5
METODOLOGI 6
Bahan 6
Alat 6
Metode 6
HASIL DAN PEMBAHASAN 9
Isolasi Kultur Primer Hepatosit Tupaia javanica 9
Infeksi Virus Pada Kultur Primer Hepatosit 9
Deteksi Infeksi dan Replikasi Virus Hepatitis B 10
SIMPULAN DAN SARAN 14
DAFTAR PUSTAKA 15
Halaman
1. Virus Hepatitis B 3
2. Bagan Spektrum Penyakit Hati Akibat Infeksi VHB 3
3. Morfologi Kultur Primer Hepatosit T. javanica B 9
4. Morfologi Kultur Primer Hepatosit T. javanica B terinfeksi 10
5. Deteksi Infeksi dan Replikasi Virus Hepatitis B 11
6. Grafik Cycle Treshold sampel Virus Hepatitis B asal owa 13
7. Grafik Cycle Treshold sampel Virus Hepatitis B asal Manusia 13
PENDAHULUAN
Latar Belakang
Saat ini lebih dari 2 milyar orang telah terinfeksi virus hepatitis B (VHB) dalam periode tertentu hidupnya. Sekitar 250 juta diantaranya masih terinfeksi dan menjadi karier. Setiap tahunnya terdapat 4 juta kasus akut hepatitis B dan sekitar 1 juta orang meninggal akibat hepatitis kronis, cirrhosis, ataupun kanker hati (El-serag 2001; WHO 2002). Centers for Disease Control and Prevention
(2011) melaporkan 3.371 kasus hepatitis B akut (1,1 kasus per 100.000 populasi) pada tahun 2009 di Amerika, dengan angka kematian sebesar 1.900 pasien. Indonesia merupakan daerah endemik infeksi VHB dengan tingkat karier 5-20% pada masyakarat umum (Creati et al. 2007).
Hepatitis ialah kondisi inflamasi pada organ hati disebabkan oleh berbagai jenis agen penyebab infeksi, alkohol, obat-obatan, dan penyakit autoimmune. Kasus hepatitis tertinggi disebabkan oleh virus, antara lain virus Hepatitis A, B, C, D, dan E. Diantara virus penyebab hepatitis, virus hepatitis B (VHB) merupakan yang tertinggi (WHO 2002). Sebagai negara berkembang dengan iklim tropis, Indonesia merupakan negara endemik terhadap berbagai jenis penyakit infeksius, termasuk salah satunya hepatitis yang disebabkan oleh VHB. Infeksi VHB pada tahap lanjut (kronis) dapat menyebabkan kegagalan hati, cirrhosis, dan
Hepatocellular Carcinoma (HCC) (Alberti et al. 1979). Infeksi VHB telah menjadi salah satu permasalahan kesehatan di berbagai penjuru dunia, terlebih lagi pasien hepatitis memiliki gejala klinis yang bervariasi. Walaupun vaksin terhadap VHB telah dikembangkan dan digunakan di seluruh dunia, namun VHB tetap menyebar terutama di Asia dan Afrika (WHO 2002). Walaupun jumlah infeksi VHB akut telah menurun karena implementasi vaksin hepatisis B, namun diberbagai negara insiden kanker dan kematian terkait VHB dilaporkan meningkat (Gamoa 2008, Hatzakis 2011) hal ini mungkin terjadi karena adanya keterlambatan efek vaksinasi, meningkatnya keakuratan proses diagnosis, dan membaiknya proses pendataan kasus infeksi VHB (Maus et al. 2012).
Virus Hepatitis B termasuk kedalam hepadnaviridae yang memiliki spesifitas inang. Hepadnavirus dari manusia dan satwa primata tingkat tinggi diperkirakan membentuk kelompok atau cluster virus-virus hepatitis B yang berkerabat cukup dekat (ICTVdB: The Universal Virus Database of the International Committee on Taxonomy of Viruses [http:/www.ictvdb.iacr.ac.uk/ Ictv/fr-index.html.]). Kemiripan yang dimiliki tersebut memberikan alternatif pengganti, misalnya pada penelitian yang bertujuan melakukan penapisan senyawa antiviral VHB manusia secara in vitro dapat menggunakan sampel VHB asal satwa primata. Tingkat infeksi VHB yang efisien telah didokumentasikan pada simpanse (Cao et al. 2003). Akan tetapi penggunaan simpanse sebagai hewan uji coba memiliki berbagai kendala seperti biaya yang tinggi, jumlah hewan yang terbatas, serta peraturan yang ketat karena kelangkaan dan pertimbangan status konservasinya.
VHB pada cell line, sedangkan kultur primer hepatosit manusia sulit didapatkan, ditambah keadaan kualitas sel yang didapatkan dari operasi mempunyai variasi sangat tinggi (Galle et al. 1994). Oleh karena itu sistem alternatif dalam eksperimen untuk mempelajari infeksi VHB sangat dibutuhkan.
Penggunaan Tupaia belangeri sebagai hewan model menjadi salah satu alternatif terbaik. Infeksi VHB pada T. belangeri dapat dilakukan secara in vivo
dan in vitro untuk analisa serta pengamatan gejala klinis, aspek molekuler, dan siklus hidup virus yang mirip keadaannya dengan kasus infeksi VHB pada manusia (Walter et al. 1996; Guha et al. 2004). Walter et al. (1996) mengemukakan infeksi in vitro menggunakan kultur primer hepatosit Tupaia belangeri berhasil mensintesa DNA dan RNA VHB serta mensekresikan Hepatitis B surface antigen (HBsAg) dan Hepatitis B extracellular antigen (HbeAg) pada medium kultur. Hal ini membuktikan bahwa VHB dapat menginfeksi dan bereplikasi secara in vitro pada sel hepatosit T. belangeri.
Tupaia belangeri atau dikenal sebagai northern tree shrew merupakan hewan yang umum ditemukan di negara Thailand, Bangladesh, Burma, dan wilayah utara Asia seperti India, Nepal, dan Cina. Hewan ini mengindikasikan tingkat ketahanan stress yang rendah. Cao et al. (2003) melaporkan berbagai faktor seperti pengekangan fisik, perubahan lingkungan, rasa lapar dan haus, kondisi kandang yang kotor, serta kondisi psikososial dapat menjadi sumber penyebab stress bagi T. belangeri. Dalam jangka panjang efek dari stress pada hewan dapat menyebabkan perubahan perilaku, anatomi, sistem endokrin, dan mempengaruhi sistem respon kebal. Hal ini tentu menjadi salah satu kendala untuk bisa melakukan penelitian dengan menggunakan T. belangeri di Indonesia, yang harus mendatangkan hewan tersebut dari daerah asalnya.
Indonesia dengan keanekaragaman hayati yang tinggi juga memiliki salah satu spesies dari tupaia, yaitu T. javanica yang berasal dari satu genus yang sama dengan T. belangeri. Ketersediaan T. javanica menjadi alternatif pilihan untuk dapat mengembangkan penelitian VHB. Penggunaan T. javanica dalam penelitian VHB selama ini belum pernah dilaporkan. Kedekatan taksonomi yang dimiliki oleh kedua spesies tersebut menjadi salah satu alasan bagi peneliti untuk dapat menggali potensi T. javanica sebagai alternatif T. belangeri. Kultur primer hepatosit T. javanica yang dapat diinfeksi oleh VHB manusia dan satwa primata diharapkan dapat dikembangkan dan dihasilkan dari penelitian ini yang dapat digunakan sebagai sistem in vitro dalam pengujian diagnostik, pembuatan antigen, dan pengujian antiviral dari virus hepatitis B di Indonesia.
Tujuan
TINJAUAN PUSTAKA
Virus Hepatitis B
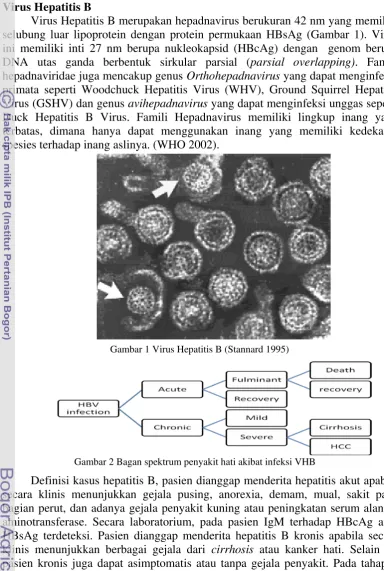
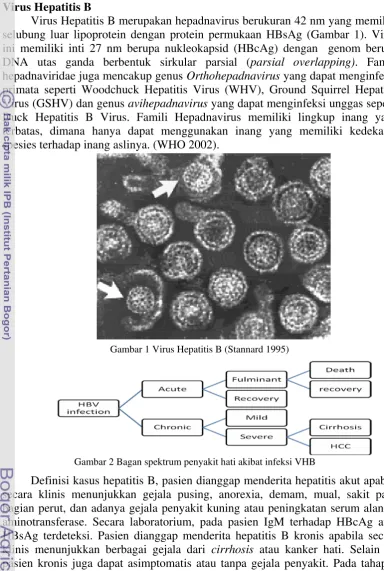
Virus Hepatitis B merupakan hepadnavirus berukuran 42 nm yang memiliki selubung luar lipoprotein dengan protein permukaan HBsAg (Gambar 1). Virus ini memiliki inti 27 nm berupa nukleokapsid (HBcAg) dengan genom berupa DNA utas ganda berbentuk sirkular parsial (parsial overlapping). Famili hepadnaviridae juga mencakup genus Orthohepadnavirus yang dapat menginfeksi primata seperti Woodchuck Hepatitis Virus (WHV), Ground Squirrel Hepatitis Virus (GSHV) dan genus avihepadnavirus yang dapat menginfeksi unggas seperti Duck Hepatitis B Virus. Famili Hepadnavirus memiliki lingkup inang yang terbatas, dimana hanya dapat menggunakan inang yang memiliki kedekatan spesies terhadap inang aslinya. (WHO 2002).
Gambar 1 Virus Hepatitis B (Stannard 1995)
Gambar 2 Bagan spektrum penyakit hati akibat infeksi VHB
Infeksi VHB umum terjadi pada masa kanak-kanak dan tidak menunjukkan gejala penyakit sampai ke tahapan karier kronis. Transmisi virus dapat terjadi melalui pertukaran cairan tubuh, tindakan seksual, dan penularan dari ibu yang positif ke anaknya pada saat proses melahirkan (WHO 2002).
Virus Hepatitis B menginfeksi sel dengan mediasi reseptor sel hepatosit, selanjutnya inti virus (DNA open circular) akan dipindah kedalam sel dan membentuk Covalently Closed Circular (cccDNA) dengan bantuan nuclear DNA repair enzymes. Tahapan selanjutnya genom VHB akan melakukan transkripsi 4 bagian secara overlap (P, C, S, dan X) dan kemudian dikeluarkan menuju sitoplasma untuk ditranslasikan menjadi protein virus.
Gen P mengkodekan DNA polymerase/reverse transcriptase, gen C mengkodekan protein inti (core), gen S mengkodekan protein permukaan (surface), dan protein X. Gen C terbagi menjadi pre-C dan C. Gen S terbagi menjadi region pre-S1, pre-S2, dan small S. Gen S memiliki peranan penting dalam proses infeksi VHB. Gen pre-S1 secara khusus berfungsi untuk mediasi pengikatan VHB pada sel hepatosit manusia (Glebe et. al 2003).
Hasil transkripsi gen P sebesar 3,5 kb membentuk enzim polimerase VHB, protein inti (HBc), protein precore, dan juga fragmen sebagai cetakan pRNA (pregenomic RNA, merupakan hasil transkripsi balik pada saat replikasi virus). Protein precore memiliki sekuen target untuk transportasi ke ER untuk proses lebih lanjut menjadi HbeAg. Hasil transkripsi gen S sebesar 2,4 kb dan 2,1 kb menghasilkan selubung luar serta protein permukaan HBs. Sedangkan penelitian pada Woodchuck Hepadna Virus mengindikasikan hasil transkripsi 0,7 kb berupa protein X berguna dalam proses inisiasi infeksi. (Guha 2004; Spandau 1988; Standring 1988; WHO 2002).
Tupaia sp.
Tupaia sp. merupakan hewan bukan pengerat yang memiliki kekerabatan yang dekat dengan primata. Termasuk dalam ordo Scandentia dan Famili Tupaiidae, hewan ini endemik pada daerah subtropikal dan tropikal seperti asia tenggara. Terdapat pada wilayah India sampai Philipina, Cina selatan hingga Jawa, Kalimantan, Sumatera, dan Bali. Habitat alaminya berapa pada hutan tropis dan area perkebunan (Kock et al 2001).
Pada infeksi in vivo, VHB dapat melakukan replikasi pada hati tupaia. Infeksi secara akut dapat dideteksi viremia dan HbsAg, dan juga keberadaan antibodi terhadap HBeAg dan HBsAg. Kondisi ini menyerupai pada pasien infeksi akut yang diderita oleh manusia. Lebih lanjut imunisasi dengan vaksin VHB dapat mencegah 88% infeksi VHB eksperimental. Pada kasus kronis peneliti menemukan induksi pembentukan HCC (Guha 2004). Selain secara in vivo, kultur primer hepatositnya mudah disiapkan dengan metode perfusi (Kock et al 2001).
Virus Hepatitis B dapat menginfeksi sel primer hepatosit hasil isolasi hati tupaia, sehingga dihasilkan cccDNA dan mRNA dan sekresi HBsAg dan HbeAg pada media kultur. Proses awal infeksi VHB pada sel primer hepatosit tupaia (PTH) sangat menyerupai proses infeksi pada sel hepatosit manusia (Glebe et al
Kultur Primer
METODOLOGI
Penelitian isolasi dan deteksi virus hepatitis B asal manusia dan satwa primata pada kultur primer hepatosit T. javanica dilakukan selama 8 bulan dimulai dari Maret 2012 sampai bulan Desember 2012. Tempat penelitian adalah fasilitas Laboratorium Mikrobiologi dan Imunologi, Pusat Studi Satwa Primata LPPM-IPB, Jalan Lodaya II nomor 5, Bogor.
Bahan
Bahan penelitian yang digunakan antara lain sel hepatosit yang diisolasi dari organ hati T. javanica. Sampel virus menggunakan VHB asal manusia serta VHB asal Owa (Hylobates moloch). Sampel virus yang digunakan berasal dari koleksi Pusat Studi Satwa Primata, IPB. Pada reaksi Polymerase Chain Reaction (PCR) dan real time PCR digunakan primer hepB-SF1 dengan sekuen 5’-TGYGGGTCACCWTATTCTTG GG-3’ dan hepB-SRout yang memiliki sekuen 5’-CACTGTTCCTGAACTGGA GC-3’. IQ5 Sybr green master mix, asam askorbat, Ethidium Bromida, gel agarosa 2%, dan larutan penyangga Tris Acetate EDTA (TAE).
Media yang digunakan ialah larutan Phosphate Buffer Saline (PBS), Dulbecco’s Modified Eagles Medium (DMEM) (Invitrogen, USA; cat# 11965-092), larutan penyangga pra-perfusi berisi Hanks Balanced Salt Solution
(Invitrogen cat#14170-112); 5mM EGTA; 0,25 µg/ml amphotericin B, larutan perfusi berisi DMEM; 100x CaCl2; 1% kolagenase tipe II, Tupaia plating media
berisi 500 ml William E media (invitrogen cat# 12551-032); 5% Fetal Bovine Serum; 5 µg/ml insulin; 5 µg/ml transferrin; 5 µg/ml sodium selenite; 0,25 µg/ml amphotericin B; dan 1% Penicillin streptomicin. Tupaia maintenance media berisi 500 ml William E media (invitrogen cat# 12551-032); 0,1% Bovine Serum Albumin; 5 µg/ml insulin; 5 µg/ml transferrin; 5 µg/ml sodium selenite; 0,25 µg/ml amphotericin B; 1% Penicillin streptomicin; 50 µM hydrocortisone (sigma); dan 0,1 µM dexamethasone (sigma). Tupaia infection media berisi 500 ml William E media (invitrogen cat# 12551-032); 0,1% Bovine Serum Albumin; 2% Dimethyl Sulfoxide; 0,25 µg/ml amphotericin B; dan 1% Penicillin streptomicin.
Alat
Analisa semi kuantitatif real time PCR menggunakan mesin IQ5 Multicolor Real Time PCR Detection System dari Biorad.
Metode Isolasi Kultur Primer Hepatosit T. Javanica
Metode isolasi mengacu pada Glebe et al. (2003). Daerah diatas situs pemotongan dijepit, lalu secara perlahan dimasukan syringe pada pembuluh portal hati. Pembilasan sel darah merah dari organ hati dilakukan secara perlahan dengan menggunakan larutan DMEM yang telah dihangatkan. Pembilasan berhasil ditandai dengan perubahan warna organ hati menjadi lebih cerah. Organ hati tanpa kantung empedu dapat dipindahkan ke cawan petri.
Organ hati diperfusi menggunakan larutan penyangga pra-perfusi menggunakan syringe dengan kecepatan 10 ml/menit selama 10-15 menit. Selanjutnya digunakan larutan perfusi selama 15 menit. Larutan diresirkulasi sampai hati menjadi semi padat. Organ lalu dicacah dan dipindahkan dalam flask
berisi larutan penyangga perfusi. Sel diinkubasi pada suhu 37°C dan digoyangkan selama 5-10 menit. Larutan kemudian disaring perlahan dengan menggunakan
gauze mesh (pori 75 µm). Larutan dipindahkan kedalam tabung falcon 50 ml. Tabung lalu disentrifugasi pada 300-500 g selama 5 menit untuk mendapatkan pelet sel. Supernatan dibuang secara perlahan dan pelet diresuspensi dengan larutan DMEM. Pencucian dengan larutan DMEM dilakukan kembali.
Sel lalu diresuspensi dengan menggunakan tupaia plating media. Penghitungan viabilitas sel dilakukan dengan menggunakan asam askorbat dan haemocytometer. Sel diinkubasi dengan konsentrasi 2,5x105 sel pada 6-well dish
(yang telah dilapisi dengan kolagen) berisi 2 ml tupaia plating media. Sel kemudian diinkubasi pada 37°C 5% CO2 semalam untuk melekatkan sel pada
dinding 6-well dish. Media diganti dengan tupaia maintenance media untuk membuang sel-sel yang mati yang tidak berikatan dengan dinding petri. Sel dinkubasi pada 37°C 5% CO2.
Sampel Virus Hepatitis B
Virus yang digunakan sebagai inokulan merupakan VHB asal manusia serta VHB asal owa (Hylobates moloch). Seluruh virus yang digunakan berasal dari koleksi Pusat Studi Satwa Primata, IPB.
Infeksi Virus Pada Kultur Primer Hepatosit
Prosedur mengacu pada Glebe et al. (2003). Larutan media pada sel dibuang dan ditambahkan larutan inokulan. Sel diinkubasi selama semalam. Setelah infeksi, media dibuang, lalu kultur dibilas dengan tupaia maintenance media,
selanjutnya kembali ditambahkan tupaia maintenance media.
Penggambilan 500 µl supernatan media sebagai sampel dilakukan setiap hari kemudian ditambahkan kembali 500 µl tupaia maintenance media kedalam kultur primer hepatosit. Sampel supernatan media disimpan untuk analisa lebih lanjut. Produk VHB yang terdapat pada supernatan akan tetap stabil selama beberapa bulan dengan penyimpanan pada suhu 4°C. Pengujian VHB pada sampel supernatan dilakukan denganPCR regio pre-S1 dan real time PCR.
Amplifikasi DNA VHB Pada Supernatan Untuk Sekuen Regio Pre-S1
Amplifikasi DNA menggunakan metode PCR dilakukan dengan menggunakan DNA sampel yang diekstraksi dari supernatan. Proses ekstraksi menggunakan kit Dneasy blood and tissue (Qiagen cat. 69504).
5’-TGYGGGTCACCWTATTCTTGGG-3’ dan hepB-SRout yang memiliki sekuen 5’-CACTGTTCCTGAACTGGAGC-3’. Pasangan primer tersebut memiliki target produk kurang lebih 455 pasang basa. Primer yang digunakan merupakan
degenerate primer, yang diharapkan mampu mengamplifikasi situs pre-S1 VHB asal manusia maupun owa. Reaksi PCR terdiri atas 1 µl primer hepB-SF1 dan hepB-SRout, 12,5 µl go taq mastermix (promega), 5,5 µl nuclease freewater, dan 5 µl DNA sampel.
Pada tahap awal dilakukan pre-PCR pada suhu 94°C selama 5 menit. Tahapan selanjutnya adalah PCR yang terdiri atas denaturasi pada suhu 94°C selama 30 detik, anealing pada suhu 52°C selama 30 detik, dan elongasi pada suhu 72°C selama 30 detik. Siklus PCR dilakukan sebanyak 45 kali. Tahap akhir post-PCR pada suhu 72°C selama 10 menit.
Produk PCR dielektroforesis pada gel agarosa 2% yang mengandung ethidium bromida 0,1 µg/ml dalam larutan penyangga TAE menggunakan elektroforesis horizontal. Penanda DNA 1 kb dan hasil PCR dimasukkan ke dalam sumur gel. Alat dokumentasi Gel Doc digunakan untuk visualisasi hasil elektroforesis.
Real Time PCR
Amplifikasi dilakukan menggunakan reaksi PCR yang terdiri atas 12,5 µl IQ sybergreenmastermix (Biorad), 1 µl primer hepB-SF1 dan hepB-SRout, 5,5 µl
HASIL DAN PEMBAHASAN
Isolasi Kultur Primer Hepatosit T. Javanica
Sel hati dari T. javanica telah berhasil dikulturkan in vitro. Secara umum sel hepatosit berbentuk poligonal memiliki satu atau lebih inti sel yang dapat diamati, namun kultur primer hepatosit yang didapatkan bermorfologi bulat (Gambar 3). Proses isolasi yang kurang optimum dapat menjadi penyebab kualitas kultur primer hepatosit kurang baik. Selain itu beberapa faktor yang dapat mempengaruhi kualitas kultur primer antara lain ialah jenis spesies, umur dan status kesehatan hewan yang digunakan, tipe jaringan yang digunakan, metode disagregasi, jenis media, serta kondisi inkubasi dan pemeliharaan kultur primer (Bird & Forrester 1981).
Selain itu penggunaan 6-well dish yang telah dilapisi dengan kolagen, menggantikan kolagen segar dapat menjadi salah satu kemungkinan penyebab kultur primer hepatosit tidak dapat berkembang dengan baik. Hasil pengamatan kultur primer hepatosit T. javanica memiliki viabilitas yang dapat dijaga >3 bulan menggunakan tupaia maintenance media. Kemampuan viabilitas kultur primer hepatosit >1 bulan juga terlah dilaporkan oleh Glebe et al. (2003)
Gambar 3 Morfologi kultur primer hepatosit T. javanica (A) hari 6 perbesaran 10x8; (B) hari 15 perbesaran 10x8
Infeksi Virus Pada Kultur Primer Hepatosit
Kultur primer hepatosit T. javanica diinfeksikan menggunakan koleksi VHB yang berasal dari owa dan manusia. Kuantifikasi VHB dilakukan dengan mengukur titer HBsAg pada masing-masing sampel VHB. Uji serologi dilakukan sebagai metode alternatif kuantifikasi VHB dikarenakan keterbatasan koleksi sampel yang dimiliki. Analisa dilakukan dengan mengirimkan sampel pada laboratorium Prodia. Pada sampel VHB asal satwa primata didapatkan titer HBsAg 60.789,04 IU/ml. Pada sampel VHB asal manusia titer HBsAg yang didapatkan berada dibawah ambang batas minimum deteksi (<0,05 IU/ml) namun hasil analisa molekuler membuktikan terdapat VHB pada sampel. HBsAg merupakan salah satu dari beberapa marka (anti-HBs, HBcAg, anti-Hbc, HBeAg, anti-HBe) yang digunakan dalam mendiagnosa pasien yang terinfeksi hepatitis B secara serologis. Keberadaan HBsAg pada pasien bergantung pada kondisi dan tahapan infeksi VHB (WHO 2002).
tupaia infecton media. Perlakuan kontrol negatif dilabel dengan huruf K. Kultur primer hepatosit yang diinfeksikan dengan VHB asal owa dilabel dengan huruf J sedangkan kultur yang diinfeksikan dengan VHB asal manusia dilabel dengan huruf H. Tahapan pembilasan dengan tupaia maintenance media dilakukan untuk mencuci kultur primer hepatosit dari sisa-sisa virus yang tidak menginfeksi sel.
Hasil pengamatan selama 15 hari pada kultur primer hepatosit yang terinfeksi tidak memperlihatkan perubahan morfologi (Gambar 4). Pengumpulan sampel dilakukan dengan menggumpulkan 500 µl supernatan media pada masing-masing perlakuan.
Gambar 4 Morfologi kultur primer hepatosit T. javanica terinfeksi (A) Sebelum infeksi perbesaran 10x8; (B) hari ketujuh sesudah infeksi perbesaran 10x10
Deteksi Infeksi Dan Replikasi VHB
Pada visualisasi hasil PCR dengan elektroforesis gel agarosa, digunakan kontrol positif berupa DNA VHB asal owa dan manusia dari koleksi Pusat Studi Satwa Primata, IPB. Sekuen regio pre-S1 VHB menghasilkan amplikon berukuran 455 pasang basa.
Pada Gambar 5 diamati perlakuan kontrol negatif sampel hari pertama (K1), ketujuh (K7), dan kelima belas (K15) tidak didapatkan pita DNA. Pada perlakuan infeksi dengan VHB owa (J) didapatkan pita DNA berukuran ±450 pasang basa yang tebal pada sampel hari pertama (J1), ketujuh (J7), dan kelima belas (J15). Hal ini menunjukkan bahwa VHB asal owa dapat menginfeksi dan bereplikasi pada kultur primer hepatosit T. javanica.
Pada perlakuan infeksi dengan VHB manusia (H) didapatkan pita DNA tipis berukuran ±450 pasang basa pada sampel hari ketujuh (H7), namun tidak didapatkan pita DNA pada sampel hari pertama (H1) dan hari kelima belas (H15) (Gambar 5). Hasil positif berupa pita pada hari ketujuh (H7) menunjukkan bahwa VHB asal manusia dapat menginfeksi dan bereplikasi pada kultur primer hepatosit
T. javanica. Analisa HBsAg yang dilakukan pada inokulan VHB H berada dibawah ambang batas deteksi (<0,05 IU/ml). Keberadaan HBsAg dalam seruma atau plasma mengindikasikan adanya infeksi VHB, namun deteksi HBsAg tidak memberikan secara nyata informasi aktivitas proses replikasi virus (Zaaijer HL et al. 1994). Selain itu, viremia pada pasien bervariasi antar pasien dan DNA VHB pada serum pasien yang sama dapat berfluktuasi dari tidak terdeteksi hingga 10 log10 IU/ml (Chu 2002). Dengan konsentrasi inokulan yang kecil, VHB asal
(H1). Sampel ini memerlukan waktu replikasi yang lebih lama untuk mencapai konsentrasi yang dapat dideteksi.
Perbedaan ketebalan pita pada Gambar 5 menunjukkan korelasi antara konsentrasi VHB pada sampel awal sebelum diinfeksikan dengan hasil replikasi pada kultur primer hepatosit. Virus hepatitis B asal satwa primata dengan titer HBsAg 60.789,04 IU/ml memiliki konsentrasi akhir VHB yang lebih tinggi daripada VHB asal manusia. Pada sampel VHB asal manusia dengan konsentrasi awal HBsAg yang lebih rendah, didapatkan hasil PCR hari pertama negatif. Hal ini menunjukkan konsentrasi VHB awal yang rendah dan tidak dapat terdeteksi sebelum sampel bereplikasi pada kultur primer hepatosit sampai hari ketujuh. Dalam penelitiannya Tuaillon et al.(2012) juga menyatakan adanya korelasi yang lemah antara titer HBsAg dengan DNA VHB pada sampel.
\
Gambar 5 Deteksi infeksi dan replikasi VHB. M : marker 1 kb ladder, K: kontrol negatif, J: VHB asal owa, H: VHB asal manusia
Proses infeksi VHB pada kultur serta uji molekuler yang dilakukan dapat memberikan diagnosa yang lebih akurat dalam mendeteksi keberadaan VHB pada sampel dibandingkan dengan uji serologis yang umum digunakan pada diagnosa pasien terinfeksi VHB, yang diketahui memiliki variasi gejala klinis serta waktu inkubasi in vivo yang panjang. Akan tetapi pertimbangan biaya serta waktu yang diperlukan menjadi faktor kelemahan metode ini dibandingkan dengan uji serologis yang ada.
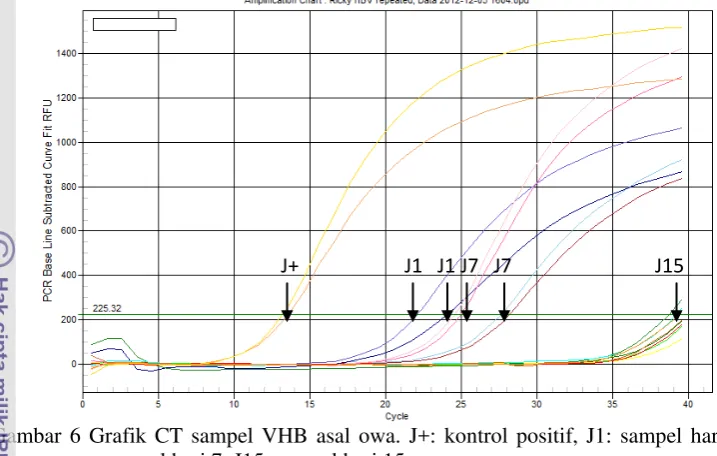
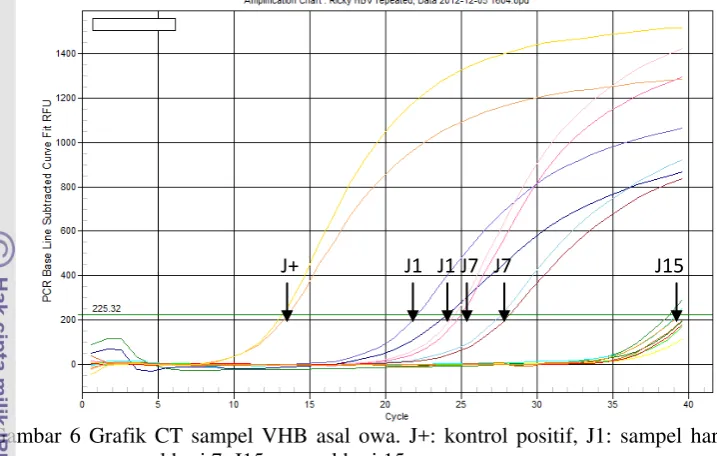
Data CT yang diperoleh pada sampel owa menunjukkan penurunan CT seiring hari pengambilan sampel (Tabel 1 dan Gambar 6). Hari pertama didapatkan data pada 24,05 dan 22,08 sedangkan pada hari ketujuh 24,97 dan 24,61. Pada hari kelima belas pada 27,65 dan 28,19. Pada Kontrol positif owa didapatkan CT pada 13,58 dan 13,19.
Pada sampel VHB asal manusia didapatkan nilai CT negatif di hari pertama, pada hari ketujuh 38,31 dan 38,40 serta pada hari kelima belas negatif. Untuk kontrol positif didapatkan data CT pada 17,79 dan 16,84 (Tabel 1 dan Gambar 7). Hasil ini menunjukkan terjadinya proses replikasi VHB pada kultur primer hepatosit T. javanica.
Glebe et al. (2003) melaporkan infeksi kultur primer hepatosit T. belangeri
peningkatan konsentrasi HBeAg dan HBsAg dimulai pada hari keenam, yang menandakan terjadinya replikasi VHB pada sel. Dalam penelitiannya Walter et al.
(1996) juga mengemukakan infeksi in vitro menggunakan kultur primer hepatosit
T. belangeri mensekresikan HBsAg sejak hari ketiga setelah infeksi dan HBeAg pada hari kelima setelah infeksi.
Tabel 1 CT real time PCR kultur primer hepatosit Tupaia javanica Sampel 1 2
NTC - -
K1 - -
K7 - -
K15 - -
J+ 13,58 13,19 J1 24,05 22,08 J7 24,97 24,61 J15 27,65 28,19 H+ 17,79 16,84
H1 - -
H7 38,31 38,40
Gambar 6 Grafik CT sampel VHB asal owa. J+: kontrol positif, J1: sampel hari 1, J7: sampel hari 7, J15: sampel hari 15
Gambar 7 Grafik CT hasil real time PCR sampel VHB asal manusia. H+: kontrol positif, H1: sampel hari 1, H7: sampel hari 7, H15: sampel hari 15
Kemampuan VHB asal owa dan manusia dalam menginfeksi dan bereplikasi menunjukkan kesamaan situs pengenalan reseptor kedua virus tersebut pada kultur primer hepatosit T. javanica. Antigen pre-S1 VHB merupakan salah satu protein yang penting dalam proses infeksi, namun konfirmasi reseptor serta situs pengenalan spesifik pada sel hepatosit belum diverifikasi (Glebe et al. 2003; Xie
et al. 2010). Selain itu analisa filogenetik yang dilakukan oleh Warren et al.(1999) menunjukkan bahwa HBV asal owa memiliki kekerabatan paling dengan VHB genotype C, yang terdistribusi di daerah Asia Tenggara, apabila dibandingkan dengan genotipe VHB lainnya. Hal ini diduga karena terjadi transmisi antar spesies oleh hepadnavirus pada satu daerah geografis.
J+ J1 J1 J7 J7 J15
SIMPULAN DAN SARAN
Simpulan
Sel hepatosit dari hati T. javanica telah berhasil dikulturkan secara in vitro. Dari hasil inokulasi VHB pada kultur primer hepatosit yang telah dilakukan diperoleh kesimpulan bahwa VHB asal manusia dan owa dapat menginfeksi dan bereplikasi pada kultur primer hepatosit T. javanica. Hasil visualisasi PCR yang telah dilakukan serta data CT yang didapatkan memberikan gambaran data semi kuantitatif bahwa replikasi VHB pada kultur primer hepatosit T. javanica. Hasil tersebut menunjukkan kultur primer hepatosit T. javanica dapat digunakan sebagai model in vitro VHB yang kompeten.
Saran
Kemampuan VHB menginfeksi kultur primer hepatosit T. javanica
memberikan alternatif penelitian VHB di Indonesia. Hasil ini memungkinkan penggunaan T. javanica sebagai hewan model dalam penelitian VHB meningkat. Walaupun T. javanica bersifat endemik dengan status konservasi yang tidak dilindung, proses penangkaran T. javanica sebaiknya dilakukan untuk menjaga kelestarian hewan tersebut di alam. Untuk mendapatkan kualitas sel hepatosit primer yang lebih baik diperlukan modifikasi metode isolasi serta metode kultur sel primer hepatosit.
DAFTAR PUSTAKA
Alberti A, Diana S, Eddleston AL, Williams R. 1979. Changes in hepatitis B virus DNA polymerase in relation to the outcome of acute hepatitis B. Gut.
20:190-195
Bird BR, Forrester FT. 1981. Basic laboratory tehniques in cell culture. Georgia (USA): CDC
Cao J, Yang EB, Su JJ, Li Y, Chow P. 2003. The tree shrews:, adjuncts and alternatives to primates as models for biomedical research. J Med Primatol. 32: 123-130.
CDC. 2009. Viral Hepatitis Surveillance. United States.
CDC. 2011. Viral Hepatitis Statistics and Surveillance. April 2012]
Chu CJ, Lok AS. 2002. Clinical utility in quantifying serum HBV DNA levels using PCR assays. J. Hepatol. 36:549-551
Creati M, Saleh A, Ruff TA, Stewart T, Otto B, Sutanto A, Clement CJ. 2007. Implementing the birthdose of hepatitis B vaccine in rural Indonesia.
Vaccine 25:5984-5993
El-serag HB. 2001. Epidemiology of hepatocellular carcinoma. Clin Liver Dis. 5:87-107
Freshney RI. 1994. Culture of animal cells: a manual of basic techniques. New Jersey (USA): John Wiley & Sons, Inc. 5th ed.
Galle PR, Hagelstein J, Kommerell B, Volkmann M, Schranz P, Zentgraf H. 1994. In vitro experimental infection of primary human hepatocytes with hepatitis B virus. Gastroentology 106:664-673.
Glebe D, Aliakbari M, Krass P, Knoop EV, Valerius KP, Gerlich WH. 2003. Pre-S1 antigen-dependent infection of Tupaia hepatocyte cultures with human hepatitis B virus. J Virol. 77(17): 9511-9521.
Guha C, Mohan S, Chowdhury MR, Chowdhury JR. 2004. Cell culture and animal models of viral hepatitis. Part 1: Hepatitis B. Lab Anim. 33 (7): 37-46.
Gomoa AI, Khan SA, Toledon MB, Waked I, Taylor-Robinson SD. 2008. Hepatocellular carcinoma: epidemiology, risk factor, and pathogenesis.
World. J. Gastroenterol. 14:4300-4308
Kock J, Nassal M, MacNelly S, Baumert TF, Blum HE, Weizsacker FV. 2001. Efficient infection of primary tupaia hepatocytes with purified human and wolly monkey hepatitis B virus. J Virol. 75 (11): 5084-5089.
Mauss S, Berg T, Rockstroh J, Sarrozin V, Wedemeyer H. 2012. Hepatology: a clinical textbook. Germany: Flying Publisher. 3rd ed.
Spandau DF, Lee CH. 1988. Trans-activation of viral enhancers by the hepatitis B virus x protein. J Virol 62(2): 427-434
Standring DN, Ou JH, Masiarz FR, Rutter WJ. 1988. A signal peptide encode within the precore region of hepatitis B virus directs the secretion of a heterogeous population of e antigens in Xenopus oocytes. Proc Natl Acad Sci USA. 85(22): 8405-8409
Stannard LM. 1995. Hepatitis B.
Tuaillon E, Mondain AM, Nagot N, Ottomani L, Kania D, Nogue E, Rubbo PA, Pageaux GP, Perre PVD, Ducos J. 2012. Comparison of serum HBsAg quantification by four immunoassays, and relationdhips of HBsAg level with HBV replication and HBV genotypes. Plos one 7(3): e32143
Walter R, Keist R, Niederost B, Pult I, Blum HE. 1996. Hepatitis B virus infection of tupaia hepatocytes in vitro and in vivo. Hepatology 24(1):1-5.
Warren KS, Heeney JL, Swan RA, Heriyanto, Verschoor EJ. 1999. A new group of Hepadnaviruses naturally infecting orangutans (Pongo pygmaeus). J Virol 73(9):7860-7865.
WHO. 2002. Hepatitis B. Geneva.
Xie Y, Zhai J, Deng Q, Tiollais P, Wang Y, Zhao M. 2010. Entry of hepatitis B virus: mechanism and new therapeutic target. Pathologie Biologie 58:301-307.
Zaaijer HL, Borg FT, Cuypers TM, Hermus MCAH, Lelie PN. 1994. Comparison of methods for detection of hepatitis B virus DNA. J. Clin. Microbiol.
RIWAYAT HIDUP
PENDAHULUAN
Latar Belakang
Saat ini lebih dari 2 milyar orang telah terinfeksi virus hepatitis B (VHB) dalam periode tertentu hidupnya. Sekitar 250 juta diantaranya masih terinfeksi dan menjadi karier. Setiap tahunnya terdapat 4 juta kasus akut hepatitis B dan sekitar 1 juta orang meninggal akibat hepatitis kronis, cirrhosis, ataupun kanker hati (El-serag 2001; WHO 2002). Centers for Disease Control and Prevention
(2011) melaporkan 3.371 kasus hepatitis B akut (1,1 kasus per 100.000 populasi) pada tahun 2009 di Amerika, dengan angka kematian sebesar 1.900 pasien. Indonesia merupakan daerah endemik infeksi VHB dengan tingkat karier 5-20% pada masyakarat umum (Creati et al. 2007).
Hepatitis ialah kondisi inflamasi pada organ hati disebabkan oleh berbagai jenis agen penyebab infeksi, alkohol, obat-obatan, dan penyakit autoimmune. Kasus hepatitis tertinggi disebabkan oleh virus, antara lain virus Hepatitis A, B, C, D, dan E. Diantara virus penyebab hepatitis, virus hepatitis B (VHB) merupakan yang tertinggi (WHO 2002). Sebagai negara berkembang dengan iklim tropis, Indonesia merupakan negara endemik terhadap berbagai jenis penyakit infeksius, termasuk salah satunya hepatitis yang disebabkan oleh VHB. Infeksi VHB pada tahap lanjut (kronis) dapat menyebabkan kegagalan hati, cirrhosis, dan
Hepatocellular Carcinoma (HCC) (Alberti et al. 1979). Infeksi VHB telah menjadi salah satu permasalahan kesehatan di berbagai penjuru dunia, terlebih lagi pasien hepatitis memiliki gejala klinis yang bervariasi. Walaupun vaksin terhadap VHB telah dikembangkan dan digunakan di seluruh dunia, namun VHB tetap menyebar terutama di Asia dan Afrika (WHO 2002). Walaupun jumlah infeksi VHB akut telah menurun karena implementasi vaksin hepatisis B, namun diberbagai negara insiden kanker dan kematian terkait VHB dilaporkan meningkat (Gamoa 2008, Hatzakis 2011) hal ini mungkin terjadi karena adanya keterlambatan efek vaksinasi, meningkatnya keakuratan proses diagnosis, dan membaiknya proses pendataan kasus infeksi VHB (Maus et al. 2012).
Virus Hepatitis B termasuk kedalam hepadnaviridae yang memiliki spesifitas inang. Hepadnavirus dari manusia dan satwa primata tingkat tinggi diperkirakan membentuk kelompok atau cluster virus-virus hepatitis B yang berkerabat cukup dekat (ICTVdB: The Universal Virus Database of the International Committee on Taxonomy of Viruses [http:/www.ictvdb.iacr.ac.uk/ Ictv/fr-index.html.]). Kemiripan yang dimiliki tersebut memberikan alternatif pengganti, misalnya pada penelitian yang bertujuan melakukan penapisan senyawa antiviral VHB manusia secara in vitro dapat menggunakan sampel VHB asal satwa primata. Tingkat infeksi VHB yang efisien telah didokumentasikan pada simpanse (Cao et al. 2003). Akan tetapi penggunaan simpanse sebagai hewan uji coba memiliki berbagai kendala seperti biaya yang tinggi, jumlah hewan yang terbatas, serta peraturan yang ketat karena kelangkaan dan pertimbangan status konservasinya.
VHB pada cell line, sedangkan kultur primer hepatosit manusia sulit didapatkan, ditambah keadaan kualitas sel yang didapatkan dari operasi mempunyai variasi sangat tinggi (Galle et al. 1994). Oleh karena itu sistem alternatif dalam eksperimen untuk mempelajari infeksi VHB sangat dibutuhkan.
Penggunaan Tupaia belangeri sebagai hewan model menjadi salah satu alternatif terbaik. Infeksi VHB pada T. belangeri dapat dilakukan secara in vivo
dan in vitro untuk analisa serta pengamatan gejala klinis, aspek molekuler, dan siklus hidup virus yang mirip keadaannya dengan kasus infeksi VHB pada manusia (Walter et al. 1996; Guha et al. 2004). Walter et al. (1996) mengemukakan infeksi in vitro menggunakan kultur primer hepatosit Tupaia belangeri berhasil mensintesa DNA dan RNA VHB serta mensekresikan Hepatitis B surface antigen (HBsAg) dan Hepatitis B extracellular antigen (HbeAg) pada medium kultur. Hal ini membuktikan bahwa VHB dapat menginfeksi dan bereplikasi secara in vitro pada sel hepatosit T. belangeri.
Tupaia belangeri atau dikenal sebagai northern tree shrew merupakan hewan yang umum ditemukan di negara Thailand, Bangladesh, Burma, dan wilayah utara Asia seperti India, Nepal, dan Cina. Hewan ini mengindikasikan tingkat ketahanan stress yang rendah. Cao et al. (2003) melaporkan berbagai faktor seperti pengekangan fisik, perubahan lingkungan, rasa lapar dan haus, kondisi kandang yang kotor, serta kondisi psikososial dapat menjadi sumber penyebab stress bagi T. belangeri. Dalam jangka panjang efek dari stress pada hewan dapat menyebabkan perubahan perilaku, anatomi, sistem endokrin, dan mempengaruhi sistem respon kebal. Hal ini tentu menjadi salah satu kendala untuk bisa melakukan penelitian dengan menggunakan T. belangeri di Indonesia, yang harus mendatangkan hewan tersebut dari daerah asalnya.
Indonesia dengan keanekaragaman hayati yang tinggi juga memiliki salah satu spesies dari tupaia, yaitu T. javanica yang berasal dari satu genus yang sama dengan T. belangeri. Ketersediaan T. javanica menjadi alternatif pilihan untuk dapat mengembangkan penelitian VHB. Penggunaan T. javanica dalam penelitian VHB selama ini belum pernah dilaporkan. Kedekatan taksonomi yang dimiliki oleh kedua spesies tersebut menjadi salah satu alasan bagi peneliti untuk dapat menggali potensi T. javanica sebagai alternatif T. belangeri. Kultur primer hepatosit T. javanica yang dapat diinfeksi oleh VHB manusia dan satwa primata diharapkan dapat dikembangkan dan dihasilkan dari penelitian ini yang dapat digunakan sebagai sistem in vitro dalam pengujian diagnostik, pembuatan antigen, dan pengujian antiviral dari virus hepatitis B di Indonesia.
Tujuan
TINJAUAN PUSTAKA
Virus Hepatitis B
Virus Hepatitis B merupakan hepadnavirus berukuran 42 nm yang memiliki selubung luar lipoprotein dengan protein permukaan HBsAg (Gambar 1). Virus ini memiliki inti 27 nm berupa nukleokapsid (HBcAg) dengan genom berupa DNA utas ganda berbentuk sirkular parsial (parsial overlapping). Famili hepadnaviridae juga mencakup genus Orthohepadnavirus yang dapat menginfeksi primata seperti Woodchuck Hepatitis Virus (WHV), Ground Squirrel Hepatitis Virus (GSHV) dan genus avihepadnavirus yang dapat menginfeksi unggas seperti Duck Hepatitis B Virus. Famili Hepadnavirus memiliki lingkup inang yang terbatas, dimana hanya dapat menggunakan inang yang memiliki kedekatan spesies terhadap inang aslinya. (WHO 2002).
Gambar 1 Virus Hepatitis B (Stannard 1995)
Gambar 2 Bagan spektrum penyakit hati akibat infeksi VHB
Infeksi VHB umum terjadi pada masa kanak-kanak dan tidak menunjukkan gejala penyakit sampai ke tahapan karier kronis. Transmisi virus dapat terjadi melalui pertukaran cairan tubuh, tindakan seksual, dan penularan dari ibu yang positif ke anaknya pada saat proses melahirkan (WHO 2002).
Virus Hepatitis B menginfeksi sel dengan mediasi reseptor sel hepatosit, selanjutnya inti virus (DNA open circular) akan dipindah kedalam sel dan membentuk Covalently Closed Circular (cccDNA) dengan bantuan nuclear DNA repair enzymes. Tahapan selanjutnya genom VHB akan melakukan transkripsi 4 bagian secara overlap (P, C, S, dan X) dan kemudian dikeluarkan menuju sitoplasma untuk ditranslasikan menjadi protein virus.
Gen P mengkodekan DNA polymerase/reverse transcriptase, gen C mengkodekan protein inti (core), gen S mengkodekan protein permukaan (surface), dan protein X. Gen C terbagi menjadi pre-C dan C. Gen S terbagi menjadi region pre-S1, pre-S2, dan small S. Gen S memiliki peranan penting dalam proses infeksi VHB. Gen pre-S1 secara khusus berfungsi untuk mediasi pengikatan VHB pada sel hepatosit manusia (Glebe et. al 2003).
Hasil transkripsi gen P sebesar 3,5 kb membentuk enzim polimerase VHB, protein inti (HBc), protein precore, dan juga fragmen sebagai cetakan pRNA (pregenomic RNA, merupakan hasil transkripsi balik pada saat replikasi virus). Protein precore memiliki sekuen target untuk transportasi ke ER untuk proses lebih lanjut menjadi HbeAg. Hasil transkripsi gen S sebesar 2,4 kb dan 2,1 kb menghasilkan selubung luar serta protein permukaan HBs. Sedangkan penelitian pada Woodchuck Hepadna Virus mengindikasikan hasil transkripsi 0,7 kb berupa protein X berguna dalam proses inisiasi infeksi. (Guha 2004; Spandau 1988; Standring 1988; WHO 2002).
Tupaia sp.
Tupaia sp. merupakan hewan bukan pengerat yang memiliki kekerabatan yang dekat dengan primata. Termasuk dalam ordo Scandentia dan Famili Tupaiidae, hewan ini endemik pada daerah subtropikal dan tropikal seperti asia tenggara. Terdapat pada wilayah India sampai Philipina, Cina selatan hingga Jawa, Kalimantan, Sumatera, dan Bali. Habitat alaminya berapa pada hutan tropis dan area perkebunan (Kock et al 2001).
Pada infeksi in vivo, VHB dapat melakukan replikasi pada hati tupaia. Infeksi secara akut dapat dideteksi viremia dan HbsAg, dan juga keberadaan antibodi terhadap HBeAg dan HBsAg. Kondisi ini menyerupai pada pasien infeksi akut yang diderita oleh manusia. Lebih lanjut imunisasi dengan vaksin VHB dapat mencegah 88% infeksi VHB eksperimental. Pada kasus kronis peneliti menemukan induksi pembentukan HCC (Guha 2004). Selain secara in vivo, kultur primer hepatositnya mudah disiapkan dengan metode perfusi (Kock et al 2001).
Virus Hepatitis B dapat menginfeksi sel primer hepatosit hasil isolasi hati tupaia, sehingga dihasilkan cccDNA dan mRNA dan sekresi HBsAg dan HbeAg pada media kultur. Proses awal infeksi VHB pada sel primer hepatosit tupaia (PTH) sangat menyerupai proses infeksi pada sel hepatosit manusia (Glebe et al
Kultur Primer
METODOLOGI
Penelitian isolasi dan deteksi virus hepatitis B asal manusia dan satwa primata pada kultur primer hepatosit T. javanica dilakukan selama 8 bulan dimulai dari Maret 2012 sampai bulan Desember 2012. Tempat penelitian adalah fasilitas Laboratorium Mikrobiologi dan Imunologi, Pusat Studi Satwa Primata LPPM-IPB, Jalan Lodaya II nomor 5, Bogor.
Bahan
Bahan penelitian yang digunakan antara lain sel hepatosit yang diisolasi dari organ hati T. javanica. Sampel virus menggunakan VHB asal manusia serta VHB asal Owa (Hylobates moloch). Sampel virus yang digunakan berasal dari koleksi Pusat Studi Satwa Primata, IPB. Pada reaksi Polymerase Chain Reaction (PCR) dan real time PCR digunakan primer hepB-SF1 dengan sekuen 5’-TGYGGGTCACCWTATTCTTG GG-3’ dan hepB-SRout yang memiliki sekuen 5’-CACTGTTCCTGAACTGGA GC-3’. IQ5 Sybr green master mix, asam askorbat, Ethidium Bromida, gel agarosa 2%, dan larutan penyangga Tris Acetate EDTA (TAE).
Media yang digunakan ialah larutan Phosphate Buffer Saline (PBS), Dulbecco’s Modified Eagles Medium (DMEM) (Invitrogen, USA; cat# 11965-092), larutan penyangga pra-perfusi berisi Hanks Balanced Salt Solution
(Invitrogen cat#14170-112); 5mM EGTA; 0,25 µg/ml amphotericin B, larutan perfusi berisi DMEM; 100x CaCl2; 1% kolagenase tipe II, Tupaia plating media
berisi 500 ml William E media (invitrogen cat# 12551-032); 5% Fetal Bovine Serum; 5 µg/ml insulin; 5 µg/ml transferrin; 5 µg/ml sodium selenite; 0,25 µg/ml amphotericin B; dan 1% Penicillin streptomicin. Tupaia maintenance media berisi 500 ml William E media (invitrogen cat# 12551-032); 0,1% Bovine Serum Albumin; 5 µg/ml insulin; 5 µg/ml transferrin; 5 µg/ml sodium selenite; 0,25 µg/ml amphotericin B; 1% Penicillin streptomicin; 50 µM hydrocortisone (sigma); dan 0,1 µM dexamethasone (sigma). Tupaia infection media berisi 500 ml William E media (invitrogen cat# 12551-032); 0,1% Bovine Serum Albumin; 2% Dimethyl Sulfoxide; 0,25 µg/ml amphotericin B; dan 1% Penicillin streptomicin.
Alat
Analisa semi kuantitatif real time PCR menggunakan mesin IQ5 Multicolor Real Time PCR Detection System dari Biorad.
Metode Isolasi Kultur Primer Hepatosit T. Javanica
Metode isolasi mengacu pada Glebe et al. (2003). Daerah diatas situs pemotongan dijepit, lalu secara perlahan dimasukan syringe pada pembuluh portal hati. Pembilasan sel darah merah dari organ hati dilakukan secara perlahan dengan menggunakan larutan DMEM yang telah dihangatkan. Pembilasan berhasil ditandai dengan perubahan warna organ hati menjadi lebih cerah. Organ hati tanpa kantung empedu dapat dipindahkan ke cawan petri.
Organ hati diperfusi menggunakan larutan penyangga pra-perfusi menggunakan syringe dengan kecepatan 10 ml/menit selama 10-15 menit. Selanjutnya digunakan larutan perfusi selama 15 menit. Larutan diresirkulasi sampai hati menjadi semi padat. Organ lalu dicacah dan dipindahkan dalam flask
berisi larutan penyangga perfusi. Sel diinkubasi pada suhu 37°C dan digoyangkan selama 5-10 menit. Larutan kemudian disaring perlahan dengan menggunakan
gauze mesh (pori 75 µm). Larutan dipindahkan kedalam tabung falcon 50 ml. Tabung lalu disentrifugasi pada 300-500 g selama 5 menit untuk mendapatkan pelet sel. Supernatan dibuang secara perlahan dan pelet diresuspensi dengan larutan DMEM. Pencucian dengan larutan DMEM dilakukan kembali.
Sel lalu diresuspensi dengan menggunakan tupaia plating media. Penghitungan viabilitas sel dilakukan dengan menggunakan asam askorbat dan haemocytometer. Sel diinkubasi dengan konsentrasi 2,5x105 sel pada 6-well dish
(yang telah dilapisi dengan kolagen) berisi 2 ml tupaia plating media. Sel kemudian diinkubasi pada 37°C 5% CO2 semalam untuk melekatkan sel pada
dinding 6-well dish. Media diganti dengan tupaia maintenance media untuk membuang sel-sel yang mati yang tidak berikatan dengan dinding petri. Sel dinkubasi pada 37°C 5% CO2.
Sampel Virus Hepatitis B
Virus yang digunakan sebagai inokulan merupakan VHB asal manusia serta VHB asal owa (Hylobates moloch). Seluruh virus yang digunakan berasal dari koleksi Pusat Studi Satwa Primata, IPB.
Infeksi Virus Pada Kultur Primer Hepatosit
Prosedur mengacu pada Glebe et al. (2003). Larutan media pada sel dibuang dan ditambahkan larutan inokulan. Sel diinkubasi selama semalam. Setelah infeksi, media dibuang, lalu kultur dibilas dengan tupaia maintenance media,
selanjutnya kembali ditambahkan tupaia maintenance media.
Penggambilan 500 µl supernatan media sebagai sampel dilakukan setiap hari kemudian ditambahkan kembali 500 µl tupaia maintenance media kedalam kultur primer hepatosit. Sampel supernatan media disimpan untuk analisa lebih lanjut. Produk VHB yang terdapat pada supernatan akan tetap stabil selama beberapa bulan dengan penyimpanan pada suhu 4°C. Pengujian VHB pada sampel supernatan dilakukan denganPCR regio pre-S1 dan real time PCR.
Amplifikasi DNA VHB Pada Supernatan Untuk Sekuen Regio Pre-S1
Amplifikasi DNA menggunakan metode PCR dilakukan dengan menggunakan DNA sampel yang diekstraksi dari supernatan. Proses ekstraksi menggunakan kit Dneasy blood and tissue (Qiagen cat. 69504).
5’-TGYGGGTCACCWTATTCTTGGG-3’ dan hepB-SRout yang memiliki sekuen 5’-CACTGTTCCTGAACTGGAGC-3’. Pasangan primer tersebut memiliki target produk kurang lebih 455 pasang basa. Primer yang digunakan merupakan
degenerate primer, yang diharapkan mampu mengamplifikasi situs pre-S1 VHB asal manusia maupun owa. Reaksi PCR terdiri atas 1 µl primer hepB-SF1 dan hepB-SRout, 12,5 µl go taq mastermix (promega), 5,5 µl nuclease freewater, dan 5 µl DNA sampel.
Pada tahap awal dilakukan pre-PCR pada suhu 94°C selama 5 menit. Tahapan selanjutnya adalah PCR yang terdiri atas denaturasi pada suhu 94°C selama 30 detik, anealing pada suhu 52°C selama 30 detik, dan elongasi pada suhu 72°C selama 30 detik. Siklus PCR dilakukan sebanyak 45 kali. Tahap akhir post-PCR pada suhu 72°C selama 10 menit.
Produk PCR dielektroforesis pada gel agarosa 2% yang mengandung ethidium bromida 0,1 µg/ml dalam larutan penyangga TAE menggunakan elektroforesis horizontal. Penanda DNA 1 kb dan hasil PCR dimasukkan ke dalam sumur gel. Alat dokumentasi Gel Doc digunakan untuk visualisasi hasil elektroforesis.
Real Time PCR
Amplifikasi dilakukan menggunakan reaksi PCR yang terdiri atas 12,5 µl IQ sybergreenmastermix (Biorad), 1 µl primer hepB-SF1 dan hepB-SRout, 5,5 µl
HASIL DAN PEMBAHASAN
Isolasi Kultur Primer Hepatosit T. Javanica
Sel hati dari T. javanica telah berhasil dikulturkan in vitro. Secara umum sel hepatosit berbentuk poligonal memiliki satu atau lebih inti sel yang dapat diamati, namun kultur primer hepatosit yang didapatkan bermorfologi bulat (Gambar 3). Proses isolasi yang kurang optimum dapat menjadi penyebab kualitas kultur primer hepatosit kurang baik. Selain itu beberapa faktor yang dapat mempengaruhi kualitas kultur primer antara lain ialah jenis spesies, umur dan status kesehatan hewan yang digunakan, tipe jaringan yang digunakan, metode disagregasi, jenis media, serta kondisi inkubasi dan pemeliharaan kultur primer (Bird & Forrester 1981).
Selain itu penggunaan 6-well dish yang telah dilapisi dengan kolagen, menggantikan kolagen segar dapat menjadi salah satu kemungkinan penyebab kultur primer hepatosit tidak dapat berkembang dengan baik. Hasil pengamatan kultur primer hepatosit T. javanica memiliki viabilitas yang dapat dijaga >3 bulan menggunakan tupaia maintenance media. Kemampuan viabilitas kultur primer hepatosit >1 bulan juga terlah dilaporkan oleh Glebe et al. (2003)
Gambar 3 Morfologi kultur primer hepatosit T. javanica (A) hari 6 perbesaran 10x8; (B) hari 15 perbesaran 10x8
Infeksi Virus Pada Kultur Primer Hepatosit
Kultur primer hepatosit T. javanica diinfeksikan menggunakan koleksi VHB yang berasal dari owa dan manusia. Kuantifikasi VHB dilakukan dengan mengukur titer HBsAg pada masing-masing sampel VHB. Uji serologi dilakukan sebagai metode alternatif kuantifikasi VHB dikarenakan keterbatasan koleksi sampel yang dimiliki. Analisa dilakukan dengan mengirimkan sampel pada laboratorium Prodia. Pada sampel VHB asal satwa primata didapatkan titer HBsAg 60.789,04 IU/ml. Pada sampel VHB asal manusia titer HBsAg yang didapatkan berada dibawah ambang batas minimum deteksi (<0,05 IU/ml) namun hasil analisa molekuler membuktikan terdapat VHB pada sampel. HBsAg merupakan salah satu dari beberapa marka (anti-HBs, HBcAg, anti-Hbc, HBeAg, anti-HBe) yang digunakan dalam mendiagnosa pasien yang terinfeksi hepatitis B secara serologis. Keberadaan HBsAg pada pasien bergantung pada kondisi dan tahapan infeksi VHB (WHO 2002).
tupaia infecton media. Perlakuan kontrol negatif dilabel dengan huruf K. Kultur primer hepatosit yang diinfeksikan dengan VHB asal owa dilabel dengan huruf J sedangkan kultur yang diinfeksikan dengan VHB asal manusia dilabel dengan huruf H. Tahapan pembilasan dengan tupaia maintenance media dilakukan untuk mencuci kultur primer hepatosit dari sisa-sisa virus yang tidak menginfeksi sel.
Hasil pengamatan selama 15 hari pada kultur primer hepatosit yang terinfeksi tidak memperlihatkan perubahan morfologi (Gambar 4). Pengumpulan sampel dilakukan dengan menggumpulkan 500 µl supernatan media pada masing-masing perlakuan.
Gambar 4 Morfologi kultur primer hepatosit T. javanica terinfeksi (A) Sebelum infeksi perbesaran 10x8; (B) hari ketujuh sesudah infeksi perbesaran 10x10
Deteksi Infeksi Dan Replikasi VHB
Pada visualisasi hasil PCR dengan elektroforesis gel agarosa, digunakan kontrol positif berupa DNA VHB asal owa dan manusia dari koleksi Pusat Studi Satwa Primata, IPB. Sekuen regio pre-S1 VHB menghasilkan amplikon berukuran 455 pasang basa.
Pada Gambar 5 diamati perlakuan kontrol negatif sampel hari pertama (K1), ketujuh (K7), dan kelima belas (K15) tidak didapatkan pita DNA. Pada perlakuan infeksi dengan VHB owa (J) didapatkan pita DNA berukuran ±450 pasang basa yang tebal pada sampel hari pertama (J1), ketujuh (J7), dan kelima belas (J15). Hal ini menunjukkan bahwa VHB asal owa dapat menginfeksi dan bereplikasi pada kultur primer hepatosit T. javanica.
Pada perlakuan infeksi dengan VHB manusia (H) didapatkan pita DNA tipis berukuran ±450 pasang basa pada sampel hari ketujuh (H7), namun tidak didapatkan pita DNA pada sampel hari pertama (H1) dan hari kelima belas (H15) (Gambar 5). Hasil positif berupa pita pada hari ketujuh (H7) menunjukkan bahwa VHB asal manusia dapat menginfeksi dan bereplikasi pada kultur primer hepatosit
T. javanica. Analisa HBsAg yang dilakukan pada inokulan VHB H berada dibawah ambang batas deteksi (<0,05 IU/ml). Keberadaan HBsAg dalam seruma atau plasma mengindikasikan adanya infeksi VHB, namun deteksi HBsAg tidak memberikan secara nyata informasi aktivitas proses replikasi virus (Zaaijer HL et al. 1994). Selain itu, viremia pada pasien bervariasi antar pasien dan DNA VHB pada serum pasien yang sama dapat berfluktuasi dari tidak terdeteksi hingga 10 log10 IU/ml (Chu 2002). Dengan konsentrasi inokulan yang kecil, VHB asal
(H1). Sampel ini memerlukan waktu replikasi yang lebih lama untuk mencapai konsentrasi yang dapat dideteksi.
Perbedaan ketebalan pita pada Gambar 5 menunjukkan korelasi antara konsentrasi VHB pada sampel awal sebelum diinfeksikan dengan hasil replikasi pada kultur primer hepatosit. Virus hepatitis B asal satwa primata dengan titer HBsAg 60.789,04 IU/ml memiliki konsentrasi akhir VHB yang lebih tinggi daripada VHB asal manusia. Pada sampel VHB asal manusia dengan konsentrasi awal HBsAg yang lebih rendah, didapatkan hasil PCR hari pertama negatif. Hal ini menunjukkan konsentrasi VHB awal yang rendah dan tidak dapat terdeteksi sebelum sampel bereplikasi pada kultur primer hepatosit sampai hari ketujuh. Dalam penelitiannya Tuaillon et al.(2012) juga menyatakan adanya korelasi yang lemah antara titer HBsAg dengan DNA VHB pada sampel.
\
Gambar 5 Deteksi infeksi dan replikasi VHB. M : marker 1 kb ladder, K: kontrol negatif, J: VHB asal owa, H: VHB asal manusia
Proses infeksi VHB pada kultur serta uji molekuler yang dilakukan dapat memberikan diagnosa yang lebih akurat dalam mendeteksi keberadaan VHB pada sampel dibandingkan dengan uji serologis yang umum digunakan pada diagnosa pasien terinfeksi VHB, yang diketahui memiliki variasi gejala klinis serta waktu inkubasi in vivo yang panjang. Akan tetapi pertimbangan biaya serta waktu yang diperlukan menjadi faktor kelemahan metode ini dibandingkan dengan uji serologis yang ada.
Data CT yang diperoleh pada sampel owa menunjukkan penurunan CT seiring hari pengambilan sampel (Tabel 1 dan Gambar 6). Hari pertama didapatkan data pada 24,05 dan 22,08 sedangkan pada hari ketujuh 24,97 dan 24,61. Pada hari kelima belas pada 27,65 dan 28,19. Pada Kontrol positif owa didapatkan CT pada 13,58 dan 13,19.
Pada sampel VHB asal manusia didapatkan nilai CT negatif di hari pertama, pada hari ketujuh 38,31 dan 38,40 serta pada hari kelima belas negatif. Untuk kontrol positif didapatkan data CT pada 17,79 dan 16,84 (Tabel 1 dan Gambar 7). Hasil ini menunjukkan terjadinya proses replikasi VHB pada kultur primer hepatosit T. javanica.
Glebe et al. (2003) melaporkan infeksi kultur primer hepatosit T. belangeri
peningkatan konsentrasi HBeAg dan HBsAg dimulai pada hari keenam, yang menandakan terjadinya replikasi VHB pada sel. Dalam penelitiannya Walter et al.
(1996) juga mengemukakan infeksi in vitro menggunakan kultur primer hepatosit
T. belangeri mensekresikan HBsAg sejak hari ketiga setelah infeksi dan HBeAg pada hari kelima setelah infeksi.
Tabel 1 CT real time PCR kultur primer hepatosit Tupaia javanica Sampel 1 2
NTC - -
K1 - -
K7 - -
K15 - -
J+ 13,58 13,19 J1 24,05 22,08 J7 24,97 24,61 J15 27,65 28,19 H+ 17,79 16,84
H1 - -
H7 38,31 38,40
Gambar 6 Grafik CT sampel VHB asal owa. J+: kontrol positif, J1: sampel hari 1, J7: sampel hari 7, J15: sampel hari 15
Gambar 7 Grafik CT hasil real time PCR sampel VHB asal manusia. H+: kontrol positif, H1: sampel hari 1, H7: sampel hari 7, H15: sampel hari 15
Kemampuan VHB asal owa dan manusia dalam menginfeksi dan bereplikasi menunjukkan kesamaan situs pengenalan reseptor kedua virus tersebut pada kultur primer hepatosit T. javanica. Antigen pre-S1 VHB merupakan salah satu protein yang penting dalam proses infeksi, namun konfirmasi reseptor serta situs pengenalan spesifik pada sel hepatosit belum diverifikasi (Glebe et al. 2003; Xie
et al. 2010). Selain itu analisa filogenetik yang dilakukan oleh Warren et al.(1999) menunjukkan bahwa HBV asal owa memiliki kekerabatan paling dengan VHB genotype C, yang terdistribusi di daerah Asia Tenggara, apabila dibandingkan dengan genotipe VHB lainnya. Hal ini diduga karena terjadi transmisi antar spesies oleh hepadnavirus pada satu daerah geografis.
J+ J1 J1 J7 J7 J15
SIMPULAN DAN SARAN
Simpulan
Sel hepatosit dari hati T. javanica telah berhasil dikulturkan secara in vitro. Dari hasil inokulasi VHB pada kultur primer hepatosit yang telah dilakukan diperoleh kesimpulan bahwa VHB asal manusia dan owa dapat menginfeksi dan bereplikasi pada kultur primer hepatosit T. javanica. Hasil visualisasi PCR yang telah dilakukan serta data CT yang didapatkan memberikan gambaran data semi kuantitatif bahwa replikasi VHB pada kultur primer hepatosit T. javanica. Hasil tersebut menunjukkan kultur primer hepatosit T. javanica dapat digunakan sebagai model in vitro VHB yang kompeten.
Saran
Kemampuan VHB menginfeksi kultur primer hepatosit T. javanica
memberikan alternatif penelitian VHB di Indonesia. Hasil ini memungkinkan penggunaan T. javanica sebagai hewan model dalam penelitian VHB meningkat. Walaupun T. javanica bersifat endemik dengan status konservasi yang tidak dilindung, proses penangkaran T. javanica sebaiknya dilakukan untuk menjaga kelestarian hewan tersebut di alam. Untuk mendapatkan kualitas sel hepatosit primer yang lebih baik diperlukan modifikasi metode isolasi serta metode kultur sel primer hepatosit.
T
UPAIA JAVANICASEBAGAI MEDIA ISOLASI DAN DETEKSI
VIRUS HEPATITIS B
RICKY
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
DAFTAR PUSTAKA
Alberti A, Diana S, Eddleston AL, Williams R. 1979. Changes in hepatitis B virus DNA polymerase in relation to the outcome of acute hepatitis B. Gut.
20:190-195
Bird BR, Forrester FT. 1981. Basic laboratory tehniques in cell culture. Georgia (USA): CDC
Cao J, Yang EB, Su JJ, Li Y, Chow P. 2003. The tree shrews:, adjuncts and alternatives to primates as models for biomedical research. J Med Primatol. 32: 123-130.
CDC. 2009. Viral Hepatitis Surveillance. United States.
CDC. 2011. Viral Hepatitis Statistics and Surveillance. April 2012]
Chu CJ, Lok AS. 2002. Clinical utility in quantifying serum HBV DNA levels using PCR assays. J. Hepatol. 36:549-551
Creati M, Saleh A, Ruff TA, Stewart T, Otto B, Sutanto A, Clement CJ. 2007. Implementing the birthdose of hepatitis B vaccine in rural Indonesia.
Vaccine 25:5984-5993
El-serag HB. 2001. Epidemiology of hepatocellular carcinoma. Clin Liver Dis. 5:87-107
Freshney RI. 1994. Culture of animal cells: a manual of basic techniques. New Jersey (USA): John Wiley & Sons, Inc. 5th ed.
Galle PR, Hagelstein J, Kommerell B, Volkmann M, Schranz P, Zentgraf H. 1994. In vitro experimental infection of primary human hepatocytes with hepatitis B virus. Gastroentology 106:664-673.
Glebe D, Aliakbari M, Krass P, Knoop EV, Valerius KP, Gerlich WH. 2003. Pre-S1 antigen-dependent infection of Tupaia hepatocyte cultures with human hepatitis B virus. J Virol. 77(17): 9511-9521.
Guha C, Mohan S, Chowdhury MR, Chowdhury JR. 2004. Cell culture and animal models of viral hepatitis. Part 1: Hepatitis B. Lab Anim. 33 (7): 37-46.
Gomoa AI, Khan SA, Toledon MB, Waked I, Taylor-Robinson SD. 2008. Hepatocellular carcinoma: epidemiology, risk factor, and pathogenesis.
World. J. Gastroenterol. 14:4300-4308
Kock J, Nassal M, MacNelly S, Baumert TF, Blum HE, Weizsacker FV. 2001. Efficient infection of primary tupaia hepatocytes with purified human and wolly monkey hepatitis B virus. J Virol. 75 (11): 5084-5089.
Mauss S, Berg T, Rockstroh J, Sarrozin V, Wedemeyer H. 2012. Hepatology: a clinical textbook. Germany: Flying Publisher. 3rd ed.
Spandau DF, Lee CH. 1988. Trans-activation of viral enhancers by the hepatitis B virus x protein. J Virol 62(2): 427-434
Standring DN, Ou JH, Masiarz FR, Rutter WJ. 1988. A signal peptide encode within the precore region of hepatitis B virus directs the secretion of a heterogeous population of e antigens in Xenopus oocytes. Proc Natl Acad Sci USA. 85(22): 8405-8409
Stannard LM. 1995. Hepatitis B.
Tuaillon E, Mondain AM, Nagot N, Ottomani L, Kania D, Nogue E, Rubbo PA, Pageaux GP, Perre PVD, Ducos J. 2012. Comparison of serum HBsAg quantification by four immunoassays, and relationdhips of HBsAg level with HBV replication and HBV genotypes. Plos one 7(3): e32143
Walter R, Keist R, Niederost B, Pult I, Blum HE. 1996. Hepatitis B virus infection of tupaia hepatocytes in vitro and in vivo. Hepatology 24(1):1-5.
Warren KS, Heeney JL, Swan RA, Heriyanto, Verschoor EJ. 1999. A new group of Hepadnaviruses naturally infecting orangutans (Pongo pygmaeus). J Virol 73(9):7860-7865.
WHO. 2002. Hepatitis B. Geneva.
Xie Y, Zhai J, Deng Q, Tiollais P, Wang Y, Zhao M. 2010. Entry of hepatitis B virus: mechanism and new therapeutic target. Pathologie Biologie 58:301-307.
Zaaijer HL, Borg FT, Cuypers TM, Hermus MCAH, Lelie PN. 1994. Comparison of methods for detection of hepatitis B virus DNA. J. Clin. Microbiol.
Isolasi dan Deteksi Virus Hepatitis B. Dibimbing oleh RETNO DAMAYANTI SOEJODONO dan JOKO PAMUNGKAS.
Infeksi virus Hepatitis B telah menjadi salah satu permasalahan kesehatan di berbagai penjuru dunia. Lingkup inang virus yang spesifik menjadi salah satu kendala dalam penelitian virus ini. Kemampuan kultur primer hepatosit Tupaia belangeri sebagai media infeksi memberikan alternatif model in vitro dalam mempelajari infeksi virus Hepatitis B. Penelitian ini mengembangkan kultur primer hepatosit Tupaia javanica asal Indonesia sebagai salah satu model in vitro untuk media isolasi dan perbanyakan serta deteksi virus Hepatitis B asal manusia dan satwa primata secara in vitro. Analisa real time PCR menunjukkan virus Hepatitis B asal manusia dan satwa primata dapat menginfeksi dan bereplikasi pada kultur primer hepatosit Tupaia javanica. Hasil ini menunjukkan kultur
primer hepatosit Tupaia javanica dapat digunakan sebagai model in vitro dalam
mempelajari infeksi virus hepatitis B.
Hepatitis B Virus Isolation and Detection. Under direction of RETNO DAMAYANTI SOEJODONO and JOKO PAMUNGKAS.
Human hepatitis B virus is a major health problem worldwide which have a very narrow host range. The susceptibility of Tupaia belangeri hepatocytes primary culture has been used as an alternative in vitro model for studying hepatitis B virus infection. In this research, we proposed the usage of T. javanica hepatocytes primary culture as an in vitro model to isolate and detect hepatitis B virus from human and Hylobates moloch. Both in vitro infection of the hepatitis B virus in T. javanica hepatocytes primary culture show viral DNA replication in Real Time PCR. The result suggest that T. javanica may become a useful model for studying hepatitis B virus infecton