SKRIPSI
SKRINING FITOKIMIA DAN ISOLASI SENYAWA FLAVONOID DARI DAUN SIRIH MERAH (Piper porphyrophyllum N.E.Br.)
Oleh:
SISKA RIA NIM 040804037
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
SKRINING FITOKIMIA DAN ISOLASI SENYAWA FLAVONOID DARI DAUN SIRIH MERAH (Piper porphyrophyllum N.E.Br.)
SKRIPSI
Oleh: SISKA RIA NIM 040804037
FAKULTAS FARMASI
HALAMAN PENGESAHAN
SKRINING FITOKIMIA DAN ISOLASI SENYAWA
FLAVONOID DARI DAUN SIRIH MERAH Piper
porphyrophyllum N. E. Br.
OLEH : SISKA RIA NIM 040804037
Medan, Januari 2011
Disetujui oleh: Disahkan Oleh: Pembimbing I, Dekan,
(Prof. Dr. Siti Morin Sinaga, MSc.,Apt) (Prof. Dr. Sumadio Hadisahputra, Apt.)
NIP 130535837 NIP 131283716
Disetujui oleh: Pembimbing II,
KATA PENGANTAR
Puji dan syukur atas kehadirat Tuhan Yang Maha Esa yang telah
melimpahkan rahmat dan karunia-Nya, sehingga penulis dapat menyelesaikan
skripsi yang berjudul “Skrining Fitokimia dan Isolasi Senyawa Flavonoid dari
Daun Sirih Merah (Piper porphyrophllum N.E.Br.)”. Skripsi ini diajukan sebagai
salah satu syarat untuk memperoleh gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara.
Pada kesempatan ini penulis ingin mempersembahkan skripsi ini sebagai
rasa terima kasih kepada Ayah dan Ibu tercinta, Mira Y. G, Noni Novita S. G,
Depintanto G, Zockindo G., Vriezka Mierza, Dameria S., Dian W., Bedy R. M.M,
Fina K., dan semua teman satu laboratorium atas doa, dorongan dan pengorbanan
baik moril maupun material selama menempuh pendidikan Strata 1 Farmasi.
Pada kesempatan ini penulis ingin menyampaikan terima kasih yang
sebesar-besarnya kepada Ibu Prof. Dr. Siti Morin Sinaga, M.Sc., Apt. dan Ibu Dr.
Marline Nainggolan, MS., Apt. yang telah membimbing dengan penuh kesabaran,
tulus dan ikhlas selama penelitian dan penulisan skripsi ini berlangsung.
Pada kesempatan ini penulis juga menyampaikan ucapan terima kasih
kepada :
1. Dekan Fakultas Farmasi Universitas Sumatera Utara, Prof. Dr. Sumadio
Hadisahputra, Apt., yang telah memberikan bantuan dan fasilitas selama masa
pendidikan.
2. Ibu Dr. Marline Nainggolan selaku Kepala Laboratorium Fitokimia yang
3. Bapak Drs. Muchlisyam, M.si., Apt selaku pembimbing Akademik.
4. Bapak dan Ibu selaku dosen penguji yang telah memberikan saran dan
kritikan kepada penulis hingga selesainya penulisan skripsi ini.
5. Seluruh Staf Pengajar, Pegawai Tata Usaha, Kakak-kakak, Abang-abang dan
Teman-teman yang telah membantu selama penelitian.
Penulis menyadari bahwa tulisan ini masih memiliki banyak kekurangan,
oleh karena itu dengan segala kerendahan hati penulis bersedia menerima kritikan
dan saran yang membangun pada skripsi ini. Semoga skripsi ini bermanfaat bagi
kita semua.
Medan, Januari 2011
SKRINING FITOKIMIA DAN ISOLASI SENYAWA FLAVONOID DARI DAUN SIRIH MERAH (Piper porphyrophyllum N.E.Br)
ABSTRAK
PHYTOCEMICAL SCREENING AND ISOLATION FLAVONOID COMPOUNDS FROM RED PIPER LEAVES (Piper porphyrophyllum N.E.Br.)
ABSTRACT
Utilization a large part of floras had been conducted since former to cure various of diseases. Red piper is one of flora that used for antibleeding, antiseptic, analgetic, antitumour, antihepatitist, leprosy. This research main to know compounds of the red piper and isolation flavonoid using spectrophotometer ultraviolet with shifts reagent. The result characterization of simplex gave the water content value is 8,600%, the water soluble axtract value is 11,866%, the ethanol soluble extract value is 11,533%, the total ash value is 1,361% and the acid insoluble ash value is 0,756%. The result phytochemichal screening show compounds there are alkaloids, flavonoids, glycosides, saponins, tannins, and triterpenoids/steroids. Extraction are conduced in maseration by using ethanol solvent, then compound dissociation flavonoid is conducted in liquid-liquid extraction by using n-hexan solvent chloroform and ethylacetate. The ethylacetate fraction was analyced using paper chromatography with various of mobile phase and comparisons to get the best mobile phase. Furthermore the ethylacetate fraction is dissociated with preparative paper chromatography with 50% acetic
acid, from preparative result was got five isolates, there were F1 isolate, F2 isolate, F3 isolate, F4 isolate, and F5 isolate. Then the isolates were analysed
DAFTAR ISI
Halaman
JUDUL ... ii
LEMBAR PENGESAHAN ... iii
KATA PENGANTAR... iv
ABSTRAK ... vi
ABSTRACT ... vii
DAFTAR ISI ... viii
DAFTAR LAMPIRAN ... xii
DAFTAR GAMBAR... xviii
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 2
1.3 Hipotesis ... 3
1.4 Tujuan ... 3
BAB II TINJAUAN PUSTAKA... 4
2.1 Uraian Tumbuhan... 4
2.1.1 Nama Daerah... 4
2.1.2 Morfologi Tumbuhan... 4
2.1.3 Sistematika Tumbuhan... 5
2.1.4 Penggunan Tumbuhan... 5
2.2 Kandungan Kimia... 6
2.2.3 Glikosida... 9
2.2.4 Tanin... 9
2.3 Ekstraksi... 10
2.4 Kromatografi Kertas... 12
2.5 Spektroskopi Serapan Ultraviolet... 13
BAB III METODE PENELITIAN ... 15
3.1 Alat-alat ... 15
3.2 Bahan-Bahan ... 15
3.3 Penyiapan Sampel ... 16
3.3.1 Pengambilan Sampel ... 16
3.3.2 Identifikasi Tumbuhan ... 16
3.3.3 Pengolahan Sampel ... 16
3.4Pembuatan Larutan Pereaksi ... 16
3.4.1 Pereaksi Bouchardat... 16
3.4.2 Pereaksi Dragendorff ... 17
3.4.3 Pereaksi Mayer ... 17
3.4.4 Pereaksi Molish ... 17
3.4.5 Pereaksi Timbal (II) Asetat 0,4 M... 17
3.4.6 Pereaksi Asam Sulfat 2 N ... 17
3.4.7 Pereaksi Asam Nitrat 0,5 N ... 17
3.4.8 Pereaksi Natrium Sitrat 3,65%... 18
3.4.9 Pereaksi Kloralhidrat ... 18
3.4.10 Pereaksi Asam Klorida 2 N ... 18
3.4.12 Pereaksi Besi (III) Klorida 1%... 18
3.4.13 Pereaksi Liebermann-Burchard ... 18
3.4.14 Pereaksi Asam Klorida 5% ... 19
3.4.15 Pereaksi Aluminium Klorida 5% ... 19
3.5Pemeriksaan Karakterisasi Simplisia ... 19
3.5.1 Pemeriksaan Makroskopik ... 19
3.5.2 Pemeriksaan Mikroskopik ... 19
3.5.3 Penetapan Kadar Air ... 20
3.5.4 Penetapan Kadar Sari yang Larut dalam Air... 20
3.5.5 Penetapan Kadar Sari yang Larut dalam Etanol .. 21
3.5.6 Penetapan Kadar Abu Total ... 21
3.5.7 Penetapan Kadar Abu yang Tidak Larut dalam Asam... 22
3.6Skrining Fitokimia ... 22
3.6.1 Pemeriksaan Alkaloid ... 23
3.6.2 Pemeriksaan Flavonoid ... 23
3.6.3 Pemeriksaan Glikosida ... 24
3.6.4 Pemeriksaan Glikosida Antrakinon ... 24
3.6.5 Pemeriksaan Saponin ... 24
3.6.5.1 Uji Busa ... 24
3.6.5.2 Uji dengan Pereaksi Liebermann-Burchard25 3.6.6 Pemeriksaan Tanin ... 25
3.6.7 Pemeriksaan Triterpenoid/ Steroid ... 25
3.8Ekstraksi Cair-cair Senyawa Flavonoid dari Ekstrak Etanol
Kental ... 26
3.9Analisis Senyawa Flavonoid dari Ekstrak Hasil Fraksinasi dengan Cara Kromatografi Kertas (KKt) ... 26
3.10.Pemisahan Senyawa Flavonoid dari Fase Gerak Asam Asetat 50% dengan Cara KKt Preparatif... 26
3.11 Kemurnian Senyawa Flavonoid dari Hasil KKt Preparatif... 26
3.12 Identifikasi Senyawa Isolat ... 27
BAB IV HASIL DAN PEMBAHASAN ... 29
BAB V KESIMPULAN DAN SARAN ... 43
5.1 Kesimpulan ... 43
5.2 Saran ... 43
BAB V DAFTAR PUSTAKA... 44
DAFTAR LAMPIRAN
Halaman
Lampiran 1 Hasil identifikasi tumbuhan ... 45
Lampiran 2 Gambar tumbuhan dan daun sirih merah (Piper
porphyrophyllum N.E.Br) ... 46
Lampiran 3 Gambar simplisia daun sirih merah... 47
Lampiran 4 Hasil mikroskopik penampang melintang daun sirih merah 48
Lampiran 5 Hasil mikroskopik serbuk simplisia daun sirih merah ... 49
Lampiran 6 Bagan kerja tahapan penelitian ... 50
Lampiran 7 Bagan kerja ekstraksi dan fraksinasi serbuk simplisia daun sirih merah ... 51
Lampiran 8 Bagan kerja isolasi senyawa flavonoid dari fraksi etilasetat ... 52
Lampiran 9 Perhitungan kadar air serbuk simplisia daun sirih merah ... 53
Lampiran 10 Perhitungan kadar sari larut dalam air serbuk simplisia daun sirih merah ... 54
Lampiran 11 Perhitungan kadar sari larut dalam etanol serbuk simplisia daun sirih merah ... 55
Lampiran 12 Perhitungan kadar abu total serbuk simplisia daun sirih
merah ... 56
Lampiran 13 Perhitungan kadar abu yang tidak larut dalam sam
daun sirih merah ... 57
Lampiran 14 Kromatogram fraksi etilasetat dengan KKt menggunakan fase gerak BAA ... 58
Lampiran 15 Kromatogram Fraksi Etilasetat dengan KKt Menggunakan fase gerak Forestal ... 60
Lampiran 17 Kromatogram Fraksi Etilasetat dengan KKt Menggunakan Fase Gerak Asam Asetat 15% ... 64
Lampiran 18 Kromatogram Fraksi Etilasetat dengan KKt Menggunakan Fase Gerak Asam Klorida 1% ... 66
Lampiran 19 Penggambaran kromatogram dari kromatografi preparatif fase gerak asam asetat 50%... 68
Lampiran 20 Kromatogram Hasil KKt Isolat F1 mnggunakan fase diam Kertas Whatmann No.1 dan Fase Gerak Asam asetat 50%.. 69
Lampiran 21 Kromatogram Hasil KKt Isolat F1 mnggunakan fse Diam Kertas Whatmann No. 1 dan Fase Gerak Asam Asetat 15% 70
Lampiran 22 Kromatogram Hasil KKt Isolat F1 mnggunakan fse Diam Kertas Whatn No. 1 dan fase gerak Asam Klorida 1% ... 71
Lampiran 23 Kromatogram Hasil KKt Isolat F2 menggunakan fase diam kertas Whatmann No. 1 dan fase gerak Forestal ... 72
Lampiran 24 Kromatogram hasil KKt isolat F2 menggunakan fase diam kertas Whatmann No. 1 dan fase gerak asam asetat 50% ... 73
Lampiran 25 Kromatogram hasil KKt isolat F2 menggunakan fase diam kertas Whatmann No. 1 dan fase gerak asam asetat 15% ... 74
Lampiran 26 Kromatogram Hasil KKt Isolat F3 menggunakan Fase Diam kertas Whatmann No. 1 dan fase gerak BAA ... 75
Lampiran 27 Kromatogram hasil KKt Isolat F3 menggunakan Fase Diam kertas Whatmann No. 1 dan fase gerak asam asetat 50% ... 76
Lampiran 28 Kromatogram hasil KKt isolat F4 menggunakan fase diam kertas Whatmann No. 1 dan fase gerak BAA ... 77
Lampiran 29 Kromatogram hasil KKt isolat F4 menggunakan fase diam kertas Whatmann No. 1 dan fase gerak asam asetat 50% ... 78
Lampiran 30 Kromatogram hasil KKt isolat F5 menggunakan fase diam kertas whatmann No. 1 dan fase gerak Forestal ... 79
Lampiran 31 Kromatogram hasil KKt isolat F5 menggunakan fase diam kertas Whatmann No. 1 dan fase gerak asam asetat 50% ... 80
menggunakan fase diam kertas Whatmann No.1, fase gerak I BAA dan fase gerak II asam asetat 50%... 81
Lampiran 33 Kromatogram hasil kemurnian isolat F2 dengan KKt dua arah menggunakan fase diam kertas Whatmann No.1, fase gerak I BAA dan fase gerak II asam asetat 50%... 82
Lampiran 34 Kromatogram hasil kemurnian isolat F3 dengan KKt dua arah menggunakan fase diam kertas Whatmann No.1, fase gerak I BAA dan fase gerak II asam setat 50%... 83
Lampiran 35 Kromatogram hasil kemurnian isolat F4 dengan KKt dua arah menggunakan fase diam kertas Whatmann No.1, fase gerak I BAA dan fase gerak II asam asetat 50%... 84
Lampiran 35 Kromatogram hasil kemurnian isolat F5 dengan KKt dua arah menggunakan fase diam kertas Whatmann No.1, fase gerak I BAA dan fase gerak II asam asetat 50%... 84
Lampiran 36 Kromatogram hasil kemurnian isolat F5 dengan KKt dua arah menggunakan fase diam kertas Whatmann No.1, fase gerak BAA dan fase gerak II asam asetat 50%... 85
Lampiran 37 Harga Rf hasil uji kemurnian kromatografi kertas satu arah... 86
Lampiran 38 Spektrum ultraviolet dari Isolat F1 dalam metanol……….... 87
Lampiran 39 Spektrum ultraviolet isolat F1 dalam metanol dan setelah
penambahan natrium hidroksida………. 88 Lampiran 40 Spektrum ultraviolet isolat F1 dalam metanol dengan
penambahan natrium hidroksida dan spektrum yang diukur setelah lima menit………. 89
Lampiran 41 Spektrum ultraviolet isolat F1 dalam metanol dan setelah
penambahan aluminium klorida dan asam klorida………... 90 Lampiran 42 Spektrum ultraviolet isolat F1 dalam metanol dengan
penambahan aluminium klorida dan setelah penambahan
aluminium klorida dan asam klorida………. 91
Lampiran 43 Spektrum ultraviolet isolat F1 dalam metanol dan setelah
penambahan natrium asetat………... 92 Lampiran 44 Spektrum ultraviolet isolat F1 dalam metanol dengan
Lampiran 45 Spektrum ultraviolet isolat F1 dalam metanol dan setelah
penambahan natrium asetat dan asam borat……….. 94
Lampiran 46 Spektrum ultraviolet dari isolat F2 dalam mehanol………... 95
Lampiran 47 Spektrum ultraviolet isolat F2 dalam metanol dan setelah
penambahan natrium hidroksida……….. 96 Lampiran 48 Spektrum ultraviolet isolat F2 dalam metanol dengan
penambahan natrium hidroksida dan spektrum yang diukur setelah lima menit………. 97
Lampiran 49 Spektrum ultraviolet isolat F2 dalam metanol dan Setelah
penambahan aluminium klorida dan asam klorida………... 98
Lampiran 50 Spektrum ultraviolet isolat F2 dalam metanol dengan penambah aluminium klorida dan setelah penambahan aluminium klorida dan asam klorida……….. 99
Lampiran 51 Spektrum ultraviolet isolat F2 dalam metanol dan setelah
penambahan natrium asetat……… 100 Lampiran 52 Spektrum ultraviolet isolat F2 dalam metanol dengan
penambahan natrium asetat dan spektrum yang diukur setelah Lima menit………. 101
Lampiran 53 Spektrum ultraviolet isolat F2 dalam metanol dan setelah
penambahan natrium asetat dan asam borat………... 102
Lampiran 54 Spektrum ultraviolet dari isolat F3 dalam metanol………… 103
Lampiran 55 Spektrum ultraviolet isolat F3 dalam metanol dan setelah
penambahan natrium hidroksida………... 104
Lampiran 56 Spektrum ultraviolet isolat F3 dalam metanol dengan penambahan natrium hidroksida dan spektrum yang diukur setelah lima menit………. 105
Lampiran 57 Spektrum ultraviolet isolat F3 dalam metanol dan setelah
penambahan aluminium klorida dan asam klorida………... 106
Lampiran 58 Spektrum ultraviolet isolat F3 dalam metanol dengan penambahan aluminium klorida dan setelah penambahan
Lampiran 59 Spektrum ultraviolet isolat F3 dalam metanol dan setelah
penambahan natrium asetat……….. 108
Lampiran 60 Spektrum ultraviolet isolat F3 dalam metanol dengan
penambahan natrium asetat dan spektrum yang diukur setelah lima menit……… 109
Lampiran 61 Spektrum ultraviolet isolat F3 dalam metanol dan setelah
penambahan natrium asetat dan asam borat………... 110
Lampiran 62 Spektrum ultraviolet dari isolat F4 dalam metanol………... 111
Lampiran 63 Spektrum ultraviolet isolat F4 dalam metanol dan setelah
penambahan natrium hidroksida……….. 112
Lampiran 64 Spektrum ultraviolet isolat F4 dalam metanol dengan penambahan natrium hidroksida dan spektrum yang diukur setelah lima menit………. 113 Lampiran 65 Spektrum ultraviolet isolat F4 dalam metanol dan setelah
penambahan aluminium klorida dan asam klorida………. 114
Lampiran 66 Spektrum ultraviolet isolat F4 dalam metanol dengan penambahan aluminium klorida dan setelah penambahan
aluminium klorida dan asam klorida………. 115
Lampiran 67 Spektrum ultraviolet isolat F4 dalam metanol dan setelah
penambahan natrium asetat……… 116
Lampiran 68 Spektrum ultraviolet isolat F4 dalam metanol dengan
penambahan natrium asetat dan spektrum yang diukur setelah lima menit………... 117
Lampiran 69 Spektrum ultraviolet isolat F4 dalam metanol dan setelah
penambahan natrium asetat dan asam borat……….. 118
Lampiran 70 Spektrum ultraviolet dari isolat F5 dalam metanol…….... 119
Lampiran 71 Spektrum ultraviolet isolat F5 dalam metanol dan setelah
penambahan natrium hidroksida………... 120
Lampiran 72 Spektrum ultraviolet isolat F5 dalam metanol dengan penambahan natrium hidroksida dan spektrum yang diukur setelah lima menit………. 121
Lampiran 73 Spektrum ultraviolet isolat F5 dalam metanol dan setelah
Lampiran 74 Spektrum ultraviolet isolat F5 dalam metanol dengan penambahan aluminium klorida dan setelah penambahan aluminium klorida dan asam klorida………. 123
Lampiran 75 Spektrum ultraviolet isolat F5 dalam metanol dan setelah penambahan natrium asetat……….... 124
Lampiran 76 Spektrum ultraviolet isolat F5 dalam metanol dengan penambahan natrium asetat dan spektrum yang diukur
setelah lima menit………. 125
DAFTAR GAMBAR
Gambar 1 Tumbuhan sirih merah (Piper porphyrophyllum N.E.Br) ... 46
Gambar 2 Daun sirih merah (Piper porphyrophyllum N.E.Br) ... 46
Gambar 3 Simplisia daun sirih merah ... 47
Gambar 4 Hasil mikroskopik penampang melintang daun sirih merah ... 48
SKRINING FITOKIMIA DAN ISOLASI SENYAWA FLAVONOID DARI DAUN SIRIH MERAH (Piper porphyrophyllum N.E.Br)
ABSTRAK
PHYTOCEMICAL SCREENING AND ISOLATION FLAVONOID COMPOUNDS FROM RED PIPER LEAVES (Piper porphyrophyllum N.E.Br.)
ABSTRACT
Utilization a large part of floras had been conducted since former to cure various of diseases. Red piper is one of flora that used for antibleeding, antiseptic, analgetic, antitumour, antihepatitist, leprosy. This research main to know compounds of the red piper and isolation flavonoid using spectrophotometer ultraviolet with shifts reagent. The result characterization of simplex gave the water content value is 8,600%, the water soluble axtract value is 11,866%, the ethanol soluble extract value is 11,533%, the total ash value is 1,361% and the acid insoluble ash value is 0,756%. The result phytochemichal screening show compounds there are alkaloids, flavonoids, glycosides, saponins, tannins, and triterpenoids/steroids. Extraction are conduced in maseration by using ethanol solvent, then compound dissociation flavonoid is conducted in liquid-liquid extraction by using n-hexan solvent chloroform and ethylacetate. The ethylacetate fraction was analyced using paper chromatography with various of mobile phase and comparisons to get the best mobile phase. Furthermore the ethylacetate fraction is dissociated with preparative paper chromatography with 50% acetic
acid, from preparative result was got five isolates, there were F1 isolate, F2 isolate, F3 isolate, F4 isolate, and F5 isolate. Then the isolates were analysed
BAB I PENDAHULUAN 1.1. Latar Belakang
Sejak ratusan tahun yang lalu, nenek moyang kita telah memanfaatkan
tanaman sebagai upaya penyembuhan jauh sebelum obat-obatan modern yang
sekarang ada. Ramuan tanaman obat yang kemudian dikenal sebutan herbal itu
terbukti mujarab dalam mengobati berbagai penyakit. Merebaknya kecenderungan
atau tren hidup kembali kealam ‘(back to nature)’ semakin menambah
keingintahuan masyarakat tentang khasiat tanaman obat (Sudewo, 2005).
Indonesia adalah salah satu negara yang kaya akan tumbuh-tumbuhan dan
merupakan sumber bahan obat tradisional yang banyak digunakan sejak dahulu
secara turun-temurun. Salah satu diantaranya adalah sirih, yang telah lama
digunakan dan diketahui masyarakat khasiatnya untuk menyembuhkan berbagai
macam penyakit yaitu memiliki sifat menahan pendarahan, penyembuh luka pada
kulit, obat saluran cerna, menguatkan gigi, antioksidan dan fungisida (Depkes,
1980).
Penggunaaan sirih merah semakin disukai karena pada umumnya
mempunyai efek samping yang kecil, tidak seperti obat-obatan dari bahan kimia.
Khasiat dari tumbuh-tumbuhan yang digunakan sebagai obat tradisional diketahui
dari penuturan orang tua atau dari pengalaman (Tampubolon, 1995).
Munculnya sirih merah dalam khasanah pengobatan herbal sudah
selayaknya disambut positif. Tanaman merambat yang sebelumnya kurang
mendapat perhatian itu kini menjadi rebutan pecinta tanaman obat. Selain cantik
berbagai jenis penyakit. Karenanya, terlepas dari pro dan kontra mengenai
keberadaannya, sosok sirih merah cukup menarik untuk dikaji dan diteliti lebih
jauh (Sudewo, 2005).
Salah satu kandungan sirih merah yaitu flavonoid. Flavonoid merupakan
salah satu golongan fenol alam yang tersebar jumlahnya. Tumbuhan yang
mengandung flavonoid dapat digunakan untuk pengobatan sitotoksis, gangguan
fungsi hati, menghambat pendarahan, antioksidan, antihipertensi dan antiinflamasi
(Farnsworth, 1996; Robinson, 1995).
Berdasarkan hal diatas, maka penulis tertarik untuk melakukan skrining
fitokimia dan isolasi senyawa flavonoid dari daun sirih merah (Piper
porphyrophyllum N.E.Br.) dengan alasan karena adanya kandungan flavonoid
serta keanekaragaman aktivitas biologis yang dimiliki oleh flavonoid. Selain itu
untuk melakukan identifikasi terhadap senyawa flavonoid hasil isolasi secara
spektrofotometri ultraviolet menggunakan pereaksi geser.
1.2 Perumusan Masalah
Berdasarkan latar belakang di atas dapat diambil perumusan masalah yaitu: 1. Apa saja senyawa kimia yang dikandung dalam daun sirih merah (Piper
porphyrophyllum N.E.Br.)?
2. Apakah senyawa flavonoid dari daun sirih merah (Piper porphyrophyllum
N.E.Br.) dapat diidentifikasi secara spektrofotometri ultraviolet
1.3 Hipotesis
Berdasarkan perumusan masalah diatas maka dibuat hipotesis yaitu:
1. Diduga daun sirih merah (Piper porphyrophyllum N.E.Br.) mempunyai
kandungan kimia yang dapat diketahui dengan melakukan skrining
fitokimia.
2. Diduga senyawa flavonoid dari daun sirih merah (Piper porphyrophyllum
N.E.Br.) dapat diidentifikasi secara spektrofotometri ultraviolet
menggunakan pereaksi geser.
1.4 Tujuan
Adapun tujuan penelitian ini adalah untuk:
1. Mengetahui kandungan kimia yang terdapat dalam daun sirih merah (Piper
porphyrophyllum N.E.Br.).
2. Melakukan isolasi dan karakterisasi senyawa flavonoid dari daun sirih
merah (Piper porphyrophyllum N.E.Br.) secara spektrofotometri
ultraviolet menggunakan pereaksi geser.
BAB II
TINJAUAN PUSTAKA 2.1. Uraian Tumbuhan
Tumbuhan sirih merah (Piper porphyrophyllum N.E.Br.) tergolong langka
karena tidak tumbuh disetiap tempat atau daerah. Sirih merah tumbuh subur di
tempat berhawa dingin dan jika terlalu banyak terkena sinar matahari, batangnya
cepat mengering, tetapi jika disiram secara berlebihan akar dan batang cepat
membusuk. Tumbuhan sirih merah akan tumbuh dengan baik jika mendapatkan
60-70% cahaya matahari. Sehingga, perlakuan khusus sangat dibutuhkan dalam
upaya menjaga syarat tumbuhnya. Banyak orang menanam tumbuhan sirih merah,
tetapi tidak banyak yang mengerti syarat tumbuhnya, sehingga gagal dan
tanamannya sering mati. Jika terkena sinar matahari langsung pada siang hari
secara terus-menerus warna merah daunnya bias menjadi pudar, buram, dan
kurang menarik (Sudewo, 2005).
2.1.1. Nama Daerah
Nama daerah: suruh, sedah (Jawa), seureuh (Sunda); ranub (Aceh);
cambai (Lampung) (Anonim, 2009).
2.1.2 Morfologi Tumbuhan
Tumbuhan sirih merah (Piper porphyrophyllum N.E.Br) tumbuh menjalar
seperti halnya sirih hijau. Batangnya bulat berwarna hijau keunguan dan tidak
berbunga. Daunnya bertangkai membentuk jantung dengan bagian atas
meruncing, bertepi rata (Sudewo, 2005). Tumbuhan ini tumbuh menjalar yang
tampak berwarna hijau gelap berbintik putih pada bagian atas dan berwarna ungu
Tumbuhan ini mempunyai ukuran panjang 4-6 inci, lebar 3-5.5 inci. Tumbuhan
ini tumbuh liar di hutan diatas tanah dan mililit pohon (Ridley, 1924). Tumbuhan
sirih merah (Piper porphyrophyllum N. E. Br.) biasanya hidup dikepulauan
Malaysia, tapi ditemukan hidup secara liar (Burkill, 1935).
2.1.3. Sistematika Tumbuhan
Sistematika tumbuhan daun sirih merah (Piper porphyrophyllum N.E.Br.) adalah sebagai berikut :
Kingdom : Plantae
Subkingdom : Tracheobionta
Super Divisi : Spermatophyta
Divisi : Magnoliophyta
Kelas : Magnoliopsida
Sub Kelas : Magnoliidae
Ordo : Piperales
Famili : Piperaceae
Genus : Piper
Spesies : Piper porphyrophyllum N.E.Br.
2.1.4. Penggunaan Tumbuhan
Tumbuhan sirih merah (Piper porphyrophyllum N.E.Br.) digunakan dalam
berbagai jenis pengobatan di Malaysia seperti pada pengobatan sakit kepala dan
sakit tulang, dada sesak, lepra, sakit perut pada anak-anak, untuk wanita setelah
melahirkan, serta untuk penyakit kulit yg disebut ‘sopak’. Tumbuhan ini
ditemukan pada saat pengobatan gajah yang terluka akibat terkena tembakan
Efek zat aktif yang terkandung daun sirih merah dapat merangsang saraf
pusat dan daya fikir. Di samping itu, juga memiliki efek pencegah ejakulasi dini,
antikejang, antiseptik, analgetik, antiketombe, antidiabetes, pelindung hati,
antidiare, mempertahankan kekebalan tubuh, dan penghilang bengkak. Daun sirih
merah juga mampu mengatasi radang paru, radang pada tenggorok, radang pada
gusi, radang pada payudara, hidung berdarah, dan batuk berdarah (Sudewo, 2005).
Bentuk-bentuk obat tradisional dari bahan alam yang dapat disejajarkan
dengan obat modern karena proses pembuatannya yang telah terstandar, dan
ditunjang dengan bukti ilmiah sampai dengan uji klinik pada manusia. Masyarakat
juga bisa didorong untuk menggunakan obat herbal karena manfaatnya jelas
dengan pembuktian secara ilmiah, bahan bakunya terdiri dari simplisia atau
sediaan galenik yang telah memenuhi persyaratan yang berlaku (Anonim, 2009).
2.2. Kandungan Kimia tumbuhan 2.2.1. Flavonoid
Flavonoid ditemukan sangat luas pada berbagai tumbuhan. Flavonoid
berfungsi sebagai pigmen pemberi warna pada bunga dan buah. Secara tidak
langsung manusia mengonsumsi flavonoid yang terdapat banyak pada
buah-buahan dan sayur-sayuran. Kata flavonoid berasal dari bahasa latin yaitu ‘flavus’,
yang artinya kuning dan golongan flavonoid termasuk warna kuning dalam warna.
Flavonoid yang termasuk antosianidin adalah berwarna merah, biru, dan ungu.
Flavonoid juga terdapat pada daun, yaitu sebagai pelindung pada tumbuhan untuk
Senyawa flavonoid adalah senyawa polifenol yang mempunyai 15 atom
karbon, terdiri dari dua cincin benzen yang dihubungkan menjadi satu oleh rantai
alifatik yang terdiri dari tiga atom karbon. Kerangka ini dapat juga ditulis sebagai
sistem C6-C3-C6 (Manitto, 1981). Senyawa ini dapat dibagi menjadi beberapa anak
golongan berdasarkan perbedaan-perbedaan pada struktur cincin
heterosiklik-oksigen tambahan dan gugus hidroksil yang terdapat pada flavonoid tersebut.
Sebagian besar flavonoid mempunyai cincin piran yang menghubungkan rantai
tiga karbon dengan salah satu dari cincin benzen (Robinson, 1995). Umumnya
senyawa flavonoid mengandung sistem aromatik yang terkonjugasi sehingga
menunjukkan pita serapan kuat pada daerah spektrum sinar ultraviolet dan
spektrum sinar tampak, umumnya dalam tumbuhan terikat pada gula yang disebut
dengan glikosida (Harborne, 1996).
Senyawa flavonoid biasanya terdapat pada semua bagian tumbuhan
termasuk daun, akar, kayu, kulit batang, tepung sari, bunga, buah, biji, dan
merupakan pigmen yang paling umum dijumpai pada seluruh tanaman mulai dari
fungus sampai tumbuhan angiospermae. Sebagai pigmen bunga flavonoid
berperan dalam menarik burung dan sengaja penyerbuk bunga, disamping itu
beberapa senyawa flavonoid mempunyai rasa pahit sehingga dapat bersifat
menolak sejenis ulat tertentu (Markham, 1988; Robinson, 1995; Sastrohamidjojo,
1996).
Flavon dan flavonol merupakan senyawa yang paling tersebar luas dari
semua pigmen tumbuhan tinggi (Robinson, 1995). Flavon sering terdapat sebagai
glikosida. Aglikon flavonol yang umum. Aglikon flavonol yang paling umum,
tetapi jenis glikosidanya lebih sedikit daripada jenis glikosida pada flavonol. Jenis
yang paling umum yaitu : 7-glukosida. Flavon berbeda dengan flavonol karena
pada flavon tidak terdapat gugus 3-hidroksi. Hal ini mempengaruhi serapan
ultraviolet, gerakan kromatografi, serta reaksi warnanya (Harborne, 1987).
Senyawa flavonon dan flavononol hanya terdapat dalam jumlah yang paing
sedikit sekali jika dibandingkan dengan golongan flavonoid lainnya (Robinson,
1995).
Isoflavon merupakan golongan flavonoid yang jumlahnya sangat sedikit
dan penting sebagai fitoaleksin yaitu senyawa pelindung yang terbentuk dalam
tumbuhan sebagai pertahanan terhadap serangan penyakit. Senyawa ini berkhasiat
sebagai antioksidan dan isiflavon sukar dicirikan karena reaksinya tidak khas
dengan pereaksi warna manapun. Beberapa isoflavon berwarana biru muda
dibawah sinar ultraviolet bila diberi uap ammonia, tetapi kebanyakan yang lain
tampak sebagai bercak lembayung dan dengan ammonia berubah menjadi coklat
(Harborne,1987).
Antosianin merupakan pewarna yang paling penting dan tersebar luas
dalam tumbuhan, digunakan sebagai pembentuk dasar pigmen merah, ungu dan
biru pada tanaman, terutama sebagai ewarna bunga dan buah-buahan. Sebagian
besar antosianin alam adalah glikosida dan aglikonnya disebut dengan
antosianidin yang terbentuk bila antosianin dihidrolisis dengan menggunakan
asam. Antosianidin yang paling umum adalah sianidin yang menyebabkan warna
merah lembayung (Harborne, 1987; Sastrohamidjojo, 1996).
Khalkon merupakan pigmen fenol kuning yang berwarna coklat kuat
maka warnanya berubah atau tetap. Khalkon menunjukkan puncak yang lebar
antara 365-390 nm didaerah spektrum tampak (Harborne, 1987).
Auron merupakan pigmen kuning yang terdapat dalam bunga tertentu,
dalam larutan basa senyawa ini berwarna merah ros dan tampak berupa bercak
kuning pada kromatogram kertas, warna kuning kuat berubah menjadi merah
jingga bila diberi uap ammonia. Senyawa ini menunjukkan puncak yang lebar
antara 390-450 nm pada daerah spektrum tampak (Harborne, 1987; Robinson,
1995).
Senyawa flavonoid baik dalam bentuk glikosida maupun dalam bentuk
aglikon mempunyai sejumlah gugus hidroksil sehingga merupakan senyawa yang
bersifat polar yang larut dalam pelarut polar. Adanya gula yang terikat pada
flavonoid (bentuk glikosida) cenderung menyebabkan flavonoid lebih mudah larut
dalam air dengan demikian campuran pelarut polar selain air dengan air
merupakan pelarut yang lebih baik untuk glikosida (Markham, 1988).
2.2.2. Glikosida
Glikosida adalah suatu senyawa yang jika dihidrolisis akan
menghasilkan bagian gula yang disebut glikon dan bagian bukan gula disebut
aglikon. Gula yang dihasilkan biasanya adalah glukosa, ramnosa dan lain
sebagainya. Jika bagian gulanya adalah glukosa maka disebut glukosida,
sedangkan jika bagian gulanya selain glukosa disebut glikosida (Harborne, 1987)
2.2.3. Tanin
Tanin adalah senyawa fenol yang tersebar luas pada tumbuhan
berpembuluh biasanya terdapat pada daun, buah, kulit kayu atau batang. Kadar
bagi tumbuhan dan membantu mengusir hewan pemakan tumbuhan. Beberapa
tanin terbukti mempunyai aktivitas antioksidan dan menghambat pertumbuhan
tumor (Harborne, 1987).
2.3 Ekstraksi
Ekstraksi merupakan suatu proses penarikan senyawa kimia dari jaringan
tumbuhan ataupun hewan dengan menggunakan penyari tertentu. Terdapat
beberapa macam metode ekstraksi, diantaranya adalah maserasi, perkolasi dan
sokletasi (Depkes, 1979).
Pembagian metode ekstraksi yaitu:
A. Cara Dingin
1. Maserasi
Maserasi adalah proses pengekstrakan simplisia dengan menggunakan pelarut
dengan beberapa kali pengocokan atau pengadukan pada temperatur ruangan
(kamar). Maserasi kinetik berarti dilakukan pengadukan yang kontinu.
Remaserasi berarti dilakukan pengulangan penambahan pelarut setelah
dilakukan penyaringan maserat pertama dan seterusnya (Ditjen POM, 2000).
2. Perkolasi
Perkolasi adalah ekstraksi dengan pelarut yang selalu baru sampai sempurna
yang umum dilakukan pada temperatur ruangan. Prosesnya terdiri dari tahapan
pengembangan bahan, tahap maserasi antara, tahap perkolasi sebenarnya
(penetasan/penampungan ekstrak), terus-menerus sampai diperoleh perkolat
B. Cara Panas
1. Refluks
Refluks adalah ekstraksi dengan pelarut pada temparatur titik didihnya, selama
waktu tertentu dan jumlah pelarut terbatas yang relatif konstan dengan adanya
pendingin balik. Umumnya dilakukan pengulangan proses pada residu
pertama sampai 3-5 kali sehingga dapat termasuk proses ekstraksi sempurna
(Ditjen POM, 2000).
2. Sokletasi
Sokletasi adalah ekstraksi menggunakan pelarut yang selalu baru yang
umumnya dilakukan dengan alat khusus sehingga terjadi ekstraksi kontinu
dengan jumlah pelarut relatif konstan dengan adanya pendingin balik (Ditjen
POM, 2000).
3. Digesti
Digesti adalah maserasi kinetik (dengan adanya pengadukan kontinu pada
temperatur yang lebih tinggi dari temperatur ruangan (kamar), yaitu secara
umum dilakukan pada temperatur 40-50◦ C (Ditjen POM, 2000).
4. Infus
Infus adalah ekstraksi dengan pelarut air pada temperatur penangas air (bejana
infus tercelup dalam penangas air mendidih, temperatur terukur pada suhu
96-98◦C selama waktu tertentu (15-20 menit) (Ditjen POM, 2000).
5. Dekok
Dekok adalah infus pada waktu yang lebih lama (≥30◦C) dan temperatur
2.4 Kromatografi Kertas
Kromatografi kertas (KKt) merupakan cara kromatografi yang paling
umum dan berguna, yang dilakukan oleh kimiawan pada saat ini, satu keuntungan
utama KKt ialah kemudahan dan kesederhanaan pada pelaksanaan pemisahan ,
yaitu hanya pada lembaran kertas saring yang berlaku sebagai medium
pemisahan. Pada KKt, senyawa biasanya dideteksi sebagai bercak berfluoresensi
ultraviolet setelah direaksikan dengan penampak bercak (Markham,1988).
Pada kromatografi kertas sebagai fase diam digunakan sehelai kertas
dengan susunan serabut tebal yang cocok. Pemisahan dapat dilakukan
menggunakan pelarut tunggal dan proses analog dengan kromatografi
penyerapan atau menggunakan dua pelarut yang tidak dapat bercampur dengan
proses analog dengan kromatografi pembagian, fase gerak merambat
perlahan-lahan melalui fase diam yang membungkus serabut kertas (Depkes, 1995).
Kadang-kadang bercak yang terdiri atas dua bercak atau lebih pada kromatografi
kertas tidak terpisah dengan baik. Jika dalam suatu fase gerak kelompok bercak
ini kecepatannnya cukup, maka kromatografi lewat kembang dapat
memisahkannya dengan lebih baik (Markham, 1988).
Gerakan noda suatu senyawa dalam pengembang tertentu disebut bilangan
Rf senyawa itu dalam pengembang tersebut. Bilangan Rf didefenisikan sebagai
jarak yangditempuh oleh senyawa dibagi dengan jarak yang ditempuh oleh garis
depan fase gerak (diukur dari garis awal). Karena itu bilangan Rf selalu lebih kecil
dari 1,0 (Markham, 1988). Cara yang lebih efektif yang dilaksanakan untuk
mengisolasi flavonoid adalah kromatografi kertas preparatif, merupakan cara
bundar pada garis awal tetapi berupa pita lebar 1-3 cm. Setelah pengembangan,
pita yang terjadi dapat dipotong-potong dan diekstraksi dengan pelarut (Markham,
1988).
2.5 Spektroskopi Serapan Ultraviolet
Spektroskopi serapan ultraviolet adalah cara yang berguna untuk
menganalisis struktur flavonoid. Cara tersebut digunakan untuk membantu
mengidentifikasi jenis flavonoid dan menentukan pola oksigenasi. Disamping itu
kedudukan gugus hidroksil fenol bebas pada inti flavonoid dapat ditentukan
dengan penambahan pereaksi geser kedalam larutan cuplikan dan mengamati
pergeseran puncak serapan yang terjadi (Markham, 1988). Spektrum flavonoid
biasanya ditentukan dalam pelarut metanol. Spektrum khas terdiri atas dua
maksima pada rentang 240-285 nm (pita II) dan 300-550 nm (pita I) (Markam,
1988).
Beberapa istilah dalam spektrofotometri ultraviolet antara lain :
a. Auksokrom ; merupakan gugus jenuh dengan adanya electron bebas (tidak
terikat), dimana jika gugus ini bergabung dengan kromofor, akan
mempengaruhi panjang gelombang dan intensitas absorban.
b. Pergeseran batokromik ; merupakan pergeseran absorban ke daerah
panjang gelombang yang lebih panjang karena danya substitusi atau efek
pelarut.
c. Pergeseran hipsokromik ; merupakan pergeseran absorban ke daerah
panjang gelombang yang lebih pendek karena adanya substitusi atau efek
pelarut.
e. Efek hiperkromik ; merupakan penurunan intensitas absorban.
f. Kromofor ; merupakan gugus yang tak jenuh yang bertanggung jawab
terhadap terjadinya absorbsi elektronik.
2.5.1 Spektrum Natrium Metoksida
Natrium metoksida adalah merupakan basa kuat yang dapat mengionisasi
hampir semua gugus hidroksil yang terdapat pada inti flavonoida. Spektrum ini
biasanya merupakan petunjuk sidik jari pola hiroksilasi. Degradasi atau
pengurangan kekuatan spektrum setelah waktu tertentu merupakan petujuk baik
akan adanya gugus yang peka tehadap basa. Pereaksi pengganti natrium
metoksida adalah larutan natrium hidroksida 2 N dalam air (Markham, 1988).
2.5.2 Spektrum Natrium Asetat
Natrium asetat hanya menyebabkan pengionan yang berarti pada gugus
hidroksil flavonoida. Natrium asetat digunakan terutama untuk mendeteksi
adanya gugus 7 hidroksil (Markham, 1988).
2.5.3 Spektrum natrium asetat/asam borat
Menjembatani kedua gugus hidroksil pada gugus orto-dihidroksi dan
digunakan untuk mendeteksinya (Markham, 1988).
2.5.4 Spektrum AlCl3/HCl
Karena membentuk kompleks antara gugus hidroksil dan keton yang
bertetangga dan membentuk kompleks dengan gugus orto-dihidroksil, pereaksi ini
dapat digunakan untuk mendeteksi kedua gugus tersebut. Jadi spekrum AlCl3
merupakan penjumlahan pengaruh semua kompleks hidroksi keton (Markham,
BAB III
METODE PENELITIAN
Metode penelitian ini meliputi pegumpulan dan pengolahan sampel,
pembuatan pereaksi, pemeriksaan karakterisasi simplisia, skrining fitokimia,
pembuatan ekstrak, isolasi senyawa flavonoid, analisis dengan kromatografi
kertas, uji kemurnian isolat dan karakterisasi hasil isolasi secara spektrofotometeri
ultraviolet menggunakan pereaksi geser.
3.1. Alat-alat yang digunakan
Alat-alat yang digunakan dalam penelitian ini adalah : alat-alat gelas,
bejana kromatografi (Dessaga), blender (National), krus porselin, lampu
ultraviolet 366 nm (Diamond), mikroskop cahaya, neraca kasar (Tanita), neraca
listrik (Vibra AJ), ovent (Memmert), penangas air (Yenako), rotary evaporator
(Haake DI), seperangkat alat penetapan kadar air, seperangkat alat refluks,
spektrofotometer ultraviolet (Shimadzu).
3.2. Bahan-bahan yang digunakan
Tumbuhan yang digunakan pada penelitian ini adalah daun sirih merah
(Piper porphyrophyllum N.E.Br.). Bahan kimia yang digunakan kecuali
dinyatakan lain adalah berkualitas pro analisis, yaitu alfa naftol, aluminium (III)
klorida, ammonium hidroksida, asam asetat anhidrida, asam asetat pekat, asam
borat anhidrat, asam klorida pekat, asam nitrat pekat, asam sulfat pekat, benzen,
besi (III) klorida, bismuth (III) nitrat, n-butanol, etanol, eter, etil asetat, n-heksan,
asetat anhidrat, natrium hidroksida, natrium sulfat anhidrat, raksa (II) klorida,
serbuk magnesium, serbuk zinkum, timbal (II) asetat, toluen dan air suling.
3.3 Penyiapan sampel 3.3.1 Pengambilan sampel
Pengambilan sampel dilakukan secara purposif tanpa membandingkan
dengan tumbuhan yang sama dari daerah lain. Sampel yang digunakan yaitu daun
sirih merah (Piper porphyrophyllum N.E.Br.), berasal dari daerah Marike,
Kabupaten Langkat, Provinsi Sumatera Utara.
3.3.2 Identifikasi Tumbuhan
Identifikasi tumbuhan dilakukan di Lembaga Ilmu Pengetahuan Indonesia
(Indonesian Institute Biologi), Pusat Penelitian Biologi (Research Center For
Biology), Bogor.
3.3.3 Pengolahan sampel
Daun sirih merah yang segar dibersihkan dari kotoran dengan cara
mencucinya dengan air bersih, ditiriskan. Kemudian dikeringkan dengan cara
diangin-anginkan di udara terbuka, terlindung dari sinar matahari langsung.
Serbuk simplisia dianggap kering bila sudah rapuh, lalu diserbuk.
3.4 Pembuatan Larutan Pereaksi
3.4.1 Pereaksi Bouchardat (Depkes, 1989)
Sebanyak 4 g kalium iodida ditimbang, kemudian dilarutkan dalam air
suling secukupnya, ditambahkan iodium sebanyak 2 g dan ditambahkan dengan
3.4.2 Pereaksi Dragendorff (Depkes, 1989)
Sebanyak 0,8 g bismuth (III) nitrat ditimbang, kemudian dilarutkan dalam
20 ml asam pekat. Pada wadah lain ditimbang 27,2 g kalium iodida lalu dilarutkan
dalam 50 ml air suling, kemudian campurkan kedua larutan dan diamkan sampai
memisah sempurna. Ambil larutan jernih dan encerkan dengan air suling hingga
100 ml.
3.4.3 Pereaksi Mayer (Depkes, 1989)
Sebanyak 1,3596 g raksa (II) klorida ditimbang, kemudian dilarutkan
dalam air suling hingga 60 ml. Pada wadah lain ditimbang sebanyak 5 g kalium
iodida lalu dilarutkan dalam 10 ml suling. Kemudian keduanya dicampur dan
ditambahkan air suling hingga 100 ml.
3.4.4 Pereaksi Molish (Depkes, 1989)
Sebanyak 3 g alfa naftol ditimbang, kemudian dilarutkan dalam asam
nitrat 0,5 N hingga 100 ml.
3.4.5 Pereaksi Timbal (II) Asetat 0,4 M (Depkes, 1989)
Sebanyak 15,17 g timbal (II) asetat ditimbang, kemudian dilarutkan dalam
air suling bebas karbondioksida hingga 100 ml.
3.4.6 Pereaksi Asam Sulfat 2 N (Depkes, 1989)
Asam sulfat pekat sebanyak 18 ml diencerkan dengan air suling
secukupnya hingga volume 100 ml.
3.4.7 Pereaksi Asam Nitrat 0,5 N (Depkes, 1989)
Asam nitrat pekat sebanyak 44,7 ml diencerkan dengan air suling
3.4.8 Pereaksi Kloralhidrat (Depkes, 1989)
Sebanyak 50 g kloralhidrat dilarutkan didalam 20 ml air suling.
3.4.9 Pereaksi Asam Klorida 2 N (Depkes, 1979)
Sebanyak 17 ml asam klorida pekat diencerkan dengan air suling hingga
100 ml.
3.4.10 Pereaksi Natrium Hidroksida 2 N (Depkes, 1979)
Sebanyak 8,002 g kristal natium hidroksida ditimbang, kemudian
dilarutkan dalam air suling hingga 100 ml.
3.4.11 Pereaksi Besi (III) Klorida 1% b/v (Depkes, 1979)
Sebanyak 1 g besi (III) klorida ditimbang, kemudian dilarutkan dalam air
hingga 100 ml.
3.4.12 Pereaksi Liebermann-Burchard (Depkes, 1979)
Sebanyak 20 bagian asam asetat anhidrat dan satu bagian asam sulfat
pekat.
3.4.13 Pereaksi Asam Klorida 4 N (Markham, 1988)
Sebanyak 50 ml asam klorida pekat diencerkan dengan air suling hingga
150 ml.
3.4.14 Pereaksi Aluminium Klorida 5 % b/v (Markham, 1988)
Sebanyak 5 g aluminium klorida ditimbang, kemudian dilarutkan dalam
metanol hingga 100 ml.
3.4.15 Fase Gerak Butanol-Air-Asam Asetat (BAA) (Markham, 1988)
Sebanyak butanol 20 ml, asam asetat 5 ml, air suling 25 ml, diambil
3.4.16 Fase Gerak Forestal (Markham, 1988)
Sebanyak 30 ml asam asetat, air suling 10 ml, dan asam klorida 3 ml.
Perbandingan fase gerak 30 : 10 : 3.
3.5 Pemerikasaan Makroskopik dan Mikoskopik Daun Sirih Merah 3.5.1 Pemeriksaan Makroskopik
Pemeriksaan makroskopik dilakukan dengan mengamati bentuk, ukuran,
warna, rasa dan bau dari daun segar sirih merah (Piper porphyrophyllum N.E.Br.).
Gambar daun segar dapat dilihat pada lampiran 2 gambar 1 halaman 46.
3.5.2 Pemerikasaan Mikroskopik
Pemeriksaan mikroskopik dilakukan terhadap daun sirih merah. Daun
sirih merah segar disayat melintang lalu diletakkan diatas kaca objek yang telah
ditetesi dengan larutan kloralhidrat dan ditutup dengan kaca penutup, kemudian
diamati dibawah mikroskop. Hasil pemeriksaan mikroskopik penampang
melintang daun sirih merah dapat dilihat pada lampiran 4 gambar 4 halaman 48.
3.6. Pemeriksaan Karakterisasi Simplisia
Pemeriksaan karakterisasi simplisia meliputi makoskopik dan mikroskopik
simplisia, penetapan kadar air, penetapan kadar sari yang larut dalam air,
penetapan kadar sari yang larut dalam etanol, penetapan kadar abu total,
penetapan kadar abu yang tidak larut dalam asam (Depkes, 1989).
3.6.1. Pemeriksaan Makroskopik
Pemeriksaan makroskopik dilakukan dengan mengamati bentuk, ukuran,
warna dari simplisia sirih merah. Gambar simplisia dapat dilihat pada lampiran 3
3.6.2 Pemeriksaan Mikroskopik
Pemeriksaan mikroskopik dilakukan terhadap serbuk simplisia sirih
merah. Serbuk simplisia ditaburkan diatas kaca objek yang telah ditetesi dengan
larutan kloralhidrat dan ditutup dengan kaca penutup, kemudian diamati dibawah
mikroskop. Hasil pemeriksaan mikroskopik serbuk simplisia dapat dilihat pada
lampiran 5 gambar 5 halaman 49.
3.6.3 Penetapan Kadar Air (WHO, 1992)
Sebanyak 200 ml toluen dan 2 ml air suling ke dalam labu alas bulat, lalu
didestilasi selama dua jam. Setelah itu, toluen didinginkan selama 30 menit, dan
dibaca volume air pada tabung penerima dengan ketelitian 0,05. Kemudian
kedalam labu tersebut dimasukkan 5 g serbuk simplisia yang telah ditimbang
seksama, dimasukkan kedalam labu alas, labu dipanaskan hati-hati selama
15 menit. Setelah toluen mendidih, kecepatan tetesan diatur sebanyak dua tetes
untuk tiap detik sampai sebagian besar air terdestilasi selanjutnya diatur empat
tetes tiap detik. Setelah semua air terdestilasi, bagian dalam pendingin dibilas
dengan toluen. Destilasi dilanjutkan selama lima menit, kemudian tabung
penerima dibiarkan mendingin pada suhu kamar. Setelah air dan toluen memisah
sempurna, volume air dibaca dengan ketelitian 0,05 ml. Selisih kedua volume air
dibaca sesuai dengan kandungan air yang terdapat dalam bahan yang diperiksa.
Kadar air dihitung dalam persen.
3.6.4 Penetapan kadar sari yang larut dalam air (Depkes, 1995)
Sebanyak 5 g serbuk simplisia di maserasi selama 24 jam dalam campuran
100 ml air-kloroform (2,5 ml kloroform dalam air sampai 1 liter) dalam labu
18 jam, lalu disaring. Sebanyak 20 ml filtrat diuapkan sampai kering dalam cawan
dangkal berdasar rata yang telah ditara dan sisa dipanaskan pada suhu 105oC
sampai bobot tetap. Kadar sari larut dalam air dihitung terhadap bahan yang telah
dikeringkan di udara.
3.6.5 Penetapan kadar sari yang larut dalam etanol (Depkes, 1995)
Sebanyak 5 g serbuk simplisia di maserasi selama 24 jam dalam 100 ml
etanol 96% dalam labu bersumbat sambil sesekali dikocok selama enam jam,
kemudian dibiarkan selama 18 jam. Kemudian disaring cepat untuk menghindari
penguapan etanol. Sebanyak 20 ml filtrat diuapkan sampai kering dalam cawan
dangkal berdasar rata yang telah ditara dan sisa dipanaskan pada suhu 105oC
sampai bobot tetap. Kadar sari larut dalam etanol dihitung terhadap bahan yang
telah dikeringkan diudara.
3.6.6 Penetapan kadar abu total (Depkes, 1995; WHO, 1992)
Sebanyak 2 g serbuk simplisia ditimbang seksama dimasukkan dalam krus
porselin yang telah dipijar dan ditara lebih dahulu, kemudian diratakan. Krus
dipijarkan pada suhu 600oC selama tiga jam, kemudian didinginkan dan
ditimbang sampai diperoleh bobot tetap. Kadar abu serbuk simplisia sirih merah
dihitung terhadap bahan yang telah dikeringkan
3.6.7 Penetapan kadar abu yang tidak larut dalam asam (WHO, 1992)
Sebanyak 25 ml asam klorida encer dimasukkan abu serbuk simplisia sirih
merah yang diperoleh dalam penetapan kadar abu total, kemudian dididihkan
selama lima menit. Bagian yang tidak larut dalam asam dikumpulkan, disaring
melalui kertas saring bebas abu kemudian dicuci dengan air panas. Residu dan
didinginkan dan ditimbang. Kadar abu tidak larut dalam asam dihitung terhadap
bahan yang dikeringkan diudara.
3.7. Skrining Fitokimia
3.7.1 Pemeriksaan Alkaloid (Depkes, 1995)
Sebanyak 0,5 g serbuk simplisia ditimbang, kemudian ditambah 1 ml asam
klorida 2 N dan 9 ml air suling, dipanaskan diatas penangas air selama dua menit,
didinginkan dan disaring. Filtrat dipakai untuk percobaan berikut:
(i) Sebanyak 3 tetes filtrat ditambahkan dua tetes larutan pereaksi Mayer, maka
akan terbentuk endapan menggumpal berwarna putih atau putih kekuningan.
(ii) Sebanyak 3 tetes filtrat ditambahkan dua tetes larutan pereaksi Bouchardat,
akan terbentuk endapan berwarna coklat sampai hitam.
(iii) Sebanyak 3 tetes filtrat ditambah dengan dua tetes larutan pereaksi
Dragendroff, akan terbentuk endapan merah atau jingga.
Percobaan dilanjutkan dengan mengocok sisa filtrat dengan 3 ml ammonia
pekat dan 10 ml campuran eter dan kloroform (3:1), diambil lapisan kloroform
lalu diuapkan diatas penangas air. Sisanya kemudian dilarutkan dengan 1 ml
asam klorida 2 N dan dibagi tiga, masing-masing ditambahkan pereaksi Mayer,
Bouchardat dan Dragendorff. Alkaloid positif jika terjadi endapan atau kekeruhan
paling sedikit dua dari tiga percobaan di atas.
3.7.2 Pemeriksaan Flavonoid (Farnsworth, 1996)
Sebanyak 10 g serbuk simplisia ditambahkan 100 ml air panas, dididihkan
selama lima menit dan disaring dalam keadaan panas. Kedalam 5 ml filtrat
amilalkohol, dikocok dan dibiarkan memisah. Flavonoid positif jika terjadi warna
merah, kuning, jingga pada lapisan amilalkohol.
3.7.3 Pemeriksaan Glikosida (Depkes, 1989)
Sebanyak 3 g serbuk simplisia disari dengan 30 ml campuran etanol 95 %
dengan air suling (7:3) dan 10 ml asam sulfat 2 N, direfluks selama sepuluh menit,
didinginkan dan disaring. Diambil 20 ml filtrat, ditambahkan 25 ml air suling dan
25 ml timbal (II) asetat 0,4 M, dikocok, didiamkan selama lima menit dan
disaring. Filtrat dipartisi dengan 20 ml campuran kloroform dan isopropanol (3:2),
dilakukan berulang sebanyak tiga kali. Lapisan air dikumpulkan, diuapkan pada
temperatur tidak lebih dari 50oC. Sisanya dilarutkan dalam 2 ml metanol,
kemudian dimasukkan kedalam tabung reaksi, selanjutnya diuapkan diatas
penangas air. Pada sisanya ditambahkan 2 ml air suling dan lima tetes pereaksi
Molish. Tambahkan secara hati-hati 2 ml asam sulfat pekat melalui dinding
tabung. Apabila terbentuk cincin ungu pada batas kedua cairan, menunjukkan
adanya glikosida.
3.7.4 Pemeriksaan Glikosida Antrakinon (Depkes, 1989)
Sebanyak 0,2 g serbuk simplisia ditambah dengan 5 ml asam sulfat 2 N,
dipanaskan sebentar, setelah dingin ditambahkan 10 ml benzen, dikocok dan
didiamkan. Lapisan benzen dipisahkan dan disaring. Kocok lapisan benzen
dengan 2 ml NaOH 2 N, didiamkan. Lapisan ini berwarna merah dan lapisan
3.7.5 Pemeriksaan Saponin 3.7.5.1 Uji Busa (Depkes, 1989)
Sebanyak 0,5 g serbuk simplisia dimasukkan kedalam tabung reaksi, lalu
ditambahkan 10 ml air panas dan didinginkan, kemudian dikocok kuat-kuat
selama sepuluh detik. Jika terbentuk busa setinggi 1-10 cm yang stabil tidak
kurang dari sepuluh menit dan tidak hilang dengan penambahan asam klorida 2 N
menunjukkan adanya saponin.
3.7.5.2 Uji dengan pereaksi Liebermann-Burchard (Depkes, 1989)
Serbuk simplisia ditimbang sebanyak 0,5 g, ditambahkan 10 ml metanol,
direfluks selama sepuluh menit kemudian sewaktu panas disaring melalui kertas
saring. Filtrat diencerkan dengan 10 ml air suling, dikocok dengan 10 ml n-heksan
lalu diambil lapisan n-heksan dan diuapkan dalam cawan penguap. Pada sisanya
ditambahkan pereaksi Liebermann-Burchard. Apabila terbentuk warna biru,
biru-hijau, merah, merah muda atau ungu menunjukkan adanya saponin.
3.7.6 Pemeriksaan Tanin (Depkes, 1989)
Sebanyak 0,5 g serbuk simplisia disari dengan 10 ml air suling, lalu
disaring. Filtratnya diencerkan dengan air suling sampai tidak berwarna. Larutan
diambil sebanyak 2 ml dan ditambahkan satu hingga dua tetes pereaksi besi (III)
klorida 1%. Apabila terjadi warna biru kehitaman atau hijau kehitaman,
menunjukkan adanya tanin.
3.7.7 Pemeriksaaan Triterpenoid/Steroid (Harborne, 1987)
Sebanyak 1 g serbuk simplisia dimaserasi dengan 20 ml n-heksan selama
dua jam. Kemudian maserat yang diperoleh disaring, lalu filtrat diuapkan dalam
Apabila terbentuk warna biru kehijauan atau merah ungu menunjukkan adanya
triterpenoid/steroid bebas.
3.8. Pembuatan ekstrak
Sebanyak 500 g serbuk simplisia dimasukkan ke dalam wadah berwarna
gelap, ditambahkan pelarut etanol 80% v/v sampai serbuk terendam sempurna
(Fanrsworth, 1966). Kemudian ditutup dan dibiarkan selama lima hari terlindung
dari cahaya sambil sering diaduk, disaring dan dipisahkan ampasnya (Depkes RI,
1985). Kemudian ampas ditambahkan cairan penyari sampai terendam sebanyak
500 ml, kemudian dilakukan perlakuan yang sama sampai diperoleh maserat
jernih. Seluruh maserat digabungkan dan diuapkan menggunakan alat penguap
vakum putar sampai diperoleh ekstrak etanol kental.
3.9 Ekstraksi Cair-Cair Senyawa Flavonoid dari Ekstrak Etanol Kental Ekstraksi cair-cair senyawa flavonoid dari ekstrak etanol kental dilakukan
berturut-turut dengan menggunakan pelarut n-heksan, kloroform, dan etilasetat.
Ekstrak etanol kental dilarutkan 10 ml etanol, dimasukkan kedalam corong pisah
kemudian difraksinasi dengan pelarut n-heksan : air (1:1), diperoleh fraksi
n-heksan dan fraksi air. Fraksi n-heksan dipisahkan, fraksi air difraksinasi kembali
dengan kloroform (1:1), diperoleh fraksi kloroform dan fraksi air. Fraksi
kloroform dipisahkan, fraksi air dihidrolisis dengan asam klorida pekat dan
direfluks selama lima jam. Fraksi air hasil hidrolisis difraksinasi kembali dengan
etilasetat (1:1), diperoleh fraksi etilasetat dan fraksi air. Fraksi etilasetat dan fraksi
air masing-masing dipekatkan diatas penangas air.
3.10. Analisis Senyawa Flavonoid dari Ekstrak Hasil Fraksinasi dengan Cara Kromatografi Kertas (KKt)
Menurut (Markham, 1988), fraksi etilasetat dianalisis dengan KKt
masing-masing menggunakan fase gerak:
(i). BAA
(ii). Forestal
(iii). Asam asetat 50%
(iv). Asam asetat 15%
(v). Asam klorida 1%
Fraksi etilasetat di totolkan pada kertas Whatmann No.1, kemudian
dimasukkan kedalam bejana yang telah dijenuhkan dengan fase gerak BAA,
Forestal, asam asetat 50%, asam asetat 15% dan asam klorida 1% dan dielusi
dengan jarak rambat 13 cm. Kemudian kertas diangkat dan dikeringkan, diamati
dibawah sinar ultraviolet. Kemudian disemprot dengan penampak bercak
aluminium klorida 5% b/v, besi (III) klorida 1% b/v dan uap ammonia kemudian
diamati dibawah sinar ultraviolet pada panjang gelombang 366 nm. Diantara
semua fase gerak diperoleh bercak yang paling banyak dan terpisah dengan baik
adalah fase gerak asam asetat 50%, maka dilanjutkan pemisahan secara
kromatografi KKt preparatif dengan fase gerak asam asetat 50%.
3.11 Pemisahan Senyawa Flavonoida dari Fase Gerak Asam asetat 50% v/v dengan cara KKt Preparatif
Terhadap fraksi etilasetat dilakukan pemisahan secara KKt preparatif
dengan fase gerak asam asetat 50%, dan fase diam kertas Whatmann No.3. Fraksi
etilasetat yang telah diencerkan ditotolkan berupa pita lebar lalu dielusi.
panjang gelombang 366 nm. Bercak diberi tanda dan digunting berupa pita
menjadi potongan-potongan kecil, dimaserasi dengan metanol selama 24 jam dan
sekali-sekali dikocok, lalu disaring. Selanjutnya filtrat dikumpulkan dan
dipekatkan hingga diperoleh isolat.
3.12 Uji Kemurnian Senyawa Flavonoid dari Hasil KKt Preparatif
Uji kemurnian terhadap isolat hasil KKt preparatif dilakukan dengan cara
kromatografi kertas dua arah menggunakan dua sistem fase gerak yaitu BAA
sebagai fase gerak I, dan asam asetat 50% sebagai fase gerak II, dengan
menggunakan fase diam kertas Whatmann No. 3, penampak bercak aluminium
klorida 5% b/v. Isolat ditotolkan pada kertas Whatmann No.3 yang berukuran
18x20 cm, dimasukkan kedalam bejana yang telah jenuh dengan uap fase gerak I
lalu dielusi, kertas diangkat dan dikeringkan, selanjutnya dielusi kembali dengan
fase gerak II dengan arah yang berbeda, kemudian kertas diangkat dan
dikeringkan, bercak diamati dibawah sinar ultraviolet pada panjang gelombang
366 nm.
3.13 Identifikasi Senyawa Isolat
Identifikasi senyawa isolat dilakukan secara spektrofotometri ultraviolet
menggunakan pereaksi geser yaitu:
(i). Isolat dilarutkan dengan metanol (larutan isolat), dimasukkan kedalam kuvet
dan kemudian diukur spektrumnya. Setelah diukur spektrumnya dalam
metanol, ditambahkan tiga tetes larutan natrium hidroksida 2 N kedalam kuvet
dan diukur spektrumnya, kemudian setelah lima menit diukur kembali
(ii). Larutan isolat ditambahkan enam tetes pereaksi aluminium klorida, dikocok
dan diukur spektrumnya, selanjutnya ditambahkan tiga tetes asam klorida 6 N
dan diukur spektrumnya.
(iii). Larutan isolat ditambahkan serbuk natrium asetat pada dasar kuvet, dikocok
dan diukur spektrumnya. Spektrum natrium asetat diukur kembali setelah lima
menit. Kemudian kedalam kuvet tersebut ditambahkan serbuk asam borat dan
dicampur, lalu diukur spektrumnya (Markham, 1988; Mabry, 1970).
BAB IV
HASIL DAN PEMBAHASAN
Hasil identifikasi tumbuhan yang dilakukan oleh Pusat dan Pengembangan
Biologi, LIPI Bogor hasilnya disebutkan tumbuhan yang digunakan adalah
tumbuhan sirih merah (Piper porphyrophyllum N.E.Br.) suku Piperaceae.
Hasilnya dapat dilihat pada lampiran 1 halaman 45. Gambar tumbuhan pada
lampiran 2 halaman 46, gambar simplisia pada lampiran 3 halaman 47.
Hasil pemeriksaan makroskopik sirih merah segar adalah helaian daun
berbentuk bulat telur, pada bagian pangkal berbentuk jantung, permukaan daun
seperti baldu dengan warna merah, pada bagian bawah daun dan warna putih
keabuan pada bagian atas daun, mempunyai rasa yang sedikit pahit. Hasil
pemeriksaan mikroskopik sirih merah menunjukkan adanya kutikula, epidermis,
hipodermis, sel minyak, palisade, bunga karang, epidermis bawah, rambut
kelenjar, berkas pembuluh, rambut penutup, kolenkim, stomata, saluran sizogen.
Hasil pemeriksaan makroskopik simplisia adalah simplisia berwarna cokelat dan
rapuh. Hasil pemeriksaan mikroskopik simplisia menunjukkan adanya permukaan
daun bagian bawah, permukaan daun bagian atas, mesofil, epidermis bawah,
pembuluh kayu, epidermis bawah, sel minyak.
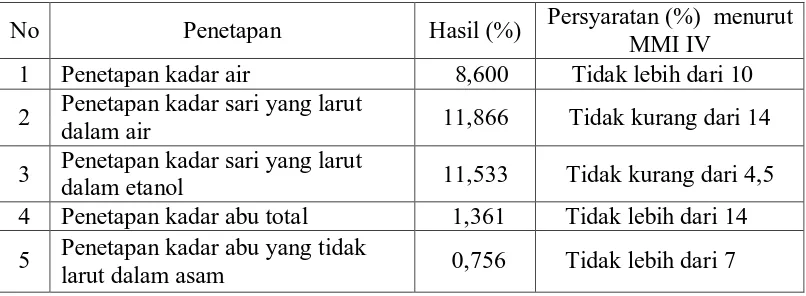
Pemeriksaan karakterisasi serbuk simplisia untuk daun sirih sebagai
standard digunakan daun sirih merah (Piper porphyrophyllum N.E.Br.) menurut
(Materia Medika Indonesia (MMI), 1980) diperoleh kadar air sebesar 8,600%, ini
menunjukkan bahwa serbuk simplisia telah memenuhi persyaratan penetapan
11,866%, ternyata jika dibandingkan dengan kadar sari pada sirih (Piper betle L.)
tidak sama yaitu (14%), ini kemungkinan pada sirih merah tumbuhan memiliki
kandungan senyawa non polar yang lebih besar. Kadar sari yang larut dalam
etanol sebesar 11,533% ini menunjukkan serbuk simplisia memenuhi persyaratan
penetapan kadar sari yang larut dalam etanol. Kadar abu total sebesar 1,361%
menunjukkan bahwa serbuk simplisia memenuhi persyaratan penetapan kadar abu
total dan kadar abu yang tidak larut dalam asam sebesar 0,756% menunjukkan
bahwa serbuk simplisia memenuhi persyaratan penetapan kadar abu yang tidak
larut dalam asam. Hasil pemeriksaan karakterisasi serbuk simplisia sirih merah
dapat dilihat pada Tabel 1.
Tabel 1. Hasil pemeriksaan karakterisasi serbuk simplisia sirih merah
No Penetapan Hasil (%) Persyaratan (%) menurut MMI IV
1 Penetapan kadar air 8,600 Tidak lebih dari 10
2 Penetapan kadar sari yang larut
dalam air 11,866 Tidak kurang dari 14
3 Penetapan kadar sari yang larut
dalam etanol 11,533 Tidak kurang dari 4,5
4 Penetapan kadar abu total 1,361 Tidak lebih dari 14
5 Penetapan kadar abu yang tidak
larut dalam asam 0,756 Tidak lebih dari 7
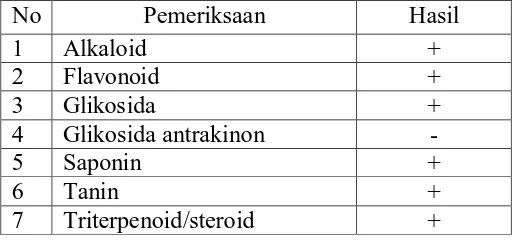
Hasil pemeriksaan skrining fitokimia daun sirih merah (Piper
porphyrophyllum N.E.Br.) menunjukkan adanya golongan senyawa alkaloid,
glikosida, flavonoid, saponin, tanin, triterpenoid/steroid. Hasilnya dapat dilihat
pada tabel 2. Pada serbuk simplisia sirih merah yang ditambahkan dengan
pereaksi Dragendorff memberikan endapan yang berwarna coklat kemerahan,
dengan pereaksi Bouchardat memberikan endapan yang berwarna jingga keruh,
dilakukan uji selanjutnya yaitu reaksi asam basa dengan penambahan amonia
pekat yang dilanjutkan dengan pengocokan menggunakan eter-kloroform (3:1)
dimana lapisan kloroform tersebut diasamkan dengan asam klorida 2 N dan
masing-masing ditambahkan dengan pereaksi Dragendorff, Bouchardat dan
Mayer. Hasil yang diperoleh ternyata sama dengan hasil sebelumnya yang
menunjukkan adanya alkaloid. Penambahan serbuk zinkum dan asam klorida
pekat memberikan warna merah kecoklatan, sedangkan penambahan serbuk
magnesium dan asam klorida pekat memberikan warna merah, menunjukkan
adanya senyawa flavonoid.
Skrining glikosida ditunjukkan dengan penambahan Molish dan asam
sulfat pekat dimana terbentuk cincin ungu kebiruan. Skrining saponin
menghasilkan busa yang stabil dan tidak hilang dengan penambahan
asam klorida 2 N. Skrining tanin dengan penambahan besi (III) klorida 1%
memberikan warna biru kehitaman menunjukkan tanin dan untuk senyawa
triterpenoid/steroid dengan penambahan pereaksi Liebermann-Burchard
memberikan warna biru hijau menunjukkan adanya triterpenoid/steroid. Hasil
skrining fitokimia serbuk simplisia sirih merah dapat dilihat pada Tabel 2.
Tabel 2. Hasil skrining fitokimia serbuk simplisia sirih merah
No Pemeriksaan Hasil
1 Alkaloid +
7 Triterpenoid/steroid +
Ekstraksi dilakukan dengan cara maserasi menggunakan pelarut etanol
80%, diharapkan senyawa-senyawa yang bersifat polar dan nonpolar dapat tersari
dengan sempurna. Hasil maserasi dari 500 g simplisia daun sirih merah dengan
etanol 80% diperoleh ekstrak kental 55,95 g. Terhadap ekstrak etanol dilakukan
metode ekstraksi cair-cair menggunakan pelarut n-heksan : air (1:1) dimana
senyawa-senyawa yang bersifat nonpolar berada pada lapisan n-heksan dan
senyawa polar berada pada lapisan air. Kemudian dilanjutkan dengan pelarut
kloroform : air (1:1), dimana senyawa-senyawa yang bersifat semipolar berada
pada lapisan kloroform dan senyawa polar berada pada lapisan air dan dilanjutkan
kembali dengan pelarut etilasetat : air (1:1).
Analisis Kromatografi kertas terhadap fraksi etilasetat digunakan lima fase
gerak yaitu BAA, Forestal, asam asetat 50%, asam asetat 15%, dan asam klorida
1%. Sebagai fase diam kertas Whatmann No.1 dengan penampak bercak uap
ammonia, aluminium klorida 5%, dan besi (III) klorida 1%, kemudian diamati
dibawah sinar ultraviolet pada panjang gelombang 366 nm. Pemisahan noda yang
baik untuk fraksi etilasetat adalah fase gerak asam asetat 50%. Hasil analisis yang
diperoleh ternyata fase gerak yang paling baik adalah asam asetat 50% karena
memberikan noda yang terbanyak yaitu lima bercak dilihat dibawah sinar lampu
ultraviolet pada panjang gelombang 366 nm, disemprot dengan Aluminium
klorida 5% dan Aluminium klorida 5%/UV, diperoleh Rf 0,15 (biru lemah), 0,52
(merah ungu), 0,65 (biru), 0,77 (ungu), 0,91 (kuning) pada sinar lampu UV.
Terhadap fraksi etilasetat dilakukan kromatografi kertas (KKt) preparatif
dengan fase gerak asam asetat 50%, fase diam kertas Whatmann No.3, selanjutnya
berupa potongan-potongan kecil, selanjutnya direndam dalam metanol selama
24 jam, sekali-sekali dikocok, lalu disaring. Maserasi diulangi hingga filtrat
jernih, kemudian masing-masing fraksi dikumpulkan menjadi satu dan
dipekatkan, hasilnya diperoleh, isolat F1 (biru lemah), F2 (merah ungu), F3 (biru),
F4 (ungu) dan F5(kuning). Terhadap kelima isolat tersebut diuji kemurnian
dengan KKt satu arah, dengan fase gerak BAA, Forestal, asam asetat 50%, asam
asetat 15%, asam klorida 1%, hasilnya tetap menunjukkan satu noda dengan sinar
lampu UV, Aluminium klorida 5% dan Aluminium klorida 5%/UV, hasilnya
dapat dilihat pada lampiran 50 halaman 86, sedangkan KKt dua arah dengan fase
gerak I BAA, fase gerak II asam asetat 50%, menggunakan penampak noda
Aluminium klorida 5%, hasilnya tetap menunjukkan satu noda. Penafsiran
spektrum ultraviolet dilakukan terhadap isolat F1, F2, F3, F4, dan F5 dengan
merujuk pada Mabry (1970) dan Markham (1988).
Penafsiran spektrum ultraviolet untuk F1 adalah sebagai berikut:
(i). Hasil spektrum F1 dalam metanol memberikan dua pita absorpsi maksimum
yaitu 364 nm (pita I) absorbsi pada cincin B (sinamoil) dan 274 nm (pita II)
absorpsi pada cincin A (benzoil). Menurut Markham (1988) diduga senyawa
flavonol dengan 3-OH dimana absorpsi pita I pada 352-385 nm dan pita II pada
240-280 nm.
(ii). Hasil spektrum F1 dalam metanol dengan penambahan natrium hidroksida
2 N menunjukkan adanya pergeseran batokromik sebanyak 1 nm pada pita I yaitu
dari 364 nm menjadi 365 nm, dan 4 nm pada pita II yaitu dari 274 nm menjadi
278 nm. Dengan penambahan natrium hidroksida 2 N dibandingkan dengan