UJI AKTIVITAS ANTIBAKTERI MINYAK ATSIRI
DAN EKSTRAK ETANOL DARI BUNGA
KECOMBRANG (
Nicolaia speciosa
Horan) TERHADAP
BAKTERI
Staphylococcus epidermidis, Staphylococcus
aureus
DAN
Pseudomonas aeruginosa
SKRIPSI
OLEH:
FERAWATI PARDOSI NIM 091524003
PROGRAM EKSTENSI SARJANA FARMASI FAKULTAS FARMASI
UJI AKTIVITAS ANTIBAKTERI MINYAK ATSIRI DAN EKSTRAK ETANOL DARI BUNGA
KECOMBRANG (Nicolaia speciosa Horan) TERHADAP BAKTERI Staphylococcus epidermidis, Staphylococcus aureus DAN
Pseudomonas aeruginosa
SKRIPSI
Diajukan untuk melengkapi salah satu syarat untuk memperoleh gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH:
FERAWATI PARDOSI NIM 091524003
PROGRAM EKSTENSI SARJANA FARMASI FAKULTAS FARMASI
PENGESAHAN SKRIPSI
UJI AKTIVITAS ANTIBAKTERI MINYAK ATSIRI
DAN EKSTRAK ETANOL DARI BUNGA
KECOMBRANG (
Nicolaia speciosa
Horan) TERHADAP
BAKTERI
Staphylococcus epidermidis, Staphylococcus
aureus
DAN
Pseudomonas aeruginosa
OLEH:
FERAWATI PARDOSI NIM 091524003
Dipertahankan di hadapan Panitia Penguji Skripsi Fakultas Farmasi
Universitas Sumatera Utara
Pada tanggal : Februari 2012
Pembimbing I, Panitia Penguji,
Dra. Erly Sitompul, M.Si., Apt Dr. Ginda Haro, M.Sc., Apt. NIP 195006121980032001 NIP 195108161980031002
Dra. Erly Sitompul, M.Si., Apt
Pembimbing II, NIP 195006121980032001
Dr. Marline Nainggolan, M.S., Apt. Dra. Suwarti Aris, M.Si., Apt. NIP 195709091985112001 NIP 195107231982032001
Drs. Nahitma Ginting, M.Si., Apt. NIP 195406281983031002
Medan, Februari 2012 Dekan,
KATA PENGANTAR
Puji dan syukur kehadirat Tuhan Yang Maha Kuasa atas anugerah dan kasih setiaNya, sehingga penulis dapat menyelesaikan penelitian dan penulisan skripsi ini untuk memenuhi syarat dalam memperoleh gelar Sarjana Farmasi pada Fakultas Farmasi Universitas Sumatera Utara.
Pada kesempatan ini penulis menyampaikan ucapan terima kasih kepada : 1. Dekan Fakultas Farmasi Universitas Sumatera Utara, Prof. Dr. Sumadio
Hadisahputra, Apt., yang telah memberikan bantuan dan fasilitas selama masa pendidikan.
2. Ibu Dra. Erly Sitompul, M.Si., Apt., dan Ibu Dr. Marline Nainggolan, M.S., Apt., yang telah membimbing dengan penuh kesabaran, tulus dan ikhlas selama penelitian dan penulisan skripsi ini berlangsung.
3. Ibu Dra. Aswita Hafni Lubis M.Si., Apt. selaku Kepala Laboratorium Fitokimia, Ibu Dra. Erly Sitompul, M.Si., Apt., selaku kepala Laboratorium Mikrobiologi dan seluruh staf yang telah memberikan fasilitas dan bantuan selama penelitian.
4. Bapak Drs. Agusmal Dalimunthe, MS., Apt selaku Penasehat Akademik yang telah memberikan petunjuk dan bimbingan kepada penulis selama masa pendidikan.
6. Bapak dan Ibu staf pengajar Fakultas Farmasi USU yang telah membina dan mendidik penulis selama menuntut ilmu di Fakultas Farmasi USU. 7. Ayahanda dan Ibunda tercinta, K. Pardosi dan L. Pasaribu, serta adek-adek
saya, atas doa, dorongan dan pengorbanan baik moril maupun material kepada penulis selama masa perkuliahan hingga selesainya skripsi ini. Penulis menyadari bahwa tulisan ini masih memiliki banyak kekurangan, oleh karena itu dengan segala kerendahan hati penulis bersedia menerima kritikan dan saran yang membangun pada skripsi ini. Semoga skripsi ini bermanfaat bagi kita semua.
Medan, Februari 2012 Penulis,
Ferawati Pardosi
UJI AKTIVITAS ANTIBAKTERI MINYAK ATSIRI DAN EKSTRAK ETANOL DARI BUNGA KECOMBRANG (Nicolaia speciosa Horan) TERHADAP BAKTERI Staphylococcus epidermidis, Staphylococcus aureus
DAN Pseudomonas aeruginosa
ABSTRAK
Bunga kecombrang (Nicolaia speciosa Horan) adalah sejenis tumbuhan rempah dan termasuk familia Zingiberaceae. Bunga kecombrang perlu dikembangkan manfaatnya, misalnya obat untuk penyakit yang berhubungan dengan kulit termasuk campak, batang semu dan pelepah daun dapat dimanfaatkan sebagai sabun. Penelitian ini bertujuan untuk mengetahui golongan senyawa kimia dan mengetahui aktivitas antibakteri minyak atsiri serta ekstrak etanol bunga kecombrang.
Isolasi minyak atsiri dilakukan dengan cara destilasi air. Skrining fitokimia dilakukan terhadap serbuk simplisia dan ekstrak etanol bunga kecombrang, karakterisasi serbuk simplisia meliputi pemeriksaan makroskopik, mikroskopik, penetapan kadar air dan uji aktivitas antibakteri minyak atsiri dan ekstrak etanol bunga kecombrang terhadap bakteri Staphylococcus epidermidis, Staphylococcus
aureus, Pseudomonas aeruginosa secara in vitro dengan metode difusi agar
menggunakan pencadang logam. Ekstraksi dilakukan dengan cara maserasi menggunakan pelarut etanol.
Hasil skrining fitokimia bunga kecombrang menunjukkan adanya senyawa flavanoida, tannin, triterpenoid/steroid dan minyak atsiri. Hasil makroskopik yaitu bunga majemuk, bentuk bongkol, diselubungi daun brakteola berupa selaput tipis warna coklat keunguan, panjang 0,5 cm sampai 2,5 cm, daun mahkota bunga berlekatan di bagian pangkal, benang sari agak melengkung dengan kepala sari bentuk lonjong dan kepala putik bentuk segitiga, tebal. Pemeriksaan mikroskopik penampang melintang bunga tampak epidermis daun mahkota bentuk bundar, parenkim bentuk bundar beberapa mengandung kristal kalsium oksalat, serbuk simplisia bunga kecombrang diperoleh adanya mahkota bunga dengan parenkim dan trakea bentuk spiral, fragmen trakea, kristal oksalat dan serabut skelrenkim. Penetapan kadar air 3,331%. Hasil uji aktivitas antibakteri menunjukkan bahwa minyak atsiri pada konsentrasi 12,5% memberikan daerah hambat yang efektif terhadap bakteri Staphyococcus epidermidis sebesar 17,2 mm, sementara terhadap
Staphyococcus aureus dan Pseudomonas aeruginosa memberikan daerah hambat
yang efektif pada konsentrasi 25% berturut-turut sebesar 15,5 mm dan 21,2 mm, untuk ekstrak etanol, memberikan daerah hambat yang efektif terhadap bakteri Staphyococcus aureus pada konsentrasi sebesar 70 mg/ml sebesar 14,0 mm, sementara terhadap Staphyococcus epidermidis dan Pseudomonas aeruginosa memberikan daerah hambat yang efektif pada konsentrasi 90 mg/ml berturut-turut sebesar 14,3 mm dan 14 mm.
TEST OF ANTIBACTERIAL ACTIVITY A VOLATILE OIL AND ETHANOL EXTRACT FROM FLOWERS KECOMBRANG ( NICOLAIA
SPECIOSA HORAN ) AGAINST THE Staphylococcus epidermidis , Staphylococcus aureus AND Pseudomonas aeruginosa
ABSTRACT
The flower of kecombrang (Nicolaia Horan speciosa) is a kind of spices that derived from family Zingiberaceae. The funtion of this planta should be developed, susch as for the treatment of disease associated with skin including measles, the pseudo-stem and midrib of leaves could be used as a soap. this research aiming to know the confederates a chemical compound and knowing antibacterial activity a volatile oil as well as ethanol extract flowers kecombrang .
Isolation of volatile oil by water distillation, phytochemical screening of simplicia powder and ethanol extracts from torch flower of kecombrang was done, the characterization simplicia powder including macroscopic, microscopic, determination of water content and antibacterial activity test of volatile oils and ethanol extract from the flowers of kecombrang against Staphylococcus epidermidis, Staphylococcus aureus, Pseudomonas aeruginosa is in vitro eksperiment by using agar diffusion methode using punch hole. The extraction process by maceration methods using solvent.
The results of phytochemical screening showed that there are flavanoids, tannins, triterpenoids / steroids and volatilel oils. The macroscopic result are flower which is covered by brakteola leaves, a thin purplish membrane, its length was 0.5 cm to 2.5 cm. The petals get juxtapusition at the base, split tube shaped. The microscopic observation from cross section of flower showed that epidermis of corolla’s leaves is circular, circular shaped parenchym with calcium oxalate crystal, in simplicia powder of flower showed the corolla has parenchym and spiral shaped trachea, trachea fragment, oxalate crystal and skelrenkim fibers. Determination of water content 3,331%. The results of antibacterial test showed that a volatile oil at concentration 12.5% giving an effective inhibiting region againt Staphyococcus epidermidis with diameter of 17.2 mm, whereas against Staphyococcus aureus and Pseudomonas aeruginosa giving an effective regions at concentration of 25% respectively are 15.5 mm and 21.2 mm for ethanol extracts providing an effective inhibitory region against Staphyococcus aureus with diameter of 14.0 mm at a concentration of 70 mg/ml , whereas the inhibitory region against Staphyococcus epidermidis and Pseudomonas aeruginosa respectively are 14.3 mm and 14 mm at concentration of 90 mg/ml.
DAFTAR ISI
Halaman
JUDUL ... i
LEMBAR PENGESAHAN ... ii
ABSTRAK ... iii
ABSTRACT ... iv
DAFTAR ISI ... v
DAFTAR TABEL ... viii
DAFTAR GAMBAR ... ix
DAFTAR LAMPIRAN ... x
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 3
1.3 Hipotesis ... 3
1.4 Tujuan Penelitian ... 3
1.5 Manfaat Penelitian ... 4
BAB III TINJAUAN PUSTAKA ... 5
2.1 Uraian Tumbuhan ... 5
2.1.1 Habitat dan daerah tumbuh ... 5
2.1.2 Sistematika tumbuhan ... 5
2.1.3 Nama asing ... 5
2.1.4 Morfologi tumbuhan ... 6
2.1.5 Kandungan kimia ... 6
2.2 Kandungan Kimia ... 7
2.2.1 Minyak atsiri ... 7
2.2.2 Flavonoida ... 7
2.2.3 Tanin ... 7
2.3.4 Steroida dan Terpenoida ... 8
2.3 Ekstraksi ... 9
2.4 Bakteri ... 8
2.4.1 Klasifikasi bakteri ... 11
2.4.2 Uji aktifitas antimikroba ... 17
2.5 Isolasi Minyak Atsiri ... 19
2.5.1 Metode penyulingan ... 19
2.5.1.1 Penyulingan dengan air ... 20
2.5.1.2 Penyulingan dengan air dan uap ... 21
2.5.1.3 Penyulingan dengan uap ... 21
BAB III METODE PENELITIAN ... 23
3.1 Alat-alat ... 23
3.2 Bahan-bahan ... 23
3.3 Pembuatan Larutan Pereaksi ... 24
3.3.1 Besi (III) Klorida 1% ... 24
3.3.2 Bouchardat ... 24
3.3.3 Dragendorff ... 24
3.3.4 Mayer ... 24
3.3.5 Molish ... 25
3.3.7 Asam sulfat 2 N ... 25
3.5.1 Pemeriksaan Makroskopik ... 26
3.11.1 Pembuatan Stok Kultur ... 30
3.11.2 Pembuatan Inokulum ... 30
3.12 Pembuatan Larutan Uji dengan Berbagai Kosnsentrasi ... 31
3.12.1 Pembuatan Konsentrasi Minyak Atsiri ... 31
3.12.2 Pembuatan Larutan Uji Ekstrak Etanol ... 31
3.12.3 Metode Pengujian Efek Antibakteri Secara in vitro ... 31
BAB IV HASIL DAN PEMBAHASAN ... 33
4.1 Identifikasi Tumbuhan ... 33
4.2 Karakterisasi Simplisia ... 33
4.3 Hasil Skrining Fitokimia ... 34
4.4 Hasil Ekstraksi ... 35
4.5 Hasil Uji Aktivitas Antibakteri Minyak Atsiri dan Ekstrak Etanol Bunga Kecombrang ... 35
BAB V KESIMPULAN DAN SARAN ... 39
5.1 Kesimpulan ... 39
5.2 Saran ... 39
DAFTAR PUSTAKA ... 40
DAFTAR TABEL
Halaman Tabel 4.1 Hasil Skrining Fitokimia ... 34 Tabel 4.2 Hasil uji Aktivitas Antibakteri Minyak Atsiri Bunga
Kecombrang ... 35 Tabel 4.3 Hasil Uji Aktivitas Antibakteri Ekstrak Etanol Bunga
DAFTAR GAMBAR
Halaman Gambar 4.1 Pengukuran diameter hambat minyak atsiri bunga
kecombrang ... 36 Gambar 4 2 Pengukuran diameter hambat Ekstrak Etanol Bunga
DAFTAR LAMPIRAN
Halaman
Lampiran 1.Hasil Identifikasi Tumbuhan Kecombrang ... 24
Lampiran 2. Gambar Tumbuhan dan Bunga kecombran ... 25
Lampiran 3. Gambar Simplisia Bunga Kecombrang ... 26
Lampiran 4. Mikroskopik Penampang Melintang Bunga Segar dan Serbuk Simplisia Bunga Kecombrang ... 27
Lampiran 5. Perhitungan Hasil Penetapan Kadar Air ... 28
Lampiran 6. Bagan Pembuatan Ekstrak Etanol ... 29
Lampiran 7. Bagan Pengujian Aktivitas Antibakteri ... 30
Lampiran 8. Hasil Uji Aktivitas Antibakteri Ekstrak Etanol Bunga Kecombrang ... 31
Lampiran 9. Hasil Uji Aktivitas Antibakteri Minyak Atsiri Bunga Kecombrang ... 32
Lampiran 10. Gambar Hasil Uji Aktivitas Antibakteri Minyak Atsiri Bunga Kecombrang Terhadap Bakteri Staphylococcus aureus ... 33
Lampiran 11. Gambar Hasil Uji Aktivitas Antibakteri Minyak Atsiri Bunga Kecombrang Terhadap Bakteri Staphylococcu epidermidis ... 34
Lampiran 12. Gambar Hasil Uji Aktivitas Antibakteri Minyak Atsiri Bunga Kecombrang Terhadap Bakteri Pseudomonas aeruginosa ... 35
Lampiran 14. Gambar Hasil Uji Aktivitas Antibakteri Ekstrak Etanol Bunga Kecombrang Terhadap Bakteri Staphylococcus
epidermidis ... 38 Lampiran 15. Gambar Hasil Uji Aktivitas Antibakteri Akstrak Etanol
Bunga Kecombrang Terhadap Bakteri Pseudomonas
aeruginosa ... 40
UJI AKTIVITAS ANTIBAKTERI MINYAK ATSIRI DAN EKSTRAK ETANOL DARI BUNGA KECOMBRANG (Nicolaia speciosa Horan) TERHADAP BAKTERI Staphylococcus epidermidis, Staphylococcus aureus
DAN Pseudomonas aeruginosa
ABSTRAK
Bunga kecombrang (Nicolaia speciosa Horan) adalah sejenis tumbuhan rempah dan termasuk familia Zingiberaceae. Bunga kecombrang perlu dikembangkan manfaatnya, misalnya obat untuk penyakit yang berhubungan dengan kulit termasuk campak, batang semu dan pelepah daun dapat dimanfaatkan sebagai sabun. Penelitian ini bertujuan untuk mengetahui golongan senyawa kimia dan mengetahui aktivitas antibakteri minyak atsiri serta ekstrak etanol bunga kecombrang.
Isolasi minyak atsiri dilakukan dengan cara destilasi air. Skrining fitokimia dilakukan terhadap serbuk simplisia dan ekstrak etanol bunga kecombrang, karakterisasi serbuk simplisia meliputi pemeriksaan makroskopik, mikroskopik, penetapan kadar air dan uji aktivitas antibakteri minyak atsiri dan ekstrak etanol bunga kecombrang terhadap bakteri Staphylococcus epidermidis, Staphylococcus
aureus, Pseudomonas aeruginosa secara in vitro dengan metode difusi agar
menggunakan pencadang logam. Ekstraksi dilakukan dengan cara maserasi menggunakan pelarut etanol.
Hasil skrining fitokimia bunga kecombrang menunjukkan adanya senyawa flavanoida, tannin, triterpenoid/steroid dan minyak atsiri. Hasil makroskopik yaitu bunga majemuk, bentuk bongkol, diselubungi daun brakteola berupa selaput tipis warna coklat keunguan, panjang 0,5 cm sampai 2,5 cm, daun mahkota bunga berlekatan di bagian pangkal, benang sari agak melengkung dengan kepala sari bentuk lonjong dan kepala putik bentuk segitiga, tebal. Pemeriksaan mikroskopik penampang melintang bunga tampak epidermis daun mahkota bentuk bundar, parenkim bentuk bundar beberapa mengandung kristal kalsium oksalat, serbuk simplisia bunga kecombrang diperoleh adanya mahkota bunga dengan parenkim dan trakea bentuk spiral, fragmen trakea, kristal oksalat dan serabut skelrenkim. Penetapan kadar air 3,331%. Hasil uji aktivitas antibakteri menunjukkan bahwa minyak atsiri pada konsentrasi 12,5% memberikan daerah hambat yang efektif terhadap bakteri Staphyococcus epidermidis sebesar 17,2 mm, sementara terhadap
Staphyococcus aureus dan Pseudomonas aeruginosa memberikan daerah hambat
yang efektif pada konsentrasi 25% berturut-turut sebesar 15,5 mm dan 21,2 mm, untuk ekstrak etanol, memberikan daerah hambat yang efektif terhadap bakteri Staphyococcus aureus pada konsentrasi sebesar 70 mg/ml sebesar 14,0 mm, sementara terhadap Staphyococcus epidermidis dan Pseudomonas aeruginosa memberikan daerah hambat yang efektif pada konsentrasi 90 mg/ml berturut-turut sebesar 14,3 mm dan 14 mm.
TEST OF ANTIBACTERIAL ACTIVITY A VOLATILE OIL AND ETHANOL EXTRACT FROM FLOWERS KECOMBRANG ( NICOLAIA
SPECIOSA HORAN ) AGAINST THE Staphylococcus epidermidis , Staphylococcus aureus AND Pseudomonas aeruginosa
ABSTRACT
The flower of kecombrang (Nicolaia Horan speciosa) is a kind of spices that derived from family Zingiberaceae. The funtion of this planta should be developed, susch as for the treatment of disease associated with skin including measles, the pseudo-stem and midrib of leaves could be used as a soap. this research aiming to know the confederates a chemical compound and knowing antibacterial activity a volatile oil as well as ethanol extract flowers kecombrang .
Isolation of volatile oil by water distillation, phytochemical screening of simplicia powder and ethanol extracts from torch flower of kecombrang was done, the characterization simplicia powder including macroscopic, microscopic, determination of water content and antibacterial activity test of volatile oils and ethanol extract from the flowers of kecombrang against Staphylococcus epidermidis, Staphylococcus aureus, Pseudomonas aeruginosa is in vitro eksperiment by using agar diffusion methode using punch hole. The extraction process by maceration methods using solvent.
The results of phytochemical screening showed that there are flavanoids, tannins, triterpenoids / steroids and volatilel oils. The macroscopic result are flower which is covered by brakteola leaves, a thin purplish membrane, its length was 0.5 cm to 2.5 cm. The petals get juxtapusition at the base, split tube shaped. The microscopic observation from cross section of flower showed that epidermis of corolla’s leaves is circular, circular shaped parenchym with calcium oxalate crystal, in simplicia powder of flower showed the corolla has parenchym and spiral shaped trachea, trachea fragment, oxalate crystal and skelrenkim fibers. Determination of water content 3,331%. The results of antibacterial test showed that a volatile oil at concentration 12.5% giving an effective inhibiting region againt Staphyococcus epidermidis with diameter of 17.2 mm, whereas against Staphyococcus aureus and Pseudomonas aeruginosa giving an effective regions at concentration of 25% respectively are 15.5 mm and 21.2 mm for ethanol extracts providing an effective inhibitory region against Staphyococcus aureus with diameter of 14.0 mm at a concentration of 70 mg/ml , whereas the inhibitory region against Staphyococcus epidermidis and Pseudomonas aeruginosa respectively are 14.3 mm and 14 mm at concentration of 90 mg/ml.
BAB I
PENDAHULUAN
1.1Latar Belakang
Indonesia merupakan salah satu negara penghasil obat yang potensial dengan keanekaragaman hayati yang dimilikinya dan menempati urutan ketiga terbesar di dunia setelah Brazil dan Zaire. Dilihat dari keragaman floranya jenis tumbuhan yang dapat dimanfaatkan sebagai tanaman obat cukup banyak berupa obat tradisional yang berasal dari tumbuhan (Hariana, 2007).
Pemanfaatan obat tradisional semakin disukai karena efek samping lebih kecil dari obat yang dibuat secara sintesis. Mahalnya obat sintesis membuat masyarakat beralih ke tumbuhan obat. Penggunaan tumbuhan obat di masyarakat terutama untuk mencegah penyakit, menjaga kesegaran tubuh maupun mengobati penyakit (Mursito, 2001).
Banyak tumbuhan rempah-rempah mengandung golongan senyawa kimia seperti flavonoid yang menunjukkan sifat antimikroba. Beberapa golongan fenol seperti flavonoid, tanin dan senyawa fenol lainnya berfungsi sebagai alat pertahanan bagi tumbuhan untuk melawan mikroorganisme patogen (Hayet, et al., 2008).
mengandung minyak atsiri, saponin, flavonoid dan polifenol yang dikenal sebagai deodoran alami yang dapat mengurangi bau badan bagi yang mengkonsumsinya. Bunga kecombrang mempunyai aktivitas antioksidan (Anonim, 2010).
Penelitian sebelumnya menyebutkan serbuk simplisia bunga kecombrang diperoleh kadar abu total 9,41%; kadar abu tidak larut dalam asam 0,36%; kadar sari yang larut dalam air 12,626%; kadar sari yang larut dalam etanol 12,055% dan kadar air 3,331% (Liska, 2011). Kandungan kimia dari buah kecombrang adalah alkaloid, glikosida, tanin, flavanoid dan triterpenoid/steroid (Meyti, 2011).
Minyak atsiri juga disebut minyak eteris merupakan minyak yang mudah menguap. Kegunaan minyak atsiri sangat luas dan spesifik, khususnya dalam berbagai bidang industri, antara lain dalam kosmetik ( sabun, pasta gigi, shampoo, lotion, dan farfum) dalam industri makanan di gunakan sebagai bahan penyedap atau penambah cita rasa, dalam industri farmasi atau obat- obatan ( anti nyeri, anti infeksi, anti bakteri) ( Lutony dan Rahmayati, 2000).
Berdasarkan uraian di atas, maka peneliti tertarik untuk melakukan pemeriksaan makroskopik, mikroskopik, skrining fitokimia dan uji aktivitas antibakteri minyak atsiri dan ekstrak etanol dari bunga kecombrang dengan metode difusi agar menggunakan bakteri Staphylococcus epidermidis, Staphylococcus aureus, dan Pseudomonas aeruginosa yang menyebabkan
1.2Perumusan Masalah
1. Apakah golongan senyawa kimia yang terdapat pada serbuk simplisia dan ekstrak etanol bunga kecombrang (Nicolaia speciosa Horan)?
2. Apakah minyak atsiri dan ekstrak etanol bunga kecombrang (Nicolaia
speciosa Horan) mempunyai aktivitas antibakteri terhadap Staphylococcus
epidermidis, Staphylococcus aureus dan Pseudomonas aeruginosa?
1.3Hipotesis
1. Serbuk simplisia dan ekstrak etanol bunga kecombrang (Nicolaia speciosa Horan) mengandung senyawa minyak atsiri, flavonoid, tanin, dan steroid/triterpenoid.
2. Minyak atsiri dan ekstrak etanol bunga kecombrang mempunyai aktivitas antibakteri terhadap pertumbuhan bakteri Staphylococcus epidermidis, Staphylococcus aureus, dan Pseudomonas aeruginosa.
1.4Tujuan
1. Untuk mengetahui senyawa kimia yang terdapat dalam bunga kecombrang (Nicolaia speciosa Horan).
2. Mengetahui adanya aktivitas antibakteri minyak atsiri dan ekstrak etanol bunga kecombrang (Nicolaia speciosa Horan) terhadap bakteri Staphylococcus epidermidis, Staphylococcus aureus, dan Pseudomonas
1.5Manfaat
Hasil penelitian ini diharapkan dapat memberikan informasi tentang efek antibakteri dari minyak atsiri dan ekstrak etanol bunga kecombrang (Nicolaia speciosa Horan) terhadap bakteri Staphylococcus epidermidis, Staphylococcus
BAB II
TINJAUAN PUSTAKA
2.1 Uraian Tumbuhan
2.1.1 Habitat dan daerah tumbuh
Kecombrang (Nicolaia speciosa Horan) adalah sejenis tumbuhan rempah dan merupakan tumbuhan tahunan berbentuk terna yang bunga, buah, serta batangnya dimanfaatkan sebagai bahan sayuran.
2.1.2 Sistematika tumbuhan
Sistematika tumbuhan kecombrang menurut (Depkes, 2000) adalah sebagai berikut :
Divisio : Spermatophyta Subdivisio : Angiospermae Kelas : Monocotyledoneae Bangsa : Zingiberales
Suku : Zingiberaceae Marga : Nicolaia
Jenis : Nicolaia speciosa Horan
2.1.3 Nama asing
2.1.4Morfologi tumbuhan
Bunga kecombrang berwarna kemerahan seperti jenis tanaman hias pisang-pisangan. Bunga dalam karangan berbentuk gasing, bertangkai panjang 0,5-2,5 m × 1,5-2,5 cm, dengan daun pelindung bentuk jorong, 7-18 cm × 1-7 cm, merah jambu hingga merah terang, berdaging, melengkung membalik jika mekar. Kelopak bentuk tabung, panjang 3-3,5 cm, bertaju 3, terbelah. Mahkota bentuk tabung, warna merah jambu, panjang 4 cm. Bentuk tanamannya mirip jahe, dengan tinggi mencapai 5 m. Batang-batang semu bentuk bulat, membesar di pangkalnya; tumbuh tegak dan banyak, berdekat-dekatan, membentuk rumpun jarang, keluar dari rimpang yang menjalar di bawah tanah. Rimpangnya tebal, berwarna krem, kemerah-jambuan ketika masih muda. Daun 15-30 helai tersusun dalam dua baris, berseling di batang semu, helaian daun jorong lonjong, 20-90 cm × 10-20 cm (Anonim, 2010).
2.1.5Kandunga kimia
Bunga kecombrang mengandung senyawa minyak atsiri, flavonoid, tanin, dan steroid/triterpenoid (Depkes, 1995).
2.1.6 Penggunaan tumbuhan
2.2 Kandungan Kimia
2.2.1 Minyak atsiri
Pada minyak atsiri yang bagian utamanya terpenoid. Zat inilah penyebab wangi, harum, atau bau yang khas pada minyak tumbuhan. Secara ekonomi senyawa tersebut penting sebagai dasar wewangian alam dan juga untuk rempah-rempah serta sebagai senyawa cita-rasa di dalam industri makanan (Harbone, 1897).
2.2.2 Flavonoida
Flavonoida merupakan salah satu golongan fenol alam yang tersebar luas pada tumbuhan hijau dan mengandung 15 atom karbon dalam inti dasarnya, yang tersusun dalam konfigurasi C6-C3-C6, yaitu dua cincin aromatik yang dihubungkan oleh satuan tiga karbon yang dapat atau tidak dapat membentuk cincin ketiga (Markham, 1988).
Flavonoida terdapat pada seluruh dunia tumbuhan mulai dari fungus sampai angiospermae yang mencakup banyak jenis pigmen yang umum dan mempunyai peranan penting dalam tumbuhan, misalnya pada bunga sebagai pigmen yang berperan dalam menarik burung dan serangga penyerbuk. Selain itu ada beberapa senyawa flavonoida yang menyerap sinar ultraviolet yang juga berperan dalam mengarahkan serangga (Robinson, 1995).
2.2.3 Tanin
yakni pertahanan bagi tumbuhan dan membantu mengusir hewan pemakan tumbuhan. Tanin terkondensasi terdapat pada paku-pakuan, gimnospermae, dan angiospermae, sedangkan tanin terhidrolisis penyebarannya terbatas pada tumbuhan berkeping dua. Beberapa tanin terbukti mempunyai antioksidan dan menghambat pertumbuhan tumor (Harborne, 1987).
2.2.4 Steroida dan Triterpenoida
Steroida merupakan suatu senyawa golongan triterpenoida yang mengandung inti siklopentanoperhidrofenantren yaitu terdiri dari tiga cincin sikloheksana dan sebuah cincin siklopentana (Harborne, 1987).
Triterpenoida adalah senyawa yang kerangka karbonnya berasal dari enam satuan isoprena dan secara biosintesis diturunkan dari hidrokarbon C30 asiklik yaitu skualena. Triterpenoida kebanyakan berupa alkohol, aldehid, asam karboksilat dan umumnya berupa senyawa tanwarna, berbentuk kristal, mempunyai titik leleh tinggi, dan bersifat optik aktif. Triterpenoida dapat dibagi menjadi sekurang-kurangnya empat golongan senyawa yaitu triterpenoida sebenarnya, steroida, saponin, dan glikosida jantung. Uji yang banyak digunakan untuk mendeteksi senyawa ini adalah reaksi Lieberman-Burchard (Harborne, 1987).
2.3 Ekstraksi
Ekstraksi adalah kegiatan penarikan kandungan kimia yang dapat larut sehingga terpisah dari bahan yang tidak larut dengan menngunakan pelarut cair. Senyawa aktif yang terdapat dalam berbagai simplisia dapat digolongkan kedalam golongan minyak atsiri, alkaloida, flavonoida dan lain-lain. Dengan diketahuinya senyawa aktif yang dikandung simplisia akan mempermudah pemilihan pelarut dengan cara yang tepat (DitJen POM, 2000).
Pembagian metode ekstraksi menurut DiJen POM (2000) adalah :
A. Cara Dingin
1. Maserasi
Maserasi adalah proses pengekstrakan simplisia menggunakan pelarut dengan beberapa kali pengocokan atau pengadukan pada temperatur ruangan (kamar).
Maserasi kinetik dilakukan dengan pengadukan yang kontinu (terus-menerus). Remaserasi dilakukan dengan pengulangan penambahan pelarut setelah dilakukan penyaringan maserat pertama dan seterusnya.
2. Perkolasi
sekurang-kurangnya 3 jam, hal ini penting terutama untuk serbuk yang keras dan bahan yang mudah mengembang.
B. Cara Panas
1. Refluks
Refluks adalah ekstraksi dengan pelarut pada temperature titik didihnya, selama waktu tertentu dan jumlah pelarut yang relativ konstan dengan adanya pendingin balik.
2. Sokletasi
Sokletasi adalah ekstraksi menggunakan pelarut yang selalu baru, umumnya dilakukan dengan alat khusus sehingga terjadi ekstraksi kontinu dan jumlah pelarut relativ konstan dengan adanya pendingin balik.
3. Digesti
Digesti adalah maserasi dengan pengadukan kontinu pada temperatur yang lebih tinggi dari temperatur ruangan yaitu pada temperature 40-50oC.
4. Infus
Infus adalah ekstraksi dengan pelarut air pada temperatur penangas air mendidih, temperatur terukur 96-98oC selama waktu tertentu (15-20 menit).
5. Dekok
2.4 Bakteri
Nama bakteri berasal dari kata “bakterion” (bahasa Yunani) yang berarti tongkat atau batang. Sekarang namanya dipakai untuk menyebutkan sekelompok mikroorganisme yang bersel satu, berbiak dengan pembelahan diri, serta demikian kecilnya sehingga hanya tampak dengan mikroskop (Dwidjoseputro, 1987).
2.4.1 Klasifikasi bakteri
Berdasarkan bentuk morfologinya, maka bakteri dapat dibagi atas tiga golongan (Dwidjoseputro, 1987), ysitu :
a. Golongan Basil
Golongan basil berbentuk serupa tongkat pendek, silindris. Basil dapat bergandengan dua-dua, atau terlepas satu sama lain, yang bergandeng-gandengan panjang disebut streptobasil, yang dua-dua disebut diplobasil.
b. Bentuk kokus
Golongan kokus merupakan bakteri yang bentuknya serupa bola-bola kecil. Golongan ini tidak sebanyak golongan basil. Kokus ada yang bergandeng-gandengan panjang berupa rantai, disebut streptokokus, ada yang berbergandeng-gandengan dua-dua, disebut diplokokus, ada yang mengelompok berempat, disebut tetrakokus, kokus yang mengelompok serupa kubus disebut sarsina.
c. Golongan Spiril
Jenis bakteri yang digunakan dalam penelitian ini adalah Staphylococcus epidermidis, Staphylococcuc aureus dan Pseudomonas aeruginosa.
a. Staphylococcus epidermidis
Sistematika bakteri Sthapylococcus epidermidis menurut (Breed, et al, 1957) adalah sebagai berikut :
Devisio : Protophyta Kelas : Schizomycetes Bangsa : Eubacteriales Suku : Micrococcaceae Marga : Staphylococcus
Jenis : Staphylococcus epidermidis
Staphylococcus epidermidis merupakan bakteri gram positif, aerob atau
anaerob fakultatif berbentuk bola atau kokus berkelompok tidak teratur, diameter 0,8 - 1,0 µm tidak membentuk spora dan tidak bergerak, koloni berwarna putih bakteri ini tumbuh cepat pada suhu 37oC. Koloni pada pembenihan padat berbentuk bulat halus, menonjol, berkilau, tidak menghasilkan pigmen, berwarna putih porselen sehingga Staphylococcus epidermidis disebut Staphylococcus albus, koagulasi-negatif dan tidak meragi manitol (Jawetz et al, 2001).
b. Staphylococcus aureus
Sistematika bakteri Staphylococcus aureus menurut Bergey edisi ke-7 (Dwidjoseputro, 1987) adalah sebagai berikut :
Familia : Micrococcaceae Genus : Staphylococcus
Species : Staphylococcus aureus
Staphylococcus aureus merupakan bakteri gram positif, aerob atau
anaerob fakultatif berbentuk bola atau kokus berkelompok tidak teratur, diameter 0,8 – 1,0 µm, tidak membentuk spora dan tifak bergerak, koloni berwarna kuning. Bakteri ini tumbuh cepat pada suhu 370C tetapi paling baik membentuk pigmen pada suhu 20-250C. koloni pada pembenihan padat berbentuk bulat halus, menonjol dan berkilau membentuk berbagai pigmen. Bakteri ini terdapat pada kulit, selaput lendir, bisul dan luka. Dapat menimbulkan penyakit melalui kemampuannya berkembang biak dan menyebar luas dalam jaringan (Jawetz, 2001).
c. Pseudomonas aeruginosa
Sistematika bakteri Pseudomonas aeruginosa menurut (Breed, et al, 1957) adalah sebagai berikut :
Divisio : Protophyta Kelas : Schizomycetes Bangsa : Pseudomonadales Suku : Pseudomonodaceae Marga : Pseudomonas
Jenis : Pseudomonas aeruginosa
Pseudomonas aeruginosa merupakan bakteri gram negatif aerob obligat
yang pendek. Pseudomonas aeruginosa membentuk koloni halus bulat dengan fluoresensi kehijauan. Bakteri ini menghasilkan piosianin suatu pigmen kebiru – biruan yang tak berfluoresensi, yang berdifusi kedalam agar. Fluorensi dapat dihasilkan bila biakan diinkubasi pada suhu 20 - 30o C dari pada yang diinkubasi pada suhu 35 - 37o C (Jawetz et al, 2001).
Pseudomonas aeruginosa tersebar luas di alam biasanya terdapat di
lingkungan yang lembab. Bakteri ini menyebabkan penyakit bila pertahanan tubuh inang abnormal. Dalam jumlah kecil, bakteri ini sering terdapat pada flora usus normal dan kulit manusia. Bakteri ini ini menimbulkan infeksi pada luka bakar, infeksi saluran kemih dan infeksi mata (Jawetz et al, 2001).
Bila suatu mikroorganisme ditanam pada media yang sesuai dalam waktu tertentu akan tumbuh memperbanyak diri, maka dapat dilihat suatu grafik pertumbuhan yang dapat dibagi dalam 4 fase menurut (Pratiwi, 2008; Dwidjoseputro, 1994) yaitu:
1. Fase penyesuaian diri (lag phase)
Fase pertama ini mikroorganisme mengalami penyesuaian pada lingkungan baru setelah pemindahan. Pada fase ini tidak terjadi perkembangbiakan sel, yang ada hanya peningkatan ukuran sel dan aktivitas metabolisme.
2. Fase pembelahan (log phase)
Fase kedua ini mikroorganisme berkembang dengan cepat yang jumlahnya meningkat secara eksponensial. Fase ini berlangsung selama 18-24 jam.
Fase ketiga terjadi keseimbangan antara jumlah sel yang membelah dengan jumlah sel yang mati. Hal ini terjadi karena akumulasi hasil metabolisme yang toksis.
4. Fase kematian
Fase dimana jumlah sel yang mati meningkat dikarenakan keadaan lingkungan seperti ketidaksediaan nutrisi dan akumulasi hasil metabolisme yang toksik.
Faktor yang mempengaruhi pertumbuhan mikroorganisme dapat meliputi temperatur, pH, tekanan osmotik, oksigen dan nutrisi dalam media pertumbuhan (Pratiwi, 2008).
1. Temperatur
Pertumbuhan bakteri sangat dipengaruhi oleh temperatur. Setiap mikroorganisme mempunyai temperatur optimum yaitu temperatur di mana terjadi kecepatan pertumbuhan optimal dan dihasilkan jumlah sel yang maksimal. Temperatur yang terlalu tinggi dapat menyebabkan denaturasi protein sedangkan temperatur yang sangat rendah aktivitas enzim akan terhenti. Berdasarkan batas temperatur dibagi atas tiga golongan:
a. psikrofil, tumbuh pada temperatur -5 sampai 30oC dengan optimum 10 sampai 20oC.
b. mesofil, tumbuh pada temperatur 10 sampai 45oC dengan optimum 20 sampai 40oC.
c. termofil, tumbuh pada termperatur 25 sampai 80oC dengan optimum 50 sampai 60oC (Pratiwi, 2008).
pH optimum bagi kebanyakan bakteri terletak antara 6,5 dan 7,5. Namun ada beberapa mikroorganisme yang dapat tumbuh pada keadaan yang sangat asam atau alkali (Pelczar dan Chan, 2006).
3. Tekanan osmosis
Osmosis merupakan perpindahan air melewati membran semipermeabel karena ketidakseimbangan material terlarut dalam media. Medium yang baik untuk pertumbuhan sel adalah medium isotonis terhadap sel tersebut. Dalam larutan hipotonik air akan masuk ke dalam sel sehingga menyebabkan sel membengkak, sedangkan dalam larutan hipertonik air akan keluar dari sel sehingga membran plasma mengerut dan lepas dari dinding sel (plasmolisis) (Pratiwi, 2008, Lay, 1996).
4. Oksigen
Berdasarkan kebutuhan oksigen dikenal mikroorganisme dibagi menjadi 5 golongan yaitu:
a. Anaerob obligat, hidup tanpa oksigen, oksigen toksik terhadap golongan ini. b. Anaerob aerotoleran, tidak mati dengan adanya oksigen.
c. Anaerob fakultatif, mampu tumbuh baik dalam suasana dengan atau tanpa oksigen.
d. Aerob obligat, tumbuh subur bila ada oksigen dalam jumlah besar.
e. Mikroaerofilik, hanya tumbuh baik dalam tekanan oksigen yang rendah (Pratiwi, 2008).
5. Nutrisi
yaitu makroelemen (elemen yang diperlukan dalam jumlah banyak) dan mikroelemen (trace element yaitu elemen nutrisi yang diperlukan dalam jumlah sedikit) (Pratiwi, 2008).
Bahan nutrisi untuk pertumbuhan mikroorganisme terdapat pada media. Media juga dapat digunakan untuk membedakan mikroorganisme dengan mengetahui habitatnya (Pratiwi, 2008).
Bermacam-macam media pertumbuhan yaitu:
1. Media sintetik yaitu media yang komponen penyusunnya sudah diketahui, 2. Media kompleks yaitu media yang tersusun dari komponen yang secara kimia
tidak diketahui dan merupakan kebutuhan nutrisi mikroorganisme.
3. Media selektif adalah media yang mendukung pertumbuhan mikroorganisme tertentu dengan menghambat pertumbuhan mikroorganisme lainnya.
4. Media diferensial digunakan untuk membedakan kelompok mikroorganisme dan dapat digunakan untuk identifikasi (Pratiwi, 2008, Lay, 1996).
2.4.2 Uji aktifitas antimikroba
Uji kepekaaan terhadap obat antimikroba pada dasarnya dapat dilakukan melalui dua cara, yaitu :
a. Metode dilusi
Cara ini digunakan untuk menentukan KHM (kadar hambat minimum) dan KBM (kadar bunuh minimum) dari obat antimikroba. Prinsip dari metode dilusi adalah sebagai berikut :
selama 18-24 jam dan diamati terjadinya kekeruhan pada tabung. Konsentrasi terendah obat pada tabung yang ditunjukkan dengan hasil biakan yang mulai tampak jernih (tidak ada pertumbuhan mikroba) adalah KHM dari obat. Konsentrasi terendah obat pada biakan padat yang ditunjukkan dengan tidak adanya pertumbuhan koloni mikroba adalah KBM dari obat terhadap bakteri uji (Pratiwi, 2008).
b. Metode difusi
Metode yang paling sering digunakan adalah metode difusi agar dengan menggunakan cakram kertas, cakram kaca, pencetak lubang. Prinsip metode ini adalah mengukur zona hambatan pertumbuhan bakteri yang terjadi akibat difusi zat yang bersifat sebagai antibakteri di dalam media padat melalui pencadang. Daerah hambatan pertumbuhan bakteri adalah daerah jernih di sekitar cakram. Luas daerah hambatan berbanding lurus dengan aktivitas antibakteri, semakin kuat daya aktivitas antibakterinya maka semakin luas daerah hambatnya. Metode ini dipengaruhi oleh banyak faktor fisik dan kimia, misalnya: pH, suhu, zat inhibitor, sifat dari media dan kemampuan difusi, ukuran molekul dan stabilitas dari bahan obat (Jawetz et al, 2001).
c. Metode turbidimetri
Penetapan aktivitas antibioti secara in vitro selain berguna untuk penetapan kadar dapat pula digunakan untuk menguji kepekaan suatu antibiotik terhadap mikroba. Kepekaan mikroba terhadap antibiotik dapat dilihat dari konsentrasi minimum untuk inhibisi oleh suatu antibiotik terhadap mikroba tertentu. Penetapan konsentrasi minimum inhibisi dapat dilakukan dengan menguji sederetan konsentrasi antibiotik yang dibuat dengan cara pengenceran, metode yang digunakan dapat dengan cara turbidimetri atau difusi agar. Konsentrasi minimum untuk inhibisi (KMI) (Wattimena, 1991).
2.5 Isolasi Minyak Atsiri
Minyak atsiri adalah zat cair yang mudah menguap bercampur dengan persenyawaan padat yang berbeda dalam hal komposisi dan titik cairnya, kelarutan dalam perlarut organik, dan kelarutan dalam air. Berdasarkan sifat tersebut, minyak atsiri dapat di buat dengan beberapa cara, yaitu penyulingan, ekstraksi dengan pelarut menguap (solvent extraction), ekstraksi dengan lemak dingin (enfleurasi), ekstraksi dengan lemak panas (maserasi) dan pengepresan (pressing) (Gunawan dan Mulyani, 2004).
2.5.1 Metode penyulingan
2.5.1.1 Penyulingan dengan air
Pada metode ini bahan yang akan disuling kontak langsung dengan air mendidih. Bahan tersebut mengapung di atas air atau terendam secara sempurna tergantung dari bobo jenis dan jumlah bahan yang di suling. Air dipanaskan dengan panas langsung. Ciri khas dari metode ini adalah kontak langsung antara bahan dengan air mendidih (Guenther,1990).
Pada metode ini, perbandingan jumlah air perebus dan bahan baku dibuat berimbang, sesuai dengan kapasitas ketel. Bahan yang telah mengalami proses pendahuluan seperti perajangan dan pelayuan dimasukkan dan dipadatkan. Selanjutnya, ketel ditutup rapat agar tidak terdapat celah yang mengakibatkan uap keluar. Uap yang dihasilkan dari perebusan air dan bahan dialirkan melalui pipa menuju ketel kondensator yang mengandung air dingin sehingga terjadi pengembunan (kondensasi). Selanjutnya,air dan minyak ditampung dalam tangki pemisah. Pemisahan air dan minyak dilakukan berdasarkan perbedaan berat jenis (Armando.R,2009).
2.5.1.2Penyulingan dengan air dan uap
Metode ini disebut juga dengan sistem kukus. Pada metode pengukusan ini, bahan diletakkan di atas piringan atau plat besi berlubang seperti ayakan yang terletak beberapa sentimeter di atas permukaan air. Pada prinsipnya, metode penyulingan ini menggunakan uap bertekanan rendah. Air dimasukkan ke dalam dasar ketel 1/3 bagian ketel. Selanjutnya, bahan dimasukkan ke dalam ketel suling hingga padat dan ketel ditutup rapat. Saat air direbus dan mendidih, uap yang terbentuk akan melalui sarangan lewat lubang- lubang kecil dan melewati celah- celah bahan. Minyak atsiri dalam bahan pun akan ikut bersama uap panas tersebut melalui pipa menuju ketel kondensator. Selanjutnya, uap air dan minyak akan mengembun dan ditampung dalam tangki pemisah. Pemisahan air dan minyak atsiri dilakukan berdasarkan berat jenis (Armando.R,2009).
Keuntungan menggunakan sistem penyulingan air dan uap adalah karena penetrasi uap secara merata ke dalam jaringan bahan dan suhu dapat dipertahankan sampai 100oC. Lama penyulingan relatif singkat, rendemen minyak lebih besar dan mutunya lebih baik jika dibandingkan dengan minyak hasil penyulingan air, dan bahan yang disuling tidak menjadi gosong ( Ketaren,1985).
Cara ini sangat baik digunakan pada bahan tumbuhan yang basah dan kering. Bahan tumbuhan yang kering harus dimaserasi dahulu. Minyak atsiri yang memiliki titik didih lebih kecil dari titik didih air akan tersuling tanpa mengalami hidrolisis ( Guenther,1990).
2.5.1.3Penyulingan dengan uap
BAB III
METODE PENELITIAN
Pada penelitian ini dilakukan secara eksperimental. Metode penelitian ini meliputi penyiapan bahan, skrining fitokimia, isolasi minyak atsiri dan pembuatan ekstrak etanol serta uji aktivitas antibakteri secara in vitro dengan metode difusi agar. Penelitian dilakukan di Laboratorium Fitokimia Fakultas Farmasi dan Laboratorium Mikrobiologi Fakultas Farmasi.
3.1 Alat – Alat
Alat yang digunakan dalam penelitian ini adalah alat-alat gelas, autoklaf (Fisons), blender (Miyako), desikator, freeze dryer (Modulio), inkubator (Memmert), kompor (Miyako), Laminar Air Flow Cabinet (Astec HLF 1200L), lemari pendingin (Uchida), mikroskop, neraca listrik (Vibra AJ), oven (Fisher), penangas air (Yenaco), pipet mikro (Eppendorf), rotary evaporator (Haake D), seperangkat alat destilasi air, silinder logam, alat destilasi air, spektrofotometer visibel (Dynamic).
3.2 Bahan – Bahan
Bahan penelitian yang digunakan adalah bunga kecombrang, nutrient
agar, Staphylococcus epidermidis, Staphylococcus aureus, dan Pseudomonas
aeruginosa, bahan kimia yang digunakan adalah berkualitas pro analisa yaitu ,alfa
etilasetat, n-heksan, iodium, isopropanol, kalium iodida, kloralhidrat, kloroform, metanol, natrium hidroksida, natrium klorida, natrium sulfat anhidrat, raksa (II) klorida, serbuk magnesium dan timbal (II) asetat. Etanol 96% (hasil destilasi).
3.3Pembuatan Larutan Pereaksi
Pembuatan larutan pereaksi besi (III) klorida 1%, Bouchardat, Dragendorff, Mayer, Molish dilakukan menurut (DitJen POM, 1995), asam klorida 2 N, asam sulfat 2 N, kloralhidrat, natrium hidroksida 2 N (Depkes, 1979), Liebermann-Bouchard ( Harbone, 1987), Timbal (II) asetat 0,4 M (Depkes, 1989).
3.3.1 Besi (III) klorida 1%
Sebanyak 1 g besi (III) klorida dilarutkan dalam air suling hingga 100 ml
3.3.2 Bouchardat
Sebanyak 4 g kalium iodida ditimbang, kemudian dilarutkan dalam air suling, ditambahkan iodium sebanyak 2 g dan dicukupkan dengan air suling hingga 100 ml.
3.3.3 Dragendorff
Sebanyak 0,85 g bismut (III) nitrat ditimbang, kemudian dilarutkan dalam 100 ml asam asetat glasial ditambahkan 40 ml air suling. Kemudian pada wadah lain ditimbang 8 g kalium iodida lalu dilarutkan dalam 20 ml air suling, lalu campurkan kedua larutan sama banyak. Kemudian ditambahkan 20 ml asam asetat glasial dan diencerkan dengan air suling hingga 100 ml.
3.3.4 Mayer
air lalu campurkan keduanya dan ditambahkan air suling hingga 100 ml.
3.3.5 Molish
Sebanyak 3 g alfa-naftol ditimbang, kemudian dilarutkan dalam asam nitrat 0,5 N hingga volume 100 ml.
3.3.6 Asam Klorida 2 N
Sebanyak 17 ml asam klorida pekat dilarutkan dalam air suling hingga volume 100 ml.
3.3.7 Asam Sulfat 2 N
Sebanyak 5,4 ml asam sulfat pekat kemudian diencerkan dengan air suling hingga 100 ml.
3.3.8 Natrium hidroksida 2 N
Sebanyak 8,002 g kristal natrium hidroksida dilarutkan dalam air suling hingga 100 ml.
3.3.9 Kloralhidrat
Sebanyak 50 g kloralhidrat dilarutkan dalam 20 ml air.
3.3.10 Liebermann-Bouchard
Sebanyak 5 ml asam asetat anhidrida dicampurkan dengan 5 ml asam sulfat pekat kemudian ditambahkan etanol hingga 50 ml
3.3.11 Timbal (II) asetat 0,4 M
Sebanyak 15,17 g timbal (II) asetat dilarutkan dalam air bebas karbondioksida hingga 100 ml.
3.4 Pengambilan dan Pengolahan Sampel
Pengambilan sampel diambil dari perkebunan tanaman kecombrang dari Pancur Batu. Sampel yang digunakan yaitu bunga kecombrang (Nicolaia speciosa Horan). Pengumpulan sampel dilakukan secara purposif yaitu tanpa membandingkan dengan tumbuhan yang sama dari daerah lain.
3.4.2 Identifikasi sampel
Hasil identifikasi tumbuhan dilakukan oleh Pusat Penelitian dan Pengembangan Biologi, Lembaga Ilmu Pengetahuan Indonesia (LIPI) adalah tumbuhan kecombrang (Nicolaia speciosa Horan) dari suku Zingiberaceae (Liska, 2011). Hasil dapat dilihat pada lampiran 1 halaman 24.
3.4.3 Pengolahan sampel
Bunga kecombrang sebanyak 10 kg, dicuci bersih dengan air mengalir, kemudian ditiriskan lalu disebarkan diatas kertas perkamen hingga airnya terserap, lalu bunganya dipisahkan dari bongkolnya lalu dikeringkan di lemari pengering sampai bila diremas akan hancur, kemudian ditimbang sebagai berat kering. Selanjutnya simplisia disimpan pada wadah ditempat yang terlindung dari sinar matahari.
3.5 Karakterisasi Simplisia
Pemeriksaan karakteristik simplisia yang meliputi pemeriksaan makroskopik, mikroskopik, penetapan kadar air.
3.5.1 Pemeriksaan makroskopik
3.5.2 Pemeriksaan mikroskopik
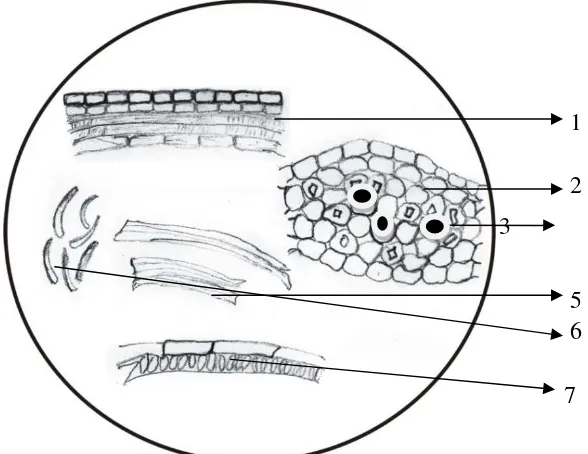
Pemeriksaan mikroskopik dilakukan terhadap serbuk simplisia dan bunga kecombrang segar. Serbuk simplisia ditaburkan sedikit diatas kaca objek, untuk bunga kecombrang segar dipotong secara melintang, kemudian masing-masing ditambahkan kloralhidrat lalu dipanaskan dan tutup dengan kaca penutup, kemudian amati dibawah mikroskop. Gambar mikroskopik dapat dilihat pada lampiran 4 halaman 27.
3.5.3Penetapan kadar air
Penetapan kadar air dilakukan dengan metode Azeotropi (Destilasi Toluen). Kedalam labu alas bulat di masukkan 200 ml toluen dan 2 ml air suling, destilasi selama 2 jam, biarkan menjadi dingin selama 30 menit dan volume air dalam tabung penampung dibaca. Selanjutnya ke dalam labu dimasukkan 5 gram serbuk simplisia lalu dipanaskan hati-hati selama 15 menit. Setelah toluena mendidih, kecepatan tetesan diatur yaitu 2 tetesan per detik sampai sebagian air terdestilasi, kemudian kecepatan destilasi dinaikkan sampai 4 tetes per detik. Setelah semua air terdestilasi, bagian dalam pendingin dibilas dengan toluena. Destilasi dilanjutkan selama 5 menit, kemudian tabung penampung dibiarkan dingin sampai sama dengan suhu kamar. Setelah air dan toluena memisah sempurna, dibaca volume air dengan ketelitian 0,05 ml. Selisih kedua volume air yang dibaca sesuai dengan kandungan air di dalam bahan yang diperiksa (WHO, 1992).
3.6 Skrining Fitokimia
kecombrang meliputi pemeriksaan senyawa golongan flavonoid, tanin, steroida/triterpenoida, dan minyak atsiri.
3.6.1 Pemeriksaan Flavonoid
Sebanyak 10 g sampel kemudian ditambahkan 100 ml air panas, dididihkan selama 5 menit dan disaring dalam keadaan panas, filtrat yang diperoleh kemudian diambil 5 ml lalu di tambahkan 0,1 g serbuk Mg dan 1 ml HCl pekat dan 2 ml amil alkohol, dikocok, dan dibiarkan memisah. Flavonoid positif jika terjadi warna merah, kuning, jingga pada lapisan amil alkohol (Farnsworth, 1966).
3.6.2 Pemeriksaan Tanin
Sebanyak 0,5 g sampel disari dengan 10 ml air suling, disaring lalu filtratnya diencerkan dengan air suling sampai tidak berwarna. Diambil 2 ml larutan lalu ditambahkan 1 sampai 2 ttes pereaksi besi (III) klorida. Terjadi warna biru atau hijau kehitaman menunjukkan adanya tanin (Farnsworth, 1966).
3.6.3 Pemeriksaan Steroida/Triterpenoida
Sebanyak 1 g sampel dimaserasi dengan 20 ml n-heksan selama 2 jam, disaring, filtrat diuapkan dalam cawan penguap, dan pada sisanya ditambahkan 20 tetes asam asetat anhidrat dan 1 tetes asam sulfat pekat (pereaksi Liebermann-Bourchardad). Apabila terbentuk warna ungu atau merah yang berubah menjadi biru hijau menunjukkan adanya steroida/triterpenoida (Farnsworth, 1966).
3.7 Pembuatan Ekstrak Etanol Bunga Kecombrang (Nicolaia speciosa
Horan) Secara Maserasi
5 hari dan terlindung dari cahaya sambil sering diaduk, serkai, peras, cuci ampas dengan cairan penyari secukupnya hingga diperoleh 100 bagian. Pindahkan kedalam bejana tertutup, biarkan di tempat sejuk, terlindung dari cahaya, selama 2 hari. Enap tuangkan atau saring (Depkes, 1979). Filtrat diuapkan menggunakan rotary evaporator pada temperatur ± 40°C sampai diperoleh ekstrak kental,
kemudian freeze dryer pada suhu - 40°C. Pembuatan ekstrak dapat dilihat pada lampiran 6 halaman 29.
3.8 Isolasi Minyak Atsiri
Isolasi minyak atsiri dilakukan dengan metode penyulingan air. Penyulingan dilakukan dengan menggunakan alat destilasi air terhadap serbuk bunga kecombrang.
Caranya : sebanyak 100 gram bunga kecombrang yang telah diserbukkan dimasukkan ke dalam labu alas bulat berleher panjang 1 liter yang telah dirangkai dalam perangkat alat destilasi air. Destilasi dilakukan selama 4 jam. Destilat ditampung dan dipisahkan bagian minyak atsirinya. Minyak atsiri yang diperoleh ditambahkan Na2SO4 anhidrat dan didiamkan selama 12 jam. Minyak atsiri dipipet dan disimpan dalam botol berwarna coklat.
3.9 Sterilisasi Alat dan Bahan
3.10 Pembuatan Media
3.10.1 Pembuatan media Nutrient Agar (NA)
Komposisi : Lab-Lemco Powder 1,0 g Yeast extract 2,0 g Peptone 5,0 g Sodium chloride 5,0 g Agar 15,0 g Cara Pembuatan :
Sebanyak 28 g nutrient agar (NA) ditimbang, disuspensikan kedalam air suling 1000 ml, lalu dipanaskan sampai larut sempurna. Lalu media dimasukkan dalam labu dan disterilkan di dalam autoklaf pada suhu 121°C selama 15 menit (Oxoid).
3.10.2 Pembuatan agar miring
Ke dalam tabung reaksi dimasukkan 5 ml media nutrient agar, didiamkan pada suhu kamar sampai sediaan membeku pada posisi miring kira-kira 45o C kemudian disimpan dalam lemari pendingin.
3.11 Pembiakan Bakteri
3.11.1 Pembuatan stok kultur
Satu koloni bakteri Staphylococcus epidermidis, Staphylococcus aureus
dan Pseudomonas aeruginosa diambil dengan menggunakan jarum ose steril lalu
3.11.2 Pembuatan inokulum
Stok kultur bakteri Staphylococcus epidermidiss, Staphylococcus aureus
dan Pseudomonas aeruginosa yang telah tumbuh diambil dengan jarum ose steril
lalu disuspensikan kedalam tabung yang berisi 10 ml larutan NaCl 0,9 %. Kemudian diukur kekeruhan larutan pada panjang gelombang 580 nm sampai diperoleh transmitan 25% (DitJen POM, 1995).
3.12 Pembuatan Larutan Uji dengan Berbagai Konsentrasi
3.12.1 Pembuatan konsentrasi minyak atsiri
Dibuat pengenceran dari konsentrasi 100% sampai diperoleh konsentrasi 50%, 25%, 12,5%, 6,25% dalam etanol 96%.
3.12.2 Pembuatan larutan uji ekstrak etanol
Ekstrak etanol ditimbang 3 g dilarutkan dengan dimetil sulfoksida (DMSO) hingga 10 ml maka konsentrasi ekstrak adalah 300 mg/ml kemudian dibuat pengenceran selanjutnya sampai diperoleh ekstrak dengan konsentrasi 200 mg/ml; 100 mg/ml; 90 mg/ml; 80 mg/ml; 70 mg/ml; 60 mg/ml ; 50 mg/ml; 40 mg/ml; 30 mg/ml.
3.12.3 Metode pengujian efek antibakteri secara in vitro
BAB IV
HASIL DAN PEMBAHASAN
4.1 Hasil Identifikasi Tumbuhan
Hasil identifikasi tumbuhan dilakukan oleh Pusat Penelitian dan Pengembangan Biologi, Lembaga Ilmu Pengetahuan Indonesia (LIPI) adalah tumbuhan kecombrang (Nicolaia speciosa Horan) dari suku Zingiberaceae (Liska, 2011). Hasil dapat dilihat pada lampiran 1 halaman 24.
4.2Karakterisasi Simplisia
Pemeriksaan makroskopik bunga kecombrang adalah bunga majemuk, bentuk bongkol, diselubungi daun brakteola berupa selaput tipis warna coklat keunguan, panjang 0,5 cm sampai 2,5 cm; mahkota bunga bentuk terompet, panjang 0,6 cm sampai 1 cm, daun mahkota bunga berlekatan di bagian pangkal, benang sari agak melengkung dengan kepala sari bentuk lonjong dan kepala putik bentuk segitiga, tebal.
Hasil pemeriksaan mikroskopik terhadap serbuk simplisia dijumpai adanya parenkim dan trakea bentuk spiral, parenkim dan serabut sklerenkim. Pada bunga kecombrang segar dijumpai adanya epidermis luar, epidermis dalam, parenkim, berkas pembuluh, kristal kalsium oksalat dan sklerenkim. Gambar mikroskopik dapat dilihat pada lampiran 4 halaman 27.
sebesar 3,331%. Penetapan kadar air dilakukan karena jika kadar airnya tinggi dapat menyebabkan pertumbuhan jamur.
4.3Hasil Skrining Fitokimia
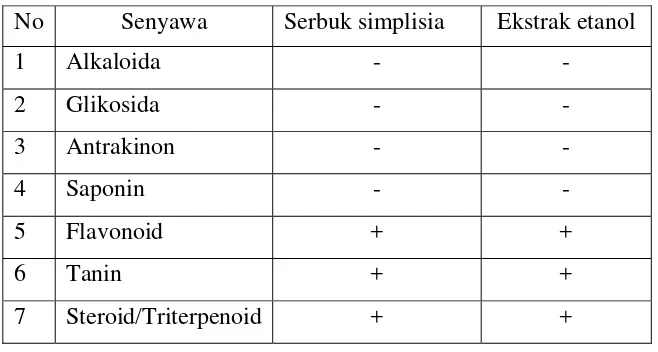
Hasil skrining fitokimia serbuk simplisia dan ekstrak etanol bunga kecombrang dijumpai adanya alkaloida, glikosida, antrakinon, saponin, flavonoid, tanin dan triterpenoid/steroid, dapat dilihat pada Tabel 3.1
Tabel 4.1 Hasil skrining fitokimia
No Senyawa Serbuk simplisia Ekstrak etanol
1 Alkaloida - -
2 Glikosida - -
3 Antrakinon - -
4 Saponin - -
5 Flavonoid + +
6 Tanin + +
7 Steroid/Triterpenoid + +
4.4 Hasil Ekstraksi
Hasil pengumpulan bunga kecombrang segar sebanyak 10 kg menghasilkan 780 g serbuk simplisia. Serbuk simplisia dimaserasi sebanyak 750 g diperoleh ekstrak kering setelah di freeze dryer sebanyak 57,106 g.
4.5 Uji aktivitas antibakteri minyak atsiri dan ekstrak etanol bunga kecombrang
Hasil uji aktivitas antibakteri dari minyak atsiri dan ekstrak etanol terhadap
Staphylococcus epidermidis, Staphylococcus aureus dan Pseudomonas
aeruginosa ternyata dapat menghambat pertumbuhan, dimana semakin tinggi
konsentrasi minyak atsiri dan ekstrak etanol yang diberikan menghasilkan diameter daerah hambat yang semakin besar, terlihat pada Tabel 3.2 dan 3.3.
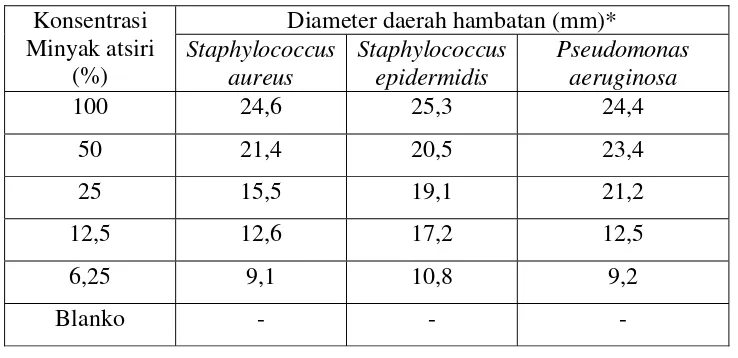
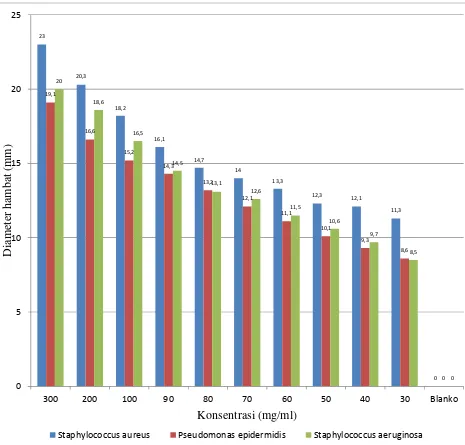
Tabel 4.2 Hasil uji aktivitas antibakteri minyak atsiri bunga kecombrang
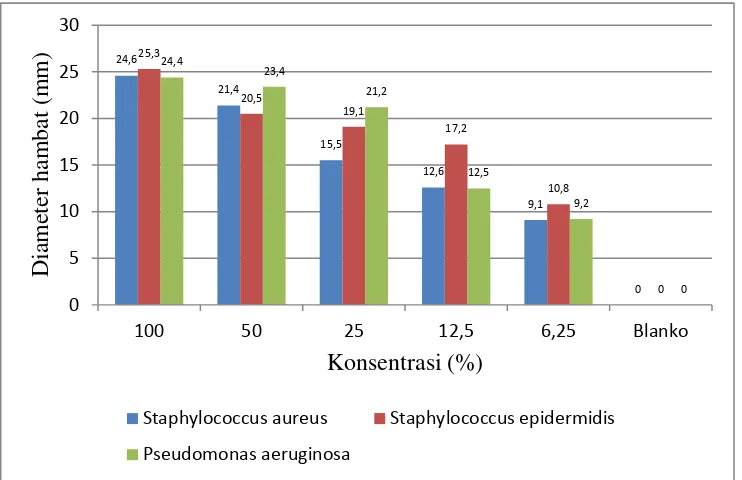
Gambar 4.1. Pengukuran diameter hambat minyak atsiri bunga kecombrang
Pada Tabel dan gambar di atas terlihat bahwa pada konsentrasi 100% untuk Staphylococcus epidermidis memberikan diameter hambat tertinggi sebesar (25,3 mm), Staphylococcus aureus (24,6 mm) dan Pseudomonas aeruginosa (24,4 mm). Pada konsentrasi 50% untuk Pseudomonas aeruginosa memberikan diameter hambat tertinggi sebesar (23,4 mm) kemudian Staphylococcus aureus (21,4 mm) dan Staphylococcus epidermidis (20,5 mm).
Pengujian aktivitas antibakteri dari minyak atsiri terhadap Staphylococcus
aureus (15,5 mm) dan Pseudomonas aeruginosa (21,2 mm) pada konsentrasi
25%, sedangkan Staphylococcus epidermidis (17,2 mm) pada konsentrasi 12,5%. Hal ini telah memenuhi persyaratan menurut DitJen POM (1995) yaitu sebesar 14 sampai 16 mm. Aktivitas antibakteri dari minyak atsiri terhadap bakteri Staphylococcus epidermidis lebih besar dibandingkan Staphylococcus aureus dan
Pseudomonas aeruginosa.
100 50 25 12,5 6,25 Blanko
D
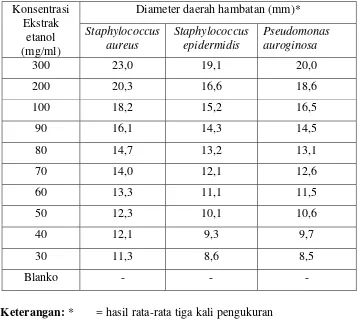
Tabel 4.3 Hasil uji aktivitas antibakteri ekstrak etanol bunga kecombrang Konsentrasi
Ekstrak etanol (mg/ml)
Diameter daerah hambatan (mm)* Staphylococcus
Hasil pengujian ekstrak etanol bunga kecombrang memberikan hasil positif terhadap bakteri Staphylococcus aureus (14,0 mm) pada konsentrasi 70 mg/ml, untuk Staphylococcus epidermidis (14,3 mm) dan Pseudomonas
aeruginosa (14,5 mm) pada konsentrasi 90 mg/ml. Aktivitas antibakteri dari
ekstrak etanol terhadap bakteri Staphylococcus aureus lebih besar dibandingkan Staphylococcus epidermidis dan Pseudomonas aeruginosa. Hasil diameter hambat
yang diberikan oleh ekstrak etanol memenuhi persyaratan DitJen POM (1995). Sedangkan pelarut dimetil sulfoksida yang dipakai pada pengujian antibakteri ekstrak etanol terhadap semua bakteri tidak memberikan daya hambat.
flavonoid dan tanin. Ini didukung oleh Agusta, (2000) dan Newall, et al, (1996) menyebutkan bahwa senyawa flavonoid dan tanin dapat menghambat pertumbuhan bakteri Staphylococcus aureus. Beberapa senyawa terpenoid yang telah diteliti memiliki aktivitas sebagai antibakteri antara lain monoterpenoid linalool, diterpenoid (-) hardwicklic acid, phytol, triterpenoid saponin dan triterpenoid glikosida (Sukadana et al, 2008; Gunawan et al, 2008).
Gambar 4.2. Pengukuran diameter hambat dari ekstrak etanol bunga kecombrang
BAB V
KESIMPULAN DAN SARAN
5.1Kesimpulan
1. Hasil skrining dari bunga kecombrang terdapat tanin, flavonoid, triterpenoid/steroid dan minyak atsiri. Hasil penetapan kadar air dari serbuk simplisia memenuhi syarat MMI yaitu sebesar 3,331%.
2. Senyawa minyak atsiri dan ekstrak etanol bunga kecombrang sama-sama memberikan aktivitas antibakteri terhadap bakteri Staphylococcus
epidermidis, Staphylococcus aureus dan Pseudomonas aeruginosa. Minyak
atsiri memberikan hasil diameter daerah hambat sebesar 17,2 mm untuk Staphylococcus epidermidis pada konsentrasi 12,5%, untuk Staphylococcus
aureus (15,5 mm) dan Pseudomonas aeruginosa (21,2 mm) memberikan
pada konsentrasi 25%. Sedangkan ekstrak etanol memberikan hasil diameter daerah hambat sebesar 14,0 mm untuk Staphylococcus aureus pada konsentrasi 70 mg/ml, untuk Staphylococcus epidermidis (14,3 mm) dan Pseudomonas aeruginosa (14,5 mm) pada konsentrasi 90 mg/ml.
5.2 Saran
DAFTAR PUSTAKA
Agusta, A. (2000). Minyak Atsiri Tumbuhan Tropika Indonesia. Bandung: Penerbit ITB Press. Hal 25.
Anonim. (2010). Kecombrang. www.wikipedia.com. Tanggal akses 7 Agustus 2011.
Anonim. (2010). Bunga Kecombrang, Deodoran Alami dan Antimikroba http://bungakecombrang/deodoranalamidanantimikroba.com.
Tanggal akses 7 Agustus 2011.
Anonim. (2010). Aktivitas Antioksidan dan Sifat Penangkal Radikal Bebas Ekstrak Bunga Kecombrang (Nicolaia speciosa Horan) Metode TEAC (Trolox Equivalent Antioxidant Capacity).
http://seminarnasional/agroindustri/universitassahidjakarta.com. Tanggal akses 7 Agustus 2011.
Armando,R. (2009). Memproduksi 15 jenis Minyak Atsiri Berkualitas. Penebar Swadaya. Hal 30.
Depkes. (1979). Farmakope Indonesia. Edisi III. Jakarta: Depkes RI. Hal. 31-36. Depkes. (1989). Materia Medika Indonesia. Jilid V. Jakarta: Departemen
Kesehatan RI. Hal. 194-197, 516, 518, 522, 536, 540, 549-553.
Difco Laboratories. (1977). Difco Manual of Dehydrated Culture Media and Reagents for Microbiology and Clinical Laboratory Procedures. Ninth edition. Detroit Michigan: Difco Laboratories. Pages 32, 64.
Ditjen POM. (1995). Farmakope Indonesia. Edisi IV. Jakarta: Depkes RI. Hal. 855, 896, 898, 1035.
Ditjen POM. (2000). Parameter Standar Umum Ekstrak Tumbuhan Obat. Jakarta : Depkes RI. Hal. 1, 10-11.
Dwidjoseputro. (1998). Dasar-Dasar Mikrobiologi. Jakarta: Penerbit D. Jambatan.
Farnsworth, N.R. (1966). Biologycal and Phytochemical Screening of Plants. Journal of Pharmaceutical Science. Volume 55(3): Hal 257-259, 263.
Guenther, E. (1987). The Essential Oils. Terjemahan. Ketaren, R.S. (1990). Minyak Atsiri. Jilid II. Penerbit Universitas Indonesia. Jakarta. Hal. 103 Gunawan, I.W.G., Bawa, I.G.A.G., dan Sutrisnayanti, N.L. (2008). Isolasi dan
Identifikasi Senyawa Terpenoid yang Aktif Antibakteri pada Herba Meniran (Phyllanthus niruri Linn.). Jurnal Kimia. 2(1): 31-39.
Hariana, A (2007). Tumbuhan Obat dan Khasiatnya. Edisi ketiga. Jakarta: Penebar Swadaya. Hal. 5.
Hayet, E., Maha, M., Samia, A., Mata, M., Gros, P., Raida, H., Ali, M.M., Mohamed, A.S., Gutmann, L., Mighri, Z., dan Mahjoub, A. (2008). Antimicrobial, Antioxidant, and Antiviral activities of Retama roetam (Forssk.) Webb Flowers Frowing in Tunisia. World J Micrcobiol Biotechnol. 24: 2933-2940.
Jawetz, E et al. (2001). Mikrobiologi Kedokteran. Edisi Kedua puluh. Jakarta: Penerbit EGC. Hal. 211-249.
Ketaren, S. (1985). Pengantar Teknologi Minyak Atsiri. Jakarta: Penerbit Balai Pustaka. Hal. 220 - 228.
Lay, B.W. (1996). Analisis Mikroba di Laboratorium. Jakarta: Raja Grafindo Persada. Hal. 57-58, 109.
Liska, I.H. (2011). Karakterisasi Simplisia dan Isolasi serta Analisis Komponen Minyak Atsiri Secara GC-MS dari Kecombrang (Nicolaia speciosa Horan). Skripsi. Fakultas Farmasi USU. Medan.
Lutony, T.L., dan Rahmayati, Y. (1994). Produksi Dan Perdagangan Minyak Atsiri. Jakarta: Penerbit Penebar Swadaya. Hal. 2.
Markham, K.R. (1988). Cara Mengidentifikasi Flavonoida. Bandung : Penerbit ITB Press. Hal. 23-47.
Meyti, A.H. (2011). Skrining Fitokimia, Karakterisasi dan Uji Aktivitas Antibakteri Etilasetat dari Buah Kecombrang (Nicolaia speciosa Horan) terhadap Bakteri Escherichia coli, Salmonella typhi dan Staphylococcus
aureus. Skripsi. Fakultas Farmasi USU. Medan.
Mursito. (2001). Ramuan Tradisional Untuk Kesehatan Anak. Jakarta: Penebar Swadaya. Hal. 2.
Newall, C.A, Anderson, L.A, Phillipson, J.D. (1996). Herbal Medicines A Guide For Health-Care Professionals. The Pharmaceutical Press. London. Hal 21.
Naufalin, R. (2005) Kajian Sifat Antimikroba Ekstrak Bunga Kecombrang Nicolaia speciosa Horan) Terhadap beberapa Mikroba Patogen dan Perusak Pangan. Disertasi. Pascasarjana IPB. Bogor.
Robinson, T. (1995). Kandungan Organik Tumbuhan Tinggi. Edisi keenam. Bandung: Penerbit ITB. Hal. 191.
World Health Organization. (1992). Quality Control Methods for Medicinal Plant Material. Switzerland: Geneva. Hal. 25-28.
Lampiran
n 1. Hasil IIdentifikasi Tumbuhann Kecombrang
Lampiran 2. Gambar Tumbuhan dan Bunga Kecombrang
Keterangan : Tanaman kecombrang
Keterangan : Bunga kecombrang segar
Lampiran 3. Gambar Simplisia Bunga Kecombrang
Lampiran 4. Mikroskopik Penampang Melintang Bunga Segar dan Serbuk Gambar penampang melintang bunga kecombrang segar
Keterangan : 1. Epidermis luar 2. Parenkim 3. Minyak atsiri 4. Berkas pembuluh 5. Kristal kalsium oksalat 6. Epidermis dalam. Gambarserbuk simplisia bunga kecombrang
Lampiran 6. Bagan Pembuatan Ekstrak Etanol
Ditambahkan etanol 80% biarkan selama 5 hari
disaring
Dicuci kembali dengan etanol 80 %
Ampas
Dipekatkan dengan rotary evaporator
Dikeringkan dengan freeze dryer
Maserat Maserasi
Maserat
Ekstrak Etanol
Lampiran 7. Bagan Pengujian Aktivitas Antibakteri
Diambil 1 ose
Disuspensikan ke dalam 10 ml NaCl
Diukur kekeruhan pada panjang gelombang 580 nm sampai diperoleh transmitan 25%
Dimasukkan 0,1 ml inokulum ke dalam cawan petri
Ditambahkan 20 ml media nutrient agar ke dalam cawan petri
Dihomogenkan dan dibiarkan hingga memadat
Ditanamkan silinder logam
Dimasukkan 0,1 ml ekstrak dengan berbagai konsentrasi
Diinkubasi pada suhu 36-37oC selama 18-24 jam
Diukur diameter daerah hambatan di sekitar silinder logam
Stok kultur
Inokulum bakteri
Media padat
Lampiran 8. Hasil Uji Aktivitas Antibakteri Ekstrak Etanol Bunga Kecombrang
Diameter daerah hambatan (mm)
Staphylococcus aureus Pseudomonas
Lampiran 9. Hasil Uji Aktivitas Antibakteri Minyak Atsiri Bunga Kecombrang
Konsentr asi Minyak atsiri (%)
Diameter daerah hambatan (mm)
Staphylococcus aureus Pseudomonas
epidermidis
Staphylococcus aeruginosa
I II III D* I II III D* I II III D*
100 24,6 24,7 24,6 24,6 25,3 25,2 25,3 25,3 24,4 24,3 24,4 24,4 50 21,4 21,4 21,3 21,3 20,5 20,3 20,6 20,6 24,4 24,4 24,3 24,3 25 15,4 15,4 15,5 15,5 19,1 19,0 19,1 19,1 21,2 21,0 21,3 21,3 12,5 12,6 12,7 12,5 12,5 17,2 17,1 17,2 17,2 12,5 12,5 12,5 12,5 6,25 9,2 9,0 9,0 9,0 10,8 10,8 10,7 10,7 9,2 9,0 9,3 9,3 Blanko - - - -
Keterangan
Lampiran 10. Gambar Hasil Uji Aktivitas Antibakteri Minyak Atsiri Bunga Kecombrang Terhadap Bakteri Staphylococcus aureus
Keterangan : Konsentrasi 100%; 50%; 25% dan blanko
Keterangan : Konsentrasi 12,5%; 6,25% dan blanko 100%
50%
25%
12.5%
Lampiran 11. Gambar Hasil Uji Aktivitas Antibakteri Minyak Atsiri Bunga Kecombrang Terhadap Bakteri Staphylococcus epidermidis
Keterangan :Konsentrasi 100%; 50%; 25% dan blanko
Keterangan : Konsentrasi 12,5%; 6,25% dan blanko
100%
25% 50%
12.5%
Lampiran 12. Gambar Hasil Uji Aktivitas Antibakteri Minyak Atsiri Bunga Kecombrang Terhadap Bakteri Pseudomonas aeruginosa
Keterangan : Konsentrasi 100%; 50%; 25% dan blanko
Keterangan : Konsentrasi 12,5%; 6,25% dan blanko 100%
50%
25%
12.5%
6.25%
Lampiran 13. Gambar Hasil Uji Aktivitas Antibakteri Ekstrak Etanol Bunga Kecombrang Terhadap Bakteri Staphylococcus aureus
Keterangan : Konsentrasi 300mg/ml; 200mg/ml; 100mg/ml
Lampiran 13 ( lanjutan)
Lampiran 14. Gambar Hasil Uji Aktivitas Antibakteri Ekstrak Etanol Bunga Kecombrang Terhadap Bakteri Staphylococcus epidermidis
Keterangan : Konsentrasi 300mg/ml; 200mg/ml; 100mg/ml dan blanko
Lampiran 14 ( lanjutan)
Lampiran 15. Gambar Hasil Uji Aktivitas Antibakteri Ekstrak Etanol Bunga Kecombrang Terhadap Bakteri Pseudomonas aeruginosa
Keterangan : Konsentrasi 300mg/ml; 200mg/ml; 100mg/ml