STUDI TENTANG PROTEIN ORGAN HATI YANG
BERINTERAKSI DENGAN AFLATOKSIN B
1EKO SUGENG PRIBADI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI DISERTASI DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa Disertasi dengan judul “Studi tentang Protein Organ Hati yang Berinteraksi dengan Aflatoksin B1” adalah karya saya sendiri dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber-sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun yang tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Bogor, Maret 2006
ii
ABSTRAK
EKO SUGENG PRIBADI. Studi tentang Protein Organ Hati yang Berinteraksi dengan Aflatoksin B1. Komisi Pembimbing: I WAYAN T. WIBAWAN, FACHRIYAN H. PASARIBU, RIZAL SYARIEF
Biotransformasi dan bioaktivasi aflatoksin merupakan suatu proses metabolisme di dalam tubuh yang berperan penting bagi aktivitas aflatoksin. Kedua proses ini terjadi di dalam organ hati. Satu tipe protein yang berikatan dengan aflatoksin B1 (PAB1) dari organ hati telah diisolasi menggunakan teknik kromatografi affinitas. AFB1 diikatkan pada matriks nitroselulosa yang diaktifkan dengan Br-CN untuk menangkap protein kemudian diinkubasi dengan ekstrak hati bebek dan ayam yang mengandung protein. Kandungan protein di dalam ekstrak kasar adalah 0,4310 mg/ml untuk hati bebek dan 0,3946 mg/ml untuk hati ayam yang diukur menggunakan metode Bradford. Ada dua pita PAB1 (66 dan 25 kDa) yang diisolasi dari protein ayam dan hanya satu pita PAB1 (66 kDa) yang diisolasi dari protein bebek ketika diisolasi menggunakan teknik SDS-PAGE. Antibodi terhadap PAB1 dihasilkan dengan menggunakan hewan coba kelinci yang disuntik dengan PAB1 yang telah diisolasi. Keberadaan dan titer antibodi terhadap PAB1 (APAB1) diperiksa menggunakan teknik AGPT. APAB1 yang diperoleh digunakan untuk memeriksa penyebaran PAB1 di dalam jaringan hati menggunakan teknik imunohistokimiawi. Penyebaran PAB1 di dalam jaringan hati didapatkan di dalam preparat jaringan hati bebek dan ayam. Keberadaan PAB1 di dalam organ hati bebek lebih banyak dan menyebar dibandingkan di dalam organ hati ayam.
iii
ABSTRACT
EKO SUGENG PRIBADI. Study on Liver Organ Proteins which Interacted to Aflatoxin B1. Supervised by I WAYAN T. WIBAWAN, FACHRIYAN H. PASARIBU, RIZAL SYARIEF
Biotransformation and bioactivation of aflatoxin play an important role in activity of aflatoxin. These processes will be took place in liver cell. The soluble intracellular aflatoxin B1-binding protein (PAB1) was isolated with an affinity chromatography technique. For this, AFB1 was immobilized on Br-CN activated nitrocellulose, then incubated with duck and chicken liver crude extract containing protein. Protein concentration of crude extract are 0.4310 mg/ml for duck liver and 0.3946 mg/ml for chicken liver measured by Bradford method. Two major protein bands was expressed by isolated PAB1 of chicken liver organs (66 and 25 kDa) and one protein band (66 kDa) for duck determined with SDS-PAGE. Antibodies against PAB1 were produced using rabbits injected with isolated PAB1 and the occurrence and the titre of specific antibodies were confirmed with AGPT. The antibody PAB1 was used to explore the distribution of PAB1 in liver tissues with immunohistochemistry technique. PAB1 distribution could be detected in duck as well as chicken liver preparation. The occurrence of PAB1 in duck liver is clearly disseminate compared to chicken.
iv
STUDI TENTANG PROTEIN ORGAN HATI
YANG BERINTERAKSI DENGAN
AFLATOKSIN B
1EKO SUGENG PRIBADI
Disertasi
Sebagai salah satu syarat untuk memperoleh gelar DOKTOR pada
Program Studi Sains Veteriner
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
v
Judul disertasi : Studi tentang Protein Organ Hati yang Berinteraksi dengan Aflatoksin B1.
Nama : Eko Sugeng Pribadi
NRP : 995133
Program Studi : Sains Veteriner
Disetujui Komisi Pembimbing
Dr. drh. I Wayan T. Wibawan, MS.
Prof. Dr. drh. Fachriyan H. Pasaribu
Ketua Anggota
Prof. Dr. Ir. H. Rizal Syarief SN, DESS Anggota
Diketahui
Ketua Program Studi Sains Veteriner Dekan Sekolah Pascasarjana
drh. Bambang P. Priosoeryanto, MS., Ph.D. Prof. Dr. Ir. Sjafrida Manuwoto, MSc.
Tanggal ujian : __________________ Tanggal lulus : __________________
vi
PRAKATA
Assalaamu’alaikum wr. wb.
Syukur alhamdulillah Penulis panjatkan kepada Allah swt karena kuasaNYA dan rahmatNYA pada akhirnya Penulis dapat menyelesaikan penulisan disertasi “Studi tentang protein organ hati yang berinteraksi dengan aflatoksin B1”
menjadi syarat untuk menyelesaikan pendidikan program doktor di Program Studi Sains Veteriner Sekolah Pascasarjana Institut Pertanian Bogor.
Penulis sangat bersyukur karena memiliki guru-guru besar, hebat dan
mengagumkan yang diantaranya adalah Dr. drh. I Wayan T. Wibawan, MS., Prof. Dr. drh. Fachriyan H. Pasaribu dan Prof. Dr. Ir. Rizal Syarief SN, DESS, yang telah bersedia dengan sabar selalu mengajak diskusi, membimbing dan mengarahkan Penulis selama menempuh pendidikan dan selalu memberi dorongan untuk menyelesaikan pendidikan ini. Rasa bangga juga Penulis rasakan karena memiliki kolega-kolega, seperti Dr. Setyo Widodo, Dr. Soeripto, Prof. Djokowoerjo Sastradipradja, Dr. Dewi Apri, drh. Gani, drh. Oetoro, drh. Sukobagyo, dr. Soedjasmiran dan masih banyak yang tidak mungkin disebutkan semuanya, yang selalu memberikan semangat untuk TETAP menyelesaikan pendidikan ini. Ucapan terima kasih kepada drh. Dewa Made Ngurah Dharma. Ucapan terima kasih khusus untuk drh. Ida Lestari, drh. Ketut Karuni, MSi, drh. Pudji, Ph.D. dan seluruh rekan di BPMSOH. Terima kasih kepada drh. Lia, drh. Yuni, drh. Wandi, Bapak Medi dan Ibu Yeni atas bantuan selama Penulis memanfaatkan fasilitas penelitian di PT. Bio Farma (Persero). Ucapan terima kasih kami haturkan kepada drh. Tutik Wresdiyati, Ph.D. yang walaupun dengan kondisi kesehatan yang kurang namun masih bersemangat berbagi pengetahuan tentang uji imunohistokimiawi. Juga, kepada drh. Adi Winarto, Ph.D. dan drh. Ketut Mudite Adnyane, Msi. yang selalu membantu dan menemani ketika kami hampir merasakan kejenuhan sewaktu melakukan uji imunohistokimiawi.
vii
dan kesediaan menemani selama penelitian. Juga Pak Rudi, Pak Said, Pak Rafi, Pak Kosasih untuk informasi kolokium, Pak Kosasih dan Pak Budi atas seluruh dukungannya.
Sujud saya kepada Bapak dan Ibu yang selalu penuh doa dan harapan agar Penulis dapat segera menyelesaikan semua ini, almarhum Papa yang selalu mengingatkan Penulis dengan perbincangan terakhirnya dan Mama. Pelukan dan ciuman hangat untuk istriku Rina, atas kesabaran dan pengertiannya menemani hingga disertasi ini selesai dikerjakan, dan tak lupa untuk Vira.
Penulis tidak dapat menyebutkan semua pihak yang selama ini telah membantu dan mendorong Penulis untuk menyelesaikan pendidikan ini. Penulis hanya berharap agar semua kebaikan yang sudah diberikan selama ini akan dibalas dengan rahmat yang berlipat dari Allah swt.
Akhir tulisan, Penulis sembahkan tulisan ini untuk pengembangan ILMU PENGETAHUAN.
Wassalaamu’alaikum wr. wb.
viii
RIWAYAT HIDUP
Penulis dilahirkan di Pendopo-Palembang pada tanggal 5 Juni 1964 dari pasangan Ponimin dan Markomah. Penulis merupakan anak pertama dari lima bersaudara.
Pendidikan dasar dan menengah pertama dilalui Penulis di Jambi. Setelah menyelesaikan pendidikan di SMA Negeri 1 Bogor, Penulis meneruskan pendidikan ke Institut Pertanian Bogor melalui jalur Proyek Perintis II (jalur tanpa ujian). Penulis menyelesaikan pendidikan sarjana kedokteran hewan pada tahun 1987 dan dokter hewan pada tahun 1988 pada Fakultas Kedokteran Hewan IPB. Pendidikan pascasarjana program magister di Program Studi Sains Veteriner Sekolah Pascasarjana IPB ditempuh selama penulis masih bekerja di sektor swasta sebagai konsultan dan program tersebut dapat diselesaikan pada tahun 1991. Program Doktor mulai dijalani sejak tahun 1999 di Program Studi Sains Veteriner Sekolah Pascasarjana IPB.
Begitu lulus dokter hewan, Penulis langsung menjalani karir di sektor swasta sebagai technical advisor di PT. Pyridam. Setahun kemudian, Penulis berkarir sebagai konsultan bidang AMDAL dan lingkungan hidup paruh waktu di beberapa kantor konsultan. Tahun 1992 menjadi pegawai negeri sipil di IPB. Saat ini Penulis terdaftar sebagai staf pengajar di Departemen Ilmu Penyakit Hewan dan Kesehatan Masyarakat Veteriner Fakultas Kedokteran Hewan IPB.
ix
Manfaat hasil penelitian ………. 5
TINJAUAN PUSTAKA ……….. 6
Cendawan Aflatoksigenik ………. 6
Sifat Fisik dan Kimiawi Aflatoksin sebagai Racun ………... 7
Biosintesis Aflatoksin ……… 9
Organ Hati dan Proses Biotransformasi Aflatoksin ………. 13
Pencemaran Aflatoksin dalam Pakan dan Bahan Makanan ………. 18
Gangguan Kesehatan Ternak dan Manusia oleh Aflatoksin ………. 22
Teknik-Teknik untuk Mendeteksi Aflatoksin dan Mendiagnosa Aflatoksikosis……….. 25
Pengendalian Mikotoksin ……….. 26
Pengobatan terhadap Aflatoksikosis ……… 30
BAHAN DAN METODE PENELITIAN ……….. 32
Tempat dan Waktu Penelitian ……… 32
Bahan Penelitian ………... 32
8.1 Pewarnaan Hematoksilin-Eosin ………. 39
8.2 Pewarnaan Imunohistokimiawi ……….. 40
x
HASIL DAN PEMBAHASAN ……… 43
Ekstraksi Hati ……… 43
Matriks AFB1 ………. 44
Protein yang Berikatan dengan AFB1 murni (PAB1) ………. 45
Antibodi Poliklonal PAB1 ……… 48
Gambaran Histologik PAB1 di Preparat Jaringan Hati Sehat ……… 50
SIMPULAN DAN SARAN ………. 57
Simpulan .……… 57
Saran ……… 57
xi
DAFTAR GAMBAR
No. Judul Hal
1. Gambaran Jalur Poliketida yang merupakan jalur awal ………… 10 metabolisme untuk sintesis aflatoksin
2. Peranan beberapa prekursor dalam tahapan sintesis aflatoksin …. 11
3. Bagan proses biotransformasi dan bioaktivasi AFB1 yang terjadi ... 14 di sitokrom P450 organ hati primata non-manusia
4. Peranan mikrosoma CYP1A2 dan CYP3A4 dalam bioaktivasi ... 15 AFB1 menjadi AFB1-8,9-epoksida
5. Hewan percobaan kelinci yang digunakan untuk memproduksi ... 33 APAB dipelihara dalam kan-dang bertingkat (Lokasi: Ruang
Pemeliharaan Hewan, Laboratorium Monitoring Hewan PT. Bio Farma (Persero)
6. Penyuntikan PAB1 kepada hewan coba kelinci melalui …………. 38
v. auricularis (a). Serum diambil setiap lima hari setelah penyuntikan untuk dilakukan pemantauan keberadaan dan titer APAB1 (b)
7. Kurva baku yang diperoleh untuk menghitung kadar protein …… 44 di dalam contoh ekstrak
8. Bagan pengaktifan nitroselulosa dengan menggunakan bromsian …. 45 (CNBr) menjadi matriks penangkapan AFB1 dan PAB1
9. Pita protein hasil uji elektroforesis terhadap PAB1 dari …………... 47 hati ayam (A), bebek (B) dan penanda (marker, P)
10. Hasil reaksi positif uji presipitasi yang diwujudkan dalam bentuk…. 48 garis presipitasi (tanda panah) antara antibodi poliklonal APAB1 (lubang pinggir) antigen PAB1 (lubang tengah) dari protein hati bebek (A) dan ayam (B)
11. Titer antibodi APAB1 yang diha-silkan oleh kelinci yang ………… 49 disuntik dengan PAB1 melalui v. auricularis
12. Garis presipitasi (tanda panah) dari hasil uji silang antara PAB1 ….. 50 dari organ hati bebek dengan APAB1 yang digertak oleh PAB1
xii
APAB1 yang digertak oleh PAB1dari organ hati bebek (b)
13. Gambaran histologik jaringan hati ayam yang sehat ………. 51 (Pewarnaan: HE. Pembesaran: 10x)
14. Gambaran histologik jaringan hati bebek yang sehat ……… 51 (Pewarnaan: HE. Pembesaran: 10x)
15. Hasil pewarnaan imunohistokimiawi terhadap hati ayam (a) dan … 52 bebek (b). Endapan berwarna coklat-kehitaman (tanda panah)
menandakan dilokasi tersebut terdapat PAB1. Pembesaran: 10x.
16. Keberadaan PAB1 di dalam endothelial pembuluh darah vena ……. 52 sentralis (tanda panah) dari hati bebek yang diwarnai dengan
teknik imunohistokimiawi. Pembesaran: 20x
17. Posisi protein yang berikatan dengan AFB1 pada sel hati ayam (a) .. 54 dan bebek (b). Lokasi protein (tanda panah) berada di daerah
sinusoid. Sedangkan hepatosit tidak terwarnai (h) (Pembesaran 100x)
DAFTAR TABEL
No. Judul Hal
1. Sifat fisik dan kimiawi aflatoksin ……… 8
2. Gen yang terlibat dalam proses biosintesis AFB1 ... 12 3. Kandungan aflatoksin pada sampel kacang tanah dan produk ... 21
olahannya di Indonesia
xiii
DAFTAR LAMPIRAN
No. Judul Hal
1
PENDAHULUAN
Latarbelakang
Indonesia yang beriklim tropis memberikan kondisi yang sangat baik bagi pertumbuhan dan perkembangan berbagai cendawan. Salah satu diantara cendawan tersebut adalah Aspergillus. Tiga spesies Aspergillus yang memiliki peran penting dalam dunia kesehatan, terutama kesehatan hewan, adalah A. fumigatus, A. flavus dan A. parasiticus. A. flavus dan A. parasiticus dikenal sebagai cendawan pencemar lapang dan gudang karena kemampuannya bertindak sebagai pencemar bagi produk-produk pertanian sejak penanganan pasca panen di ladang hingga produk tersebut disimpan di gudang-gudang penyimpanan.
A. flavus dan A. parasiticus dikenal juga sebagai cendawan toksigenik. Salah satu mikotoksin yang sangat dikenal yang dihasilkan oleh kedua spesies ini adalah toksin aflatoksin. Aflatoksin dapat dihasilkan oleh kedua spesies ketika menghadapi kondisi yang ekstrim baik saat masih di ladang/kebun maupun di gudang-gudang penyimpanan. Cekaman (stres) yang dialami cendawan akibat peningkatan suhu gudang penyimpanan, atau cekaman akibat serangan serangga gudang dapat menggertak cendawan untuk menghasilkan aflatoksin. Jagung dan kacang tanah, merupakan komoditi pertanian yang paling rentan terhadap pencemaran oleh aflatoksin. Pencemaran oleh aflatoksin terhadap jagung dan kacang tanah mendapat perhatian yang serius karena jagung merupakan komponen utama penyusun pakan ternak. Sedangkan banyak makanan tradisional Indonesia yang menggunakan kacang tanah, seperti bumbu-bumbu pecel, gado-gado, sate dan sebagainya. Aflatoksin tidak mengalami kerusakan terhadap proses pengolahan makanan, seperti pemanasan karena sifatnya yang termotoleran hingga suhu mencapai 220 oC (Syarief et al. 2003).
2
kejadian aflatoksikosis pada ternak telah terekam dalam beberapa hasil penelitian. Kerugian yang ditimbulkan oleh kejadian aflatoksikosis tidak dapat dihindari karena aflatoksin menyerang organ hati sehingga menyebabkan gangguan pertumbuhan ternak. Dampak yang diakibatkan oleh aflatoksikosis tidak hanya selama ternak dipelihara saja, tetapi setelah ternak dipanenpun masih menyisakan permasalahan. Residu aflatoksin dan metabolitnya pada produk-produk asal hewan menjadi permasalahan lain lagi. Pribadi dan Patriana (1996) mendapati akumulasi residu aflatoksin pada beberapa bagian karkas ayam dalam skala penelitian. Tidak tertutup kemungkinan untuk mendapatkan hasil yang sama bila dilakukan pengamatan yang lebih mendalam pada karkas-karkas ayam yang dijual. Aflatoksin M1 pun dapat saja ditemukan di produk susu segar dari peternakan sapi perah yang pakannya tercemar aflatoksin. Walaupun penelitian telah merekam keberadaan residu aflatoksin dalam beberapa produk asal hewan, namun masih jarang diperoleh penelitian-penelitian yang memusatkan perhatiannya pada kesehatan konsumen setelah memakan produk-produk yang berpotensi tercemari oleh aflatoksin.
3
Rusaknya sel-sel hati yang diakibatkan oleh aflatoksin telah diamati oleh beberapa peneliti baik pada hewan (Chen et al. 1994; Jenning et al. 1994) maupun pada manusia (Cole et al. 1989; Begue et al. 1988). Beberapa tanggap seluler sel hati dari hewan yang mengalami aflatoksikosis dapat berupa terjadinya peroksidasi lipida (Shen et al. 1994), perubahan keutuhan membran dan penghambatan enzim glutathione-S-transferase (Jenning et al. 1994), peningkatan aktivitas sangat tinggi pada sitokrom dari sel-sel hepatik yang mengiringi proses pembesaran organ hati (Iwaki et al. 1990).
Tingkat kerusakan sel-sel hati dalam kasus karsinoma hepatoseluler pada hewan percobaan telah diteliti oleh beberapa peneliti. Nunez et al. (1991) mendapati bahwa organ hati yang mengalami karsinoma hepatoseluler akan kehilangan hubungan antara hepatosit dan sinusoid, antara hepatosit dan sistem saluran empedu dan antar hepatosit itu sendiri. Sedangkan Pritchard dan Butler (1988) mendapatkan bahwa perkembangan pembentukan tumor hati dapat ditandai dengan adanya nodul-nodul yang bersifat eosinofilik di dalam sel.
Proses biotransformasi yang terjadi di dalam organ hati merupakan tahap awal yang sangat penting bagi aflatoksin. Aflatoksin mengalami bioaktivasi setelah melalui proses biotransformasi sehingga bersifat radikal, toksik dan memberikan efek karsinogenik. Proses biotransformasi aflatoksin dimulai dengan terjadinya oksidasi di dalam sitokrom P-450 dan selanjutnya akan menghasilkan berbagai metabolit aflatoksin dengan tingkat toksisitas yang tidak lebih rendah dari senyawa awalnya (Eaton dan Groopman 1994).
4
maka dikembangkan suatu pemikiran (iii) apakah ada sejenis protein yang berada di dalam organ hati yang dapat berikatan dengan aflatoksin?; (iv) seandainya memang protein ini yang bertanggungjawab terhadap kejadian aflatoksikosis,
apakah keberadaan protein di organ hati dapat digunakan sebagai parameter
tingkat kepekaan antar spesies hewan terhadap aflatoksin?
Tujuan Penelitian
Sampai saat ini hasil-hasil penelitian yang secara tegas mengarah ke upaya mencari jawaban atas pemikiran-pemikiran di atas belum tercatat, namun dari hasil yang sudah ada dapat dirangkai pemikiran-pemikiran melalui penelitian ini. Penelitian yang dilakukan ini bertujuan:
1. Isolasi protein pada organ hati yang dapat berikatan dengan aflatoksin B1 (AFB1). Protein yang telah diisolasi dapat dikatakan sebagai protein yang terikat AFB1 (PAB1);
2. Identifikasi dan karakterisasi protein PAB1;
3. Pengamatan keberadaan protein PAB1 di organ hati ayam dan bebek. Keberadaan PAB1 dan pola penyebarannya di jaringan hati akan digunakan untuk menjelaskan perbedaan kepekaan antara bebek dan ayamterhadap aflatoksikosis.
Hipotesis
Hipotesis yang diajukan dalam penelitian ini adalah
H0 : didapatkan protein di dalam organ hati yang bereaksi dengan AFB1 dan menyebar pada organ hati bebek dan ayam
H1 : tidak didapatkan protein di dalam organ hati yang bereaksi dengan
5
Manfaat Hasil Penelitian
Informasi mengenai protein terikat AFB1 masih belum banyak dilaporkan dan dari penelitian ini diharapkan diperoleh informasi mengenai:
1. adanya protein yang memiliki kemampuan untuk berikatan dengan AFB1 (PAB1),
2. sifat antigenik PAB1 sehingga mampu menggertak untuk memproduksi antibodi (APAB1),
3. PAB1 yang dapat digunakan sebagai penentu perbedaan kepekaan antara bebek dan ayam terhadap AFB1,
6
TINJAUAN PUSTAKA
Cendawan Aflatoksigenik
Indonesia yang beriklim tropis memberikan kondisi yang sangat baik bagi pertumbuhan dan perkembangan berbagai cendawan. Salah satu diantara cendawan tersebut adalah Aspergillus sp. A. flavus dan A. parasiticus dikenal sebagai cendawan toksigenik karena kedua spesies ini mampu menghasilkan aflatoksin. Namun demikian, masih ada keraguan dari para ahli apakah
Penicillium puberulum dan A. nomius memiliki kemampuan untuk memproduksi aflatoksin. Hal ini dikarenakan proses identifikasi yang dinilai masih belum tepat (Syarief et al. 2003).
Semula hanya dikenal aflatoksin B1, B2, G1, G2, M1, dan M2 saja. Akan tetapi, dengan semakin maju teknik pemeriksaan saat ini telah dikenal beberapa aflatoksin berikut metabolit-metabolitnya selain yang telah dikemukakan sebelumnya, diantaranya adalah B2 B3, GM1, G2 , M1, M2, M2 , GM2, P1, Q1, Ro, RB1, RB2, AFL, AFLH, AFLM dan turunan metoksi, etoksi dan asetoksi (Bhat 1991; Kuilman et al. 1998; Kuilman 1999).
A. flavus merupakan cendawan patogen oportunistik. Cendawan ini banyak terdapat di lingkungan karena spesies ini mampu hidup dengan bahan-bahan organik yang ada. A. flavus memiliki kemampuan untuk menginfeksi tanaman, insekta, hewan dan manusia. Tanaman dapat terinfeksi oleh A. flavus
7
penyebaran spora-spora cendawan untuk menjadi pencemar. Insekta-insekta yang terinfeksi A. flavus dapat menjangkau setiap sudut di dalam lokasi gudang sehingga memperluas wilayah pencemaran yang dilakukan oleh cendawan ini. Perluasan pencemaran di dalam gudang dapat terjadi dalam jangka waktu 24 jam (Cotty, 1991).
Sifat Fisik dan Kimiawi Aflatoksin sebagai Racun
8
Penelitian-penelitian yang mempelajari reaksi kimiawi aflatoksin telah banyak dilakukan dengan tujuan untuk mendapatkan cara terbaik mendetoksifikasi aflatoksin. Pada lingkungan kering, aflatoksin merupakan senyawa yang sangat stabil terhadap panas sampai mencapai titik leburnya (Tabel 1). Peningkatan suhu akan membuka cincin lakton sehingga akan terjadi dekarboksilasi (decarboxylation) yang menyebabkan rusaknya aflatoksin. Kekompakan lakton akan mengalami hidrolisis di dalam larutan alkali. Namun, bila larutan basa tersebut dilakukan upaya untuk mengasamkannya (asidifikasi), maka proses hidrolisis ini membalik kembali (reversible) yang diikuti dengan proses resiklisasi (recyclization). Cincin dapat dibuka dengan menaikkan suhu sampai mencapai 100 o
C yang diikuti dengan dekarboksilasi. Bila proses ini dipertahankan, maka akan terjadi kehilangan kelompok metoksi dari cincin aromatik. Proses serupa dapat terjadi dengan menggunakan amonia dan beberapa senyawa amin. AFB1 dan AFG1 dapat berubah menjadi AFB2 dan AFG2
di dalam larutan asam-asam mineral karena terjadi penambahan air terkatalisasi asam pada ikatan ganda cincin furan. Turunan asetoksi dari AFB1 dan AFG1 akan terbentuk dengan adanya reaksi asam asetat anhidrida dan HCl. Metabolit yang sama juga akan diperoleh dengan adanya formic acid-thionyl chloride, acetic acid-thionyl chloride dan
Tabel 1. Sifat fisik dan kimiawi aflatoksin
--- Aflatoksin Rumus molekul Berat molekul Titik lebur (oC) --- B1 C17 H12O6 312 268-269
B2 C17 H14O6 314 286-289
G1 C17 H12O7 328 244-246
G2 C17 H14O7 330 237-240
M1 C17 H12O7 328 299
M2 C17 H14O7 330 293
B2 C17 H14O7 330 240
G2 C17 H14O8 346 190
---
9
trifluoroacetic acid. Molekul aflatoksin akan kehilangan sifat pendaran fluoresennya bila direaksikan dengan senyawa-senyawa pengoksidasi seperti
sodium hypochlorite, potassium permanganate, chlorine, hydrogen peroxide, ozon dan sodium perborate. Proses reduksi melalui hidrogenasi pada AFB1 dan AFG1 akan menghasilkan AFB2 dan AFG2. Proses reduksi AFB1 oleh hidrogen 3 mol akan menghasilkan tetrahidroksiaflatoxin. Reduksi AFB1 dan B2 dengan sodium borohidrida akan menyebabkan terbukanya cincin lakton dan terjadi reduksi pada kelompok asam dan kelompok keto di dalam cincin siklopentena. Proses ini akan menghasilkan AFRB1 dan AFRB2 (Reddy dan Waliyar 2000).
Biosintesis Aflatoksin
Aflatoksin merupakan salah satu metabolit sekunder yang dihasilkan oleh
A. flavus dan A. parasiticus yang tumbuh subur pada kondisi tropis dan subtropis. Aflatoksin dikategorikan sebagai metabolit sekunder karena tidak memiliki peranan dalam pertumbuhan dan perkembangan cendawan yang menghasilkannya. Sebaliknya, beberapa metabolit primer dan antara (intermediate) ada yang berperan sebagai bahan baku untuk memproduksi metabolit sekunder ini.
Kendati kedua cendawan mampu berperan sebagai pencemar pada berbagai produk pertanian, tetapi tidak pada semua produk pertanian tersebut kedua cendawan ini mampu menghasilkan aflatoksin. Bahan-bahan kaya minyak, seperti kacang tanah dan biji kapas (cottonseed) merupakan komoditi yang sangat disukai untuk menghasilkan toksin. Produksi aflatoksin dirangsang oleh lipida dan protein yang dikandung oleh substrat. Setelah pemecahan lipida oleh enzim lipase, asam-asam lemak dimetabolisasi menjadi asetil-koenzim A oleh -?oksidasi. Selanjutnya, asetil-koenzim A akan masuk ke dalam sistem metabolisme melalui
10
Beberapa protein berperan sebagai prekursor dalam tahap-tahap sintesis aflatoksin. Prekursor yang sudah dikenali diantaranya asam norsolorinat, averantin, averufanin, averufin, 1’-hidroksiversikolorona, asetat hemiacetal versikonal, versiconal, versikolorin A, dimetilsterigmatosistin, sterigmatosistin, o -metilsterigmatosistin (Bhatnagar et al. 1987; McCormick et al. 1987; Bhatnagar et al 1989; Yabe et al. 1989; Yabe et al. 1998; Sakuno et al. 2003; Yabe et al.
2003). Peranan masing-masing prekursor pada tahap sintesis aflatoksin terpapar
dalam Gambar 2 berikut. Enzim yang berperan sebagai katalisator dalam biosintesis aflatoksin diantaranya dua metiltransferase masing-masing memiliki bobot molekul 168 dan 48 kDa dan reduktase dengan bobot molekul 38 kDa
11
Beberapa penelitian yang difokuskan untuk melihat gen-gen yang terlibat dalam proses biosintesis AFB1 telah banyak diteliti. Ada 6-8 kromosom dengan ukuran 3 sampai > 7 Mb yang telah diidentifikasi melalui analisis karyotipe (Foultz et al. 1995). Beberapa gen yang telah diidentifikasi terpapar dalam Tabel 2 berikut.
Gambar 2. Peranan beberapa prekursor dalam tahapan sintesis aflatoksin.
12
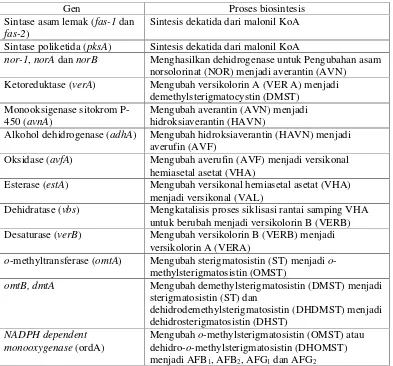
Tabel 2. Gen yang terlibat dalam proses biosintesis AFB1
Gen Proses biosintesis
Sintase asam lemak (fas-1 dan
fas-2)
Sintesis dekatida dari malonil KoA Sintase poliketida (pksA) Sintesis dekatida dari malonil KoA
nor-1, norA dan norB Menghasilkan dehidrogenase untuk Pengubahan asam norsolorinat (NOR) menjadi averantin (AVN)
Ketoreduktase (verA) Mengubah versikolorin A (VER A) menjadi demethylsterigmatocystin (DMST)
Monooksigenase sitokrom P-450 (avnA)
Mengubah averantin (AVN) menjadi hidroksiaverantin (HAVN)
Alkohol dehidrogenase (adhA) Mengubah hidroksiaverantin (HAVN) menjadi averufin (AVF)
Oksidase (avfA) Mengubah averufin (AVF) menjadi versikonal hemiasetal asetat (VHA)
Esterase (estA) Mengubah versikonal hemiasetal asetat (VHA) menjadi versikonal (VAL)
Dehidratase (vbs) Mengkatalisis proses siklisasi rantai samping VHA untuk berubah menjadi versikolorin B (VERB) Desaturase (verB) Mengubah versikolorin B (VERB) menjadi
versikolorin A (VERA)
o-methyltransferase (omtA) Mengubah sterigmatosistin (ST) menjadi o -methylsterigmatosistin (OMST)
omtB, dmtA Mengubah demethylsterigmatosistin (DMST) menjadi sterigmatosistin (ST) dan
dehidrodemethylsterigmatosistin (DHDMST) menjadi dehidrosterigmatosistin (DHST)
NADPH dependent monooxygenase (ordA)
Mengubah o-methylsterigmatosistin (OMST) atau dehidro-o-methylsterigmatosistin (DHOMST) (AFB2) yang struktur molekulnya menyerupai AFB1 tidak memiliki toksisitas seperti yang dimiliki AFB1 karena kehilangan cincin furannya. Demikian pula dengan aflatoksin G1, G2 dan M1.
metabolit-13
metabolit yang mengakibatkan substrat pertumbuhan menjadi asam (asidifikasi) dengan pH yang dapat mencapai 3,8 (Karunaratne et al. 1990). Asam glukonat yang dihasilkan oleh Aspergillus niger dan Aspergillus tamarii juga dapat menghambat sintesis aflatoksin. Faktor-faktor lain yang mengganggu sintesis aflatoksin adalah suhu tinggi (lebih dari 40 oC), aw, pH dan beberapa garam/asam tertentu yang ada di dalam makanan dan bahan makanan dapat menekan produksi aflatoksin oleh A. flavus.
Organ Hati dan Proses Biotransformasi Aflatoksin
Organ hati merupakan satu-satunya organ yang melakukan fungsi detoksikasi. Organ ini menerima berbagai jenis senyawa dari darah yang masuk ke dalam tubuh melalui jalur saluran pencernaan, saluran pernafasan, kulit dan penyuntikan. Bahan toksikan yang masuk ke tubuh akan mengalami proses biotransformasi dalam upaya mendetoksikasi bahan tersebut. Proses ini akan mengubah sifat toksikan yang semula larut lemak menjadi bahan yang mudah larut dalam air sehingga mudah dikeluarkan dari tubuh (ekskresi). Proses biotransformasi terjadi di retikulum endoplasmik yang melibatkan sistem enzim sitokrom P-450 dan sitosol. Selama proses biotransformasi, toksikan akan mengalami dua fase proses detoksikasi. Fase I terjadi di retikulum endoplasmik dan toksikan akan mengalami pemaparan atau penambahan kelompok-kelompok fungsional oleh 2 sistem enzim. Sistem enzim yang terlibat adalah sistem enzim pada sitokrom P-450 (mixed function oxygenase, MFO) dan mixed function amine oxidase (flavin monooxygenase). Toksikan akan mengalami proses oksidasi, reduksi dan hidrolisis di fase I. Metabolit yang dihasilkan dapat langsung diekskresikan atau masuk ke sistem yang berlaku di Fase II. Fase ini terjadi di sitosol dan enzim-enzim yang terlibat pada fase ini akan mengkonjugasi toksikan. Metabolit yang dihasilkan dari Fase II akan langsung diekskresikan (Sipes dan Gandolfi 1986; Goodsell 2001).
14
menjadi sasaran utama, tetapi di dalam organ hati aflatoksin ini akan mengalami perubahan biologik (biotransformasi) dan bioaktivasi. Sehingga yang semula aflatoksin mungkin tidak memiliki sifat toksik setelah masuk ke dalam organ hati
menjadi toksik dan bersifat karsinogenik (Gambar 3).
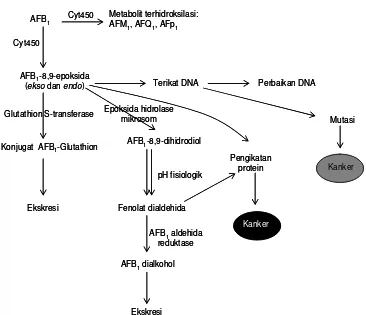
Hal ini dibuktikan dengan diketemukan senyawa AFB1-8,9-epoksida yang sangat radikal sesaat setelah diperkirakan AFB1 masuk ke dalam organ hati (Baertschi et al. 1988). Retikulum endoplasmik dan sitosol merupakan organel sel hati yang berperan dalam proses biotransformasi aflatoksin. Sistem enzim sitokrom P-450 pada retikulum endoplasmik terlibat dalam proses biotransformasi Fase I. Tidak hanya satu jenis sitokrom P-450 yang terlibat, tetapi terdapat berbagai jenis sitokrom P-450 yang terlibat dalam proses biotransformasi AFB1 tersebut (Ramsdell dan Eaton 1990). Wilson et al. (1997) memperlihatkan adanya
Kanker
AFB1 Cyt450 Metabolit terhidroksilasi:
AFM1, AFQ1, AFp1
Cyt450
AFB1-8,9-epoksida
(ekso dan endo) Terikat DNA Perbaikan DNA
Mutasi
(ekso dan endo) Terikat DNA Perbaikan DNA
Mutasi
Gambar 3. Bagan proses biotransformasi dan bioaktivasi AFB1 yang terjadi di
15
peranan mikrosoma CYP1A2 dan CYP3A4 dalam proses pembuatan radikal AFB1-8,9-epoksida (Gambar 4). Proses biotransformasi Fase II dialami aflatoksin di sitosol.
Gambar 4. Peranan mikrosoma CYP1A2 dan CYP3A4 dalam bioaktivasi AFB1 menjadi AFB1-8,9-epoksida (Wilson et al., 1997)
Secara umum, proses biotransformasi yang dialami aflatoksin di dalam organ hati dikelompokkan menjadi (i) oksidasi yang terdiri dari epoksidasi, hidroksilasi, o-demetilasi dan pembentukan AFB(G)2 ; (ii) reduksi dan (iii) konjugasi yang terdiri dari konjugasi glutathion epoksida dan glukoronilasi derivat terhidroksilat.
16
dalam bentuk radikal seperti ini bila tidak diikat dengan gluthation sangat memudahkan untuk berikatan dengan DNA (Goodsell 2001). Reaksi epoksidasi di dalam sitokrom ini melibatkan enzim epoksida hidrolase. Aflatoxin P1 (AFP1), Aflatoxin M1 (AFM1) dan Aflatoxin Q1 (AFQ1) merupakan turunan dari AFB1 yang mengalami epoksidasi di sitokrom P-450 (Monroe dan Eaton 1987). Epoksida akan menyebabkan kerusakan oksidatif pada lipida dan lipoprotein yang merupakan komponen sel (Daniels et al. 1990). Akibat kerusakan oksidatif ini menyebabkan munculnya radikal-radikal bebas, seperti O3, radikal bebas hidroksil dan H2O2. Aktivitas radikal bebas akan menyebabkan kerusakan lipida, enzim, asam nukleat dan protein yang menandakan terjadinya kerusakan sel dan DNA (Shen et al. 1994). Kerusakan sel-sel hati akan ditandai dengan penglepasan enzim-enzim hati sehingga kadar enzim-enzim hati akan meningkat di dalam plasma darah (Brucato et al. 1986; Karakilcik et al. 2004).
Hidroksilasi yang terjadi di sitokrom P-450 menghasilkan metabolit yang aktivitas biologiknya lebih rendah dibandingkan senyawa utama. AFB1 akan mengalami proses hidroksilasi dan perubahan yang terjadi pada ikatan di posisi 3 dan 9a dapat mengubah AFB1 menjadi AFQ1 dan AFM1. Kedua metabolit yang dihasilkan ini tidak mengalami proses epoksidasi sehingga tidak terbentuk metabolit epoksidanya.
Sama halnya dengan proses hidroksilasi, melalui proses o-dimetilisasi
akan mengubah AFB1 menjadi AFP1 dan AFM1. AFP1 dapat membentuk epoksida sehingga mampu menyebabkan kanker (Ross et al. 1992). Sedangkan AFM1 yang terbentuk dapat bertindak sebagai substrat dan lansung berubah menjadi 4,9a-dihydroxy AFB1.
17
Proses reduksi dapat mengubah AFB1 menjadi aflatoksikol (AFL). Proses pembentukan aflatoksikol melibatkan enzim reduktase sitosolik sebagai katalisator di organ hati ayam. AFL dapat menjadi bahan baku kembali untuk menghasilkan AFB1. Sehingga, seringkali dikatakan bahwa AFL merupakan “cadangan” untuk membuat AFB1 yang tersimpan di dalam tubuh. Toksisitas AFL tidak kalah dibandingkan dengan senyawa induknya karena AFL masih tetap bersifat karsinogenik dan mutagenik. Bila terjadi oksidasi pada posisi 9a hidroksilasi dari AFL akan membentuk AFL-M1. Senyawa terakhir ini juga dapat dihasilkan dari reduksi AFM1. AFQ1 dapat direduksi menjadi aflatoksikol H1.
Dua reaksi, yakni konjugasi glutathion (GSH) epoksida dan glukoronidasi metabolit terhidroksilat terjadi dalam proses konjugasi AFB1. Konjugat GSH AFB1-8,9-epoksida merupakan metabolit utama yang dihasilkan melalui reaksi ini. Reaksi konjugasi GSH merupakan reaksi yang penting untuk menentukan efek toksin terhadap AFB1 pada beberapa spesies. Reaksi konjugasi terhadap AFB 1 melibatkan enzim glutathion S-transferase sitosolik (Hayes et al. 1991). Beberapa metabolit lain yang dihasilkan melalui proses konjugasi AFB1 diantaranya glukoronida AFL, AFL-M1 dan AFP1.
Liu et al. (1990) mendapatkan bahwa aktivasi AFB1 tidak hanya terjadi di sistem enzim sitokrom P-450. Tetapi, proses ini dapat terjadi tanpa melibatkan organel tersebut. Ko-oksigenasi AFB1 dapat terjadi dengan bantuan dari asam arakhidonat dan prostaglandin H-sintase. Lipoksigenase yang diperoleh dari kedele juga diketahui mampu mengaktiviasi AFB1 menjadi metabolit yang berikatan dengan DNA (Liu dan Massey 1992). Namun, kadar radikal yang dihasilkan sangat rendah dibandingkan yang dihasilkan sitokrom P-450. Yakni, hanya berkisar 1-2% dibandingkan yang terjadi melalui sitokrom P-450.
18
mendapatkan dosis AFB1. Proses biotransformasi diganggu melalui mekanisme seperti (i) mencegah ikatan antara AFB1 dan DNA, (ii) meningkatkan aktivitas mikrosom, (iii) meningkatkan aktivitas konjugasi terhadap AFB1-8,9-epoksida, (iv) meningkatkan produksi enzim glutathion-S-transferase, dan (v) terjadi penurunan kadar enzim reduktase NADPH-cyt P-450 khusus disebabkan oleh defisiensi riboflavin. Faktor makanan yang dapat mengganggu proses biotransformasi adalah makanan yang mengandung protein berkadar rendah, defisiensi vitamin A, defisiensi riboflavin, brokoli, keberadaan senyawa diallyl sulfida dan ajoene di dalam Allium (kelompok bawang putih) dan capsaicin (Dunaif dan Campbell 1987; Bhattacharaya et al. 1989). Obat-obat yang telah diketahui mengganggu biotransformasi AFB1 adalah butylated-hydroxyanisole, ethoxyquin, dithiolthion dan oltipraz (Ansher et al. 1986, Williams et al. 1986, Monroe dan Eaton 1987; Liu et al. 1988; Kensler et al. 1992).
Pencemaran Aflatoksin dalam Pakan dan Bahan Makanan
Cendawan-cendawan aflatoksigenik ini dapat tumbuh dengan baik pada sistem perakaran dan tanaman-tanaman yang berdekatan dengan tanah, seperti kacang tanah. Tanaman dan sistem perakaran seperti ini menyediakan bahan untuk kolonisasi cendawan aflatoksigenik di buah-buahan yang berdekatan dengan tanah. A. flavus dapat diisolasi dari selaput di sejumlah kacang tanah yang dibeli dari toko-toko grosir-kacang tanah yang memperlihatkan bercak abu-abu atau hitam di bawah selaputnya. Kacang tanah merupakan komoditas pertanian yang paling rentan tercemari oleh A. flavus. Komiditi pertanian berikutnya yang rentan adalah jagung dan kedele (Pitt et al. 1998). Pencemaran oleh genus Aspergillus
tidak hanya terjadi di toko-toko, tetapi telah terjadi sejak di ladang dan gudang penyimpanan. Li et al. (2000) menyatakan ada tiga genus kapang yang hingga saat ini sangat dikenal sebagai cendawan gudang, yakni Penicillium, Aspergillus
19
tumbuh dengan baik pada kondisi suhu 10-12 oC sampai 42-43 oC. Suhu optimum untuk pertumbuhannya adalah 32-33 oC dan pH optimumnya sama dengan 6 (Bahri et al. 2004).
Industri pakan ternak merupakan salah satu industri hulu yang memiliki kepedulian terhadap pencemaran aflatoksin. Komponen pakan ternak, misalnya jagung, bungkil kedele, dan bungkil kelapa, merupakan substrat yang sangat cocok untuk pertumbuhan cendawan aflatoksigenik. Cemaran aflatoksin pada pakan ternak, terutama jagung, telah menjadi masalah bagi industri pakan ternak. Perhatian para praktisi industri pakan ternak mulai terusik tatkala beberapa hasil penelitian terhadap bahan mentah penyusun pakan ternak mulai ditampilkan. Purwoko et al. (1991) yang melakukan penyidikan terhadap keberadaan aflatoksin di dalam bahan mentah penyusun pakan ternak/unggas mendapatkan bahwa 91% jagung yang diperiksa mengandung aflatoksin dengan kadar toksin berkisar dari 22-6171 µg/kg dan 100% dedak yang diperiksa mengandung aflatoksin dengan kadar toksin berkisar dari 36-71 µg/kg. Bahri (1998 dan 2001) dan Bahri et al.
(2005) mendapati bahwa lebih dari 70% contoh jagung, kacang tanah, dedak, konsentrat dan pakan ayam komersial yang diperoleh dari Lampung dan Jawa Timur mengandung AFB1. Kandungan AFB1 di contoh-contoh yang diperiksa berkisar 13,5 – 134,2 g/kg. Walaupun secara individu ada contoh yang mengandung AFB1 di bawah baku mutu, tetapi ada juga yang jauh melampui baku mutu sebanyak 50 ppb yang ditetapkan oleh SNI 01-3929-1995 tentang ransum ayam ras petelur dan SNI 01-4483-1998 tentang jagung bahan baku pakan.
20
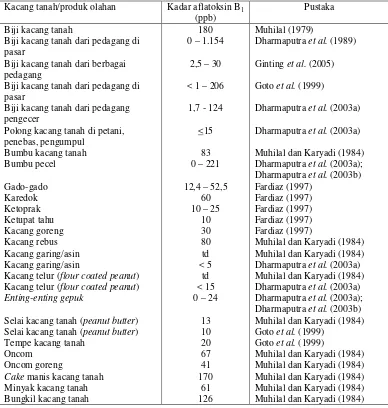
Beberapa bahan makanan yang sangat digemari dan bahan bakunya dari kacang tanah diantaranya bumbu pecel dan makanan yang sejenis, seperti bumbu sate dan kecap, sangat rentan terhadap pencemaran aflatoksin. Pengamatan pencemaran aflatoksin di dalam bahan-bahan makanan telah diselidiki sejak tahun 1979. Beberapa bahan makanan yang diperiksa kala itu telah diketahui mengandung AFB1 dan AFG1 seperti yang terpapar dalam Tabel 3.
Resiko mengkonsumsi makanan asal hewan yang tercemar aflatoksin tergantung pada pakan yang dimakan oleh ternak tersebut. Peluang mengkonsumsi makanan yang mengandung residu aflatoksin semakin besar bila pakan ternak telah tercemari oleh aflatoksin. Aflatoksin yang masuk ke dalam tubuh ternak bersama pakan akan mengalami proses biotransformasi di dalam tubuh ternak dan metabolitnya akan tersimpan di beberapa bagian tubuh ternak atau produk yang dihasilkannya. Tidak hanya metabolitnya, sejumlah aflatoksin yang masih beredar di dalam tubuh ternak pun dapat juga terkumpul. Sejumlah AFB1 telah terlacak berada di beberapa bagian karkas dan jeroan ayam yang di dalam pakannya mendapatkan perlakuan pemberian sejumlah AFB1 (Pribadi dan Unang 1996). Pribadi dan Patriana (1994) mendapatkan adanya AFB1 di dalam telur yang diperoleh dari beberapa peternakan ayam petelur. Sedangkan Maryam
21
Tabel 3. Kandungan aflatoksin pada sampel kacang tanah dan produk olahannya di Indonesia
Kacang tanah/produk olahan Kadar aflatoksin B1
(ppb)
Pustaka
Biji kacang tanah
Biji kacang tanah dari pedagang di pasar
Biji kacang tanah dari berbagai pedagang
Biji kacang tanah dari pedagang di pasar
Kacang telur (flour coated peanut) Kacang telur (flour coated peanut)
Enting-enting gepuk
22
Sapi perah yang pakannya tercemari AFB1 menghasilkan susu yang mengandung residu AFM1 dengan kadar berkisar 0,04-0,17 ppb (Bahri et al. 1994). Carvajal et al. (2003) mendapatkan data bahwa sebanyak 40% produk susu di Meksiko mengandung AFM1 dengan kadar > 0,05 g/kg (ppb) dan sebanyak 10% mengandung AFM1 dengan kadar <0,05 g/kg.Hasil ini menegaskan bahwa AFM1 tidak rusak oleh perlakuan selama proses produksi karena aflatoksin baru akan rusak pada suhu 270 oC (Beuchat 2000 dalam Galvez et al. 2003). Sejumlah residu AFM1 masih dapat terlacak di beberapa jenis produk olahan susu, seperti keju (40-60%), krim (10%) dan butter (2%) dari kadar AFM1 pada produk awalnya. Adanya residu AFM1 dibeberapa produk olahan susu tersebut berkaitan dengan kasein susu (Lòpez et al. 2001).
Pemerintah melalui SNI 01-6366-2000 tentang batas maksimum cemaran mikroba dan batas maksimum residu dalam bahan makanan asal hewan, telah menetapkan bahwa kadar AFB1 yang diperbolehkan adalah 0,02 mg/kg untuk produk daging dan telur serta 0,001 mg/kg untuk produk susu. Kuiper-Goodman (1989) mendapatkan dosis aman untuk AFM1 adalah 0,066 mg/kg dengan TD50 sebesar 10,38 mg/kg. Sedangkan Codex Alimentarius Commission menetapkan kadar maksimum AFM1 di dalam produk susu adalah 0,5 g/kg.
Gangguan Kesehatan Ternak dan Manusia oleh Aflatoksin
23
AFB1 menjadikan organ hati sebagai organ sasarannya dan memiliki sifat hepatokarsinogenik, mutagenik dan teratogenik. Aflatoksin dapat menyebabkan kanker hati pada manusia, hewan laboratorium dan hewan ternak (Brucato et al.
1986; Ronald et al. 1992; Cassand et al. 1993; Harvey et al. 1994; Netke et al.
1997). Dampak aflatoksikosis pada ternak sangat beragam tergantung dari spesies, umur, bangsa dan kandungan protein di dalam pakan. Hewan muda lebih rentan dibandingkan yang tua (FSRIO 2005).
Ternak yang mengalami aflatoksikosis melalui pakannya akan mengalami anoreksia, ikterus, depresi, keluar cairan dari hidung, gangguan pada saluran pencernaan, penurunan fungsi organ reproduksi, asites atau hidrothoraks, penurunan bobot badan, bobot organ hati akan meningkat, penurunan tanggap kebal (imunosupresi), penurunan produksi susu dan telur dan gangguan pertumbuhan (Ghosh et al. 1990; Hegazy et al. 1991; Rao dan Joshi 1991; Kubena dan Harvey 1993; Suzanna et al. 1994; Azzam dan Gabal 1998; Gabal dan Azzam 1998; Glavits dan Salyi 1998; Madden dan Stahr 1999; Sklan et al. 2001; Ortatatli
et al. 2002; Rizzi et al. 2003; FSRIO 2005). Beberapa gejala klinis juga telah diamati pada babi (Coppock et al. 1989), kuda (Bortell et al. 1983), sapi (Colvin et al. 1984; Brucato et al. 1986), domba (Abdelsalem et al. 1989), anjing (Liggert et al. 1986; Bastianello et al. 1987) dan unggas (Glavits dan Salyi 1998; Priosoeryanto et al. 2002). Sifat teratogenik AFB1 diperlihatkan dengan adanya penurunan daya tetas dan abnormalitas pada embryo yang dihasilkan (Widiastuti et al. 1996; Azzam dan Gabal 1998; Celik et al. 2000; Bahri et al. 2005).
Pemeriksaan patologik pada semua ternak penderita memberikan hasil yang hampir mirip karena aflatoksikosis akan menyerang organ hati. Penderita aflatoksikosis akan mengalami hemorrhagi, nekrosis hepatik dan proliferasi pembuluh empedu. Sel-sel hati yang terperangkap oleh proliferasi pembuluh empedu dan jaringan ikat mengalami degenerasi lemak (Junjunan et al. 2000; Priosoeryanto et al. 2002).
24
penumpukan lipida di hepatosit. Perubahan-perubahan enzim di dalam serum telah dilaporkan dalam penelitian-penelitian. Beberapa enzim hati, seperti aspartat transaminase, alkalin fosfatase, kreatin fosfokinase, laktat dehidrogenase; urea, trigliserida; kolesterol dan albumin akan meningkat selama mengalami aflatoksikosis (Madden dan Stahr 1999; Karakilcik et al. 2004).
Aflatoksin juga menyebabkan gangguan kesehatan pada manusia. Aflatoksikosis pada manusia biasanya disebabkan oleh mengkonsumsi makanan yang tercemari oleh aflatoksin sebagai akibat dari tercemarnya bahan baku pangan, seperti kacang tanah, kacang kedele atau susu (William et al. 2004). Aflatoksikosis pada manusia menimbulkan gejala klinis seperti sakit perut, muntah-muntah, oedema organ paru, oedema di bagian ekstremitas bawah, konvulsi, kerusakan organ hati, koma dan tidak mustahil mengakibatkan kematian. AFB1 telah dinyatakan sebagai salah satu penyebab kanker hati (hepatocelluler
carcinoma, HCC) baik di masyarakat Asia dan Afrika maupun di negara lainnya (Jackson et al. 2001; Hinton et al. 2003; FSRIO 2005; GenNet 2005; Bommakanti dan Waliyar, 2005; Winter 2005). AFB1 telah diketahui sebagai penyebab gangguan reproduksi berupa infertilitas pada pria (Uriah et al. 2001) dan kekebalan seluler (Jiang et al. 2005).
Aflatoksin juga dikenal sebagai pemicu bagi munculnya penyakit lain. Resiko terinfeksi oleh virus Hepatitis B meningkat dengan adanya intoksikosis AFB1 (Groopman dan Kensler 1999). AFB1 juga berkaitan erat dengan kejadian kwashiorkor, malnutrisi dan Reye’s syndrome (Nelson et al. 1980; Roberts dan Richard 1992; Fields et al. 1999; Peraica et al. 1999; Gong et al. 2002; Bankole dan Adebanjo 2003; Bennett dan Klich 2003; Williams et al. 2004).
25
1990; Ghosh et al. 1991), ayam dan kalkun (Neldon-Ortiz dan Qureshi 1991, 1992) dan babi (Silvotti et al. 1997). AFB1 juga menghambat sintesis dan menurunkan kemampuan beberapa sitokin peradangan (inflammatory cytokines) pada rodensia (Jakab et al. 1994; Moon et al. 1999), sapi (Kurtz dan Czuprynscki, 1992), manusia (Rossano et al., 1999; Williams et al. 2004). Babi umur 4 minggu yang diberikan AFB1 dengan dosis 140 dan 280 ppb mengalami penurunan sitokin IL-1ß dan TNF-a, tetapi mengalami peningkatan IL-10 (Liu et al. 2002, Marin et al. 2002). Hasil berbeda diperoleh Turner et al. (2003) yang mendapati bahwa keberadaan AFB1 yang terikat albumin di dalam darah tidak menurunkan fungsi tanggap kebal seluler, tetapi justru mempengaruhi produksi IgA sekretori (sIgA).
Teknik-Teknik untuk Mendeteksi Aflatoksin dan Mendiagnosa Aflatoksikosis
Ada tiga tahapan penting yang dilibatkan dalam proses menyidik aflatoksin dalam contoh yang diperiksa. Ketiga tahapan tersebut adalah ekstraksi, pemurnian (purifikasi) dan penentuan (determinasi). Ekstrak contoh untuk penyidikan aflatoksin biasanya menggunakan kombinasi klorohidrokarbon-air, atau metanol-air, atau asetonitril-air. Cukup banyak produk-produk komersial yang dapat digunakan untuk memurnikan ekstrak contoh. Cartridge merupakan salah satu kolom pemurni yang cukup banyak digunakan. Cartridge merupakan kolom mikro yang terbuat dari tabung plastik yang di dalamnya berisi 100-500 mg partikel fase stationer 40 g yang berada di tengah dan ujung dari tabung tersebut. Jenis partikel yang digunakan dapat berupa jel silika, C18, Florisil® dan
phenyl-bounded SPE cartridge. Perkembangan teknologi dan imunologi menghasilkan kolom afinitas. Kolom ini menggunakan lapisan agarose yang mengandung antibodi terhadap aflatoksin yang diperiksa (Trucksess et al. 1991; Carvajal et al.
2003; Bahri et al. 2005).
26
Beberapa jenis teknik kromatografi yang digunakan diantaranya thin layer chromatography (TLC, dengan kemampuan mengidentifikasi dan menghitung kadar aflatoksin < 1 ng/g), high performance thin layer chromatography
(HPTLC) dan high pressure liquid chromatography (HPLC) (Coker 1988; AOAC 1990).
Dalam perjalanan waktu, pelaksanaan penyidikan aflatoksin membutuhkan peningkatan sensitifitas, spesifisitas, kecermatan, ketepatan, stabilitas dan kesederhanaan teknik. Biaya yang digunakan untuk melakukan penyidikan diupayakan untuk dihemat. Tuntutan-tuntutan tersebut memicu pengembangan teknik penyidikan. Penyidikan dengan teknik imunologik menjawab hampir semua tuntutan tersebut. Beberapa teknik imunologik digunakan adalah metode
agar gel precipitation test (AGPT), radioimmunoassay (RIA), enzyme-linked immunooirbent assay (ELISA) dan immunoaffinity coloumn assay (IACA). Antibodi poliklonal atau monoklonal terhadap aflatoksin yang disidik digunakan dalam teknik-teknik tersebut. Namun, bila menggunakan antibodi monoklonal akan meningkatkan sensitifitas dan spesifisitas uji yang dilakukan (Koeltzow dan Tanner 1990; Frino et al. 2000).
Pengendalian Aflatoksin
27
T. harzianum, T. viride, T. auroviride, T. longibrachiatum, T. hamatum, Erotium chevalieri, dan Fusarium moniliforme; dan bakteri Pseudomonas telah dicoba ditumbuhkan bersama dengan A. flavus. Pertumbuhan A. flavus mengalami hambatan dengan adanya spesies-spesies tersebut. Dari hasil itu muncul dugaan bahwa spesies-spesies tersebut memiliki tingkat pertumbuhan yang cepat sehingga mendominasi lingkungan, atau menghasilkan enzim-enzim hidrolitik, atau senyawa anticendawan atau memiliki sifat mikoparasitisme lainnya (Dharmaputra dan Putri 1996; Anonim 2000).
Penyingkiran aflatoksin yang terkandung di dalam bahan makanan dengan memanfaatkan bakteri-bakteri asam laktat (BAL) juga telah diteliti. Lactobacillus rhamnosus galur GG (ATCC 53103) dan L. rhamnosus galur LC-705 (DSM 7061) mampu menyingkir aflatoksin yang diimbuhkan ke dalam media tumbuh bakteri tersebut (Haskard et al. 2001). Selain dua galur tersebut, Lactobacillus amylovorus dan Bifidobacterium juga mampu menyingkirkan aflatoksin dari bahan makanan. Kemampuan bakteri Lactobacillus amylovorus menyingkirkan aflatoksin dapat mencapai 50% dari jumlah awal (Peltonen et al. 2001).
Fokus utama untuk mengendalikan mikotoksin di dalam pakan dan makanan adalah mengendalikan keberadaan aflatoksin di dalam bahan bakunya. Hal ini harus dilakukan bila menginginkan produk akhir yang akan dihasilkan tidak memiliki resiko tercemar aflatoksin. Aflatoksin menjadi fokus kritis dalam proses pengolahan pakan dan makanan karena aflatoksin baru dapat dihancurkan pada suhu 270 oC. Sehingga, walaupun masuk ke dalam proses pengolahan, toksin ini masih tetap ada di dalam produk yang akan dihasilkan (Galvez et al. 2003).
28
Upaya yang lain untuk menyingkirkan aflatoksin secara kimiawi adalah dengan menggunakan pengikat (binder). Pengikat merupakan partikel kecil dengan area permukaan yang luas yang memiliki kemampuan tinggi untuk menyerap dibandingkan menetralkan. Mabbett (2005) mengemukakan bahwa karakter pengikat yang efektif haruslah memenuhi kriteria-kriteria efektif pada tingkat inklusif yang rendah, dapat tercampurkan dengan cepat dan merata, memiliki stabilitas yang tinggi selama proses pengolahan pakan dan penyimpanan pakan, selektif untuk mikotoksin saja, bekerja cepat, kuat dan mengikat untuk jangka waktu yang lama, efektif mengikat untuk berbagai jenis mikotoksin, efektif bekerja pada kisaran pH yang lebar, dapat terurai di lingkungan dan ramah lingkungan
Pengikat mikotoksin yang pertama kali dikembangkan adalah lumpur mineral anorganik. Ada tiga pengikat dari jenis ini, yaitu bentonit, zeolit dan aluminosilikat. Zeolit, baik yang sintetik maupun yang alami, juga telah digunakan untuk mengikat aflatoksin. Miazzo et al. (2000) mendapati zeolit sintetik yang diberikan dengan kadar satu persen ke dalam pakan yang sebelumnya telah dicampur 2,5 mg/kg AFB1 mampu melindungi ayam pedaging terhadap efek aflatoksikosis. Pengikat aluminosilikat dinilai lebih efektif. Ketika dicampur air, permukaan segera bereaksi dengan ujung grup fungsional dari mikotoksin dan memegangnya dengan erat. Pemberian hidrated sodium calsium aluminosilicate
(HSCAS) 0,5% dapat mengurangi aflatoksikosis pada ayam. Akan tetapi, penggunaan HSCAS masih dinilai belum efesien karena diperlukan 4-10 kg/ton pakan. Kekurangan HSCAS lainnya adalah tidak dapat diuraikan secara biologik, melicinkan lantai kandang, tidak ada nilai nutrisi (malah mengurangi nilai nutrisi karena mengikat tidak selektif terhadap vitamin, mineral dan asam-asam amino), tidak dapat digunakan untuk mikotoksin lainnnya, seperti zearalenon, okhratoksin dan trikhotesen (Mabbett 2005).
29
kepada pemanfaatan Lactobacillus rhamnosus, Propionibacterium dan
Flavobacterium aurantiacum untuk menguraikan aflatoksin. Ketiga mikroba ini telah terbukti dapat menghancurkan aflatoksin di media pertumbuhan dan produk-produk susu, jagung, minyak jagung, selai kacang, ekstrak kedele, kacang dan susu kacang (Lillehoj dan Ciegler 1968; Chourasia dan Sinha 1995; Line dan Brackett 1995; Pribadi et al. 1998; Bata dan Lasztity 1999; El-Nezami et al.1996; El-Nezami et al.1998; Kankaanpää et al. 2000, Pierides et al. 2000; Souza dan Brackett 2000).
Saat ini telah dicoba untuk memanfaatkan bahan-bahan organik yang memiliki kemampun mengikat dan menyingkirkan aflatoksin. Bahan dinding sel khamir yang terdiri dari glukan dan mannan dinilai memiliki kemampuan untuk mengikat aflatoksin. Bahan tersebut adalah glukomannan teresterifikasi (esterified glucomannan, EGM) dan manan-oligosakarida termodifikasi (modified mannan-oligosaccharide). Kedua bahan ini dinilai memiliki kemampuan tinggi dan mudah terurai di lingkungan. Pengamatan mikroskopik menggunakan mikroskop elektron didapatkan gambaran bahwa luas permukaan EGM yang dapat mengikat aflatoksin mencapai 2,2 hektar. Jauh lebih luas dibandingkan lumpur pengikat. Melalui perhitungan dalam skala laboratorium, sebanyak 300 g EGM sudah cukup sebanding dengan 8 kg pengikat mineral. Suatu angka yang mencerminkan betapa efisien dan efektifnya EGM. EGM memiliki daya kerja mengikat mikotoksin yang cukup luas. Selain mampu mengikat dengan kuat aflatoksin (95%), senyawa ini juga mampu mengikat zearalenon (77%) dan fumonisin (59%).
MOS memiliki kelebihan dapat mengikat lebih cepat, kadar pengikatan lebih tinggi, berspektrum luas (tidak hanya mengikat aflatoksin saja) dan tidak terpengaruhi oleh keadaan pH. Kemampuan pengikatan AFB1 oleh MOS dapat mencapai 80% pada pH 6,8 dibandingkan hanya 60% pada pH 4,5 (Mabbett 2005).
30
piperin, piperilin, piperitin, piperolein A dan B, dan piperanin yang ada di dalam lada hitam (Amad dan Dharmaputra 1996; Dharmaputra et al. 1996); ekstrak kunyit dan lada hitam (Dharmaputra et al. 1999); capsaicin yang ada di cabe merah (Teel 1991); sulforafan (sulforaphane) yang ada di dalam sayur brokoli (Medscape 2003); diallyl sulfida dan ajoene (Tadi et al. 1991), alisin (alicin) dan turunannya yang terdapat di bawang putih (Shin dan Kwon 2003a dan 2003b; Kwon dan Moon 2005); dan klorofilin (chlorophyllin) yang merupakan campuran dari turunan klorofil (Medscape 2003).
Untuk melindungi kesehatan konsumen dan hewan, Badan Pengawas Obat dan Makanan Amerika Serikat (US Food and Drug Administration, US FDA) telah menetapkan bahwa kandungan aflatoksin tidak boleh lebih dari 20 ppb di jagung dan kacang-kacangan lainnnya yang akan dimakan oleh hewan usia muda (ayam dan pedet), atau untuk pemanfaatan yang belum diketahui; 20 ppb di pakan hewan; 100 ppb di jagung dan kacang-kacangan lainnya yang diperuntukan pembibitan sapi pedaging, pembibitan babi dan unggas; 200 ppb di jagung dan kacang-kacangan lainnya yang diperuntukan penggemukan babi; dan 300 ppb di jagung dan kacang-kacangan lainnya yang diperuntukan penggemukan sapi, babi dan unggas (GenNet 2005).
Pengobatan terhadap Aflatoksikosis
Penelitian-penelitian untuk mencari kiat mengobati aflatoksikosis telah dilakukan. Pemberian vitamin A, C, E, selenium, gluthation dan antioksidan dapat mencegah kerusakan yang lebih parah pada organ hati akibat aktivitas AFB1 (Brucato et al. 1986; Cassand et al. 1993; Harvey et al. 1994; Ming-Wei et al.
1994; Netke et al. 1997; Karakilcik et al. 2004).
31
ayam yang mendapatkan aflatoksin pada pakannya dan antibiotika lebih baik dibandingkan kelompok yang tidak mendapatkan antibiotika (Susanto et al. 1995).
Penelitian mengenai pembuatan vaksin AFB1 telah dimulai oleh Wilkinson
32
BAHAN DAN METODE PENELITIAN
Tempat dan Waktu Penelitian
Penelitian dimulai sejak bulan Februari 2005 sampai Agustus 2005. Beberapa laboratorium digunakan untuk menunjang penelitian ini, diantaranya (i) Laboratorium Bakteriologi Fakultas Kedokteran Hewan IPB untuk pemeriksaan keberadaan APAB melalui uji imunodifusi (agar gel precipitation test, AGPT) dan pemeliharaan beberapa hewan coba ayam dan bebek yang sehat untuk diambil organ hatinya; (ii) Laboratorium Histologi Fakultas Kedokteran Hewan IPB untuk melakukan uji imunohistokimiawi, (iii) Laboratorium Patologi Balai Besar Pengujian Mutu dan Sertifikasi Obat Hewan (BBPMSOH) Departemen Pertanian untuk pembuatan preparat histologik dan pewarnaan HE; (iv) Laboratorium Biokimia Fakultas Matematika dan Ilmu Pengetahuan Alam IPB untuk mengektraksi, mengisolasi dan mengkarakterisasi protein PAB; dan (v) Laboratorium Monitoring Mutu Hewan PT. Bio Farma (Persero) untuk memproduksi antibodi terhadap PAB (APAB) dan sekaligus pemeriksaan keberadaan APAB.
Bahan Penelitian 1. Hewan Percobaan
33
Hewan percobaan bebek dan ayam ras pedaging dengan jumlah masing-masing empat ekor telah dipelihara untuk kepentingan penelitian ini. Bebek dipelihara tidak dari kecil karena tidak mudah untuk mendapatkan anakannya. Bebek dipelihara di dalam kandang selama lebih kurang satu bulan. Sedangkan ayam ras dipelihara sejak DOC di dalam kandang. Ayam yang dipelihara ini diberi pakan komersial khusus untuk ayam pedaging. Ayam dipelihara hingga mencapai bobot badan 1,5-1,8 kg. Selama masa pemeliharaan diusahakan untuk meniadakan faktor-faktor yang membuat bebek dan ayam mengalami cekaman. Bebek dan ayam dipotong di akhir masa pemeliharaan untuk diambil organ hatinya.
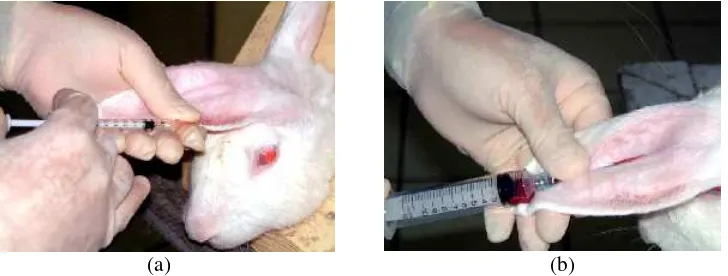
Gambar 5. Hewan percobaan kelinci yang digunakan untuk memproduksi APAB1 dipelihara dalam kandang
34
2. Organ Hati
Sebanyak 100 g organ hati bebek dan ayam yang tidak mengalami perubahan patologik digunakan dalam penelitian ini. Sejumlah organ hati ayam diperoleh dari rumah potong unggas yang ada di Bogor dan dari ayam yang dipelihara. Sedangkan organ hati bebek diperoleh dengan cara memotong beberapa ekor bebek yang diperoleh dari pasar.
3. Bahan Kimia
Bahan kimia yang digunakan dalam penelitian ini adalah Aflatoksin B1 (Sigma), dimetilsulfoksida (DMSO, Sigma), 50 mM Tris pH 7,0, 10 mM EDTA, 25 mM benzamidin, 10 mM fenilmetilsulfonil, 1 mM ditiotreitol, 1% Triton X-100 dan 0,1 M NaCl, bovine standar albumin (Sigma), kertas nitroselulosa, bromsian (Br-CN), larutan garam penyangga fosfat (phosphate buffer saline, PBS), larutan bufer tetPABorat 0,05 M, larutan glisin-HCl 0,1 M pH 2,5, larutan NaOH 1 N, sodium dodesil sulfat (SDS) 2%, gliserol 10%, 2-merkaptoetanol 0,05%, bromfenolbiru 0,002%, etanol, asam asetat Coomassie Blue 0,25%, metanol, Agaros (Heidelberg), polietilenglikol (PEG 6000, BDH Limited) dan sodium azida (NaN3, Merck).
Metode Penelitian
Tahapan-tahapan yang dilakukan dalam penelitian ini adalah (i) mengektraksi, (ii) pembuatan matriks AFB1, (iii) pemurnian dan mengkarakterisasi PAB, (iv) membuat antibodi poliklonal terhadap PAB1 (APAB1), dan (v) pemeriksaan histologik ikatan PAB1 dan APAB1 di jaringan hati.
1. Ekstraksi Sel Hati
35
selama satu menit pada kecepatan 20 Hz dalam 500 ml larutan penyangga yang tersusun atas 50 mM Tris pH 7,0, 10 mM EDTA, 25 mM benzamidin, 10 mM fenilmetilsulfonil, 1 mM ditiotreitol, 1% Triton X-100 dan 0,1 M NaCl. Jaringan yang telah dihancurkan tersebut, kemudian dihomogenisasi selama satu menit pada kecepatan 10 Hz menggunakan Polytron dengan probe berukuran 1,2 cm. Homogenat dipusing (sentrifugasi) pada 40.000 x g selama 30 menit pada 4 oC.
2. Penentuan Kadar Protein
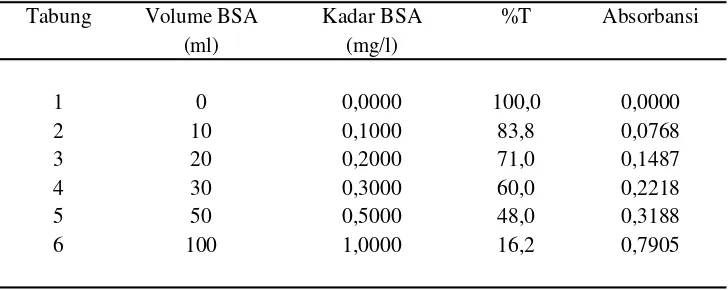
Kandungan protein total dari ekstrak kotor (crude extract protein) diukur menggunakan metode Bradford (1976) dengan BSA sebagai acuan. Beberapa larutan ekstrak protein mulai dari volume 10 l sampai 30 l dimasukkan ke dalam tabung reaksi. Kemudian ditambahkan air suling sebagai pengencer hingga volume akhir mencapai 100 l. Kemudian ditambahkan 100 L NaOH 1M dan tiga mililiter peraksi Bradford. Campuran dikocok dan didiamkan selama 45 menit. Setelah dibuat deret contoh, maka dibuatkan juga deret larutan baku BSA dengan berbagai kadar bertingkat. Setelah semua deret contoh dan larutan baku siap, diukur absorbansinya menggunakan spektrofotomer pada = 595 nm. Kadar protein diukur dengan cara mengekstrapolasikan ke dalam kurva baku dari larutan baku BSA (Bradford 1976).
3. Pembuatan Matriks AFB1
Isolasi PAB1 dilakukan dengan menggunakan teknik khromatografi afinitas (Wibawan et al. 1992). Terlebih dahulu dibuat matriks aktif dengan mengaktifkan nitroselulosa (5x5 cm2) yang direndam dalam bromsian (CNBr) dengan kadar 2% larutan garam penyangga fosfat (PBS) selama 60 menit. Pada tahap perendaman ini, pH dijaga dalam kisaran 11-15. Membran nitroselulosa dicuci dengan air suling sebanyak 8-10 kali pencucian (Estuningsih, 2001).
36
tetraborat 0,05 M. Setelah pencucian ini, berarti matriks telah siap digunakan untuk menangkap protein sel hati.
4. Pemurnian PAB1
Ekstrak organ hati yang telah diukur kandungan proteinnya diinkubasikan dengan matriks nitroselulose aktif selama 45-60 menit pada suhu empat derajat Celcius. Kemudian matriks dibasuh dengan PBS untuk menghilangkan bahan-bahan yang tidak melekat pada matriks. Ikatan spesifik antara PAB1, AFB1 dan matriks dielusi menggunakan 2,0 ml larutan glisin-HCl 0,1 M pH 2,5. Nilai pH bilasan dinetralkan menggunakan larutan NaOH 1 N hingga mencapai pH + 7,0. Protein (selanjutnya diberi kode PAB1) hasil elusi diukur kembali menggunakan metode Bradford (1976) dengan BSA sebagai acuan.
5. Karakterisasi PAB1
Sebelum dilakukan karakterisasi dengan elektroforesis, PAB1 terlebih dahulu dipekatkan dan didialisis. PAB1 dipekatkan dengan cara pengendapan menggunakan amonium sulfat. PAB1 yang dimiliki dimasukkan ke dalam wadah gelas yang disekeliling luar wadah diberi batu es. Amonium sulfat ditambahkan sedikit demi sedikit sambil diaduk menggunakan batang magnet. Jumlah paling banyak amonium sulfat yang ditambahkan adalah 516 g/1000 ml dikalikan volume ekstrak protein. Setelah semua amonium sulfat ditambahkan, ekstrak protein disimpan pada suhu empat derajat Celcius selama 24 jam. Setelah waktu penyimpanan tercapai, dilakukan pemusingan pada kecepatan 10.000 rpm pada 4 o
C. Setelah pemusingan selesai dan diperoleh endapan, kemudian ditambahkan penyangga fosfat 50 mM pH 6,5 kira-kira sebanyak 1,0 ml (tidak boleh terlalu banyak). Ekstrak protein ini selanjutnya akan didialisis.
37
Karakterisasi PAB1 dengan elektroforesis dilakukan menggunakan teknik SDS-PAGE (Wibawan et al. 1992). Penanda baku yang digunakan untuk elektroforesis mengandung karbonil anhidrase (29 kDa), albumin telur (45 kDa), albumin sapi (66 kDa), fosforilasi (97,4 kDa), -galaktosidase (116 kDa) dan miosin (205 kDa). Sebanyak 25,0 L bilasan protein dan 5,0 L penanda molekular baku (Biorad, Ltd.) dicampurkan dengan 5,0 L penyangga contoh (Tris-HCl 1 mol/L pH 6,8, SDS 2%, gliserol 10%, 2-merkaptoethanol 0,05%, bromfenolbiru 0,002%). Campuran dimasukkan ke sumur penampung pada jel poliakrilamida dalam rendaman running buffer dan dilewatkan pada tegangan 80 volt dan kuat arus 0,065 A selama 40-50 menit. Setelah contoh mencapai batas bawah jel, jel dilepaskan dari cetakannya untuk diwarnai. Jel difiksasi menggunakan larutan ethanol-asam asetat (10,0 ml ethanol, 10,0 ml asam asetat dan 80,0 ml air suling). Pewarnaan dilakukan dengan menggunakan Coomassie Blue 0,25% selama 18 jam pada suhu 25 oC. Setelah masa pewarnaan dicapai, dilakukan perendaman dalam larutan pemucat (10,0 ml metanol, 10,0 ml asam asetat dan 80,0 ml air suling). Bila pita terlihat kontras dengan jel, maka jel diangkat dan direndam dalam air suling, disimpan pada suhu empat derajat Celcius untuk menentukan pita protein yang dibentuk.
6. Produksi Anti-Protein (APAB1)
Sebanyak 0,2 ml ekstrak PAB1 yang diperoleh dari organ hati bebek dan ayam disuntikkan ke kelompok kelinci yang berbeda melalui v. auricularis untuk mendapatkan anti-protein (Gambar 6a). Penyuntikan diulang (booster) pada hari ke-8, 15 dan 22. Setiap hari ke-5 setelah penyuntikan, dilakukan pengambilan darah sebanyak 3,0-5,0 ml melalui a. auricularis dengan tujuan pemanenan serum (Gambar 6b).
7. Uji Keberadaan Anti-Protein (APAB1)