PTIMALISASI METODE RESIN PENGENDAP PARTIKULAT
ASAM IMINODIASETAT UNTUK PENENTUAN LOGAM
BERAT (Cu, Cd, Fe, Mn, Zn) AIR LAUT
SITI NURSEVTYANI
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
OPTIMALISASI METODE RESIN PENGENDAP
PARTIKULAT ASAM IMINODIASETAT UNTUK
PENENTUAN LOGAM BERAT (Cu, Cd, Fe, Mn, Zn) AIR
LAUT
SITI NURSEVTYANI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul : Optimalisasi Metode Resin Pengendap Partikulat Asam Iminodiasetat Untuk
Penentuan Logam Berat (Cu, Cd, Fe, Mn, Zn) Air Laut
Nama : Siti Nursevtyani
NIM : G44204046
Menyetujui,
Pembimbing I,
Pembimbing II,
Armi Wulanawati, S.Si, M.Si
NIP 19690725 200003 2 001
Erini Yuwatini, Ph.D
NIP 19650704 199303 2 001
Mengetahui
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
Institut Pertanian Bogor
Dr. Drh. Hasim, D E A
NIP 19610328 198601 1 002
PENDAHULUAN
Luasnya wilayah laut menyebabkan tingginya tingkat pemanfaatannya sebagai salah satu sumber pelengkap kebutuhan hidup manusia. Penggunaan teknologi yang praktis dan efisien namun tidak memperhatikan dampaknya terhadap lingkungan dapat menyebabkan kerusakan lingkungan. Laut sering dijadikan tempat pembuangan limbah, sehingga mengandung sejumlah senyawa dan logam berat yang dapat membahayakan manusia dan organisme disekitarnya.
Penentuan logam dalam air laut sangat penting untuk berbagai aspek dalam ilmu kimia kelautan. Logam dalam air laut dapat ditentukan dengan berbagai teknik pemisahan, di antaranya adalah ekstraksi cair–cair, pertukaran ion, dan adsorpsi. Namun, teknik–teknik ini membutuhkan proses yang cukup lama dan sangat memungkinkan terjadinya kesalahan yang menyebabkan hasil yang diperoleh menjadi tidak valid. Oleh karena itu, diperlukan suatu metode yang cepat, mudah, efektif dan efisien. Salah satu metode yang sesuai dengan hal tersebut adalah penggunaan reagen pengkelat untuk mengikat logam sehingga terbentuk kompleks yang akan mengendap.
Metode yang sedang populer adalah penggunaan suspended particulate reagent iminodiacetic acid, SPR–IDA yang merupakan metode ekstraksi fase padat karena pengekstrak yang digunakan berfase padat mulai dari bahan alami hingga bahan sintesis seperti biomaterial. SPR–IDA terdiri atas polimer berbentuk manik 0.2 µm yang berikatan secara selektif dengan logam esensial menggunakan gugus pengkelat asam iminodiasetat. Pesavento M et al. (1997) melakukan analisis kapasitas adsorpsi logam berat terhadap air laut buatan menggunakan resin bergugus iminodiasetat yang menghasilkan bilangan kompleks instrinsik dari tiap logam berbeda–beda, bergantung pada jenis komponen yang terdapat dalam resin tersebut. Selanjutnya, Dragan et al. (2008) menyatakan bahwa kapasitas adsorpsi logam pada resin yang memiliki gugus iminodiasetat (CR–10 dan CR–5) lebih besar daripada resin komersial Amberlite IRC–178 karena adanya tiga atom pendonor pasangan electron pada resin yang disebutkan pertama.
Dalam metode SPR–IDA, pengaturan berbagai kondisi percobaan seperti jumlah
volume resin yang digunakan, pH, kecepatan dan waktu sentrifus, serta pemekatan (perbandingan HNO3 dan air) berperan
sangat penting, sebab ketepatan dan ketelitian analisis logam ditentukan oleh ikatan antara logam dengan SPR–IDA, kebasaan, ketepatan pemisahan masing– masing logam. Oleh karena itu, penelitian ini bertujuan menentukan kondisi pengaturan yang optimum dari metode SPR– IDA untuk menganalisis logam–logam berat seperti Cu, Cd, Fe, Mn, dan Zn dalam air laut yang bermuatan +2, sesuai dengan lepasnya dua proton dari resin asam iminodiasetat. Logam–logam ini dapat berikatan dengan resin SPR–IDA karena resin akan melepaskan dua hidrogennya untuk digantikan dengan logam tersebut
TINJAUAN PUSTAKA
Logam Berat
Logam merupakan salah satu kebutuhan manusia. Logam dibutuhkan dalam proses metabolisme maupun kegiatan sehari–hari. Logam dalam proses metabolisme berfungsi sebagai kofaktor enzim dan protein. Terkadang logam didefinisikan sebagai suatu bahan yang padat, keras, kaku, dan sulit dibentuk, seperti emas, perak, dan platina. Logam tidak selalu terdapat dalam bentuk padat, tetapi juga dalam bentuk cair. Logam yang berbentuk cair dalam suhu kamar, diantaranya adalah air raksa atau merkuri (Hg), sesium (Cs), dan galium (Ga) (Saefudin 1999).
Menurut jenisnya logam dibedakan menjadi 2, yaitu logam ringan dan logam berat. Logam ringan merupakan unsur logam dengan densitas kurang dari 5 g/cm3, seperti natrium (Na), kalium (K), dan kalsium (Ca) sementara logam berat mempunyai densitas lebih dari 5 g/cm3, seperti merkuri (Hg), timbal (Pb), dan arsenik (As) (Kusnoputranto 1996).
Hutagalung et al. (1997) melaporkan bahwa logam yang terdapat dalam air laut terdapat dalam dua bentuk, yaitu terlarut dan tersuspensi. Kedua bentuk tersebut dapat dipisahkan menggunakan kertas saring dengan diameter pori 0.45 m. Secara alamiah logam berat terdapat dalam air laut namun kadarnya sangat rendah, yaitu berkisar antara 10–5–10–2 ppm.
PENDAHULUAN
Luasnya wilayah laut menyebabkan tingginya tingkat pemanfaatannya sebagai salah satu sumber pelengkap kebutuhan hidup manusia. Penggunaan teknologi yang praktis dan efisien namun tidak memperhatikan dampaknya terhadap lingkungan dapat menyebabkan kerusakan lingkungan. Laut sering dijadikan tempat pembuangan limbah, sehingga mengandung sejumlah senyawa dan logam berat yang dapat membahayakan manusia dan organisme disekitarnya.
Penentuan logam dalam air laut sangat penting untuk berbagai aspek dalam ilmu kimia kelautan. Logam dalam air laut dapat ditentukan dengan berbagai teknik pemisahan, di antaranya adalah ekstraksi cair–cair, pertukaran ion, dan adsorpsi. Namun, teknik–teknik ini membutuhkan proses yang cukup lama dan sangat memungkinkan terjadinya kesalahan yang menyebabkan hasil yang diperoleh menjadi tidak valid. Oleh karena itu, diperlukan suatu metode yang cepat, mudah, efektif dan efisien. Salah satu metode yang sesuai dengan hal tersebut adalah penggunaan reagen pengkelat untuk mengikat logam sehingga terbentuk kompleks yang akan mengendap.
Metode yang sedang populer adalah penggunaan suspended particulate reagent iminodiacetic acid, SPR–IDA yang merupakan metode ekstraksi fase padat karena pengekstrak yang digunakan berfase padat mulai dari bahan alami hingga bahan sintesis seperti biomaterial. SPR–IDA terdiri atas polimer berbentuk manik 0.2 µm yang berikatan secara selektif dengan logam esensial menggunakan gugus pengkelat asam iminodiasetat. Pesavento M et al. (1997) melakukan analisis kapasitas adsorpsi logam berat terhadap air laut buatan menggunakan resin bergugus iminodiasetat yang menghasilkan bilangan kompleks instrinsik dari tiap logam berbeda–beda, bergantung pada jenis komponen yang terdapat dalam resin tersebut. Selanjutnya, Dragan et al. (2008) menyatakan bahwa kapasitas adsorpsi logam pada resin yang memiliki gugus iminodiasetat (CR–10 dan CR–5) lebih besar daripada resin komersial Amberlite IRC–178 karena adanya tiga atom pendonor pasangan electron pada resin yang disebutkan pertama.
Dalam metode SPR–IDA, pengaturan berbagai kondisi percobaan seperti jumlah
volume resin yang digunakan, pH, kecepatan dan waktu sentrifus, serta pemekatan (perbandingan HNO3 dan air) berperan
sangat penting, sebab ketepatan dan ketelitian analisis logam ditentukan oleh ikatan antara logam dengan SPR–IDA, kebasaan, ketepatan pemisahan masing– masing logam. Oleh karena itu, penelitian ini bertujuan menentukan kondisi pengaturan yang optimum dari metode SPR– IDA untuk menganalisis logam–logam berat seperti Cu, Cd, Fe, Mn, dan Zn dalam air laut yang bermuatan +2, sesuai dengan lepasnya dua proton dari resin asam iminodiasetat. Logam–logam ini dapat berikatan dengan resin SPR–IDA karena resin akan melepaskan dua hidrogennya untuk digantikan dengan logam tersebut
TINJAUAN PUSTAKA
Logam Berat
Logam merupakan salah satu kebutuhan manusia. Logam dibutuhkan dalam proses metabolisme maupun kegiatan sehari–hari. Logam dalam proses metabolisme berfungsi sebagai kofaktor enzim dan protein. Terkadang logam didefinisikan sebagai suatu bahan yang padat, keras, kaku, dan sulit dibentuk, seperti emas, perak, dan platina. Logam tidak selalu terdapat dalam bentuk padat, tetapi juga dalam bentuk cair. Logam yang berbentuk cair dalam suhu kamar, diantaranya adalah air raksa atau merkuri (Hg), sesium (Cs), dan galium (Ga) (Saefudin 1999).
Menurut jenisnya logam dibedakan menjadi 2, yaitu logam ringan dan logam berat. Logam ringan merupakan unsur logam dengan densitas kurang dari 5 g/cm3, seperti natrium (Na), kalium (K), dan kalsium (Ca) sementara logam berat mempunyai densitas lebih dari 5 g/cm3, seperti merkuri (Hg), timbal (Pb), dan arsenik (As) (Kusnoputranto 1996).
Hutagalung et al. (1997) melaporkan bahwa logam yang terdapat dalam air laut terdapat dalam dua bentuk, yaitu terlarut dan tersuspensi. Kedua bentuk tersebut dapat dipisahkan menggunakan kertas saring dengan diameter pori 0.45 m. Secara alamiah logam berat terdapat dalam air laut namun kadarnya sangat rendah, yaitu berkisar antara 10–5–10–2 ppm.
biologi dari udara, tanah dan air yang merugikan kehidupan manusia atau makhluk lain (Farbridge 1972). PP RI Nomor 19 Tahun 1999 menegaskan bahwa pencemaran laut adalah masuknya atau dimasukkannya makhluk hidup, zat, energi, dan/atau komponen lain ke dalam lingkungan laut oleh kegiatan manusia sehingga kualitasnya turun sampai ke tingkat tertentu yang menyebabkan lingkungan laut tidak sesuai lagi dengan baku mutu dan/atau fungsinya.
Efek yang ditimbulkan oleh logam berat berbeda–beda, tergantung pada kelompok beracunnya. Berdasarkan sifat racunnya, logam berat dapat digolongkan menjadi 4 kelompok (Lampiran 1).
Kadmium (Cd)
Kadmium adalah logam yang berwarna putih keperakan dengan nomor atom 48 dan nomor massa 112.4 g/mol. Kadmium mempunyai titik leleh 320.9°C. Berat jenis kadmium adalah 8.65 g/cm3 (Brady 1999). Menurut Slamet (1994) kadmium adalah logam yang berwarna putih keperakan, lunak, dan tahan korosi. Manfaat kadmium sangat luas, seperti dalam pembuatan logam campur, baterai Ni–Cd, serta elektroplating.
Organ–organ reproduksi dapat dipengaruhi oleh masuknya logam ini dalam dosis yang kecil (Garrido et al. 1998). Logam ini dapat dipekatkan dalam ginjal yang selanjutnya dapat menyebabkan terjadinya kerusakan ginjal dan keretakan tulang akibat kadmium yang dikenal sebagai penyakit itai–itai (Kusnoputranto 1996).
Tembaga (Cu)
Tembaga merupakan logam berwarna merah dengan nomor atom 29 dan nomor massa 63.55 g/mol. Tembaga mempunyai titik leleh 1083.4°C. Berat jenis tembaga adalah 8.92 g/cm3 (Brady 1999). Adanya tembaga dengan konsentrasi tinggi biasanya dapat dihubungkan dengan korosi pipa–pipa tembaga, limbah industri, atau dalam reservoir yang menggunakan tembaga sulfat sebagai algisida (Sitepoe 1997; Edvantoro et al. 1998). Pada binatang lunak (moluska) sel leukosit sangat berperan dalam sistem translokasi dan detoksikasi logam. Hal ini terutama ditemukan pada kerang kecil (oyster) yang hidup dalam air yang terkontaminasi tembaga (Cu) yang terikat oleh sel leukosit, sehingga menyebabkan kerang tersebut berwarna kehijau–hijauan (Supriyanto et al. 2007). Apabila
terakumulasi dalam tubuh dan konsentrasinya cukup besar maka logam ini akan meracuni manusia. Pengaruh racun yang ditimbulkan dapat berupa muntah– muntah, rasa terbakar di daerah esofagus dan lambung, serta diare (Supriharyono 2000).
Mangan (Mn)
Mangan merupakan logam berwarna putih abu–abu dengan nomor atom 25 dan nomor massa 54.9380 g/mol. Mangan mempunyai titik leleh 1247 °C. Berat jenis mangan adalah 7.43 g/cm3. Pemaparan yang berlebih melalui jalur pernafasan dapat mengakibatkan gangguan terhadap paru– paru. U.S. EPA (2006) melaporkan konsentrasi maksimum Mn dalam air minum adalah 0.05 mg/L serta kombinasi antara Mn dan Fe adalah 0.3 mg/L (Csuros M 1994).
Besi (Fe)
Besi adalah logam berwarna perak dengan nomor atom 26 dan nomor massa 55.847 g/mol. Logam ini memiliki densitas 7.847 g/cm3.Besi (Fe2+) merupakan unsur kelumit yang digunakan oleh hampir semua makhluk hidup. Pengecualian untuk beberapa organisme yang hidup di lingkungan sedikit Fe dan dapat berkembang dengan menggunakan unsur ain untuk proses metabolismenya,misalnya mangan sebagai katalis atau hemosianin untuk menggantikan hemoglobin. Fe yang terdapat dalam enzim biasanya mengandung gugus prostetik heme, berpartisipasi dalam reaksi oksidasi–reduksi secara biologi dan dalam transport beberapa gas terlarut.
Zink (Zn)
Zink merupakan logam berwarna perak kebiruan dengan nomor atom 30 dan nomor massa 65.37 g/mol. Zn mempunyai titik leleh 430 °C. Berat jenis mangan adalah 7.11 g cm–3. Zn merupakan unsur esensial untuk manusia. Kekurangan Zn akan menyebabkan kehilangan nafsu makan, berkurangnya kepekaan untuk merasa dan mencium, lamanya masa penyembuhan, dan iritasi kulit.
Asam Iminodiasetat
gugus asam lewis bivalen atau dua gugus asam lewis monovalen. Selain sebagai senyawa antara untuk senyawa pengkelat, iminodiasetat juga merupakan senyawa glifosfat herbisida, dan surfaktan. Bentuk garam dan esternya digunakan untuk pembuatan pestisida.
Gambar 1 Struktur molekul asam iminodiasetat
Asam iminodiasetat digunakan sebagai senyawa pengkelat untuk penentuan logam dalam air laut karena dapat membentuk kompleks logam iminodiasetat. Logam akan berikatan dengan gugus –COO– pada pH sekitar 8–8.5 (Anonim 2006). Berikut adalah reaksi yang terjadi:
N O O O H OH H + N O O O O H M M2+
+ 2H+
Gambar 2 Kompleks logam-iminodiasetat
Metode Resin Pengendap Partikulat Asam Iminodiasetat
Suspended particulate reagent iminodiacetic acid (SPR–IDA) merupakan metode analisis logam pada air laut yang menggunakan resin SPR–IDA. Resin SPR– IDA ini berfungsi untuk memisahkan logam–logam berat dalam air laut dari senyawa–senyawa lainnya dengan cara mengikatnya sehingga terbentuk sebagai endapan. Kemudian logam yang terikat oleh larutan SPR–IDA dilarutkan kembali oleh HNO3 dan diukur konsentrasinya
menggunakan spektrofotometer serapan atom (SSA) (Anonim 2006).
Optimalisasi
Optimalisasi merupakan penentuan kondisi yang memberikan nilai terbaik dari pengukuran. Optimalisasi perlu dilakukan dalam suatu metode untuk memperoleh hasil terbaik selama pengukuran dengan metode tersebut. Metode SPR–IDA merupakan metode yang terdiri atas beberapa tahap
yang perlu diperhatikan ketelitiannya, diantaranya adalah volume resin SPR–IDA yang digunakan, pH, kecepatan dan waktu sentrifus, serta pemekatan.
Anonim (2006) melaporkan volume resin SPR–IDA yang digunakan adalah 50 µL. Volume resin ini harus ditentukan terlebih dahulu kondisi optimumnya dengan membuat ragam volume. Volume resin yang memberikan absorbans tertinggi merupakan volume optimum resin SPR–IDA.
Variabel lain yang juga perlu ditentukan kondisi optimumnya adalah pH. Logam akan berikatan dengan resin asam iminodiasetat secara baik pada pH agak basa, yaitu pH 8–9 (Anonim 2006). Hal ini disebabkan pada kondisi basa, asam iminodiasetat akan melepaskan hidrogen sehingga terbentuk –COO– yang kemudian berikatan ionik dengan logam. pH yang memberikan nilai absorbans tertinggi merupakan pH optimum.
Pemisahan menggunakan sentrifus juga dilakukan pada metode ini. Pengkondisian alat berupa kecepatan dan waktu sentrifus perlu diperhatikan untuk memperoleh hasil pemisahan yang baik. Molekul dengan bobot jenis tinggi akan terpisah dan berada di bawah molekul dengan bobot jenis rendah. Kecepatan dan waktu sentrifus yang memberikan absorbans maksimum merupakan kecepatan dan waktu sentrifus yang optimum.
Sejumlah HNO3 dan air bebas ion
ditambahkan untuk melarutkan logam yang mengendap setelah proses sentrifus. Semakin banyak HNO3 dan semakin sedikit
air yang ditambahkan, maka semakin tinggi konsentrasi yang dihasilkan. Nisbah optimum ditandai dengan nisbah volume HNO3 dan air yang memberikan absorbans
tertinggi.
Hasil optimalisasi dapat dilihat berdasarkan nilai kedapatulangan (%) yang berkisar antara 80–120% (Harmita 2004). Perhitungan kedapatulangan dapat ditetapkan dengan rumus sebagai berikut:
% 100 %= × a f C C ngan Kedapatula Ket:
Cf = Konsentrasi hasil pengukuran (µg/L) Ca = Konsentrasi yang ditambahkan (µg/L)
Spektrofotometer Serapan Atom(SSA)
SSA adalah suatu teknik analisis yang umumnya digunakan untuk penentuan
2H+
logam dan metaloid yang berdasarkan pada penyerapan (absorpsi) radiasi oleh atom bebas unsur logam tersebut. Atom–atom menyerap cahaya tersebut pada panjang gelombang tertentu bergantung pada sifat unsurnya (Khopkar 1990). Cahaya pada panjang gelombang tertentu mempunyai cukup energi untuk mengubah tingkat elektronik suatu atom. Transisi elektronik suatu unsur bersifat spesifik. Dengan absorpsi energi, berarti memperoleh lebih banyak energi suatu atom pada keadaan dasar dinaikkan tingkat energinya ke tingkat eksitasi (Khopkar 1990). Saat keadaan tidak stabil, atom–atom bebas akan secara spontan segera kembali ke konfigurasi keadaan dasarnya. Elektron berubah kembali menjadi bentuk semula dengan posisi orbital yang stabil dan disertai dengan pemancaran energi radiasi yang jumlahnya sebanding dengan energi awal yang terserap oleh atom pada posisi eksitasi. Spektrum serapan suatu atom terdiri atas garis–garis sempit dengan batas– batas yang terlihat jelas. Hal ini terlihat jelas oleh transisi antar tingkat–tingkat energi elektron dari elektron pada kulit terluar atom tersebut.
Berdasarkan hukum Lambert–Beer, analisis kuantitatif dari spektroskopi atom diperoleh dari resonansi panjang gelombang cahaya dengan intensitas awal (Io) yang difokuskan pada sel nyala (flame) pada keadaan dasar. Intensitas awal cahaya akan berkurang akibat dari jumlah konsentrasi atom dalam sel nyala. Cahaya tereduksi (I) secara langsung akan terukur pada detektor. Jumlah cahaya yang terserap diperoleh melalui perbandingan rasio antara Io dan I berdasarkan % T (transmitan, yaitu perhitungan intensitas cahaya yang diteruskan) atau berdasarkan perhitungan A (absorbans, yaitu perhitungan intensitas cahaya yang diserap).
Rumusan hukum Lambert–Beer:
BAHAN DAN METODE
Bahan dan Alat
Bahan–bahan yang digunakan adalah air laut buatan, NH4OH 25%, HNO3 20%,
standard reference material (SRM), dan resin SPR–IDA.
Alat–alat yang digunakan adalah SSA (Shimadzu AA 6800), sentrifus, dan tabung sentrifus polietilen.
Metode
Metode SPR–IDA diawali dengan menambahkan standar logam ke dalam air laut buatan, sehingga konsentrasinya terdiri dari Cu, Fe dan Mn, serta Cd dan Zn berturut-turut adalah 50.0, 10.0, 1.0 µg/L. Air laut buatan ini dimasukkan sebanyak 10 mL ke dalam tabung sentrifus dan ditambahkan resin sebanyak 40µL, dihomogenkan lalu didiamkan 10 menit, ditambahkan 0.4 mL NH4OH 25%,
dihomogenkan kembali. pH diatur hingga 8– 8.5 menggunakan NH4OH 25%. Larutan
disentrifus pada kecepatan 5000 rpm selama 30 menit, kemudian didekantasi. Cairan beningnya dibuang, sedangkan supernatan ditambahkan 1 mL HNO3 20% dan 9 mL air
bebas ion, disentrifus selama 30 menit. Filtrat kemudian diukur dengan SSA tungku grafit (Anonim 2006).
Optimalisasi dilakukan untuk volume resin 40–60 µL (selang 10 µL). Dengan perlakuan yang sama, dilakukan optimalisasi pH 6.5–10.5 (selang 1), kecepatan sentrifus 1000–5000 rpm (selang 1000 rpm) selama 15–30 menit (selang 5 menit), HNO3 0.5–2.0
mL, serta air 8–9.5 mL.
HASIL DAN PEMBAHASAN
Optimalisasi merupakan penentuan kondisi yang memberikan nilai terbaik dari pengukuran. Hasil optimalisasi dapat dilihat berdasarkan nilai kedapatulangan (%) yang berkisar antara 80–120% (Harmita 2004). Nilai kedapatulangan akan tinggi apabila konsentrasi yang dihasilkan juga tinggi. Optimalisasi dilakukan terhadap metode SPR–IDA agar logam berat dalam air laut dapat terikat kuat pada resin, sehingga dapat terukur dengan lebih baik.
logam dan metaloid yang berdasarkan pada penyerapan (absorpsi) radiasi oleh atom bebas unsur logam tersebut. Atom–atom menyerap cahaya tersebut pada panjang gelombang tertentu bergantung pada sifat unsurnya (Khopkar 1990). Cahaya pada panjang gelombang tertentu mempunyai cukup energi untuk mengubah tingkat elektronik suatu atom. Transisi elektronik suatu unsur bersifat spesifik. Dengan absorpsi energi, berarti memperoleh lebih banyak energi suatu atom pada keadaan dasar dinaikkan tingkat energinya ke tingkat eksitasi (Khopkar 1990). Saat keadaan tidak stabil, atom–atom bebas akan secara spontan segera kembali ke konfigurasi keadaan dasarnya. Elektron berubah kembali menjadi bentuk semula dengan posisi orbital yang stabil dan disertai dengan pemancaran energi radiasi yang jumlahnya sebanding dengan energi awal yang terserap oleh atom pada posisi eksitasi. Spektrum serapan suatu atom terdiri atas garis–garis sempit dengan batas– batas yang terlihat jelas. Hal ini terlihat jelas oleh transisi antar tingkat–tingkat energi elektron dari elektron pada kulit terluar atom tersebut.
Berdasarkan hukum Lambert–Beer, analisis kuantitatif dari spektroskopi atom diperoleh dari resonansi panjang gelombang cahaya dengan intensitas awal (Io) yang difokuskan pada sel nyala (flame) pada keadaan dasar. Intensitas awal cahaya akan berkurang akibat dari jumlah konsentrasi atom dalam sel nyala. Cahaya tereduksi (I) secara langsung akan terukur pada detektor. Jumlah cahaya yang terserap diperoleh melalui perbandingan rasio antara Io dan I berdasarkan % T (transmitan, yaitu perhitungan intensitas cahaya yang diteruskan) atau berdasarkan perhitungan A (absorbans, yaitu perhitungan intensitas cahaya yang diserap).
Rumusan hukum Lambert–Beer:
BAHAN DAN METODE
Bahan dan Alat
Bahan–bahan yang digunakan adalah air laut buatan, NH4OH 25%, HNO3 20%,
standard reference material (SRM), dan resin SPR–IDA.
Alat–alat yang digunakan adalah SSA (Shimadzu AA 6800), sentrifus, dan tabung sentrifus polietilen.
Metode
Metode SPR–IDA diawali dengan menambahkan standar logam ke dalam air laut buatan, sehingga konsentrasinya terdiri dari Cu, Fe dan Mn, serta Cd dan Zn berturut-turut adalah 50.0, 10.0, 1.0 µg/L. Air laut buatan ini dimasukkan sebanyak 10 mL ke dalam tabung sentrifus dan ditambahkan resin sebanyak 40µL, dihomogenkan lalu didiamkan 10 menit, ditambahkan 0.4 mL NH4OH 25%,
dihomogenkan kembali. pH diatur hingga 8– 8.5 menggunakan NH4OH 25%. Larutan
disentrifus pada kecepatan 5000 rpm selama 30 menit, kemudian didekantasi. Cairan beningnya dibuang, sedangkan supernatan ditambahkan 1 mL HNO3 20% dan 9 mL air
bebas ion, disentrifus selama 30 menit. Filtrat kemudian diukur dengan SSA tungku grafit (Anonim 2006).
Optimalisasi dilakukan untuk volume resin 40–60 µL (selang 10 µL). Dengan perlakuan yang sama, dilakukan optimalisasi pH 6.5–10.5 (selang 1), kecepatan sentrifus 1000–5000 rpm (selang 1000 rpm) selama 15–30 menit (selang 5 menit), HNO3 0.5–2.0
mL, serta air 8–9.5 mL.
HASIL DAN PEMBAHASAN
Optimalisasi merupakan penentuan kondisi yang memberikan nilai terbaik dari pengukuran. Hasil optimalisasi dapat dilihat berdasarkan nilai kedapatulangan (%) yang berkisar antara 80–120% (Harmita 2004). Nilai kedapatulangan akan tinggi apabila konsentrasi yang dihasilkan juga tinggi. Optimalisasi dilakukan terhadap metode SPR–IDA agar logam berat dalam air laut dapat terikat kuat pada resin, sehingga dapat terukur dengan lebih baik.
logam dan metaloid yang berdasarkan pada penyerapan (absorpsi) radiasi oleh atom bebas unsur logam tersebut. Atom–atom menyerap cahaya tersebut pada panjang gelombang tertentu bergantung pada sifat unsurnya (Khopkar 1990). Cahaya pada panjang gelombang tertentu mempunyai cukup energi untuk mengubah tingkat elektronik suatu atom. Transisi elektronik suatu unsur bersifat spesifik. Dengan absorpsi energi, berarti memperoleh lebih banyak energi suatu atom pada keadaan dasar dinaikkan tingkat energinya ke tingkat eksitasi (Khopkar 1990). Saat keadaan tidak stabil, atom–atom bebas akan secara spontan segera kembali ke konfigurasi keadaan dasarnya. Elektron berubah kembali menjadi bentuk semula dengan posisi orbital yang stabil dan disertai dengan pemancaran energi radiasi yang jumlahnya sebanding dengan energi awal yang terserap oleh atom pada posisi eksitasi. Spektrum serapan suatu atom terdiri atas garis–garis sempit dengan batas– batas yang terlihat jelas. Hal ini terlihat jelas oleh transisi antar tingkat–tingkat energi elektron dari elektron pada kulit terluar atom tersebut.
Berdasarkan hukum Lambert–Beer, analisis kuantitatif dari spektroskopi atom diperoleh dari resonansi panjang gelombang cahaya dengan intensitas awal (Io) yang difokuskan pada sel nyala (flame) pada keadaan dasar. Intensitas awal cahaya akan berkurang akibat dari jumlah konsentrasi atom dalam sel nyala. Cahaya tereduksi (I) secara langsung akan terukur pada detektor. Jumlah cahaya yang terserap diperoleh melalui perbandingan rasio antara Io dan I berdasarkan % T (transmitan, yaitu perhitungan intensitas cahaya yang diteruskan) atau berdasarkan perhitungan A (absorbans, yaitu perhitungan intensitas cahaya yang diserap).
Rumusan hukum Lambert–Beer:
BAHAN DAN METODE
Bahan dan Alat
Bahan–bahan yang digunakan adalah air laut buatan, NH4OH 25%, HNO3 20%,
standard reference material (SRM), dan resin SPR–IDA.
Alat–alat yang digunakan adalah SSA (Shimadzu AA 6800), sentrifus, dan tabung sentrifus polietilen.
Metode
Metode SPR–IDA diawali dengan menambahkan standar logam ke dalam air laut buatan, sehingga konsentrasinya terdiri dari Cu, Fe dan Mn, serta Cd dan Zn berturut-turut adalah 50.0, 10.0, 1.0 µg/L. Air laut buatan ini dimasukkan sebanyak 10 mL ke dalam tabung sentrifus dan ditambahkan resin sebanyak 40µL, dihomogenkan lalu didiamkan 10 menit, ditambahkan 0.4 mL NH4OH 25%,
dihomogenkan kembali. pH diatur hingga 8– 8.5 menggunakan NH4OH 25%. Larutan
disentrifus pada kecepatan 5000 rpm selama 30 menit, kemudian didekantasi. Cairan beningnya dibuang, sedangkan supernatan ditambahkan 1 mL HNO3 20% dan 9 mL air
bebas ion, disentrifus selama 30 menit. Filtrat kemudian diukur dengan SSA tungku grafit (Anonim 2006).
Optimalisasi dilakukan untuk volume resin 40–60 µL (selang 10 µL). Dengan perlakuan yang sama, dilakukan optimalisasi pH 6.5–10.5 (selang 1), kecepatan sentrifus 1000–5000 rpm (selang 1000 rpm) selama 15–30 menit (selang 5 menit), HNO3 0.5–2.0
mL, serta air 8–9.5 mL.
HASIL DAN PEMBAHASAN
Optimalisasi merupakan penentuan kondisi yang memberikan nilai terbaik dari pengukuran. Hasil optimalisasi dapat dilihat berdasarkan nilai kedapatulangan (%) yang berkisar antara 80–120% (Harmita 2004). Nilai kedapatulangan akan tinggi apabila konsentrasi yang dihasilkan juga tinggi. Optimalisasi dilakukan terhadap metode SPR–IDA agar logam berat dalam air laut dapat terikat kuat pada resin, sehingga dapat terukur dengan lebih baik.
Volume SPR–IDA
Setiap logam memberikan respon yang berbeda pada tiap parameter optimalisasi. Pada optimalisasi volume SPR–IDA, Cu dan Cd memberikan nilai kedapatulangan (Tabel 1) yang lebih baik dibandingkan dengan logam lainnya, yaitu pada volume resin 40 µL sementara Fe dan Zn pada 50 µL, serta Mn pada 60 µL . Optimalisasi juga dilakukan pada volume SPR–IDA 30 µL untuk Cu dan Cd, serta 70 µL untuk Mn dan Zn dengan tujuan mengetahui nilai kedapatulangan sebelum/setelah titik optimum.
Tabel 1 Nilai rerata kedapatulangan (%) logam pada berbagai volume resin SPR–IDA (µL)
Kedapatulangan (%)
30 40 50 60 70
Ion logam
(+2) (µL)
Cu 85.7 1102.5 90.4 69.7 – Cd 25.8 99.8 57.8 70.0 – Fe – 73.8 96.4 91.7 – Mn – 44.3 70.1 86.3 45.6
Zn – 59.4 109.2 112.4 75.1 Ket:(–) tidak dilakukan
Logam yang bertindak sebagai asam lewis lemah akan berikatan dengan basa Lewis lemah. Menurut teori asam basa Lewis, logam bertindak sebagai asam karena merupakan akseptor pasangan elektron bebas.
Resin asam iminodiasetat bersifat sebagai basa Lewis yang menyumbangkan pasangan elektronnya kepada logam. Berdasarkan klasifikasi asam dan basa Lewis, Cu, Fe, dan Zn merupakan logam asam Lewis yang dapat bertindak sebagai kuat ataupun lemah (borderline), Cd dan Mn merupakan logam asam lewis lemah, sedangkan SPR–IDA merupakan resin yang bersifat basa Lewis lemah.
Selain itu, diketahui bahwa logam– logam berat (Cu, Cd, Fe, Mn, Zn) termasuk logam–logam transisi yang memiliki kisaran bilangan oksidasi yang berbeda–beda. Cu mempunyai 2 bilangan oksidasi (biloks) (+1 dan +2), Cd dan Zn mempunyai 1 biloks (+2), Fe (+2 dan +3), serta Mn mempunyai 6 biloks (+2, +3, +4, +5, +6, +7). Hal ini menyebabkan kestabilan logam berbeda satu dengan yang lainnya. Cu dan Cd memberikan konsentrasi optimum pada volume SPR–IDA sebanyak 40 µL. Ini menunjukkan bahwa Cu dan Cd lebih
berperan sebagai asam lewis lemah sehingga membutuhkan volume resin yang lebih sedikit dibandingkan dengan Fe, Zn, dan Mn. Volume SPR–IDA pada Mn lebih banyak disebabkan karena rendahnya kestabilan Mn akibat banyaknya kisaran bilangan oksidasi Mn dan telah terisinya orbital setengah penuh, sehingga membutuhkan energi tinggi untuk berikatan.
pH
Faktor penting lainnya dalam proses pengkelatan logam dengan sistem pertukaran ion adalah pH. Penambahan sejumlah NH4OH berfungsi sebagai pemberi
suasana basa sehingga diharapkan SPR–IDA akan melepaskan dua protonnya (H+) untuk digantikan dengan logam bermuatan +2.
N O O O H OH H N O O O H OH H
Gambar 3 Reaksi ionisasi asam iminodiasetat
Untuk menjaga kestabilan ikatan logam dan SPR–IDA, pH diatur menggunakan HNO3 20% pada beberapa kondisi, yaitu
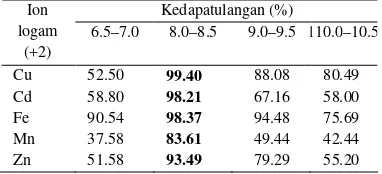
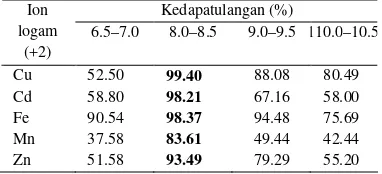
6.5–7.0, 8.0–8.5, 9.0–9.5, dan 10–10.5. Berdasarkan hasil yang diperoleh, pH optimum untuk menjaga kestabilan logam adalah pH 8.0–8.5 untuk semua logam. Pada kondisi ini, diperoleh nilai kedapatulangan yang baik (Tabel 2).
Tabel 2 Nilai rerata kedapatulangan (%) logam pada berbagai kondisi pH
Kedapatulangan (%)
6.5–7.0 8.0–8.5 9.0–9.5 110.0–10.5 Ion
logam (+2)
Cu 52.50 99.40 88.08 80.49
Cd 58.80 98.21 67.16 58.00
Fe 90.54 98.37 94.48 75.69
Mn 37.58 83.61 49.44 42.44
Zn 51.58 93.49 79.29 55.20
sebanding dengan turunnya kemampuan resin untuk mengikat logam (Lampiran 5).
Kecepatan dan Waktu Sentrifus
Sentrifus merupakan teknik pemisahan berdasarkan perbedaan bobot jenis. Molekul dengan bobot jenis lebih rendah akan berada di atas molekul dengan bobot jenis yang lebih tinggi. Metode SPR–IDA menggunakan dua kali sentrifus. Tahap pertama untuk memisahkan logam dengan garam–garam yang terdapat dalam air laut dan tahap kedua untuk memisahkan logam dengan SPR–IDA setelah ditambahkan larutan HNO3 20%. Proses pemisahan ini
akan sangat berpengaruh pada nilai kedapatulangan yang diperoleh.
Tabel 3 Nilai rerata kedapatulangan (%) logam pada berbagai kecepatan sentrifus (rpm)
Kedapatulangan (%)
1000 2000 3000 4000 5000
Ion logam
(+2) (rpm)
Cu 62.25 79.87 82.31 97.77 81.23
Cd 52.65 56.64 65.30 100.64 87.31
Fe 37.03 53.26 62.34 58.15 98.19
Mn 50.00 67.45 86.80 98.74 89.28
Zn 42.51 38.51 43.90 44.36 105.3
Tabel 3 menunjukkan bahwa Cu, Cd, dan Mn memberikan hasil optimum pada kecepatan sentrifus 4000 rpm, Fe dan Zn pada 5000 rpm. Hal ini berkaitan dengan jumlah volume resin lebih sedkit dibandingkan dengan logam lainnya karena sifat logamnya yang lebih stabil, sehingga tidak membutuhkan kecepatan sentrifus yang terlalu tinggi. Selain kestabilan akibat bobot, hal lain menunjukkan bahwa semakin lama waktu sentrifus, pemisahan akan semakin baik. Ini terlihat pada Tabel 4 yang menunjukkan bahwa semua logam memiliki waktu optimalisasi yang sama, yaitu 25 menit.
Tabel 4 Rerata kedapatulangan (%) logam pada berbagai waktu sentrifus (menit)
Kedapatulangan (%)
15 20 25 30
Ion logam
(+2) (menit)
Cu 58.35 78.29 99.40 74.33 Cd 55.07 86.76 101.59 86.43 Fe 44.22 64.34 91.88 75.10 Mn 54.41 66.83 97.62 78.13 Zn 45.73 68.69 98.38 83.90
Pada menit ke-30, kedapatulangan yang diperoleh berkurang berdasarkan nilai konsentrasinya (Lampiran 8). Lamanya waktu pemisahan akan menyebabkan naiknya suhu sampel hingga 80ºC, sehingga terjadi desorpsi logam. Selain itu, desorpsi logam juga dipegaruhi oleh ikatan yang terbentuk antara resin dan logam. Ikatan yang terbentuk adalah ikatan kovalen koordinasi. Ikatan ini lebih lemah kekuatannya dibandingkan dengan ikatan kovalen, sehingga apabila terjadi kenaikan suhu yang cukup signifikan, kemungkinan logam akan terlepas dari resin SPR-IDA pun akan lebih cepat.
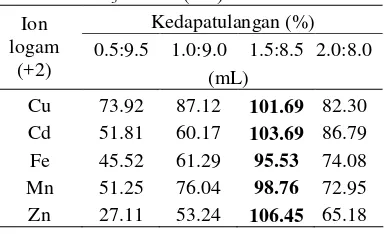
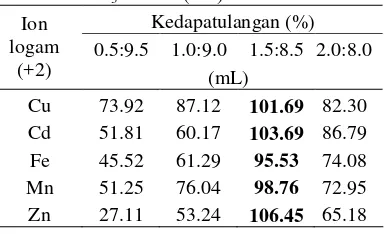
Nisbah HNO3 dan air
Penambahan HNO3 20% setelah proses
pemisahan tahap 1 selesai bertujuan untuk melarutkan kembali logam yang telah di ikat oleh SPR–IDA.
Tabel 5 Nilai rerata kedapatulangan (%) logam pada berbagai perbandingan HNO3 dan air (mL)
Kedapatulangan (%) 0.5:9.5 1.0:9.0 1.5:8.5 2.0:8.0 Ion
logam
(+2) (mL)
Cu 73.92 87.12 101.69 82.30 Cd 51.81 60.17 103.69 86.79 Fe 45.52 61.29 95.53 74.08 Mn 51.25 76.04 98.76 72.95 Zn 27.11 53.24 106.45 65.18
SIMPULAN DAN SARAN
Simpulan
Optimalisasi metode SPR–IDA untuk logam Cu, Cd. Fe, Mn, dan Zn telah dilakukan untuk parameter volume SPR– IDA, pH, kecepatan dan waktu sentrifus, serta pemekatan. Optimalisasi yang diperoleh, yaitu volume SPR–IDA untuk logam Cu, Cd, Fe, Mn, Fe, dan Zn berturut– turut adalah 40 µL, 40 µL, 50 µL, 50 µL, 60 µL. pH untuk semua logam adalah 8.0–8.5. Kecepatan sentrifus untuk Cu dan Cd adalah 4000 rpm, sedangkan Fe, Mn, dan Zn adalah 5000 rpm. Waktu sentrifus untuk semua logam adalah 25 menit. Nisbah HNO3 dan
air optimum untuk semua logam adalah 1.5:8.5 mL.
Saran
Perlu dilakukan penelitian lanjutan untuk memvalidasi metode SPR–IDA serta mengapliksikannya pada sampel air laut untuk memastikan bahwa metode ini benar– benar dapat diterapkan untuk penentuan logam dalam air laut. Selain itu, perlu dilakukan juga proses pemekatan dan membandingkan hasil metode ini dengan metode lain untuk meningkatkan keakurasian data.
DAFTAR PUSTAKA
Anonim. 2006. SPR–IDA reagent for preconcentration/matrix elimination. Cetac Technologies: Canada.
[Terhubung Berkala].
http://www.cetac.com. [1 Desember
2008]
Brady JE. 1999. Kimia Universitas Asas dan Struktur. Ed ke–5. Maun S et al.,penerjemah; Jakarta: Binarupa Aksara. Terjemahan dari: General Chemistry Principles and Structure
Csuros M. 1994. Environmental Sampling and Analysis for Technicians. Florida: Lewis Publisher.
Das M & Mitali S. [Tanpa tahun].Solid Phase Extraction of Cu(II) and Zn(II) Using Ligand Immobilized Silica Gel
for the Removal, Recovery, Preconcentration vis–à–vis Separation from Mixture: India
Dragan ES & Dinu MV. 2008. Heavy metals adsorption on some iminodiacetate chelating resins as a function of the adsorption parameters. Reactive & Functional Polymers. Vol 68. 1346– 1354.
Edvantoro BB et al. 1998. Laporan
Pelaksanaan Pengkajian
Pengembangan Uji Toksikologi (LD– 50) dari Industri Pelapisan Logam. Serpong: Laboratorium B3 Pusapedal– Bapedal.
Ewing GW. 1985. Instrumental Methods of Chemical Analysis. 2nd Edition. New York: McGraw Hill.
Farbridge RW. 1972. The Encyclopedia of Geochemistry and Enviromental Science. New York: Van Nostrand Reinhold.
Garrido et al. 1998. Interference removal for cadmium determination in waste water and sewage sludge by flow injection cold vapour generation atomic absorption spectrometry. J. Anal. At. Spectrom. Vol 13. 1145–1149.
Harmita. 2004. Petunjuk pelaksanaan validasi metode dan cara perhitungannya. Majalah Ilmu Kefarmasian. Departemen Farmasi FMIPA–UI
Huang et al. 1994. Direct determination of zinc in seawater by graphite furnace atomic absorption spectrometry. Spectrochimica Acta. 837–846.
Khopkar SM. 1990. Konsep Dasar Kimia Analitik. A Saptorahardjo, penerjemah; Jakarta: UI Press. Terjemahan dari: Basic Concepts of Analytical Chemistry.
SIMPULAN DAN SARAN
Simpulan
Optimalisasi metode SPR–IDA untuk logam Cu, Cd. Fe, Mn, dan Zn telah dilakukan untuk parameter volume SPR– IDA, pH, kecepatan dan waktu sentrifus, serta pemekatan. Optimalisasi yang diperoleh, yaitu volume SPR–IDA untuk logam Cu, Cd, Fe, Mn, Fe, dan Zn berturut– turut adalah 40 µL, 40 µL, 50 µL, 50 µL, 60 µL. pH untuk semua logam adalah 8.0–8.5. Kecepatan sentrifus untuk Cu dan Cd adalah 4000 rpm, sedangkan Fe, Mn, dan Zn adalah 5000 rpm. Waktu sentrifus untuk semua logam adalah 25 menit. Nisbah HNO3 dan
air optimum untuk semua logam adalah 1.5:8.5 mL.
Saran
Perlu dilakukan penelitian lanjutan untuk memvalidasi metode SPR–IDA serta mengapliksikannya pada sampel air laut untuk memastikan bahwa metode ini benar– benar dapat diterapkan untuk penentuan logam dalam air laut. Selain itu, perlu dilakukan juga proses pemekatan dan membandingkan hasil metode ini dengan metode lain untuk meningkatkan keakurasian data.
DAFTAR PUSTAKA
Anonim. 2006. SPR–IDA reagent for preconcentration/matrix elimination. Cetac Technologies: Canada.
[Terhubung Berkala].
http://www.cetac.com. [1 Desember
2008]
Brady JE. 1999. Kimia Universitas Asas dan Struktur. Ed ke–5. Maun S et al.,penerjemah; Jakarta: Binarupa Aksara. Terjemahan dari: General Chemistry Principles and Structure
Csuros M. 1994. Environmental Sampling and Analysis for Technicians. Florida: Lewis Publisher.
Das M & Mitali S. [Tanpa tahun].Solid Phase Extraction of Cu(II) and Zn(II) Using Ligand Immobilized Silica Gel
for the Removal, Recovery, Preconcentration vis–à–vis Separation from Mixture: India
Dragan ES & Dinu MV. 2008. Heavy metals adsorption on some iminodiacetate chelating resins as a function of the adsorption parameters. Reactive & Functional Polymers. Vol 68. 1346– 1354.
Edvantoro BB et al. 1998. Laporan
Pelaksanaan Pengkajian
Pengembangan Uji Toksikologi (LD– 50) dari Industri Pelapisan Logam. Serpong: Laboratorium B3 Pusapedal– Bapedal.
Ewing GW. 1985. Instrumental Methods of Chemical Analysis. 2nd Edition. New York: McGraw Hill.
Farbridge RW. 1972. The Encyclopedia of Geochemistry and Enviromental Science. New York: Van Nostrand Reinhold.
Garrido et al. 1998. Interference removal for cadmium determination in waste water and sewage sludge by flow injection cold vapour generation atomic absorption spectrometry. J. Anal. At. Spectrom. Vol 13. 1145–1149.
Harmita. 2004. Petunjuk pelaksanaan validasi metode dan cara perhitungannya. Majalah Ilmu Kefarmasian. Departemen Farmasi FMIPA–UI
Huang et al. 1994. Direct determination of zinc in seawater by graphite furnace atomic absorption spectrometry. Spectrochimica Acta. 837–846.
Khopkar SM. 1990. Konsep Dasar Kimia Analitik. A Saptorahardjo, penerjemah; Jakarta: UI Press. Terjemahan dari: Basic Concepts of Analytical Chemistry.
Lee YN & Choi HS. 2006. Determination of Copper(II) in various samples by flame atomic absorption spectrophotometry after column preconcentration onto pulverized Amberlite XAD–4 loaded with N– Benzoylphenylhydroxylamine. Anal Chem Vol 62. 845–851.
Pecsock RL et al. 1976. Modern Methods of Chemical analysis. Ed ke–2. New York: Wiley.
Pesavento M et al. 1997. Sorption of divalent metals ion on an iminodiacetic resin from artificial seawater. Analchim. Vol 346. 381–391.
Saefudin A. 1999. Kumpulan Materi Kuliah Toksikologi Lingkungan. Jakarta: Program Studi Ilmu Lingkungan Program Pascasarjana Universitas Indonesia. Slamet JS. 1994. Kesehatan Lingkungan. Yogyakarta: Gajah Mada University Press.
Sitepoe M. 1997. Air Untuk Kehidupan: Pencemaran Air dan Usaha Pencegahan. Jakarta: Grasindo.
Supriharyono MS. 2000. Pelestarian dan Pengelolaan Sumber Daya Alam di Wilayah Pesisir Tropis. Jakarta: PT Gramedia.
Supriyanto et al. 2007. Analisis Cemaran Logam Berat Pb, Cu, dan Cd pada Ikan Air Tawar Dengan Metode Spektrometri Nyala Serapan Atom (SSA). Prosiding Seminar SDM Teknologi Nuklir. Yogyakarta. 21–22 November 2007.
Tokahoglu S et al. 2002. Determination of trace metals in waters by FAAS after enrichment as metal-HMDTC complexes using solid phase extraction. Koreanchem. Vol 23.693-698
Lampiran 1 Kelompok logam berat berdasarkan sifat racun
No
Jenis logam
Sifat racun
Efek yang ditimbulkan
1
Hg, Pb, Cd, Cr, As, Sb,
Ti, dan U
Sangat beracun
Dapat menimbulkan kematian
atau
gangguan
terhadap
kesehatan
terutama
pada
manusia yang tidak dapat pulih
pada waktu yang singkat
2
Ba, Po, Cu, Au, Li, Mn,
Se, Te, Va, dan Ge.
Moderat
Menyebabkan
gangguan
kesehatan baik yang dapat pulih
maupun yang tidak dapat pulih
dalam waktu yang relatif lama.
3
Be, Co, Fe, Mg, Ni, K,
Ti, dan Zn.
Kurang beracun
Dalam jumlah besar dapat
menyebabkan
gangguan
kesehatan
4
Al, Na, Sn, dan Ca.
Tidak beracun
Tidak menimbulkan efek yang
parah terhadap kesehatan.
Lampiran 2 Diagram alir optimalisasi volume SPR-IDA
+ 0.4 mL NH
4OH, dihomogenkan
Kocok hingga homogen,
biarkan 10’ menit
10 mL air laut buatan
+ 40-60 µL resin SPR-IDA (selang 10 µL)
Atur pH 8-8.5
Dekantasi
Sentrifus 5000 rpm, t= 30’
Supernatan
1.0 mL HNO
320%
dihomogenkan
Filtrat
+ air bebas ion
9.0 mL, dihomogenkan
Buang
Ukur SSA tungku grafit
Filtrat
Supernatan
Sentrifus 5000 rpm, t= 30’
Ket:
Lampiran 3 Pembuatan pereaksi
1.
Air laut buatan (salinitas 35 ‰) dibuat dari NaCl 23.926 g, Na
2SO
44.008 g,
KCl 0.677 g, NaHCO
30.196 g, KBr 0.098 g, H
3BO
30.026 g, NaF 0.003 g,
MgCl
2.6H
2O 10.83 g, CaCl
2.2H
2O 1.52 g, dan SrCl
2.6H
2O 0.02 g, kemudian
dilarutkan menggunakan akuades menjadi 1 liter dalam labu takar.
2.
Larutan logam dibuat dengan variasi konsentrasi 0.00; 2.00; 5.00; 10.00;
20.00; 40.00; 80.00; dan 100.00 µg/L (Cu), 0.00; 0.50; 1.00; 1.50; 2.00 µg/L
(Cd dan Zn), 0.00; 2.00; 5.00; 10.00; 15.00; 20.00 µg/L (Fe dan Mn)
Kurva Standar Cd
Kurva Standar Mn
Kurva Standar Zn
Kurva Standar Cu
Lampiran 5 Optimalisasi Volume SPR-IDA
Optimalisasi Volume SPR-IDA Logam Cu
Volume SPR-IDA (µL)
30 40 50 60
Ulangan
A [Cu,µg/L] Rec A [Cu,µg/L] Rec A [Cu,µg/L] Rec A [Cu,µg/L) Rec 1 0.1224 21.1034 42.21 0.3157 54.4310 108.86 0.2413 41.6034 83.21 0.1967 33.9138 67.83 2 0.1276 22.0000 44.00 0.3066 52.8621 105.72 0.247 42.5862 85.17 0.2087 35.9828 71.97 3 0.1232 21.2414 42.48 0.3014 51.9655 103.93 0.2655 45.7759 91.55 0.2014 34.7241 69.45 4 0.1229 21.1897 42.38 0.2963 51.0862 102.17 0.2782 47.9655 95.93 0.1904 32.8276 65.66 5 0.1245 21.4655 42.93 0.2831 48.8103 97.62 0.2282 39.3448 78.69 0.2038 35.1379 70.28 6 0.1240 21.3793 42.76 0.2863 49.3621 98.72 0.2896 49.9310 99.86 0.2064 35.5862 71.17 7 0.1249 21.5345 43.07 0.2919 50.3276 100.66 0.2847 49.0862 98.17 0.2072 35.7241 71.45 Rerata 0.1242 21.4163 42.8325 0.2973 51.2635 102.53 0.2621 45.1847 90.37 0.2021 34.8424 69.68
Ket: Rec (%): Recovery = kedapatulangan (%)
Optimalisasi Volume SPR-IDA Logam Cd
Volume SPR-IDA (µL)
40 50 60 70
Ulangan
A [Cd,µg/L] Rec A [Cd,µg/L] Rec A [Cd,µg/L] Rec A [Cd,µg/L] Rec 1 0.1125 0.2594 25.94 0.5761 1.3283 132.83 0.2996 0.6908 69.08 0.2819 0.6500 65.00 2 0.1064 0.2453 24.53 0.5999 1.3832 138.32 0.1496 0.3449 34.49 0.3097 0.7141 71.41 3 0.1072 0.2472 24.72 0.5880 1.3558 135.58 0.2988 0.6890 68.90 0.2942 0.6783 67.83 4 0.1174 0.2707 27.07 0.3177 0.7325 73.25 0.3764 0.8679 86.79 0.2988 0.6890 68.90 5 0.1115 0.2571 25.71 0.3150 0.7263 72.63 0.1078 0.2486 24.86 0.2979 0.6869 68.69 6 0.1104 0.2546 25.46 0.3188 0.7351 73.51 0.2327 0.5365 53.65 0.3140 0.7240 72.40 7 0.1182 0.2725 27.25 0.3138 0.7235 72.35 0.2892 0.6668 66.68 0.3284 0.7572 75.72 Rerata 0.1119 0.2581 25.81 0.4328 0.9978 99.79 0.2506 0.5778 57.79 0.3036 0.6999 69.99
Optimalisasi Volume SPR-IDA Logam Fe
Volume SPR-IDA (µL)
40 50 60 70
Ulangan A [Fe,µg/L] Rec A [Fe,µg/L] Rec A [Fe,µg/L] Rec A [Fe,µg/L] Rec 1 0.3506 7.5887 75.89 0.4487 9.7121 97.12 0.4375 9.4697 94.70 0.1861 4.0281 40.28 2 0.3466 7.5022 75.02 0.4681 10.1320 101.32 0.4516 9.7749 97.75 0.1853 4.0108 40.11 3 0.3651 7.9026 79.03 0.4474 9.6840 96.84 0.4163 9.0108 90.11 0.1941 4.2013 42.01 4 0.3952 8.5541 85.54 0.4307 9.3225 93.23 0.4026 8.7143 87.14 0.1853 4.0108 40.11 5 0.3273 7.0844 70.84 0.4700 10.1732 101.73 0.4328 9.3680 93.68 0.1826 3.9524 39.52 6 0.3099 6.7078 67.08 0.4578 9.9091 99.09 0.4357 9.4307 94.31 0.1802 3.9004 39.00 7 0.2925 6.3312 63.31 0.3937 8.5216 85.22 0.3883 8.4048 84.05 0.1703 3.6861 36.86 Rerata 0.3410 7.3816 73.82 0.4452 9.6364 96.36 0.4235 9.1676 91.68 0.1834 3.9700 39.70
Optimalisasi Volume SPR-IDA Logam Mn
Volume SPR-IDA (µL)
40 50 60 70
Ulangan A [Mn,µg/L] Rec A [Mn,µg/L] Rec A [Mn,µg/L] Rec A [Mn,µg/L] Rec 1 0.3973 8.8683 88.68 0.3095 6.9085 69.08 0.4062 9.0670 90.67 0.2290 5.1116 51.12 2 0.3682 8.2188 82.19 0.3045 6.7969 67.97 0.4154 9.2723 92.72 0.2251 5.0246 50.25 3 0.4496 10.0357 100.36 0.3154 7.0402 70.40 0.4312 9.6250 96.25 0.1876 4.1875 41.88 4 0.3935 8.7835 87.83 0.3621 8.0826 80.83 0.4228 9.4375 94.38 0.1773 3.9576 39.58 5 0.3748 8.3661 83.66 0.3533 7.8862 78.86 0.3737 8.3415 83.42 0.1891 4.2210 42.21 6 0.3533 7.8862 78.86 0.2878 6.4241 64.24 0.3506 7.8259 78.26 0.2075 4.6317 46.32 7 0.3627 8.0960 80.96 0.2645 5.9040 59.04 0.3061 6.8326 68.33 0.2132 4.7589 47.59 Rerata 0.3856 8.6078 86.08 0.3139 7.0061 70.06 0.3866 8.6288 86.29 0.2041 4.5561 45.56
Optimalisasi Volume SPR-IDA Logam Zn
Volume SPR-IDA (µL)
40 50 60 70
Lampiran 6 Optimalisasi pH
Optimalisasi Logam Cu
pH
6.5-7.0 8.0-8.5 9.0-9.5 10.0-10.5
Ulangan A [Cu,µg/L] Rec A [Cu,µg/L] Rec A [Cu,µg/L] Rec A [Cu,µg/L] Rec 1 0.1405 24.2241 48.45 0.2832 48.8276 97.66 0.2563 44.1897 88.38 0.2386 41.1379 82.28 2 0.1501 25.8793 51.76 0.2854 49.2069 98.41 0.2529 43.6034 87.21 0.2332 40.2069 80.41 3 0.1480 25.5172 51.03 0.2815 48.5345 97.07 0.2513 43.3276 86.66 0.2346 40.4483 80.90 4 0.1492 25.7241 51.45 0.2820 48.6207 97.24 0.2563 44.1897 88.38 0.2359 40.6724 81.34 5 0.1512 26.0690 52.14 0.2918 50.3103 100.62 0.2576 44.4138 88.83 0.2333 40.2241 80.45 6 0.1600 27.5862 55.17 0.2950 50.8621 101.72 0.2558 44.1034 88.21 0.2289 39.4655 78.93 7 0.1667 28.7414 57.48 0.2989 51.5345 103.07 0.2579 44.4655 88.93 0.2294 39.5517 79.10 Rerata 0.1522 26.2488 52.50 0.2883 49.6995 99.40 0.2554 44.0419 88.08 0.2334 40.2438 80.49
Ket: Rec (%): Recovery = kedapatulangan (%)
Optimalisasi pH Logam Cd
pH
6.5-7.0 8.0-8.5 9.0-9.5 10.0-10.5
Ulangan A [Cd,µg/L] Rec A [Cd,µg/L] Rec A [Cd,µg/L] Rec A [Cd,µg/L] Rec 1 0.2523 0.5827 58.27 0.4315 0.9965 99.65 0.2876 0.6642 66.42 0.2499 0.5771 57.71 2 0.2478 0.5723 57.23 0.4308 0.9949 99.49 0.2937 0.6783 67.83 0.2599 0.6002 60.02 3 0.2502 0.5778 57.78 0.4291 0.9910 99.10 0.2951 0.6815 68.15 0.2536 0.5857 58.57 4 0.2603 0.6012 60.12 0.4250 0.9815 98.15 0.2892 0.6679 66.79 0.2649 0.6118 61.18 5 0.2566 0.5926 59.26 0.4293 0.9915 99.15 0.2813 0.6497 64.97 0.2506 0.5788 57.88 6 0.2633 0.6081 60.81 0.4175 0.9642 96.42 0.2973 0.6866 68.66 0.2286 0.5279 52.79 7 0.2517 0.5813 58.13 0.4134 0.9547 95.47 0.2915 0.6732 67.32 0.2505 0.5785 57.85 Rerata 0.2546 0.5880 58.80 0.4252 0.9821 98.21 0.2908 0.6716 67.16 0.2511 0.5800 58.00
Optimalisasi pH Logam Fe
pH
6.5-7.0 8.0-8.5 9.0-9.5 10.0-10.5
Ulangan A [Fe,µg/L] Rec A [Fe,µg/L] Rec A [Fe,µg/L] Rec A [Fe,µg/L] Rec 1 0.3942 8.5325 85.32 0.5188 11.2294 112.29 0.4327 9.3658 93.66 0.3538 7.6580 76.58 2 0.3899 8.4394 84.39 0.5258 11.3810 113.81 0.5062 10.9567 109.57 0.3637 7.8723 78.72 3 0.3794 8.2121 82.12 0.4543 9.8333 98.33 0.4023 8.7078 87.08 0.3627 7.8506 78.51 4 0.3462 7.4935 74.94 0.4075 8.8203 88.20 0.4087 8.8463 88.46 0.3627 7.8506 78.51 5 0.3048 6.5974 65.97 0.5901 12.7727 127.73 0.4667 10.1017 101.02 0.3442 7.4502 74.50 6 0.3514 7.6061 76.06 0.3498 7.5714 75.71 0.4682 10.1342 101.34 0.3362 7.2771 72.77 7 0.3476 7.5238 75.24 0.3351 7.2532 72.53 0.3707 8.0238 80.24 0.3246 7.0260 70.26 Rerata 0.3591 7.7721 77.72 0.4545 9.8374 98.37 0.4365 9.4481 94.48 0.3497 7.5693 75.69
Optimalisasi pH Logam Mn
pH
Ulangan 6.5-7.0 8.0-8.5 9.0-9.5 10.0-10.5
A [Mn,µg/L] Rec A [Mn,µg/L] Rec A Mn,µg/L] Rec A [Mn,µg/L] Rec 1 0.1749 3.7857 37.86 0.3823 8.2749 82.75 0.2433 5.2662 52.66 0.1918 4.1515 41.52 2 0.1739 3.7641 37.64 0.3648 7.8961 78.96 0.2240 4.8485 48.48 0.1879 4.0671 40.67 3 0.1764 3.8182 38.18 0.4472 9.6797 96.80 0.2512 5.4372 54.37 0.1997 4.3225 43.23 4 0.1725 3.7338 37.34 0.3855 8.3442 83.44 0.2623 5.6775 56.77 0.1937 4.1926 41.93 5 0.1706 3.6926 36.93 0.3672 7.9481 79.48 0.2020 4.3723 43.72 0.1992 4.3117 43.12 6 0.1754 3.7965 37.97 0.4065 8.7987 87.99 0.2078 4.4978 44.98 0.1991 4.3095 43.10 7 0.1715 3.7121 37.12 0.3505 7.5866 75.87 0.2083 4.5087 45.09 0.2012 4.3550 43.55 Rerata 0.1736 3.7576 37.58 0.3863 8.3612 83.61 0.2284 4.9440 49.44 0.1961 4.2443 42.44
Optimalisasi pH Logam Zn
pH
6.5-7.0 8.0-8.5 9.0-9.5 10.0-10.5
Lampiran 7 Optimalisasi Kecepatan Sentrifus
Optimalisasi Kecepatan Sentrifus (rpm) Logam Cu
Kecepatan sentrifus (rpm)
Ulangan 1000 2000 3000 4000 5000
A [Cu,µg/L] %Rec A (µg/L) %Rec A (µg/L) %Rec A (µg/L) %Rec A (µg/L) %Rec 1 0.2041 35.1897 70.38 0.2300 39.6552 79.31 0.2426 41.8276 83.66 0.2875 49.5690 99.14 0.2333 40.2241 80.45 2 0.1779 30.6724 61.34 0.2244 38.6897 77.38 0.2431 41.9138 83.83 0.2869 49.4655 98.93 0.2419 41.7069 83.41 3 0.1808 31.1724 62.34 0.2332 40.2069 80.41 0.2382 41.0690 82.14 0.2868 49.4483 98.90 0.2436 42.0000 84.00 4 0.1737 29.9483 59.90 0.2340 40.3448 80.69 0.2411 41.5690 83.14 0.2881 49.6724 99.34 0.2410 41.5517 83.10 5 0.1724 29.7241 59.45 0.2231 38.4655 76.93 0.2362 40.7241 81.45 0.2806 48.3793 96.76 0.2265 39.0517 78.10 6 0.1800 31.0345 62.07 0.2322 40.0345 80.07 0.2335 40.2586 80.52 0.2782 47.9655 95.93 0.2311 39.8448 79.69 7 0.1747 30.1207 60.24 0.2445 42.1552 84.31 0.2362 40.7241 81.45 0.2767 47.7069 95.41 0.2315 39.9138 79.83 Rerata 0.1805 31.1232 62.25 0.2316 39.9360 79.87 0.2387 41.1552 82.31 0.2835 48.8867 97.77 0.2356 40.6133 81.23 Ket: Rec (%): Recovery = kedapatulangan (%)
Optimalisasi Kecepatan Sentrifus (rpm) Logam Cd
Kecepatan sentrifus (rpm)
1000 2000 3000 4000 5000
Ulangan
A [Cd,µg/L] Rec A [Cd,µg/L] Rec A [Cd,µg/L] Rec A [Cd,µg/L] Rec A [Cd,µg/L] Rec 1 0.2379 0.5494 54.94 0.2433 0.5619 56.19 0.2786 0.6434 64.34 0.4183 0.9661 96.61 0.3843 0.8875 88.75 2 0.2359 0.5448 54.48 0.2444 0.5644 56.44 0.2851 0.6584 65.84 0.3925 0.9065 90.65 0.3813 0.8806 88.06 3 0.2258 0.5215 52.15 0.2448 0.5654 56.54 0.2827 0.6529 65.29 0.4403 1.0169 101.69 0.3765 0.8695 86.95 4 0.2224 0.5136 51.36 0.2483 0.5734 57.34 0.2807 0.6483 64.83 0.4549 1.0506 105.06 0.3791 0.8755 87.55 5 0.2281 0.5268 52.68 0.2430 0.5612 56.12 0.2831 0.6538 65.38 0.4396 1.0152 101.52 0.3742 0.8642 86.42 6 0.2208 0.5099 50.99 0.2414 0.5575 55.75 0.2815 0.6501 65.01 0.4526 1.0453 104.53 0.3743 0.8644 86.44 7 0.2249 0.5194 51.94 0.2517 0.5813 58.13 0.2876 0.6642 66.42 0.4521 1.0441 104.41 0.3768 0.8702 87.02
Rerata 0.2280 0.5265 52.65 0.2453 0.5664 56.64 0.2828 0.6530 65.30 0.4358 1.0064 100.64 0.3781 0.8731 87.31
Optimalisasi Kecepatan Sentrifus (rpm) Logam Fe
Kecepatan sentrifus (rpm)
Ulangan 1000 2000 3000 4000 5000
A [Fe,µg/L] Rec A [Fe,µg/L] Rec A [Fe,µg/L] Rec A [Fe,µg/L] Rec A [Fe,µg/L] Rec 1 0.1680 3.6522 36.52 0.2839 6.1717 61.72 0.3157 6.8630 68.63 0.2813 6.1152 61.15 0.4598 9.9957 99.96 2 0.1732 3.7652 37.65 0.2858 6.2130 62.13 0.3053 6.6370 66.37 0.2867 6.2326 62.33 0.4572 9.9391 99.39 3 0.1611 3.5022 35.02 0.2194 4.7698 47.70 0.2797 6.0804 60.80 0.2970 6.4565 64.57 0.4510 9.8043 98.04 4 0.1545 3.3587 33.59 0.2093 4.5500 45.50 0.2666 5.7957 57.96 0.2554 5.5522 55.52 0.4712 10.2435 102.43 5 0.1639 3.5630 35.63 0.2290 4.9783 49.78 0.3044 6.6174 66.17 0.2707 5.8848 58.85 0.4199 9.1283 91.28 6 0.1656 3.6000 36.00 0.2465 5.3587 53.59 0.3191 6.9370 69.37 0.2417 5.2543 52.54 0.4073 8.8543 88.54 7 0.2062 4.4826 44.83 0.2410 5.2391 52.39 0.2166 4.7087 47.09 0.2395 5.2065 52.07 0.4952 10.7652 107.65 Rerata 0.1704 3.7034 37.03 0.2450 5.3258 53.26 0.2868 6.2342 62.34 0.2675 5.8146 58.15 0.4517 9.8186 98.19
Optimalisasi Kecepatan Sentrifus (rpm) Logam Mn
Kecepatan sentrifus (rpm)
Ulangan 1000 2000 3000 4000 5000
A [Mn,µg/L] Rec A [Mn,µg/L] Rec A [Mn,µg/L] Rec A [Mn,µg/L] Rec A [Mn,µg/L] Rec 1 0.2229 5.0659 50.66 0.2938 6.6773 66.77 0.3749 8.5205 85.20 0.4237 9.6295 96.30 0.4008 9.1091 91.09 2 0.2234 5.0773 50.77 0.2924 6.6455 66.45 0.3796 8.6273 86.27 0.4237 9.6295 96.30 0.3871 8.7977 87.98 3 0.2220 5.0455 50.45 0.2944 6.6909 66.91 0.3770 8.5682 85.68 0.4250 9.6591 96.59 0.3824 8.6909 86.91 4 0.2227 5.0614 50.61 0.2996 6.8091 68.09 0.3795 8.6250 86.25 0.4289 9.7477 97.48 0.4017 9.1295 91.30 5 0.2196 4.9909 49.91 0.2986 6.7864 67.86 0.3853 8.7568 87.57 0.4391 9.9795 99.80 0.3880 8.8182 88.18 6 0.2159 4.9068 49.07 0.2985 6.7841 67.84 0.3872 8.8000 88.00 0.4453 10.1205 101.20 0.3973 9.0295 90.30 7 0.2136 4.8545 48.55 0.3002 6.8227 68.23 0.3899 8.8614 88.61 0.4555 10.3523 103.52 0.3924 8.9182 89.18 Rerata 0.2200 5.0003 50.00 0.2968 6.7451 67.45 0.3819 8.6799 86.80 0.4345 9.8740 98.74 0.3928 8.9276 89.28
Optimalisasi Kecepatan Sentrifus (rpm) Logam Zn
Kecepatan sentrifus (rpm)
Ulangan 1000 2000 3000 4000 5000
A [Zn,µg/L] Rec A [Zn,µg/L] Rec A [Zn,µg/L] Rec A [Zn,µg/L] Rec A [Zn,µg/L] Rec 1 0.2001 0.3882 38.82 0.2012 0.3903 39.03 0.1970 0.3822 38.22 0.2294 0.4450 44.50 0.5435 1.0543 105.43 2 0.2063 0.4002 40.02 0.1990 0.3860 38.60 0.1934 0.3752 37.52 0.2292 0.4446 44.46 0.5598 1.0859 108.59 3 0.2836 0.5501 55.01 0.1936 0.3756 37.56 0.2423 0.4700 47.00 0.2190 0.4248 42.48 0.5997 1.1633 116.33 4 0.2390 0.4636 46.36 0.1968 0.3818 38.18 0.2436 0.4726 47.26 0.2336 0.4532 45.32 0.5469 1.0609 106.09 5 0.2441 0.4735 47.35 0.2146 0.4163 41.63 0.2253 0.4371 43.71 0.2204 0.4275 42.75 0.5325 1.0330 103.30 6 0.1888 0.3662 36.62 0.2120 0.4113 41.13 0.2189 0.4246 42.46 0.2215 0.4297 42.97 0.5135 0.9961 99.61
Lampiran 8 Optimalisasi Waktu Sentrifus
Optimalisasi Waktu Sentrifus Logam Cu
Waktu Sentrifus (Menit)
Ulangan 15 20 25 30
A [Cu,µg/L] %Rec A [Cu,µg/L] %Rec A [Cu,µg/L] %Rec A [Cu,µg/L] %Rec 1 0.1702 29.3448 58.69 0.2257 38.9138 77.83 0.2848 49.1034 98.21 0.2190 37.7586 75.52 2 0.1721 29.6724 59.34 0.2260 38.9655 77.93 0.2825 48.7069 97.41 0.2167 37.3621 74.72 3 0.1728 29.7931 59.59 0.2291 39.5000 79.00 0.2891 49.8448 99.69 0.2143 36.9483 73.90 4 0.1695 29.2241 58.45 0.2296 39.5862 79.17 0.2822 48.6552 97.31 0.2130 36.7241 73.45 5 0.1717 29.6034 59.21 0.2274 39.2069 78.41 0.2908 50.1379 100.28 0.2164 37.3103 74.62 6 0.1652 28.4828 56.97 0.2267 39.0862 78.17 0.2948 50.8276 101.66 0.2179 37.5690 75.14 7 0.1631 28.1207 56.24 0.2248 38.7586 77.52 0.2937 50.6379 101.28 0.2116 36.4828 72.97 Rerata 0.1692 29.1773 58.35 0.2270 39.1453 78.29 0.2883 49.7020 99.40 0.2156 37.1650 74.33
Ket: Rec (%): Recovery = kedapatulangan (%)
Optimalisasi Waktu Sentrifus Logam Cd
Waktu Sentrifus (Menit)
Ulangan 15 20 25 30
A [Cd,µg/L] Rec A [Cd,µg/L] Rec A [Cd,µg/L] Rec A [Cd,µg/L] Rec 1 0.2466 0.5695 56.95 0.3750 0.8661 86.61 0.4351 1.0048 100.48 0.3771 0.8709 87.09 2 0.2365 0.5462 54.62 0.3727 0.8607 86.07 0.4384 1.0125 101.25 0.3772 0.8711 87.11 3 0.2354 0.5436 54.36 0.3803 0.8783 87.83 0.4391 1.0141 101.41 0.3782 0.8734 87.34 4 0.2391 0.5522 55.22 0.3720 0.8591 85.91 0.4374 1.0102 101.02 0.3712 0.8573 85.73 5 0.2374 0.5483 54.83 0.3769 0.8704 87.04 0.4393 1.0145 101.45 0.3722 0.8596 85.96 6 0.2348 0.5423 54.23 0.3783 0.8737 87.37 0.4473 1.0330 103.30 0.3712 0.8573 85.73 7 0.2393 0.5527 55.27 0.3744 0.8647 86.47 0.4425 1.0219 102.19 0.3726 0.8605 86.05 Rerata 0.2384 0.5507 55.07 0.3757 0.8676 86.76 0.4399 1.0159 101.59 0.3742 0.8643 86.43
Optimalisasi Waktu Sentrifus (menit) Logam Fe
Waktu Sentrifus (Menit)
15 20 25 30
Ulangan A [Fe,µg/L] Rec A [Fe,µg/L] Rec A [Fe,µg/L] Rec A [Fe,µg/L] Rec 1 0.2029 4.4109 44.11 0.3071 6.6761 66.76 0.4303 9.3543 93.54 0.3344 7.2696 72.70 2 0.2054 4.4652 44.65 0.3077 6.6891 66.89 0.4514 9.8130 98.13 0.3407 7.4065 74.07 3 0.2014 4.3783 43.78 0.3018 6.5609 65.61 0.4311 9.3717 93.72 0.3268 7.1043 71.04 4 0.2066 4.4913 44.91 0.3031 6.5891 65.89 0.4136 8.9913 89.91 0.3251 7.0674 70.67 5 0.1993 4.3326 43.33 0.2807 6.1022 61.02 0.4139 8.9978 89.98 0.3604 7.8348 78.35 6 0.1954 4.2478 42.48 0.2878 6.2565 62.57 0.4138 8.9957 89.96 0.3704 8.0522 80.52 7 0.2130 4.6304 46.30 0.2837 6.1674 61.67 0.4045 8.7935 87.93 0.3604 7.8348 78.35 Rerata 0.2034 4.4224 44.22 0.2960 6.4345 64.34 0.4227 9.1882 91.88 0.3455 7.5099 75.10
Optimalisasi Waktu Sentrifus (menit) Logam Mn
Waktu Sentrifus (Menit)
15 20 25 30
Ulangan
A [Mn,µg/L] Rec A [Mn,µg/L] Rec A [Mn,µg/L] Rec A [Mn,µg/L] Rec 1 0.2410 5.4773 54.77 0.2791 6.3432 63.43 0.4254 9.6682 96.68 0.3482 7.9136 79.14 2 0.2410 5.4773 54.77 0.2860 6.5000 65.00 0.4327 9.8341 98.34 0.3472 7.8909 78.91 3 0.2348 5.3364 53.36 0.3082 7.0045 70.05 0.4192 9.5273 95.27 0.3396 7.7182 77.18 4 0.2486 5.6500 56.50 0.3044 6.9182 69.18 0.4417 10.0386 100.39 0.3426 7.7864 77.86 5 0.2424 5.5091 55.09 0.2980 6.7727 67.73 0.4363 9.9159 99.16 0.3558 8.0864 80.86 6 0.2397 5.4477 54.48 0.2932 6.6636 66.64 0.4214 9.5773 95.77 0.3558 8.0864 80.86 7 0.2284 5.1909 51.91 0.2896 6.5818 65.82 0.4300 9.7727 97.73 0.3171 7.2068 72.07 Rerata 0.2394 5.4412 54.41 0.2941 6.6834 66.83 0.4295 9.7620 97.62 0.3438 7.8127 78.13
Optimalisasi Waktu Sentrifus (menit) Logam Zn
Waktu Sentrifus (Menit)
Ulangan 15 20 25 30
Lampiran 9 Optimalisasi Nisbah HNO
3dan air (mL)
Optimalisasi Nisbah HNO
3:air (mL) Logam Cu
HNO3:air (mL)0.5:9.5 1.0:9.0 1.5:8.5 2.0:8.0
Ulangan A [Cu,µg/L] Rec A [Cu,µg/L] Rec A [Cu,µg/L] Rec A [Cu,µg/L] Rec 1 0.2117 36.5000 73.00 0.2548 43.9310 87.86 0.2888 49.7931 99.59 0.2315 39.9138 79.83 2 0.2190 37.7586 75.52 0.2516 43.3793 86.76 0.2829 48.7759 97.55 0.2357 40.6379 81.28 3 0.2116 36.4828 72.97 0.2591 44.6724 89.34 0.2951 50.8793 101.76 0.2348 40.4828 80.97 4 0.2166 37.3448 74.69 0.2551 43.9828 87.97 0.2974 51.2759 102.55 0.2218 38.2414 76.48 5 0.2119 36.5345 73.07 0.2540 43.7931 87.59 0.2995 51.6379 103.28 0.2483 42.8103 85.62 6 0.2150 37.0690 74.14 0.2450 42.2414 84.48 0.3005 51.8103 103.62 0.2487 42.8793 85.76 7 0.2148 37.0345 74.07 0.2490 42.9310 85.86 0.3001 51.7414 103.48 0.2499 43.0862 86.17 Rerata 0.2144 36.9606 73.92 0.2527 43.5616 87.12 0.2949 50.8448 101.69 0.2387 41.1502 82.30 Ket: Rec (%): Recovery = kedapatulangan (%)
Optimalisasi Nisbah HNO
3:air (mL) Logam Cd
HNO3:air (mL)0.5:9.5 1.0:9.0 1.5:8.5 2.0:8.0
Ulangan A [Cd,µg/L] Rec A [Cd,µg/L] Rec A [Cd,µg/L] Rec A [Cd,µg/L] Rec 1 0.2296 0.5303 53.03 0.2657 0.6136 61.36 0.4508 1.0411 104.11 0.3765 0.8695 86.95 2 0.2258 0.5215 52.15 0.2673 0.6173 61.73 0.4521 1.0441 104.41 0.3764 0.8693 86.93 3 0.2224 0.5136 51.36 0.2602 0.6009 60.09 0.4549 1.0506 105.06 0.3732 0.8619 86.19 4 0.2281 0.5268 52.68 0.2668 0.6162 61.62 0.4526 1.0453 104.53 0.3791 0.8755 87.55 5 0.2208 0.5099 50.99 0.2544 0.5875 58.75 0.4396 1.0152 101.52 0.3742 0.8642 86.42 6 0.2249 0.5194 51.94 0.2578 0.5954 59.54 0.4403 1.0169 101.69 0.3743 0.8644 86.44 7 0.2188 0.5053 50.53 0.2517 0.5813 58.13 0.4526 1.0453 104.53 0.3768 0.8702 87.02 Rerata 0.2243 0.5181 51.81 0.2606 0.6017 60.17 0.4490 1.0369 103.69 0.3758 0.8679 86.79
Optimalisasi Nisbah HNO
3:air (mL) Logam Fe
HNO3:air (mL)Ulangan 0.5:9.5 1.0:9.0 1.5:8.5 2.0:8.0
A [Fe,µg/L] Rec A [Fe,µg/L] Rec A [Fe,µg/L] Rec A [Fe,µg/L] Rec 1 0.2120 4.6087 46.09 0.2852 6.2000 62.00 0.4476 9.7304 97.30 0.3380 7.3478 73.48 2 0.2151 4.6761 46.76 0.2823 6.1370 61.37 0.4475 9.7283 97.28 0.3327 7.2326 72.33 3 0.2192 4.7652 47.65 0.2837 6.1674 61.67 0.4394 9.5522 95.52 0.3368 7.3217 73.22 4 0.2152 4.6783 46.78 0.2908 6.3217 63.22 0.4307 9.3630 93.63 0.3467 7.5370 75.37 5 0.2075 4.5109 45.11 0.2917 6.3413 63.41 0.4383 9.5283 95.28 0.3437 7.4717 74.72 6 0.1992 4.3304 43.30 0.2707 5.8848 58.85 0.4398 9.5609 95.61 0.3416 7.4261 74.26 7 0.1976 4.2957 42.96 0.2690 5.8478 58.48 0.4328 9.4087 94.09 0.3460 7.5217 75.22 Rerata 0.2094 4.5522 45.52 0.2819 6.1286 61.29 0.4394 9.5531 95.53 0.3408 7.4084 74.08
Optimalisasi Nisbah HNO
3:air (mL) Logam Mn
HNO3:air (mL)Ulangan 0.5:9.5 1.0:9.0 1.5:8.5 2.0:8.0
A [Mn,µg/L] Rec A [Mn,µg/L] Rec A [Mn,µg/L] Rec A [Mn,µg/L] Rec 1 0.2337 5.3114 53.11 0.3289 7.4750 74.75 0.4370 9.9318 99.32 0.3432 7.8000 78.00 2 0.2403 5.4614 54.61 0.3464 7.8727 78.73 0.4464 10.1455 101.45 0.3214 6.9870 69.87 3 0.2221 5.0477 50.48 0.3426 7.7864 77.86 0.4344 9.8727 98.73 0.3306 7.1870 71.87 4 0.2147 4.8795 48.80 0.3228 7.3364 73.36 0.4168 9.4727 94.73 0.3390 7.3696 73.70 5 0.2134 4.8500 48.50 0.3364 7.6455 76.45 0.4479 10.1795 101.80 0.3343 7.2674 72.67 6 0.2343 5.3250 53.25 0.3328 7.5636 75.64 0.4530 10.2955 102.95 0.3310 7.1957 71.96 7 0.2201 5.0023 50.02 0.3320 7.5455 75.45 0.4062 9.2318 92.32 0.3338 7.2565 72.57 Rerata 0.2255 5.1253 51.25 0.3346 7.6036 76.04 0.4345 9.8756 98.76 0.3333 7.2947 72.95
Optimalisasi Nisbah HNO
3:air (mL) Logam Zn
HNO3:air (mL)0.5:9.5 1.0:9.0 1.5:8.5 2.0:8.0
Ulangan
Lampiran 10 Contoh perhitungan optimalisasi volume SPR-IDA
Logam Cu
Persamaan garis:
Berdasarkan persamaan garis, diperoleh:
Ket:
y
= Absorban
x
= Konsentrasi
C
f= Konsentrasi hasil pengukuran (µg/L)
PTIMALISASI METODE RESIN PENGENDAP PARTIKULAT
ASAM IMINODIASETAT UNTUK PENENTUAN LOGAM
BERAT (Cu, Cd, Fe, Mn, Zn) AIR LAUT
SITI NURSEVTYANI
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
OPTIMALISASI METODE RESIN PENGENDAP
PARTIKULAT ASAM IMINODIASETAT UNTUK
PENENTUAN LOGAM BERAT (Cu, Cd, Fe, Mn, Zn) AIR
LAUT
SITI NURSEVTYANI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul : Optimalisasi Metode Resin Pengendap Partikulat Asam Iminodiasetat Untuk
Penentuan Logam Berat (Cu, Cd, Fe, Mn, Zn) Air Laut
Nama : Siti Nursevtyani
NIM : G44204046
Menyetujui,
Pembimbing I,
Pembimbing II,
Armi Wulanawati, S.Si, M.Si
NIP 19690725 200003 2 001
Erini Yuwatini, Ph.D
NIP 19650704 199303 2 001
Mengetahui
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
Institut Pertanian Bogor
Dr. Drh. Hasim, D E A
NIP 19610328 198601 1 002
ABSTRAK
SITI NURSEVTYANI
. Optimalisasi Metode Resin Pengendap Partikulat Asam
Iminodiasetat Untuk Penentuan Logam Berat (Cu, Cd, Fe, Mn, Zn) Air Laut.
Dibimbing Oleh ARMI WULANAWATI dan ERINI YUWATINI.
Metode resin pengendap partikulat asam iminodiasetat merupakan metode
untuk penentuan Cu(II), Cd(II), Fe(II), Mn(II), and Zn(II) dalam air laut
menggunakan spektrofotometri serapan atom tungku grafit. Pada dasarnya metode
tersebut tergolong metode ekstraksi fase padat karena menggunakan resin
padatan. Optimalisasi metode ini dilakukan untuk parameter volume SPR-IDA,
pH, kecepatan dan waktu sentrifus, serta nisbah HNO
3dan air yang digunakan
terhadap logam Cu, Cd, fe, Mn, dan Zn. Optimalisasi volume SPR-IDA untuk
logam Cu, Cd, Fe, Mn, Fe, dan Zn berturut-turut adalah 40, 40, 50, 50, dan 60 µL.
pH optimum pembentukan kompleks untuk semua logam adalah 8.0-8.5.
Kecepatan sentrifus untuk Cu, Cd dan Mn adalah 4000 rpm, sedangkan Fe dan Zn
adalah 5000 rpm. Waktu sentrifus untuk semua logam adalah 25 menit. Nisbah
HNO
3dan air optimum untuk semua logam adalah 1.5:8.5 mL.
ABSTRACT