Lampiran 3. Gambar buah dan kulit buah sawo manila
Buah sawo manila
Lampiran 6. Gambar mikroskopik serbuk simplisia kulit buah sawo manila perbesaran 10 x 40
Parenkim berisi sel minyak Berkas pembuluh berbentuk spiral
Lampiran 7. Bagan metode penelitian
Kulit buah sawo manila
Simplisia
Serbuk simplisia
Karakterisasi simplisia Skrining fitokimia
Meliputi pemeriksaan : 1. Makroskopik 2. Mikroskopik Meliputi penetapan : 1. Kadar air
2. Kadar sari larut air 3. Kadar sari larut etanol 4. Kadar abu
5. Kadar abu tidak larut asam
Meliputi pemeriksaan :
dikeringkan di lemari pengering
dilakukan makroskopik dihaluskan
Lampiran 7. (Lanjutan) Pembuatan ekstrak etanol kulit buah sawo manila
dihentikan perkolasi apabila 500 mg perkolat yang keluar terakhir diuapkan tidak meninggalkan sisa 300 g serbuk simplisia
Perkolat
Ekstrak kental etanol 85 g
Uji antibakteri
direndam dengan pelarut etanol 96% selama 3 jam dalam bejana tertutup dipindahkan massa ke dalam perkolator
didiamkan selam 24 jam
dibuka kran dan dibiarkan ekstrak menetes dari perkolator dengan kecepatan 1 ml per menit
Lampiran 7. (Lanjutan) Pembuatan fraksi n-heksana, etilasetat dan air dari ekstrak etanol kulit buah sawo manila
30 g ekstrak kental etanol
Lapisan atas Lapisan bawah
Fraksi n-heksana 0,78 g
Uji antibakteri
Lapisan atas Lapisan bawah
Fraksi air 24,4 g Fraksi etilasetat 0,92 g
Uji antibakteri Uji antibakteri
dilarutkan dalam 60 ml etanol
didiamkan sampai terbentuk 2 lapisan dikocok
ditambahkan 150 ml akuades dan 150 ml n-heksana dimasukkan ke dalam corong pisah
dipekatkan dengan rotary evaportor
dimasukkan ke dalam corong pisah ditambahkan 150 ml etilasetat
dikocok
didiamkan sampai terbentuk 2 lapisan
Lampiran 7. (Lanjutan) Pengujian aktivitas ntibakteri
Biakan murni bakteri
Stok kultur bakteri
Inokulum bakteri
Media padat
Hasil
diinkubasi pada suhu 35 ± 2ºC selama 18-24 jam
diinokulasi pada media nutrient agar miring dengan cara menggores
diambil dengan jarum ose steril
diukur kekeruhan suspense bakteri menggunakan spektrofotometer UV pada panjang gelombang 580 nm sampai diperoleh nilai transmitan 25%
diambil 1 ose
disuspensikan ke dalam 10 ml nutrient broth
dituang 15 ml media NA steril ke dalam cawan petri dimasukkan 0,1 ml inokulum ke dalam cawan petri
dihomogenkan dan dibiarkan hingga memadat
diletakkan cakram kertas yang telah direndam dengan ekstrak/fraksi dengan berbagai konsentrasi dan pelarut DMSO sebagai blanko ke atas media padat
Lampiran 8. Perhitungan penetapan kadar air simplisia kulit buah sawo manila
℅ Kadar air = Volume air (ml)
Berat sampel (g)× 100℅
1. Berat sampel = 5,012 g Volume air = 0,15 ml
℅ Kadar air = 0,15 ml
5,012 g × 100℅ = 2,99℅
2. Berat sampel = 5,045 g Volume air = 0,10 ml
℅ Kadar air = 0,10 ml
5,045 g × 100℅ = 1,98℅
3. Berat sampel = 5,033 g Volume air = 0,10 ml
℅ Kadar air = 0,10 ml
5,033 g × 100℅ = 1,98℅
℅ Kadar air rata-rata = 2,99 ℅ + 1,98℅ + 1,98℅
Lampiran 10. Perhitungan penetapan kadar sari larut dalam etanol simplisia kulit buah sawo manila
Lampiran 11. Perhitungan penetapan kadar abu total simplisia kulit buah sawo manila
℅ Kadar abu total = Berat abu (g)
Berat sampel (g)× 100℅
1. Berat sampel = 2,0303 g Berat abu = 0,1295 g
℅ Kadar abu total = 0,1295 g
2,0303 g × 100℅ = 6,37℅
2. Berat sampel = 2,0482 g Berat abu = 0,1288 g
℅ Kadar abu total = 0.1288 g
2,0482 g × 100℅ = 6,28℅
3. Berat sampel = 2,0350 g Berat abu = 0,1290 g
℅ Kadar abu total = 0.1290 g
2,0350 g × 100℅ = 6,33℅
℅ Kadar abu total rata-rata = 6,37℅ + 6,28℅+ 6,33℅
Lampiran 12. Perhitungan penetapan kadar abu tidak larut dalam asam simplisia kulit buah sawo manila
℅ Kadar abu tidak larut asam = Berat abu (g)
Berat sampel (g)× 100℅
1. Berat sampel = 2,0303 g Berat abu = 0,0092 g
℅ Kadar abu tidak larut asam = 0,0092 g
2,0303 g × 100℅ = 0,45℅
2. Berat sampel = 2,0482 g Berat abu = 0,0112 g
℅ Kadar abu tidak larut asam = 0,0112 g
2,0482 g × 100℅ = 0,54℅
3. Berat sampel = 2,0350 g Berat abu = 0,0098 g
℅ Kadar abu tidak larut asam = 0,0098 g
2,0350 g × 100℅ = 0,48℅
℅ Kadar abu tidak larut asam rata-rata = 0,45 ℅ + 0,54℅+ 0,48℅
Lampiran 13. Hasil pengukuran diameter daerah hambatan pertumbuhan bakteri Staphylococcus aureus dan Escherichia coli pada ekstrak etanol kulit buah sawo manila
Konsentrasi Daerah diameter hambatan (mm)
(mg/ml) Staphylococcus aureus Eschericia coli
D1 D2 D3 D* D1 D2 D3 D*
500 20,8 20,5 20,3 20,53 19,15 19,6 21,6 20,11 400 19,9 19,8 19,5 19,73 18,3 18,65 18,1 18,35 300 18,2 19,0 18,7 18,63 16,25 17,55 18,0 17,26 200 17,2 17,0 17,7 17,3 15,0 16,5 15,0 15,5 100 16,6 16,55 15,6 16,25 14,0 14,25 14,5 14,25
50 14,8 14,6 13,85 14,41 13,0 13,55 13,75 13,43
Blanko - - - -
Keterangan:
D : Diameter daerah hambatan
Lampiran 14. Hasil pengukuran diameter daerah hambatan pertumbuhan bakteri Staphylococcus aureus dan Escherichia coli pada fraksi n-heksana kulit buah sawo manila
Konsentrasi Daerah diameter hambatan (mm)
(mg/ml) Staphylococcus aureus Eschericia coli
D1 D2 D3 D* D1 D2 D3 D*
500 17,8 16,3 15,3 16,46 9,0 8,95 9,15 9,03 400 15,1 15,0 14,2 14,76 8,3 8,1 8,0 8,13 300 11,7 10,1 11,0 10,93 7,85 7,7 7,7 7,75 200 7,7 7,95 7,7 7,78 7,75 7,6 7,65 7,66 100 7,6 7,15 7,2 7,31 7,6 7,5 7,4 7,5
50 7,0 7,0 7,15 7,05 7,35 7,2 7,1 7,21
Blanko - - - -
Keterangan:
D : Diameter daerah hambatan
* : Rata-rata diameter daerah hambatan - : Tidak terdapat daerah hambatan Blanko : DMSO
Lampiran 15. Hasil pengukuran diameter daerah hambatan pertumbuhan bakteri Staphylococcus aureus dan Escherichia coli pada fraksi etilasetat kulit buah sawo manila
Konsentrasi Daerah diameter hambatan (mm)
(mg/ml) Staphylococcus aureus Eschericia coli
D1 D2 D3 D* D1 D2 D3 D*
500 20,0 21,0 20,4 20,46 18,4 19,0 18,8 18,73 400 19,65 19,3 19,8 19,58 16,95 17,0 17,0 16,98 300 17,6 17,9 18,0 18,83 15,9 16,0 15,8 15,9 200 15,0 18,1 16,5 16,53 15,6 15,5 15,0 15,36 100 15,2 15,5 15,75 15,48 15,4 15,0 14,95 15,11 50 13,0 13,6 13,7 13,43 12,2 12,0 12,3 12,16
Blanko - - - -
Keterangan:
D : Diameter daerah hambatan
Lampiran 16. Hasil pengukuran diameter daerah hambatan pertumbuhan bakteri Staphylococcus aureus dan Escherichia coli pada fraksi air kulit buah sawo manila
Konsentrasi Daerah diameter hambatan (mm)
(mg/ml) Staphylococcus aureus Eschericia coli
D1 D2 D3 D* D1 D2 D3 D*
500 19,95 19,8 19,9 19,88 10,0 10,2 9,9 10,03 400 17,95 18,4 18,2 18,18 8,55 9,25 8,6 8,8 300 16,55 16,9 16,8 16,75 8,35 8,25 8,5 8,36 200 15,0 15,1 14,95 15,01 8,0 8,15 8,1 8,08 100 13,65 13,9 13,85 13,8 7,2 7,45 7,95 7,53 50 12,8 12,9 12,2 12,63 6,6 7,1 7,0 6,9
Blanko - - - -
Keterangan:
D : Diameter daerah hambatan
Lampiran 17. Gambar hasil uji aktivitas antibakteri ekstrak etanol kulit buah sawo manila terhadap bakteri Staphylococcus aureus
Keterangan : Konsentrasi ekstrak dalam satuan mg/ml
500
400
300
Blanko
50 200
Lampiran 18. Gambar hasil uji aktivitas antibakteri ekstrak etanol kulit buah sawo manila terhadap bakteri Escherichia coli
Keterangan : Konsentrasi ekstrak dalam satuan mg/ml
500
400
300
Lampiran 19. Gambar hasil uji aktivitas antibakteri fraksi n-heksana kulit buah sawo manila terhadap bakteri Staphylococcus aureus
Keterangan : Konsentrasi ekstrak dalam satuan mg/ml
500
400
300
Blanko
50 200
Lampiran 20. Gambar hasil uji aktivitas antibakteri fraksi n-heksana kulit buah sawo manila terhadap bakteri Escherichia coli
Keterangan : Konsentrasi ekstrak dalam satuan mg/ml
500
400
300
50 100 Blanko
Lampiran 21. Gambar hasil uji aktivitas antibakteri fraksi etilasetat kulit buah sawo manila terhadap bakteri Staphylococcus aureus
Keterangan : Konsentrasi ekstrak dalam satuan mg/ml
500
300 400
Blanko
50 200
Lampiran 22. Gambar hasil uji aktivitas antibakteri fraksi etilasetat kulit buah sawo manila terhadap bakteri Escherichia coli
Keterangan : Konsentrasi ekstrak dalam satuan mg/ml
500
400
300
Blanko
Lampiran 23. Gambar hasil uji aktivitas antibakteri fraksi air kulit buah sawo manila terhadap bakteri Staphylococcus aureus
Keterangan : Konsentrasi ekstrak dalam satuan mg/ml
500
300 400
Blanko
Lampiran 24. Gambar hasil uji aktivitas antibakteri fraksi air kulit buah sawo manila terhadap bakteri Escherichia coli
Keterangan : Konsentrasi ekstrak dalam satuan mg/ml
500
300 400
Blanko
DAFTAR PUSTAKA
Alcamo, I. (1983). Fundamentals of Microbiology. Canada : Addison-Wesley Publishing Company, Inc. Halaman 556-557.
Ashari, S. (2006). Meningkatkan Keunggulan Bebuahan Tropis Indonesia. Edisi I. Yogyakarta : ANDI. Halaman 115.
Azmi, N. (2013). Skrining Fitokimia dan Uji Aktivitas Antibakteri Ekstrak Etanol Serta Fraksi-Fraksi Bunga Belimbing Wuluh (Averrhoa bilimbi L.) Terhadap Bakteri Staphylococcus aureus dan Escherichia coli. Skripsi. Medan : Universitas Sumatera Utara. Halaman22-23, 45-46.
Basset, J., Denney, R. C., Jeffrey, G. H., dan Mendham, J. (1994). Buku Ajar Vogel : Kimia Analisis Kuantitatif Anorganik. Edisi 4. Jakarta : EGC. Halaman 165.
Depkes RI. (1995). Materia Medika Indonesia. Jilid VI. Jakarta: Departemen Kesehatan RI. Halaman 299-304, 306, 321, 325, 333-336.
Depkes RI. (a.2000). Acuan Sediaan Herbal. Departemen Kesehatan RI. Halaman 7-8.
Depkes RI. (b.2000). Parameter Standar Umum Ekstrak Tumbuhan Obat. Jakarta: Departemen Kesehatan RI. Halaman 10-11, 17.
Ditjen POM. (1995). Farmakope Indonesia. Edisi IV. Jakarta: Departemen Kesehatan RI. Halaman 7, 855, 891, 896-898.
Duke, J.A. (1929). Duke’s Handbook of Medicinal Plants of Latin America. USA : Taylor and Francis Group, LLC. Halaman 433-434.
Dwidjoseputro, D. (1994). Dasar-dasar Mikrobiologi. Jakarta: Djambatan. Halaman 17, 105, 117- 119.
Farnsworth, N.R. (1966). Biologycal and Phytochemical Screening of Plants. Journal of Pharmaceutical Science. 55(3): 262-264.
Harborne, J.B. (1987). Metode Fitokimia Penuntun Cara Modern Menganalisis Tumbuhan. Terjemahan: Kosasih Padmawinata dan Iwang Soediro. Edisi Ketiga. Bandung: ITB Press. Halaman 147.
Heyne, K. (1987). Tumbuhan Berguna Indonesia. Jilid III. Cetakan I. Jakarta: Badan Litbang Kehutanan. Halaman 1584.
Irianto, K. (2006). Mikrobiologi Menguak Dunia Mikroorganisme. Jilid I. Bandung : CV. Yrama Widya. Halaman 75, 85-87.
Irianto, K. (2013). Mikrobiologi Medis. Bandung : Alfabeta. Halaman 44.
Jawetz, E., Melnick, J.L., dan Adelberg, E.A. (2007). Mikrobiologi Kedokteran. Alih Bahasa: Huriawati Hartanto, Chaerunnisa Rachman, Alifa Dimanti, dan Aryana Diani. Edisi 23. Jakarta: EGC. Halaman 225.
Juwita, J. (2013). Uji Aktivitas Antibakteri Ekstrak Buah Muda, Daun dan Kulit Batang Sawo Manila (Manilkara zapota (L.) Van Royen terhadap Vibrio cholerae dan Clostridium perfringens. Yogyakarta : Universitas Atma Jaya. Halaman 45.
Kariman. (2014). Bebas Penyakit dengan Tanaman Ajaib. Cetakan I. Surakarta : Open books. Halaman 91.
Lay, B.W. (1994). Analisis Mikroba di Laboratorium. Jakarta: PT. Raja Grafindo Persada. Halaman 67.
Mustary, M., Djide, M.N., Mahmud, I., dan Hasyim, N. (2011). Uji Daya Hambat dan Analisis KLT-Bioautografi Perasan Buah Sawo Manila (Achras zapota Linn) Terhadap Bakteri Uji Salmonella thyposa. Jurnal MKMI. Volume 7. Makassar : Universitas Hasanuddin. Halaman 25.
Naufalin, R., Jenie, B.S.L., Kusnandar, F., Sudarwamto, M., dan Rukmini, H. (2005). Aktivitas Antibakteri Ekstrak Bunga Kecombrang Terhadap Bakteri Patogen dan Perusak Pangan. Jurnal Teknologi dan Industri Pangan. Volume 16 : (2). Halaman121-122.
Ningrum, H.P.,Yeni, L.F., dan Ariyati, E. (2012). Uji Daya Antibakteri Ekstrak Sawo Manila Terhadap E.coli dan Implemantasinya dalam Pembelajaran Peranan Bakteri. FKIP Untan. Halaman 2.
Oxoid. (1982). The Oxoid Manual of Culture Media, Ingredients and Other Laboratory Services. Fifth Edition. Hampshire: Oxoid Limited. Halaman 223 - 224.
Pelczar, M., dan Chan, E.C.S. (1988). Elements of Microbiology. New York: McGraw-Hill Companies Inc. Terjemahan: Ratna Siri Hadioetomo, Teja Imas, Sutarmi Tjitosomo, Sri Lestari Angka. Dasar-Dasar Mikrobiologi. Jakarta: Penerbit UI-Press. Halaman 145.
Putra, W. S. (2015). Kitab Herbal Nusantara. Yogyakarta: KATAHATI. Halaman 1
Rohman, A. (2007). Kimia Farmasi Analisis. Yogyakarta : Pustaka Pelajar. Halaman 46-47.
Simanullang, J.M. (2013). Uji Antibakteri Ekstrak Daun Sawo (Manilkara zapota) terhadap Bakteri Staphylococcus aureus dan Eschericia coli. Medan : USU. Halaman 37.
Staf Pengajar FK UI. (1994). Mikrobiologi Kedokteran. Jakarta : Binarupa Aksara. Halaman 103-104, 163.
Sunarjono, H. (2013). Berkebun 21 Jenis Tanaman Buah. Cetakan X. Jakarta : Penebar Swadaya. Halaman 88.
Sundararaj, T., Anthoniraj, S., Kannan, N., dan Muthukaruppan, S.M. (2004). Microbiology. First Edition. Chennai : Government of Tamil Tadu. Halaman 150.
Tjitrosoepomo, G. (2000). Taksonomi Tumbuhan (Spermatophyta).Yogyakarta: UGM-Press. Halaman 324-325.
Volk, W.A. (1992). Basic Microbiology. Edisi ketujuh. New York: Harper Collins Publishers. Halaman 45-46.
Waluyo, L. (2010). Teknik Dasar Metode Mikrobiologi. Malang: UMM Press. Halaman 105.
WHO. (1998). Quality Control Methods for Medicinal Plant Materials. Switzerland: Geneva Press. Halaman 31-33.
BAB III
METODE PENELITIAN
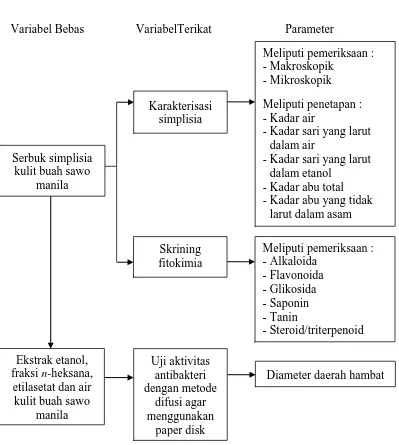
Metode penelitian yang digunakan adalah metode eksperimental. Tahap penelitian meliputi pengambilan bahan tumbuhan, identifikasi bahan tumbuhan, pembuatan simplisia, karakterisasi simplisia, skrining fitokimia, pembuatan ekstrak etanol dan fraksi kulit buah sawo manila, kemudian dilakukan uji aktivitas antibakteri menggunakan metode difusi agar dengan cakram kertas. Parameter yang diamati yaitu besarnya diameter daya hambat pertumbuhan bakteri. Penelitian ini dilakukan di Laboratorium Farmakognosi dan Mikrobiologi Fakultas Farmasi Universitas Sumatera Utara, Medan.
3.1 Alat
3.2 Bahan
Bahan yang digunakan adalah kulit buah sawo manila (Manilkara zapota (L.) P. Royen), nutrient agar (NA), nutrient broth (NB), bakteri Staphylococcus aureus dan Escherichia coli, air suling. Bahan kimia yang digunakan berkualitas
pro analisis, kecuali dinyatakan lain yaitu alfa naftol, alkohol 70%, amil alkohol, asam klorida pekat, asam asetat anhidrida, asam nitrat, asam sulfat pekat, besi (III) klorida, bismuth (III) nitrat, dimetilsulfoksida (DMSO), etanol 96%, etilasetat, iodium, isopropanol, kalium iodida, kloralhidrat, kloroform, metanol, natrium hidroksida, natrium klorida, natrium sulfat anhidrida, n-heksana, raksa (II) klorida, serbuk magnesium, serbuk zinkum, timbal (II) asetat dan toluena.
3.3 Penyiapan Bahan Tumbuhan
Penyiapan bahan tumbuhan meliputi pengambilan bahan tumbuhan, identifikasi bahan tumbuhan dan pembuatan simplisia kulit buah sawo manila (Manilkara zapota (L.) P. Royen).
3.3.1 Pengumpulan bahan tumbuhan
Pengambilan bahan tumbuhan dilakukan secara purposif yaitu tanpa membandingkan dengan tumbuhan yang sama dari daerah lain. Bahan yang diambil adalah buah sawo manila matang yang diperoleh dari pasar buah Setia Budi Tanjung Sari Medan, Provinsi Sumatera Utara. Sampel yang digunakan adalah kulit buah sawo manila (Manilkara zapota (L.) P. Royen).
3.3.2 Identifikasi tumbuhan
3.3.3 Pembuatan simplisia
Pembuatan simplisia dilakukan dengan cara buah sawo manila (segar yang telah dikumpulkan, dibersihkan dari pengotor yang melekat, lalu dicuci dengan air sampai bersih dan ditiriskan. Kulit buah sawo manila dikupas dengan pisau sehingga terpisah antara kulit buah dengan daging buah. Gambar kulit buah sawo manila dapat dilihat pada Lampiran 3, halaman 47. Kulit buah sawo manila kemudian dikeringkan di dalam lemari pengering sampai simplisia rapuh ketika diremas. Gambar simplisia kulit buah sawo manila dapat dilihat pada Lampiran 4, halaman 48. Simplisia yang sudah kering selanjutnya diblender menjadi serbuk dan disimpan dalam wadah plastik yang tertutup rapat. Gambar serbuk simplisia kulit buah sawo manila dapat dilihat pada Lampiran 5, halaman 49.
3.4 Pembuatan Pereaksi
3.4.1 Pereaksi Mayer
Larutan raksa (II) klorida P 2,26% b/v sebanyak 60 ml dicampur dengan 10 ml larutan kalium iodida P 50% b/v, kemudian ditambahkan air secukupnya hingga 100 ml (Depkes RI, 1995).
3.4.2 Pereaksi Dragendorff
Larutan bismuth (III) nitrat P 40% b/v dalam asam nitrat P sebanyak 20 ml dicampur dengan 50 ml kalium iodida P 54,4% b/v, didiamkan sampai memisah sempurna, lalu diambil lapisan jernihnya dan diencerkan dengan air secukupnya hingga 100 ml (Depkes RI, 1995).
3.4.3 Pereaksi Bouchardat
suling sampai 100 ml (Depkes RI, 1995). 3.4.4 Pereaksi Molish
Sebanyak3 g α-naftol P dilarutkan dalam asam nitrat 0,5 N hingga
diperoleh larutan 100 ml (Depkes RI, 1995). 3.4.5 Pereaksi Liebermann-Burchard
Campurkan 5 ml asam sulfat pekat dengan 50 ml etanol. Tambahkan hati-hati 5 ml asam asetat anhidrida ke dalam campuran tersebut dan didinginkan (Depkes RI, 1995).
3.4.6 Pereaksi besi (III) klorida 1% b/v
Sebanyak 1 g besi (III) klorida dilarutkan dalam air suling sampai 100 ml (Depkes RI, 1995).
3.4.7 Pereaksi timbal (II) asetat 0,4 M
Sebanyak 15,17 g timbal (II) asetat P dilarutkan dalam air suling bebas CO2 hingga 100 ml (Depkes RI, 1995).
3.4.8 Pereaksi asam klorida 2 N
Sebanyak 17 ml asam klorida pekat diencerkan dengan air suling sampai 100 ml (Depkes RI, 1995).
3.4.9 Pereaksi natrium hidroksida 2 N
Sebanyak 8,001 g natrium hidroksida ditimbang, kemudian dilarutkan dalam air suling hingga 100 ml (Depkes RI, 1995).
3.4.10 Larutan asam sulfat 2 N
Larutan asam sulfat pekat sebanyak 9,8 ml ditambahan air suling sampai 100 ml (Depkes RI, 1995).
3.4.11 Larutan kloralhidrat
air suling (Depkes RI, 1995).
3.5 Pemeriksaan Karakteristik Simplisia
Pemeriksaan karakteristik simplisia meliputi pemeriksaan makroskopik, mikroskopik, penetapan kadar air, penetapan kadar sari yang larut dalam air, penetapan kadar sari yang larut dalam etanol, penetapan kadar abu total dan penetapan kadar abu yang tidak larut dalam asam.
3.5.1 Pemeriksaan makroskopik
Pemeriksan makroskopik dilakukan dengan mengamati morfologi luar tumbuhan yaitu bentuk, ukuran dan permukaan kulit sedangkan pemeriksaan organoleptis meliputi bau, rasa dan warna dari kulit buah sawo manila.
3.5.2 Pemeriksaan mikroskopik
Pemeriksaan mikroskopik dilakukan terhadap serbuk simplisia kulit buah sawo manila. Serbuk simplisia ditaburkan diatas kaca objek yang telah ditetesi dengan kloralhidrat dan ditutup dengan kaca penutup, kemudian dilihat dibawah mikroskop. Gambar mikroskopik serbuk simplisia dapat dilihat pada Lampiran 6, halaman 50.
3.5.3 Penetapan kadar air
diatur lebih kurang 2 tetes tiap detik setelah toluen mendidih, hingga sebagian air tersuling, kemudian naikkan kecepatan penyulingan hingga 4 tetes tiap detik. Bagian dalam pendingin dibilas dengan toluen setelah semua air tersuling. Penyulingan dilanjutkan selama 5 menit, kemudian tabung penerima dibiarkan mendingin sampai suhu kamar. Volume dibaca dengan ketelitian 0,05 ml setelah air dan toluen memisah sempurna. Selisih kedua volume air dibaca sesuai dengan kandungan air yang terdapat dalam bahan yang diperiksa (WHO, 1998). Perhitungan kadar air dapat dilihat pada Lampiran 8, halaman 55.
3.5.4 Penetapan kadar sari yang larut dalam air
Sebanyak 5 g serbuk simplisia, dimaserasi selama 24 jam dalam 100 ml air-kloroform (2,5 ml kloroform dalam air suling sampai 1 liter) dalam labu bersumbat sambil dikocok sesekali selama 6 jam pertama, kemudian dibiarkan selama 18 jam, lalu disaring. Uapkan 20 ml filtrat sampai kering dalam cawan penguap yang berdasar rata yang telah ditara dan sisa dipanaskan pada suhu 105°C sampai diperoleh bobot tetap. Kadar sari yang larut dalam air dihitung terhadap bahan yang telah dikeringkan (Depkes RI, 1995). Perhitungan kadar sari yang larut dalam air dapat dilihat pada Lampiran 9, halaman 56.
3.5.5 Penetapan kadar sari yang larut dalam etanol
yang larut dalam etanol dapat dilihat pada Lampiran 10, halaman 57. 3.5.6 Penetapan kadar abu total
Sebanyak 2 g serbuk yang telah digerus dan ditimbang seksama dimasukkan dalam krus porselin yang telah dipijar dan ditara, kemudian diratakan. Krus dipijar perlahan-lahan sampai arang habis, pijaran dilakukan pada suhu 600°C selama 3 jam kemudian didinginkan dan ditimbang sampai diperoleh bobot tetap. Kadar abu dihitung terhadap bahan yang telah dikeringkan (Depkes RI, 1995). Perhitungan kadar abu total dapat dilihat pada Lampiran 11, halaman 58.
3.5.7 Penetapan kadar abu tidak larut dalam asam
Abu yang diperoleh dalam penetapan kadar abu dididihkan dalam 25 ml asam klorida encer selama 5 menit, bagian yang tidak larut dalam asam dikumpulkan, disaring melalui kertas saring, dipijarkan, kemudian didinginkan dan ditimbang sampai bobot tetap. Kadar abu yang tidak larut dalam asam dihitung terhadap bahan yang telah dikeringkan (Depkes RI, 1995). Perhitungan kadar abu yang tidak larut dalam asam dapat dilihat pada Lampiran 12, halaman 59.
3.6 Skrining Fitokimia
3.6.1 Pemeriksaan alkaloida
Serbuk simplisia ditimbang 0,5 g kemudian ditambahkan 1 ml asam klorida 2 N dan 9 ml air suling, dipanaskan diatas penangas air selama 2 menit, didinginkan dan disaring. Filtrat yang diperoleh dipakai untuk uji alkaloida sebagai berikut:
endapan menggumpal berwarna putih atau putih kekuningan.
b. Filtrat 3 tetes ditambah 2 tetes larutan pereaksi Bouchardat, maka akan terbentuk endapan berwarna coklat.
c. Filtrat 3 tetes ditambah 2 tetes larutan pereaksi Dragendorff, maka akan terbentuk endapan warna merah atau jingga.
Alkaloida disebut positif jika terjadi endapan atau kekeruhan paling sedikit dua dari tiga percobaan diatas (Depkes RI, 1995).
3.6.2 Pemeriksaan flavonoida
Sebanyak 10 g serbuk simplisia ditambahkan 10 ml air panas, dididihkan selama 5 menit dan disaring dalam keadaan panas, ke dalam 5 ml filtrat ditambahkan 0,1 g serbuk magnesium dan 1 ml asam klorida pekat dan 2 ml amil alkohol, dikocok dan dibiarkan memisah. Flavonoida positif jika terjadi warna merah atau kuning atau jingga pada lapisan amil alkohol (Farnsworth, 1966). 3.6.3 Pemeriksaan glikosida
larutan pereaksi Molish, lalu ditambahkan dengan hati-hati 2 ml asam sulfat pekat, terbentuk cincin ungu pada batas kedua cairan (Depkes RI, 1995).
3.6.4 Pemeriksaan tanin
Sebanyak 0,5 g serbuk simplisia disari dengan 10 ml air suling lalu disaring, filtratnya diencerkan dengan air sampai tidak berwarna. Larutan diambil sebanyak 2 ml dan ditambahkan 1-2 tetes pereaksi besi (III) klorida 1 %. Terbentuknya warna biru atau kehitaman menunjukkan adanya tanin (Farnsworth, 1966).
3.6.5 Pemeriksaan saponin
Sebanyak 0,5 g serbuk simplisia dimasukan ke dalam tabung reaksi, lalu ditambahkan 10 ml air panas, dinginkan kemudian dikocok kuat-kuat selama 10 detik. Saponin positif jika terbentuk busa setinggi 1-10 cm yang stabil tidak kurang dari 10 menit dan tidak hilang dengan penambahan 1 tetes asam klorida 2 N (Depkes RI, 1995).
3.6.6 Pemeriksaan steroid/triterpenoid
Sebanyak 1 g serbuk simplisia dimaserasi dengan 20 ml eter selama 2 jam, lalu disaring. Filtrat diuapkan dalam cawan penguap. Sisa pengupan ditambahkan 20 tetes asam asetat anhidrida dan 1 tetes asam sulfat pekat (pereaksi Liebermann-Burchard), diteteskan pada saat akan mereaksikan sampel uji. Terbentuknya warna biru atau biru hijau menunjukkan adanya steroid, sedangkan warna merah, merah muda atau ungu menunjukkan adanya triterpenoid (Harborne, 1987).
3.7 Pembuatan Ekstrak Etanol Kulit Buah Sawo Manila
biarkan sekurang-kurangnya selama 3 jam. Pindahkan massa sedikit demi sedikit ke dalam perkolator sambil tiap kali di tekan hati-hati, tuangi cairan penyari secukupnya sampai cairan mulai menetes dan di atas simplisia masih terdapat selapis cairan penyari, perkolator ditutup dan dibiarkan selama 24 jam. Cairan dibiarkan menetes dengan kecepatan 1 ml tiap menit, cairan penyari ditambahkan berulang-ulang secukupnya hingga selalu terdapat selapis cairan penyari diatas simplisia. Perkolasi dihentikan hingga 500 mg perkolat yang keluar terakhir diuapkan tidak meninggalkan sisa. Perkolat yang diperoleh dipekatkan dengan alat penguap rotary evaporator (Depkes RI, a.2000). Bagan pembuatan ekstrak etanol dapat dilihat pada Lampiran 7, halaman 52.
3.7.1 Pembuatan fraksi-fraksi dari ekstrak etanol
Sebanyak 30 g ekstrak etanol dilarutkan dengan 60 ml etanol dan ditambahkan 150 ml air suling, dimasukkan ke dalam corong pisah, ditambahkan 150 ml n-heksana, dikocok, didiamkan sampai lapisan terpisah, pisahkan, diambil lapisan n-heksana dan diuapkan. Lapisan air ditambahkan 150 ml etilasetat, dikocok, didiamkan sampai lapisan terpisah, pisahkan, diambil lapisan etilasetat, diuapkan, selanjutnya diambil fraksi air dan diuapkan. Masing-masing fraksi di uji aktivitas antibakteri. Bagan pembuatan fraksi dapat dilihat pada Lampiran 7, halaman 53.
3.8 Sterilisasi Alat
3.9 Pembuatan Media
3.9.1 Media nutrient agar (NA)
Komposisi: Lab-Lemco Powder 1 g/L Yeast Extract 2 g/L
Peptone 5 g/L
Sodium Chloride 5 g/L
Agar 15 g/L
Cara pembuatan: Sebanyak 28 g nutrien agar (NA) disuspensikan kedalam air suling 1000 ml, lalu dipanaskan sampai bahan larut sempurna dan disterilkan di dalam autoklaf pada suhu 121oC selama 15 menit (Oxoid, 1982).
3.9.2 Media nutrient broth (NB)
Komposisi: Lab-Lemco Powder 1 g/L Yeast Extract 2 g/L
Peptone 5 g/L
Sodium Chloride 5 g/L
Cara pembuatan : Sebanyak 13 g media nutrient broth (NB) dilarutkan dengan air suling 1000 ml, lalu dipanaskan sampai larut sempurna, kemudian media dimasukkan dalam erlenmeyer steril yang bertutup dan disterilkan dalam autoklaf pada suhu 121oC selama 15 menit (Oxoid, 1982).
3.10 Pembuatan Media Agar Miring
3.11 Pembuatan Stok Kultur
Biakan bakteri Staphylococcus aureus diambil dengan jarum ose steril lalu diinokulasikan pada permukaan media nutrient agar miring dengan cara menggores, kemudian diinkubasi dalam inkubator pada suhu 35 ± 2°C selama 18-24 jam. Prosedur yang sama juga dilakukan pada biakan bakteri Escherichia coli. Bagan pembuatan stok kultur dapat dilihat pada Lampiran 7, halaman 54.
3.12 Penyiapan Inokulum Bakteri
Koloni bakteri Staphylococcus aureus diambil dari stok kultur menggunakan jarum ose steril kemudian disuspensikan ke dalam 10 ml media nutrient broth steril lalu diinkubasikan pada suhu 35 ± 2°C sampai didapat
kekeruhan dengan transmitan 25% menggunakan alat spektrofotometer UV panjang gelombang 580 nm (Ditjen POM, 1995). Prosedur yang sama juga dilakukan untuk koloni bakteri Escherichia coli. Bagan pembuatan inokulum bakteri dapat dilihat pada Lampiran 7, halaman 54.
3.13 Pembuatan Larutan Uji Ekstrak Etanol, Fraksi n-Heksana, Fraksi Etilasetat dan Fraksi Air Kulit Buah Sawo Manila dengan Berbagai Konsentrasi
3.14 Pengujian Aktivitas Antibakteri Secara In Vitro
Sebanyak 0,1 ml inokulum (Staphylococcus aureus) dimasukkan ke dalam cawan petri steril, setelah itu dituang media Nutrient Agar (NA) yang telah dicairkan sebanyak 15 ml dengan suhu 45-50°C dihomogenkan sampai media dan bakteri tercampur rata, kemudian dibiarkan sampai media memadat. Cakram kertas yang telah direndam dengan ekstrak/fraksi dengan berbagai konsentrasi dan pelarut DMSO sebagai blanko diletakkan pada media yang telah padat, kemudian diinkubasi dalam inkubator pada suhu 35 ± 2°C selama 18-24 jam. Diameter daerah hambat di sekitar larutan penguji diukur dengan menggunakan jangka sorong (Ditjen POM, 1995). Prosedur yang sama juga dilakukan terhadap Escherichia coli. Bagan pengujian aktivitas antibakteri dapat dilihat pada
BAB IV
HASIL DAN PEMBAHASAN
4.1 Hasil Identifikasi Tumbuhan
Hasil identifikasi tumbuhan yang dilakukan di Herbarium Bogoriense Bidang Botani Pusat Penelitian dan Pengembangan Biologi–LIPI Bogor, di Cibinong menunjukkan bahwa bahan tumbuhan adalah buah sawo manila, jenis Manilkara zapota (L.) P. Royen, suku Sapotaceae.
4.2 Hasil Karakterisasi Simplisia
4.2.1 Pemeriksaan makroskopik
Hasil pemeriksaan makroskopik morfologi luar kulit buah sawo manila segar yaitu permukaan kulitnya sedikit kasar, panjangnya ± 3 cm dan lebarnya ± 2 cm. Pemeriksaan organoleptis kulit buah sawo manila segar yaitu berwarna coklat muda, rasanya kelat dan agak pahit serta berbau khas. Hasil pemeriksaan makroskopik morfologi luar simplisia kulit buah sawo manila yaitu permukaan kulitnya sedikit kasar, panjangnya ± 2,5 cm dan lebarnya ± 1,5 cm. Pemeriksaan organoleptis simplisia kulit buah sawo manila yaitu kulitnya berwarna coklat tua dan berkeriput, rasanya kelat dan agak pahit serta berbau khas.
4.2.2 Pemeriksaan mikroskopik
Hasil pemeriksaan mikroskopik dari serbuk simplisia kulit buah sawo manila (Manilkara zapota (L.) P. Royen) menunjukkan adanya parenkim berisi sel minyak, serabut sklerenkim dan berkas pembuluh berbentuk spiral.
4.2.3 Hasil pemeriksaan karakteristik serbuk simplisia
pada Tabel 4.1 berikut.
Tabel 4.1. Data karakterisasi serbuk simplisia kulit buah sawo manila
Berdasarkan tabel di atas diperoleh kadar air sebesar 2,31 %. Kadar air yang diperoleh telah memenuhi persyaratan MMI yakni tidak melebihi 10%. Penetapan kadar air pada simplisia dilakukan untuk mengetahui jumlah air yang terkandung dalam simplisia yang digunakan. Kadar air simplisia ditetapkan untuk menjaga kualitas simplisia karena kadar air berkaitan dengan kemungkinan pertumbuhan jamur/kapang (Depkes RI, b.2000).
Hasil karakterisasi kadar sari larut air diperoleh sebesar 64,48 % dan kadar sari larut dalam etanol diperoleh sebesar 59,60 %. Penetapan kadar sari dapat dilihat bahwa kadar sari yang larut dalam air lebih tinggi daripada kadar sari yang larut dalam etanol, hal ini menunjukkan bahwa senyawa yang terlarut dalam air lebih besar daripada senyawa yang terlarut dalam etanol. Senyawa-senyawa yang dapat larut dalam air adalah glikosida, tanin dan flavonoid sedangkan senyawa-senyawa yang dapat larut dalam etanol adalah glikosida, steroid/triterpenoid dan flavonoid (Depkes RI, b.2000).
Hasil karakterisasi kadar abu total diperoleh sebesar 6,32% dan kadar abu yang tidak larut asam diperoleh sebesar 0,49%. Penetapan kadar abu total dilakukan untuk memberikan gambaran kandungan mineral internal dan eksternal dari proses awal sampai terbentuknya ekstrak sedangkan penetapan kadar abu
No. Jenis karakterisasi Kadar (%)
1. Penetapan kadar air 2,31
2. Penetapan kadar sari larut air 64,48
3. Penetapan kadar sari larut etanol 59,60
4. Penetapan kadar abu 6,32
tidak larut dalam asam dilakukan untuk mengetahui kadar senyawa yang tidak larut dalam asam, misalnya silika dan pasir (Depkes RI, b.2000).
4.3 Hasil Skrining Fitokimia
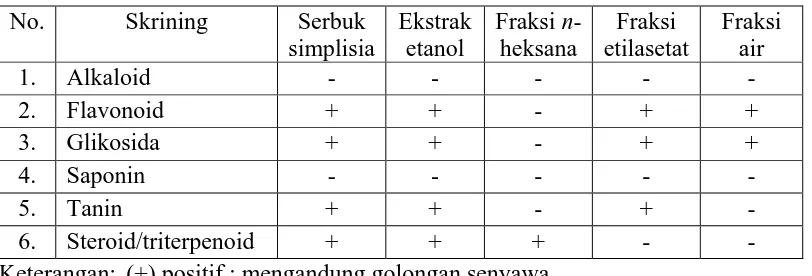
Hasil skrining fitokimia terhadap simplisia, ekstrak etanol, fraksi n-heksana, fraksi etilasetat dan fraksi air kulit buah sawo manila (Manilkara zapota (L.) P. Royen) dapat dilihat pada Tabel 4.2 sebagai berikut.
Tabel 4.2 Hasil skrining fitokimia kulit buah sawo manila No. Skrining Serbuk
Keterangan: (+) positif : mengandung golongan senyawa (-) negatif : tidak mengandung golongan senyawa
cairan hal ini menunjukkan adanya glikosida. Penambahan serbuk Mg, asam klorida pekat dan amil alkohol kemudian dibiarkan memisah memberikan warna kuning jingga hal ini menunjukkan adanya senyawa flavonoid. Penambahan FeCl3 1% memberikan warna hijau kebiruan yang menunjukkan adanya senyawa tanin. Fraksi air yang ditambahkan pereaksi Molish dan asam sulfat pekat, terbentuk cincin berwarna ungu pada batas cairan hal ini menunjukkan adanya glikosida. Penambahan serbuk Mg, asam klorida pekat dan amil alkohol kemudian dibiarkan memisah memberikan warna kuning jingga hal ini menunjukkan adanya senyawa flavonoid.
4.4 Hasil Ekstraksi Kulit Buah Sawo Manila
Hasil perkolasi 300 g serbuk kulit buah sawo manila (Manilkara zapota (L.) P. Royen) dengan pelarut etanol 96% yaitu sebanyak 85 g, kemudian dilakukan fraksinasi dari 30 g ekstrak etanol diperoleh hasil fraksi n-heksana 0,78 g, fraksi etilasetat 0,92 g dan fraksi air 24,47 g.
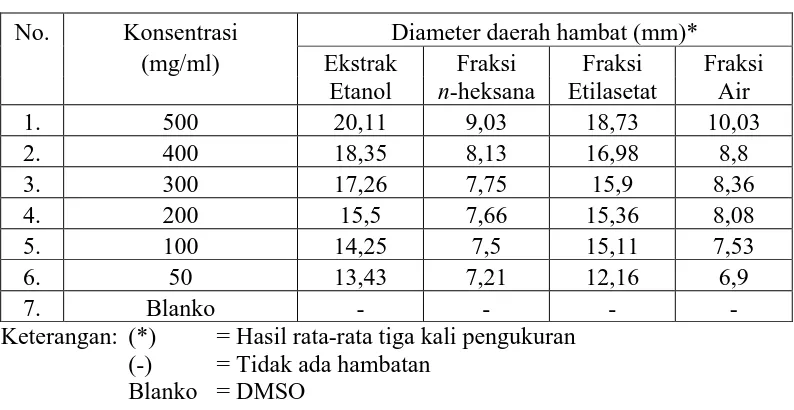
4.5 Hasil Uji Aktivitas Antibakteri Ekstrak Etanol, Fraksi n-Heksana, Fraksi Etilasetat dan Fraksi Air Kulit Buah Sawo Manila terhadap Bakteri Staphylococcus aureus dan Escherichia coli
Escherichia coli dapat dilihat pada Tabel 4.3 dan Tabel 4.4 berikut.
Tabel 4.3 Hasil pengukuran diameter daerah hambatan pertumbuhan bakteri Staphylococcus aureus
No. Konsentrasi Diameter daerah hambat (mm)*
(mg/ml) Ekstrak Fraksi Fraksi Fraksi
Tabel 4.4 Hasil pengukuran diameter daerah hambatan pertumbuhan bakteri Escherichia coli
No. Konsentrasi Diameter daerah hambat (mm)*
(mg/ml) Ekstrak Fraksi Fraksi Fraksi
Keterangan: (*) = Hasil rata-rata tiga kali pengukuran (-) = Tidak ada hambatan
Blanko = DMSO
Berdasarkan Farmakope Indonesia (1995), batas daerah hambatan yang efektif adalah dengan diameter lebih kurang dari 14 mm sampai 16 mm. Tabel 4.3 dan 4.4 di atas menunjukkan bahwa ekstrak etanol memberikan diameter daerah hambat yang efektif terhadap Staphylococcus aureus yang diperoleh pada konsentrasi 50 mg/ml dengan diameter daerah hambat 14,41 mm sedangkan pada Escherichia coli diameter daerah hambat yang efektif pada konsentrasi 100 mg/ml
mg/ml dengan diameter daerah hambat 15,48 mm sedangkan pada Escherichia coli diameter daerah hambat yang efektif pada konsentrasi 100 mg/ml dengan
diameter 15,11 mm. Fraksi air memberikan diameter daerah hambat yang efektif terhadap bakteri Staphylococcus aureus pada konsentrasi 200 mg/ml dengan diameter daerah hambat 15,01 mm sedangkan pada Escherichia coli memberikan diameter daerah hambat yang kurang efektif yang diperoleh pada konsentrasi 500 mg/ml dengan diameter 10,03 mm. Fraksi n-heksana memberikan diameter daerah hambat yang efektif pada Staphylococcus aureus yang diperoleh pada konsentrasi 400 mg/ml dengan diameter daerah hambat 14,76 mm sedangkan pada Escherichia coli memberikan diameter daerah hambat yang kurang efektif yang
diperoleh pada konsentrasi 500 mg/ml dengan diameter 9,03 mm.
Aktivitas antibakteri yang didapatkan dari ekstrak etanol merupakan aktivitas antibakteri terkuat dalam menghambat pertumbuhan bakteri Staphylococcus aureus dan Escherichia coli karena kandungan senyawa metabolit
sekunder yang terdapat dalam ekstrak etanol kulit buah sawo manila adalah golongan senyawa yang memiliki aktivitas antibakteri yang kuat yaitu flavonoid, glikosida, tanin dan steroid/triterpenoid.
Hasil penelitian menunjukkan bahwa pada bakteri Staphylococcus aureus memberikan diameter hambat lebih besar dibandingkan dengan bakteri Escherichia coli. Menurut Volk (1992), perbedaan diameter daerah hambat pada
bakteri gram positif dengan bakteri gram negatif tersebut terjadi karena kedua bakteri uji tersebut memilki komposisi dan struktur dinding sel yang berbeda sehingga mengakibatkan bakteri gram positif lebih rentan terhadap senyawa-senyawa kimia dibandingkan gram negatif. Struktur dinding sel bakteri gram positif lebih sederhana, yaitu berlapis tunggal dengan kandungan lipid yang rendah (1 - 4%) sehingga memudahkan bahan bioaktif masuk ke dalam sel. Struktur dinding sel bakteri gram negatif lebih kompleks, yaitu berlapis tiga terdiri dari lapisan luar lipoprotein, lapisan tengah lipopolisakarida yang berperan sebagai penghalang masuknya bahan bioaktif antibakteri dan lapisan dalam berupa peptidoglikan dengan kandungan lipid tinggi (11 - 12%).
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
a. Hasil pemeriksaan makroskopik morfologi luar kulit buah sawo manila segar yaitu permukaan kulitnya sedikit kasar, panjangnya ± 3 cm dan lebarnya ± 2 cm. Pemeriksaan organoleptis kulit buah sawo manila segar yaitu berwarna coklat muda, rasanya kelat dan agak pahit serta berbau khas. Hasil pemeriksaan makroskopik morfologi luar simplisia kulit buah sawo manila yaitu permukaan kulitnya sedikit kasar, panjangnya ± 2,5 cm dan lebarnya ± 1,5 cm. Pemeriksaan organoleptis simplisia kulit buah sawo manila yaitu kulitnya berwarna coklat tua dan berkeriput, rasanya kelat dan agak pahit serta berbau khas. Hasil pemeriksaan mikroskopik serbuk simplisia kulit buah sawo manila memperlihatkan adanya parenkim berisi sel minyak, serabut sklerenkim dan berkas pembuluh berbentuk spiral. Hasil karakterisasi simplisia diperoleh kadar air sebesar 2,31%, kadar sari larut air sebesar 64,48%, kadar sari larut etanol sebesar 59,60%, kadar abu total sebesar 6,32% dan kadar abu yang tidak larut asam sebesar 0,49%.
b. Hasil skrining fitokimia menunjukkan bahwa simplisia dan ekstrak etanol kulit buah sawo manila mengandung golongan senyawa kimia flavonoid, glikosida, tanin dan steroid/triterpenoid; fraksi n-heksana mengandung senyawa steroid/triterpenoid; fraksi etilasetat mengandung senyawa flavonoid, glikosida dan tanin; fraksi air mengandung senyawa flavonoid dan glikosida.
5.2 Saran
BAB II
TINJAUAN PUSTAKA
2.1 Uraian Tumbuhan
Uraian tumbuhan meliputi morfologi tumbuhan, habitat, sistematika tumbuhan, sinonim, nama asing, nama daerah, khasiat tumbuhan dan kandungan senyawa kimia.
2.1.1 Morfologi tumbuhan
tunggang (Sunarjono, 2013). 2.1.2 Habitat
Tumbuhan sawo merupakan tumbuhan endemis di kawasan tropis benua Amerika, tepatnya di Meksiko hingga Guatemala, Salvador dan Honduras Utara. Dewasa ini tanaman sawo sudah menyebar luas di seluruh kawasan tropis. Sentra produksi buah sawo yang terkenal di Indonesia antara lain di Ciamis, Bekasi, Wonogiri, Boyolali, Banyuwangi, Trenggalek, Blitar, Bantul, Sleman, Buleleng dan Jembrana (Ashari, 2006).
2.1.3 Sistematika tumbuhan
Menurut Tjitrosoepomo (2000), sistematika tumbuhan sawo manila diklasifikasikan sebagai berikut :
Divisi : Spermatophyta Sub-divisi : Angiospermae Kelas : Dicotyledoneae Bangsa : Ebenales
Suku : Sapotaceae Genus : Manilkara
Spesies : Manilkara zapota (L.) P. Royen 2.1.4 Sinonim
Sinonim dari sawo manila adalah Achras zapota L. (Duke, 1929). 2.1.5 Nama asing
2.1.6 Nama daerah
Nama daerah, Sumatera: sawo ciku; Sunda: sawo manila; Jawa: sawo londo, sawo menilo, sawo manila; Madura: sabu manela; Bali: sabo jawa (Heyne, 1987).
2.1.7 Khasiat tumbuhan
Sawo manila berkhasiat untuk menguatkan tulang, menjaga kulit tetap sehat, obat sembelit, menghambat diare serta obat penyakit tipus (Kariman, 2014; Mustary, dkk., 2011).
2.1.8 Kandungan senyawa kimia
Kandungan yang terdapat dalam sawo manila adalah flavonoid, saponin, tanin, natrium, kalium, kalsium, magnesium, fosfor dan vitamin C (Kariman, 2014; Widyaningrum, 2011).
2.2 Ekstraksi
Ekstraksi merupakan penarikan senyawa kimia dari jaringan tumbuhan ataupun hewan dengan menggunakan penyari tertentu. Cara ekstraksi yang tepat tergantung pada bahan tumbuhan yang diekstraksi dan jenis senyawa yang diisolasi (Ditjen POM, 1995). Ekstrak adalah sediaan pekat yang diperoleh dengan mengekstraksi zat aktif dari simplisia nabati atau hewani menggunakan pelarut yang sesuai, kemudian semua atau hampir semua pelarut diuapkan dan massa atau serbuk yang tersisa diperlakukan sedemikian rupa hingga memenuhi baku yang telah ditetapkan (Ditjen POM, b.2000).
Ada beberapa metode ekstraksi dengan menggunakan pelarut (Depkes RI, b.
a. Maserasi adalah proses penyarian simplisia dengan menggunakan pelarut dengan beberapa kali pengocokan atau pengadukan yang dilakukan pada temperatur kamar.
b. Perkolasi adalah ekstraksi dengan pelarut yang selalu baru, umumnya dilakukan pada temperatur ruangan. Prosesnya terdiri dari pengembangan bahan, tahapan maserasi antara, tahap perkolasi sebenarnya (penetesan/penampungan ekstrak) terus menerus sampai diperoleh ekstrak (perkolat) yang tidak meninggalkan sisa bila 500 mg perkolat terakhir
diuapkan pada suhu ± 50ºC. 2. Cara panas
a. Refluks adalah ekstraksi dengan pelarut pada temperatur titik didihnya, selama waktu tertentu dan jumlah pelarut terbatas yang relatif konstan dengan adanya pendingin balik.
b. Sokletasi adalah ekstraksi menggunakan pelarut yang selalu baru yang umumnya dilakukan dengan alat khusus sehingga terjadi ekstrak kontinu dengan jumlah pelarut relatif konstan dengan adanya pendingin balik.
c. Digesti adalah maserasi kinetik (dengan pengadukan kontinu) pada temperatur yang lebih tinggi dari temperatur kamar, yaitu secara umum dilakukan pada temperatur 40-50ºC.
d. Infundasi adalah ekstraksi dengan pelarut air pada temperatur penangas air (bejana infus tercelup dalam penangas air mendidih, temperatur terukur 96-98ºC) selama waktu tertentu (15-20 menit).
2.3 Fraksinasi
Ekstraksi cair-cair merupakan suatu teknik yang mana suatu larutan dibuat bersentuhan (biasanya dalam air) dengan suatu pelarut kedua (biasanya pelarut organik), yang tidak tercampurkan, pada proses ini terjadi pemindahan satu atau lebih zat terlarut (solute) kedalam pelarut yang kedua (Basset, dkk., 1994).
Pemisahan yang dapat dilakukan bersifat sederhana, bersih, cepat dan mudah, yang dapat dilakukan dengan cara mengocok-ngocok dalam sebuah corong pisah selama beberapa menit (Basset, dkk., 1994). Analit-analit yang mudah terekstraksi dalam pelarut organik adalah molekul-molekul netral yang berikatan secara kovalen dengan substituen yang bersifat nonpolar atau agak polar. Senyawa-senyawa yang mudah mengalami ionisasi dan senyawa polar lainnya akan tertahan dalam fase air (Rohman, 2007).
Pelarut yang dipilih untuk ekstraksi pelarut ialah pelarut yang mempunyai kelarutan yang rendah dalam air, dapat menguap sehingga memudahkan penghilangan pelarut organik setelah dilakukan ekstraksi dan mempunyai kemurnian yang tinggi untuk meminimalkan adanya kontaminasi sampel (Rohman, 2007).
2.4 Sterilisasi
Sterilisasi berarti membebaskan tiap benda atau substansi dari semua kehidupan dalam bentuk apapun, tujuannya untuk mendapatkan keadaan yang steril. Sterilisasi dapat dilakukan dengan tiga cara, yaitu: a) Sterilisasi pemanasan basah dengan menggunakan uap atau air panas, b) Sterilisasi kering dalam tanur, dan c) Pembakaran total (incineration) (Irianto, 2006).
I. Sterilisasi kering a. Pemijaran
Pemijaran digunakan untuk sterilisasi pada ose, ujung-ujung pinset dan sudip (spatula) logam.
b. Jilatan api (Flaming)
Jilatan api digunakan untuk sterilisasi pada skalpel, jarum, mulut tabung biakan, kaca objek, dan kaca penutup. Benda-benda tersebut dijilatkan pada api bunsen tanpa membiarkannya memijar.
c. Tanur uap panas (Hot-Air Oven)
Sebagian besar sterilisasi kering dilakukan dengan alat ini. Biasanya digunakan suhu 160-165ºC selama 1 jam. Cara ini baik dilakukan terhadap alat-alat kering yang terbuat dari kaca, seperti tabung reaksi, cawan petri, labu, pipet, pinset, skalpel, gunting, kapas hapus tenggorok dan alat suntik dari kaca. Sterilisasi ini juga dapat dilakukan pada suhu 170ºC selama 2 jam.
II.Sterilisasi basah
a. Perebusan dalam air
Cara ini hanya cukup untuk mematikan mikroorganisme yang tidak berspora.
b. Uap dalam tekanan
2.5 Bakteri
Nama bakteri berasal dari kata “bacterion” (bahasa Yunani) yang berarti tongkat atau batang. Sekarang nama itu dipakai untuk menyebut sekelompok mikroorganisme yang bersel satu, berkembangbiak dengan pembelahan diri, serta demikian kecilnya sehingga hanya tampak dengan mikroskop (Dwidjoseputro, 1994).
Bakteri adalah sel prokariotik dan uniseluler. Sel-selnya secara khas berbentuk bola, batang atau spiral. Bakteri yang khas berdiameter sekitar 0,5 – 1,0 µm dan panjangnya 1,5 – 2,5 µm (Irianto, 2013).
Berdasarkan proses pewarnaan gram, bakteri dibagi menjadi dua golongan yaitu bakteri gram positif dan bakteri gram negatif. Bakteri gram positif menyerap zat warna pertama yaitu kristal violet yang menyebabkan warna ungu, sedangkan bakteri gram negatif menyerap zat warna kedua yaitu safranin dan menyebabkannya berwarna merah. Perbedaan hasil dalam pewarnaan gram disebabkan perbedaan struktur, terutama dinding sel kedua bakteri tersebut (Waluyo, 2010).
Menurut Volk (1992), struktur dinding sel bakteri gram positif lebih sederhana, yaitu berlapis tunggal dengan kandungan lipid yang rendah (1 -4%) sehingga memudahkan bahan bioaktif masuk ke dalam sel. Struktur dinding sel bakteri gram negatif lebih kompleks, yaitu berlapis tiga terdiri dari lapisan luar lipoprotein, lapisan tengah lipopolisakarida yang berperan sebagai penghalang masuknya bahan bioaktif antibakteri dan lapisan dalam berupa peptidoglikan dengan kandungan lipid tinggi (11 - 12%).
2.5.1 Staphylococcus aureus
Berikut sistematika Staphylococcus aureus (Staf Pengajar FK UI, 1994): Divisi : Protophyta
Kelas : Schizomycetes Ordo : Eubacteriales Famili : Micrococcaceae Genus : Staphylococcus Spesies : Staphylococcus aureus
Staphylococcus berasal dari kata staphyle yang berarti kelompok buah anggur dan kokus yang berarti bulat. Bakteri ini sering ditemukan sebagai bakteri flora normal kulit dan selaput lendir pada manusia yang dapat menjadi penyebab infeksi baik pada manusia maupun pada hewan. Staphylococcus aureus merupakan bakteri gram positif yang berbentuk bulat dan merupakan patogen utama pada manusia (Jawetz, et al., 2007). Beberapa jenis bakteri ini dapat membuat enterotoksin yang dapat menyebabkan keracunan makanan. infeksi lokal pada kulit, hidung, uretra, saluran pernafasan dan saluran pencernaan (Harris, et al., 2002; Staf Pengajar FK UI, 1994). Diameter bakteri ini antara 0,8-1,0 mikron. Bakteri ini berbentuk speris, tidak bergerak, tidak berspora, tumbuh dengan baik pada temperatur 37ºC dan bersifat anaerob fakultatif (Staf Pengajar FK UI, 1994). 2.5.2 Escherichia coli
Bakteri ini berbentuk batang pendek (kokobasil), mempunyai alat gerak flagela tipe peritrik (flagela yang terdapat diseluruh permukaan sel), ukuran 0,4-0,7 µm × 1,4 µm dan tumbuh dengan baik pada hampir semua media yang dipakai di laboratorium mikrobiologi (Staf Pengajar FK UI, 1994).
Divisi : Protophyta Kelas : Schizomycetes Ordo : Enterobacteriales Famili : Enterobacteriaceae Genus : Escherichia
Spesies : Escherichia coli
Escherichia coli adalah bakteri gram negatif, merupakan flora normal dan
banyak ditemukan pada usus manusia tetapi dapat menyebabkan gangguan pencernaan seperti diare (Pratiwi, 2008; Sundararaj, et al., 2004).
2.5.3 Morfologi sel bakteri
Ada beberapa bentuk dasar sel bakteri menurut Pratiwi (2008), yaitu : a. Bentuk bulat (cocci)
Bakteri berbentuk bulat dapat dibedakan atas beberapa jenis, antara lain diplococci (sel yang berpasangan atau dua sel), streptococci (rangkaian sel yang membentuk rantai panjang atau pendek), tetrad (empat sel bulat yang membentuk persegi empat), staphylococci (kumpulan sel yang menyerupai buah anggur) dan sarcina (kumpulan sel berbentuk kubus yang terdiri dari 8 sel atau lebih).
b. Bentuk bacilli
Sebagian besar bacilli tampak sebagai batang tunggal. Terbagi dalam dua bentuk yaitu diplobacilli (berpasangan) dan streptobacilli (membentuk rantai). d. Bentuk spiral
2.5.4 Fase pertumbuhan mikroorganisme
Fase pertumbuhan mikroorganisme menurut Pratiwi (2008), terbagi menjadi empat macam fase, yaitu :
I. Fase lag (fase adaptasi), merupakan fase penyesuaian mikroorganisme pada suatu lingkungan baru. Ciri fase lag adalah tidak adanya peningkatan jumlah sel, yang ada hanyalah peningkatan ukuran sel. Lama fase lag tergantung pada kondisi dan jumlah awal mikroorganisme dan media pertumbuhan.
II. Fase log (fase eksponensial), merupakan fase dimana mikroorganisme tumbuh dan membelah pada kecepatan maksimum, tergantung pada genetika mikroorganisme, sifat media dan kondisi pertumbuhan. Sel baru terbentuk dengan laju konstan dan massa yang bertambah secara eksponensial.
III.Fase stasioner, merupakan fase dimana pertumbuhan mikroorganisme berhenti dan terjadi keseimbangan antara jumlah sel yang membelah dengan jumlah sel yang mati.
IV.Fase kematian, merupakan fase dimana jumlah sel yang mati meningkat. Faktor penyebabnya adalah ketidaktersediaan nutrisi dan akumulasi produk buangan yang toksik.
2.6 Uji Aktivitas Antibakteri
Beberapa bahan antimikrobial tidak bersifat membunuh, tetapi hanya dapat menghambat pertumbuhan mikroorganisme. Bahan antimikrobial dapat bersifat menghambat (bakteriostatik) apabila digunakan dalam konsentrasi kecil, namun bila digunakan dalam konsentrasi tinggi dapat mematikan mikroorganisme (bakterisid) (Lay, 1994).
(KHM) yaitu konsentrasi terendah bahan antimikrobial yang menghambat pertumbuhan dan Konsentrasi Bunuh Minimum (KBM) bahan antimikrobial terhadap mikroorganisme. KHM didefinisikan sebagai konsentrasi terendah bahan antimikrobial yang menghambat pertumbuhan, sedangkan KBM adalah konsentrasi terendah bahan antimikrobial yang mematikan (Lay, 1994).
Aktivitas potensi antibakteri dapat ditunjukkan pada kondisi yang sesuai dengan efek daya hambatnya terhadap bakteri. Ada dua metode umum yang dapat digunakan yaitu metode difusi dan metode dilusi (Pratiwi, 2008).
Ada beberapa metode yang digunakan untuk uji aktivitas antimikroba, antara lain:
a. Metode dilusi
digunakan untuk menguji beberapa mikroba uji (Pratiwi, 2008). b. Metode difusi
BAB I
PENDAHULUAN
1. Latar Belakang
Indonesia menyimpan keragaman tumbuhan yang mengandung zat aktif sehingga tumbuhan tersebut dapat digunakan sebagai obat (Putra, 2015). Tumbuhan merupakan keragaman hayati yang selalu ada di sekitar kita baik itu yang tumbuh secara liar maupun yang sengaja dibudidayakan. Sejak zaman dahulu, tumbuhan sudah digunakan sebagai tanaman obat walaupun penggunaannya disebarkan secara turun-temurun maupun dari mulut ke mulut. Tumbuhan secara fungsional tidak lagi dipandang sebagai bahan konsumsi maupun penghias saja tetapi juga sebagai tumbuhan obat yang multifungsi (Widyaningrum, 2011). Salah satu tumbuhan obat yang sering digunakan adalah sawo manila (Mustary, dkk., 2011).
Tumbuhan sawo merupakan tumbuhan endemis di kawasan tropis benua Amerika, tepatnya di Meksiko hingga Guatemala, Salvador dan Honduras Utara. Dewasa ini tanaman sawo sudah menyebar luas di seluruh kawasan tropis. Sentra produksi buah sawo yang terkenal di Indonesia antara lain di Ciamis, Bekasi, Wonogiri, Boyolali, Banyuwangi, Trenggalek, Blitar, Bantul, Sleman, Buleleng dan Jembrana. Sebagian jenis yang dibudidayakan adalah sawo apel dan sawo manila (Ashari, 2006).
pahit disebabkan tingginya kandungan tanin, sehingga daya antibakteri buah sawo yang masih muda lebih tinggi dari pada buah sawo yang sudah tua. Tanin mempunyai rasa sepat pada tumbuhan dan berfungsi sebagai pelindung bagi tanaman. Sawo merupakan salah satu jenis tanaman buah yang sudah lama dikenal dan ditanam di Indonesia. Sawo dijadikan sebagai alternatif obat-obatan herbal. Berdasarkan wawancara dengan salah satu penduduk Kabupaten Natuna, didapatkan informasi bahwa masyarakat tersebut telah menggunakan buah sawo manila muda sebagai alternatif pengobatan dalam kehidupan sehari-hari karena mereka lebih memilih pengobatan secara alami. Masyarakat kota Pontianak juga menggunakan buah sawo manila muda sebagai obat sakit perut dikarenakan diare (Ningrum, dkk., 2012). Buah sawo juga dapat digunakan sebagai obat penyakit tipus (Mustary, dkk., 2011). Buah sawo manila muda digunakan untuk mengobati diare dengan meminum sarinya yaitu dengan cara direbus maupun dengan cara diiris, ditumbuk, diperas kemudian disaring dan di ambil sarinya (Ningrum, dkk., 2012).
Antibakteri adalah senyawa yang dapat mengganggu pertumbuhan dan metabolisme bakteri, sehingga senyawa tersebut dapat menghambat pertumbuhan (bakteriostatik) atau bahkan membunuh bakteri (bakterisid) (Pelczar dan Chan, 1988). Beberapa bakteri penyebab diare adalah Staphylococcus aureus, Escherichia coli, Vibrio cholerae, Clostridium perfringens, Shigella dysenteriae
dan Salmonella thypi (Alcamo, 1983 ; Staf Pengajar FK UI, 1994). Staphylococcus aureus merupakan bakteri gram positif yang berbentuk bulat dan
uretra, saluran pernafasan dan saluran pencernaan (Harris, et al., 2002). Escherichia coli adalah bakteri gram negatif, merupakan flora normal dan banyak
ditemukan pada usus manusia tetapi dapat menyebabkan gangguan pencernaan seperti diare (Pratiwi, 2008; Sundararaj, et al., 2004).
Penelitian sebelumnya telah melakukan uji antibakteri ekstrak daun sawo (Manilkara zapota) terhadap bakteri Staphylococcus aureus dan Escherichia coli dengan menggunakan metode difusi cakram. Hasil pengujian menunjukkan bahwa ekstrak daun sawo memiliki aktivitas sebagai anti bakteri. Ekstrak etanol daun sawo menunjukkan daya hambat yang lebih tinggi dibandingkan dengan pelarut air dan metanol (Simanullang, 2013).
Menurut Juwita (2013), ekstrak buah muda, daun dan kulit batang sawo manila (Manilkara zapota (L.) P. Royen memiliki aktivitas antibakteri terhadap Vibrio cholerae dan Clostridium perfringens. Hasil pengujian menunjukkan
bahwa kulit batang sawo manila merupakan sumber zat antibakteri yang memiliki aktivitas antibakteri paling baik dalam menghambat pertumbuhan bakteri uji yaitu Clostridiium perfringens dan Vibrio cholerae dimana pada konsentrasi 60 mg/ml
tidak terdapat bakteri yang tumbuh. Ningrum, dkk., (2012) juga telah melakukan Uji Daya Antibakteri Ekstrak Sawo Manila Terhadap E.coli dan Implemantasinya dalam Pembelajaran Peranan Bakteri dimana menunjukkan konsentrasi efektif untuk ekstrak buah sawo manila adalah pada konsentrasi 75%.
aureus dan Escherichia coli menggunakan metode difusi agar dengan cakram
kertas.
1.2 Perumusan Masalah
Berdasarkan latar belakang di atas, maka dapat dirumuskan masalah sebagai berikut :
a. apakah karakteristik simplisia kulit buah sawo manila memenuhi persyaratan mutu simplisia?
b. apakah golongan senyawa kimia yang terdapat di dalam kulit buah sawo manila?
c. apakah ekstrak etanol, fraksi n-heksana, fraksi etilasetat dan fraksi air kulit buah sawo manilamemiliki aktivitas antibakteri terhadap bakteri Staphylococcus aureus dan Escherichia coli?
1.3 Hipotesis
Berdasarkan perumusan masalah di atas, maka hipotesis pada penelitian ini adalah :
a. karakteristik simplisia kulit buah sawo manila memenuhi persyaratan mutu simplisia.
b. golongan senyawa kimia yang terdapat di dalam kulit buah sawo manila adalah glikosida, tanin, flavonoid dan steroid/triterpenoid.
1.4 Tujuan Penelitian
Tujuan dari penelitian ini adalah :
a. untuk mengetahui karakteristik simplisia kulit buah sawo manila.
b. untuk mengetahui golongan senyawa kimia yang terdapat di dalam kulit buah sawo manila.
c. untuk mengetahui aktivitas antibakteri ekstrak etanol, fraksi n-heksana, fraksi etilasetat dan fraksi air kulit buah sawo manila terhadap bakteri Staphylococcus aureus dan Escherichia coli.
1.5 Manfaat Penelitian
1.6 Kerangka Pikir Penelitian
Kerangka pikir dari penelitian ini dapat dilihat pada Gambar 1.1 berikut:
Gambar 1.1 Bagan kerangka pikir penelitian Ekstrak etanol,
-Kadar sari yang larut dalam air
UJI AKTIVITAS ANTIBAKTERI EKSTRAK ETANOL DAN FRAKSI KULIT BUAH SAWO MANILA (Manilkara zapota (L.) P. Royen)
TERHADAP BAKTERI Staphylococcus aureus DAN Escherichia coli
ABSTRAK
Sawo merupakan salah satu jenis tanaman buah yang sudah lama dikenal dan ditanam di Indonesia. Pemanfaatan bagian dari tanaman seperti akar, batang, daun, kulit dan buah dapat digunakan sebagai obat. Sawo manila berkhasiat untuk obat sembelit serta menghambat diare. Kandungan yang terdapat dalam buah sawo manila meliputi flavonoid, saponin dan tanin. Tujuan penelitian ini adalah untuk mengetahui karakteristik simplisia, kandungan senyawa kimia dan uji aktivitas antibakteri dari kulit buah sawo manila (Manilkara zapota (L.) P. Royen).
Pemeriksaan karakteristik simplisia meliputi pemeriksaan makroskopik, mikroskopik, penetapan kadar air, penetapan kadar sari larut air, penetapan kadar sari larut etanol, penetapan kadar abu total dan penetapan kadar abu tidak larut asam. Skrining fitokimia meliputi pemeriksaan golongan senyawa alkaloid, flavonoid, glikosida, saponin, tanin dan steroid/triterpenoid. Ekstraksi dilakukan secara perkolasi dan fraksinasi dilakukan secara ekstraksi cair-cair. Uji aktivitas antibakteri terhadap bakteri Staphylococcus aureus dan Escherichia coli dilakukan dengan metode difusi agar menggunakan cakram kertas.
Hasil yang diperoleh dari pemeriksaan karakteristik simplisia adalah kadar air 2,31%, kadar sari larut air 64,48%, kadar sari larut etanol 59,60%, kadar abu total 6,32%, kadar abu tidak larut asam 0,49%. Hasil skrining fitokimia serbuk simplisia mengandung golongan senyawa flavonoid, glikosida, tanin dan steroid/triterpenoid. Hasil uji aktivitas antibakteri menunjukkan bahwa ekstrak etanol dan fraksi etilasetat memberikan diameter daerah hambat yang efektif terhadap Staphylococcus aureus dan Escherichia coli sedangkan fraksi air dan fraksi n-heksana hanya memberikan diameter daerah hambat yang efektif terhadap Staphylococcus aureus.
ANTIBACTERIAL ACTIVITY TEST OF ETHANOL EXTRACTS AND FRACTION OF MANILA SAPODILLA PERICARPIUM
FRUIT (Manilkara zapota (L.) P. Royen) AGAINST
Staphylococcus aureus AND Escherichia coli
ABSTRACT
Sapodilla is a kind of plants which has been known for a long time in Indonesia. The process of part of plants like root, rod, leaf, pericarpium and fruit can be used as medicine. Manila sapodilla can be used as constipation drugs and diarrhea drugs. The content of sapodilla are contained flavonoid, saponin and tanin. The purpose of this research was to know about simplex characterization, chemical constituents and antibacterial activity test of manila sapodilla pericarpium fruit (Manilkara zapota (L) P. Royen).
Simplex characterization including level of water content, level of water-soluble extract, level of ethanol-water-soluble extract, level of total ash, and level of ash not soluble in acid. Phytochemical screening including determination alkaloid, flavonoid, glycoside, saponin, tanin and steroid/triterpenoid. The simplex extracted by percolation and fractination used liquid-liquid extraction. Test of antibacterial activity against Staphylococcus aureus and Escherichia coli by agar diffusion method using paper disk.
The results of simplex characterization were obtained level of water content 2.31%, level of water-soluble extract 64.48%, level of ethanol-soluble extract 59.60%, level of total ash 6.32% and level of ash not soluble in acid 0.49%. The results of phytochemical screening from simplex contains flavonoid, glycoside, tanin and steroid/triterpenoid. The results of antibacterial activity of ethanol extract and ethylacetate fraction were gave effective inhibitory against Staphylococcus aureus and Escherichia coli while water fraction and n-hexane fraction only effective inhibitory for Staphylococcus aureus.
UJI AKTIVITAS ANTIBAKTERI EKSTRAK ETANOL
DAN FRAKSI KULIT BUAH SAWO MANILA
(Manilkara zapota (L.) P. Royen) TERHADAP
BAKTERI Staphylococcus aureus
DAN Escherichia coli
SKRIPSI
Diajukan sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH:
RIZKY WIDYA PRATIWI
NIM 111501154
PROGRAM STUDI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
UJI AKTIVITAS ANTIBAKTERI EKSTRAK ETANOL
DAN FRAKSI KULIT BUAH SAWO MANILA
(Manilkara zapota (L.) P. Royen) TERHADAP
BAKTERI Staphylococcus aureus
DAN Escherichia coli
SKRIPSI
Diajukan sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH:
RIZKY WIDYA PRATIWI
NIM 111501154
PROGRAM STUDI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
PENGESAHAN SKRIPSI
UJI AKTIVITAS ANTIBAKTERI EKSTRAK ETANOL
DAN FRAKSI KULIT BUAH SAWO MANILA
(Manilkara zapota (L.) P. Royen) TERHADAP
BAKTERI Staphylococcus aureus
DAN Escherichia coli
OLEH:
RIZKY WIDYA PRATIWI
NIM 111501154
Dipertahankan di Hadapan Panitia Penguji Skripsi Fakultas Farmasi Universitas Sumatera Utara
Pada Tanggal : 25 November 2015
Disetujui Oleh: Pembimbing I,
Drs. Suryadi Achmad, M. Sc., Apt. NIP 195109081985031002
Panitia Penguji,
Dr. Marline Nainggolan, M.S., Apt. NIP 195709091985112001
Drs. Suryadi Achmad, M. Sc., Apt.
KATA PENGANTAR
Puji syukur kehadirat Allah SWT atas segala limpahan rahmat serta karunia-Nya sehingga penulis dapat menyelesaikan penelitian dan penyusunan skripsi yang berjudul “Uji Aktivitas Antibakteri Ekstrak Etanol dan Fraksi Kulit Buah Sawo Manila (Manilkara zapota (L.) P. Royen) Terhadap Bakteri Staphylococcus aureus dan Escherichia coli”. Skripsi ini diajukan untuk melengkapi salah satu
syarat untuk memperoleh gelar Sarjana Farmasi di Fakultas Farmasi Universitas Sumatera Utara.
Pada kesempatan ini dengan kerendahan hati penulis mengucapkan terima kasih yang sebesar-besarnya kepada Ibu Dr. Masfria, M. S., Apt., selaku Pejabat Dekan Fakultas Farmasi Universitas Sumatera Utara, Ibu Prof. Dr. Julia Reveny, M. Si., Apt., selaku Wakil Dekan I Fakultas Farmasi Universitas Sumatera Utara, Bapak Drs. Suryadi Achmad, M. Sc., Apt. dan Ibu Dra. Erly Sitompul, M. Si., Apt., selaku dosen pembimbing, Ibu Dr. Marline Nainggolan, M.S., Apt., Bapak Dr. Panal Sitorus, M. Si., Apt. dan Ibu Dra dosen penguji, yang telah menyediakan fasilitas, memberikan kritik, saran dan arahan untuk menyempurnakan skripsi ini. Bapak dan Ibu staf pengajar Fakultas Farmasi yang telah mendidik selama perkuliahan, serta Ibu Sri Yuliasmi, S. Farm., M. Si., Apt. selaku penasehat akademik yang membimbing penulis selama masa perkuliahan hingga selesai.
yang tidak pernah berhenti. Abangda tercinta Iip Citomanyu, S. Kom, adinda tercinta Rifky Abimanyu dan Baihaqy Anggitomanyu serta seluruh keluarga yang selalu mendoakan dan memberikan semangat hingga selesainya penulisan skripsi ini.
Penulis menyadari sepenuhnya bahwa dalam penulisan skripsi ini masih jauh dari kesempurnaan, oleh karena itu dengan segala kerendahan hati, penulis menerima kritik dan saran demi kesempurnaan skripsi ini. Akhirnya, penulis berharap semoga skripsi ini dapat memberi manfaat bagi kita semua.
Medan, 25 November 2015 Penulis,
UJI AKTIVITAS ANTIBAKTERI EKSTRAK ETANOL DAN FRAKSI KULIT BUAH SAWO MANILA (Manilkara zapota (L.) P. Royen)
TERHADAP BAKTERI Staphylococcus aureus DAN Escherichia coli
ABSTRAK
Sawo merupakan salah satu jenis tanaman buah yang sudah lama dikenal dan ditanam di Indonesia. Pemanfaatan bagian dari tanaman seperti akar, batang, daun, kulit dan buah dapat digunakan sebagai obat. Sawo manila berkhasiat untuk obat sembelit serta menghambat diare. Kandungan yang terdapat dalam buah sawo manila meliputi flavonoid, saponin dan tanin. Tujuan penelitian ini adalah untuk mengetahui karakteristik simplisia, kandungan senyawa kimia dan uji aktivitas antibakteri dari kulit buah sawo manila (Manilkara zapota (L.) P. Royen).
Pemeriksaan karakteristik simplisia meliputi pemeriksaan makroskopik, mikroskopik, penetapan kadar air, penetapan kadar sari larut air, penetapan kadar sari larut etanol, penetapan kadar abu total dan penetapan kadar abu tidak larut asam. Skrining fitokimia meliputi pemeriksaan golongan senyawa alkaloid, flavonoid, glikosida, saponin, tanin dan steroid/triterpenoid. Ekstraksi dilakukan secara perkolasi dan fraksinasi dilakukan secara ekstraksi cair-cair. Uji aktivitas antibakteri terhadap bakteri Staphylococcus aureus dan Escherichia coli dilakukan dengan metode difusi agar menggunakan cakram kertas.
Hasil yang diperoleh dari pemeriksaan karakteristik simplisia adalah kadar air 2,31%, kadar sari larut air 64,48%, kadar sari larut etanol 59,60%, kadar abu total 6,32%, kadar abu tidak larut asam 0,49%. Hasil skrining fitokimia serbuk simplisia mengandung golongan senyawa flavonoid, glikosida, tanin dan steroid/triterpenoid. Hasil uji aktivitas antibakteri menunjukkan bahwa ekstrak etanol dan fraksi etilasetat memberikan diameter daerah hambat yang efektif terhadap Staphylococcus aureus dan Escherichia coli sedangkan fraksi air dan fraksi n-heksana hanya memberikan diameter daerah hambat yang efektif terhadap Staphylococcus aureus.