Lampiran 1. Data Hasil perhitungan konsentrasi Iodium dalam sampel garam konsumsi pada suhu ruang
No Kode Sampel Konsentrasi (mg/kg) Keterangan
1 A 49,165 ± 1,5190 MS
2 B 47,3958 ± 1,5208 MS
3 C 42,7980 ± 1,5208 MS
4 D 41,3829 ± 2,6340 MS
5 E 42,0903 ± 1,5208 MS
6 F 36,7848 ± 4,0238 MS
7 G 24,4053 ± 2,6340 TMS
8 H 18,3924 ± 1,5208 TMS
9 I 10,9647 ± 1,5208 TMS
10 J 9,9036 ± 1,5208 TMS
Keterangan:
MS : Memenuhi Standar
TMS : Tidak Memenuhi Standar
Lampiran 2. Data Hasil perhitungan konsentrasi Iodium dalam sampel garam konsumsi pada suhu pemanasan 500C
No Kode Sampel Konsentrasi (mg/kg) Keterangan
1 A 42,7977 ± 1,5208 MS
2 B 39,2607 ± 2,6343 MS
3 C 37,8460 ± 1,5208 MS
4 D 34,3089 ± 1,5208 MS
5 E 36,7848 ± 1,5208 MS
7 G 19,8072 ± 1,5208 TMS
8 H 14,1480 ± 1,5208 TMS
9 I 7,7814 ± 1,5208 TMS
10 J 7,0740 ± 1,5208 TMS
Keterangan:
MS : Memenuhi Standar
TMS : Tidak Memenuhi Standar
Lampiran 3. Data Hasil perhitungan konsentrasi Iodium dalam sampel garam konsumsi pada suhu pemanasan 750C
No Kode Sampel Konsentrasi (mg/kg) Keterangan
1 A 36,7848 ± 3,0417 MS
2 B 35,3700 ± 1,5208 MS
3 C 33,2480 ± 1,5208 MS
4 D 31,4793 ± 1,5208 MS
5 E 33,6010 ± 1,5208 MS
6 F 24,4053 ± 2,6340 TMS
7 G 15,9165 ± 2,6340 TMS
8 H 10,9647 ± 1,5208 TMS
9 I 3,8907 ± 1,5208 TMS
10 J 3,5370 ± 1,5208 TMS
Keterangan:
MS : Memenuhi Standar
Lampiran 4. Syarat Mutu Garam konsumsi sesuai SNI 01-3556-2000
No Parameter Satuan Persyaratan Mutu
1 Kadar Air (H2O) % (b/b) maks. 7,0
2 Kadar NaCl
(dihitung dari jumlah Klorida (Cl-)
% (b/b) min. 94,7
3 Iodium dihitung sebagai KIO3 mg/kg min. 30
4 Cemaran Logam
Timbal (Pb) mg/kg maks. 10,0
Tembaga (Cu) mg/kg maks. 10,0
Raksa (Hg) mg/kg maks. 0,1
Lampiran 5. Sebaran-t
Nilai t untuk selang kepercayaan 90% 95% 98% 99%
Nilai gawat t untuk nilai P 0,10 0,05 0,02 0,01
Banyaknya derajat kebebasan
1 6,31 12,71 31,82 63,66
2 2,92 4,30 6,96 9,92
3 2,35 3,18 4,54 5,84
4 2,13 2,78 3,75 4,60
5 2,02 2,57 3,36 4,03
6 1,94 2,45 3,14 3,71
7 1,89 2,36 3,00 3,50
8 1,86 2,31 2,90 3,36
9 1,83 2,26 2,82 3,25
10 1,81 2,23 2,76 3,17
12 1,78 2,18 2,68 3,05
14 1,76 2,14 2,62 2,98
16 1,75 2,12 2,58 2,92
18 1,73 2,10 2,55 2,88
20 1,72 2,09 2,53 2,85
30 1,70 2,04 2,46 2,75
50 1,68 2,01 2,40 2,68
∞ 1,64 1,96 2,33 2,58
Keterangan:
Lampiran 6. Gambar produk kemasan Garam konsumsi dari berbagai macam merek yang dianalisis
Lampiran 7. Contoh larutan sampel garam yang memenuhi standar (gambar kiri dengan kode sampel A) dan yang Tidak memenuhi standar
Lampiran 8. Perbandingan jumlah Iodium yang dilepaskan melalui warna larutan dari Garam konsumsi yang memenuhi standar (gambar kiri) dengan yang tidak memenuhi standar (kanan)
Lampiran 10. Perbandingan warna larutan sampel sebelum ditiitrasi (kiri) dan setelah mendekati titik akhir titrasi (kanan) sebelum penambahan indikator amilum
DAFTAR PUSTAKA
Basset, J. 1994. Buku Ajar Vogel Kimia Analisis Kuantitatif Anorganik. Edisi keempat. Jakarta : EGC
Ahuja, S. 1989. Selectivity and Detectability Optimizations in HPLC. New York: John Wiley & Sons
Almatsier, S. 2009. Prinsip Dasar Ilmu Gizi. Jakarta : Gramedia Pustaka Utama
Anggraini, N. 2001. Perbandingan Metode Titrasi Iodometri dan Spektrofotometri Sinar Tampak untuk Penentuan Kandungan Iodat dalam Garam Pasar. [Skripsi] Jakarta : FT. UI
Arisman. 2009. Gizi dalam Daur Kehidupan. Edisi kedua. Jakarta : Penerbit Buku Kedokteran EGC
Austin, G.T. 1996. Industri Proses Kimia. Jilid 1. Edisi kelima. Jakarta : Erlangga
BPOM RI. 2006. Penentuan Spesi Iodium dalam Garam Beriodium dan Makanan dengan Metode HPLC Pasangan Ion. Volume 7. No.3. ISSN 1829-9334
Buckle, K.A., R.A.Edwards., G.H.Fleet., and M.Wooton. 1987. Ilmu Pangan. Jakarta: UI
Cahyadi, W. 2008. Pengaruh Lama Penyimpanan, Kelembaban Relatif (RH), dan Suhu Terhadap Kestabilan Garam Beryodium. [Jurnal Teknologi dan Indudtri Pangan] Bandung: FT. Universitas Pasundan
Chauhan, S.A., Bhatt, A.M., Bhatt, M.P., Majeetha K.M. 1992. Stability of Iodized Salt with Respect to Iodine Salt. [Journal of Research and Industry] India
Day,R.A. dan Underwood,A.L. 1992. Analisis Kimia Kuantitatif. Jakarta : Erlangga
Departemen Gizi dan Kesehatan Masyarakat FKM UI. 2007. Gizi dan Kesehatan Masyarakat. Edisi Pertama. Jakarta : Raja Grafindo Persada
Diosady, L.L., Alberti,J.O., Venkantesh Mannar, M.G and Stone,T. 1997. Stability of Iodine in Iodized Salt Used for Correction of Iodine Deficiency Disorder Food and Nutrition. [Bulletin] 18 (4): 388-96
Fleck,H. dan Elizabeth, M. 1962. Introduction to Nutrition. New York : The Macmillan Company
Hardjadi, W. 1985. Ilmu Kimia Analitik Dasar. Jakarta : Gramedia Pustaka Utama
Irawati, A. 1993. Kadar Zat Iodium dari Garam Beriodium Selama Proses Pengemasan, Penyimpanan, dan Penanganan di Rumahtangga di wilayah Bogor. [Jurnal Penelitian Gizi Makanan]
Khopkar, S.M. 2008. Konsep Dasar Kimia Analitik. Jakarta : UI-Press
Miller, J.C dan Miller, J.N. 1991. Statistik Untuk Kimia Analitik. Bandung : Penerbit ITB
Moehji, S. 1992. Ilmu Gizi. Jakarta : Penerbit Bhratara
Muchadi, D. 1992. Masalah-masalah Fortifikasi Iodium dalam Penangggulangan GAKI. PAU Pangan dan Gizi. Bogor : IPB
Mulja, M. 1995. Analisis Instrumental. Bandung: Airlangga Universitas Press
Mulyono, HAM. 2006. Kamus Kimia. Jakarta : PT Bumi Aksara
Riyanto. 2004. Optimasi Metode Penentuan Kandungan Iodium dalam Garam Dapur dengan Spektrofotometri UV-VIS. [Jurnal Ilmiah] FMIPA Universitas Islam Indonesia
Rohman, A. 2007. Kimia Farmasi Analisis. Yogyakarta : Pustaka belajar
Saksono, N. 2002. Analisis Iodat Dalam Bumbu Dapur Dengan Metode Iodometri Dan X-Ray Fluorescence. [Jurnal teknologi] FT UI
Shongwe, S. 2007. Manual of Laboratory Methods for fortified Food (Vitamin A, Riboflavin, Iron and Iodine ). Part 1 (Determination of Iodine in Salt). Tanzania : ECSA-HC
SNI 01-3556-2000. Kadar spesi Iodium dalam Garam dapur
Sudarmadji, S. 1989. Analisis Bahan Makanan dan Pertanian. Cetakan Pertama. Yogyakarta : Liberty Yogyakarta
Vogel, A. I. 1979. Textbook of Macro and Semimicro Qualitative Inorganic Analysis. London: Longman Group Limited
Widyakarya Nasional Pangan dan Gizi. 2004
WHO. 1996. Trace elements in human nutrition and health
BAB 3
METODE PENELITIAN
3.1. Alat
− Neraca Analitik Shimadzu ATX 224
− Buret Pyrex
− Statif dan Klem
− Termometer Fisons − Hot plate Fisher − Beaker Glass Pyrex − Labu Erlenmeyer Pyrex − Pipet Volume Pyrex − Maat Pipet Pyrex − Labu ukur Pyrex − Oven
− Cawan Krusibel
3.2. Bahan
− Garam konsumsi dengan kode sampel A, B, C, D, E, F, G, H, I, dan J − Na2S2O3.5H2O p.a.E.Merck
− KI p.a.E.Merck
− KIO3 p.a.E.Merck
− H2SO4(p) p.a.E.Merck
3.3. Prosedur Penelitian
3.3.1. Penyediaan Reagen
a) Larutan standar Na2S2O3 0,005 N
Sebanyak 1,2400 gram Na2S2O3.5H2O dilarutkan dengan aquadest dan
diencerkan dengan aquadest dalam labu ukur 1000 mL sampai garis tanda,
kemudian ditambahkan 3 tetes kloroform lalu dihomogenkan. Larutan ini
disimpan dalam botol kaca borosilikat yang gelap.
b) Larutan KI 10%
Sebanyak 10 gram KI dilarutkan dengan aquadest dan diencerkan dengan
aquadest dalam labu ukur 100 mL sampai garis tanda kemudian
dihomogenkan. Larutan ini disimpan dalam botol kaca borosilikat yang
gelap.
c) Larutan Indikator Amilum 0,5 %
Sebanyak 0,5 gram Amilum dilarutkan dengan aquadest dan diencerkan
dengan aquadest dalam labu ukur 100 mL sampai garis tanda lalu
dihomogenkan kemudian dididihkan selama 2 menit hingga larutan jernih.
d) Larutan baku KIO3 0,005 N
Sebanyak 0,1783 gram kristal KIO3 yang telah dikeringkan dari dalam
oven pada suhu 1050C selama 2 jam dilarutkan dengan aquadest dan diencerkan dengan aquadest dalam labu ukur 1000 mL sampai garis tanda
kemudian dihomogenkan.
e) Larutan H2SO4 2N
Sebanyak 13,8 mL H2SO4(p) dimasukkan secara perlahan-lahan ke dalam
labu ukur 250 mL yang telah berisi aquadest, kemudian diencerkan dengan
3.3.2. Preparasi Larutan Sampel
Sebanyak 50 gram sampel dilarutkan dengan aquadest dan diencerkan dengan
aquadest dalam labu ukur 250 mL hingga garis tanda kemudian dihomogenkan.
Larutan ini disimpan dalam botol kaca borosilikat yang gelap.
3.3.3. Standarisasi Larutan standar Na2S2O3
Dipipet sebanyak 10 mL larutan baku KIO3 0,005 N dan dimasukkan ke dalam
labu Erlenmeyer 250 mL. Ditambahkan 5 mL KI 10% dan 2 mL H2SO4 2 N.
Disimpan pada tempat gelap tanpa paparan cahaya selama 5-10 menit untuk
mencapai reaksi yang optimal. Dititrasi dengan larutan standar Na2S2O3 hingga
terjadi perubahan warna dari kuning menjadi kuning lemah. Kemudian
ditambahkan 2 mL indikator amilum 0,5% lalu dititrasi kembali dengan larutan
standar Na2S2O3 hingga warna larutan hilang. Lalu dicatat volume larutan standar
Na2S2O3 yang digunakan. Diulangi prosedur yang sama sebanyak 3 kali dan
dihitung Normalitas Na2S2O3 dengan menggunakan rumus sebagai berikut :
���2�2�3 =
����3 ����3
���2�2�3
Dimana: ���2�2�3 adalah Normalitas larutan standar Na2S2O3 (mek/mL)
���2�2�3 adalah volume rata-rata larutan standar Na2S2O3 (mL)
����3 adalah normalitas larutan KIO3 yang digunakan (mL)
3.3.4. Penentuan I2 pada suhu ruang dengan metode titrasi Iodometri
Dipipet sebanyak 10 mL larutan sampel dan dimasukkan ke dalam labu
Erlenmeyer. Ditambahkan 5 mL KI 10% dan 2 mL H2SO4 2N. Disimpan pada
tempat gelap tanpa paparan cahaya selama 5-10 menit untuk mencapai reaksi yang
optimal. Dititrasi dengan larutan standar Na2S2O3 0,0050 N hingga terjadi
perubahan warna dari kuning menjadi kuning lemah. Kemudian ditambahkan 2
mL indikator amilum 0,5% lalu dititrasi kembali dengan larutan standar Na2S2O3
0,0050 N hingga warna biru dari larutan hilang. Lalu dicatat volume larutan
standar Na2S2O3 0,0050 N yang digunakan. Diulangi prosedur yang sama
sebanyak 3 kali.
3.3.5. Penentuan I2 pada suhu pemanasan 500C dan suhu pemanasan 750C
dengan metode titrasi Iodometri
Dipipet sebanyak 10 mL larutan sampel dan dimasukkan ke dalam labu
Erlenmeyer, ditambahkan 5 mL KI 10%. Kemudian campuran larutan dipanaskan
diatas hotplate yang telah diatur dan diukur suhunya dengan menggunakan
termometer hingga suhu 500C. Ditambahkan 2 mL H2SO4 2 N yang telah
dipanaskan hingga suhu 500C. Dititrasi dengan larutan standar Na2S2O3 0,0050 N
hingga terjadi perubahan warna dari kuning menjadi kuning lemah. Kemudian
ditambahkan 2 mL indikator amilum 0,5% lalu dititrasi kembali dengan larutan
standar Na2S2O3 0,0050 N hingga warna biru dari larutan hilang. Lalu dicatat
volume larutan standar Na2S2O3 0,0050 N yang digunakan. Diulangi prosedur
yang sama sebanyak 3 kali. Dilakukan prosedur yang sama untuk penentuan kadar
3.4. Bagan Penelitian
3.4.1. Preparasi sampel
dimasukkan ke dalam beaker glass 100 mL
dilarutkan dengan aquadest
dipindahkan ke dalam labu ukur 250 mL
diencerkan dengan aquadest hingga garis tanda
dihomogenkan
50 gram sampel garam
3.4.2. Standarisasi larutan standar Na2S2O3
dimasukkan ke dalam labu Erlenmeyer
ditambahkan 5 mL KI 10%
ditambahkan 2 mL H2SO4 2 N
disimpan pada tempat gelap tanpa paparan cahaya
selama 5-10 menit untuk mencapai reaksi yang
optimal
dititrasi dengan larutan standar Na2S2O3 hingga
terjadi perubahan warna dari kuning hingga kuning
lemah
ditambahkan 2 mL indikator amilum 0,5%
dititrasi kembali dengan menggunakan larutan
standar Na2S2O3 hingga warna biru larutan hilang
dicatat volume larutan standar Na2S2O3 yang
terpakai
diulangi sebanyak 3 kali 10 mL larutan KIO3 0,005 N
3.4.3. Penentuan kadar I2 dengan metode titrasi Iodometri
a) Penentuan kadar I2 pada suhu ruang
dimasukkan ke dalam labu Erlenmeyer
ditambahkan 5 mL KI 10%
ditambahkan 2 mL H2SO4 2 N
disimpan pada tempat gelap tanpa paparan cahaya
selama 5-10 menit untuk mencapai reaksi yang
optimal
dititrasi dengan larutan standar Na2S2O3 0,0050 N
hingga terjadi perubahan warna dari kuning hingga
kuning lemah
ditambahkan 2 mL indikator amilum 0,5%
dititrasi kembali dengan menggunakan larutan
standar Na2S2O3 0,0050 N hingga warna biru
larutan hilang
dicatat volume larutan standar Na2S2O3 0,0050 N
yang terpakai
diulangi sebanyak 3 kali 10 mL larutan sampel
b) Penentuan kadar I2 pada suhu pemanasan 500C
dimasukkan ke dalam labu Erlenmeyer
ditambahkan 5 mL KI 10%
dipanaskan hingga suhu 500C
ditambahkan 2 mL H2SO4 2 N yang telah
dipanaskan pada suhu 500C
dititrasi dengan larutan standar Na2S2O3 0,0050 N
hingga terjadi perubahan warna dari kuning hingga
kuning lemah
ditambahkan 2 mL indikator amilum 0,5%
dititrasi kembali dengan menggunakan larutan
standar Na2S2O3 0,0050 N hingga warna biru
larutan hilang
dicatat volume larutan standar Na2S2O3 0,0050 N
yang terpakai
diulangi sebanyak 3 kali
dilakukan prosedur yang sama untuk sampel dengan
pemanasan pada suhu 750C 10 mL sampel larutan garam
BAB 4
HASIL DAN PEMBAHASAN
4.1. Hasil Penelitian
Dari hasil penelitian yang telah dilakukan maka data hasil pengamatan volume
titrasi larutan standar Na2S2O3 0,0050 Ndalam sampel yang dapat dilihat pada
tabel 4.1 berikut ini :
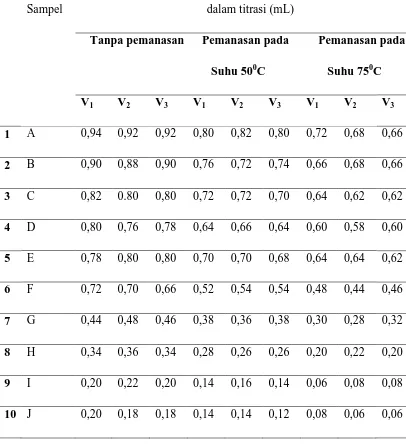
Tabel 4.1. Data Volume larutan standar Na2S2O3 0,0050 N untuk penentuan
Iodium
No Kode
Sampel
Volume Larutan standar Na2S2O3 0,005 N yang digunakan
dalam titrasi (mL)
Tanpa pemanasan Pemanasan pada
Suhu 500C
Pemanasan pada
Suhu 750C
V1 V2 V3 V1 V2 V3 V1 V2 V3
1 A 0,94 0,92 0,92 0,80 0,82 0,80 0,72 0,68 0,66
2 B 0,90 0,88 0,90 0,76 0,72 0,74 0,66 0,68 0,66
3 C 0,82 0.80 0,80 0,72 0,72 0,70 0,64 0,62 0,62
4 D 0,80 0,76 0,78 0,64 0,66 0,64 0,60 0,58 0,60
5 E 0,78 0,80 0,80 0,70 0,70 0,68 0,64 0,64 0,62
6 F 0,72 0,70 0,66 0,52 0,54 0,54 0,48 0,44 0,46
7 G 0,44 0,48 0,46 0,38 0,36 0,38 0,30 0,28 0,32
8 H 0,34 0,36 0,34 0,28 0,26 0,26 0,20 0,22 0,20
9 I 0,20 0,22 0,20 0,14 0,16 0,14 0,06 0,08 0,08
Keterangan Kode Sampel :
A = Garam konsumsi yang diperoleh dari pajak modern, di dalam kemasan
tercantum SNI 01-3556-2000 dengan waktu kadaluarsa Desember 2016.
B = Garam konsumsi yang diperoleh dari pajak modern, di dalam kemasan
tercantum SNI 01-3556-2000 dengan waktu kadaluarsa Desember 2016.
C = Garam konsumsi yang diperoleh dari pajak modern, di dalam kemasan
tercantum SNI 01-3556-1999 dengan waktu kadaluarsa Desember 2016.
D = Garam konsumsi yang diperoleh dari pajak modern, di dalam kemasan
tercantum SNI 01-3556-2000 dengan waktu kadaluarsa Desember 2020.
E = Garam konsumsi yang diperoleh dari pajak tradisional, di dalam
kemasan tercantum SNI 01-3556-2000 tetapi tidak ada tercantum waktu
kadaluarsa.
F = Garam konsumsi yang diperoleh dari pajak modern, di dalam kemasan
tercantum SNI 01-3556-2000 dengan waktu kadaluarsa Oktober 2019.
G = Garam konsumsi yang diperoleh dari pajak tradisional, di dalam
kemasan tercantum SNI 01-3556-2000 tetapi tidak ada mencantumkan
waktu kadaluarsa.
H = Garam konsumsi yang diperoleh dari pajak modern, di dalam kemasan
tercantum SNI 01-3556-2000 dengan waktu kadaluarsa Desember 2020.
I = Garam konsumsi yang diperoleh dari pajak tradisional, di dalam
kemasan tercantum SNI 01-3556-2000 tetapi tidak ada tercantum waktu
kadaluarsa.
J = Garam konsumsi yang diperoleh dari pajak tradisional, di dalam
kemasan tercantum SNI 01-3556-2000 tetapi tidak ada tercantum waktu
4.1.1. Perhitungan Kadar Iodium pada garam merek A untuk suhu ruang
Penentuan kadar Iodium dapat dihitung sebagai berikut : (Shongwe, S. 2007)
I (mg/kg) = N Na2S2O3 (eq L⁄ ) ×V Na2S2O3 (mL )×21,222 (g eq L) ×Volume awal (mL )⁄
w (kg )×V.sampel (mL )
Keterangan :
N Na2S2O3 : Normalitas larutan standar Na2S2O3 yang digunakan dalam titrasi
(N)
V Na2S2O3 : Volume larutan standar Na2S2O3 yang digunakan dalam titrasi
(mL)
W : Berat sampel yang digunakan (kg)
V sampel : Volume sampel yang digunakan dalam titrasi (mL)
V awal : Volume sampel keseluruhan (mL)
Maka diperoleh:
X1 = 49,8717 mg/kg
X2 = 48,8106 mg/kg
X3 = 48,8106 mg/kg
X = ∑ ��
� = 49,1643 mg/kg
Kemudian dihitung simpangan baku (Miller,J.C., Miller J.N., 1991) sebagai
(X1 − X )2
Dari harga simpangan baku (S) yang diperoleh diatas dapat dihitung konsentrasi
Iodium (I2) dengan batas kepercayaan melalui persamaan berikut:
µ = X ± ��
derajat kepercayaan 95% (p = 0,05) nilai t = 4,30 (Lampiran 4). Sehingga
diperoleh:
µ = 49,165 ±4,30 (0,6126)
√3
= 49,165 ± 1,5208 mg/kg
Perhitungan yang sama dilakukan untuk sampel garam merek B, C, D, E, F, G, H,
4.1.2. Perhitungan Kadar Iodium pada garam merek A untuk suhu 500C
Penentuan kadar Iodium dapat dihitung sebagai berikut :
I (mg/kg) = N Na2S2O3 (eq L⁄ ) ×V Na2S2O3 (mL )×21,222 (g eq L) ×Volume awal (mL )⁄
w (kg )×V.sampel (mL )
Keterangan :
N Na2S2O3 : Normalitas larutan standar Na2S2O3 yang digunakan dalam titrasi
(N)
V Na2S2O3 : Volume larutan standar Na2S2O3 yang digunakan dalam titrasi
(mL)
W : Berat sampel yang digunakan (kg)
V sampel : Volume sampel yang digunakan dalam titrasi (mL)
V awal : Volume sampel keseluruhan (mL)
Maka diperoleh:
X1 = 42,4440 mg/kg
X2 = 43,5051 mg/kg
X3 = 42,4440 mg/kg
X = ∑ ��
� = 42,7977 mg/kg
Kemudian dihitung simpangan baku sebagai berikut :
(X1 − X )2 = (42,4440 – 42,7977)2 = 0,1251
(X2 − X )2
= (43,5051 – 42,7977)2 = 0,5004
(X3 − X )2 = (42,4440 – 42,7977)2 = 0,1251
Maka, S =
�
Σ�X1 − x�2
n −1
= �0,7506 2
= 0,6126
Dari harga simpangan baku (S) yang diperoleh diatas dapat dihitung konsentrasi
Iodium (I2) dengan batas kepercayaan melalui persamaan berikut:
µ = X ± ��
√�
dimana: µ = populasi rata-rata
X = kadar Iodium rata-rata
t = harga t distribusi
S = Simpangan baku
n = jumlah perlakuan
dari data distribusi untuk n = 3, derajat kepercayaan (dk) = n – 1 = 2. Untuk
derajat kepercayaan 95% (p = 0,05) nilai t = 4,30. Sehingga diperoleh:
µ = 42,7977 ±4,30 (0,6126)
√3
= 42, 7977 ± 1,5208 mg/kg
Perhitungan yang sama dilakukan untuk sampel garam merek B, C, D, E, F, G, H,
4.1.3. Perhitungan Kadar Iodium pada garam merek A untuk suhu 750C
Penentuan kadar Iodium dapat dihitung sebagai berikut :
I (mg/kg) = N Na2S2O3 (eq L⁄ ) ×V Na2S2O3 (mL )×21,222 (g eq L) ×Volume awal (mL )⁄
w (kg )×V.sampel (mL )
Keterangan :
N Na2S2O3 : Normalitas larutan standar Na2S2O3 yang digunakan dalam titrasi
(N)
V Na2S2O3 : Volume larutan standar Na2S2O3 yang digunakan dalam titrasi
(mL)
W : Berat sampel yang digunakan (kg)
V sampel : Volume sampel yang digunakan dalam titrasi (mL)
V awal : Volume sampel keseluruhan (mL)
Maka diperoleh:
X1 = 35,0163 mg/kg
X2 = 36,0774 mg/kg
X3 = 35,0163 mg/kg
X = ∑ ��
� = 35,3700 mg/kg
Kemudian dihitung simpangan baku sebagai berikut :
(X1 − X )2 = (35,0163 – 35,3700)2 = 0,1251
(X2 − X )2
= (36,0774 – 35,3700)2 = 0,5004
(X3 − X )2
= (35,0163 – 35,3700)2 = 0,1251
Maka, S =
�
Σ�X1 − x�2
n −1
= �0,7506 2
= 0,6126
Dari harga simpangan baku (S) yang diperoleh diatas dapat dihitung konsentrasi
Iodium (I2) dengan batas kepercayaan melalui persamaan berikut:
µ = X ± ��
√�
dimana: µ = populasi rata-rata
X = kadar Iodium rata-rata
t = harga t distribusi
S = Simpangan baku
n = jumlah perlakuan
dari data distribusi untuk n = 3, derajat kepercayaan (dk) = n – 1 = 2. Untuk
derajat kepercayaan 95% (p = 0,05) nilai t = 4,30. Sehingga diperoleh:
µ = 35,3700 ±4,30 (0,6126)
√3
= 35,3700 ± 1,5208 mg/kg
Perhitungan yang sama dilakukan untuk sampel garam merek B, C, D, E, F, G, H,
4.2 Pembahasan
Telah dilakukan penentuan kadar Iodium di dalam garam konsumsi yang
diperoleh dari pasar kota Medan dengan menggunakan metode titrasi Iodometri
pada suhu ruang, suhu pemanasan 500C, dan suhu pemanasan 750C. Berdasarkan hasil penelitian yang telah dilakukan terhadap kadar Iodium di dalam berbagai
merek garam konsumsi yang berbeda A, B, C, D, E, F, G, H, I, dan J (Lampiran 6)
pada suhu ruang, suhu 500C, dan suhu 750C diperoleh hasil masing-masing secara
berturut-turut adalah (49,1650 mg/kg; 42,7977 mg/kg; 35,3700 mg/kg); (47,3958
mg/kg; 39,2607 mg/kg; 36,7848 mg/kg); (41,3830 mg/kg; 34,3090 mg/kg;
31,4790 mg/kg); (42,7980 mg/kg; 37,8460 mg/kg; 33,2480 mg/kg); (42,0900
mg/kg; 36,7850 mg/kg; 33,6010 mg/kg); (36,7850 mg/kg; 28,2960 mg/kg;
24,4050 mg/kg); (24,4050 mg/kg; 19,8070 mg/kg; 15,9170 mg/kg); (18,3924
mg/kg; 14,1480 mg/kg; 10,9647 mg/kg); (10,9647 mg/kg; 7,7814 mg/kg; 3,8907
mg/kg); (9,9036 mg/kg; 7,0740 mg/kg; 3,3570 mg/kg).
Penentuan kadar Iodium pada penelitian ini dilakukan menggunakan titrasi
Iodometri dengan larutan standar Na2S2O3 0,0050 N, karena tehnik titrasi
merupakan tehnik yang sederhana, tetapi memiliki keakuratan yang tinggi.
Menurut penelitian yang telah dilakukan oleh Novita Anggraini (2001) mengenai
penentuan kandungan iodat dalam garam pasar yang menyimpulkan bahwa
dengan metode spektrofotometri walaupun menurut prinsip analisisnya lebih baik,
daripada iodometri, ternyata kurang akurat karena pembentukan warna larutan
yang kurang stabil dan memerlukan waktu tunggu. Agar pembentukan warna
lebih cepat dan stabil perlu dilakukan pengadukan, dan waktu pendiaman yang
akan meningkatkan sensitifitas analisis. Pada titrasi ini, sampel yang bersifat
oksidator akan direduksi dengan Kalium Iodida berlebih yang selanjutnya akan
membebaskan Iodium (Lampiran 10) yang selanjutnya akan dititrasi dengan
larutan standar Na2S2O3. Karena reaksi akan cepat berlangsung dalam kondisi
asam, maka diperlukan pengaturan pH yang sesuai. Penentuan Iodium pada
suasana asam dengan indikator amilum (Lampiran 11) dikendalikan dengan
penambahan H2SO4 2 N. Menurut hasil penelitian yang dilakukan oleh Riyanto
dan asam klorida dan untuk memperoleh asam yang paling baik tela1h dilakukan
optimasi, dan hasil penelitian menunjukkan bahwa asam sulfat merupakan asam
yang paling baik karena memberikan hasil Absorbansi yang tinggi dibandingkan
dengan asam nitrat dan asam klorida pada pH 2.
Menurut Buckle, K.A; R.A. Edwards; G.H. Fleet; and M. Wooton (1987)
plastik jenis PE mempunyai daya tembus uap air yang tinggi. Selain itu warna
terang plastik dapat mempercepat oksidasi iodium lebih banyak. Di samping itu
jenis plastik ini tidak tahan terhadap oksigen, dimana permeabilitas oksigen dapat
terjadi melalui pori-pori plastik. Keadaan tersebut menyebabkan terjadinya
oksidasi kalium iodat yang ada pada garam yang kemudian membebaskan I2
berupa gas ke udara. Kehilangan kadar iodium terbanyak pada garam yang
dikemas dengan menggunakan plastik yang berwarna bening dan kehilangan
kadar iodium paling sedikit adalah pada garam yang dikemas dengan
menggunakan gelas berwarna merah gelap. Kadar iodium garam setelah disimpan
selama 8 minggu adalah berkisar antara 31.40 ppm dan 39.43 ppm atau berkurang
sebanyak 7.70 % sampai 22.60 % (Anies Irawati, 1993), dan menurut Mutchadi
(1992) ; Diosady, L.L; Alberti, J.O; Venkatesh Mannar, M.G and Stone, T (1997)
bahwa garam beriodium yang dikemas dalam karung plastik dan disimpan selama
3 bulan pada suhu ruang, kandungan Iodatnya dapat dipertahankan sekitar 75%,
dan setelah disimpan selama 9 bulan turun sampai 50% dari kadar semula.
Dari hasil yang diperoleh dapat dilihat bahwa kadar Iodium pada produk
garam dengan merek yang berbeda memiliki kadar yang berbeda juga, hal ini juga
dapat terlihat dari warna kuning larutan sampel (Lampiran 8). Dari 10 sampel
yang dianalisis pada suhu ruang, ditemukan bahwa terdapat 6 sampel yang
memenuhi SNI 01-3556-2000 (Lampiran 5) dan terdapat 4 sampel yang belum
memenuhi standar yang telah ditetapkan. Secara fisik warna larutan sampel yang
memenuhi standar juga berbeda dengan larutan sampel yang tidak memenuhi
standar (Lampiran7). Hal ini disebabkan karena :
1. Jumlah Iodium yang ditambahkan pada proses fortifikasi yang tidak
memenuhi standar yang telah ditetapkan.
3. Penurunan kadar selama peredaran yang mungkin dipengaruhi oleh bahan
pembungkus, kondisi dan situasi pembungkus dan lamanya penyimpanan.
Iodium merupakan mineral mikro esensial yang sangat dibutuhkan oleh tubuh dan
berperan penting dalam pembentukan hormon tiroksin yang terdapat di dalam
kelenjar tiroid yang sangat diperlukan pada perkembangan fisik dan mental
manusia. Tubuh tidak mampu memproduksi Iodium, oleh karenanya kebutuhan
akan Iodium ini dapat terpenuhi dari asupan makanan sehari-hari.
Gangguan Akibat Kekurangan Iodium (GAKI) merupakan masalah serius
yang berkembang di Indonesia dan juga di dunia, karena dampak ini berpengaruh
pada masalah kecerdasan terutama berdampak bagi perkembangan Sumber Daya
Manusia. Untuk menanggulangi masalah GAKI dalam jangka panjang, di
Indonesia sendiri pemerintah telah mencanangkan program fortifikasi Iodium ke
dalam garam konsumsi beriodium. Tentunya program ini perlu pengawasan yang
ketat dari pihak yang berkaitan serta evaluasi seperti pada program yang lainnya.
Banyaknya jumlah garam konsumsi dengan merek berbeda yang beredar di
masyarakat harus perlu pengawasan yang ketat dari pemerintah karena masih
banyak ditemukan garam-garam yang belum memenuhi standar sekalipun
sebagian besar garam-garam tersebut telah mencantumkan SNI pada kemasannya.
Adanya kebiasaan masyarakat kita khususnya para kaum ibu yang lebih sering
menggunakan garam dapur dibandingkan dengan garam meja yang disebabkan
karena faktor harga garam dapur yang relatif lebih murah serta kurangnya
pengetahuan masyarakat mengenai syarat mutu garam konsumsi sehingga
masyarakat kurang memperhatikan hal tersebut. Selain hal diatas, garam yang
terlalu cepat dimasukkan pada saat memasak dan pada suhu yang tinggi pada saat
pengolahannya sangat berpengaruh terhadap kadar Iodium yang ada.
Di Indonesia, berdasarkan penelitian YLKI (Yayasan Lembaga Konsumen
Indonesia, 1999), lebih dari separuh garam yang beredar di pasar tidak
mengandung Iodium (Arisman, 2009). Dari hasil penelitian juga dapat dilihat
bahwa kenaikan suhu akan mengakibatkan penurunan kadar Iodium dalam
masing-masing sampel yang dianalisis, hal ini juga dapat dilihat dari warna
satu dari mineral yang bersifat sensitif terhadap panas dan cahaya. Iodium yang
terdapat dalam bahan makanan tidak 100% masuk ke dalam sistem pencernaan
kita. Proses pengolahan bahan makanan akan mengurangi ketersediaan Iodium
dari makanan kita. Hilangnya Iodium selama pengolahan berbanding lurus dengan
suhu dan waktu pengolahan. Semakin tinggi suhu dan semakin lama waktu yang
digunakan untuk mengolah suatu bahan makanan, maka akan semakin tinggi
jumlah Iodium yang hilang. Proses penggorengan akan mengurangi kandungan
Iodium sekitar 20%, pemanggangan sekitar 23% dan perebusan sebesar 58%
(Dept. Gizi dan Kes.Mas FKM UI, 2007). Kerusakan selama proses memasak
dapat diperkecil dengan cara menambahkan garam setelah selesai memasak, serta
mengganti garam yang telah biasa digunakan dengan garam beriodium. Hal ini
juga didukung oleh penelitian yang telah dilakukan oleh Cahyadi, W (2008) yang
menyimpulkan bahwa persentase penurunan kadar Iodat menjadi Iodium terbesar
terjadi pada kondisi suhu 400C yaitu sebesar 66,86% dan 50,85% pada RH 60% dan 100% dengan waktu penyimpanan selama 14 hari, sedangkan pada kondisi
ruang (suhu 25,50C) dengan RH 60-65% menunjukkan persentase penurunan
kadar Iodat sebesar 46,51%. Apabila kondisi pengepakan, penyimpanan dan
penanganannya kurang baik, setelah disimpan selama 9 bulan, kandungan
Iodatnya yang tertinggal hanyalah sekitar 10% dari kadar semula (Diosady, L.L;
BAB 5
KESIMPULAN DAN SARAN
5.1. Kesimpulan
Dari hasil penelitian yang telah dilakukan dapat diambil kesimpulan sebagai
berikut:
1. Kadar Iodium pada sampel garam konsumsi merek A, B, C, D, E, F, G, H,
I, dan J pada suhu ruang secara berturut-turut adalah 49,1650 mg/kg,
47,3958 mg/kg, 41,3830 mg/kg, 42,7980 mg/kg, 42,0900 mg/kg, 36,7850
mg/kg, 24,4050 mg/kg, 18,3924 mg/kg, 10,9647 mg/kg, dan 9,9036
mg/kg, pada suhu pemanasan 500C secara berturut-turut adalah 42,7977 mg/kg, 39,2607 mg/kg, 34,3090 mg/kg, 37,8460 mg/kg, 36,7850 mg/kg,
28,2960 mg/kg, 19,8070 mg/kg, 7,0740 mg/kg, 7,7814 mg/kg, dan
14,1480 mg/kg, dan pada suhu pemanasan 750C secara berturut-turut
adalah 35,3700 mg/kg, 36,7848 mg/kg, 31,4790 mg/kg, 33,2480 mg/kg,
33,6010 mg/kg, 24,4050 mg/kg, 15,9170 mg/kg, 10,9647 mg/kg, 3,8907
mg/kg, dan 3,3570 mg/kg.
2. Hasil kadar Iodium yang diperoleh menunjukkan bahwa kadar Iodium
dalam garam konsumsi dari 10 merek yang dianalisis pada suhu ruang
didapatkan 6 merek garam konsumsi yang memenuhi SNI 01-3556-2000,
dan 4 merek garam lainnya tidak memenuhi persyaratan SNI
01-3556-2000 sekalipun pada kemasan telah tercantum memenuhi Standar Nasional
Indonesia.
5.2. Saran
Untuk peneliti selanjutnya disarankan untuk melakukan analisis kadar Iodium
menggunakan metode potensiometri dengan Elektroda selektif ion iodat karena
BAB 2
TINJAUAN PUSTAKA
2.1. Garam
Garam merupakan bahan tambahan pangan yang sangat penting dalam kehidupan
sehari-hari, dapat digunakan sebagai penyedap dan pengawet makanan. Garam
pernah menjadi barang pujaan dan pernah pula digunakan sebagai alat
pembayaran, sebagai pengganti mata uang di Tibet dan Mongolia. Penyaluran
garam digunakan sebagai senjata politik oleh pemerintah-pemerintah zaman
dahulu dan di negara-negara Timur garam dikenakan pajak yang tinggi. Istilah
“salary” (gaji) dalam bahasa inggris sesungguhnya berasal dari kata “salt” (garam)
(George T. Austin, 1996).
Terdapat 2 jenis garam yang dikonsumsi oleh masyarakat yaitu :
1. Garam Dapur
Garam dapur merupakan garam yang diperoleh dari air laut dengan cara
diuapkan dan dikeringkan di bawah terik matahari.
2. Garam Meja
Garam meja merupakan garam konsumsi yang diolah sedemikian rupa
baik menggunakan maupun tanpa menggunakan bahan-bahan anti gumpalan atau
bahan pengering sehingga menjadi halus dan putih bersih.
Garam dapat diperoleh dengan 3 cara :
1. Penguapan air laut dengan sinar matahari di pesisir pasifik atau dari air
danau asin di daerah barat.
2. Penambangan batuan garam (rock salt).
Kemurnian garam yang dibuat dengan penguapan air garam biasanya lebih dari
99%, Garam hasil tambang berbeda-beda komposisinya tergantung pada lokasi,
namun biasanya mengandung lebih dari 95% dan beberapa garam batuan dapat
mencapai kemurnian hingga 99,5 %, larutan yang didapat dari sumur biasanya
mempunyai kemurnian 98 % dan lebih banyak bergantung pada kemurnian air
yang diinjeksikan ke dalam sumur untuk melarutkan garam dari lapisan batuan
(George T. Austin, 1996).
2.1.1. Garam Beriodium
Garam beriodium merupakan garam yang telah mengalami proses fortifikasi
(penambahan) Iodium. Penggunaan garam beriodium di Indonesia dimulai pada
tahun 1927 di daerah Tengger dan Dieng yang merupakan daerah pegunungan
yang endemis GAKI. Di Indonesia Iodium yang ditambahkan adalah dalam
bentuk KIO3. Penggunaan KIO3 pada proses fortifikasi disebabkan oleh kestabilan
KIO3 lebih baik dibanding dengan KI sehingga tidak diperlukan stabilizier, selain
itu kelarutan KIO3 lebih kecil dibanding dengan KI, oleh karenanya kemungkinan
terjadinya leaching akan lebih kecil. Leaching adalah peristiwa dimana partikel
atau senyawa terlarut dalam cairan dan ikut terbawa bersama cairan tersebut
melewati padatan tempat partikel atau senyawa tadi berada. Iodat garam-garam
alkali larut dalam air, iodat logam-logam lainnya sangat sedikit larut, dan
umumnya kurang larut dari klorat dan bromat padanannya. Beberapa kelarutan
dalam g/L pada 200C adalah : timbel iodat 0,03 (250C), Perak iodat 0,06, barium iodat 0,22, kalsium iodat 3,7, kalium iodat 81,3 dan natrium iodat 90,0 (Vogel,
A.I., 1979). Pemilihan KIO3 juga berdasarkan pada kemudahan KIO3 terurai
dalam tubuh manusia dan dibawa ke kelenjar tiroid, KIO3 tidak bersifat racun dan
telah disetujui serta direkomendasikan oleh FAO/WHO. Dibandingkan dengan
cara menanggulangi masalah GAKI yang lain, penggunaan garam beriodium
paling murah dan paling sederhana karena garam merupakan bahan tambahan
Meskipun merupakan cara yang paling murah dan sederhana, beberapa
kendala yang muncul yang dihadapi oleh pemerintah dalam penyediaan garam
beriodium di lapangan, yaitu :
1. Produksi garam tidak tersentralisasi sehingga menyulitkan dalam
memonitoring. Dari 1 juta ton garam yang diproduksi hanya 30% yang
diproduksi oleh PN garam, sisanya tersebar di berbagai daerah. Kadar
Iodium ternyata sangat rendah, hanya 58% dari garam beriodium yang
dikomsumsi di RT yang memenuhi persyaratan.
2. Cara pengolahan garam beriodium sebaiknya ditambahkan pada saat
makanan akan disantap untuk mengurangi kehilangan. Pada umumnya
masyarakat menambahkan garam saat mempersiapkan bumbu, terutama
bumbu-bumbu yang dihaluskan. Masakan yang pedas dan asam ternyata
akan menghilangkan Iodium.
3. Penerimaan masyarakat. Masyarakat belum semua mengonsumsi garam
biasa. Hasil SKRT 1996, rumah tangga yang mengonsumsi garam
beriodium baru 85%, yang memenuhi persyaratan hanya 58%, kurang
27% dan tidak beriodium 15%. Sebagian masyarakat beranggapan bahwa
garam beriodium kurang asin dibanding dengan garam biasa, selain itu ada
yang mengatakan garam beriodium rasanya pahit (Dept.Gizi dan Kes.Mas
FKM UI).
2.2. Iodium
Iodium merupakan anion monovalen yang berada dalam golongan VIIA dalam
sistem periodik. Iodium berwarna ungu, memiliki titik didih 1830C serta memiliki titik leleh 1130C dengan keelektronegatifan sebesar 2,5. Iodium ini pertama kali diisolasi oleh Courtais pada tahun 1811, dia menuliskan bahwa selain berwarna
ungu, Iodium memiliki bau seperti klorin (Henrietta Fleck dan Elizabeth Munves,
1962). Iodium merupakan mineral esensial yang jumlahnya sangat sedikit di
dalam tubuh, yaitu kurang lebih 0,00004% dari berat badan atau 15-23 mg.
Sekitar 75% terdapat di dalam kelenjar tiroid yang digunakan untuk mensintesis
Hormon-hormon ini diperlukan untuk pertumbuhan normal, perkembangan fisik
dan mental hewan dan manusia. Hormon tiroid mengontrol kecepatan tiap sel
menggunakan oksigen. Dengan demikian, hormon tiroid mengontrol kecepatan
pelepasan energi dari zat gizi yang menghasilkan energi. Tiroksin dapat
merangsang metabolisme hingga 30%, disamping itu kedua hormon ini mengatur
suhu tubuh, reproduksi, pembentukan sel darah merah serta fungsi otot dan syaraf.
Iodium juga berperan dalam perubahan karoten menjadi bentuk aktif Vitamin A,
sintesis protein dan absorpsi karbohidrat dari saluran cerna, selain itu Iodium juga
berperan dalam sintesis kolesterol darah. Sisa Iodium berada dalam jaringan lain,
terutama di dalam kelenjar-kelenjar ludah, payudara, lambung dan di dalam ginjal.
Didalam darah Iodium terdapat dalam bentuk iodium bebas atau terikat dengan
protein (Sunita Almatsier, 2009).
Iodium merupakan salah satu dari mineral yang bersifat sensitif terhadap
panas dan cahaya. Iodium yang terdapat dalam bahan makanan tidak 100% masuk
ke dalam sistem pencernaan kita. Proses pengolahan bahan makanan akan
mengurangi ketersediaan Iodium dari makanan kita. Hilangnya Iodium selama
pengolahan berbanding lurus dengan suhu dan waktu pengolahan. Semakin tinggi
suhu dan semakin lama waktu yang digunakan untuk mengolah suatu bahan
makanan, maka akan semakin tinggi jumlah Iodium yang hilang. Proses
penggorengan akan mengurangi kandungan Iodium sekitar 20%, pemanggangan
sekitar 23% dan perebusan sebesar 58% (Dept. Gizi dan Kes.Mas FKM UI, 2007).
Kerusakan selama proses memasak dapat diperkecil dengan cara menambahkan
garam setelah selesai memasak, serta mengganti garam yang telah biasa
digunakan dengan garam beriodium. Di Indonesia, berdasarkan penelitian YLKI
(Yayasan Lembaga Konsumen Indonesia, 1999), lebih dari separuh garam yang
2.2.1. Angka Kecukupan Iodium
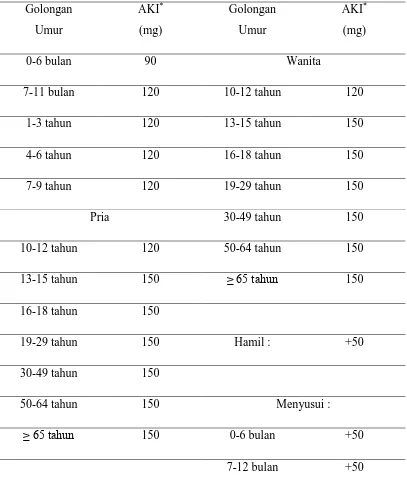
Rata-rata jumlah Iodium yang dianjurkan biasanya dipatok sebesar 100-150
µg/hari, suatu jumlah yang telah terbukti cukup untuk mempertahankan fungsi
normal kelenjar tiroid, asupan Iodium ini berbeda untuk masing-masing usia dan
kebutuhannya. Angka kecukupan Iodium sehari yang dianjurkan berdasarkan
Widyakarya Nasional Pangan dan Gizi (2004) dapat dilihat pada tabel 2.1 berikut:
Tabel 2.1. Angka kecukupan Iodium yang dianjurkan
Golongan
Sumber: Widyakarya Nasional Pangan dan Gizi, 2004
2.2.2. Absorpsi Iodium di dalam tubuh
Proses penyerapan Iodium di dalam tubuh dimulai dari saluran pencernaan.
Iodium dalam makanan berupa Iodat, Iodida, Iodium, dan kompleks Iodium yang
akan diubah menjadi iodida sebelum diserap oleh usus halus, tetapi tidak semua
Iodium akan diserap oleh usus halus melainkan beberapa diantaranya langsung
masuk ke dalam saluran darah melalui dinding lambung (Winarno, 1992). Setelah
diabsorpsi, iodida akan masuk ke dalam aliran darah dan diserap oleh kelenjar
tiroid sebanyak 1/3 dan sisanya diekskresikan melalui ginjal, pernapasan dan
feses. Dalam bentuk ikatan organik di dalam makanan hewani hanya separuh dari
Iodium yang dapat dikomsumsi dan diabsorpsi. Di dalam darah, Iodium terdapat
dalam bentuk bebas atau terikat protein. Ternyata penyerapan Iodium ini
berlangsung sangat cepat, yaitu dalam waktu 3-6 menit setelah makanan dicerna
dalam mulut (Freind, 1972).
Membran tiroid mempunyai kapasitas spesifik untuk memindahkan iodida
ke bagian belakang kelenjar. Dalam kelenjar tiroid, Iodium bergabung dengan
molekul tirosin membentuk tiroksin (tetraiodotironin) dan triiodotironin. Hormon
tersebut dikeluarkan ke dalam saluran darah menurut kebutuhan dan permintaan
tubuh. Tiroksin merupakan lebih dari 95% dari hormon tiroid yang ada dalam
darah. Dalam kelenjar gondok, tiroksin dan triiodotironin bergabung dengan
sebuah molekul protein menjadi tiroglobulin dan merupakan bentuk iodium untuk
disimpan. Pembuangan Iodium dilakukan melalui ginjal, dalam jumlah yang kecil
dikeluarkan juga melalui usus dan keringat, dan yang dikeluarkan melalui feses
biasanya merupakan Iodium yang tidak dapat diserap atau yang berasal dari
empedu (Winarno, 1992).
2.2.3. Gangguan Akibat Kekurangan Iodium (GAKI)
Terjadinya kekurangan Iodium terutama diakibatkan rendahnya kadar Iodium
dalam tanah sehingga air dan tumbuh-tumbuhan yang hidup di daerah tersebut
rendah kadar Iodiumnya (Sjahmien Moehji, 1992). Hal ini dapat memberikan
dampak yang sangat serius, seperti yang akan dijelaskan pada tabel 2.2 dibawah
Tabel 2.2. Spektrum Gangguan Akibat kekurangan Iodium
Tahap Perkembangan Bentuk Gangguan
Janin Keguguran (Aborsi)
Lahir mati
Kelainan Kongenital
Kematian Perinatal
Kematian bayi
Kretinisme syaraf
Kretinisme miksedema
Kerusakan psikomotor
Bayi baru lahir Gondok neonatus
Hipotiroidisme neonatus
Anak dan Remaja Gondok
Hipotiroidisme juvenile
Fungsi mental
Perkembangan fisik terhambat
Dewasa Gondok dan penyulit
Hipotiroidisme
Fungsi mental
Hipertiroidisme diimbas oleh Iodium
Semua Usia Kepekaan terhadap radiasi Iodium
(Dikutip dari : Trace elements in human nutrition and health, WHO 1996)
Bila kekurangan berlanjut, sel kelenjar tiroid akan membesar dalam usaha
meningkatkan pengambilan Iodium oleh kelenjar tersebut. Bila pembesaran ini
menampak disebut dengan gondok sederhana dan bila terdapat secara meluas di
suatu daerah maka dinamakan gondok endemik. Gondok dapat diperlihatkan
dalam bentuk yang berbeda, yaitu dalam bentuk kretinisme di satu sisi dan
pembesaran kelenjar tiroid di sisi lain. Gangguan Akibat Kekurangan Iodium
(GAKI) disebabkan karena kurangnya asupan Iodium yang masuk ke dalam tubuh
sehingga konsentrasi hormon tiroid menurun dan hormon perangsang tiroid/TSH
meningkat agar kelenjar tiroid mampu menyerap lebih banyak Iodium.
Program penanggulangan GAKI dilakukan yakni dengan mengadakan
pendekatan dan pembuatan program jangka pendek dan jangka panjang. Program
jangka pendek meliputi distribusi kapsul Iodium kepada kelompok sasaran di
daerah endemik sedang dan berat . Sedangkan program jangka panjang meliputi
Iodisasi garam, promosi penganekaragaman pangan dan menu gizi seimbang, dan
penurunan konsumsi pangan goitrogenik. Terdapat 10 indikator pada program
penanggulangan GAKI secara berkelanjutan, yaitu adanya tim penanggulangan
GAKI di tingkat kabupaten yang efektif, komitmen politis penanggulangan GAKI
dan garam beriodium untuk semua, adanya eksekutif yang ditunjuk untuk
bertanggung jawab dalam mengeliminasi IDD, adanya peraturan daerah yang
resmi tentang peredaran garam beriodium, surveilans GAKI, penyuluhan massal
dan mobilisasi sosial terhadap konsumsi garam beriodium dan pentingnya IDD
(Iodine Deficiency Disorder) atau GAKI, ketersediaan data reguler garam
beriodium dari pabrik, pedagang, dan rumah tangga, data reguler ekskresi Iodium
dalam urin kelompok rawan, menjalin kerjasama dengan produsen garam untuk
mempertahankan kualitas garam, data base hasil monitoring beriodium, UIE, dan
2.3 Analisis Penentuan Iodium
2.3.1. Analisis Kimia
Analisis Kimia merupakan cara penetapan atau pengujian adanya suatu zat atau
unsur di dalam suatu bahan/sampel. Disebut analisis kimia kualitatif, bila
pengujian itu bertujuan hanya untuk mengidentifikasi jenis zat atau konstituen
dalam bahan itu, sedangkan disebut analisis kimia kuantitatif bila bertujuan untuk
menetapkan jumlah (kuantitas) dari zat atau konstituen dalam suatu bahan
(Mulyono HAM, 2006).
Faktor-faktor penting yang harus diperhitungkan dalam memilih suatu metode
analisis yang tepat adalah :
a. sifat informasi yang dicari
b. ukuran contoh yang tersedia dan proporsi penyusun yang ditetapkan
c. tujuan diperlukannya data analitis itu.
Tehnik utama yang digunakan dalam analisis anorganik kuantitatif didasarkan
pada :
a) penampilan kuantitatif reaksi-reaksi kimia yang cocok atau pengukuran
banyaknya reagensia yang diperlukan untuk menyempurnakan reaksi atau
pemastian banyaknya hasil reaksi yang mungkin.
b) pengukuran listrik yang sesuai.
c) pengukuran sifat optis tertentu (misalnya spektra serapan) gabungan
pengukuran optis atau listrik dan reaksi kimia kuantitatif (J.Basset, 1994).
Prosedur analisa yang ideal sebaiknya memenuhi beberapa syarat yaitu : sahih,
tepat, cermat, cepat, hemat, selamat, dapat diulang, khusus, andal dan mantap
(Slamet Sudarmadji, 1989). Suatu hasil dari analisis kimia dikatakan akurat
apabila hasil yang diperoleh sangat mendekati nilai sebenarnya dari suatu besaran
terukur, dan dikatakan teliti apabila terdapat kesesuaian diantara seperangkat hasil
2.3.1.1. Titrimetri
Dalam analisis titrimetri, zat yang akan dianalisis dibiarkan bereaksi dengan zat
lain yang konsentrasinya diketahui dan dialirkan dari buret dalam bentuk larutan,
konsentrasi larutan yang tidak diketahui kemudian dihitung (S.M.Khopkar, 2008).
Tidak semua reaksi dapat digunakan sebagai reaksi titrasi. Untuk itu reaksi harus
memenuhi syarat-syarat sebagai berikut :
1. Berlangsung sempurna, tunggal, dan menurut persamaan yang jelas (dasar
teoritis).
2. Cepat dan reversible (dasar praktis). Bila tidak cepat, titrasi akan memakan
waktu terlalu banyak. Lebih-lebih menjelang titik akhir, reaksi akan
semakin lambat karena konsentrasi titran mendekati nol (kecepatan reaksi
sebanding dengan konsentrasi). Bila reaksi tidak reversible, penentuan titik
akhir titrasi tidak tegas.
3. Ada penunjuk titik akhir titrasi (indikator). Penunjuk itu dapat :
a) Timbul dari reaksi itu sendiri, misalnya : titrasi campuran asam
oksalat dan asam sulfat oleh KMnO4, selama titrasi belum selesai
titrat tidak berwarna, tetapi setelah titik akhir titrasi tercapai,
larutan berubah menjadi berwarna karena kelebihan setetes saja
dari titran akan menyebabkan warna yang jelas.
b) Berasal dari luar, dan dapat berupa suatu zat yang dimasukkan ke
dalam titrat. Zat itu disebut indikator dan menunjukkan titik akhir
titrasi karena: a) menyebabkan perubahan warna titrat.
b) menimbulkan perubahan kekeruhan dalam titrat
(larutan jernih menjadi keruh atau sebaliknya).
4. Larutan baku yang direaksikan dengan analat harus mudah didapat dan
sederhana menggunakannya, juga harus stabil sehingga konsentrasinya
tidak mudah berubah apabila disimpan (W.Hardjadi, 1985).
Semua metode titrimetri tergantung pada larutan standar yang mengandung
sejumlah reagen persatuan volume larutan dengan ketetapan yang tinggi. Reaksi
antara zat yang dipilih sebagai standar primer harus memiliki syarat-syarat
- Harus mudah didapat dalam bentuk murni atau dalam keadaan kemurnian
yang diketahui. Pada umumnya jumlah semua zat pengotor tidak boleh
melebihi 0,01 sampai 0,02% dan harus mungkin untuk mengujinya
terhadap kotoran dengan uji kualitatif yang kepekaannya diketahui.
- Zat harus mudah dikeringkan dan tidak boleh higroskopis sehingga tidak
menarik air ketika ditimbang. Tidak boleh kehilangan berat sewaktu
terkena udara. Garam hidrat biasanya tidak digunakan sebagai standar
primer.
- Standar primer sepatutnya mempunyai berat ekivalen yang tinggi untuk
dapat mengurangi akibat kesalahan dalam penimbangannya.
- Asam dan basanya, sebaliknya yang kuat yaitu terdisosiasi tinggi. Akan
tetapi asam atau basa lemah dapat digunakan sebagai standar primer
tanpa kerugian yang besar, apabila larutan standar harus digunakan untuk
analisis contoh asam atau basa lemah (R.A.Day dan A.L.Underwood,
1992)
Titrasi dapat digolongkan menjadi :
A. Titrasi berdasarkan reaksi-reaksi metatetik, yaitu reaksi pertukaran ion,
dalam reaksi ini tak terjadi perubahan keadaan oksidasi-reduksi tetapi
hanya bergantung pada bersenyawanya ion-ion yang terlibat. Titrasi ini
dapat dibedakan menjadi :
a) Titrasi asidimetri-alkalimetri, yaitu titrasi yang menyangkut asam
atau basa. Pada titrasi ini perubahan terpenting yang mendasari
penentuan titik akhir dan cara perhitungan ialah perubahan pH
titrat.
b) Titrasi presipitasi, yaitu titrasi berdasarkan pembentukan endapan.
c) Titrasi kompleksiometri, yaitu titrasi berdasarkan pembentukan
persenyawaan kompleks.
B. Titrasi berdasarkan reaksi redoks, yaitu titrasi yang melibatkan suatu
perubahan keadaan oksidasi atau didasarkan pada perpindahan elektron,
2.3.1.2. Titrasi Redoks
Titrasi redoks dapat dibedakan berdasarkan cara pemakaiannya :
1. Na2S203 sebagai titran, dikenal juga sebagai titrasi tak langsung
(Iodometri)
2. I2 sebagai titran, dikenal sebagai titrasi langsung (Iodimetri)
3. Suatu oksidator kuat sebagai titran, yang paling sering digunakan
adalah: a) KMnO4 b) K2Cr2O7 c) Ce (IV)
4. Suatu reduktor kuat sebagai titran.
Banyak pengerjaan titrasi redoks yang dilakukan dengan menggunakan indikator
warna. Ada beberapa macam indikator yang dapat digunakan dalam titrasi redoks
yaitu :
1. Suatu zat berwarna yang dapat bekerja sebagai indikator sendiri.
Contoh : KMnO4
2. Indikator spesifik yaitu suatu zat yang bereaksi dengan membentuk warna
yang khusus dengan salah satu pereaksi dalam suatu reaksi.
contoh : Amilum, KSCN
3. Indikator luar atau uji noda, indikator ini digunakan apabila tidak ada
diperoleh indikator dalam. Contoh : ion feri sianida untuk meneliti adanya
ion besi (II) dengan pembentukan warna biru turnbull diatas sebuah piring
noda diluar bejana titrasi.
4. Potensial redoks dapat diikuti selama titrasi dan titik ekivalennya
ditemukan dari perubahan yang besar dari potensial pada kurva titrasi.
contoh : pada titrasi potensiometri
5. Suatu indikator yang sendirinya mengalami oksidasi-reduksi, zat demikian
dapat ditunjuk sebagai suatu indikator indeks yang benar (R.A.Day dan
A.L.Underwood, 1992).
Biasanya dua jenis indikator digunakan untuk menentukan titik akhir
titrasi redoks, dimana indikator tersebut adalah indikator eksternal maupun
indikator internal. Indikator redoks ini tidak terlalu banyak karena molekul
organik dapat mengalami perubahan yang lebih radikal dalam titrasi tersebut
2.3.1.3. Titrasi yang melibatkan Iodium
Titrasi yang melibatkan Iodium dapat dilakukan dengan 2 cara yaitu:
a) Titrasi langsung (iodimetri)
Iodium merupakan oksidator yang relatif kuat dengan nilai potensial oksidasi
sebesar +0,535 V. Dalam metode ini, analat dioksidasi oleh I2 sehingga I2
tereduksi menjadi ion Iodida. Iod (I2) merupakan oksidator yang tidak terlalu kuat,
sehingga hanya zat-zat yang merupakan reduktor yang cukup kuat dapat dititrasi,
salah satu penggunaan dari titrasi ini memanfaatkan kesanggupan ikatan rangkap
zat organik untuk meng-addisi Iod, misalnya untuk penentuan bilangan Iod lemak
dan minyak. Deteksi titik akhir pada iodimetri ini dapat dilakukan dengan
menggunakan indikator amilum yang akan menghasilkan warna biru pada titik
akhir titrasi (Abdul Rohman, 2007).
b) Titrasi tidak langsung (Iodometri)
Analat harus berbentuk suatu oksidator yang cukup kuat, karena dalam metoda ini
analat selalu direduksi dulu dengan KI sehingga terbentuk I2 :
Oksanalat + I- Redanalat + I2
2S2O3= + I2 S406= + 2I- (W.Hardjadi, 1985)
Reaksi S2O3= dengan I2 berlangsung baik dari segi kesempurnaannya, berdasarkan
potensial redoks masing-masing :
S4O6= + 2e- 2S2O3= E0 = 0,08 volt
I2 + 2e- 2I- E0 = 0,536 volt
Titrasi dapat dilakukan tanpa indikator dari luar karena warna I2 yang dititrasi itu
akan lenyap bila titik akhir tercapai, warna itu mula-mula cokelat agak tua,
menjadi lebih muda, lalu kuning, kuning muda dan seterusnya sampai akhirnya
lenyap. Namun lebih mudah dan lebih jelas bila ditambahkan amilum sebagai
indikator (W.Hardjadi, 1985). Pada titrasi ini, sampel yang bersifat oksidator
direduksi dengan Kalium Iodida berlebih yang akan membebaskan Iodium yang
selanjutnya akan dititrasi dengan larutan baku Natrium Tiosulfat. Banyaknya
volume Natrium Tiosulfat yang digunakan sebagai titran setara dengan iodium
larutan netral, tetapi lebih cepat dalam larutan asam dan dipercepat dengan adanya
cahaya matahari. Setelah penambahan Kalium iodida pada larutan yang asam dari
suatu pereaksi oksidasi, larutan tidak boleh dibiarkan terlalu lama berhubungan
dengan udara, karena iodium akan terbentuk oleh reaksi terdahulu. Kalium Iodida
yang digunakan harus bebas Iodat karena kedua zat ini bereaksi dalam suasana
asam menghasilkan Iodium.
Beberapa hal yang harus diperhatikan dalam titrasi Iodometri yang dapat
bertindak sebagai sumber kesalahan titrasi adalah:
1). Kesalahan Oksigen, adanya Oksigen di udara dapat menyebabkan hasil titrasi
tidak akurat (terlalu tinggi), karena Oksigen dapat mengoksidasi ion Iodida
menjadi I2 dan reaksi ini mengarah pada pH rendah. Selain hal itu reaksi ini
dikatalisis oleh cahaya dan panas.
O2 + 4I- + 4H+ ↔ 2I2 + 2H2O
2). Pada pH tinggi akan muncul bahaya lain, yaitu bereaksinya I2 yang terbentuk
dengan air (hidrolisa) dan hasil reaksinya bereaksi lanjut:
4 ×{I2 + H2O ↔ HOI + I- + H+} (a)
4 × HOI + S2O3= + H2O ↔ 2SO4= + 4I- + 6H+ (b)
Tentu saja hal ini akan menyebabkan penggunaan Na2S203 menurun. Konstanta
kesetimbangan reaksi (a) lebih kecil, yaitu 10-13, namun pada pH tinggi kesetimbangan akan bergeser ke kanan sehingga pada pH sekitar 11,5 terjadi
kesalahan sampai 4%.
3). Penambahan Amilum terlalu awal
Banyak reaksi analat dengan KI yang berjalan agak lambat, karena itu perlu
ditunggu agar mencapai reaksi yang optimum sebelum dititrasi, tetapi tidak
disarankan untuk membiarkan larutan terlalu lama karena akan menyebabkan
Iodium menguap. Iodium merupakan zat padat yang sukar larut dalam air, tetapi
mudah larut dalam larutan KI membentuk ion I3-. Jadi KI yang ditambahkan
selain mereduksi analat, juga melarutkan I2 dari hasil reaksi, oleh karena itu KI
2.3.2. Analisis Instrumental
Analisis instrumental dikenal juga sebagai analisis fisiko-kimia, sebab pada
pengerjaannya, dalam penentuan sampel yang akan dianalisis dipakai instrumen
yang memadai dan yang ditentukan adalah sifat-sifat fisiko-kimia dari molekul
atau atom dalam sampel yang dianalisis. Analisis instrumental mengalami
perkembangan yang pesat karena kemajuan tehnik elektronika. Beberapa hal yang
membuat perkembangan yang pesat pada analisis instrumental ini yaitu adanya
tuntutan dan kebutuhan analisis terhadap matriks sampel yang sulit serta
diperlukannya waktu analisis yang singkat. Kesahihan analisis instrumental
didukung oleh kecermatan, ketelitian, keterulangan, sensitivitas, kelurusan,
kepemilahan, kemantapan, atau ketahanan dan kestabilan dari suatu metode
analisis yang digunakan (M. Mulja, 1995).
Terdapat beberapa tehnik atau metode analisis instrumental yang dapat
digunakan pada penentuan kadar Iodium dalam garam konsumsi, diantaranya
adalah :
1. Potensiometri
Potensial sel galvani bergantung pada aktivitas spesies ion tertentu dalam
larutan sel, oleh karenanya pengukuran potensial sel menjadi cukup
penting dalam kimia analisis. Dalam banyak kasus suatu sel dapat direka
sehingga potensialnya bergantung pada aktifitas suatu spesies ion tunggal
dalam larutan itu. Salah satu elektrode haruslah sedemikian rupa sehingga
potensialnya bergantung pada aktifitas ion yang akan ditetapkan, elektrode
itu disebut elektrode indikator, dan elektrode yang lain adalah pembanding
yang potensialnya diketahui dan tetap konstan selama penetapan
(Day,R.A. dan Underwood,A.L. 1992). Pada penentuan kadar Iodat
dengan metode potensiometri ini menggunakan Elektroda selektif ion
iodat. Perkembangan elektroda selektif ion ini berkembang sangat pesat
karena kelebihan-kelebihan yaitu memberikan respon secara selektif
terhadap spesi ion tertentu dan bagian luarnya akan mengadakan kontak
dengan spesi yang akan ditentukan, serta waktu analisis yang cepat.
konsentrasi analit yang dapat diukur, bilangan Nernst, dan batas deteksi.
Kisaran konsentrasi yang dapat diukur adalah batasan bawah dan atas
konsentrasi iodat yang masih memenuhi persamaan Nernst. Harga
bilangan Nernst ditentukan pada kisaran konsentrasi tersebut, sehingga
kedua parameter tersebut saling berkaitan. Ketiga parameter di atas sangat
dipengaruhi oleh keadaan fisik dari elektroda yaitu kerapatan dan
homogenitas ionofor pada lapisan membran.
2. Spektrofotometri Sinar Tampak
Tehnik spektrofotometri adalah salah satu tehnik analisis fisiko-kimia
yang mengamati tentang interaksi atom atau molekul dengan radiasi
elektromagnetik (M. Mulja, 1995). Di dalam metode spektrofotometri,
larutan sampel mengabsorpsi radiasi elektromagnetik dari suatu sumber
cahaya tertentu dan jumlah sinar yang diabsorpsi adalah sebanding dengan
konsentrasi analit yang ada di dalam larutan. Metode ini dapat digunakan
untuk menentukan kadar Iodium berdasarkan intensitas serapan pada
panjang gelombang yang dibentuk oleh warna larutan yang mengandung
sampel Iodium tersebut. Panjang gelombang yang digunakan adalah
panjang gelombang maksimum yang memberikan absorbansi serapan
maksimum. Alasan dilakukan pengukuran pada panjang gelombang
tersebut adalah perubahan absorban untuk setiap satuan konsentrasi adalah
paling besar pada panjang gelombang maksimum sehingga akan diperoleh
kepekaan analisis yang maksimal. Disamping itu pita serapan di sekitar
panjang gelombang maksimum datar dan pengukuran ulang dengan
kesalahan yang kecil yang dengan demikian akan memenuhi hukum
Lambert-Beer. Kelemahan dari metode ini yaitu metode ini membutuhkan
suatu zat yang dapat menghasilkan warna yang spesifik ketika
3. Kromatografi Cair Kinerja Tinggi Pasangan Ion
Pada umumnya metode kromatografi untuk pemisahan spesi ion
digunakan dengan cara pertukaran ion, namun sekarang menggunakan
metode yang lebih mudah yaitu menggunakan metode kromatografi
pasangan ion. Metode kromatografi cair kinerja tinggi pasangan ion
umumnya menggunakan sistem pelarut air dicampur dengan metil alkohol
ataupun asetonitril. Kolom yang digunakan adalah kolom fase balik
dengan gugus alkil C18. Agar senyawa ini mempunyai sifat lipofil yang
memadai sehingga dapat tertahan dalam kolom, ditambahkan ion lawan ke
dalam eluen. Senyawa yang terionisasi (R-)aq yang larut dalam air dapat
diekstraksi ke dalam pelarut organik dengan menggunakan ion lawan yang
cocok (TBA+)aq dan bergabung membentuk suatu pasangan ion
(R-TBA+)aq yang mempunyai afinitas yang memadai terhadap kolom fase
balik sehingga terjadi retensi yang berbeda. Penentuan kadar Iodium dapat
dilakukan dengan menggunakan metode kromatografi cair kinerja tinggi
pasangan ion, dimana metode ini mempunyai selektivitas yang tinggi,
handal dan lebih baik dibandingkan dengan metode lain untuk penentuan
sampel ionik. Selain itu metode ini mempunyai daya pisah yang sangat
baik antara semua senyawa bukan ionik sehingga tidak ada gangguan
antara elusi senyawa ionik dan bukan ionik. Oleh karena itu metode ini
dapat digunakan untuk memisahkan senyawa ionik dan bukan ionik dalam
sampel (Ahuja,S. 1989).
4. X-Ray Fluorescence
Metode X-ray Fluorescence dapat dipergunakan untuk menganalisis unsur
iodium dalam sampel yang berwarna seperti halnya iodium dalam bumbu
dapur. Prinsip pengukuran X-ray Fluorescence berdasarkan atas terjadinya
proses eksitasi elektron pada kulit atom bagian dalam ketika atom suatu
unsur tersebut ditembaki sinar-X, kekosongan elektron tersebut akan diisi
oleh elektron bagian luar dengan melepaskan energi yang spesifik untuk
setiap unsur. Pengujian dengan metode X-ray Fluorescence dilakukan
dalam sampel dengan besarnya intensitas iodium dalam larutan standar
menggunakan perhitungan garis regresi. Intensitas yang diukur oleh alat
X-ray Fluorescence berasal dari proses eksitasi elektron pada kulit bagian
dalam dari atom iodium. Oleh karena itu metode X-Ray Fluorescence ini
akan memberikan nilai intensitas secara total dari iodium dalam semua
bentuk senyawa baik itu iodat (IO3-), iodida (I-), iodium (I2), dan
sebagainya. Metode X-ray Fluorescence adalah metode yang lebih tepat
dibandingkan metode iodometri untuk menganalisis iodat dalam matrik
bumbu dapur, karena X-ray Fluorescence dapat menganalisis iodat dalam
berbagai bentuk dan analisisnya tidak dipengaruhi oleh warna sedangkan
iodometri hanya dapat menganalisis dalam bentuk iodat saja disamping
analisisnya dipengaruhi oleh perubahan warna (Nelson Saksono, 2002).
2.4. Indikator Amilum
Amilum dapat dipisahkan menjadi 2 komponen utama yaitu amilosa dan
amilopektin, yang terdapat dalam proporsi berbeda dalam berbagai
tumbuh-tumbuhan. Amilosa adalah suatu senyawa berantai lurus dan terdapat melimpah
pada pati kentang, memberi warna biru ketika berikatan dengan iod dan rantainya
mengambil bentuk spiral. Amilopektin merupakan senyawa yang mempunyai
struktur rantai bercabang, membentuk suatu produk berwarna ungu-merah,
mungkin dengan adsorpsi (J.Basset, 1994). Keunggulan Indikator ini terutama
terletak pada harganya yang murah dan warna biru dari kompleks kanji-iodium
dapat dipakai untuk suatu uji yang sangat peka terhadap iodium. Kepekaan akan
lebih besar terhadap larutan yang sedikit asam daripada larutan netral dan lebih
besar lagi dengan hadirnya ion iodida (R.A.Day dan A.L.Underwood, 1992).
Beberapa kelemahan dari indikator Amilum yaitu : (1) tidak dapat larut dalam air
dingin, (2) suspensinya tidak stabil dalam air, (3) dengan iod menghasilkan suatu
kompleks yang tidak dapat larut dalam air sehingga Amilum tidak dapat
ditambahkan terlalu awal dalam titrasi karena itu dalam titrasi iodometri ini
penambahan indikator dilakukan mendekati titik akhir ketika warna mulai
dan menyebabkannya sukar terlepas yang akan menyebabkan warna biru sulit
hilang sehingga titik akhir tidak kelihatan tajam lagi, dan bahkan apabila Iod
masih banyak sekali akan dapat menguraikan amilum dan hasil penguraian ini
mengganggu perubahan warna pada titik akhir (W.Hardjadi, 1985), (4)
Kadang-kadang terdapat titik akhir yang sulit diamati bila larutan encer (R.A.Day dan
A.L.Underwood, 1992).
2.5. Larutan Baku Na2S2O3
Larutan standar yang umumnya digunakan dalam titrasi iodometri adalah Natrium
Tiosulfat. Garam ini biasanya tersedia dalam bentuk pentahidratnya
Na2S2O3.5H2O. Larutan ini bukanlah merupakan suatu larutan standar primer
sehingga harus distandarisasi terlebih dahulu sebelum penggunaannya, dan larutan
ini tidak stabil untuk waktu yang lama. Kestabilan larutan mudah dipengaruhi
oleh pH rendah, sinar matahari, dan terutama adanya bakteri yang memanfaatkan
Sulfur hingga terbentuk SO32-, SO42- dan belerang koloidal. Tiosulfat dapat terurai
dalam larutan asam, membentuk belerang sebagai endapan seperti susu (R.A.Day
dan A.L.Underwood, 1992).
S2O32- + 2H+ H2S203 H2SO3 + S(P)
akan tetapi reaksinya lambat dan tidak akan terjadi apabila tiosulfat dititrasi dalam
larutan asam dari iodium jika larutannya diaduk dengan baik, karena reaksi antara
tiosulfat dengan iodium lebih cepat dari reaksi peruraian.
I2 + 2S2032- 2I- + S4O62-
Reaksi itu cepat dan berlangsung sampai lengkap dan tidak ada reaksi samping.
Apabila pH larutan diatas 9, maka tiosulfat akan dioksidasi sebagian menjadi
sulfat: 4I2 + S2O32- + 5H2O 8I- + 2SO42-+ 10H+
Pada pembuatan larutan Natrium Tiosulfat air yang digunakan dididihkan terlebih
dahulu untuk membuatnya bebas dari kuman dan seringkali ditambahkan
kloroform, boraks, natrium karbonat sebagai pengawet. Beberapa larutan standar
primer yang umumnya digunakan untuk standarisasi Natrium Tiosulfat yaitu
Kalium Iodat, Kalium Bromat, Kalium Dikromat, Larutan iod standar, Serium
BAB 1
PENDAHULUAN
1.1. Latar Belakang
Garam merupakan bahan tambahan pangan yang sangat penting dalam kehidupan
sehari-hari. Hampir seluruh makanan umumnya menggunakan garam sebagai
penyedap / pemberi cita rasa pada makanan, selain itu digunakan juga sebagai
pengawet makanan serta banyak digunakan untuk bahan tambahan dalam industri
pangan. Selain itu, karena harga garam konsumsi yang relatif murah dan
terjangkau oleh semua lapisan masyarakat maka pemerintah memilih garam
konsumsi sebagai sarana untuk memenuhi angka kecukupan Iodium setiap
harinya, karena Iodium tidak dapat diproduksi sendiri oleh tubuh. Iodium yang
terdapat dalam garam tersebut merupakan salah satu dari mineral yang bersifat
sensitif terhadap panas dan cahaya. Iodium yang terdapat dalam bahan makanan
tidak 100% masuk ke dalam sistem pencernaan kita. Proses pengolahan bahan
makanan yakni pemberian garam pada suhu tinggi apalagi sampai masakan
mendidih akan mengurangi ketersediaan Iodium dari garam tersebut dan
hilangnya Iodium selama pengolahan berbanding lurus dengan suhu dan waktu
pengolahan. Semakin tinggi suhu dan semakin lama waktu yang digunakan untuk
mengolah suatu bahan makanan, maka akan semakin tinggi jumlah Iodium yang
hilang.
Iodium merupakan mineral esensial yang sangat dibutuhkan oleh tubuh
karena memainkan peranan penting pada sistem metabolisme manusia dan hewan
yang jumlahnya sangat sedikit di dalam tubuh, yaitu kurang lebih 0,00004% dari
berat badan atau 15-23 mg. Sekitar 75% terdapat di dalam kelenjar tiroid yang
digunakan untuk mensintesis hormon tiroksin, tetraiodotironin (T4), dan