PEMBENTUKAN SILIKA DAN ASAM LEMAK TAK
JENUH RANTAI PANJANG DIATOM LAUT
Chaetoceros gracilis
ALBERTA RIKA PRATIWI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI DISERTASI DAN
SUMBER INFORMASI
\
Dengan ini saya menyatakan bahwa disertasi Kajian Protein yang Mengkatalisis Pembentukan Silika dan Asam Lemak Tak Jenuh Rantai Panjang Diatom Laut Chaetoceros gracilis adalah karya saya sendiri dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
@ Hak cipta milik IPB, tahun 2010
Hak cipta dilindungi undang-undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
KAJIAN PROTEIN YANG MENGKATALISIS
PEMBENTUKAN SILIKA DAN ASAM LEMAK TAK
JENUH RANTAI PANJANG DIATOM LAUT
Chaetoceros gracilis
ALBERTA RIKA PRATIWI
Disertasi
sebagai salah satu syarat untuk memperoleh gelar Doktor pada
Program Studi Ilmu Pangan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
gracilis
Nama : Alberta Rika Pratiwi
NIM : F261040061
Disetujui
Komisi Pembimbing
Ketua
Prof. Dr. Ir. Maggy Thenawidjaya Suhartono,
Dr. Ir. Dahrul Syah
Anggota Anggota
Dr. Ir. Linawati, MS
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana Program Doktor
Dr. Ir. Ratih Dewanti-Haryadi, M.Sc Prof. Dr. Ir. Khairil Anwar Notodiputro, MS
PRAKATA
Puji syukur dipanjatkan kepada Tuhan Yang Maha Esa atas rahmatNya, sehingga penulis dapat menyelesaikan penelitian yang berjudul Kajian Protein yang Mengkatalisis Pembentukan Silika dan Asam Lemak Tak Jenh Rantai Panjang Diatom Chaetoceros gracilis sebagai syarat menempuh program doktor di Institut Pertanian Bogor.
Ucapan terimakasih penulis ucapkan kepada Prof. Dr. Ir. Maggy Thenawidjaja Suhartono sebagai ketua komisi, Dr. Dahrul Syah dan Dr. Ir. Linawati, MS sebagai anggota komisi, yang telah meluangkan waktu memberikan bimbingan dalam penelitian dan penulisan laporan selama menempuh pendidikan program doktor di program studi Ilmu Pangan – Sekolah Pascasarjana Institut Pertanian Bogor.
Penulis juga mengucapkan terimakasih kepada Yayasan Sanjaja melalui Rektor Universiats Katolik Soegijapranata-Semarang yang telah memberikan beasiswa program studi S3, Direktorat Pendidikan Tinggi yang telah membiayai sebagian penelitian melalui program Hibah Bersaing tahun 2007/2008 juga kepada Dekan Sekolah Pascasarjana IPB untuk program Hibah Penelitian Doktor tahun 2009 hingga penelitian ini dapat selesai. Tidak lupa penulis sampaikan terimakasih yang sedalam-dalamnya kepada Dra. Lily M. Panggabean M.Sc di laboratorium Budidaya Mikroalga LIPI Jakarta yang telah memperkenankan penulis menggunakan kultur diatom Chaetoceros gracilis sebagai materi penelitian, kepada Dekanat Fakultas Teknobiologi, Universitas Katolik Atmajaya Jakarta, kepada Dr. Ita Juwita dari Fakultas Kedokteran Hewan IPB dan kepada Dr. Wiryono SJ dari Universitas Katolik Sanata Dharma Yogyakarta yang telah memfasilitasi penelitian ini khususnya dalam analisis 2 dimensi.
Kepada para staf dan teknisi yang telah membantu penelitian di laboratorium Budidaya Mikroalga-LIPI Jakarta, laboratorium Mikrobiologi Keamanan Pangan, Kimia Pangan Seafast Center IPB dan laboratorium di lingkungan Pusat Penelitian Sumberdaya Hayati dan Bioteknologi-IPB, laboratorium Kimia-LIPI Bandung, laboratorium Biokimia dan Teknologi Enzim Fakultas Teknobiologi Atmajaya serta laboratorium terpadu Fakultas Kedokteran Hewan-IPB, penulis mengucapkan terimakasih atas bantuan dan semangatnya dalam menyelesaikan penelitian.
Kepada seluruh bapak ibu, saudara dan saudari di progarm S3 IPN serta semua teman-teman di progdi Ilmu Pangan yang tergabung dalam FORMASIP. Kepada semua rekan dan sahabat yang tidak dapat penulis sebutkan satu-persatu, penulis mengucapkan terimakasih sebesar-besarnya atas doa, kerjasama dan persahabatan selama ini. Penulis juga mengucapkan terimakasih kepada ibu, adik-adik serta saudara-saudara untuk doa dan semangat yang diberikan selama ini.
Penulis dilahirkan di Solo pada tanggal 8 Mei 1966, sebagai anak pertama dari 5 bersaudara dari bapak Dominikus Soekisno (alm.) dan ibu Theresia Sri Partini. Pendidikan sarjana strata satu ditempuh di Fakultas Biologi Universitas Gadjah Mada Yogyakarta lulus tahun 1991. Tahun 1996 melanjutkan pendidikan strata dua di program studi Mikrobiologi, Departemen Biologi-FMIPA Institut Teknologi Bandung lulus tahun 1999. Pada tahun 2004 penulis memperoleh kesempatan studi jenjang S3 dari Yayasan Sanjaja-Universitas Katolik Soegijapranata di progran studi Ilmu Pangan Institut Pertanian Bogor.
Setelah lulus strata satu penulis menjadi staf di Lembaga Studi Realino-Yogyakarta tahun 1991-1993. Tahun 1993 menjadi staf peneliti Lembaga Penelitian dan Pengabdian Universitas Katolik Soegijapranata Semarang dan tahun 1995 hingga sekarang menjadi staf pengajar di program studi Teknologi Pangan Fakultas Teknologi Pertanian Universitas Katolik Soegijapranata Semarang.
Sebagian hasil penelitian penulis pada program S3, telah dipresentasikan dan dipublikasikan baik sebagai penulis utama maupun penulis kedua. Karya yang berjudul Characterization of Silaffin-like protein which Catalyze Formation Silica Stucture Isolated from Indonesian Marine Diatom telah dipresentasikan dalam bentuk
Penguji luar ujian tertutup:
drh. Sulistyani, M.Sc, Ph.D
Departemen Biokimia-FMIPA Institut Pertanian Bogor Prof. Dr. Ir. Alex Hartana
Departemen Biologi-FMIA Institut Pertanian Bogor Penguji luar ujian terbuka:
Raymon Tjandrawinata, PhD,MS,MBA
Direktur Laboratorium Biomolekuler, PT Dexa Medica-Jakarta Prof. Dr. Hari Eko Irianto
Halaman
DAFTAR TABEL ... xi
DAFTAR GAMBAR ... xii
DAFTAR LAMPIRAN ... xiv
PENDAHULUAN... 1
Latar Belakang ... Tujuan Penelitian ... Manfaat Penelitian ... 1 5 5 TINJAUAN PUSTAKA... 6
Karakteristik Diatom Chaetoceros gracilis... Polimer Silika, Biosilika dan Aplikasi dalam Bidang Pangan ... Asam Lemak Dan Biosintesis Polyunsaturated Fatty Acid Diatom... 6 8 18 METODE DAN BAHAN ... ... 24
Tempat Pelaksanaan Penelitian ... Bahan dan Alat ... Tahap Penelitian I ... Tahap Penelitian II………... Tahap Penelitian III ... 24 25 26 28 30 HASIL DAN PEMBAHASAN 35 Profil Protein dan Lipid Chaetoceros gracilis Selama Pertumbuhan ... Karakteristik Protein Total Berdasarkan Analisis 2 Dimensi ... Karakteristik Protein yang Terlibat dalam Biosintesis Nanosilika ... Asam Lemak dan Karakteristik Protein Terlibat Biosintesis PUFA ... Hipotesis Jalur Biosintesis DHA Chaetoceros gracilis... 35 41 45 54 76 SIMPULAN DAN SARAN ... 89
Halaman
1 Karakteristik protein SIT C. gracilis berdasarkan analisis 2 dimensi ……… 46 2 Berat molekul protein silaffin yang telah diketahui dari berbagai jenis diatom 53
3 Prosentase relatif asam lemak terhadap asam lemak total dari fase akhir eksponensial hingga fase kematian pertumbuhan C. gracilis ……… ……. 55 4 Berat molekul (kDa) dan titik isoelektrik protein protein terdeteksi yang terlibat
dalam sintesis PUFA C.gracilis ……… 70
5 Karateristik berat molekul dan titik isoelektrik dari berbagai diatom……….. 71
6 Protein enzim yang terlibat sintesis PUFA dan PUFA yang ditemukan dalam
setiap fase pertumbuhan C. gracilis……….. 75 7 Protein enzim yang teridentifikasi pada C. gracilis yang terlibat dalam
biosintesis PUFA dan asam lemak yang menjadi substrat serta produk yang
mungkin terbentuk sebagai hasil aktivitas protein enzimnya... 77
8 Reaksi desaturasi dan elongasi yang dibuat berdasarkan 4 kategori yang melibatkan unsur asam lemak substrat, enzim dan asam lemak produk ...
79
0 Halaman
1 Skema reproduksi aseksual pada diatom secara skematis (Round et
al.1990) ... 7
2. Struktur dinding sel silicaseous dari jenis diatom berbeda . A. Diatom Cymathoneis sp. B. Diatom Anorthoneis sp (Round et al. 1990).... 12
3. Pembentukan dinding sel silicaseous dalam siklus sel diatom (Kröger & Wetherbee, 2000) ... 13
4. Hasil SEM presipitasi silika yang terbentuk dari katalis (A) sil 1A dan (B) Silaffin campuran dari C. fuciformis (Kröger et al. 1999) ... 16
5. Hasil SEM presipitasi silika dengan pori tak beraturan menggunakan katalis gabungan Sil 2 dan Sil 1A C. Fuciformis (Poulsen et al. 2003) 16 6. Biosintesis keluarga PUFA omega 9, 6 dan 3 dari mikroalga (Yap & Chen 2001) ... ... 22
7. Hipotesis biosintesa EPA P. tricornutum (Arao & Yamada 1994) ... 23
8. Hipotesis biosintesa EPA P. tricornutum (Domergue et al. 2002) ... 23
9. Skema garis besar penelitian ... 24
10. Skema penelitian tahap I ... 26
11. Skema penelitian tahap II ... 29
12. Skema penelitian tahap III ... 31
13. Prinsip kerja metode analisis 2 dimensi ... 33
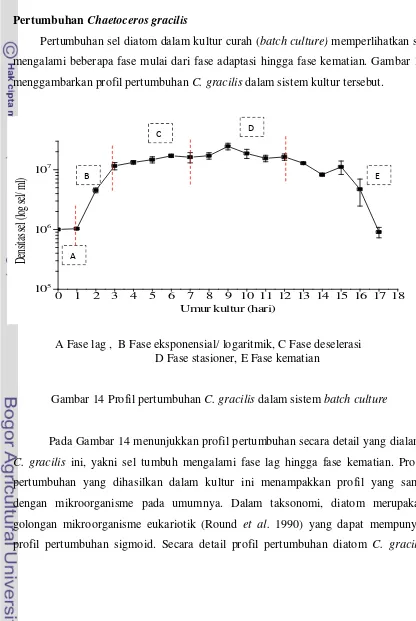
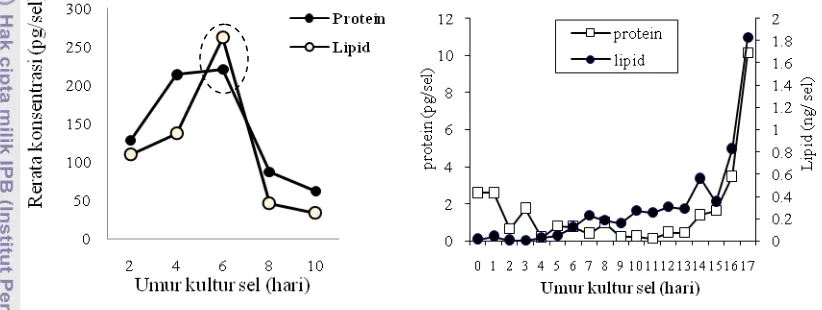
14. Profil pertumbuhan C. gracilis dalam sistem batchculture…………. 35
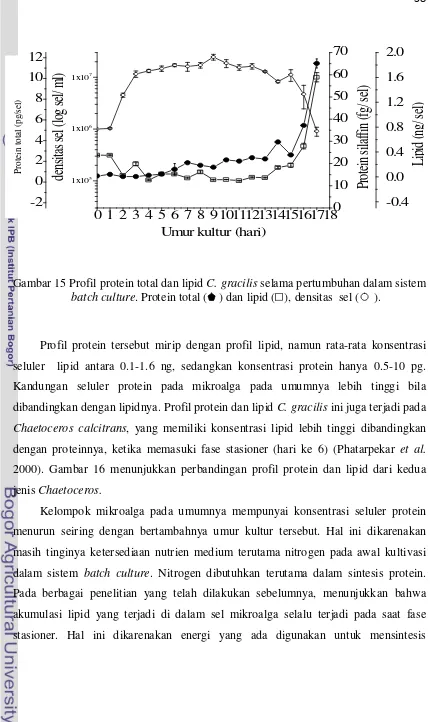
15. Profil protein dan lipid C. gracilis selama pertumbuhan dalam sistem batch culture……….……….. 38 16. Konsentrasi seluler protein dan lipid C.calcitrans (Phatarpekar et al. 2000) (A) dan C. gracilis (B) pada pertumbuhan dalam kultur sistem batch. Tanda garis merah (---) menunjukkan fase atau umur kultur yang menunjukkan konsentrasi protein lebih rendah dari lipid. ... 39
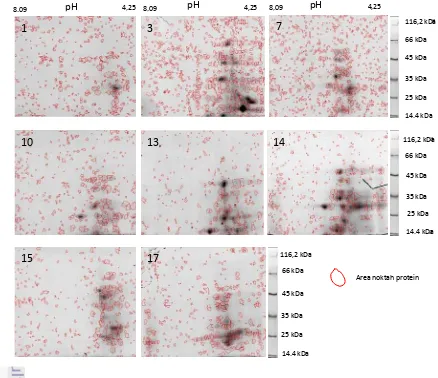
17. Protein yang terdeteksi hasil analisis 2 dimensi protein C.gracilis … 41 18. Hasil analisis 2 dimensi pada diatom Thalassiosira pseudonana (Sandia National Laboratories-USA, hasil 2 dimensi pada Chaetoceros gracilis (B)……… 42
19. Jumlah noktah protein dan volume noktah protein hasil deteksi program melanie selama pertumbuhan C.gracilis ……….. 44
21. Grafik hubungan antara volume total protein SIT dan bobot frustule
C. gracilis. ... 48
22. Profil silaffin dan silika frustule yang terbentuk selama pertumbuhan
C.gracilis ... 50 23. Analisis 2 dimensi terhadap protein silaffin (A), gambar 3 dimensi
tiap noktah 5 fraksi protein silaffin (B).……….. 52
24 Scanning Electron Microscope polimer silika hasil reaksi in vitro protein silaffin C. gracilis dengan substrat TEOS (Manurung et al.
2007)... ... 54 25 Komposisi saturated fatty acid (SAFA), monounsaturated fatty acid
(MUFA) dan polyunsaturated fatty acid (PUFA) dari C. gracilis
selama pertumbuhan. ... 56 26 Komposisi SAFA (proporsi relatif dari total SAFA) selama
pertumbuhan C.gracilis. ………... 58 27 Komposisi MUFA (proporsi relatif dari total MUFA) selama
pertumbuhan C.gracilis ……… 59
28 Konsentrasi asam oleat (proporsi relatif dari total asam lemak) sebagai substrat pembentukan total PUFA selama pertumbuhan C. gracilis Lingkaran garis titik-titik menunjukkan umur kultur ketika
konsentrasi asam oleat terendah sedangkan PUFA tertinggi ……… 60 29 Komposisi PUFA (proporsi relatif dari total PUFA) selama
pertumbuhan C.gracilis ……….. 61 30 Pembentukan arachidonic acid/ AA(20:4-ω6) melalui asam
eikosadienoat (20:2ω6) and asam γ-linolenic (18:3ω6) yang dikatalisis oleh desaturase ∆8, desaturase ∆5 dan elongase (Khozin et
al. 1997)……….. 64
31 Noktah protein yang terdeteksi berperan dalam sintesis PUFA C.
gracilis (tanda lingkaran merah) ……… 68 32 Noktah protein transport asam lemak yang terdeteksi pada umur
xiv
halaman
1 Kurva standar titik isoelektrik dan berat molekul ………... 98
Latar Belakang
Nanosilika adalah material silika berskala nano yang akhir-akhir ini menjadi
bahan penting untuk berbagai alat. Pada bidang pangan nanosilika dimanfaatkan
antara lain sebagai filtering agent, yakni komponen membran ultrafiltrasi industri minuman, dan elemen alat analitik bionanosensor serta bahan komposit active packaging. Silika sendiri merupakan polimer yang tersusun dalam tiga dimensi dari silikon dioksida (SiO2
Metode-metode yang digunakan untuk memperoleh silika (polimer) dengan
kemurnian tinggi atau silikon (unsur silika) yang diaplikasikan di industri, pada
umumnya menggunakan kondisi-kondisi yang ekstrim seperti temperatur, tekanan
dan prekursor yang sering bersifat toksik. Misalnya silika-silika ultrapure polycrystalline silicon dan silicon carbide sebagai bahan semikonduktor diperoleh dengan cara meleburkan quartz pada tungku temperatur tinggi hingga ribuan derajat celcius (Maeda & Komatsu 1996). Lapisan silikon diosida (wafer) silica chip yang merupakan salah satu komponen penting komputer dibuat dari polisilikon yang
merupakan reaksi triklorosilane dengan hidrogen dengan suhu 1000°C dan dikristalkan dengan suhu 1200 °C (Rhicardson, 2001). Kondisi ekstrim yang juga melibatkan bahan kimia berbahaya, menjadi evaluasi mendasar dalam industri silika
akhir-akhir ini.
) yang banyak ditemukan di alam. Silika memiliki sifat tidak
berwarna, tidak berasa dan secara fisiologi bersifat inert, tahan terhadap reaksi kimia
pada temperatur biasa tetapi dapat mengalami berbagai transformasi pada temperatur
tinggi. Karakteristik demikian menyebabkan banyaknya aplikasi berbasis silika.
Polyunsaturated fatty acid (PUFA) merupakan asam lemak dengan rantai hidrokarbon panjang dan memiliki ikatan rangkap lebih dari satu dalam bentuk cis sehingga mempunyai sifat tidak jenuh. PUFA dengan rantai sangat panjang seperti
karena peranannya dalam bidang kesehatan. Secara individu AA dalam tubuh
manusia berperan sebagai prekursor sejumlah eukosanoid atau sebagai prekursor
molekul proinflamantori untuk respon sistem imun. EPA diperlukan bagi penderita
depresi atau bipolar disorder sedangkan DHA bersama EPA diperlukan untuk mengurangi risiko penyakit jantung koroner dan digunakan sebagai proteksi terhadap
kanker. Meskipun AA, EPA dan DHA secara komersial telah diproduksi dari fungi,
ikan, minyak ikan dan jaringan hewan serta mikroalga, namun hal tersebut telah
menjadi bahan evaluasi yang berkaitan dengan produktivitas dan sumber bahan baku
yang tidak dapat diterima semua konsumen.
Sementara, di alam terdapat organisme salah satu keluarga mikroalga yakni
diatom yang menghasilkan silika dan PUFA hingga rantai panjang. Karakteristik
diatom adalah memiliki silika sekitar 90% sebagai komponen dinding selnya dengan
struktur teratur berskala nano, menyimpan cadangan makanannya berupa lipid
(Round et al. 1990) dan secara genetis memiliki kemampuan mensintesa PUFA sendiri secara langsung karena enzim yang dimilikinya (Yap & Chen 2001). Hasil
penelitian Dunstan et al. (1994) menunjukkan bahwa diatom mampu menghasilkan PUFA sekitar 3-62% dari total asam lemak. Kedua bahan tersebut (silika dan PUFA
diproduksi oleh diatom melalui suatu mekansime sintesis yang melibatkan biokatalis
protein tertentu.
Silika dengan morfologi yang teratur, presisi dan berukuran nano (10-9) yang
dimiliki setiap diatom, secara genetis dikontrol oleh protein yang berlangsung dalam
kondisi ringan. Protein yang berperan dalam proses silifikasi diatom telah ditemukan,
yakni silisic acid transport protein (protein SIT), yang berperan membawa asam silikat dari lingkungannya melewati lipid bilayer masuk ke dalam silica deposition vesicle (SDV) dan protein silaffin (silica affinity) yang berperan dalam polimerisasi asam silikat menjadi nanosilika di dalam SDV (Hildenbrand et al. 1997; Kröger et al. 1999). Protein-protein tersebut telah diketahui mengatur biosilifikasi secara in vivo dalam sistem metabolisme pada kondisi lingkungan alam yang ringan. Dengan
telah melakukan reaksi in vitro protein silaffin diatom Chilindrotheca fuciformis dengan susbtrat Tetraethoxyorthosilicate (TEOS) untuk menghasilkan polimer nanosilika dalam beberapa menit pada temperatur ruang. Sementara Manurung et al. (2007) juga telah berhasil mengekstraksi protein silaffin dari diatom Chaetoceros gracilis dan mereaksikan secara in vitro dengan TEOS menghasilkan polimer silika dalam waktu 10 menit pada suhu ruang (26-28°C).
Dengan mempelajari protein yang terlibat dalam biosilifikasi in vivo akan membuka pemahaman baru dalam mendesain proses pembentukan material berbasis
silika secara ramah lingkungan. Menurut Poulsen & Kröger (2004), sekuen asam
amino protein silaffin yang diisolasi dari dua jenis diatom yang berbeda tidak saling
memiliki homologi, sehingga setiap jenis diatom diduga memiliki karakteristik
protein silaffin yang khusus sesuai dengan karakteristik struktur nanosilika yang
dimiliki. Dengan demikian masih diperlukannya informasi protein-protein yang
terlibat dalam biosintesis silika dari spesies-spesies diatom spesifik, misalnya dari
laut tropis seperti perairan wilayah Indonesia. Hal ini bertujuan untuk menghasilkan
polimer nanosilika spesifik yang dapat diaplikasikan untuk setiap kebutuhan secara
khusus.
Diatom mensintesis omega 6 (AA) maupun omega 3 (EPA dan DHA) secara de novo. Hal ini sangat berbeda dengan hewan termasuk mamalia yang hanya mampu menghasilkan PUFA rantai panjang apabila memperoleh prekursor C18 (asam
linoleat dan asam α-linolenat) dari makanannya, sedangkan tanaman hanya mampu
menghasilkan PUFA hingga C18. Diatom dan juga mikroalga lainnya melakukan
reaksi desaturasi dan elongasi untuk memperpanjang rantai C18 dengan enzim
desaturase dan elongase yang dimiliki. Enzim desaturase Δ6, Δ5 dan Δ4 merupakan
karakteristik utama yang dimiliki mikroalga pada umumnya.
Berbagai karakterisasi protein enzim desaturase dan elongase khususnya
pembentuk AA, EPA dan DHA dari berbagai jenis mikroalga telah mulai dilaporkan.
Sebagai contohnya adalah protein enzim desaturase Δ6 yang mengkatalisis
pembentukan 18:3Δ6,9,12 (ω6) dan Δ5 yang bekerja pada asam lemak atom C20
Phaeodactylum tricornutum (Demergue et al. 2002). Sementara Tonon et al. (2005), telah mengidentifikasi gen-gen yang mengkode desaturase Δ6, Δ5 dan Δ4 yang
terlibat langsung dalam biosintesis EPA dan DHA dari diatom Thalassiosira pseudonana. Setiap jenis diatom secara genetik dapat memiliki jenis PUFA yang berbeda-beda dari C16 hingga C22 yang dipengaruhi oleh jalur biosintesis dan
protein pembentuknya. Jalur biosintesis long chain-PUFA diatom belum sepenuhnya diketahui, karena begitu beragamnya jenis-jenis asam lemak yang dimiliki untuk
setiap jenis diatom. Berbagai studi gen maupun protein yang terlibat dalam sintesis
PUFA dari berbagai jenis organisme penghasil PUFA de novo telah dilakukan untuk meningkatkan produksi PUFA melalui sumber-sumber alternatif termasuk
kemungkinan memproduksi vegetable oil yang dapat mengandung PUFA (Vrinten et al. 2007).
Untuk itu masih sangat diperlukan kajian mendalam untuk memberikan
informasi dasar mekanisme biosintesis PUFA terkait dengan protein yang
mensintesisnya dari berbagai sumber termasuk jenis-jenis diatom. Studi protein yang
terlibat dalam biosintesis PUFA ini memberikan pengetahuan dasar dalam
meningkatkan produksi PUFA penting secara spesifik melalui berbagai kemungkinan
rekayasa bioteknologi untuk memproduksi misalnya DHA-enriched crops.
Dalam kultur sistem batch dengan medium yang mengandung silikat, diatom mengakumulasi lipid ketika memasuki fase stasioner atau pada saat konsentrasi
nutrien medium mulai menurun. Roessler (1988), telah membuktikan bahwa aktivitas
enzim sitrat sintase dan asetil KoA karboksilase meningkat 3 kali ketika silica depletion. Hal ini mengindikasikan adanya suatu hubungan yang berkaitan dengan waktu sintesis silika dinding sel dan lipid atau asam lemak di dalam kultur diatom.
Sintesis dinding sel silicaseous sangat aktif ketika sel melakukan pembelahan. Mekanisme demikian berpeluang mengeskplorasi organisme diatom ini dengan
mempelajari mekanisme dasar sintesis kedua bahan (silika dan PUFA) yang diketahui
memiliki nilai ekonomi penting saat ini.
aspek molekuler untuk tujuan eksplorasi PUFA dan nanosilika. Diatom jenis tersebut
juga merupakan jenis yang dapat dan mudah dikulturkan. Disamping itu telah
dilakukan studi awal karakteristik ekstrak protein silaffin C. gracilis asal laut Indonesia ini, yang terbukti mampu mengkatalisis pembentukan polimer silika secara
in vitro pada suhu ruang dalam beberapa menit.
Tujuan Penelitian
Berdasarkan latar belakang yang disampaikan, maka tujuan umum dari
penelitian ini adalah mengkaji protein yang terlibat dalam biosintesis nanosilika dan
biosintesis asam lemak tak jenuh rantai panjang dari diatom laut C. gracilis asal Indonesia. Secara lebih terperinci penelitian ini bertujuan, 1) mempelajari profil
protein dan lipid C. gracilis selama pertumbuhan dalam kultur sistem batch, 2) mempelajari karakteristik (berat molekul dan titik isoelektrik) protein melalui analisis
2 dimensi dan studi bioinformatika untuk identifikasi protein yang terlibat dalam
biosintesis nanosilika dan 3) mempelajari karakteristik (berat molekul dan titik
isoelektrik) protein melalui analisis 2 dimensi dan studi bioinformatika untuk
mengidentifikasi jenis protein yang terlibat dalam biosintesis PUFA dan memprediksi
jalur biosintesis PUFA.
Manfaat Penelitian
Penelitian ini diharapkan dapat memberikan informasi dasar pada tingkat
protein dalam mempelajari biosintesis nanosilika dan PUFA dari diatom C. gracilis asal laut Indonesia. Informasi ini sebagai langkah awal di dalam pengembangan
industri strategis untuk merancang produksi material berbasis nanosilika secara
ramah lingkungan dan pengembangan industri asam lemak rantai panjang secara
Karakteristik Diatom Chaetoceros gracilis
Karakteristik Umum Diatom
Diatom adalah nama populer untuk semua organisme yang masuk dalam
kelas Bacillariophyceae. Diatom merupakan organisme uniseluler berukuran 10-200 µm, memiliki pigmen klorofil a, c1, c2 dan karotenoid, hidup bebas secara
fotosintetik autotrof sebagai fitoplankton. Oleh karena ukurannya kecil, maka
disebut sebagai mikroalga, meskipun dapat ditemukan dalam bentuk koloni
hingga mencapai panjang beberapa milimeter membentuk spiral, heliks dan
zig-zag (Round et al. 1990).
Konstruksi dinding biosilika diatom yang disebut dengan frustule memiliki bentuk seperti petridish, yang mempunyai bagian yang saling berpotongan disebut girdle band (copulae). Bidang-bidang yang saling berpotongan tersebut, bagian atas disebut epiteka dan bagian bawah disebut hipoteka. Bagian atas permukaan setiap theca disebut valve mempunyai permukaan dengan pola pori-pori teratur disebut areolae yang memberikan karakteristik setiap jenisnya. Secara garis besar diatom, berdasarkan bentuknya digolongkan menjadi centris dengan bentuk sel bulat dan pennate bentuk sel lonjong atau bulat memanjang (Round et al. 1990).
Sistem Reproduksi. Reproduksi diatom dapat terjadi secara aseksual maupun seksual. Reproduksi aseksual merupakan reproduksi yang paling umum
untuk diatom. Reproduksi aseksual pada mahluk hidup ini terjadi dengan
pembelahan sitoplasma dalam frustule, sehingga epiteka induk akan menghasilkan hipoteka yang baru dan hipoteka yang lama akan menjadi epiteka yang
menghasilkan hipoteka yang baru pula pada anakannya dan seterusnya. Maka
suksesi reproduksi aseksual ini akan menghasilkan ukuran sel yang semakin kecil.
Ketika ukurannya mencapai minimum maka selanjutnya akan dikompensasi
dengan tumbuhnya auksospora (expandable zygote cell) berukuran besar yang akan membelah dan menghasilkan sel baru berukuran besar. Pembentukan
auksospora atau auksosporulasi merupakan bagian dari fase reproduksi seksual
seksual. Skema mekanisme reproduksi aseksual pada mikroalga dapat dilihat pada
Gambar 1A & 1B
Gambar 1 Skema reproduksi aseksual diatom secara skematis (Round et al. 1990)
Gordon & Parkinson (1999) menemukan bahwa frustule pada diatom mengandung silika yang berpori dengan ukuran sekitar 40 nm atau 100-200 nm.
Karakteristik lainnya adalah mempunyai lipid dan crysolaminarin sebagai cadangan makanannya dan silika sekitar 90% (Round et al. 1990). Diatom rata-rata mengandung lipid 1-39 % dari berat kering (Becker 1994) dan dapat
mengandung asam lemak 1.6-70 pg/sel dengan PUFA antara 5-62% dari total
asam lemak (Dunstan et al. 1994). Diatom juga mengandung protein sekitar 20-25% per berat kering, karbohidrat 5-7% per berat kering (Brown et al. 1997).
auksospora A
B Auksosporulasi
Hipoteka Epiteka
Chaetoceros gracilis
Chaetoceros gracilis merupakan salah satu anggota dari genus Chaetoceros, Secara morfologi merupakan diatom tunggal dengan bentuk sel sentries.
Sel-selnya membentuk rantai atau koloni hingga panjangnya mencapai 200µ m. Rantai
tersebut dibentuk oleh hubungan internal antar spina. Menurut Isnansetyo &
Kurniastuty (1995), Chaetoceros yang ditemukan di perairan Indonesia umumnya berukuran 3-30 µ m, bentuk bulat berdiameter 4-6µ m atau berbentuk segi empat
dengan ukuran 8-12 x 7-18µm.
Chaetoceros toleran terhadap suhu air hingga 40 oC, namun pertumbuhan optimal pada kisaran suhu 25-30o
Kingdom : Plantae
C. Toleransi terhadap salinitas 6-50‰ dengan
salinitas optimum 17-25‰. Chaetoceros gracilis mudah dikulturkan dalam medium yang mengandung silikat dengan pencahayaan minimal 3000 lx
(Isnansetyo dan Kurniastuty 1995). Menurut Bold & Wynne 1985, sistematika C. gracilis adalah sebagai berikut:
filum : Chrysophyta
kelas : Bacillariophyceae
ordo : Centrales
subordo : Biddulphioideae
familia : Chaetoceraceae
genus : Chaetoceros spesies : gracillis
Polimer Silika, Biosilika dan Aplikasi dalam Bidang Pangan
Polimer Silika dan Industri Silika
Silika merupakan polimer tersusun dalam susunan tiga dimensi dari silikon
dioksida (SiO2). Silika (Silikon dioksida/ SiO2) sangat banyak ditemukan secara
alami dalam bentuk bebas sebagai quartz dan campuran sebagai silikat. Silikat adalah komponen kimia yang mengandung silikon, oksigen dan elemen metal,
seperti orthosilikat mengandung gugus SiO4-4 dan metalsilikat gugus SiO4-2.
Silika ditemukan dengan berbagai bentuk seperti crystalline (quartz atau heksagonal, kristabolit atau tetrahedran, tridimit atau triklinat) dan silika
amorphous (bentuk opal, chaledony, flint, jasper dan diatomaceous earth) serta glass. Silika tersebut memiliki sifat tidak berwarna, tidak berasa dan secara fisiologi bersifat inert, mempunyai sifat tahan terhadap reaksi kimia pada
temperatur biasa tetapi dapat mengalami berbagai transformasi pada temperatur
tinggi (Ning 2002).
Silika untuk keperluan industri pada umumnya memerlukan tingkat
kemurnian tertentu, struktur tertentu atau bentuk spesifik berkaitan dengan bentuk
dan ukuran pori-porinya. Silika murni dan berpori skala nano selama ini diperoleh
antara lain dengan cara 1) acid deposition dari larutan Na2SiO3
Metoda hidrothermal menggunakan campuran kalsium-silikat yang
diperoleh dengan mencampurkan Ca(OH)
, 2) metode sol-gel
dari organo-silicone compound, 3) vapour deposition dari a silica fume dan 4) metoda hidrothermal (Ono et al. 2001).
2
Pada prinsipnya metoda untuk memperoleh silika atau silikon yang
diaplikasikan di industri pada umumnya menggunakan temperatur tinggi dan
suatu prekursor. Hal tersebut seperti yang diungkapkan oleh Maeda & Komatsu
(1996), yang melaporkan bahwa ultrapure polycrystalline silicon dan silicon carbide bahan semikonduktor diperoleh dengan cara meleburkan quartz pada tungku temperatur tinggi. Brinker & Scherer (1990), memperoleh silika dengan
menggunakan sodium silikat sebagai prekursor yang diperoleh dengan cara
melebur quartz sand dengan sodium karbonat menggunakan temperatur 1300 ºC. dengan berbagai silika seperti silika
amorf atau silika kristal, selanjutnya campuran tersebut dipanaskan dengan
temperatur 140 ºC, tekanan 0,4-1 MPa selama 8 jam (Ono et al. 2001). Kalapathy et al. (2000), melaporkan silika murni yang diperoleh dari abu sekam padi dilakukan dengan ekstraksi alkali dilanjutkan dengan pengendapan asam
kemudian dipanaskan hingga 80 ºC selama 12 jam. Menurut Harsono (2002),
silika dari abu sekam padi diperoleh dengan memanaskan hingga 190 ºC, namun
untuk memperoleh silika dengan kristalinitas tinggi, harus dipanaskan lebih lanjut
Silikon semikonduktor dibuat dengan mereaksikan crude metal dengan campuran gas hidrogen dan hidrogen klorida dalam fluidised bed sehingga menghasilkan SiHCl3
Wafer dibuat dari polisilikon hasil reaksi triklorosilan dengan hidrogen pada suhu 1000 ºC lalu dikristalkan dengan suhu 1200 ºC. Wafer ini sebagai template untuk lapisan silika berikutnya hingga mencapai ketebalan beberapa mikron,
kemudian dilanjutkan pemberian muatan dan pengemasan menjadi chip (Richardson 2001). Fiber glass sebagai bahan utama dalam alat pendeteksi seperti stetoskop dibuat dengan cara oksidasi thermal silikon tetraklorida dan suhu sekitar
2500 ºC, dengan reaksi SiCl
. Selanjutnya dilakukan destilasi dan direduksi
menggunakan hidrogen menghasilkan filamen pre silikon, kemudian dipanaskan
hingga 1150 ºC. Demikian juga dengan produk-produk intermediet seperti silica chip, fiber glass dan keramik juga dibuat dengan temperatur tinggi. Silica chip digunakan sebagai sparepart komputer atau assay kit, dibuat dengan beberapa tahap yang diawali dengan pembuatan lapisan silika yang disebut wafer.
4 + O2 SiO2 + 2Cl2
Metoda sol-gel dalam pembuatan silika merupakan metoda yang
menggunakan suhu ruang. Menurut Ester et al. (2005), proses sol-gel adalah suatu teknik untuk memproduksi amorphous inorganic solid seperti glass. Istilah sol didefinisikan sebagai suatu larutan koloidal dengan partikel berukuran < 100nm
dan gel adalah larutan koloid semisolid. Silika glass yang dibuat dengan metoda sol-gel menghasilkan homogenitas yang baik, kemurnian tinggi dan porous. Hal ini memungkinkan dibuat suatu matriks berpori, bening dan bersifat optik
sehingga dapat digunakan sebagai sensor. Lebih jauh, dengan ditemukan proses
sol-gel dapat membuat silica glass bening mengandung bahan organik maupun inorganik pada suhu rendah.
(Fiber Tech 2004).
Pada proses sol-gel, bentuk sol koloidal diperoleh dari hasil hidrolisis dan
polikondensasi prekursor metalorganik. Prekursor tersebut adalah metal alkoxide dengan rumus molekul M(OR)n, dan OR- nya dapat berbentuk metoxy (OCH3)
atau ethoxy (OC2H5 ). Bahan yang paling sering digunakan untuk membuat
hidrolisis merupakan tahap pembentukan gugus silanol (Si-OH) dengan
melepaskan alkohol atau H2
Adamson (2004) membuat lapisan tipis silika secara kimia dengan surfaktan
dan TEOS sebagai prekursor, tetap memerlukan template untuk dasar lapisan tipis tersebut, namun juga dapat dilakukan tanpa template. Proses sintesis silika secara kimia baik dengan temperatur rendah maupun temperatur tinggi memerlukan
prekursor, katalis dan template. Penggunaan ke tiga unsur tersebut juga ditemukan dalam pembuatan polimer silika secara in vitro menggunakan katalis biologi protein atau sering disebut sebagai proses biosilika yang berasal dari organisme
penghasil silika.
O sebagai by product, kemudian dilanjutkan dengan kondensasi membentuk gugus siloxane (Si-O-Si). Partikel silika amorphous yang dapat dihasilkan dengan metoda sol-gel berdiameter 5-10 nm (Ester et al.2005). Substrat TEOS juga digunakan dalam pembuatan thin-film dari silika dengan
metoda vacum ultraviolet radiation (Takezoe et al. 1999).
Biosilika
Silika juga diproduksi oleh banyak organisme termasuk binatang dan
tumbuhan tinggi, bakteri, protista, tanaman, invertebrata maupun vertebrata.
Mineral silika yang terjadi di alam menunjukkan sifat fisik dan memiliki derajat
hidrasi dengan struktur yang bervariasi. Selain itu, pembentukannya berada di
bawah kondisi sekelilingnya dengan pH netral dan suhu rendah kira-kira 4-40º C
(Perry 2003). Menurut Perry (2003), biosilika oleh organisme dapat terjadi secara
intraseluler atau ekstraseluler di suatu organel khusus yang juga terdapat
karbohidrat, lipid dan protein. Organel khusus tempat terdepositnya silika dan
pembentukannya disebut silica deposition vesicle yang dimiliki oleh diatom (Kröger et al. 1999), sedangkan vakuola sel sclerocytes yang terletak di jaringan mesophyl merupakan tempat terdepositnya asam silikat untuk membentuk spikula silika pada spons (Brusca & Brusca 1990).
Diatom merupakan penyumbang terbesar silika di alam karena sebagian
besar selnya mengandung silika sebagai penyusun utama dinding sel endoskeleton
maupun eksosekeleton. Biota lain yang mengandung silika sebagai bagian
Radiolaria. Dinding sel diatom silicaseous mengandung silika amorf atau opaline 96.5%, berpola teratur rapi (ornicate) dan berpori dengan skala nanometer. Gambar 2 memperlihatkan struktur dinding sel dari jenis diatom berbeda.
Gambar 2 Struktur dinding sel silicaseous dari jenis diatom yang berbeda. A.Diatom Cymathoneis sp. B. Diatom Anorthoneis sp (Round et al.
1990)
Pembentukan silika sebagai bagian dari penyusun endo mapun eksoskeleton
terkait dengan pembelahan sel itu sendiri. Menurut Kröger & Wetherbee (2000),
mekanisme pembentukan dinding sel silicaseous dimulai pada awal sitokinesis. Menurut Kröger & Wetherbee (2000), secara umum mekanisme pembelahan sel
meliputi sitokinesis, perluasan valve SDV, eksositosis, pemisahan sel dan pertumbuhan sel. Pada tahap sitokinesis, sitoplasma terbagi menjadi 2 bagian
masing-masing mengandung ruangan khusus yang disebut valve SDV yang merupakan tempat terdepositnya silika, dilanjutkan dengan perluasan valve SDV
sebagai calon valve baru. Perluasan ini akan memperjelas pemisahan sitoplasma, kemudian dilanjutkan dengan tahap eksositosis yakni menuju pemisahan sel. Pada
tahap ini, valve SDV yang mengalami perluasan akan menjadi calon valve. Selanjutnya diikuti terbentuknya girdle band SDV yang diikuti proses diferensiasi membentuk girdle band baru selama tahap pertumbuhan sel. Tahap pembentukan girdle band baru diikuti dengan pematangan valve SDVatau diferensiasi menjadi valve baru dan akhirnya membentuk sel utuh baru hasil pembelahan dengan dinding sel silicaseous (Kröger & Wetherbee, 2000). Gambar 3 memperlihatkan
A
proses pembentukan dinding sel ketika sel mengalami pembelahan dalam siklus
sel diatom.
Gambar 3 Pembentukan dinding sel silicaseous dalam siklus sel diatom (Kröger & Wetherbee, 2000).
Silika yang terbentuk sebagai penyusun dinding sel diatom merupakan salah
satu contoh peristiwa biologi organisme yang memanfaatkan langsung komponen
disekitarnya untuk menyusun bagian tubuhnya. Menurut Poulsen & Kröger
(2004), selama terjadi evolusi, diatom dan organisme penghasil silika lain seperti
spons dan radiolaria memerlukan asam monosilikat Si(OH)4
Asam silikat Si(OH)
yang ada di habitat
untuk pembentukan struktur yang spesifik pada setiap endo dan eksoskeleton.
3O- yang banyak terdapat diperairan laut ditransport
secara aktif masuk ke dalam appratus golgi. Dari apparatus golgi ini asam silikat masuk ke dalam organel yang disebut a small silicon-laden vesicle oleh mikrofilamen (Lee 1989). Hildenbrand et al. (1998) menemukan bahwa mikrofilamen tersebut adalah sejenis protein transporter yang memiliki atom Na+
sitokinesis
ekspansi
eksositosis Pemisahan sel
Pertumbuh an sel
SDV Replikasi
yang disebut protein silica transpoter. Selanjutnya a small silicon-laden vesicle menjadi silica deposition vesicle (SDV) yakni organel yang mempolimerisasi asam silikat menjadi polimer silika.
Di dalam SDV asam silikat mengalami reaksi kondensasi dengan gugus
hidroksi dari suatu protein.
Mekanisme pemindahan silika menjadi dinding sel silicaseous belum jelas meskipun telah diketahui sebagian dari komponen yang terlibat biosilifikasi
diatom (Sumper & Kröger 2004).
Kröger et al. (1997) dan Kröger et al. (1999) memastikan adanya peran molekul organik yang terlibat dalam pembentukan
silika di dalam SDV. Mereka berhasil mengisolasi serta mengkarakterisasi sebagai
satu set peptida polikationik berberat molekul rendah dan peptida berberat
molekul tinggi. Selain itu ada komponen lain yakni non protein rantai poliamin
panjang dengan rantai spesifik yang berperan dalam penyusunan pola silika
(Sumper 2002). SDV silicaseous dalam pertumbuhan sel diatom mengalami perluasan dan bergabung dengan silicalemma membentuk jaringan skeletal yang diduga melibatkan protein trans-silicalemma dan elemen skeletal (Lee 1989).
Protein yang Terlibat dalam Biosilika Diatom
Kröger et al. (1997) telah menemukan adanya protein yang terlibat dalam pembentukan silika dari diatom Cylindrotheca fucifomis yang kemudian dikenal dengan protein silaffin. Protein tersebut bertanggungjawab pada tingkat molekuler
dalam membentuk struktur silika berukuran nano dari asam silikat (silikon) di
dalam lingkungannya. Proteinsilaffin sangat kuat terikat dengan silika dan hanya
ditemukan di dalam SDV yang telah terintegrasi menjadi dinding sel.
Protein silaffin diatom Cylindrotheca fuciformis terdiri tiga polipeptida yaitu silaffin 1A (4 kDa), silaffin 1B (8 kDa) dan silaffin 2 (17 kDa), serta komponen
non-protein yakni poliamin (<3,5 kDa). Hasil analisis sekuens protein
menunjukkan silaffin 1A terdiri dari dua campuran peptida yang sama dan disebut
silaffin 1A1, 1A2, masing-masing mengandung 15 dan 18 asam amino dan
memiliki homologi sekuens yang cukup tinggi dengan silaffin 1B.
Poulsen & Kröger (2004), mengkarakterisasi protein silaffin diatom
pseudonana mengandung 5 peptida, yakni tpSil 1H (35 kDa), tpSil 2H (35 kDa), tpSil 1L (19 kDa), tpSil 2L (18 kDa) dan tpSil 3 (35 kda). Peptida tpSil 1H dan
2H mempunyai berat molekul yang lebih tiggi dari tpSil 1L dan 2L. Analisis
sekuen N-terminal terhadap 5 protein silaffin utama dari T. pseudonana ternyata tidak homolog dengan protein silaffin C. fucifrmis, namun mempunyai kemiripan komposisi asam amino. Protein tpSil 1 & 2H mempunyai komposisi asam amino
yang tidak jelas karena banyaknya asam amino yang tidak teridentifikasi dan
mengandung campuran 2 peptida yang mempunyai sekuen berbeda sama sekali.
Pada tpSil 1L dan 2L merupakan sekuen yang mirip, namun juga mengandung
asam amino yang tidak teridentifikasi.
Spons juga memiliki silika yang juga dikontrol oleh protein yang disebut
protein silicatein. Menurut Shimizu et al. (1998), protein silicatein dari spons Tethya aurantia terdiri dari 3 protein dengan berat molekul 29, 28 dan 27 kDa yang kemudian disebut sebagai 3 subunit α, β dan γ. Tiga protein tersebut sebagai
protein isomer, karena satu subunit mampu melakukan reaksi katalis dan susunan
asam aminonya juga hampir sama. Hasil sekuen silicatein α mempunyai
kemiripan yang tinggi dengan famili cathepsin-L. Tiga ratus tiga puluh satu asam amino yang menyusun silicatein didominasi oleh residu serin, tirosin dan treonin
(Shimizu et al.1998). Protein silicatein yang diisolasi dari spons Suberitas domuncula mempunyai 79% kemiripan dengan silicatein T. aurantia, tersusun atas 331 asam amino dengan berat molekul 36. 30 kDa dan 23. 12 kDa (Krasco et al. 2000).
Pembentukan Silika secara In Vitro Menggunakan Katalis Protein
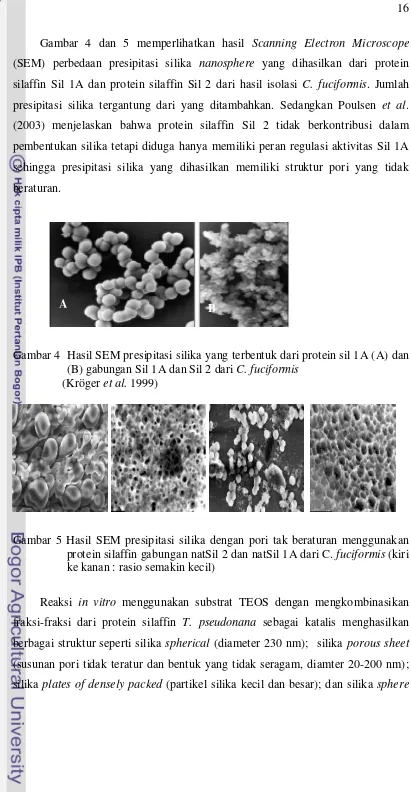
Kröger et al. (1999), menunjukkan bahwa protein silaffin Cylindrotheca fuciformis secara in vitro mampu menghasilkan silika nanosphere pada pH < 7 dan temperatur ruang ketika ditambahkan larutan asam silikat dalam beberapa
detik. Lebih lanjut diungkapkan bahwa protein silaffin Sil 1A mampu secara
Gambar 4 dan 5 memperlihatkan hasil Scanning Electron Microscope (SEM) perbedaan presipitasi silika nanosphere yang dihasilkan dari protein silaffin Sil 1A dan protein silaffin Sil 2 dari hasil isolasi C. fuciformis. Jumlah presipitasi silika tergantung dari yang ditambahkan. Sedangkan Poulsen et al. (2003) menjelaskan bahwa protein silaffin Sil 2 tidak berkontribusi dalam
pembentukan silika tetapi diduga hanya memiliki peran regulasi aktivitas Sil 1A
sehingga presipitasi silika yang dihasilkan memiliki struktur pori yang tidak
beraturan.
Gambar 4 Hasil SEM presipitasi silika yang terbentuk dari protein sil 1A (A) dan (B) gabungan Sil 1A dan Sil 2 dari C.fuciformis
(Kröger et al. 1999)
Gambar 5 Hasil SEM presipitasi silika dengan pori tak beraturan menggunakan protein silaffin gabungan natSil 2 dan natSil 1A dari C. fuciformis (kiri ke kanan : rasio semakin kecil)
Reaksi in vitro menggunakan substrat TEOS dengan mengkombinasikan fraksi-fraksi dari protein silaffin T. pseudonana sebagai katalis menghasilkan berbagai struktur seperti silika spherical (diameter 230 nm); silika porous sheet (susunan pori tidak teratur dan bentuk yang tidak seragam, diamter 20-200 nm);
silika plates of densely packed (partikel silika kecil dan besar); dan silika sphere
[image:31.595.101.512.49.842.2]polydisperse(diameter dari 900 nm hingga 4,2 μm) (Poulsen et al. 2003). Struktur silika yang terbentuk tergantung jenis peptida silaffin yang menyusun dan
keterlibatan long-chain polyamin (Poulsen & Kröger 2004). Hasil penelitian Manurung et al. (2007), memperlihatkan protein biosilika yag diisolasi dari diatom C. gracilis mampu mengkatalisa pembentukan silika sphere dalam waktu 10 menit menggunakan TEOS yang dihidrolisis dengan asam klorida sebagai
substrat.
Menurut Poulsen et al. (2003), protein pada mekanisme biosintesis silika bertindak sebagai template dan asam monosilikat hasil hidrolisis TMOS (Tetramethoxyorthosilicate) bertindak sebagai prekursor. Berdasarkan mekanisme polimerisasi yang diajukan oleh Poulsen & Kroger (2004) dan Shimizu et al. (1999), katalis protein silicatein dan silaffin memiliki keistimewaan karena selain
sebagai katalis juga menjadi tempat melekatnya silika yang terbentuk sebagai
hasil polimerisasi atau bertindak sebagai template.
Silika dan Aplikasinya dalam Bidang Pangan
Menurut Singh (1979), sudah sejak lama silika sebagai fosil diatom di dasar
laut yang disebut tanah diatomite mempunyai pori-pori yang ideal untuk filter oil dan sebagai clearing solvent, demikian juga untuk industri yang memerlukan filtration devices untuk industri minuman. Tanah diatom atau diatomite atau diatomaceous earth atau kieselguhr dieksplorasi sebagai bahan pembuatan pasta gigi, metal polishes dan sebagai absorben liquid nitroglycerins dalam pembuatan dinamit (Lee 1989). Oleh karena sifat yang tidak membahayakan bagi kesehatan
terutama yang berbentuk amorf, mempunyai daya serap tinggi, berpori halus dan
secara kimia stabil banyak dimanfaatkan di dalam industri pangan terutama
banyak digunakan sebagai filtering agent yang banyak ditemui di industri minuman seperti beer dan wine.
Menurut Sumper & Kröger (2004) berdasarkan sifat struktur nanosilika pada
dinding sel diatom ini dapat berfungsi sebagai filtrasi. Apabila dapat
mengidentifikasi dan menyeleksi sifat dinding sel diatom, akan berpeluang
merupakan aspek yang menentukan untuk produk yang tidak tahan panas. Sistem
filtrasi yang digunakan biasanya menggunakan membran ultrafiltrasi.
Salah satu alat analitik untuk bidang pangan penting saat ini adalah
biosensor, yakni suatu alat deteksi yang menggunakan agen biologi dan sensing. Biosensor membutuhkan suatu komponen yang dapat merespon sesuai ukuran
molekul targetnya yang disebut biochip. Penggunaan struktur nanosilika akan meningkatkan respon sensornya karena bersifat highly refractive native (Tamiya et al. 2005). Silika yang bersifat fiber optic dalam biosensor merupakan transducer yang mengirimkan sinyal kimia ke sinyal elektrik untuk menghasilkan secara proposional konsentrasi yang menjadi target deteksi (Turner & Newman
1989). Bahan nanokomposit silika dan emas merupakan elemen pelapis pada tip nanosensor yang berbahan serat optik. Pelapis komposit silica-gold merupakan nanosensor devises yang penting untuk mengurangi pantulan cahaya (Dinh 2005).
Industri pengemasan makanan silika dimanfaatkan dalam pengembangan
sensor dan elektronik pada lapisan transistor thin berbasis thin-film silico. Lapisan ini untuk melapisi material kemasan seperti kertas dan plastik, sehingga secara
aktif menjaga kesegaran dan kondisi produk.
Asam Lemak dan Biosintesis Polyunsaturated Fatty Acid Diatom
Diatom merupakan salah satu kelas mikrolga yang berpotensi menghasikan
asam lemak. Komposisi asam lemak diatom beragam dari rantai pendek hingga
tantai panjang, dari asam lemak jenuh (saturated fatty acid) hingga rantai panjang dengan banyak ikatan rangkap atau polyunsaturated fatty acid. Telah diketahui, diatom dikenal menghasilkan PUFA EPA dan DHA yang tinggi. Dari berbagai
penelitian yang telah dilakukan terhadap berbagai jenis diatom, menunjukkan
konsentrasi rata-rata EPA adalah 0.6 hingga 40.7% dari total asam lemak dan
DHA 0.1-6.6 % dari total asam lemak (Dunstan et al. 1994).
Kemampuannya menghasilkan asam lemak EPA dan DHA tinggi terkait
selain diatom memiliki lipid sebagai cadangan makanan, mensintesis PUFA rantai
ini terkait dengan mekanisme sintesisnya yang secara genetis memiliki protein
enzim yang mensintesis hingga PUFA DHA.
BiosintesisAsam Lemak
PUFA adalah asam lemak dengan jumlah atom C minimal 20 dan
mempunyai ikatan rangkap lebih dari satu dalam bentuk cis (Gurr et al. 2002). Diatom merupakan organisme fotoautotrof yang menggunakan karbondioksida
sebagai satu-satunya sumber karbon untuk membentuk molekul organik baik
glukosa, protein, lipid dan lain-lain. Sintesis asam lemak diatom dan mikroalga
lain secara umum mempunyai kesamaan dengan tumbuhan.
Pembentukan asam lemak tersebut mutlak menggunakan asetil KoA yang
dihasilkan dari proses fotosintesis. Proses tersebut terjadi di dalam plastida, yakni
suatu organel sel tumbuhan yang mengandung pigmen penangkap cahaya.
Plastida diatom dengan pigmen karotenoid dominan menangkap cahaya untuk
menghasilkan energi ATP & NADPH yang akan digunakan untuk mereduksi
karbondioksida membentuk glukosa. Piruvat yang dihasilkan dalam proses akhir
glikolisis pindah ke mitokondria untuk menghasilkan asetil KoA karena
keberadaan piruvat dehidrogenase, kemudian diikuti secara spontan pembebasan
asam asetat yang dikatalisis oleh enzim asetil KoA thioesterase. Asam asetat yang
terbentuk keluar dari mitokondria dan dikatalisa oleh enzim asetil KoA sintetase
bersama energi ATP membetuk asetil KoA. Asam asetat merupakan substrat
pembentukan asetil KoA yang merupakan kunci pembentukan asam lemak (Yap
& Chen 2001). Asam asetat sebagai substrat pembentuk asetil KoA di dalam
diatom merupakan mekanisme yang mirip pembentukan asetil KoA pada
tumbuhan dalam sintesis asam lemak. Namun diatom Cyclotella cryptica, menggunakan asam sitrat sebagai prekursor asetil KoA, karena ditemukan enzim
sitrat sintase yang mengkatalisa terbentuknya asetil KoA (Roessler 1988).
Dalam proses fotosintesis, karbon dioksida difiksasi oleh enzim asetil KoA
karboksilase menggunakan asetil KoA dan energi yang diperoleh (ATP dan
NADPH) secara bertahap menghasilkan propionil-KoA dan butiril-KoA
kemudian berlanjut menjadi malonil KoA melalui enzim karboksiltransferase
Dari malonil KoA selanjutnya terjadi rangkaian reaksi yang membentuk
rantai panjang asam lemak C18 (asam stearat). Acyl Carrier Protein (ACP) bersama propionil KoA membentuk malonil-ACP yang dikatalisa oleh enzim
transasilase malonil-KoA-ACP. Selanjutnya malonil-ACP dengan asetil ACP dikatalisa oleh β-ketoasil-ACP sintase menghasilkan diketobutiril-ACP, yang
direduksi dengan penambahan NADPH dan ketoasil- ACP reduktase sehingga
membentuk B-hidroksibutiril-ACP. Enzim β-hidroksiasil-ACP dehidrase
kemudian mengkatalisa pembentukan butinil-ACP dari β-hidroksibutiril-ACP,
selanjutnya dikatalisa oleh enoyl-ACP reduktase membentuk butanoil-ACP. Pada tahap ini selanjutnya pembentukan rantai panjang asam lemak dilakukan kembali
bersama asetil-ACP dan β-ketoasil-ACP-sintase. Kompleks enzim untuk mengkatalisa penambahan dua atom C adalah enzim kompleks fatty acid synthase (Yap & Chen 2001). Kompleks enzim fatty acid synthase ini merupakan enzim yang berfungsi seperti lengan panjang yang memfiksasi substrat dan
meneruskan dari pusat reaksi ke pusat reaksi lainnya.
Pada tumbuhan dan kelompok alga, rangkaian proses panjang yang
dilakukan oleh enzim fatty acid synthase berlangsung berulang kali hingga diperoleh asam lemak stearat (18:0). Asam stearat menjadi awal pembentukan
asam lemak tidak jenuh dengan satu ikatan rangkap atau monounsaturated fatty acid (MUFA). Pembentukan asam lemak tidak jenuh dan seterusnya dalam pembentukan asam lemak dengan rantai lebih panjang dan lebih tidak jenuh
menggunakan proses desaturasi dan elongasi. Kedua proses tersebut melibatkan
enzim desaturase dan elongase. Pembentukan asam oleat (18:1) merupakan proses
desaturasi dari enzim desaturase Δ9 pada asam stearat (18:0). Asam oleat inilah
selanjutnya menjadi prekursor pembentukan PUFA baik omega 9, 6 dan 3 (Yap &
Chen 2001). PUFA dapat diklasifikasikan menjadi 4 golongan yaitu omega-3 (ω
-3), omega-6 (ω-6), omega-7 (ω-7), dan omega-9 (ω-9). Omega-3 dan omega-6
merupakan golongan yang paling dominan pada mikroalga (Chen & Jiang 2000).
Biosintesis PUFA
MUFA diatom merupakan bagian dari proses panjang pembentukan PUFA
Dengan terbentuknya prekursor asam oleat, mekanisme pembentukan asam lemak
tak jenuh rantai panjang (PUFA) selanjutnya dikatalisa oleh enzim kompleks
desaturase dan elongase melalui proses desaturasi dan elongasi. Pada mikroalga
proses desaturasi merupakan proses aerobik (Gurr et al. 2002). Desaturasi merupakan reaksi penambahan ikatan rangkap yang melibatkan enzim-enzim
desaturase sedangkan elongasi merupakan reaksi penambahan atom C yang
melibatkan enzim elongase (Lobb 1992). Organisme tingkat rendah misalnya
alga, mempunyai kemampuan mendesaturasi rantai asam lemak seperti organisme
tingkat tinggi dan p
Asam oleat (18:1Δ9) didesaturasi oleh enzim desaturase Δ12 membentuk asam linoleat (LA, 18:2Δ9,12) dilanjutkan oleh enzim desaturase Δ15 membentuk asam α-linolenat (ALA, 18:Δ9,12,15). LA merupakan prekursor keluarga PUFA omega 6 rantai lebih panjang, sedangkan ALA merupakan prekursor keluarga
PUFA omega 3 rantai lebih panjang dan PUFA lebih panjang akan diproduksi
oleh serangkaian aktivitas desaturasi dan elongasi dari prekursor-prekursornya
(Yap & Chen 2001).
roses desaturasi dan elongasinya memiliki aktivitas yang
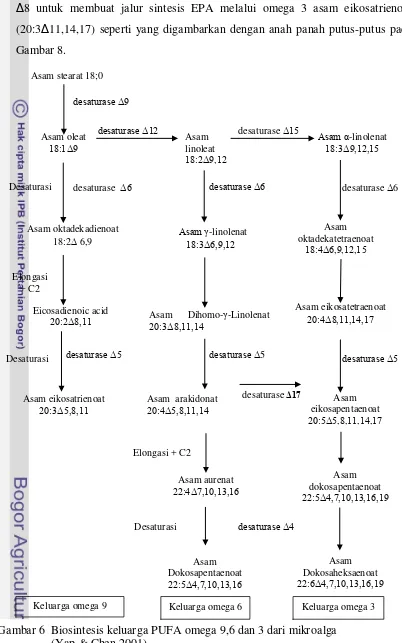
berurutan untuk mensintesis berbagai jenis PUFA (Yap & Chen 2001). Gambar 6
memperlihatkan jalur sintesis PUFA pada umumnya mikroalga.
Kemampuan yang dimiliki mikroalga tersebut dikarenakan keberadaan
sejumlah enzim yang berperan dalam proses desaturasi dan elongasi (Yap & Chen
(2001), namun jalur metabolisme sintesisnya belum jelas diketahui seperti pada
tanaman atau hewan (Domergue et al. 2002). Arao dan Yamada (1994) melaporkan ada 7 hipotesis biosintesis EPA diatom Phaeodactylum tricornutum, yang diawali dengan substrat asam oleat (18:1Δ9, ω9) dengan metode analisis menggunakan penelusuran radiolabeling pada asam acetat([1-14C] asam acetat)
untuk melihat asam lemak yang disintesis selama pertumbuhannya (Gambar 7).
Begitu juga dengan Khozin et al. (1997) melaporkan ada 4 jalur hipotesis biosintesis EPA pada Porpyridium cruentum, dengan metode labeling ([1-14
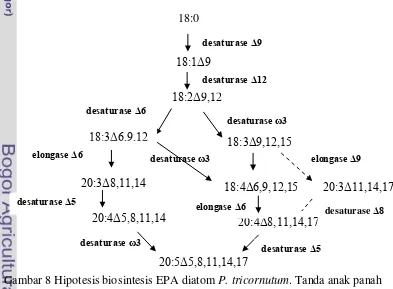
Domergue et al. (2002), juga menggambarkan kemungkinan jalur sintesis EPA diatom P. tricornutum berdasarkan enzim yang ditemukan, seperti yang terlihat pada Gambar 8. Jalur biosintesis yang terdapat pada diatom tersebut
C]
masih merupakan hipotesis yang melibatkan enzim elongase Δ9 dan desaturase
Δ8 untuk membuat jalur sintesis EPA melalui omega 3 asam eikosatrienoat (20:3Δ11,14,17) seperti yang digambarkan dengan anah panah putus-putus pada
Gambar 8.
Gambar 6 Biosintesis keluarga PUFA omega 9,6 dan 3 dari mikroalga (Yap & Chen 2001)
desaturase Δ12 desaturase Δ15
desaturaseΔ17
Keluarga omega 3 Keluarga omega 6
Keluarga omega 9 Asam stearat 18;0
desaturase Δ9
Asam oleat 18:1Δ9
Desaturasi desaturase Δ6
Asam oktadekadienoat 18:2∆ 6,9
Elongasi + C2
Eicosadienoic acid 20:2Δ8,11
Desaturasi desaturase Δ5
Asam eikosatrienoat 20:3Δ5,8,11
Asam linoleat 18:2Δ9,12
Asam γ-linolenat 18:3Δ6,9,12
Asam Dihomo-γ-Linolenat 20:3Δ8,11,14
Asam arakidonat 20:4Δ5,8,11,14
desaturase Δ5
Asam aurenat 22:4Δ7,10,13,16 Elongasi + C2
Desaturasi Asam Dokosapentaenoat 22:5Δ4,7,10,13,16 desaturase Δ6 desaturase Δ4
Asam α-linolenat 18:3Δ9,12,15 Asam oktadekatetraenoat 18:4Δ6,9,12,15 Asam eikosatetraenoat 20:4Δ8,11,14,17 Asam eikosapentaenoat 20:5Δ5,8,11,14,17 desaturase Δ5 Asam dokosapentaenoat 22:5Δ4,7,10,13,16,19 Asam Dokosaheksaenoat 22:6Δ4,7,10,13,16,19
[image:37.595.98.500.104.747.2]Jalur I : 18:1 (ω-9) 18:2 (ω-6) 18:3 (ω-3) 20:5 (ω-3)
Jalur II : 20:3 (ω-6) 20:4 (ω-6)20:5 (ω-3)
Jalur III: 18:1 (ω-9) 18:2 (ω-6) 18:3 (ω-3) 18:4 (ω-3) 20:4 (ω-3) 20:5 (ω-3)
Jalur IV: 18:1 (n-9) 18:2 (n-6) 18:3 (n-3) 18:4 (n-3) 20:4 (n-3) 20:5 (n-3)
18:3 (n-6) Jalur V:
18:1 (n-9) 18:2 (n-6) 18:3 (n-3) 18:4 (n-3) 20:4 (n-3) 20:5 (n-3)
18:3 (n-6)
20:3 (n-6) 20:4 (n-6) Jalur VI:
20:3 (n-3)
18:1 (n-9) 18:2 (n-6) 18:3 (n-3) 18:4 (n-3) 20:4 (n-3) 20:5 (n-3)
18:3 (n-6)
20:3 (n-6) 20:4 (n-6)
Jalur VII:
18:1(n-9) 18:2 (n-6)
[image:38.595.105.490.96.817.2]20:1(n-9) 20:2 (n-6) 20:3 (n-6) 20:4 (n-3) 20:5 (n-3)
Gambar 7 Hipotesis biosintesis EPA P. tricornutum (Arao & Yamada (1994)
[image:38.595.110.503.437.726.2]
Gambar 8 Hipotesis biosintesis EPA diatom P. tricornutum. Tanda anak panah putus-putus menunjukkan jalur yang tidak biasa ditemui pada diatom (Domergue et al. 2002).
18:3Δ9,12,15
desaturase ω3
20:3Δ8,11,14 20:3Δ11,14,17
20:4Δ8,11,14,17
20:5Δ5,8,11,14,17
desaturase Δ8
desaturase Δ5 elongase Δ6
elongase Δ9
18:4Δ6,9,12,15
20:4Δ5,8,11,14
desaturase ω3 desaturase Δ5
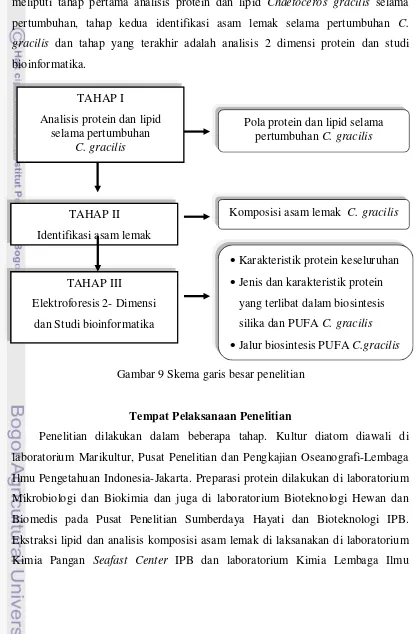
Tahap-tahap penelitian dan hasil yang diharapkan dalam peneltian ini secara
garis besar dapat dilihat pada Gambar 9. Penelitian dilakukan dalam 3 tahap yang
[image:39.595.101.517.176.810.2]meliputi tahap pertama analisis protein dan lipid Chaetoceros gracilis selama pertumbuhan, tahap kedua identifikasi asam lemak selama pertumbuhan C. gracilis dan tahap yang terakhir adalah analisis 2 dimensi protein dan studi bioinformatika.
Gambar 9 Skema garis besar penelitian
Tempat Pelaksanaan Penelitian
Penelitian dilakukan dalam beberapa tahap. Kultur diatom diawali di
laboratorium Marikultur, Pusat Penelitian dan Pengkajian Oseanografi-Lembaga
Ilmu Pengetahuan Indonesia-Jakarta. Preparasi protein dilakukan di laboratorium
Mikrobiologi dan Biokimia dan juga di laboratorium Bioteknologi Hewan dan
Biomedis pada Pusat Penelitian Sumberdaya Hayati dan Bioteknologi IPB.
Ekstraksi lipid dan analisis komposisi asam lemak di laksanakan di laboratorium
Kimia Pangan Seafast Center IPB dan laboratorium Kimia Lembaga Ilmu TAHAP I
Analisis protein dan lipid selama pertumbuhan
C. gracilis
Pola protein dan lipid selama pertumbuhan C. gracilis
TAHAP II
Identifikasi asam lemak
TAHAP III
Elektroforesis 2- Dimensi
dan Studi bioinformatika
Komposisi asam lemak C. gracilis
• Karakteristik protein keseluruhan • Jenis dan karakteristik protein
yang terlibat dalam biosintesis
Pengetahuan Indonesia-Bandung. Analisis 2 dimensi dilakukan di laboratorium
Biokimia dan Teknologi Enzim, Fakultas Teknobiologi Universitas Katolik
Atmajaya-Jakarta dan laboratorium terpadu Fakultas Kedokteran Hewan Institut
Pertanian Bogor.
Bahan dan Alat
Diatom Chaetoceros gracilis merupakan organisme yang menjadi objek penelitian studi protein diperoleh sebagai kultur murni dari Pusat Penelitian dan
Pengkajian Oceanologi-LIPI yang diambil dari perairan Teluk Jakarta Indonesia.
Medium kultur modifikasi f/2 Guilard meliputi makronutrien (NaNO3,
NaH2PO4.2H2O, Na2SiO3.9H2O), mikronutrien (FeCl3.6H2O dan Na2EDTA),
dan vitamin (B1, B12, biotin) serta trace metal (CuSO4.5H2O, ZnSO4.7H2O,
NaMoO4.2H2O, (NH4)6Mo7O24.4H2O, MnCl2.4H2O, 0.6 µM CoCl2.6H2
Ekstraksi protein total menggunakan bahan kimia yang terdiri dari Tris-Cl
pH 6.8 SDS, EDTA, aseton, HF, NH
O).
Perangkat kultur sistem batch dilengkapi dengan sumber cahaya, pengatur waktu dan aerator.
4F. Pengukuran kadar protein menggunakan
metode Bradford dengan pelarut yang terdiri dari etanol, asam fosforat, Serva Blue G dan dibaca menggunakan Spektrofotometer UV. Ekstraksi lipid dan analisi komposisi asam lemak menggunakan CHCl3, KOH, MeOH, 20% BF3/MeOH,
NaCl, petroleum benzen, Na2SO4, gas N2
Analisis 2 dimensi terdiri dari preparasi protein, elektroforesis 1 dimensi dan
2 dimensi. Bahan kimia yang digunakan meliputi Tris-Cl pH 7.5, MgCl
, heksan dan isooktan. Identifikasi asam
lemak menggunakan Gas Chromatograph Mass Spectrophotometer QP-5000.
2, KCl,
EDTA, PMSF, Triton X-100, TCA; urea, Triton X-100, β-merkaptoetanol,
ampholine pH 3-10, SDS, Tris-HCl pH 8.8, gliserol, DTT, iodoasetamida.
Elektroforesis 1 dimensi menggunakan peralatan Protean IEF-Biorad, sedangkan
elektroforesis 2 dimensi menggunakan peralatan Mini Elektrophoresis SDS-PAGE-Biorad. Pewarnaan gel hasil 2 dimensi menggunakan pewarnaan
Coomassie blue yang mengandung Coomassie blue R-250, metanol dan asam asetat glasial. Bahan-bahan kimia yang digunakan dalam penelitian ini merupakan
dipindai menggunakan High Resolution Scanner – Image Scanner (Amersham Pharmacia Biotech).
Karakterisasi protein dilakukan menggunakan perangkat lunak Melanie
7.0
fikasi protein menggunakan program TagIdent expasy.
proteomic.tools).
Penelitian Tahap I
Penelitian tahap pertama adalah kultivasi C. gracilis dalam kultur sistem curah atau batch dengan kondisi yang diterapkan. Kultur sistem batch adalah sistem kultur dalam suatu media dan kondisi lingkungan yang terbatas dalam
periode waktu tertentu. Setelah pelet sel dikumpulkan, selanjutnya dilakukan
analisis baik kandungan seluler protein total termasuk protein silaffin maupun
analisis kandungan seluler lipid selama pertumbuhan C. gracilis. Skema penelitian tahap pertama dapat dilihat pada Gambar 10.
Gambar 10 Skema penelitian tahap I
Kultivasi dalam medium modifikasi f/2 Guilard
HASIL
Profil protein dan lipid selama pertumbuhan C. gracilis
Kultur murni C. gracilis
Analisis kandungan seluler protein total dan protein silaffin
Kultivasi Diatom C. gracilis
Media pertumbuhan yang digunakan untuk menumbuhkan C.gracilis adalah media f/2 Guillard (Round et al. 1990) yang dimodifikasi oleh P3O-LIPI sebagai kurator. Medium f/2 mengandung air laut alami yang ditambah dengan sejumlah
mineral dengan komposisi makronutrien 0.99 mM NaNO3, 0.07 mM
NaH2PO4.2H2O, 5.3 µM Na2SiO3.9H2O; mikronutrien 5.4 µM FeCl3.6H2O dan
26.9 µM Na2EDTA serta vitamin yang terdiri dari 0.6 µM vitamin B1, 0.001 µM
vitamin B12, 0.004 µM biotin serta trace metal 0.8 µM CuSO4.5H2O, 2.1 µM
ZnSO4.7H2O, 0.5 µM NaMoO4.2H2O, 0.005 µM (NH4)6Mo7O24.4H2O, 18.2
µM MnCl2.4H2O, 0.6 µM CoCl2.6H2
Diatom C. gracilis dikulturkan dalam kultur sistem batch dengan suhu 16-19 °C, inokulum 10
O. Media kultur diatur pada pH 8 dan
salinitas 28‰.
5
sel/ ml, aerasi secara kontinyu dan pencahayaan sebesar
4000-5000 lx dilakukan dengan periode 12 jam terang:12 jam gelap. Pertambahan
sel diatom dimonitor setiap hari dengan menggunakan kotak hitung
Haemocytometer Neubauer. Hasil penghitungan sel diplot sebagai sumbu y dan waktu dalam hari sebagai sumbu x untuk pembuatan grafik kurva pertumbuhan.
Ekstraksi Protein Total (Rousch et al. 2004)
Protein keseluruhan sel adalah protein yang diperoleh dari ekstraksi
seluruh sel. Pelet biomasa sel C. gracilis yang diperoleh, diresuspensi dengan larutan bufer yang mengandung 100 mM Tris-HCl, pH 6.8 dan 4% SDS,
kemudian dididihkan untuk mengekstrak protein terlarut. Hasil ekstraksi
selanjutnya disentrifugasi dengan kecepatan 14 000 xg, suhu 4°C selama 30 menit untuk memisahkan material yang tak larut. Filtrat yang diperoleh, disiapkan
untuk analisis kadar protein terlarut.
Ekstraksi Protein Silaffin (Kroger et al. 1999)
Protein silaffin terletak di dalam SDV yang telah terintegrasi dengan dinding
sel diatom, sehingga untuk memperolehnya perlu mendapatkan dinding sel murni
selama 20 menit. Endapan yang diperoleh dicuci 2 kali dengan air bebas ion,
dilanjutkan dengan aseton 2 kali dan diulang kembali dengan air bebas ion.
Setelah proses pencucian kemudian dikeringudarakan, untuk memperoleh dinding
sel silicaceous (frustule).
Frustule yang telah diperoleh dilarutkan ke dalam bufer 2 M HF dalam 8 M NH4F (pH 5) pada suhu 4°C hingga tidak ditemukan adanya endapan. Larutan
bufer dihilangkan dengan metode dialisis cut off 3 kDa dalam air bebas ion, suhu 4 °C, selama 4 jam yang dilakukan sebanyak 9 kali. Dialisat kemudian disentrifus
dengan kecepatan 10 000 xg, 20 menit, suhu 4 °C. Endapan protein yang diperoleh disuspensi dengan air bebas ion lalu disimpan dalam suhu -4 °C.
Analisis Kadar Protein (Bollag & Edelstein 1991)
Pengukuran kadar protein menggunakan metode Bradford dengan Bovine Serum Albumiun (BSA) sebagai standar. Sebanyak 100 µ l filtrat protein direaksikan dengan 2 ml larutan Bradford diinkubasi sekitar 5 menit lalu diamati dengan spektrofotometer pada λ 595 nm.
Ekstraksi dan Kuantifikasi lipid (Dunstan et al. 1994)
Pelet sel diatom yang diperoleh, diekstrak menggunakan sonikasi selama
3x3 menit pada 20 KHz (Soniprep 150 MSE) dalam larutan 5 ml CHCl3
-MeOH-H2O (5:10:4). Campuran larutan tersebut lalu ditambah larutan CHCl3-H2O (1:1)
sehingga menjadi larutan CHCl3-MeOH-H2O dengan perbandingan 10:10:9
sehingga terbentuk 2 fase. Fase kloroform dikumpulkan kemudian diuapkan
dengan gas N2 hingga kering dan ditimbang sebagai berat total lipid. Analisis
lipid dilakukan setiap hari untuk memperoleh profil kandungan lipid sel selama
pertumbuhan.
Penelitian Tahap II
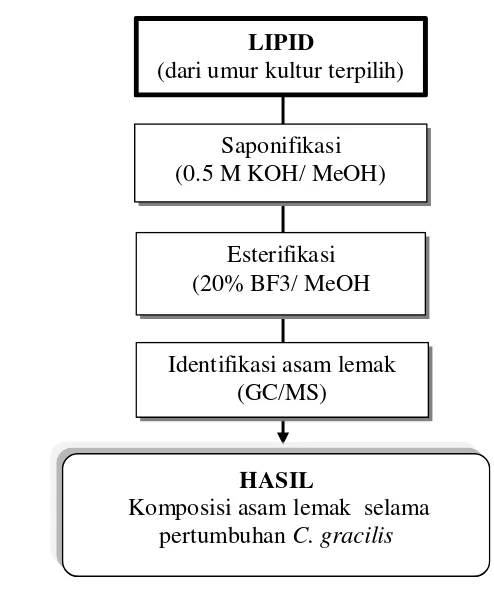
Analisis Komposisi Asam Lemak (Dunstan et al. 1994)
Analisis asam lemak dilakukan dari fase akhir eksponensial hingga fase
kematian (berdasarkan profil lipid selama pertumbuhan). Gambar 11 merupakan
Gambar 11 Skema tahap analisis komposisi asam lemak
Lipid yang diperoleh (Tahap I) disaponifikasi menggunakan prinsip
hidrolisis kalium hidroksida dalam metanol (100 ml 0.5 M KOH/ MeOH),
kemudian direfluk selama 5-10 menit untuk melepaskan asam lemak menjadi
asam lemak bebas. Asam lemak yang telah dilepaskan selanjutnya diesterifikasi
sehingga membentuk derivat metil ester dari asam lemak (Fatty Acid Methyl Esther = FAME). Setelah direfluk ditambahkan 5 ml 20% BF3 dalam MeOH. Larutan tersebut dididihkan sebentar kemudian ditambah sedikit isooktan pekat
lalu dididihkan kembali.
Tahap selanjutnya ditambah 20% NaCl, dikocok kuat dan sedikit dipanaskan
hingga terbentuk 2 fase. Fase atas (isooktan dan lipid) diambil, dilarutkan dalam
petroleum benzen (40-60 °C) dan disaring dalam corong pisah. Kemudian larutan
petroleum benzene dicuci dengan akuades sampai bebas asam (untuk
mengetahuinya dibantu dengan kertas lakmus universal). Fase petroleum benzene
kemudian ditambahkan Na2SO4, disaring masuk ke dalam labu evaporator dan
dilanjutkan evaporasi untuk menguapkan pelarutnya. Selanjutnya dikeringkan LIPID
(dari umur kultur terpilih)
Saponifikasi (0.5 M KOH/ MeOH)
Esterifikasi (20% BF3/ MeOH
Identifikasi asam lemak (GC/MS)
HASIL
dengan gas N2
FAME dalam pelarut isooktan sebanyak 1 µl diinjekkan pada CG/MS
dengan kolom DB-17 (panjang 30 m, diameter 0,25 mm). Kondisi kolom dengan
suhu injektor and detektor 250 °C, setelah 1 menit suhu dinaikan sampai 100 °C
selama 3 menit, lalu dinaikkan 10 °C per menit hingga 230 °C dan ditahan selama
3 menit, dinaikkan terus hingga 260 °C, ditahan 10 menit. Tekanan gas 64.5 Kpa
dan flow rate 1 ml menit
sehingga akan terbentuk metil ester. Metil ester yang terbentuk
dilarutkan dalam isooktan konsentrasi 5% untuk identifikasi asam lemak
menggunakan GC/ MS.
-1.
Penelitian Tahap III
Penelitian tahap ke tiga merupakan tahap identifikasi dan karakteristisasi
protein menggunakan analisis elektroforesis 2 dimensi. Protein hasil ekstraksi
dilakukan separasi ke dalam titik isoelektrik (elektroforesis 1 dimensi) kemudian
diekulibrasi sebelum dilakukan seperasi ke dalam berat molekul (elektroforesis 2
dimensi). Hasil elektroforesis 2 dimensi dideteksi dan diidentifikasi jenis protein
target (yang terlibat dalam sintesis silika dan sintesis PUFA). Penelusuran jenis
protein dilakukan berdasarkan studi bioinformatika.
Secara khusus untuk protein yang teridentifikasi sebagai protein yang
terlibat dalam sintesis PUFA digunakan untuk memprediksi jalur biosintesis
PUFA bersama profil PUFA dari Penelitian Tahap II. Diagram alir tahapan
Penelitian Tahap III dapat dilihat pada Gambar 12.
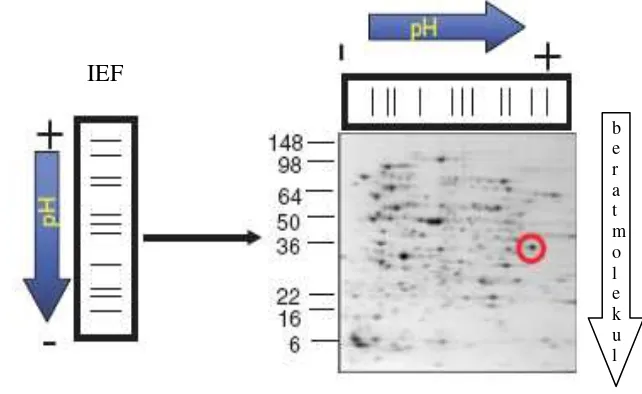
Analisis 2 dimensi (
Analisis 2 dimensi dilakukan untuk memperoleh informasi protein yang
dimiliki berdasarkan perkiraan berat molekul dan titik isoelektrik. Analisis 2
dimensi merupakan analisis dengan dasar elektroforesis gel poliaklilamid,
sehingga juga sering disebut elektroforesis 2 dimensi. Secara teknis adalah suatu
metode pemisahan protein kompleks ke dalam titik isoelektrik pada arah
horisontal (isoelekteric focusing) dan berat molekul pada arah vertikal (SDS-PAGE).
Phillips & Bogyo 2005)
Dengan menggunakan metode ini, protein dipisahkan sesuai dalam
dimensi ke dua (SDS-PAGE). Analisis ini diawali dengan preparasi protein
kemudian elektroforesis 1 dimensi, ekuilibrasi kemudian elektroforesis 2 dimensi.
Gambar 12 Skema penelitian tahap III.
<