DURASI PROTEKSI VAKSIN KOKTAIL UNTUK PENCEGAHAN
PENYAKIT MOTILE AEROMONADS SEPTICEMIA DAN
STREPTOCOCCOSIS PADA IKAN NILA (Oreochromis niloticus)
TUTI SUMIATI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Durasi Proteksi Vaksin Koktail untuk Pencegahan Penyakit Motile Aeromonads Septicemia dan Streptococcosis pada Ikan Nila (Oreochromis niloticus) adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
RINGKASAN
TUTI SUMIATI. Durasi Proteksi Vaksin Koktail untuk Pencegahan Penyakit Motile Aeromonads Septicemia dan Streptococcosis pada Ikan Nila (Oreochromis niloticus). Dibimbing oleh SUKENDA, SRI NURYATI dan ANGELA MARIANA LUSIASTUTI.
Ko-infeksi bakteri Aeromonas hydrophila dan Streptococcus agalactiae rentan terjadi pada budidaya nila, sehingga pencegahan menggunakan vaksin koktail yang mengandung kedua bakterin tersebut merupakan langkah yang tepat untuk pengendaliannya. Vaksinasi ikan bertujuan untuk menginduksi respons imun spesifik yang ditunjukkan oleh peningkatan produksi antibodi pada ikan yang divaksinasi. Evaluasi vaksin yang berhubungan dengan kekebalan protektif akan menjadi alternatif yang dapat dilakukan untuk pengujian. Metode konvensional seperti aglutinasi serum hanya dapat dilakukan ketika tingkat antibodi yang dihasilkan relatif tinggi. Untuk mendeteksi respons antibodi dengan konsentrasi yang kurang atau sangat kecil, metode yang lebih sensitif akan lebih membantu memberikan hasil yang optimal. Penelitian dilakukan dalam dua tahap yaitu pengembangan metode ELISA untuk mendeteksi respons imun spesifik dan menganalisis durasi proteksi vaksin koktail untuk pencegahan penyakit motile aeromonads septicemia (MAS) dan streptococcosis pada ikan nila (O. niloticus).
Penelitian tahap pertama dilakukan untuk pengembangan metode ELISA melalui penentuan konsentrasi optimum antigen kemudian menganalisis respons imun spesifik (antibodi) ikan nila yang divaksinasi dengan menggunakan konsentrasi optimum antigen yang diperoleh. Berdasarkan penghitungan kepadatan sel dan konsentrasi protein antigen diperoleh hasil A. hydrophila lebih tinggi sebesar 1,84 x 1011 CFU/mL dan 3.54 mg/mL dibandingkan dengan S. agalactiae 0,74 x 109 CFU/mL dan 0.05 mg/mL. Konsentrasi optimum antigen A. hydrophila dan S. agalactiae untuk penentuan antibodi ikan nila menggunakan indirect - ELISA masing-masing sama yaitu sebesar 10 µg/mL. Konsentrasi tersebut dapat digunakan untuk mendeteksi antibodi spesifik terhadap A. hydrophila dan S. agalactiae pada ikan nila yang divaksinasi.
Penelitian tahap kedua dilakukan untuk menganalisis durasi imunitas protektif terhadap A. hydrophila dan S. agalactiae pada ikan nila (O. niloticus) yang divaksin dan korelasinya terhadap tingkat mortalitas setelah uji tantang. Uji tantang dilakukan untuk tiga periode, yaitu pada hari ke-22, 50 dan 78 pascavaksinasi ikan dengan infeksi tunggal A. hydrophila 108 CFU/mL, S. agalactiae 104 CFU/mL dan ko-infeksi dari kedua jenis bakteri tersebut. Tingkat mortalitas ikan yang divaksinasi setelah uji tantang berbeda nyata dengan kontrol (P<0,05) dengan persentase mortalitas paling rendah diperoleh setelah uji tantang hari ke-50. Mortalitas yang diperoleh adalah 10%, 20% dan 20% masing-masing diuji tantang dengan A. hydrophila, S. agalactiae dan ko-infeksi, sedangkan mortalitas kontrol diperoleh 83,3%, 73,3%, dan 83,3%. Konsentrasi antibodi spesifik pada ikan yang divaksin lebih tinggi dibandingkan kontrol, dan terdapat korelasi antara antibodi yang dihasilkan dengan tingkat mortalitas ikan setelah diuji tantang.
SUMMARY
TUTI SUMIATI. Protective duration of Cocktail Vaccine Against Motile Aeromonads Septicemia and Streptococcosis in Nile Tilapia (Oreochromis niloticus). Supervised by SUKENDA, SRI NURYATI and ANGELA MARIANA LUSIASTUTI.
Co-infection of Aeromonas hydrophila and Streptococcus agalactiae susceptible in cultured nile tilapia (Oreochromis niloticus). Prevention using a cocktail vaccine containing both bacterias are the right step to control the diseases. Fish vaccination aims to induce a specific immune response indicated by an increase of antibodies in vaccinated fish. Evaluation of vaccine associated with protective immunity would be an alternative that can be done for testing. Conventional methods such as serum agglutination can only be done when the level of antibodies produced relatively high. To detect antibody response at less concentrations, , more sensitive methods will further help provide optimal results. The study was conducted in two phases, the development of the ELISA method to detect specific immune response and to analyze the protective duration of cocktail vaccine for disease prevention of motile aeromonads septicemia and streptococcosis in nile tilapia (O. niloticus).
First step was to develop of ELISA method to determine the optimum concentration of antigen, then analyzing the specific immune response (antibody) in nile tilapia vaccinated using the optimum concentration of antigen. Based on the calculation of the cell density and the concentration of the antigen protein obtained the results of A. hydrophila 1,84 x 1011 cfu/mL and 3.54 mg/mL higher than S. agalactiae 0,74 x 109 cfu/mL and 0.05 mg/mL. The optimum concentration of both antigen A. hydrophila and S. agalactiae for determination of antibodies in tilapia was 10 µg/mL. The value concentration can be used to detect antibody serum in tilapia post vaccination with cocktail vaccine against A. hydrophila and S. agalactiae.
The second step was to analyze the duration of protective immunity against A. hydrophila and S. agalactiae in tilapia (O. niloticus) and its correlation with mortality rate post challenge. Challenge test was performed for three groups, on day 22, 50 and 78 post-vaccination and the fishes were challenged with single infection of A. hydrophila 108 cfu / mL and S. agalactiae 104 cfu / mL and co-infection of both bacterias by intra peritoneal. The mortality rate of vaccinated post-challenge test was significantly different from controls (P<0.05) with the lowest percentage of mortality was obtained challenge test after 50th day vaccination. The mortality rate obtained was 10%, 20% and 20% respectively tested challenged with A. hydrophila, S. agalactiae and co-infection, while the control was obtained 83,3%, 73,3%, and 83,3%. The concentration of specific antibodies in vaccinated fish was higher than the control, and there was a correlation between the production of antibody with the mortality rate of fish after challenge test.
©Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Akuakultur
DURASI PROTEKSI VAKSIN KOKTAIL UNTUK PENCEGAHAN
PENYAKIT MOTILE AEROMONADS SEPTICEMIA DAN
STREPTOCOCCOSIS PADA IKAN NILA (Oreochromis niloticus)
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2015
Judul Tesis : Durasi Proteksi Vaksin Koktail untuk Pencegahan Penyakit Motile Aeromonads Septicemia dan Streptococcosis pada Ikan Nila (Oreochromis niloticus)
Nama : Tuti Sumiati
NIM : C151120481
Disetujui oleh Komisi Pembimbing
Dr Ir Sukenda, MSc Ketua
Dr Sri Nuryati, SPi MSi Anggota
Dr drh Angela Mariana Lusiastuti, MSi Anggota
Diketahui oleh
Ketua Program Studi Ilmu Akuakultur
Dr Ir Widanarni, MSi
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
Tanggal Ujian: 16 September 2015
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Desember 2013 – September 2014 ini ialah Durasi Proteksi Vaksin Koktail untuk Pencegahan Penyakit Motile Aeromonads Septicemia dan Streptococcosis pada Ikan Nila (Oreochromis niloticus).
Terima kasih penulis ucapkan kepada Bapak Dr Ir Sukenda, MSc, Ibu Dr Sri Nuryati, SPi MSi, dan Ibu Dr drh Angela Mariana Lusiastuti, MSi, selaku pembimbing yang banyak memberi saran dan masukan, serta kepada Dr Ir Nur Bambang Priyo Utomo, Msi dan Dr Ir Widanarni, MSi sebagai penguji. Terima kasih juga penulis sampaikan kepada Kementrian Kelautan dan Perikanan yang telah memberikan beasiswa periode September 2012 – Agustus 2014. Disamping itu, penghargaan penulis sampaikan kepada Kepala Balai Penelitian dan Pengembangan Budidaya Air Tawar; Ir Taukhid, MSc; Dr Desy Sugiani, MSi ; drh Uni Purwaningsih, MSi; Nunak Nafiqoh, SPi MSc, Ahmad Wahyudi; Edy Farid Wadjdy; Bambang Priadi; Mikdarullah; serta seluruh staf peneliti dan karyawan-karyawati lingkup IP4I Depok dan BPPBAT Bogor. Terima kasih untuk teman - teman AKU 2012 semoga silaturahim kita tetap terjalin. Ungkapan terima kasih juga disampaikan kepada ibunda Roro Rodiah, ayahanda Omon Suratman serta seluruh keluarga, atas segala doa dan kasih sayangnya, dan terima kasih juga untuk suami tercinta Ridwan Nirwana, dan tiga jagoan “Fathi, Fakhry
dan Fathan” yang selalu menemani dan memberikan semangat pada saat-saat tersulit dalam menyelesaikan penelitian dan penulisan tesis ini.
Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 4
Tujuan Penelitian 4
Manfaat Penelitian 4
2 METODE 5
Waktu dan Tempat Penelitian 5
Bahan 5
Prosedur Penelitian 5
Tahap 1 Pengembangan Metode ELISA untuk Mendeteksi Respons Imun Spesifik pada Ikan Nila (O. niloticus) 5 Tahap 2 Durasi Proteksi Vaksin Koktail untuk Pencegahan Penyakit Motile Aeromonads Septicemia dan Streptococcosis pada Ikan Nila
(O. niloticus) 7
Parameter yang Diamati 8
Analisis Data 9
3 HASIL DAN PEMBAHASAN 10
Hasil 10
Pembahasan 18
4 KESIMPULAN DAN SARAN 24
Kesimpulan 24
Saran 24
DAFTAR PUSTAKA 25
LAMPIRAN 32
DAFTAR TABEL
1 Periode dan Jenis Uji Tantang Ikan Nila Setelah Vaksinasi 8 2 Kepadatan sel dan konsentrasi protein antigen Aeromonas hydrophila
dan Streptococcus agalactiae 10
3 Mortalitas kumulatif dan RPS ikan nila (O. niloticus) yang divaksinasi dengan vaksin koktail A. hydrophila – S. agalactiae pada beberapa
periode uji tantang 14
DAFTAR GAMBAR
1 Alur Penelitian Durasi Proteksi Vaksin Koktail Untuk Pencegahan Penyakit Motile Aeromonads Septicemia Dan Streptococcosis Pada
Ikan Nila (O. niloticus) 6
2 Nilai OD ELISA serum kontrol positif dan kontrol negatif ikan nila (O. niloticus) pada berbagai pengenceran antigen A. hydrophila 11 3 Nilai OD ELISA serum kontrol positif dan kontrol negatif ikan nila (O.
niloticus) pada berbagai pengenceran antigen S. agalactiae 11 4 Titer antibodi dari serum ikan nila (O. niloticus) dengan pelapisan
antigen A. hydrophila (A) dan S. agalactiae (B) 12 5 Kinetika antibodi spesifik ikan nila (O. niloticus) pasca vaksinasi
terhadap antigen A. hydrophila dan S. agalactiae 13 6 Tren kematian ikan nila yang divaksinasi dengan vaksin koktail setelah
diuji tantang dengan infeksi tunggal A. hydrophila, S. agalactiae, dan
ko-infeksi pada periode uji tantang 15
7 Level antibodi spesifik ikan nila (O. niloticus) yang divaksinasi koktail terhadap antigen A. hydrophila (kiri) dan S. agalactiae (kanan) pada
beberapa periode uji tantang 17
DAFTAR LAMPIRAN
1 Berat protein antigen A. hydrophila dan S. agalactiae dan kurva standar
protein 32
2 Nilai survival rate (SR) dan relative percent survival (RPS) ikan nila
berdasarkan waktu dan jenisuji tantang 34
3 Pengukuran konsentrasi protein 35
1
PENDAHULUAN
Latar Belakang
Ikan nila (Oreochromis niloticus) merupakan salah satu komoditas prioritas pada perikanan budidaya. Intensifikasi pada budidaya ikan ini serta pola pemberian pakan yang kurang tepat menyebabkan kualitas lingkungan budidaya menjadi menurun, akibatnya kasus kejadian penyakit ikut berkembang. Kasus kematian ikan pada budidaya nila disebabkan oleh beberapa jenis bakteri diantaranya adalah infeksi bakteri Aeromonas hydrophila dan Streptococcus sp. yang menjadi salah satu faktor penghambat pada peningkatan hasil produksi (Supriyadi et al. 2005). Hal ini telah mengakibatkan kerugian ekonomi, karena selain menurunkan produksi akibat adanya kematian ikan juga menurunkan kualitas produk perikanan.
Penyakit bercak merah atau sering disebut dengan penyakit MAS (Motile Aeromonads Septicemia) disebabkan oleh bakteri A. hydrophila. Bakteri A. hydrophila merupakan bakteri yang umum ditemukan di perairan dan merupakan mikroflora normal pada ikan, pada kondisi lingkungan budidaya yang buruk A. hydrophila menjadi agen penginfeksi sekunder (Cipriano 2001; Joice et al. 2002) yang bersifat sangat virulen (Angka et al. 1995). Apabila jumlahnya di perairan melebihi 104 sel per mililiter maka bakteri tersebut dapat menjadi patogen (Irianto 2003) yang mengakibatkan kematian ikan budidaya sekitar 10 - 70% (Ibrahem et al. 2008). Aeromonas hydrophila menyebabkan penyakit haemorrhagic septicemia pada ikan tropika maupun dari daerah beriklim sedang (Austin dan Austin 1999; Nielsen et al. 2001) dan merupakan patogen oportunistik dari berbagai hewan akuatik. Gejala klinis ikan nila yang terinfeksi MAS ditandai dengan adanya septikemia, ascites, ulcer, dan nekrosis otot dan dapat mengakibatkan kematian 10 - 70% (Supriyadi et al. 2005; Ibrahem et al. 2008). Komisi Kesehatan Ikan dan Lingkungan Nasional pada 2006 telah menetapkan jenis penyakit ini sebagai salah satu penyakit ikan utama di Indonesia.
2
70% (Siti-Zahrah et al. 2008) dan umumnya terkait dengan multi faktor seperti fluktuasi suhu air, peningkatan kadar ammonia dan kadar oksigen terlarut yang rendah (Evans et al. 2002).
Teknik pengendalian penyakit dapat dilakukan dengan pencegahan dan pengobatan. Selama ini, teknik pengobatan lebih mengandalkan pada penggunaan bahan kimia/obat serta antibiotik. Tetapi, penggunaan bahan-bahan tersebut memiliki dampak negatif terhadap lingkungan perairan, ikan, maupun konsumen. Selain itu issue global terus berkembang berkenaan dengan residu terhadap penggunaan bahan kimia/obat/antibiotik pada perikanan budidaya (Supriyadi dan Rukyani 2000; Le Breton 2009; Douet et al. 2009). Oleh karena itu penggunaan bahan kimia dan antibiotik pada perikanan budidaya dibatasi.
Pencegahan merupakan langkah paling ideal untuk pengendalian kasus penyakit pada budidaya ikan, salah satu alternatif yang ditawarkan yaitu dengan metode vaksinasi. Program vaksinasi pada perikanan budidaya telah terbukti memberi kontribusi yang signifikan terhadap peningkatan produksi serta menurunkan penggunaan antibiotik (Rahman dan Kawai 2000; Ebanks et al. 2004; Sommerset et al. 2005). Vaksinasi menggunakan vaksin monovalen A. hydrophila inaktif telah memberikan proteksi pada beberapa jenis ikan (Chandran et al. 2002; Poobalane 2007; Jeney et al. 2009; Ismail et al. 2010; Sugiani dan Komarudin 2011). Sedangkan vaksinasi monovalen S. agalactiae yang diinaktifasi telah banyak dilakukan penelitian dengan menggunakan berbagai sediaan antara lain sel utuh, extracellular product (ECP) maupun kombinasi sel utuh dan ECP (Evans et al. 2004; Pasnik et al. 2005; Hardi et al. 2010; Pretto-Giordano et al. 2010; Taukhid dan Purwaningsih 2011).
Penelitian mengenai kombinasi beberapa jenis ataupun strain sumber antigen sebagai bahan pembuat vaksin atau sering disebut vaksin polivalen sudah dilakukan dan menunjukkan hasil yang bervariasi. Penggunaan vaksin polivalen diharapkan akan memberikan nilai proteksi yang lebih baik daripada vaksin monovalen ketika terjadi ko-infeksi. Osman et al. (2009) melaporkan bahwa ikan nila yang divaksinasi dengan vaksin polivalen kombinasi dari Aeromonas spp. (A. hydrophila, A. sobria dan A. caviae) dan Pseudomonas fluorescens menghasilkan relative percent survival (RPS) 81%. Bastardo et al. (2012) menjelaskan bahwa tingkat proteksi yang tinggi dihasilkan oleh ikan rainbow trout yang divaksinasi dengan vaksin bivalen Lactococcus garvieae dan A. hydrophila pada 30 hari pasca vaksinasi setelah diuji tantang dengan infeksi tunggal dari masing-masing antigen tersebut. Sugiani (2012) melaporkan bahwa vaksin bivalen A. hydrophila dan S. agalactiae kombinasi sel utuh dan ECP lebih mampu memproteksi ikan terhadap infeksi tunggal A. hydrophila (RPS 100%), infeksi tunggal S. agalactiae (RPS 78,4%), dan ko-infeksinya (RPS 56,7%) daripada vaksin monovalen. Sedangkan Sumiati et al. (2012) menyatakan nilai RPS tertinggi pasca uji tantang dengan ko-infeksi maupun ko-infeksi tunggal diperoleh dari perlakuan vaksinasi koktail sel utuh dengan komposisi 25% (A. hydrophila) dan 75% (S. agalactiae) baik dengan aplikasi oral maupun aplikasi rendam.
dari respons imun non spesifik (innate) dan respons imun spesifik (adaptive) (Iwama dan Nakanishi 1996). Respons fisik yang terdapat pada ikan meliputi tingkah laku, penurunan nafsu makan, dan gerakan berenang. Respons imun non-spesifik ditunjukkan dengan adanya perubahan pada gambaran darah dan kimia darah. Sedangkan respons imun spesifik ditunjukkan dengan peningkatan produksi antibodi pada ikan yang divaksin. Hasil beberapa penelitian menunjukkan bahwa terdapat perbedaan pada beberapa parameter imunitas seperti gambaran darah, indeks fagositosis, aktifitas lisosim, aktifitas komplemen dan produksi antibodi spesifik pada ikan yang divaksin dibanding kontrol (Vivas et al. 2005; Swain et al. 2007; Tengjaroenkul dan Yowarach 2009; Jeney et al. 2009; Silva et al. 2009; Pleyghan et al. 2010; Zheng et al. 2012; Sugiani et al. 2012). Namun seiring waktu pemeliharaan, keberadaan antibodi sebagai respons imun spesifik yang dapat memproteksi ikan dari infeksi patogen akan terus menurun.
Untuk mencapai sasaran vaksinasi yaitu terbentuknya antibodi spesifik dan menghasilkan sintasan yang tinggi, maka vaksin harus bersifat imunogenik dan menghasilkan waktu proteksi yang lama serta aman (Ellis 1988; Sommerset et al. 2005). Johnson et al. (1982) menyebutkan bahwa metode/teknik vaksinasi dan ukuran ikan berpengaruh terhadap durasi dan tingkat proteksi ikan yang divaksin. Sedangkan Pretto-Giordano et al. (2010) menganalisis bahwa beberapa faktor yang berpengaruh terhadap khasiat vaksin Streptococcus pada ikan nila antara lain faktor antigenisitas bakteri sebagai sumber vaksin (imunogenisitas), komposisi, konsentrasi dan metode aplikasi vaksin, penggunaan adjuvant, umur dan jenis ikan serta suhu lingkungan. Namun demikian, imunogenisitasantigenisitas bakteri merupakan faktor yang paling penting dalam hubungannya dengan vaksinasi.
Berdasarkan penelitian Pasnik et al. (2005) disebutkan bahwa waktu proteksi vaksin S. agalactiae dari ECP dan sel utuh mulai mengalami penurunan pada hari ke-47 setelah vaksinasi. Sedangkan penelitian yang dilakukan Bastardo et al. (2012) menjelaskan bahwa tingkat proteksi ikan rainbow trout yang divaksin dengan vaksin bivalen L. garvieae dan A. hydrophila menurun setelah 90 hari pascavaksinasi. Hasil penelitian Rusli (2012) menjelaskan bahwa nilai titer antibodi dan tingkat proteksi yang dihasilkan oleh vaksin S. agalactiae dari ECP, sel utuh dan gabungannya pada ikan nila terus menurun setelah 28 hari pascavaksinasi.
Keberadaan respons imun spesifik ditunjukkan dengan peningkatan produksi antibodi pada ikan yang divaksin dan dapat diketahui dengan beberapa metode yang sudah banyak dikembangkan, salah satunya adalah metode indirect-enzim linked immunosorbent assay (indirect-ELISA). Prinsip ELISA secara umum adalah mendeteksi adanya antibodi atau antigen dalam sampel. Adanya ikatan antara antigen dan antibodi yang berpasangan ditandai dengan penggunaan enzim spesifik dan dideteksi melalui penambahan substrat serta dapat dilihat secara visual melalui perubahan warna (Crowther 1995), atau melalui ELISA reader dengan panjang gelombang tertentu.
4
Perumusan Masalah
Ko-infeksi bakteri Aeromonas hydrophila dan Streptococcus agalactiae rentan terjadi pada budidaya nila. Bakteri A. hydrophila penyebab penyakit MAS telah banyak dilaporkan dapat menginfeksi ikan air tawar di Indonesia hampir dari semua jenis dan pada semua stadia, serta mengakibatkan kematian sampai 70%. Ikan nila juga rentan oleh penyakit bakterial lainnya yaitu penyakit streptococcosis. Penyakit ini disebabkan oleh jenis Streptococcus seperti S. iniae, S. agalactiae dan S. difficile. Infeksi S. agalactiae dapat menyebabkan kematian mencapai 60-70%. Kematian ikan bisa mencapai 100% jika terjadi ko-infeksi dari kedua jenis bakteri tersebut, sehingga pencegahan menggunakan vaksin koktail yang mengandung kedua bakterin tersebut merupakan langkah yang tepat untuk pengendaliannya. Vaksinasi koktail sel utuh bakterin A. hydrophila dan S. agalactiae terhadap ikan nila telah memberikan proteksi baik pada infeksi tunggal A. hydrophila dan S. agalactiae maupun ko-infeksi dari kedua antigen tersebut selama 21 hari pasca vaksinasi. Memori respons imun spesifik memiliki nilai praktis hanya jika memori kekebalan dapat menginduksi respons imun spesifik dan protektif terhadap patogen target. Kekhususan perlindungan dan durasi imunitas merupakan bagian penting dari tujuan vaksinasi. Evaluasi vaksin yang berhubungan dengan kekebalan protektif akan menjadi alternatif yang dapat dilakukan untuk pengujian. Metode konvensional seperti aglutinasi serum hanya dapat dilakukan ketika tingkat antibodi yang dihasilkan relatif tinggi. Untuk mendeteksi respons antibodi dengan konsentrasi yang kurang atau sangat kecil, metode yang lebih sensitif akan membantu memberikan hasil yang optimal. Oleh karena itu perlu dilakukan pengembangan metode yang lebih sensitif yang dapat digunakan untuk mendeteksi antibodi spesifik terhadap A. hydrophila dan S. agalactiae pada ikan nila yang divaksinasi. Selain itu perlu dilakukan penelitian untuk melihat durasi proteksi vaksin koktail A. hydrophila dan S. agalactiae untuk pencegahan penyakit MAS dan streptococcosis pada ikan nila.
Tujuan Penelitian
Tujuan dari penelitian ini adalah:
1. Melakukan pengembangan metode indirect ELISA dengan menentukan dan menganalisis konsentrasi optimum antigen A. hydrophila dan S. agalactiae untuk mengukur titer antibodi ikan nila pascavaksinasi;
2. Menganalisis kinetika produksi antibodi ikan nila yang divaksinasi dengan vaksin koktail A. hydrophila dan S. agalactiae;
3. Menganalisis durasi imunitas vaksin koktail A. hydrophila dan S. agalactiae pada ikan nila dan korelasinya terhadap kelangsungan hidup pascauji tantang.
Manfaat Penelitian
2
METODE
Waktu dan Tempat Penelitian
Penelitian dilakukan di Laboratorium Kesehatan Ikan dan Instalasi Penelitian Lingkungan dan Toksikologi, Balai Penelitian dan Pengembangan Budidaya Air Tawar (BPPBAT) Bogor, serta Instalasi Penelitian dan Pengembangan Pengendalian Penyakit Ikan (IP4I) Depok. Penelitian dilakukan dari bulan September 2013 sampai Desember 2014.
Bahan
Ikan Uji
Ikan uji yang digunakan adalah ikan nila (O. niloticus) berukuran 16,5 g + 3,4 yang berasal dari Instalasi Penelitian Plasma Nutfah Ikan Budidaya Air Tawar Cijeruk, berdasarkan penelusuran rekam jejak dari populasi ikan uji tidak ada riwayat terjadi kasus penyakit dari bakteri target. Selain itu, selama masa aklimatisasi tidak ditemukan adanya gejala penyakit dari karakteristik yang akan muncul ketika terinfeksi penyakit MAS dan streptococcosis atau kondisi ikan sudah stabil.
Isolat Bakteri
Sumber antigen yaitu bakteri A. hydrophila isolat AHL0905-2 dan S. agalactiae isolat N14G yang akan digunakan merupakan koleksi BPPBAT Badan litbang Kementrian Kelautan dan Perikanan, Bogor. Aeromonas hydrophila diinokulasi pada media Triptic Soy Agar (TSA) dan S. agalactiae diinokulasi pada media Brain Heart Infussion Agar (BHIA).
Vaksin
Vaksin koktail bakterin A. hydrophila dan S. agalactiae yang digunakan merupakan hasil gabungan vaksin monovalen dari masing-masing bakterin dengan konsentrasi 10 11 CFU/mL dengan formulasi 25% A. hydrophila dan 75% S. agalactiae (Sumiati et al. 2012).
Prosedur Penelitian
Pelaksanaan penelitian dilakukan dalam dua tahap kegiatan. Adapun skema penelitian tersaji pada Gambar 1.
Tahap 1 Pengembangan metode ELISA untuk mendeteksi respons imun spesifik pada ikan nila (O. niloticus)
6
pengendaliannya. Penelitian ini bertujuan untuk menganalisis respons antibodi
ikan nila yang divaksinasi dengan vaksin koktail bakterin A. hydrophila dan S. agalactiae dengan menggunakan ELISA. Penelitian dilakukan dalam dua tahap, tahap pertama adalah optimalisasi metode ELISA, yang terdiri dari persiapan antigen dan penentuan konsentrasi optimum antigen untuk deteksi antibodi dan tahap kedua adalah mendeteksi antibodi pasca vaksinasi ikan nila.
Optimalisasi ELISA
Preparasi antigen dan ekstraksi protein
Sumber antigen yaitu bakteri A. hydrophila isolat AHL0905-2 dan S. agalactiae isolat N14G yang digunakan merupakan koleksi BPPBAT Kementrian Kelautan dan Perikanan. Bakteri A. hydrophila diinokulasi pada media Triptic Soy Agar (TSA) dan S. agalactiae diinokulasi pada media Brain Heart Infussion Agar (BHIA). Kemudian diinkubasi selama 24 jam, selanjutnya dipanen ke dalam 10 mL salin 0,85 %.
Sebagian dari masing-masing sediaan antigen dilakukan pengujian kepadatan bakteri (SNI, 2006), dan sebagian lagi disonikasi pada 40 Hz selama 5 menit (on ice), selanjutnya disentrifugasi selama 60 menit pada 3000 g dan suhu
Alur Pelaksanaan Penelitian
Gambar 1 Alur Penelitian Durasi Proteksi Vaksin Koktail Untuk Pencegahan Penyakit Motile Aeromonads Septicemia Dan Streptococcosis Pada Ikan Nila (O. niloticus)
1AlurPenelitianDurasiProteksiVaksinKoktailUntukPencegahanPenyakit Motile TAHAP 2
DURASI PROTEKSI VAKSIN KOKTAIL UNTUK PENCEGAHAN PENYAKIT MOTILE AEROMONADS SEPTICEMIADAN STREPTOCOCCOSIS PADA IKAN NILA (Oreochromis niloticus)
Melakukan analisis terhadap kinetika titer antibodi, durasi imunitas protektif, tren mortalitas, serta efektivitas vaksin
Titer antibodi, Mortalitas, dan RPS TAHAP 1
PENGEMBANGAN METODE ELISA UNTUK MENDETEKSI RESPON IMUN SPESIFIK PADA IKAN NILA (Oreochromis niloticus)
4oC (Sugiani at al. 2014). Antigen siap untuk dilakukan pengukuran kadar protein (Bradford, 1976).
Optimalisasi konsentrasi antigen
Optimalisasi konsentrasi dilakukan dengan tujuan untuk mengetahui konsentrasi optimal antigen melalui titrasi protein (Lubis, 2013). Larutan buffer yang digunakan dalam penelitian ini adalah 0.1 M karbonat-bikarbonat pH 9,6. Optimalisasi konsentrasi antigen dilakukan mulai dari konsentrasi 40 μg/ml
diencerkan serial 40, 20, 10, 5, 2,5 μg/ml dimasukkan ke dalam sumur mikrotiter. Selanjutnya diinkubasi pada suhu 4 oC selama semalam. Kemudian dilakukan uji indirect ELISA, sehingga dari nilai OD yang dihasilkan diperoleh konsentrasi antigen yang optimal digunakan untuk pengujian sampel antibodi serum ikan nila
Tahap 2 Durasi Proteksi Vaksin Koktail untuk Pencegahan Penyakit Motile
Aeromonads Septicemia dan Streptococcosis pada Ikan Nila (O. niloticus)
Vaksinasi ikan bertujuan untuk menginduksi respons imun spesifik yang ditunjukkan oleh peningkatan produksi antibodi pada ikan yang divaksinasi. Namun seiring waktu, keberadaan antibodi yang terbentuk akan terus menurun. Kinerja vaksinasi koktail A. hydrophila – S. agalactiae pada ikan nila antara lain durasi imunitas yang dievaluasi setelah dilakukan uji tantang.
Vaksinasi
Sediaan vaksin koktail yang diuji pada penelitian ini merupakan campuran dari vaksin monovalen sel utuh A. hydrophila inaktif serta vaksin monovalen sel utuh S. agalactiae inaktif dengan formulasi 25% A. hydrophila dan 75% S. agalactiae, dengan konsentrasi akhir masing-masing bakterin 1011 CFU/mL (Sumiati et al. 2012). Vaksinasi dilakukan dengan teknik perendaman, vaksin diencerkan terlebih dahulu dengan dosis 1 mL vaksin ke dalam 10 L air bersih, sehingga konsentrasi akhir vaksin di air berkisar 107 CFU/mL. Kelompok vaksinasi, ikan sebanyak 400 ekor direndam dalam larutan vaksin yang sudah diencerkan selama 15 - 30 menit sambil diaerasi, untuk kontrol ikan direndam dalam air tanpa vaksin. Setelah vaksinasi ikan dipelihara selama 4 bulan di kolam dengan volume 10 m3 dengan kepadatan ikan 20 ekor/m3.
Uji tantang
8
kepadatan ikan 10 ekor/kontainer, ikan dipelihara selama 14 hari setelah uji tantang.
Parameter yang Diamati
Beberapa parameter uji yang diamati dalam penelitian ini diantaranya adalah optimalisasi konsentrasi antigen untuk mengukur titer antibodi ikan nila dengan metode ELISA, kinetika titer antibodi ikan nila setelah vaksinasi dan efektivitas vaksin dievaluasi dari titer antibodi dan mortalitas ikan setelah uji tantang dengan menghitung relative percent survival (RPS).
Optimalisasi Konsentrasi Antigen
Optimalisasi konsentrasi dilakukan dengan tujuan untuk mengetahui konsentrasi optimal antigen melalui pengenceran protein (Lubis, 2013). Larutan buffer yang digunakan dalam penelitian ini adalah menggunakan 0.1 M karbonat-bikarbonat pH 9,6. Konsentrasi protein antigen yang digunakan mulai dari
konsentrasi 40 μg/ml dan diencerkan serial 40, 20, 10, 5, 2,5 μg/ml dimasukkan ke dalam sumur mikrotiter dan diinkubasi pada suhu 4o C selama semalam. Selanjutnya uji indirect ELISA dilakukan untuk mendapatkani nilai OD sehingga diperoleh konsentrasi antigen yang optimal digunakan untuk pengujian sampel antibodi serum ikan nila.
Tabel 1 Periode dan Jenis Uji Tantang Ikan Nila Setelah Vaksinasi Kelompok Waktu dan Jenis uji tantang
Kinetika Titer Antibodi Ikan Nila
Sampel serum dikumpulkan dari 4 ekor ikan pada setiap kelompok (vaksinasi dan kontrol). Pengambilan darah dilakukan sebelum vaksinasi, dan setiap dua minggu setelah vaksinasi selama masa pemeliharaan (112 hari). Darah diambil tanpa menggunakan anti-koagulan, kemudian dilakukan sentrifugasi dan serum yang diperoleh disimpan pada freezer -20 oC sampai digunakan untuk pengujian.
Durasi Imunitas Protektif
Durasi imunitas dievaluasi berdasarkan periode proteksi dari hasil vaksinasi dengan melakukan uji tantang baik dengan infeksi tunggal A. hydrophila, S. agalactiae, maupun ko-infeksi dari kedua patogen tersebut. Hasilnya dievaluasi berdasarkan titer antibodi dan tingkat mortalitas ikan yang dipelihara selama 14 hari setelah uji tantang.
Tren Mortalitas Ikan
Tren mortalitas ikan dievaluasi berdasarkan waktu dan jumlah kematian ikan yang terjadi baik terhadap infeksi tunggal A. hydrophila, S. agalactiae, maupun ko-infeksi dari kedua patogen tersebut pada setiap kelompok uji tantang. Efektivitas Vaksin
Efektifitas vaksin koktail dilakukan dengan menghitung relative percent survival (RPS) (Ellis, 1988).
Relative Percent Survival (RPS):
� = 1− % � �� � � � � ��� �
% � �� � � 100
Analisis Data
10
3
HASIL DAN PEMBAHASAN
Hasil
Tahap I Pengembangan Metode ELISA untuk Mendeteksi Respons Imun Spesifik pada Ikan Nila (O. niloticus)
Optimasi konsentrasi antigen
Pelapisan antigen merupakan tahap pertama pada proses ELISA, dan ini merupakan proses ketika antigen yang sesuai dilarutkan dan diinkubasi hingga terabsorpsi pada permukaan sumur mikrotiter. Absorpsi terjadi secara pasif sebagai hasil interaksi hidrofobik antara rantai asam amino pada antigen yang digunakan untuk melapisi dan permukaan cawan mikrotiter. Hal itu tergantung pada waktu dan suhu inkubasi, pH buffer, dan konsentrasi antigen.
Hasil penghitungan kepadatan sel bakteri yang akan digunakan sebagai antigen untuk pelapis dan hasil pengujian konsentrasi protein antigen dengan metode Bradford disajikan pada Tabel 2.
Antigen merupakan suatu bahan atau senyawa yang dapat merangsang pembentukan satu jenis atau lebih antibodi. Antigen ini dapat berwujud protein, lemak, dan polisakarida (Wibawan dan Soejoedono, 2013). Pada penelitian ini, hasil penghitungan kepadatan bakteri berbanding lurus dengan konsentrasi protein. Berdasarkan data yang diperoleh diketahui bahwa baik kepadatan sel maupun konsentrasi protein pada antigen A. hydrophila lebih tinggi daripada konsentrasi protein antigen S. agalactiae. Data tersebut menunjukkan bahwa konsentrasi awal dari masing-masing antigen berbeda. Adanya perbedaan kepadatan sel disebabkan karena waktu pematangan dari kedua jenis bakteri tersebut berbeda. Sugiani (2012) menganalisis bahwa karakter waktu pematangan atau kinetika sel bakteri A. hydrophila akan mencapai puncak pertumbuhan pada 24 jam masa inkubasi. Sedangkan kinetika sel bakteri S. agalactiae akan mencapai puncak pertumbuhan pada 72 jam masa inkubasi. Perbedaan jumlah kepadatan sel akan berpengaruh juga pada konsentrasi protein yang dihasilkan. Oleh karena itu, sebelum antigen tersebut digunakan untuk melakukan uji ELISA, maka harus dilakukan optimalisasi konsentrasi antigen terlebih dahulu.
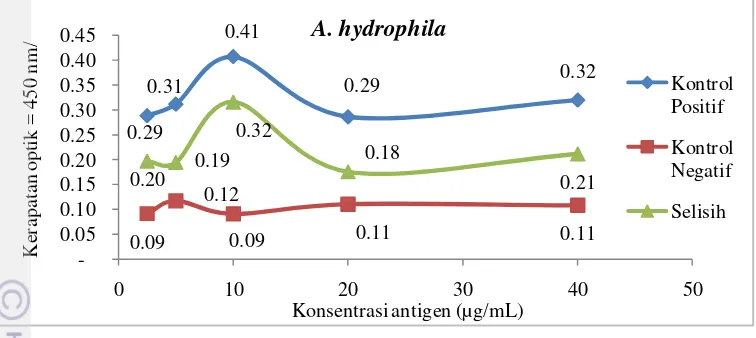
Konsentrasi antigen yang optimal menjadi langkah penting dalam proses deteksi antibodi menggunakan ELISA. Hasil optimalisasi ELISA dinyatakan dalam bentuk konsentrasi optimal antigen dengan konsentrasi yang sudah ditentukan. Hasil pengujian konsentrasi optimal antigen A. hydrophila dan S. agalactiae disajikan pada Gambar 2 dan Gambar 3.
Hasil yang diperoleh menunjukkan bahwa selisih nilai OD antara kontrol positif dan kontrol negatif paling tinggi diperoleh dari konsentrasi antigen 10 µg/mL baik untuk A. hydrophila sebesar 0,32 maupun S. agalactiae sebesar 0,21. Thuvander et al. (1987) menggunakan antigen untuk pelapis dengan konsentrasi 10 µg/ml antigen untuk deteksi Vibrio anguillarum pada trout pelangi. Estevez et al (1994) hanya memerlukan 1 µg/ml untuk mendeteksi V. anguillarum pada turbot, sedangkan Romstad et al. (2014) menggunakan 5 µg/ml untuk mengetahui potensi vaksin pada Atlantic salmon dengan melakukan uji serologis bakteri A. salmonicida. Konsentrasi antigen tergantung jenis antigen yang dipakai, antigen dari jenis protein umumnya memerlukan konsentrasi yang lebih kecil dibandingkan dari lipid ataupun karbohidrat. Protein bersifat hidrofobik seperti halnya cawan mikrotiter, jadi meskipun konsentrasi lebih kecil akan lebih mudah menempel dibandingkan dengan lipid ataupun karbohidrat. Crowther (1995) menjelaskan bahwa konsentrasi antigen optimal sebagai pelapis cawan mikrotiter yang digunakan pada metode indirect ELISA berada di kisaran 1 – 10 µg/ml.
Gambar 2 Nilai OD ELISA serum kontrol positif dan kontrol negatif ikan nila (O. niloticus) pada berbagai pengenceran antigen A. hydrophila.
0.29
Gambar 3 Nilai OD ELISA serum kontrol positif dan kontrol negatif ikan nila (O. niloticus) pada berbagai pengenceran antigen S. agalactiae.
12
Estimasi konsentrasi antigen sangat penting dalam uji ELISA, pada kondisi antigen berlebih maka proses penempelan antigen-antibodi tidak maksimal, sehingga antibodi akan terlepas dan terbuang pada saat pencucian. Begitu juga jika antigen yang berfungsi melapisi permukaan cawan dalam jumlah yang kurang, maka permukaan cawan akan lebih banyak yang kosong sehingga antibodi yang ditambahkan tidak maksimal berikatan dengan antigen. Oleh karena itu informasi mengenai konsentrasi antigen yang optimal sangat diperlukan. Konsentrasi antigen merupakan salah satu faktor pembatas dalam uji ELISA (Botus dan Oncescu, 2006).
Uji ELISA berdasarkan konsentrasi optimal
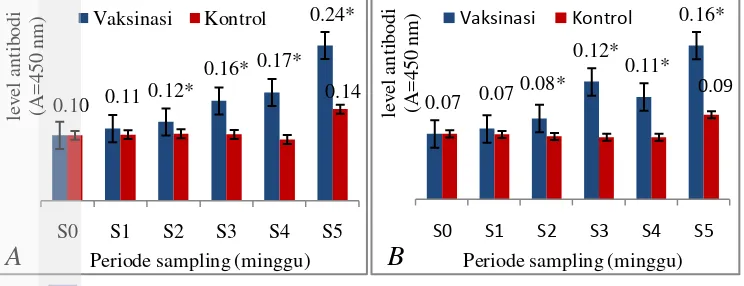
Antibodi serum ikan nila yang divaksinasi dengan vaksin koktail A. hydrophila dan S. agalactiae melalui perendaman telah diukur dengan ELISA. Hasil pengujian titer antibodi ikan nila disajikan pada Gambar 4. Data tersebut menunjukkan nilai titer antibodi ikan nila sebelum vaksinasi, selama masa induksi kekebalan setelah vaksinasi, dan setelah uji tantang. Kelompok yang divaksinasi memiliki titer antibodi yang lebih tinggi daripada kontrol. Pada minggu pertama, titer antibodi kelompok ikan yang divaksinasi tidak berbeda nyata dengan kontrol (P>0,05). Minggu kedua sampai minggu kelima, tingkat antibodi kelompok vaksinasi secara signifikan lebih tinggi dibanding kontrol (P <0,05), meskipun pada minggu keempat titer antibodi sempat turun terhadap S. agalactiae. Secara statistik, hasil penelitian menunjukkan bahwa konsentrasi antibodi spesifik ikan yang divaksinasi secara signifikan lebih tinggi daripada kontrol baik terhadap A. hydrophila maupun S. agalactiae.
Hal tersebut menunjukkan bahwa antigen yang dimasukkan bersifat imunogenik karena mampu meningkatkan nilai titer antibodi pada kelompok vaksinasi. Tetapi hal yang lebih penting bahwa antibodi yang dihasilkan harus bersifat imunogenik dan protektif, yaitu antibodi yang dihasilkan mampu menginduksi respons imun dan memproteksi inang dari paparan antigen homolog (Wibawan dan Soejoedono, 2013).
Gambar 4 Titer antibodi dari serum ikan nila (O. niloticus) dengan pelapisan antigen A. hydrophila (A) dan S. agalactiae (B).
Vaksinasi = serum ikan yang divaksinasi; Kontrol = serum ikan kontrol. S0 = sebelum vaksinasi; S1, S2, S3 = setelah vaksinasi; S4, S5 = periode setelah uji tantang.
Tahap 2 Durasi Proteksi Vaksin Koktail untuk Pencegahan Penyakit Motile
Aeromonads Septicemia dan Streptococcosis pada Ikan Nila (O. niloticus)
Kinetika Antibodi Serum Ikan Nila terhadap A. hydrophila dan S. agalactiae
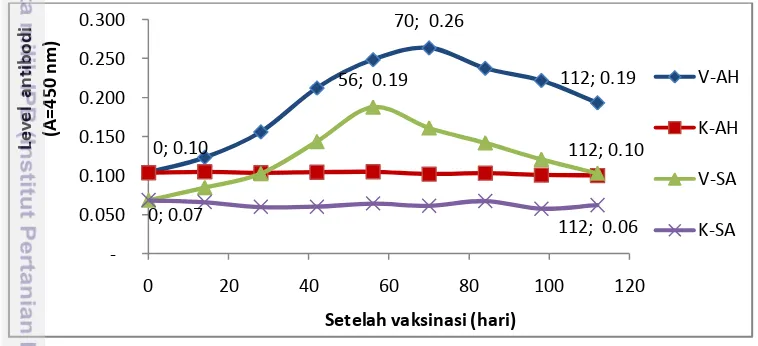
Respons imun spesifik ikan nila dari kelompok ikan yang divaksinasi dan kelompok kontrol diukur dengan menggunakan ELISA, terhadap antigen A. hydrophila dan S. agalactiae. Keberadaan antibodi spesifik ditunjukkan dengan peningkatan produksi antibodi pada ikan yang divaksin. Kinetika produksi antibodi pada kelompok ikan yang divaksin dan kontrol terhadap antigen A. hydrophila dan S. agalactiae disajikan pada Gambar 5.
Kadar antibodi basal pada ikan nila terhadap A. hydrophila lebih tinggi dibandingkan dengan S. agalactiae, dengan nilai OD masing-masing adalah 0,104 dan 0,069. Titer antibodi serum ikan yang divaksinasi secara signifikan lebih tinggi (P<0,05) dibandingkan kontrol. Konsentrasi antibodi ikan pasca vaksinasi
pada kelompok vaksinasi terus mengalami peningkatan, baik terhadap A. hydrophila maupun S. agalactiae. Respons imun maksimum tercapai pada hari ke-56 untuk S. agalactiae dengan nilai OD sebesar 0,188 dan hari ke-70 terhadap A. hydrophila dengan nilai OD sebesar 0,264 (Gambar 5). Kondisi ini terjadi diduga karena sifat dari kedua antigen tersebut berbeda, A. hydrophila merupakan kelompok bakteri Gram negatif memiliki struktur yang lebih komplek daripada S. agalactiae sebagai kelompok bakteri Gram positif yang memiliki struktur lebih sederhana. Determinan antigenik (epitop) yang dimiliki oleh A. hydrophila lebih komplek antara lain lipopolisakarida (LPS), outer membrane protein (OMP), α
dan β haemolisisn, aerolisin, enterotoksin ACT, ALT dan AST, protease dan RNase. Selain itu amonabactin, enterotoksin dan sitoksin merupakan faktor virulen penting lainnya untuk spesies Aeromonas (Angka et al. 1995; Perez et al, 2002; Alavandi & Ananthan, 2003; Poobalane, 2007). Substansi tersebut merupakan faktor virulen, dan beberapa faktor virulen bersifat imunogenik.
Gambar 5 Kinetika antibodi spesifik ikan nila (O. niloticus) pasca vaksinasi terhadap antigen A. hydrophila dan S. agalactiae.
14
Efektivitas Vaksin Koktail A. hydrophila – S. agalactiae pada Ikan Nila Hasil pemeriksaan secara bakteriologis terhadap ikan nila setelah diuji tantang yang menunjukkan gejala klinis ditemukan adanya infeksi bakteri A. hydrophila, S. agalactiae atau kedua bakteri tersebut. Berdasarkan hasil pemeriksaan tersebut, maka dapat diasumsikan bahwa kematian ikan nila yang terjadi disebabkan oleh bakteri target.
Ikan yang divaksinasi menghasilkan respons imun sehingga terlindungi terhadap mortalitas dan menghasilkan tingkat kelangsungan hidup lebih tinggi ketika dilakukan uji tantang. Sedangkan ikan kontrol tidak mampu menghasilkan respons antibodi spesifik dan memberikan mortalitas tinggi ketika dilakukan uji tantang sehingga menghasilkan tingkat kelangsungan hidup yang rendah. Mortalitas dan relative percent survival (RPS) ikan nila yang divaksinasi dengan vaksin koktail A. hydrophila dan S. agalactiae setelah uji tantang terhadap antigen homolog disajikan pada Tabel 3.
Tingkat kematian ikan nila yang divaksin secara signifikan lebih rendah dibandingkan kontrol untuk setiap periode uji tantang (P<0,05). Dari ketiga jenis uji tantang, mortalitas paling rendah terjadi pada uji tantang dengan infeksi tunggal A. hydrophila 10%, 17% dan 30% pada uji tantang hari ke-22, 50 dan 78. Pada uji tantang dengan infeksi tunggal S. agalactiae dan ko-infeksi mortalitas relatif sama pada setiap periode uji tantang sebesar 20%, 33% untuk uji tantang hari ke-22 dan ke-50. Sedangkan pada uji tantang ke-3, mortalitas dengan ko-infeksi lebih tinggi 43% daripada ko-infeksi tunggal oleh S. agalactiae 40%. Dalam penelitian ini pada semua periode uji tantang diperoleh hasil bahwa vaksin koktail A. hydrophila dan S. agalactiae memberikan proteksi terhadap antigen homolog baik ketika terjadi infeksi tunggal A. hydrophila, S. agalactiae maupun ketika terjadi ko-infeksi. Aeromonas hydrophila pada kondisi optimum hanya membutuhkan waktu dalam hitungan jam untuk menyebabkan infeksi pada inang, berbeda halnya dengan S. agalactiae yang membutuhkan waktu lebih lama untuk Tabel 3 Mortalitas kumulatif dan RPS ikan nila (O. niloticus) yang divaksinasi SA = S. agalactiae AH-SA = Koinfeksi A. hydrophila – S. agalactiae
menyebabkan infeksi setelah terjadinya kontak dengan antigen. Berdasarkan analisis dengan t-student test menunjukkan bahwa perlakuan vaksin koktail A. hydrophila dan S. agalactiae berbeda nyata (P<0.05) dengan kontrol baik terhadap infeksi tunggal maupun ko-infeksinya.
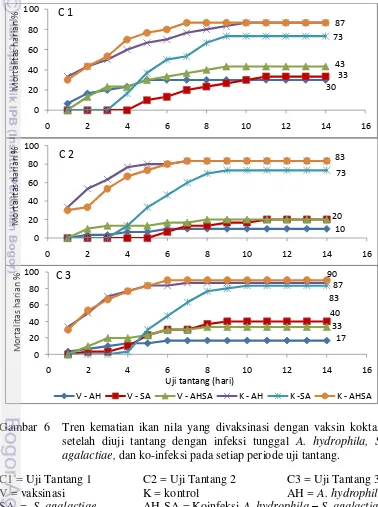
Tren Mortalitas Ikan Nila setelah Diuji Tantang
Berdasarkan tingkat kematian kumulatif ikan setelah uji tantang, maka dapat dilihat tren kematian ikan pada setiap periode uji tantang baik dengan infeksi tunggal bakteri A. hydrophila, S. agalactiae maupun ko-infeksi dari kedua jenis bakteri tersebut. Tren kematian ikan nila kelompok vaksinasi setelah dilakukan
Gambar 6 Tren kematian ikan nila yang divaksinasi dengan vaksin koktail setelah diuji tantang dengan infeksi tunggal A. hydrophila, S. agalactiae, dan ko-infeksi pada setiap periode uji tantang.
16
uji tantang disajikan pada Gambar 6. Tingkat kematian yang terjadi dari setiap kelompok uji tantang berbeda (Gambar 6 C1, C2 dan C3). Pola infeksi kedua jenis bakteri tersebut berbeda, infeksi tunggal A. hydrophila dan ko-infeksi menyebabkan infeksi akut sedangkan S. agalactiae menyebabkan infeksi yang bersifat sub-akut.
Pengamatan terhadap tren kematian ikan nila yang diuji tantang pada hari ke-22, 50 dan 78 setelah vaksinasi, dilakukan selama 14 hari. Pada semua periode uji tantang, kematian ikan kontrol sudah terjadi sejak 24 jam setelah uji tantang dengan uji tantang infeksi tunggal A. hydrophila dan ko-infeksi. Kematian mencapai sekitar 30% dan terus meningkat sampai hari ke-9 dengan rata-rata tingkat kematian mencapai 87%, dan terjadi pada semua periode uji tantang. Sedangkan pada kelompok vaksinasi kematian ikan terjadi mulai hari ke-2 dengan kisaran sekitar 13% untuk setiap kelompok uji tantang, dan terus terjadi sampai hari ke-7. Tingkat kematian ikan yang divaksinasi bervariasi, kematian akibat infeksi tunggal A. hydrophila dan ko-infeksi paling tinggi terjadi pada uji tantang hari ke-22 (30% dan 43%), kemudian uji tantang hari ke-78 (17 % dan 40%). Kematian paling rendah pada uji tantang hari ke-50 masing-masing 10% dan 20%.
Kematian ikan pada kelompok uji tantang dengan infeksi tunggal S. agalactiae mulai terjadi pada hari ke-4 baik kelompok vaksinasi maupun kontrol pada semua periode uji tantang, kecuali pada uji tantang hari ke-50 kematian kelompok vaksinasi mulai terjadi hari ke-6. Kematian pada kelompok vaksinasi secara signifikan lebih kecil dibandingkan kelompok kontrol untuk setiap periode uji tantang (P<0.05). Tingkat kematian ikan pada kelompok uji tantang dengan
17
Aeromonas hydrophila Streptococcus agalactiae
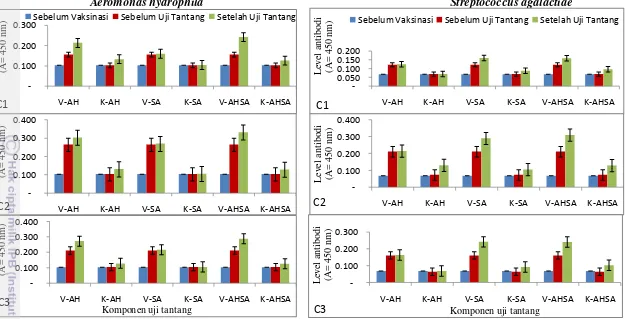
Gambar 7 Level antibodi spesifik ikan nila (O. niloticus) yang divaksinasi koktail terhadap antigen A. hydrophila ( kiri) dan S. agalactiae (kanan) pada beberapa periode uji tantang
C1 = Uji Tantang 1 C2 = Uji Tantang 2 C3 = Uji Tantang 3 V = vaksinasi; K= kontrol
Sebelum Vaksinasi Sebelum Uji Tantang Setelah Uji Tantang
-Sebelum Vaksinasi Sebelum Uji Tantang Setelah Uji Tantang
-18
33
Konsentrasi antibodi spesifik pada kelompok vaksinasi meningkat secara signifikan dalam merespons infeksi buatan pada saat uji tantang, namun pada kelompok kontrol kenaikan terlihat tidak nyata. Peningkatan konsentrasi antibodi teramati hanya ketika ikan terpapar oleh antigen yang homolog. Kejadian ini terlihat ketika ikan diuji tantang dengan A. hydrophila, konsentrasi antibodi serum dari kelompok tersebut teramati sangat tinggi ketika dilakukan pengamatan ELISA menggunakan antigen pelapis yang homolog (Gambar 7, kiri). Tetapi pada saat dilakukan pengamatan dengan antigen pelapis yang berbeda dalam hal ini S. agalactiae, maka tidak menghasilkan peningkatan konsentrasi antibodi yang berarti. Hal yang sama terjadi juga pada kondisi sebaliknya (Gambar 7, kanan). Pada akhir masa pengamatan masih ditemukan adanya antibodi yang terbentuk pada ikan yang divaksinasi, hal ini menunjukkan vaksin yang diberikan masih mampu membantu tubuh untuk mengeliminasi patogen yang menginfeksi.
Pembahasan
Ikan bergantung pada sistem kekebalan tubuh mereka untuk menjaga kesehatan, dan menghasilkan antibodi spesifik sebagai respons terhadap infeksi oleh organisme patogen (virus, bakteri, jamur, parasit), atau vaksinasi untuk menginduksi imunitas jangka panjang. Metode pemberian vaksin melalui perendaman bertujuan untuk mengekspose permukaan tubuh ikan secara langsung terhadap larutan vaksin, metode ini mengandalkan daya serap terutama oleh insang yang memiliki kemampuan imbibisi (peristiwa penyerapan air oleh permukaan zat-zat yang hidrofilik (Ellis, 1988). Terbentuknya respons imun spesifik (antibodi) dimulai dari masuknya antigen dalam hal ini A. hydrophila dan S. agalactiae ke dalam tubuh ikan kemudian difagosit oleh makrofag. Makrofag akan memberikan rangsangan ke sel limfosit untuk memproduksi antibodi sesuai jenis antigen yang masuk. Deteksi antibodi pada ikan dapat menggunakan beberapa metode, salah satunya dengan metode ELISA. Metode ini memiliki keunggulan yaitu sederhana, sensitif, efektif dan murah (Ostland et al. 2008).
ELISA adalah tes sensitif yang bergantung pada deteksi antigen dengan antibodi, dan perubahan warna melalui reaksi enzimatik berkorelasi dengan kehadiran antigen. Akurasi terhadap hasil ELISA ditentukan oleh beberapa faktor antara lain ditentukan cara preparasi dan konsentrasi antigen yang digunakan (Ostland et al. 2008). Romstad et al. (2012) juga menyebutkan bahwa selain konsentrasi antigen, metode preparasi antigen juga menentukan terhadap hasil titer antibodi. Sugiani et al. (2014) menyampaikan bahwa preparasi antigen terbaik untuk deteksi antibodi terhadap S. agalactiae diperoleh dari produk ekstra seluler yang disonikasi. Metode ELISA dapat digunakan untuk mengukur respons antibodi dan dapat digunakan untuk memastikan ikan yang dilindungi dari berbagai patogen atau pengaruh vaksinasi terhadap respons imun ikan. Sukenda dan Wakabayashi (2002) menggunakan prosedur indirect –ELISA yang cukup sensitif untuk mendeteksi antibodi serum Plecogiossus altivelis yang divaksinasi dengan bakterin dengan metode perendaman.
konvensional untuk estimasi antibodi pada ikan, seperti aglutinasi serum hanya dapat dilakukan ketika kadar antibodi serum yang dihasilkan relatif tinggi. Untuk mendeteksi respons antibodi dengan konsentrasi yang kurang atau sangat kecil, metode yang lebih sensitif akan lebih membantu memberikan hasil yang optimal. Oleh karena itu, ELISA dikembangkan untuk mendeteksi antibodi terhadap A. hydrophila dan S. agalactiae pada ikan nila setelah vaksinasi. Adanya antibodi spesifik yang lebih tinggi dalam populasi ikan setelah vaksinasi menunjukkan bahwa seluruh populasi dapat dilindungi dengan adanya vaksinasi. Dengan melakukan optimasi konsentrasi antigen dalam ELISA memungkinkan untuk mendeteksi antibodi spesifik ikan yang divaksinasi terhadap vaksin koktail A. hydrophila dan S. agalactiae.
Kinetika antibodi ikan terhadap A. hydrophila telah dilaporkan oleh beberapa peneliti. Hasil penelitian ini sejalan dengan penelitian yang dilakukan Bastardo et al. (2012) yang memperoleh konsentrasi antibodi basal ikan rainbow trout yang divaksinasi dengan vaksin bivalen terhadap A. hydrophila lebih tinggi dari Lactococcus garviae dengan nilai OD masing-masing 0,101 dan 0,028. Demikian juga hasil penelitian Dehghani et al. (2012) memperoleh konsentrasi antibodi basal ikan trout pelangi terhadap A. hydrophila sebesar 0,15. Seperti halnya penelitian terdahulu, pada penelitian ini diketahui kadar antibodi basal pada ikan nila terhadap A. hydrophila adalah 0,104. Tingginya konsentrasi antibodi ikan terhadap A. hydrophila pada penelitian ini diduga ikan telah terpapar oleh antigen tersebut sebelum adanya perlakuan vaksinasi. Ismail et al. (2010) juga menyebutkan bahwa ikan nila yang telah mengalami kontak fisik secara alami dengan bakteri A. hydrophila memiliki nilai titer antibodi pada log 2. Hasil penelitian Vinay et al. (2013) menegaskan bahwa nilai OD titer antibodi ikan rohu (Labeo rohita) kontrol terhadap A. hydrophila berkisar 0,05 – 0,07, sedangkan nilai OD titer antibodi ikan yang terpapar dengan sel bebas dari bakteri tersebut berkisar 0,10 – 0,13 dan nilai OD titer antibodi ikan yang divaksinasi dengan biofilm berkisar 0,40 – 0,67. Hal tersebut sangat wajar karena secara alami bakteri A. hydrophila merupakan mikroflora normal pada ikan, selain itu bakteri ini terdistribusi luas hampir di seluruh perairan di dunia dan mampu beradaptasi pada lingkungan perairan dengan kisaran yang luas terhadap kelembaban, kecerahan, pH, salinitas dan suhu (Swann dan white, 1991; Cipriano, 2001). Oleh karena itu, tubuh ikan akan melakukan respons tanggap kebal terhadap A. hydrophila, sehingga konsentrasi antibodi serum dari ikan uji yang terdeteksipun akan lebih tinggi.
20
Sementara pada penelitian ini antibodi maksimum terdeteksi pada hari ke-56 pasca vaksinasi melalui perendaman dengan nilai OD sebesar 0,188.
Beberapa faktor yang diduga menjadi penyebab perbedaan hasil penelitian yang dilakukan antara lain ukuran ikan, konsentrasi serta strain working seed yang digunakan sebagai bahan pembuat vaksin. Pasnik et al. (2005) menggunakan ikan nila dengan bobot rata-rata 45,5 g sedangkan ikan uji yang digunakan dalam penelitian Rusli (2012) jauh lebih kecil yaitu 20 – 25 g. Ukuran ikan sangat mempengaruhi tingkat proteksi vaksin terhadap patogen target. Johnson et al. (1982) melaporkan bahwa ikan salmon ukuran 4 g yang divaksin dengan Vibrio anguillarum dan Yersinia ruckeri melalui perendaman memberikan waktu perlindungan lebih lama daripada ukuran 1 dan 2 g. Faktor lain yaitu konsentrasi dan strain working seed vaksin S. agalactiae yang digunakan. Konsentrasi working seed vaksin S. agalactiae yang digunakan Rusli (2012) merujuk hasil penelitian yang dilakukan oleh Pasnik et al. (2005) yaitu sebesar 109 CFU /mL, sementara isolat yang digunakan dalam masing-masing penelitian tersebut berbeda. Sedangkan Sugiani et al. (2012) menggunakan strain S. agalactiae yang sama seperti dalam penelitian Rusli (2012) dan konsentrasi yang digunakan sebesar 1011 CFU/mL. Perbedaan strain isolat dan konsentrasi tersebut diduga akan memberikan tingkat proteksi yang berbeda ketika ikan terpapar oleh patogen target dan ditunjukkan dengan tingkat kematian ikan pada periode uji tantang. Dengan demikian dalam pembuatan vaksin konsentrasi optimum semestinya harus diketahui terlebih dahulu.
Kinetika antibodi spesifik ikan nila yang divaksinasi terhadap A. hydrophila dan S. agalactiae yang diperoleh selama masa pemeliharaan berkorelasi dengan proteksi setelah dilakukan uji tantang dengan antigen homolog. Pada awal masa induksi kekebalan, antibodi yang dihasilkan belum banyak sehingga ketika ada paparan dari antigen, ikan tidak maksimal dalam melakukan perlindungan terhadap infeksi. Hal ini terlihat dari persentase kematian yang lebih tinggi pada periode pertama uji tantang dibandingkan periode berikutnya. Proteksi maksimal terjadi pada fase kedua, ditandai dengan jumlah kematian ikan yang paling rendah diantara dua kelompok lainnya. Sedangkan pada uji tantang tahap ketiga meskipun jumlah antibodi sudah mulai menurun, tetapi ikan masih mampu memproteksi dirinya terhadap adanya ko-infeksi A. hydrophila dan S. agalactiae. Dari tiga periode uji tantang, nilai proteksi yang diperoleh setelah dilakukan ko-infeksi paling tinggi dari kelompok yang diuji tantang hari ke-50. Hasil ini sejalan dengan beberapa penelitian yang pernah dilakukan (Pasnik et al. 2005; Ibrahem et al. 2008; Abdel-Hadi et al. 2009; Prasad & Areechon 2010).
Terdapat beberapa faktor yang menentukan terhadap hasil vaksinasi, antara lain sumber antigen, metode produksi, metode inaktifasi, konsentrasi, dosis, metode aplikasi, dan penambahan adjuvant (Brown 1978; Johnson et al. 1982; Ellis 1989; Thuvander et al. 1994; Pretto-Giordano et al. 2010). Ostland et al. (2008) mengkaji bahwa produksi antibodi terhadap antigen biasanya memakan waktu beberapa minggu meskipun hal ini tergantung pada jenis ikan dan suhu perairan, di mana sel T helper dan sel B yang mengenali molekul asing dari antigen akan menginduksi respons imun spesifik dari antigen yang dikenalinya.
Pasnik et al. (2005) menganalisis bahwa ikan nila yang divaksinasi dengan ECP dan sel utuh S. agalactiae melalui injeksi sampai hari ke-90 masih memberikan proteksi sampai 62%. Plumb (1984) menjelaskan bahwa titer antibodi yang lebih tinggi tidak selalu dapat diartikan akan memberikan tingkat perlindungan atau kekebalan yang tinggi juga. Tetapi yang dapat dikaji dari hasil penelitian ini bahwa vaksinasi pada ikan nila melalui perendaman dengan vaksin koktail gabungan dari A. hydrophila dan S. agalactiae dapat menginduksi respons imun spesifik terhadap antigen homolog. Kinetika produksi antibodi yang dihasilkan dari vaksin koktail tersebut mencapai puncaknya pada waktu yang berbeda. Hal ini menunjukkan bahwa respons imun spesifik yang dihasilkan oleh tubuh akan berbeda terhadap antigen yang berbeda.
Hasil penelitian ini menunjukkan bahwa tingkat perlindungan ikan nila terhadap infeksi A. hydrophila lebih tinggi dibandingkan dengan S. agalactiae dan ko-infeksi setelah uji tantang dengan menggunakan dosis LD50. Hal ini diduga terkait dengan perbedaan sifat, antigenisitas dan tingkat virulensi dari masing-masing jenis antigen tersebut. Aeromonas hydrophila merupakan bakteri Gram negatif, sedangkan S. agalactiae termasuk bakteri Gram positif. Menurut Williams (2003) bagian yang bersifat virulen pada bakteri gram positif adalah eksotoksinnya (ECP dan toksin lainnya), sebaliknya dengan bakteri gram negatif, LPS (endotoksin) bersifat lebih virulen. Lebih jauh Pretto-Giordano et al (2010) menyatakan bahwa faktor yang dapat menyebabkan immunogenisitas suatu antigen diantaranya adalah komposisi kimia antigen yang kompleks dan epitop atau determinan antigenik. Aeromonas hydrophila mempunyai determinan yang multivalen yaitu outer membrane protein F (OmpF) 47 kDa, thermostable hemolysis protein 50 kDa yang berasal dari ECP, lipopolisakarida 31-38 kDa dan S-layers atau Paracrystalline surface protein 52 kDa. Sedangkan S. agalactia hanya mempunyai cell surface protein yang memberikan immunitas protektif. Sugiani (2012) menganalisis bahwa bakteri A. hydrophila pada dosis tinggi (LD100) lebih mematikan untuk ikan nila dibandingkan dengan bakteri S. agalactiae. Sedangkan untuk bakteri S. agalactiae berlaku hal yang sebaliknya, yaitu pada dosis rendah (LD50) bakteri ini lebih virulen dibandingkan dengan A. hydrophila pada nila.
Bakteri sebagai antigen yang dipakai sebagai sumber bahan vaksin pada penelitian ini tersusun atas senyawa protein yang memiliki kadar dan ukuran yang berbeda – beda pada setiap struktur penyusunnya. Profil protein suatu bakteri dapat digunakan sebagai bahan acuan dalam penentuan potensi imunogenik dari suatu sediaan vaksin, karena setiap jenis protein memiliki kemampuan imunogenik yang berbeda. Selain itu juga, profil protein dapat digunakan sebagai karakter identifikasi untuk melihat strain dari bakteri, seperti yang dilakukan oleh Korkoca & Boynukara (2003).
22
27.79, 24.14, 22.50, 16.58, 14.74, 12.50 dan 7.29 kDa. Sedangkan pita protein S. agalactiae pada penelitian Sugiani (2012) sebanyak 10 pita. yaitu 111,86; 83,42; 79,09; 58,98; 54,45; 34,61; 23,20; 18,74; 17,77; dan 15,97 kDa.
Stuart (1999) menganalisis bahwa molekul antigen yang bersifat imunogenik memiliki ukuran lebih besar dari 60 kDa. Sementara Perez et al. (2002) mendapatkan bahwa acetylcholinesterase protoxin yang merupakan molekul protein berukuran 45 kDa dari A. hydrophila dapat menginduksi respons imun ikan trout. Poobalane (2007) menganalisis bahwa protein dari A. hydrophila dengan ukuran 50 kDa merupakan molekul yang sangat imunogenik. Sedangkan Amrullah et al. (2014) menganalisis bahwa toxin protein ECP dari bakteri S. agalactiae berukuran 89 kDa mampu meningkatkan respons imun spesifik dan non spesifik pada ikan nila.
Efektivitas vaksin pada penelitian ini sesuai dengan penelitian yang dilakukan sebelumnya bahwa ikan nila yang divaksinasi dengan vaksin koktail melalui perendaman memberikan proteksi yang lebih tinggi ketika diuji tantang dengan A. hydrophila (63%) dibandingkan dengan S. agalactiae (50%) (Sumiati et al. 2012). Hal yang sama juga dilaporkan oleh Sugiani (2012) bahwa vaksin bivalen sel utuh pada ikan nila telah memberikan proteksi 100% terhadap A. hydrophila dan 72% terhadap S. agalactiae. Sementara Bastardo et al. (2012) mendapatkan bahwa vaksin bivalen telah memberikan level proteksi sebesar 85% setelah ditantang dengan A. hydrophila dan 76,2% setelah ditantang dengan L. garvieae. Sedangkan Nikoskelainen et al. (2007) menyatakan bahwa vaksin koktail sel utuh memberikan proteksi yang lebih baik daripada vaksin monovalen pada ikan trout pelangi dan salmon Atlantik (Salmo salar).
Beberapa penelitian lain menunjukkan bahwa perlindungan terhadap spesies patogen berhubungan langsung dengan konsentrasi antibodi serum (Gudmundsdottir et al. 1997; Bricknell et al. 1999; Pasnik et al. 2005), terdapat korelasi signifikan yang ditemukan dalam penelitian ini antara konsentrasi antibodi anti-A. hydrophila dan anti-S. agalactiae dengan tingkat kelangsungan hidup. Hasil dari penelitian ini menunjukkan bahwa respons antibodi spesifik secara signifikan berkorelasi dengan tingkat kelangsungan hidup pada 22, 50 dan 78 hari setelah vaksinasi. Penurunan antibodi terjadi pada hari ke-78 pasca vaksinasi baik terhadap A. hydrophila maupun S. agalactiae. Meskipun tingkat kelangsungan hidup menurun pada hari ke-78 setelah vaksinasi, penurunan yang terjadi tidak signifikan.
hydrophila dan L. garviae memberikan proteksi pada ikan raibow trout sampai 90 hari setelah vaksinasi.
Sistem pertahanan ikan akan terbentuk sempurna saat ikan telah dewasa. Pada benih, sistem kekebalan tubuh sudah terbentuk tetapi belum berfungsi optimal sehingga kurang efisien menahan infeksi patogen sehingga rentan penyakit. Sistem pertahanan non spesifik adalah pertahanan terdepan menghadapi patogen karena memberikan respons langsung terhadap antigen. Sistem pertahanan tubuh non spesifik terdiri dari kulit dan selaput mukosa. Sistem pertahanan tubuh spesifik, kekebalan khusus yang membuat limfosit peka untuk segera menyerang patogen tertentu (Anderson, 1974). Sehingga efektivitas penggunaan vaksin akan maksimal jika diaplikasikan pada ikan dengan ukuran atau umur yang sesuai. Lendir dan epidermis juga merupakan faktor penting dalam mekanisme pertahanan ikan terhadap patogen. Sistem kekebalan non-spesifik mencakup pertahanan pertama dan pertahanan kedua. Pertahanan pertama yaitu pertahanan fisik meliputi, sisik, kulit, dan mukus. Mukus memiliki kemampuan menghambat kolonisasi mikroorganisma pada kulit, insang dan mukosa. Mukus ikan mengandung imunoglobulin (IgM) alami dan bukan sebagai respons dari pemaparan antigen. Imunoglobulin merupakan antibodi yang dapat menghancurkan patogen yang menyerang tubuh. Adapun sisik dan kulit berperan dalam melindungi ikan dari kemungkinan luka dan sangat penting peranannya dalam mengendalikan osmolaritas tubuh. Kerusakan pada sisik atau kulit dapat mempermudah patogen menginfeksi inang. Pertahanan kedua disebut pertahanan humoral yaitu pertahanan yang bersifat plasmatik dan berada pada cairan dan jaringan tubuh. Komponen pertahanan humoral dari kekebalan non-spesifik antara lain: lisozim, interferon, laktoferin, komplemen, protein-protein dasar (antara lain, histon dan protein kationik), serta polipeptida dan fibronektin.
Jika respons ikan yang dilakukan terhadap bakteri dihasilkan pada permukaan kulit, maka vaksinasi perendaman mungkin merupakan metode vaksinasi yang paling tepat karena paparan vaksin terjadi melalui rute yang sama dengan eksposur alami bakteri. Selain itu, dengan ditemukan antigen yang dapat memberikan dan menginduksi sistem kekebalan tubuh yang relatif tahan dalam durasi yang lama tanpa efek samping yang tidak diinginkan, maka dapat menghilangkan kebutuhan untuk vaksin ulang dan akan memberikan keuntungan bagi pembudidaya.
24
4
KESIMPULAN DAN SARAN
Kesimpulan
Simpulan yang dapat dirangkum dari hasil penelitian ini antara lain:
1. Konsentrasi optimum antigen A. hydrophila dan S. agalactiae untuk penentuan antibodi dalam ikan nila dengan menggunakan indirect - ELISA masing-masing sama yaitu sebesar 10 µg/mL. Konsentrasi tersebut dapat digunakan untuk mendeteksi antibodi spesifik terhadap A. hydrophila dan S. agalactiae pada ikan nila yang divaksinasi;
2. Kadar antibodi basal pada ikan sebelum vaksinasi terhadap A. hydrophila lebih tinggi dari pada S. agalactiae. Vaksinasi koktail bakterin A. hydrophila dan S. agalactiae dapat menginduksi dan meningkatkan produksi antibodi spesifik pada ikan nila, dan respons antibodi maksimum tercapai dalam waktu 70 hari terhadap A. hydrophila dan 56 hari terhadap S. agalactiae; 3. Vaksin koktail A. hydrophila - S. agalactiae masih memberikan proteksi
terhadap infeksi tunggal A. hydrophila, S. agalactiae dan ko-infeksi dari kedua bakteri tersebut pada ikan nila sampai hari ke 78 setelah vaksinasi. Tingkat mortalitas paling rendah diperoleh pada periode uji tantang kedua hari ke-50 setelah vaksinasi pada ikan nila baik terhadap A. hydrophila, S. agalactiae, maupun ko-infeksi.
Saran
Sedangkan saran dari penelitian ini yaitu:
1. Konsentrasi optimum dari masing-masing antigen sebesar 10 µg/mL dapat digunakan untuk mendeteksi antibodi spesifik terhadap A. hydrophila dan S. agalactiae pada ikan nila yang divaksinasi.
DAFTAR PUSTAKA
Abdel-Hadi YM, Shamsudin MN, Yussof K, Zakaria S. 2009. Indoor study on the immunization of red tilapia: Oreohromis niloticus x O. mossambicus against aeromonad and pseudomonad septicemias. J. Fish. Intl., 4(3): 45
– 51.
Alavandi, S.V. and Ananthan, S. 2003. Biochemical characteristics serogroups, and virulence factors of Aeromonas species isolated from cases of diarrhoea and domestic water samples in Chennai, Indian. J. of Medical Microb. 21 (4): 233 – 238.
Amrullah, Sukenda, Harris E, Alimuddin, Lusiastuti AM. 2014. Immunogenicity of the 89 kDa toxin protein from extracellular products of streptococcus in Oreochromis niloticus. J. Fish. Aquat Sci. 9 (4): 176 – 186.
Anderson DP. 1974. Fish immunology. Hongkong: TFH Publication Ltd. pp 182 Angka SL, Lamb TJ, Sin YM. 1995. Some virulence characteristics of Aeromonas
hydrophila in walking catfish (Clarias gariepinus). Aquaculture 130: 103-l 12
Austin B, Austin DA. 1999. Chapter 2 - Characteristics of the diseases. In Bacterial Pathogens: Diseases of Farmed and Wild Fish. pp 13-15.
Bastardo A, Ravelo C, Castro N, Calheiros J, Romalde JL. 2012. Effectiveness of bivalent vaccines against Aeromonas hydrophila and Lactococcus garvieae infections in rainbow trout Oncorhynchus mykiss (Walbaum). Fish & Shellfish Immunology 32: 756 – 761.
Botus D, Oncescu T. 2006. Optimizing immune enzymatic reactions (ELISA) for the detection of antibody against NDV virus. Analele Universită Ńii din Bucuresti –Chimie, Anul XV (serienouă), vol. II: 33 - 41.
Bradford MM. 1976. A rapid and sensitive method for the quantitation of microorganisms quantities of protein in utilizing the principle of protein dye binding. Anal.Biochem72:248-254.
Bricknell IR, King JA, Bowden TJ, Ellis AE (1999) Duration of protective antibodies, and the correlation with protection in Atlantic salmon (Salmosalar L.), following vaccination with an Aeromonas salmonicida vaccine containing iron-regulated outer membrane proteins and secretory polysaccharide. Fish Shellfish Immunol 9:139–151.
Brown Al. 1978. Immunity and Practical Vaccine Development. Marine Fisheries Review 1286. 4pp.