i
PENGUJIAN TETRAZOLIUM DAN RESPIRASI BENIH
KORO PEDANG (
Canavalia ensiformis
)
SILMY FADILLAH RAHMAYANI
DEPARTEMEN AGRONOMI DAN HORTIKULTURA FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
iii
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Pengujian Tetrazolium dan Respirasi Benih Koro Pedang (Canavalia ensiformis) adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan disajikan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Februari 2015
Silmy Fadillah Rahmayani
NIM A24100092
ii
ABSTRAK
SILMY FADILLAH RAHMAYANI. Pengujian Tetrazolium dan Respirasi Benih Koro Pedang (Canavalia ensiformis). Dibimbing oleh TATIEK KARTIKA SUHARSI dan MEMEN SURAHMAN.
Koro pedang saat ini dikembangkan sebagai komoditas substitusi kedelai karena kandungan proteinnya yang cukup tinggi. Tujuan penelitian ini adalah untuk menguji viabilitas benih koro pedang dengan pengujian tetrazolium dan pengujian respirasi benih. Penelitian ini menggunakan tiga lot benih koro pedang yang berbeda yaitu lot benih A (dipanen bulan Maret 2014 di Bojong Bogor, disimpan dalam ruang kamar), lot benih B (dipanen bulan November 2013 di Ciherang Bogor, disimpan dalam ruang ber-AC), dan lot benih C (dipanen bulan September 2012 di Leuwikopo Bogor, disimpan dalam ruang ber-AC). Penelitian ini terdiri dari dua percobaan. Percobaan 1 ialah pengujian tetrazolium. Percobaan 2 ialah penguijian respirasi benih. Masing-masing percobaan menggunakan rancangan acak lengkap dengan pengusangan cepat secara fisik sebagai faktornya, yang terdiri atas 0, 8, 12, 16, dan 20 jam. Hasil percobaan 1 menunjukkan bahwa pola topografi pewarnaan tetrazolium benih koro pedang belum bisa digunakan untuk mengevaluasi mutu fisiologis benih koro pedang. Hasil percobaan 2 menunjukkan bahwa metode pengujian respirasi benih dengan cosmotector belum bisa digunakan untuk mengevaluasi mutu fisiologis benih koro pedang.
Kata kunci: pengujian respirasi benih, pengujian tetrazolium, viabilitas benih, vigor benih
ABSTRACT
SILMY FADILLAH RAHMAYANI. Tetrazolium and Seed Respiration Tests of the Jack Bean Seed (Canavalia ensiformis). Supervised by TATIEK KARTIKA SUHARSI and MEMEN SURAHMAN.
iii
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian
pada
Departemen Agronomi dan Hortikultura
PENGUJIAN TETRAZOLIUM DAN RESPIRASI BENIH
KORO PEDANG (
Canavalia ensiformis
)
SILMY FADILLAH RAHMAYANI
DEPARTEMEN AGRONOMI DAN HORTIKULTURA FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
vii
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Penelitian yang berjudul Pengujian Tetrazolium dan Respirasi Benih Koro Pedang (Canavalia ensiformis) ini telah dilaksanakan dari bulan Juli - September 2014 di Laboratorium Benih dan Laboratorium Pascapanen Departemen Agronomi dan Hortikultura Fakultas Pertanian Institut Pertanian Bogor serta greenhouse Kebun Percobaan Leuwikopo Darmaga Bogor.
Terima kasih penulis ucapkan kepada Ibu Dr Tatiek Kartika Suharsi, MS dan Bapak Prof Dr Ir Memen Surahman, MScAgr selaku pembimbing skripsi, serta Dr Ir Suwarto, MS selaku pembimbing akademik atas bimbingan dan sarannya. Ungkapan terima kasih juga disampaikan kepada orangtua, keluarga, serta teman-teman atas segala doa dan bantuannya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Februari 2015
viii
DAFTAR ISI
DAFTAR TABEL ix
DAFTAR GAMBAR ix
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
TINJAUAN PUSTAKA 2
Tanaman Koro Pedang 2
Pengujian Tetrazolium 3
Pengujian Respirasi Benih 4
METODE 5
Tempat dan Waktu 5
Bahan dan Alat 5
Pengamatan 9
Analisis Data 11
HASIL DAN PEMBAHASAN 12
Kondisi Awal Lot Benih Koro Pedang 12
Percobaan 1 : Pengujian Tetrazolium Benih Koro Pedang 12 Percobaan 2 : Pengujian Respirasi Benih Koro Pedang 19
SIMPULAN DAN SARAN 23
Simpulan 23
Saran 23
DAFTAR PUSTAKA 23
ix
DAFTAR TABEL
1. Lot benih koro pedang yang digunakan 6
2. Kadar air dan viabilitas awal tiga lot benih koro pedang 12 3. Hasil pengujian tetrazolium dan pengujian langsung lima sub lot benih
A 14
4. Hasil analisis korelasi dan regresi antara pengujian tetrazolium dan
pengujian langsung lot benih A 15
5. Hasil pengujian tetrazolium dan pengujian langsung lima sub lot benih
B 16
6. Hasil analisis korelasi dan regresi antara pengujian tetrazolium dan
pengujian langsung lot benih B 17
7. Hasil pengujian tetrazolium dan pengujian langsung lima sub lot benih
C 18
8. Hasil analisis korelasi dan regresi antara pengujian tetrazolium dan
pengujian langsung lot benih C 19
9. Hasil pengujian respirasi dan pengujian langsung lima sub lot benih A 19 10. Hasil analisis korelasi dan regresi antara pengujian respirasi dan
pengujian langsung lot benih A 20
11. Hasil pengujian respirasi dan pengujian langsung lima sub lot benih B 20 12. Hasil analisis korelasi dan regresi antara pengujian respirasi dan
pengujian langsung lot benih B 21
DAFTAR GAMBAR
1. Waterbath tipe NTT-120 6
2. Cosmotector tipe XP-314 6
3. Proses perendaman benih koro pedang dengan tetrazolium 7
4. Inkubasi benih koro pedang di dalam toples 8
5. Pengujian langsung benih koro pedang 9
6. Pola topografi pewarnaan tetrazolium benih koro pedang 13 7. Hasil pewarnaan tetrazolium benih koro pedang yang sesuai dengan
pola untuk benih hidup 15
8. Hasil pewarnaan tetrazolium benih koro pedang yang sesuai dengan
pola untuk kecambah normal kuat 16
9. Hasil pewarnaan tetrazolium benih koro pedang yang sesuai dengan
1
PENDAHULUAN
Latar Belakang
Koro pedang (Canavalia ensiformis) saat ini mulai diproduksi dan dikembangkan sebagai salah satu komoditas substitusi kedelai karena kandungan proteinnya yang cukup tinggi yaitu 29.8 % (Doss et al. 2011). Puslitbangtan (2007) menambahkan bahwa produksi benih koro pedang dapat mencapai 4.5 ton biji kering ha-1.
Salah satu penentu keberhasilan dalam kegiatan produksi benih koro pedang ialah penggunaan benih bermutu fisiologis tinggi. Mutu fisiologis benih berkaitan dengan tingkat viabilitas atau daya hidup benih. Informasi mengenai mutu fisiologis benih diperoleh dari pengujian benih. Indikasi dari pengujian benih ada dua jenis, yaitu indikasi langsung dan indikasi tidak langsung. Pengujian benih indikasi langsung ialah dengan mengamati gejala pertumbuhan, sedangkan pengujian benih indikasi tidak langsung tidak menghasilkan kecambah (Sadjad 1993).
Pengujian benih indikasi tidak langsung di antaranya ialah pengujian tetrazolium dan pengujian respirasi benih. Menurut ISTA (2014), pengujian tetrazolium merupakan pengujian secara biokimiawi yang digunakan untuk mendapatkan nilai viabilitas benih secara cepat menggunakan larutan 2,3,5-trifenil tetrazolium klorida/bromida. Larutan tetrazolium diimbibisi ke dalam benih lalu berikatan dengan hidrogen yang dilepaskan oleh enzim dehidrogenase pada proses reduksi dalam sel-sel yang hidup sehingga menghasilkan endapan trifenil formazan berwarna merah yang mengindikasikan benih hidup sedangkan pada benih mati tidak terjadi proses reduksi sehingga benih mati menjadi tidak berwarna.
Pengujian respirasi benih merupakan pengujian yang dapat mendeteksi laju respirasi benih dengan mengukur kadar gas CO2 yang dihasilkan dalam proses respirasi benih. Pengujian respirasi benih telah dilakukan pada beberapa benih pangan menggunakan cosmotector tipe XP-314 yang berfungsi sebagai alat pengukur kadar CO2. Pengujian respirasi benih jagung (Zea Mays) oleh Nurfarida (2011) menghasilkan laju respirasi benih yang berkorelasi nyata dengan parameter viabilitas dan vigor benih. Hasil pengujian respirasi benih kedelai (Glycine max) oleh Permatasari (2011) menunjukkan bahwa semakin tinggi laju respirasi benih maka semakin tinggi pula viabilitas dan vigor benihnya. Menurut Baharizki (2012), pengujian respirasi benih kacang tanah (Arachis hypogaea) juga menunjukkan bahwa semakin tinggi laju respirasi benih maka semakin tinggi pula viabilitas dan vigor benihnya.
2
tetrazolium atau pengujian respirasi benih sebaiknya dikonfirmasikan kembali dengan pengujian viabilitas benih dengan indikasi langsung sehingga ketepatan informasinya terjamin.
Tujuan Penelitian
Tujuan penelitian ini adalah menguji viabilitas benih koro pedang dengan pengujian tetrazolium dan pengujian respirasi benih.
TINJAUAN PUSTAKA
Tanaman Koro Pedang
Koro pedang merupakan salah satu jenis legum yang berasal dari Amerika selatan. Keberadaan koro pedang telah tersebar secara meluas dan banyak ditanam di Afrika, Asia, Hindia Barat, Amerika Latin and India (Doss et al. 2011). Menurut Purwanto (2007), koro pedang di Indonesia dikenal dengan berbagai macam nama daerah, yaitu kara bedog, kowas bakol, kembang koweh (sunda); koro bendo (jawa); serta koro ortel, kara wedung (madura).
Tanaman koro pedang berupa perdu, batang tegak, tinggi 50 - 75 cm, dan berakar tunggang. Daunnya trifoliat berwarna hijau. Bunganya majemuk berwarna putih keunguan. Polongnya mempunyai panjang 25 - 35 cm, lebar 2.5 - 4 cm, berwarna hijau saat muda dan berubah menjadi berwarna kuning jerami saat tua. Bijinya berwarna putih, berbentuk bulat lonjong, panjang 1 – 2 cm, dan panjang hilumnya sepertiga dari panjang bijinya (Stephens 2012).
Kandungan protein koro pedang cukup tinggi yaitu 29.8 % sehingga dapat berpotensi sebagai komoditas substitusi kedelai (Doss et al. 2011). Koro pedang juga mengandung senyawa yang beracun jika dikonsumsi dalam kondisi mentah, di antaranya ialah HCN dan hemaglutinin. HCN pada koro pedang berupa glikosianida sianogenik yang akan terurai menjadi asam sianida saat teroksidasi (Suciati 2012). HCN dalam koro pedang dapat diturunkan kadarnya bahkan sampai 0 ppm dengan cara perebusan pada suhu 100 oC selama 30 menit dan perendaman dalam larutan garam 5 % selama 24 jam (Wahjuningsih dan Saddewisasi 2013). Penelitian pembuatan tempe koro pedang yang dilakukan oleh Fitriah (2013) menunjukkan bahwa perebusan dan perendaman di dalam larutan garam menyebabkan penurunan aktivitas hemaglutinin dari 50.76 HU mg-1 protein ekstrak pada biji koro pedang mentah menjadi 9.52 HU mg-1 protein ekstrak pada tempe koro pedang.
3 koro pedang biasa dikonsumsi sebagai camilan ringan. Penelitian mengenai produk olahan koro pedang saat ini terus dikembangkan. Produk tempe berbahan dasar koro pedang berdasarkan hasil penelitian Abdalla (2013) memiliki karakter yang sama dengan tempe kedelai dari segi bentuk dan tekstur secara visual, tapi terdapat perbedaan tingkat keempukan antara tempe koro pedang dan tempe kedelai pada pengujian secara objektif. Rata-rata nilai keempukan tempe koro lebih tinggi yaitu 126.42 (kg det-1) 10-1 mm division dibandingkan nilai keempukan tempe kedelai yaitu 96.05 (kg det-1) 10-1 mm division. Menurut Istiani (2010), produk tempe koro pedang berpotensi dalam upaya pemanfaatan sebagai antioksidan alami karena aktivitas antioksidannya lebih tinggi (77.32 %)
dibandingkan dengan β-karoten (43.25 %) dan tidak berbeda nyata dengan
vitamin C (75.62 %) dan α-tokoferol (76.41 %).
Produk lainnya ialah yoghurt berbahan dasar koro pedang. Hasil penelitian Suryaningrum dan Kusuma (2013) melaporkan bahwa bakteri Streptococcus thermophillus dan Lactobacillus bulgaricus dapat tumbuh dalam media koro pedang putih sebagai bahan baku pembuatan yoghurt. Koro pedang juga dapat diolah menjadi protein rich flour (PRF) dengan sifat fisik, kimia, dan fungsional teknis yang baik untuk digunakan sebagai bahan baku makanan. Menurut Windrati et al. (2010), PRF koro pedang memiliki kandungan protein 37.61 %, lemak 4.49 %, pati 36.70 % (amilosa 31.12 % dan amilopektin 68.88 %), dan asam glutamat (asam amino terbesar dalam PRF koro pedang) sebesar 5.47 %.
Nafi’ (2007) menambahkan bahwa PRF koro pedang mengandung isoleusin tertinggi yaitu 74 %, dibandingkan PRF koro kratok (Phaseolus lunatus) yaitu 41 % dan koro komak (Lablab purpureus) yaitu 63 %.
Pengujian Tetrazolium
Pengujian tetrazolium merupakan pengujian secara biokimiawi yang digunakan untuk mendapatkan nilai viabilitas benih menggunakan larutan 2,3,5-trifenil tetrazolium klorida/bromida yang tidak berwarna sebagai indikator untuk mengindikasikan proses reduksi yang terjadi dalam sel-sel hidup. Larutan tetrazolium diimbibisi ke dalam benih lalu berikatan dengan hidrogen yang dilepaskan oleh enzim dehidrogenase pada proses reduksi dalam sel-sel yang hidup sehingga menghasilkan trifenil formazan. Trifenil formazan merupakan endapaan berwarna merah, stabil, dan tidak larut dalam air. Endapan formazan menyebabkan benih berwarna merah sehingga mengindikasikan benih hidup sedangkan pada benih mati tidak terjadi proses reduksi sehingga benih mati menjadi tidak berwarna (ISTA 2014).
4
dengan tepat, tidak dapat membedakan benih dorman dan benih tidak dorman, mikroorganisme yang berbahaya bagi perkecambahan tidak dapat terdeteksi, dan harga tetrazolium yang relatif mahal (Patil dan Dadlani 2009).
Pengujian tetrazolium telah banyak dilakukan secara meluas pada berbagai benih tanaman pangan, hortikultura, dan perkebunan. Hasil pengujian tetrazolium pada benih kedelai (G. max) yang dilakukan oleh Dina et al.(2007) ialah terdapat pola topografi pewarnaan tetrazolium yang mempunyai korelasi yang tinggi dengan pertumbuhan dan hasil produksi tanaman kedelai. Penelitian Deminicis et al. (2014) menunjukkan bahwa skarifikasi menggunakan ampelas, perendaman di
dalam air selama 18 jam pada suhu 25˚C, dan penggunaan konsentrasi larutan
tetrazolium 1 % selama 150 menit pada suhu ruang ialah metode pengujian tetrazolium terbaik untuk mengevaluasi viabilitas benih koro benguk hitam (Stizolobium aterrimum). Pramoedinata (2007) melaporkan bahwa benih pepaya (Carica papaya) genotipe IPB 7 dan 8 yang telah mengalami perlakuan regresi antara pengujian daya berkecambah dan pengujian tetrazolium pada benih kayu kuku (P. mooniana) menghasilkan nilai koefisien determinan yang paling tinggi (99.66 %) dibandingkan dengan pengujian cepat lainnya (pengujian hidrogen peroksida = 98.50 %; pengujian belah = 98.47 %; dan pengujian eksisi embrio = 98.33 %)
Pengujian Respirasi Benih
Respirasi merupakan proses katabolisme atau penguraian senyawa organik menjadi senyawa anorganik. Proses respirasi merombak glukosa dan menghasilkan CO2 serta energi (Andhi et al. 2012). Pengujian respirasi benih dapat mendeteksi laju respirasi benih dengan mengukur kadar CO2 yang dihasilkan benih dalam proses respirasi dengan menggunakan cosmotector tipe XP-314. Pengujian respirasi benih jagung (Z. Mays) yang dilakukan oleh Nurfarida (2011) dengan menggunakan cosmotector tipe XP-314 menghasilkan bahwa laju respirasi benih berkorelasi nyata dengan parameter viabilitas dan vigor benih. Permatasari (2011) melakukan pengujian respirasi benih kedelai (G. max) dan hasilnya ialah semakin tinggi laju respirasi benih maka semakin tinggi pula viabilitas dan vigor benih. Begitu pula dengan hasil pengujian respirasi benih oleh Baharizki (2012) yang menunjukkan bahwa semakin tinggi laju respirasi benih kacang tanah (A. hypogaea) maka semakin tinggi pula viabilitas dan vigor benihnya.
5 jam-1). Lesilolo (2012) menyatakan bahwa semakin rendah kadar air benih maka laju respirasinya juga semakin rendah sehingga benih dapat disimpan lebih lama karena laju deteriorisasinya lambat. Penyimpanan terbuka (bulk storage) benih karet (Hevea brasiliensis) dengan kadar air tinggi juga memicu peningkatan laju respirasi benih berdasarkan hasil penelitian Samjaya et al.(2010).
Respirasi benih juga dipengaruhi oleh suhu penyimpanan. Respirasi benih pada suhu rendah berjalan lebih lambat dibandingkan dengan suhu tinggi, sehingga viabilitas benih dapat dipertahankan lebih lama. Laju respirasi benih kedelai yang disimpan 90 hari pada musim hujan (suhu rata-rata penyimpanan 26.15 oC) lebih rendah dibandingkan laju respirasi benih kedelai yang disimpan 90 hari pada musim kemarau (suhu rata-rata penyimpanan 26.78 oC) berdasarkan hasil penelitian Hartawan (2011). Menurut Anto dan Jayaram (2010), suhu berperan dalam meningkatkan laju respirasi benih yang diproduksi pada musim hujan dan disimpan pada musim kemarau.
Laju respirasi benih ortodoks berbeda dengan laju respirasi benih rekalsitran. Laju respirasi benih kedelai (ortodoks) cenderung turun selama penyimpanan berdasarkan hasil penelitian Hartawan (2011), sedangkan laju respirasi benih karet (rekalsitran) selama penyimpanan cenderung naik (Hartawan dan Nengsih 2012). Peningkatan laju respirasi benih karet (H. brasiliensis) dalam penyimpanan disebabkan oleh kadar air benih karet yang tinggi (> 50 %) dan kondisi penyimpanan yang lembab sehingga memacu benih karet untuk berespirasi.
METODE
Tempat dan Waktu
Percobaan dalam penelitian ini dilaksanakan pada bulan Juli - September 2014. Percobaan dalam penelitian ini dilaksanakan di Laboratorium Benih dan Laboratorium Pascapanen Departemen Agronomi dan Hortikultura, Fakultas Pertanian, Institut Pertanian Bogor serta Greenhouse Kebun Percobaan Leuwikopo Darmaga Bogor.
Bahan dan Alat
6
Tabel 1 Lot benih koro pedang yang digunakan
Alat yang digunakan untuk mendevigorasikan lot benih koro pedang pada penelitian ini ialah waterbath tipe NTT-1200 (Gambar 1). Selain itu, penelitian ini juga menggunakan cosmotector tipe XP-314 untuk mengukur respirasi benih (Gambar 2), oven, toples inkubasi, timbangan digital, boks plastik, gelas kaca, desikator, cawan, gunting pangkas, pinset, dan sudip.
Gambar 1 Waterbath tipe NTT-120 Gambar 2 Cosmotector tipe XP-314
Metode Penelitian
Penelitian ini terdiri dari dua percobaan. Percobaan pertama ialah pengujian tetrazolium benih koro pedang. Percobaan kedua ialah pengujian respirasi benih koro pedang. Pengujian benih koro pedang dengan indikasi langsung dilakukan sebagai pembanding pengujian tetrazolium dan pengujian respirasi benih.
7
Percobaan 1 : Pengujian Tetrazolium Benih Koro Pedang
Percobaan ini diawali dengan pembuatan pola topografi pewarnaan tetrazolium benih koro pedang setelah diperoleh sub lot benih hasil pengusangan secara fisik. Masing-masing lima sub lot benih A, B, dan C sebanyak 10 butir direndam dalam aquades selama 12 jam. Kulit benih koro pedang dikupas dan keping kotiledon dibuka tapi tidak sampai terpisah. Benih koro pedang direndam dengan larutan tetrazolium 1 %, 0.5 %, dan 0.1 %. dalam gelas kaca kedap cahaya yang telah dibungkus dengan kertas alumunium, lalu dimasukkan ke dalam oven bersuhu 30 oC selama 18 jam. Larutan tetrazolium dengan konsentrasi 1 %, 0.5 %, dan 0.1 % tidak menunjukkan adanya perbedaan dari segi intensitas pewarnaan sehingga konsentrasi 0.1 % dipilih untuk digunakan pada tahap selanjutnya dalam pengujian tetrazolium benih koro pedang karena lebih ekonomis.
Pengamatan pola yang terbentuk dilakukan dengan mengacu pada pola topografi pewarnaan tetrazolium benih kedelai dan penilaiannya terhadap bagian-bagian esensial benih yang terwarnai dan tidak terwarnai. Hasilnya diperoleh sembilan pola topografi pewarnaan tetrazolium benih koro pedang. Pola topografi yang terbentuk digambar lalu dikelompokkan menjadi benih hidup, benih mati, kecambah normal kuat, kecambah normal, dan kecambah abnormal.
Pengujian tetrazolium benih koro pedang dilakukan setelah pola topografi pewarnaan selesai dibuat. Benih koro pedang sebanyak 25 butir per satu satuan percobaan direndam dalam aquades selama 12 jam. Kulit benih koro pedang dikupas dan keping kotiledon dibuka tapi tidak sampai terpisah. Benih koro pedang direndam dengan larutan tetrazolium 0.1 % dalam gelas kaca kedap cahaya yang telah dibungkus dengan kertas alumunium, lalu dimasukkan ke dalam oven bersuhu 30 oC selama 18 jam (Gambar 3).
Gambar 3 Proses perendaman benih koro pedang dengan tetrazolium
8
Pengujian Respirasi Benih Koro Pedang
Lima sub lot benih koro pedang yang dihasilkan dari pengusangan fisik diuji viabilitas dengan pengujian respirasi benih. Pengujian respirasi benih koro pedang diawali dengan perendaman 25 butir benih koro pedang per satu satuan percobaan dalam aquades selama 12 jam sebagai perlakuan awal agar respirasi benih meningkat dan konsentrasi CO2 dapat terdeteksi oleh cosmotector tipe XP-314.
Benih koro pedang dimasukkan ke dalam toples inkubasi, ditutup rapat dan direkatkan dengan isolasi agar tidak terjadi kebocoran (Gambar 4). Toples disimpan selama 24 jam dalam suhu ruang kamar. Setelah itu, kadar CO2 dalam toples inkubasi diukur menggunakan cosmotector tipe XP-314. Hasil pengukuran konsentrasi CO2 dimasukkan ke dalam rumus laju respirasi benih, yaitu :
L =
keterangan :
L = laju respirasi benih (mg CO2 kg benih-1 jam-1)
V = volume udara bebas dalam toples (Vtoples– Vbahan) dalam mL K = kadar CO2 sesudah inkubasi – kadar CO2 awal (0.03 %) W = waktu inkubasi (jam)
B = bobot bahan (kg)
Nilai 1.76 merupakan konstanta gas
Nilai laju respirasi benih koro pedang dibandingkan dengan nilai PTM, DB, IV, KST, dan KCT hasil pengujian langsung benih koro pedang.
Gambar 4 Inkubasi benih koro pedang di dalam toples
Pengujian Langsung Benih Koro Pedang
9
Gambar 5 Pengujian langsung benih koro pedang
Pengamatan
Pengujian Tetrazolium Benih Koro Pedang
1. Benih Hidup (%)
Benih hidup diamati dengan menghitung persentase benih yang berpotensi menjadi kecambah normal dan abnormal. Persentase benih hidup dihitung dari gabungan persentase yang dihasilkan pola 1, 2, 3, 4, 5, 6, dan 7. 2. Kecambah Normal (%)
Kecambah normal diamati dengan menghitung persentase benih yang berpotensi menjadi kecambah normal. Persentase kecambah normal dihitung dari gabungan persentase yang dihasilkan pola pola 1, 2, 3, dan 4.
3. Kecambah Normal Kuat (%)
Kecambah normal kuat diamati dengan menghitung persentase benih yang berpotensi menjadi kecambah normal kuat. Persentase kecambah normal kuat dihitung dari gabungan persentase yang dihasilkan pola pola 1 dan 2.
Pengujian Respirasi Benih Koro Pedang
4. Laju respirasi Benih
Pengujian respirasi benih dilakukan dengan mengukur kadar CO2 yang dilepaskanbenih dalam inkubasi selama 24 jam. Hasil pengukuran kadar CO2 dimasukkan ke dalam rumus laju respirasi benih, yaitu:
L =
keterangan :
L = laju respirasi benih (mg CO2 kg benih-1 jam-1)
10
W = waktu inkubasi (jam) B = bobot bahan (kg)
Nilai 1.76 merupakan konstanta gas
Pengujian Viabilitas Benih Koro Pedang secara Langsung
5. Potensi Tumbuh Maksimum (PTM)
PTM merupakan tolok ukur parameter viabilitas total yang dihitung pada hari terakhir pengamatan (hari ke-7) berdasarkan jumlah kecambah normal dan abnormal yang tumbuh. Persentase PTM dihitung dengan rumus:
PTM (%) =
keterangan :
∑ KN = jumlah kecambah normal
∑ KAN = jumlah kecambah abnormal
6. Daya Berkecambah (DB)
Persentasi DB dihitung berdasarkan jumlah persentase kecambah normal pada pengamatan pertama yang dilakukan pada hari ke-5 dan pengamatan kedua pada hari ke-7 (Febriyanti 2013). DB dihitung dengan rumus :
DB (%) =
keterangan :
∑ KN I = jumlah kecambah normal pada hari ke-5
∑ KN II = jumlah kecambah normal pada hari ke-7
7. Indeks Vigor (IV)
IV merupakan persentase kecambah normal pada hari ke-5. IV dihitung dengan rumus :
IV (%) =
keterangan:
∑ KN I = jumlah kecambah normal pada hari ke-5 8. Keserempakan Tumbuh (KST)
KST benih diukur berdasarkan kecambah normal kuat pada hari di antara hitungan pertama dan hitungan kedua (hari ke-6). Kecambah normal kuat adalah kecambah yang memiliki kinerja tumbuh kuat di antara kecambah yang tumbuh normal. KST dihitung dengan rumus :
11 9. Kecepatan Tumbuh (KCT)
KCT diukur berdasarkan jumlah tambahan perkecambahan setiap hari atau etmal (24 jam) selama kurun waktu perkecambahan. KCT dihitung dengan rumus:
KCT (% per etmal) = keterangan :
t = waktu pengamatan (etmal)
N = persentase kecambah normal setiap pengamatan tn = waktu akhir pengamatan
Analisis Data
Penelitian ini terdiri dari dua percobaan. Percobaan pertama ialah pengujian tetrazolium lot benih A, lot benih B, dan lot benih C. Percobaan kedua ialah pengujian respirasi lot benih A, lot benih B, dan lot benih C. Masing-masing percobaan menggunakan rancangan acak lengkap (RAL) dengan satu faktor perlakuan yaitu pengusangan cepat secara fisik.
Pengolahan data dianalisis dengan sidik ragam (Uji F) pada taraf 5% menggunakan aplikasi SAS (Statistical Analysis System). Parameter pengamatan yang menunjukan pengaruh nyata, diuji lanjut dengan menggunakan DMRT (Duncan Multiple Range Test). Model linier aditif yang digunakan ialah:
Yij = μ + α + ∑ij
keterangan : i = 0, 8, 12, 16, dan 20 jam j = 1, 2, dan 3
Yij = nilai parameter pada perlakuan pengusangan cepat secara fisik ke-i dan kelompok ke-j
μ = nilai tengah populasi
αi = pengaruh perlakuan pengusangan cepat secara fisik pada taraf ke-i
∑ij = pengaruh acak pada perlakuan pengusangan cepat secara fisik ke-i dan kelompok ke-j
Data hasil pengujian tetrazolium dan pengujian respirasi dibandingkan dengan data hasil pengujian langsung dengan cara dianalisis korelasi pearson dan regresi linier sederhana. Nilai koefisien korelasi mendekati 1 (r 1) menggambarkan adanya keeratan hubungan atau korelasi. Persamaan analisis regresi, yaitu :
y = a + bx
keterangan : y = tolok ukur pengujian tetrazolium atau pengujian respirasi a = titik potong garis dengan sumbu y
b = kemiringan garis
12
HASIL DAN PEMBAHASAN
Kondisi Awal Lot Benih Koro Pedang
Kadar air dan viabilitas awal lot benih koro pedang ditunjukkan pada Tabel 2. Lot benih A memiliki kadar air diatas 14 %, sedangkan lot benih B dan lot benih C memiliki kadar air dibawah 12 %. Menurut (Distan 2013), kadar air yang aman untuk benih tanaman pangan (ortodoks) ialah maksimal 12 %.
Masing-masing lot benih memiliki viabilitas dengan tolok ukur DB yang masih cukup tinggi yaitu diatas 80 %, sesuai dengan standar DB untuk benih tanaman pangan yaitu diatas 80 % (Distan 2013).
Tabel 2 Kadar air dan viabilitas awal tiga lot benih koro pedang Lot KST : keserempakan tumbuh; KCT : kecepatan tumbuh.
Percobaan 1 : Pengujian Tetrazolium Benih Koro Pedang
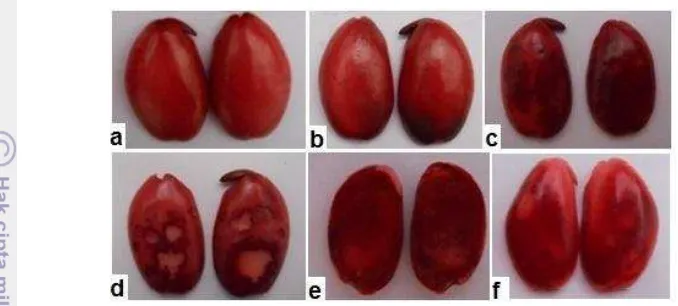
Percobaan 1 diawali dengan pembuatan pola topografi pewarnaan tetrazolium benih koro pedang dengan mengacu pada pola topografi pewarnaan tetrazolium benih kedelai dan penilaiannya terhadap bagian-bagian esensial benih yang terwarnai dan tidak terwarnai. Sub lot benih A, B, dan C hasil pengusangan secara fisik selama 0, 8, 12, 16, dan 20 jam direndam dalam larutan tetrazolium 1 %, 0.5 %, dan 0.1 %. Larutan tetrazolium dengan konsentrasi 1 %, 0.5 %, dan 0.1 % tidak menunjukkan adanya perbedaan dari segi intensitas pewarnaan sehingga konsentrasi 0.1 % dipilih untuk digunakan pada tahap selanjutnya dalam pengujian tetrazolium benih koro pedang karena lebih ekonomis. Hasil yang diperoleh didapatkan sembilan pola topografi pewarnaan tetrazolium benih koro pedang (Gambar 6).
13 Pola 5 ialah benih berwarna merah terang dengan ujung radikula berwarna putih. Pola 6 ialah benih berwarna merah terang dengan plumula berwarna putih. Pola 7 ialah benih berwarna meah terang dengan sebagain radikula dan sebagian kotiledon berwarna putih. Pola 8 ialah benih berwarna merah muda. Pola 9 ialah benih berwarna putih atau tidak berwarna.
Pola yang dibuat dikelompokan menjadi benih hidup, benih mati, kecambah normal kuat, kecambah normal, dan kecambah abnormal. Pola untuk benih hidup ialah pola 1 - 7, sedangkan pola untuk benih mati ialah pola 8 – 9. Pola untuk kecambah normal kuat ialah pola 1 – 2, pola untuk kecambah normal ialah pola 1
– 4, sedangkan pola untuk kecambah abnormal ialah pola 5 – 7. Bagian peralihan antara radikula dan kotiledon, ujung radikula, serta persentase bagian yang hidup dari kotiledon menjadi dasar pengelompokan tersebut.
14
Lot Benih A
Pengusangan cepat secara fisik lot benih A berpengaruh secara nyata terhadap tolok ukur kecambah normal, tapi tidak berpengaruh secara nyata terhadap tolok ukur benih hidup dan kecambah normal kuat. Hasil pengujian tetrazolium lima sub lot benih A menunjukkan nilai benih hidupberkisar 98 - 100 %, nilai kecambah normal berkisar 33.33 - 56 %, dan nilai kecambah normal kuat berkisar 18.67 - 30.67 % (Tabel 3). Menurut Muis et al. (2004), semakin lama waktu pengusangan maka pola warna merah pada pengujian tetrazolium benih kayu kuku (Pericopsis mooniana) juga semakin menurun.
Tolok ukur PTM, DB, dan KST pada lot benih A tidak dipengaruhi secara nyata oleh pengusangan cepat secara fisik. Hasil pengujian langsung lima lot benih A menunjukkan nilai PTM berkisar 93.33 - 98.67 %, nilai DB berkisar 73.33 - 90.67 %, dan nilai KST berkisar 36 - 64 % (Tabel 3).
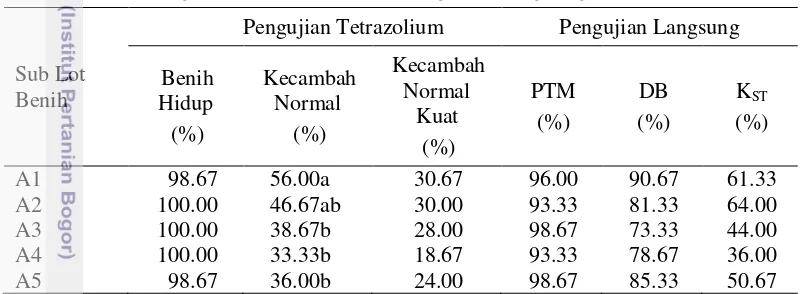
Tabel 3 Hasil pengujian tetrazolium dan pengujian langsung lima sub lot benih A
Sub Lot tumbuh maksimum pada pengujian tetrazolium; DBTTZ : daya berkecambah pada pengujian tetrazolium; KST.TTZ : keserempakan tumbuh pada pengujian tetrazolium; PTM : potensi tumbuh maksimum; DB : daya berkecambah; KST : keserempakan tumbuh; Angka-angka pada kolom yang sama yang diikuti oleh huruf yang sama tidak berbeda nyata pada taraf uji 5 % (uji selang tetrazolium yang dibuat kurang sensitif dalam mendeteksi PTMTTZ pada lot benih A. Kisaran pola 1 - 7 diduga terlalu longgar untuk dikelompokkan sebagai benih hidup(Gambar 7).
15 penting sehingga tidak terwarnainya daerah ini menunjukkan terjadinya kerusakan yang menyebabkan benih tidak dapat berkecambah.
Gambar 7 Hasil pewarnaan tetrazolium benih koro pedang sesuai dengan pola benih hidup (a: pola 1; b: pola 2; c: pola 3; d: pola 4; e: pola 5; f: pola 7)
Nilai koefisien korelasi (r) tidak nyata pada semua tolok ukur, tapi, nilai koefisien korelasi antara tolok ukur kecambah normal kuatdan KST pada lot benih A paling erat, yaitu 0.84 (Tabel 4). Nilai koefisien determinasi (R2) antara tolok ukur kecambah normal kuatdan KST mencapai 70.90 % (Tabel 4).
Tabel 4 Hasil analisis korelasi dan regresi antara pengujian tetrazolium dan
PTM : potensi tumbuh maksimum (%); DB : daya berkecambah (%); KST : keserempakan tumbuh (%); tn : tidak nyata pada taraf uji 5 %.
Lot Benih B
16 mempunyai kulit (testa) yang keras sehingga permeabilitasnya rendah. Menurut Ma et al. (2004), permeabilitas kulit benih ditentukan oleh jaringan palisade yang di dalamnya terdapat sebuah lapisan (light line) yang diduga berfungsi sebagai pengatur proses imbibisi ke dalam benih. Krisnawati dan Adie (2008) juga melaporkan bahwa light line pada kulit benih legum yang keras memiliki sifat impermeabilitas yang tinggi.
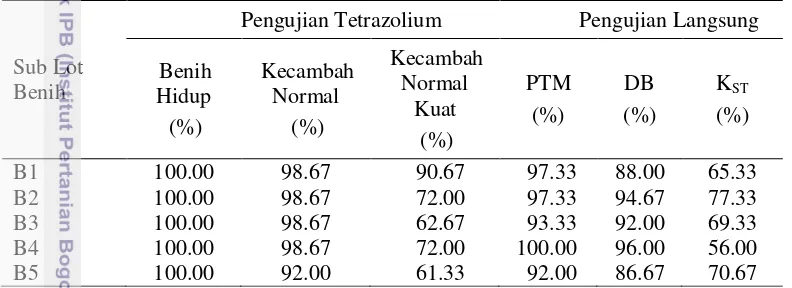
Tabel 5 Hasil pengujian tetrazolium dan pengujian langsung lima sub lot benih B
Sub Lot tumbuh maksimum; DB : daya berkecambah; KST : keserempakan tumbuh.
Korelasi antara tolok ukur kecambah normal dan DB pada lot benih B memiliki arah yang positif atau searah, sedangkan korelasi antara tolok ukur kecambah normal kuatdan KST memiliki arah yang negatif atau berlawanan arah (Tabel 6). Pola pewarnaan tetrazolium yang dibuat kurang sensitif dalam mendeteksi kecambah normal kuat pada lot benih B. Kisaran pola 1 - 2 sebagai pola untuk kecambah normal kuat(Gambar 8) diduga terlalu longgar.
17 Pola 2 yang merupakan pola benih yang berpotensi menjadi kecambah normal kuat dengan ciri-ciri ada warna merah agak tua pada sebagian kotiledon, pada pengujian langsung mungkin tidak dapat berkecambah normal kuat atau hanya dapat berkecambah normal. Hal ini didukung oleh Leist (2004) yang menyatakan bahwa benih dikotil bervigor tinggi memiliki ciri-ciri yaitu seluruh bagian kotiledon terwarnai dengan warna merah yang cerah dan merata.
Nilai koefisien korelasi (r) tidak nyata pada semua tolok ukur, tapi, nilai koefisien korelasi antara tolok ukur kecambah normaldan DB pada lot benih B paling erat, yaitu 0.66 (Tabel 6). Nilai koefisien determinasi (R2) antara tolok ukur kecambah normaldengan DB hanya mencapai 43.50 % (Tabel 6).
Tabel 6 Hasil analisis korelasi dan regresi antara pengujian tetrazolium dan
DB : daya berkecambah (%); KST : keserempakan tumbuh (%); tn : tidak nyata pada taraf uji 5 %.
Lot Benih C
18
Tabel 7 Hasil pengujian tetrazolium dan pengujian langsung lima sub lot benih C
Sub Lot tumbuh maksimum; DB : daya berkecambah; KST : keserempakan tumbuh.
Korelasi antara tolok ukur kecambah normal kuatdan KST pada lot benih C memiliki arah yang positif atau searah, sedangkan korelasi antara tolok ukur kecambah normal dan DB memiliki arah yang negatif atau berlawanan arah (Tabel 8). Pola pewarnaan tetrazolium yang dibuat kurang sensitif dalam mendeteksi kecambah normalpada lot benih C. Kisaran pola 1 - 4 sebagai pola untuk kecambah normal (Gambar 9) diduga terlalu longgar.
Pola 4 yang merupakan pola benih yang berpotensi menjadi kecambah normal dengan ciri-ciri ada bagian kotiledonnya (tidak pada bagian yang menghubungkan dengan poros embrio) yang tidak terwarnai, pada pengujian langsung mungkin termasuk kecambah abnormal. Menurut Leist (2004), bagian kotiledon yang tidak terwarnai menunjukkan kerusakan akibat serangan hama atau penyakit sehingga tidak dapat berkecambah normal.
19 Nilai koefisien korelasi (r) tidak nyata pada semua tolok ukur, tapi, nilai koefisien korelasi antara tolok ukur kecambah normal kuat danKST pada lot benih C paling erat, yaitu 0.47 (Tabel 8). Nilai koefisien determinasi (R2) antara tolok kecambah normal kuatdanKST hanya mencapai 22.40 % (Tabel 8).
Tabel 8 Hasil analisis korelasi dan regresi antara pengujian tetrazolium dan
DB : daya berkecambah (%); KST : keserempakan tumbuh (%); tn : tidak nyata pada taraf uji 5 %.
Percobaan 2 : Pengujian Respirasi Benih Koro Pedang
Lot Benih A
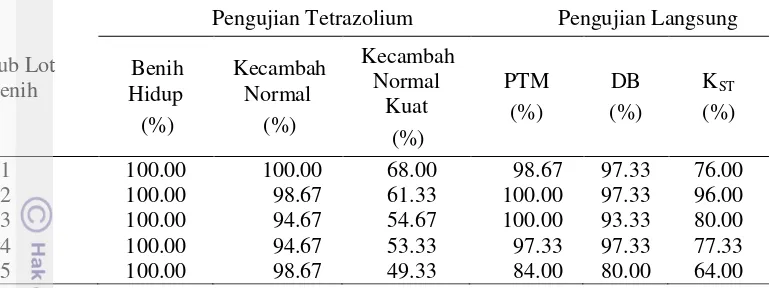
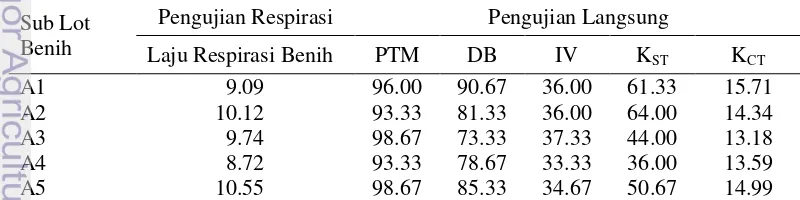
Pengusangan cepat secara fisik lot benih A tidak berpengaruh secara nyata terhadap tolok ukur laju respirasi benih. Hasil pengujian respirasi lima sub lot benih A menunjukkan nilai laju respirasi benih yang berkisar 8.72 - 10.55 mg CO2 kg benih-1 jam-1 (Tabel 9).
Tolok ukur PTM, DB, IV, KST, dan KCT pada lot benih A tidak dipengaruhi secara nyata oleh pengusangan cepat secara fisik. Hasil pengujian langsung lima lot benih A menunjukkan nilai PTM berkisar 93.33 - 98.67 %, nilai DB berkisar 73.33 - 90.67 %, nilai IV berkisar 33.33 - 37.33 %, nilai KST berkisar 36 - 64 %, dan nilai KCT berkisar 13.18 – 15.71 % etmal-1 (Tabel 9).
Tabel 9 Hasil pengujian respirasi dan pengujian langsung lima sub lot benih A Sub Lot
20
Korelasi antara laju respirasi benih dan PTM, DB, IV, KST, serta KCT pada lot benih A memiliki arah yang positif atau searah (Tabel 10). Hal ini sesuai dengan Nurfarida (2011) yang melaporkan bahwa korelasi antara laju respirasi benih dan tolok ukur PTM, DB, IV, KST, serta KCT pada benih jagung (Z. Mays) memiliki hubungan yang searah.
Nilai koefisien korelasi (r) tidak nyata pada semua tolok ukur, tapi, nilai koefisien korelasi antara laju respirasi benih danPTM pada lot benih A paling erat, yaitu 0.49 (Tabel 10). Nilai koefisien determinasi (R2) antara laju respirasi benih danPTM hanya mencapai 23.80 % (Tabel 10).
Tabel 10 Hasil analisis korelasi dan regresi antara pengujian respirasi dan benih B menunjukkan nilai laju respirasi benih yang berkisar 8.44 - 12.96 mg CO2 kg benih-1 jam-1 (Tabel 11).
21 Tolok ukur PTM, DB, IV, KST, dan KCT pada lot benih B tidak dipengaruhi secara nyata oleh pengusangan cepat secara fisik. Hasil pengujian langsung lima lot benih A menunjukkan nilai PTM berkisar 92 - 100 %, nilai DB berkisar 86.67 - 96 %, nilai IV berkisar 37.33 - 49.33 %, nilai KST berkisar 56 - 77.33 %, dan nilai KCT berkisar 15.40 - 17.39 % etmal-1 (Tabel 11).
Korelasi yang positif atau searah pada lot benih B hanya terjadi antara laju respirasi dan tolok ukur PTM, IV, dan KST (Tabel 12). Hal ini sesuai dengan Baharizki (2012) yang melaporkan bahwa korelasi antara laju respirasi benih dan tolok ukur PTM, IV, serta KST pada benih kacang tanah juga memiliki hubungan yang searah.
Nilai koefisien korelasi (r) tidak nyata pada semua tolok ukur, tapi, nilai koefisien korelasi antara laju respirasi benih danKST pada lot benih B paling erat, yaitu 0.32 (Tabel 12). Nilai koefisien determinasi (R2) antara laju respirasi benih danKST hanya mencapai 10.50 % (Tabel 12).
Tabel 12 Hasil analisis korelasi dan regresi antara pengujian respirasi dan pengujian langsung lot benih B
Tolok Ukur
Pengusangan cepat secara fisik lot benih C tidak berpengaruh secara nyata terhadap tolok ukur laju respirasi benih. Hasil pengujian respirasi lima sub lot benih C menunjukkan nilai laju respirasi benih yang cukup rendah yaitu berkisar 5.26 - 8.80 mg CO2 kg benih-1 jam-1 (Tabel 13).
Tolok ukur PTM, DB, IV, KST, dan KCT pada lot benih C tidak dipengaruhi secara nyata oleh pengusangan cepat secara fisik. Hasil pengujian langsung lima lot benih C menunjukkan nilai PTM berkisar 84 - 100 %, nilai DB berkisar 80 - 97.33 %, nilai IV berkisar 33.33 - 64 %, nilai KST berkisar 64 - 96 %, dan nilai KCT berkisar 14.09 - 18.36 % etmal-1 (Tabel 13).
22
Tabel 13 Hasil pengujian respirasi dan pengujian langsung lima sub lot benih D Sub Lot indeks vigor (%); KST : keserempakan tumbuh (%); KCT : kecepatan tumbuh (% etmal-1).
Korelasi antara laju respirasi benih dan PTM, DB, IV, KST, serta KCT pada lot benih C memiliki arah yang positif atau searah (Tabel 14). Hal ini sesuai dengan Permatasari (2011) yang melaporkan bahwa korelasi antara laju respirasi benih danPTM, DB, IV, KST, serta KCT pada benih kedelai memiliki hubungan yaitu mencapai 92.30 % (Tabel 14).
23
SIMPULAN DAN SARAN
Simpulan
Hasil pembuatan sub lot benih dengan waterbath belum bisa menghasilkan mutu fisiologis benih koro pedang yang gradual. Pola topografi pewarnaan tetrazolium benih koro pedang yang dibuat dalam penelitian ini belum bisa digunakan untuk mengevaluasi mutu fisiologis benih koro pedang karena polanya kurang bervariasi. Metode pengujian respirasi benih dengan cosmotector belum bisa digunakan untuk mengevaluasi mutu fisiologis benih koro pedang karena alat yang digunakan untuk pengukuran laju respirasi benih masih belum sempurna sehingga diperkirakan ada CO2 yang terbuang dan tidak terukur.
Saran
Lama penderaan perlu ditambah untuk mendapatkan viabilitas sub lot benih koro pedang yang gradual. Penelitian mengenai pembuatan pola topografi pewarnaan tetrazolium pada benih koro pedang perlu dilakukan lebih lanjut untuk mendapatkan pola pewarnaan yang lebih sensitif dalam mendeteksi viabilitas benih koro pedang.
Pengujian cepat viabilitas untuk lot benih koro pedang dengan viabilitas dan vigor awal yang sedang sebaiknya melalui pengujian tetrazolium. Pengujian tetrazolium lebih efektif dilakukan pada lot benih dengan viabilitas awal yang sedang karena dapat menghasilkan variasi pola topografi yang lebih beragam.
Lot benih koro pedang dengan viabilitas dan vigor awal yang tinggi tidak menghasilkan variasi pola topografi yang beragam sehingga kurang efektif jika diuji tetrazolium. Pengujian cepat viabilitas lot benih koro pedang dengan viabilitas dan vigor awal yang tinggi sebaiknya melalui pengujian respirasi benih.
DAFTAR PUSTAKA
Abdalla B. 2013. Pengujian aktivitas antibakteri ekstrak tempe koro pedang (Canavalia ensiformis L.) terhadap Escherichia coli dan Staphylococcus aureus [skripsi]. Bogor (ID): Institut Pertanian Bogor.
24
Anto KB, Jayaram KM. 2010. Effect of temperature treatment on seed water content and viability of green pea and soybean. Int J Bot. 6:122-126.
Baharizki J. 2012. Pengembangan uji cepat viabilitas dan vigor benih kacang tanah (Arachis hypogaea L.) menggunakan pengukuran respirasi dengan alat kosmotektor [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Deminicis BB, Rodrigues PDR, Faria BP, Vieira HD, Filho ADP, Freitas GF. 2014. Tetrazolium test to evaluate Stizolobium aterrimum seeds quality.
AJPS. 5:148-152.
Dina, Widajati E, Wirawan B, Ilyas S. 2007. Pola topografi pewarnaan tetrazolium sebagai tolok ukur viabilitas dan vigor benih kedelai (Glycine max L.Merr.) untuk pendugaan pertumbuhan tanaman di lapangan. Bul Agron. 35(2):88-95.
[Distan] Dinas Pertanian dan Ketahanan Pangan Provinsi Gorontalo (ID). 2013. Teknis perbanyakan benih tanaman padi, jagung, dan kedelai [internet] [diunduh 2014 Des 2]. Tersedia pada : http://distan.gorontaloprov.go.id. Doss A, Pugalenthi M, Vadivel VG, Subhashini G, Subash RA. 2011. Effects of
processing technique on the nutritional composition and antinutrients content of under utilized food legume Canavalia ensiformis L.DC. Int Food Res J. 18(3):965-970
Febriyanti F. 2013. Viabilitas benih koro pedang putih (Canavalia ensiformis
(L.)DC) yang disimpan pada beberapa jenis kemasan dan periode simpan [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Fitriah NM. 2013. Aktivitas hemaglutinin olahan koro pedang (Canavalia ensiformis L.) [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Hartawan R. 2011. Pengaruh fotoperiodesitas, asam indol asetat, dan fosfor terhadap daya simpan benih kedelai pada musim hujan dan kemarau.
Agrivigor. 10(2):168-177.
Hartawan R, Nengsih Y. 2012. Kadar air dan karbohidrat berperan penting dalam mempertahankan kualitas benih karet. Agrovigor. 5(2):103-112.
[ISTA] International Seed Testing Association (ZH). 2014. Seed Science and Technology. International Rules for Seed Testing.
Istiani Y. 2010. Karakterisasi senyawa bioaktif isoflavon dan uji aktivitas antioksidan dari ekstrak etanol tempe berbahan baku koro pedang (Canavalia ensiformis) [thesis]. Surakarta (ID): Universitas Sebelas Maret. Krisnawati A, Edie MM. 2008. Ragam karakter morfologi kulit biji beberapa
genotipe plasma nutfah kedelai. Bul Plasm Nutf. 14(1):14-18.
Leist N. 2004. Seed vigour determination by means of the topographical tetrazolium test. ISTA Seed Quality Assesment Training; 2004 Nov 22-26. Hanoi, Vietnam. Hanoi (VN) : APSA.
25
Nafi’ A. 2007. Kajian sifat nutrisional dan fungsional protein rich flour (PRF) koro-koran : studi lanjut pengembangan PRF sebagai food ingredient baru. Jember (ID): Universitas Jember.
Nurfarida M. 2011. Pengembangan uji cepat vigor benih jagung (Zea mays L.) dengan alat pengukur laju respirasi kosmotektor [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Muis MI, Satjapradja O, Luluk S, Zanzibar. 2004. Penentuan viabilitas benih kayu kuku (Pericopsis mooniana) berdasarkan uji cepat (uji tetrazolium, uji eksisi embrio, uji belah, dan uji hidrogen peroksida). J Nus Syl. 4:9-24.
Patil VN, Dadlani M. 2009. Tetrazolium test for seed viability and vigour.
Handbook of Seed Testing. Nueva Delhi (IN). 209-241.
Permatasari OSI. 2011. Pengembangan uji cepat vigor benih kedelai (Glycine max
L. Merr.)menggunakan metode respirasi dengan alat kosmotektor [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Pramoedinata E. 2007. Ketahanan benih beberapa genotipe pepaya (Carica papaya L.) terhadap pengeringan [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Purwanto I. 2007. Mengenal Lebih Dekat Leguminosa. Jakarta (ID): Kanisius. [Puslitbangtan] Pusat Penelitian dan Pengembangan Tanaman Pangan (ID). 2007.
Kelayakan dan teknologi budi daya koro pedang (Canavalia sp) [internet]. [diunduh 2014 Okt 10]. Tersedia pada : www.puslittan.bogor.net.
Sadjad S. 1993. Dari Benih Kepada Benih. Jakarta (ID): Penerbit Grasindo. Samjaya ZR, Dhafar ZR, Negara ZP, Hasmeda M, Suryaningtiyas H. 2010.
Respirasi dan penurunan mutu benih karet selam penyimpanan. Seminar Nasional Hasil Penelitian Bidang Pertanian “Pertanian Terintegrasi untuk Mencapai Millenium Development Goals (MDGs)”. Palembang (ID): Universitas Sriwijaya. (1):421-434.
Shintarika F, Suwarno FC, Suwarno 2013. Pengujian vigor daya simpan dan vigor terhadap kekeringan pada benih padi gogo dan padi sawah. Bul Agrohort. 1:67-61
Stephens JM. 2012. Bean, Jack (Canavalia ensiformis (L.) D.C.Bean) [internet]. [Diunduh pada 2014 Oktober 21]. Tersedia pada : http://edis.ifas.ufl.edu. Suciati A. 2012. Pengaruh Lama Perendaman dan Fermentasi terhadap
Kandungan HCN pada Tempe Kacang Koro [skripsi]. Makassar (ID): fisiologi dan biokimia deteriorasi benih kedelai dalam penyimpanan. JIPI. 11(2):76-87.
Wahjuningsih SB, Saddewisasi W. 2013. Pemanfaatan koro pedang pada aplikasi produk pangan dan analisis ekonominya. Riptek. 7(2):1-10.
Windrati WS, Nafi A, Augustine PD. 2010. Sifat nutritional protein rich flour (PRF) koro pedang (Canavalia ensiformis L.). Agroteknologi. 4(1):18-26. Zanzibar M, Herdiana N. 2010. Akurasi metode uji cepat dalam menduga mutu
26
RIWAYAT HIDUP
Penulis dilahirkan di Subang pada tanggal 09 April 1993 dari ayah Abdulrachman Afarid dan ibu Tuti Puspawati. Penulis merupakan putri kelima dari enam bersaudara. Penulis lulus dari SMAN 1 Subang pada tahun 2010 dan pada tahun yang sama penulis melanjutkan pendidikan S-1 Departemen Agronomi dan Hortikultura di Institut Pertanian Bogor (IPB) melalui jalur Undangan Seleksi Masuk IPB.
Selama mengikuti perkuliahan, penulis menjadi asisten responsi dan praktikum Tingkat Persiapan Bersama (TPB) untuk matakuliah Pendidikan Agama Islam dan Biologi Dasar pada tahun 2013-2014. Penulis juga menjadi
senior resident Asrama Putri TPB IPB pada tahun 2012-2013. Organisasi yang pernah diikuti oleh penulis adalah Badan Eksekutif Mahasiswa Fakultas Pertanian (BEM A) Kabinet Unity sebagai bendahara departemen Akademik dan Profesi pada periode kepengurusan tahun 2011-2012. Penulis juga pernah tergabung dalam kegiatan kepanitiaan Masa Perkenalan Kampus Mahasiswa Baru (MPKMB) pada tahun 2011. Penulis juga tergabung dalam Organisasi Mahasiswa