AKTIVITAS ANTIFUNGI EKSTRAK DAUN MIANA (
Coleus
scutellariodes
[L] Benth) PADA PERTUMBUHAN
Candida albicans
SECARA
IN VITRO
DWI AYU SETIANINGRUM
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Aktivitas Antifungi Ekstrak Daun Miana (Coleus scuttellariodes [L] Benth) pada Pertumbuhan
Candida albicans Secara In Vitro adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Juli 2014
Dwi Ayu Setianingrum
ABSTRAK
DWI AYU SETIANINGRUM. Aktivitas Antifungi Ekstrak Daun Miana (Coleus scuttellariodes [L] Benth) pada Pertumbuhan Candida albicans Secara In Vitro. Dibimbing oleh MARIA BINTANG dan SYAEFUDIN.
Miana (Coleus scutellariodes [L] Benth) merupakan salah satu tanaman obat tradisional dari famili Lamiaceae, mengandung senyawa flavonoid, tanin, saponin, steroid, dan triterpenoid yang dapat digunakan sebagai antifungi. Penelitian ini bertujuan menguji aktivitas antifungi ekstrak daun miana terhadap
C. albicans dan menganalisis senyawa aktif dalam ekstrak daun miana yang bersifat antifungi terhadap C. albicans. Metode penelitian ini meliputi, ekstraksi menggunakan air, etanol 70%, dan aseton, uji aktivitas antifungi dengan metode difusi sumur agar dan identifikasi senyawa aktif ekstrak penghambatan terbaik dengan Gas Chromatography-Mass Spectrometry (GC-MS). Hasil uji menunjukkan bahwa ekstrak aseton konsentrasi 400 mg/mL memiliki aktivitas penghambatan tertinggi dengan diameter zona hambat sebesar 4.66 mm, termasuk dalam kategori lemah, sedangkan ekstrak air dan etanol 70% tidak menunjukkan adanya aktivitas antifungi. Kontrol positif nistatin konsentrasi 1.028 mg/mL lebih efektif dalam menghambat C. albicans. Nilai konsentrasi hambat tumbuh minimum ekstrak aseton sebesar 1.56 mg/mL. Hasil identifikasi ekstrak aseton dengan GC-MS diperoleh senyawa fitol sebesar 41.29%.
Kata kunci: antifungi, Candida albicans, Coleus scutellariodes
ABSTRACT
DWI AYU SETIANINGRUM. Antifungal Activity of Coleus scuttellariodes [L] Benth Leaves Extract on Candida albicans In Vitro. Supervised by MARIA BINTANG and SYAEFUDIN.
Miana (Coleus scuttellariodes [L] Benth) is one of the traditional medicine from family Lamiceae having flavonoids, tannins, saponins, steroids, and triterpenoids compound those can be used as antifungal. The objectives of this research were to examine the antifungal activity of Coleus scuttellariodes [L] Benth leaves extract against C. albicans and to analyze the active compounds in
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Biokimia
AKTIVITAS ANTIFUNGI EKSTRAK DAUN MIANA (
Coleus
Scutellariodes
[L] benth) PADA PERTUMBUHAN
Candida albicans
SECARA IN VITRO
DWI AYU SETIANINGRUM
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
Judul Skripsi : Aktivitas Antifungi Ekstrak Daun Miana (Coleus scutellariodes [L] benth) pada Pertumbuhan Candida albicans Secara In Vitro
Nama : Dwi Ayu Setianingrum NIM : G84100013
Disetujui oleh
Prof Dr drh Maria Bintang, MS Pembimbing I
Syaefudin, SSi, MSi Pembimbing II
Diketahui oleh
Dr Ir I Made Artika, MAppSc Ketua Departemen
PRAKATA
Bismillahirrahmanirrahim
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Penelitian ini berjudul Aktivitas Antifungi Ekstrak Daun Miana (Coleus scuttellariodes [L] Benth) pada Pertumbuhan Candida albicans Secara In Vitro. Penelitian ini dilakukan sejak bulan Desember 2013 sampai April 2014, bertempat di Laboratorium Departemen Biokimia, Fakultas Matematika dan Ilmu Pengetahuan Alam; Laboratorium Mikrobiologi Medik, Fakultas Kedokteran Hewan, Institut Pertanian Bogor; dan Laboratorium Pengujian Hasil Hutan, Badan Penelitian dan Pengembangan Kehutanan, Bogor.
Penulis menyampaikan terima kasih kepada Prof Dr drh Maria Bintang, MS dan Syaefudin, SSi, MSi selaku pembimbing yang telah memberikan bimbingan, motivasi, dan saran selama penulisan karya ilmiah ini. Ungkapan terima kasih juga penulis sampaikan kepada ayah, ibu, kakak, adik, serta seluruh keluarga atas segala perhatian, doa, dan kasih sayangnya. Terima kasih juga penulis ucapkan kepada seluruh staf laboratorium Biokimia, Pak Agus, kak Merry dan rekan kerja penelitian (Zia, Puji, dan Nazula) atas bantuan dan saran yang diberikan selama pelaksanaan penelitian dan beasiswa Yayasan Amanah IPB yang telah membantu dalam biaya penelitian ini.
Penulis juga mengucapkan terima kasih kepada teman-teman seperjuangan Biokimia 47, Sabriners, serta sahabat-sahabat yang tidak dapat disebutkan satu persatu atas segala bantuan, saran, dan motivasi yang diberikan. Semoga karya ilmiah ini bermanfaat.
Bogor, Juli 2014
DAFTAR ISI
DAFTAR TABEL viii
DAFTAR GAMBAR viii
DAFTAR LAMPIRAN viii
PENDAHULUAN 1
BAHAN DAN METODE
Bahan dan Alat 2
Metode 2
HASIL
Kadar Air, Kadar Abu dan Rendemen Simplisia Daun Miana 6
Analisis Fitokimia 6
Aktivitas Antifungi Ekstrak Daun Miana 6
Konsentrasi Hambat Tumbuh Minimum (KHTM) 7
Identifikasi Senyawa Ekstrak Aseton 8
PEMBAHASAN
Kadar Air, Kadar Abu dan Rendemen Simplisia Daun Miana 9
Analisis Fitokimia 10
Aktivitas Antifungi dan Konsentrasi Hambat Tumbuh Minimum Ekstrak
Daun Miana 11
Identifikasi Senyawa Ekstrak Aseton 12
SIMPULAN DAN SARAN
Simpulan 13
Saran 13
DAFTAR PUSTAKA 14
DAFTAR TABEL
1 Kondisi alat GC-MS 5
2 Hasil analisis proksimat simplisia dan rendemen ekstrak daun miana 6
3 Hasil analisis fitokimia 6
DAFTAR GAMBAR
1 Diameter zona hambat Candida albicans ekstrak aseton 7 2 Diameter zona hambat minimum Candida albicans ekstrak aseton 8 3 Kromatogram komponen ekstrak aseton dengan GC-MS 9
DAFTAR LAMPIRAN
1 Kadar air simplisia daun miana 17
2 Kadar abu simplisia daun miana 17
3 Rendemen ekstrak daun miana 17
4 Uji aktivitas antifungi ekstrak daun miana terhadap Candida albicans 18 5 Uji KHTM ekstrak aseton daun miana terhadap C. albicans 18 6 Foto uji aktivitas antifungi ekstrak daun miana 18
7 Foto uji KHTM ekstrak aseton 19
8 Uji fitokimia ekstrak daun miana 20
9 Hasil analisis statistika uji aktivitas antifungi dan uji KHTM ekstrak
aseton daun miana 21
PENDAHULUAN
Infeksi fungi merupakan masalah kesehatan yang dihadapi di seluruh dunia dan terus mengalami peningkatan terutama di negara-negara berkembang. Fungi tumbuh subur di daerah beriklim tropis dengan kelembaban tinggi seperti Indonesia. Salah satu fungi penyebab penyakit infeksi pada wanita adalah
Candida albicans. Candida albicans merupakan fungi patogen yang paling banyak menyebabkan candidiasis vaginalis dengan gejalanya ditandai adanya keputihan yang kadang-kadang disertai gatal atau iritasi vulva (Soemiati dan Berna 2002). Candida albicans juga dapat menyerang organ-organ lain seperti mulut, kulit, kuku, paru-paru, saluran pencernaan, saluran kemih, jantung dan selaput otak. Sebanyak 75% dari jumlah wanita di Indonesia diperkirakan akan menderita candidiasis vaginalis minimal sekali dalam hidupnya, dimana 40-45% dari penderita tersebut akan mengalami infeksi berulang dua kali atau lebih (Sundari dan Winarno 1996; Lanchers et al. 2000; Ferrer 2000). Menurut Noer (2007) menyatakan bahwa sebanyak 51.8% remaja wanita memiliki kesadaran yang rendah terhadap penyakit keputihan. Oleh karena itu, diperlukan solusi yang tepat untuk mengatasi penyakit ini.
Selama ini pengobatan penyakit yang disebabkan oleh infeksi fungi menggunakan antibiotik seperti derivat imidazol, derivat triazol, nistatin, dan amfoterisis B (Rochani 2009). Namun penggunaan antibiotik tersebut dapat menyebabkan resistensi dan menimbulkan efek samping. Hal inilah yang menjadi salah satu faktor bagi masyarakat beralih ke pengobatan alternatif menggunakan bahan alam atau obat tradisional. Salah satu tanaman yang dimanfaatkan sebagai obat tradisional adalah tanaman miana (Coleus scuttellariodes [L] Benth).
Batang dan daun miana mengandung minyak atsiri (karvakol, eugenol, dan etil salisilat), fenol, tanin, lemak, dan fitosterol (Winarto 2007). Tanaman miana juga memiliki senyawa aktif seperti flavonoid, steroid, tanin, dan saponin (Ridwan dan Yunani 2007). Tanaman ini mempunyai banyak manfaat dibidang kesehatan terutama bagian daunnya. Secara empiris masyarakat sudah menggunakan air rebusan daun miana sebagai obat keputihan, selain itu tanaman ini juga telah dikenal luas sebagai obat sakit demam, nifas, wasir, bisul, borok, luka bernanah, penambah nafsu makan dan peluruh haid (Wijayakusuma et al.
1996). Penelitian terdahulu melaporkan bahwa daun miana memiliki aktivitas antibakteri (Rahmawati 2008), anticestoda (Ridwan dan Yunani 2007), dan antioksidan (Hardiyanti et al. 2013).
2
BAHAN DAN METODE
Bahan dan Alat
Bahan-bahan yang digunakan adalah daun miana yang tua (3-5 helai dari pucuk) yang diperoleh dari BALITRO-Bogor, kultur Candida albicans INACC Y116 yang diperoleh dari LIPI Cibinong-Bogor, media Potato Dextrose Agar
(PDA), NaCl 0.9%, kertas saring, alumunium foil, kloroform, amoniak, pereaksi Dragendorf, pereaksi Mayer, perekasi Wagner, H2SO4 2M, H2SO4 pekat, dH2O, metanol, eter, asam asetat anhiridat, FeCl3 1 % (b/v), etanol 70 %, etanol 30 %, aseton, standar McFarland (3), nistatin Phapros, dan dimetilsulfoksida (DMSO) 5%.
Alat-alat yang digunakan meliputi alat-alat gelas, pipet volumetrik, pipet mikro, pipet tetes, cawan Petri, cawan porselin, wadah plastik, oven, autoklaf, inkubator, rotavapor eyela osb-2100, laminar air flow cabinet, lemari pendingin, eksikator, vortex vibrofix vf1, penangas air, neraca analitik, shaker, lup inokulasi, tanur, bunsen, tabung Durham, mesin penggiling, dan GC-MS-QP2010 SHIMIDAZU.
Metode
Preparasi Sampel
Daun miana yang digunakan dalam penelitian adalah daun miana tua yang diperoleh dari 3-5 helai dari pucuk tanaman dengan bentuk daun yang sempurna dan berwarna merah keunguan, atau merah gelap. Sampel daun segar diambil sebanyak 2 kg. Daun miana dicuci dengan air bersih dan ditiriskan dalam wadah plastik, selanjutnya dikeringkan dalam oven dengan suhu 50oC selama 4-5 hari sampai diperoleh berat akhirnya yang konstan. Daun miana kering dihaluskan dengan menggunakan mesin penggiling hingga menjadi serbuk halus berukuran 100 mesh. Simplisia yang didapat dibungkus dengan plastik dan disimpan untuk pengujian selanjutnya.
Penetapan Kadar Air (AOAC 2006)
Cawan porselin dikeringkan di dalam oven bersuhu 105oC selama 1 jam, kemudian didinginkan dalam eksikator selama 15 menit. Cawan porselin yang telah dingin selanjutnya ditimbang untuk menentukan bobot kosongnya. Sebanyak 2 gram serbuk daun miana dimasukan ke dalam cawan porselin, kemudian dimasukkan ke dalam oven selama 3 jam dengan suhu 105oC. Cawan selanjutnya didinginkan dalam eksikator selama 15 menit, cawan beserta isinya ditimbang. Perlakuan dilakukan berulang kali sampai diperoleh bobot yang konstan. Penentuan kadar air dilakukan sebanyak 3 kali ulangan. Kadar air dapat dihitung menggunakan persamaan sebagai berikut:
Kadar Air = × 100% Keterangan
3
Penetapan Kadar Abu (AOAC 2006)
Penetapan kadar abu diawali dengan memasukkan cawan porselin ke dalam tanur dengan suhu 550oC selama 1 jam kemudian didinginkan dalam eksikator selama 15 menit. Selanjutnya bobot cawan ditimbang. Sebanyak 2 g serbuk daun miana dimasukkan ke dalam cawan lalu dipanaskan diatas bunsen sampai tidak berasap lagi. Selanjutnya sampel dimasukakan ke dalam tanur dengan suhu 600oC dan dibiarkan selama 6 jam. Pemanasan sampai diperoleh abu berwarna putih keabu-abuan. Penimbangan dilakukan sampai diperoleh bobot sampel yang konstan. Penentuan kadar abu dilakukan sebanyak 3 kali ulangan. Penentuan kadar abu dapat dihitung menggunakan persamaan sebagai berikut:
Kadar Abu = × 100 % Keterangan
a = bobot cawan + sampel setelah dikeringkan (g) b = bobot cawan sebelum dikeringkan (g)
c = bobot sampel basah (g)
Pembuatan Ekstrak Etanol 70 %, Air (BPOM 2004), dan Ekstrak Aseton Daun Miana (Modifikasi Rahmawati 2008)
Simplisia daun miana yang diperoleh diekstraksi dengan metode maserasi (etanol 70 % dan aseton) dan perebusan (air). Ekstraksi menggunakan metode maserasi, sebanyak 10 g serbuk simplisia ditambahkan masing-masing pelarut etanol 70% dan aseton dengan perbandingan 1:10 (b/v), dimasukkan ke dalam erlenmeyer direndam selama 24 jam sambil digoyang-goyangkan dengan shaker. Ekstraksi menggunakan pelarut air dengan cara merebus simplisia sebanyak 10 g pada air mendidih. Simplisia dicampurkan ke dalam air mendidih dengan perbandingan 1:10 (b/v), kemudian direbus pada suhu 100oC sampai mendidih. Filtrat hasil maserasi dan perebusan disaring. Perlakuan maserasi dan perebusan (menggunakan sampel daun, bekas sebelumnya) diulang hingga 2 kali. Filtrat hasil rebusan dan maserasi dikumpulkan dan kemudian dipekatkan dengan rotavapor sampai diperoleh sampel yang menyerupai pasta. Pembuatan ekstrak dilakukan dengan 3 kali ulangan, lalu rendemen yang diperoleh dirata-ratakan.
Rendemen (%) = × 100%
Analisis Fitokimia (Harbone 1987)
Uji Alkaloid. Sebanyak 0.05 g ekstrak ditambahkan 10 mL kloroform dan 3 tetes amoniak. Fraksi kloroform dipisahkan dan diasamkan dengan 2 tetes H2SO4 2 M. fraksi asam dibagi menjadi 3 tabung dan masing-masing tabung ditambahkan dengan pereaksi Dragendorf, Meyer, dan Wagner sebanyak 3 tetes. Sampel positif mengandung alkaloid ditandai dengan terbentuknya endapan putih, merah dan coklat untuk perekasi Mayer, Dragendorf, dan Wagner.
4
Uji Saponin. Sebanyak 0.05 g ekstrak ditambahkan dengan 5 mL air kemudian dipanaskan selama 5 menit. Selanjutnya sampel dikocok selama 5 menit. Adanya saponin ditunjukkan dengan terbentuknya busa yang stabil setelah didiamkan selama 10 menit.
Uji Tanin. Sebanyak 0.05 g ekstrak ditambahkan dengan 5 mL air, kemudian didihkan selama 5 menit. Larutan selanjutnya disaring, filtrat yang diperoleh ditambahkan dengan 5 tetes FeCl3 1 % (b/v). Adanya warna biru tua atau hitam yang terbentuk menunjukkan adanya tanin.
Uji triterpenoid dan Steroid. Sebanyak 0.05 g ekstrak ditambahkan dengan 5 mL etanol 30 %, kemudian dipanaskan pada suhu 50oC selama 5 menit. Sampel disaring, filtrat yang diperoleh diuapkan hingga kering. Residu ditambah 0.5 mL eter dan dipindahkan ke dalam tabung reaksi, lalu ditambahkan dengan pereaksi Liebermann Burchard (3 tetes asam asetat anhiridat dan 1 tetes H2SO4 pekat). Adanya triterpenoid ditandai dengan terbentuknya warna merah atau ungu, sedangkan adanya steroid ditunjukkan dengan warna hijau atau biru.
Pembuatan Media
Media Potato Dextrose Agar (PDA) ditimbang sebanyak 3.9 g lalu dicampurkan dengan 100 mL air dalam tabung bertutup. Larutan dibuat homogen dengan cara diaduk sambil dipanaskan. Media yang masih dalam keadaan cair, kemudian disterilisasi dengan autoklaf pada tekanan 2 atm pada suhu 121°C selama 15 menit.
Peremajaan Kultur C. albicans (Ghozali et al. 2009)
Kultur C. albicans diperoleh dari LIPI Cibinong, Bogor yang telah dibiakkan dalam media Potato Dextrose agar (PDA). Biakan C. albicans diambil satu ose lalu digoreskan pada permukaan media PDA dalam cawan Petri. Biakan
C. albicans lalu diinkubasi pada suhu 37oC selama 48 jam sampai terbentuk koloni bulat putih.
Uji Aktivitas Antifungi Metode Sumur Agar (Bintang 1993) dan Konsentrasi Hambat Tumbuh Minimum (KHTM)
5 standar positif, dimasukkan 50 µL nistatin 1.028 mg/mL. Adapun standar negatif dimasukkan 50 µL pelarut dari masing-masing ekstrak. Aktivitas antifungi ditentukan dengan pengukuran zona bening di sekitar lubang yang berisi ekstrak sampel menggunakan jangka sorong dengan dua kali pengukuran diameter dan hasilnya dirata-ratakan. Pengujian setiap ekstrak dilakukan sebanyak tiga kali ulangan dan hasilnya dirata-ratakan. Ekstrak yang memiliki aktivitas antifungi, selanjutnya ditentukan konsentrasi hambat tumbuh minimum (KHTM). Uji KHTM ekstrak aseton dilakukan dengan menurunkan konsentrasi ekstrak menjadi 6.25 mg/mL, 3.125 mg/mL, 1.56 mg/mL, 0.78 mg/mL, 0.39 mg/mL, dan 0.19 mg/mL dengan prosedur yang sama pada uji aktivitas antifungi yang telah dilakukan sebelumnya. KHTM ditentukan pada konsentrasi terkecil yang menunjukkan zona hambat tumbuh C. albicans.
Analisis GC-MS (Gas Chromatography-Mass Spectrometry)
Identifikasi senyawa yang memiliki aktivitas antifungi dilakukan menggunakan pirolisis kromatografi gas spektrometri massa (Py-GC-MS). Ekstrak yang diidentifikasi dengan Py-GC-MS adalah ekstrak yang memiliki aktivitas antifungi yang paling besar, dalam penelitian ini adalah ekstrak aseton. Sampel yang dinalisis langsung dimasukkan ke dalam tempat contoh. Sebelum dilakukan analisis GC-MS sampel masuk dalam pirolisis unit dan dipanaskan dalam lingkungan bebas oksigen pada suhu 280oC. tahapan ini menghasilkan panas yang dimediasi pembelahan ikatan kimia dalam struktur makromolekul dan menghasilkan berat molekul rendah dengan komposisi yang mengindikasikan jenis spesifik makromolekul. Campuran senyawa kemudian masuk ke kolom analisis GC-MS. Kondisi alat Py-GC-MS untuk analisis ini ditunjukkan pada Tabel 1.
Tabel 1 Kondisi alat GC-MS
Spesifikasi Keterangan
Merek Shimadzu Type GCMS-QP2010
Gas Helium
Detektor FID (Flame Ionization Detector)
Kolom Capiler Type Phase Rtx-5MS; 60 m; 0.25 mmID
Suhu kolom 50oC
Tekanan (kPa) 100
Laju alir kolom (mL/min) 0.85
Rasio pemisahan 112.3
6
HASIL
Kadar Air, Kadar Abu dan Rendemen Simplisia Daun Miana
Hasil analisis proksimat menunjukkan bahwa simplisia daun miana memiliki kadar air sebesar 3.31±1.02% dan kadar abu sebesar 10.16±0.41%. Ekstraksi daun miana menggunakan tiga pelarut yaitu air, etanol 70 %, dan aseton menghasilkan nilai rendemen yang berbeda-beda pada setiap pelarut. Nilai rendemen terbesar dihasilkan oleh pelarut air yaitu 18.63±0.33%, diikuti dengan pelarut etanol 70 %, dan aseton (Tabel 2).
Tabel 2 Hasil analisis proksimat simplisia dan rendemen ekstrak daun miana Sampel Kadar Air
Analisis fitokimia dilakukan untuk mengetahui kandungan senyawa metabolit sekunder dalam ekstrak secara kualitatif. Hasil analisis fitokimia ekstrak daun miana menggunakan pelarut air, etanol 70% dan aseton menunjukkan hasil positif adanya senyawa flavonoid, saponin, tanin, triterpenoid, dan steroid, sedangkan tidak terdeteksi untuk senyawa alkaloid (Tabel 3).
Tabel 3 Hasil analisis fitokimia
Jenis uji Air Etanol 70 % Aseton
Alkaloid - -
-Keterangan: + (terdapat senyawa), - (tidak terdapat senyawa)
Aktivitas Antifungi Ekstrak Daun Miana
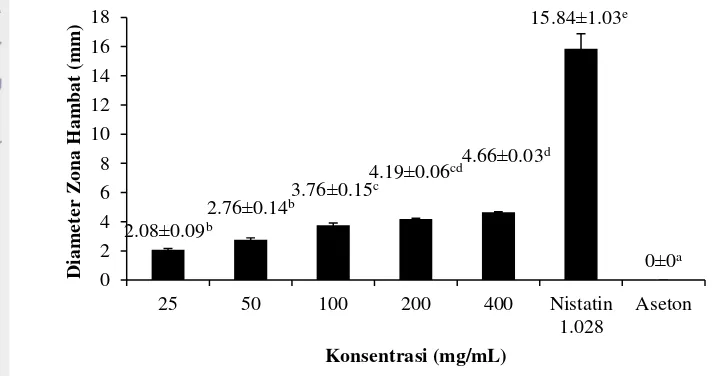
7 diameter zona hambat yang terbentuk. Nilai aktivitas antifungi tertinggi terdapat pada ekstrak aseton dengan konsentrasi 400 mg/mL menghasilkan zona hambat sebesar 4.66 mm dan masih termasuk dalam kategori lemah. Kontrol positif menggunakan nistatin dengan konsentrasi 1.028 mg/mL terbukti menghambat pertumbuhan C.albicans dengan menghasilkan zona hambat sebesar 15.84 mm. Nistatin menghasilkan zona hambat yang lebih besar dibandingkan dengan ekstrak aseton daun miana pada semua konsentrasi yang diujikan, hal ini menunjukkan bahwa nistatin lebih efektif dalam menghambat pertumbuhan C. albicans. Kontrol negatif menggunakan pelarut masing-masing ekstrak antara lain air (ekstrak air), DMSO 5% (ekstrak etanol 70%), dan aseton (ekstrak aseton) tidak membentuk zona hambat yang menunjukkan tidak terdapat aktivitas antifungi.
Analisis statistik menunjukkan bahwa ekstrak aseton pada konsentrasi 25 mg/mL tidak berbeda nyata (P<0.05) dengan konsentrasi 50 mg/mL tetapi berbeda nyata dengan (P<0.05) dengan konsentrasi 100 mg/mL, 200 mg/mL, dan 400 mg/mL. Ekstrak aseton konsentrasi 100 mg/mL tidak berbeda nyata (P<0.05) dengan konsentrasi 200 mg/mL tetapi berbeda nyata (P<0.05) dengan konsentrasi 25 mg/mL, 50 mg/mL, dan 400 mg/mL. Ekstrak aseton konsentrasi 400 mg/mL tidak berbeda nyata (P<0.05) dengan konsentrasi 200 mg/mL tetapi berbeda nyata (P<0.05) dengan konsentrasi 25 mg/mL, 50 mg/mL, dan 100 mg/mL. Kontrol positif nistatin konsentrasi 1.028 mg/mL berbeda nyata (P<0.05) dengan ekstrak konsentrasi 25 mg/ml, 50 mg/mL, 100 mg/mL, 200 mg/mL, dan 400 mg/mL.
Gambar 1 Diameter zona hambat Candida albicans ekstrak aseton
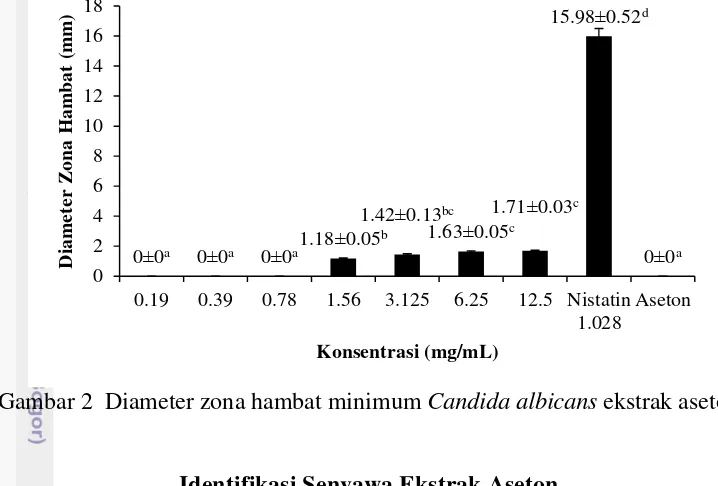
Konsentrasi Hambat Tumbuh Minimum (KHTM)
Penentuan konsentrasi hambat tumbuh minimum (KHTM) dilakukan untuk menentukan konsentrasi terkecil pada ekstrak aseton daun miana yang dapat menghambat pertumbuhan C. albicans. Ekstrak air dan ekstrak etanol 70% tidak dilakukan pada pengujian ini dikarenakan kedua ekstrak tidak menunjukkan aktivitas antifungi. Nilai KHTM ekstrak aseton daun miana terhadap C. albicans
adalah 1.56 mg/mL (Lampiran 5).
Analisis statistik menunjukkan bahwa ekstrak aseton pada konsentrasi 1.56 mg/mL tidak berbeda nyata (P<0.05) dengan konsentrasi 3.125 mg/mL tetapi berbeda nyata (P<0.05) dengan konsentrasi 6.25 mg/mL dan 12.5 mg/mL. Ekstrak
8
aseton pada konsentrasi 3.125 mg/mL tidak berbeda nyata (P<0.05) dengan konsentrasi 1.56 mg/mL, 6.25 mg/mL dan 12.5 mg/mL. Konsentrasi ekstrak aseton 0.19 mg/mL, 0.39 mg/mL, dan 0.78 mg/mL tidak menghasilkan zona hambat terhadap C. albicans. Kontrol positif nistatin konsentrasi 1.028 mg/mL berbeda nyata (P<0.05) dengan ekstrak aseton konsentrasi 1. 56 mg/mL, 3.125 mg/mL, 6.25 mg/mL, dan 12.5 mg/mL. Kontrol positif nistatin konsentrasi 1.028 mg/mL menghasilkan zona hambat C. albicans sebesar 15.98 mm lebih besar dibandingkan dengan ekstrak aseton daun miana pada semua konsentrasi yang diujikan (Gambar 2). Hal ini menunjukkan bahwa nistatin masih lebih efektif dibandingkan dengan ekstrak aseton dalam menghambat pertumbuhan C. albicans.
Gambar 2 Diameter zona hambat minimum Candida albicans ekstrak aseton
Identifikasi Senyawa Ekstrak Aseton
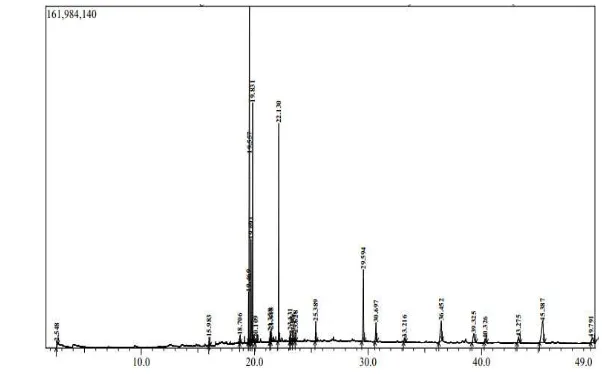
Ekstrak aseton daun miana yang memiliki aktivitas antifungi dianalisis komponen senyawa yang terkandung di dalamnya dengan menggunakan pirolisis kromatografi gas spektrometri massa. Kromatogram hasil analisis ekstrak aseton daun miana dengan GC memperlihatkan 25 puncak seperti yang ditunjukkan dalam Gambar 3. Masing-masing puncak diidentifikasi lebih lanjut dengan spektrometer massa, dimana setiap senyawa memiliki pola fragmentasi massa yang spesifik. Identifikasi dilakukan dengan membandingkan spektrum massa masing-masing puncak dengan senyawa-senyawa yang sudah diketahui dan terprogram dalam database GC-MS, sehingga dapat diduga senyawa-senyawa penyusun ekstrak aseton daun miana.
Berdasarkan data dari GC-MS, ekstrak aseton daun miana mengandung 15 senyawa aktif. Senyawa-senyawa utama yang teridentifikasi merupakan golongan senyawa terpenoid dan alkana. Senyawa tepenoid tersebut yaitu 2-Heksadesen-1-ol, 3,7,11,15-tetrametil (CAS) fitol pada puncak ke 5, 7, dan 10 dengan masing-masing konsentrasi sebesar 29.21%, 12.08%, dan 0.60% sehingga secara keseluruhan konsentrasinya sebesar 41.29% dan neofitadiena pada puncak ke 6 dan 11 dengan konsentrasi berturut-turut 6.94% dan 12.75% sehingga secara keseluruhan konsentrasinya sebesar 19.69%, dan senyawa golongan alkana yang teridentifikasi adalah tetratetrakontan (CAS) n-tetratetrakontan pada puncak ke 18,
0±0a 0±0a 0±0a 1.18±0.05
0.19 0.39 0.78 1.56 3.125 6.25 12.5 Nistatin
9 19, 20, 22, 23, 24, dan 25 dengan total konsentrasi sebesar 18.37%. Senyawa aktif lain yang teridentifikasi namun dalam jumlah yang lebih sedikit, diantaranya senyawa hidrokarbon, asam lemak, aldehid, dan vitamin E (Lampiran 10).
Gambar 3 Kromatogram komponen ekstrak aseton dengan GC-MS
PEMBAHASAN
Kadar Air, Kadar Abu dan Rendemen Simplisia Daun Miana
Daun miana yang digunakan pada penelitian ini terlebih dahulu dikeringkan dan ditentukan kadar air dan kadar abunya. Penentuan kadar air perlu dilakukan untuk mengetahui jumlah kandungan air dalam bahan. Kadar air berkaitan dengan mutu bahan selama masa penyimpanan. Pengeringan sampel dimaksudkan untuk menghindari kontaminasi mikroba. Mikroba memerlukan air untuk mempertahankan hidupnya. Kadar air yang tinggi dapat mempengaruhi pertumbuhan mikroba dan dapat merusak serta menurunkan aktivitas biologi bahan selama masa penyimpanan (Harjadi 1993). Kadar air yang baik dalam bahan adalah kurang dari 10% (Depkes 2008). Bahan dengan kadar air rendah tersebut dapat disimpan dalam waktu yang cukup lama. Hal ini dikarenakan kemungkinan bahan rusak oleh mikroba saat penyimpanan sangat kecil.
10
Penentuan kadar abu dilakukan untuk menentukkan adanya kandungan mineral/senyawa anorganik dalam suatu bahan. Pembakaran dengan suhu yang tinggi yaitu 600oC akan menghancurkan senyawa-senyawa organik ke dalam bentuk gas yang mudah terbang, sedangkan mineral sebagai senyawa anorganik akan tertinggal dalam bentuk abu yang dapat digunakan untuk analisis kualitatif dan kuantitatif. Kadar abu simplisia daun miana pada penelitian adalah 10.16±0.41% maka komponen anorganik dari simplisia berkisar 10.16% dari bobot keseluruhan. Kadar abu yang diperoleh dari penelitian tidak berbeda jauh dari penelitian Rahmawati (2008) sebesar 8.52%.
Daun miana yang akan diekstraksi terlebih dahulu dibuat serbuk dengan ukuran 100 mesh sehingga dapat meningkatkan efektivitas ekstraksi. Ukuran luas permukaan bahan merupakan salah satu hal yang mempengaruhi laju reaksi. Semakin kecil atau halus ukuran bahan yang digunakan maka semakin luas bidang kontak antara bahan dengan pelarutnya, sehingga semakin meningkatkan efektivitas ekstraksi (Tuyet dan Chuyen 2007).
Ekstraksi daun miana dilakukan menggunakan tiga pelarut yaitu air, etanol 70%, dan aseton. Pemilihan pelarut berdasarkan pada prinsip kelarutan “like dissolve like” artinya senyawa polar hanya larut dalam pelarut polar dan begitu
pula sebaliknya untuk senyawa-senyawa bersifat nonpolar. Air dan etanol 70 % dipilih berdasarkan ketertarikan senyawa aktif yang diduga berkhasiat antimikroba yang ingin diambil dari daun miana, yakni flavonoid, tanin, dan saponin. Aseton dipilih berdasarkan penelitian yang dilakukan Rahmawati (2008) terhadap aktivitas antibakteri daun miana menunjukkan bahwa ekstraksi dengan metode maserasi menggunakan pelarut aseton menghasilkan aktivitas antibakteri paling besar dibandingkan dengan pelarut air dan heksan.
Rendemen merupakan komponen senyawa bioaktif dalam daun miana yang terekstrak dengan pelarut yang digunakan. Rendemen hasil ekstraksi menghasilkan nilai yang berbeda-beda sesuai dengan pelarut yang digunakan. Pelarut air mampu menarik senyawa aktif dalam daun miana lebih banyak dibandingkan dengan etanol 70% dan aseton. Perbedaan rendemen tersebut terjadi karena terdapat perbedaan sifat kepolaran antara air, etanol 70%, dan aseton. Menurut markom et al. (2007), aseton, etanol 70%, dan air memiliki indeks Snyder (polaritas pelarut) yang semakin meningkat dengan nilai berturut-turut 5.4, 7.3, dan 9.0. Hal ini menunjukkan bahwa air memiliki sifat lebih polar dibandingkan dengan etanol 70% dan aseton, dan etanol 70% memiliki sifat lebih polar dibandingkan dengan aseton. Rendemen ekstrak air yang lebih tinggi dibandingkan dengan rendemen ekstrak etanol 70% dan aseton menunjukkan bahwa senyawa metabolit sekunder pada daun miana diduga lebih banyak yang bersifat polar.
Analisis Fitokimia
11 sama dan tempat pengambilan daun yang sama yaitu di daerah Bogor mengandung adanya senyawa tanin, saponin, dan triterpenoid, tetapi tidak terdeteksi adanya senyawa flavonoid dan steroid. Perbedaan ini diduga dikarenakan morfologi daun yang berbeda dimana pada penelitian ini memiliki daun yang lebih lebar dan besar, daun miana juga berasal dari rumpun tanaman yang berbeda, selain itu senyawa metabolit sekunder yang jumlahnya sangat sedikit pada daun miana sehingga tidak terdeteksi pada saat analisis, waktu analisis fitokimia yang tidak sama, dan diduga disebabkan oleh kondisi reagen kimia pada analisis fitokimia yang sudah lama atau telah rusak. Namun hasil penelitian ini sesuai dengan penelitian Ridwan dan Ayunina (2007) yang melaporkan bahwa daun miana memiliki kandungan flavonoid, tanin, saponin, dan steroid. Hasil penelitian Lisdawati et al. (2008) juga melaporkan bahwa daun miana mengandung senyawa flavonoid, triterpenoid, dan tannin.
Perbedaan pelarut yang digunakan pada proses ekstraksi memberikan hasil yang berbeda terhadap senyawa metabolit sekunder yang terdapat pada daun miana. Hasil analisis fitokimia menunjukkan bahwa pelarut yang memiliki kepolaran lebih rendah dapat menarik senyawa bioaktif yang bersifat nonpolar seperti steroid pada ekstrak aseton dan triterpenoid pada ekstrak etanol 70%. Senyawa metabolit sekunder yang bersifat polar seperti saponin dan tannin memberikan hasil positif untuk ekstrak air, etanol 70%, dan aseton.
Hasil penelitian Kumalasari dan Sulistyani (2011) melaporkan bahwa senyawa golongan polifenol, flavonoid dan saponin dalam ekstrak etanol batang Binahong mempunyai aktivitas antifungi terhadap Candida albicans. Hasil penelitian menunjukkan bahwa daun miana juga memiliki senyawa-senyawa aktif seperti tanin, flavonoid, saponin, steroid, dan terpenoid, senyawa-senyawa inilah yang diduga berperan dalam menghambat pertumbuhan C.albicans.
Aktivitas Antifungi dan Konsentrasi Hambat Tumbuh Minimum Ekstrak Daun Miana
12
Penentuan KHTM dilakukan setelah diperoleh data bahwa ekstrak aseton daun miana memiliki aktivitas antifungi. Penentuannya dilakukan dengan cara menentukan konsentrasi minimal yang dapat menghambat pertumbuhan mikroba uji (David dan Stout 1971). Nilai KHTM ekstrak aseton daun miana adalah 1.56 mg/mL dengan diameter zona hambat sebesar 1.18 mm (Lampiran 5). Nilai KHTM suatu antimikroba berlawanan dengan sensitivitas mikroba yang diuji, hal ini berarti bahwa suatu mikroba dikatakan memiliki sensitif yang tinggi terhadap suatu senyawa antimikroba bila memiliki nilai KHTM yang rendah. Nilai KHTM akan berbeda-beda untuk setiap mikroba dan antimikroba yang digunakan.
Davis dan Stout (1971) menggolongkan ketentuan kekuatan antimikroba menjadi 3 kategori. Kategori lemah jika diameter zona hambat yang terbentuk ≤ 5 mm, kategori sedang pada kisaran 5-10 mm, dan kategori kuat ≥ 10 mm. Ekstrak aseton daun miana pada konsentrasi tertinggi 400 mg/mL mampu menghambat C. albicans dengan zona hambat sebesar 4.66 mm. Zona hambat ini termasuk dalam kategori lemah, karena kurang dari 5 mm. Hasil ini menunjukkan sangat kecilnya aktivitas antifungi ekstrak aseton daun miana terhadap C. albicans. Bila dibandingkan dengan kontrol positif nistatin konsentrasi 1.028 mg/mL menghasilkan zona hambat yang jauh lebih besar (15.91 mm) dan termasuk dalam kategori sangat kuat. Nistatin masih terbukti efektif dalam menghambat C. albicans dibandingkan ekstrak aseton daun miana. Hasil penelitian Fauziah (2014) melaporkan ekstrak aseton daun sirih (Piper betle) pada konsentrasi 400 mg/mL menghasilkan diameter zona hambat terhadap C. albicans sebesar 18.4833 mm, termasuk dalam kategori antifungi yang kuat dan jauh lebih besar dibandingkan dengan ekstrak aseton daun miana pada konsentrasi yang sama. Walaupun aktivitasnya rendah, namun ekstrak aseton daun miana memberikan hasil positif dalam menghambat pertumbuhan C. albicans. Aktifitas yang rendah ini diduga disebabkan oleh ekstrak yang masih dalam bentuk ekstrak kasar sehingga konsentrasi senyawa aktif terlalu kecil dan masih mengandung banyak pengotor.
Ekstrak aseton memiliki aktivitas antifungi yang paling baik dibandingkan dengan ekstrak air dan etanol 70%. Hal ini disebabkan oleh kandungan senyawa metabolit sekunder yang tertarik oleh masing-masing pelarut, diduga senyawa yang berperan besar dalam penghambatan C. albicans adalah senyawa-senyawa yang memiliki kepolaran lebih rendah sehingga hanya mampu tertarik oleh pelarut aseton. Hal inilah yang menyebabkan tidak adanya aktivitas penghambatan C. albicans pada ekstrak air dan etanol 70%. Berdasarkan hasil analisis statistika pada tingkat kepercayaan 95%, perlakuan dengan perbedaan konsentrasi yang diujikan memberikan pengaruh nyata terhadap diameter zona hambat yang dihasilkan. Perbedaan konsentrasi yang diujikan, menghasilkan diameter zona hambat yang berbeda-beda, semakin tinggi konsentrasi yang diujikan maka semakin besar diameter zona hambat yang dihasilkan. Sesuai dengan penelitian Warsinah et al. (2011) bahwa semakin tinggi konsentrasi fraksi kulit batang kecapi (Sandoricum koetjape) menghasilkan kematian atau penghambatan pertumbuhan Candida albicans yang semakin besar.
Identifikasi Senyawa Ekstrak Aseton
(GC-13 MS). GC-MS merupakan metode untuk mengidentifikasi suatu senyawa, baik satu komponen maupun campuran. Keuntungan spektrometer massa adalah ketepatannya dalam menentukan fragmentasi dan molekul-molekul serta dapat mengidentifikasi komponen-komponen yang terdapat dalam jumlah kecil.
Senyawa utama dalam ekstrak aseton daun miana adalah senyawa turunan terpenoid yaitu 2-Heksadesen-1-ol, 3,7,11,15-tetrametil (CAS) fitol (41.29%). Senyawa fitol merupakan golongan senyawa asiklik diterpen alkohol yang merupakan bagian dari klorofil pada tanaman dan prekursor untuk pembentukan vitamin E. Fitol biasa digunakan dalam kosmetik, shampo, sabun toilet, pembersih rumah tangga karena menunjukkan aktivitas antimikroba, antikanker, dan antidiueretik (McGinty et al. 2010). Fitol menunjukkan aktivitas antimikroba yang tinggi terhadap mikroba pada makanan (Pillai dan Nair 2013). Fitol juga dilaporkan memiliki aktivitas antimikroba, antivirus, antioksidan dan antitumor (Mckay dan Blumber 2006). Senyawa terbesar kedua masih termasuk ke dalam turunan senyawa terpenoid, yaitu neofitadiena (19.69%). Neofitadiena dilaporkan memiliki aktivitas antipiretik, analgesik, anti-inflamsi, antimikroba, dan antioksidan (Venkata et al. 2012). Senyawa terpenoid yang bersifat lipofilik dapat menyebabkan gangguan pada membran sel fungi dan dapat melarutkan lipid yang terdapat pada membran sel (Cowan 1999; Panda 2010). Senyawa terbesar ketiga adalah golongan senyawa alkana yaitu tetratetrakontan (18.37%). Tetratetrakontan adalah senyawa hidrokarbon yang dilaporkan memiliki aktivitas antiinflamasi dan aktivitas analgesik (Pandurangan et al. 2008) dan antibakteri (Kumar et al. 2009).
Senyawa yang diduga berperan besar dalam aktivitas antifungi ekstrak aseton daun miana terhadap pertumbuhan C.albicans adalah dua senyawa terbesar yang telah disebutkan diatas. Selain itu senyawa-senyawa lain yang memiliki aktifitas antifungi namun dalam jumlah yang kecil diantaranya senyawa turunan asam lemak seperti asam 1,2-Benzenadikarbosiklik, bis(2-etilhexil) ester (CAS) (turunan asam ftalat) dan asam heksadekanoat, metil ester (CAS) (turunan asam palmitat) dan alfa-tokoferol-asetat (vitamin E).
SIMPULAN DAN SARAN
Simpulan
Daun miana memiliki potensi yang lemah sebagai antifungi. Aktivitas antifungi terbesar dihasilkan dari ekstrak aseton pada konsentrasi 400 mg/mL dengan diameter zona hambat sebesar 4.66 mm. Nilai konsentrasi hambat tumbuh ekstrak aseton daun miana sebesar 1.56 mg/mL. Hasil analisis statistik menunjukkan bahwa perbedaan variasi konsentrasi ekstrak yang diujikan pada taraf nyata 95% berpengaruh nyata terhadap diameter zona hambat C. albicans. Ekstrak aseton daun miana sebagian besar mengandung senyawa fitol (41.29%).
Saran
14
oleh ekstrak aseton daun miana dan analisis mekanisme ekstrak aseton daun miana dalam mengambat pertumbuhan jamur.
DAFTAR PUSTAKA
[AOAC] Association of Official Analytical Chemist. 2006. Official Method of Analysis. Washington DC (US): Association of Official Analytical Chemist Inc.
Bidarigh S, Khoshkholgh PMRM, Issazadeh KMA. 2011. In Vitro anti-candida activity of Ficus lyrata L. ethyl acetat latex extract and nystatin on clinical Isolates and standard strains of Candida albicans. IPCBEE 18: 115-119. Bintang M. 1993. Studi antimikroba dari Streptococcus lactis BCC2295.
[disertasi]. Bandung (ID): Program Doktor ITB.
[BPOM RI] Badan Pengawasan Obat dan Makanan Republik Indonesia. 2004.
Ekstrak Tumbuhan Indonsia Vol.2. Jakarta (ID):BPOM.
Cowan MM. 1999. Plant products as antimicrobial agents. Clinical Microbiology Review 12(4): 564-582. [internet]. [diunduh 2014 April 3]. Tersedia pada http://www.heart-intl.net/HEART/120104/PlantProductsasAntimicribial.pdf. David WW, Stout TR. 1971. Disc plate method of microbiological antibiotic assay: factors influencing variability and error. Appl Microbiol 22 (4): 659-665.
[Depkes] Departemen Kesehatan. 2008. Farmakope Herbal Indonesia. Edisi 1. Jakarta (ID): DepKes RI.
Gozali D, Rusmiati D, Utama P. 2009. Formulasi dan Uji Stabilitas Mikroemulsi Ketokonazole Sebagai Antijamur Candida albicans dan Tricophyton mentagrophytes. Farmaka 7 (2): 54-67.
HarborneJB. 1987. Metode Fitokimia. Bandung (ID): Institut Teknologi Bandung. Harjadi W. 1993. Ilmu Kimia Analitik Dasar. Jakarta (ID): Gramedia.
Fauziah D. 2014. Aktivitas penghambatan Candida albicans oleh ekstrak daun sirih hijau (Piper betle) in vitro. [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Ferrer J. 2000. Vaginal candidosis: epidemiological and etiological factors.
Int J Gynecol Obstet 71(1):1–7.
Hardiyanti Y, Djaswir D, Adlis S. 2013. Ekstraksi dan uji antioksdian senyawa antosianin dari daun miana (Coleus sutellarioides L (Benth) serta aplikasinya pada minuman. J. Kimia Unand 2(2): 44-50.
Kumalasari E, Sulistyani N. 2011. Aktivitas antifungi ekstrak etanol batang binahong (Anredera cordifolia (Tenore) Steen) Terhadap Candida albicans
15 Kumar A, Jayachandran T, Aravindhan P, Deecaraman D, Iiavarasan R, Padmanabhan N. 2009. Neutral components in the leaves and Seeds of
Syzigium cumini. African Journal of Pharmacy and Pharmacology 3(11): 560–561
Lanchares JL, Hernande ML. 2000. Recurrent vaginal candidiasis changes in etiopathogenical pattern. Int. J Gynecol and Obstet 71(1):29–35.
Lisdawati, Vivi. 2008. Karakterisasi daun miana (Plectranthus scutellaroides [L] Benth) dan buah sirih (Piper betle L) secara fisiko kimia dari ramuan local antimalarial daerah Sulawesi Utara. Media Litbang Kesehatan, Badan LitbangKes.
Markom M, Hasan M, Daud WRW, Singh H, Jaim JM. 2007. Extraction of hydrolysable tannins from Phyllanthus niruri Linn: Effects solvents and extraction methods, Separation a Purification Technology, 52, pp. 487-496. Mattjik AA, Sumertajaya IM. 2006. Perancangan Percobaan dengan
Aplikasi SAS dan Minitab, Jilid I. Bogor (ID): IPB Press.
McGinty D et al. 2010. Fragrance material review on phytol. Food and Chemical Toxicology 48: 59-63.
Mckay DL, Blumberg JB. 2006. A review of the bioactivity and health benefits of
peppermint tea ( L.). Phytother Res 20: 619-633.
Noer WHS. 2007. Hubungan pengetahuan dan sikap remaja puteri tentang keputihan (flour albus) dengan upaya pencegahannya (studi pada siswi SMS Tunas Patria Ungaran [skripsi]. Semarang (ID): Fakultas Kesehatan Masyarakat, Universitas Dipenogoro.
Panda K, Brahma SS, Dutta K. 2010. Selective antifungal action of crude extracts of Cassia fistula L: A preltminary study on Candida and Aspergilllus spesies. Malaysian Journal of Microbiology 6(1): 62-68.
Pandurangan A, Khosa RL, Hemalatha S. 2008. Anti-inflammatory and analgesic activity of Ichnocarpus frutescens. Pharmacology online 1:392-399.
Pillai LS, Nair BR. 2013. GC-MS analysis of Chloroform extract of Cleome burmanni W. and A. (Cleomaceae). Int J Pharm Sci Res 4(5): 1930-1933. Rahmawati F. 2008. Isolasi dan karakterisasi senyawa antibakteri ekstrak daun
miana (Coleus scuttelariodes L. Benth). [tesis]. Bogor (ID): Sekolah Pascasarjana Institut Pertanian Bogor.
Ridawati, Betty SL, Ita D, Wellyzar S. 2011. Aktivitas antifungal minyak atsiri jinten putih terhadap Candida parapsilosis SS25, C. orthopsilosis NN14, C. metapsilosis MP27, dan C. etchellsii MP18. Makara Sains 15(1): 58-62. Ridwan Y, Ayunina YQ. 2007. Fitokimia dan aktivitas anthelmintika terhadap
cacing pita ayam dari beberapa varietas miana (Coleus blumei benth) secara in vitro. J. Protein 14(1):17-20
16
skrining fitokimianya [skripsi]. Surakarta (ID): Universitas Muhamadiyah Surakarta. http://etd.eprints.ums.ac.id/5267/1/K100050305.pdf.
Safriani NR. 2014. Ekstrak daun miana (Coleus scutellarioides [L] Benth) sebagai antifungi Candida tropicalis in vitro. [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Soemiati A, Berna E. 2002. Uji pendahuluan efek antijamur infus daun sirih (Piper betle L.), kulit buah delima (Punica granatum L.) dan rimpang kunyit (Curcuma domestica Val.) terhadap jamur Candida albicans.
Makara Sains 6(3).
Sundari D, Winarno MW. 1996. Efek farmakologi dan fitokimia komponen penyusun jamu keputihan. [internet]. [diunduh 2014 April 1]. Tersedia pada: http://www.kalbe.co.id/files/cdk/07EfekFarmakologiFitokimiaKomponen10 8.pdf/07EfekFarmakologiKomponen108.html.
Tuyet T, Chuyen NV. 2007. Anthihiperglicemic activity of an aqueos extract from flower buds of Clistocalyx operculatus (Roxb.). Merr and Perry. Biosci Biotechnol Biochem 71: 69-76.
Venkata RB et al. 2012. Antibacterial, antioxidant activity and GC-MS analysis of
Eupatorium odoratu. Asian J Pharm Clin Res 5 (2): 99-106.
Warsinah, Kusumawati E, Sunarto. 2011. Identifikasi senyawa antifungi dari kulit batang kecapi (Sandoricum koetjape) dan aktivitasnya terhadap Candida albicans. Majalah Obat Tradisional 16(3): 165-173.
Wijayakusuma HS. 1996. Tanaman Berkhasiat obat di Indonesia. Cetakan kedua. Jakarta (ID): Pustaka Kartini. Hal.7
17 Lampiran 1 Kadar air simplisia daun miana
No Lampiran 2 Kadar abu simplisia daun miana
No
18
Lampiran 4 Uji aktivitas antifungi ekstrak daun miana terhadap Candida albicans
Ekstrak Konsentrasi (mg/mL)
Diameter Zona Hambat (mm)
Ulangan 1 Ulangan 2 Ulangan 3 Rataan
Air 400 0 0 0 0
200 0 0 0 0
100 0 0 0 0
50 0 0 0 0
25 0 0 0 0
Etanol 70 % 400 0 0 0 0
200 0 0 0 0
100 0 0 0 0
50 0 0 0 0
25 0 0 0 0
Aseton 400 4.68 4.63 4.68 4.66±0.03
200 4.23 4.13 4.23 4.19±0.06
100 3.93 3.73 3.64 3.76±0.15
50 2.68 2.93 2.68 2.76±0.14
25 1.97 2.13 2.13 2.08±0.09
Nistatin 1.028 15.62 14.93 16.96 15.84±1.03
Lampiran 5 Uji KHTM ekstrak aseton daun miana terhadap C. albicans
Konsentrasi (mg/mL)
Diameter Zona Hambat (mm)
Rerata Ulangan 1 Ulangan 2 Ulangan 3
12.5 1.73 1.68 1.73 1.71±0.03
6.25 1.58 1.65 1.68 1.63±0.05
3.125 1.43 1.58 1.33 1.44±0.13
1.56 1.18 1.23 1.13 1.18±0.05
0.78 0 0 0 0
0.39 0 0 0 0
0.19 0 0 0 0
Nistatin (1.028) 16.58 15.73 15.63 15.98
Lampiran 6 Foto uji aktivitas antifungi ekstrak daun miana Ekstrak akudes
19 Ekstrak etanol 70%
Ul 1 Ul 2 Ul 3 Ekstrak aseton
Ul 1 Ul 2 Ul 3 Keterangan:
1. Kontrol negatif akuades (ekstrak akuades), DMSO 5% (ekstrak etanol 70%) dan aseton (pelarut aseton)
2. Kontrol positif (nistatin 1.028 mg/mL) 3. Ekstrak konsentrasi 400 mg/mL 4. Ekstrak konsentrasi 200 mg/mL 5. Ekstrak konsentrasi 100 mg/mL 6. Ekstrak konsentrasi 50 mg/mL 7. Ekstrak konsentrasi 25 mg/mL 8. Ekstrak konsentrasi 12.5 mg/mL
Lampiran 7 Foto uji KHTM ekstrak aseton
20
Keterangan:
1. Kontrol negatif (pelarut aseton)
2. Kontrol positif (nistatin 1.028 mg/mL) 3. Ekstrak konsentrasi 6.25 mg/mL 4. Ekstrak konsentrasi 3.125 mg/mL 5. Ekstrak konsentrasi 1.56 mg/mL 6. Ekstrak konsentrasi 0.78 mg/mL 7. Ekstrak konsentrasi 0.39 mg/mL 8. Ekstrak konsentrasi 0.19 mg/mL
Lampiran 8 Uji fitokimia ekstrak daun miana
Jenis Uji Ekstrak
Akuades Etanol 70% Aseton
Alkaloid
Flavonoid
Saponin
Tanin
21 Lampiran 9 Hasil analisis statistika uji aktivitas antifungi dan uji KHTM ekstrak
aseton daun miana
ANOVA
Sum of Squares df Mean Square F Sig.
Between Groups 473.698 6 78.950 493.362 .000
Within Groups 2.240 14 .160
Total 475.939 20
Uji lanjut Duncan
konsentrasi N Subset for alpha = 0.05
1 2 3 4 5
0 3 .0000
25 3 2.0743
50 3 2.7583
100 3 3.7617
200 3 4.1917 4.1917
400 3 4.6583
1.028 3 15.8367
Sig. 1.000 .055 .209 .175 1.000
ANOVA
Sum of Squares df Mean Square F Sig.
Between Groups 633.092 8 79.137 2.527E3 .000
Within Groups .564 18 .031
Total 633.656 26
Uji lanjut Duncan
konsentrasi N Subset for alpha = 0.05
1 2 3 4
0 3 .0000
0.19 3 .0000
0.39 3 .0000
0.78 3 .0000
1.56 3 1.1750
3.125 3 1.3917 1.3917
6.25 3 1.6333
12.5 3 1.7083
1.028 3 15.9800
Sig. 1.000 .151 .051 1.000
22
Lampiran 10 Komponen ekstrak aseton dengan GC-MS
Puncak Waktu
2 15.983 7904380 0.51 Naphthalene,
1,2,3,4-tetrahydro-1,4,6-trimethyl- (CAS)
3 18.706 5479238 0.36 1-Dodecanol, 3,7,11-trimethyl-(CAS)
Hexahydrofarsenol
4 19.469 41090726 2.67 2-Hexadecene, 3,7,11,15-tetramethyl
5 19.557 448968282 29.21 2-Hexadecen-1-ol,
3,7,11,15-tetramethyl (CAS) Phytol
6 19.691 106733111 6.94 Neophytadiene
7 19.831 185652497 12.08 2-Hexadecen-1-ol,
3,7,11,15-tetramethyl (CAS) Phytol
8 20.109 7560427 0.49 Hexadecanoic acid, methyl ester (CAS)
Methyl palmitate
9 21.358 7475925 0.49 9,12,15-Octadecatrienoic acid, methyl
ester, (Z,Z,Z)- (CAS) Methyl linolenate
10 21.448 9201888 0.60 2-Hexadecen-1-ol,
3,7,11,15-tetramethyl (CAS) Phytol
11 22.130 196029672 12.75 Neophytadiene
12 23.131 9249776 0.60 9-Octadecenal, (Z)- (CAS)
CIS-OCTADEC-9-ENAL
13 23.293 5639982 0.37 Cyclohexane, eicosyl- (CAS)
1-Cyclohexyleicosane
14 23.456 7207498 0.47 9-Tricosene, (Z)- (CAS) Muscalure
15 23.628 6831613 0.44 Hexanedioic acid, dioctyl ester (CAS)
Dioctyl
16 25.389 20805813 1.35 1,2-Benzenedicarboxylic acid,
bis(2-ethylhexyl) ester (CAS) Bis(2-ethylhexyl)
17 29.594 140119102 9.12 2,6,10,14,18,22-Tetracosahexaene,
2,6,10,15,19,23-hexamethyl- (CAS)
18 30.697 35699028 2.32 Tetratetracontane (CAS)
n-Tetratetracontane
19 33.216 9107293 0.59 Tetratetracontane (CAS)
n-Tetratetracontane
20 36.452 73308889 4.77 Tetratetracontane (CAS)
n-Tetratetracontane
21 39.325 36389101 2.37 Alpha-tocopherol-acetat (Vitamin E
acetat)
22 40.326 9670249 0.63 Tetratetracontane (CAS)
n-Tetratetracontane
23 43.275 20539574 1.34 Tetratetracontane (CAS)
n-Tetratetracontane
24 45.387 110504156 7.19 Tetratetracontane (CAS)
n-Tetratetracontane
25 49.791 23569406 1.53 Tetratetracontane (CAS)
n-Tetratetracontane
23
RIWAYAT HIDUP
Penulis dilahirkan di Indramayu pada tanggal 15 Mei 1992 dari ayah bernama Syahroni, SPd.I dan ibu bernama Kuswinih. Penulis merupakan anak kedua dari 3 bersaudara. Pendidikan penulis dimulai dari SD Negeri Muntur 1 kemudian melanjutkan pendidikan ke jenjang Sekolah Menengah Pertama di SMP Negeri 1 Losarang. Tahun 2010 penulis menyelesaikan pendidikan Sekolah Menengah Atas di SMA Negeri 1 Sindang, Indramayu dan pada tahun yang sama lolos seleksi masuk Institut Pertanian Bogor (IPB) melalui jalur Undangan Seleksi Masuk IPB (USMI) dan diterima di Departemen Biokimia, Fakultas Matematika dan Ilmu Pengetahuan Alam.
Selama mengikuti perkuliahan penulis pernah menjadi asisten praktikum mata kuliah Biologi Dasar tahun ajaran 2011/2012 dan 2012/2013, asisten praktikum mata kuliah Biokimia Umum, Pengantar Penelitian Biokimia, dan Struktur dan Fungsi Subseluler tahun ajaran 2013/2014. Penulis juga aktif dalam kegiatan organisasi kampus, diantaranya Anggota Divisi Bioanalisis Community Research and Educatioan of Biochemistry (CREB’s) periode 2011/2012 dan Bendahara Ikatan Mahasiswa Darma Ayu (IKADA) Bogor tahun 2011-2012. Penulis juga pernah aktif dalam beberapa kepanitiaan seperti panitia Biochemistry Champion League tahun 2011, Populer tahun 2011, SPIRIT FMIPA tahun 2012, EXPLO SCIENCE FMIPA tahun 2012, Masa Perkenalan Kampus Mahasiswa Biokimia tahun 2012, Seminar dan Kajian Ilmiah Kehalalan Lomba Karya Ilmiah 2012, Pesta Sains Nasional tahun 2012, dan IPB Art Contest 2013.