KARAKTERISASI SIMPLISIA, SKRINING FITOKIMIA DAN ISOLASI SENYAWA FLAVONOIDA DARI DAUN TUMBUHAN
PACAR AIR (Impatiens balsamina L.)
SKRIPSI
Oleh : BUSTOMI
071524007
FAKULTAS FARMASI
KARAKTERISASI SIMPLISIA, SKRINING FITOKIMIA DAN ISOLASI SENYAWA FLAVONOIDA DARI DAUN TUMBUHAN
PACAR AIR (Impatiens balsamina L.)
SKRIPSI
Diajukan untuk melengkapi salah satu syarat untuk mencapai Gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
Oleh: BUSTOMI NIM : 071524007
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
Pengesahan Skripsi
KARAKTERISASI SIMPLISIA, SKRINING FITOKIMIA DAN ISOLASI SENYAWA FLAVONOIDA DARI DAUN TUMNBUHAN PACAR AIR
( Impatiens balsamina L.) Oleh:
BUSTOMI NIM 071524007
Dipertahankan di Hadapan Panitia Penguji Skripsi Fakultas Farmasi
Universitas Sumatera Utara Pada tanggal : Maret 2010
Pembimbing I, Panitia Penguji,
(Dra. Aswita Hafni Lubis, M.Si., Apt) (Dra.Siti Aman, MS., Apt ) NIP. 195304031983032001 NIP. 194508281974122001
Pembimbing II, (Drs Panal Sitorus, M.Si., Apt) NIP. 195310301980031002
(Dra. Suwarti Aris, M.Si., Apt) (Dra. Marline Nainggolan, MS., Apt)
NIP. 195107231982032001 NIP. 195709091985112001
(Dra. Aswita Hafni Lubis, M.Si., Apt) NIP. 195304031983032001
Dekan Fakultas Farmasi
KATA PENGANTAR
Puji dan syukur kehadirat Allah SWT yang telah melimpahkan rahmat dan hidayahNya sehingga penulis dapat menyelesaikan penelitian dan penulisan skripsi yang berjudul “ Karakterisasi Simplisia, Skrining Fitokimia dan Isolasi Senyawa Flavonoida dari Daun Tumnbuhan Pacar Air (Impatiens balsamina L.)” untuk memenuhi syarat guna mencapai gelar sarjana farmasi pada Fakultas Farmasi Universitas Sumatera Utara. Salah satu tumbuhan obat yang berkhasiat sebagai obat adalah tumbuhan pacar air, namun sebagian masyarakat hanya mengetahui bahwa tumbuhan pacar air digunakan hanya sebagai tanaman hias dan pewarna kuku. Oleh karena itu dalam penelitian ini peneliti tertarik untuk melakukan skrining fitokimia dan isolasi senyawa flavonoida, dimana senyawa flavonoida berkhasiat sebagai antioksidan, antiinflamasi dan lain-lain. Hendaknya hasil penelitian ini menjadi langkah awal yang diharapkan sehingga daun pacar air dapat digunakan sebagai obat oleh masyarakat secara luas.
Pada kesempatan ini dengan segala kerendahan hati penulis mengucapkan terimakasih yang tak terhingga kepada Ayahanda Simin dan ibunda Lasinem, serta kakanda Sulasno, Ngatini dan adinda tersayang Minto, Toni, Bowo dan Lastry yang telah dengan penuh kesabaran dan kasih sayang selalu memberi dorongan, bimbingan, nasehat serta doa.
1. Bapak Prof. Dr. Sumadiohadisahputra, Apt., selaku Dekan Fakultas Farmasi Universitas Sumatera.
2. Ibu Dra. Aswita Hafni Lubis, M.Si., Apt.,. dan Dra. Suwarti Aris, M.Si., Apt., selaku dosen pembimbing yang telah membimbing penulis dengan penuh kesabaran selama penelitian hingga selesainya skripsi ini.
3. Ibu Dra.Siti Aman, MS., Apt., Dra. Marline Nainggolan, M.S., Apt., dan Bapak Drs. Panal Sitorus, M.Si., Apt., selaku penguji yang telah menguji dan memberikan masukan kepada penulis dalam penyusunan skripsi ini
4. Bapak Drs. Awaluddin Saragih., Apt., selaku kepala Laboratorim Farmakognosi yang telah memberikan izin dan fasilitas untuk penulis sehingga dapat mengerjakan dan menyelesaikan penelitian Asisten Laboratorim obat tradisional, Farmakognosi dan staf – staf farmasi yang banyak memberikan dorongan dan bantuan selama penelitian
5. Semua mahasiswa/wi farmasi khususnya farmasi ekstensi 2007 yang tidak disebutkan satu persatu, terimakasih untuk semangat dan do’a nya.
Semoga skripsi ini dapat menjadi sumbangan yang berarti bagi ilmu pengetahuan khususnya pada ilmu farmasi. Penulis mengharapkan kritik dan saran demi kesempurnaan skripsi ini.
Medan, Maret 2010 Penulis
KARAKTERISASI SIMPLISIA, SKRINING FITOKIMIA DAN ISOLASI SENYAWA FLAVONOIDA DARI DAUN TUMBUHAN
PACAR AIR (Impatien balsamina L.) ABSTRAK
Tumbuhan yang digunakan pada penelitian ini adalah daun dari tumbuhan pacar air (Impatiens balsamina L.) tumbuhan pacar air ini karakterisasinya belum terdapat di buku monografi tumbuhan Materia Medika Indonesia (MMI). Telah dilakukan uji karakterisasi, ekstraksi dan isolasi senyawa flavonoida dari daun pacar air (Impatiens balsamina L.) hasil karakterisasi kadar air (7.99%), kadar sari larut dalam air (17.62%), kadar sari larut dalam etnol (10.02%), kadar abu total ( 1.67%), kadar abu yang tidak larut dalam asam (0.29%) dan hasil skrining fitokimia positif untuk senyawa flavonoida dan glikosida. Ekstraksi dilakukan secara perkolasi menggunakan pelarut etanol 96 %, ekstrak etanol yang diperoleh dilakukan fraksinasi cair-cair menggunakan pelarut n-heksan, kloroform dan etilasetat. Hasil fraksinasi di lakukan kromatografi kertas (KKt) dengan berbagai fase gerak. Hasil KKt dari masing-masing fraksi terbaik pada fraksi etilasetat dengan pengembang asam klorida 5%. Hasil KKt kemudian dilakukan KKt preparatif, diperoleh tiga noda yaitu PEa1 Rf 0.65, PEa2 Rf 0.25 dan PEa3 Rf 0.05 dengan fase gerak asam klorida 5%. Isolat PEa1 yang diperoleh di karakterisasi dengan spektropotometri UV dengan menggunakan pereaksi geser (shift reagent) hasil penafsiran spektropotometri UV terhadap PEa1 adalah senyawa gologan flavonoida isoflavon yang mempunyai gugus o-diOH pada cincin A, pada atom C6 dan 7.
CHARACTERIZATION OF SYMPLICIA, PHYTOCHEMICAL SCREENING AND ISOLATION OF FLAVONOIDA COMPOUND FROM
PACAR AIR (Impatients balsamina L.) LEAF ABSTRACT
The plant used in this research is pacar air (Impatients balsamina L.) leaf. The characterization of this plant was not found in monography literature of Indonesian Medical Material Plant (MMI). The characterization test, extractation and isolation of flavonoida compound from pacar air leaf have been conducted. Charaterization result of water concentration was 7,99%, concentration of water soluble extract was 17,62%, the concentration of ethanol soluble extract was 10,02%, total concentration of ash 1,67%, the concentration of acid insoluble ash was 0,29% and screening result of positive phytochemical of flavonoida ang glycoside compound. Extration was conducted by percolation is fractioned by liquid-liquid using the hexane solvent, chloroform and etilacetat. The fractionation result was conducted through paper chromatography (KKt) with several phases of motion. The KKt result of each fraction was best found in fraction of etilacetat with acid chloride expander of 5 %. The KKt result is then conducted with preparative KKt, three stains have been gained, they were PEaI Rf 0,65, Pea2 Rf 0,25 and Pea3 Rf 0,05 with phase of chloride acid motion 5%. The isolation of PEaI gained is characterized with UV spectrophotometer by using shift reagent, the interpretation result of UV spectrofotometer on PEaI is compound of flavonoida isoflavon class with cluster of o-diOH in A ring, in atom C6 and 7.
Keywords: characterization, phytrochemical screening and isolation of flaonoida
DAFTAR ISI
Halaman
JUDUL ………. i
LEMBAR PENGESAHAN ... ii
KATA PENGANTAR... ... ... iii
ABSTRAK ... v
ABSTRACT ... vi
DAFTAR ISI ... ... vii
DAFTAR TABEL ... x
DAFTAR GAMBAR ... xi DAFTAR LAMPIRAN ... xiii BAB I PENDAHULUAN ... 1
1.1 Latar belakang ... 1
1.2 Perumusan masalah ... 3
1.3 Hipotesis ... 3
1.4 Tujuan penelitian ... 3
1.6 Manfaat penelitian ... 4
BAB II TINJAUAN PUSTAKA ... 5
BAB III METODE PENELITIAN ... 21
2.1 Alat-alat ... 21
2.2 Bahan-bahan ... 21
2.3.1 Larutan pereaksi Meyer... 22
2.3.2 Larutan pereaksi Dragendrof ... 22
2.3.3 Larutan pereaksi Bouchardat ... 22
2.3.4 Larutan pereaksi Molish ... 22
2.3.5 Larutan pereaksi Liberman Bouchardat ... 22
2.3.6 Larutan pereaksi besi (III) klorida 1% ... 23
2.3.7 Larutan pereaksi timbal (II) asetat ... 23
2.3.8 Larutan pereaksi natrium hidroksida 2 N ... 23
2.3.9 Larutan pereaksi asam klorida 2 N ... 23
2.3.10 Larutan aluminium (III) klorida 5% ... 23
2.4 Pengumpulan, identifikasi dan pengolahan sampel ... 23
2.4.1 Pengumpulan sampel ... 23
2.4.2 Identifikasi sampel ... 24
2.4.3 Pengolahan sampel ... 24
2.5 Pemeriksaan karakterisasi simplisia ... 24
2.5.1 Pemeriksaan makroskopik ... 24
2.5.2 Pemeriksaan mikroskopik ... 25
2.5.3 Penetapan kadar air ... 25
2.5.4 Penetapan kadar abu total ... 26
2.5.5 Penetapan kadar abu yang tidak larut dalam asam ... 26
3.5.6 Penetapan kadar sari larut dalam air ... 26
2.5.7 Penetapan kadar sari larut dalam etanol ... 27
2.6.2 Pemeriksaan flavonoida ... 27
2.6.3 Pemeriksaan tanin ... 28
2.6.4 Pemeriksaan glikosida ... 28
2.6.5 Pemeriksaan saponin... 28
2.6.6 Pemeriksaan steroida/ triterpenoida ... 29
2.6.7 pemeriksaan minyak tsirih ... 29
2.7 Pembuatan Ekstrak ... 29
2.8 Ektraksi cair-cair senyawa flavonoida terhadap ekstrak Etanol ... 30
2.9 Analisa masing-masing fraksi dilakukan secara Kromatografi kertas... 30
2.10 Pemeriksaan senyawa flavonoid dari fraksi etilasetat secara KKt ... 31
2.11 Uji kemurnian senyawa ... 32
2.12 Karakterisasi isolat ... 32
2.12.1 Karakterisasi Isolat dengan Spektrofotometri Ultraviolet dengan Penambahan Pereaksi geser ... 32
BAB IV HASIL DAN PEMBAHASAN ... 34
BAB V KESIMPULAN DAN SARAN ... 38
4.1 Kesimpulan ... 38
4.2 Saran .. ... 38
BAB IV DAFTAR PUSTAKA ... 39
DAFTAR TABEL
Tabel Halaman
1. Makroskopik simplisia daun tumbuhan pacar air ... 44 2. Hasil pemeriksaan karakterisasi serbuk simplisia daun pacar
DAFTAR GAMBAR
Gambar Halaman
1. Tumbuhan pacar air ( Impatiens balsamina L). ... 41
2. Daun tumbuhan pacar air ... 41
3. Simplisia daun tumbhan pacar air ... 43
4. Simplisia serbuk pacar air... 43
5. Mikroskopik serbuk simplisia daun pacar air perbesaran 10 x 4045 ... 45
6. Bagan I pembuatan ekstrak serbuk simplisia daun tumbuhan pacar air ... 53
7. Bagan 2 metode penelitian... 54
8. Bagan 2 fraksinasi cair-cair senyawa flavonoida dari Ekstrak etanol... 55
9. Bagan 4 isolasi senyawa flavonoida dari fraksi etilasetat dengan KKt ... 56
10. Krmatogram masing-masing fraksi ... 57
11. Kromatogram fraksi etilasetat dengan beberapa fase gerak 62
12 KKt preparatif fraksi etilasetat ... 63
13. KKt Kualitatif PEa1 fraksi etilasetat ... 64
14. Kkt Kualitatif Pea2 fraksi etilasetat ... 65
15 . Kromatogram KKt Dua Arah Isolat PEaI ... 66
16. Kromatogram KKt dua Arah Isolat PEa2 ... 67
17. Spektum sinar UV larutan isolat PEaI dalam metanol ... 68
penambahan NaOH dibandingkan dengan spektrum yang
diukur setelah 5 menit ... 70 20. Spektrum sinar UV larutan isolat PEaI dalam
penambahan AlCl3 dibandingkan dengan spektrum isolat
dalam metanol ... 71 21. Spektrum sinar UV larutan isolat PEaI dalam
penambahan AlCl 3 dibandingkan dengan spektrum isolat
dalam HCL... 72 22. Spektrum sinar UV larutan isolat PEaI dalam
DAFTAR LAMPIRAN
Lampiran Halaman
1. Gambar tumbuhan pacar air... ... 41
2. Hasil Identifikasi Tumbuhan... 42
3. Gambar simplisia tumbuhan pacar air ... 43
4. Makroskopik simplisia daun tumbuhan pacar air ... 44
5. Mikroskopik serbuk daun pacar air ... 45
6. Perhitungan hasil pemeriksan karasteristik simplisia. ... 46
7. Hasil skrining fitokimia dari daun pacar air ... ...52
8. Bagan pembutan ekstrak serbuk simplisia daun pacar air (Impatiens balsaminna L.)…... …..53
9. Bagan metode penelitian ... …..54
10. Bagan fraksinasi cair-cair senyawa flavonoida dari ekstrak etanol. …. . ... .55
11. Bagan isolasi senyawa flavonoida dari fraksi etilasetat dengan KKt ... …. 56
12. Kromatogram masing-masing fraksi ... …..57
13. Kromatogram fraksinasi etilasetat dengan beberapa fase gerak ... …..62
14. KKt preparatif fraksi etilasetat ... …63
15. KKt kualitatif PEa1 dari fraksi etilasetat... 64
20. KKt kualitatif PEa2 dari fraksi etil asetat... 65
21. Kromatogram KKt dua arah dari isolat PEa1 dari fraksi etilasetat ... ...66
22. Kromatogram KKt dua arah dari isolat PEaII dari fraksi etilasetat ... ...67
23. Spektum sinar UV larutan isolat PEaI dalam metanol ... 68
25. Sektrum sinar UV larutan isolat PEaI dalam penambahan NaOH dibandingkan dengan spektrum yang diukur setelah
5 menit ... ...70 26. Sektrum sinar UV larutan isolat PEaI dalam penambahan
AlCl3 dibandingkan dengan spektrum isolat dalam metanol ... ...71 27 Spektrum sinar UV larutan isolat PEaI dalam penambahan
AlCl 3 dibandingkan dengan spektrum isolat dalam HCL ... ...72 26. Spektrum sinar UV larutan isolat PEaI dalam penambahan
KARAKTERISASI SIMPLISIA, SKRINING FITOKIMIA DAN ISOLASI SENYAWA FLAVONOIDA DARI DAUN TUMBUHAN
PACAR AIR (Impatien balsamina L.) ABSTRAK
Tumbuhan yang digunakan pada penelitian ini adalah daun dari tumbuhan pacar air (Impatiens balsamina L.) tumbuhan pacar air ini karakterisasinya belum terdapat di buku monografi tumbuhan Materia Medika Indonesia (MMI). Telah dilakukan uji karakterisasi, ekstraksi dan isolasi senyawa flavonoida dari daun pacar air (Impatiens balsamina L.) hasil karakterisasi kadar air (7.99%), kadar sari larut dalam air (17.62%), kadar sari larut dalam etnol (10.02%), kadar abu total ( 1.67%), kadar abu yang tidak larut dalam asam (0.29%) dan hasil skrining fitokimia positif untuk senyawa flavonoida dan glikosida. Ekstraksi dilakukan secara perkolasi menggunakan pelarut etanol 96 %, ekstrak etanol yang diperoleh dilakukan fraksinasi cair-cair menggunakan pelarut n-heksan, kloroform dan etilasetat. Hasil fraksinasi di lakukan kromatografi kertas (KKt) dengan berbagai fase gerak. Hasil KKt dari masing-masing fraksi terbaik pada fraksi etilasetat dengan pengembang asam klorida 5%. Hasil KKt kemudian dilakukan KKt preparatif, diperoleh tiga noda yaitu PEa1 Rf 0.65, PEa2 Rf 0.25 dan PEa3 Rf 0.05 dengan fase gerak asam klorida 5%. Isolat PEa1 yang diperoleh di karakterisasi dengan spektropotometri UV dengan menggunakan pereaksi geser (shift reagent) hasil penafsiran spektropotometri UV terhadap PEa1 adalah senyawa gologan flavonoida isoflavon yang mempunyai gugus o-diOH pada cincin A, pada atom C6 dan 7.
CHARACTERIZATION OF SYMPLICIA, PHYTOCHEMICAL SCREENING AND ISOLATION OF FLAVONOIDA COMPOUND FROM
PACAR AIR (Impatients balsamina L.) LEAF ABSTRACT
The plant used in this research is pacar air (Impatients balsamina L.) leaf. The characterization of this plant was not found in monography literature of Indonesian Medical Material Plant (MMI). The characterization test, extractation and isolation of flavonoida compound from pacar air leaf have been conducted. Charaterization result of water concentration was 7,99%, concentration of water soluble extract was 17,62%, the concentration of ethanol soluble extract was 10,02%, total concentration of ash 1,67%, the concentration of acid insoluble ash was 0,29% and screening result of positive phytochemical of flavonoida ang glycoside compound. Extration was conducted by percolation is fractioned by liquid-liquid using the hexane solvent, chloroform and etilacetat. The fractionation result was conducted through paper chromatography (KKt) with several phases of motion. The KKt result of each fraction was best found in fraction of etilacetat with acid chloride expander of 5 %. The KKt result is then conducted with preparative KKt, three stains have been gained, they were PEaI Rf 0,65, Pea2 Rf 0,25 and Pea3 Rf 0,05 with phase of chloride acid motion 5%. The isolation of PEaI gained is characterized with UV spectrophotometer by using shift reagent, the interpretation result of UV spectrofotometer on PEaI is compound of flavonoida isoflavon class with cluster of o-diOH in A ring, in atom C6 and 7.
Keywords: characterization, phytrochemical screening and isolation of flaonoida
BAB I PENDAHULUAN 1.1 Latar Belakang
Pembangunan nasional di bidang kesehatan adalah terciptanya kemampuan hidup sehat setiap penduduk agar dapat mewujudkan derajat kesehatan masyarakat yang optimal sebagai salah satu unsur kesejahteraan umum dari pembangunan nasional. Untuk mewujudkan tujuan tersebut perlu peran serta masyarakat guna memanfaatkan pekarangan rumah untuk menanam tanaman obat-obatan. Karena tanaman ini sangat besar manfaatnya bagi masyarakat , selain untuk konsumsi, juga dapat dijadikan obat tradisional bahkan dapat menambah penghasilan masyarakat dari hasil penjualan tanaman, selain dimanfaatkan untuk obat dapat juga ditata dengan baik sebagai penghias pekarangan. Pekarangan rumah menjadi tampak asri dan penghuninya dapat memperoleh obat-obatan yang diperlukan untuk menjaga kesehatan.
Pemanfaatan berbagai jenis tumbuhan pekarangan rumah merupakan salah satu gambaran masyarakat yang telah menyadari arti pentingnya tumbuhan tersebut bagi penyembuhan penyakit. Oleh karena itu, budidaya tumbuhan obat tradisional perlu digalakkan oleh masyarakat dengan memanfaatkan pekarangan rumah sehingga dapat memberikan manfaat terhadap dirinya, keluarga dan masyarakat (Anonim,2009).
kamperol, monoglikosida, biji mengandung saponin dan fixel oil, akar sianidin, monoglikosida. Pemeriksaan kandungan kimia daun pacar air belum dilakukan, sehingga perlu dilakukan skrining fitokimia dari daun pacar air dan juga tumbuhan pacar air ini belum terdapat pada monografi tumbuhan yaitu Materia Medika Indonesia (MMI) sebagai petunjuk karakterisasi simplisia.
Tumbuhan ini memiliki banyak khasiat obat, diantaranya bagian yang digunakan adalah biji, daun, bunga dan akarnya. Biji digunakan untuk mengatasi terlambat haid, sulit melahirhan, rasa tersumbat ditenggorokan, bengkak akibat terbentur (memar), tumor perut, dan kanker saluran cerana dibagian atas. Bunga digunakan untuk mengatasi terlambat haid, dan bengkak karena gumpalan bekuan darah. Daun digunakan untuk mengatasi keputihan dan nyeri haid. Akar digunakan untuk mengatasi rematik, leher kaku, sakit pinggan, terlambat haid. (Anonim 2009).
Dalam kehidupan sehari-hari masyarakat menggunakan tumbuhan ini dengan melumatkan daun pacar air segar, lalu ditempelkan pada bagian tubuh yang luka, cara lain dengan merebus daun pacar air segar secukupnya lalu digunakan air rebusan untuk mencuci luka.
1.2 Perumusan masalah
Berdasarkan latar belakang di atas perumusan masalah penelitian yaitu:
a. Karakterisasi tumbuhan pacar air (Impatiens balsamina L.) belum terdapat dibuku monografi tumbuhan Materia Medika Indonesia (MMI) oleh karena itu perlu dilakukan karakterisasi simplisia yang nantinya dapat dijadikan sebagai perbandingan.
b. Golongan senyawa kimia apakah yang terdapat dalam daun tumbuhan pacar air (Impatiens balsamina L.).
c. Apakah senyawa flavonoida dari daun tumbuhan pacar air (Impatiens balsamina L.) dapat diisolasi dengan ekstrak etanol.
1.3 Hipotesa
Berdasarkan perumusan masalah diatas maka dibuat hipotesis sebagai berikut: a. Diduga karakterisasi simplisia tumbuhan pacar air (Impatiens balsamina
L.) dapat diketahui.
b. Diduga dapat diketahui golongan senyawa kimia yang terdapat didalam daun tumbuhan pacar air (Impatiens balsamina L.).
c. Diduga senyawa flavonoida dari daun tumbuhan pacar air (Impatiens balsamina L.) dapat diisolasi dari ekstrak etanol
1.4 Tujuan penelitian
Adapun tujuan dilakukannya penelitian ini adalah
a. Untuk melakukan karakterisasi simplisia daun tumbuhan pacar air (Impatiens balsamina L.).
c. Untuk mengisolasi senyawa flavonoida dari daun tumbuhan pacar air (Impatiens balsamina L.) secara kromatografi kertas (KKt), isolat yang diperoleh diidentifikasi dengan spektrofotometri UV menggunakan pereaksi geser (shift reagent).
1.5 Manfaat penelitian
Hasil penelitian diharapkan dapat digunakan :
a. Sebagai sumber informasi mengenai karakterisasi simplisia tumbuhan pacar air (Impatiens balsamina L.).
b. Sebagai sumber informasi mengenai kandungan golongan senyawa daun pacar air (Impatiens balsamina L.).
BAB II
TINJAUAN PUSTAKA 2.1 Uraian tumbuhan
Uraian tumbuhan meliputi, morfologi tumbuhan, sistematika tumbuhan, nama daerah, kandungan senyawa kimia dan khasiat tumbuhan.
2.1.1Morfologi tumbuhan
daun mahkota memanjang menjadi taji dengan panjang 0,2-2 cm. Daun mahkota 5, lepas. Daun mahkota samping berbentuk jantung terbalik dengan panjang 2-2,5 cm, yang 2 bersatu dengan kuku, yang lain lepas tidak berkuku dan lebih pendek. Ada 5 benangsari dengan tangkai sari yang pendek, lepas, agak bersatu. Kepala sarinya bersatu membentuk tudung putih. Bunga terkumpul 1-3. Setiap tangkai hanya berbunga 1 dan tangkainya tidak beruas, memiliki 5 kepala putik (Anonim,2009).
2.1.2Sistematika tumbuhan
Sistematika tumbuhan pacar air adalah sebagai berikut: Devisi : Spermatophyta
Sub devisi : Angiospermae Kelas : Dicotyledoneae Subkelas : Dialypetalae
Ordo : Sapindales
Famili : Balsaminaceae
Genus : Impatiens
Jenis : Impatiens balsamina L.
(Depkes, 1994) 2.1.3Nama daerah
2.1.4Kandungan kimia
Pada bunga terkandung antosianin (sianidin, delpinidin, pelargonidin, malpidin), kamferol, biji mengandung saponin, fixel oil, kuersetin dan akar mengandung sianidin monoglikosida (Yuniarti, 2001).
2.1.5Khasiat tumbuhan
Tumbuhan pacar air dapat mengobati keputihan, nyeri haid, radang usus buntu, kronis, antiinflamasi, patah tulang atau retak, mengurangi rasa nyeri, bisul, radang kulit, radang kuku, meluruhkan haid, mempermudah persalinan dan mengobati kanker saluran pencernaan (Arief, 2005).
2.2 Uraian kimia 2.2.1Flavonoida
Flavonoida merupakan salah satu golongan fenol alam yang tersebar luas pada tumbuhan hijau dan mengandung 15 atom karbon dalam inti dasarnya, yang tersusun dalam konfigurasi C6-C3-C6, yaitu dua cincin aromatik yang dihubungkan oleh satuan tiga karbon yang dapat atau tidak dapat membentuk cincin ketiga (Markham, 1988).
Flavonoida merupakan salah satu golongan fenol alam yang tersebar luas pada tumbuhan hijau dan mengandung 15 atom karbon dalam inti dasarnya, yang tersusun dalam konfigurasi C6-C3-C6, yaitu dua cincin aromatik yang dihubungkan oleh satuan tiga karbon yang dapat atau tidak dapat membentuk cincin ketiga (Markham, 1988).
Struktur karangka flavonoida
Umumnya senyawa flavonoida dalam tumbuhan terikat dengan gula sehingga disebut sebagai glikosida dan aglikon flavonoida yang berbeda-beda mungkin saja terdapat pada satu tumbuhan dalam beberapa bentuk kombinasi glikosida. Oleh karena itu dalam menganalisis flavonoida biasanya lebih baik memeriksa aglikon yang telah dihidrolisis dibandingkan dalam bentuk glukosida dengan kerumitan strukturnya. Flavonoida berkhasiat sebagai antioksidan, antibakteri dan antiinflamasi (Harborne, 1987).
Struktur umum flavonoida
2.2.2Identifikasi flavonoida
Sebagian besar senyawa flavonoida alam ditemukan dalam bentuk glikosida, dimana unit flavonoida terikat pada suatu gula. Glikosida adalah kombinasi antara suatu gula dan suatu alkohol yang sering berikatan melalui ikatan glikosida. Pada prinsipnya, ikatan glikosida terbentuk apabila gugus hidroksi dari alkohol beradisi pada gugus karbonil dari gula, sama seperti adisi alkohol kepada aldehida yang dikatalisa oleh asam menghasilkan suatu asetat.
Pada hidroksi oleh asam, suatu glikosida terurai kembali atas komponen-komponennya menghasilkan gula dan alkohol yang sebanding dan alkohol yang dihasilkan ini disebut aglikon. Residu dari glikosida flavonoida alam adalah
O 1
2
5
4 7
8
4 5
6
2 3
1
3 6
9
glukosa, ramnosa, galaktosa dan gentiobiosa sehingga glikosida tersebut masing-masing disebut glukosida, ramnosida, galaktosida dan gentiobiosida.
Flavonoida dapat ditemukan sebagai mono, di atau triglikosida dimana satu, dua atau tiga gugus hidroksil dalam molekul flavonoida terikat oleh gula. poliglikosida larut dalam air dan sedikit larut dalam pelarut organik seperti eter, benzen, kloroform dan aseton.
2.2.3 Glikosida
Glikosida adalah suatu senyawa yang jika dihidrolisis akan menghasilkan bagian gula yang disebut glikon dan bagian bukan gula disebut aglikon. Gula yang dihasilkan biasanya adalah glukosa, ramnosa dan lain sebagainya. Jika bagian gulanya adalah glukosa maka disebut glukosida, sedangkan jika bagian gulanya selain glukosa disebut glikosida.
Menurut farnsworth (1996), pembagian glikosida berdasarkan atom yang menghubungkan bagian gula dan bagian bukan gula adalah sebagai berikut:
1. O-glikosida: jika bagian gula dan bukan gula dihubungkan oleh atom O. 2. S-glikosida: jika bagian gula dan bukan gula dihubungkan oleh atom S. 3. N- glikosida: jika bagian gula dan bukan gula dihubungkan oleh atom N. 4. C-glikosida: jika bagian gula dan bukan gula dihubungkan oleh atom C. 2.3 Metode ekstraksi
Ada beberapa cara ekstraksi menggunakan pelarut antara lain: 1. Cara dingin
a. Maserasi
Maserasi adalah proses pengekstraksian simplisia menggunakan pelarut dengan beberapa kali pengadukan dan pendiaman pada temperatur ruangan. Sedangkan remaserasi adalah pengulangan penambahan pelarut setelah dilakukan penyaringan maserat pertama dan seterusnya.
b. Perkolasi
Perkolasi adalah ekstraksi menggunakan pelarut yang selalu baru sampai sempurna yang umumnya dilakukan pada temperatur ruangan, serbuk simplisia yang akan diperkolasi tidak langsung dimasukkan kedalam bejana perkolator, tetapi dibasahi atau dimaserasi terlebih dahulu dengan cairan penyari sekurang-kurangnya 3 jam. Bila serbuk simplisia tersebut langsung dialiri dengan cairan penyari, maka cairan penyari tidak dapat menembus ke seluruh sel dengan sempurna.
2. Cara panas a. Refluks
Refluks adalah ekstraksi menggunakan pelarut pada temperatur titik didihnya selama waktu tertentu dan jumlah pelarut terbatas yang relatif konstan dengan adanya pendingan balik.
b. Sokletasi
c. Digesti
Digesti adalah maserasi kinetik (dengan pengadukan kontinu) pada temperatur yang lebih tinggi dari temperatur ruangan (kamar) yaitu secara umum dilakukan pada temperatur 40-500C.
d. Infus
Infus adalah ekstraksi dengan pelarut air pada temperatur penangas air (bejana infus tercelup dalam penangas air mendidih, temperatur terukur 96-980C) selama waktu tertentu (15-20 menit).
e. Dekok
Dekok adalah infus pada waktu yang lebih lama (≥ 30 0C) dan temperatur sampai titik didih air (Depkes, 2000).
2.4 Kromatografi
Kromatrografi adalah metode pemeriksaan berdasarkan proses minggrasi dari komponen-komponen senyawa diantara dua fase yaitu fase diam dan fase gerak. Fase gerak membawa zat terlarut melalui media sehingga terpisah dari zat terlarut lainnya yang terelusi lebih awal atau lebih akhir, umumnya zat terlarut dibawah melalui media pemisah oleh aliran suatu pelarut berbentuk cairan atau gas yang disebut toluena. Fase diam dapat bertindak sebagai penyerap, seperti alumina dan slika gel atau dapat bertindak melarutkan zat terlarut sehingga terjadi partisi antara fase diam dan fase gerak. Dalam proses ini suatu lapisan cairan pada penyangga yang inert berfungsi sebagai fase diam (Ditjen POM, 1995).
partisi. Karena fase gerak dapat berupa zat cair atau gas maka terdapat empat macam sistem kromatografi, yaitu :
1. Fase gerak cair-fase diam dan padat (kromatografi serapan) :
• Kromatografi lapis tipis
• Kromatografi kolom 2. Fase gerak gas-fase diam padat :
• Kromatografi gas padat
3. Fase gerak cair-fase diam cair (kromatografi partisi) :
• Kromatografi kertas 4. Fase gerak gas-fase diam cair :
• kromatografi gas cair
Semua pemisahan dengan kromatografi tergantung pada kenyataan bahwa senyawa-senyawa yang dipisahkan terdistribusi diantara fase gerak dan fase diam dalam perbandingan yang sangat berbeda-beda dari satu senyawa terhadap senyawa yang lain (Sastrohamidjojo,1991).
2.4.1Kromatografi kertas
Kromatografi kertas merupakan kromatografi partisi dimana fase geraknya adalah air yang disokong oleh molekul-molekul selulosa dari kertas. Kertas yang digunakan adalah kertas Whatman No.1 dan kertas yang lebih tebal Whatman No. 3 biasanya untuk pemisahan campuran dalam jumlah yang lebih besar karena dapat menampung lebih banyak cuplikan (Sastrohamidjojo, 1991).
beberapa senyawa atau untuk mengurangi kelarutan yang lainnya (Sastrohamidjojo, 1991).
Fase gerak terdiri dari satu atau beberapa pelarut dan bila diperlukan dapat menggunakan sistem pelarut multi komponen, berupa suatu campuran sederhana mungkin yang terdiri atas maksimum tiga komponen. Pada pemisahan senyawa organik selalu menggunakan pelarut campur, tujuannya untuk memperoleh polaritas yang tepat sehinga diperoleh pemisahan senyawa yang baik. Kombinasi pelarut berdasarkan atas polaritas masing-masing pelarut sehingga dengan demikian diperoleh sistem penggabung yang cocok (Stahl, 1985).
Jarak pengembang senyawa pada kromatogram biasanya dinyatakan dengan harga Rf (Stahl, 1985).
Rf =
Jarak yang ditempuh oleh tiap bercak dari titik pentotolan diukur dari pusat bercak dan harga Rf berada antara 0,00–1,00. Harga Rf sangat beguna untuk mengidentifikasi suatu senyawa (Eaton, 1989).
Faktor-faktor yang mempengaruhi harga Rf adalah sebagai berikut: (Sastrohamidjojo,1991).
1. Struktur kimia senyawa yang dipisahkan 2. Sifat penyerap
3. Tebal dan kerataan lapisan penyerap 4. Pelarut dan drajat kemurniannya
5. Drajat kejenuhan uap pengembang dalam bejana 6. Teknik percobaan
7. Jumlah cuplikan yang digunakan
Menurut Sastrohamidjojo (1991), kromatografi kertas dapat dikembangkan dengan cara :
1. Menurun (desendens)
Dilakukan dengan membiarkan fase gerak merambat turun pada kertas kromatografi, kertas digantungkan dalam bejana menggunakan batang kaca dan batang kaca lain menahan ujung atas kertas yang tercelup dalam fase gerak. Setelah bejana ditutup, fase gerak dibiarkan merambat turun pada kertas (Depkes, 1979).
2. Menaik (esendens)
Kertas digantung pada penggantung berbentuk kail yang dipasang pada penutup bejana kromatografi. Pelarut diletakkan pada bagian bawah dari bejana lalu ujung bawah kertas dicelupkan ke dalam fase gerak sehingga fase gerak merambat naik pada kertas.
3. Mendatar
Kertas yang digunakan berbentuk bulat dan ditengahnya diberi lubang tempat untuk meletakkan sumbu yang terbuat dari gulungan kertas atau benag. Fase gerak akan naik membasahi kertas dan merambat melingkar memisahkan senyawa yang ditotolkan.
senyawa bila dilihat dibawah sinar ultraviolet yang mudah diamati pada kertas. Kedua, tekniknya mudah dipelajari, memberikan hasil yang cepat dan memerlukan peralatan yang tidak mahal. Selain itu, metode kromatografi kertas merupakan cara terbaik untuk mengidentifikasi campuran senyawa flavonoida dengan jumlah yang sedikit (Gaissman, 1962).
2.5 Spektrofotometri Ultraviolet
Spektrofotometri ultraviolet adalah suatu metode spektrofotometri serapan dengan cara mengukur serapan radiasi elektromagnetik suatu larutan pada panjang gelombang tertentu. Spktrum ultraviolet digambarkan sebagai hubungan antara panjang gelombang (frekuensi serapan) dengan insensitas serapan (transmitansi atau absorbansi) (Sastrohamidjojo, 1985)
Apabila suatu molekul menyerap radiasi ultraviolet, maka didalam molekul tersebut terjadi perpindahan atau tranmisi tingkat energi elektron-elektron ikatan diorbital molekul paling luar dari tingkat energi yang lebih mudah (orbital ikatan π) ketingkat energi yang lebih tinggi (orbital anti ikatan π*
). Keuntungan dari serapan ultraviolet adalah selektifnya dimana gugus-gugus yang khas dapat dikenal dalam molekul-molekul yang sangat kompleks (Noerdin, 1985).
Serapan molekul didalam daerah ultraviolet bergantung pada struktur elektronik dari molekul, apabila suatu molekul menyerap radiasi ultraviolet didalam molekul terjadi perpindahan tingkat energi elektron-elektron ikatan pada orbital molekul paling luar dari tingkat energi yang lebih rendah ketingkat energi yang lebih tnggi (Silverstein, 1986)
Penggunaan pereaksi geser (shift reagent) dalam spektrofotometri ultraviolet untuk menganalisis struktur flavonoida
Spektrofotometri UV adalah cara yang paling berguna untuk menganalisis struktur flavonoida, biasanya ditentukan dalam larutan dengan pelarut metanol atau etanol. Spektrum senyawa flavonoida terdiri atas dua pita absorbsi maksimum, yaitu pita I pada rentang 300-550 nm dan pita II pada 240-285 nm. Pita I menunjukkan absorbsi system benzoil pada cincin A (Markham, 1988).
Rentang serapan maksimum spectrum UV beberapa senyawa flavonoida menurut Markham (1988) adalah :
Pita II (nm) Pita I (nm) Jenis Flavonoida 250-280
250-280 250-280 245-275 275-295 230-270 230-270 270-280
310-350 330-350 350-385 310-330 300-330 340-390 380-430 465-560
Flavon
Flavonol (3-OH tersubstitusi) Flavonol (3-OH bebas)
Isoflavon
Flavonon dan dihidroflavonol) Khalkon
Spektrum serapan UV beberapa jenis golongan flavonoida menurut Markham 98(18) adalah :
Kedudukan gugus hidroksi fenol bebas pada inti flavonoida dapat ditentukan dengan menambahkan pereaksi geser ke dalam larutan cuplikan dan mengamati puncak serapan yang terjadi (Markham, 1988).
Langkah pertama yang dilakukan dalam menafsirkan spectrum yaitu menentukan jenis flavonoida dengan memperhatikan :
1. Bentuk umum spectrum dalam methanol 2. Panjang gelombang pita serapan
Langkah kedua adalah memperhatikan arti perubahan spektrum yang disebabkan oleh penembahan berbagai pereaksi geser (Markham, 1988).
Spektrum natrium metoksida
Natrium metoksida merupakan basa kuat yang dapat mengionisasi hampir semua gugus hidroksi pada inti flavonoida. Spektrum ini biasanya merupakan petunjuk sidik jari pola hidroksilasi dan juga bermanfaat untuk mendeteksi gugus hidroksi yang lebih asam dan tidak tersubstitusi. Degradasi atau pengurangan kekuatan spektrum setelah waktu tertentu merupakan petunjuk baik akan adanya gugus yang peka terhadap basa. Pereaksi pengganti natrium metoksida yang cocok ialah larutan NaOH 2 M dalam air (Mabry, 1970).
Spektrum AlCl3 dan AlCl3/ HCl
AlCl3 membentuk kompleks tahan asam dengan gugus hidroksi (pada C3 atau C5) dan keton, juga membentuk kompleks tak tahan asam dengan gugus orto-dihidroksi, sehingga dapat digunakan untuk mendeteksi kedua gugus tersebut. Spektrum AlCl3/HCl hanya berguna untuk mendeteksi gugus hidroksi yang bertetangga dengan gugus keton, karena gugus tersebut dengan AlCl3 akan membentuk senyawa kompleks yang tahan asam (Mabry, 1970)
Spektrum natrium asetat
Spektrum natrium asetat/asam borat
BAB III
METODE PENELITIAN
Metode yang dilakukan pada tumbuhan ini adalah metode eksperimental yang meliputipengumpulan, penyiapan sampel, identifikasi, pembuatan simplisia, pemeriksaan karakterisasi simplisia, skrining fitokimia, pembuatan ekstrak, analisis kromatografi kertas, uji kemurnian isolat dan karakterisasi isolat spektrofotometri ultraviolet menggunakan pereaksi geser (shift reagent).
3.1 Alat-alat
Alat-alat yang digunakan pada penelitian ini adalah alat-alat gelas laboratorium, cawan penguap, blender (National), oven listrik, (Fisher scientific), neraca kasar (Ohaus), neraca analitik (Mettler tolede), penguap vakum putar, penangas air, eksikator, seperangkat alat penetapan kadar air, lampu UV 366 nm, bejana kromatografi dan spektrofotometer UV (Shimadzu QP-5000) dan mikroskop (Olympus).
3.2 Bahan-bahan
3.3 Pembuatan larutan pereaksi 3.3.1 Larutan pereaksi Mayer
Sebanyak 5 g kalium iodida dalam 10 ml air suling kemudian ditambahkan larutan 1,36 g merkuri (II) klorida dalam 60 ml air suling. Larutan dikocok dan ditambahkan air suling hingga 100 ml.
3.3.2 Larutan pereaksi Dragendrof
Sebanyak 8 g bismut nitrat dilarutkan dalam asam nitrat 20 ml kemudian dicampur dengan larutan kalium iodida sebanyak 27,2 g dalam 50 ml air suling. Campuran didiamkan sampai memisah sempurna. Larutan jernih diambil dan diencerkan dengan air secukupnya hingga 100 ml.
3.3.3 Larutan pereaksi Bouchardat
Sebanyak 4 g kalium iodida dilarutkan dalam 20 ml air suling kemudian ditambah 2 g iodium sambil diaduk sampai larut, lalu ditambah air suling hingga 100 ml.
3.3.4 Larutan pereaksi Molish
Sebanyak 3 g α- naftol dilarutkan dalam asam nitrat 0,5 N secukupnya hingga diperoleh larutan 100 ml.
3.3.5 Larutan pereaksi Liebarmann-Bourchard
Sebanyak 20 bagian asam asetat anhidrat dicampurkan dengan 1 bagian asam sulfat pekat dan 50 bagian kloroform. Larutan pereaksi ini harus dibuat baru.
3.3.6 Larutan pereaksi besi (III) klorida 1%
3.3.7 Larutan pereaksi timbal (II) asetat
Sebanyak 15,17 g timbal (II) asetat ditimbang, kemudian dilarutkan dalam air hingga 100 ml.
3.3.8 Larutan pereaksi natrium hidroksida 2 N
Sebanyak 8 g kristal natrium hidroksida dilarutkan dalam air suling hingga diperoleh larutan 100 ml.
3.3.9 Larutan pereaksi asam klorida 2 N
Sebanyak 17 ml asam klorida pekat diencerkan dengan air suling sampai 100 ml.
3.3.10 Larutan aluminium (III) klorida 5%
Sebanyak 5 g aluminium (III) klorida ditimbang, kemudian dilarutkan dalam metanol hingga 100 ml ( Harborne, 1989).
3.4 Pengumpulan sampel, identifikasi tumbuhan dan pengolahan sampel 3.4.1 Pengumpulan sampel
Pungumpulan sampel dilakukan secara purposif, tanpa membandingkan tumbuhan serupa didaerah lain. Sampel yang digunakan adalah daun tumbuhan pacar air (Impatiens balsamina L.) yang bunganya berwarna ungu, diambil dari lahan kosong jalan Gaperta Ujung, Medan. Gambar tumbuhan dan daun tumbuhan pacar air dapat dilihat pada lampiran I halaman 39.
3.4.2 Identifikasi tumbuhan
3.4.3 Pengolahan sampel
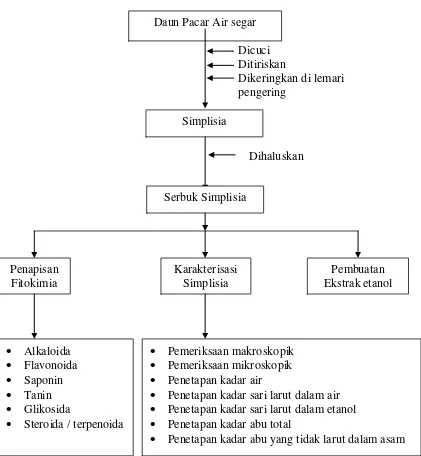
Daun tumbuhan pacar air (Impatiens balsamina L.) yang telah dikumpulkan dan dibersihkan dari pengotoran dengan menggunakan air bersih, ditiriskan, ditimbang sebagai berat basah, kemudian dikeringkan di dalam lemari pengering lalu ditimbang, sebagai berat kering. Sampel selanjutnya diserbuk dengan menggunakan blender lalu disimpan di dalam wadah plastik tertutup. Gambar simplisia daun dan simplisia serbuk pacar air dapat dilihat pada lampiran 3 halaman 40.
3.5 Pemeriksaan karakteristik sampel
Pemeriksaan karakteristik sampel meliputi pemeriksaan makroskopik, pemeriksaan mikroskopik, penetapan kadar air, pemeriksaan kadar sari yang larut dalam air, pemeriksaan kadar sari yang larut dalam etanol, penetapan kadar abu total, penetapan kadar abu yang tidak larut dalam asam (Material Medika Indonesia, 1989).
3.5.1 Pemeriksaan makroskopik
Pemeriksaan makroskopik dilakukan terhadap simplisia daun tumbuhan pacar air meliputi bentuk, bau, rasa dan warna. Hasil dapat dilihat pada lampiran 4 tabel 1 halaman 41.
3.5.2.Pemeriksaan mikroskopik
dilakukan pemeriksaan mikroskopik irisan melintang daun pacar air. Pemeriksaan mikroskopik dapat dilihat pada lampiran 5 halaman 42
3.5.3 Penetapan kadar air
Penetapan kadar air dilakukan dengan metode Azeotropi (destilasi toluen). Alat meliputi labu alas bulat 500 ml, penampung, tabung penerima 5 ml bersekala 0,05 ml, pendingin, tabung penyambung dan pemanas.
Cara penetapan :
Ke dalam labu bulat dimasukkan 200 ml toluen dan 2 ml air suling, didestilasi selama 2 jam, biarkan mendingin selama 30 menit dan volume air pada tabung penerimaan dibaca. Kemudian ke dalam labu dimasukkan 5 g serbuk simplisia yang telah ditimbang seksama, lalu dipanaskan hati-hati selama 15 menit. Setelah toluen mulai mendidih, kecepatan tetesan diatur, kurang lebih 2 tetes tiap detik, hingga sebagian air terdestilasi. Kemudian kecepatan destilasi dinaikkan hingga 4 tetes perdetik. Setelah semua air terdestilasi, bagian dalam pendingin dibilas dengan toluen yang telah dijenuhkan. Destilasi dilanjutkan selama 5 menit, kemudin tabung penerima dibiarkan mendingin sampai suhu kamar. Setelah air dan toluen memisah sempurna, volume air dibaca dengan ketelitian 0,05 ml. Selisih kedua volume air yang dibaca sesuai dengan kandungan air yang terdapat dalam bahan yang diperiksa (WHO, 1992).
3.5.4 Penetapan kadar abu total
kemudian didinginkan dan ditimbang sampai diperoleh bobot tetap. Kadar abu total dihitung terhadap bahan yang telah dikeringkan di udara (WHO, 1992). 3.5.5 Penetapan kadar abu yang tidak larut dalam asam
Abu yang telah diperoleh dari penetapan kadar abu total didihkan dalam 25 ml asam klorida 2 N selama 5 menit. Bagian yang tidak larut dalam asam dikumpulkan, disaring melalui kertas saring, dipijarkan hingga bobot tetap kemudian didinginkan dan ditimbang. Kadar abu yang tidak larut dalam asam dihitung terhadap bahan yang telah dikeringkan di udara (WHO, 1992).
3.5.6 Penetapan kadar sari yang larut dalam air
Sebanyak 5 g serbuk di maserasi selama 24 jam dalam 100 ml air-kloroform (2,5 ml air-kloroform dalam air suling 1000 ml), dalam labu bersumbat sambil sesekali dikocok selam 6 jam pertama kemudian dibiarkan selama 18 jam dan disaring. Sejumlah 20 ml filtrat pertama diuapkan sampai kering dalam cawan dangkal berdasar rata yang telah ditara. Sisa dipanaskan dalam open pada 1050C sampai diperoleh bobot konstan kadar sari yang larut di dalam air dihitung terhadap bahan yang telah dikeringkan di udara (Material Medika Indonesia, 1989).
3.5.7 Penetapan kadar sari yang larut dalam etanol
yang telah dikeringkan di udara (Material Medika Indonesia, 1989). Perhitungan hasil karakteristik simplisia dapat dilihat pada lampiran 6 halaman 43.
3.6 Skrining fitokimia
3.6.1 Pemeriksaan alkaloida
Serbuk simplisia ditimbag sebanyak 0,5 g kemudian ditambahkan 1 ml asam klorida 2 N dan 9 ml air suling, dipanaskan di atas penangas air selama 2 menit, didinginkan lalu disaring. Filtrat dipakai untuk percobaan berikut :
a. Diambil 3 tetes filtrat, lalu ditambahkan 2 tetes pereaksi Mayer b. Diambil 3 tetes filtrat, lalu ditambahkan 2 tetes pereaksi Bouchardat c. Diambil 3 tetes filtrat, lalu ditambahkan 2 tetes pereaksi Dragendrof Alkaloida dianggap positif jika terjadi endapan atau paling sedikit dua atau tiga dari percobaan diatas (Depkes, 1995).
3.6.2 Pemeriksaan flavonoida
Sebanyak 10 g serbuk simplisia kemudian ditambahkan 100 ml air panas, dididihkan selama 5 menit dan disaring dalam keadaan panas. Filtrat yang diperoleh kemudian diambil 5 ml lalu ditambahkan 0,1 g serbuk Mg dan 1 ml HCl pekat dan 2 ml amil alkohol, dikocok, dan dibiarkan memisah. Flavonoida positif jika terjadi warna merah, kuning, jingga pada lapisan amil alkohol. (Farnsworth, 1966).
3.6.3 Pemeriksaan tanin
3.6.4 Pemeriksaan glikosida
Serbuk simplisia ditimbang sebanyak 3 g kemudian disari dengan 30 ml campuran 7 bagian volume etanol 96 % dan 3 bagian volume air suling (7:3), direfluks selama 10 menit, didinginkan dan disaring. Pada 20 ml filtrat ditambahkan 25 ml timbal (II) asetat 0,4 N, dikocok, didiamkan selama 5 menit lalu disaring. Filtrat disari sebanyak 3 kali, tiap kali dengan 20 ml campuran 3 bagian volume kloroform P dan 2 bagian volume isopropanolol P. Pada lapisan kloroform ditambahkan natrium sulfat anhidrat P secukupnya disaring, dan diuapkan pada temperatur tidak lebih dari 500C. Dilarutkan sisanya dengan 2 ml metanol, kemudian diambil 0,1 ml larutan percobaan dimasukkan ke dalam tabung reaksi, diuapkan di atas penangas air. Pada sisa ditambahkan 2 ml air dan 5 tetes pereaksi Molish, ditambahkan hati-hati 2 ml asam sulfat terbentuk cincin warna ungu pada batas kedua cairan menunjukkan adanya ikatan gula (Depkes,1995).
3.6.5 Pemeriksaan saponin
Sebanyak 0,5 g sampel dimasukkan ke dalam tabung reaksi dan ditambahkan 10 ml air suling panas, didinginkan kemudian dikocok kuat-kuat selama 10 detik, terbentuk buih atau busa yang selama tidak kurang dari 10 menit setinggi 1-10 cm. pada penambahkan 1 tetes larutan asam klorida 2 N, apabila buih tidak hilang menunjukkan adanya saponin ( Depkes, 1995)
3.6.6 Pemeriksaan steroida/ triterpenoida
merah kemudian berubah menjadi hijau biru menunjukkan adanya steroida triterpenoida (Harborne, 1978). Hasil skrining fitokimia dapat dilihat pada lampiran 7 tabel 3 halaman 49.
3.6.7 Pemeriksaan minyak atsiri
Dilakukan secara mikroskopik dapat dilihat dibawah mikroskop yang memberikan tetesan-tetesan minyak.
3.7 Pembuatan ekstrak
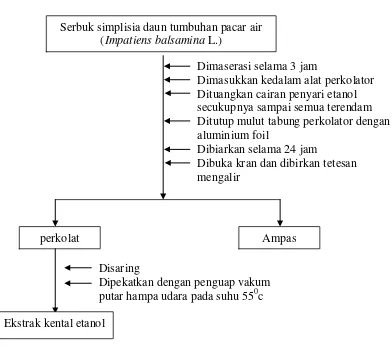
Sebanyak 400 g sebuk simplisia dimasukkan kedalam bejana tertutup dan dibasahi dengan cairan penyari etanol 96 %, direndam selama 3 jam. Massa dipindahkan sedikit-sedikit kedalam perkolator, kemudian cairan penyari dituangkan sampai semua simplisia terendam dan terdapat selapis cairan penyari di atasnya, perkolator ditutup dengan aluminium foil dan dibiarkan selama 24 jam kemudian kran perkolator dibuka dan dibiarkan tetesan ekstrak mengalir dengan kecepatan 1 ml permenit, cairan penyari ditambah berulang-ulang sehingga selalu terdapat selapis cairan penyari diatas simplisia, sampai cairan yang keluar tidak berwarna lagi, jika cairan diuapkan tidak meninggalkan sisa. Perkolat yang diperoleh dipekatkan dengan penguap vakum putar pada temperatur tidak lebih 500C hingga diperoleh ekstrak kental. Dapat dilihat pada lampiran 8 halaman 53 metode penelitian pada lampiran 9 halaman 51.
3.8 Ektraksi cair-cair senyawa flavonoida terhadap ekstrak etanol
Ekstraksi cair-cair senyawa flavonoida ekstrak etanol dilakukan berturut-turut hingga sempurna dengan pelarut n-heksan, kloroform dan etilasetat.
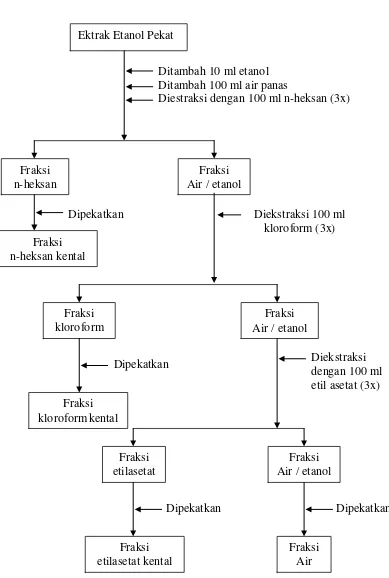
Ekstrak etanol kental ditambahkan 10 ml etanol, dilarutkan dalam air panas sebanyak 100 ml, dan dimasukkan kedalam corong pisah, mula-mula difraksinasi dengan pelarut heksan 100 ml sebanyak ( 3x ) diperoleh fraksi n-heksan dan fraksi air. Fraksi n-n-heksan dipisahkan, fraksi air difraksinasi lagi dengan kloroform 100 ml sebanyak (3x) dan diperoleh fraksi kloroform dan fraksi air, pada kloroform dipisahkan, fraksi air difraksinasi dengan etilasetat 100 ml sebanyak ( 3x ), diperoleh fraksi etilasetat dan fraksi air. Masing-masing fraksi yang diperoleh diuapkan menggunakan penguap vokum putar. ekstraksi cair-cair dapat dilihat pada lampiran 10 halaman 55 isolasi senyawa flavonoida dari fraksi etil asetat dapat dilihat pada lampiran 11 halaman 53.
3.9 Analisis masing-masing fraksi dilakukan secara kromatografi kertas Terhadap ekstrak hasil fraksinasi dilakukan kromatografi kertas (KKt) dengan pengembang BAA (n-butanol - asam asetat - air) (4:1:5), Forestal (asam asertat – air – asam klorida) (30:10:3), asam klorida 1 %, asam klorida 5 % dan asam asetat 50 % sebanyak 10 ml. Fase diam adalah kertas Whatman No. 3 yang
berukuran 2 x 12 cm dan sebagai penampak bercak aluminium (III) klorida 5 %. Prosedur kerja, fraksi nheksan, kloroform, etil asetat dan air masing
lampiran 12 halaman 57 kromatogram fraksi etilasetat dengan berbagai fase gerak dapat dilihat pada lampira 13 halaman 59.
3.10 Pemeriksaan senyawa flavonoida fraksi etilasetat secara KKt
Fraksi etilasetat dilakukan pemisahan secara KKt preparatif. fase diam kertas Whatman no.3 yang berukuran 15 x 25 cm.dan fase gerak asam klorida 5 %.
Prosedur kerja :
Ekstrak etilasetat yang telah diencerkan ditotolkan pada fase diam berupa pita, kemudian dimasukkan ke dalam chamber berisi fase gerak yang telah dijenuhkan. Lalu dielusi dengan jarak rambat 20 cm. Kertas dikeluarkan dan dikeringkan bagian tepi kanan dan kiri disemprot dengan pereaksi aluminium (III) klorida 5 % dalam etanol dan dilihat dibawah lampu ultraviolet (UV), bercak yang sesuai diberi tanda dan diperoleh tiga pita yang disebut pita EaI, pita EaII dan pita EaIII. Ketiga pita digunting terpisah berupa potongan-potongan kecil direndam dalam metanol selama 24 jam dan sekali-sekali dikocok. Lalu disaring, selanjutnya filtrat dipekatkan hingga diperoleh isolat kental. Hasil isolat kental yang diperoleh dari hasil KKt preparatif dilakukan KKt kualitatif. Hasil preparatif dapat dilihat pada lampiran 14 halamn 60 KKt kualitatif dapat dilihat pada lampiran 15 halaman 61.
3.11 Uji Kemurnian Senyawa
dijenuhkan, kemudian dielusi dengan jarak rambat 12,50 cm, kertas dikeluarkan dan dikeringkan. Kertas dielusi kembali menggunakan pengembang kedua dengan arah yang berbeda dengan jarak rambat 12,50 cm, setelah itu kertas diangkat dan dikeringkan, kemudian diamati dan disemprot dengan pereaksi aluminium (III) klorida 5 % dalam etanol dan di lihat dibawah lampu ultraviolet. Hasil dapat di lihat pada lampiran 16 halaman 63.
3.12 Karakterisasi isolat
Karakterisasi hasil isolat dilakukan dengan spektrofotomerti ultraviolet.
3.12.1 Karakterisasi isolat dengan spektrofotometri ultraviolet dengan penambahan pereaksi geser ( shift reagent)
1. Isolat dilarutkan dalam etanol, dimasukkan ke dalam kuvet dan kemudian diukur absorbansinya pada panjang gelombang 200-500 nm. Setelah diukur spektrumnya dalam metanol, ditambahkan 3 tetes larutan NaOH 2 N kedalam kuvet dan direkam spektrumnya, kemudian direkam kembali setelah 5 menit
2. Larutan isolat ditambahkan 6 tetes preaksi AlCl3, dikocok dan diukur spektrumnya, selanjutnya ditambahkan 3 tetes HCl dan diukur spektrumnya
BAB IV
HASIL DAN PEMBAHASAN
Hasil identifikasi tumbuhan yang dilakukan oleh Lembaga Ilmu Pengetahuan Indonesia (LIPI) - Pusat Penelitian dan Pengembangan Biologi– Bogor adalah tumbuhan pacar air (Impatiens balsamina L.), suku Balsaminaceae.
Analisis KKt dari masing-masng fraksi dilakukan dengan lima jenis fase gerak yaitu asam klorida 1%, asam klorida 5%, asam asetat 50%, forestal dan BAA, sebagai fase diam adalah kertas Whatman no. 3 dan penampak bercak sinar ultraviolet (UV) 366 nm dan aluminium (III) klorida 5%.
Pemisahan terbaik pada masing-masing fraksi ditunjukkan oleh fraksi etilasetat dengan fase gerak asam klorida 5% dimana fraksi etilasetat memberikan tiga noda yang terpisah yaitu P1 mempunyai Rf 0,66 berflouresensi biru muda, P2 mempunyai Rf 0,26 berflouresensi kuning dan P3 mempunyai Rf 0.052 berflouresensi hijau kuning dilihat dibawah sinar ultraviolet (UV) 366 nm.
Terhadap fraksi etilasetat dinyatakan dengan KKt preparatif sebagai fase gerak asam klorida 5% dan fase diam kertas Whatman no. 3 diperoleh tiga fraksi yaitu PEa1, PEa2 dan PEa3 masing-masing pita dipisahkan berdasarkan flouresensinya di bawah sinar UV 366 nm dari hasil isolasi ternyata PEa3 jumlahnya sangat sedikit maka analisis selanjutnya hanya dilakukan terhadap PEa1 dan PEa2. Masing-masing fraksi digunting berupa potongan-potongan kecil, direndam dalam metanol selama 24 jam dan sekali-sekali dikocok, lalu disaring kemudian diuapkan hingga diperoleh kristal isolat, untuk Pea1 sebanyak 10 mg dan Pea2 5 mg, selanjutnya PEa1 dan PEa2 dilakukan KKt kualitatif dimana PEa1 mempunyai Rf 0,65 berflouresensi biru dan PEa2 mempunyai Rf 0,25 berflouresensi kuning dengan fase gerak asam klorida 5% dengan penampak noda sinar UV 366 nm dan aluminium klorida 5%.
366 nm dan setelah disemprot dengan aluminium (III) klorida 5% serta dilihat dibawah sinar UV 366 nm tetap menunjukkan satu noda.
Hasil isolat PEa1 mempunyai Rf 0.65 memberi warna biru dengan sinar UV 366 nm dan setelah disemprot dengan aluminium (III) klorida 5% tetap berfloresensi biru sedangkan isolat PEa2 mempunyai Rf 0.25 memberi warna lembayung gelap dengan sinar UV 366 nm dan setelah disemprot dengan aluminium (III) klorida 5% berflourensensi kunung.
Penafsiran spektrum UV hanya dilakukan untuk isolat PEa1 sedangkan isolat PEa2 tidak dilakukan karena isolat kristal yang dihasilkan hanya sedikit.
Penafsiran spektrum UV dilakukan untuk isolat PEaI sebagai berikut :
1. Hasil spektrum PEa1 dalam metanol memberikan pita absorbsi maksimum 327.0 nm (pita 1) dan 248.0 nm (pita 2). Ini sesuai untuk senywa flavonoida golongan isoflavon dimana panjang gelombang absorbsi maksimum adalah 310 - 330 nm (pita 1) dan 245 - 275 nm (pita 2), dengan demikian senyawa flavonoida tersebut diduga adalah golongan isoflavon ( Markham, 1988).
2. Hasil spektrum PEa1 dalam metanol dengan penambahan natrium hidroksida menunjukkan pergeseran batokromik pada pita 1 dengan atau tanpa peningkatan intensitas, menunjukkan adanya OH pada cincin A. Pada pendiaman selama lima menit pita 2 kekuatan menurun dengan bertambahnya waktu menunjukan o-diOH pada cincin A.
klorida memberikan pergeseran batokromik 11 - 30 nm, menunjukkan O-diOH pada cincin A atom C 6 dan 7.
4. Hasil spektrum P1 dalam metanol dengan penambahan natrium asetat kekuatan berkurang dengan bertambahnya waktu, menunjukkan gugus yang peka terhadap basa pada atom C 6 dan 7.
Hasil penafsiran spektrum UV dengan penambahan pereaksi geser terhadap isolat PEa1 dapat disimpulkan bahwa senyawa flavonoid ini adalah golongan isoflavon yang mempunyai gugus O-diOH pada cincin A pada atom C6 dan 7 ( Markham, 1988).
Rumus bangun
OH
BAB V
KESIMPULAN DAN SARAN 5.1. Kesimpulan
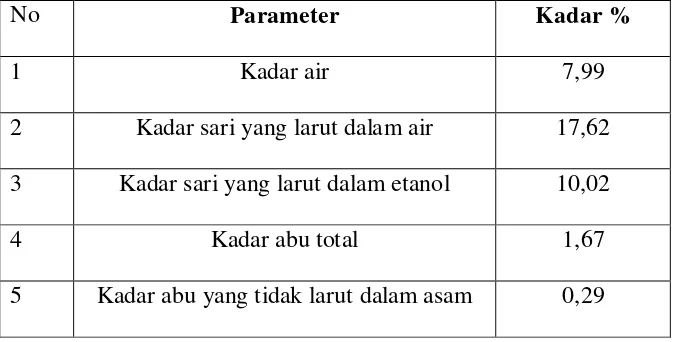
Hasil pemeriksaan karakterisasi simplisia daun tumbuhan pacar air (Impatiens balsamina L.) meliputi penetapan kadar air adalah 7,99 %, penetapan kadar sari yang larut dalam air adalah 17,62 %, penetapan kadar sari yang larut dalam etanol adalah 10,02 %, penetapan kadar abu total adalah 1,67 % dan penetapan kadar abu yang tidak larut dalam asam adalah 0,29 %.
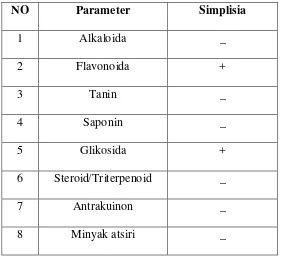
Hasil pemeriksaan skrining fitokimia serbuk simplisia daun pacar air menunjukkan senywa flavonoida dan glikosida.
Hasil isolasi senyawa flavonoida dari daun tumbuhan pacar air (Impatiens balsamina L.) dengan kromatografi kertas diperoleh tiga isolat murni yaitu isolat
PEaI (Rf 0,66), isolat PEa2 (Rf 0,26) dan isolat PEa3 (Rf 0,052) masing-masing meggunakan pengembang asam klorida 5 % dan penampak noda aluminium klorida 5% di bawah sinar UV 366 nm. Hasil karakterisasi isolat secara spektrofotometri dengan penambahan pereaksi geser disimpulkan isolat PEaI adalah senyawa flavonoida golongan isoflavon yang mempunyai gugus O-diOH pada cincin A atom C6 dan 7.
5.2. Saran
DAFTAR PUSTAKA
Adnan, M. (1997). Teknik Kromatografi Untuk Analisis Bahan Makanan. Edisi I. Yogyakarta : Penerbit ANDI. Hal. 10-12.
Anonim. (2009).
Anonim.(2009) Arief, H. (2005). Tumbuhan Obat dan Khasiatnya. Cetakan Pertama. Jakarta:
Penerbit Penebar swadaya. Hal.151-154.
Depkes RI. (1994). Inventaris Tanaman Obat Indonesia (III). Jakarta: Badan penelitian dan Pengembangan Kesehatan. Hal. 101.
Ditjen POM. (1974). Ekstrak Farmakofe Indonesia. Jakarta: Departemen Kesehatan RI. Hal. 831.
Ditjen POM. (1979). Farmakofe Indonesia. Edisi III. Jakarta: Departemen Kesehatan RI. Hal.902.
Ditjen POM. (2000). Parameter Standar Umum Ekstrak Tumbuhan Obat. Jakarta: Departemen Kesehatan RI. Hal. 10-11.
Ditjen POM. (1995). Material Medika Indonesia. Jilid VI. Cetakan keenam. Jakarta: Departemen Kesehatan RI. Hal.321-325, 333-337.
Eaton, D.C. (1989). Laboratory Investigation in Organic Chmistry. USA: Mc Graw Hill.P.149-150.
Farnsworth, N.R. (1986). Biological and Phytochemical Screening of Plants. Journal of Pharmaceutical Science. Volume 55. Number 3. Chicago: Reheis ChemicalCompany P.262-263.
Geissman, T.A. (1962). Priciples of Organic Chemistry. Fourth Edition. San fransisco: W.H. freeman and Company. P.61,108.
Griter, R.J. Bobitt, J.M., dan Schwarting, A.E. (1991). Pengantar Kromatografi. Terjemahan: Padmawinata, K. Edisi II. Bandung: Penerbit ITB. Hal. 1-9, 107-178.
Harborne, J.B. (1978). Metode Fitokimia. Edisi II. Penerjemah: Kosasih Padmawinata dan Iwang Soediro. Bandung : Penerbit ITB. Hal. 152.
Markham, K.R. (1988). Cara mengidentifikasi Flavonoida. Bandung : Penerbit ITB hal.23-47.
Noerdin, D. ( 1985), Elusidasi Struktur Senyawa Organik Dengan Cara Spektroskofi Ultralembayung dan Inflamerah. Edisi I. Bandung: Penerbit Angkasa. Hal. 1,,4,8.
Sastrohamidjojo, H. (1985). Spektroskopi. Edisi I. yogyakarta: Penerbit Liberty. Hal. 1,11-12, 23-24.
Sastrohamidjojo, H.(1991). Kromatografi. Edisi II. Yogyakarta: Liberty. Hal. 1-9, 13-17, 23-24, 26-36.
Stahl, E. (1985). Analisis Obat Secara Kromatografi dan Mikroskopi. Terjemahan: Padmawinata, K dan Sudiro, I. Bandung: Penerbit ITB. Hal. 3-18.
Lampiran 1
Gambar 1. Tumbuhan pacar air ( Impatiens balsamina L.)
[image:56.595.157.467.414.654.2]Lampiran 3
Gambar 3 Simplisia daun tumbuhan pacar air ( Impatiens balsamina L.)
[image:58.595.161.463.373.584.2]Lampiran 4
Tabel 1. Makroskopik daun tumbuhan pacar air
NO ORGANOLEPTIS SIMPLISIA
1 Bentuk Keriput, bergulung, panjang 2-6 cm dan lebar 2-3 cm
2 Bau Tidak berbau
Lampiran 5
Gambar 5. Mikroskopik Serbuk Simplisia Dau Pacar Air Perbesaran 10 x 40 Keterangan :
1. Rambut penutup
2. Stomata tipe Anomositik
Lampiran 6
I. Perhitungan hasil pemeriksaan karakteristik simplisia 1. Perhitungan penetapan kadar air simplisia
1. Berat sampel I = 5,003 g Volume air = 0,5 ml
Kadar air = x 100% 9,99% 5,003
5 ,
0 =
2. Berat sampel II = 5,005 g Volume air = 0,3 ml
Kadar air = x 100% 5,99% 5,005
3 ,
0 =
3. Berat sampel III = 5,002 g Volume air = 0,4 ml
Kadar air = x 100% 7,99% 5,002
4 ,
0 =
Kadar air rata-rata = 100%
3 % 7,99 % 5,99 % 99 , 9 x + +
= 7,99 %
2. Perhitungan penetapan kadar sari yang larut dalam air
% 100 x 20 100 x sampel hasil sisa gr Berat air dalam larut yang sari kadar Persen Berat =
1. Berat sampel I = 5,003 g
Berat cawan awal = 47,571 g
Kadar air simplisia = x 100% sampel
% 100 x 20 100 x 5,003 47,571 47,760 air dalam larut yang sari kadar
Persen =
= 18,88 %
2.Berat sampel II = 5,001 g
Berat cawan awal = 60,330 g Berat cawan akhir rata-rata = 60,505 g
% 100 x 20 100 x 5,001 60,330 60,505 air dalam larut yang sari kadar
Persen =
=17,49 % 3.Berat sampel III = 5,002 g Berat cawan awal = 43,373 g Berat cawan akhir rata-rata = 43,528 g
% 100 x 20 100 x 5,002 43,373 43,528 air dalam larut yang sari kadar
Persen =
= 16,49 %
Kadar sari rata-rata = 100%
3 % 16,49 % 17,49 % 18,88 x + + = 17,62%
3. Perhitungan penetapan kadar sari yang larut dalam etanol
% 100 x 20 100 x sampel hasil sisa gr Berat etanol dalam larut yang sari kadar Persen Berat =
1. Berat sampel I = 5,001 g
Berat cawan awal = 43,080 g
Berat cawan akhir rata-rata = 43,178 g
% 100 x 20 100 x 5,001 43,080 43,178 etanol dalam larut yang sari kadar
= 9,59 %
2.Berat sampel II = 5,000 g
Berat cawan awal = 62,391 g Berat cawan akhir rata-rata = 62,483 g
% 100 x 20 100 x 5,000 62,391 -62,483 etanol dalam larut yang sari kadar
Persen =
= 9,20 % 3. Berat sampel III = 5,004 g Berat cawan awal = 47,670 g Berat cawan akhir rata-rata = 47,783 g
% 100 x 20 100 x 5,004 47,670 47,783 etanol dalam larut yang sari kadar
Persen =
= 11,29 %
Kadar sari rata-rata = 100%
3 11,29% 9,20% % 9,59 x + +
= 10,03 % 4. Perhitungan penetapan kadar abu total
% 100 x sampel Berat hasil sisa gr Berat abu total kadar Persen =
1. Berat sampel I = 2,0005 g Berat abu = 0,0374 g
Persen kadar abu total = x 100% 2,0005
0374 , 0
= 1,87%
Persen kadar abu total = x 100% 2,0009
0314 , 0
= 1,57 %
3. Berat sampel III = 2,0000 g Berat abu = 0,0319 g Persen kadar abu total = x 100%
2,0000 0319 , 0
= 1,59 %
Kadar abu total rata-rata = 100%
3 1,59% 1,57% % 1,87 x + +
= 1,67 %
5. Perhitungan penetapan kadar abu yang tidak larut dalam asam % 100 x sampel Berat hasil sisa gr Berat asam larut abu tidak kadar
Persen =
1.Berat sampel I = 2,0005 g Berat abu = 0,0028 g
Persen kadar abu tidak larut asam = x 100% 2,0005
0028 , 0
= 0,14 %
2.Berat sampel II = 2,0009 g Berat abu = 0,0089 g
Persen kadar abu tidak larut asam = x 100% 2,0009
0089 , 0
= 0,44 %
3.Berat sampel III = 2,0000 g Berat abu = 0,0061 g
Persen kadar abu tidak larut asam = x 100% 2,0000
0061 , 0
= 0,31 %
Kadar abu tidak larut asam rata-rata = 100% 3 0,31% 0,44% % 0,14 x + +
(Lanjutan)
Tabel 2. Hasil pemeriksaan karakterisasi serbuk simplisia daun pacar air
No Parameter Kadar %
1 Kadar air 7,99
2 Kadar sari yang larut dalam air 17,62 3 Kadar sari yang larut dalam etanol 10,02
4 Kadar abu total 1,67
Lampiran 7
Tabel 1. Hasil skrining fitokimia dari daun pacar air
NO Parameter Simplisia
1 Alkaloida _
2 Flavonoida +
3 Tanin _
4 Saponin _
5 Glikosida +
6 Steroid/Triterpenoid _
7 Antrakuinon _
8 Minyak atsiri _
Lampiran 8
[image:67.595.112.504.115.462.2]
Gambar 6. Bagan 1. Pembuatan ekstrak serbuk simplisia daun tumbuhan pacar Air (Impatiens balsaminna L.)
Dimaserasi selama 3 jam
Dimasukkan kedalam alat perkolator Dituangkan cairan penyari etanol secukupnya sampai semua terendam Ditutup mulut tabung perkolator dengan aluminium foil
Dibiarkan selama 24 jam
Dibuka kran dan dibirkan tetesan mengalir
Serbuk simplisia daun tumbuhan pacar air (Impatiens balsamina L.)
Ampas perkolat
Disaring
Lampiran 9
Gambar 7. Bagan 2. Metode penelitian
Daun Pacar Air segar Dicuci Ditiriskan
Dikeringkan di lemari pengering
Simplisia
Dihaluskan
Serbuk Simplisia
Pembuatan Ekstrak etanol Penapisan
Fitokimia
Karakterisasi Simplisia
• Pemeriksaan makroskopik
• Pemeriksaan mikroskopik
• Penetapan kadar air
• Penetapan kadar sari larut dalam air
• Penetapan kadar sari larut dalam etanol
• Penetapan kadar abu total
• Penetapan kadar abu yang tidak larut dalam asam
• Alkaloida
• Flavonoida
• Saponin
• Tanin
• Glikosida
Lampiran 10
[image:69.595.115.504.102.680.2]
Gambar 8. Bagan 3. Fraksinasi cair-cair senyawa flavonoida dari ekstrak etanol. Ektrak Etanol Pekat
Ditambah 10 ml etanol Ditambah 100 ml air panas
Diestraksi dengan 100 ml n-heksan (3x)
Fraksi Air / etanol Fraksi
n-heksan
Dipekatkan Diekstraksi 100 ml
kloroform (3x) Fraksi
n-heksan kental
Fraksi kloroform
Fraksi Air / etanol
Diekstraksi dengan 100 ml etil asetat (3x) Dipekatkan
Fraksi kloroformkental
Fraksi etilasetat
Fraksi Air / etanol
Dipekatkan Dipekatkan
Fraksi Air Fraksi
Lampiran 11
Gambar 9. Bagan 4. Isolasi senyawa flavonoida dari fraksi etilasetat dengan KKt.
Fraksi Etil Asetat
Di KKt dengan pengembang Forestal
BAA
Asam asetat 50 % HCL 1 %
HCL 5 %
Kromatogram Forestal
Kromatogram HCL 5 %
Kromatogram Asam asetat 50 % Kromatogram
HCL 1 %
Kromatogram BAA
Di KKt preparatif
Pita I Pita II Pita III
Digunting Direndam Disaring Diuapkan Digunting Direndam Disaring Diuapkan
Isolat pita II Isolat pita I
Di KKt kualitatif Di KKt kualitatif
II coklat Rf (0.25) 1 Biru
Rf (0.65)
Di KKt dua arah Di KKt dua arah
kromatogram Kromatogram
dengan satu noda (isolate murni )
Penentuan struktur dengan spekropotometri UV dengan pereaksi geser
Lampiran 12
Gambar 10 : Kromatogram masing-masing fraksi setelah dilihat dibawah sinar UV
Keterangan :
1. fraksi n-heksan, 2. fraksi kloroform, 3. fraksi etil asetat, 4. fraksi air, = berfluorensensi; c = coklat; k= kuning; b= biru; hk= hijau kuning; tp= tempat penotolan; bp= batas penotolan; penampak bercak aluminium III klorida 5 % dalam etanol, fase diam kertas Whatman no. 3 dan fase gerak Forestal
b c
k
•
1 •
hk
2 c
• h
3 k
c
•
bp
tp 4
h hk b
(Lanjutan)
Gambar 11 : Kromatogram masing-masing fraksi setelah dilihat dibawah sinar UV
Keterangan :
1. fraksi n-heksan, 2. fraksi kloroform, 3. fraksi etil asetat, 4. fraksi air, = berfluorensensi; c = coklat; k= kuning; b= biru; hk= hijau kuning; tp= tempat penotolan; bp= batas penotolan; penampak bercak aluminium III klorida 5 % dalam etanol, fase diam kertas Whatman no. 3 dan fase gerak asam asetat 50 %.
b
h
• 1
• 2 hk
b c
• h
3 k c
• c h
bp
(Lanjutan)
Gambar 12 : Kromatogram masing-masing fraksi setelah dilihat dibawah sinar UV
Keterangan :
1. fraksi n-heksan, 2. fraksi kloroform, 3. fraksi etil asetat, 4. fraksi air, = berfluorensensi; c = coklat; k= kuning; b= biru; hk= hijau kuning; tp= tempat penotolan; bp= batas penotolan; penampak bercak aluminium III klorida 5 % dalam etanol, fase diam kertas Whatman no. 3 dan fase gerak BAA.
c k
hk
• 1
• 2 hk
c
• 3 b
k c
• 4 b c k
bp
(Lanjutan)
Gambar 13 : Kromatogram masing-masing fraksi setelah dilihat dibawah sinar UV
Keterangan :
1. fraksi n-heksan, 2. fraksi kloroform, 3. fraksi etil asetat, 4. fraksi air, = berfluorensensi; c = coklat; k= kuning; b= biru; hk= hijau kuning; tp= tempat penotolan; bp= batas penotolan; penampak bercak aluminium III klorida 5 % dalam etanol, fase diam kertas Whatman no. 3 dan fase gerak asam klorida 1 %
b
k • 1
• 2 hk
b
• b
k
3 hk
• b
h
bp
(Lanjutan)
Gambar 14 : Kromatogram masing-masing fraksi setelah dilihat dibawah sinar UV
Keterangan :
1. fraksi n-heksan, 2. fraksi kloroform, 3. fraksi etil asetat, 4. fraksi air, = berfluorensensi; c = coklat; k= kuning; b= biru; hk= hijau kuning; tp= tempat penotolan; bp= batas penotolan; penampak bercak aluminium III klorida 5 % dalam etanol, fase diam kertas Whatman no. 3 dan fase gerak asam klorida 5 %
b