EKSPLORASI DAN IDENTIFIKASI CENDAWAN
ANTAGONIS TERHADAP
Rigidoporus lignosus
PENYEBAB
JAMUR AKAR PUTIH PADA KARET
ALCHEMI PUTRI JULIANTIKA KUSDIANA
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
ABSTRAK
ALCHEMI PUTRI JULIAN TIKA KUSDIAN A. Eksplorasi dan Identifikasi Cendawan Antagonis terhadap Rigidoporus lignosus Penyebab Jamur Akar Putih pada Karet. Dibimbing oleh MEITY SURADJI SINAGA.
Industri karet berperan dalam peningkatan pendapatan petani, masyarakat, dan negara, juga dalam pembuatan produk, serta peranan terhadap pelestarian lingkungan. Salah satu hambatan dalam pengembangan budidaya karet adalah adanya penyakit jamur akar putih yang disebabkan oleh Rigidoporus lignosus. Penelitian ini bertujuan mengeksplorasi dan mengidentifikasi cendawan antagonis terhadap R. lignosus. Penelitian dilakukan dengan mengambil contoh tanah dari tanaman karet dan kelapa sawit untuk dibuat suspensi. Suspensi dibuat seri pengenceran hingga tingkat pengenceran 10-5, masing- masing seri pengenceran tersebut diambil sebanyak 1 ml suspensi dan dibiakkan pada media potato dextrose agar (PDA). Uji antagonisme in vitro antara agens antagonis dengan
R. lignosus dilakukan dengan menggunakan metode dual culture. Pengamatan dilakukan dengan mengukur jari-jari koloni patogen yang menjauhi isolat cendawan kandidat dan jari-jari koloni patogen yang mendekati isolat cendawan kandidat, serta menghitung penghambatan kandidat agens antagonis. Identifikasi menggunakan compound microscope. Dari hasil isolasi cendawan rhizosfer diperoleh 26 isolat kandidat antagonis, 10 isolat diantaranya memiliki kemampuan antagonisme terhadap patogen R. lignosus. Hasil identifikasi menunjukkan sebanyak tiga isolat adalah Trichoderma harzianum, enam isolat adalah Gliocladium virens, dan satu isolat adalah Penicillium resticulosum.
Mekanisme antagonis yang dilakukan oleh T. harzianum dan G. virens adalah
hiperparasit, antibiosis, lisis, dan kompetisi ruang. Sedangkan untuk
P. resticulosum adalah kompetisi ruang.
EKSPLORASI DAN IDENTIFIKASI CENDAWAN
ANTAGONIS TERHADAP
Rigidoporus lignosus
PENYEBAB
JAMUR AKAR PUTIH PADA KARET
ALCHEMI PUTRI JULIANTIKA KUSDIANA
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian
pada
Departemen Proteksi Tanaman
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
Judul Skripsi : Eksplorasi dan Identifikasi Cendawan Antagonis terhadap
Rigidoporus lignosus Penyebab Jamur Akar Putih pada Karet Nama Mahasiswa : Alchemi Putri Juliantika Kusdiana
NIM : A34070005
Menyetujui, Dosen Pembimbing
Prof. Dr. Ir. Meity Suradji Sinaga, M.Sc NIP. 19501125 197603 2 002
Mengetahui,
Ketua Departemen Proteksi Tanaman
Prof. Dr. Ir. Dadang, M.Sc NIP. 19640204 199002 1 002
RIWAYAT HIDUP
Penulis dilahirkan di Garut, Jawa Barat pada tanggal 18 Juli 1990. Penulis merupakan putri pertama dari tiga bersaudara pasangan Bapak Drs. Nandang Kusdiana dan Ibu Ika Kartika, SPd.
Penulis menyelesaikan pendidikan sekolah menengah atas di SMA Negeri 1 Cibatu, Garut pada tahun 2007. Pada tahun yang sama penulis melanjutkan studinya di Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor melalui jalur Undangan Seleksi Masuk Institut Pertanian Bogor (USMI).
PRAKATA
Puji syukur penulis panjatkan kehadirat Allah SWT yang telah melimpahkan rahmat-Nya, sehingga penulis dapat menyelesaikan skripsi yang
berjudul “Eksplorasi dan Identifikasi Cendawan Antagonis terhadap Rigidoporus lignosus Penyebab Jamur Akar Putih pada Karet”. Skripsi ini disusun sebagai
salah satu syarat untuk memperoleh gelar Sarjana Pertanian pada Departemen Proteksi Tanaman, Institut Pertanian Bogor. Penelitian dilaksanakan di Laboratorium Mikologi Tumbuhan, Departemen Proteksi Tanaman, Institut Pertanian Bogor dari bulan Februari sampai bulan Juli 2011.
Penulis menyadari bahwa tanpa bimbingan, dukungan, dan bantuan dari berbagai pihak, penulis tidak dapat berbuat maksimal dalam menyelesaikan skripsi ini. Untuk itu dengan rasa tulus pada kesempatan ini, penulis ingin menyampaikan ucapan terima kasih kepada:
1. Prof. Dr. Ir. Meity Suradji Sinaga, MSc selaku dosen pembimbing yang senantiasa memberikan bimbingan, masukan, dan arahan kepada penulis; 2. Dr. Ir. Idham Sakti Harahap, MSc selaku dosen penguji tamu yang telah
memberikan arahan dan saran yang bermanfaat;
3. PT Perkebunan Nusantara VIII, perkebunan karet Jalupang, Jawa Barat dan PT Perkebunan Nusantara IV, perkebunan kelapa sawit Adolina, Sumatera Utara atas izin dan kerjasamanya dalam pengambilan contoh tanah;
4. Ayahanda Drs. Nandang Kusdiana dan Ibunda Ika Kartika, SPd. yang tak henti-hentinya memberi perhatian dan bantuan moril maupun spiritual, yang
mana setiap langkah, gerak, dan ucapnya merupakan do‟a bagi penulis, serta kedua adik penulis Benzena Dwi Putra Kusdiana dan Chemistry Melika Putri Kusdiana;
5. Keluarga besar Bapak H. Ohan Suhana (alm) dan Bapak Japar Sidiq (alm) yang selalu memberikan doa dan dukungannya kepada penulis;
6. Keluarga besar Kaslieyitno Albarru, SE. atas semangat, perhatian, dan dukungannya kepada penulis;
7. Sahabat seperjuangan Proteksi Tanaman 44, khususnya kepada Nur‟asiah, Etika Ayu Kusumadewi, dan Nur „Izza Faiqatul Himmah;
8. Rekan kerja di Laboratorium Mikologi, Bapak Dadang Surachman, mba Dian Safitri, M. Julyanda, Veronica, dan Bapak Fajar Rianto;
9. Sahabat AGGS, Umu Rosidah, Rizky Agnestia Andini, Khusnul Khotimah, Rina Rystiawati (alm), Rima Rachmawati, Noor Zuhaidha, Siti Saadah, dan Azizah Purwitasari;
10. Mahasiswa, dosen, staff, beserta laboran Departemen Proteksi Tanaman, serta semua pihak yang tidak dapat disebutkan satu persatu.
Penulis menyadari bahwa skripsi ini masih jauh dari kesempurnaan. O leh karena itu, penulis mengharapkan kritik dan saran yang bersifat membangun untuk kedepannya. Akhir kata penulis serahkan skripsi ini dengan penuh rasa bangga.
Bogor, Oktober 2011
DAFTAR ISI
Faktor yang Mempengaruhi Perkembangan Penyakit ... 6
vii
Kesimpulan ... 26
Saran ... 26
DAFTAR PUSTAKA ... 27
DAFTAR TABEL
Halaman 1 Hasil eksplorasi cendawan rhizosfer pada pertanaman karet dan
kelapa sawit ... 16 2 Persen penghambatan oleh kandidat cendawan antagonis terhadap
DAFTAR GAMBAR
Halaman 1 Hasil uji antagonisme in vitro cendawan rhizosfer dengan cendawan
R. lignosus pada satu hsi kandidat cendawan antagonis ... 19
2 Hasil uji antagonisme in vitro cendawan rhizosfer dengan cendawan R. lignosus pada tujuh hsi kandidat cendawan antagonis ... 20
3 Trichoderma harzianum hasil identifikasi isolat L, S, dan V ... 22
4 Gliocladium virens hasil identifikasi isolat F, I, J, K, N, dan W ... 23
DAFTAR LAMPIRAN
Halaman 1 Isolat hasil eksplorasi dari tanah rhizosfer karet dan kelapa sawit ... 31 2 Jari-jari pertumbuhan koloni patogen R. lignosus pada media PDA
termodifikasi ... 32 3 Persen penghambatan pertumbuhan koloni R. lignosus oleh kandidat
PENDAHULUAN
Latar Belakang
Karet merupakan salah satu tanaman perkebunan yang mempunyai peran penting bagi subsektor perkebunan negara Indonesia. Indonesia merupakan negara produsen karet dunia terbesar bersama dua negara produsen karet alam lainnya yaitu Thailand dan Malaysia. Indonesia memberikan kontribusi sebesar 26% dari total produksi karet alam dunia. Pengembangan industri karet memberi manfaat dalam peningkatan pendapatan petani, masyarakat, dan negara. Selain itu, industri karet memiliki berbagai macam kegunaan baik untuk industri ban maupun produk lainnya seperti untuk kebutuhan kesehatan, properti atau ba ngunan, farmasi, dan peranan pertanaman karet terhadap pelestarian lingkungan (Deptan 2010). Berdasarkan data dari Badan Pusat Statistik (2009), luas lahan karet di Indonesia mencapai 5,264 juta hektar dengan produksi karet kering sebanyak 640,787 ton. Produksi karet menciptakan nilai tambah di dalam negeri dan ekspor sebagai penghasil devisa bagi negara.
Pengembangan industri karet hingga saat ini terus dilakukan. Namun, terdapat hambatan dalam pengembangan budidaya karet tersebut antara lain adanya serangan penyakit. Diantaranya penyakit penting yang menyerang karet adalah penyakit jamur akar putih (JAP) yang disebabkan oleh cendawan
2
tersebut dapat menimbulkan kerusakan di kebun entres, tanama n belum menghasilkan, dan tanaman menghasilkan. Kerusakan berat sering terjadi pada tanaman belum menghasilkan. Kematian tanaman mengakibatkan rendahnya kerapatan pohon karet per hektar yang berpengaruh langsung terhadap produktivitas kebun karet (Situmorang 2004).
Jamur akar putih menjadi penyakit yang sangat penting karena penyebabnya memiliki kisaran inang yang luas. Selain menyerang karet, jamur akar putih dapat menyerang teh, kopi, kakao, kelapa sawit, mangga, nangka, ubi kayu, jati, cengkeh, duwet, lamtoro, sengon, dadap, nibung, kapur barus, cemara, kayu besi, meranti, rasamala, walikukun, kesambi, randu alas, kumpas, akasia, Ficus spp., dan Agzelia sp. Jamur akar putih juga dapat menyerang pupuk hijau, seperti
Tephrosia spp. dan Crotalaria spp. Tanaman penutup tanah kacangan yang menjalar (legume creeping cover, LCC) juga rentan terhadap jamur akar ini (Semangun 2000).
Serangan patogen R. lignosus menyebabkan akar menjadi busuk dan umumnya ditumbuhi rizomorf cendawan. Gejala tampak pada daun; daun-daun yang semula tampak hijau segar berubah menjadi layu, berwarna kusam, dan akhirnya kering (Pawirosoemardjo 2004).
Beberapa cara pengendalian penyakit jamur akar putih telah dilakukan, diantaranya dengan menghilangkan tunggul-tunggul atau organ tanaman berkayu secara tuntas sebagai sumber infeksi, menanam tanaman penutup tanah jenis leguminosa, pelumasan dan penyiraman fungisida, serta pengendalian dengan menggunakan agens hayati seperti Trichoderma spp. yang bersifat antagonis terhadap patogen (Pawirosoemardjo 2004).
Penyakit jamur akar putih efektif dikendalikan dengan pengendalian hayati menggunakan agens antagonis, seperti Trichoderma spp. (Widyastuti et al. 1998). Eksplorasi pada tanah rhizosfer karet dan kelapa sawit dilakukan dalam penelitian ini, guna mencari cendawan antagonis lainnya yang diharapkan dapat efektif dan stabil bila dilakukan pengendalian penyakit jamur akar putih dengan menggunakan pengendalian hayati.
3
atau lebih organisme yang berlangsung secara alami atau melalui manipulasi lingkungan, inang, antagonis, atau dengan introduksi secara massal satu atau lebih organisme antagonis (Cook & Baker 1983).
Tujuan Penelitian
Penelitian ini bertujuan untuk mengeksplorasi dan mengidentifikasi cendawan antagonis terhadap R. lignosus.
Manfaat Penelitian
Manfaat yang diharapkan dari penelitian ini ialah memperoleh beberapa cendawan antagonis yang berpotensi menghambat dan menekan perkembangan
TINJAUAN PUSTAKA
Tanaman Karet
Budidaya Karet
Pembangunan kebun karet diperlukan manajemen dan teknologi budidaya tanaman karet yang memperhatikan syarat tumbuh tanaman karet, klon‐klon karet rekomendasi, bahan tanam atau bibit, persiapan tanam dan penanaman, pemeliharaan tanaman meliputi pengendalian gulma; pemupukan; dan pengendalian penyakit, serta penyadapan atau panen (Anwar 2001).
Klon Karet
Klon unggul baru merupakan syarat utama agar komoditas karet dapat menghasilkan produksi dengan tingkat produktivitas yang tinggi sehingga dapat menguntungkan dalam persaingan global. Klon karet unggul yang dihasilkan oleh Balai Penelitian Karet Sembawa direkomendasikan untuk periode tahun 2010-2014 yang disesuaikan dengan Undang-Undang No. 12 Tahun 1992 tentang Sistem Budidaya Tanaman yang menyebutkan bahwa klon/varietas yang dapat disebarluaskan kepada pengguna harus berupa benih bina. Klon anjuran komersial dikelompokkan menjadi dua kelompok yaitu kelompok klon penghasil lateks (IRR 104, IRR 112, IRR 118, IRR 220, BPM 24, PB 260, PB 330, dan PB 340) dan penghasil lateks-kayu (RRIC 100, IRR 5, IRR 39, IRR 42, IRR 107, dan IRR 119), sedangkan benih anjuran untuk batang bawah (AVROS 2037, GT 1, BPM 24, PB 260, RRIC 100, dan PB 330) (Ditjenbun 2010).
Penyakit Jamur Akar Putih pada Karet
Patogen Penyebab Jamur Akar Putih
Penyakit jamur akar putih disebabkan oleh cendawan Rigidoporus lignosus
5
dengan nama Fomes lignosus (Klotzsch) Bres. Cendawan ini mempunyai lebih kurang 35 nama lain (sinonim) (Semangun 2000).
Sebaran Penyakit
Penyakit jamur akar putih menyebar di perkebunan karet daerah tropik terutama Indonesia. Penyakit ini dijumpai di dataran rendah, dataran tinggi, dan di daerah beriklim basah dan kering dengan keparahan penyakit yang berbeda. Daerah yang sering mengalami serangan skala berat adalah Riau, Sumatera Barat, dan Kalimantan Barat; serangan skala sedang adalah Nangro Aceh Dar ussalam, Sumatera Utara, Jambi, sebagian Sumatera Selatan, sebagian Bengkulu, dan sebagian Lampung; dan serangan skala ringan adalah Jawa Barat, Jawa Tengah, Jawa Timur, Kalimantan Selatan, Kalimantan Tengah, dan Kalimantan Timur (Situmorang et al. 2006).
Daur Penyakit
Penyakit jamur akar putih R. lignosus tergolong ke dalam tipe epidemik penyakit monosiklik. Penyakit monosiklik adalah penyakit yang untuk menyebabkan kehilangan produksi yang sangat tinggi, atau yang dapat mematikan tanaman hanya dengan satu siklus infeksi per siklus tanaman (Sinaga 2004).
Jamur akar putih terutama menular karena adanya kontak antara akar tanaman sehat dengan akar tanaman sakit, atau dengan kayu-kayu yang mengandung cendawan R. lignosus. Cendawan ini dapat menular dengan perantaraan rizomorf. Rizomorf pada jamur akar putih dapat menjalar bebas dalam tanah (Semangun 2000).
Gejala Penyakit Jamur Akar Putih
6
pertama, hal ini tergantung kepada banyaknya bibit penyakit (patogen) yang terdapat dalam tanah. Penyakit akar putih sering menimbulkan kerusakan pada areal pertanaman yang terdapat banyak tunggul atau sisa akar kayu, bekas tanaman tua atau bekas hutan primer, atau tanah gembur dan berpasir (Situmorang & Budiman 2003).
Serangan patogen R. lignosus menyebabkan akar menjadi busuk dan umumnya ditumbuhi rizomorf cendawan. Rizomorf adalah paduan kompak benang-benang cendawan yang menyerupai akar tanaman. Rizomorf yang muda berwarna putih dan bentuknya pipih, semakin tua umur rizomorf warna putih tersebut berubah menjadi kuning gading, dan bentuknya menyerupai akar rambut. Membusuknya akar diduga karena rusaknya struktur kimia kulit dan kayu akibat enzim yang dihasilkan cendawan. Gejala yang tampak pada daun adalah daun-daun yang semula tampak hijau segar berubah menjadi layu, berwar na kusam, dan akhirnya kering. Pada keadaan tersebut menunjukkan bahwa tanaman telah menderita serangan pada tahap lanjut dan tidak mungkin untuk diselamatkan. Selain dapat menyerang secara akut, R. lignosus dapat pula menyerang secara kronis pada tanaman yang telah tua. Gejala serangan secara kronis tersebut tidak tampak jelas, dan baru terlihat apabila tanaman dibongkar, sebagian akar-akarnya telah ditumbuhi rizomorf cendawan (Pawirosoemardjo 2004).
Faktor yang Mempengaruhi Perkembangan Penyakit
Berdasarkan konsep segitiga penyakit, perkembangan penyakit akar putih tergantung dari tiga faktor, yaitu karet (inang), R. lignosus (patogen), dan lingkungan (Prasetyo et al. 2009).
7
sangat ditentukan oleh banyaknya tunggul di lahan yang bersangkutan. Lama bertahan R. lignosus dalam tanah di samping ditentukan oleh hal tersebut juga ditentukan oleh ikut sertanya organisme renik yang melapukkan tunggul. Penularan penyakit terjadi karena adanya kontak akar sakit dan sehat atau adanya miselium yang tumbuh dari food base di sekitar perakaran tanaman sehat (Pawirosoemardjo 2004). Tunggul yang telah terinfeksi jamur akar putih menjadi sumber penularan yang sangat efektif melalui kontak akar menular ke tunggul lain di dekatnya dan menjadi sumber infeksi baru. Pada tunggul tersebut, cendawan membentuk badan buah yang membebaskan banyak spora ke udara dan mendarat ke permukaan tunggul lain, sebagian kecil spora ini akan berkecambah di permukaan tunggul dan berkembang masuk sampai ke perakaran. Hal ini merupakan faktor penyebab bahwa kebun-kebun yang bertunggul akan mengalami serangan berat penyakit jamur akar putih (Situmorang 2004).
Menurut Situmorang (2004), kondisi asal pertanaman kare t mempengaruhi perkembangan penyakit akar putih. Kebun bertunggul yang berasal dari bekas kebun karet tua dan hutan primer akan menyebabkan serangan berat. Tunggul sebagai sumber infeksi dan sumber energi cendawan akan membantu perkembangan penyakit akar putih lebih cepat. Rongga-rongga bekas akar tunggul dalam tanah akan membantu pergerakan cendawan dalam tanah sehingga mempercepat terjadinya infeksi dan penyebaran patogen.
8
topografinya berbukit serangan penyakit relatif ringan sampai sedang karena perembesan air lebih cepat dan tanahnya lebih cepat kering sehingga mengakibatkan perkembangan jamur akar putih tertekan. Penyakit ini juga dapat berkembang lebih baik pada tanah bertekstur kasar/berpasir atau berstruktur gembur berpasir daripada bertekstur halus/liat atau berstruktur padat. Miselia atau rizomorf cendawan akan lebih mudah bergerak menembus tanah berpori daripada tanah padat sehingga penularan patogen akan berlangsung lebih cepat. Cendawan pun berkembang baik pada tanah bereaksi netral pH 6-7 dan pada tanah dengan kapasitas kejenuhan air tanah 80-90%. Kondisi ini biasanya terjadi pada awal sampai akhir musim hujan sehingga selama musim hujan perkembangan penyakit lebih cepat (Situmorang 2004).
Pengendalian Penyakit
Strategi pengelolaan penyakit untuk menghadapi penyakit penting tanaman karet di masa mendatang adalah pengendalian penyakit yang berbasis epidemiologis dan ekobiologis penyakit yaitu (1) menurunkan inokulum awal/initial penyakit (Q/Xo), (2) menekan laju infeksi (R/r), dan (3) menekan periode epidemik (t). Strategi tersebut dapat diaplikasikan secara tunggal atau kombinasi yang berdasarkan konsep pengendalian hama terpadu (PHT). Prinsip pengendalian tradisional yaitu penghindaran, eksklusi, eradikasi, proteksi, resistensi, dan terapi tetap dimanfaatkan untuk digunakan menjadi taktik-taktit pengendalian dalam penyusunan suatu stategi pengendalian yang holistik (Sinaga 2004).
Pengendalian Hayati
9
kisaran inang yang luas. Berdasarkan biologi patogen tersebut, maka pengendalian hayati berpeluang baik untuk berhasil (Susanto 2002).
Pengendalian hayati merupakan perlindungan pada tanaman dari patogen tanaman termasuk penyebaran mikroorganisme antagonis pada saat setelah atau sebelum terjadinya infeksi patogen. Mekanisme dari biokontrol organisme yaitu dalam melemahkan atau membunuh patogen tanaman dengan perlawanan yaitu memparasit patogen secara langsung, memproduksi antibiotik (toksin), dan kemampuannnya dalam kompetisi ruang dan nutrisi, produksi enzim untuk melawan komponen sel patogen, menginduksi respon ketahanan tanaman, dan produksi metabolisme tanaman dalam menstimulasi perkecambahan spora patogen (Agrios 2005).
Pengendalian hayati adalah semua kondisi atau praktik yang berpengaruh terhadap penurunan daya tahan atau kegiatan patogen tanaman melalui interaksi dengan agensia organisme hidup lainnya (selain manusia), yang menghasilkan penurunan keberadaan penyakit yang disebabkan oleh patogen (Soesanto 2008).
Sinaga (2006) mengemukakan bahwa introduksi agens antagonis berpotensi mengendalikan patogen-patogen tular tanah. Aplikasi agens antagonis menunjukkan inisiasi langsung dalam menekan inokulum patogen, mencegah kolonisasi patogen, melindungi perkecambahan biji dan akar tanaman dari infeksi, selain itu agens antagonis dapat langsung menghambat patogen dengan sekresi antibiotik, berkompetisi terhadap ruang dan atau nutrisi, menginduksi proses ketahanan tanaman, serta interaksi langsung dengan patogen. Interaksi yang terjadi berupa hiperparasit, hiperpatogen, atau predator melalui destruksi unit-unit propagatif (propagul) atau biomassa, sehingga dapat mengurangi kepadatan inokulum dan aktivitas patogen.
10
Trichoderma harzianum
Cendawan T. harzianum merupakan cendawan antagonis utama yang efektif digunakan dalam pengendalian penyakit pada pertanian (Amin et al. 2010).
T. harzianum merupakan agen biokontrol yang dapat hidup dalam pathosistem berbeda, dapat menyeimbangkan tanah, dan tidak berbahaya bagi organisme bermanfaat lainnya (Monte & Llobell 2003; Ha 2010).
Mekanisme antagonis dari Trichoderma adalah (1) mycopasitism yaitu cendawan yang mendapatkan nutrisi dari cendawan lainnya tanpa memberikan manfaat, (2) antibiosis yaitu hubungan antara dua organisme yang dapat merugikan salah satu organisme, biasanya salah satu organisme memproduksi toksik, (3) kompetisi nutrisi atau ruang, (4) toleransi terhadap stres melalui akar ditingkatkan dan perkembangan tanaman, (5) penyerapan nutrisi anorganik, (6) induksi resistensi, (7) inaktivasi enzim patogen (Widyastuti 2006).
Morfologi secara mikroskopis untuk cenda wan T. harzianum adalah konidiofor hialin, bercabang banyak; fialid tunggal atau dengan kelompok; konidia (phialospora) hialin, sel tunggal, oval, biasanya mudah dikenal dengan pertumbuhannya yang cepat dan konidia hijau; bersifat saprofitik di tanah atau pada kayu, beberapa spesies dilaporkan bersifat parasit pada cendawan lain (Barnett & Hunter 1998). Klamidospora berwarna cokelat kebulatan (Watanabe 2002).
Gliocladium virens
Gliocladium sp. dapat mengendalikan beberapa patogen tular tanah. Cendawan tersebut dapat mengolonisasi mikroba lain, sehingga mikroba tersebut tidak dapat berkembang. G. virens dapat menghasilkan antibiotik gliotoksin dan viridin yang dapat menekan perkembangan mikroba lain (Cook & Baker 1983).
G. virens merupakan cendawan antagonis yang memiliki mekanisme antagonis
mycoparasit dan dapat memproduksi bahan antifungi (Paulitz & Linderman 1991).
11
terutama pada metula, septat, massa spora fialid pada cabang apikal. Konidia hijau muda, massa hijau tua, elips atau kebulatan, sel tunggal. Klamidospora bulat atau kebulatan (Watanabe 2002).
Penicillium resticulosum
Penicillium sp. merupakan cendawan yang dapat memproduksi beberapa
mycotoxins (Agrios 2005). Koloni Penicillium sp. umumnya tumbuh cepat, berwarna hijau, kadang-kadang putih, dan kebanyakan memiliki konidiofor yang
padat (Miftakhurohmah & Noveriza 2009). Morfologi secara mikroskopis untuk
BAHAN DAN METODE
Waktu dan Tempat Penelitian
Penelitian dilaksanakan dari bulan Februari sampai bulan Juli 2011 di Laboratorium Mikologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor.
Bahan
Bahan-bahan yang digunakan pada penelitian ini adalah tanah yang diambil dari rhizosfer tanaman karet PT Perkebunan Nusantara VIII, Jalupang, Subang,
Jawa Barat; tanah yang diambil dari rhizosfer tanaman kelapa sawit PT Perkebunan Nusantara IV, Adolina, Sumatera Utara; media Potato Dextrose
Agar (PDA); media Malt Extract Agar (MEA); serta isolat cendawan R. lignosus
dan T. harzianum koleksi Laboratorium Mikologi Tumbuhan, Departemen Proteksi Tanaman, Institut Pertanian Bogor.
Metode
Pengambilan Contoh Tanah
Contoh tanah diambil dari tanaman karet dan kelapa sawit. Eksplorasipada tanah rhizosfer tanaman karet dilakukan pada tiga lahan tanaman belum menghasilkan (TBM) dengan tahun tanam 2005, 2007, dan 2008, serta tiga lahan tanaman menghasilkan (TM) dengan tahun tanam 1987, 1989, dan 1991. Eksplorasi pada tanah rhizosfer tanaman kelapa sawit dilakukan pada tiga lahan tanaman dengan tahun tanam 1998 dan tiga lahan tanaman dengan tahun tanam 2006.
13
±0,5 kg sebagai contoh tanah untuk eksplorasi cendawan rhizosfer di laboratorium.
Isolasi Cendawan Rhizosfer
Isolasi cendawan rhizosfer dilakukan dengan teknik pengenceran dengan dua ulangan. Sebanyak 10 g contoh tanah disuspensikan ke dalam labu Erlenmeyer yang telah diisi 90 ml air destilata dan diguncang menggunakan
shaker dengan kecepatan 120 rpm selama 15 menit. Suspensi yang dihasilkan segera dibuat seri pengenceran hingga tingkat pengenceran 10-5 dengan mengambil 1 ml suspensi dan dimasukkan ke dalam tabung reaksi berisi 9 ml air destilata. Masing- masing seri pengenceran tersebut diambil sebanyak 0,1 ml suspensi dan dibiakkan pada media PDA. Tiap koloni cendawan yang tumbuh dikelompokkan berdasarkan bentuk dan warna koloni, kemudian dimurnikan. Semua mikroorganisme yang diperoleh diuji potensi antagonismenya terhadap
R. lignosus. Uji antagonisme dilakukan dengan metode uji ganda pada media PDA.
Uji Antagonisme in Vitro
Uji antagonisme in vitro antara kandidat cendawan antagonis dengan
14
Uji Kemampuan Antagonis
Besarnya pengaruh penghambatan agens antagonis terhadap patogen dihitung menggunakan rumus persentase:
Catatan : bila koloni pertumbuhan R. lignosus sudah tertutup oleh koloni kandidat antagonis, maka dianggap persentase penghambatan cendawan antagonis (I) = 100%.
Identifikasi Cendawan Antagonis
Cendawan yang memiliki nilai persen penghambatan yang tinggi terhadap patogen R. lignosus dimurnikan menggunakan media PDA dan media MEA untuk dilakukan identifikasi sementara di bawah compound microscope (perbesaran 400x). Identifikasi dilakukan dengan melihat penciri hifa dan percabangan, pembentukan konidium atau spora, serta bentuk konidiumnya. Identifikasi cendawan menggunakan kunci determinasi Barnett & Hunter (1998), Watanabe (2002), dan “Doctor Fungi” (http://nt.ars- grin.gov/).
Keterangan :
P : Koloni cendawan patogen R. lignosus
A : Koloni cendawan kandidat antagonis
R1 : Jari-jari koloni R. lignosus yang menjauhi koloni cendawan kandidat antagonis
R2 : Jari-jari koloni R. lignosus yang mendekati koloni cendawan kandidat antagonis
15
Rancangan Percobaan dan Analisis Data
Rancangan percobaan yang dilakukan pada uji antagonisme in vitro adalah Rancangan Acak Lengkap (RAL). Masing- masing perlakuan dilakukan sebanyak tiga kali ulangan, sehingga terdapat 81 unit percobaan. Pengaruh interaksi antara kedua faktor diamati selama sembilan hari setelah inokulasi. Data yang diperoleh dianalisis dengan Microsoft Office Excel 2007 dan dengan analisis sidik ragam menggunakan program Statistical Analysis System (SAS) versi 9.1.3. Perlakuan
yang berpengaruh nyata diuji lanjut dengan uji Duncan dengan taraf α = 0,05
HASIL DAN PEMBAHASAN
Eksplorasi Cendawan Rhizosfer
Hasil eksplorasi cendawan yang dilakukan pada tanah rhizosfer yang berasal dari areal tanaman karet di PT Perkebunan Nusantara VIII, Jalupang, Subang, Jawa Barat dan tanah rhizosfer yang berasal dari areal tanaman kelapa sawit di PT Perkebunan Nusantara IV, Adolina, Sumatera Utara diperoleh 26 jenis cendawan. Sebanyak 14 isolat diantaranya berasal dari tanah rhizosfer karet dan 12 isolat berasal dari tanah rhizosfer kelapa sawit (Tabel 1).
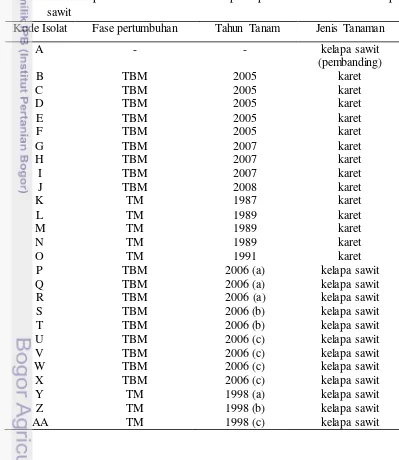
Tabel 1 Hasil eksplorasi cendawan rhizosfer pada pertanaman karet dan kelapa sawit
Kode Isolat Fase pertumbuhan Tahun Tanam Jenis Tanaman
17
Selanjutnya cendawan hasil eksplorasi tersebut diuji kemampuan antagonisme in vitro terhadap cendawan patogen R. lignosus. Sebagai pembanding positif digunakan isolat A yaitu cendawan Trichoderma harzianum
yang telah teridentifikasi kemampuan antagonismenya terhadap berbagai patogen, termasuk R. lignosus. Pada uji antagonisme in vitro terdapat 27 perlakuan dengan ulangan sebanyak tiga kali.
Uji Antagonisme in Vitro
Dalam pengujian antagonisme in vitro dengan menggunakan media PDA, patogen R. lignosus diinokulasikan empat hari lebih dulu dari inokulasi cendawan kandidat antagonis. Hal ini dilakukan karena pertumbuhan patogen R. lignosus
sangat lambat. Pengamatan dilakukan hingga sembilan hsi cendawan kandidat antagonis dengan mengukur jari-jari koloni patogen R. lignosus yang menjauhi koloni cendawan kandidat antagonis (R1) dan jari-jari koloni patogen R. lignosus
yang mendekati koloni cendawan kandidat antagonis (R2). Beberapa calon antagonis menunjukkan efek penghambatan yang cepat yaitu 100% seperti penghambatan yang dilakukan oleh T. harzianum (isolat A) sebagai pembanding positif. Uji antagonisme in vitro dari berbagai macam kandidat antagonis yang diperoleh disajikan pada tabel 2.
18
Tabel 2 Persen penghambatan oleh kandidat cendawan antagonis terhadap pertumbuhan koloni patogen R. lignosus
Perlakuan Penghambatan (%) Perlakuan Penghambatan (%) A 100,00a* O 81,11abcde
Pada hari pertama nampak perkembangan koloni isolat kandidat antagonis uji belum menghambat koloni cendawan R. lignosus secara nyata. Masing- masing isolat uji dalam uji ganda memiliki diameter koloni yang masih kecil (± 7,5 mm), hampir sama dengan diameter koloni R. lignosus dan belum terjadi kontak langsung antara kedua koloni.
19
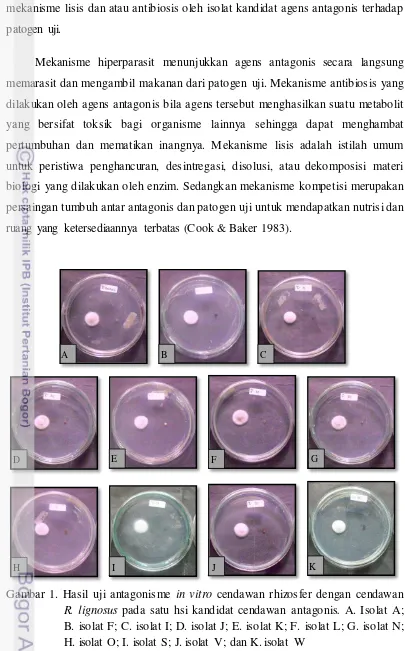
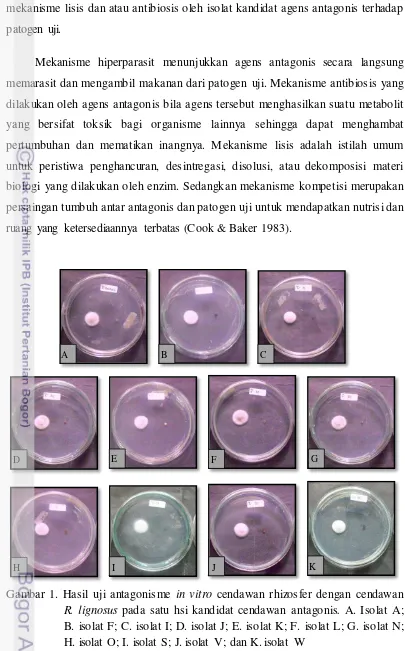
mekanisme lisis dan atau antibiosis oleh isolat kandidat agens antagonis terhadap patogen uji.
Mekanisme hiperparasit menunjukkan agens antagonis secara langsung memarasit dan mengambil makanan dari patogen uji. Mekanisme antibiosis yang dilakukan oleh agens antagonis bila agens tersebut menghasilkan suatu metabolit yang bersifat toksik bagi organisme lainnya sehingga dapat menghambat pertumbuhan dan mematikan inangnya. Mekanisme lisis adalah istilah umum untuk peristiwa penghancuran, desintregasi, disolusi, atau dekomposisi materi biologi yang dilakukan oleh enzim. Sedangkan mekanisme kompetisi merupakan persaingan tumbuh antar antagonis dan patogen uji untuk mendapatkan nutrisi dan ruang yang ketersediaannya terbatas (Cook & Baker 1983).
Gambar 1. Hasil uji antagonisme in vitro cendawan rhizosfer dengan cendawan
R. lignosus pada satu hsi kandidat cendawan antagonis. A. Isolat A; B. isolat F; C. isolat I; D. isolat J; E. isolat K; F. isolat L; G. isolat N; H. isolat O; I. isolat S; J. isolat V; dan K. isolat W
A B C
D E F G
20
Gambar 2. Hasil uji antagonisme in vitro cendawan rhizosfer dengan cendawan
R. lignosus pada tujuh hsi kandidat cendawan antagonis. A. Isolat A; B. isolat F; C. isolat I; D. isolat J; E. isolat K; F. isolat L; G. isolat N; H. isolat O; I. isolat S; J. isolat V; dan K. isolat W
Identifikasi Cendawan
Sepuluh isolat kandidat antagonis di antara 26 cendawan kandidat antagonis uji yang menunjukkan nilai persentase penghambatan tidak berbeda nyata dengan isolat pembanding positif T. harzianum diidentifikasi. Kesepuluh isolat tersebut diperoleh dari tanah rhizosfer karet dan kelapa sawit. Berdasarkan identifikasi dengan kunci identifikasi Barnett & Hunter (1998), Watanabe (2002), dan Doctor Fungi (http://nt.ars-grin.gov) diperoleh hasil identifikasi seperti tercantum dalam tabel 3.
Identifikasi dari media MEA menggunakan Doctor Fungi untuk cendawan
T. harzianum terdapat kriteria sebagai berikut. Cendawan T. harzianum memiliki konidia berbentuk semi bulat hingga lonjong telur, dengan kisaran ukuran panjang konidia (2,0-)2,7-3,5(-5,0) µm dan lebar (1,8-)2,5-3,0(-4,0) µm. Konidia berdinding halus dengan pigmentasi berwarna hijau. Konidiofor dengan cabang
21 pendukung adalah (0,3-)(0,5-0,9(-1,6) µm. Klamidospora berbentuk bulat kebulatan. Askospora berbentuk dimorfik berwarna hijau dengan kisaran panjang (3,0-)4,3-4,4(-5,6) µm dan lebar (2,8-)3,9-4,0(-5,2) µm.
Kriteria cendawan Gliocladium virens dari identifikasi Doctor Fungi pada media MEA adalah cendawan memiliki konidia yang berdinding halus, berbentuk lonjong atau kebulatan dengan pigmentasi berwarna hijau. Kisaran panjang konidia (3,6-)4,5-4,7(-5,8) µm dan lebar (3,0-)3,9-4,0(-4,8) µm, sehingga kisaran rasio dari panjang dan lebar tersebut (0,9-)1,1-1,2(-1,5) µm. Konidiofor memiliki kisaran panjang (10,0)-40,6-63,5(-150,0) µm dan lebar (3,0-)4,9-5,3(-6,9) µm.
Fialid memiliki kisaran panjang (5,6-)8,8-9,2(-14,3) µm dan lebar (1,4-)2,3-2,4(-3,4) µm, sehingga rasio panjang dan lebar berkisar (1,5-)2,2-2,3(-3,4) µm, dengan lebar sel pendukung (2,2-)4,0-4,3(-5,2) µm.
Klamidospora berbentuk kebulatan atau lonjong dengan panjang (5,8-)8,6-9,8(-16,2) µm. Askospora berwarna hijau tua dengan bentuk dimorfik.
Kisaran panjang askospora adalah (4,0-)5,0-5,5(-6,5) µm dan lebar (4,0-)5,0-5,5(-6,5) µm, serta panjang proximal (4,0-)5,0-5,5(-6,5) µm dengan
lebar proximal (4,5-)5,0-5,5 µm.
Morfologi cendawan Penicillium resticulosum pada Watanabe (2002) adalah konidiofor hialin dan tegak lurus dengan panjang 60-130 µm. Percabangan terdapat pada bagian ujung dengan kisaran panjang cabang primer 10-12,8 µm dan lebar 2,5-2,8 µm. Fialid berukuran panjang 10-12,5 µm dan lebar 2,5 µm. konidia hialin, berbentuk kebulatan dengan diamater 2,1-2,8 µm.
Berdasarkan kriteria-kriteria tersebut, hasil identifikasi untuk sepuluh isolat
yang memiliki nilai persen penghambatan yang tinggi terhadap patogen
22
cendawan Trichoderma harzianum, enam isolat (isolat F, I, J, K, N, dan W) yang berasal dari tanah rhizosfer karet dan kelapa sawit merupakan cendawan
Gliocladium virens, serta satu isolat (isolat O) yang berasal da ri rhizosfer karet merupakan cendawan Penicillium resticulosum.
Gambar 3. Trichoderma harzianum hasil identifikasi isolat L, S, dan V. A. konidiofor dan percabangan pada media MEA; B. konidia pada
media MEA; C. fialid pada media PDA; D. konidiofor dan percabangan pada media PDA; E. konidiofor dan konidium pada media PDA
Trichoderma spp. mempunyai konidia yang berdinding halus dan berbentuk semi bulat hingga oval pendek, koloni mula- mula berwarna hialin, lalu menjadi putih kehijauan, dan selanjutnya hijau tua terutama pada bagian yang menunjukkan banyak terdapat konidia. Konidiofor dapat bercabang menyerupai piramida yaitu pada bagian bawah cabang lateral yang berulang- ulang, sedangkan semakin ke ujung percabangan menjadi bertambah pendek. Fialid tampak langsing dan panjang terutama pada apeks dari cabang (Domsch et al. 1993).
C B
A
23
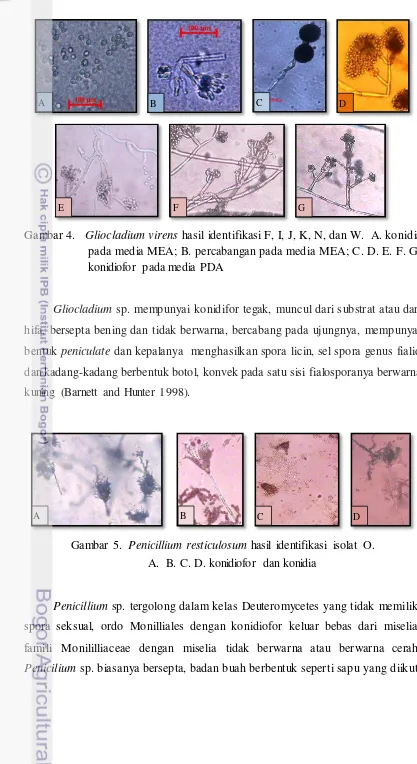
Gambar 4. Gliocladiumvirens hasil identifikasi F, I, J, K, N, dan W. A. konidia pada media MEA; B. percabangan pada media MEA; C. D. E. F. G. konidiofor pada media PDA
Gliocladium sp. mempunyai konidifor tegak, muncul dari substrat atau dari hifa, bersepta bening dan tidak berwarna, bercabang pada ujungnya, mempunyai
bentuk peniculate dan kepalanya menghasilkan spora licin, sel spora genus fialid
dan kadang-kadang berbentuk botol, konvek pada satu sisi fialosporanya berwarna
kuning (Barnett and Hunter 1998).
Gambar 5. Penicillium resticulosum hasil identifikasi isolat O. A. B. C. D. konidiofor dan konidia
Penicillium sp. tergolong dalam kelas Deuteromycetes yang tidak memiliki spora seksual, ordo Monilliales dengan konidiofor keluar bebas dari miselia, famili Monililliaceae dengan miselia tidak berwarna atau berwarna cerah.
Penicilium sp. biasanya bersepta, badan buah berbentuk seperti sapu yang diikuti
D C
B A
G F
E
D C
24
sterigma dan konidia yang tersusun seperti rantai. Konidia pada hampir semua spesies saat masih muda berwarna hijau kemudian berubah menjadi kecoklatan (Domsch et al. 1993).
Tabel 3 Hasil identifikasi cendawan
Isolat Fase Pertumbuhan Tahun Tanam Jenis tanaman Hasil Identifikasi F TBM 2005 karet G. virens pengendalian penyakit pada berbagai tanaman. Agens antagonis tersebut nyata dapat menekan pertumbuhan patogen dengan mekanisme hiperparasitisme, lisis, dan toksisitas, serta persaingan ruang dan hara (Retnosari 2011).
Trichoderma spp. mempunyai daya antagonistik yang tinggi dan dapat mengeluarkan toksik, sehingga dapat menghambat bahkan mematikan cendawan lain dan beberapa isolat Trichoderma spp. mampu tumbuh di atas isolat jamur akar putih (Widyastuti et al. 1999). Cendawan T. harzianum merupakan cendawan antagonis utama yang digunakan dalam pengendalian berbagai penyakit pada berbagai tanaman (Monte & Llobell 2003; Ha 2010).
25
untuk melakukan mycoparasite dan merupakan agens yang efektif untuk banyak patogen tular tanah, seperti Rhizoctonia solani, Sclerotinia sclerotiorum, Sclerotium rolfsii, Pythium ultimum. Mekanisme biokontrol yang dilakukan adalah parasit, antibiosis, kompetisi, dan lisis. Strains G. virens berpotensi untuk memproduksi beberapa tipe metabolit antifungi (Jash et al. 2006).
KESIMPULAN DAN SARAN
Kesimpulan
Dari rhizosfer di areal karet dan kelapa sawit diperoleh 26 isolat kandidat antagonis, 10 isolat diantaranya (isolat F, I, J, K, L, N, O, S, V, dan W) memiliki kemampuan antagonisme in vitro yang tinggi terhadap patogen R. lignosus. Hasil identifikasi menunjukkan isolat L, S, dan V adalah Trichoderma harzianum, dan isolat F, I, J, K, N, dan W adalah Gliocladium virens, sedangkan isolat O adalah
Penicillium resticulosum. Mekanisme antagonis yang dilakukan oleh
T. harzianum dan G. virens adalah hiperparasit, antibiosis, lisis, dan kompetisi ruang. Sedangkan mekanisme antagonis yang dilakukan oleh P. resticulosum
adalah kompetisi ruang.
Saran
DAFTAR PUSTAKA
Agrios GN. 2005. Plant Pathology. Ed ke-5. London: Elsevier Academic Press. Amin F, Razdan VK, Mohiddin FA, Bhat KA, Banday S. 2010. Potential of
Trichoderma species as biocontrol agents of soil borne fungal propagules. J Phytol 2(10):38-41.
Anwar C. 2001. Budidaya karet. Medan: Pusat Penelitian Karet.
Barnett HL, Hunter BB. 1998. Ilustrated Genera of Imperfect Fungi. Ed ke-4. Minnesota: APS Press.
Birkinshaw JH, Raistrick H, Smith G. 1942. Fumaryl-dl-alanine
(Fumaromono-dl-alanide), a metabolic product of Penicillium resticulosum sp. nov. Di dalam: Studies in the Biochemistry of Micro-organisms 7:829-835.
[BPS] Badan Pusat Statistik. 2009. Luas tanaman perkebunan besar menurut jenis tanaman. http://bps.go.id diakses tanggal 17 Juni 2011.
[BPS] Badan Pusat Statistik. 2009. Produksi perkebunan besar menurut jenis tanaman. http://bps.go.id diakses tanggal 17 Juni 2011.
Cook RJ, Baker KF. 1983. The Nature and Practice of Biological Control of Plant Patogen. USA: The American Phytopathological Society.
[Deptan] Departemen Pertanian. 2010. Kebijakan pengembangan agribisnis karet. http://deptan.go.id diakses tanggal 17 Juni 2011.
[Ditjenbun] Direktorat Jenderal Perkebunan, Departemen Pertanian. 2011. Rekomendasi klon karet unggul periode 2010-2014. http://ditjenbun.deptan.go.id diakses tanggal 17 Juni 2011.
Domsch KH, Gams W, Anderson TH. 1993. Compendium of Soil Fungi. IHW-Verlag.
Farid AM, Lee SS, Maziah Z, Rosli H, Norwati M. 2006. Root rot in tree species other than Acacia. Di dalam: Potter et al., editor. Heart rot and root rot in tropical Acacia plantations. Proceedings of a Workshop Held; Yogyakarta, 7-9 February 2006. Canberra: ACIAR Proceedings. 124:hlm 60-66.
Ha TN. 2010. Using Trichoderma species for biological control of plant pathogens in Vietnam. ISSAAS 16(1):17-21.
Harman GE. 2000. Myths and dogmas of biocontrol changes in perception derived from research on Trichoderma harzianum. Plant Dis 84(4):377-391.
Holliday P. 1996. Pioneer of root disease control in Hevea rubber. Mycologist
10(2):66-68.
28
Jash S, Khalko S, Bose S, Roy M, Pan S. 2006. Morphological and physiological characterization of some mutant isolates of Gliocladium virens, a potential mycoparasite of sclerotial plant pathogens. Indian J Agric Res 40(2):114-118.
Mattjik AA, Sumertajaya M. 2006. Perancangan Percobaan dengan Aplikasi SAS dan Minitab. Bogor: Institut Pertanian Bogor Press.
Miftakhurohmah, Noveriza R. 2009. Deteksi cendawan kontaminan pada sisa benih jahe merah dan jahe putih kecil. Bul. Littro. 20(2):167-172.
Monte E, Llobell A. 2003. Trichoderma in organic agriculture. Proceedings V World Avocado Congress. Hlm 725-733.
Paulitz TC, Linderman RG. 1991. Lack of antagonism beetwen the biocontrol agent Gliocladium virens and vesicular arbuscular mycorrhizal fungi. New Phytol (117):303-308.
Pawirosoemardjo S. 2004. Manajemen pengendalian penyakit penting dalam upaya mengamankan target produksi karet nasional tahun 2020. Di dalam: Situmorang et al., editor. Strategi Pengelolaan Penyakit Tanaman Karet untuk Mempertahankan Potensi Produksi Mendukung Industri Perkaretan Indonesia Tahun 2020. Prosiding Pertemuan Teknis; Palembang, 6-7 Oktober 2004. Palembang: Pusat Penelitian Karet. hlm 21-45.
Prasetyo J, Aeny TN, Suharjo R. 2009. The corellation between white rot (Rigidoporus lignosus L.) incidence and soil characters of rubber ecosystem in Penumangan Baru, Lampung. HPT Tropika 9(2):149-157.
Retnosari E. 2011. Identifikasi penyebab busuk pangkal batang Jeruk (citrus
spp.) serta uji antagonisme in vitro dengan Trichoderma harzianum dan Gliocladium virens [skripsi]. Bogor: Fakultas Pertanian, Institut Pertanian Bogor.
Semangun H. 2000. Penyakit-Penyakit Tanaman Perkebunan di Indonesia. Ed ke-4. Yogyakarta: Gadjah Mada University Press.
Sinaga MS. 1993. Prospek Gliocladium sebagai agen biokontrol patogen tular tanah. Agrotek 1(2):4-7.
Sinaga MS. 2004. Strategi pengelolaan penyakit penting tanaman karet di Indonesia pada masa mendatang. Di dalam: Situmorang et al., editor.
Strategi Pengelolaan Penyakit Tanaman Karet untuk Mempertahankan Potensi Produksi Mendukung Industri Perkaretan Indonesia Tahun 2020. Prosiding Pertemuan Teknis; Palembang, 6-7 Oktober 2004. Palembang: Pusat Penelitian Karet. hlm 11-20.
Sinaga MS. 2006. Dasar-Dasar Ilmu Penyakit Tumbuhan. Ed ke-2. Jakarta: Penebar Swadaya.
Situmorang A, Budiman A. 2003. Penyakit Tanaman Karet dan Pengendaliannya. Palembang: Pusat Penelitian Karet, Balai Penelitian Sembawa.
29
rubber plantation of Indonesia. Di dalam: Pawirosoemardjo et al., editor. Proceedings International Workshop on White Root Disease of Hevea
Rubber; Salatiga, 28-29 November 2006. Salatiga, Indonesian Rubber Research Institute. Hlm 27-33.
Situmorang A. 2004. Status dan manajemen pengendalian penyakit akar putih di perkebunan karet. Di dalam: Situmorang et al., editor. Strategi Pengelolaan Penyakit Tanaman Karet untuk Mempertahankan Potensi Produksi Mendukung Industri Perkaretan Indonesia Tahun 2020. Prosiding Pertemuan Teknis; Palembang, 6-7 Oktober 2004. Palembang: Pusat Penelitian Karet. hlm 66-86.
Soesanto L. 2008. Pengantar Pengendalian Hayati Penyakit Tanaman. Jakarta: PT Raja Grafindo Persada.
Susanto A. 2002. Kajian pengendalian hayati Ganoderma boninense Pat. penyebab penyakit busuk pangkal batang kelapa sawit [disertasi]. Bogor: Fakultas Pertanian, Institut Pertanian Bogor.
Watanabe T. 2002. Pictorial Atlas of Soil and Seed Fungi. Ed ke-2. Florida: CSC Press.
Widyastuti SM, Sumardi, Harjono. 1999. Potensi antagonistik tiga Trichoderma
spp. terhadap delapan penyakit akar tanaman kehutanan. Buletin
Kehutanan 41:2-10.
Widyastuti SM, Sumardi, Hidayati N. 1998. Kemampuan Trichoderma spp. untuk pengendalian hayati jamur akar putih pada Acacia mangium secara in vitro. Buletin Kehutanan 36:24-28.
Widyastuti SM. 2006. The biological control of Ganoderma root rot by
31
Lampiran 1 Isolat hasil eksplorasi dari tanah rhizosfer karet dan kelapa sawit
Keterangan : Koloni isolat Trichoderma harzianum (A), koloni isolat hasil eksplorasi cendawan rhizosfer (B – AA).
U V
M N O P
I J K L
Q R S T
W X
G
F H
E
A B C D
Lampiran 3 Jari-jari pertumbuhan koloni patogen R. lignosus pada media PDA termodifikasi
Kode Isolat
Jari-Jari Koloni R. lignosus (mm)
33
Kode Isolat
Jari-jari koloni R. lignosus (mm)
35
Lampiran 3 Persen penghambatan pertumbuhan koloni R. lignosus oleh kandidat cendawan antagonis
Kode Persen Penghambatan Hari ke-
36
Kode Persen Penghambatan Hari ke-
EKSPLORASI DAN IDENTIFIKASI CENDAWAN
ANTAGONIS TERHADAP
Rigidoporus lignosus
PENYEBAB
JAMUR AKAR PUTIH PADA KARET
ALCHEMI PUTRI JULIANTIKA KUSDIANA
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
ABSTRAK
ALCHEMI PUTRI JULIAN TIKA KUSDIAN A. Eksplorasi dan Identifikasi Cendawan Antagonis terhadap Rigidoporus lignosus Penyebab Jamur Akar Putih pada Karet. Dibimbing oleh MEITY SURADJI SINAGA.
Industri karet berperan dalam peningkatan pendapatan petani, masyarakat, dan negara, juga dalam pembuatan produk, serta peranan terhadap pelestarian lingkungan. Salah satu hambatan dalam pengembangan budidaya karet adalah adanya penyakit jamur akar putih yang disebabkan oleh Rigidoporus lignosus. Penelitian ini bertujuan mengeksplorasi dan mengidentifikasi cendawan antagonis terhadap R. lignosus. Penelitian dilakukan dengan mengambil contoh tanah dari tanaman karet dan kelapa sawit untuk dibuat suspensi. Suspensi dibuat seri pengenceran hingga tingkat pengenceran 10-5, masing- masing seri pengenceran tersebut diambil sebanyak 1 ml suspensi dan dibiakkan pada media potato dextrose agar (PDA). Uji antagonisme in vitro antara agens antagonis dengan
R. lignosus dilakukan dengan menggunakan metode dual culture. Pengamatan dilakukan dengan mengukur jari-jari koloni patogen yang menjauhi isolat cendawan kandidat dan jari-jari koloni patogen yang mendekati isolat cendawan kandidat, serta menghitung penghambatan kandidat agens antagonis. Identifikasi menggunakan compound microscope. Dari hasil isolasi cendawan rhizosfer diperoleh 26 isolat kandidat antagonis, 10 isolat diantaranya memiliki kemampuan antagonisme terhadap patogen R. lignosus. Hasil identifikasi menunjukkan sebanyak tiga isolat adalah Trichoderma harzianum, enam isolat adalah Gliocladium virens, dan satu isolat adalah Penicillium resticulosum.
Mekanisme antagonis yang dilakukan oleh T. harzianum dan G. virens adalah
hiperparasit, antibiosis, lisis, dan kompetisi ruang. Sedangkan untuk
P. resticulosum adalah kompetisi ruang.
PENDAHULUAN
Latar Belakang
Karet merupakan salah satu tanaman perkebunan yang mempunyai peran penting bagi subsektor perkebunan negara Indonesia. Indonesia merupakan negara produsen karet dunia terbesar bersama dua negara produsen karet alam lainnya yaitu Thailand dan Malaysia. Indonesia memberikan kontribusi sebesar 26% dari total produksi karet alam dunia. Pengembangan industri karet memberi manfaat dalam peningkatan pendapatan petani, masyarakat, dan negara. Selain itu, industri karet memiliki berbagai macam kegunaan baik untuk industri ban maupun produk lainnya seperti untuk kebutuhan kesehatan, properti atau ba ngunan, farmasi, dan peranan pertanaman karet terhadap pelestarian lingkungan (Deptan 2010). Berdasarkan data dari Badan Pusat Statistik (2009), luas lahan karet di Indonesia mencapai 5,264 juta hektar dengan produksi karet kering sebanyak 640,787 ton. Produksi karet menciptakan nilai tambah di dalam negeri dan ekspor sebagai penghasil devisa bagi negara.
Pengembangan industri karet hingga saat ini terus dilakukan. Namun, terdapat hambatan dalam pengembangan budidaya karet tersebut antara lain adanya serangan penyakit. Diantaranya penyakit penting yang menyerang karet adalah penyakit jamur akar putih (JAP) yang disebabkan oleh cendawan
2
tersebut dapat menimbulkan kerusakan di kebun entres, tanama n belum menghasilkan, dan tanaman menghasilkan. Kerusakan berat sering terjadi pada tanaman belum menghasilkan. Kematian tanaman mengakibatkan rendahnya kerapatan pohon karet per hektar yang berpengaruh langsung terhadap produktivitas kebun karet (Situmorang 2004).
Jamur akar putih menjadi penyakit yang sangat penting karena penyebabnya memiliki kisaran inang yang luas. Selain menyerang karet, jamur akar putih dapat menyerang teh, kopi, kakao, kelapa sawit, mangga, nangka, ubi kayu, jati, cengkeh, duwet, lamtoro, sengon, dadap, nibung, kapur barus, cemara, kayu besi, meranti, rasamala, walikukun, kesambi, randu alas, kumpas, akasia, Ficus spp., dan Agzelia sp. Jamur akar putih juga dapat menyerang pupuk hijau, seperti
Tephrosia spp. dan Crotalaria spp. Tanaman penutup tanah kacangan yang menjalar (legume creeping cover, LCC) juga rentan terhadap jamur akar ini (Semangun 2000).
Serangan patogen R. lignosus menyebabkan akar menjadi busuk dan umumnya ditumbuhi rizomorf cendawan. Gejala tampak pada daun; daun-daun yang semula tampak hijau segar berubah menjadi layu, berwarna kusam, dan akhirnya kering (Pawirosoemardjo 2004).
Beberapa cara pengendalian penyakit jamur akar putih telah dilakukan, diantaranya dengan menghilangkan tunggul-tunggul atau organ tanaman berkayu secara tuntas sebagai sumber infeksi, menanam tanaman penutup tanah jenis leguminosa, pelumasan dan penyiraman fungisida, serta pengendalian dengan menggunakan agens hayati seperti Trichoderma spp. yang bersifat antagonis terhadap patogen (Pawirosoemardjo 2004).
Penyakit jamur akar putih efektif dikendalikan dengan pengendalian hayati menggunakan agens antagonis, seperti Trichoderma spp. (Widyastuti et al. 1998). Eksplorasi pada tanah rhizosfer karet dan kelapa sawit dilakukan dalam penelitian ini, guna mencari cendawan antagonis lainnya yang diharapkan dapat efektif dan stabil bila dilakukan pengendalian penyakit jamur akar putih dengan menggunakan pengendalian hayati.
3
atau lebih organisme yang berlangsung secara alami atau melalui manipulasi lingkungan, inang, antagonis, atau dengan introduksi secara massal satu atau lebih organisme antagonis (Cook & Baker 1983).
Tujuan Penelitian
Penelitian ini bertujuan untuk mengeksplorasi dan mengidentifikasi cendawan antagonis terhadap R. lignosus.
Manfaat Penelitian
Manfaat yang diharapkan dari penelitian ini ialah memperoleh beberapa cendawan antagonis yang berpotensi menghambat dan menekan perkembangan
TINJAUAN PUSTAKA
Tanaman Karet
Budidaya Karet
Pembangunan kebun karet diperlukan manajemen dan teknologi budidaya tanaman karet yang memperhatikan syarat tumbuh tanaman karet, klon‐klon karet rekomendasi, bahan tanam atau bibit, persiapan tanam dan penanaman, pemeliharaan tanaman meliputi pengendalian gulma; pemupukan; dan pengendalian penyakit, serta penyadapan atau panen (Anwar 2001).
Klon Karet
Klon unggul baru merupakan syarat utama agar komoditas karet dapat menghasilkan produksi dengan tingkat produktivitas yang tinggi sehingga dapat menguntungkan dalam persaingan global. Klon karet unggul yang dihasilkan oleh Balai Penelitian Karet Sembawa direkomendasikan untuk periode tahun 2010-2014 yang disesuaikan dengan Undang-Undang No. 12 Tahun 1992 tentang Sistem Budidaya Tanaman yang menyebutkan bahwa klon/varietas yang dapat disebarluaskan kepada pengguna harus berupa benih bina. Klon anjuran komersial dikelompokkan menjadi dua kelompok yaitu kelompok klon penghasil lateks (IRR 104, IRR 112, IRR 118, IRR 220, BPM 24, PB 260, PB 330, dan PB 340) dan penghasil lateks-kayu (RRIC 100, IRR 5, IRR 39, IRR 42, IRR 107, dan IRR 119), sedangkan benih anjuran untuk batang bawah (AVROS 2037, GT 1, BPM 24, PB 260, RRIC 100, dan PB 330) (Ditjenbun 2010).
Penyakit Jamur Akar Putih pada Karet
Patogen Penyebab Jamur Akar Putih
Penyakit jamur akar putih disebabkan oleh cendawan Rigidoporus lignosus
5
dengan nama Fomes lignosus (Klotzsch) Bres. Cendawan ini mempunyai lebih kurang 35 nama lain (sinonim) (Semangun 2000).
Sebaran Penyakit
Penyakit jamur akar putih menyebar di perkebunan karet daerah tropik terutama Indonesia. Penyakit ini dijumpai di dataran rendah, dataran tinggi, dan di daerah beriklim basah dan kering dengan keparahan penyakit yang berbeda. Daerah yang sering mengalami serangan skala berat adalah Riau, Sumatera Barat, dan Kalimantan Barat; serangan skala sedang adalah Nangro Aceh Dar ussalam, Sumatera Utara, Jambi, sebagian Sumatera Selatan, sebagian Bengkulu, dan sebagian Lampung; dan serangan skala ringan adalah Jawa Barat, Jawa Tengah, Jawa Timur, Kalimantan Selatan, Kalimantan Tengah, dan Kalimantan Timur (Situmorang et al. 2006).
Daur Penyakit
Penyakit jamur akar putih R. lignosus tergolong ke dalam tipe epidemik penyakit monosiklik. Penyakit monosiklik adalah penyakit yang untuk menyebabkan kehilangan produksi yang sangat tinggi, atau yang dapat mematikan tanaman hanya dengan satu siklus infeksi per siklus tanaman (Sinaga 2004).
Jamur akar putih terutama menular karena adanya kontak antara akar tanaman sehat dengan akar tanaman sakit, atau dengan kayu-kayu yang mengandung cendawan R. lignosus. Cendawan ini dapat menular dengan perantaraan rizomorf. Rizomorf pada jamur akar putih dapat menjalar bebas dalam tanah (Semangun 2000).
Gejala Penyakit Jamur Akar Putih
6
pertama, hal ini tergantung kepada banyaknya bibit penyakit (patogen) yang terdapat dalam tanah. Penyakit akar putih sering menimbulkan kerusakan pada areal pertanaman yang terdapat banyak tunggul atau sisa akar kayu, bekas tanaman tua atau bekas hutan primer, atau tanah gembur dan berpasir (Situmorang & Budiman 2003).
Serangan patogen R. lignosus menyebabkan akar menjadi busuk dan umumnya ditumbuhi rizomorf cendawan. Rizomorf adalah paduan kompak benang-benang cendawan yang menyerupai akar tanaman. Rizomorf yang muda berwarna putih dan bentuknya pipih, semakin tua umur rizomorf warna putih tersebut berubah menjadi kuning gading, dan bentuknya menyerupai akar rambut. Membusuknya akar diduga karena rusaknya struktur kimia kulit dan kayu akibat enzim yang dihasilkan cendawan. Gejala yang tampak pada daun adalah daun-daun yang semula tampak hijau segar berubah menjadi layu, berwar na kusam, dan akhirnya kering. Pada keadaan tersebut menunjukkan bahwa tanaman telah menderita serangan pada tahap lanjut dan tidak mungkin untuk diselamatkan. Selain dapat menyerang secara akut, R. lignosus dapat pula menyerang secara kronis pada tanaman yang telah tua. Gejala serangan secara kronis tersebut tidak tampak jelas, dan baru terlihat apabila tanaman dibongkar, sebagian akar-akarnya telah ditumbuhi rizomorf cendawan (Pawirosoemardjo 2004).
Faktor yang Mempengaruhi Perkembangan Penyakit
Berdasarkan konsep segitiga penyakit, perkembangan penyakit akar putih tergantung dari tiga faktor, yaitu karet (inang), R. lignosus (patogen), dan lingkungan (Prasetyo et al. 2009).
7
sangat ditentukan oleh banyaknya tunggul di lahan yang bersangkutan. Lama bertahan R. lignosus dalam tanah di samping ditentukan oleh hal tersebut juga ditentukan oleh ikut sertanya organisme renik yang melapukkan tunggul. Penularan penyakit terjadi karena adanya kontak akar sakit dan sehat atau adanya miselium yang tumbuh dari food base di sekitar perakaran tanaman sehat (Pawirosoemardjo 2004). Tunggul yang telah terinfeksi jamur akar putih menjadi sumber penularan yang sangat efektif melalui kontak akar menular ke tunggul lain di dekatnya dan menjadi sumber infeksi baru. Pada tunggul tersebut, cendawan membentuk badan buah yang membebaskan banyak spora ke udara dan mendarat ke permukaan tunggul lain, sebagian kecil spora ini akan berkecambah di permukaan tunggul dan berkembang masuk sampai ke perakaran. Hal ini merupakan faktor penyebab bahwa kebun-kebun yang bertunggul akan mengalami serangan berat penyakit jamur akar putih (Situmorang 2004).
Menurut Situmorang (2004), kondisi asal pertanaman kare t mempengaruhi perkembangan penyakit akar putih. Kebun bertunggul yang berasal dari bekas kebun karet tua dan hutan primer akan menyebabkan serangan berat. Tunggul sebagai sumber infeksi dan sumber energi cendawan akan membantu perkembangan penyakit akar putih lebih cepat. Rongga-rongga bekas akar tunggul dalam tanah akan membantu pergerakan cendawan dalam tanah sehingga mempercepat terjadinya infeksi dan penyebaran patogen.
8
topografinya berbukit serangan penyakit relatif ringan sampai sedang karena perembesan air lebih cepat dan tanahnya lebih cepat kering sehingga mengakibatkan perkembangan jamur akar putih tertekan. Penyakit ini juga dapat berkembang lebih baik pada tanah bertekstur kasar/berpasir atau berstruktur gembur berpasir daripada bertekstur halus/liat atau berstruktur padat. Miselia atau rizomorf cendawan akan lebih mudah bergerak menembus tanah berpori daripada tanah padat sehingga penularan patogen akan berlangsung lebih cepat. Cendawan pun berkembang baik pada tanah bereaksi netral pH 6-7 dan pada tanah dengan kapasitas kejenuhan air tanah 80-90%. Kondisi ini biasanya terjadi pada awal sampai akhir musim hujan sehingga selama musim hujan perkembangan penyakit lebih cepat (Situmorang 2004).
Pengendalian Penyakit
Strategi pengelolaan penyakit untuk menghadapi penyakit penting tanaman karet di masa mendatang adalah pengendalian penyakit yang berbasis epidemiologis dan ekobiologis penyakit yaitu (1) menurunkan inokulum awal/initial penyakit (Q/Xo), (2) menekan laju infeksi (R/r), dan (3) menekan periode epidemik (t). Strategi tersebut dapat diaplikasikan secara tunggal atau kombinasi yang berdasarkan konsep pengendalian hama terpadu (PHT). Prinsip pengendalian tradisional yaitu penghindaran, eksklusi, eradikasi, proteksi, resistensi, dan terapi tetap dimanfaatkan untuk digunakan menjadi taktik-taktit pengendalian dalam penyusunan suatu stategi pengendalian yang holistik (Sinaga 2004).
Pengendalian Hayati
9
kisaran inang yang luas. Berdasarkan biologi patogen tersebut, maka pengendalian hayati berpeluang baik untuk berhasil (Susanto 2002).
Pengendalian hayati merupakan perlindungan pada tanaman dari patogen tanaman termasuk penyebaran mikroorganisme antagonis pada saat setelah atau sebelum terjadinya infeksi patogen. Mekanisme dari biokontrol organisme yaitu dalam melemahkan atau membunuh patogen tanaman dengan perlawanan yaitu memparasit patogen secara langsung, memproduksi antibiotik (toksin), dan kemampuannnya dalam kompetisi ruang dan nutrisi, produksi enzim untuk melawan komponen sel patogen, menginduksi respon ketahanan tanaman, dan produksi metabolisme tanaman dalam menstimulasi perkecambahan spora patogen (Agrios 2005).
Pengendalian hayati adalah semua kondisi atau praktik yang berpengaruh terhadap penurunan daya tahan atau kegiatan patogen tanaman melalui interaksi dengan agensia organisme hidup lainnya (selain manusia), yang menghasilkan penurunan keberadaan penyakit yang disebabkan oleh patogen (Soesanto 2008).
Sinaga (2006) mengemukakan bahwa introduksi agens antagonis berpotensi mengendalikan patogen-patogen tular tanah. Aplikasi agens antagonis menunjukkan inisiasi langsung dalam menekan inokulum patogen, mencegah kolonisasi patogen, melindungi perkecambahan biji dan akar tanaman dari infeksi, selain itu agens antagonis dapat langsung menghambat patogen dengan sekresi antibiotik, berkompetisi terhadap ruang dan atau nutrisi, menginduksi proses ketahanan tanaman, serta interaksi langsung dengan patogen. Interaksi yang terjadi berupa hiperparasit, hiperpatogen, atau predator melalui destruksi unit-unit propagatif (propagul) atau biomassa, sehingga dapat mengurangi kepadatan inokulum dan aktivitas patogen.
10
Trichoderma harzianum
Cendawan T. harzianum merupakan cendawan antagonis utama yang efektif digunakan dalam pengendalian penyakit pada pertanian (Amin et al. 2010).
T. harzianum merupakan agen biokontrol yang dapat hidup dalam pathosistem berbeda, dapat menyeimbangkan tanah, dan tidak berbahaya bagi organisme bermanfaat lainnya (Monte & Llobell 2003; Ha 2010).
Mekanisme antagonis dari Trichoderma adalah (1) mycopasitism yaitu cendawan yang mendapatkan nutrisi dari cendawan lainnya tanpa memberikan manfaat, (2) antibiosis yaitu hubungan antara dua organisme yang dapat merugikan salah satu organisme, biasanya salah satu organisme memproduksi toksik, (3) kompetisi nutrisi atau ruang, (4) toleransi terhadap stres melalui akar ditingkatkan dan perkembangan tanaman, (5) penyerapan nutrisi anorganik, (6) induksi resistensi, (7) inaktivasi enzim patogen (Widyastuti 2006).
Morfologi secara mikroskopis untuk cenda wan T. harzianum adalah konidiofor hialin, bercabang banyak; fialid tunggal atau dengan kelompok; konidia (phialospora) hialin, sel tunggal, oval, biasanya mudah dikenal dengan pertumbuhannya yang cepat dan konidia hijau; bersifat saprofitik di tanah atau pada kayu, beberapa spesies dilaporkan bersifat parasit pada cendawan lain (Barnett & Hunter 1998). Klamidospora berwarna cokelat kebulatan (Watanabe 2002).
Gliocladium virens
Gliocladium sp. dapat mengendalikan beberapa patogen tular tanah. Cendawan tersebut dapat mengolonisasi mikroba lain, sehingga mikroba tersebut tidak dapat berkembang. G. virens dapat menghasilkan antibiotik gliotoksin dan viridin yang dapat menekan perkembangan mikroba lain (Cook & Baker 1983).
G. virens merupakan cendawan antagonis yang memiliki mekanisme antagonis
mycoparasit dan dapat memproduksi bahan antifungi (Paulitz & Linderman 1991).
11
terutama pada metula, septat, massa spora fialid pada cabang apikal. Konidia hijau muda, massa hijau tua, elips atau kebulatan, sel tunggal. Klamidospora bulat atau kebulatan (Watanabe 2002).
Penicillium resticulosum
Penicillium sp. merupakan cendawan yang dapat memproduksi beberapa
mycotoxins (Agrios 2005). Koloni Penicillium sp. umumnya tumbuh cepat, berwarna hijau, kadang-kadang putih, dan kebanyakan memiliki konidiofor yang
padat (Miftakhurohmah & Noveriza 2009). Morfologi secara mikroskopis untuk
BAHAN DAN METODE
Waktu dan Tempat Penelitian
Penelitian dilaksanakan dari bulan Februari sampai bulan Juli 2011 di Laboratorium Mikologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor.
Bahan
Bahan-bahan yang digunakan pada penelitian ini adalah tanah yang diambil dari rhizosfer tanaman karet PT Perkebunan Nusantara VIII, Jalupang, Subang,
Jawa Barat; tanah yang diambil dari rhizosfer tanaman kelapa sawit PT Perkebunan Nusantara IV, Adolina, Sumatera Utara; media Potato Dextrose
Agar (PDA); media Malt Extract Agar (MEA); serta isolat cendawan R. lignosus
dan T. harzianum koleksi Laboratorium Mikologi Tumbuhan, Departemen Proteksi Tanaman, Institut Pertanian Bogor.
Metode
Pengambilan Contoh Tanah
Contoh tanah diambil dari tanaman karet dan kelapa sawit. Eksplorasipada tanah rhizosfer tanaman karet dilakukan pada tiga lahan tanaman belum menghasilkan (TBM) dengan tahun tanam 2005, 2007, dan 2008, serta tiga lahan tanaman menghasilkan (TM) dengan tahun tanam 1987, 1989, dan 1991. Eksplorasi pada tanah rhizosfer tanaman kelapa sawit dilakukan pada tiga lahan tanaman dengan tahun tanam 1998 dan tiga lahan tanaman dengan tahun tanam 2006.