PENGARUH FORMULA
CAJUPUTS CANDY
PADA DAYA KOMPETITIF
Streptococcus sanguinis
TERHADAP
Streptococcus mutans
DALAM BIOFILM MULTISPESIES
BERNADETA RATNA EKA SARI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Pengaruh Formula
Cajuputs Candy pada Daya Kompetitif Streptococcus sanguinis terhadap
Streptococcus mutans dalam Biofilm Multispesies adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Juli 2013
Bernadeta Ratna Eka Sari
NIM F251100051
RINGKASAN
BERNADETA RATNA EKA SARI. Pengaruh Formula Cajuputs Candy pada Daya Kompetitif Streptococcus sanguinis terhadap Streptococcus mutans dalam Biofilm Multispesies. Dibimbing oleh CHRISTOFORA HANNY WIJAYA dan BOY MUCHLIS BACHTIAR.
Pengembangan cajuputs candy sebagai pangan fungsional diarahkan pada pemeliharaan kesehatan rongga mulut dan gigi. Cajuputs candy merupakan sejenis permen keras yang menggunakan minyak atsiri kayu putih dan peppermint
sebagai komponen flavornya. Komponen flavor cajuputs candy diduga dapat berperan sebagai senyawa antimikroba. Streptococcus sanguinis merupakan bakteri yang dikaitkan dengan kesehatan rongga mulut karena berperan mengontrol pertumbuhan Streptococcus mutans (bakteri penyebab karies gigi). Kedua bakteri ini mempunyai interaksi antagonistis mutualistik yang berperan dalam pencegahan karies gigi. Penelitian ini bertujuan menentukan pengaruh pemberian dua jenis cajuputs candy, yaitu cajuputs candy sukrosa (CCS) dan
cajuputs candy non-sukrosa (CCNS), pada daya kompetitif S. sanguinis terhadap
S. mutans dalam biofilm multispesies (S. sanguinis+S. mutans) yang diindikasikan oleh kemampuannya membentuk biofilm, mengontrol pertumbuhan
S. mutans, dan mengekspresikan mRNA spxB secara in vitro. Ekspresi mRNA
spxB merupakan refleksi produksi hidrogen peroksida (H2O2) oleh S. sanguinis
yang digunakan untuk menghambat pertumbuhan S. mutans dalam lingkungan biofilm.
Keberadaan komponen volatil dalam flavor cajuputs candy dianalisis menggunakan Gas Chromatography-Mass Spectrometry (GC-MS). Uji penghambatan biofilm dilakukan dengan mengukur nilai optical density (OD) biofilm. Uji ini digunakan untuk menganalisis pengaruh pemberian formula uji
candy pada pembentukan biofilm multispesies secara in vitro. Jumlah DNA bakteri total, proporsi DNA bakteri, serta ekspresi mRNA spxB dalam biofilm multispesies dikuantifikasi secara relatif menggunakan teknik real-time polymerase chain reaction (real-time PCR).
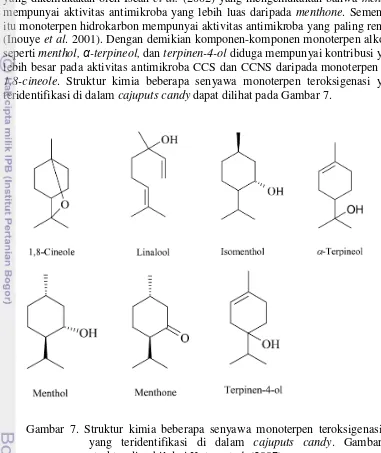
Analisis komponen volatil menunjukkan CCS mengandung beberapa komponen volatil yang telah diketahui mempunyai sifat antimikroba, yaitu 1,8-cineole (23,67%), α-terpineol (9,17%), menthol (7,29%), β-caryophyllene
(6,78%), menthone (3,30%), dan terpinen-4-ol (1,86%). Demikian pula CCNS juga mengandung komponen volatil yang diketahui mempunyai aktivitas antimikroba, yaitu menthol (13,32%), α-terpineol (9,97%), 1,8-cineole (8,48%), β-caryophyllene (7,64%), menthone (4,43%) dan terpinen-4-ol (1,28%).
mengindikasikan CCS dan CCNS dapat menghambat pembentukan biofilm oleh
S. mutans dan S. sanguinis.
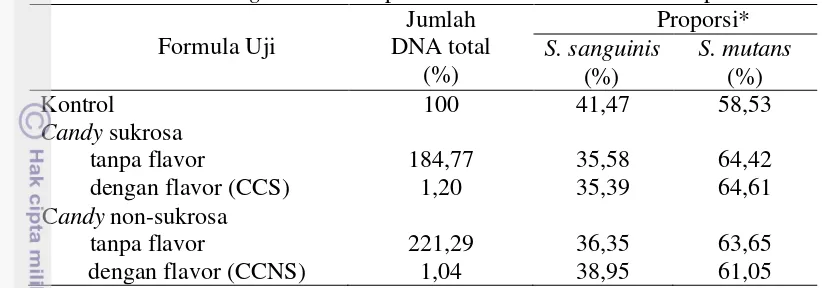
Pada pemberian candy sukrosa dan candy non-sukrosa tanpa flavor terjadi penurunan kemampuan membentuk biofilm, namun tidak sebesar penurunan yang diakibatkan oleh pemberian candy dengan flavor, yaitu CCS dan CCNS. Penurunan aktivitas pembentukan biofilm pada pemberian candy sukrosa dan non-sukrosa tanpa flavor berturut-turut adalah sebesar 36,9% dan 47,1%. Meskipun menurunkan densitas biofilm, pemberian candy sukrosa dan candy non-sukrosa tanpa flavor dapat meningkatkan jumlah DNA bakteri total dalam biofilm multispesies. Hal ini ditunjukkan dari meningkatnya hasil kuantifikasi jumlah DNA total akibat pemberian candy sukrosa tanpa flavor secara relatif sebesar 184,77% dan akibat pemberian candy non-sukrosa tanpa flavor sebesar 221,29% dibandingkan dengan kontrol (100%). Pemberian bahan sukrosa tanpa adanya penambahan komponen antibakteri dapat menginduksi pertumbuhan bakteri S. sanguinis dan S. mutans. Bahkan bahan non-sukrosa (isomalt), yang merupakan gula alkohol non-kariogenik, dengan waktu paparan yang cukup lama (sekitar 20 jam) masih mungkin difermentasi oleh kedua S. sanguinis dan S. mutans untuk melakukan pertumbuhan. Fenomena ini mengindikasikan bahwa penambahan komponen flavor minyak kayu putih dan peppermint pada formula candy dapat menekan pertumbuhan mikroorganisme dalam mulut.
Hasil perhitungan proporsi DNA bakteri S. sanguinis terhadap S. mutans
dalam biofilm multispesies menunjukkan proporsi DNA S. sanguinis lebih kecil daripada S. mutans, yaitu berkisar antara 35-42% untuk S. sanguinis dan 58-65% untuk S. mutans. Proporsi DNA kedua bakteri tersebut secara statistik tidak berbeda nyata dengan kontrol. Hal ini mengindikasikan pemberian kedua jenis
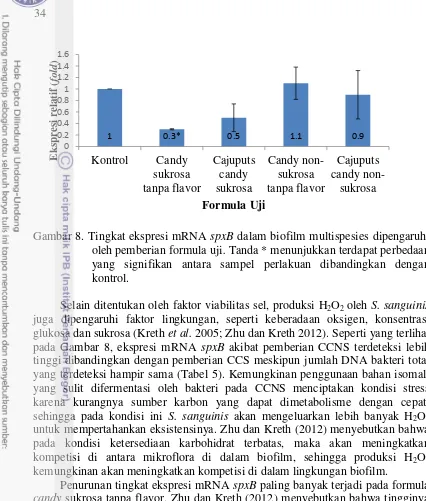
cajuputs candy tidak mempengaruhi interaksi S. sanguinis dengan S. mutans. Analisis ekspresi mRNA spxB dengan teknik real-time PCR menunjukkan terdeteksinya mRNA spxB pada pemberian CCS sebesar 0,5 dan pada CCNS sebesar 0,9 secara relatif dibandingkan dengan kontrol yang mempunyai tingkat ekspresi mRNA spxB sebesar 1,0. Pada pemberian candy sukrosa tanpa flavor tingkat ekspresi mRNA spxB terdeteksi sebesar 0,3 dan pada pemberian candy
non-sukrosa tanpa flavor sedikit meningkat, yaitu sebesar 1,1. Masih terdeteksinya ekspresi mRNA spxB ini mengindikasikan bahwa pemberian kedua macam cajuputs candy ini tidak mempengaruhi kemampuan S. sanguinis
menghasilkan H2O2, sehingga tetap bersifat kompetitif terhadap S. mutans.
Dengan demikian kesimpulan hasil penelitian ini adalah kedua jenis cajuputs candy, yaitu CCS dan CCNS, mampu memelihara daya kompetitif S. sanguinis
terhadap S. mutans dalam lingkungan biofilm multispesies.
Kata kunci: cajuputs candy, penghambatan biofim, Streptococcus sanguinis,
SUMMARY
BERNADETA RATNA EKA SARI. Effect of Cajuputs Candy Formulas on Competitive Capacity of Streptococcus sanguinis upon Streptococcus mutans in Multispecies Biofilm. Supervised by CHRISTOFORA HANNY WIJAYA and BOY MUCHLIS BACHTIAR.
Cajuputs candy development as a functional food has been shifted to maintain the oral health. Cajuputs candy is classified as hard candy which utilized cajuput and peppermint oil as its flavor components.Streptococcus sanguinis is a health-associated species which can control the growth of cariogenic species, S. mutans. These two oral Streptococci have antagonistic interaction which plays a role in preventing dental caries formation. The aim of this research is to determine the effects of two type of cajuputs candy, i.e. Sucrose Cajuputs Candy (SCC) and Non-Sucrose Cajuputs Candy (NSCC), on competitive capacity of S. sanguinis
upon S. mutans in multispecies (S. sanguinis+S. mutans) biofilm, which is indicated by its ability to form biofilm, control the growth of S. mutans, and expressed spxB mRNA. The spxB mRNA expression reflected hydrogen peroxide (H2O2) production by S. sanguinis.
Volatile constituents of cajuputs candy’s flavors were analyzed using Gas Chromatography-Mass Spectrometry (GC-MS). In vitro biofilm assay with optical density (OD) measurement was used to examine the potency of cajuputs candy in inhibiting the formation of multispecies biofilm. Quantitative real-time polymerase chain reaction (real-time PCR) techniques were applied for quantification of spxB mRNA and relative amount of total DNA bacterium in the biofilms.
Several reported antimicrobial components, i.e. 1,8-cineole (23,67%), α -terpineol (9,17%), menthol (7,29%), β-caryophyllene (6,78%), menthone (3,30%), and terpinen-4-ol (1,86%) were detected in SCC. Meanwhile, the reported antimicrobial components, i.e. menthol (13,32%), α-terpineol (9,97%), 1,8-cineole (8,48%), β-caryophyllene (7,64%), menthone (4,43%) and terpinen-4-ol (1,28%) were also detected in NSCC.
The biofilm assay showed that the exposures of SSC and NSCC were effective in inhibiting multispecies biofilm. Biofilm inhibition caused by SCC was 59,2% and NSCC was 68,2%. Moreover, SCC and NSCC exposures also decreased the relative amount of total DNA in multispecies biofilm to be 1,20% and 1,04% compared to the control (100%), respectively. These reductions were indicating that SCC and NSCC could inhibit biofilm formation of S. sanguinis and
S. mutans, in vitro.
Even a non-sucrose utilization, in this study is isomalt - a non-cariogenic polyol-, with a long exposure time (approx. 20 hours) in this research could be fermented by these Streptococci and can be used for their growth. This indicated that cajuput and peppermint oil in SCC and NSCC showed antibacterial activity.
The proportion of S. sanguinis DNA in multispecies biofilms was lower than S. mutans DNA in all samples, which ranged from 35 to 42% for S. sanguinis
and 58 to 65% for S. mutans. This bacterial DNA proportion was not statistically significant compared with the control, suggest that cajuputs candy exposures did not affect S. sanguinis and S. mutans interaction.
Analysis of spxB mRNA of S. sanguinis shows that SCC and NSCC exposures could maintain spxB mRNA expression level relatively at 0.5 fold and 0.9 fold compared with the control (1,0 fold), respectively. The expression of
spxB mRNA was decreased to be 0.3 fold after sucrose candy without flavor exposure, while exposures of non-sucrose candy without flavor increase spxB
mRNA expression to be 1.1 fold. The detected spxB mRNA in the biofilms indicated that cajuputs candy formulas exposures did not affect S. sanguinis
ability to produce H2O2 and could be considered as competitive against S. mutans.
Both cajuputs candies (SCC and NSCC) have the potency in maintaining the competitive capacity of S. sanguinis upon S. mutans in multispecies biofilm. Keywords: cajuputs candy, biofilm inhibition, Streptococcus sanguinis,
© Hak Cipta Milik IPB, Tahun 2013
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Pangan
PENGARUH FORMULA
CAJUPUTS CANDY
PADA DAYA KOMPETITIF
Streptococcus sanguinis
TERHADAP
Streptococcus mutans
DALAM BIOFILM MULTISPESIES
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2013
Judul Tesis : Pengaruh Formula Cajuputs Candy pada Daya Kompetitif
Streptococcus sanguinis terhadap Streptococcus mutans dalam Biofilm Multispesies
Nama : Bernadeta Ratna Eka Sari NIM : F251100051
Disetujui oleh Komisi Pembimbing
Prof. Dr. Ir. C. Hanny Wijaya, M.Agr Ketua
Prof. drg. Boy M. Bachtiar, MS, Ph.D Anggota
Diketahui oleh
Ketua Program Studi Ilmu Pangan
Prof. Dr. Ir. Ratih Dewanti-Hariyadi, M.Sc
Dekan Sekolah Pascasarjana
Dr. Ir. Dahrul Syah, MSc.Agr
PRAKATA
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Esa dan Maha Kasih atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Juli 2012 ini ialah Pengaruh Formula Cajuputs Candy pada Daya Kompetitif Streptococcus sanguinis terhadap Streptococcus mutans dalam Biofilm Multispesies.
Terima kasih penulis ucapkan kepada Ibu Prof. Dr. Ir. C. Hanny Wijaya, M.Agr dan Bapak Prof. drg. Boy M. Bachtiar, MS, Ph.D selaku pembimbing yang dengan sabar dan tak pernah lelah memberikan semangat dan saran yang sangat penulis perlukan. Penulis juga mengucapkan terima kasih kepada Dr. Ir. Harsi D. Kusumaningrum, M.Si selaku dosen penguji luar komisi pembimbing yang telah banyak memberikan saran yang melengkapi tesis ini. Selain itu, penulis juga mengucapkan terima kasih kepada Departemen Pendidikan atas pendanaan penelitian ini melalui Hibah Kompetensi (HIKOM) 2012 yang diperoleh oleh Ibu Prof. Dr. Ir. C. Hanny Wijaya, M.Agr. Di samping itu, ucapan terima kasih juga penulis sampaikan kepada Saudari Dessy Ashari, S.Si dan Saudari Maysaroh, S.Si dari Laboratorium Biologi Oral FKG-UI, dan Saudari Desi Arofah dari Laboratorium Analisis Flavor Balai Besar Penelitian Padi Sukamandi, yang telah banyak membantu penulis selama menjalankan penelitian. Penulis juga tidak lupa mengucapkan terima kasih kepada Saudari Gracella atas bantuan berupa penyediaan beberapa bahan baku penelitian.
Ungkapan terima kasih mendalam juga penulis sampaikan kepada ayah, ibu, suami, mertua, adik, serta seluruh keluarga, atas segala doa, dukungan, dan kasih sayangnya yang tiada henti. Penulis juga mengucapkan terima kasih kepada keluarga besar IPN 2010, rekan sebimbingan (Ayu, Elok, Winny, Intan, Bu Maria, Bu Irdha, dan Yunita), dosen dan staf Prodi Ilmu Pangan, serta rekan-rekan lainnya yang tidak dapat disebutkan satu per satu, yang telah memberikan inspirasi, semangat, motivasi, doa, dan kebersamaan kepada penulis selama kuliah dan penelitian. Semoga karya ilmiah ini bermanfaat.
Bogor, Juli 2013
DAFTAR ISI
DAFTAR TABEL xv
DAFTAR GAMBAR xv
DAFTAR LAMPIRAN xvi
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 4
Hipotesis 4
2 TINJAUAN PUSTAKA
Minyak Kayu Putih 4
Minyak Peppermint 5
Cajuputs Candy 6
Biofilm dan Karies Gigi 7
Peran S. sanguinis dan S. mutans pada Kejadian Karies Gigi 8
Piruvat Oksidase (Spx) 10
Minyak Atsiri sebagai Komponen Antimikroba 10
Teknik Kuantitatif Real-Time Polymerase Chain Reaction (real-time PCR)
11 3 METODOLOGI PENELITIAN
Waktu dan Tempat Penelitian 12
Bahan 12
Alat 13
Metode 13
Pembuatan Permen sebagai Formula Uji 14
Analisis Komponen Volatil 14
Pembenihan dan Persiapan Bakteri Uji 16
Uji Penghambatan Biofilm oleh Formula Uji 17
Penumbuhan Biofilm, Ekstraksi RNA, dan Sintesis cDNA 17
Kuantifikasi Ekspresi mRNA spxB 19
Ekstraksi DNA dan Kuantifikasi DNA 19
Analisis Statistik 21
4 HASIL DAN PEMBAHASAN
Identifikasi Komponen Volatil Flavor Cajuputs Candy 21 Pengaruh Formula Uji terhadap Pembentukan Biofilm Multispesies 28 Pengaruh Formula Uji terhadap Jumlah DNA Bakteri Total dan Proporsi DNA S. sanguinis terhadap S. mutans dalam Biofilm
Multispesies 30
Hubungan Kandungan Komponen Volatil Cajuputs Candy dengan
Aktivitas Antimikroba 36
5 SIMPULAN DAN SARAN
Simpulan 37
Saran 37
DAFTAR PUSTAKA 38
LAMPIRAN 43
DAFTAR RIWAYAT HIDUP 63
DAFTAR TABEL
1 Primer yang digunakan untuk analisis real-time PCR beserta urutan
oligonukleotidanya 13
2 Komposisi komponen volatil ekstrak minyak kayu putih (MKP), minyak
peppermint (MP), cajuputs candy sukrosa (CCS), dan cajuputs candy
non-sukrosa (CCNS) 22
3 Komponen volatil pada cajuputs candy yang diduga mempunyai aktivitas antimikroba dan penggolongannya berdasarkan unit terpen penyusunnya 25 4 Perbedaan nilai OD biofilm multispesies setelah pemberian formula uji 28 5 Pengaruh formula uji terhadap jumlah DNA bakteri total dan proporsi
DNA S. sanguinis terhadap S. mutans dalam biofilm multispesies 31
DAFTAR GAMBAR
1 Cajuputs Candy 6
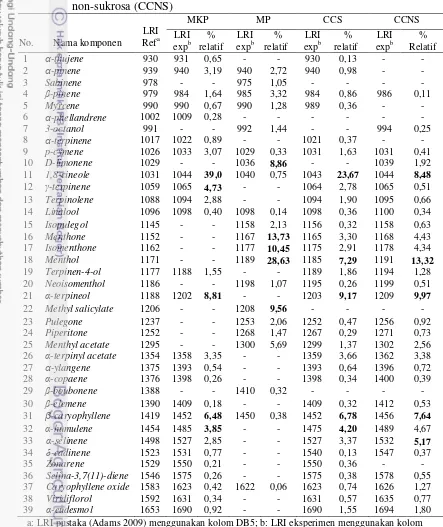
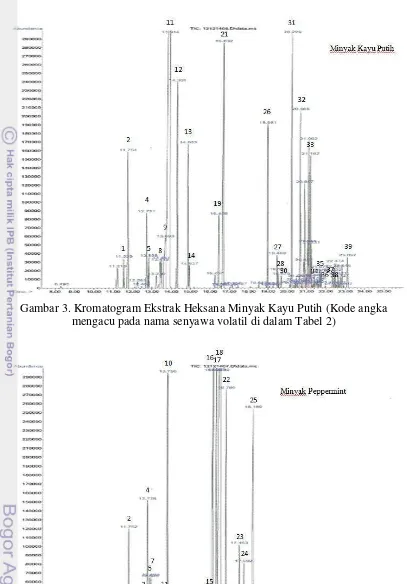
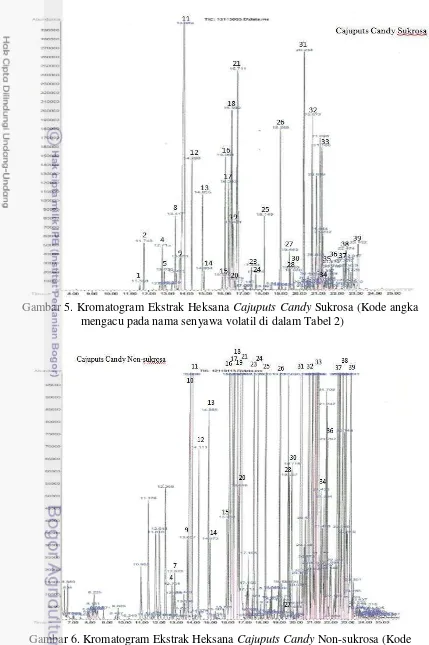
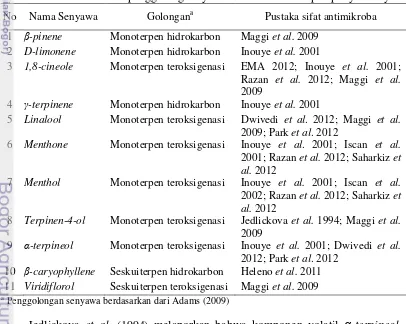
2 Skema antagonisme S. sanguinis dengan S. mutans 9 3 Kromatogram Ekstrak Heksana Minyak Kayu Putih 23 4 Kromatogram Ekstrak Heksana Minyak Peppermint 23 5 Kromatogram Ekstrak Heksana Cajuputs Candy Sukrosa 24 6 Kromatogram Ekstrak Heksana Cajuputs Candy Non-sukrosa 24 7 Struktur kimia beberapa senyawa monoterpen teroksigenasi yang
teridentifikasi di dalam cajuputs candy 27
8 Tingkat ekspresi mRNA spxB dalam biofilm multispesies dipengaruhi
DAFTAR LAMPIRAN
1 Hasil Identifikasi Komponen Volatil Minyak Kayu Putih 43 2 Hasil Identifikasi Komponen Volatil Minyak Peppermint 45
3 Hasil Identifikasi Komponen Volatil CCS 47
4 Hasil Identifikasi Komponen Volatil CCNS 49
5 Kromatogram Ekstrak Heksana Minyak Kayu Putih 51 6 Kromatogram Ekstrak Heksana Minyak Peppermint 51 7 Kromatogram Ekstrak Heksana Cajuputs Candy Sukrosa (CCS) 52 8 Kromatogram Ekstrak Heksana Cajuputs Candy Non-sukrosa (CCNS) 52
9 Nilai Optical Density (OD) Uji Biofilm 53
10 Hasil analisis statistik student t test optical density (OD) biofilm pada uji penghambatan biofilm akibat pemberian formula uji 54 11 Hasil kuantifikasi jumlah relatif DNA bakteri total dalam biofilm
multispesies akibat pengaruh formula uji berdasarkan nilai CT yang
teramplifikasi pada mesin real-time PCR 55
12 Hasil perhitungan proporsi DNA S. sanguinis terhadap S. mutans dalam biofilm multispesies akibat pengaruh formula uji berdasarkan nilai CT yang teramplifikasi pada mesin real-time PCR 56 13 Tabulasi Perhitungan Proporsi DNA S. sanguinis dan S. mutans 57 14 Hasil analisis statistik student t test pada proporsi DNA S. sanguinis
terhadap S. mutans dalam biofilm multispesies akibat pengaruh formula
uji 58
15 Hasil kuantifikasi tingkat ekspresi mRNA spxB dalam biofilm multispesies akibat pengaruh formula uji berdasarkan nilai CT yang
teramplifikasi pada mesin real-time PCR 60
1
PENDAHULUAN
Latar Belakang
Cajuputs candy merupakan sejenis permen keras yang mengandung minyak atsiri kayu putih (cajuput oil) dan peppermint sebagai komponen flavornya (Nuramdhan 2010; Rachmatillah 2011; Christie 2012). Saat ini terdapat dua jenis cajuputs candy, yaitu Cajuputs Candy Sukrosa (CCS) dan Cajuputs Candy Non-Sukrosa (CCNS). CCNS dikembangkan dari CCS dengan mengganti bahan sukrosa dan glukosa dengan isomalt yang dikombinasikan dengan pemanis buatan (intense sweetener) acesulfame-K (Christie 2012). Isomalt merupakan gula alkohol yang rendah kalori dan tidak memicu karies gigi (Wijaya dan Mulyono 2010). Inovasi ini dimaksudkan agar cajuputs candy mempunyai khasiat yang lebih baik lagi sebagai permen kesehatan, yaitu permen yang rendah kalori dan dapat membantu menjaga kesehatan mulut dan gigi (oral health care).
Penggunaan minyak kayu putih dan peppermint dalam cajuputs candy
berpotensi untuk berperan sebagai pangan fungsional yang bermanfaat bagi kesehatan (Wijaya 2011). Beberapa penelitian yang mengkaji manfaat cajuputs candy terhadap kesehatan mulut dan gigi telah dilakukan. Cajuputs candy
memiliki manfaat melegakan tenggorokan dan menghambat pertumbuhan bakteri penyebab karies gigi, yaitu Streptococcus mutans (Wijaya et al. 2011). Melalui penelitian Nurramdhan (2010), formula CCS terbukti mampu menekan akumulasi biofilm Streptococcus mutans serotif c dan d yang dapat menyebabkan karies gigi. Racmatillah (2011) melaporkan bahwa formula CCS mampu menekan pembentukan biofilm dan viabilitas Candida albicans, yaitu fungi yang dapat menyebabkan sariawan (Tjampakasari 2006 diacu dalam Rachmatillah 2011). Sementara itu Iftari (2013) melaporkan bahwa formula CCNS mampu menghambat aktivitas mRNA gtfC S. mutans yang berperan dalam aktivitas pembentukan biofilm S. mutans.
Beberapa studi terakhir menunjukkan bahwa jenis makanan yang diasup dapat menentukan status kesehatan oral seseorang (Kazemi et al. 2011). Oleh karena itu asupan pangan fungsional seperti cajuputs candy diharapkan dapat mendukung pemeliharaan kesehatan mulut dan gigi. Karies gigi merupakan penyakit gigi yang diderita oleh mayoritas penduduk di Indonesia dengan prevalensi sebesar 72,1% (Depkes RI 2008). Faktor diet (pola makan) merupakan salah satu faktor yang dapat memicu timbulnya karies gigi selain faktor host
(struktur gigi, saliva), mikroorganisme, dan waktu (Samaranayake 2002).
2
Studi-studi in vitro dan in vivo menunjukkan bahwa interaksi antara S. sanguinis dan S. mutans bersifat antagonistis (Kreth et al. 2005). Interaksi antagonistis ini telah diteliti mampu mengurangi atau menunda kejadian karies gigi (Kreth et al. 2005). S. sanguinis merupakan bakteri yang sering dikaitkan dengan kesehatan mulut dan gigi (Percival et al. 2006; Turner et al. 2009). Sebagai bakteri pengkoloni awal (pioneer colonizer), kolonisasi S. sanguinis
dalam membentuk biofilm dapat menekan pertumbuhan S. mutans agar tidak mendominasi biofilm (Kreth et al. 2005; Kreth et al. 2008). Dalam kompetisi untuk membentuk biofilm dan mempertahankan eksistensinya, S. sanguinis
menghasilkan hidrogen peroksida (H2O2) untuk menekan pertumbuhan S. mutans
(Zheng et al. 2011a). Zat H2O2 merupakan satu-satunya zat antibakteri yang
disekresikan oleh S. sanguinis, yang dihasilkan melalui aktivitas enzim piruvat oksidase atau Spx (Zheng et al. 2011b). Aktivitas enzim Spx S. sanguinis ini dikode oleh gen spxB, yang diekspresikan oleh mRNA spxB (Zheng et al. 2011b). Paparan cajuputs candy pada rongga mulut dapat mempengaruhi interaksi
S. sanguinis dengan S. mutans di dalam lingkungan biofilm. Daya kompetitif S. sanguinis terhadap S. mutans di dalam biofilm, yang diindikasikan oleh kemampuannya membentuk biofilm, mengontrol pertumbuhan S. mutans, dan mengekspresikan mRNA spxB sebagai refleksi produksi H2O2, berperan dalam
penundaan kejadian karies gigi (Kreth et al. 2005). Oleh karena itu, penelitian ini bertujuan menentukan pengaruh cajuputs candy pada daya kompetitif S. sanguinis
terhadap S. mutans di dalam biofilm multispesies (S. sanguinis+S. mutans). Pemberian cajuputs candy diharapkan tetap mampu menjaga daya kompetitif S. sanguinis terhadap S. mutans di dalam lingkungan biofilm, sehingga permen ini dapat bermanfaat untuk mendukung pemeliharaan kesehatan mulut dan gigi.
Perumusan Masalah
Cajuputs candy mengandung minyak kayu putih dan minyak peppermint
sebagai komponen flavornya. Beberapa komponen volatil minyak kayu putih dan minyak peppermint dilaporkan mempunyai aktivitas antimikroba terhadap bakteri
Streptococcus spp (Jedlickova et al. 1994; Galvao et al. 2012). Aktivitas antimikroba CCS dan CCNS dalam menghambat pembentukan biofilm S. mutans
masing-masing dilaporkan oleh Nurramdhan (2010) dan Iftari (2013). Iftari (2013) lebih lanjut menunjukkan penghambatan CCNS terhadap ekspresi mRNA
gtfC, yaitu gen yang mengkode pembentukan glukan tidak larut air yang menempel kuat pada permukaan gigi (plak) oleh S. mutans. Hasil penelitian Iftari (2013) menunjukkan bahwa penghambatan mRNA gtfC S. mutans paling optimal terjadi pada masa inkubasi 4 jam.
3 Metode untuk menguji pengaruh cajuputs candy terhadap interaksi S. sanguinis dan S. mutans adalah dengan memberikan permen ke dalam biofilm multispesies, yaitu biofilm yang terdiri dari bakteri S. sanguinis yang ditumbuhkan bersama dengan S. mutan, secara in vitro. Biofilm multispesies (S. sanguinis + S. mutans) ini dimaksudkan sebagai bentuk interaksi mikrobial yang mendekati kondisi sesungguhnya di dalam rongga mulut, yang tidak hanya terdiri dari satu spesies bakteri saja, namun merupakan komunitas polimikrobial yang kompleks (Kreth et al. 2008). Dampak paparan cajuputs candy terhadap daya kompetitif S. sanguinis dapat dilihat melalui pengujian penghambatan biofilm, kuantifikasi jumlah DNA bakteri total dan proporsi DNA S. sanguinis terhadap S. mutans dalam biofilm, serta kuantifikasi mRNA spxB S. sanguinis.
Uji penghambatan biofilm digunakan untuk menentukan dampak pemberian CCS dan CCNS terhadap kemampuan kedua bakteri dalam membentuk biomassa biofilm, yang tercermin dari nilai optical density (OD). Semakin tinggi nilai OD, maka semakin banyak biofilm yang terbentuk (Yamanaka et al. 2004). Kuantifikasi DNA bakteri total dan proporsi DNA bakteri dalam biofilm, serta mRNA spxB dilakukan dengan teknik real-time PCR menggunakan pasangan primer spesifik sehingga dapat menghitung DNA dan mRNA target secara akurat. Kuantifikasi DNA bakteri total dapat digunakan untuk menentukan dampak pemberian CCS dan CCNS terhadap peningkatan atau penurunan jumlah bakteri dalam biofilm, sebagai indikasi aktivitas antimikroba cajuputs candy. Sedangkan pengaruh cajuputs candy terhadap peran kontrol S. sanguinis terhadap S. mutans
dapat ditentukan dengan menganalisis proporsi DNA S. sanguinis dan S. mutans
dalam biofilm. Lalu untuk melihat pengaruh CCS dan CCNS terhadap kemampuan S. sanguinis mengekspresikan mRNA spxB, yaitu gen yang merefleksikan produksi H2O2, maka dapat dilakukan dengan mengkuantifikasi
mRNA spxB. Gen spxB yang dimiliki oleh S. sanguinis tidak terdapat pada S. mutans, sehingga dengan menggunakan primer spesifik, teknik real-time PCR
dapat membedakan dan menghitung dengan akurat tingkat ekspresi mRNA spxB S. sanguinis (Zheng et al. 2011a).
4
Tujuan Penelitian
Penelitian ini bertujuan untuk menentukan pengaruh Cajuputs Candy
Sukrosa (CCS), Cajuputs Candy Non-Sukrosa (CCNS) pada daya kompetitif
Streptococcus sanguinis terhadap S. mutans dalam biofilm multispesies (S. sanguinis + S. mutans).
Hipotesis
Cajuputs Candy Sukrosa (CCS) dan Cajuputs Candy Non-Sukrosa (CCNS) mampu memelihara daya kompetitif Streptoccocus sanguinis terhadap S. mutans
dalam biofilm multispesies (S. sanguinis + S. mutans).
2
TINJAUAN PUSTAKA
Minyak Kayu Putih
Minyak kayu putih dikenal juga dengan nama cajeput oil (Fr., Ger., Sp., Lt.) atau cajuput oil (Ing.), dihasilkan dari proses distilasi bagian daun dan cabang tanaman kayu putih (Melaleuca cajuputi Roxb) atau ―white wood‖ yang merupakan tanaman penghasil minyak atsiri khas Indonesia. Menurut BSN (2006), mengacu pada SNI 06-3954-2006 tentang Minyak Kayu Putih, minyak kayu putih didefinisikan sebagai minyak atsiri yang diperoleh dengan cara penyulingan daun dan ranting dari tanaman kayu putih (Melaleuca leucadendron). Minyak kayu putih mempunyai penampakan sebagai cairan bening, hampir tidak berwarna, sampai agak hijau atau kuning, mempunyai aroma yang kuat, kamfor dan aromatik, dengan rasa yang pahit dan membakar (Burdock 2010).
Mutu minyak kayu putih diklasifikasikan menjadi dua kelas, yaitu mutu utama (U) dan mutu pertama (P). Klasifikasi mutu tersebut yang dibedakan berdasarkan kadar sineol, yaitu senyawa kimia golongan ester turunan terpen alkohol yang terdapat dalam minyak atsiri kayu putih. Minyak kayu putih mutu U mempunyai kadar cineole ≥ 55%, sedang mutu P mempunyai kadar cineole
kurang dari 55% (Dephut 2001).
Minyak kayu putih sering digunakan sebagai obat antiseptik dan carrigens
pada pembuatan obat-obat kumur dan pasta gigi (Parera 2005). Minyak kayu putih juga dapat digunakan sebagai ekspektoran, antiiritasi, scabisida, rubefacient, dan antimikotik (Agusta 2000). Penggunaannya sebagai ekspektoran dalam kasus
laryngitis dan bronchitis banyak disoroti. Selain digunakan sebagai obat, minyak kayu putih dapat digunakan pula sebagai bahan flavoring untuk makanan (Agusta 2000). Minyak kayu putih ini dapat digolongkan sebagai bahan flavor alami yang diijinkan, baik oleh FDA (Food and Drug Administration), JECFA (Joint Expert FAO/WHO Committee on Food Additives), maupun FEMA (Flavor Extract
5 mempunyai PADI (Possible Average Daily Intake) sebesar 0,831 mg. Penggunaan minyak kayu putih dalam produk makanan, yaitu pada produk soft candy secara umum digunakan sebanyak 6,80 ppm dan maksimal 9,5 ppm (Burdock 2010). Penggunaannya secara oral mempunyai batas toksisitas LD50 oral rat sebesar 3870,00 mg/kg berat badan, sementara toksisitas dermal (LD50) dan penghirupan (LC50) batasnya tidak ditentukan sehingga penggunaan minyak kayu putih untuk konsumsi secara oral cukup aman (thegoodscentcompany 2011). Wijaya et al. (2005) telah mengembangkan produk permen dengan menggunakan minyak kayu putih murni sebagai flavornya dengan konsentrasi sebanyak 0,25-1%.
Guenther (1990) melaporkan komponen utama dalam minyak kayu putih adalah sineol sebanyak 50-60%. Komponen-komponen minyak kayu putih dapat diidentifikasi menggunakan instrumen kromatografi gas yang dilengkapi dengan spektrometer massa (GC-MS) (Agusta 2000). Komponen-komponen yang terdapat dalam minyak kayu putih antara lain cineole, terpineol, pinene, benzaldehide, limonene, dan sesquiterpene (Ketaren 1990). Muchtaridi et al.
(2004) melakukan identifikasi komponen minyak atsiri yang diekstrak dari daun minyak kayu putih (Melaleuca leucadendron Linn.) menggunakan GC-MS dan melaporkan komponen-komponen yang terdapat di dalamnya antara lain 1,8-cineole (22,45%), α-terpineol (12,45%), (E)-caryophyllene (6,95%), β-pinene
(5,74%), α-humulene (4,70%), β-selinene (3,82%), β-myrcene (3,58%), α-selinene
(2,9%), dan α-terpinyl acetate (2,74%).
Komponen-komponen volatil minyak kayu putih selain berperan memberikan karakteristik aroma minyak kayu putih, juga berperan sebagai komponen aroma aktif yang mempunyai aktivitas antibakteri. Jedlickova et al.
(1994) menyebutkan bahwa komponen dalam minyak kayu putih, yaitu 1,8-cineole, linalool, α-terpineol, dan terpinen-4-ol sangat potensial untuk digunakan sebagai antibakteri. Dari keempat senyawa tersebut, α-terpineol dan terpien-4-ol
adalah komponen yang paling efektif sebagai antibakteri dan mampu menghambat beberapa strain mikroba, seperti Candida albicans, Streptococcus spp, A, B, C, dan G, Enterobacter spp, Salmonella spp, dan Klebsiella pneumonia (Jedlickova
et al. 1994). James (1989) menyebutkan bahwa senyawa aktif yang berfungsi sebagai antiseptik dalam minyak kayu putih adalah senyawa kristalin fenolik, 3,5-dimetil-4,6-di-o-metilfloroasetopinon dengan kadar sekitar 10%.
Minyak Peppermint
Minyak peppermint diperoleh dari hasil distilasi daun Mentha piperita.
Minyak peppermint mempunyai karakteristik aroma segar, tajam, bau mentol yang kuat, sweet, rasa balsamic yang tajam, diikuti sensasi dingin ketika udara berhembus masuk ke dalam mulut (Burdock 2010). Minyak peppermint berwarna bening sampai kuning pucat dan mempunyai viskositas mirip dengan air. Burdock (2010) menyebutkan komponen minyak peppermint meliputi α-pinene dan β -pinene, limonene, cineole, ethyl amylcarbinol, menthone, isomenthone menthofuran, menthol, neomenthol, isomenthol, menthyl acetate, dan piperitone. Kandungan menthone berkisar 15-32%, ester (menthyl acetate) antara 3-10%, dan
6
Minyak peppermint secara tradisional telah lama digunakan untuk pengobatan. Kandungan komponen utama pada minyak peppermint seperti
menthol, menthone, menthyl acetate, 1,8-cineole, limonene, β-pinene, dan β -caryophyllene dilaporkan mampu menghambat beberapa bakteri (Catherine et al.
2012). Efek bekaterisidal minyak peppermint bahkan lebih kuat daripada minyak kayu putih (Razan et al. 2012). Komponen menthol dilaporkan mampu menghambat pembentukan biofilm bakteri S. mutans dan S. sanguinis (Dwivedi et al. 2012).
Minyak peppermint selain digunakan sebagai bahan pengobatan (farmasi) juga digunakan sebagai flavouring agent di industri makanan maupun kosmetik (Alankar 2009). Konsumsi minyak peppermint dinyatakan aman oleh organisasi flavor dunia FEMA (Flavor Extract Manufacturer’s Association) dengan nilai PADI (Possible Average Daily Intake) sebesar 35,772 mg. Batas konsumsi individual yang pernah dilaporkan adalah sebesar 1,1751 mg/kg/hari dan penggunaannya dalam berbagai jenis makanan berkisar antara 6 sampai dengan 8300 ppm (Burdock 2010).
Cajuputs Candy
Cajuputs candy merupakan permen keras yang mengandung minyak atsiri kayu putih dan peppermint sebagai komponen flavornya (Gambar 1). Permen keras mempunyai tekstur yang keras, penampakan yang jernih dan biasanya terdiri dari komponen dasar sukrosa dan sirup glukosa serta bahan-bahan lain untuk memberikan rasa dan penampakan yang lebih baik (Jackson 1995). Cajuputs candy pada awalnya dikembangkan dengan tujuan untuk melestarikan kekayaan herbal asli Indonesia dan menambah nilai ekonomis minyak kayu putih (Halimah 1997). Penggunaan minyak kayu putih dan peppermint dalam cajuputs candy
menjadikannya berpotensi sebagai pangan fungsional untuk menjaga kesehatan mulut dan gigi (Wijaya 2011)
Gambar 1 Cajuputs Candy
7 mikroorganisme menghasilkan asam (Decker dan Loveren 2003), sedangkan isomalt merupakan karbohidrat yang sangat lambat difermentasi oleh mikroorganisme sehingga sulit digunakan oleh mikroorganisme untuk diubah menjadi asam (Mayo dan Ritchie 2009). Asam yang dihasilkan dari proses fermentasi oleh mikroorganisme dapat menyebabkan dekasilfikasi lapisan gigi dan memicu timbulnya karies (Imfeld 1999). Selain sulit difermentasi oleh mikroorganisme, isomalt memiliki nilai kalori hanya setengah dari nilai kalori sukrosa, yaitu hanya dua kalori per gram, sehingga cocok digunakan sebagai gula diet bagi penderita diabetes (polyol.org 2012).
Optimasi produk cajuputs candy telah dilakukan pada bahan baku utama dan komponen flavornya (Rachmatillah 2011; Christie 2012). Hasil uji organoleptik terhadap CCS diperoleh skor kesukaan keseluruhan sebesar 4.99 - 5.24 pada skala 1-9, yaitu netral hingga agak suka (Rachmatillah 2011), sedangkan CCNS memperoleh skor kesukaan keseluruhan sebesar 6,76 pada skala 1-9 atau agak suka menuju suka (Christie (2012).
Melalui penelitian khasiat yang berkelanjutan (Lampiran 17), cajuputs candy mempunyai potensi sebagai pangan fungsional yang bermanfaat bagi pemeliharaan kesehatan gigi dan rongga mulut (Wijaya 2011). Formulasi CCS sebagai permen dengan khasiat sebagai pelega tenggorokan telah mendapatkan hak paten dengan nomor ID 0 000 385 S. CCS juga telah diteliti mampu menekan akumulasi biofilm bakteri S. mutans serotif c, yaitu bakteri penyebab karies gigi, secara in vitro (Nurramdhan 2010; Wijaya et al. 2011). CCS juga dilaporkan mampu menekan pembentukan biofilm dan viabilitas fungi Candida albicans
penyebab candidiasis, secara in vitro (Rachmatillah 2011). Sementara itu Iftari (2013) melaporkan potensi CCNS dalam menghambat aktivitas pembentukan biofilm S. mutans yang diindikasikan oleh penghambatan terhadap ekspresi mRNA gtfC S. mutans. Menurut Iftari (2013), daya hambat CCNS terhadap ekspresi mRNA gtfCS. mutans paling optimal pada masa inkubasi 4 jam.
Berdasarkan penelitian-penelitian yang telah dilakukan, cajuputs candy telah terbukti secara in vitro memiliki manfaat bagi kesehatan rongga mulut dan gigi (Wijaya 2011). Namun demikian, kajian ilmiah terhadap potensi fungsional
cajuputs candy dalam pemeliharaan kesehatan mulut dan gigi perlu terus dilakukan agar manfaat yang ada dapat diidentifikasi dan dikarakterisasi dengan baik dan terbukti memberikan pengaruh yang nyata terhadap target fungsi dalam tubuh yang mendukung isu kesehatan. Kajian khasiat ini perlu sesuai definisi pangan fungsional menurut BPOM RI (2005). Selanjutnya, kajian ilmah tersebut harus disebarluaskan kepada masyarakat melalui media informasi ilmiah yang dapat dipercaya, sehingga masyarakat mendapatkan informasi yang benar dan dapat dipertanggungjawabkan kebenarannya.
Biofilm dan Karies Gigi
Mikroorganisme pada permukaan mukosa rongga mulut berada dalam bentuk komunitas polimikrobial kompleks yang disebut biofilm (Kreth et al.
8
bakteri itu sendiri maupun yang diperoleh dari lingkungan tempat mikroorganisme itu tumbuh (Marsh 1999). Menurut Liu et al. (2011), matriks ektraseluler biofilm berupa polisakarida, protein, dan DNA. Plak gigi merupakan salah satu bentuk biofilm yang paling sering dijumpai di dalam rongga mulut dan sudah banyak diteliti, sehingga dapat dikarakterisasi dengan baik (Kreth et al.
2008).
Biofilm di dalam mulut menghadapi berbagai fenomena perubahan yang disebabkan karena asupan makanan. Asupan makanan dapat menyebabkan perubahan suhu, pH, serta aliran saliva dalam rongga mulut (Kreth et al. 2005). Perubahan ini dapat mempengaruhi fungsi komponen-komponen di dalam biofilm dan pada kondisi-kondisi tertentu dapat memicu timbulnya penyakit infeksi. Penyakit infeksi yang dapat disebabkan karena akumulasi biofilm bakteri
Streptococci antara lain karies gigi (Kreth et al. 2008). Biofilm terbentuk sebagai hasil dari pelekatan awal dan pertumbuhan suatu kelompok bakteri yang melibatkan guorum sensing, yaitu reaksi komunikasi intermikrobial dengan mencegah organisme tertentu untuk berada pada permukaan atau tergabung dalam komunitas. Dengan ini pencegahan karies gigi dapat dicapai dengan cara menghalangi penempelan S. mutans di pelikel saliva (Nobbs et al. 2009). Pengontrolan kolonisasi merupakan cara yang tepat untuk menciptakan lingkungan mikroflora mulut yang menguntungkan (Nobbs et al. 2009).
Bakteri di dalam rongga mulut, sekitar 20%-nya terdiri dari Streptococci. Bakteri Streptococci pengkoloni awal memulai pembentukan biofilm (plak gigi) dan mempunyai sebaran temporal yang spesifik dan spasial yang sangat menentukan pembentukan biofilm oral. Bakteri Streptococci tersebut mampu menggunakan bermacam jenis karbohidrat untuk membentuk biofilm. (Kreth et al.
2008). Koloni Streptococci di dalam biofilm mampu menggunakan karbohidrat seperti sukrosa dan glukosa untuk membentuk matriks biofilm (plak) dengan cepat. Fermentasi sukrosa dan glukosa ini menghasilkan asam yang dapat menurunkan pH plak. Penurunan pH plak gigi dapat menyebabkan demineralisasi lapisan gigi (Imfeld 1999). Bakteri S. mutans sangat tahan berada pada kondisi asam, sehingga dapat menginvasi biofilm dan memicu terjadinya karies gigi (Kreth et al. 2005).
Mekanisme degradasi oleh mikroorganisme yang berbeda dilaporkan pada karbohidrat golongan poliol, seperti xilitol, sorbitol, manitol, maltitol, dan isomalt. Semua gula alkohol (poliol) tersebut dilaporkan bersifat non-kariogenik atau sangat rendah sifat kariogeniknya (Imfeld 1999). Berdasarkan studi telemetri pH plak, gula alkohol tidak bersifat menurunkan pH dengan cepat karena gula alkohol tersebut sangat lambat difermentasi oleh mikroorganisme, sehingga bersifat mampu mencegah karies (Imfeld 1999). Biofilm yang dihasilkan akibat paparan gula alkohol dilaporkan mempunyai densitas yang lebih rendah dan lebih lama terbentuk dibandingkan pada paparan gula sukrosa (Imfeld 1999).
Peran S. sanguinis dan S. mutans pada Kejadian Karies Gigi
9 positif dan anaerob fakultatif (Kreth et al. 2008). S. mutans merupakan bakteri yang paling berkontribusi pada kejadian karies gigi karena kemampuannya menghasilkan asam yang dapat menurunkan pH rongga mulut dan menyebabkan demineralisasi gigi (Kreth et al. 2008; Liu et al. 2010). Sementara itu S. sanguinis
adalah bakteri indigenus rongga mulut, muncul bersama dengan tumbuhnya gigi dan merupakan komponen penting pada flora normal mulut manusia (Caufield et al. 2000). S. sanguinis merupakan bakteri pembentuk koloni awal (pioneer colonizer) yang dapat langsung menempel pada permukaan gigi, membentuk koloni, dan berperan sebagai tempat bertambatnya berbagai mikroorganisme mulut yang lain sehingga mampu berkolonisasi membentuk plak gigi (Xu et al. 2007).
Bakteri-bakteri pembentuk koloni awal seperti S. sanguinis dapat berperan mencegah berkembangbiaknya bakteri patogen S. mutans, sehingga tidak menyebabkan penyakit (Kreth et al. 2005). Peran S. sanguinis dalam mencegah invasi S. mutans sangat erat kaitannya dengan interaksi yang terjadi antara kedua bakteri tersebut. Interaksi antara S. sanguinis dan S. mutans dalam biofilm telah diteliti bersifat antagonistis (Kreth et al. 2008). Antagonisme di antara keduanya menguntungkan bagi host karena dapat berperan dalam penundaan kejadian karies gigi (Kreth et al. 2005; Kreth et al. 2008; Nobbs et al. 2009). Adapun mekanisme antagonisme S. sanguinis dengan S. mutans menurut Huang et al. (2011) dapat dilihat pada Gambar 2.
Gambar 2. Skema antagonisme S. mutans dengan S. sanguinis (Huang et al. 2011)
Berdasarkan Gambar 2 di atas, ketika S. sanguinis berada pada biofilm oral dalam jumlah besar, sebagai agen pengkoloni awal S. sanguinis dapat menekan jumlah S. mutans. Sebaliknya jika S. mutans sudah mendominasi biofilm, maka S. mutans akan menghambat kolonisasi S. sanguinis maupun S. gordonii (Huang et al. 2011). Dalam interaksi antagonistik tersebut, S. sanguinis
mampu menghasilkan zat antimikroba, yaitu hidrogen peroksida atau H2O2 untuk
menekan pertumbuhan S. mutans, sehingga jumlah S. mutans tetap rendah (Kreth
10
asam laktat yang dihasilkan dari hasil fermentasi karbohidrat. Produksi asam laktat ini dapat mengubah pH mulut menjadi asam, sehingga menyebabkan demineralisasi gigi dan menimbulkan karies gigi (Huang et al. 2011). S. mutans
sendiri tidak dapat menghasilkan H2O2 dan tidak memiliki enzim katalase untuk
memecah H2O2, sehingga adanya H2O2 yang disekresikan oleh S. sanguinis dalam
lingkungan biofilm dapat menyebabkan kematian bagi S. mutans (Zheng et al.
2011a).
Piruvat Oksidase (Spx)
Piruvat oksidase mempunyai fungsi metabolit mengkatalis pembentukan asetil-fosfat dari piruvat. Proses ini menghasilkan CO2 dan H2O2 (Zheng et al.
2011b). Piruvat oksidase atau Spx merupakan enzim yang berperan dalam sekresi hidrogen peroksida (H2O2) oleh S. sanguinis. Aktivitas enzim Spx S. sanguinis ini
dikodekan oleh gen spxB, yang diekspresikan oleh mRNA spxB (Zheng et al.
2011a; Zhu dan Kreth 2012). H2O2 merupakan satu-satunya zat antimikroba yang
dihasilkan oleh S. sanguinis untuk berkompetisi dengan kompetitornya (Zheng et al. 2011b). Produksi H2O2 berperan dalam mekanisme proteksi bakteri pembentuk
koloni awal, seperti pada S. sanguinis, untuk melawan invasi spesies kompetitornya pada tahap awal pembentukan biofilm (Zhu dan Kreth 2012). Produksi H2O2 mempunyai peran penting dalam interaksi kompetitif S. sanguinis
untuk menghambat pertumbuhan S. mutans (Zheng et al. 2011a; Zhu dan Kreth 2012). Efek bakterisidal H2O2 dialami oleh bakteri yang tidak dapat beradaptasi
dengan H2O2, yaitu bakteri yang tidak mempunyai aktivitas katalase yang dapat
memetabolisme H2O2 sehingga akan mengalami stress oksidatif (Zheng et al.
2011a).
Produksi H2O2 oleh S. sanguinis sangat dipengaruhi oleh keberadaan
oksigen di dalam lingkungan biofilm. Ekspresi spxB sangat jauh berkurang pada kondisi anaerobik (Zhu dan Kreth 2012). Faktor-faktor lingkungan seperti densitas sel, ketersediaan nutrisi, dan pH juga turut mempengaruhi produksi H2O2.
Pada lingkungan yang kaya nutrisi, produksi H2O2 terhenti dan energi yang
diperlukan untuk menghasilkan H2O2 digunakan untuk pertumbuhan sel (Kreth et
al. 2005). Sebaliknya jika nutrisi yang ada di lingkungan hanya sedikit atau jika pH lingkungan rendah, maka H2O2 akan diproduksi lagi dan kembali terjadi
kompetisi melawan S. mutans. Dengan demikian lingkungan mengatur kompetisi dan koeksistensi S. sanguinis dan S. mutans di dalam biofilm (Kreth et al. 2005).
S. mutans tidak memiliki gen spxB, sehingga S. mutans tidak dapat menghasilkan H2O2 (Zheng et al. 2011a). Dengan demikian deteksi mRNA spxB
S. sangunis dapat dilakukan dan dikuantifikasi secara spesifik dengan primer spesifik spxB menggunakan teknik Real-Time Polymerase Chain Reaction (Zheng
et al. 2011a).
Minyak atsiri sebagai komponen antimikroba
11 minyak atsiri juga banyak digunakan untuk keperluan pengobatan (Iscan et al. 2002). Minyak atsiri diketahui kaya akan kandungan komponen yang mempunyai cakupan aktivitas antimikroba yang luas sehingga dapat digunakan untuk pengobatan (Reichling et al. 2009). Dengan cakupan aktivitas antimikroba yang luas, selain digunakan untuk pengobatan minyak atsiri juga dapat digunakan sebagai bahan pengawet alami untuk produk-produk makanan (Iscan et al. 2002).
Minyak atsiri biasanya merupakan campuran dari berbagai macam komponen dengan beberapa macam gugus fungsional. Variasi ini menjadikan minyak atsiri bekerja pada beberapa target dalam mekanisme yang berbeda-beda (Reichling et al. 2009). Minyak atsiri merupakan kandidat yang potensial untuk mengobati penyakit infeksi yang ringan dan tidak kompleks (Razan et al. 2012). Penggunaan antibiotik sintetis maupun semi-sintetis banyak menimbulkan pro dan kontra selama 50 tahun terakhir, sehingga penelitian ke arah penemuan antimikroba alami sangat diperlukan (Iscan et al. 2002). Hal ini menjadikan penggunaan minyak atsiri sebagai zat antimikroba alami menjadi sangat penting.
Minyak atsiri dapat bermanfaat sebagai antibakteri dan antijamur (Agusta 2000). Komponen penyusun minyak atsiri sebagian besar merupakan volatil yang mudah menguap dan memiliki berat molekul kecil (Agusta 2000). Dengan berat molekul yang kecil ini memudahkan komponen volatil minyak atsiri untuk masuk ke dalam membran sel dan merusak struktur membran sehingga menyebabkan kematian sel. Komponen monoterpen seperti 1,8-cineole, menthol, dan menthone
bersifat hidrofobik atau lipofilik sehingga memudahkannya untuk masuk ke dalam membran sel, meningkatkan fluiditas dan permebilitas sitoplasma sel dan merusak struktur sel (Reichling et al. 2009).
Teknik Analisis Kuantitatif Real-Time Polymerase Chain Reaction
(Real-Time PCR)
Analisis kuantitatif menggunakan teknik real-time PCR merupakan salah satu teknik analisis yang sangat penting dalam bidang biologi molekuler saat ini.
Real-time PCR mempunyai prinsip kerja yang sama dengan PCR tradisional, yaitu penggandaan eksponesial molekul DNA menggunakan enzim DNA polymerase
dan primer spesifik (Santos et al. 2004). Perbedaan real-time PCR dengan PCR tradisional adalah real-time PCR dapat mendeteksi akumulasi amplikon selama reaksi berlangsung dikarenakan penggunaan dye yang dapat berpendar dan memberikan sinyal akumulasi amplikon. Pada teknik real-time PCR, data diukur pada fase eksponensial dari reaksi PCR (Labrenz et al. 2004).
Teknik real-time PCR merupakan metode yang akurat dan sangat sensitif untuk mengukur ekspresi gen (mRNA) dalam jumlah yang sangat rendah (Cury et al. 2007). Selain dapat digunakan untuk mengkuantifikasi RNA, teknik ini juga dapat digunakan untuk mengkuantifikasi DNA (Yoshida et al. 2003; Suzuki et al.
2005). Kelebihan teknik real-time PCR dalam mendeteksi dan mengkuantifikasi bakteri dibandingkan dengan metode kultur secara konvensional, yaitu sangat sensitif, spesifik, dan cepat (Yano et al. 2002; Hata et al. 2006).
12
mRNA maupun kuantifikasi bakteri menggunakan teknik real-time PCR ini dapat dilakukan dengan dua metode, yaitu metode absolut dan relatif (Livak dan Schmittgen 2001; Yoshida et al. 2003). Metode absolut digunakan untuk menentukan jumlah penggandaan sampel yang dimasukkan dengan cara membandingkan sinyal real-time PCR terhadap suatu kurva standar (Livak dan Schmittgen 2001). Pada metode kuantifikasi relatif, sinyal real-time PCR dari transkripsi target pada suatu kelompok perlakuan dikaitkan dengan transkripsi kelompok lain yang tidak diberikan perlakuan (Livak dan Schmittgen 2001). Penentuan tingkat ekspresi mRNA dan jumlah DNA pada penelitian ini dilakukan dengan metode kuantifikasi relatif karena dilakukan perbandingan sinyal transkripsi suatu kelompok sampel yang diberikan perlakuan dengan kelompok kontrol yang tidak diberikan perlakuan. Efek perlakuan ditentukan secara relatif melalui perhitungan besarnya kenaikan atau penurunan ekspresi dan jumlah DNA antara kelompok sampel perlakuan dibandingkan kelompok kontrol yang tidak diberikan perlakuan.
3
METODOLOGI PENELITIAN
Waktu dan tempat penelitian
Penelitian dilaksanakan pada bulan Juli 2012 sampai dengan Mei 2013 di Laboratorium Kimia Pangan dan Laboratorium Pengolahan Departemen ITP Fakultas Teknologi Pertanian IPB (Bogor) untuk pembuatan formula uji cajuputs candy, Laboratoriun Analisis Flavor Balai Besar Penelitian Padi Sukamandi (Subang) untuk analisis komponen volatil, serta Laboratorium Biologi Oral Fakultas Kedokteran Gigi Universitas Indonesia (Jakarta) untuk uji in vitro yang meliputi, uji penghambatan biofilm, kuantifikasi DNA bakteri, dan kuantifikasi mRNA spxB.
Bahan
Bahan-bahan yang digunakan terdiri dari bahan baku permen dan bahan untuk analisis (kimia dan mikrobiologi). Bahan-bahan yang digunakan untuk membuat permen adalah sukrosa, glukosa cair, isomalt dan acesulfame-K, air demineral, minyak kayu putih hasil distilasi tanaman M. leucadendron food grade
(produksi Pulau Buru Maluku), minyak peppermint food grade, serta perisa buah (honeydew flavor). Bahan kimia yang digunakan untuk analisis antara lain media
Brain Heart Infusion (BHI) agar, BHI cair, aquades, miliQ water, pelarut hexan (JT Baker), standar alkana C8-20, gas N2, gas CO2, kristal violet 1%, alkohol 70%
(teknis), etanol 95% (Merck), etanol absolut p.a. (Merck), phosphate buffer saline
atau PBS, Trizol reagent (Invitrogen), isopropanol (Merck), kloroform, SYBR green (Kapa Biosystems), Ultrapure distiled water (Invitrogen), serta primer real-time PCR (1st BASE Custom Oligos, Singapura). Untuk primer real-time PCR
13 Alat
Peralatan yang digunakan meliputi peralatan untuk membuat permen, peralatan untuk analisis kimia, dan analisis biologi (uji biofilm dan analisis real-time PCR). Peralatan untuk membuat permen antara lain, beaker glass, hotplate
(Cimarec, Thermolyne) dan cetakan permen dari bahan Teflon. Peralatan untuk analisis kimia komponen volatil antara lain, shaker, vial amber 10 ml (Agilent), dan GC-MS (Agilent Technologie4 7890A-5975c inert XLEI/CI, scan mass 33-550). Peralatan untuk uji biofilm antara lain shaker (B. Braun Biotech),
microplate 6 dan 96 sumur (Iwaki), bunsen, ose, tabung Eppendorf, vorteks, tabung mikroaerofilik, lemari inkubator (Memmert), lemari pendingin 20°C dan -80°C (GEA), dan microplate reader (Bio-Rad Benchmark). Peralatan untuk analisis real-time PCR antara lain, mesin PCR (Bio-Rad), sentrifus (Sorvall Heraeus), penangas air (Memmert), heat block, spektrofotometer (Ultraspec), dan mesin real-time PCR (Bio-Rad CFX96). Sedangkan peralatan pendukung yang digunakan antara lain timbangan analitik (Ohauss), gelas ukur, gelas piala, pipet Mohr (Iwaki), Erlenmeyer, autoklaf, mikropipet (Eppendorf, Rainin, dan Biorad), sendok, pipet tetes, sudip, kotak pendingin, dan botol semprot.
Tabel 1 Primer yang digunakan untuk analisis menggunakan real-time PCR
beserta urutan oligonukleotidanya
Nama Primer Urutan Oligonukleotida (5’-3’) Pustaka
Sm 16S rRNA forward CCTACGGGAGGCAGCAGTAG Shemesh et al. (2007) Sm 16S rRNA reverse CAACAGAGCTTTACGATCCGAAA Shemesh et al. (2007) Ss 16S rRNA forward CCGCCTAAGGTGGGATAGATGATTG Zheng et al. (2011a) Ss 16S rRNA reverse ACCTTCCGATACGGCTACCTTGTTAC Zheng et al. (2011a) Ss spxBforward AATTCGGCGGCTCAATCG Zheng et al. (2011a) Ss spxB reverse AAGGATAGCAAGGAATGGAGTG Zheng et al. (2011a) bakteri total forward TCCTACGGGAGGCAGCAGT Suzuki et al. (2005) bakteri total reverse GGACTACCAGGGTATCTAATCCTGTT Suzuki et al. (2005)
Metode
Penelitian ini dilakukan dalam dua tahap. Tahap pertama adalah pembuatan permen yang digunakan sebagai formula uji. Tahap kedua adalah tahapan analisis, meliputi analisis komponen volatil cajuputs candy (CCS dan CCNS) dan pengujian pengaruh formula uji secara in vitro. Uji in vitro dimulai dengan pembenihan dan persiapan bakteri S. sanguinis dan S. mutans, lalu dilanjutkan dengan uji penghambatan biofilm multispesies (S. sanguinis + S. mutans) dan analisis kuantifikasi DNA dan ekspresi mRNA dalam biofilm setelah pemberian formula uji. Biomassa biofilm yang terbentuk ditentukan dengan mengukur nilai absorbansinya yang dinyatakan sebagai nilai optical density (OD) menggunakan
14
Pembuatan Permen sebagai Formula Uji
Penelitian ini akan menguji dua jenis formulasi permen (candy), yaitu candy
sukrosa dan candy non-sukrosa. Formula uji candy sukrosa terdiri dari: 1) candy
sukrosa tanpa flavor dan 2) cajuputs candy sukrosa (CCS). Sedangkan formula
candy non-sukrosa terdiri dari: 1) candy non-sukrosa tanpa flavor dan 2) cajuputs candy non-sukrosa (CCNS). CCS dibuat berdasarkan prosedur yang dilakukan oleh Halimah (1997) dan untuk CCNS dibuat berdasarkan prosedur yang dilakukan oleh Christie (2012). Formula candy sukrosa dan candy non-sukrosa tanpa flavor dibuat dan digunakan masing sebagai kontrol positif masing-masing bagi CCS dan CCNS. Dengan demikian terdapat empat macam formula uji yang dibuat untuk keperluan uji in vitro, yaitu:
1) Candy sukrosa tanpa flavor 2) CCS
3) Candy non-sukrosa tanpa flavor 4) CCNS
Penjelasan ringkas mengenai tahap-tahap pembuatan CCS dan CCNS yang dilakukan adalah sebagai berikut: pertama-tama bahan-bahan untuk membuat permen CCS dan CCNS ditimbang atau ditakar sesuai formulasi masing-masing permen (rincian formulasi ada pada dosen pembimbing). CCS dibuat dengan mencampurkan sukrosa sebanyak a% (b/b) dengan air demineral sebanyak c% (v/b) dalam gelas piala kemudian dipanaskan di atas hot plate sambil diaduk-aduk. Setelah mencapai suhu 110ºC, glukosa sebanyak d% (b/b) dimasukkan dan diaduk rata. Pada saat mencapai suhu 140ºC, hot plate dimatikan dan adonan permen diturunkan dari hot plate. Ke dalam adonan permen tersebut ditambahkan minyak kayu putih sebanyak e% (v/v) dan peppermint f% (v/v), diaduk rata, dan permen segera dicetak. Candy sukrosa tanpa flavor dibuat dengan prosedur yang sama dengan CCS namun tanpa penambahan komponen flavor.
Permen CCNS dibuat dengan mencampurkan isomalt sebanyak g% (b/b) dengan air demineral sebanyak h% (v/b) di dalam gelas piala kemudian dipanaskan di atas hot plate sambil diaduk. Setelah tercapai suhu 150ºC, adonan permen diturunkan dari hot plate dan dibiarkan suhunya turun sampai 140ºC, kemudian dimasukkan acesulfame-K sebanyak i% (b/b) dan diaduk rata. Minyak kayu putih sebanyak j% (v/v), minyak peppermint sebanyak k% (v/v), dan perisa
honeydew sebanyak l% (v/v) dimasukkan dalam adonan, diaduk rata, lalu dicetak.
Candy non-sukrosa tanpa flavor dibuat dengan prosedur yang sama dengan CCNS namun tanpa penambahan komponen flavor.
Untuk keperluan uji in vitro, semua formula uji cajuputs candy dilarutkan menggunakan BHI cair steril (1:1). Media pertumbuhan (BHI cair) beserta bakteri saja disertakan dalam pengujian dan digunakan sebagai kontrol negatif, yaitu perlakuan yang menunjukkan tidak adanya pengaruh dari formula cajuputs candy.
Analisis Komponen Volatil
15 Sebanyak 5 mL pelarut heksana ditambahkan ke dalam 1 mL minyak kayu putih atau minyak peppermint untuk mengekstrak komponen volatilnya. Hasil pencampuran kemudian dikocok menggunakan shaker selama 3-4 jam, hingga terbentuk dua lapisan. Lapisan heksana yang berada pada bagian atas, dipipet dengan hati-hati dan dipindahkan ke dalam storage vial. Larutan heksana yang mengandung komponen volatil ini kemudian dipekatkan dengan cara dihembus gas N2 sampai volumenya berkurang hingga menjadi 1,0-1,5 mL.
Ekstraksi komponen volatil CCS dan CCNS dilakukan dengan cara menimbang 50 g permen, dimasukkan ke dalam Erlenmeyer, lalu ditambahkan 20 mL air akuades, 5 mL pelarut heksan (mutu GC-MS), dan 500 µL standar internal 1,4-diklorobenzena 1%. Campuran ini di-shaker selama 24 jam sampai terpisah membentuk dua lapisan. Lapisan heksana yang ada di bagian atas, dipipet dengan hati-hati, dipindahkan ke dalan storage vial. Larutan heksana ini kemudian dipekatkan dengan cara dihembus gas N2 hingga volumenya berkisar 1,0-1,5 mL.
Ekstrak volatil minyak kayu putih, minyak peppermint, CCS, dan CCNS lalu disuntikkan ke alat GC-MS. Standar alkana C8-C20 yang digunakan sebagai
standar eksternal juga disuntikkan dengan kondisi GC-MS sama dengan sampel. Kolom yang digunakan untuk analisis menggunakan GC-MS adalah kolom DB-5 (60 m × 0,25 mm × 0,25 µm) dan fase gerak gas helium. Kondisi analisis GC-MS dijalankan dengan suhu injektor 250°C, suhu detektor 280°C, volume injeksi 0,5 mL, model injeksi split (rasio 50:1 untuk cajuputs candy sukrosa, 5:1 untuk cajuputs candy non-sukrosa, dan 100:1 untuk minyak atsiri). Adapun program suhu kolom awal yaitu 60°C, ditahan lima menit lalu dinaikkan sampai 250°C dengan laju kenaikan 10°C/menit, kemudian ditahan selama dua menit. Program yang sama juga dilakukan untuk standar alkana C8-C20.
Nilai Linear Retention Indices (LRI) dan spektrum massa (MS) digunakan untuk mengidentifikasi komponen yang berhasil dipisahkan GC-MS. Nilai LRI dihitung berdasarkan waktu retensi standar alkana (C8-20) yang disuntikkan pada
GC-MS menggunakan kolom dan kondisi yang sama dengan sampel. Penentuan nilai LRI dilakukan dengan melihat waktu retensi suatu puncak (peak) yang terdeteksi pada kromatogram, kemudian dihitung nilainya dengan menggunakan rumus:
( tx– tn)
LRIx = --- × 100
(tn + 1 – tn)
Keterangan:
LRIx = nilai indeks retensi linier komponen x
tx = waktu retensi komponen x (menit)
tn = waktu retensi standar alkana, dengan n atom karbon yang muncul
sebelum komponen x (menit)
tn+1 = waktu retensi standar alkana, dengan n+1 atom karbon yang
muncul sesudah komponen x (menit)
16
Identifikasi suatu komponen volatil dilakukan dengan membandingkan nilai LRI hasil perhitungannya dengan nilai LRI yang terdapat pada pustaka dan juga membandingkan spektrum massa komponen dengan spektrum massa pada library
koleksi NIST (National Institute of Standard and Technology) dan spektrum massa pada pustaka yang menggunakan kolom GC-MS yang sama (Muchtaridi et al. 2004). Sedangkan penentuan konsentrasi tiap-tiap komponen yang teridentifikasi dilakukan dengan menghitung persentase luas area puncak (peak) suatu komponen terhadap luas area total komponen. Konsentrasi setiap komponen yang teridentifikasi dinyatakan sebagai % relatif. Perhitungan yang dilakukan adalah sebagai berikut:
luas area senyawa x
% relatif senyawa x = _____________________ × 100%
luas area senyawa total
Pembenihan dan Persiapan Bakteri Uji
Bakteri yang digunakan pada penelitian ini adalah S. sanguinis ATCC 10556, S. mutans XC (serotipe C). Bakteri dari stok kultur (-80°C) ditumbuhkan pada media BHI agar dalam tabung mikroaerofilik yang diberi campuran gas (CO2
10%, N2 80%, H2 10%) untuk memberikan suasana mikroaerofilik. Untuk
keperluan percobaan, maka bakteri ditumbuhkan dalam media BHI cair di inkubator pada suhu 37°C selama 24 jam. Medium BHI cair yang telah ditumbuhi oleh bakteri uji selanjutnya distandardisasi dengan cara diukur absorbansinya atau nilai Optical Density-nya (OD) menggunakan microplate reader. Untuk mendapatkan densitas bakteri sebesar 106 CFU/mL, nilai OD S. sanguinis ditera pada panjang gelombang 490 nm dengan nilai absorbansi sebesar 0,477. Sedangkan OD S. mutans yang mengindikasikan densitas sel sebesar 106 CFU/mL ditera pada panjang gelombang 450 nm dengan nilai absorbansi sebesar 0,061. Jika nilai absorbansi tiap strain bakteri kurang dari yang ditentukan, maka dilakukan pemekatan dengan cara disentrifus 12.000×g, diambil peletnya kemudian ditambahkan BHI cair steril, lalu ditera lagi OD-nya sampai sesuai. Jika setelah pemekatan absorbansinya lebih dari yang ditentukan untuk masing-masing strain, maka dilakukan pengenceran kembali dengan jumlah BHI cair steril yang ditambahkan dihitung terlebih dahulu dengan rumus:
V1 × M1 = V2 × M2
Keterangan:
V1 = volume awal mikroba uji
M1= konsentrasi mikroba uji yang diukur dengan microplate reader
V2 = volume yang dibutuhkan untuk melakukan percobaan
M2 = konsentrasi mikroba yang diharapkan (106 CFU/mL)
17 Uji Penghambatan Biofilm oleh Formula Uji
Uji penghambatan biofilm dilakukan berdasarkan prosedur yang dilakukan oleh Yamanaka et al. (2004) dengan modifikasi. Pertama-tama dilakukan penumbuhan biofilm multispesies (S. sanguinis + S. mutans) dalam microplate 96 sumur, yaitu 100 µL bakteri S. sanguinis (106 CFU/mL) diinokulasikan ke dalam
microplate 96 sumur, kemudian diinkubasikan dalam tabung anaerob dalam suasana mikroaerofilik (CO2 10%, N2 80%, H2 10%) pada suhu 37ºC. Dua jam
kemudian, ke dalam sumur yang telah berisi kultur S. sanguinis, ditambahkan kultur S. mutans sebanyak 100 µL (106 CFU/mL), sehingga total volume bakteri menjadi 200 µL dan diinkubasikan kembali selama semalam (16-18 jam) pada suhu 37°C. Selesai inkubasi, cairan BHI yang mengandung bakteri planktonik dibuang dan biofilm yang menempel di dasar sumur dibilas dua kali menggunakan 200 µL cairan PBS steril, sehingga hanya tertinggal biofilm saja. Kemudian ke dalam microplate yang sudah mengandung biofilm tersebut ditambahkan formula uji dalam BHI cair (1:1) sebanyak 200 µL. Sebagai kontrol negatif, digunakan media BHI steril sebagai pengganti formula uji. Microplate
selanjutnya diinkubasikan kembali dalam tabung mikroaerofilik yang diberi campuran gas (CO2 10%, N2 80%, H2 10%) selama semalam (16-18 jam) pada
suhu 37°C. Selesai inkubasi, cairan BHI dan larutan formula uji yang mengandung bakteri planktonik dibuang dan biofilm yang menempel di dasar sumur dibilas dua kali menggunakan 200 µL cairan PBS steril. Tahap selanjutnya, 200 µL kristal violet 1% ditambahkan ke dalam microplate. Setelah 15 menit, kristal violet dibuang dan dilakukan pencucian dengan PBS steril sebanyak dua kali, kemudian dikeringkan dengan cara melewatkan microplate di atas api bunsen. Setelah kering, ke dalam setiap sumur ditambahkan etanol (95%) sebanyak 200 µL untuk melepaskan kristal violet yang menempel pada biofilm. Selanjutnya dilakukan pengukuran nilai absorbansi (OD). Nilai OD ditera menggunakan microplate reader pada panjang gelombang 490 nm. Nilai OD adalah tingkat kemampuan gelombang cahaya untuk menembus suatu larutan atau suspensi. Nilai OD mencerminkan jumlah sel yang menyerap kristal violet. Persentase penghambatan dihitung dengan rumus :
(OD kontrol– OD sampel)
% penghambatan = ________________________ × 100% OD kontrol
Penumbuhan Biofilm, Ekstraksi RNA, dan Sintesis cDNA