EVALUASI KEEFEKTIFAN PENGHAMBATAN BEBERAPA
AGENS BIOKONTROL TERHADAP PERTUMBUHAN
Marasmius palmivorus Sharples
SWINDA KRISTINA SITOMPUL
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
SWINDA KRISTINA SITOMPUL. Evaluasi Keefektifan Penghambatan Beberapa Agens Biokontrol terhadap Pertumbuhan Marasmius palmivorus
Sharples. Dibimbing oleh MEITY SURADJI SINAGA.
Marasmius palmivorus Sharples merupakan penyebab penyakit busuk tandan buah pada kelapa sawit. Telah dilakukan suatu kajian yang bertujuan untuk mengevaluasi keefektifan beberapa agens biokontrol dalam menghambat pertumbuhan M. palmivorus. Uji antagonisme secara in vitro antara agens biokontrol dengan M. palmivorus dilakukan dengan metode uji ganda (Trichoderma harzianum (TH17), Gliocladium fimbriatum (G84), Bacillus subtilis (B12), Pseudomonas fluorescens (P1), Aktinomiset APS5 dan APS12) dan peracunan media (menggunakan ekstrak metabolit APS5 dan APS12) pada agar kentang dekstrosa. Variabel yang diukur pada metode uji ganda maupun peracunan media adalah % penghambatan. Hasil penelitian menunjukkan metabolit aktinomiset (APS5 dan APS12) mampu 100% menghambat pertumbuhan M. palmivorus baik pada hari pertama bahkan hingga 6 hsi. Sedangkan, dengan metode uji ganda isolat APS5 dan APS12 tidak dapat menghambat pertumbuhan koloni patogen. Cendawan antagonis TH17 dan G84 efektif menghambat pertumbuhan M. palmivorus 100% pada 4 hsi. Kemampuan penghambatan TH17 dan G84 lebih tinggi secara nyata dibandingkan dengan isolat B12. Isolat B12 hanya mampu menghambat pertumbuhan patogen sebesar 36.88% pada 6 hsi. Sedangkan isolat P1 hingga 6 hsi tidak mampu menghambat pertumbuhan M. palmivorus (persen penghambatan -33.01%).
3
ABSTRACT
SWINDA KRISTINA SITOMPUL. Effectivines evaluation of Some Biocontrol Agents Inhibiting the growth of Marasmius palmivorus Sharples. Supervised by of MEITY SURADJI SINAGA.
Marasmius palmivorus Sharples is a cause of bunch rot disease on oil palm trees. A study has been conducted to evaluate the effectiveness of some biocontrol agents in inhibiting the growth of M. palmivorus. Antagonistict test between M. palmivorus and biocontrol agents was conducted by using dual culture method (Trichoderma harzianum (TH17), Gliocladium fimbriatum (G84), Bacillus subtilis (B12), Pseudomonas fluorescens (P1), actinomycetes APS5 and APS12) and poisoning test (using metabolit extract of APS5 and APS12) in potato dextrose agar. Variable measured for dual culture method and poisoning test was percentage of inhibition. The result showed actinomycetes (APS5 and APS12) metabolit could 100% inhibit the growth of M. palmivorus at 1 even up to 6 days after incubation periods. Meanwhile, by dual culture method, APS12 and APS5 isolates could not inhibit the growth of pathogenic colonies. Antagonistic fungus TH17 and G84 have effectively inhibited 100% M. palmivorus growth at 4 days after incubation. The inhibition ability of TH17 and G84 significantly higher than B12 isolate. B12 isolate was only able to inhibit 36.88% growth of pathogens at 6 days after incubation. P1 isolate was not able to inhibit M. palmivorus growth until 6 days after incubation (inhibition percentage -33.01%).
AGENS BIOKONTROL TERHADAP PERTUMBUHAN
Marasmius palmivorus Sharples
SWINDA KRISTINA SITOMPUL
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian
pada
Departemen Proteksi Tanaman
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
5
Judul Skripsi : Evaluasi Keefektifan Penghambatan Beberapa Agens Biokontrol terhadap Pertumbuhan Marasmius palmivorus
Sharples
Nama Mahasiswa : Swinda Kristina Sitompul NIM : A34080003
Disetujui oleh
Prof. Dr. Ir. Meity Suradji Sinaga, M.Sc Dosen Pembimbing
Diketahui oleh
Dr. Ir. Abdjad Asih Nawangsih, MSi. Ketua Departemen
PRAKATA
Puji dan syukur penulis panjatkan ke hadirat Tuhan Yang Maha Esa atas karunia-Nya sehingga penulis dapat menyelesaikan skripsi yang berjudul
“Evaluasi Keefektifan Penghambatan Beberapa Agens Biokontrol terhadap
Pertumbuhan Marasmius palmivorus Sharples”. Penelitian dan penulisan skripsi ini merupakan salah satu syarat untuk memperoleh gelar Sarjana Pertanian di Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor. Penelitian ini dilaksanakan di Laboratorium Mikologi, Departemen Proteksi Tanaman dari Juni sampai November 2012.
Ucapan terima kasih penulis sampaikan kepada:
1. Prof. Dr. Ir. Meity Suradji Sinaga, M.Sc. selaku dosen pembimbing yang telah memberikan bimbingan, arahan, saran, dan pengetahuan kepada penulis.
2. Dr. Ir. Teguh Santoso, DEA. selaku dosen penguji tamu yang telah memberikan saran dan masukan.
3. Dosen dan Staf pegawai Departemen Proteksi Tanaman yang telah mengajar dan memberikan ilmu pengetahuan yang sangat luas.
4. Keluarga tercinta yang telah memberikan doa dan motivasi kepada penulis. 5. Teman-teman komisi diaspora dan Departemen Proteksi Tanaman yang
telah memberikan motivasi dan dukungan yang sangat berharga.
6. Rekan kerja dan laboran di Laboratorium Mikologi yang telah berpartisipasi dalam penelitian ini.
7. Genksi Social Fund (GSF) yang telah membantu dalam penelitian ini baik berupa materi maupun motivasi.
Semoga hasil penelitian ini dapat bermanfaat meskipun masih terdapat kekurangan. Oleh karena itu, penulis mengharapkan kritik dan saran yang bersifat membangun untuk perbaikan skripsi ini.
Bogor, Februari 2013
7
DAFTAR ISI
DAFTAR TABEL vii
DAFTAR GAMBAR vii
DAFTAR LAMPIRAN vii
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 3
Manfaat Penelitian 3
BAHAN DAN METODE 4
Tempat dan Waktu Penelitian 4
Bahan 4
Metode 4
Isolasi Patogen dari Bahan Tanaman Sakit 4 Peremajaan Agens Antagonis 4 Uji Antagonisme secara In Vitro 5 Rancangan Percobaan dan Analisis Data 6
HASIL DAN PEMBAHASAN 7
Isolasi Cendawan Patogen 7 Uji Antagonisme secara In Vitro 8
SIMPULAN DAN SARAN 14
DAFTAR PUSTAKA 15
DAFTAR TABEL
1. Persentase penghambatan agens antogonis 9
DAFTAR GAMBAR
1. Gejala busuk tandan kelapa sawit, nampak miselium dan tubuh buah
M.palmivorus (A), gejala busuk tandan yang sudah kering (B) 8
2. Miselium M. palmivorus dibawah mikroskop dengan perbesaran 40 x
10 7
3. Uji antagonisme oleh aktinomiset dengan metode uji ganda, koloni patogen mampu tumbuh diatas koloni agens antagonis (a) APS5, dan
(b) APS 12 9
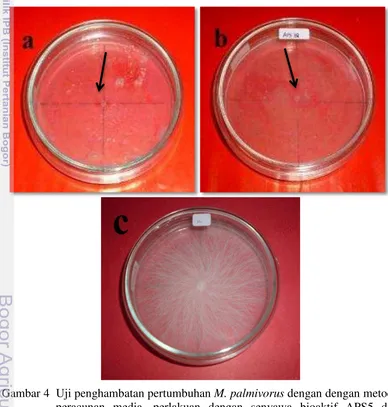
4. Uji penghambatan pertumbuhan M. palmivorus dengan dengan metode peracunan media, perlakuan dengan senyawa bioaktif APS5 dan APS12 tidak ada pertumbuhan koloni patogen (a dan b), pada perlakuan kontrol koloni patogen memenuhi cawan petri pada hari
ke-6 hsi (c) 10
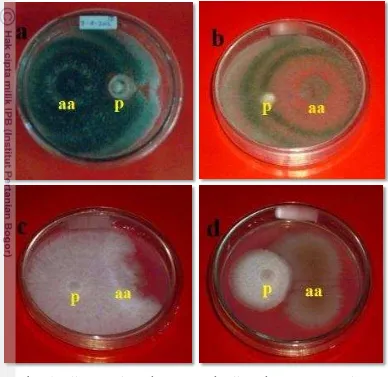
5. Uji antagonisme dengan metode uji ganda, agens antagonis mampu menekan pertumbuhan patogen M. palmivorus (a) TH17, (b) G84, (d) B12, dan (c) koloni patogen mampu tumbuh menutupi koloni P1 12
DAFTAR LAMPIRAN
1. Jari – jari pertumbuhan koloni patogen M. palmivorus dengan metode uji ganda pada media PDA 18 2. Rata – rata persen penghambatan pertumbuhan koloni M. palmivorus
oleh kandidat cendawan antagonis 19 3. Diameter pertumbuhan koloni patogen M. palmivorus pada perlakuan
kontrol 20
PENDAHULUAN
Latar Belakang
Kelapa sawit merupakan salah satu komoditas tanaman perkebunan yang sangat potensial di Indonesia. Kelapa sawit juga dapat menjadi komoditas strategis sebagai penghasil devisa negara dari sektor non migas sekaligus memberikan lapangan kerja yang lebih luas. Cerahnya prospek komoditas minyak kelapa sawit dalam perdagangan minyak nabati dunia telah mendorong pemerintah Indonesia untuk memacu pengembangan areal perkebunan kelapa sawit. Prospek perkembangan industri kelapa sawit masih sangat terbuka, hal ini nampak dari peningkatan areal kelapa sawit seiring meningkatnya kebutuhan masyarakat, ekspor, dan pemasukan devisa negara. Pada tahun 2011 diketahui bahwa, luas lahan perkebunan kelapa sawit di Indonesia mencapai 8.908.399 ha dengan jumlah produksi 22.508.011 ton (Direktorat Jendral Perkebunan 2011).
Perkembangan dan produktivitas kelapa sawit yang terus meningkat, perlu perhatian khusus terhadap faktor-faktor yang mempengaruhi pertumbuhan dan produktivitas kelapa sawit. Salah satu faktor yang dapat mempengaruhinya adalah penyakit tanaman. Penyebab penyakit pada tanaman kelapa sawit dapat menyerang pada tahap pembibitan, dilahan perkebunan baik pada tahap tanaman belum menghasilkan (TBM) maupun pada tahap tanaman menghasilkan (TM). Pada tahap tanaman menghasilkan terdapat beberapa penyakit yang dapat mempengaruhi hasil produksi buah. Menurut Turner (1981), beragam jenis cendawan dan bakteri penyebab penyakit yang berhasil diisolasi dari tandan buah yang sakit. Salah satu penyebab penyakit tandan buah pada kelapa sawit ialah cendawan Marasmius palmivorus Sharples. Marasmius palmivorus merupakan filum Basidiomycota, klas Basidiomycetes, ordo Agaricales dan famili Marasmiaceae (CABI 2007). Spesies Marasmius terjadi secara meluas, menyebabkan banyak penyakit pada jangkauan yang luas pada tanaman tropikal (Holliday 1980).
Penyakit busuk tandan terdapat di semua negara penghasil kelapa sawit dengan derajat kerugian yang berbeda-beda. Umumnya, serangan cendawan M. palmivorus sebenarnya tidak terlalu serius pada tanaman kelapa sawit, namun pada kondisi tertentu dapat menyebabkan kerugian ekonomi. Serangan berat cendawan ini menyebabkan hasil produksi buah menurun, sehingga dapat menyebabkan kerugian ekonomi. Penyakit ini tercatat pertama kali menyebabkan kerugian ekonomis hanya di Peninsular Malaysia, Sabah, dan Indonesia (Sharples 1925) dan tidak hanya terdapat pada perkebunan berumur 3-9 tahun yang baru mulai berbuah, namun terdapat pula pada tanaman tua. Serangan cendawan M. palmivorus hingga mencapai 34% pada tanaman tua. Hal ini diilaporkan terdapat pada kebun Bah Birong Ulu, Sumatera Utara dengan ketinggian sekitar 800 mdpl (Taniwiryono 2012).
buah menjadi coklat muda. Pembusukan ke dalam buah ini dapat meningkatkan kadar asam lemak bebas karena mengalami lipolisis yang disebabkan oleh enzim yang diproduksi patogen (Thompson 1931). Banyak laporan menyatakan pada periode musim hujan, dengan kondisi basah yang berkepanjangan sangat mendukung perkembangan penyakit busuk tandan.
Perkembangan miselium terjadi pada bagian dalam belakang tandan, dibagian bawah pelepah daun, dimana kondisi tersebut sangat lembab. Pada tahap perkembangan selanjutnya, miselium cendawan tumbuh menutupi permukaan buah dan menembus mesocarp sehingga menghasilkan penyakit busuk awal yang berwarna coklat cerah yang dengan jelas berasal dari jaringan yang sehat. Buah yang terinfeksi yang masih tertinggal di tandan pada akhirnya akan kering, meninggalkan hanya jaringan berserat dari mesocarp. Pada awalnya buah diserang oleh M. palmivorus diikuti oleh serangan sekunder oleh mikroorganisme lain.
Patogen M. palmivorus merupakan cendawan saprofit yang hidup pada bermacam-macam bahan organik atau sisa-sisa tanaman. Perkembangan cendawan saprofit menjadi parasit bergantung pada keadaan lingkungan yang mendukung pertumbuhan dan perkembangannya. Faktor lingkungan yang mempengaruhi pertumbuhan dan perkembangan cendawan M. pamivorus yaitu kelembaban, penyerbukan yang tidak sempurna, pemangkasan, dan curah hujan. Kelembaban yang lebih tinggi di perkebunan dapat terjadi karena faktor cuaca, jarak tanam yang terlalu rapat. Jarak tanam yang terlalu rapat menyebabkan kelapa sawit menjadi tegak sehingga kelembaban diantara pelepah-pelepah daun (tempat terdapatnya tandan-tandan) menjadi lebih tinggi.
Penyebaran patogen melalui angin dan kelembaban sangat menentukan luasnya penyebaran penyakit. Sumber penyebarannya berasal dari beberapa tanaman inang lain diantaranya tanaman kelapa, nenas, pisang, dan karet. Penularan akan terjadi bila sumber infeksi kontak atau terbawa angin ke bagian tanaman yang sehat, terbawa serangga atau alat-alat pertanian yang dapat mengakibatkan penyebaran penyakit busuk tandan buah kelapa sawit (Domsch et al. 1980). Pengendalian penyakit busuk tandan sering dilakukan secara mekanis dan kimiawi. Pengendalian secara mekanis dilakukan dengan mengurangi kelembaban kebun, antara lain dengan menanam dengan jarak tanam yang sesuai. Pengendalian penyakit yang dilakukan dengan menggunakan fungisida kimia sintesis diketahui tidak bijaksana dan dapat menimbulkan dampak buruk bagi kesehatan, pencemaran lingkungan, dan gangguan keseimbangan ekologis. Pengurangan dampak negatif penggunaan fungisida kimia sintetik tersebut dapat dilakukan dengan berbagai cara, salah satunya ialah dengan aplikasi pengendalian hayati.
3
terhadap ruang dan atau nutrisi, menginduksi proses ketahanan tanaman, serta interaksi langsung dengan patogen.
Pemanfaatan agens biokontrol dalam pengendalian hayati telah terbukti efektif untuk mengendalikan pertumbuhan cendawan Ganoderma boninenses Pat. penyebab penyakit penting pada kelapa sawit yaitu penyakit busuk pangkal batang. Berbagai mikroba antagonis, seperti Trichoderma spp., Gliocladium sp.,
Pseudomonas kelompok fluorescens, dan fungi mikoriza arbuskular (FMA) (Sinaga et al. 2001, Siddiquee et al. 2009, Zainudin & Abdullah 2008). Cendawan
Trichoderma spp., Gliocladium sp. melakukan penghambatan dan mematikan G. boninenses melalui mekanisme hiperparasitisme, lisis, toksin, persaingan tumbuh dan memicu ketahanan tanaman (Sinaga et al. 2001). Sedangkan mekanisme penghambatan G. boninenses oleh Bacillus sp. tidak melalui hiperparasitisme melalui antibiosis dengan mengeluarkan antibiotik (Susanto 2002). Oleh karena itu, perlu dilakukan suatu kajian beberapa agens biokontrol yang diketahui efektif terhadap G. boninenses kemungkinan efektif mengendalikan penyebab busuk tandan.
Tujuan Penelitian
Penelitian ini bertujuan untuk mengevaluasi keefektifan agens biokontrol dalam menghambat pertumbuhan Marasmius palmivorus penyebab busuk tandan kelapa sawit.
Manfaat Penelitian
BAHAN DAN METODE
Waktu dan Tempat Penelitian
Penelitian dilaksanakan dari bulan Juni sampai bulan November 2012 di Laboratorium Mikologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor.
Bahan
Bahan-bahan yang digunakan pada penelitian ini adalah tandan tanaman kelapa sawit yang terserang Marasmius palmivorus, media YCED (Casamino Acids-yeast extract-glucose-agar), media NA (Nutrient Agar), media PDA (Potato Dextrose Agar), media LB (Luria Broth), isolat cendawan Marasmius sp., isolat Trichoderma harzianum (TH17), isolat Gliocladium fimbriatum (G84), isolat Bacillus subtilis (B12), isolat Pseudomonas fluorescens (P1), isolat aktinomiset (APS5 dan APS12).
Metode
Isolasi Patogen dari Bahan Tanaman Sakit
Sampel tandan atau buah yang menunjukkan gejala busuk tandan yang disebabkan oleh tpatogen M. palmivorus diperoleh dari perkebunan kelapa sawit di PTPN VIII Leuwiliang, Bogor. Sterilisasi permukaan dilakukan dengan mencuci buah yang terinfeksi, kemudian didisenfeksi menggunakan bahan aktif natrium hipoklorit (NaOCl) 1% selama satu menit, dibilas menggunakan air steril sebanyak tiga kali pembilasan, lalu dikeringanginkan. Isolasi patogen dilakukan dengan memotong diantara bagian buah yang bergejala dan yang sehat sepanjang 0.5 cm, kemudian ditanam pada media PDA. Isolasi patogen juga dilakukan dengan memotong bagian tubuh buah dari cendawan M. palmivorus secara melintang pada bagian tangkai tubuh buah, kemudian ditanam pada media PDA dan di inkubasi pada suhu ruang. Biakan Marasmius sp. yang diperoleh dari stok kultur koleksi Laboratorium Klinik Tanaman, Departemen Proteksi Tanaman, Institut Pertanian Bogor digunakan sebagai pembanding dengan isolat M. palmivorus yang diperoleh dari hasil isolasi tanaman kelapa sawit yang sakit di lapangan.
Peremajaan Agens Antagonis
5
ini dilakukan dengan menumbuhkan dalam media pada media PDA lalu diinkubasi suhu ruang.
Uji Antagonisme secara In Vitro
Penghambatan pertumbuhan M. palmivorus dilakukan dengan metode uji ganda dan metode peracunan media. Uji antagonisme dengan metode uji ganda menggunakan agens biokontrol TH17, G84, B12, P1, APS5 dan APS12. Koloni
M. palmivorus diinokulasikan pada media PDA dengan jarak 3 cm dari koloni agens biokontrol. Diameter masing-masing agens biokontrol (TH17 dan G84) dan patogen sebesar 0.5 cm, dengan tiap pengujian dilakukan lima kali ulangan. Penghambatan pertumbuhan M. palmivorus juga dilakukan dengan modifikasi uji ganda yang menggunakan agens antagonis APS5 dan APS12. Pengujian dilakukan dengan menggoreskan masing – masing APS5 dan APS12 pada media PDA dan mengelilingi koloni patogen yang ditumbuhkan di tengah media PDA
Jari-jari koloni patogen yang menjauhi koloni mikroba antagonis
2
Jari-jari koloni patogen yang mendekati koloni antagonis
Pengamatan pertumbuhan patogen dengan metode uji ganda dilakukan dengan mengukur jari-jari koloni patogen yang mendekati koloni biokontrol dan jari-jari koloni patogen yang menjauhi koloni biokontrol, serta menghitung persentase penghambatan pertumbuhan patogen oleh koloni agens antagonis. Pengaruh penghambatan agens antagonis terhadap pertumbuhan patogen menggunakan rumus persentase menurut Skidmore and Dickinson (1976):
Keterangan :
R1 : Jari-jari koloni patogen yang menjauhi koloni biokontrol R2 : Jari-jari koloni patogen yang mendekati koloni biokontrol PPh : Persentase penghambatan pertumbuhan
senyawa bioaktif yang steril. Senyawa bioaktif tersebut dicampurkan ke dalam
media PDA yang telah dicairkan dengan suhu kurang lebih 50˚C, kemudian
dimasukkan kedalam cawan petri. Koloni M. palmivorus yang berumur 7 hari diinokulasikan pada titik pusat cawan petri dengan diameter 0.5 cm, kemudian diinkubasi pada suhu ruang. Pengamatan dilakukan terhadap pertumbuhan miselium pada setiap perlakuan dengan menghitung persentase penghambatan M. palmivorus dengan persamaan :
Keterangan :
Dk = diameter koloni M. palmivorus pada kontrol Dp = diameter koloni M. palmivorus pada perlakuan
Rancangan Percobaan dan Analisis Data
Rancangan percobaan yang dilakukan pada uji antagonisme secara in vitro
adalah Rancangan Acak Lengkap (RAL). Masing-masing perlakuan dilakukan sebanyak 5 kali ulangan, sehingga terdapat 30 unit percobaan. Pengaruh interaksi antara kedua faktor diamati selama 6 hari setelah inokulasi. Data yang diperoleh dianalisis dengan Microsoft Office Excel 2007 dan dengan analisis sidik ragam menggunakan program Statistical Analysis System (SAS) versi 9.1.3. Perlakuan yang berpengaruh nyata diuji lanjut dengan uji Duncan dengan taraf α = 0,05
7
HASIL DAN PEMBAHASAN
Isolasi Cendawan Patogen
Perkebunan kelapa sawit PT Perkebunan Nusantara VIII Cikasungka, Cigudeg, Bogor, Jawa Barat, memiliki topografi bergelombang dengan ketinggian tempat 360 m dpl dan pH tanah berkisar 4.9-6.1. Tingginya serangan penyakit sangat dipengaruhi oleh faktor lingkungan yaitu suhu, kelembaban, curah hujan, penyerbukan yang tidak sempurna dan ketinggian tempat. Menurut Harahap et al.
(2000) kesesuaian lahan berdasarkan ketinggian tempat berhubungan langsung dengan suhu, udara, tanah, penyinaran matahari dan kelembaban. Suhu udara menurun dengan bertambahnya ketinggian tempat, sebaliknya kelembaban udara akan semakin tinggi. Kelembaban tinggi dalam kebun dapat terjadi karena cuaca, jarak tanam yang terlalu rapat, pemangkasan daun yang terlambat, dan sebagainya. Pada pengamatan di lahan perkebunan kelapa sawit terdapat banyak gulma yang tumbuh pada daerah piringan dan gawangan tanaman kelapa sawit. Hartley (1969) mengemukakan kebun yang banyak ditumbuhi oleh gulma yang terlalu rapat akan menghambat sirkulasi udara yang secara langsung akan meningkatkan kelembaban.
Gejala yang ditimbulkan akibat infeksi patogen ini yaitu busuk pada tandan yang ditandai dengan pertumbuhan miselium berwarna putih meluas di permukaan tandan (Gambar 1A). Pada infeksi stadium dini, cendawan ini tidak menyebabkan kerusakan yang merugikan. Infeksi berat yang terjadi pada permukaan tandan dapat menyebabkan buah sawit menjadi busuk pada bagian mesokarp. Buah yang busuk ditunjukkan oleh bagian buah yang terinfeksi berwarna coklat cerah yang jelas berbeda dari jaringan yang sehat (warna orange). Pembusukan ini sangat meningkatkan kadar asam lemak buah karena terjadinya penguraian lemak atau lipolisis, karena aktivitas enzim yang dihasilkan oleh M. palmivorus. Buah yang terinfeksi yang masih ada pada tandan akhirnya akan kering dan hanya meninggalkan jaringan berserat dari mesocarp (Gambar 1B) dan terdapat pula serangga atau mikroorganisme lain pada tandan.
Gambar 1 Gejala busuk tandan kelapa sawit, nampak miselium dan tubuh buah
Pengamatan secara makroskopis pada tanaman kelapa sawit menunjukkan bahwa cendawan M. palmivorus membentuk tubuh buah seperti payung dengan miselium berwarna putih seperti kipas yang meluas pada permukaan tandan. Tubuh buah cendawan ini berwarna putih, namun pada kondisi yang mendukung pertumbuhannya bagian bawah pileus berwarna kemerahan dan mengkerut pada cuaca kering. Ukuran stipe-nya sekitar 10 x 12 mm dan bagian pileus mencapai diameter 5-6 cm. Bagian pileus biasanya keras, tipis dan membetuk setengah lingkaran. Pada tanaman kelapa sawit yang menunjukkan gejala busuk tandan berhasil di isolasi patogen M. palmivorus. Patogen ini tidak membentuk tubuh buah pada media agar buatan, namun koloni tampak berwarna putih hingga putih kemerah-merahan. Cendawan M. palmivorus dibawah mikroskop mempunyai miselium yang bercabang tanpa septa (Gambar 2). Namun, pada tidak terlihat jelas clamp connection pada pengamatan dibawah mikroskop perbesaran 40x100. Cendawan M. palmivorus merupakan kelompok basidiomycetes yang tidak memproduksi spora aseksual (konidia) dan hanya memproduksi spora seksual (basidiospora). Inokulum patogen ini, spora dapat disebarkan melalui angin, terbawa serangga atau terbawa dalam sisa – sisa tanaman sakit dan alat – alat pertanian yang digunakan.
Gambar 2 Miselium M. palmivorus dibawah mikroskop dengan perbesaran 40 x 10
Uji Antagonisme secara In Vitro
9
Tabel 1 Persentase penghambatan agens antagonis.
No berbeda nyata berdasarkan uji selang berganda Duncan pada taraf nyata 5%. **
Metabolit aktinomiset (APS5 dan APS12). ***
Isolat aktinomiset (APS5 dan APS12).
Pada uji pendahuluan dilakukan metode uji ganda untuk mengevaluasi kemampuan penghambatan aktinomiset APS5 dan APS12 terhadap pertumbuhan koloni M. palmivorus. Berdasarkan pengamatan, persen penghambatan pertumbuhan M. palmivorus oleh isolat aktinomiset APS5 dan APS12 masing-masing sebesar -26.62% dan -22.42% pada 6 hsi. Hasil yang diperoleh tersebut dengan menyatakan bahwa koloni patogen masih mampu tumbuh menutupi koloni aktinomiset, sehingga tidak tampak proses penghambatan (Gambar 3a dan 3b). Hal ini terjadi karena, pertumbuhan aktinomiset pada permukaaan agar yang sangat lambat. Selanjutnya dilakukan modifikasi uji ganda yaitu dengan memberikan inokulum APS5 dan APS12 disekeliling M. palmivorus dengan penggoresan, nampak koloni patogen tidak tumbuh. Berdasarkan pengamatan, isolat APS5 dan APS12 menghasilkan metabolit yang toksin dan fungistatis bagi
M. palmivorus. Oleh karena itu, kemudian dilakukan uji penghambatan pertumbuhan koloni M. palmivorus oleh aktinomiset dilakukan dengan metode peracunan media menggunakan larutan metabolit yang diperoleh dari isolat APS5 dan APS12.
Hasil uji peracunan media dengan senyawa metabolit APS5 dan APS12 menunjukkan efek penghambatan yang paling tinggi (100%) dan yang paling cepat pada 1 hsi hingga 6 hsi, patogen tetap tidak dapat tumbuh sama sekali. Terbukti berdasarkan pengamatan pada kontrol, tampak jelas bahwa patogen dapat tumbuh membentuk koloni dan memenuhi cawan petri pada hari keenam (Gambar 3c). Sedangkan patogen yang diinokulasikan pada media PDA yang terdapat senyawa bioaktif baik APS5 atau pun APS12 tampak tidak ada pertumbuhan koloni patogen tersebut (Gambar 4a dan 4b). Aktinomiset APS5 dan APS12 memiliki senyawa metobolit yang sangat toksik bagi M. palmivorus. Hal ini diketahui dengan tidak tumbuhnnya koloni patogen pada media yang telah diberikan 1 ml : 9 ml PDA. Setelah pengamatan hari keenam setalah inokulasi koloni patogen dipindahkan pada media PDA baru, namun koloni patogen nampak tidak tumbuh. Hal ini diduga koloni patogen langsung mati saat berada pada media yang telah dicampur dengan senyawa metabolit APS5 dan APS12.
11
Aktinomiset termasuk kedalam golongan bakteri positif dan dapat menghasilkan struktur bertahan berupa spora. Koloni aktinomiset memiliki ciri khas berupa penampakan yang terlihat berdebu dalam media agar. Penampakan tersebut merupakan spora yang dihasilkan oleh hifa aerial yang hanya dimiliki oleh aktinomiset. Menurut Ainsworth (1971), aktivitas antimikroba disebabkan oleh senyawa antibiotik yang dihasilkan oleh aktinomiset, seperti amphotericin, cyclohexarnide, nystatin, dan streptomycin. Oskay et al. (2004) melaporkan bahwa aktinomiset merupakan mikroorganisme yang mampu mensintesis banyak metabolit sekunder seperti antibiotik, pestisida, antiseptik, selulase, dan xylanase. Todar (2008) juga mengemukakan bahwa aktinomiset mampu menghasilkan senyawa antibiotik seperti tertasiklin, streptomisin, eritromisin, kloramfenikol, ivermektin, dan rifampisin.
Kemampuan penghambatan agens biokontrol dengan metabolit APS5 dan APS12 terhadap pertumbuhan koloni M. palmivorus diduga karena adanya aktivitas antimikroba yang tinggi (toksin). Dugaan ini diperkuat karena, pada pengujian metode peracunan media yang diberikan adalah larutan senyawa bioaktif aktinomiset dan mekanisme penghambatan aktinomiset melalui metabolit toksik yang dihasilkan. Sedangkan isolat APS5 dan APS12 secara langsung tidak menghambat pertumbuhan koloni M. palmivorus. Berdasarkan informasi diatas menunjukkan bahwa metabolit APS5 dan APS12 memiliki kemampuan penghambatan pertumbuhan M. palmivorus yang sangat tinggi dan memberikan efek pengendalian yang menjanjikan.
Cendawan antagonis T. harzianum (TH17) dan G. fimbriatum (G84) memiliki kemampuan penghambatan pertumbuhan koloni M. palmivorus yang tidak berbeda nyata. Kemampuan penghambatan oleh kedua agens antagonis ini sangat tinggi pada 4 hsi yaitu 100%. Pada proses penghambatan pertumbuhan patogen, agens antagonis TH17 mampu menutupi cawan petri pada 4 hsi. Sedangkan, pada ada hari keenam pertumbuhan TH17 dan G84 menunjukkan over growth, sehingga menutupi petumbuhan koloni patogen dan tumbuh diatas koloni patogen (Gambar 4a dan 4b). Penghambatan terhadap pertumbuhan M. palmivorus oleh agens antagonis TH17 dan G84 disebabkan karena pertumbuhan koloninya lebih cepat dibanding cendawan patogen. Hal ini didukung oleh Djafaruddin (2000) menjelaskan bahwa faktor penting yang menentukan aktivitas mikroorganisme antagonis yang dapat mengendalikan patogen adalah memiliki kecepatan pertumbuhan yang tinggi sehingga mampu berkompetisi dengan patogen dalam hal makanan dan penguasaan ruang yang pada akhirnya dapat menekan pertumbuhan cendawan patogen.
Adanya penghambatan terhadap pertumbuhan diameter koloni M. palmivorus diduga karena adanya enzim dan senyawa yang terdapat pada agens antagonis T. harzianum yang mampu merusak dinding sel patogen. Hal tersebut menunjukkan adanya mekanisme penghambatan hiperparasitisme, antibiosis, lisis dan toksisitas, kompetisi ruang sebelum terjadi antagonis pada koloni patogen tampak adanya zona penghambatan seperti kompetisi ruang dan nutrisi oleh kandidat antagonis. Hal yang sama juga terjadi pada mekanisme penghambatan oleh agens antagonis G. fimbriatum. Menurut Lewis dan Papavizas (1984) selama
Trichoderma sp. tumbuh aktif menghasilkan sejumlah besar enzim yang dapat menglarutkan dinding sel patogen. Cendawan agens biokontrol T. harzianum
memproduksi metabolit seperti asam sitrat, etanol, dan berbagai enzim seperti urease, selulase, glukanase, dan kitinase. Enzim tersebut berguna untuk meningkatkan efisiensi aktivitas biokontrol terhadap patogen yang mengandung kitin dan hasil metabolit dipengaruhi kandungan nutrisi yang terdapat dalam media. Rosaline (2000) menyatakan Gliocladium sp. dapat berperan mengendalikan patogen tanaman karena mnghasilkan senyawa metabolit seperi gliotoksin, viridin dan paraquinon yang bersifat fungitoksik terhadap patogen.
Gambar 5 Uji antagonisme dengan metode uji ganda, agens antagonis mampu menekan pertumbuhan patogen M. palmivorus (a) TH17, (b) G84, (d) B12, dan (c) koloni patogen mampu tumbuh menutupi koloni P1
Hasil persen penghambatan terhadap pertumbuhan M. palmivorus oleh kandidat agens biokontrol B. subtilis (B12) sebesar 36.88% pada 6 hsi. Hal ini menunjukkan bahwa agens biokontrol B12 mememberikan efek penghambatan terhadap koloni patogen yang rendah. Mekanisme penghambatan yang dimiliki B. Subtilis yaitu mekanisme antibiosis. Hal tersebut nampak bahwa penghambatan B12 menimbulkan batas yang jelas (zona bening) dengan koloni M. palmivorus
13
SIMPULAN DAN SARAN
Evaluasi antagonisme metode uji ganda isolat aktinomiset APS5 dan APS12 tidak menunjukkan penghambatan terhadap pertumbuhan Marasmius palmivorus. Uji penghambatan pertumbuhan M. palmivorus dengan metode peracunan media, menunjukkan bahwa metabolit aktinomiset APS5 dan APS12 memiliki kemampuan persen penghambatan yang sangat tinggi pada 1-6 hsi. Cendawan antagonis T. harzianum (TH17) dan G. fimbriatum (G84) memiliki nilai persen penghambatan yang tinggi (100%) pada 4 hsi hingga 6 hsi. Sedangkan, kandidat
B. subtilis (B12) memiliki nilai persen penghambatan yang rendah yaitu sebesar 36.88% pada 6 hsi. Pada studi ini diketahui P. fluorescens (P1) tidak menunjukkan adanya proses penghambatan terhadap pertumbuhan koloni M. palmivorus. Mekanisme penghambatan aktinomiset terhadap M. palmivorus
15
DAFTAR PUSTAKA
[Ditjenbun] Direktorat Jenderal perkebunan. 2011. Statistik Perkebunan Indonesia
2011-2012 kelapa sawit. Jakarta (ID): Departemen Pertanian.
[CABI] Central for Agricultural and Bioscience International. 2007. Crop Protection Compendium [CD-ROM]. Wallingford (UK): CAB International.
Ainsworth GC. 1971. Ainsworth & Bisby’s Dictionary of the Fungi. Surrey:
Commonwealth Mycological Institute.
CAB International. 2007. Crop protection compendium. Wallingford (UK): CAB International [internet]. [diunduh 2012 Oktober 9]. Tersedia pada: www. cabicompendium.org/cpc.
Cook Rj, Baker KF. 1983. The Nature and practice of biological control of plant pathogen. The American Phytophatological Society.
Djafaruddin. 2000. Dasar – Dasar Pengendalian Penyakit Tanaman. Bumi Aksara: Jakarta.
Domsch KH, Gams W, Anderson TH. 1980. Compedium of Soil Fungi Vol 1. New York : Academic Press.
Harahap, I,Y., Winarna R.E.S, Sutarta. 2000. Produktivitas kelapa sawit tinjauan dari aspek tanah dan iklim dalam prosiding pertemuan kelapa sawit 200-I. Pusat penelitian kelapa sawit, Medan (ID) : hal 115.
Hartley, J.S. 1969. The Oil Palm. Longmans Green and Co Ltd. London 1:648. Holliday P. 1980. Fungus diseases of tropical crops. Cambridge (UK): Cambridge
University Press.View Abstract
Lewis JA. Papavizas GC. 1984. Production of Clamidospores and conidia by
Trichoderma spp. In Liquid and Solid. Growth Media. J. Soil Biology and Biochemistry, 15(4):351-357
Mattjik AA, Sumertajaya M. 2006. Perancangan Percobaan dengan Aplikasi SAS dan Minitab. Bogor (ID): Institut Pertanian Bogor Press.
Oskay MO, Tamer U, Azeri C. 2004. Antibacterial activity of some actinomycetes isolated from farming soils of Turkey. African Journal of Biotecnology. 3 (9): 441-446
Pahan I. 2006. Panduan Lengkap Kelapa Sawit. Jakarta: Penebar Swadaya.
Putra MC. 2011. Kompatibilitas Bacillus spp. dan aktinomiset sebagai agens potential Trichoderma harzianum for antagonistic properties against
Ganoderma boninense. Food, Agriculture, & Environment 7(3&4):970-976.
Sinaga MS, Susanto A, Tjahjono B, Soseno R. Sudharto. 2001. Kajian pengendalian hayati Ganoderma boninense Pat. penyebab penyakit busuk pangkal batang kelapa sawit [tesis]. Bogor (ID): Institut Pertanian Bogor. Sinaga MS. 2006. Dasar-dasar Ilmu Penyakit Tumbuhan. Depok (ID): Penebar
Skidmore AM. and Dickinson CH, 1976. Colony interactions and hyphal interference between Septoria nodorum and phylloplane fungi. Transactions of the British Mycological Society 66(1): 57-64.
Smith D, Onions AUS. 1994. The preservations and maintanance of living fungi. Oxon: Center For Agriculture and Bioscience International (CABI).
Susanto A. 2002. Kajian pengendalian hayati Ganoderma boninense Pat. Penyebab penyakit busuk pangkal batang kelapa sawit [disertasi]. Bogor (ID): Institut Pertanian Bogor.
Soesanto L. 2008. Pengantar Pengendalian Hayati Penyakit Tanaman. Jakarta (ID): PT Raja Grafindo Persada.
Taniwiryono. 2012. Mewaspadai hama dan penyakit di musim hujan : Sawit Indonesia [internet]. http://sawit-indonesia.com/index.php/hama-penyakit/ 111-mewaspadai-hama-dan-penyakit-di-musim-kemarau [19 Januari 2013] Todar K. 2008. Antimicrobial agents used in treatment of infection disease
[research report]. Madison (US): University of Wisconsin.
Turner PD. 1981. Oil Palm Diseases and Disorders. Kuala Lumpur: Oxford University Press.
Zainudin NAIM, Abdullah F. 2008. Disease suppression in Ganoderma infected oil palm seedlings treated with Trichoderma harzianum. Plant Protec Sci
17
19
Lampiran 1 Jari-jari pertumbuhan koloni patogen M. palmivorus dengan metode uji ganda pada media PDA (Lanjutan)
Kandidat Agens
Biokontrol Ulangan
Jari – jari Koloni M. palmivorus (cm)
Hari ke- 1 2 3 4 5 6
R1 R2 R1 R2 R1 R2 R1 R2 R1 R2 R1 R2 APS5
4 0.1 0.1 0.3 0.3 0.5 0.6 1.4 1.7 1.8 2.2 2.3 2.9 APS12 0.2 0.2 0.4 0.4 1.2 1.4 1.7 2 2.2 2.7 2.5 3.2
TH17
5
0.3 0.3 0.7 0.5 1.1 0.5 1.2 0 1.2 0 1.2 0 G84 0.3 0.3 0.6 0.5 0.8 0.6 0.9 0 0.9 0 0.9 0 B12 0.2 0.2 0.5 0.5 0.9 0.7 1.4 1.2 1.9 1.3 2.6 1.5 P1 0.3 0.3 0.5 0.6 0.9 1.1 1.3 1.7 1.9 2.5 2.8 3.7 APS5 0.1 0.1 0.4 0.4 0.7 0.8 1.6 1.9 2.1 2.5 2.6 3.3 APS12 0.2 0.2 0.5 0.5 1.6 1.7 2 2.3 2.4 2.8 3 3.5
Lampiran 2 Rata – rata persen penghambatan pertumbuhan koloni M. palmivorus oleh kandidat cendawan antagonis
Kandidat Agens Biokontrol Rata- rata persen Penghambatan Hari ke- (%)
1 2 3 4 5 6
TH17 0.00 30.00 54.39 100.00 100.00 100.00 G84 0.00 22.00 32.38 100.00 100.00 100.00 B12 0.00 0.00 13.80 18.97 27.74 36.89 P1 0.00 -11.33 -21.09 -27.38 -30.72 -32.96 Metabolit APS 5 100.00 100.00 100.00 100.00 100.00 100.00 Metaboli APS 12 100.00 100.00 100.00 100.00 100.00 100.00 Isolat APS5 0.00 0.00 -17.71 -20.95 -23.66 -26.45 Isolat APS12 0.00 0.00 -12.55 -18.18 -19.39 -22.42
Lampiran 3 Diameter pertumbuhan koloni patogen M. palmivorus pada perlakuan kontrol
Perlakuan Ulangan Diameter koloni M. palmivorus (cm)
Hari ke- 1 2 3 4 5 6
Kontrol
1 1 1.8 2.6 5.8 7 9 2 1.2 1.9 2.8 5.7 6.9 8.9 3 0.9 1.6 2.5 5.6 7 9 4 1 1.8 2.6 5.9 7.2 9 5 1 1.8 2.6 5.8 7 9
Lampiran 4 Isolat Agens Antagonis
Keterangan : APS5 (A), APS12 (B), Pseudomonas fluorescens (C), Bacillus subtilis (D), Gliocladium fimbriatum (E), Trichoderma harzianum
(F)
A B
C D
21
RIWAYAT HIDUP
Penulis lahir di Belawan pada tanggal 9 Februari 1991 sebagai anak pertama dari enam bersaudara dari pasangan Bapak Robert Sitompul dan Ibu Sorta Aritonang. Penulis menyelesaikan pendidikan sekolah dasar di SDN No.142907 Gonting Julu, Kecamatan Barumun tengah, Tapanuli Selatan, Sumatera Utara pada tahun 2002. Menyelesaikan pendidikan sekolah menengah pertama di SMP Swata Bintang Timur Rantau Prapat, Labuhan Batu Sumtera Utara pada tahun 2005. Penulis juga menyelesaikan sekolah menengah atas di SMAN 2 Rantau Utara, Labuhan Batu, Sumatera Utara pada tahun 2008.