UJI AKTIVITAS ANTIBAKTERI EKSTRAK ETANOL, FRAKSI n-HEKSANA DAN ETILASETAT DAUN SIDAGURI (Sida rhombifolia L.)
TERHADAP BEBERAPA BAKTERI
SKRIPSI
OLEH:
ASTRI WULANDARI NIM 071524004
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
UJI AKTIVITAS ANTIBAKTERI EKSTRAK ETANOL, FRAKSI n-HEKSANA DAN ETILASETAT DAUN SIDAGURI (Sida rhombifolia L.)
TERHADAP BEBERAPA BAKTERI
SKRIPSI
Diajukan untuk melengkapi salah satu syarat untuk mencapai Gelar Sarjana Farmasi pada Falkutas Farmasi
Universitas Sumatera Utara
OLEH:
ASTRI WULANDARI NIM 071524004
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
PENGESAHAN SKRIPSI
UJI AKTIVITAS ANTIBAKTERI EKSTRAK ETANOL, FRAKSI n-HEKSANA DAN ETILASETAT DAUN SIDAGURI (Sida rhombifolia L.)
TERHADAP BEBERAPA BAKTERI
OLEH:
ASTRI WULANDARI NIM 071524004
Dipertahankan di hadapan Panitia Penguji Fakultas Farmasi
Universitas Sumatera Utara Pada tanggal : 8 Desember 2010
Pembimbing I, Panitia Penguji,
(Dra. Saleha Salbi, M.Si., Apt.) (Dr. Ginda Haro, M.Sc., Apt.) NIP 194909061980032001 NIP 195108161980031002
Pembimbing II, (Dra. Saleha Salbi, M.Si., Apt.)
NIP 194909061980032001
(Dra. Masfria, MS., Apt.)
NIP 195707231986012001
(Dra. Aswita Hafni Lubis, M.Si., Apt.) NIP 195304031983032001
(Dra. Erly Sitompul, M.Si., Apt.) NIP 195304031983032001
Medan, Desember 2010 Fakultas Farmasi Universitas Sumatera Utara
Dekan,
KATA PENGANTAR
Puji syukur kehadirat Allah Subhana wata’ala yang telah memberi rahmat
dan karuniya-Nya, sehingga penulis dapat menyelesaikan penelitian dan penulisan
skripsi ini. Terimakasih dan rasa hormat yang besar kepada Ayahanda Rudiono
dan Ibunda Yani serta seluruh keluarga besar yang selalu mendukung, memberi
semangat dan do’a kepada penulis untuk menyelesaikan studi serta kesuksesan
penulis.
Penulis juga mengucapka terimakasih sebesar-besarnya kepada:
1. Ibu Dra. Saleha Salbi, M.Si., Apt dan Ibu Dra. Masfria, MS., Apt yang
telah membimbing penulis dengan penuh kesabaran dan tanggung jawab
selama penelitian hingga selesainya penyusunan skripsi ini.
2. Bapak Dekan dan para pembantu Dekan Fakultas Farmasi Universitas
Sumatera Utara, yang telah memberikan fasilitas kepada penulis sehingga
dapat menyelesaikan pendidikan.
3. Bapak Dr. Ginda Haro, M.Sc., Apt, Ibu Dra. Aswita Hafni Lubis, M.Si.,
Apt dan Ibu Erly Sitompul, M.Si., Apt selaku dosen penguji yang telah
memberikan masukan dalam penyusunan skripsi ini.
4. Bapak dan Ibu pengajar Fakultas Farmasi USU yang telah mendidik
penulis hingga menyelesaikan pendidikan.
5. Bapak kepala Laboratorium Farmakognosi beserta staf yang telah banyak
6. Teman-teman mahasiswa/i Falkutas Farmasi USU khususnya ekstensi
2007 yang telah memberikan bantuan dan dorongan kepada penulis selama
perkuliahan maupun pendidikan hingga selesainya pendidikan.
Semoga Allah subhana wata’ala melindungi dan melimpahkan rahmat dan
karunia-Nya kepada kita semua. Penulis berharap semoga skripsi ini menjadi
sumbangan yang berarti bagi ilmu pengetahuan khususnya dibidang Farmasi.
Medan, Desember 2010 Penulis
Uji Aktivitas Antibakteri Ekstrak Etanol, Fraksi n-Heksana dan Etilasetat Daun Sidaguri (Sida rhombifolia L.) Terhadap Beberapa Bakteri
Abstrak
Tumbuhan banyak digunakan untuk mengobati berbagai macam infeksi yang disebabkan oleh bakteri. Salah satu tumbuhan yang berkhasiat sebagai obat adalah daun sidaguri. Penelitian ini dilakukan untuk menguji aktivitas antibakteri dari daun sidaguri. Tahapan kerja meliputi pengumpulan sampel, pengolahan sampel, karakterisasi simplisia, skrining fitokimia, dan pembuatan ekstrak etanol daun sidaguri secara maserasi kemudian difraksinasi berturut-turut dengan pelarut n-heksana dan etilasetat. Selanjutnya ekstrak etanol, fraksi n-heksana dan etilasetat diuji aktivitas antibakteri terhadap beberapa bakteri dengan metode difusi agar menggunakan pencetak lubang (punch hole).
Hasil karakterisasi simplisia daun sidaguri yaitu hasil pemeriksaan makroskopik serbuk simplisia daun sidaguri berwarna hijau kecoklatan, tidak berbau, rasa agak kelat. Hasil pemeriksaan mikroskopik serbuk simplisia memperlihatkan adanya rambut penutup bentuk bintang, epidermis dengan stomata, sel parenkim berisi kristal kalsium oksalat, mesofil dengan kristal kalsium oksalat, dan serabut sklerenkim. Penetapan kadar air 7,32%, kadar sari larut dalam air 10,75%, kadar sari larut dalam etanol 5,26%, kadar abu total 6,99%, kadar abu yang tidak larut dalam asam 0,84%. Hasil skrining fitokimia serbuk simplisia daun sidaguri menunjukkan adanya senyawa flavonoida, alkaloida, tanin, saponin.
Hasil uji aktivitas antibakteri menunjukkan bahwa ekstrak etanol dapat menghambat pertumbuhan bakteri Staphylococcus aureus pada konsentrasi 80 mg/ml dengan diameter daerah hambat sebesar 14,88 mm, bakteri Escherichia coli pada konsentrasi 60 mg/ml dengan diameter daerah hambat sebesar 14,85 mm, dan bakteri Pseudomonas aeruginosa pada konsentrasi 70 mg/ml dengan diameter daerah hambat sebesar 15,65 mm. Sedangkan pada fraksi etilasetat dapat menghambat pertumbuhan bakteri Staphylococcus aureus pada konsentrasi 70 mg/ml dengan diameter daerah hambat sebesar 15,33 mm, bakteri Escherichia coli pada konsentrasi 80 mg/ml dengan diameter daerah hambat sebesar 14,84 mm, dan bakteri Pseudomonas aeruginosa pada konsentrasi 50 mg/ml dengan diameter daerah hambat sebesar 15,59 mm. Sedangkan fraksi n-heksana tidak memberikan efek antibakteri.
Antibacterial Activity Test of Extract Ethanol, and Fraction n-Hexane and Ethylacetate Leaves Sidaguri (Sida rhombifolia L.) Against Some Bacteria
Abstract
Plants are widely used to treat various infections caused by bacteria. One plant is efficacious as a medicine is leaf sidaguri. This research was conducted to test the antibacterial activity of leaf sidaguri. Stage work includes sample collection, sample processing, characterization of crude drug, phytochemical screening, and the manufacture of ethanol extract of leaves by maceration sidaguri then fractionated successively with the solvent n-hexane and ethylacetate. Furthermore, ethanol extract, fraction of n-hexane and ethylacetate tested antibacterial activity against some bacteria using agar diffusion method using the punchhole.
Results Characterization of crude leaf sidaguri is the result of macroscopic examination of crude drug powder sidaguri green leaves brown, odorless, taste slightly brown. Results Microscopic examination showed a crude drug powder cover star-shaped hair, epidermis with stomata, parenchyma cells contain calcium oxalate crystals, mesophyll with calcium oxalate crystals, and fibers sklerenkim. Determination of water content 7,32%, water soluble extract concentration 10,75%, levels of soluble extract in ethanol 5,26%, total ash 6,99%, ash insoluble in acid 0,84%. Phytochemical screening results indicate a compound leaf sidaguri flavonoida, alkaloids, tannins, saponins.
Test results showed that the antibacterial activity of ethanol extract can inhibit the growth of Staphylococcus aureus at a concentration of 80 mg/ml with inhibition zone diameter of 14,88 mm, Escherichia coli at a concentration of 60 mg/ml with inhibition zone diameter of 14,85 mm, and Pseudomonas aeruginosa at a concentration of 70 mg/ml with inhibition zone diameter of 15,65 mm. While in the ethylacetate fraction can inhibit the growth of Staphylococcus aureus at a concentration of 70 mg/ml with inhibition zone diameter of 15,33 mm, Escherichia coli at a concentration of 80 mg/ml with inhibition zone diameter of 14,84 mm, and Pseudomonas aeruginosa at a concentration of 50 mg/ml with inhibition zone diameter of 15,59 mm. While the fraction of n-hexane does not provide antibacterial effects.
DAFTAR ISI
Halaman
JUDUL ... i
HALAMAN PENGESAHAN ... ii
ABSTRAK ... iii
ABSTRACT ... iv
DAFTAR ISI ... v
DAFTAR TABEL ... ix
DAFTAR GAMBAR... x
DAFTAR LAMPIRAN ... xi
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 2
1.3 Hipotesis ... 3
1.4 Tujuan Penelitian... 3
1.5 Manfaat Penelitian ... 3
BAB II TINJAUAN PUSTAKA ... 4
BAB III METODOLOGI PENELITIAN ... 15
3.1 Alat - Alat ... 15
3.2 Bahan - Bahan ... 15
3.3 Pembuatan Larutan Pereaksi ... 16
3.3.1 Larutan Pereaksi Bouchardat ... 16
3.3.2 Larutan Pereaksi Mayer ... 16
3.3.4 Larutan Pereaksi Molish ... 17
3.3.5 Larutan Pereaksi Asam Klorida 2 N ... 17
3.3.6 Larutan Pereaksi Asam Sulfat 2 N ... 17
3.3.7 Larutan Pereaksi Natrium Hidroksida 2 N ... 17
3.3.8 Larutan Pereaksi Lieberman-Burchard ... 17
3.3.9 Larutan Pereaksi Besi (III) klorida 1% ... 17
3.3.10 Larutan Pereaksi Timbal (II) asetat 0,4 M ... 17
3.3.11 Larutan Pereaksi Kloralhidrat ... 18
3.4 Persiapan Sampel ... 18
3.4.1 Pengambilan Sampel Tumbuhan ... 18
3.4.2 Identifikasi Tumbuhan ... 18
3.4.3 Pengolahan Simplisia ... 18
3.5 Karakterisasi Simplisia ... 19
3.5.1 Pemeriksaan Makroskopik ... 19
3.5.2 Pemeriksaan Mikroskopik ... 19
3.5.3 Penetapan Kadar Air ... 19
3.5.4 Penetapan Kadar Sari Larut Dalam Air ... 20
3.5.5 Penetapan Kadar Sari Larut Dalam Etanol ... 20
3.5.6 Penetapan Kadar Abu Total ... 20
3.5.7 Penetapan Kadar Abu Yang Tidak Larut Dalam Asam ... 21
3.6 Uji Senyawa Kimia ... 21
3.6.1 Pemeriksaan Alkaloida ... 21
3.6.2 Pemeriksaan Glikosida... 22
3.6.4 Pemeriksaan Tanin... 22
3.6.5 Pemeriksaan Saponin ... 23
3.6.6 Pemeriksaan Antrakinon ... 23
3.6.7 Pemeriksaan Steroida/Triterpenoida ... 23
3.7 Pembuatan Ekstrak Daun Sidaguri (Sida rhombifolia .L.) ... 23
3.7.1 Pembuatan Ekstrak Etanol ... 23
3.7.2 Pembuatan Fraksi n-Heksana dan Fraksi Etilasetat ... 24
3.8 Sterilisasi Alat ... 24
3.9 Pembuatan Media ... 25
3.9.1 Pembuatan Media Nutrient Agar (NA) ... 25
3.9.2 Larutan NaCl 0,9% ... 25
3.9.3 Suspensi Standar Mc.Farland ... 25
3.10 Pembiakan Bakteri ... 26
3.10.1 Pembuatan Stok Kultur ... 26
3.10.1.1 Bakteri Staphylococcus aureus ... 26
3.10.1.2 Bakteri Escherichia coli ... 26
3.10.1.3 Bakteri Pseudomonas aeruginosa ... 26
3.10.2 Pembuatan Inokulum ... 26
3.10.2.1 Bakteri Staphylococcus aureus ... 26
3.10.2.2 Bakteri Escherichia coli ... 27
3.10.2.3 Bakteri Pseudomonas aeruginosa ... 27
3.11 Pembuatan Larutan Uji (Ekstrak Etanol, Fraksi n-Heksana dan Etilasetat ) Dengan Berbagai Konsentrasi ... 28
3.12 Pengujian Efek Antibakteri secara In vitro ... 28
BAB V KESIMPULAN DAN SARAN ... 34
5.1 Kesimpulan ... 34
5.2 Saran ... 35
DAFTAR PUSTAKA ... 36
DAFTAR TABEL
Halaman
Tabel 1. Hasil Pemeriksaan Karakterisasi Serbuk Simplisia Sidaguri (Sida rhombifolia .L.) ... 29
Tabel 2. Hasil Skrining Fitokimia Serbuk Simplisia, Ekstrak Etanol, Etilasetat, dan n-Heksana Daun Sidaguri ... 30 Tabel 3. Hasil Diameter Daerah Hambat Pertumbuhan Bakteri
Staphylococcus aureus, Escherichia coli dan Pseudomonas aeruginosa Pada Ekstrak Etanol dan Fraksi Etilasetat ... 31
Tabel 4. Hasil Diameter Daerah Hambatan Pertumbuhan Bakteri Staphylococcus aureus Pada Ekstrak Etanol, Fraksi Etilasetat, n-Heksana ... 49
Tabel 5. Hasil Diameter Daerah Hambatan Pertumbuhan Bakteri Escherichia coli Pada Ekstrak Etanol, Fraksi Etilasetat, n-Heksana... 50 Tabel 6. Hasil Diameter Daerah Hambatan Pertumbuhan Bakteri
DAFTAR GAMBAR
Halaman
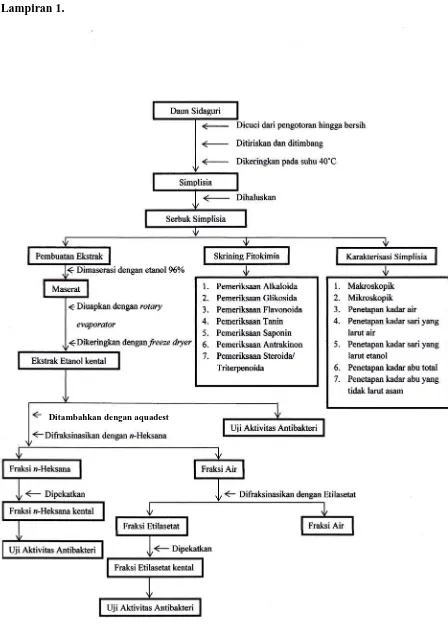
Gambar 1. Bagan Penelitian ... 37
Gambar 2. Hasil Identifikasi Tumbuhan ... 38
Gambar 3. Tumbuhan Sidaguri (Sida rhombifolia. L.) ... 39
Gambar 4. Daun Sidaguri Segar ... 40
Gambar 5. Simplisia Daun Sidaguri ... 40
Gambar 6. Serbuk Simplisia Daun Sidaguri ... 41
Gambar 7. Mikroskopik Serbuk Simplisia Daun Sidaguri (Sida rhombifolia. L.) ... 42
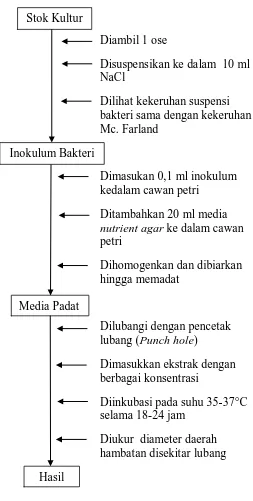
Gambar 8 . Bagan Pengujian Aktivitas Antibakteri ... 48
Gambar 9. Pengujian Aktivitas Antibakteri Ekstrak Etanol Daun Sidaguri Terhadap Bakteri Staphylococcus aureus ... 52
Gambar 10. Pengujian Aktivitas Antibakteri Ekstrak Etanol Daun Sidaguri Terhadap Bakteri Escherichia coli ... 52
Gambar 11. Pengujian Aktivitas Antibakteri Ekstrak Etanol Daun Sidaguri Terhadap Bakteri Pseudomonas aeruginosa ... 52
Gambar 12. Pengujian Aktivitas Antibakteri Ekstrak Etilasetat Daun Sidaguri Terhadap Bakteri Staphylococcus aureus ... 53
Gambar 13. Pengujian Aktivitas Antibakteri Ekstrak Etilasetat Daun Sidaguri Terhadap Bakteri Escherichia coli ... 53
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Bagan Penelitian ... 37
Lampiran 2. Hasil Identifikasi Tumbuhan ... 38
Lampiran 3. Tumbuhan Sidaguri (Sida rhombifolia .L.) ... 39
Lampiran 4. Gambar Simplisia Daun Sidaguri ... 40
Lampiran 5. Serbuk Simplisia Daun Sidaguri ... 41
Lampiran 6. Gambar Mikroskopik Serbuk Simplisia Daun Sidaguri ... 42
Lampiran 7. Perhitungan Karakterisasi Simplisia Daun Sidaguri ... 43
Lampiran 8. Bagan Pengujian Aktivitas Antibakteri ... 48
Lampiran 9. Hasil Diameter Daerah Hambatan Pertumbuhan Bakteri Staphylococcus aureus Pada Ekstrak Etanol, Fraksi Etilasetat, n-Heksana, dan Air ... 49
Lampiran 10. Hasil Diameter Daerah Hambatan Pertumbuhan Bakteri Escherichia coli Pada Ekstrak Etanol, Fraksi Etilasetat, n-Heksana, dan Air ... 50
Lampiran 11. Hasil Diameter Daerah Hambatan Pertumbuhan Bakteri Pseudomonas aeruginosa Pada Ekstrak Etanol, Fraksi Etilasetat, n-Heksana, dan Air ... 51
Lampiran 12. Gambar Pengujian Aktivitas Antibakteri Ekstrak Etanol Daun Sidaguri Terhadap Pertumbuhan Bakteri Staphylococcus aureus, Escherichia coli dan Pseudomonas aeruginosa ... 52
Uji Aktivitas Antibakteri Ekstrak Etanol, Fraksi n-Heksana dan Etilasetat Daun Sidaguri (Sida rhombifolia L.) Terhadap Beberapa Bakteri
Abstrak
Tumbuhan banyak digunakan untuk mengobati berbagai macam infeksi yang disebabkan oleh bakteri. Salah satu tumbuhan yang berkhasiat sebagai obat adalah daun sidaguri. Penelitian ini dilakukan untuk menguji aktivitas antibakteri dari daun sidaguri. Tahapan kerja meliputi pengumpulan sampel, pengolahan sampel, karakterisasi simplisia, skrining fitokimia, dan pembuatan ekstrak etanol daun sidaguri secara maserasi kemudian difraksinasi berturut-turut dengan pelarut n-heksana dan etilasetat. Selanjutnya ekstrak etanol, fraksi n-heksana dan etilasetat diuji aktivitas antibakteri terhadap beberapa bakteri dengan metode difusi agar menggunakan pencetak lubang (punch hole).
Hasil karakterisasi simplisia daun sidaguri yaitu hasil pemeriksaan makroskopik serbuk simplisia daun sidaguri berwarna hijau kecoklatan, tidak berbau, rasa agak kelat. Hasil pemeriksaan mikroskopik serbuk simplisia memperlihatkan adanya rambut penutup bentuk bintang, epidermis dengan stomata, sel parenkim berisi kristal kalsium oksalat, mesofil dengan kristal kalsium oksalat, dan serabut sklerenkim. Penetapan kadar air 7,32%, kadar sari larut dalam air 10,75%, kadar sari larut dalam etanol 5,26%, kadar abu total 6,99%, kadar abu yang tidak larut dalam asam 0,84%. Hasil skrining fitokimia serbuk simplisia daun sidaguri menunjukkan adanya senyawa flavonoida, alkaloida, tanin, saponin.
Hasil uji aktivitas antibakteri menunjukkan bahwa ekstrak etanol dapat menghambat pertumbuhan bakteri Staphylococcus aureus pada konsentrasi 80 mg/ml dengan diameter daerah hambat sebesar 14,88 mm, bakteri Escherichia coli pada konsentrasi 60 mg/ml dengan diameter daerah hambat sebesar 14,85 mm, dan bakteri Pseudomonas aeruginosa pada konsentrasi 70 mg/ml dengan diameter daerah hambat sebesar 15,65 mm. Sedangkan pada fraksi etilasetat dapat menghambat pertumbuhan bakteri Staphylococcus aureus pada konsentrasi 70 mg/ml dengan diameter daerah hambat sebesar 15,33 mm, bakteri Escherichia coli pada konsentrasi 80 mg/ml dengan diameter daerah hambat sebesar 14,84 mm, dan bakteri Pseudomonas aeruginosa pada konsentrasi 50 mg/ml dengan diameter daerah hambat sebesar 15,59 mm. Sedangkan fraksi n-heksana tidak memberikan efek antibakteri.
Antibacterial Activity Test of Extract Ethanol, and Fraction n-Hexane and Ethylacetate Leaves Sidaguri (Sida rhombifolia L.) Against Some Bacteria
Abstract
Plants are widely used to treat various infections caused by bacteria. One plant is efficacious as a medicine is leaf sidaguri. This research was conducted to test the antibacterial activity of leaf sidaguri. Stage work includes sample collection, sample processing, characterization of crude drug, phytochemical screening, and the manufacture of ethanol extract of leaves by maceration sidaguri then fractionated successively with the solvent n-hexane and ethylacetate. Furthermore, ethanol extract, fraction of n-hexane and ethylacetate tested antibacterial activity against some bacteria using agar diffusion method using the punchhole.
Results Characterization of crude leaf sidaguri is the result of macroscopic examination of crude drug powder sidaguri green leaves brown, odorless, taste slightly brown. Results Microscopic examination showed a crude drug powder cover star-shaped hair, epidermis with stomata, parenchyma cells contain calcium oxalate crystals, mesophyll with calcium oxalate crystals, and fibers sklerenkim. Determination of water content 7,32%, water soluble extract concentration 10,75%, levels of soluble extract in ethanol 5,26%, total ash 6,99%, ash insoluble in acid 0,84%. Phytochemical screening results indicate a compound leaf sidaguri flavonoida, alkaloids, tannins, saponins.
Test results showed that the antibacterial activity of ethanol extract can inhibit the growth of Staphylococcus aureus at a concentration of 80 mg/ml with inhibition zone diameter of 14,88 mm, Escherichia coli at a concentration of 60 mg/ml with inhibition zone diameter of 14,85 mm, and Pseudomonas aeruginosa at a concentration of 70 mg/ml with inhibition zone diameter of 15,65 mm. While in the ethylacetate fraction can inhibit the growth of Staphylococcus aureus at a concentration of 70 mg/ml with inhibition zone diameter of 15,33 mm, Escherichia coli at a concentration of 80 mg/ml with inhibition zone diameter of 14,84 mm, and Pseudomonas aeruginosa at a concentration of 50 mg/ml with inhibition zone diameter of 15,59 mm. While the fraction of n-hexane does not provide antibacterial effects.
BAB I PENDAHULUAN
1.1Latar Belakang
Masyarakat Indonesia sudah mengenal dan menggunakan tumbuhan untuk
mengobati berbagai macam infeksi yang disebabkan oleh bakteri. Tumbuhan yang
digunakan sebagai obat mudah didapat di sekitar pekarangan rumah. Kelebihan
dari pengobatan dengan menggunakan ramuan tumbuhan secara tradisonal tidak
ada efek samping yang ditimbulkan seperti yang terjadi pada pengobatan kimia.
Cukup banyak jenis tumbuhan yang dapat dimanfaatkan sebagai tumbuhan obat,
salah satu tumbuhan yang berkhasiat sebagai obat adalah Sida rhombifolia L.
dengan nama daerah sidaguri (Thomas, 1992).
Tumbuhan sidaguri tersebar didaerah tropis, dari dataran rendah sampai
1450 meter di atas permukaan laut. Tumbuhan ini termasuk tumbuhan perdu yang
dapat ditemukan di tepi jalan, pekarangan rumah, hutan, ladang, dan
tempat-tempat yang sedikit terlindung dari cahaya matahari. Sidaguri sudah lama dikenal
masyarakat untuk menyembuhkan penyakit seperti asma, sakit gigi, reumatik,
sakit perut yang digunakan adalah akar dan semua bagian tumbuhan sidaguri.
Sedangkan daun sidaguri berkhasiat sebagai obat bisul, gatal pada kulit, obat
borok, obat kudis, obat cacing, disentri, diare (Endjo D, 2004).
Dalam penelitian tumbuhan, satu atau lebih senyawa yang bermanfaat
dalam pengobatan mempunyai respon aktivitas. Maka harus dilakukan skrining
fitokimia dan karakterisasi. Karakterisasi dilakukan untuk memenuhi persyaratan
mutu yang telah ditetapkan dari materia medika indonesia, sedangkan skrining
senyawa kimia dalam suatu tumbuhan (Farnsworth, 1966). Berdasarkan literatur
diketahui bahwa daun sidaguri mengandung tanin, flavonoida, alkaloida, saponin
(Depkes RI, 2001). Senyawa fenol seperti flavonoid, tanin memiliki aktivitas
sebagai antibakteri (Robinson, 1995).
Beberapa jenis penyakit yang menyerang tubuh manusia dapat disebabkan
oleh bakteri diantaranya adalah bakteri Staphylococcus aureus, Escherichia coli
dan Pseudomonas aeruginosa. Bakteri Staphylococcus aureus merupakan bakteri
gram positif yang banyak terdapat pada kulit terutama infeksi pada kulit yang
dapat menyebabkan terjadinya bisul. Bakteri Pseudomonas aeruginosa
merupakan bakteri gram negatif yang menyebabkan infeksi pada luka sehingga
menimbulkan nanah (Jawetz, 2001). Bakteri Escherichia coli merupakan bakteri
gram negatif sebagai indikator pencemaran air. Bila air minum yang sudah
tercemar oleh bakteri ini dikonsumsi, maka dapat menyebabkan diare (Lay, 1992).
Berdasarkan hal tersebut, peneliti menguji aktivitas antibakteri ekstrak
etanol, fraksi n-heksana dan etilasetat daun sidaguri terhadap bakteri
Staphylococcus aureus, Escherichia coli dan Pseudomonas aeruginosa dengan
metode difusi agar menggunakan pencetak lubang (punch hole). Untuk tujuan ini
maka pada penelitian dilakukan karakterisasi simplisia, skrining fitokimia, dan
pembuatan ekstrak etanol daun sidaguri secara maserasi kemudian difraksinasi
berturut-turut dengan pelarut n-heksana dan etilasetat.
1.2Perumusan Masalah
1. Apakah ekstrak etanol, fraksi n-heksana dan etilasetat daun sidaguri
memiliki aktivitas antibakteri terhadap bakteri Staphylococcus aureus,
2. Apakah ekstrak etanol, fraksi n-heksana dan etilasetat daun sidaguri
memberikan aktivitas atibakteri yang berbeda terhadap masing-masing
bakteri Staphylococcus aureus, Escherichia coli dan Pseudomonas
aeruginosa ?
1.3Hipotesis
1. Ekstrak etanol, fraksi n-heksana dan etilasetat daun sidaguri memiliki
aktivitas antibakteri terhadap bakteri Staphylococcus aureus, Escherichia
coli dan Pseudomonas aeruginosa.
2. Ekstrak etanol, fraksi n-heksana dan etilasetat daun sidaguri memberikan
aktivitas yang berbeda terhadap masing-masing bakteri Staphylococcus
aureus, Escherichia coli dan Pseudomonas aeruginosa.
1.4Tujuan Penelitian
1. Untuk mengetahui adanya aktivitas antibakteri dari ekstrak etanol, fraksi
n-heksana dan etilasetat daun sidaguri terhadap bakteri Staphylococcus
aureus, Escherichia coli dan Pseudomonas aeruginosa.
2. Untuk mengetahui perbedaan aktivitas antibakteri dari ekstrak etanol,
fraksi n-heksana dan etilasetat daun sidaguri terhadap masing-masing
bakteri Staphylococcus aureus, Escherichia coli dan Pseudomonas
aeruginosa.
1.5Manfaat Penelitian
Hasil penelitian ini diharapkan dapat memberikan informasi tentang efek
antibakteri dari ekstrak etanol, fraksi n-heksana dan etilasetat daun sidaguri
BAB II
TINJAUAN PUSTAKA
Morfologi Tumbuhan
Tumbuhan Sida rhombifolia .L. merupakan tumbuhan dikotil berakar
tunggang. Tumbuhan ini termasuk tumbuhan perdu, tegak, bercabang, tinggi
dapat mencapai 2 meter. Daun berbentuk bulat memanjang atau belah ketupat,
tangkai daun pendek, helai daun dengan tepi bergerigi, ujung runcing, tulang daun
menyirip, kadang-kadang sisi bawah berambut abu-abu rapat. Bunga tunggal
berwarna kuning cerah yang keluar dari ketiak daun dengan penampang bergaris
tengah 2 atau 2,5cm. Bakal buah beruang 8-10, pada kulit buah terdapat semacam
jarum panjang dan tegak (Sastroamidjojo, 1967).
Sistematika Tumbuhan
Kingdom : Plantae
Divisi : Spermatophyta
Sub divisi : Angiospermae
Kelas : Dicotyledonae
Bangsa : Malvales
Suku : Malvaceae
Marga : Sida
Kandungan Kimia
Daun dan akar Sida rhombifolia mengandung saponin, di samping itu
daunnya mengandung alkaloida dan tanin. Sedangkan akarnya mengandung
flavonoida dan polifenol (Depkes RI, 2001).
Khasiat
Daun Sida rhombifolia berkhasiat sebagai obat bisul, obat gatal pada kulit,
obat borok, obat kudis, obat cacing, disentri, diare (Depkes RI, 2001) . Sedangkan
akarnya berkhasiat untuk menyembuhkan penyakit seperti asma, sakit gigi,
reumatik (Endjo D, 2004).
Metode Ekstraksi
Ekstrak adalah kegiatan penarik kandungan kimia yang dapat larut
sehingga terpisah dari bahan yang tidak dapat larut dengan pelarut cair (Depkes
RI, 2000).
Ekstraksi dengan menggunakan pelarut dapat dilakukan dengan beberapa
cara (Depkes RI,2000) yaitu :
Cara dingin a. Maserasi
Maserasi adalah proses pengekstrakan simplisia dengan menggunakan
pelarut dengan beberapa kali pengadukan pada temperature ruangan (Depkes RI,
2000).
b. Perkolasi
Perkolasi adalah ekstraksi dengan pelarut sampai sempurna (exhaustive
extraction) yang umumnya dilakukan pada temperatur ruangan. Proses terdiri dari
tahapan pengembangan bahan, tahap maserasi antara, tahap perkolasi sebenarnya
Cara Panas a. Refluks
Refluks adalah ekstraksi dengan pelarut pada temperatur titik didihnya,
selama waktu tertentu dan jumlah pelarut yang ralatif konstan dengan adanya
pendingin balik (Depkes RI, 2000).
b. Soxhlet
Soxhlet adalah ekstraksi menggunakan pelarut yang umumnya dilakukan
dengan alat khusus sehingga terjadi ekstraksi kontinu dengan jumlah pelarut
relatif konstan dengan adanya pendingin balik (Depkes RI, 2000).
c. Infus
Infus adalah sediaan cair yang dibuat dengan menyari simplisia nabati
dengan air pada suhu 90°C selama 15 menit (depkes RI, 2000).
Uji Efek Antibakteri
Pengujian aktivitas antibakteri dapat dilakukan dengan dua cara yaitu
metode difusi agar dan turbidimetri (Pratiwi, 2008).
Cara Difusi
Sebagai pencadang dapat digunakan cakram kertas, silinder gelas,
porselen, logam dan pencetak lubang ( Punch Hole ).
a Cara tuang
Media agar yang telah diinokulasikan dengan suspensi bakteri uji
dituangkan ke dalam cawan petri, dan dibiarkan memadat. Ke dalam cakram yang
digunakan di teteskan zat antibakteri, kemudian diinkubasikan pada suhu 37°C
selama 18 – 24 jam. Daerah bening yang terdapat di sekeliling cakram kertas atau
b Cara sebar
media agar dituangkan kedalam cawan petri kemudian dibiarkan memadat.
Lalu disebarkan suspensi bakteri uji. Media dilubangi dengan alat pencetak
lubang ( Punch Hole ), diteteskan dengan zat antibakteri, didiamkan,
diinkubasikan pada suhu 37°C selama 18 – 24 jam. Diukur zona hambatnya yaitu
daerah bening disekitar lubang dengan menggunakan jangka sorong ( Soemarno,
2000 ; Atmawidjaja, 1988 ).
Cara Turbidimetri
Pada cara ini digunakan media cair. Pertama dilakukan penuangan media
ke dalam tabung reaksi, ditambahkan suspensi bakteri, kemudian dilakukan
pemipetan larutan uji, dilakukan inkubasi. Selanjutnya dilakukan pengukuran
kekeruhan, kekeruhan yang disebabkan oleh pertumbuhan bakteri diukur dengan
menggunakan instrument yang cocok, misalnya nephelometer setelah itu
dilakukan penghitungan potensi ( Atmawidjaja, 1988 ).
Sterilisasi
Peralatan yang dipergunakan dalam uji antibakteri harus dalam keadaan
steril. Artinya pada peralatan tersebut tidak didapatkan bakteri lain yang tidak
diharapkan, baik yang akan merusak media dan proses yang sedang berlangssung.
Steril didapatkan melalui sterilisasi, cara sterilisasi yang umum dilakukan
antara lain :
a. Sterilisasi secara fisik, misalnya dengan pemanasan penggunaan sinar
gelombang pendek seperti sinar X, sinar gama dan sinar ultra violet.
b. Sterilisasi secara mekanik, dengan menggunakan desinfektan dan larutan
Dengan udara panas, dipergunakan alat yang dinamakan oven dengan
temperatur antara 170 - 180°C dan waktu yang dipergunakan adalah selama 2
jam. Cara ini umum dipergunakan untuk mensterilkan peralatan gelas.
Sterilisasi dengan uap air panas dan tekanan tinggi merupakan cara yang
paling banyak digunakan misalnya dengan penggunaan alat yang dinamakan
autoklaf. Alat ini mempunyai temperatur uap sekitar 121°C. Selain alat, media
yang akan digunakan juga terlebih dahulu disterikan di dalam otoklaf selama 15 –
20 menit. Hal ini tergantung pada banyak sedikitnya media yang akan disterilkan
(Suriawira, 2005).
Uraian Bakteri
Bakteri (Dwijoseputro, 1978)
Bakteri adalah mikroorganisme yang bersel satu, berkembang biak dengan
cara membelah diri, serta demikian kecilnya sehingga hanya dapat dilihat dengan
menggunakan mikroskop.
Klasifikasi Bakteri
Berdasarkan bentuk morfologinya, maka bakteri dapat di bagi atas tiga
bagian (Pratiwi, 2008) yaitu :
1. Bentuk Basil
Basil adalah bakteri yang bentuknya menyerupai batang atau silinder,
membelah dalam satu bidang, sebagian besar basil tampak sebagai batang tunggal,
berpasangan atau dalam bentuk rantai pendek atau panjang. Bentuk basil ini dapat
dibedakan atas :
a) Bentuk tunggal, yaitu basil yang terlepas satu sama lain dengan ujung –
b) Diplobasil, yaitu basil yang bergandengan dua – dua dengan ujung – ujungnya
yang tumpul.
c) Streptobasil, yaitu basil yang bergandeng – gandengan panjang dengan ujung
– ujungnya yang tumpul.
2. Bentuk kokus
Kokus adalah bakteri yang berbentuk bulat atau oval, ada yang hidup
sendiri dan ada yang dijumpai hidup berpasangan, kubus atau membentuk rantai
panjang, bergantung pada caranya membelah diri kemudian melekat atau sama
lain setelah pembelahan. Bentuk kokus ini dapat dibedakan atas :
a) Diplokokus, yaitu kokus yang bergandengan dua – dua.
b) Tertakokus, yaitu kokus yang mengelompok berempat.
c) Staphylokokus, yaitu kokus yang mengelompok merupakan suatu untaian.
d) Streptokokus, yaitu kokus yang bergandeng – gandengan panjang seperti
rantai.
e) Sarsina, kokus yang mengelompok serupa kubus.
3. Bentuk Spiral
Kelompok bakteri ini terdiri atas beraneka ragam bentuk bakteri berbentuk
silinder, yang bukan lurus seperti basil melainkan melingkar. Bakteri bentuk spiral
ini dibedakan menjadi beberapa jenis antara lain :
a) Vibrio, yaitu bakteri yang benbentuk batang melengkung menyerupai koma,
ada yang tumbuh sebagai benang – benang membelit atau berbentuk s.
b) Spiril, yaitu dari kata spirilium yang menyerupai spiral atau lilitan yang
c) Spirochaeta, yaitu juga merupakan bakteri spiral, tetapi bedanya bakteri ini
memiliki spiri yang bersifat fleksibel (mampu melenturkan dan melekukkan
tubuhnya sambil bergerak).
2.1.1 Uraian Staphylococcus aureus
Staphylococcus merupakan kokus gram positif, aerobik atau anaerobik
fakultatif. Nama ini berasal dari Yunani staphyle yang berarti setandan anggur.
Staphylococcus aureus ditemuka n sebagai flora normal pada kulit, selaput lendir,
bisul dan luka.
Sistematika Staphylococcus aureus (Dwidjoseputro, 1988) Divisi : Protophyta
Klas : Schizomycetes
Bangsa : Eubacteriales
Suku : Micrococcaceae
Marga : Staphylococcus
Jenis : Staphylococcus aureus
Morfologi Staphylococcus aureus
a. Cirri – ciri bakteri Staphylococcus aureus
Sel berbentuk bola dengan diameter rata – rata 0,7 – 1,2 µm tersusun
dalam kelompok – kelompok. Pada biakan cair ditemukan dalam bentuk
berpasangan, rantai pendek dan kokus yang tunggal. Kokus muda bersifat gram
positif. Bakteri Staphylococcus aureus tidak bergerak dan tidak membentuk spora.
b. Biakan Bakteri Staphylococcus aureus
Bakteri ini tumbuh baik pada suhu 37°C. Pertumbuhan terbaik dan khas
pertumbuhan adalah 7,4. Bakteri ini berbentuk bulat, cembung, dan
mengkilap. Warna khas adalah kuning keemasan.
Uraian Escherichia coli
Sistematika Escherchia coli (Dwidjoseputro, 1988) Divisi : Protophyta
Kelas : Schizomycetes
Bangsa : Eubacteriales
Suku : Enterobacteriaceae
Marga : Escherichia
Jenis : Escherichia coli
Escherichia coli disebut juga Bacterium coli. Escherichia coli merupakan
bakteri gram negatif aerobik atau anaerobik fakultatif, lebarnya 0,4 – 0, 7 µ m,
panjang 1 – 4 µ m yang mempunyai cirri – cirri : batang lurus, bergerak dengan
flagel atau tidak bergerak. Escherichia coli tumbuh sangat baik pada temperatur
37°C, tetapi dia dapat tumbuh pada temperature 8 - 46°C (Pelczar,1988).
Escherichia coli biasanya hidup pada tinja dan terdapat dalam saluran
cerna. Bakteri ini menyebabkan masalah kesehatan pada manusia seperti diare,
dan masalah pencernaan lainnya (Anonimc
a. Nutrisi
, 2009).
Faktor – Faktor yang Mempengaruhi Pertumbuhan Bakteri
Semua mikroorganisme memerlukan nutrisi sebagai sumber energi dan
pertumbuhan selnya. Unsur – unsur dasar tersebut adalah karbon, nitrogen, sulfur,
mempengaruhi pertumbuhan mikroba hingga pada akhirnya dapat menyebabkan
kematian (Gamman, 1992).
b. Temperatur
Bakteri sangat peka terhadap suhu atau temperatur dan daya tahannya
tidak sama untuk semua spesies. Bakteri dapat diklasifikasikan menjadi tiga
kelompok berdasarkan suhu pertumbuhan yang diperlukan,diantaranya :
a. Psikrofil, ( mikroorganisme yang suka dingin ) dapat tumbuh baik pada
suhu di bawah 20°C. kisaran suhu optimumnya adalah 10 - 20°C.
b. Mesofil, ( mikroorganisme yang suka pada suhu sedang ) memiliki suhu
pertumbuhan optimal antara 20 - 45°C.
c. Termofil, ( mikroorganisme yang suka pada suhu tinggi ) dapat tumbuh
baik pada suhu di atas 45°C. Suhu optimumnya antara 50 - 60°C
(Gamman, 1992).
c. Waktu
Laju pertumbuhan bakteri bervariasi menurut spesies dan kondisi
pertumbuhannya. Pada kondisi optimal bakteri memperbanyak diri dengan
pembelahan biner setiap 20 menit sekali. Kurva pertumbuhan bakteri merupakan
gambaran pertumbuhan secara bertahap sejak awal hingga terhenti mengadakan
kegiatan. Ada 4 fase pertumbuhan bakteri, diantaranya :
Fase Lambat ( lag phase ) : Fase yang terjadi antara beberapa jam
tergantung pada umur dal sel inokulum, spesies, dan lingkungannya.
Waktu pada fase lag ini dibutuhkan untuk kegiatan metabolisme dalam
penyesuaian diri dengan kondisi pertumbuhan dalam lingkungan yang
Fase Log ( Log phase ) : Setelah beradaptasi terhadap kondisi baru, sel –
sel ini akan tumbuh dan membelah diri secara eksponensial sampai jumlah
maksimum yang dapat dibantu oleh kondisi lingkungan yang dicapai
Fase Tetap ( Stationary phase ) : populasi bakteri jarang dapat tetap
tumbuh secara eksponensial dengan kecepatan tinggi untuk jangka waktu
yang lama. Setelah 48 jam, pertumbuhan eksponensial satu sel bakteri
dengan waktu 20 menit akan menghasilkan sebesar 2,2 x 1031 gr.
Pertumbuhan populasi mikroorganisme biasanya dibatasi oleh habisnya
nutrisi yang tersedia, akibatnya kecepatan pertumbuhan menurun dan
pertumbuhan akhirnya terhenti dan pada titik ini dikatakan sebagai fase
tetap ( stationary phase ). Komposisi sel – sel pada fase ini berbeda
dibandingkan dengan sel – sel saat fase eksponensial dan umumnya lebih
tahan terhadap perubahan panas, dingin maupun radiasi.
Fase Menurun ( death phase ) : Sel – sel pada fase tetap, akhirnya akan
mati bila tidak di pindahkan ke media segar yang lainnya. Sebagaimana
pertumbuhan, kematian sel juga secara eksponensial dan karenannya
dalam bentuk logaritmis, fase menurun atau kematian ini merupakan
penurunan secara garis lurus yang digambarkan oleh jumlah sel – sel yang
hidup terhadap waktu. Kecepatan kematian berbeda – beda tergantung dari
lingkungan dan spesies mikroorganisme (Waluyo, 2004).
d. Oksigen
Oksigen dapat mempengaruhi pertumbuhan mikroorganisme. Bakteri
dapat dibedakan menjadi 4 kelompok berdasarkan kebutuhan oksigen selama
Aerob yaitu bakteri yang membutuhkan oksigen di dalam
pertumbuhannya.
Anaerob yaitu bakteri yang tidak membutuhkan oksigen di dalam
pertumbuhannya, bahkan oksigen ini dapat menjadi racun bagi bakteri
tersebut.
Anaerob fakultatif yaitu bakteri yang dapat hidup tumbuh dengan atau
tanpa adanya oksigen.
Mikroaerofilik yaitu bakteri yang memerlukan hanya sedikit oksigen
dalam pertumbuhannya.
e. pH
Pertumbuhan bakteri juga memerlukan pH tertentu, namun umumnya
bakteri memiliki jarak pH yaitu sekitar pH 6,5 – 7,5 atau pada pH netral (Waluyo,
2004).
f. Tekanan Osmosis
Medium yang baik bagi pertumbuhan bakteri adalah medium yang isotonis
terhadap isi sel bakteri. Jika bakteri ditempatkan dalam suatu larutan hipertonis
terhadap isi sel, maka bakteri akan mengalami plasmolisis yaitu terlepasnya
sitoplasma dalam membran sel. Sebaliknya bila bakteri ditempatkan dalam suatu
larutan hipotonis maka dapat menyebabkan pecahnya sel bakteri karena masuknya
BAB III
METODOLOGI PENELITIAN
Metode penelitian yang dilakukan adalah metode eksperimental. Metode
penelitian ini meliputi pengumpulan sampel, pengolahan sampel, karakterisasi
simplisia, skrining fitokimia, pembuatan ekstrak etanol dengan cara maserasi
kemudian difraksinasi berturut-turut dengan pelarut n-heksana dan etilasetat, diuji
aktivitas antibakteri secara in vitro dengan metode difusi agar menggunakan
pencetak lubang (punch hole). Penelitian dilakukan di Laboratorium
Farmakognosi Fakultas Farmasi dan Laboratorium Mikrobiologi Fakultas MIPA,
Universitas Sumatera Utara.
3.1 Alat-alat
Alat-alat yang digunakan dalam penelitian ini adalah alat-alat gelas,
blender (Philips), autoklaf (Fisons), inkubator (Fiber Scientific), lemari pendingin
(Toshiba), oven (Gallenkamp), mortir dan lumpang, lampu bunsen, desikator,
neraca kasar (Ohanus), neraca listrik (Vibra AJ), penangas air (Yenaco),
seperangkat alat destilasi, jarum ose, pencetak lubang (punch hole), statif dan
klem, jangka sorong, spatula, pinset, kapas, mikro pipet (Eppendorf), rotary
evaporator (Haake D), freeze dryer (Modulio).
3.2 Bahan-bahan
Bahan-bahan yang digunakan pada penelitian ini adalah simplisia daun
sidaguri (Sida rhombifolia L.), nutrient agar (Difco), aquadest, Staphylococcus
aureus ATCC 29213, Escherichia coli ATCC 25922 dan Pseudomonas
analisa (E.Merck) yaitu n-heksana, etilasetat, benzen, kloroform, eter, asam asetat
glasial, isopropanol, asam sulfat, asam klorida, serbuk magnesium, kloralhidrat,
iodium, kalium iodida, metanol, natrium klorida, natrium hidroksida, alfa naftol,
serbuk zinkum, timbal (II) asetat, raksa (II) klorida, toluena, bismut (III) nitrat,
besi (III) klorida, natrium sulfat anhidrat.
3.3 Pembuatan Larutan Pereaksi 3.3.1 Larutan Pereaksi Bouchardat
Sebanyak 4 g kalium iodida dilarutkan dalam 20 ml air suling, kemudian
ditambahkan sedikit demi sedikit 2 g iodium dan dicukupkan dengan air suling
hingga 100 ml (Depkes RI, 1980).
3.3.2 Larutan Pereaksi Mayer
Sebanyak 1,36 g raksa (II) klorida, dilarutkan dalam 60 ml air suling.
Kemudian pada wadah lain ditimbang sebanyak 5 g kalium iodida lalu dilarutkan
dalam 10 ml air suling. Kedua larutan dicampurkan dan ditambahkan air suling
hingga diperoleh larutan 100 ml (Depkes RI, 1980).
3.3.3 Larutan Pereaksi Dragendorff
Sebanyak 8 g bismut (III) nitrat ditimbang, kemudian dilarutkan dalam 20
ml asam nitrat pekat. Pada wadah lain ditimbang sebanyak 27,2 g kalium iodida
lalu dilarutkan dalam 50 ml air suling. Kemudian kedua larutan dicampurkan dan
didiamkan sampai memisah sempurna. Larutan yang jernih diambil dan
3.3.4 Larutan Pereaksi Molish
Sebanyak 3 g alfa-naftol ditambahkan beberapa tetes etanol kemudian
dilarutkan dalam asam nitrat 0,5 N hingga 100 ml (Ditjen POM, 1979).
3.3.5 Larutan Pereaksi Asam Klorida 2 N
Sebanyak 17 ml asam klorida pekat diencerkan dalam air suling hingga
100 ml (Ditjen POM, 1979).
3.3.6 Larutan Pereaksi Asam Sulfat 2 N
Sebanyak 5,4 ml asam sulfat pekat diencerkan dengan air suling hingga
100 ml (Ditjen POM, 1979).
3.3.7 Larutan Pereaksi Natrium Hidroksida 2 N
Sebanyak 8,002 g kristal natrium hidroksida dilarutkan dalam air suling
hingga 100 ml (Ditjen POM, 1979).
3.3.8 Larutan pereaksi Lieberman-Burchard
Sebanyak 20 bagian asam asetat anhidrat dicampurkan dengan 1 bagian
asam sulfat pekat dan 50 bagian kloroform. Larutan pereaksi harus dibuat baru
(Harborne, 1987).
3.3.9 Larutan Pereaksi Besi (III) klorida 1% (b/v)
Sebanyak 1 g besi (III) klorida dilarutkan dalam air suling hingga 100 ml
(Ditjen POM, 1979).
3.3.10 Larutan Pereaksi Timbal (II) asetat 0,4 M
Sebanyak 15,17 g timbal (II) asetat dilarutkan dalam air suling bebas
3.3.11 Larutan Pereaksi Kloralhidrat
Sebanyak 50 g kloralhidrat dilarutkan dalam 20 ml air suling (Depkes RI,
1995).
3.4 Persiapan Sampel
3.4.1 Pengambilan Sampel Tumbuhan
Pengumpulan sampel dilakukan secara purposif yaitu tanpa
membandingkan dengan tumbuhan yang sama dari daerah lain. Sampel yang
digunakan adalah daun sidaguri yang berwarna hijau dan masih segar, yang
diambil dari sekitar daerah kecamatan marelan (sampel dapat dilihat pada
lampiran 3 halaman 29).
3.4.2 Identifikasi Tumbuhan
Identifikasi tumbuhan dilakukan oleh Lembaga Ilmu Pengetahuan
Indonesia (LIPI) Pusat Penelitian dan Pengembangan Biologi Bogor (hasil
identifikasi tumbuhan dapat dilihat pada lampiran 2 halaman 28).
3.4.3 Pengolahan Simplisia
Daun sidaguri yang telah dikumpulkan, dicuci bersih dengan air mengalir,
ditiriskan, lalu ditimbang berat basah, kemudian dikeringkan kedalam lemari
pengering dengan suhu 40-50°C. Daun dianggap kering bila dapat diremas rapuh
dan hancur, lalu ditimbang berat kering. Kemudian diserbukkan dengan
menggunakan blender lalu disimpan di dalam wadah kering dan terlindung dari
3.5 Karakterisasi Simplisia 3.5.1 Pemeriksaan Makroskopik
Pemeriksaan makroskopik dilakukan terhadap serbuk simplisia daun
sidaguri dengan mengamati bentuk, bau, rasa dan warna.
3.5.2 Pemeriksan Mikroskopik
Pemeriksaan mikroskopik dilakukan terhadap serbuk simplisia daun
sidaguri. Serbuk simplisia ditaburkan di atas kaca objek yang telah ditetesi dengan
larutan kloralhidrat dan tutup dengan kaca penutup, kemudian diamati di bawah
mikroskop (hasil dapat dilihat pada lampiran 6 halaman 32).
3.5.3 Penetapan Kadar Air
Penetapan kadar air dilakukan dengan metode azeotropi (destilasi toluena).
Cara penetapan: ke dalam labu alas bulat dimasukkan 200 ml toluena dan 2 ml air
suling, lalu didestilasi selama 2 jam. Setelah itu, toluena dibiarkan mendingin
selama 30 menit dan dibaca volume air pada tabung penerima dengan ketelitian
0,05 ml. Kemudian kedalam labu tersebut dimasukkan 5 g serbuk simplisia yang
telah ditimbang seksama, labu dipanaskan hati-hati selama 15 menit. Setelah
toluena mendidih, kecepatan tetesan diatur lebih kurang 2 tetes tiap detik, hingga
sebagian air terdestilasi, kemudian naikkan kecepatan tetesan hingga 4 tetes tiap
detik. Setelah semua air terdestilasi, bagian dalam pendingin dibilas dengan
toluena yang telah jenuh. Destilasi dilanjutkan selama 5 menit, kemudian tabung
penerima dibiarkan mendingin sampai suhu kamar. Setelah air dan toluena
memisah sempurna, volume air dibaca dengan ketelitian 0,05 ml. Selisih kedua
volume air yang dibaca sesuai dengan kandungan air yang terdapat dalam bahan
3.5.4 Penetapan Kadar Sari Larut Dalam Air
Sebanyak 5 g serbuk simplisia dimaserasi selama 24 jam dalam 100 ml
air-kloroform (2,5 ml kloroform dalam aquadest sampai 1 liter) dengan
menggunakan botol bersumbat sambil sekali-kali dikocok selama 6 jam pertama,
kemudian dibiarkan selama 18-24 jam dan disaring. sebanyak 20 ml filtrat
pertama diuapkan hingga kering dalam cawan yang berdasar rata yang telah
dipanaskan dan ditara. Residu dipanaskan dalam oven pada suhu 105°C sampai
diperoleh bobot tetap. Kadar sari yang larut dalam air di hitung terhadap bahan
yang telah dikeringkan diudara (Depkes RI, 1995).
3.5.5 Penetapan Kadar Sari Larut Dalam Etanol
Sebanyak 5 g serbuk simplisia dimaserasi selama 24 jam dalam 100 ml
etanol 96 % dengan menggunakan botol bersumbat sambil sekali-kali dikocok
selama 6 jam pertama, kemudian dibiarkan selama 18-24 jam dan disaring.
Sebanyak 20 ml filtrat pertama diuapkan hingga kering dalam cawan yang
berdasar rata yang telah dipanaskan dan ditara. Residu dipanaskan dalam oven
pada suhu 105°C sampai diperoleh bobot tetap. Kadar sari larut dalam etanol
dihitung terhadap bahan yang telah dikeringkan diudara (Depkes RI, 1995).
3.5.6 Penetapan Kadar Abu Total
Sebanyak 2 g serbuk simplisia yang telah digerus dan ditimbang seksama,
dimasukkan kedalam krus porselin yang telah dipijar dan ditara, kemudian
diratakan. Krus porselin bersama isinya dipijarkan perlahan-lahan hingga arang
habis, dinginkan, ditimbang sampai diperoleh bobot yang tetap. Kadar abu
3.5.7 Penetapan Kadar Abu Yang Tidak Larut Dalam Asam
Abu yang diperoleh pada penetapan kadar abu total dididihkan dengan 25
ml asam klorida encer selama 5 menit, bagian yang tidak larut dalam asam
dikumpulkan, saring dengan kertas saring, lalu cuci dengan air panas. Kemudian
residu dan kertas saring dipijarkan sampai diperoleh bobot tetap, didinginkan dan
ditimbang beratnya. Kadar abu yang tidak larut dalam asam dihitung terhadap
bahan yang telah dikeringkan diudara (Depkes RI, 1995).
3.6 Uji Senyawa Kimia
Skrining fitokimia serbuk simplisia meliputi pemeriksaan senyawa
golongan alkaloida, glikosida, steroida/triterpenoida, flavonoida, saponin, tanin
dan antrakinon.
3.6.1 Pemeriksaan Alkaloida
Sebanyak 0,5 g serbuk simplisia ditambahkan 1 ml asam klorida 2 N dan 9
ml air suling, dipanaskan di atas penangas air selama 2 menit, didinginkan dan
disaring. Filtrat dipakai untuk uji alkaloida sebagai berikut :
a. Filtrat sebanyak 3 tetes ditambah dengan 2 tetes larutan pereaksi Meyer
akan terbentuk endapan menggumpal berwarna putih atau kuning.
b. Filtrat sebanyak 3 tetes ditambah dengan 2 tetes larutan pereaksi
Bouchardat, akan terbentuk endapan berwarna coklat sampai kehitaman.
c. Filtrat sebanyak 3 tetes ditambah dengan 2 tetes larutan pereaksi
Dragendorf, akan terbentuk endapan berwarna merah atau jingga.
Alkaloida positif jika terjadi endapan atau kekeruhan paling sedikit dua dari tiga
3.6.2 Pemeriksaan Glikosida
Sebanyak 3 g serbuk simplisia, disari dengan 30 ml campuran etanol 96%
dengan air suling (7:3) direfluks selama 10 menit, didinginkan dan disaring. Pada
20 ml filtrat ditambahkan 25 ml air suling dan 25 ml timbal (II) asetat 0,4 M,
dikocok, didiamkan 5 menit lalu disaring. Filtrat disari dengan 20 ml campuran
isopropanol dan kloroform (2:3), dilakukan berulang sebanyak 3 kali. Kumpulan
sari air tambahkan natrium sulfat anhidrat, saring, kemudian diuapkan pada
temperatur tidak lebih dari 50°C, sisanya dilarutkan dalam 2 ml metanol. Larutan
sari air dalam metanol dimasukkan ke dalam tabung reaksi selanjutnya diuapkan
diatas penangas air, pada sisa ditambahkan 2 ml air dan 5 tetes larutan pereaksi
molish. Tambahkan hati-hati 2 ml asam sulfat pekat melalui dinding tabung,
terbentuknya cincin ungu pada batas kedua cairan menunjukkan adanya glikosida
(Depkes RI, 1995).
3.6.3 Pemeriksaan Flavonoida
Sebanyak 10 g serbuk simplisia ditambahkan 10 ml air panas, dididihkan
selama 5 menit dan disaring dalam keadaan panas, kedalam 5 ml filtrat
ditambahkan 0,1 g serbuk magnesium dan 1 ml asam klorida pekat dan 2 ml amil
alkohol, dikocok dan dibiarkan memisah. Flavonoida positif jika terjadi warna
merah atau kuning atau jingga pada lapisan amil alkohol (Farnsworth, 1966).
3.6.4 Pemeriksaan Tanin
Sebanyak 0,5 g serbuk simplisia disari dengan 10 ml air suling lalu
disaring, filtratnya diencerkan dengan air sampai tidak berwama. Larutan diambil
sebanyak 2 ml dan ditambahkan 1-2 tetes pereaksi besi (III) klorida 1 %. Jika
3.6.5 Pemeriksaan Saponin
Sebanyak 0,5 g serbuk simplisia dimasukkan dalam tabung reaksi,
ditambahkan 10 ml air panas, didinginkan kemudian dikocok kuat-kuat selama 10
detik, jika terbentuk buih setinggi 1 sampai 10 cm yang stabil tidak kurang dari 10
menit dan tidak hilang dengan penambahan 1 tetes asam klorida 2 N menunjukkan
adanya saponin (Depkes RI, 1995).
3.6.6 Pemeriksaan Antrakinon
Sebanyak 0,2 g serbuk simplisia ditambah 5 ml asam sulfat 2 N
dipanaskan, setelah dingin ditambahkan 10 ml benzena, dikocok dan didiamkan.
Lapisan benzena dipisahkan dan disaring. Lapisan benzena dikocok dengan 2 ml
natrium hidroksida 2 N, didiamkan. Lapisan air berwama merah dan lapisan
benzena tidak berwarna menunjukkan adanya antrakinon (Depkes RI, 1995).
3.6.7 Pemeriksaan Steroida/Triterpenoida
Sebanyak 1 g serbuk simplisia dimaserasi dengan 20 ml eter selama 2 jam,
disaring, filtrat diuapkan dalam cawan penguap dan pada sisanya ditambahkan 20
tetes asam anhidrat dan 1 tetes asam sulfat pekat (pereaksi Lieberman-Burchard).
Apabila terbentuk warna ungu atau merah yang berubah menjadi biru kehijauan
menunjukkan adanya steroida/Triterpenoida (Harborne, 1987).
3.7 Pembuatan Ekstrak Daun Sidaguri 3.7.1 Pembuatan Ekstrak Etanol
Sebanyak 500 g serbuk simplisia dimaserasi dengan etanol 96 % dalam
wadah tertutup rapat dan dibiarkan pada suhu kamar selama 5 hari terlindung dari
cahaya matahari sambil sering diaduk, kemudian disaring dan ampas dimaserasi
meninggalkan sisa). Maserat yang diperoleh dipekatkan dengan menggunakan
rotary evaporator pada temperatur ± 40°C sampai diperoleh ekstrak kental,
kemudian dikeringkan dengan freeze dryer pada suhu -40°C selama ± 24 jam.
3.7.2 Pembuatan Fraksi n-Heksana dan Fraksi Etilasetat
Sebanyak 20 g ekstrak etanol ditambahkan 50 ml aquadest lalu
ditambahkan 50 ml n-heksana, dikocok dalam corong pisah dan dibiarkan sampai
memisah, kemudian dipisahkan. Selanjutnya difraksinasi kembali dengan pelarut
n-heksana hingga diperoleh fraksi n-heksana yang jernih (tidak memberikan
reaksi positif dengan penambahan pereaksi Lieberman-Burchard). Kemudian
fraksi air ditambahkan 50 ml etilasetat, dikocok dan dibiarkan memisah. Lapisan
etilasetat dipisahkan dan fraksinasi dilanjutkan sampai diperoleh fraksi etilasetat
yang jernih (tidak memberikan hasil positif dengan penambahan pereaksi FeCl3).
Kumpulan hasil fraksi n-heksana dan fraksi etilasetat masing-masing diuapkan
dengan rotary evaporator pada temperatur ± 40°C sampai diperoleh ekstrak
kental, kemudian dikeringkan dengan freeze dryer pada suhu -40°C selama ± 24
jam.
3.8 Sterilisasi Alat
Alat-alat yang digunakan dalam uji aktivitas antibakteri ini, disterilkan
terlebih dahulu sebelum dipakai. Alat-alat gelas disterilkan didalam oven pada
suhu 170°C selama 1-2 jam. Media disterilkan di autoklaf pada suhu 121°C
3.9 Pembuatan Media
3.9.1 Pembuatan Media Nutrient Agar (NA) Komposisi : Beef extract 3 g
Peptone 5 g Agar 15 g
Cara Pembuatan :
Sebanyak 23 g nutrient agar (NA) dimasukkan kedalam erlenmeyer
tambahkan air suling 1000 ml, lalu dipanaskan sampai larut. Kemudian disterilkan
di dalam autoklaf pada suhu 121°C selama 15 menit (Difco Laboratories, 1977).
3.9.2 Larutan NaCl 0,9%
Komposisi : Natrium Klorida 0,9 g Air suling ad 100 ml
Cara Pembuatan :
Natrium klorida ditimbang sebanyak 0,9 g dilarutkan dengan air suling
steril sedikit demi sedikit sampai 100 ml. Kemudian disterilkan di autoklaf pada
suhu 121°C selama 15 menit.
3.9.3 Suspensi Standar Mc.Farland
Komposisi : Larutan barium klorida 1,175% 0,05 ml
Larutan asam sulfat 1% 9,95 ml
Cara Pembuatan :
Kedua larutan dicampurkan dalam tabung reaksi steril, dikocok sampai
homogen dan ditutup. Apabila kekeruhan hasil suspensi bakteri sama dengan
kekeruhan suspensi standar berarti konsentrasi bakteri 108CFU/ml (Colony
3.10 Pembiakan Bakteri 3.10.1 Pembuatan Stok Kultur
3.10.1.1 Bakteri Staphylococcus aureus
Satu koloni bakteri Staphylococcus aureus diambil dengan menggunakan
jarum ose steril lalu ditanamkan pada media nutrient agar (NA) miring dengan
cara menggores, setelah itu diinkubasi dalam inkubator pada suhu 35 ±1°C selama
18-24 jam (Ditjen POM, 1995).
3.10.1.2 Bakteri Escherichia coli
Satu koloni bakteri Escherichia coli diambil dengan menggunakan jarum
ose steril lalu ditanamkan pada media nutrient agar (NA) miring dengan cara
menggores, setelah itu diinkubasi dalam inkubator pada suhu 35 ±1°C selama
18-24 jam (Ditjen POM, 1995).
3.10.1.3 Bakteri Pseudomonas aeruginosa
Satu koloni bakteri Pseudomonas aeruginosa diambil dengan
menggunakan jarum ose steril lalu ditanamkan pada media nutrient agar (NA)
miring dengan cara menggores, setelah itu diinkubasi dalam inkubator pada suhu
35 ±1°C selama 18-24 jam (Ditjen POM, 1995).
3.10.2 Pembuatan Inokulum
3.10.2.1 Bakteri Staphylococcus aureus
Stok kultur bakteri Staphylococcus aureus yang telah tumbuh diambil
dengan jarum ose steril lalu disuspensikan kedalam tabung yang berisi 10 ml
larutan NaCl 0,9% diinkubasi selama ±1 jam sampai didapat kekeruhan suspensi
bakteri yang sama dengan kekeruhan standar Mc.Farland, ini berarti konsentrasi
memipet 0,1 ml biakan bakteri (108CFU/ml), dimasukkan kedalam tabung steril
yang berisi larutan NaCl 0,9% sebanyak 9,9 ml dan dikocok homogen. Maka
diperoleh suspensi bakteri dengan konsentrasi 106CFU/ml (Ditjen POM, 1995).
3.10.2.2 Bakteri Escherichia coli
Stok kultur bakteri Escherichia coli yang telah tumbuh diambil dengan
jarum ose steril lalu disuspensikan kedalam tabung yang berisi 10 ml larutan NaCl
0,9% diinkubasi selama ±1 jam sampai didapat kekeruhan suspensi bakteri yang
sama dengan kekeruhan standar Mc.Farland, ini berarti konsentrasi suspensi
bakteri adalah 108CFU/ml. Setelah itu dilakukan pengenceran dengan memipet
0,1 ml biakan bakteri (108CFU/ml), dimasukkan kedalam tabung steril yang berisi
larutan NaCl 0,9% sebanyak 9,9 ml dan dikocok homogen. Maka diperoleh
suspensi bakteri dengan konsentrasi 106CFU/ml (Ditjen POM, 1995).
3.10.2.3 Bakteri Pseudomonas aeruginosa
Stok kultur bakteri Pseudomonas aeruginosa yang telah tumbuh diambil
dengan jarum ose steril lalu disuspensikan kedalam tabung yang berisi 10 ml
larutan NaCl 0,9% diinkubasi selama ±1 jam sampai didapat kekeruhan suspensi
bakteri yang sama dengan kekeruhan standar Mc.Farland, ini berarti konsentrasi
suspensi bakteri adalah 108CFU/ml. Setelah itu dilakukan pengenceran dengan
memipet 0,1 ml biakan bakteri (108CFU/ml), dimasukkan kedalam tabung steril
yang berisi larutan NaCl 0,9% sebanyak 9,9 ml dan dikocok homogen. Maka
3.11 Pembuatan Larutan Uji (Ekstrak Etanol, Fraksi n-Heksana dan Etilasetat) Dengan Berbagai Konsentrasi
1. Ditimbang sebanyak 5 g ekstrak etanol daun sidaguri dilarutkan dengan
etanol 96% cukupkan hingga 10 ml. Konsentrasi ekstrak etanol adalah 500
mg/ml. kemudian dibuat pengenceran sampai diperoleh ekstrak etanol
dengan konsentrasi 400 mg/ml, 300 mg/ml, 200 mg/ml, 100 mg/ml,
90 mg/ml, 80 mg/ml, 70 mg/ml, 60 mg/ml, 50 mg/ml, 40 mg/ml, 30 mg/ml
dan 20 mg/ml.
2. Terhadap fraksi n-heksana dan etilasetat dibuat prosedur yang sama
dengan ekstrak etanol, dengan menimbang masing-masing fraksi sebanyak
5 g dan konsentrasi fraksi dilakukan sama dengan konsentrasi ekstrak
etanol.
3.12 Pengujian Efek Antibakteri secara In vitro
Media agar steril dicairkan dan ditunggu hingga suhu mencapai ± 45°C.
Suspensi bakteri sebanyak 0,1 ml yang telah diukur kekeruhannya kemudian
dimasukkan kedalam cawan petri steril. Kemudian dicampurkan dengan media
agar, homogenkan campuran dan dibiarkan memadat. Media dilubangi dengan
pencetak lubang (punch hole), lalu dimasukkan ekstrak kedalam lubang dengan
berbagai variasi konsentrasi, inkubasi pada suhu 35-37°C selama 18-24 jam. Hasil
pengukuran uji aktivitas antibakteri dari ekstrak etanol, fraksi n-heksana dan
etilasetat daun sidaguri dapat diukur dengan menggunakan jangka sorong.
Percobaan ini dilakukan tiga kali (Hasil pengukuran hambatan dapat dilihat pada
BAB IV
HASIL DAN PEMBAHASAN
Hasil identifikasi tumbuhan yang dilakukan di Pusat Penelitian dan
Pengembangan LIPI Bogor, menunjukkan bahwa tumbuhan yang diteliti adalah
Sida rhombifolia L. suku Malvaceae.
Hasil pemeriksaan makroskopik serbuk simplisia daun sidaguri berwarna
hijau kecoklatan, tidak berbau, rasa agak kelat. Hasil pemeriksaan mikroskopik
serbuk simplisia memperlihatkan adanya rambut penutup bentuk bintang,
epidermis dengan stomata, sel parenkim berisi kristal kalsium oksalat, mesofil
dengan kristal kalsium oksalat, dan serabut sklerenkim. Hasil pemeriksaan
[image:45.595.115.528.423.578.2]karakterisasi dari serbuk simplisia daun sidaguri dapat dilihat pada tabel 1.
Tabel 1. Hasil Pemeriksaan Karakterisasi Serbuk Simplisia Sidaguri
No Parameter Hasil
(%)
MMI, 1995
1 Kadar air 7,32 Tidak lebih dari 10%
2 Kadar sari larut dalam air 10,75 Tidak kurang dari 7% 3 Kadar sari larut dalam etanol 5,26 Tidak kurang dari 3,5%
4 Kadar Abu total 6,99 Tidak lebih dari 8%
5 Kadar abu yang tidak larut dalam asam 0,84 Tidak lebih dari 1%
Tujuan dilakukan pemeriksaan karakterisasi pada simplisia untuk
memenuhi syarat simplisia. Kadar yang diperoleh dari hasil karakterisasi simplisia
tersebut memenuhi syarat sesuai dengan standar Materia Medika Indonesia
(MMI) edisi VI, sehingga simplisia dapat digunakan sebagai bahan penelitian.
Hasil penyarian 500 g serbuk daun Sidaguri dilakukan dengan metode
fraksinasi n-heksana dan etilasetat dengan 20 g ekstrak etanol, maka diperoleh
ekstrak n-heksana sebanyak 18,685 g, ekstrak etil asetat sebanyak 18,268 g.
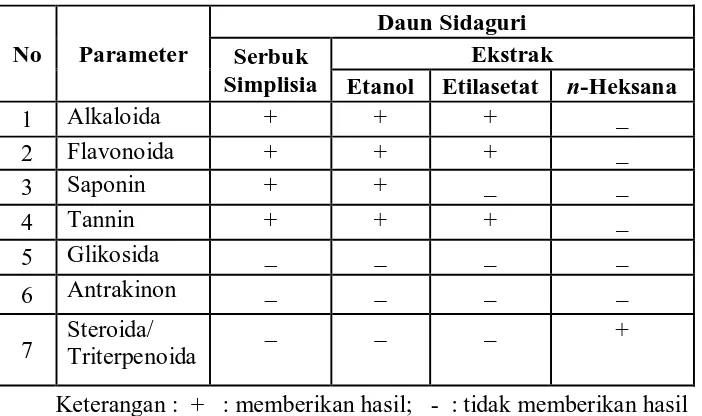
Skrining fitokimia serbuk simplisia, ekstrak etanol, ekstrak etilasetat, dan
ekstrak n-heksana daun sidaguri dilakukan untuk mengetahui senyawa kimia yang
terdapat pada simplisia tersebut.
Tabel 2. Hasil Skrining Fitokimia Serbuk Simplisia, Ekstrak Etanol, Etilasetat, dan n-Heksana Daun Sidaguri
No Parameter
Daun Sidaguri Serbuk
Simplisia
Ekstrak
Etanol Etilasetat n-Heksana
1 Alkaloida + + + _
2 Flavonoida + + + _
3 Saponin + + _ _
4 Tannin + + + _
5 Glikosida _ _ _ _
6 Antrakinon _ _ _ _
7 Steroida/ Triterpenoida _ _ _ +
Keterangan : + : memberikan hasil; - : tidak memberikan hasil
Hasil uji aktivitas antibakteri menunjukkan bahwa ekstrak etanol dan
fraksi etilasetat dapat menghambat pertumbuhan bakteri Staphylococcus aureus,
Escherichia coli dan Pseudomonas aeruginosa. Semakin tinggi konsentrasi
ekstrak akan menghasilkan diameter daerah hambat yang semakin besar. Hal ini
dapat disebabkan semakin banyaknya zat aktif yang terkandung dalam ekstrak
maupun fraksi tersebut. Sedangkan pada fraksi n-heksana tidak menunjukkan
aktivitas antibakteri terhadap ketiga bakteri. Hal ini disebabkan karena senyawa
nonpolar yaitu steroid/triterpenoid yang tertarik dengan pelarut n-heksana tidak
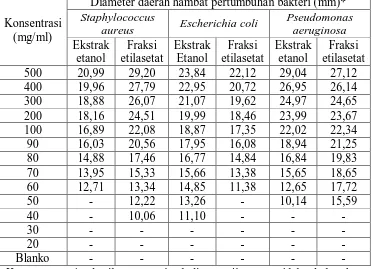
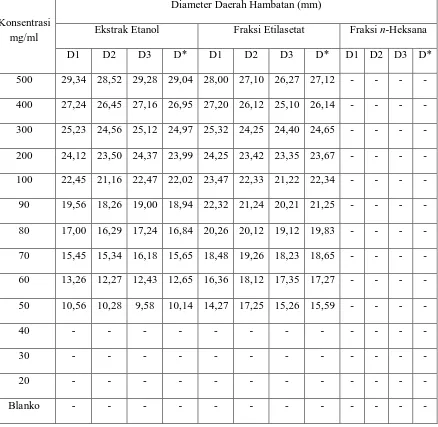
[image:46.595.113.464.278.486.2]Tabel 3. Hasil Diameter Daerah Hambat Pertumbuhan Bakteri Staphylococcus aureus, Escherichia coli dan Pseudomonas aeruginosa Pada Ekstrak Etanol dan Fraksi Etilasetat
Konsentrasi (mg/ml)
Diameter daerah hambat pertumbuhan bakteri (mm)* Staphylococcus
aureus Escherichia coli
Pseudomonas aeruginosa Ekstrak etanol Fraksi etilasetat Ekstrak Etanol Fraksi etilasetat Ekstrak etanol Fraksi etilasetat
500 20,99 29,20 23,84 22,12 29,04 27,12
400 19,96 27,79 22,95 20,72 26,95 26,14
300 18,88 26,07 21,07 19,62 24,97 24,65
200 18,16 24,51 19,99 18,46 23,99 23,67
100 16,89 22,08 18,87 17,35 22,02 22,34
90 16,03 20,56 17,95 16,08 18,94 21,25
80 14,88 17,46 16,77 14,84 16,84 19,83
70 13,95 15,33 15,66 13,38 15,65 18,65
60 12,71 13,34 14,85 11,38 12,65 17,72
50 - 12,22 13,26 - 10,14 15,59
40 - 10,06 11,10 - - -
30 - - - -
20 - - - -
Blanko - - - -
Keterangan : * = hasil rata-rata tiga kali pengujian ; - = tidak ada hambatan
Pada tabel 3 diatas pengujian ekstrak etanol dan fraksi etilasetat dapat
memberikan kemampuan menghambat pertumbuhan bakteri yang memuaskan.
Menurut Ditjen POM (1995), diameter daerah hambat antibakteri yang paling
efektif terhadap uji antibakteri adalah 14 sampai 16 mm. Hasil uji aktivitas
antibakteri menunjukkan bahwa ekstrak etanol dapat menghambat pertumbuhan
bakteri Staphylococcus aureus pada konsentrasi 80 mg/ml dengan diameter
daerah hambat sebesar 14,88 mm. Bakteri Escherichia coli pada konsentrasi 60
mg/ml dengan diameter daerah hambat sebesar 14,85 mm dan bakteri
Pseudomonas aeruginosa pada konsentrasi 70 mg/ml dengan diameter daerah
hambat sebesar 15,65 mm. Sedangkan pada fraksi etilasetat dapat menghambat
pertumbuhan bakteri Staphylococcus aureus pada konsentrasi 70 mg/ml dengan
[image:47.595.114.487.142.411.2]konsentrasi 80 mg/ml dengan diameter daerah hambat sebesar 14,84 mm dan
bakteri Pseudomonas aeruginosa pada konsentrasi 50 mg/ml dengan diameter
daerah hambat sebesar 15,59 mm.
Hal ini menunjukkan bahwa aktivitas fraksi etilasetat daun sidagur i (Sida
rhombifolia L.) dalam menghambat pertumbuhan bakteri gram positif
Staphylococcus aureus lebih baik bila dibandingkan dengan bakteri gram negatif
yaitu Escherichia coli dan Pseudomonas aeruginosa. Sedangkan pada ekstrak
etanol daun sidaguri (Sida rhombifolia L.) dalam menghambat pertumbuhan
bakteri gram negatif yaitu Escherichia coli dan Pseudomonas aeruginosa lebih
baik bila dibandingkan bakteri gram positif Staphylococcus aureus. Perbedaan
kepekaan ini disebabkan adanya perbedaan dalam struktur sel, dimana dinding sel
bakteri gram negatif lebih kompleks bila dibandingkan terhadap bakteri gram
positif (Pelczar, 1986).
Konsentrasi hambat minimum (KHM) ekstrak etanol dan fraksi etilsetat
terhadap ketiga bakteri berbeda-beda. Dimana ekstrak etanol pada bakteri
Escherichia coli pada konsentrasi 40 mg/ml dengan diameter daerah hambat
sebesar 11,10 mm, bakteri Pseudomonas aeruginosa pada konsentrasi 50 mg/ml
dengan diameter daerah hambat sebesar 10,14 mm dan bakteri Staphylococcus
aureus pada konsentrasi 60 mg/ml dengan diameter daerah hambat sebesar
12,71mm. Sedangkan fraksi etilasetat pada bakteri Staphylococcus aureus pada
konsentrasi 60 mg/ml dengan diameter daerah hambat sebesar 11,38 mm, bakteri
Pseudomonas aeruginosa pada konsentrasi 50 mg/ml dengan diameter daerah
hambat sebesar 15,59 mm dan bakteri Escherichia coli pada konsentrasi 40 mg/ml
Berdasarkan hasil pengujian yang diperoleh dapat dikatakan bahwa daun
sidaguri (Sida rhombifolia L.) mempunyai kemampuan sebagai antibakteri
terhadap bakteri Staphylococcus aureus, Escherichia coli dan Pseudomonas
aeruginosa. Hal ini dikarenakan dalam daun sidaguri (Sida rhombifolia L.)
mengandung senyawa fenol seperti tanin, flavonoida yang mempunyai aktivitas
antibakteri (Robinson, 1995).
BAB V
KESIMPULAN DAN SARAN
5.1Kesimpulan
1. Hasil uji aktivitas antibakteri menunjukkan bahwa ekstrak etanol dan
fraksi etilasetat mempunyai aktivitas sebagai antibakteri terhadap bakteri
Staphylococcus aureus, Escherichia coli dan Pseudomonas aeruginosa.
Sedangkan pada fraksi n-heksana tidak menunjukkan aktivitas antibakteri
terhadap bakteri Staphylococcus aureus, Escherichia coli dan
Pseudomonas aeruginosa.
2. Perbedaan hasil uji aktivitas antibakteri menunjukkan bahwa ekstrak
etanol dapat menghambat pertumbuhan bakteri Staphylococcus aureus
pada konsentrasi 80 mg/ml dengan diameter daerah hambat sebesar
14,88 mm. Bakteri Escherichia coli pada konsentrasi 60 mg/ml dengan
diameter daerah hambat sebesar 14,85 mm dan bakteri Pseudomonas
aeruginosa pada konsentrasi 70 mg/ml dengan diameter daerah hambat
sebesar 15,65 mm. Sedangkan pada fraksi etilasetat dapat menghambat
pertumbuhan bakteri Staphylococcus aureus pada konsentrasi 70 mg/ml
dengan diameter daerah hambat sebesar 15,33 mm. Bakteri Escherichia
coli pada konsentrasi 80 mg/ml dengan diameter daerah hambat sebesar
14,84 mm dan bakteri Pseudomonas aeruginosa pada konsentrasi
50 mg/ml dengan diameter daerah hambat sebesar 15,59 mm. Sedangkan
5.2Saran
Disarankan pada peneliti selanjutnya untuk mengisolasi dan
mengidentifikasi senyawa yang berkhasiat sebagai antibakteri dan melakukan uji
DAFTAR PUSTAKA
Depkes RI. (1980). Materia Medika Indonesia. Jilid IV. Cetakan Pertama. Jakarta: Direktorat Jenderal Pengawasan Obat dan Makanan. Halaman. 94-98.
Depkes RI. (1995). Materia Medika Indonesia. Jilid VI. Cetakan Keenam. Jakarta: Direktorat Jenderal Pengawasan Obat dan Makanan. Halaman. 247-251, 299-304, 321-325.
Depkes RI. (2001). Inventaris Tanaman Obat Indonesia 1. Jilid II. Jakarta: Departemen Kesehatan RI. Halaman. 311-312.
Difco. (1977). Difco Manual of Dehydrated Culture Media and Reagents for Microbiology and Clinical Laboratory Procedures. 9th ed. Detroit Michigan : Difco Laboratories. Page. 32-33.
Ditjen POM. (1979). Farmakope Indonesia. Edisi III. Jakarta : Departemen Kesehatan RI. Halaman. 9, 902.
Ditjen POM. (1995). Farmakope Indonesia. Edisi IV. Jakarta : Departemen Kesehatan RI. Halaman. 855, 896, 898, 1035.
Djauhariya Endjo, Hernani., (2004). Gulma Sebagai Tanaman Obat. Cetakan I. Jakarta: Penerbit penebar Swadaya. Halaman. 2-6, 8-9.
F