EFISIENSI PENULARAN Cucumber mosaic virus, Zucchini
yellow mosaic virus, DAN Squash mosaic virus MELALUI
BENIH CUCURBITACEAE
YUDIA NURHAELENA
DEPARTEMEN PROTEKSI TANAMAN FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
i
ABSTRAK
YUDIA NURHAELENA. Efisiensi Penularan Cucumber mosaic virus, Zucchini yellow mosaic virus, dan Squash mosaic virus Melalui Benih Cucurbitaceae. Dibimbing oleh SRI HENDRASTUTI HIDAYAT.
Virus yang ditularkan melalui benih telah diketahui menyebabkan efek negatif terhadap perkecambahan benih dan pertumbuhan bibit dan dapat menyebabkan penyebaran penyakit yang lebih luas di lapangan. Penelitian ini dilakukan untuk mengidentifikasi virus-virus yang ditularkan benih Cucurbitaceae dan mempelajari potensi peran mereka sebagai inokulum primer di lapangan. Benih Cucurbitaceae yang digunakan dalam penelitian yaitu mentimun, oyong, semangka, zucchini, melon, dan kaboca diperoleh dari benih komersial yang tersedia di pasar. Evaluasi virus yang ditularkan melalui benih dilakukan dengan menggunakan metode growing on test. Teknik I-ELISA dan DIBA digunakan untuk mendeteksi infeksi virus. Tiga virus yaitu CMV, SqMV, dan ZYMV terdeteksi dari lahan pertanaman mentimun di Situgede, Dramaga, Bogor. CMV terdeteksi dari benih melon varietas Kinanti dan benih zucchini masing-masing sebesar 2% serta dari benih kaboca sebesar 12%. SqMV terdeteksi sebesar 80%, 6%, dan 2% berturut-turut dari benih mentimun, melon varietas Kinanti dan oyong. Infeksi virus terdeteksi pada bibit berumur 2 sampai 5 minggu setelah tanam yaitu CMV pada kaboca dan SqMV pada mentimun. Hasil ini menunjukkan peran potensial dari virus yang ditularkan melalui benih sebagai inokulum primer di lapangan.
i
ABSTRACT
YUDIA NURHAELENA. Seed transmission efficiency of Cucumber mosaic virus, Zucchini yellow mosaic virus and Squash mosaic virus in Cucurbitaceae. Supervised by SRI HENDRASTUTI HIDAYAT.
Seed-transmitted viruses have been known to cause negative effect on seed germination and seedling growth and may cause disease spread more widely in the field. Research was conducted to identify seed-transmitted viruses from Cucurbitaceae and to study their potential role as primary inoculum in the field. Cucurbitaceae seeds used in the experiment i.e. cucumber, bottle gourd, watermelon, zucchini, melon, and kabocha were obtained from commercial seeds available in the market. Evaluation of seed-transmitted viruses was done using growing on test method. I-ELISA and DIBA was used for detection of virus infection. Three viruses i.e. CMV, SqMV, and ZYMV were detected from cucumber field in Situgede, Dramaga, Bogor. CMV was detected from melon variety Kinanti and zucchini seed (2%) as well as from kabocha seed (12%). SqMV was detected 80%, 6%, and 2% from cucumber, melon variety Kinanti and bottle gourd seeds, respectively. Virus infection was detected in seedling up to 5 weeks after transplanting, i.e. CMV in kabocha and SqMV in cucumber. This results indicated the potential role of seed-transmitted viruses as primary inoculums in the field.
iii
© Hak Cipta milik IPB, tahun 2013 Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
EFISIENSI PENULARAN Cucumber mosaic virus, Zucchini
yellow mosaic virus, DAN Squash mosaic virus MELALUI
BENIH CUCURBITACEAE
YUDIA NURHAELENA
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian
pada
Departemen Proteksi Tanaman
DEPARTEMEN PROTEKSI TANAMAN FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
Judul Skripsi : Efisiensi Penularan Cucumber mosaic virus, Zucchini yellow mosaic virus, dan Squash mosaic virus Melalui Benih Cucurbitaceae
Nama Mahasiswa : Yudia Nurhaelena NIM : A34080035
Disetujui oleh
Dr. Ir. Sri Hendrastuti Hidayat, M.Sc. Pembimbing
Diketahui oleh
Dr. Ir. Abdjad Asih Nawangsih, M.Si. Ketua Departemen
PRAKATA
Puji syukur penulis panjatkan kepada Tuhan Yang Maha Esa atas segala karunia-Nya, sehingga penelitian dan penulisan skripsi yang berjudul “Efisiensi penularan Cucumber mosaic virus, Zucchini yellow mosaic virus, dan Squash mosaic virus melalui benih Cucurbitaceae” dapat terselesaikan. Penulis menyampaikan ucapan terimakasih kepada kedua orang tua, kakak, dan keluarga atas doa, dukungan, kasih sayang, dan semangat yang selalu diberikan kepada penulis untuk dapat menyelesaikan pendidikan di IPB. Ucapan terimakasih juga penulis sampaikan kepada Dr. Ir. Sri Hendrastuti Hidayat, M.Sc selaku dosen pembimbing atas bimbingan, saran, dan masukan selama penelitian berlangsung hingga penulisan skripsi ini.
Penulis mengucapkan terimakasih juga kepada sahabat seperjuangan Proteksi Tanaman angkatan 45, rekan-rekan di Laboratorium Virologi Tumbuhan atas kebersamaan, bantuan dan dukungannya selama di IPB. Tidak ada yang penulis berikan kepada seluruh pihak yang telah memberikan dukungan, doa, bantuan, bimbingan, dan pengorbanan kecuali doa semoga Tuhan Yang Maha Esa memberikan rahmat dan balasan yang jauh lebih baik kepada semuanya. Akhirnya penulis berharap semoga skripsi ini dapat bermanfaat bagi berbagai pihak yang berkepentingan dan pengembangan ilmu pengetahuan di masa yang akan datang.
Bogor, Maret 2013
vii
DAFTAR ISI
DAFTAR TABEL viii
DAFTAR GAMBAR viii
DAFTAR LAMPIRAN viii
PENDAHULUAN
Latar Belakang 1
Tujuan Penelitian 2
Manfaat Penelitian 3
BAHAN DAN METODE
Tempat dan Waktu 4
Deteksi Virus yang Menginfeksi Tanaman Cucurbitaceae 4
Deteksi Virus Tular Benih 4
Pengukuran Titer Virus Tular Benih 5 Deteksi Virus dengan Metode Indirect ELISA (I-ELISA) 5 Deteksi Virus dengan Metode Dot Immunobinding Assay (DIBA) 6 HASIL DAN PEMBAHASAN
Gejala Infeksi Virus pada Tanaman Cucurbitaceae di Lapangan 8 Efisiensi Penularan Virus Melalui Benih Cucurbitaceae 9 Potensi Virus Tular Benih Sebagai Sumber Inokulum 11
KESIMPULAN DAN SARAN 13
DAFTAR PUSTAKA 14
LAMPIRAN 16
viii
DAFTAR TABEL
1 Daftar benih Cucurbitaceae yang digunakan pada pengujian virus
tular benih 5
2 Hasil deteksi virus dari tanaman mentimun berdasarkan reaksi ELISA 9
3 Proporsi virus terbawa benih Cucurbitaceae 10
4 Rata-rata nilai absorbansi ELISA hasil pengujian sampel benih Cucurbitaceae terhadap antiserum CMV dan SqMV 11
5 Rata rata nilai skor DIBA sampel benih Cucurbitaceae terhadap antiserum CMV dan SqMV 12
DAFTAR GAMBAR
1 Penentuan skor berdasarkan reaksi DIBA pada membran nitroselulosa 72 Gejala pada tanaman mentimun di Situ Gede 8
3 Gejala daun tanaman Cucurbitaceae di rumah kaca 10
4 Membran nitroselulosa yang menunjukkan perbedaan intensitas perubahan warna (skor 1-5) pada pengujian menggunakan metode DIBA 12
DAFTAR LAMPIRAN
1 Nilai absorbansi ELISA sampel dari lapangan 172 Nilai absorbansi ELISA daun mentimun untuk pengujian benih 17
3 Nilai absorbansi ELISA daun oyong untuk pengujian benih 17
4 Nilai absorbansi ELISA daun melon untuk pengujian benih 17
5 Nilai absorbansi ELISA daun zucchini untuk pengujian benih 18
6 Nilai absorbansi ELISA daun semangka untuk pengujian benih 18
1
PENDAHULUAN
Latar Belakang
Tanaman Cucurbitaceae merupakan kelompok tanaman yang memiliki keanekaragaman jenis. Berbagai spesies Cucurbitaceae telah dimanfaatkan oleh manusia sebagai sumber pangan dan berbagai produk berguna yang penting. Sebagian besar Cucurbitaceae berasal dari wilayah tropika terutama dari Afrika dan Asia Tenggara. Selain di daerah tropika, budidaya tanaman Cucurbitaceae secara luas juga dilakukan di wilayah beriklim sedang yang memiliki periode cuaca panas yang panjang (Rubatzky dan Yamaguchi 1997).
Tanaman Cucurbitaceae optimal pada suhu 25-30⁰C. Beberapa spesies dapat tumbuh dengan baik pada suhu antara 15⁰C dan 20⁰C. Tanaman Cucurbitaceae tidak cocok ditanam pada suhu dingin dan lahan dengan drainase tanah yang tidak baik. Sebagian besar tanaman Cucurbitaceae diperbanyak dengan biji dan biasanya ditanam secara langsung di lapangan. Benih dapat berkecambah paling cepat pada suhu 30-35 ⁰C. Tanah yang dingin dapat menunda perkecambahan dan dapat menyebabkab buah membusuk. Jenis-jenis tanaman Cucurbitaceae yang penting adalah semangka (Citrullus lanatus), mentimun (Cucumic sativus L.), melon (Cucumis melo L.), zucchini (Cucurbita pepo), kaboca (Cucurbit maxima), oyong (Luffa acutangula), paria (Momordica charantia) (Rubatzky dan Yamaguchi 1997).
Produksi tanaman Cucurbitaceae di lapangan dapat dipengaruhi oleh banyak faktor, diantaranya adalah musim, keadaan di pertanaman, adanya serangan dari organisme pengganggu tanaman (OPT), dan kualitas dari benih yang digunakan. Patogen yang menyerang tanaman Cucurbitaceae dapat berasal dari kelompok bakteri, cendawan, nematoda dan virus. Contoh bakteri terbawa benih yang menyerang tanaman Cucurbitaceae adalah Pseudomonas syringae pv. lachrymans
menyebabkan penyakit bercak daun pada tanaman mentimun, Pseudomonas pseudoalcaligenes subsp. citrulli menyebabkan penyakit hawar pada bibit tanaman semangka, dan Xanthomonas campestris pv. cucurbitae menyebabkan penyakit bercak daun pada kaboca. Contoh cendawan terbawa benih yang menyerang tanaman Cucurbitaceae adalah Colletotrichum lagenarium
menyebabkan penyakit antraknosa, Didymella bryoniae penyebab penyakit bercak daun, Fusarium oxysporum f.sp cucumerinum penyebab penyakit layu pada mentimun, dan Pythium aphanidermatum penyebab damping-off. Virus tular benih yang dapat menyebabkan penyakit pada tanaman Cucurbitaceae adalah
Cucumber green mottle mosaic virus (CGMMV), Cucumber leaf spot virus
(CLSV), Cucumber mosaic virus (CMV), Melon necrotic spot virus (MNSV),
Muskmelon necrotic spot virus, Papaya ringspot virus (PRSV), Squash mosaic virus (SqMV), Tobacco ringspot virus (TRSV), Watermelon mosaic virus
2
penting. Keunggulan penggunaan benih bermutu adalah dapat menjamin keberhasilan petani, keturunan benih diketahui, pertumbuhan benih seragam, menghasilkan benih yang sehat, masak dan panen serempak, dan mempunyai produktivitas tinggi. Benih bermutu memiliki beberapa kriteria unggul yaitu mencakup kriteria mutu genetis, mutu fisiologis, mutu fisik dan kesehatan benih. Mutu genetis menggambarkan sifat-sifat unggul yang diwariskan oleh tanaman induk, mutu fisiologis menunjukkan viabilitas dan vigor benih. Mutu fisik mencakup struktur morfologis, ukuran, berat, dan penampakan benih. Kesehatan benih menunjukkan potensi benih sebagai pembawa patogen dan penyakit tanaman (Susetyo 2012).
Berbagai metode yang dapat digunakan untuk mendeteksi patogen terbawa benih adalah pemeriksaan benih kering, pemeriksaan secara perendaman, pemeriksaan dengan cara inkubasi (metode kertas, metode agar, metode inkubasi dengan media batu bata, pasir, tanah, dan metode growing on test) (Sutopo 2004). Salah satu cara untuk mendeteksi benih yang membawa virus adalah dengan metode growing on test. Pada metode ini benih ditumbuhkan pada media tanam. Benih harus ditumbuhkan terlebih dahulu karena virus tumbuhan tidak dapat hidup aktif di luar inangnya, tidak dapat ditumbuhkan pada media agar cawan petri, tetapi harus dimasukkan dalam sel-sel hidup (Bos 1990).
Melalui metode growing on test, telah dilaporkan beberapa kasus virus yang terbawa benih. CMV terbukti terbawa pada benih kacang sebesar 30% di India (Abdullahi et al. 2001), tomat terbukti membawa TMV berkisar antara 19,5-27% di Turki (Sevik dan Kose-Tohumcu 2011), Lockhart (1985) juga melaporkan sebesar 20-23% SqMV dapat terbawa benih Chenopodium spp. di Morocco. Selain itu, Alvarez dan Campbell (1978) menyatakan SqMV juga terbawa benih
cantaloupe (C. melo) sebesar 10,6% di California. Tobias et al. (2003) juga melaporkan sekitar 0,3% sampai 15,3% ZYMV terbawa benih Cucurbita pepo
conv. citrullinina var. styriaca di Jerman. Menurut Lestari (2011) SqMV terbukti ditemukan pada 13,3% benih oyong dan semangka, 33,3% pada benih zucchini, 73,3% pada benih kaboca, dan 100% pada benih mentimun dan melon. ZYMV hanya ditemukan pada benih oyong dan zucchini berturut-turut sebesar 13,3% dan 26,67%.
Fakta yang berhubungan dengan efisiensi penularan virus melalui benih masih perlu diperkuat melalui berbagai kegiatan penelitian. Penelitian ini membahas tentang 3 virus yang menginfeksi tanaman Cucurbitaceae, yaitu CMV, ZYMV, dan SqMV pada 6 jenis benih Cucurbitaceae yang berbeda dengan penelitian-penelitian sebelumnya.
Tujuan Penelitian
3
Manfaat Penelitian
4
BAHAN DAN METODE
Tempat dan Waktu
Penelitian dilaksanakan di Laboratorium Virologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor dan di rumah kaca, Kebun Percobaan Cikabayan, Darmaga. Penelitian dimulai dari bulan Maret sampai Desember 2012.
Deteksi Virus yang Menginfeksi Tanaman Cucurbitaceae
Sampel berasal dari pertanaman mentimun milik petani di desa Situ Gede, Kecamatan Dramaga, Kabupaten Bogor. Daun mentimun yang dikumpulkan adalah daun yang menunjukkan gejala infeksi virus, yaitu mosaik hijau tua dan hijau muda, daun berwarna hijau gelap, mosaik hijau tua dan kuning, mosaik hijau muda dan kuning. Sampel tanaman yang berasal dari lapangan dibawa ke Laboratorium Virologi Tumbuhan untuk ditimbang kemudian disimpan pada suhu -80 ⁰C atau langsung digunakan untuk deteksi virus.
Sampel yang telah ditimbang digunakan untuk deteksi virus menggunakan antiserum, yaitu CMV, ZYMV, dan SqMV dengan teknik Indirect Enzyme-linked Immunosorbent Assay (I-ELISA). Deteksi virus ini dilakukan untuk mengetahui ada atau tidaknya ketiga macam virus pada sampel lapangan.
Deteksi Virus Tular Benih
Benih yang diuji terdiri dari beberapa jenis tanaman Cucurbitaceae, yaitu mentimun (Cucumis sativus L.), oyong (Luffa acutangula), melon (Cucumis melo
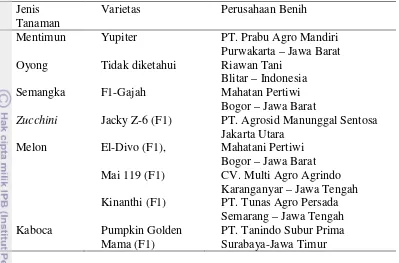
L.), semangka (Citrullus lanatus), zucchini (Cucurbita pepo) dan kaboca (Cucurbita maxima Duch.). Benih yang diuji merupakan benih yang umum ditanam petani dan diproduksi oleh produsen benih di Indonesia (Tabel 1).
Jumlah benih yang diuji adalah 50 benih dari masing-masing jenis tanaman. Benih tersebut ditumbuhkan pada media tanah steril yang mengandung kompos dengan perbandingan 1:1. Setelah daun pertama pada tanaman muncul kemudian dilakukan pengambilan sampel pada tiap-tiap tanaman. Sampel yang telah diambil kemudian ditimbang sebesar 0,1 g dan disimpan pada suhu -80 ⁰C atau langsung digunakan untuk deteksi virus.
Deteksi virus dilakukan menggunakan metode I-ELISA. Pengujian dilakukan menggunakan tiga jenis antiserum yaitu antiserum CMV, ZYMV, dan SqMV untuk mengetahui persentase tular benih masing-masing virus (CMV, ZYMV, dan SqMV). Persentase virus yang ditularkan melalui benih dihitung dengan rumus sebagai berikut:
Persentase virus tular benih = jumlahbenihterinfeksi
5
Tabel 1 Daftar benih Cucurbitaceae yang digunakan pada pengujian virus tular benih
Jenis Tanaman
Varietas Perusahaan Benih
Mentimun Yupiter PT. Prabu Agro Mandiri Purwakarta – Jawa Barat Oyong Tidak diketahui Riawan Tani
Blitar – Indonesia Semangka F1-Gajah Mahatan Pertiwi
Bogor – Jawa Barat
Zucchini Jacky Z-6 (F1) PT. Agrosid Manunggal Sentosa Jakarta Utara
Pengukuran Titer Virus Tular Benih
Benih-benih yang terbukti membawa virus dan memiliki efisiensi penularan paling tinggi untuk masing-masing virus pada pengujian sebelumnya kemudian ditanam kembali sebanyak 50 benih untuk masing-masing jenis benih sesuai dengan metode yang telah dijelaskan sebelumnya. Benih ditanam hingga muncul daun pertama. Sampel tanaman yang diambil merupakan daun muda yang baru muncul. Sampel diambil saat tanaman berumur 2 minggu setelah tanam (MST), 3 MST, 4 MST, dan 5 MST. Sampel tanaman yang telah diambil kemudian ditimbang sebesar 0,1 g dan disimpan pada suhu -80 ⁰Catau langsung digunakan untuk deteksi virus. Deteksi virus untuk sampel tanaman 2 dan 3 MST menggunakan metode I-ELISA; sedangkan untuk sampel tanaman 4 dan 5 MST menggunakan metode Dot Immunobinding assay (DIBA). Perbedaan penggunaan metode ini didasarkan pada tingkat sensitivitas masing-masing metode. Metode ELISA lebih sensitif dibandingkan dengan DIBA sehingga digunakan untuk mendeteksi virus dengan konsentrasi yang rendah pada tanaman yang berumur 2 dan 3 MST.
Deteksi Virus dengan Metode Indirect ELISA (I-ELISA)
Metode ELISA dilakukan berdasarkan panduan prosedur kit ELISA (Agdia Inc). Pertama-tama antigen disiapkan dengan menggerus sampel daun yang diberi GEB (general extract buffer/polyvinylpyrrolidone 20 g, chicken egg albumin 2 g,
Na2SO3 1.3 g, yang dilarutkan dalam 100 ml PBST) pH 7.4 dengan perbandingan
6
menggunakan PBST (phosphate buffer salien tween/NaCl 8 g, Na2HPO4 1.15 g,
KH2PO4 0.2 g, KCl 0.2 g, air destilata 1.000 ml + Tween 20 0.5 ml) sebanyak 5
kali. Setelah dicuci, protein yang terikat pada sumur plat mikrotiter diblok dengan menambahkan 100 µl blocking solution (PBST yang mengandung susu skim 2%). Plat mikrotiter kemudian diinkubasi pada suhu 37 oC selama 30 menit. Plat kemudian dicuci kembali menggunakan PBST sebanyak 5 kali.
Antiserum masing-masing virus (CMV, ZYMV, SqMV) kemudian dimasukkan sebanyak 100 µl ke dalam sumuran plat mikrotiter sesuai peta yang telah dibuat. Antiserum sebelumnya diencerkan dengan ECI (bovine serum albumin 0.2 g, polyvinylpyrrolidone 2 g, PBST 100 ml) sesuai perbandingan yang tertera pada kemasan antiserum yaitu 1:500, 1:200, 1:200 berturut-turut untuk CMV, ZYMV, dan SqMV. Plat mikrotiter kemudian diinkubasi pada suhu 37 oC selama 2 jam, selanjutnya dicuci dengan menggunakan PBST seperti tahapan sebelumnya.
Antiserum kedua (goat anti-rabbit globulin/GAR) kemudian dimasukkan pada sumuran sebanyak 100 µl setelah dilakukan pengenceran menggunakan bufer konjugat dengan perbandingan 1:2500. Plat mikrotiter kemudian diinkubasi pada suhu 37 oC selama 2 jam kemudian dicuci menggunakan PBST sebanyak 5 kali.
Tahapan terakhir adalah memasukkan 100 µl substrat solution ( p-Nitrophenyl Phospate 5 mg dalam bufer substrat 5 ml MgCl2 0.1 g, NaN3 0.2 g,
dietholamine 97 ml, air destilata 1.000 ml) ke dalam sumuran plat mikrotiter. Plat mikrotiter tersebut kemudian diinkubasi dalam ruang gelap pada suhu ruang selama 15 menit sampai 60 menit. Nilai absorbansi dibaca menggunakan ELISA
reader model 550 (Bio-Rad, USA) pada panjang gelombang 405 nm. Sampel dinyatakan positif jika nilai absorbansi sampel 1.5 kali lebih besar dari nilai absorbansi nilai kontrol negatif.
Deteksi Virus dengan Metode Dot Immunobinding Assay (DIBA)
Jaringan daun tanaman uji digerus dalam tris buffer saline (TBS dengan perbandingan 1:10). Cairan perasan tanaman selanjutnya diteteskan ke atas membran nitroselulosa sebanyak 10 µl. Setelah tetesan sampel kering, membran direndam di dalam 10 ml larutan blocking not fat milk 2% dalam TBS yang mengandung Triton X-100 dengan konsentrasi akhir 2%. Membran kemudian diinkubasi pada suhu ruang sambil digoyang dengan kecepatan 50 rpm selama 2 jam. Membran kemudian dicuci 5 kali dengan dH2O, tiap pencucian berlangsung
5 menit sambil digoyang dengan kecepatan 100 rpm. Membran selanjutnya di rendam dalam 5 ml TBS yang mengandung antiserum 5 µl ditambah non fat milk
7
warna putih menjadi ungu pada membran nitroselulosa yang telah ditetesi cairan perasan dan reaksi dapat dihentikan dengan merendam membran dalam dH2O.
Penentuan titer (kadar) virus di dalam jaringan tanaman didasarkan pada intensitas warna reaksi DIBA pada membran nitroselulosa. Intensitas warna ungu yang kuat akan mendapatkan skor yang lebih tinggi dibandingkan intensitas warna ungu yang lemah dengan kisaran skor 0 sampai 6 (Gambar 1).
Intensitas perubahan warna pada membran
Skor 6 5 4 3 2 1 0
8
HASIL DAN PEMBAHASAN
Gejala Infeksi Virus pada Tanaman Cucurbitaceae di Lapangan
Sebanyak 6 sampel tanaman mentimun yang menunjukkan gejala yang berbeda berhasil diperoleh dari lapangan. Gejala pada daun mentimun diantaranya yaitu mosaik hijau tua dan hijau muda, dengan warna hijau tua lebih banyak di daerah sekitar tulang daun (vein banding) dan mengalami pelepuhan (Gambar 2A), daun berwarna hijau tua dan tidak mengalami pelepuhan (Gambar 2B), adanya mosaik hijau tua dan kuning, dengan warna hijau tua lebih banyak terdapat di sekitar tulang daun, daun mengalami pelepuhan (Gambar 2C), adanya mosaik hijau tua dan kuning dengan warna hijau tua lebih dominan dan lebih banyak terdapat di daerah sekitar tulang daun, daun mengalami pelepuhan (Gambar 2D), daun berwarna kuning namun tulang daun masih berwarna hijau (Gambar 2E), adanya mosaik antara hijau muda dan kuning, dengan warna hijau muda terdapat didaerah sekitar tulang daun dan tulang daun masih berwarna hijau tua (Gambar 2F).
Gambar 2 Gejala pada tanaman mentimun di Situ Gede. A) mosaik hijau tua dan hijau muda, B) hijau tua, C) dan D) mosaik hijau tua dan kuning, E) mosaik hijau muda dan kuning, F) mosaik hijau tua, hijau muda dan kuning.
B
C
D
E
F
9
Tabel 2 Hasil deteksi virus dari tanaman mentimun berdasarkan reaksi ELISA
Jenis Sampel Jenis Virus
CMV SqMV ZYMV
Keterangan: CMV, Cucumber mosaic virus; SqMV, Squash mosaic virus; ZYMV, Zucchini
mosaic virus
Tiga jenis virus berhasil terdeteksi dari tanaman mentimun yaitu CMV, ZYMV, dan SqMV (Tabel 2). Sampel daun A,C, dan D terinfeksi oleh ketiga jenis virus; sampel E dan F terinfeksi dua jenis virus (CMV dan SqMV); sedangkan sampel daun B tidak memberikan reaksi positif terhadap ketiga jenis virus (Lampiran 1). Gejala pada sampel daun A, C, dan D relatif lebih parah dibandingkan sampel daun B,E, dan F. Hubungan antara jenis virus yang terdeteksi pada sampel daun mentimun dengan gejala yang diamati tidak dapat disimpulkan karena tanaman mentimun di lapangan dapat terinfeksi oleh beberapa jenis virus lainnya. Aulia (2004 dalam Lestari 2011) melaporkan bahwa virus-virus yang menginfeksi tanaman Cucurbitaceae di Bogor adalah CMV, PRSV-W, SqMV, TRSV, WMV-2, ZYMV.
Infeksi virus di lapangan dapat terjadi melalui berbagai cara. Benih merupakan faktor utama infeksi virus di lapangan. Apabila benih telah membawa virus maka benih tersebut dapat menjadi sumber infeksi di lapangan. Selain benih, infeksi virus di lapangan dapat terjadi karena adanya serangga vektor. Serangga vektor dapat menularkan virus ketika serangga tersebut makan daun yang telah terinfeksi virus, kemudian serangga memakan daun lain yang sehat. Kutudaun (Hemiptera: Aphididae) dilaporkan sebagai serangga vektor CMV dan ZYMV. Kumbang (Coleoptera: Chrysomelidae) merupakan serangga vektor SqMV (Kucharek dan Purcifull 1997). Adanya tanaman inang lain disekitar pertanaman juga dapat menjadi sumber infeksi di lapangan.
Efisiensi Penularan Virus Melalui Benih Cucurbitaceae
10
terdeteksi pada sampel benih melon varietas Kinanthi (Lampiran 4). Diantara 8 jenis benih Cucurbitaceae yang diuji, terdapat 3 jenis benih yang bebas virus yaitu melon varietas El Divo, melon varietas Mai 119, dan semangka varietas Gajah, karena ketiga benih tersebut memiliki NAE yang rendah untuk ketiga virus (Lampiran 4 dan 6).
Pengujian SqMV dan ZYMV tular benih Cucurbitaceae di Indonesia telah dilaporkan oleh Lestari (2011) dengan hasil yang hampir sama. Benih mentimun varietas Penus dan melon Emerald Jewel (F1) terinfeksi SqMV dengan persentase yang tinggi (100%) tetapi infeksi ZYMV tidak terdeteksi. Benih oyong varietas Jaka (F1) juga terinfeksi SqMV dan ZYMV masing-masing sebesar 13,3%, benih kaboca dan semangka terinfeksi SqMV berturut-turut 73,3% dan 13,3%. Alvarez dan Campbell (1978) melaporkan benih yang membawa SqMV sebesar 10,6%. Simmons et al. (2011) juga melaporkan benih C.pepo subsp texana membawa ZYMV sebesar 1,6% dan Tobias et al. (2003) melaporkan infeksi ZYMV pada benih Cucurbita pepo convar. citrullinina var styriaca yang berasal dari tanaman yang sakit mencapai 15%.
Virus tular benih dapat berperan sebagai inokulum primer di lapangan. Inokulum selanjutnya dapat menyebar di lapangan dengan bantuan serangga-serangga vektor. Alat-alat pertanian yang digunakan petani untuk mengolah lahannya juga dapat berperan dalam penyebaran inokulum. Inokulum-inokulum dapat menempel pada alat-alat pertanian, apabila petani kembali menggunakan alat-alat pertanian tanpa membersihkannya terlebih dahulu maka inokulum yang ada pada alat-alat pertanian dapat menempel pada tanaman yang sehat.
Tabel 3 Proporsi benih Cucurbitaceae yang terinfeksi virus
Tanaman Varietas Σ Benih terinfeksi/Σ Benih yang diuji (%)
Gambar 3 Gejala daun tanaman Cucurbitaceae di rumah kaca. Daun mentimun (A dan B); daun kaboca (C)
11
Tanaman di rumah kaca selain diambil sebagai sampel untuk ELISA dan DIBA juga diamati gejala yang timbul. Daun mentimun memiliki gejala mosaik yang ringan, adanya mosaik hijau gelap dengan hijau muda kekuningan. Selain adanya mosaik, bagian pinggir daun mulai berubah menjadi agak kekuningan (Gambar 3A). Gejala vein clearing, daerah sekitar pertulangan daun berwarna hijau muda kekuningan (Gambar 3B). Babadoost (1999) menyatakan bahwa gejala SqMV pada daun yang lebih muda adalah vein clearing dan bercak kekuningan. Gejala yang ditimbulkan masih ringan karena virus baru menginfeksi tumbuhan dan bereplikasi. Gejala tidak terlihat ketika tanaman berumur 2 MST, karena tanaman ketika berumur 2 MST masih muda sehingga gejala pada daun belum terlihat dengan jelas. Tanaman kaboca juga menunjukkan adanya gejala terinfeksi virus. Daun menunjukkan gejala adanya bercak-bercak kuning (Gambar 3C). Menurut Provvidenti (1996) daun yang terinfeksi CMV mengalami penghambatan pertumbuhan, adanya bercak kuning pada daun, daun mengalami malformasi dan ukurannya mengecil.
Potensi Virus Tular Benih Sebagai Sumber Inokulum
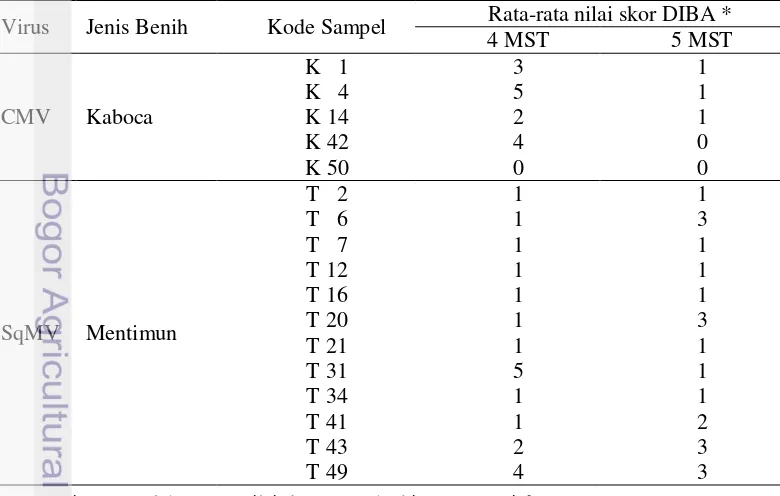
Virus terbawa benih sangat berpotensi menjadi sumber penyakit di lapangan, karena virus sudah berada di dalam jaringan tanaman sejak awal pertumbuhan tanaman. Infeksi CMV pada benih kaboca dan SqMV pada benih mentimun dideteksi pada 2 MST sampai 5 MST untuk mengetahui potensi kedua virus tersebut sebagai sumber inokulum di lapangan. Deteksi ELISA pada 2 dan 3 MST menunjukkan reaksi positif CMV dan SqMV berturut-turut pada benih kaboca dan mentimun (Tabel 4). Titer kedua virus pada 3 MST cenderung lebih tinggi dibandingkan pada 2 MST. Hal tersebut mengindikasikan bahwa titer virus pada benih berpotensi untuk meningkat.
Tabel 4 Rata-rata nilai absorbansi ELISA hasil pengujian sampel benih Cucurbitaceae terhadap antiserum CMV dan SqMV
Virus Jenis Benih Rata-rata Nilai Absorbansi ELISA*
2 MST 3 MST Kontrol negatif
CMV Kaboca 0,2813 0,3189 0,1825
SqMV Mentimun 0,2463 0,2843 0,1523
* MST, minggu setelah tanam
* Reaksi ELISA dianggap positif apabila sampel tanaman yang diuji mempunyai nilai absorbansi ≥ 1,5 kali kontrol negatif
Setelah sampel dideteksi dengan ELISA pada 2 dan 3 MST, kemudian sampel yang sama dideteksi dengan DIBA pada 4 dan 5 MST. Sampel yang digunakan untuk pengujian ini adalah sampel yang memiliki nilai absorbansi ELISA yang tinggi dan menunjukkan reaksi positif pada pengujian 2 MST dan 3 MST. Hasil pengujian virus yang ditularkan melalui benih menggunakan metode DIBA adalah benih yang positif mempunyai signal adanya perubahan warna menjadi ungu (Gambar 4). Pengujian ini menggunakan 5 sampel benih yang terinfeksi CMV dan 12 sampel benih yang terinfeksi SqMV.
12
Gambar 4 Membran nitroselulosa yang menunjukkan perbedaan intensitas perubahan warna (skor 1-5) pada pengujian menggunakan metode DIBA
Hampir semua sampel pada 4 MST memiliki skor yang tinggi, hanya beberapa saja yang memiliki skor yang rendah. Skor yang tinggi pada 4 MST mengalami penurunan skor pada pengujian 5 MST. Sebaliknya ada beberapa sampel yang memiliki skor rendah pada pengujian 4 MST namun memiliki skor yang tinggi pada 5 MST (Tabel 5). Penurunan skor pada 4 MST ke 5MST dapat disebabkan adanya kecenderungan terjadi recovery. Recovery adalah pemulihan tanaman terhadap virus. Daun yang baru tumbuh memiliki gejala yang lebih sedikit bahkan tidak ada walaupun mungkin virus masih berada di dalam tumbuhan.
Tabel 5 Rata rata nilai skor DIBA sampel benih Cucurbitaceae terhadap antiserum CMV dan SqMV
Virus Jenis Benih Kode Sampel Rata-rata nilai skor DIBA *
4 MST 5 MST
13
KESIMPULAN DAN SARAN
Tanaman mentimun di desa Situgede, Kecamatan Dramaga, Kabupaten Bogor terinfeksi oleh 3 macam virus, yaitu CMV, ZYMV, dan SqMV. Dua virus, yaitu CMV dan SqMV terbukti dapat ditularkan melalui benih Cucurbitaceae, yaitu mentimun, oyong, melon varietas Kinanthi, zucchini, dan kaboca yang beredar di pasaran dengan efisiensi penularan yang berbeda. Efisiensi penularan CMV melalui benih berkisar 2-12%, sementara SqMV berkisar 6-80%. Virus terbawa benih masih dapat terdeteksi hingga 5 MST sehingga benih dapat berperan sebagai sumber inokulum yang potensial di lapangan.
14
DAFTAR PUSTAKA
Abdullahi I, Ikotun T, Winter S, Thottappilly G, Atiri GI. 2001. Investigation on seed transmission of Cucumber mosaic virus in Cowpea. African Crop Sci J. 9(4):677-684.
Agarwal VK, Sinclair JB. 1997. Principles of Seed Pathology. Ed ke-2. CRC Press Inc.
Alvarez M, Campbell RN. 1978. Transmission and distribution of Squash mosaic virus in seeds of cantaloupe. Phytopathology. 68(3):257-263.
Aulia R. 2004. Inventarisasi dan deteksi virus penyebab mosaik pada family cucurbitaceae di Kotamadya Bogor, Pasir Muncang dan Cibodas [skripsi]. Bogor (ID): Fakultas Pertanian, Institut Pertanian Bogor.
Babadoost M. 1999. Mosaic disease of cucurbits. University of Illionis Urbana Champaign (USA): Department of Crop Sciences [diunduh pada 28 November 2012]. Tersedia pada alamat: http://web.aces.uiuc.edu/vista/pdf_pubs/926.pdf
Bos L. 1990. Pengantar Virologi Tumbuhan. Triharso, penerjemah. Yogyakarta (ID): Gajah Mada University Press. Terjemahan dari: Introduction to Plant Virology.
Coutts B. 2006. Virus disease of cucurbit crops. Farmnote 166 Juni 2006. [Internet]. Perth (AU): Department of Agriculture. [ diunduh pada 13
Januari 2013]. Tersedia pada alamat: http://www.agric.wa.gov.au/objtwr/imported_assets/content/hort/veg/pw/fn
2006_viruscucurbits_bcoutts.pdf
Kucharek T, Purcifull D. 1997. Aphid-transmitted viruses of cucurbits in Florida. Gainesville (US): University of Florida.
Lestari SM. 2011. Keberadaan beberapa virus dan efisiensi tular benih Squash mosaic virus pada cucurbitaceae [skripsi]. Bogor (ID): Fakultas Pertanian, Institut Pertanian Bogor.
Lockhart BEL, Jebbour F, Lennon AM. 1985. Seed transmission of Squash mosaic virus in Chenopodium spp. Plant Disease 69(11):946-947.
Prabowo DP. 2009. Survei hama dan penyakit pada pertanaman mentimun (Cucumis sativus Linn.) di desa Ciherang, Kecamatan Pacet, Kabupaten Cianjur, Jawa Barat [skripsi]. Bogor (ID): Fakultas Pertanian, Institut Pertanian Bogor.
Provvidenti R. 1996. Disease Caused by Viruses. Di dalam: Zitter TA, Hopkins DL, Thomas CE, editor. Compendium of Cucurbit Disease. US: The American Phytopathological Society Press.
Purba ERD. 2011. Pengaruh infeksi Squash mosaic comovirus terhadap perkembangan penyakit mosaik pada lima varietas mentimun (Cucumis sativus L.) [skripsi]. Bogor (ID): Fakultas Pertanian, Institut Pertanian Bogor.
15
Sevik MA, Kose-Tohumcu E. 2011. The ELISA analysis results in tomato (Lycopersicon esculentum Mill.) seed health testing for Tobacco mosaic virus. Zemdirbyste=Agriculture. 98(3):301-306.
Simmons HE, Holmes EC, Gildow FE, Bothe-Goralczyk MA, Stephenson AG. 2011. Experimental verification of seed transmission of Zucchini yellow mosaic virus. Plant Disease. 95(6):751-754. doi: 10.1094/PDIS-11-10-0843.
Sutopo L. 2004. Teknologi Benih. Jakarta (ID): PT Raja Grafindo Persada. Susetyo HP. 2012. Pengolahan Benih Melati [internet]. Jakarta (ID): Direktorat
Jenderal Hortikultura; [diunduh pada 17 Januari 2013]. Tersedia pada: http://ditlin.hortikultura.deptan.go.id/index/php?option=com_content&view =article&id=499:pengelolaan-benih-melati&catid=42:demo-category.
16
17
Lampiran 1 Nilai absorbansi ELISA sampel dari lapangan
Sampel Nilai Absorbansi ELISA
CMV ZYMV SqMV
Lampiran 2 Nilai absorbansi ELISA daun mentimun untuk pengujian benih Sampel Nilai absorbansi ELISA
CMV ZYMV SqMV
Lampiran 3 Nilai absorbansi ELISA daun oyong untuk pengujian benih Sampel Nilai absorbansi ELISA
CMV ZYMV SqMV
Lampiran 4 Nilai absorbansi ELISA daun melon untuk pengujian benih Varietas Sampel Nilai absorbansi ELISA
18
Lampiran 5 Nilai absorbansi ELISA daun zucchini untuk pengujian benih Sampel Nilai absorbansi ELISA
CMV ZYMV SqMV
Zucchini 1 0.1560 0.0690 0.1285
Zucchini 2 0.1420 0.0710 0.1270
Zucchini 3 0.1770 0.0900 0.1920
Zucchini 4 0.1420 0.0685 0.1815
Zucchini 5 0.1570 0.0745 0.1590
Lampiran 6 Nilai absorbansi ELISA daun semangka untuk pengujian benih Sampel Nilai absorbansi ELISA
CMV ZYMV SqMV
Semangka 1 0.1165 0.1020 0.2280 Semangka 2 0.1070 0.1050 0.2550 Semangka 3 0.1255 0.1005 0.2020 Semangka 4 0.1200 0.1160 0.2075 Semangka 5 0.1385 0.1405 0.2055
Lampiran 7 Nilai absorbansi ELISA daun kaboca untuk pengujian benih Sampel Nilai absorbansi ELISA
CMV ZYMV SqMV
19
RIWAYAT HIDUP
Penulis dilahirkan di Purworejo pada tanggal 29 Juli 1990 dari Bapak Sutomo dan Ibu Nurdiyani dan merupakan anak kedua dari dua bersaudara. Penulis menyelesaikan pendidikan di SMA Negeri 2 Purworejo dan lulus pada tahun 2008. Penulis diterima sebagai mahasiswa Departemen Proteksi Tanaman di Institut Pertanian Bogor melalui Undangan Seleksi Masuk IPB (USMI) pada tahun 2008.