GENERASI F4 DARI SILANG BALIK KETIGA
NAZARUDIN
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa tesis berjudul Analisis Pewarisan Gen CsNitr1-Lpada Tanaman Padi Ciherang Transgenik Generasi F4 dari Silang Balik Ketiga adalah benar karya saya bersama komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
NAZARUDIN. Analisis Pewarisan GenCsNitr1-L pada Tanaman Padi Ciherang Transgenik Generasi F4 dari Silang Balik Ketiga. Dibimbing oleh SUHARSONO dan SUSTIPRIJATNO.
Upaya peningkatan produksi padi saat ini memiliki berbagai kendala, seperti konversi lahan sawah, perubahan iklim dan penurunan kualitas lahan yang berdampak terhadap penurunan produktivitas. Petani memberikan tambahan pupuk kimiawi untuk meningkatkan produktivitas padi terutama pupuk nitrogen. Kondisi sawah dengan penggenangan untuk menanam padi dapat mengakibatkan hilangnya unsur hara nitrogen karena terlarut, menguap dan mengalami denitrifikasi, sehingga sebagian besar dari jumlah pupuk nitrogen yang diaplikasikan di lahan sawah tidak dapat diserap tanaman secara optimal.
Gen Nitr1-L adalah gen yang menyandikan nitrit transporter yang termasuk dalam kelompok proton-dependen oligopeptide transporter (POT), sehingga penyerapan nitrit oleh tanaman yang mengandung transporter ini menjadi efisien. Gen yang menyandikan protein ini (CsNitr1-L) di bawah kontrol promoter 35S CaMV telah diintroduksikan ke tanaman padi (Oriza sativa L.) subspesies japonica cv. Nipponbare. Untuk mentransfer gen ini, padi transgenik japonica cv. Nipponbare telah disilangkan dengan padi subspesies indica varietas Ciherang, diikuti dengan silang balik dan menyerbuk sendiri sampai generasi BC3F4. Tujuan penelitian ini adalah untuk menganalisis introgresi genCsNitr1-L di tanaman padi transgenik generasi BC3F4.
Tanaman padi transgenik generasi BC3F4 yang dipilih berdasarkan ketahanan terhadap higromisin. Lebih dari 90% dari populasi BC3F4 adalah tanaman padi transgenik putatif. Tanaman transgenik dikonfirmasi dengan analisis PCR menggunakan primer yang sesuai dengan gen hpt. Produktivitas biji galur transgenik lebih tinggi daripada non-transgenik. Berdasarkan produktivitas tertinggi dari setiap galur transgenik, G3, G7, G8, G11, empat tanaman transgenik dianalisis dengan PCR. Analisis PCR menunjukkan bahwa keempat tanaman transgenik mengandung CsNitr1-L di bawah kendali promoter 35S CaMV. Hasil penelitian menunjukkan bahwa transgen CsNitr1-L telah diwariskan kepada generasi BC3F4.
NAZARUDIN. Inheritance CsNitr1-L Gene in Transgenic Rice Plants Ciherang Generation of BC3F4. Under Direction of SUHARSONO and SUSTIPRIJATNO
Efforts to increase rice production today meet some constraints, such as lans use conversion, climate change and degradation of quality of land affecting the productivity. Farmers provide additional chemical fertilizer to increase rice productivity especially nitrogen fertilizer. Field conditions with submarging system for rice plant can result in the loss of nitrogen fertilizer due to dissolve, evaporate and undergo denitrification, so most of the amount of nitrogen fertilizer applied in rice fields can not be optimally absorbed by plants.
Nitr1-Lgene is a gene that encode nitrites transporter which is included in the group of proton oligopeptide transporter (POT), so the absorption of nitrites by the plants containing this transporter becomes efficient. The gene encoding this protein (CsNitr1-L) under the control of 35S CaMV promoter had been introduced into rice plants (Oriza sativa L.) subspecies Japonica cv. Nipponbare. To transfer this gene, the japonica transgenic rice had been crossed with Indica rice cv. Ciherang, followed by back-cross and self pollination until BC3F4 generation. The aim of this study was to analyse introgression of CsNitr1-L gene in the transgenic rice BC3F4 generation.
The transgenic rice plants in BC3F4 generation were selected based on the resistance to hygromicin. More than 90% population of BC3F4 are putatively transgenic rice plants. These transgenic plants were confirmed by PCR analysis by using primers corresponding tohptgene. The seed productivity of transgenic lines was higher than that of nontransgenic ones. Based on the highest productivity of every transgenic line of G3, G7, G8, G11, four transgenic plants were analysed by PCR. PCR analysis showed that these four transgenic plants contained CsNitr1-L under the control of 35S CaMV promoter. The result indicated that the transgene ofCsNitr1-Lwas introgressed into BC3F4 generation.
Keywords : Nitr1-L gene, transgenic rice, inheritance, nitrite transporter,
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Bioteknologi
GENERASI F4 DARI SILANG BALIK KETIGA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Nama : Nazarudin NRP : P051090061
Disetujui oleh Komisi Pembimbing
Prof. Dr. Ir. Suharsono, DEA Ketua
Dr. Sustiprijatno, MSc Anggota
Diketahui oleh
Ketua Program Studi Bioteknologi
Prof. Dr. Ir. Suharsono, DEA
Dekan Sekolah Pascasarjana
Dr. Ir. Dahrul Syah, MScAgr
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga penulis dapat menyelesaikan keseluruhan rangkaian studi untuk mendapatkan gelar magister. Terima kasih disampaikan kepada kedua pembimbing, yaitu: Bapak Prof Dr Ir Suharsono, DEA dan Bapak Dr Sustiprijatno, MSc. yang telah memberikan kesempatan, kepercayaan dan bimbingannya. Tidak lupa juga ungkapan terimakasih sebesar-besarnya ditujukan kepada rekan-rekan PS. Bioteknologi dan teman-teman yang tidak bisa penulis sebutkan satu persatu.
Teruntuk Ibu yang doanya selalu mengiringi perjalan ananda, penulis mengucapkan terimakasih atas waktu, pikiran, materi dan semangat yang telah diberikan. Akhir kata, semoga tesis ini bermanfaat bagi kemajuan pertanian dan bioteknologi di Indonesia.
Bogor, Juli 2013
DAFTAR TABEL xiii
Padi(Oriyza sativa) 4
Asimilasi Nitrat 6
Seleksi Kecambah Transgenik dengan Higromisin 10
Perlakuan Pupuk 10
Analisis Fenotipe 10
Rancangan Percobaan 11
Isolasi DNA Tanaman 11
Analisis GenhptdanCsNitr1-Ldengan PCR 12
4 HASIL DAN PEMBAHASAN 13
Seleksi Resistensi Kecambah Padi Ciherang transgenik Terhadap
higromisin 13
Jumlah Biji Tiap Malai 18
Berat Biji Tiap Rumpun 19
Analisi Integrasi genCsNitr1-Lpada Tanaman Transgenik 19
5 SIMPULAN 21
DAFTAR PUSTAKA 22
LAMPIRAN 25
1 Seleksi ketahanan kecambah terhadap higromisin pada tanaman
padi Ciherang 13
2 Pengaruh genotipe terhadap tinggi (cm) tanaman pada setiap dosis
pemupukan urea 15
3 Pengaruh genotipe terhadap jumlah anakan tiap rumpun pada
setiap dosis pemupukan urea 15
4 Pengaruh genotipe terhadap berat kering tanaman tiap rumpun
pada setiap dosis pemupukan urea 16
5 Pengaruh genotipe terhadap umur berbunga (hari) pada setiap
dosis pemupukan urea 16
6 Pengaruh genotipe terhadap panjang malai tanaman tiap rumpun
pada setiap dosis pemupukan urea 17
7 Pengaruh genotipe terhadap bobot seratus biji tanaman tiap
rumpun pada setiap dosis pemupukan urea 18 8 Pengaruh genotipe terhadap jumlah biji tiap malai pada setiap
dosis pemupukan urea 18
9 Pengaruh genotipe terhadap berat biji tiap rumpun pada setiap
dosis pemupukan urea 19
DAFTAR GAMBAR
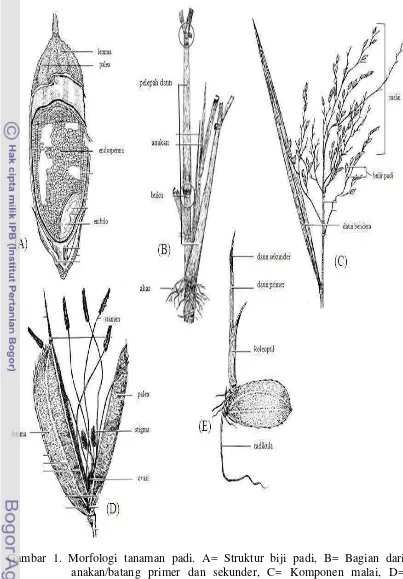
1 Morfologi tanaman padi 5
2 Proses asimilasi nitrat di akar dan daun tanaman 6 3 Perubahan nitrat menjadi amonium yang terjadi di dalam sel 7
4 Peta daerah T-DNA plasmid pIG121HM 9
5 Perkecambahan padi di media selektif MS0 yang mengandung 50 mg/l higromisin dan di media non selektif MS0 yang tidak
mengandung higromisin umur 18 hari. 13
6 Hasil PCR dengan kombinasi primer HPT-F dan primer HPT-R
untuk amplifikasi gen hpt 14
7 Hasil PCR dengan kombinasi primer 35S-F Ca CaMV dan
CsNitr1-L-R 20
1 Latar Belakang
Padi (Oryza sativa L.) merupakan komoditas serealia yang diproduksi terbesar kedua setelah gandum. Asia merupakan sentra produksi dan konsumen terbesar dunia, namun padi juga merupakan tanaman penting dibeberapa wilayah Utara dan Selatan Amerika, Afrika, Australia dan Eropa (Wailes et al. 1998). Sekitar 114 negara di seluruh dunia menanam padi dengan luas panen sekitar 153 juta hektar dan menghasilkan lebih dari 600 juta ton per tahun (FAO 2012). Wilayah Asia memproduksi padi sekitar 90% dari total produksi dunia, dua negara diantaranya yaitu Cina dan India yang menanam padi lebih dari setengah total produksi dunia (IRRI 2012). Produksi padi di Indonesia pada tahun 2012 mencapai 69 juta ton dengan produktivitas 51.36 kuintal per hektar (BPS 2012). Di Indonesia upaya peningkatan produksi padi saat ini terganjal oleh berbagai kendala, seperti konversi lahan sawah yang masih terus berjalan, perubahan iklim, dan kualitas sumberdaya lahan yang semakin menurun, sehingga berdampak terhadap penurunan produktivitas (Pramono et al. 2005; Wangiyana et al. 2008; Azwir dan Ridwan 2009).
Usaha mengatasi penurunan kualitas sumber daya lahan melalui intensifikasi masih memungkinkan yaitu melalui perakitan varietas unggul tanaman padi. Salah satu cara dalam perakitan varieatas unggul adalah rekayasa genetika tanaman yang efisien dalam penggunaan pupuk, khususnya pupuk nitrogen. Efisiensi pupuk nitrogen dapat dilakukan dengan memodifikasi jalur nitrat yaitu memanfaatkan gen-gen transporter yang berkerja pada jalur asimilasi nitrat, seperti tansporter nitrat (NTR), transporter nitrit (Nitr1), transporter ammonium (MRT), transporter amida (GOGAT). Sugiura et al. (2007) telah berhasil mengidentifikasi transporter nitrit (CsNitr1-L) yang berfungsi dalam mempercepat transportasi nitrit menuju kloroplas. Menurut Sustiprijatno et al. (2006) gen CsNitr1-L termasuk kedalam kelompok gen proton-dependen oligopeptide tranporter (POT).
Tanah sawah adalah tanah yang digunakan untuk menanam padi sawah, baik secara terus menerus sepanjang tahun maupun bergiliran dengan tanaman palawija.Tanah sawah di Indonesia saat ini umumnya ditemukan pada tanah yang cukup baik di daerah datar maupun perbukitan yang diteraskan. Umumnya tanah sawah terdapat di Jawa, Bali, Lombok, Sumatera Barat, Sumatera Utara, Aceh, dan Sulawesi Selatan. Biasanya tanah sawah yang digunakan untuk menanam padi adalah dalam keadaan tergenang. Penggenangan tanah mengakibatkan perubahan-perubahan sifat kimia tanah yang mempengaruhi pertumbuhan tanaman padi. Pengaruh negatif dari penggenangan ini adalah mudah hilangnya unsur hara seperti nitrogen karena mudah terlarut, menguap dan mengalami denitrifikasi. Optimasi produktivitas padi lahan sawah merupakan salah satu peluang untuk peningkatan produksi padi. Di Indonesia rata-rata produktivitas padi adalah 4,7 ton/ha, sedangkan potensinya dapat mencapai 6-7 ton/ha (Makarimet al.2000).
besar dalam produksi padi di seluruh dunia (Lea dan Miflin 2011). Hasil produksi padi tergantung pada jumlah nitrogen yang diberikan. Namun, hampir setengah bagian dari jumlah nitrogen yang diaplikasikan di lapangan terutama lahan sawah banyak mengalami kehilangan karena penguapan, denitrifikasi, dan pencucian (Hardjowigeno 2010). Akibat dari tidak efisiennya penggunaan pupuk nitrogen tersebut menyebabkan biaya produksi tinggi, sehingga dapat merugikan dan menurunkan pendapatan petani (Ikhwani 2012).
Nitrogen adalah bagian penting dari kehidupan. Tanaman, hewan dan bakteri menggunakan nitrogen untuk mensintesis asam amino, dan asam-asam amino ini bersatu membentuk protein. Tanaman mengambil nitrogen dalam bentuk ion amonium (NH4+) dan ion nitrat (NO3-). Alur asimilasi nitrat dimulai
oleh reduksi nitrat menjadi nitrit oleh enzim nitrat reduktase di dalam sitoplasma, kemudian nitrit direduksi menjadi amonium oleh enzim nitrit reduktase di dalam kloroplas. Amonium yang dihasilkan merupakan bahan dasar untuk metabolisme protein (Hopkins dan Hiiner 2008). Nitrit adalah produk antara yang sangat penting karena dapat meracuni tanaman, sehingga keberadaannya di sitoplasma harus sekecil mungkin atau tidak ada sama sekali. Nitrit di sitoplasma dapat dipindah dengan cepat oleh transporter nitrit menuju kloroplas sehingga penyerapan nitrat oleh tanaman menjadi semakin besar. Apabila akumulasi nitrit di sitoplasma besar, dapat mengganggu pertumbuhan tanaman. Pada dasarnya tanaman padi memiliki transporter nitrit namun tidak aktif (Sustiprijatno et al. 2006). Asimilasi nitrat pada tanaman terjadi di akar dan daun. Nitrat akan di simpan di vakuola akar atau akan di transfer ke mesofil daun namun sebelumnya nitrat akan direduksi terlebih dahulu menjadi nitrit di sitosol kemudian direduksi lagi menjadi NH4+di dalam kloroplas (Sugiuraet al.2007).
Sustiprijatnoet al. (2006) telah berhasil memodifikasi proses transfer nitrit dari sitosol ke kloroplas pada tanaman padi Oryza sativa L. subspesies japonica cv. Nipponbare dengan memasukkan gen CsNitr1-L yang berasal dari tanaman mentimun. Nitrit di sitoplasma dapat dipindah dengan cepat oleh transporter nitrit menuju kloroplas, sehingga penyerapan nitrat oleh tanaman padi menjadi semakin besar. Padi kultivar Nipponbare transgenik yang mengandung gen CsNitr1-L di bawah kendali promoter 35S (35S CaMV) telah disilangkan dengan padi lokal kultivar Ciherang untuk memindahkan genCsNitr1-L di bawah kendali promoter 35S CaMV ke dalam genom kultivar Ciherang. Turunan F1 dari hasil persilangan ini kemudian dilakukan persilangan balik dengan kultivar Ciherang sehingga didapat tanaman BC1F1.
Tujuan penelitian
2 TINJAUAN PUSTAKA
Padi (Oryza sativaL.)
Padi (Oryza sativa L.) merupakan komoditas serealia yang diproduksi terbesar kedua setelah gandum. Asia merupakan sentra produksi dan konsumen terbesar dunia. Selain Asia, padi juga merupakan tanaman penting di beberapa wilayah Utara dan Selatan Amerika, Afrika, Australia dan Eropa (Wailes et al. 1998). Padi yang dibudidayakan saat ini ada dua jenis yaitu Oryza sativa L. (padi Asia) dan Oryza glaberrima (padi Afrika), namun hanya Oryza sativa L. yang dibudidayakan secara luas terutama di Asia (Datta 1981). Terdapat 25 spesies padi (AAK 1990), yang tersebar mulai dari Afrika, Asia, Amerika hingga Australia (Chang 2003). Padi termasuk dalam Divisi Angiospermae, Kelas Monocotyledonae, Ordo Poales, Famili Poaceae atau Gramineae, Genus Oryza sativa. Oryza sativa berdasarkan ekogeografi terdiri dari subspesies indica, javanica dan japonica yang terpisah secara genetik (Siregar 1981).
Padi indica merupakan indigenus Asia dengan iklim tropis dan subtropis. Padi japonica (sinica) terbatas pada wilayah subtropik (Chang 2003). Subspesies padi javanicamerupakan yang paling banyak ditanam di Indonesia. Menurut Datta (1981), budidaya tanaman padi diklasifikasikan menjadi tiga yaitu: (1) lahan kering, tanpa air yang tergenang atau tanpa pengairan, (2) lahan basah, dan (3) tergenang.
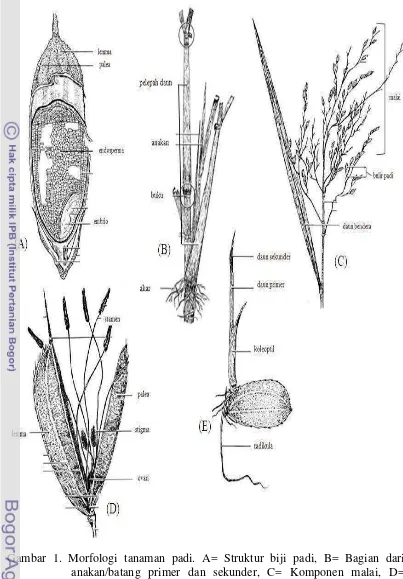
Padi japonica memiliki ciri daun sempit berwarna hijau tua bulir bulat berambut panjang. Contoh padi japonica adalah kultivar Nipponbare. Sedangkan padi indica memiliki ciri berdaun sempit berwarna hijau terang, bulir ramping umumnya tidak berbulu, contohnya padi Ciherang. Secara umum famili Gramineae memiliki ciri akar serabut, daun berbentuk lanset, urat daun sejajar, memiliki pelepah daun, bunga tersusun seperti bunga majemuk, dengan satuan bunga berupa floret yang tersusun dalam spikelet. Secara umum, morfologi tanaman padi disajikan pada Gambar 1.
Ciherang merupakan padi sawah varietas unggul hasil beberapa kali persilangan, yaitu IR18349-53-1-3-1-3/IR19661-131-3-1//IR119661-131-3-1///IR64////IR64 Cere. Umur tanamannya cukup singkat yaitu 116 hingga 125 hari, bentuk tanaman tegak, dengan tinggi mencapai 107 hingga 115 sentimeter, menghasilkan anakan produktif 14 hingga 17 batang (Suprihatnoet al. 2007).
Asimilasi Nitrat
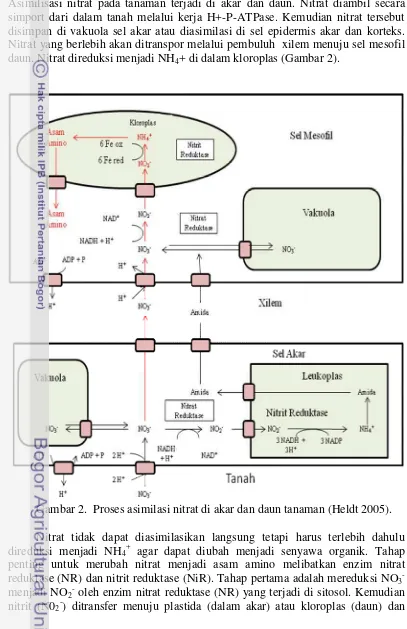
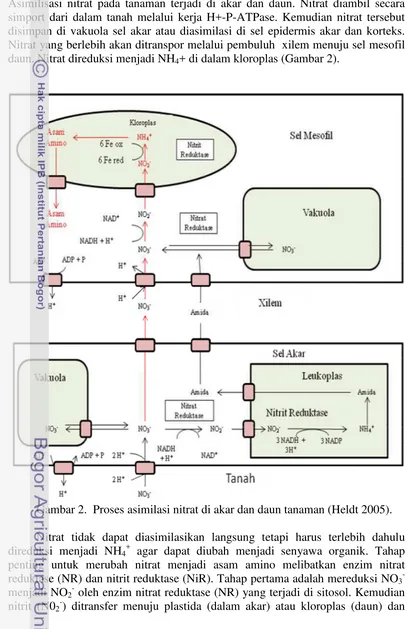
Tumbuhan menggunakan nitrat sebagai substrat awal untuk sintesis senyawa yang mengandung nitrogen seperti asam amino (Marschner 1995). Asimilisasi nitrat pada tanaman terjadi di akar dan daun. Nitrat diambil secara simport dari dalam tanah melalui kerja H+-P-ATPase. Kemudian nitrat tersebut disimpan di vakuola sel akar atau diasimilasi di sel epidermis akar dan korteks. Nitrat yang berlebih akan ditranspor melalui pembuluh xilem menuju sel mesofil daun. Nitrat direduksi menjadi NH4+ di dalam kloroplas (Gambar 2).
Gambar 2. Proses asimilasi nitrat di akar dan daun tanaman (Heldt 2005).
Nitrat tidak dapat diasimilasikan langsung tetapi harus terlebih dahulu direduksi menjadi NH4+ agar dapat diubah menjadi senyawa organik. Tahap
penting untuk merubah nitrat menjadi asam amino melibatkan enzim nitrat reduktase (NR) dan nitrit reduktase (NiR). Tahap pertama adalah mereduksi NO3
-menjadi NO2- oleh enzim nitrat reduktase (NR) yang terjadi di sitosol. Kemudian
oleh enzim nitrit reduktase (NiR), N02-diubah menjadi NH4+(Hopkin dan Hiiner
2008). Reaksi perubahan nitrat menjadi amonium disajikan pada Gambar 3. Nitrit jarang ditemukan pada konsentrasi tinggi karena dapat meracuni tanaman (Oji dan Okamoto 1981, Takahasi et al. 1998 Sugiura et al. 2007), sehingga perlu untuk diminimalisir keberadaanya (Sustiprijatnoet al. 2006).
Aktifitas enzim nitrat reduktase di akar banyak dipengaruhi oleh fotosintesis. Hal ini dapat dilihat dari aktifitas enzim NR yang menjadi aktif setelah terjadinya fotosintesis (Sawhneyet al. 1972, Hopkin dan Hiiner 2008).
Gambar 3. Perubahan nitrat menjadi amonium yang terjadi di dalam sel.
Peranan GenNitr1-L
Gen Nitr1-L merupakan gen yang menyandikan transporter nitrit. Pada tanaman tingkat tinggi terdapat dua gen yang serupa yaitu Nitr1-L dan Nitr1-S (Sugiura et al. 2007). Transporter nitrit yang berfungsi pada membran kloroplas ini dapat mengangkut nitrit dari sitosol ke dalam stroma di kloroplas. Gen CsNitr1-Lyang berasal dari tanaman mentimun telah diisolasi oleh Takahashi dan Sugiura [Tanpa tahun]. Gen CsNitr1-S Merupakan isoform dari gen CsNitr1-L dengan 484 urutan asam amino yang identik, namun tidak memiliki asam amino ke 120 N-terminal (Sugiuraet al. 2007).
Nitr1-L merupakan kelompok gen POT (Oligopeptide Transporter). Salah satu kelompok gen ini ditemukan pertama kali di Candida albicans. Gen ini kemudian banyak ditemukan pada tanaman tingkat tinggi (Tsay et al. 2007). Reduksi nitrit menjadi amonia memerlukan penyerapan enam elektron yang dikatalis oleh enzim nitrit reduktase yang terletak di plastida. Reduktase nitrit berisi cluster 4Fe 4S kovalen terikat satu molekul FAD, dan satu siroheme siklik tetrapyrrole dengan satu atom Fe di tengah. Strukturnya berbeda dari heme karena mengandung residu asetil dan propionil tambahan yang berasal dari sintesis pirol Cluster 4Fe-4S, FAD, dan siroheme membentuk rantai transpor electron dimana elektron ditransfer dari ferredoxin menjadi nitrit . Nitrit reduktase memiliki afinitas yang sangat tinggi untuk nitrit. Kapasitas untuk pengurangan nitrit dalam kloroplas jauh lebih besar dari pada untuk pengurangan nitrat di sitosol. Oleh karena itu semua nitrit yang dibentuk oleh reduktase nitrat dapat sepenuhnya dikonversi menjadi amonia. Hal ini penting karena nitrit merupakan racun bagi sel (Siddiqiet al. 1992).
Enzim nitrit reduktase (NiR) 8H++ NO2-+6e- → NH4++ 2H2O
Shingles et al. (1996) menjelaskan transportasi NO2- diseluruh amplop kloroplas terjadi oleh pengangkutan terprotonasi bentuk NO2- dan HNO atau dengan penyerapan ion nitrit. Fungsi dari H+-ATPase pada bagian dalam amplop kloroplas mungkin untuk menghasilkan gradien untuk kegiatan transportasi proton. Transport diseluruh amplop kloroplas vesikel membran dapat terjadi dengan salah satu dari tiga mekanisme penting atau kombinasi ketiganya yaitu melalui difusi, melintasi membran atau disosiasi dengan vesikel.
3 METODOLOGI
Waktu dan Tempat
Penelitian ini dilakukan mulai April 2012 sampai dengan Agustus 2012 di Laboratorium Biologi Molekuler, Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumberdaya Genetik Pertanian, Badan Penelitian dan Pengembangan Pertanian.
Bahan
Bahan tanaman yang digunakan adalah populasi BC3F4 dari persilangan antara padi japonica cv. Nipponbare transgenik dan padi indica kultivar Ciherang. Ciri-ciri padi Ciherang disajikan pada Lampiran 1. Primer HPT-F (5’ GATGCCTCCGCTCGAAGTAGCG 3’) dan primer HPT-R (5’ GCATCTCCCGCCGTGCAC3’) digunakan untuk mengidentifikasi adanya gen hpt.Primer 35S - F (5’ GAGAGAAAGCTTCATGGAGTCAAAGATTCAAA 3’) dan primer CsNitr1-L-R (5’ ATAGATGATGGAGGCGATGG 3’) digunakan untuk mengetahui gen CsNitr1-L yang difusikan dengan promoter 35S CaMV menggunakan polymerase chain reaction (PCR). Primer Aktin-F (5’ TCCATCTTGGCATCTCTCA 3’) dan Primer Aktin-R (5’ GTACCCGCATCAGGCATC 3’) digunakan untuk mengamplifikasi aktin sebagai kontrol internal tanaman padi untuk mengetahui keberadaan DNA genom. Posisi primer HPT, 35S dan CsNitr1 disajikan pada gambar 4.
Metod e Peneli ti an
Seleksi kecambah transgenik dengan higromisin
Biji padi dikeringkan di dalam inkubator pada suhu 45 °C selama 2 hari. Biji-biji tersebut kemudian disterilisasi dengan perendaman dengan etanol 70% selama 1 menit dan pada larutan pemutih/bleach 30% (konsentrasi akhir sodium hypochlorite NaOCl 2%) + tween selama 1 jam. Biji kemudian dibilas dengan akuades steril sebanyak lima kali. Biji yang telah disterilkan kemudian ditumbuhkan di media MS0 yang mengandung 50 mg/l antibiotik higromisin selama tiga minggu untuk mendapatkan tanaman yang tahan higromisin. Sebagai kontrol terhadap efektifitas media seleksi, padi non transgenik ditanam di media selektif yang sama dengan media untuk tanaman transgenik.
Bibit yang tumbuh dipindahkan ke cawan petri baru dengan media air selama 1 minggu kemudian bibit dipindah ke media tanam berupa bak kecil yang berisi tanah selama 2 minggu. Selanjutnya bibit ini dipindah ke media ember yang berisi tanah, yang telah dianalisis terlebih dahulu untuk mengetahui kandungan N-total. Tanah yang digunakan sebagai media tumbuh adalah 10 kg/ember. Setiap ember ditanami satu bibit.
Perlakuan pupuk
Tanaman transgenik dan non transgenik yang telah dipindah ke ember diberi pupuk dasar 100 kg TSP dan 100 kg/ha KCl tiap hektar, pada saat tanam. Pupuk urea diberikan sebagai perlakuan dengan empat taraf yaitu 0, 50, 100 dan 150 kg/ha. Urea di berikan 3 kali yaitu 25% pada saat tanam, 25% berumur 4 MST dan 50% memasuki primordia akhir. Percobaan setiap genotipe pada setiap dosis pemupukan terdiri dari dua bibit.
Analisis fenotipe
Fenotipe yang diamati meliputi tinggi tanaman, jumlah tanaman tiap rumpun, berat kering tanaman, hari mulai berbunga, panjang malai, berat 100 biji, jumlah biji per malai dan berat biji tiap rumpun. Data yang diperoleh kemudian dianalisis dengan uji beda nyata. Tinggi tanaman diukur mulai dari titik tumbuh hingga leher malai, yang dilakukan di akhir penelitian (panen) terhadap satu tanaman yang paling tinggi dalam satu rumpun. Jumlah anakan tiap rumpun dihitung ketika tanaman memasuki masa reproduktif ditandai dengan keluarnya malai dengan menghitung semua tanaman dalam satu rumpun dikurangi dengan tanaman induk. Umur berbunga dihitung dari saat tanam sampai dengan tanaman menghasilkan malai.
Rancanan percobaan
Percobaan ini terdiri dari 4 macam dosis pemupukan yaitu 0, 50, 100 dan 150 kg/ha. Masing-masing percobaan pemupukan menggunakan rancangan acak kelompok dengan satu perlakuan dan dua ulangan. Perlakuan terdiri dari lima genotipe. Masing-masing perlakuan terdiri dari dua tanaman. Adapun rumus matematikanya adalah sebagai berikut:
Yij = µ + τi + Bj + єij
Dimana :
Yij : Pengamatan Faktor genotipe taraf ke-i, faktor pemupukan taraf kej dan kelompok ke-k
µ : Rataan Umum
τi : Pengaruh Faktor genotipe pada taraf ke-i
Bj : Pengaruh Kelompok pada taraf ke-j
єij : Pengaruh galat pada faktor genotipe taraf ke-i dan kelompok ke-j
Pengolahan data dilakukan terhadap pengaruh genotipe untuk masing-masing dosis pemupukan dan tidak dilakukan pengolahan antar dosis pemupukan.
Isolasi DNA tanaman
Analisis genhptdanCsNitr1-Ldengan PCR
DNA yang telah diisolasi selanjutnya dianalisis dengan PCR menggunakan metode Sambrook dan Russel (1989). Reaksi PCR terdiri dari 100
ɳg DNA, 7,5 µl Readymix PCR kit 2G, 0,75 DMSO, 0,75 µl primer forward (10 µM), 0,75 µl primer reverse (10 µM), dan 4,25 µl ddH2O steril dengan total
4 HASIL DAN PEMBAHASAN
Seleksi Resistensi Kecambah Padi Ciherang Transgenik terhadap Higromisin
Seleksi terhadap kecambah yang resisten terhadap higromisin menunjukkan bahwa rata-rata kecambah yang resisten adalah diatas 90%. Pada media selektif yang sama tidak satupun kecambah dari tanaman padi varietas Ciherang non transgenik yang tumbuh (Tabel 1). Di media non selektif yang merupakan media MS0 tanpa higromisin, semua kecambah non transgenik dapat tumbuh normal (Gambar 5). Hal ini menunjukkan bahwa media selektif yang mengandung 50 mg/l higromisin mampu membedakan tanaman transgenik dari tanaman non transgenik.
Tabel 1. Seleksi ketahanan kecambah terhadap higromisin pada tanaman padi Ciherang
Genotipe Jumlah Biji awal
Kecambah Resisten
terhadap higromisin Persentase Kecambah resisten higromisin Resisten Sensitif
G3 100 96 4 96%
G7 100 93 7 93%
G8 100 91 9 91%
G11 100 98 2 98%
Ciherang 100 0 100 0%
Tanaman yang hidup di media selektif ini diduga mengandung transgen yaitu genhpt danCsNitr-L. Untuk mengkonfirmasi bahwa tanaman yang resisten higromisin adalah transgenik yang mengandung gen hpt, dari tiap galur, 4 tanaman transgenik putatif diambil secara acak untuk dianalisis secara molekuler dengan PCR. PCR dengan primer HPT-F dan HPT-R menghasilkan amplifikasi sebesar 516 pasang basa (pb) yang sesuai dengan daerah hpt yang diapit oleh kedua primer tersebut. PCR terhadap tanaman padi Ciherang non transgenik dengan primer yang sama dan kondisi yang sama tidak menghasilkan amplifikasi DNA (Gambar 6). Hasil ini mengkonfirmasi bahwa tanaman yang resisten higromisin mengandung gen hpt sehingga seluruh tanaman resisten higromisin adalah transgenik. Tanaman transgenik yang mengandung hpt yang sudah dikonfirmasi secara molekuler untuk selanjutnya ditanam di ember untuk mengetahui fenotipenya.
Analisis Fenotipe Pertumbuhan
Tinggi tanaman padi
Pertumbuhan tanaman padi tidak lepas dari peran unsur hara terutama unsur Nitrogen (N). Masa vegetatif awal tanaman padi membutuhkan unsur N yang tinggi untuk pertambahan biomasa dan pembentukan tajuk tanaman serta pengisian biji (Dobermann dan Fairhurst 2000; Tegeder dan Rentsch 2010).
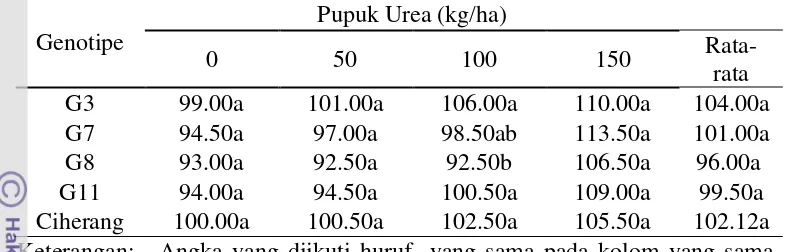
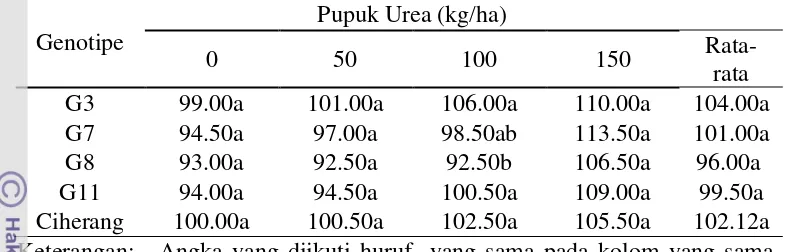
Pada tingkat pemupukan urea yang sama tanaman transgenik mempunyai tinggi yang tidak berbeda nyata dengan tanaman non transgenik (Tabel 2). Hal ini menunjukkan bahwa gen CsNitr1-L tidak berpengaruh nyata terhadap tinggi tanaman. Hal ini dikarenakan nitrat yang merupakan sumber hara selain amonium oleh tanaman transgenik lebih di arahkan ke pengisian sink bukan ke pengisian source sehingga tinggi tanaman padi transgenik tidak berbeda dengan tanaman non transgenik. Dijelaskan oleh Gardner et al. (1991) bahwa tanaman yang memiliki karakter genotipe yang kuat tidak dapat dimodifikasi oleh pengaruh luar.
Jumlah anakan tiap rumpun
Tanaman transgenik dan non transgenik pada dosis 0 dan 100 kg/ha, menghasilkan jumlah anakan tiap rumpun yang tidak berbeda, sedangkan pada dosis 50 dan 150 kg/ha G3 dan G11 menghasilkan rumpun yang paling banyak (Tabel 3). Tingginya rumpun pada G3 dan G11 kemungkinan adanya protein transporter nitrit yang berperan dalam meningkatkan proses asimilasi nitrat lebih baik dari galur transgenik lainnya. Penelitian yang dilakukan oleh Ning et a.l (2009) jumlah anakan lebih banyak dipengaruhi oleh lingkungan seperti kerapatan populasi dan jarak tanam serta nutrisi yang tersedia. Yao-Hong et al. (2009) menjelaskan bahwa kebanyakan tanaman menyerap asimilat lebih tinggi pada saat inisiasi malai. Asimilat lebih digunakan untuk pembentukan malai dan pengisisan gabah (Makarimet al. 2000; Suhartatiket al. 2007).
Berat kering tanaman tiap rumpun
Tanaman transgenik dan non-transgenik pada pemupukan 0 dan 50 kg/ha urea cenderung memiliki bobot kering yang tidak berbeda. Pada dosis urea diatas 100 kg/ha, tanaman nontransgenik menunjukkan berat kering yang lebih tinggi (Tabel 4). Tingginya bobot kering tanaman non-transgenik sebagai akibat
Tabel 2. Pengaruh genotipe terhadap tinggi (cm) tanaman pada setiap dosis pemupukan urea.
Genotipe
Pupuk Urea (kg/ha)
0 50 100 150
Rata-rata G3 99.00a 101.00a 106.00a 110.00a 104.00a G7 94.50a 97.00a 98.50ab 113.50a 101.00a G8 93.00a 92.50a 92.50b 106.50a 96.00a G11 94.00a 94.50a 100.50a 109.00a 99.50a Ciherang 100.00a 100.50a 102.50a 105.50a 102.12a Keterangan: Angka yang diikuti huruf yang sama pada kolom yang sama
adalah tidak berbeda nyata pada uji DMRT 5%.
Tabel 3. Pengaruh genotipe terhadap jumlah anakan tiap rumpun pada setiap dosis pemupukan urea.
Genotipe Pupuk Urea (kg/ha)
0 50 100 150 Rata-rata
G3 5.50a 19.00a 12.00a 24.00a 15.12ab
G7 4.00a 13.00b 13.00a 12.00b 10.50c
G8 7.50a 7.50c 15.50a 18.00b 09.62c
G11 11.50a 16.00ab 18.50a 27.50a 15.87a
Ciherang 10.00a 11.00bc 12.00a 13.50b 11.62bc Keterangan: Angka yang diikuti huruf yang sama pada kolom yang sama tidak
akumulasi asimilat yang tertahan di sumber (source) tanaman yaitu bagian vegetatif yang tidak sepenuhnya dipindahkan dengan baik oleh tanaman untuk pembentukansink. Hal ini di jelaskan oleh Makarim dan Suhartatik (2009) bahwa sejak inisiasi malai, terjadi penumpukan asimilat namun setelah antesis bobot jerami berkurang hingga 90%. Pada tanaman transgenik bobot brangkasan kering lebih ringan dibanding tanaman nontransgenik sebagai akibat aktifitas transgen yang cukup tinggi untuk pembentukan hasil (Zhaoet al. 2010).
Umur berbunga
Umur berbunga tanaman transgenik pada setiap dosis pemupukan yang sama mulai dari pemupukan 0 kg/ha urea hingga 150 kg/ha urea, berbeda nyata dengan tanaman non-transgenik. Tanaman transgenik cenderung memasuki masa reproduktif lebih cepat dibandingkan dengan tanaman non-transgenik (Tabel 5). Hal ini diduga bahwa transgen mengangkut asimilat dengan cepat sehingga memacu tanaman untuk memasuki masa reproduktif lebih cepat. Gardner et al. (1991) menjelaskan bahwa tanaman akan memasuki masa reproduktif lebih cepat ketika nutrisi yang diterima sudah mencukupi untuk itu. Yao-Hong (2009) menunjukkan nutrisi akan diserap tanaman lebih tinggi pada saat memasuki masa reproduktif.
Tabel 4. Pengaruh genotipe terhadap berat kering tanaman tiap rumpun pada setiap dosis pemupukan urea.
Genotipe Pupuk Urea (kg/ha)
0 50 100 150 Rata-rata
G3 0.11a 0.12a 0.14b 0.16a 0.13b
G7 0.10a 0.11a 0.12b 0.13b 0.11bc
G8 0.09a 0.10a 0.11b 0.13b 0.10c
G11 0.11a 0.11a 0.14b 0.16a 0.13bc
Ciherang 0.11a 0.16a 0.17a 0.18a 0.15a
Keterangan: Angka yang diikuti huruf yang sama pada kolom yang sama tidak berbeda nyata pada uji DMRT 5%.
Tabel 5. Pengaruh genotipe terhadap umur berbunga (hari) pada setiap dosis pemupukan urea.
Genotipe Pupuk Urea (kg/ha)
0 50 100 150 Rata-rata
G3 62c 70bc 62c 63c 64c
G7 71ab 73ab 72ab 72ab 72b
G8 69abc 74ab 67bc 67bc 69b
G11 63bc 64c 64c 65bc 64c
Ciherang 77a 78a 78a 76a 77a
Panjang malai
Malai tanaman padi menopang gabah yang merupakan sink yang perlu dipenuhi dengan fotosintat dari berbagai sumber (source) dalam tanaman (Makarim dan Suhartatik 2009). Secara umum tanaman non trangenik memiliki rata-rata panjang malai yang lebih panjang daripada tanaman transgenik kecuali G8 (Tabel 6). Hal ini kemungkinan karena umur berbunga tanaman nontransgenik lebih panjang daripada tanaman transgenik. Menurut Pringadiet al.(2008) bahwa panjang malai menentukan hasil akhir namun tidak selamanya demikian dikarenakan ada faktor lain seperti kerapatan biji dan persentase kehampaan.
Bobot seratus biji
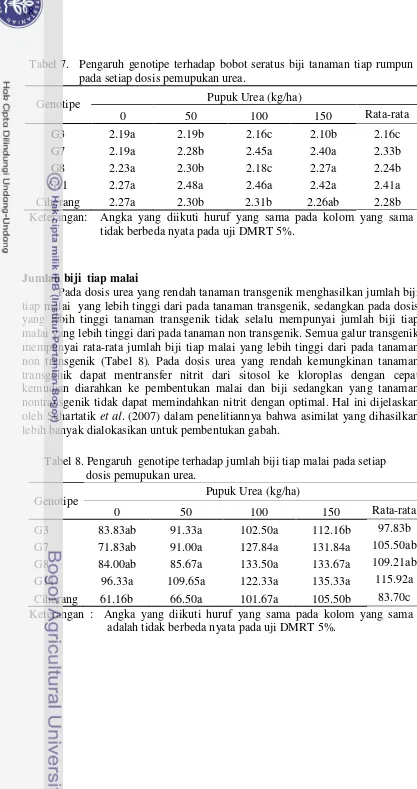
Pada kondisi yang sama tanpa perlakuan 0 kg/ha urea, tanaman transgenik mempunyai biji yang berukuran tidak berbeda nyata dengan tanaman non transgenik. Namun dengan adanya perlakuan pemupukan tanaman transgenik menghasilkan biji dengan ukuran yang cukup bervariasi. Galur 11 mempunyai ukuran biji yang berbeda nyata dengan tanaman transgenik lainnya dan nontransgenik (Tabel 7).
Tabel 6. Pengaruh genotipe terhadap panjang malai pada setiap dosis pemupukan urea.
Genotipe Pupuk Urea (kg/ha)
0 50 100 150 Rata-rata
G3 22ab 23a 22c 24a 23b
G7 21ab 22a 24b 25a 23b
G8 23ab 25a 26a 26a 25a
G11 21b 24a 23c 24a 23b
Ciherang 24a 25a 26a 24a 25a
Jumlah biji tiap malai
Pada dosis urea yang rendah tanaman transgenik menghasilkan jumlah biji tiap malai yang lebih tinggi dari pada tanaman transgenik, sedangkan pada dosis yang lebih tinggi tanaman transgenik tidak selalu mempunyai jumlah biji tiap malai yang lebih tinggi dari pada tanaman non transgenik. Semua galur transgenik mempunyai rata-rata jumlah biji tiap malai yang lebih tinggi dari pada tanaman non transgenik (Tabel 8). Pada dosis urea yang rendah kemungkinan tanaman transgenik dapat mentransfer nitrit dari sitosol ke kloroplas dengan cepat kemudian diarahkan ke pembentukan malai dan biji sedangkan yang tanaman nontransgenik tidak dapat memindahkan nitrit dengan optimal. Hal ini dijelaskan oleh Suhartatiket al. (2007) dalam penelitiannya bahwa asimilat yang dihasilkan lebih banyak dialokasikan untuk pembentukan gabah.
Tabel 7. Pengaruh genotipe terhadap bobot seratus biji tanaman tiap rumpun pada setiap dosis pemupukan urea.
Genotipe Pupuk Urea (kg/ha)
0 50 100 150 Rata-rata
G3 2.19a 2.19b 2.16c 2.10b 2.16c
G7 2.19a 2.28b 2.45a 2.40a 2.33b
G8 2.23a 2.30b 2.18c 2.27a 2.24b
G11 2.27a 2.48a 2.46a 2.42a 2.41a
Ciherang 2.27a 2.30b 2.31b 2.26ab 2.28b
Keterangan: Angka yang diikuti huruf yang sama pada kolom yang sama tidak berbeda nyata pada uji DMRT 5%.
Tabel 8. Pengaruh genotipe terhadap jumlah biji tiap malai pada setiap dosis pemupukan urea.
Genotipe Pupuk Urea (kg/ha)
0 50 100 150 Rata-rata
G3 83.83ab 91.33a 102.50a 112.16b 97.83b
G7 71.83ab 91.00a 127.84a 131.84a 105.50ab G8 84.00ab 85.67a 133.50a 133.67a 109.21ab G11 96.33a 109.65a 122.33a 135.33a 115.92a Ciherang 61.16b 66.50a 101.67a 105.50b 83.70c Keterangan : Angka yang diikuti huruf yang sama pada kolom yang sama
Berat biji tiap rumpun
Rata-rata produksi biji tiap rumpun tanaman transgenik lebih tinggi dari pada tanaman non transgenik. Di antara tanaman transgenik, G3 dan G11 mempunyai produksi biji yang lebih tinggi dari pada galur transgenik lainnya (Tabel 9). Tingginya produksi biji tanaman transgenik kemungkinan disebabkan oleh transporter nitrit yang disandi oleh genCsNitr1-Lyang berada pada tanaman transgenik yang mengalokasikan sebagian besar asimilat yang terbentuk (source) maupun yang tersimpan (sink) untuk pengisian biji. Hasil penelitian Ning et al. (2009) menunjukkan bahwa hasil fotosintat lebih banyak didistribusikan ke pembentukan malai dan pengisian biji. Asimilat yang dikumpulkan dengan cepat oleh tanaman transgenik dengan adanya protein transporter nitrit yang disandi oleh gen CsNitr1-L digunakan untuk pembentukan biji sehingga berat biji rata-rata tanaman transgenik lebih tinggi dari pada tanaman non transgenik. Hasil penelitian Pertiwi (2010), menunjukkan bahwa tanaman transgenik yang membawa gen CsNitr1-L mengekspresikan enzim transporter nitrit lebih tinggi dibanding tanaman non transgenik.
Analisis Integrasi GenCsNitr1-Lpada Tanaman Trangenik
Untuk mengetahui adanya gen CsNitr1-L pada generasi BC3F4 empat tanam transgenik yang masing-masing berasal dari empat galur yang berbeda yang mempunyai produksi yang paling tinggi diambil untuk dianalisis dengan PCR.
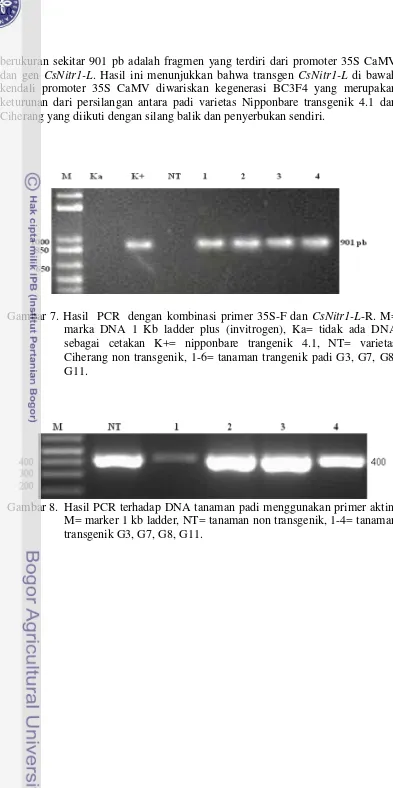
Analisis PCR dengan pasangan primer 35S-F dan primer Cs-R terhadap 4 tanaman transgenik putatif menunjukkan bahwa keempat tanaman tersebut mengandung fragmen berukuran 901 pasang basa (pb). Dengan kondisi PCR yang sama, DNA dari tanaman non transgenik tidak menghasilkan amplifikasi sebesar 901 pb (Gambar 7). Dengan primer yang dapat mengamplifikasi gen aktin, seluruh tanaman baik tanaman transgenik maupun non transgenik dapat menghasilkan fragmen sebesar 400 pb (Gambar 8). Hal ini menunjukkan bahwa seluruh DNA dari tanaman yang dianalisis adalah baik dan amplikon yang
Tabel 9. Pengaruh genotipe terhadap berat biji tiap rumpun pada setiap dosis pemupukan urea.
G3 17.30a 39.53a 41.29ab 57.83a 36.56a
G7 18.75a 22.42a 34.75abc 41.27ab 29.29b
G8 15.50a 18.24a 24.64bc 49.41ab 26.95bc
G11 17.25a 33.78a 47.93a 58.74a 39.42a
Ciherang 09.25a 17.00a 17.00c 34.75b 19.68c Keterangan : Angka yang diikuti huruf yang sama pada kolom yang sama
berukuran sekitar 901 pb adalah fragmen yang terdiri dari promoter 35S CaMV dan gen CsNitr1-L. Hasil ini menunjukkan bahwa transgen CsNitr1-L di bawah kendali promoter 35S CaMV diwariskan kegenerasi BC3F4 yang merupakan keturunan dari persilangan antara padi varietas Nipponbare transgenik 4.1 dan Ciherang yang diikuti dengan silang balik dan penyerbukan sendiri.
Gambar 7. Hasil PCR dengan kombinasi primer 35S-F dan CsNitr1-L-R. M= marka DNA 1 Kb ladder plus (invitrogen), Ka= tidak ada DNA sebagai cetakan K+= nipponbare trangenik 4.1, NT= varietas Ciherang non transgenik, 1-6= tanaman trangenik padi G3, G7, G8, G11.
5 SIMPULAN
DAFTAR PUSTAKA
AAK. Budidaya Tanaman Padi. 1990. Yogyakarta (ID). Kanisius.
Azwir, Ridwan. 2009. Peningkatan produktivitas padi sawah dengan perbaikan teknologi budidaya.Akta Agrosia. 12:212-218.
Bowsher CG, Emes MJ, Cammack R, Hucklesby DP. 1988. Purification and properties of nitrite reduktase from roots of pea (Pisum sativum cv. Meteor).Planta.175:334-340
[BPS] Badan Pusat Statistik 2012. Statistik Indonesia 2012. Jakarta. http://www.bps.go.id [10 Maret 2012].
Cahal GS, Gosal SS. 2002. Principles and Procedures of Plant Breeding Biotechnologycal and Conventional Approaches. Harrow (UK). Alpha Science International.
Chang TT. 2003. Origin, domestication, and diversification. Di dalam: Smith CW, Dilday RH, eds. Rice: Origin, History, Technology, and Production. Chap 1.1. The United States of America (US): J Wiley 3-25.
De Datta SK. 1981. Principles and Practices of Rice Production. Singapore (SG): A Wiley Interscience.
Dobermann A, Fairhurst 2000. Rice Nutrient Disorders and Nutrien Management. International Rice Research Institute, Los Banos (PH). 192 p.
Doyle JJ, Doyle JL. 1990. A rapid total DNA preparation procedure for fresh plant tissue. Focus.12:13-15.
[FAO] Food Agriculture Organization. 2012. FAO Statistical Yearbook 2012. Rome. Italy. http://www.fao.org [5 Maret 2012].
Gardner FP, Pearce RB, Mitchell RL. 1991. Fisiologi Tanaman Budidaya. Jakarta (ID): UI Press.
Hardjowigeno S. 2010. Ilmu Tanah. Jakarta (ID): Akademika Pressindo. Heldt HW. 2005. Plant Biochemistry. German (DE). Elsevier Academic Pr.
Hopkins WG, Hiiner NPA. 2008. Introduction to Plant Physiology. 4th edition. New York (US): J. Wiley.
Ida S, Mikami B. 1986. Spinach ferredoxin-nitrite reductase: a purification procedure and characterization of chemical properties. Biochim
Biophysica Acta. 871:167-178.
Ida S, Iwagami K, Minobe S. 1989. Purification and characterization of moleculer and immunological properties of rice ferredoxin nitrite reductase. Biol
Chem.53:2777-2784.
Ikhwani. 2012. The effect of submergence and N fertilizer application on plant growth and production of submerged tolerant rice variety. J Lahan Suboptimal.1:12-21
[IRRI] International Rice Research Institute. 2012. Rice Production and Processing. http://irri.org/about-rice/rice-facts/rice-production and processing.html. [1 Maret 2012].
Khomawatie I. 2010. Ekspresi Fenotipe Padi Transgenik Pembawa GenCsNitr1-L terhadap Variasi Dosis Pemupukan Nitrogen. [Skripsi]. Institut Pertanian Bogor. Bogor (ID).
Limbongan YL, Purwoko BS, Trikosoemaningtyas, Aswidinoor H. 2009. Respon padi sawah terhadap pemupukan nitrogen di dataran tinggi. J Agron Indonesia.37:175-182.
Mackill DJ, Septiningsih E, Pamplona AM, Sanchez D, Iftekhar K, Masudussaman AS, Collard B, Neeraja C, Vergara G, Maghirang-Rodriguez R, Heuer S, Ismail AM. 2007. Marker assisted selection for submergence tolerance in rice.J Mol Plant Breed. 5:207-208.
Makarim AK, Nugraha US, dan Kartasasmita UG. 2000. Teknologi Produksi Padi Sawah. Pusat Penelitian dan Pengembangan Tanaman Pangan. Bogor (ID). Marschner. H 1995. Mineral Nutrition of Higher Plants Ed ke-2. London (UK).
Academic Pr.
Matsuo T, Hoshikawa. 1993. Science of The Rice Plant. Morphology. Nosan Gyoson Bunka kyokai (Nobunkyo). Tokyo (JP).
Mokhele B, Zhan X, Yang G, dan Zhang X. 2011. Nitrogen assimilation in crop plants and its affecting factors.Can J Plant.92: 1-7
Nasholom T, Kielland K, dan Ganeteg U. 2009. Uptake of organic nitrogen by plants.Phytol. 182: 31-48
Ning H, Liu Z, Wang Q, Lin Z, Chen S, Li G, Wang S, Ding Y. 2009. Effect of nitrogen fertilizer application on grain phytic acid and protein concentrations in japonica and its variations with genotypes. J Cereal. 50: 49-55.
Ntanos DA, Koutroubas SD. 2002. Dry matter and N accumulation and translocation for indica and japonica rice under mediterranean conditions. Field Cereal.74: 93-101.
Oji Y, Okamoto S. 1981. Nitrite utilization in barley plans as compared with nitrate and ammonium utilization.Sci Rep. 14: 349-353.
Pramono J, Basuki S, Widarto. 2005. Increasing effort of irrigated rice productivity through of integrated crop and resources approach. Agrosains. 7: 1-6.
Pringadi K, Toha HM, Nuryanto B. Pengaruh Pemupukan Terhadap Pertumbuhan dan Hasil Padi Gogo Dataran Rendah. Balai Besar Penelitian Tanaman Padi (ID). pp 325-338
Pertiwi N. (2010). Ekspresi gen CsNitr1-L pada padi transgenik dan pengaruhnya terhadap variasi pemupukan nitrogen.[skripsi]. Institut Pertanian Bogor (ID).
Reyes-valdes MH. 2000. A model for marker-based selection in gene introgression breeding program.Crop Sci. 40:91-98.
Sambrook J, Russel DW. 1989. Molecular cloning : A Laboratory Manual. 3rd edition. New York (US): Laboratory Pr.
Sawhney SK, Prakash V, Naik MS. 1972. Nitrate and nitrite reductase activities in induced chlorophyll mutannts of barley.FEBS.22:2.
Shingles R, Michael H, Roh, Richard EM. 1996. Nitrite transport in chloroplast inner envelope vesikle.Plant Physiol.112: 1375-1381.
Sing BK, Modgal SC. 1978. Dry-matter production, phosphorus and potassium uptake as influenced by levels and methods of nitrogen application in rainfed upland rice.Plant Soil.50:691-701.
Siregar H. 1981. Budidaya Tanaman Padi di Indonesia. Jakarta (ID): Rineka. Sugiura M, Georgescu MN, Takahashi M. 2007. A nitrite transporter associated
with nitrite uptake by higher plant chloroplasts. Plant Cell Physiol. 48(7):1022-1035.
Suhartatik E, Makarim AK, Abdullah B. 2007. Respons galur padi tipe baru terhadap waktu dan jumlah pemberian pupuk nitrogen. Balai Besar Penelitian Tanaman Padi Indonesia (ID). pp 649-661.
Suprihatno B, Aan A, Daradjat, Satoto, Baehaki N, Widiarta, Agus Setyono S, Dewi I, Ooy S, Lesmana, Sembiring H. 2007. Deskripsi Varietas Padi. Balai Besar Penelitian Tanaman Padi. Subang. Jawa Barat (ID).
Sustiprijatno, Sugiura M, Ogawa K, Takahashi M. 2006. Improvement of nitrate-and nitrite-dependent growth of rice by the introduction of a constitutively expressing chloroplastic nitrite transporter.Plant Biotechnol. 23:47-54. Takahashi M, Haruki H, Sugiura M. 1998. In Photosynthesis: Mechanism
and Effects. pp. 3621–3624. Kluwar Academic publishers, Dordrecht. The Netherlands.
Takahashi M, Sasaki Y, Ida S, Morikawa H. 2001. Nitrite reductase gene enrichment improves assimilation of NO2 in arabidopsis. Plant Physiol. 126:731-741.
Takahashi M, Sugiura M. [tanpa tahun]. Localization of a New Class of Transporter for Nitrogenous Compound in Chloroplast Envelopes. pp 599-8532.
Tegeder M, Rentsch D. 2010. Uptake and partitioning of amino acids and peptides. Molecular Plant.3(6):997-1011.
Tsay YF, Chiu CC, Tsai CB, Ho CH, Hsu PK. 2007. Nitrat transporters and peptide transporter. Minireview. Institute of Molecular Biology, Academia Sinica, Taipei, Taiwan.FEBS. 581:2290–2300.
Unkles SE, Symington VF, Kotur Z, Wang Y, Siddiqi MY, Kinghorn JR, Glass ADM. 2011. Physiological and biochemical characterization of AnNitA, the Aspergillus nidulans high-affinity nitrite transporter. Eukaryotic Cell 10: 1724-1732.
Vaucheret H, Jean-Christophe P, Philippe M, Taline E. 1997. Nitrate reductase and nitrite reductase as targets to study gene silencing phenomena in transgenic plants. Euphytica00:195-200.
Wailes EJ, Gail L, Cramer, Eddie CC, James MH. 1998. Arkansas Global Rice Model: International Baseline Projections for 1998-2010. Arkansas: The Arkansas Agricultural Experiment Station (US), University of Arkansas. Wangiyana W, Pramurti RD, Wiresyamsi A. 2008. Pertumbuhan dan hasil padi
cv. Ciherang antara teknik konvensional dan sri dengan pemberian stres air ringan dan pemupukan lewat daun padi fase reproduktif.Agroteksos18:1-3.
Lampiran
Lampiran 1. Ciri-ciri morfologi padi Ciherang.
Nama Varietas : Ciherang
Tinggi Tanaman : 107-115 cm Anakan Produktif : 14-17 batang
Warna Kaki : Hijau
Warna Batang : Hijau
Warna Daun Telinga : Putih
Warna Daun : Hijau
Muka Daun : Kasar pada sebelah bawah
Posisi Daun : Tegak
Daun Bendera : Tegak
Bentuk Gabah : Panjang ramping
Warna Gabah : Kuning bersih
Kerontokan : Sedang
Kerebahan : Sedang
Tekstur Nasi : Pulen
Kadar Amilosa : 23%
Bobot 1000 Butir : 27-28 kg Rata-rata Produksi : 6,0 ton/Ha Potensi Hasil : 5-8,5 ton/Ha
Ketahanan Terhadap Hama : Tahan terhadap wereng coklat biotipe 2 dan 3
Ketahanan Terhadap Penyakit : Tahan terhadap bakteri hawar daun (HDB) strain III dan IV
Anjuran : Cocok ditanam pada musim hujan dan kemarau dengan ketinggian di bawah 500 mdpl
RIWAYAT HIDUP
Penulis dilahirkan di Sambas, Kalimantan Barat pada tanggal 20 April 1982, dari Bapak H Mustafa H.Djunit dan Ibu Sulastri, Penulis merupakan Putra kedelapan dari sembilan bersaudara.
Tahun 1999 penulis lulus dari SMU Muhammadiyah 1 Pontianak dan pada tahun 2000, penulis melanjutkan pendidikan di Jurusan Agronomi, Fakultas Pertanian Universitas Panca Bhakti Pontianak dan selesai pada tahun 2006 dengan gelar Sarjana Pertanian.
1 Latar Belakang
Padi (Oryza sativa L.) merupakan komoditas serealia yang diproduksi terbesar kedua setelah gandum. Asia merupakan sentra produksi dan konsumen terbesar dunia, namun padi juga merupakan tanaman penting dibeberapa wilayah Utara dan Selatan Amerika, Afrika, Australia dan Eropa (Wailes et al. 1998). Sekitar 114 negara di seluruh dunia menanam padi dengan luas panen sekitar 153 juta hektar dan menghasilkan lebih dari 600 juta ton per tahun (FAO 2012). Wilayah Asia memproduksi padi sekitar 90% dari total produksi dunia, dua negara diantaranya yaitu Cina dan India yang menanam padi lebih dari setengah total produksi dunia (IRRI 2012). Produksi padi di Indonesia pada tahun 2012 mencapai 69 juta ton dengan produktivitas 51.36 kuintal per hektar (BPS 2012). Di Indonesia upaya peningkatan produksi padi saat ini terganjal oleh berbagai kendala, seperti konversi lahan sawah yang masih terus berjalan, perubahan iklim, dan kualitas sumberdaya lahan yang semakin menurun, sehingga berdampak terhadap penurunan produktivitas (Pramono et al. 2005; Wangiyana et al. 2008; Azwir dan Ridwan 2009).
Usaha mengatasi penurunan kualitas sumber daya lahan melalui intensifikasi masih memungkinkan yaitu melalui perakitan varietas unggul tanaman padi. Salah satu cara dalam perakitan varieatas unggul adalah rekayasa genetika tanaman yang efisien dalam penggunaan pupuk, khususnya pupuk nitrogen. Efisiensi pupuk nitrogen dapat dilakukan dengan memodifikasi jalur nitrat yaitu memanfaatkan gen-gen transporter yang berkerja pada jalur asimilasi nitrat, seperti tansporter nitrat (NTR), transporter nitrit (Nitr1), transporter ammonium (MRT), transporter amida (GOGAT). Sugiura et al. (2007) telah berhasil mengidentifikasi transporter nitrit (CsNitr1-L) yang berfungsi dalam mempercepat transportasi nitrit menuju kloroplas. Menurut Sustiprijatno et al. (2006) gen CsNitr1-L termasuk kedalam kelompok gen proton-dependen oligopeptide tranporter (POT).
Tanah sawah adalah tanah yang digunakan untuk menanam padi sawah, baik secara terus menerus sepanjang tahun maupun bergiliran dengan tanaman palawija.Tanah sawah di Indonesia saat ini umumnya ditemukan pada tanah yang cukup baik di daerah datar maupun perbukitan yang diteraskan. Umumnya tanah sawah terdapat di Jawa, Bali, Lombok, Sumatera Barat, Sumatera Utara, Aceh, dan Sulawesi Selatan. Biasanya tanah sawah yang digunakan untuk menanam padi adalah dalam keadaan tergenang. Penggenangan tanah mengakibatkan perubahan-perubahan sifat kimia tanah yang mempengaruhi pertumbuhan tanaman padi. Pengaruh negatif dari penggenangan ini adalah mudah hilangnya unsur hara seperti nitrogen karena mudah terlarut, menguap dan mengalami denitrifikasi. Optimasi produktivitas padi lahan sawah merupakan salah satu peluang untuk peningkatan produksi padi. Di Indonesia rata-rata produktivitas padi adalah 4,7 ton/ha, sedangkan potensinya dapat mencapai 6-7 ton/ha (Makarimet al.2000).
besar dalam produksi padi di seluruh dunia (Lea dan Miflin 2011). Hasil produksi padi tergantung pada jumlah nitrogen yang diberikan. Namun, hampir setengah bagian dari jumlah nitrogen yang diaplikasikan di lapangan terutama lahan sawah banyak mengalami kehilangan karena penguapan, denitrifikasi, dan pencucian (Hardjowigeno 2010). Akibat dari tidak efisiennya penggunaan pupuk nitrogen tersebut menyebabkan biaya produksi tinggi, sehingga dapat merugikan dan menurunkan pendapatan petani (Ikhwani 2012).
Nitrogen adalah bagian penting dari kehidupan. Tanaman, hewan dan bakteri menggunakan nitrogen untuk mensintesis asam amino, dan asam-asam amino ini bersatu membentuk protein. Tanaman mengambil nitrogen dalam bentuk ion amonium (NH4+) dan ion nitrat (NO3-). Alur asimilasi nitrat dimulai
oleh reduksi nitrat menjadi nitrit oleh enzim nitrat reduktase di dalam sitoplasma, kemudian nitrit direduksi menjadi amonium oleh enzim nitrit reduktase di dalam kloroplas. Amonium yang dihasilkan merupakan bahan dasar untuk metabolisme protein (Hopkins dan Hiiner 2008). Nitrit adalah produk antara yang sangat penting karena dapat meracuni tanaman, sehingga keberadaannya di sitoplasma harus sekecil mungkin atau tidak ada sama sekali. Nitrit di sitoplasma dapat dipindah dengan cepat oleh transporter nitrit menuju kloroplas sehingga penyerapan nitrat oleh tanaman menjadi semakin besar. Apabila akumulasi nitrit di sitoplasma besar, dapat mengganggu pertumbuhan tanaman. Pada dasarnya tanaman padi memiliki transporter nitrit namun tidak aktif (Sustiprijatno et al. 2006). Asimilasi nitrat pada tanaman terjadi di akar dan daun. Nitrat akan di simpan di vakuola akar atau akan di transfer ke mesofil daun namun sebelumnya nitrat akan direduksi terlebih dahulu menjadi nitrit di sitosol kemudian direduksi lagi menjadi NH4+di dalam kloroplas (Sugiuraet al.2007).
Sustiprijatnoet al. (2006) telah berhasil memodifikasi proses transfer nitrit dari sitosol ke kloroplas pada tanaman padi Oryza sativa L. subspesies japonica cv. Nipponbare dengan memasukkan gen CsNitr1-L yang berasal dari tanaman mentimun. Nitrit di sitoplasma dapat dipindah dengan cepat oleh transporter nitrit menuju kloroplas, sehingga penyerapan nitrat oleh tanaman padi menjadi semakin besar. Padi kultivar Nipponbare transgenik yang mengandung gen CsNitr1-L di bawah kendali promoter 35S (35S CaMV) telah disilangkan dengan padi lokal kultivar Ciherang untuk memindahkan genCsNitr1-L di bawah kendali promoter 35S CaMV ke dalam genom kultivar Ciherang. Turunan F1 dari hasil persilangan ini kemudian dilakukan persilangan balik dengan kultivar Ciherang sehingga didapat tanaman BC1F1.
Tujuan penelitian
2 TINJAUAN PUSTAKA
Padi (Oryza sativaL.)
Padi (Oryza sativa L.) merupakan komoditas serealia yang diproduksi terbesar kedua setelah gandum. Asia merupakan sentra produksi dan konsumen terbesar dunia. Selain Asia, padi juga merupakan tanaman penting di beberapa wilayah Utara dan Selatan Amerika, Afrika, Australia dan Eropa (Wailes et al. 1998). Padi yang dibudidayakan saat ini ada dua jenis yaitu Oryza sativa L. (padi Asia) dan Oryza glaberrima (padi Afrika), namun hanya Oryza sativa L. yang dibudidayakan secara luas terutama di Asia (Datta 1981). Terdapat 25 spesies padi (AAK 1990), yang tersebar mulai dari Afrika, Asia, Amerika hingga Australia (Chang 2003). Padi termasuk dalam Divisi Angiospermae, Kelas Monocotyledonae, Ordo Poales, Famili Poaceae atau Gramineae, Genus Oryza sativa. Oryza sativa berdasarkan ekogeografi terdiri dari subspesies indica, javanica dan japonica yang terpisah secara genetik (Siregar 1981).
Padi indica merupakan indigenus Asia dengan iklim tropis dan subtropis. Padi japonica (sinica) terbatas pada wilayah subtropik (Chang 2003). Subspesies padi javanicamerupakan yang paling banyak ditanam di Indonesia. Menurut Datta (1981), budidaya tanaman padi diklasifikasikan menjadi tiga yaitu: (1) lahan kering, tanpa air yang tergenang atau tanpa pengairan, (2) lahan basah, dan (3) tergenang.
Padi japonica memiliki ciri daun sempit berwarna hijau tua bulir bulat berambut panjang. Contoh padi japonica adalah kultivar Nipponbare. Sedangkan padi indica memiliki ciri berdaun sempit berwarna hijau terang, bulir ramping umumnya tidak berbulu, contohnya padi Ciherang. Secara umum famili Gramineae memiliki ciri akar serabut, daun berbentuk lanset, urat daun sejajar, memiliki pelepah daun, bunga tersusun seperti bunga majemuk, dengan satuan bunga berupa floret yang tersusun dalam spikelet. Secara umum, morfologi tanaman padi disajikan pada Gambar 1.
Ciherang merupakan padi sawah varietas unggul hasil beberapa kali persilangan, yaitu IR18349-53-1-3-1-3/IR19661-131-3-1//IR119661-131-3-1///IR64////IR64 Cere. Umur tanamannya cukup singkat yaitu 116 hingga 125 hari, bentuk tanaman tegak, dengan tinggi mencapai 107 hingga 115 sentimeter, menghasilkan anakan produktif 14 hingga 17 batang (Suprihatnoet al. 2007).
Asimilasi Nitrat
Tumbuhan menggunakan nitrat sebagai substrat awal untuk sintesis senyawa yang mengandung nitrogen seperti asam amino (Marschner 1995). Asimilisasi nitrat pada tanaman terjadi di akar dan daun. Nitrat diambil secara simport dari dalam tanah melalui kerja H+-P-ATPase. Kemudian nitrat tersebut disimpan di vakuola sel akar atau diasimilasi di sel epidermis akar dan korteks. Nitrat yang berlebih akan ditranspor melalui pembuluh xilem menuju sel mesofil daun. Nitrat direduksi menjadi NH4+ di dalam kloroplas (Gambar 2).
Gambar 2. Proses asimilasi nitrat di akar dan daun tanaman (Heldt 2005).
Nitrat tidak dapat diasimilasikan langsung tetapi harus terlebih dahulu direduksi menjadi NH4+ agar dapat diubah menjadi senyawa organik. Tahap
penting untuk merubah nitrat menjadi asam amino melibatkan enzim nitrat reduktase (NR) dan nitrit reduktase (NiR). Tahap pertama adalah mereduksi NO3
-menjadi NO2- oleh enzim nitrat reduktase (NR) yang terjadi di sitosol. Kemudian
oleh enzim nitrit reduktase (NiR), N02-diubah menjadi NH4+(Hopkin dan Hiiner
2008). Reaksi perubahan nitrat menjadi amonium disajikan pada Gambar 3. Nitrit jarang ditemukan pada konsentrasi tinggi karena dapat meracuni tanaman (Oji dan Okamoto 1981, Takahasi et al. 1998 Sugiura et al. 2007), sehingga perlu untuk diminimalisir keberadaanya (Sustiprijatnoet al. 2006).
Aktifitas enzim nitrat reduktase di akar banyak dipengaruhi oleh fotosintesis. Hal ini dapat dilihat dari aktifitas enzim NR yang menjadi aktif setelah terjadinya fotosintesis (Sawhneyet al. 1972, Hopkin dan Hiiner 2008).
Gambar 3. Perubahan nitrat menjadi amonium yang terjadi di dalam sel.
Peranan GenNitr1-L
Gen Nitr1-L merupakan gen yang menyandikan transporter nitrit. Pada tanaman tingkat tinggi terdapat dua gen yang serupa yaitu Nitr1-L dan Nitr1-S (Sugiura et al. 2007). Transporter nitrit yang berfungsi pada membran kloroplas ini dapat mengangkut nitrit dari sitosol ke dalam stroma di kloroplas. Gen CsNitr1-Lyang berasal dari tanaman mentimun telah diisolasi oleh Takahashi dan Sugiura [Tanpa tahun]. Gen CsNitr1-S Merupakan isoform dari gen CsNitr1-L dengan 484 urutan asam amino yang identik, namun tidak memiliki asam amino ke 120 N-terminal (Sugiuraet al. 2007).
Nitr1-L merupakan kelompok gen POT (Oligopeptide Transporter). Salah satu kelompok gen ini ditemukan pertama kali di Candida albicans. Gen ini kemudian banyak ditemukan pada tanaman tingkat tinggi (Tsay et al. 2007). Reduksi nitrit menjadi amonia memerlukan penyerapan enam elektron yang dikatalis oleh enzim nitrit reduktase yang terletak di plastida. Reduktase nitrit berisi cluster 4Fe 4S kovalen terikat satu molekul FAD, dan satu siroheme siklik tetrapyrrole dengan satu atom Fe di tengah. Strukturnya berbeda dari heme karena mengandung residu asetil dan propionil tambahan yang berasal dari sintesis pirol Cluster 4Fe-4S, FAD, dan siroheme membentuk rantai transpor electron dimana elektron ditransfer dari ferredoxin menjadi nitrit . Nitrit reduktase memiliki afinitas yang sangat tinggi untuk nitrit. Kapasitas untuk pengurangan nitrit dalam kloroplas jauh lebih besar dari pada untuk pengurangan nitrat di sitosol. Oleh karena itu semua nitrit yang dibentuk oleh reduktase nitrat dapat sepenuhnya dikonversi menjadi amonia. Hal ini penting karena nitrit merupakan racun bagi sel (Siddiqiet al. 1992).
Enzim nitrit reduktase (NiR) 8H++ NO2-+6e- → NH4++ 2H2O
Shingles et al. (1996) menjelaskan transportasi NO2- diseluruh amplop kloroplas terjadi oleh pengangkutan terprotonasi bentuk NO2- dan HNO atau dengan penyerapan ion nitrit. Fungsi dari H+-ATPase pada bagian dalam amplop kloroplas mungkin untuk menghasilkan gradien untuk kegiatan transportasi proton. Transport diseluruh amplop kloroplas vesikel membran dapat terjadi dengan salah satu dari tiga mekanisme penting atau kombinasi ketiganya yaitu melalui difusi, melintasi membran atau disosiasi dengan vesikel.
3 METODOLOGI
Waktu dan Tempat
Penelitian ini dilakukan mulai April 2012 sampai dengan Agustus 2012 di Laboratorium Biologi Molekuler, Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumberdaya Genetik Pertanian, Badan Penelitian dan Pengembangan Pertanian.
Bahan
Bahan tanaman yang digunakan adalah populasi BC3F4 dari persilangan antara padi japonica cv. Nipponbare transgenik dan padi indica kultivar Ciherang. Ciri-ciri padi Ciherang disajikan pada Lampiran 1. Primer HPT-F (5’ GATGCCTCCGCTCGAAGTAGCG 3’) dan primer HPT-R (5’ GCATCTCCCGCCGTGCAC3’) digunakan untuk mengidentifikasi adanya gen hpt.Primer 35S - F (5’ GAGAGAAAGCTTCATGGAGTCAAAGATTCAAA 3’) dan primer CsNitr1-L-R (5’ ATAGATGATGGAGGCGATGG 3’) digunakan untuk mengetahui gen CsNitr1-L yang difusikan dengan promoter 35S CaMV menggunakan polymerase chain reaction (PCR). Primer Aktin-F (5’ TCCATCTTGGCATCTCTCA 3’) dan Primer Aktin-R (5’ GTACCCGCATCAGGCATC 3’) digunakan untuk mengamplifikasi aktin sebagai kontrol internal tanaman padi untuk mengetahui keberadaan DNA genom. Posisi primer HPT, 35S dan CsNitr1 disajikan pada gambar 4.
Metod e Peneli ti an
Seleksi kecambah transgenik dengan higromisin
Biji padi dikeringkan di dalam inkubator pada suhu 45 °C selama 2 hari. Biji-biji tersebut kemudian disterilisasi dengan perendaman dengan etanol 70% selama 1 menit dan pada larutan pemutih/bleach 30% (konsentrasi akhir sodium hypochlorite NaOCl 2%) + tween selama 1 jam. Biji kemudian dibilas dengan akuades steril sebanyak lima kali. Biji yang telah disterilkan kemudian ditumbuhkan di media MS0 yang mengandung 50 mg/l antibiotik higromisin selama tiga minggu untuk mendapatkan tanaman yang tahan higromisin. Sebagai kontrol terhadap efektifitas media seleksi, padi non transgenik ditanam di media selektif yang sama dengan media untuk tanaman transgenik.
Bibit yang tumbuh dipindahkan ke cawan petri baru dengan media air selama 1 minggu kemudian bibit dipindah ke media tanam berupa bak kecil yang berisi tanah selama 2 minggu. Selanjutnya bibit ini dipindah ke media ember yang berisi tanah, yang telah dianalisis terlebih dahulu untuk mengetahui kandungan N-total. Tanah yang digunakan sebagai media tumbuh adalah 10 kg/ember. Setiap ember ditanami satu bibit.
Perlakuan pupuk
Tanaman transgenik dan non transgenik yang telah dipindah ke ember diberi pupuk dasar 100 kg TSP dan 100 kg/ha KCl tiap hektar, pada saat tanam. Pupuk urea diberikan sebagai perlakuan dengan empat taraf yaitu 0, 50, 100 dan 150 kg/ha. Urea di berikan 3 kali yaitu 25% pada saat tanam, 25% berumur 4 MST dan 50% memasuki primordia akhir. Percobaan setiap genotipe pada setiap dosis pemupukan terdiri dari dua bibit.
Analisis fenotipe
Fenotipe yang diamati meliputi tinggi tanaman, jumlah tanaman tiap rumpun, berat kering tanaman, hari mulai berbunga, panjang malai, berat 100 biji, jumlah biji per malai dan berat biji tiap rumpun. Data yang diperoleh kemudian dianalisis dengan uji beda nyata. Tinggi tanaman diukur mulai dari titik tumbuh hingga leher malai, yang dilakukan di akhir penelitian (panen) terhadap satu tanaman yang paling tinggi dalam satu rumpun. Jumlah anakan tiap rumpun dihitung ketika tanaman memasuki masa reproduktif ditandai dengan keluarnya malai dengan menghitung semua tanaman dalam satu rumpun dikurangi dengan tanaman induk. Umur berbunga dihitung dari saat tanam sampai dengan tanaman menghasilkan malai.
Rancanan percobaan
Percobaan ini terdiri dari 4 macam dosis pemupukan yaitu 0, 50, 100 dan 150 kg/ha. Masing-masing percobaan pemupukan menggunakan rancangan acak kelompok dengan satu perlakuan dan dua ulangan. Perlakuan terdiri dari lima genotipe. Masing-masing perlakuan terdiri dari dua tanaman. Adapun rumus matematikanya adalah sebagai berikut:
Yij = µ + τi + Bj + єij
Dimana :
Yij : Pengamatan Faktor genotipe taraf ke-i, faktor pemupukan taraf kej dan kelompok ke-k
µ : Rataan Umum
τi : Pengaruh Faktor genotipe pada taraf ke-i
Bj : Pengaruh Kelompok pada taraf ke-j
єij : Pengaruh galat pada faktor genotipe taraf ke-i dan kelompok ke-j
Pengolahan data dilakukan terhadap pengaruh genotipe untuk masing-masing dosis pemupukan dan tidak dilakukan pengolahan antar dosis pemupukan.
Isolasi DNA tanaman
Analisis genhptdanCsNitr1-Ldengan PCR
DNA yang telah diisolasi selanjutnya dianalisis dengan PCR menggunakan metode Sambrook dan Russel (1989). Reaksi PCR terdiri dari 100
ɳg DNA, 7,5 µl Readymix PCR kit 2G, 0,75 DMSO, 0,75 µl primer forward (10 µM), 0,75 µl primer reverse (10 µM), dan 4,25 µl ddH2O steril dengan total
4 HASIL DAN PEMBAHASAN
Seleksi Resistensi Kecambah Padi Ciherang Transgenik terhadap Higromisin
Seleksi terhadap kecambah yang resisten terhadap higromisin menunjukkan bahwa rata-rata kecambah yang resisten adalah diatas 90%. Pada media selektif yang sama tidak satupun kecambah dari tanaman padi varietas Ciherang non transgenik yang tumbuh (Tabel 1). Di media non selektif yang merupakan media MS0 tanpa higromisin, semua kecambah non transgenik dapat tumbuh normal (Gambar 5). Hal ini menunjukkan bahwa media selektif yang mengandung 50 mg/l higromisin mampu membedakan tanaman transgenik dari tanaman non transgenik.
Tabel 1. Seleksi ketahanan kecambah terhadap higromisin pada tanaman padi Ciherang
Genotipe Jumlah Biji awal
Kecambah Resisten
terhadap higromisin Persentase Kecambah resisten higromisin Resisten Sensitif
G3 100 96 4 96%
G7 100 93 7 93%
G8 100 91 9 91%
G11 100 98 2 98%
Ciherang 100 0 100 0%
Tanaman yang hidup di media selektif ini diduga mengandung transgen yaitu genhpt danCsNitr-L. Untuk mengkonfirmasi bahwa tanaman yang resisten higromisin adalah transgenik yang mengandung gen hpt, dari tiap galur, 4 tanaman transgenik putatif diambil secara acak untuk dianalisis secara molekuler dengan PCR. PCR dengan primer HPT-F dan HPT-R menghasilkan amplifikasi sebesar 516 pasang basa (pb) yang sesuai dengan daerah hpt yang diapit oleh kedua primer tersebut. PCR terhadap tanaman padi Ciherang non transgenik dengan primer yang sama dan kondisi yang sama tidak menghasilkan amplifikasi DNA (Gambar 6). Hasil ini mengkonfirmasi bahwa tanaman yang resisten higromisin mengandung gen hpt sehingga seluruh tanaman resisten higromisin adalah transgenik. Tanaman transgenik yang mengandung hpt yang sudah dikonfirmasi secara molekuler untuk selanjutnya ditanam di ember untuk mengetahui fenotipenya.
Analisis Fenotipe Pertumbuhan
Tinggi tanaman padi
Pertumbuhan tanaman padi tidak lepas dari peran unsur hara terutama unsur Nitrogen (N). Masa vegetatif awal tanaman padi membutuhkan unsur N yang tinggi untuk pertambahan biomasa dan pembentukan tajuk tanaman serta pengisian biji (Dobermann dan Fairhurst 2000; Tegeder dan Rentsch 2010).
Pada tingkat pemupukan urea yang sama tanaman transgenik mempunyai tinggi yang tidak berbeda nyata dengan tanaman non transgenik (Tabel 2). Hal ini menunjukkan bahwa gen CsNitr1-L tidak berpengaruh nyata terhadap tinggi tanaman. Hal ini dikarenakan nitrat yang merupakan sumber hara selain amonium oleh tanaman transgenik lebih di arahkan ke pengisian sink bukan ke pengisian source sehingga tinggi tanaman padi transgenik tidak berbeda dengan tanaman non transgenik. Dijelaskan oleh Gardner et al. (1991) bahwa tanaman yang memiliki karakter genotipe yang kuat tidak dapat dimodifikasi oleh pengaruh luar.
Jumlah anakan tiap rumpun
Tanaman transgenik dan non transgenik pada dosis 0 dan 100 kg/ha, menghasilkan jumlah anakan tiap rumpun yang tidak berbeda, sedangkan pada dosis 50 dan 150 kg/ha G3 dan G11 menghasilkan rumpun yang paling banyak (Tabel 3). Tingginya rumpun pada G3 dan G11 kemungkinan adanya protein transporter nitrit yang berperan dalam meningkatkan proses asimilasi nitrat lebih baik dari galur transgenik lainnya. Penelitian yang dilakukan oleh Ning et a.l (2009) jumlah anakan lebih banyak dipengaruhi oleh lingkungan seperti kerapatan populasi dan jarak tanam serta nutrisi yang tersedia. Yao-Hong et al. (2009) menjelaskan bahwa kebanyakan tanaman menyerap asimilat lebih tinggi pada saat inisiasi malai. Asimilat lebih digunakan untuk pembentukan malai dan pengisisan gabah (Makarimet al. 2000; Suhartatiket al. 2007).
Berat kering tanaman tiap rumpun
Tanaman transgenik dan non-transgenik pada pemupukan 0 dan 50 kg/ha urea cenderung memiliki bobot kering yang tidak berbeda. Pada dosis urea diatas 100 kg/ha, tanaman nontransgenik menunjukkan berat kering yang lebih tinggi (Tabel 4). Tingginya bobot kering tanaman non-transgenik sebagai akibat
Tabel 2. Pengaruh genotipe terhadap tinggi (cm) tanaman pada setiap dosis pemupukan urea.
Genotipe
Pupuk Urea (kg/ha)
0 50 100 150
Rata-rata G3 99.00a 101.00a 106.00a 110.00a 104.00a G7 94.50a 97.00a 98.50ab 113.50a 101.00a G8 93.00a 92.50a 92.50b 106.50a 96.00a G11 94.00a 94.50a 100.50a 109.00a 99.50a Ciherang 100.00a 100.50a 102.50a 105.50a 102.12a Keterangan: Angka yang diikuti huruf yang sama pada kolom yang sama
adalah tidak berbeda nyata pada uji DMRT 5%.
Tabel 3. Pengaruh genotipe terhadap jumlah anakan tiap rumpun pada setiap dosis pemupukan urea.
Genotipe Pupuk Urea (kg/ha)
0 50 100 150 Rata-rata
G3 5.50a 19.00a 12.00a 24.00a 15.12ab
G7 4.00a 13.00b 13.00a 12.00b 10.50c
G8 7.50a 7.50c 15.50a 18.00b 09.62c
G11 11.50a 16.00ab 18.50a 27.50a 15.87a
Ciherang 10.00a 11.00bc 12.00a 13.50b 11.62bc Keterangan: Angka yang diikuti huruf yang sama pada kolom yang sama tidak