INDUKSI OVULASI DAN PEMIJAHAN PADA IKAN PATIN
SIAM (
Pangasianodon hypopthalmus
) DENGAN MANIPULASI
HORMONAL
YUDHA LESTIRA DHEWANTARA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Induksi Ovulasi Dan Pemijahan Pada Ikan Patin Siam (Pangasianodon hypopthalmus) Dengan Manipulasi Hormonal adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, September 2013
Yudha Lestira Dhewantara
RINGKASAN
YUDHA LESTIRA DHEWANTARA. Induksi Ovulasi dan Pemijahan pada Ikan Patin Siam (Pangasianodon Hypopthalmus) dengan Manipulasi Hormonal. Dibimbing oleh AGUS OMAN SUDRAJAT dan RITA ROSTIKA
Ikan patin siam merupakan spesies yang diintroduksi dari Thailand, memiliki ekonomis penting karena dagingnya sangat disukai oleh masyarakat Indonesia. Budidaya ikan ini berkembang pesat, sehingga kebutuhanakan benih semakin meningkat. Pemijahan dari ikan ini hanya dapat dilakukan secara pemijahan buatan dengan melakukan stripping, yang dapat menyebabkan penurunan kualitas broodstock, gamet dan benih.
Tujuan penelitian ini adalah untuk menginduksi secara hormonal untuk ovulasi dan pemijahan semi alamiah bagi ikan patin dan mengevaluasi efektivitas dan efisiensi penggunaan hormon lhrh, antidopamin (AD), aromatase inhibitor (AI), prostaglandin (PGF2a), oxytocin dan Ovaprim untuk menginduksi ovulasi dan pemijahan pada ikan ini. Induk patin (1.5 – 3.5 kg per ekor) diberi perlakuan dengan injeksi hormonal dengan: LHRHa + AI (Spawnprime 1); AD + AI
(Spawnprime 2); LHRHa + AD + AI + PGF2α (Spawnprime 3); LHRHa + AD + AI + PGF2α + oksitosin (Spawnprime 4); LHRHa + AD + oksitosin (Spawnprime 5); LHRHa + AD + PGF2α (spawnprime 6), AI + oksitosin (spawnprime 7), AI + PGF2α (spawnprime 8); ovaprim; dan NaCl (0.90%).
Hasil penelitian menunjukkan bahwa spawnprime memiliki lebih cepat dalam waktu ovulasi (6-8 jam) dibandingkan ovaprim (12 jam). Spawnprime 1, 2, 5, dan 6 dapat memijah dengan stipping, sementara spawnprime 3,4,7 dan 8 secara alami. Hasil terbaik ditunjukkan oleh spawnprime 4 yang menyebabkan tingkat ovulasi 100%. Waktu ovulasi di spawnprime 4 adalah 6 jam dan 33 menit, jumlah telur yang diovulasi adalah 140.912 ± 21304 telur, derajat pembuahan adalah 91.87% ± 3.03, derajat penetasan adalah 92.33% ± 5.86, tingkat kelangsungan hidup larva 93.91% ± 2.96, telur diameter 1.05 ± 0.04 mm dan konsentrasi estradiol 0.7 pg / ml. spawnprime dapat diinduksi untuk ovulasi dan pemijahan natural (tanpa stripping). Spawnprime dapat digunakan sebagai alternatif dalam pemijahan buatan.
SUMMARY
YUDHA LESTIRA DHEWANTARA. Induction of Ovulation and Spawning in Catfish (Pangasianodon hypopthalmus) with Hormonal Manipulation. Supervised by AGUS OMAN SUDRAJAT and RITA ROSTIKA
Striped catfish is a species introduced from Thailand, has economically important because the meat is preferred by Indonesian society. Fish farming is growing rapidly, thus increasing the need for seed. Spawning of these fish can only be done by artificial spawning by stripping, which can lead to decreased quality of broodstock, gametes and seeds.
The purposeof this study is to hormonally induce ovulation and spawning of seminatural for catfish and evaluate the effectiveness and efficiency of the use of hormone LHRH, antidopamin (AD), aromatase inhibitors (AI), prostaglandin(PGF2a), oxytocin and ovaprim to induce ovulation and spawning on this fish. Mature fish (1.5 - 3.5 kg per fish), was treated by hormonal injection with: LHRHa + AI (Spawnprime 1); AD + AI (Spawnprime 2); LHRHa + AD +
AI + PGF2α (Spawnprime 3); LHRHa + AD + AI + PGF2α + oxytocin
(Spawnprime 4); LHRHa + AD + oxytocin (Spawnprime 5); LHRHa + AD + PGF2α (spawnprime 6), AI + oxytocin (spawnprime 7), AI + PGF2α (spawnprime 8); ovaprim, and NaCl (0.90%).
The results showed that spawnprime has faster latency period (6-8 hours) compared ovaprim (12 hours). spawnprime 1, 2, 5, and 6 can be spawned artificially by stipping, while spawnprime 3,4,7 and 8 naturally. The best results were shown by spawnprime 4 which causes ovulation rate of 100%. The latency period in spawnprime 4 is 6 hours and 33 minutes, the amount of egg in ovulation time is 195.000 ± 41079.19 eggs, the fertilization rate is 91.87% ± 3.03, the hatching rate is 92.33% ± 5.86, the survival rate of larvae 93.91% ± 2.96, diameter egg is 1.05 ± 0.04 mm and concentrations of estradiol 0.7 pg / ml. spawnprime can induced for ovulation and ntural spawning (without stripping) on stripped catfish. Spawnprime can be used as an alternative in the artificial propagation.
© Hak Cipta Milik IPB, Tahun 2013
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Akuakultur
INDUKSI OVULASI DAN PEMIJAHAN PADA IKAN PATIN
SIAM (
Pangasianodon hypopthalmus
) DENGAN MANIPULASI
HORMONAL
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2013
Judul Tesis : Induksi Ovulasi dan Pemijahan pada Ikan Patin Siam (Pangasianodon hypopthalmus) dengan Manipulasi Hormonal Nama : Yudha Lestira Dhewantara
NIM : C151110301
Disetujui oleh Komisi Pembimbing
Dr Ir Agus Oman Sudrajat, MSc Ketua
Dr Ir Rita Rostika, MP Anggota
Diketahui oleh
Ketua Departemen Budidaya Perairan
Dr Ir Sukenda, MSc
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Judul yang dipilih dalam penelitian yang dilaksanakan sejak bulan Oktober 2012 sampai Maret 2013 ini adalah Induksi Ovulasi Dan Pemijahan Ikan Patin Siam (Pangasianodon Hypopthalmus) Dengan Manipulasi Hormonal.
Terima kasih penulis ucapkan kepada Bapak Dr Ir Agus Oman Sudrajat, M.Sc dan Ibu Dr Ir Rita Rostika, MP selaku pembimbing, Staf pengajar, pegawai dan laboran Departemen Budidaya Perairan atas dukungan serta bantuannya. Beasiswa Unggulan Dikti atas bantuan beasiswa selama menempuh pendidikan, Wawan Gunawan, Irus Rustandi, Ino Irawan, yang telah membantu dalam penyelesaian penelitian ini, teknisi Balai Besar Pengembangan Budidaya Air Tawar Sukabumi, Bapak Ahmad Jauhari Pamungkas, M.Si sebagai pendamping lapangan dan memfasilitasi penelitian di BBPBAT Sukabumi. Rekan satu penelitian Boedi Rachman, Wiwin Kusuma yang telah membantu penelitian ini. Teman-teman Akuakultur 2011, Epro Barades, Ahya, Farah Diana, Ibu Veni, Putra, Hanif dan Ovie Triantari yang telah membantu dalam penyelesaian tesis ini. Terima kasih juga disampaikan kepada ayah, ibu, serta seluruh keluarga, atas segala doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Agustus 2013
Yudha Lestira Dhewantara
DAFTAR ISI
halaman
DAFTAR GAMBAR iv
DAFTAR TABEL iv
DAFTAR LAMPIRAN iv
1. PENDAHULUAN 1
Latar Belakang 1
Tujuan 3
Perumusan Masalah 3
Kerangka Pemikiran 3
Hipotesis 4
2. TINJAUAN PUSTAKA 4
Biologi Ikan Patin Siam 4
Perkembangan Ovari 5
Anti Dopamin 9
Aromatase Inhibitor 10
Prostglandin 11
3 METODE 12
Waktu dan Tempat Penelitian 12
Bahan Penelitian 12
Parameter Uji 14
4 HASIL DAN PEMBAHASAN 16
Konsentrasi Hormon dalam Darah 16
Keberhasilan dan Lama Waktu Ovulasi 16
Jumlah Telur yang Dikeuarkan 18
Diameter Telur 19
Derajat Pembuahan 20
Derajat Penetasan 20
Kelangsungan Hidup 21
5 KESIMPULAN DAN SARAN 26
Kesimpulan 26
Saran 26
DAFTAR PUSTAKA 26
LAMPIRAN 31
DAFTAR GAMBAR
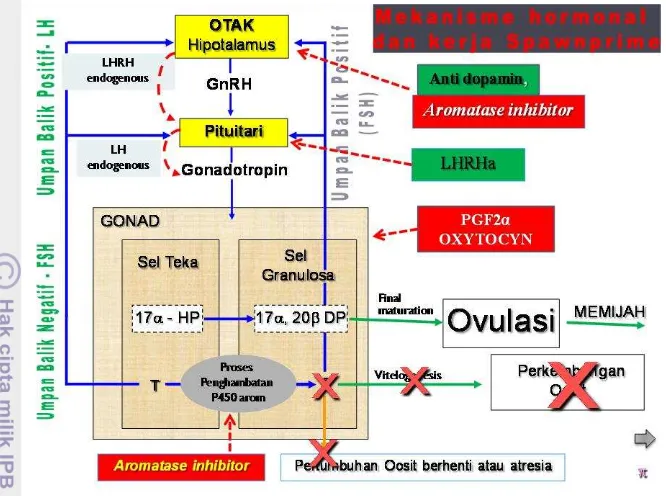
halaman 1 Mekanisme Hormonal Dan Kerja Spawnprime 4
2 Ikan Patin Siam 5
3 Skema Proses Perkembangan Oosit 8
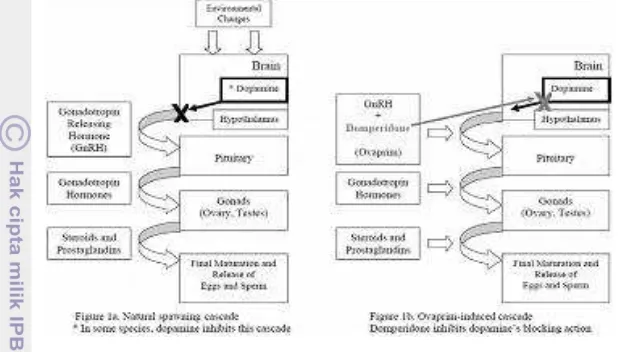
4 Mekanisme Antidopamin (Domperidone) 10
5 Konsentrasi Hormon Dalam Darah 16
6 Induk Ikan Patin Yang Di Suntik Perlakuan
Spawnprime 3 Dan 4 17
7 Jumlah Telur Ikan Patin 18
8 Diameter Telur Patin 19
8.1 Diameter Satu Butir telur Ikan Patin 19
9 Derajat Pembuahan 20
10 Derajat Penetasan 21
11 Kelangsungan Hidup 21
DAFTAR TABEL
1 Pembagian tingkat perkembangan ovari (TKG) 6 2 Keberhasilan dan lamanya waktu ovulasi pada ikan patin 17 3 Hasil penghitungan harga spawnprime dibandingkan
dengan Ovaprim 22
DAFTAR LAMPIRAN
1 Wadah Pematangan Gonad Induk Patin 31
2 Konsentrasi Estradiol- 17β 32
3 Jumlah Telur Yang Diovulasikan 32
4 Diameter Telur 33
5 Derajat Pembuahan 36
6 Derajat Penetasan 37
7 Kelangsungan Hidup 38
1PENDAHULUAN
Latar Belakang
Ikan patin merupakan salah satu dari sepuluh komoditas unggulan Kementerian Kelautan dan Perikanan (KKP) yang ditargetkan pada tahun 2014 produksinya mencapai 1.883.000 ton. Pada tahun 2011, target kebutuhan benih ikan patin nasional mencapai 478.000.000 ekor, namun total produksi sampai akhir tahun 2011 hanya sebesar 263.023.634 ekor atau terpenuhi sekitar 55%. Pada tahun 2012 ini, produksi ikan patin nasional ditargetkan 651.000 ton. Sementara itu, proyeksi kebutuhan benih ikan patin hanya untuk wilayah Sumatera saja sebesar 251.900.000 ekor dengan target produksi 97.100 ton. Selain itu, pada tahun 2012 ini KKP menetapkan ikan patin sebagai salah satu komoditas industrialisasi budidaya perikanan bersama udang, bandeng, dan rumput laut (KKP 2012).
Kebutuhan benih ikan patin yang masih belum terpenuhi disebabkan oleh produksi benih yang tidak berkesinambungan. Hal ini dapat disebabkan oleh beberapa faktor antara lain pembenihan yang cukup rumit serta ketersedian lahan potensial yang kurang memadai. Menurut Bukit (2007) pembenihan ikan patin lebih banyak berkembang di Jawa Barat dibanding daerah lain, hal ini dikarenakan oleh kondisi cuaca, iklim, dan pH air yang menunjang, serta pakan yang berupa cacing sutera banyak ditemukan di Jawa Barat. Hal ini berbeda dengan wilayah Kalimantan dan Sumatera yang lebih fokus pada usaha pembesaran.
Di Indonesia terdapat 14 spesies ikan patin, adapun spesies patin yang ada di Indonesia adalah Pangasius nieuwenhuisii, Pangasius humeralis, Pangasius lithostoma,Pangasius mahakamensis, Pangasius djambal, Pangasius macronema, Pangasius polyuranodon, Pangasius nasutus, Pangasius kunyit, Pangasius rheophilus, Pteropangasius micronemus, Helicophagus typus, Helicophagus waandersiidan Pangasianodon hypophthalmus (Gustiano et al.
2003a; Gustiano 2009). Di Indonesia baru tiga spesies ikan patin yang dibudiyakan, seperti ikan patin siam (Pangasianodon hypopthamus), ikan patin jambal (Pangasius djambal), dan ikan patin nasutus (Pangasius nasutus), merupakan spesies-spesies yang potensial untuk dikembangkan sebagai komoditas unggulan perikanan budidaya.
Ikan patin siam (Pangasianodon hypopthalmus) merupakan spesies ikan patin yang diintroduksi darai Thailand dan salah satu ikan yang bernilai ekonomis tinggi, karena dagingnya disukai dibeberapa daerah di Indonesia, terutama di Sumatera Selatan, Jambi, Riau dan Kalimantan. Ikan ini diterima sebagai ikan konsumsi karena menyerupai ikan asli daerah tersebut yaitu ikan patin (Pangasius pangasius) yang keberadaannya mulai berkurang. Menurut Legendre et al. (1998), kelebihan ikan patin siam ini mempunyai daya toleransi yang tinggi terhadap kondisi kualitas air yang kurang baik dan produksi telur (fekunditas) yang tinggi, sehingga budidayanya telah meluas. Selain itu teknik pemijahan buatan pada patin ini juga relatif mudah dilakukan.
2
itu perlu dilakukan suatu cara agar menjadi berkelanjutan, salah satunya dengan menggunakan hormone. Banyak jenis hormon yang dapat digunakan untuk merangsang terjadinya ovulasi dan pemijahan pada ikan. Namun, setiap jenis hormone memiliki dosis yang berbeda.
Ovaprim merupakan produk premiks yang terdiri dari campuran salmon Gonadotropin - Releasing Hormone analogue (sGnRHa [D-Arg6-Pro9-NetsGnRHa] dengan dopamin antagonis dari jenis domperidone. Pada kegiatan pembenihan, ovaprim digunakan sebagai bahan perangsang pematangan gonad dan pemijahan pada induk. Ovaprim berperan dalam memacu proses ovulasi dan pemijahan pada ikan. GnRH-a yang terkandung dalam ovaprim berperan merangsang hipofisa untuk melepaskan gonadotropin (Lam 1995).
Penelitian yang dilakukan oleh Affonso et al. (1999), pemberian AI sebesar 10 mg/kg pada induk coho salmon siap mijah, hasil yang didapat yaitu pada H 10 mulai ovulasi sebesar 67% dengan fertilitas 85%. Pemakaian LHRHa telah berhasil digunakan dalam menginduksi pembenihan ikan bandeng. Dengan demikian, LHRHa memiliki fungsi seperti sGnRHa pada ovaprim.
Prostaglandin F2α (PGF2α) merupakan derivat dari struktur asam prostanoat dan berasal dari asam lemak esensial melalui seleksi dan oksidasi (Tunner dan Bagnara 1988), pgf2α pada ikan berperan untuk merangsang terjadinya pengeluaran oosite yang telah matang dari saluran reproduksi (ovulasi). Mekanisme kerja hormon dalam terjadinya ovulasi pada prostaglandin bersama dengan hormon LH akan meningkatkan aktivitas enzim proteolitik di folikel sehingga akan menstimulasi inti sel telur yang berada di tengah untuk bergerak ke pinggir dan selanjutnya melebur menuju kutub animal, yang berarti telur siap diovulasikan.
Ikan patin tidak bisa memijah secara semi alami, dikarenkan tidak adanya
refleks spawning, sehingga pemijahan harus dilakukan dengan cara stripping. Adapun teknik stripping dapat berdampak negatif pada induk. Adapun dampak negatifnya yaitu induk bisa cepat stress, rusaknya organ reproduksi, sehingga kualitas gamet tidak optimal dan rusak dan pada saat telur dan sperma dicampurkan.
Tujuan Penelitian
Penelitian ini bertujuan untuk menginduksi ikan patin siam (Pangasianodon hypopthalmus) secara hormonal ovulasi dan pemijahan semi alami serta mengevaluasi efektifitas efisiensi penggunaan kombinasi hormon LHRH, AD, AI, PGF2α, oxytocin.
Rumusan Masalah
Pemijahan ikan patin sangat bergantung oleh rangsangan hormonal dan harus distripping untuk mengeluarkan gametnya untuk proses pembuahan buatan, sehingga pembenihan ikan ini belum dapat dilakukan tanpa rangsangan hormon. Hormon yang digunakan saat ini berupa ovaprim, yang didalamnya terkandung campuran salmon GnRH dan dopamin antagonis jenis domperidon. Ikan patin tidak dapat memijah alami walaupun diberi penyuntikan ovaprim dikarenakan tidak adanya reflex spawning, sehingga pemijahan harus ditambahkan dengan penyuntikkan ovaprim dan dilakukan proses stripping. Tetapi teknik stripping dapat berdampak negatif pada induk, dimana dapat menyebabkan stres, rusaknya organ reproduksi, sehingga kualitas gamet tidak optimal. Selain itu pada saat telur dan sperma dicampurkan tidak terjadi pembuahan, kualitas benih yang kurang baik. Pengembangan induksi hormonal yang lebih efektif harus dilakukan untuk pemijahan semi alami ikan patin siam sehingga mampu menginduksi ovulasi dan pemijahan ikan patin secara semi alami (tanpa stripping).
Kerangka Pemikiran
Mekanisme hormonal untuk vitelogenesis, pematangan serta ovulasi oosit melibatkan GnRH, gonadotropin, estradiol-17β, testosterone, 17α- 20β dihidrosiprogesteron dan aromatase. Hormon gonadotropin yang dilepaskan oleh kelenjar pituitari akan terbawa oleh aliran darah lalu masuk ke dalam gonad. Gonadotropin kemudian masuk ke sel teka, menstimulir terbentuknya testosteron yang kemudian akan masuk ke sel granulosa untuk diubah oleh enzim aromatase menjadi hormon estradiol 17β. Perkembangan telur pada tahap penyerapan vitelogenin akan berhenti ketika oosit telah mencapai ukuran maksimal. Menurut Nagahama et al (1995), proses pematangan oosit terjadi karena rangsangan Leutinizing Hormone (LH) pada folikel, kemudian terjadi proses pembentukan
hormon steroid, pada sel teka membentuk 17α-hidroksiprogesteron dan pada sel
granulose terbentuk 17α,20β dihidroksi-4-pregnen-3-one, dan hormon steroid yang terakhir inilah yang mempunyai peranan sebagai mediator kematangan oosit lebih lanjut. Produksi estradiol 17β dan aktivitas aromatase, diikuti oleh
peningkatan testosterone, dan 17α,20β-dihidroksi-4-pregnen-3-one (17α,20β-DP)
4
Gambar 1 Mekanisme Hormonal pada Ikan. Sumber: Sudrajat (2010)
Hipotesis
Formulasi spawnprime yang terdiri dari LHRH, anti dopamin, aromatase inhibitor, oxytocin dan prostaglandin mampu menginduksi ovulasi dan pemijahan ikan patin secara semi alami
1 TINJAUAN PUSTAKA
Biologi Ikan Patin Siam (Pangasianodon hypopthalmus)
Patin siam (Pangasianodon hypophthalmus Sauvage 1878) merupakan spesies patin di Indonesia yang diintroduksi dari Bangkok, Thailand pada tahun 1972 (Hardjamulia 1976; Pouyaud et al. 1998). Patin siam di Indonesia terutama terdapat di lingkungan budidaya, seperti perkolaman dan keramba jaring apung, serta beberapa telah terlepas dan menghuni perairan sungai-sungai besar di Jawa dan Sumatera yang merupakan daerah-daerah sentra produksi patin siam, yakni di sungai citarum dan batang hari.
Punggung induk patin siam berwarna abu-abu dengan sirip-sirip yang berwarna kuning kemerahan ketika baru diambil dari kolam (Gambar 2). Patin siam memiliki warna daging yang kuning (LRPTBPAT 2006). Gelembung renang patin siam berfungsi sebagai organ pernafasan tambahan dalam mengambil gas oksigen secara langsung dari udara (Browman et al. 1985).
Kelas : Pisces Sub-kelas : Teleostei Ordo : Ostariophysi Sub-ordo : Siluroidea Famili : Pangasidae Genus : Pangasius
Spesies : Pangasianodon hyphopthalmus
Habitat ikan patin adalah perairan tawar, kecuali Pangasius polyuranodon
yang terkadang juga ditemui pada perairan payau, serta Pangasius pangasius dan
Pangasius krempfi yang terdapat di perairan laut dan bermigrasi ke perairan tawar (Roberts dan Vidthayanon 1991). Ikan patin tersebar di kawasan Asia Selatan dan Asia Tenggara, tersebar dari India hingga Indonesia (Pouyaud et al. 2004) dan juga China (Yang et al. 2007).
Ikan patin siam tergolong ikan bertulang sejati (teleostei). Ikan teleostei biasanya mempunyai sepasang ovarium berbentuk kompak yang terdapat di dalam rongga perut, berisi oogonium, oosit dengan sel-sel folikel yang mengitarinya, jaringan penunjang atau stroma, jaringan pembuluh darah dan saraf (Nagahama 1983). Oosit dikelilingi oleh dua lapisan utama, di bagian luar lapisan teka dan di bagian dalam lapisan granulose yang masing-masing dipisahkan oleh membran. Sel teka dan granulose berperan sebagai penghasil steroid yang berperan penting dlam proses perkembangan gonad. Kematangan kelamin ikan patin siam dimulai pada umur 3 tahun dengan bobot 2 – 4 kg (Legendre et al. 1998a).
Perkembangan Ovari
Swanson (2008) menyatakan reproduksi pada ikan, seperti pada vertebrata tingkat tinggi diatur oleh sistem endokrin reproduksi yang terdiri dari otak (hypothalamus), kelenjar pituitari dan gonad. Kelenjar pituitari berperan dalam menginisiasi pematangan reproduksi (puberty), pemeliharaan reproduksi sperma dan telur pada gonad, merangsang pematangan akhir dan pengeluaran gamet (spawning).
Perkembangan gonad atau oogenesis ialah transformasi oogonia menjadi oosit. Komponen utama oosit berasal dari senyawa vitelogenin berbobot molekul
Gambar 2 Ikan patin siam (Pangasianodon hypopthalmus) Dokumentasi 2013
6
tinggi asal darah yang disintesis di dalam hati (Donalson dan Hunter 1983). Tyler
et al. 1991 menyatakan bahwa vitelogenin adalah proses induksi dan sintesis vitelogenin dihati. Vitelogenin diangkut melalui darah menuju oosit dan melalui penyerapan secara selektif kemudian disimpan sebagai kuning oosit. Akumulasi kuning oosit tersebut menyebabkan penambahan ukuran oosit. Proses pematangan gonad pada ikan melibatkan dua macam hormone gonadotropin yang dihasilkan oleh adenohipofisis, yaitu FSH yang berperan merangsang perkembangan folikel melalui sekresi estradiol- 17β dan LH yang berperan dalam merangsang pematangan akhir (Nagahama 1983).
Ovari yang terpilih, yaitu yang memiliki tingkat perkembangan gonad (tingkat kematangan gonad) berbeda segera dimasukkan ke dalam botol sampel
berisi larutan fiksatif Bouin’s dan diberikan tanda. Preparasi histologis gonad juga
dilakukan untuk penentuan karakteristik internal oosit agar diperoleh data yang lebih lengkap dan akurat serta sekaligus sebagai pembanding dan penegasan dari hasil dari pengamatan karakteristik eksternalnya. Pembagian tingkat perkembangan ovary (TKG) (P. hypophthalmus) yang disampaikan oleh Siregar (1999) seperti pada
Perubahan bentuk dari oogonia sekunder menjadi oosit dikenal sebagai oogenesis. Saat itu terjadi pertumbuhan sitoplasma dan inti sel di dalam oosit. Selama perubahan itu diiringi pula oleh perubahan folikel (Bromage dan Camaratunga 1988). Selanjutnya membagi pertumbuhan oosit ikan sebagai berikut:
1. Pertumbuhan primer (Previtellogenesis)
2. Pertumbuhan sekunder (Exogenous vitellogenesis) 3. Pertumbuhan tersier (Maturasi, hidrasi, dan ovulasi)
Sementara itu berkaitan periode waktu pemijahan ikan, Wallace dan Selman (1981) membedakan menjadi tiga tipe, yaitu (1) sinkronisme total yaitu seluruh oosit berada pada tingkat perkembangan ataustadia yang sama, (2) sinkronisme per grup yaitu sedikitnya terdapat dua populasi oosit yang berada dalam stadia yang sama dan (3) asinkronisme yaitu oosit pada ovarium terdiri dari semua stadia. Berdasarkan hal tersebut, lamanya jangka pemijahan pada ikan dapat diduga dari ukuran diameter telur. Jika waktu pemijahan pendek, semua telur matang yang terdapat dalam ovarium berukuran sama. Tetapi bila waktu pemijahan pada kisaran waktu yang lama maka ukuran telur yang berada dalam ovarium berbeda-beda.
Pada ikan yang mempunyai siklus reproduksi tahunan atau tengah tahunan akan terlihat adanya puncak-puncak pembelahan oogonia. Ikan yang memijah sepanjang tahun, perbanyakan oogonia akan berlangsung terus menerus sepanjang tahun. Transformasi oogonia menjadi oosit primer banyak terjadi pada tahap pertumbuhan yang ditandai dengan munculnya kromosom. Segera setelah itu, folikel berubah bentuk, dari semula yang berbentuk skuamosa menjadi berbentuk kapsul oosit. Inti sel terletak pada bagian sentral dibungkus oleh lapisan sitoplasma yang tipis. Pada perkembangan selanjutnya, oosit membentuk lapisan korion, membran, granulosa, membran, dan teka. Butir-butir lemak juga mulai terlihat ditumpuk pada sitoplasma dan bersamaan dengan itu muncul kortikal alveoli.
Siklus reproduksi pada ikan betina terbagi menjadi dua periode, yaitu pertumbuhan oosit (gametogenesis atau vitelogenesis) dan periode maturasi (Mananos et al. 2009). Selama proses maturasi terjadi perbedaan tahapan dari perkembangan oosit sebelum terjadi ovulasi atau pemijahan (Akarasanon et al. 2004). Pada kebanyakan spesies non-mamalia, oosit mencapai ukuran akhir selama vitellogenesis dan memulai tahap pematangan serta ovulasi bila ada stimulasi hormonal yang mencukupi (Carnevali et al. 2006). Namun seperti pada kebanyakan vertebrata, oosit ikan teleost yang sudah mencapai pertumbuhan akhir belum dapat dibuahi dan harus mencapai tahap akhir penyelesaian pembelahan meiotik dan perubahan struktur oosit. Proses tersebut meliputi GVBD (germinal vesicle breakdown),
Semua proses tersebut dikendalikan oleh sistem syaraf pusat sebagai respon terhadap perubahan lingkungan (Carnevali et al. 2006) dengan peran tiga mediator utama: gonadotrophin (GTH), MIH (maturation-inducing hormone) dan MPF (maturation-promoting factor) (Nagahama 1987). Sinyal lingkungan yang ditangkap sistem syaraf direspon hipothalamus dengan mengeluarkan
8
gonadotrophin, GtH I atau FSH (follicle-stimulating hormone) dan GtH II atau LH (luteinizing hormone) (Carnevali et al. 2006). Menurut Suzuki et al. 1988 dalam Yaron (1995), kedua substansi tersebut menstimulasi sekresi estradiol dari folikel tetapi GtH II lebih potent menstimulasi sekresi 17,20-P dari folikel post vitellogenik.
Ovulasi berhubungan dengan adanya kerusakan pada germinal folikel (GVBD) dan pemecahan serta pelepasan oosit yang sudah matang (Patino dan Sullivan 2002). Selain peran MIH, gonadothropin dan 2-hydroxyoestradiol juga dilaporkan dapat merangsang kemampuan ovulasi secara langsung. Inkubasi in vitro fragmen ovari ikan Atlantic croacker pada medium 5 IU HCG tanpa dilanjutkan dengan inkubasi pada MIH dapat tetap merangsang kemampuan pematangan oosit dan ovulasi (Patino dan Sullivan 2002). Sedangkan inkubasi in vitro folikel utuh ikan lele pada medium 5 mM 2-hydroxyoestradiol dapat merangsang sintesis 17α,20β-dihydroxy-4-pregnen-3-one dan menghasilkan pengaruh signifikan pada GVBD (Mishra dan Joy 2006).
Menurut Effendi (1997) kematangan seksual pada ikan dicirikan oleh perkembangan diameter rata-rata telur dan distribusi penyebaran ukuran telur. Setelah mencapai ukuran maksimum, perkembangan akan terhenti dan oosit akan memasuki fase dorman (Woynarovich dan Hovarth 1980).
Gambar 3 Skema proses perkembangan oosit (Nagahama et al. 1995)
hormon. Sinyal lingkungan akan ditangkap oleh hipotalamus dan mengaktifkan sel LHRH yang akan merangsang kelenjar pituitary (hipofisis) untuk menghasilkan gonadotropin.
Manipulasi hormon merupakan salah satu teknik yang dapat digunakan untuk menginduksi kematangan gonad, ovulasi, dan pemijahan. Berbagai jenis hormon terdapat pada tubuh ikan, salah satu yang dapat memicu terjadinya ovulasi adalah LHRH (Leutinizing Hormone Releasing Hormone), yaitu hormon dari golongan protein yang dihasilkan oleh hipotalamus. LHRH memiliki molekul yang sangat kecil sehingga bila diberikan pada ikan maka terjadi penguraian yang sangat cepat . LHRH memiliki waktu paruh yang pendek. Oleh karenanya, para ahli menciptakan LHRH sintetik (LHRHa) yang bertujuan untuk memperpanjang waktu paruh atau keberadaannya lebih lama dalam darah. Sejak tahun 1980, LHRH-a telah digunakan untuk merangsang ovulasi dan pemijahan ikan. LHRHa bekerja merangsang sekresi hormon gonadotropin dari kelenjar hipofisa yang dapat merangsang terjadinya ovulasi dan pemijahan (Abdullah 2007). Penggunaan LHRHa melalui penyuntikan pada induk betina ternyata dapat meningkatkan produksi telur sedangkan pada induk jantan dapat meningkatkan jumlah spermatozoa (Linhart et al. 2000). Namun pada kondisi alamiah sekresi gonadotropin dihambat oleh dopamin, karenanya diperlukan suatu mekanisme baru yang dapat menghambat ataupun menghentikan kerja dari dopamin.
Secara alami, vitelogenesis dan diferensiasi oosit diawali dengan adanya sinyal lingkungan seperti hujan, perubahan suhu atau katersedian substrat untuk penempelan telur yang diterima oleh sistem syaraf pusat dan diteruskan ke hipotalamus. Hipotalamus akan merespon sinyal tersebutdengan melepaskan GnRH yang bekerja dikelenjar hipofisis. Selanjutnya kelenjar hipofisis akan melepaskan hormon GTH I yang bekerja di lapisan teka pada oosit (Yaron 1995). Akibat kerja hormon GTH I pada ovarium, lapisan teka akan mensintesis testosteron. Selanjutnya pada lapisan granulosa, testosteron akan diubah menjadi estradiol-17β oleh enzim aromatase. Estradiol-17β akan merangsang hati untuk mensintesis vitelogenin yang merupakan bakal kuning telur. Melalui aliran darah, vitelogenin akan diserap secara selektif oleh lapisan folikel oosit. Proses inilah yang dikenal dengan vitelogenesis, sedangkan proses selanjutnya adalah pematangan akhir yang di dalamnya terjadi pergerakan inti telur ke tepi atau germinal vesicle breakdown (GVBD) dan ovulasi yang ditandai dengan pecahnya lapisan folikel dan keluarnya telur ke dalam rongga ovari (Yaron 1995).
Anti Dopamin
Dopamin menghambat sekresi GnRH (FSHGH), perkembangan gonad dengan menstimulus sekresi hormon penghambat perkembangan gonad dan bahan kimia yang dapat menghambat kinerja dopamine adalah antidopamin Chan et al
10
merangsang ovulasi ikan sumatra (Puntius tetrazona). Demikian pula percobaan penggunaan spawnprim oleh Hidayat (2010) yang mampu menginduksi ovulasi ikan komet (Carassius auratus auratus) pada komposisi domperidone10 mg/ml.
Aromatase Inhibitor
Aromatase inhibitor mampu membloking produksi estrogen dengan menghambat proses aromatase pada hipotalamus – hipofisis – gonad dari umpan balik negatif estrogen, hasilnya sekresi FSH meningkat merangsang perkembangan ovary sampai terjadinya ovulasi, sehingga AI dapat digunakan sebagai induksi ovulasi (Holzer et al. 2006).
Secara umum aromatase inhibitor menghambat aromatase melalui dua cara yaitu dengan menghambat proses transkripsi dari gen- gen aromatase sehingga mRNA tidak terbentuk dan sebagai konsekuensinya enzim aromatase tidak ada, atau melalui cara bersaing dengan substrat alami (testosteron) sehingga aktivitas aromatase tidak berjalan (Brodie 1991).
Penyuntikan aromatase inhibitor diharapkan mampu menghambat kerja enzim aromatase dalam mengkonfersi testosteron menjadi estradiol-17β pada lapisan sel granulosa. Hal ini menyebabkan konsentrasi hormon estradiol-17β dalam darah menurun sehingga menghambat hati untuk mensintesis vitelogenin maka proses viteligenesis terhenti.
Menurut Affonso et al. (1999b) penyuntikan inhibitor aromatase dengan dosis 10 mg/kg pada ikan coho salmon siap mijah, menurunkan produksi estradiol-17β setelah penyuntikan, produksi testosteron meningkat mencapai puncaknya atau sebesar 294 ng/ml setelah 96 jam setelah penyuntikan,produksi
17α, 20β dihidroksi- 4- pregnen-3-one (17α,20β-DP) mulai meningkat pada 6 jam
setelah penyuntikan, dan mencapai puncaknya atau sebesar 733.4 ng/ml 192 jam setelah penyuntikan. Pada hari ke- 10 setelah penyuntikan mulai terjadi ovulasi sebanyak 67% dan tingkat fertilisasinya mencapai 85%.
testosterone, meningkatkan 17α, 20β dihidroksi- 4- pregnen-3-one (17α,20β-DP) dan testosterone. Juga terjadi penghambatan perkembangan oosit, serta banyak ditemui oosit yang mengalami atresi. Atresi juga terjadi gonad kekurangan hormon gonadotropin (Woynarovich dan Howard 1980). Hong dan Donalson (1998) menyatakan bahwa implantasi IA dengan dosis 100mg/kg berat tubuh pada 44 hari perlakuan telah terjadi atresi pada gonad ikan coho salmon.
Aromatase inhibitor (AI) mampu membloking produksi estrogen dengan menghambat proses aromatisasi pada hipothalamus-hipophisis-gonad axis dari umpan balik negatif estrogen, hasilnya sekresi FSH meningkat merangsang perkembangan ovari sampai terjadinya ovulasi, sehingga AI dapat digunakan sebagai induksi ovulasi (Casper dan Mitwally 2006).
Prostaglandin (PGF2α)
Prostaglandin (PG) tersebar luas di berbagai jaringan pada hewan dan tumbuhan. Itu telah diusulkan bahwa PG, terutama PGF2a dan PGE2, memainkan peran penting dalam fisiologi reproduksi, terutama dalam ovarium steroidogenesis (Denning-Kendall et al. 1994), ovulasi, partus, dan pemijahan pada mamalia dan teleosts (Murdoch et al. 1993; Stanley-Samuelson et al. 1993; Pertricellis et al.
1994; 1994). Dalam invertebrata juga PG telah dilaporkan untuk menginduksi pemijahan di abalone Haliotis refescens dan kerang Mytilus califorianus (Morse et al. 1977), dan merangsang produksi telur di air tawar siput Helisoma durgi (Kunigelis et al. 1986).
Prostaglandin merupakan salah satu hormon yang berperanan penting dalam proses-proses reproduksi. Reproduksi atau perkembangbiakan adalah suatu kemewahan fungsi tubuh yang secara fisiologik tidak vital bagi kehidupan individual tetapi sangat penting bagi kelanjutan keturunan suatu jenis atau bangsa hewan. Menurut Brander dan Pugh (1977) prostaglandin adalah suatu hormon jaringan yang tersebar luas di dalam tubuh hewan yang terdiri atas beberapa bentuk dan dapat menyebabkan respon yang luas terhadap organ-organ tubuh. Prostaglandin berasal dari asam-asam lemak tidak jenuh dan mempunyai 20 buah untaian carbon (C) dan disertai dengan sebuah cincin yang mempunyai 5 buah atom c. Berdasarkan strukturnya prostaglandin dibagi dalam 5 kelompok, yaitu prostaglandin A (PGA), PGB, PGC, PGE dan PGF. Prostaglandin yang terbanyak didapati dalam jaringan tubuh adalah PGE dan PGF.
12
3 METODE
Waktu dan Tempat
Penelitian ini telah dilaksanakan pada bulan Oktober 2012 sampai Maret 2013 dan bertempat di kolam Percobaan Babakan Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor dan Balai Besar Pengembangan Budidaya Air Tawar Sukabumi. Selin itu analisis hormon dilakukan di Laboratorium Hormon Unit Rehabilitasi dan Reproduksi Departemen Klinik, Reproduksi dan Patologi Fakultas Kedokteran Hewan Institut Pertanian Bogor .
Bahan Penelitian
Alat yang digunakan dalam penelitian ini adalah sepuluh buah syringe 0.5 ml, enam buah syringe 10 ml, sepuluh buah syringe 3ml, kain lap, kamera digital, cawan petri, serokan ikan, mikroskop mikrometer, timbangan digital, botol 10ml sepuluh buah, kateter, gelas piala, lampu senter, dua buah baskom, dua belas buah waring, sepuluh buah akuarium, dan kolam, dan alat-alat untuk mengukur kualitas air.
Bahan yang digunakan dalam penelitian ini adalah ikan patin siam sebagai ikan uji yang sudah matang gonad, LHRH, aromatase inhibitor, anti dopamin,
PGF2α (Prostaglandin), Oxytocin, larutan NaCl 0.90%, propelin glycol, larutan
serra, dan anti koagulan.
Ikan Uji
Ikan uji yang digunakan adalah ikan patin yang siap memijah. Ikan patin yang digunakan berumur 3 tahun dengan bobot yang berkisar antara 1 – 3.5kg / ekor. Sebanyak 70 ekor induk ikan patin siam.
Persiapan Wadah
Wadah yang digunakan untuk pemeliharaan ikan adalah kolam dengan dimensi 12 x 6 x 1.5 m dan waring berdimensi 300 x 200 x 90 cm. Sedangkan wadah yang digunakan untuk perlakuan penelitian yaitu bak fiber bulat dengan kapasitas volume air sebanyak 3000 L.
Persiapan wadah pemeliharaan dilakukan dengan menseleksi kolam yang tidak bocor ataupun rembes. Selanjutnya kolam dibersihkan dari sisa kotoran. Setelah bersih, kolam dibiarkan kering sendiri selama 3 hari, hal ini dilakukan untuk menguapkan spora dari bibit penyakit yang masih hidup mati. Setelah itu, kolam diisi dengan air sumur dan di pasang waring.
mengecek apakah bocor atau tidak. Setelah bersih, bak fiber dikeringkan selama 1 hari. Selanjutnya bak fiber tersebut baru akan diisi dengan air sehari sebelum perlakuan dimulai. Gambar tata letak kolam dan waring terdapat pada Lampiran 1.
Pemeliharaan Ikan
Ikan patin yang digunakan adalah ikan patin siam dengan ukuran 1 kg sampai 3.5 kg yang diperoleh dari petani patin di Bogor. Pada awal pemeliharaan, ikan dipelihara dalam waring yang berdimensi 300 x 200 x 90 cm. Sebelum ditebar dalam waring, ikan diaklimatisasikan terlebih dahulu selama beberapa menit hingga suhu dalam kolam dan antara ikan jantan dan betina dipisah.
Pembuatan Spawnprime
Spawnprime adalah campuran larutan dari lima macam bahan yaitu larutan LHRH, larutan aromatase inhibitor (AI), larutan anti dopamin (AD), PGF2α (Prostaglandin), dan oxytocin.
Rancangan Penelitian
Penelitian ini menggunakan metode eksperimen dengan menggunakan Rancangan Acak Lengkap (RAL) yang terdiri dari sepuluh perlakuan dan masing-masing diulang lima kali.
Perlakuan yang akan diuji adalah kombinasi penggunaan LHRH, anti dopamin, Aromatase inhibitor, prostaglandin (PGF2α), dan oxytocin dala spawnprime : Kontrol positif : ovaprim (0.6 ml/kg)
Kontrol negatif : larutan fisiologis (NaCl 0.90% /kg) Spawnprime 1 : LHRHa + AI
Spawnprime 2 : AD + AI
Spawnprime 3 : LHRHa + AD + AI + PGF2α
Spawnprime 4 : LHRHa + AD + AI + PGF2α + Oxytocin Spawnprime 5 : LHRHa + AD + oxytocin
Spawnprime 6 : LHRHa + AD + PGF2α Spawnprime 7 : AI + oxytocin
Spawnprime 8 : AI + PGF2α
Seleksi Ikan Uji
14
gonad ditandai dengan bagian perut atas (dibawah linea lateralis) yang membesar dan cenderung lembek, warna tubuh yang cenderung memudar, serta warna daerah genital yang cenderung berwarna kuning bening.
Parameter Uji
Analisis hormon estradiol - 17 β
Untuk mengetahui fluktuasi konsentrasi hormon estradiol 17- β selama penelitian, maka dilakukan pengambilan darah terhadap 3 sampel ikan uji pada masing – masing perlakuan yaitu pada jam ke -0, jam ke - 6, dan jam ke - 12. Metodenya dengan membius ikan menggunakan minyak cengkeh dengan konsentrasi 0.5 ppm. Darah diambil sebelum hormon disuntikan dan diambil dari arteri pada pangkal ekor sebanyak 1 ml menggunakan syringe bervolume 3 ml yang sebelumnya syringe di beri anti koagulan, selanjutnya disentrifiuse dengan kecepatan 5000 rpm selama 15 menit , plasma darah diambil dan disimpan pada
freezer bersuhu – 20 oC selama 12 jam selanjutnya dilakukan pengukuran dengan menggunakan metode Vidas ELISA kit untuk 17- estradiol (REF 30 330), Kit hormon terdiri atas strip dengan 10 well (Lampiran 9).
Keberhasilan dan Lama Waktu Ovulasi
Setelah ikan diberikan perlakuan (dengan disuntik) sesuai dengan dosisnya kemudian diamati hasilnya yakni ikan berhasil berovulasi atau tidak. Jika ikan berovulasi maka dilakukan juga pencatatan terhadap lamanya waktu ikan tersebut berovulasi setelah ikan tersebut disuntik. Pengamatan terhadap berhasil tidaknya ikan berovulasi dimulai pada enam jam pasca penyuntikan dilakukan.
Jumlah Telur yang Diovulasikan (Spawned Eggs)
Pengamatan adanya telur dilakukan pada dasar bak fiber setelah 6 jam penyuntikan. Pengamatan dilanjut setiap 30 menit. Dilakukan stripping/ pengurutan telur pada induk yang tidak memijah setelah 6 jam
Diameter Telur
dikalikan dengan pembesaran empat puluh kali, maka didapatkan hasil diameter telur ikan patin sebenarnya dalam satuan mm.
Derajat Pembuahan
Derajat pembuahan ditentukan dari jumlah telur yang dibuahi dibagi dengan jumlah total telur dan dinyatakan dalam persen. Derajat pembuahan dapat dihitung dengan menggunakan rumus Effendie 1997 :
Derajat Penetasan
Derajat penetasan ditentukan dari jumlah telur yang menetas dibagi dengan total telur yang dibuahi dan dinyatakan dalam persen. Derajat penetasan dapat dihitung dengan menggunakan rumus sebagai berikut :
Tingkat Kelangsungan Hidup Larva setelah 4 hari (SR4)
Tingkat kelangsungan hidup larva setelah 4 hari (SR4) dihitung berdasarkan jumlah larva pada hari kedua setelah menetas dibagi jumlah total larva yang menetas. Menggunakan rumus Effendie 1997 yaitu :
Survival Rate 4 (SR4) = x 100%
Analisis Data
16
4 HASIL DAN PEMBAHASAN
HASIL
Konsentrasi Estradiol Dalam Darah
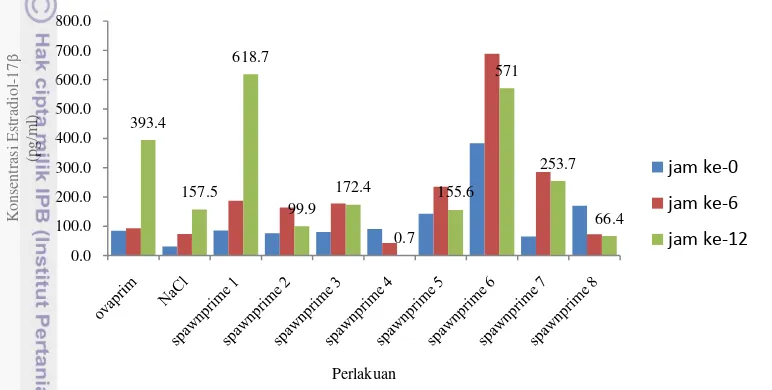
Konsentrasi hormon dalam darah ikan patin hasil induksi ovulasi dapat dilihat pada (Gambar 5) Lampiran 2.
Gambar 5 Kadar estradiol-17β dalam plasma ikan patin siam
Konsentrasi hormon estradiol-17β dalam darah ikan patin siam (pangasianodon hypopthalamus) selama percobaan dapat dilihat pada Gambar 5 dan Lampiran 2. Konsentrasi hormon estradiol-17β dalam darah pada ikan yang diberi perlakuan ovaprim, NaCl, spawnprime 1 sampai 8 menunjukkan perubahan estradiol dari jam ke – 0, jam ke- 6 dan jam ke- 12 pasca penyuntikan. Setelah itu pada induk patin yang disuntik dengan ovaprim mengalami kenaikan konsentrasi estradiol-17β sampai jam ke 12 seperti perlakuan NaCl, dan spawnprime 1. Sementara spawnprime 2 sampai 8 mengalami knalikan dari jam ke 0 sampai jam ke 6, dan mengalami penurunan konsentrasi estradiol-17β pada jam ke 12. Dimana pada perlakun tersebut menunjukkan final oosit maturation (FOM), khusus pada perlakuan spawnprime 3, 4, 7 dan 8 penurunan ini menyebabkan pemijahan secara semi alami, dimana konsentrasi estradiol paling rendah terdapat pada perlakuan spawnprime 4, kelompok ikan ini terjadi pemijahan semi alami dan waktu pemijahan yang tercepat.
Keberhasilan dan Lama Waktu Ovulasi
Induksi ovulasi pada ikan patin dengan perlakuan ovaprim dapat merangsang ovulasi dengan persentase keberhasilan mencapai 100%, demikian pula dengan pelakuan spawnprime. Pada penyuntikan dengan NaCl pada control negatif ternyata tidak merangsang terjadinya ovulasi pada ikan patin. Hal ini
terlihat dari kemampuan perlakuan spawnprime 3 dan 4 dalam menginduksi induk patin yang sudah matang gonad untuk berovulasi sendiri atau tanpa striping
(Gambar 6).
Spawnprime 3 spawnprime 4
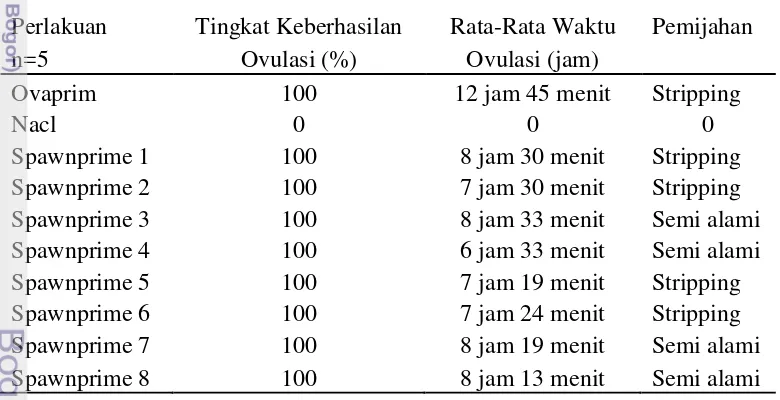
Tabel 2 Keberhasilan dan lamanya waktu ovulasi pada ikan patin
Perlakuan Tingkat Keberhasilan Rata-Rata Waktu Pemijahan
n=5 Ovulasi (%) Ovulasi (jam)
Ovaprim 100 12 jam 45 menit Stripping
Nacl 0 0 0
Spawnprime 1 100 8 jam 30 menit Stripping
Spawnprime 2 100 7 jam 30 menit Stripping
Spawnprime 3 100 8 jam 33 menit Semi alami
Spawnprime 4 100 6 jam 33 menit Semi alami
Spawnprime 5 100 7 jam 19 menit Stripping
Spawnprime 6 100 7 jam 24 menit Stripping
Spawnprime 7 100 8 jam 19 menit Semi alami
Spawnprime 8 100 8 jam 13 menit Semi alami
Pada Tabel 2, keberhasilan ovulasi pada semua perlakuan mencapai 100% kecuali pada perlakuan NaCl, pada seluruh perlakuan spawnprime 1 sampai 8 menghasilkan waktu ovulasi lebih cepat dibandingkan dengan ovaprim yaitu 12 jam 45 menit dengan proses pemijahan secara stripping. Dimana perlakuan spawnprime 3, 4, 7 dan 8 memijah secara semi alami, bahkan spawnprime 4 menghasilkan waktu ovulasi yang paling cepat yaitu 6 jam 33 menit dengan pemijahan semi alami, artinya ikan ini memijah tanpa distripping. Sedangkan Gambar 6 Induk ikan patin yang disuntik perlakuan spawnprime 3 dan 4.
18
perlakuan lainnya masih dengan cara distripping tetapi memiliki waktu yang lebih cepat dari ovaprim.
Jumlah Telur yang Dikeluarkan (Spawned Egg)
Pada penelitian ini digunakan induk ikan patin siam yang telah matang gonad dengan bobot yang berbeda dengan kisaran bobot 1.5 kg – 3.5 kg. Dari ikan-ikan yang berovulasi, seluruh telur yang dikeluarkan dihitung dan didapatkan hasil jumlah telur yang diovulasikan berkisar antara 122.100 ± 28179 sampai 140.912 ± 21304 butir telur. Namun secara statistik tidak menunjukkan perbedaan yang nyata antar perlakuan P>0.05 (Lampiran 3). Jumlah telur yang diovulasikan pada penelitian ini dapat dilihat pada Gambar 7:
Hasil penelitian yang di ANOVA menggunakan Minitab 16, seluruh perlakuan berpengaruh signifikan terhadap jumlah telur yang diovulasi semua (P> 0.05). Hasil terbaik adalah perlakuan spawnprime 4 dengan jumlah telur ikan patin yang diovulasikan sebesar 140.912 ± 21304.
Diameter Telur
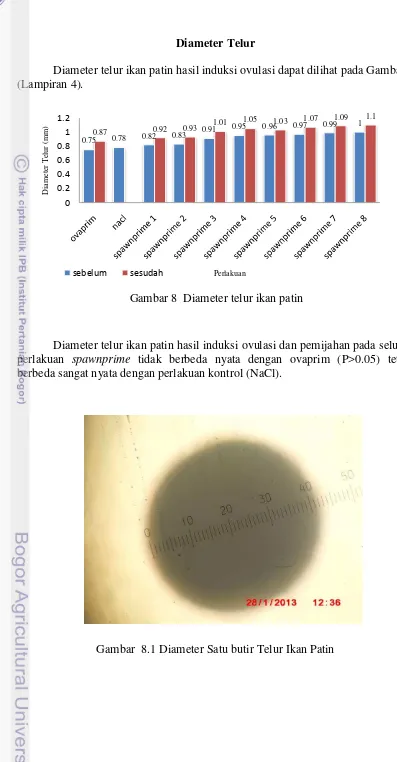
Diameter telur ikan patin hasil induksi ovulasi dapat dilihat pada Gambar 8 (Lampiran 4).
Diameter telur ikan patin hasil induksi ovulasi dan pemijahan pada seluruh perlakuan spawnprime tidak berbeda nyata dengan ovaprim (P>0.05) tetapi berbeda sangat nyata dengan perlakuan kontrol (NaCl).
Gambar 8.1 Diameter Satu butir Telur Ikan Patin
0.75 0.78 0.82 0.83
0.91 0.95 0.96 0.97 0.99 1
0.87 0.92 0.93
1.01 1.05 1.03 1.07 1.09 1.1
0 0.2 0.4 0.6 0.8 1 1.2
D
ia
me
te
r
T
el
u
r
(mm
)
Perlakuan
sebelum sesudah
20
Derajat Pembuahan Telur Patin
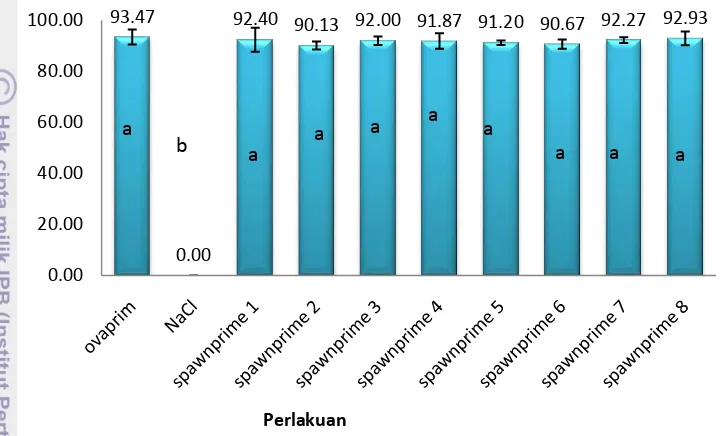
Derajat pembuahan telur hasil induksi ovulasi pada penelitian ini dapat dilihat pada Gambar 9 (Lampiran 5) :
Hasil penelitian pada Gambar 9 menunjukkan secara analisis ANOVA menggunakan Minitab 16, hasil analisis data pada lampiran 5 menggunakan ANOVA (Minitab 16) menunjukkan bahwa seluruh perlakuan berpengaruh signifikan terhadap derajat pembuahan telur patin (P> 0.05).
Derajat Penetasan Telur Patin
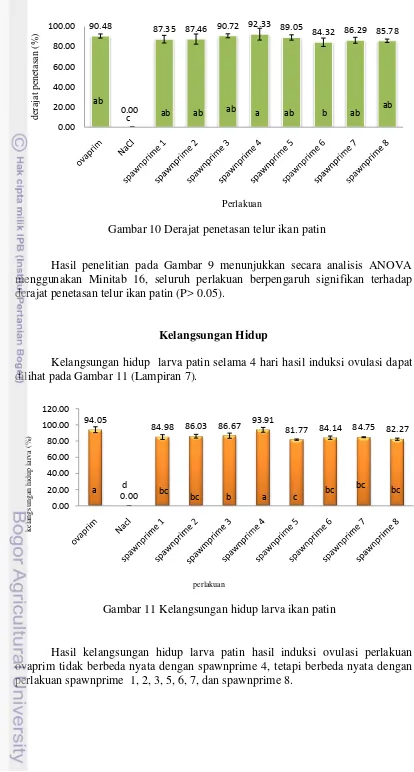
Derajat penetasan telur ikan patin hasil induksi ovulasi dapat dilihat pada Gambar 10 (Lampiran 6).
Gambar 9 Derajat pembuahan ikan patin 93.47
0.00
92.40 90.13 92.00 91.87 91.20 90.67 92.27 92.93
Hasil penelitian pada Gambar 9 menunjukkan secara analisis ANOVA menggunakan Minitab 16, seluruh perlakuan berpengaruh signifikan terhadap derajat penetasan telur ikan patin (P> 0.05).
Kelangsungan Hidup
Kelangsungan hidup larva patin selama 4 hari hasil induksi ovulasi dapat dilihat pada Gambar 11 (Lampiran 7).
Hasil kelangsungan hidup larva patin hasil induksi ovulasi perlakuan ovaprim tidak berbeda nyata dengan spawnprime 4, tetapi berbeda nyata dengan perlakuan spawnprime 1, 2, 3, 5, 6, 7, dan spawnprime 8.
90.48
0.00
87.35 87.46 90.72 92.33 89.05 84.32 86.29 85.78
0.00
84.98 86.03 86.67 93.91 81.77 84.14 84.75 82.27
22
Tabel 3 Hasil penghitungan harga spawnprime dibandingkan dengan ovaprim Premix Harga (Rp) Penghematan (%) per 10ml
Produk Pemijahan Harga (Rp) Ovaprim Stripping 200.000 - 220.000 Spawnprime 1 Stripping 115.000 Spawnprime 2 Stripping 15.000 Spawnprime 3 Semi Alami 140.000 Spawnprime 4 Semi Alami 155.000 Spawnprime 5 Stripping 135.000 Spawnprime 6 Stripping 129.000 Spawnprime 7 Semi Alami 140.000 Spawnprime 8 Semi Alami 38.000
Berdasarkan hitungan secara ekonomi maka spawnprime yang paling ekonomis dibandingkan dengan ovaprim. Seiring dengan meningkatnya kandungan LHRHa pada spawnprime maka harga pun meningkat. Karena spawnprime menunjukkan bahwa komponen LHRHa yang paling mahal, tetapi pada spawnprime 4 lebih efisien dan efektif terhadap induksi ovulasi dan pemijahan ikan patin secara semi alami bila dibandingkan dengan ovaprim.
Pembahasan
Pemijahan adalah proses pengeluaran sel telur oleh induk betina dan sperma oleh induk jantan yang kemudian diikuti dengan perkawinan. Pemijahan sebagai salah satu aspek dari reproduksi merupakan mata rantai dari siklus hidup yang menentukan kelangsungan hidup species. Penambahan populasi ikan tergantung dari kondisi tempat telur dan larva ikan yang kelak akan berkembang. Oleh karena itu pemijahan menuntut keamanan bagi kelangsungan hidup larva/benih ikan, tempat yang cocok, waktu yang tepat dan kondisi yang lebih menguntungkan.
Sampai saat ini, pemijahan ikan patin masih dilakukan secara buatan yaitu melalui pemberian rangsangan hormon untuk proses pematangan akhir gonad, pengeluaran telur dilakukan dengan cara pengurutan (stripping) dan pembuahan dilakukan secara kering dengan mencampur sperma dan telur.
bisa, maka dari itu di lakukannya manipulasi Rangsangan hormonal yang diberikan kepada ikan merupakan salah satu alternaltif dalam memanipulasi proses ovulasi, dikarenakan tidak adanya reflex spawning. Maka dari itu pemijahan harus dilakukan dengan cara stripping.
Penelitian ini bertujuan menginduksi secara hormonal ovulasi dan pemijahan semi alami pada ikan patin siam (Pangasianodon hypopthalmus) dan mengevaluasi efektifitas efisiensi penggunaan kombinasi hormon LHRH, AD, AI,
PGF2α, oxytocin dengan ovaprim dalam induksi pemijahan ikan patin.
Parameter penelitian yang diuji meliputi konsentrasi estradiol-17β, keberhasilan dan lama waktu ovulasi, jumlah telur yang diovulasi, diameter telur, derajat pembuahan, derajat penetasan, dan kelangsungan hidup. Estradiol-17β merupakan steroid yang penting terutama pada ikan betina yang sedang mengalami proses vitelogenesis. Proses pematangan gonad diprediksi melalui kadar testosteron dan estradiol-17β plasma terhadap perkembangan oosit (Mackenzie et al. 1989). Oleh karena itu kadar steroid plasma dapat digunakan sebagai indikator dari pematangan gonad (Zairin et al. 1992).
Hasil penelitian menunjukkan bahwa perlakuan spawnprime 4 merupakan perlakuan terbaik pada penelitian ini. Hasil pada parameter pertama yaitu konsentrasi estradiol-17β, membuktikan bahwa perlakuan spawnprime 4 dapat menginduksi ovulasi dan pemijahan ikan patin secara semi alami. Konsentrasi estradiol-17β dalam plasma darah ikan patin menunjukkan pada spawnprime 3, 4, 7, dan 8 mengalami penurunan pada jam ke- 12, dimana kematangan sudah sempurna dan terjadinya ovulasi sehingga perlakuan tersebut memijah secara semi alami. Penurunan estradiol 17β dan aromatase menyebabkan oosit mengalami GVBD dan berakhir pada ovulasi. Oleh karena itu, proses ovulasi yang ditambahkan AI lebih lama dibandingkan tanpa penambahan AI. Namun demikian konsentrasi LHRHa pada ovaprim sangat tinggi sehingga dengan adanya penurunan LHRHa dapat disubstitusi melalui AI.
Keberadaan estradiol-17β menyebabkan terjadinya umpan balik positif terhadap GTH, pada awal perkembangan oosit setelah ovulasi terjadi peningkatan GTH diikuti peningkatan estradiol-17β (Fostier et al. 1983), semakin tinggi produksi estrogen menyebabkan oosit berkembang semakin besar (Afono et al.
1999a; Nagahama et al. 1995). Estardiol- 17β merangsang hati untuk memproduksi vitelogenin (VTG), dialirkan kedalam darah dan akan masuk kedalam oosit. Dipihak lain estradiol-17β yang semakin tinggi akan menyebabkan umpan balik negatif terhadap FSH dan umpan balik positif terhadap LH. Umpan balik negatif terhadap FSH berakibat pada penurunan aktivitas aromatase yang diikuti penurunan produksi estradiol- 17β. Puncak aktivitas aromatase pada ikan pascavitelogenesis, penelitian ini terjadi pad jam ke-6 setelah diinduksi. Setelah mencapai pascavitelogenesis aktivitas aromatase akan menurun drastis yang diikuti penurunan produksi estradiol- 17β (Nagahama et al. 1995)
24
dibandingkan ovaprim. Hal ini sesuai dengan Casper dan Mitwally, (2006) yang menyebutkan bahwa AI dapat memblocking produksi estrogen dengan menghambat aromatase pada organ tertentu yang menghasilkan sekresi FSH yang meningkat sehingga merangsang perkembangan ovari sehingga terjadi ovulasi. Hal lain juga yang mempengaruhi adalah aktivitas aromatase akan meningkat dan mencapai puncaknya pada pasavetelogenesis. Hal ini sesuai dengan Nagahama (1995) yang menyebutkan kinerja aromatase akan meningkat dan terjadi kinerja yang optimum pada saat pascavitelogenesis karena pascavitelogenesis produksi
estradiol 17βakan menurun demikian juga aromatase.
Keberhasilan memijah juga ditunjukkan pada perlakuan premiks buatan. Pada perlakuan C.1-C.3, tingkat keberhasilannya mencapai 66,67% dan perlakuan C.4 mencapai 100%. Hal tersebut menunjukkan bahwa premiks buatan tersebut juga mampu memicu terjadinya ovulasi pada ikan Sumatra (Permana 2009). Kemampuan dari LHRHa dalam merangsang pengeluaran hormon gonadotropin dibantu dengan adanya anti dopamin yang mampu menghambat kerja dopamin telah cukup terbukti untuk mempercepat dan memicu terjadinya ovulasi. Pemberian aromatase inhibitor juga dapat memicu terjadinya ovulasi . Hal ini dikarenakan, aromatase inhibitor memiliki peran dalam menurunkan aktivitas aromatase dalam gonad akibatnya produksi estrogen-17β turun dan meningkatkan produksi testosteron, hal tersebut merupakan awal sinyal balik positif terhadap LH sehingga proses pematangan oosit akan berlangsung lebih cepat. Menurut Basuki (2007), penambahan aromatase inhibitor (AI) juga memungkinkan kerja LH dalam menurunkan enzim aromatase tadi akan diperkuat atau digantikan oleh AI, sehingga peranan LH dalam proses pematangan dan ovulasi akan lebih efisien.
Keberhasilan memijah pada ikan bergantung kepada faktor internal dan eksternal. Faktor internal antara lain: genetika, umur induk, ukuran induk, dan tingkat kematangan gonad yang dipengaruhi oleh sistem fisiologis yang berlangsung di dalam tubuh ikan, khususnya sistem hormon. Faktor eksternal merupakan faktor yang mampu merangsang ikan memijah, seperti lingkungan yang meliputi substrat, pakan, suhu, intensitas cahaya, kulaitas air, dan tingkat stres. Adanya faktor lingkungan yang dapat diterima sebagai sinyal maka pemijahan dapat terjadi. Hal ini diungkapkan oleh Sumantri (2006) yang menyebutkan bahwa pemijahan dapat terjadi karena faktor eksternal seperti suhu, pakan, cahaya, dan lain-lain.
Parameter jumlah telur yang diovulasikan pada penelitian ini berkisar antara 122.100 ± 28179 sampai 140.912 ± 21304 butir. Pada perlakuan
yang telah masak sebelum folikel pecah, karena pengaruh hormon dalam perkembangan dan pematangan oosit berperan besar dalam proses tersebut.
Parameter diameter telur, diameter telur akan berbeda antar pelakuan yang diberikan hormon dengan yang alami. Hal ini terjadi karena diameter telur dapat dipengaruhi oleh induksi hormon yang diberikan pada induk. Ukuran diameter telur dipengaruhi oleh banyaknya vitelogenin yang tersimpan di dalamnya yang terjadi ketika proses perkembangan telur. Namun demikian, menurut Effendie (1997) tidak semua ikan memiliki hubungan yang berbanding lurus antara fekunditas dan diameter sel telur. Ukuran telur ikan berkaitan dengan tingkat kematangan gonad pada induk. Semakin tinggi tingkat kematangan gonad maka ukuran telur semakin membesar dan akan berhenti setelah mencapai ukuran tertentu (maksimal). Saat kondisi tersebut menurut Abdullah (2007), nukleus tertarik ke tengah dan mengalami perubahan bentuk selama beberapa saat. Tahap ini disebut tahap istirahat (dorman) dimana ikan menunggu kondisi lingkungan yang baik untuk memijah. Induk ikan yang diseleksi sebelum diberi perlakuan telah mencapai tingkat kematangan gonad akhir dengan ukuran telur dominan diduga telah mencapai ukuran tertentu (maksimal). Berdasarkan hasil pada Gambar 10, diameter telur ikan yang disuntik Spawnprime 1, 2, 3, 4, 5, 6, 7dan 8 dan Ovaprim memiliki ukuran yang tidak berbeda nyata. Dominansi telur yang telah mencapai ukuran maksimal mengalami ovulasi setelah dirangsang oleh
Spawnprime dan Ovaprim sehingga telur yang dikeluarkan memiliki ukuran yang sama. Diameter telur yang terbesar yakni 1.10 ± 0.05 pada perlakuan spawnprime
8, hal ini dijelaskan oleh Nagahama et al. (1995) menyatakan bahwa perkembangan oosit dari pravitelogenesis ke vitelogenesis terjadi karena peningkatan produksi estradiol-17β. SNI (2000) Matang gonad pada ikan betina adalah kondisi ikan yang sudah siap untuk dikawinkan (dipijahkan) yang ditandai oleh diameter telur yang sudah mencapai ukuran 1.0 mm – 1.2 mm, seragam dan tidak menggumpal bila diberikan larutan sera inti terlihat berada di pinggir serta warna telur kekuningan. Pada ikan jantan ditandai oleh urogenitalnya yang memerah, bila dilakukan pengurutan pada bagian perut akan mengeluarkan sperma berwarna putih susu dan kental.
Pembuahan merupakan peleburan sel gamet jantan dengan sel gamet betina. Saat terjadi pembuahan hanya satu sel gamet jantan yang akan masuk melalui lubang mikrofil pada sel gamet betina. Pembuahan juga sering dijadikan indikator kualitas telur dimana kemampuan telur untuk berkembangan menjadi embrio setelah terjadi pembuahan hingga menetas dipengaruhi reaksi-reaksi dari dalam telur itu sendiri. Berdasarkan hasil pada Gambar 7, pembuahan telur ikan yang disuntikan Spawnprime dan Ovaprim memiliki derajat yang tidak berbeda nyata. Spawnprime dan Ovaprim memiliki kinerja yang sama untuk menghasilkan kualitas telur yang diovulasikan, sehingga kemampuan telur terbuahi setelah dicampur sperma pun sama, namun pada penyuntikan dengan ovaprim menghasilkan 93.47% ± 2.96.
26
Hasil penelitian membuktikan bahwa penyuntikan perlakuan spawnprime 4 efektif dan efisien untuk induksi ovulasi dan pemijahan ikan patin secara semi alami, hal ini terlihat dari konsistensi hasil yang dicapai pada setiap parameter dbandingkan perlakuan kontrol (ovaprim) dengan teknik pemijahan secara stripping. Bila dibandingkan dengan spawnprime 4 teknik pemijahannya secara semi alami dan menghasilkan waktu ovulasi yang paling tercepat dibandingkan ovaprim yaitu 6 jam 33 menit sedangkan ovaprim 12 jam 45 menit.
Biaya pembuatan spawnprime seperti yang ditunjukkan pada tabel 3, spawnprime 4 memiliki biaya pengadaan yang paling efisien, dimana biaya pembuatan spawnprime ini sebesar Rp. 155.000,- dengan tingkat keberhasilan dan waktu memijah tercepat bila dibandingkan dengan ovaprim yaitu 6 jam 33 menit. Melalui penggunaan spawnprime 4 dalam menginduksi ovulasi dan pemijahan secara semi alami pada ikan patin, dapat menekan biaya produksi pembenihan khususnya pengadaan sarana pemijahan buatan pada ikan dan dapat mengganti peran ovaprim. Bila dibandingkan dengan perlakuan spawnprime 8 dimana biaya pembuatan ini sebesar Rp 38.000,-. Hasil kelangsungan hidup dari dua perlakuan ini antara spawnprime 4 dan spawnprime 8 yaitu 93.91% dan 82.27% dengan teknik pemijahan secara semi alami. Dengan waktu ovulasi 8 jam 13 menit pada perlakuan spawnprime 8.
5 SIMPULAN DAN SARAN
SIMPULAN
Spawnprime lebih efektif, efisien dan ekonomis bila dibandingkan dengan ovaprim. Induksi ovulasi dan pemijahan ikan patin siam secara semi alami dapat dilakukan dengan spawnprime 4 (LHRH+AD+AI+PGF2α+OXY).
SARAN
Induksi ovulasi dan pemijahan secara semi alami dapat dilakukan dengan penyuntikan spawnprime. Penyempurnaan dosis untuk setiap komposisi dalam spawnprime 4 harus dilakukan untuk meningkatkan efektifitas pemijahan.
DAFTAR PUSTAKA
Abdullah N. 2007. Efektivitas Pemberian Ovaprim Secara Topikal Pada Proses Ovulasi Dan Pemijahan Induk Ikan Mas Koki (Carassius auratus). [Tesis]. Sekolah Pascasarjana. Institut Pertanian Bogor. Bogor.
Female Coho Salmon (Onchorinchus Kisuth) During Vitellogenesis. Fish Physiol. Biochem. 20 : 231-241.
Afonso LOB, iwama GK, Smith J, Donaldson EM. 1999b. Effect Of Aromatase Inhibitor Fadrozol On Plasma On Plasma Sex Steroid Secretion and Ovulation Rate In Female Coho Salmon, Onchorhynchus kisutch Close To Final Maruration. Gen Comp Endocrinol 133: 221-229.
Brander GC, DH Pugh. 1977. Veterinary Applied Pharmacology and Therapeutics. Third Ed. The English Language Book Society and Bailliere Tindall. London.
Brodie A. 1991. Aromatase And Its Inhibitors-An Overview. Journal Steroid Bioche. Molec. Biol. Vol. 40, No. 1-3, pp. 225-261.
Bromage N, R Cumaranatunga. 1988. Egg Production In The Rainbow Trout. In J. F. Muir and R. D. Roberts (Ed) Recent advances in aquaculture. Vol. 3 Croom Helm, London & Sydney, Timber Press, Portland, Oregon.
Browman M W, D L Kramer. 1985. Pangasius Sutchi (Pangasiidae), An Air-Breathing Catfish That Uses The Swimbladder As An Accessory Respiratory Organ. Copeia 4: 994-998.
Carnevali O, Ciona C, Tosti L, Lubzens E, Maradona F. 2006. Role Of Cathepsins In Ovarian Follicle Growth and Maturation. General and Comparative Endocrinology, 146:195-203.
Casper R, Mitwally MFM. 2006. Aromatase Inhibitor for Ovulation Induction. J Clinic Endocrinol Metabol. 91. 3: 760-771
Crodsky M.G. 1984. Sifat Umum Hormon. Hal 533 – 540 dalam Martin, W. D. Jr., P. A. Mayes, and V. W, Rodwell. Editor. Biokimia. Edisi 19. EGC. Penerbit Buku Kedokteran.
Donaldson EM and GA Hunter. 1983. Induced Final Maturation, Ovulation, and Spermation In Cultured Fish. P. 354 – 390. In WS Hoar, DJ Randall, and EM Donaldson (Eds.). Fish Physiology. Vol. XB. Academic press. Inc. Effendi M. 1997. Biologi Perikanan. Yayasan Pustaka Nusantara. 162hal.
Gustiano R. Sudarto. L Pouyaud. 2003a. How to Recognize Pangasius Djambal. In: J. Slembrouck, O. Komarudin, Maskur and M. Legendre (eds.). Technical Manual for Artificial Propagation of the Indonesian Catfish, Pangasius djambal. Karya Pratama. Jakarta. Pp. 3-14.
Denning-Kendall, P.A., Wathes, D.C., 1994. Acute effects of prostaglandin F2a, luteinizing hormone, and estra-diol on second messenger systems and on the secretion of oxytocin and progesterone from granulosa and earlyluteal cells of the ewe. Biol. Reprod. 50, 765–773
Gustiano, R. 2009. Pangasiid catfishes of Indonesia. Buletin Plasma Nutfah 15(2): 91-100.
Hardjamulia A. 1976. Problems in freshwater fish breeding and the results of the introduction of improved techniques in Indonesia. Research Institute for Inland Fisheries. Sukabumi. 12 pp.
Hidayat R. 2010. Efektivitas spawnprim pada proses ovulasi dan pemijahan ikan komet Carassius auratus auratus. [Skripsi]. Program Studi Teknologi dan
Manajemen Akuakultur, Departemen Budidaya Perairan,Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Bogor.
28
Hong W, Donalson EM. 1998. Effect Of The Aromatase Inhibitor Fadrozole on Gonadal Development in Coho Salmon, Oncorhynchus kisutch. Asian Fish Sci 10: 339-345
Kunigelis, S.C., Saleuddin, A.S.M., 1986. Reproduction in the freshwater gastropod Helisoma: involvement of prostaglandin in egg production. Int. J. Invertebr. Reprod. Dev. 10, 159–167.
KKP (Kementerian Kelautan dan Perikanan). 2012. Produktivitas budidaya ikan di Indonesia. www.dkp.go.id [25 Mei 2013]
Lam TJ. 1995. Possibie Roles of Hormones in The Control Of Egg Overripening and Embryonic and Larva Development in Fish. In; Proc. If The intern. Symp. On Biotech Applic in Aquaculture,Kuo CM, Jen LW, and Pung PH.((Editor). Asian Fisheries Soc. In Assoc. With Institut of Fish Science. National Taiwan Unv. And Institut of Zoology. Academia Sinica. ROC. P. 29 – 39.
Legendre M, J Slembrouck, J Subagja. 1998a. First Results on Growth and Artificial Propagation of Pangasius Djambal In Indonesia. In The Biological Diversity and Aquaculture of Clariid and Pangasiid Catfishes In South East Asia. Proceeding Of The Midtem Workshop Of The “Catfish
Asia Project”. 11-15 May, 1998. Cantho. Vietnam. P. 97-101.
Legendre M, J Subagja, J Slembrouck. 1998b. Absence of Marked Seasonal Variation in Sexual Maturity of pangasius hypopthalmus Booder Held in Ponds at the Sukamandi Station. Java. Indonesia. In The Biological Diversity and Aquaculture of clariid and Pangasiid Catfishes in South
Easth Asia Proceedings of the Midterm Workshop of the “Catfish Asia
Project”. 11 – 15 May. 1998. Cantlo. Vietnam. P. 91 – 95.
LRPTBPAT. 2006. Dokumen Usulan Pelepasan Patin Hibrida. Loka Riset Pemuliaan dan Teknologi Budidaya Perikanan Air Tawar. Loka Riset Pemuliaan dan Teknologi Budidaya Perikanan Air Tawar (LRPTBPAT). Sukamandi. 14 hal.
MacKenzie D S, P Thomas, S M Farrar.1989. Seasonal Changes In Thyroid and Reproduction Steroid Hormones In Female Channel Catfish (Ichtalurus Punctatus) In Pond Culture. Aquaculture, 78: 63 – 80.
Mananos E, Duncan, Mylonas C. 2009. Reproduction and control of ovulation, spermiation and spawning in cultured fish. pp 5-81.
Mishra, Joy. 2006. Effects of gonadotrophin in vivo and 2-hydroxyoestradiol-17b in vitro on follicular steroid hormone profile associated with oocyte maturation in the catfish Heteropneustes fossilis. Journal of endocrinology, 189:341-353.
Morse, D.E., Duncan, H., Hooker, N., Morse, A., 1977. Hydrogen peroxide induces spawning in mollusks, with activation of prostaglandin endoperoxide synthetase. Science 196, 298–300.
Murdoch, W.J., Hansen, T.R., McPherson, L.A., 1993. A review-role of eicosanoids in vertebrate ovulation. Prostaglandins 46, 85–115.
Nagahama Y. 1983. The Functional Morphology Of Teleost Gonad. P. 223 – 275. In WS Hoar, DJ Randall, and EM Donaldson. (Eds.) Fish Physiology. Vol IXA. Academic PRESS. Inc.
Nagahama Y. 1994. Endocrine Regulation of Gametogenesis in Fish. Int. Dev. Biol 38. 217-229.50
Nagahama Y et al. 1995. Regulation of oocyte growth and maturation in fish. Dev boil 30: 103-145.
Nandeesha M C, Rao K G, Jayanna R N, Parker N C, Varghese T J, Keshavanath P, Shetty H P C. 1990. Induced spawning of indian major carps through single application of ovaprim-c, in: Hirano, R., I. Hanyu (Eds.), The Second Asian Fisheries. Forum. 991 p. Asian Fisheries Society, Manila, Philippines.
Patino R, Sullivan C V. 2003. Ovarian follicle growth, maturation and ovulation in teleost fish. Fish Physiology and Biochemistry, 26:57-70.
Permana D. 2009. Efektivitas Aromatase Inhibitor dalam Pematangan Gonad dan Stimulasi Ovulasi pada Ikan Sumatra Puntius tetrazona. [Skripsi]. Institut Pertanian Bogor. Bogor.
Pertricellis, L.D., Marzo, V.D., 1994. Review: aquatic invertebrates open up new perspectives in eicosanoid research: biosynthesis and bioactivity. Prostaglandins Leukot. Essent. Fat. Acids 51, 215–229.
Pouyaud L, R Gustiano, M Legendre. 1998. Phylogenetic relationship among pangasiid catfish species (Siluriformes, Pangasiidae) and new insights on their zoogeography. In: M. Legendre and A. Parisele (eds.). The Biological Diversity and Aquaculture of Clariid and Pangasiid Catfishes in South-East Asia. Proceeding of The Mid-Term Workshop of the Catfish Asia Project, 11-15 May 1998. Cantho, Vietnam. Pp. 49-56
Pouyaud L, R Gustiano, G G, Teugels. 2004. Contribution to the phylogeny of the Pangasiidae based on mitochondrial 12S rDNA. Indonesian Journal of Agricultural Science 5(2): 45-62
Roberts T R, C Vidthayanon. 1991. Systematic revision of the Asian catfish family Pangasiidae, with biological observations and description of three new species. Proceedings of the Academy of Natural Sciences of Philadelphia 143: 97-144.
Saanin H. 1968. Taksonomi dan Kunci Identifikasi Ikan. Binacipta : Bandung Siregar M.1999. Stimulasi Pematangan Gonad Bakal Induk Betina Ikan Jambal
Siam (Pangasium Hypopthalmus F) dengan Hormon HCG. Thesis. Program Pascasarjana. Institut Pertanian Bogor
Stancy N E, F W Goethz. 1982. Role of Prostaglandins in Fish Reproduction. Can. J. Fish Aquat. Sci. 39: 92 – 98.
Stanley-Samuelson, D., 1994. Review: assessing the significance of prostaglandins and other eicosanoids ininsect physiology. J. Insect Physiol. 40, 3–11
Sudrajat A O. 2010. Catatan Kuliah Endokrinologi. Sekolah Pasca Sarjana IPB. Bogor.
Sumantri D. 2006. Efektivitas ovaprim dan aromatase inhibitor dalam mempercepat pemijahan pada ikan lele dumbo Clarias sp. [Skripsi]. Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Bogor.
SNI : 01- 6483.1 – 2000. Induk ikan patin siam (Pangasius hyphthalmus) kelas induk pokok (Parent Stock)