ABSTRAK
ROBERT EDUARD SUEK. Penyimpanan In Vitro dengan Teknik Pertumbuhan Minimal dan Regenerasi Pasca Penyimpanan Kultur Purwoceng (Pimpinella pruatjan Molk.). Dibimbing oleh RITA MEGIA dan IRENG DARWATI.
Purwoceng adalah salah satu tumbuhan obat langka Indonesia dengan kategori endangered
atau hampir punah karena eksploitasi tanpa penanaman kembali dan habitat aslinya yang sudah rusak. Ekstrak akarnya berkhasiat obat sebagai diuretik, tonik dan terutama sebagai afrodisiak. Penelitian awal menemukan bahwa purwoceng dapat dikonservasi baik secara in vitro dengan teknik pertumbuhan minimal pada media DKW dengan sukrosa 30 gram, sorbitol 1% tanpa paklobutrazol (S1P0); dan sorbitol 3% dan paklobutrazol 1 ppm (S3P1) pada masa penyimpanan empat dan delapan bulan. Namun, regenerasinya pada media DKW + BA 4 ppm + Thidiazuron (TDZ) 0,4 ppm + Glutamin 100 ppm dengan penambahan GA3 3 ppm selama tiga bulan menunjukkan kultur tersebut mengalami penurunan daya regenerasi dan masih mempertahankan morfologi kerdil pada tahap regenerasi. Pengaruh perlakuan sorbitol dan paklobutrazol selama penyimpanan masih terbawa. Penelitian ini dilakukan melalui penanaman tunas aksilar purwoceng yang ditumbuhkan pada media penyimpanan dengan masa penyimpanan enam bulan. Regenerasi dilakukan selama dua bulan pada media DKW dengan sukrosa 30 gram, kombinasi GA3 (0, 1, 3, 5 ppm) dan BAP (0, 1, 2, 3 ppm). Perlakuan sorbitol dan paklobutrazol yang baik pada tahap penyimpanan adalah S1P0. Perlakuan S1P0 menyebabkan tanaman memiliki pertumbuhan yang cenderung lambat, tampak normal, memproduksi akar dan daya kultur baik sedangkan eksplan dari S3P1 tumbuh lebih lambat, kerdil, roset dan jumlah akar sedikit. Perlakuan yang baik pada tahap regenerasi untuk eksplan dari S1P0 adalah G1B1 (GA3 1 ppm dan BAP 1 ppm) dan G5B0. Perlakuan tersebut menyebabkan tanaman tumbuh subur, tidak kerdil, daya hidup kultur yang normal dan memproduksi akar. Walaupun eksplan telah disimpan selama enam bulan, masalah penurunan daya regenerasi dan morfologi yang kerdil dapat diatasi pada tahap regenerasi.
Kata kunci : in vitro, Pimpinella pruatjan Molk., penyimpanan, regenerasi
ABSTRACT
ROBERT EDUARD SUEK. Storage of In Vitro with Minimal Growth Technique and Regeneration After Storage of Purwoceng Culture (Pimpinella pruatjan Molk.). Supervised by RITA MEGIA and IRENG DARWATI.
Purwoceng is one of the rare medicinal plants of Indonesia which is categorized as endangered plant because of the exploitation without replanting and the damage of natural habitat. Roots extracts of this medicinal plant can be used as diuretics, tonics, and especially as aphrodisiacs. Preliminary research found that purwoceng can be good conserved in vitro with minimal growth technique on DKW medium with 30 grams of sucrose, 1% sorbitol without paklobutrazol (S1P0); and 3% sorbitol and 1 ppm paklobutrazol (S3P1) in the storage period of four months and eight months. However, their regeneration within three months in media DKW + BA 4 ppm + Thidiazuron (TDZ) 0,4 ppm + Glutamin 100 ppm that added with GA3 3 ppm decreased and they maintained their dwarf morphology in the regeneration stage. Effect of sorbitol and paklobutrazol treatment during storage was still brought. This research was conducted by planting of axillary buds purwoceng which was grown on the storage media within six months of storage period. The regeneration was carried out for two months on DKW medium with 30 grams of sucrose, combination of GA3 (0, 1, 3, 5 ppm) and BAP (0, 1, 2, 3 ppm). The good treatment in this storage phase was S1P0. Explants of S1P0 had tend to grow slowly and normally, produced good roots and good condition; whereas explants of S3P1 slow growth rate, dwarf and poor of root. The good combination at regeneration phase from explants of S1P0 was G1B1 (GA3 1 ppm and BAP 1 ppm) and G5B0. The treatment of G1B1 and G5B0 produced fertile and no dwarfts plants which have high growth rate, their culture vitality were normal, and they produce root.
PENDAHULUAN
Latar Belakang
Tumbuhan obat memiliki potensi dan pemanfaatan yang semakin meningkat melalui industri agromedisin. Hal ini dilihat dari semakin banyaknya penduduk dunia yang kembali beralih pada obat alami. Agromedisin adalah rangkaian proses pengolahan bahan-bahan nabati mulai dari budidaya tumbuhan berkhasiat obat yang kemudian diolah menjadi bahan baku baik berupa simplisia, produk olahan berupa ekstrak, minyak atsiri maupun sediaan obat jadi. Peluang ini sudah dimanfaatkan oleh industri jamu Indonesia. Salah satu tumbuhan obat terkenal adalah purwoceng (Pimpinella pruatjan Molk.). Tumbuhan ini telah lama dimanfaatkan oleh penduduk sekitar daratan Dieng sebagai salah satu obat tradisional. Sejauh ini pasokan bahan baku obat sebagian besar (± 80%) masih mengandalkan hasil penambangan dari alam (Rostiana et al.
2006). Ekstrak akarnya digunakan sebagai diuretik (melancarkan saluran air seni), tonik (meningkatkan stamina tubuh), dalam seduhan, dan terutama sebagai afrodisiak (meningkatkan gairah seksual) (Heyne 1987). Ekstrak akar purwoceng mempunyai daya kerja mempertinggi aktifitas motorik, mempertinggi tonus otot-otot lurik, menstimulasi susunan syaraf pusat pada titik tangkap kerja pada medula oblongata, dan meningkatkan tingkah laku seksual tikus jantan (Caropeboka et al. 1979). Metabolit sekunder yang terdapat pada akar purwoceng, yaitu: turunan kumarin, sterol, saponin, dan alkaloid. Bahan-bahan tersebut berkhasiat sebagai obat analgetik, antipiretika, antithelmitika, sedative, anti fungi, anti bakteri dan anti kanker (Caropeboka & Lubis 1975) tetapi khasiat utamanya sebagai afrodisiak.
Purwoceng merupakan tumbuhan langka yang hampir punah dengan kategori
endangered atau hampir punah (Rivai et al.
1992) bahkan termasuk dalam Appendix I berdasarkan CITES (Convention on International Trading in Endangered Species of Wild Floral and Fauna) yang berarti sangat dilindungi. Tanaman ini memerlukan persyaratan agronomis yang spesifik sedangkan habitat aslinya sudah rusak akibat perubahan peruntukan lahan sehingga konservasi in situ (di dalam habitatnya) hampir tidak mungkin dilakukan. Pencegahan terhadap kepunahan perlu dilakukan dengan konservasi sesegera mungkin. Teknologi
kultur in vitro merupakan teknologi yang dapat diterapkan untuk menghindari kepunahan tumbuhan ini. Teknik ini mempunyai beberapa keuntungan seperti tidak memerlukan areal yang luas, bebas dari gangguan hama (penyakit), memudahkan pertukaran, dan biakan dapat segera diperbanyak apabila diperlukan (Lestari & Mariska 1997).
Penyimpanan secara in vitro dengan teknik pertumbuhan minimal adalah suatu teknik memperlambat pertumbuhan agar waktu subkultur dapat diperpanjang. Pada penyimpanan ini eksplan dikondisikan tumbuh dalam keadaan sub optimal dimana pertumbuhan berlangsung lambat (Engelman 1991). Berbagai cara dapat dilakukan, antara lain: pengaturan kondisi lingkungan, penggunaan regulator osmotik seperti sukrosa, sorbitol, dan manitol (Bessembinder
et al. 1993) dan pemberian zat penghambat tumbuh seperti paklobutrazol, acymidol, dan cycocel (Withers 1985). Zat penghambat
tumbuh “growth retardants” didefinisikan
sebagai senyawa organik sintetik: apabila diberikan pada tumbuhan yang responsif akan menghambat perpanjangan sel pada meristem sub apikal, mengurangi laju perpanjangan batang tanpa mempengaruhi pertumbuhan dan perkembangan daun (William 2003).
Penelitian awal konservasi in vitro
sebagai koleksi aktif menemukan bahwa purwoceng dapat dikonservasi terbaik secara
in vitro dengan teknik pertumbuhan minimal pada media perbanyakan Driver Kuniyaki dan Walnut (DKW) dengan retardan paklobutrazol 5 ppm dan masa simpan kurang dari empat bulan (Rahayu & Sunarlim 2002). Penelitian lanjutan mendapatkan hasil yang baik menggunakan media DKW dengan sukrosa 30 gram, S1P0 dan S3P1 pada masa penyimpanan empat dan delapan bulan. Namun, regenerasinya pada media DKW + BA 4 ppm + Thidiazuron (TDZ) 0,4 ppm + Glutamin 100 ppm dengan penambahan GA3 3 ppm selama tiga bulan menunjukkan kultur tersebut mengalami penurunan daya regenerasi dan masih mempertahankan morfologi kerdil sebagai pengaruh perlakuan sorbitol dan paklobutrazol selama penyimpanan masih terbawa (Ningsih 2009).
regenerasi menggunakan zat pengatur tumbuh tertentu perlu dilakukan.
Tujuan Penelitian
Tujuan penelitian adalah membandingkan pertumbuhan purwoceng pada media penyimpanan in vitro S1P0 dan S3P1 dengan teknik pertumbuhan minimal dan mendapatkan konsentrasi kombinasi zat pengatur tumbuh Giberelin (GA3) dan Sitokinin (BAP) yang tepat untuk regenerasinya yang optimal.
Hipotesis Penelitian
Hipotesis penelitian ini adalah ada perbedaan pertumbuhan purwoceng pada media penyimpanan secara in vitro S1P0 dan S3P1 dengan teknik pertumbuhan minimal selama enam bulan dan ada perbedaan respon terhadap perlakuan Giberelin (GA3) dan Sitokinin (BAP) yang optimal untuk regenerasi kultur purwoceng selama dua bulan.
BAHAN DAN METODE
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan mulai bulan Februari 2009 sampai bulan April 2010 di Laboratorium Tanaman Obat dan Aromatik (Balittro).
Bahan dan Alat
Bahan yang digunakan dalam penelitian ini adalah tunas pucuk in vitro purwoceng dan media DKW (Lampiran 1), sorbitol, paklobutrazol, GA3 (Giberelin A3), dan BAP (Benzil Amino Purin).
Alat yang digunakan antara lain botol kultur, alat-alat diseksi, autoklaf, pH meter, thermometer, timbangan, laminar air flow cabinet (LAFC), lampu, gelas piala, penangas air, bulb, pipet, batang pengaduk, magnet pengaduk, kertas alumunium, karet, kertas label dan alat tulis.
Metode Penelitian
Sterilisasi alat dan bahan. Sterilisasi botol kultur, cawan petri dan alat-alat diseksi dilakukan dengan penyimpanan pada oven dengan suhu 150 0C selama minimal 3 jam. Sterilisasi aquades dan media kultur dilakukan dengan menggunakan autoklaf pada tekanan 15 psi dan suhu 121 0C selama 20 menit.
Pembuatan media. Media yang digunakan berupa media perbanyakan DKW. Metode pembuatan media DKW untuk 1 liter
diawali dengan pemipetan 5 hara makro (Lampiran 1) masing-masing sebanyak 50 ml, hara mikro (Lampiran 1) sebanyak 10 ml, Fe-EDTA sebanyak 10 ml, myoinositol sebanyak 1 g dan vitamin sebanyak 1 ml berturut-turut dari masing-masing stok. Zat pengatur tumbuh dan zat penghambat pertumbuhan dimasukkan pada media. Selanjutnya dilakukan penambahan sukrosa sebanyak 30 g. Aquades ditambahkan hingga volume 1 liter. Bahan-bahan tersebut kemudian diukur pH-nya. pH media diusahakan mencapai 5,6-5,8 dengan penambahan 0,1-0,01 KOH atau HCl. Kemudian media ditambahkan 3 g phytagel sebagai pemadat. Media didihkan sambil diaduk hingga larutan mendidih dan bening. Media dituangkan ke botol kultur masing-masing 25 ml dan ditutup dengan kertas alumunium.
Perbanyakan sumber eksplan. Perbanyakan sumber eksplan dilakukan dengan penanaman eksplan dari subkultur purwoceng pada media DKW dengan sukrosa 3%. Eksplan berukuran ± 1 cm, 2-4 helai daun, tunas tunggal dan dibersihkan dari bagian tumbuhan yang layu. Tindakan subkultur dilakukan sampai diperoleh tunas yang cukup untuk percobaan.
Pertumbuhan minimal selama enam bulan. Penyimpanan in vitro eksplan tanpa daun berukuran ± 0,8 cm dari bagian meristem pucuk disimpan dalam media DKW dengan sukrosa 3% yang mengandung sorbitol 1% tanpa paklobutrazol (S1P0); dan kombinasi sorbitol 3% dan paklobutrazol 1 ppm (S3P1). Satu unit (botol) perlakuan mengandung 3 eksplan dengan jumlah ulangan 10 kali. Setiap ulangan terdiri dari 10 unit. Percobaan disusun secara faktorial dalam lingkungan Rancangan Acak Lengkap (Lampiran 2).
regenerasi menggunakan zat pengatur tumbuh tertentu perlu dilakukan.
Tujuan Penelitian
Tujuan penelitian adalah membandingkan pertumbuhan purwoceng pada media penyimpanan in vitro S1P0 dan S3P1 dengan teknik pertumbuhan minimal dan mendapatkan konsentrasi kombinasi zat pengatur tumbuh Giberelin (GA3) dan Sitokinin (BAP) yang tepat untuk regenerasinya yang optimal.
Hipotesis Penelitian
Hipotesis penelitian ini adalah ada perbedaan pertumbuhan purwoceng pada media penyimpanan secara in vitro S1P0 dan S3P1 dengan teknik pertumbuhan minimal selama enam bulan dan ada perbedaan respon terhadap perlakuan Giberelin (GA3) dan Sitokinin (BAP) yang optimal untuk regenerasi kultur purwoceng selama dua bulan.
BAHAN DAN METODE
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan mulai bulan Februari 2009 sampai bulan April 2010 di Laboratorium Tanaman Obat dan Aromatik (Balittro).
Bahan dan Alat
Bahan yang digunakan dalam penelitian ini adalah tunas pucuk in vitro purwoceng dan media DKW (Lampiran 1), sorbitol, paklobutrazol, GA3 (Giberelin A3), dan BAP (Benzil Amino Purin).
Alat yang digunakan antara lain botol kultur, alat-alat diseksi, autoklaf, pH meter, thermometer, timbangan, laminar air flow cabinet (LAFC), lampu, gelas piala, penangas air, bulb, pipet, batang pengaduk, magnet pengaduk, kertas alumunium, karet, kertas label dan alat tulis.
Metode Penelitian
Sterilisasi alat dan bahan. Sterilisasi botol kultur, cawan petri dan alat-alat diseksi dilakukan dengan penyimpanan pada oven dengan suhu 150 0C selama minimal 3 jam. Sterilisasi aquades dan media kultur dilakukan dengan menggunakan autoklaf pada tekanan 15 psi dan suhu 121 0C selama 20 menit.
Pembuatan media. Media yang digunakan berupa media perbanyakan DKW. Metode pembuatan media DKW untuk 1 liter
diawali dengan pemipetan 5 hara makro (Lampiran 1) masing-masing sebanyak 50 ml, hara mikro (Lampiran 1) sebanyak 10 ml, Fe-EDTA sebanyak 10 ml, myoinositol sebanyak 1 g dan vitamin sebanyak 1 ml berturut-turut dari masing-masing stok. Zat pengatur tumbuh dan zat penghambat pertumbuhan dimasukkan pada media. Selanjutnya dilakukan penambahan sukrosa sebanyak 30 g. Aquades ditambahkan hingga volume 1 liter. Bahan-bahan tersebut kemudian diukur pH-nya. pH media diusahakan mencapai 5,6-5,8 dengan penambahan 0,1-0,01 KOH atau HCl. Kemudian media ditambahkan 3 g phytagel sebagai pemadat. Media didihkan sambil diaduk hingga larutan mendidih dan bening. Media dituangkan ke botol kultur masing-masing 25 ml dan ditutup dengan kertas alumunium.
Perbanyakan sumber eksplan. Perbanyakan sumber eksplan dilakukan dengan penanaman eksplan dari subkultur purwoceng pada media DKW dengan sukrosa 3%. Eksplan berukuran ± 1 cm, 2-4 helai daun, tunas tunggal dan dibersihkan dari bagian tumbuhan yang layu. Tindakan subkultur dilakukan sampai diperoleh tunas yang cukup untuk percobaan.
Pertumbuhan minimal selama enam bulan. Penyimpanan in vitro eksplan tanpa daun berukuran ± 0,8 cm dari bagian meristem pucuk disimpan dalam media DKW dengan sukrosa 3% yang mengandung sorbitol 1% tanpa paklobutrazol (S1P0); dan kombinasi sorbitol 3% dan paklobutrazol 1 ppm (S3P1). Satu unit (botol) perlakuan mengandung 3 eksplan dengan jumlah ulangan 10 kali. Setiap ulangan terdiri dari 10 unit. Percobaan disusun secara faktorial dalam lingkungan Rancangan Acak Lengkap (Lampiran 2).
Percobaan disusun secara dua faktor dalam Rancangan Acak Lengkap. Faktor pertama adalah S1P0 dan S3P1. Faktor kedua adalah G0B0, G0B1, G0B2, G0B3, G1B0, G1B1, G1B2, G1B3, G3B0, G3B1, G3B2, G3B3, G5B0, G5B1, G5B2, dan G5B3 (Lampiran 3).
Pengamatan. Peubah yang diamati meliputi jumlah tunas, jumlah daun segar, jumlah daun layu, dan jumlah akar setiap bulan; tinggi tumbuhan dan bobot basah setiap dua bulan. Pengamatan kualitatif dilakukan pada akhir tahap penyimpanan (bulan keenam) dan akhir tahap regenerasi (bulan kedua). Eksplan difoto di dalam laminar. Warna eksplan hasil foto diolah dengan Photoshop CS3. Besaran angka yang menggambarkan kondisi eksplan dikelompokkan dalam tiga kategori; yaitu: nilai 3 untuk warna hijau, nilai 2 untuk warna coklat dan nilai 1 untuk warna putih (Tabel 1).
Tabel 1. Standar warna kode desimal RGB Warna Red (R) Green (G) Blue (B) Hijau 0-173 100-255 0-170 Coklat 128-255 0-248 0-220 Putih 240-255 235-255 215-255 Sumber: http://id.wikipedia.org/wiki/Daftar _warna [20 Maret 2011]
Kondisi Kultur dan Anova. Kondisi inkubasi untuk penyimpanan dan regenerasi adalah di ruang kultur bersuhu 18 ± 2 0C pada intensitas penyinaran 800-1000 lux dengan fotoperiodisitas 16 jam. Data dianalisis dengan ANOVA dilanjutkan dengan uji Duncan Multi Range Test (DMRT) pada taraf
α = 5% mengunakan program SAS for Windows 9.1.
HASIL
Pertumbuhan minimal selama enam bulan. Penelitian awal mengggunakan eksplan berukuran ± 0,2 cm tetapi hanya 6,67% yang tumbuh setelah empat bulan. Ukuran eksplan diganti menjadi ± 0,8 cm.
Presentasi pertumbuhan meningkat menjadi 100% dengan ukuran tersebut.
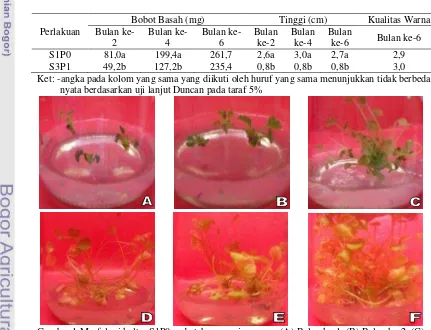
Hasil pengamatan penyimpanan purwoceng dengan teknik pertumbuhan minimal selama enam bulan (Gambar 1 F & 2 F) menunjukkan semua ulangan pada kedua perlakuan mampu bertahan dengan hambatan pertumbuhan yang berbeda. Bebas kontaminasi bakteri dan/atau jamur mencapai 92% pada S1P0 dan 91% pada S3P1. Semua eksplan tumbuh sampai bulan kedua tetapi pada bulan ketiga terdapat beberapa eksplan berhenti pertumbuhannya dan menghitam. Beberapa eksplan tersebut tumbuh kembali setelah 1 sampai 2 bulan kemudian.
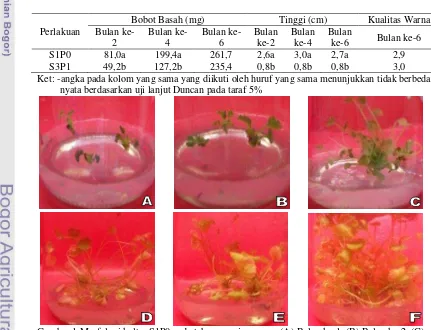
Perlakuan S1P0 menghasilkan rata-rata jumlah daun segar lebih banyak dari pada S3P1 dan berbeda nyata pada setiap bulan, hal ini diikuti dengan peningkatan jumlah daun layu. Hasil pengamatan sampai bulan keenam rata-rata jumlah daun segar dan layu S1P0 sebesar 12,2 dan 7,0 (Tabel 2). Hasil pengolahan data statistik penyimpanan dapat dilihat pada lampiran 4. Perlakuan S1P0 juga memiliki jumlah akar terbanyak dengan rata-rata 1,3 dan berbeda nyata dengan S3P1 (Tabel 3). Jumlah eksplan yang berakar sebanyak 83 eksplan (27%) dari 300 eksplan pada S1P0 (Gambar 1C) dan 9 eksplan dari 300 eksplan (3%) pada S3P1. Rata-rata jumlah tunas S1P0 lebih banyak sebesar 3,9 (Tabel 3) dan berbeda nyata dengan S3P1. Bobot basah S1P0 tidak berbeda nyata dengan S3P1 walaupun memiliki rata-rata lebih berat, yaitu: 261,7 mg (Tabel 4). Rata-rata tinggi eksplan S1P0 lebih tinggi 2,7 cm dan berbeda nyata dibanding rata-rata tinggi eksplan S3P1 (Tabel 4). Pada pengamatan kualitas warna, walaupun tidak berbeda nyata tetapi warna eksplan S3P1 lebih hijau dari S1P0 dengan nilai sebesar 3,0 (Tabel 4).
Percobaan disusun secara dua faktor dalam Rancangan Acak Lengkap. Faktor pertama adalah S1P0 dan S3P1. Faktor kedua adalah G0B0, G0B1, G0B2, G0B3, G1B0, G1B1, G1B2, G1B3, G3B0, G3B1, G3B2, G3B3, G5B0, G5B1, G5B2, dan G5B3 (Lampiran 3).
Pengamatan. Peubah yang diamati meliputi jumlah tunas, jumlah daun segar, jumlah daun layu, dan jumlah akar setiap bulan; tinggi tumbuhan dan bobot basah setiap dua bulan. Pengamatan kualitatif dilakukan pada akhir tahap penyimpanan (bulan keenam) dan akhir tahap regenerasi (bulan kedua). Eksplan difoto di dalam laminar. Warna eksplan hasil foto diolah dengan Photoshop CS3. Besaran angka yang menggambarkan kondisi eksplan dikelompokkan dalam tiga kategori; yaitu: nilai 3 untuk warna hijau, nilai 2 untuk warna coklat dan nilai 1 untuk warna putih (Tabel 1).
Tabel 1. Standar warna kode desimal RGB Warna Red (R) Green (G) Blue (B) Hijau 0-173 100-255 0-170 Coklat 128-255 0-248 0-220 Putih 240-255 235-255 215-255 Sumber: http://id.wikipedia.org/wiki/Daftar _warna [20 Maret 2011]
Kondisi Kultur dan Anova. Kondisi inkubasi untuk penyimpanan dan regenerasi adalah di ruang kultur bersuhu 18 ± 2 0C pada intensitas penyinaran 800-1000 lux dengan fotoperiodisitas 16 jam. Data dianalisis dengan ANOVA dilanjutkan dengan uji Duncan Multi Range Test (DMRT) pada taraf
α = 5% mengunakan program SAS for Windows 9.1.
HASIL
Pertumbuhan minimal selama enam bulan. Penelitian awal mengggunakan eksplan berukuran ± 0,2 cm tetapi hanya 6,67% yang tumbuh setelah empat bulan. Ukuran eksplan diganti menjadi ± 0,8 cm.
Presentasi pertumbuhan meningkat menjadi 100% dengan ukuran tersebut.
Hasil pengamatan penyimpanan purwoceng dengan teknik pertumbuhan minimal selama enam bulan (Gambar 1 F & 2 F) menunjukkan semua ulangan pada kedua perlakuan mampu bertahan dengan hambatan pertumbuhan yang berbeda. Bebas kontaminasi bakteri dan/atau jamur mencapai 92% pada S1P0 dan 91% pada S3P1. Semua eksplan tumbuh sampai bulan kedua tetapi pada bulan ketiga terdapat beberapa eksplan berhenti pertumbuhannya dan menghitam. Beberapa eksplan tersebut tumbuh kembali setelah 1 sampai 2 bulan kemudian.
Perlakuan S1P0 menghasilkan rata-rata jumlah daun segar lebih banyak dari pada S3P1 dan berbeda nyata pada setiap bulan, hal ini diikuti dengan peningkatan jumlah daun layu. Hasil pengamatan sampai bulan keenam rata-rata jumlah daun segar dan layu S1P0 sebesar 12,2 dan 7,0 (Tabel 2). Hasil pengolahan data statistik penyimpanan dapat dilihat pada lampiran 4. Perlakuan S1P0 juga memiliki jumlah akar terbanyak dengan rata-rata 1,3 dan berbeda nyata dengan S3P1 (Tabel 3). Jumlah eksplan yang berakar sebanyak 83 eksplan (27%) dari 300 eksplan pada S1P0 (Gambar 1C) dan 9 eksplan dari 300 eksplan (3%) pada S3P1. Rata-rata jumlah tunas S1P0 lebih banyak sebesar 3,9 (Tabel 3) dan berbeda nyata dengan S3P1. Bobot basah S1P0 tidak berbeda nyata dengan S3P1 walaupun memiliki rata-rata lebih berat, yaitu: 261,7 mg (Tabel 4). Rata-rata tinggi eksplan S1P0 lebih tinggi 2,7 cm dan berbeda nyata dibanding rata-rata tinggi eksplan S3P1 (Tabel 4). Pada pengamatan kualitas warna, walaupun tidak berbeda nyata tetapi warna eksplan S3P1 lebih hijau dari S1P0 dengan nilai sebesar 3,0 (Tabel 4).
4
Tabel 2 Pengaruh pemberian sorbitol dan paklobutrazol terhadap rata-rata jumlah daun segar dan jumlah daun layu.
Perlakuan Jumlah daun segar Jumlah daun layu
B1 B2 B3 B4 B5 B6 B1 B2 B3 B4 B5 B6
S1P0 2,9a 6,9a 8,1a 10,2a 11,0a 12,3a 0,0 0,2 1,8a 3,6a 4,9a 7,0a S3P1 1,9b 3,9b 6,0b 7,0b 7,4b 7,9b 0,0 0,3 1,5b 2,7b 3,8b 5,6b Ket: -angka pada kolom yang sama yang diikuti oleh huruf yang sama menunjukkan tidak berbeda nyata berdasarkan uji lanjut Duncan pada taraf 5%
-B1: Bulan ke-1, dst
Tabel 3 Pengaruh pemberian sorbitol dan paklobutrazol terhadap rata-rata jumlah akar dan jumlah tunas.
Perlakuan Jumlah akar Jumlah tunas
B1 B2 B3 B4 B5 B6 B1 B2 B3 B4 B5 B6
S1P0 0,0 0,1a 0,5a 0,7a 1,0a 1,3a 1,0 1,6a 2,1a 2,9a 3,2a 3,9a S3P1 0,0 0,0b 0,0b 0,0b 0,0b 0,1b 1,0 1,1b 1,5b 2,0b 2,1b 2,4b Ket: -angka pada kolom yang sama yang diikuti oleh huruf yang sama menunjukkan tidak berbeda nyata berdasarkan uji lanjut Duncan pada taraf 5%
-B1: Bulan ke-1, dst
Tabel 4 Pengaruh pemberian sorbitol dan paklobutrazol terhadap rata-rata bobot basah, tinggi dan kualitas warna.
Perlakuan
Bobot Basah (mg) Tinggi (cm) Kualitas Warna Bulan
ke-2
Bulan ke-4
Bulan ke-6
Bulan ke-2
Bulan ke-4
Bulan
ke-6 Bulan ke-6 S1P0 81,0a 199,4a 261,7 2,6a 3,0a 2,7a 2,9 S3P1 49,2b 127,2b 235,4 0,8b 0,8b 0,8b 3,0 Ket: -angka pada kolom yang sama yang diikuti oleh huruf yang sama menunjukkan tidak berbeda nyata berdasarkan uji lanjut Duncan pada taraf 5%
5
Gambar 2 Morfologi kultur S3P1 pada tahap penyimpanan : (A) Bulan ke-1, (B) Bulan ke-2, (C) Bulan ke-3, (D) Bulan ke-4, (E) Bulan ke-5, dan (F) Bulan ke-6.
Pengujian daya regenerasi pasca penyimpanan selama dua bulan. Bebas kontaminasi bakteri dan/atau jamur masing-masing mencapai 97% pada eksplan dari S1P0 dan S3P1. Semua eksplan yang diregenerasikan menghasilkan daun pada bulan pertama. Pada bulan pertama, faktor pertama (S1P0 dan S3P1) dan faktor kedua (Kombinasi GA3 dan BAP) berbeda nyata tetapi tidak memiliki interaksi dalam peningkatan jumlah daun segar sedangkan interaksi faktor pertama dan kedua berpengaruh nyata dalam meningkatkan jumlah daun segar pada bulan kedua. Hasil pengolahan data statistik regenerasi dapat dilihat pada lampiran 5. Pada eksplan dari hasil penyimpanan S1P0 dihasilkan rata-rata jumlah daun segar terbanyak pada perlakuan G5B2 sebesar 41,0 dan berbeda nyata dibanding kontrol pada bulan kedua (Tabel 5). Hal ini berbeda pada eksplan hasil penyimpanan S3P1, dimana jumlah daun segar lebih banyak diperoleh pada perlakuan
G5B0 sebesar 33,3 namun tidak berbeda nyata dengan kontrol (Tabel 5).
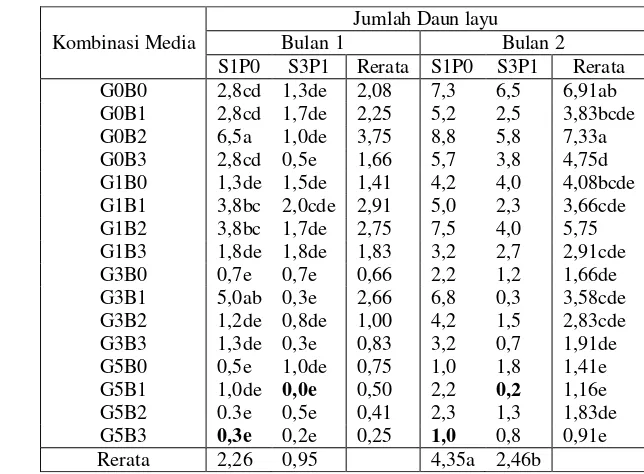
Hasil pengamatan sampai pada bulan kedua. Pengamatan jumlah daun layu menunjukkan eksplan dari hasil penyimpanan S1P0 menghasilkan jumlah daun layu terendah pada perlakuan G5B3 sebesar 1 dan terendah pada perlakuan G5B1 dari eksplan S3P1 sebesar 0,2 (Tabel 6). Hasil secara statistik menunjukkan rata-rata jumlah daun layu berbeda nyata pada kedua faktor pada dua bulan dimana pada bulan kedua tidak terjadi interaksi yang berpengaruh nyata dalam penurunan jumlah daun layu.
6
Tabel 5 Pengaruh kombinasi GA3 dan BAP dari eksplan hasil penyimpanan perlakuan S1P0 dan S3P1 terhadap rata-rata jumlah daun segar pada 2 bulan regenerasi
Ket: -angka pada kolom dan baris yang sama yang diikuti oleh huruf yang sama menunjukkan tidak berbeda nyata berdasarkan uji lanjut Duncan pada taraf 5%
Tabel 6 Pengaruh kombinasi GA3 dan BAP dari eksplan hasil penyimpanan perlakuan S1P0 dan S3P1 terhadap rata-rata jumlah daun layu pada 2 bulan regenerasi
Ket: -angka pada kolom dan baris yang sama yang diikuti oleh huruf yang sama menunjukkan tidak berbeda nyata berdasarkan uji lanjut Duncan pada taraf 5%
Hormon giberelin dan sitokinin yang digunakan pada media regenerasi dalam bentuk GA3 dan BAP pada semua perlakuan mampu menumbuhkan tunas pada minggu pertama dengan persentasi 100%. Tunas yang tumbuh beregenerasi dengan kecenderungan
tunas banyak. Persentasi kemunculan tunas terbanyak pada perlakuan G5B2 sebesar 12, 7 untuk eksplan dari S1P0 dan perlakuan G3B1 sebesar 13,7 pada ekplan dari S3P1 pada bulan kedua (Tabel 7). Interaksi faktor pertama dan faktor kedua berpengaruh nyata Kombinasi Media
Jumlah Daun Segar
Bulan 1 Bulan 2
S1P0 S3P1 Rerata S1P0 S3P1 Rerata G0B0 14,3 19,7 17,00bc 13,7efg 20,8bcdefg 17,25 G0B1 20,3 8,7 14,50c 22,8bcdefg 15,3efg 19,08 G0B2 17,3 15,5 16,41c 24,2bcdefg 16,3defg 20,25 G0B3 18,5 9,8 14,16c 21,7bcdefg 14,3efg 18,00 G1B0 15,0 14,7 14,83c 17,0defg 23,5bcdefg 20,25 G1B1 16,8 16,7 16,75c 18,8cdefg 25,8abcdefg 22,33 G1B2 26,0 18,7 22,33 25,7abcdefg 18,7 cdefg 22,16 G1B3 10,2 21,5 15,83c 16,5defg 21,8bcdefg 19,16 G3B0 17,7 16,8 17,25bc 18,3cdefg 22,3bcdefg 20,33 G3B1 31,0 28,5 29,75a 36,7ab 32,0abcde 34,33 G3B2 11,0 17,7 14,33c 20,0bcdefg 23,2bcdefg 21,58 G3B3 26,8 9,2 18,00bc 35,0abc 11,2efg 23,33 G5B0 11,7 15,2 13,41c 15,0efg 33,3abcd 24,16 G5B1 24,5 12,0 18,25bc 29,2abcdef 17,7defg 23,41 G5B2 35,2 19,7 27,41ab 41,0a 24,7 abcdefg 32,83 G5B3 15,5 12,5 14,00c 20,8bcdefg 14,7efg 17,75
Rerata 19,49a 16,04b 23,55 20,97
Kombinasi Media
Jumlah Daun layu
Bulan 1 Bulan 2
7
pada peningkatan jumlah tunas pada bulan kedua namun pada bulan pertama tidak terjadi.
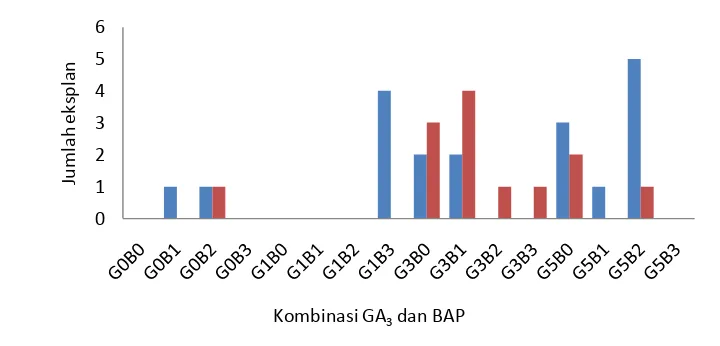
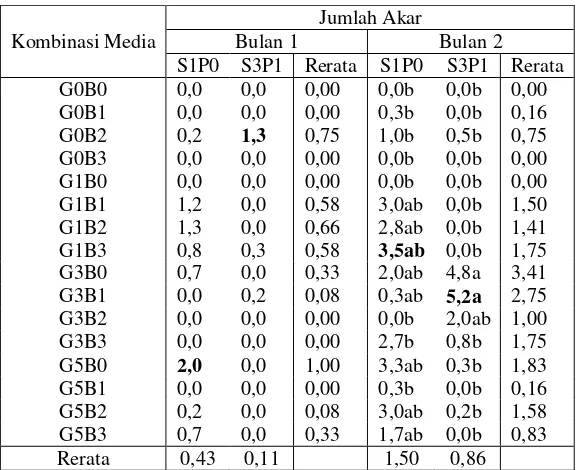
Pada masing-masing perlakuan terdapat 6 eksplan. Walaupun rata-rata jumlah akar terbanyak dihasilkan dari perlakuan G1B3 dari eksplan S1P0 sebanyak 3,5 (Tabel 8), namun jumlah eksplan berakar terbanyak dihasilkan dari perlakuan G5B2 sebanyak
lima eksplan pada eksplan dari S1P0 (Gambar 3). Perlakuan G3B1 pada eksplan yang berasal dari S3P1 memiliki rata-rata jumlah akar terbanyak sebesar 5,2 pada bulan kedua (Tabel 8). Faktor tunggal dan interaksinya tidak berpengaruh nyata pada bulan pertama namun interaksi kedua faktor berpengaruh nyata dalam peningkatan jumlah akar pada bulan kedua.
Tabel 7 Pengaruh kombinasi GA3 dan BAP dari eksplan hasil penyimpanan perlakuan S1P0 dan S3P1 terhadap rata-rata jumlah tunas pada 2 bulan regenerasi
Kombinasi Media
Jumlah Tunas
Bulan 1 Bulan 2
S1P0 S3P1 Rerata S1P0 S3P1 Rerata G0B0 4,2 3,2 3,66cd 5,3de 6,2cde 5,75 G0B1 6,2 2,0 4,08cd 7,7bcde 3,8e 5,75 G0B2 4,5 3,3 3,91cd 5,7de 4,8de 5,25 G0B3 4,3 1,7 3,00d 5,3de 4,5de 4,91 G1B0 3,3 3,8 3,58cd 4,2de 5,3de 4,75 G1B1 4,0 3,2 3,58cd 4,5de 6,3cde 5,41 G1B2 7,8 3,8 5,83bc 9,2abcd 5,2de 7,16 G1B3 3,3 3,5 3,41cd 4,7de 4,7de 4,66 G3B0 4,3 4,0 4,16cd 5,3de 6,0cde 5,66 G3B1 8,8 8,0 8,41a 12,2ab 13,7a 12,91 G3B2 4,7 4,3 4,50cd 5,7de 6,2cde 5,91 G3B3 7,7 1,7 4,66cd 10,7ab 3,5e 7,08 G5B0 2,7 3,3 3,00d 4,0e 7,7bcde 5,83 G5B1 5,5 2,8 4,16cd 7,7acde 5,8cde 6,75 G5B2 10,0 5,2 7,58ab 12,7a 8,0bcde 10,33 G5B3 4,2 2,8 3,50cd 5,3de 5,7de 5,50
Rerata 5,34a 3,54b 6,87 6,08
Ket: -angka pada kolom dan baris yang sama yang diikuti oleh huruf yang sama menunjukkan tidak berbeda nyata berdasarkan uji lanjut Duncan pada taraf 5%
Gambar 3 Pengaruh GA3 kombinasi GA3 dan BAP dari eksplan hasil penyimpanan perlakuan S1P0 ( ) dan S3P1 ( ) terhadap eksplan berakar pada bulan kedua regenerasi
0 1 2 3 4 5 6
Jum
lah
eks
pl
an
8
Tabel 8 Pengaruh kombinasi GA3 dan BAP dari eksplan hasil penyimpanan perlakuan S1P0 dan S3P1 terhadap rata-rata jumlah akar pada 2 bulan regenerasi
Kombinasi Media
Jumlah Akar
Bulan 1 Bulan 2
S1P0 S3P1 Rerata S1P0 S3P1 Rerata G0B0 0,0 0,0 0,00 0,0b 0,0b 0,00 G0B1 0,0 0,0 0,00 0,3b 0,0b 0,16 G0B2 0,2 1,3 0,75 1,0b 0,5b 0,75 G0B3 0,0 0,0 0,00 0,0b 0,0b 0,00 G1B0 0,0 0,0 0,00 0,0b 0,0b 0,00 G1B1 1,2 0,0 0,58 3,0ab 0,0b 1,50 G1B2 1,3 0,0 0,66 2,8ab 0,0b 1,41 G1B3 0,8 0,3 0,58 3,5ab 0,0b 1,75 G3B0 0,7 0,0 0,33 2,0ab 4,8a 3,41 G3B1 0,0 0,2 0,08 0,3ab 5,2a 2,75 G3B2 0,0 0,0 0,00 0,0b 2,0ab 1,00 G3B3 0,0 0,0 0,00 2,7b 0,8b 1,75 G5B0 2,0 0,0 1,00 3,3ab 0,3b 1,83 G5B1 0,0 0,0 0,00 0,3b 0,0b 0,16 G5B2 0,2 0,0 0,08 3,0ab 0,2b 1,58 G5B3 0,7 0,0 0,33 1,7ab 0,0b 0,83 Rerata 0,43 0,11 1,50 0,86
Ket: -angka pada kolom dan baris yang sama yang diikuti oleh huruf yang sama menunjukkan tidak berbeda nyata berdasarkan uji lanjut Duncan pada taraf 5%
Pengamatan bobot basah pada bulan pertama dan kedua menunjukkan perlakuan G0B2 memiliki rata-rata bobot basah terberat sebesar 341,8 g dan 829,9 g eksplan dari S1P0 dan perlakuan G5B0 dan G3B1 memiliki rata-rata bobot basah terberat sebesar 134,0 g dan 1033,8 g eksplan dari S3P1 (Tabel 9). Interaksi kedua faktor berpengaruh nyata dalam peningkatan bobot basah eksplan selama dua bulan regenerasi. Peningkatan pertumbuhan pada bobot basah bervariasi. Pada eksplan dari S1P0, sepuluh perlakuan memiliki bobot basah di atas kontrol berurut mulai dari yang paling berat, yaitu: G0B2, G5B2, G5B3, G3B5, G1B2, G3B2, G3B1, G1B1, G5B1 dan G0B1, meski bulan pertama hanya terdapat tiga perlakuan yang memiliki bobot di atas kontrol. Berbeda dengan eksplan dari S3P1, dengan dua perlakuan yang memiliki bobot basah di atas kontrol, yaitu: G3B1 dan G5B2 walaupun pada bulan pertama terdapat tigabelas perlakuan yang memiliki bobot basah di atas kontrol (Tabel 9).
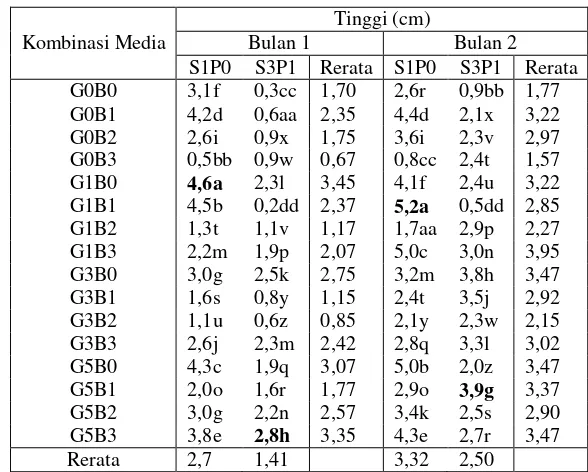
Tinggi tanaman pada bulan keenam menurun. Tinggi tanaman diukur dari pangkal tangkai hingga ujung daun dari tangkai yang masih segar pada masing-masing eksplan. Pada tahap regenerasi terjadi peningkatan tinggi yang signifikan pada kedua perlakuan. Rata-rata tinggi paling besar pada bulan kedua terjadi pada eksplan dari S1P0 mencapai 5,2 cm pada perlakuan G1B1 sedangkan S3P1 hanya memiliki rata-rata tinggi sebesar 3,9 cm pada perlakuan G5B1 (Tabel 10). Pertumbuhan tunas secara statistik menunjukkan berbeda nyata pada kedua faktor dan interaksinya berpengaruh nyata pada peningkatan tinggi tanaman pada dua bulan regenerasi.
9
Tabel 9 Pengaruh kombinasi GA3 dan BAP dari eksplan hasil penyimpanan perlakuan S1P0 dan S3P1 terhadap rata-rata bobot basah pada 2 bulan regenerasi
Ket: angka pada kolom dan baris yang sama yang diikuti oleh huruf yang sama menunjukkan tidak berbeda nyata berdasarkan uji lanjut Duncan pada taraf 5%
Tabel 10 Pengaruh kombinasi GA3 dan BAP dari eksplan hasil penyimpanan perlakuan S1P0 dan S3P1 terhadap rata-rata tinggi tunas pada 2 bulan regenerasi
Kombinasi Media
Tinggi (cm)
Bulan 1 Bulan 2
S1P0 S3P1 Rerata S1P0 S3P1 Rerata G0B0 3,1f 0,3cc 1,70 2,6r 0,9bb 1,77 G0B1 4,2d 0,6aa 2,35 4,4d 2,1x 3,22 G0B2 2,6i 0,9x 1,75 3,6i 2,3v 2,97 G0B3 0,5bb 0,9w 0,67 0,8cc 2,4t 1,57 G1B0 4,6a 2,3l 3,45 4,1f 2,4u 3,22 G1B1 4,5b 0,2dd 2,37 5,2a 0,5dd 2,85 G1B2 1,3t 1,1v 1,17 1,7aa 2,9p 2,27 G1B3 2,2m 1,9p 2,07 5,0c 3,0n 3,95 G3B0 3,0g 2,5k 2,75 3,2m 3,8h 3,47 G3B1 1,6s 0,8y 1,15 2,4t 3,5j 2,92 G3B2 1,1u 0,6z 0,85 2,1y 2,3w 2,15 G3B3 2,6j 2,3m 2,42 2,8q 3,3l 3,02 G5B0 4,3c 1,9q 3,07 5,0b 2,0z 3,47 G5B1 2,0o 1,6r 1,77 2,9o 3,9g 3,37 G5B2 3,0g 2,2n 2,57 3,4k 2,5s 2,90 G5B3 3,8e 2,8h 3,35 4,3e 2,7r 3,47 Rerata 2,7 1,41 3,32 2,50
Ket: angka pada kolom dan baris yang sama yang diikuti oleh huruf yang sama menunjukkan tidak berbeda nyata berdasarkan uji lanjut Duncan pada taraf 5%
Kombinasi Media
Bobot Basah (g)
Bulan 1 Bulan 2
S1P0 S3P1 Rerata S1P0 S3P1 Rerata G0B0 143,0d 61,6z 102,3 277,1y 556,8e 417,0 G0B1 80,1p 98,0i 89,3 312,2v 158,6ee 235,4 G0B2 341,8a 44,8cc 193,3 892,9b 354,1r 623,5 G0B3 48,6bb 39,8ff 44,2 116,5ff 296,9w 206,7 G1B0 89,4l 75,4q 82,4 227,8aa 381,5m 304,7 G1B1 94,0k 66,5u 80,3 352,4s 361,7q 357,1 G1B2 227,2c 96,0j 161,6 492,2i 332,2t 412,2 G1B3 72,9r 83,2n 78,1 266,8z 296,1x 281,5 G3B0 40,7ee 102,1h 71,4 190,0bb 427,9k 309,0 G3B1 68,9s 132,8f 100,9 402,6i 1033,8a 720,7 G3B2 315,4b 62,4y 188,9 485,2j 372,1n 429,7 G3B3 65,9w 44,7dd 55,3 543,9g 362,1p 453,0 G5B0 66,1v 134,0e 100,1 166,4dd 523,4h 344,9 G5B1 80,8o 63,0x 71,9 324,8u 363,8o 344,3 G5B2 50,7aa 67,7t 59,2 595,5d 823,6c 709,6 G5B3 102,3g 88,5m 95,4 546,7f 179,0cc 362,9
10
Tabel 11 Pengaruh kombinasi GA3 dan BAP dari eksplan pada hasil penyimpanan perlakuan S1P0 dan S3P1 terhadap rata-rata jumlah tunas pada 2 bulan regenerasi
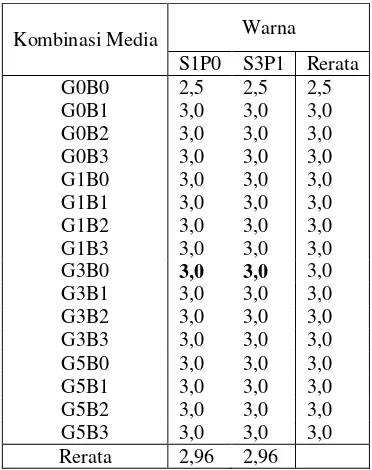
Kombinasi Media Warna S1P0 S3P1 Rerata G0B0 2,5 2,5 2,5 G0B1 3,0 3,0 3,0 G0B2 3,0 3,0 3,0 G0B3 3,0 3,0 3,0 G1B0 3,0 3,0 3,0 G1B1 3,0 3,0 3,0 G1B2 3,0 3,0 3,0 G1B3 3,0 3,0 3,0 G3B0 3,0 3,0 3,0 G3B1 3,0 3,0 3,0 G3B2 3,0 3,0 3,0 G3B3 3,0 3,0 3,0 G5B0 3,0 3,0 3,0 G5B1 3,0 3,0 3,0 G5B2 3,0 3,0 3,0 G5B3 3,0 3,0 3,0 Rerata 2,96 2,96
PEMBAHASAN
Pertumbuhan tanaman purwoceng dapat dilihat dari pertumbuhan daunnya. Pemberian sorbitol dan paklobutrazol memberikan pengaruh pada pembentukan daun. Pada media perbanyakan DKW dengan gula 30 gram perliter, eksplan menghasilkan tunas dan daun pertama pada minggu pertama pada penelitian pendahuluan sedangkan pada perlakuan S1P0 dan S3P1 tumbuh pada minggu kedua bahkan semuanya bertunas pada minggu ketiga. Pengaruh awal yang dapat dilihat adalah munculnya tunas dan daun pertama melambat. Pembentukan daun terhambat diduga karena adanya stres osmotik oleh sorbitol. Sorbitol merupakan gula alkohol yang merupakan monosakarida poliol (1, 2, 3, 4, 5, 6 –Hexanehexol) dengan rumus kimia C6H14O6. Sorbitol menyebabkan potensial osmotik media menjadi rendah dan menyebabkan penyerapan unsur hara oleh sel tanaman menjadi lambat (Bessembinder et al. 1993; Shibli et al. 2006). Selain itu, paklobutrazol mengakibatkan pertumbuhan sel terhambat karena paklobutrazol menghambat sintesis GA3 (Lampiran 6).
Pengaruh sorbitol dan paklobutrazol masih terlihat jelas pada eksplan yang berasal dari S3P1. Hal ini terlihat pada daun yang masih kecil walaupun GA3 dapat meningkatkan perluasan daun (Suwasono 1986) tetapi jumlah daun segar dapat
ditingkatkan secara menyeluruh bahkan eksplan dari S3P1 memiliki jumlah helaian daun segar terbanyak. Selain itu, pertumbuhan daun pertama berlangsung cepat dimana semua eksplan sudah membentuk tunas dan daun baru pada minggu pertama. Pertumbuhan daun dipengaruhi oleh sitokinin karena sitokinin merupakan hormon yang berperan penting dalam propagasi pertumbuhan tunas dan pembelahan sel (Wetherell 1982). Jumlah daun layu cenderung berkurang dengan peningkatan konsentrasi GA3 karena giberelin menghasilkan awal siklus pembelahan sel dengan menstimulir penbentukkan gen CDK (Cyclin-dependent Protein Kinase) sehingga memacu sel pada fase G1 untuk memasuki fase S dan memperpendek fase S tersebut, sehingga peningkatan jumlah sel yang menyebabkan sel tumbuh dengan cepat (Salisbury & Ross 1992).
11
Sorbitol yang meningkatkan tekanan osmotik sehingga kecepatan metabolisme tumbuhan rendah.
Paklobutrazol yang menghambat sintesis giberelin di dalam tumbuhan sehingga tunas tumbuh setelah minggu kedua karena pembelahan dan pemanjangan sel terhambat (Withers 1985). Sorbitol yang meningkatkan tekanan osmotik sehingga kecepatan metabolisme tumbuhan rendah.
Giberelin di dalam tanaman berperan dalam merangsang pembelahan sel dan menghilangkan dormansi tunas (Wattimena 1988) dan GA3 dilaporkan meningkatkan pertumbuhan dan perkembangan tunas (Roest & Bokelmann 1976) sehingga seluruh eksplan pada tahap regenerasi tumbuh pada minggu pertama. Ratio GA3 dan BAP mempengaruhi perbanyakan tunas secara nyata pada kentang. GA3 dapat meningkatkan pemanjangan pucuk selama perbanyakan pucuk in vitro berlangsung pada konsentrasi tinggi. BAP dapat memberikan dampak kemajuan secara nyata pada induksi perbanyakan pucuk dengan konsentrasi sedang (Rabbani et al. 2001). Kombinasi perlakuan yang diberikan memberikan hasil yang sama pada kultur purwoceng. Adanya kemajuan pada perbanyakan pucuk dan peningkatan pemanjangan pucuk selama dua bulan.
Penambahan Paklobutrazol pada perlakuan S3P1 sangat mempengaruhi pertumbuhan ke arah tinggi sehingga terjadi perbedaan yang sangat mencolok dengan perlakuan S1P0. Retardan ini dapat menghambat pertumbuhan tanaman dengan cara menekan pertambahan tinggi tanaman, pemanjangan ruas, dan luas daun (Wattimena 1988). Pada Ipomea batatas, sorbitol dapat memperpendek fase lag kemudian memasuki fase stress shock tetapi morfologi tumbuhan tetap normal hanya tumbuhan menjadi lebih kecil termasuk sel-selnya (Wang et al. 1999). Pada penelitian ini pengukuran dilakukan di dalam LAFC karena tangkai daun tumbuh tidak teratur dan tidak tegak serta tanaman akan melengkung jika sudah mencapai tinggi botol ± 5 cm. Selain itu, bias kaca pada botol dapat menyebabkan pengukuran tidak tepat. Pada satu eksplan terdapat beberapa tunas dengan tinggi yang berbeda jauh.
Pada tahap regenerasi, tinggi tunas yang berasal dari satu eksplan merata dan cepat pertumbuhannya. Hormon giberelin dapat merangsang pertumbuhan pada batang (Suwasono 1986). GA3 secara nyata meningkatkan pemanjangan pucuk selama
perbanyakan pucuk pada konsentrasi tinggi tetapi tangkai daun tetap tumbuh tidak teratur dan tidak tegak. Kombinasi perlakuan yang diberikan dapat mengatasi pengaruh sorbitol dan paclobutrazol pada tahap penyimpanan.
Pembentukan akar tetap terjadi walaupun auksin tidak ditambahkan karena auksin endogen sudah mencukupi untuk pembentukan akar (Agustarini 2009). Pemberian paklobutrazol sangat mempengaruhi produksi akar walaupun dosisnya hanya 1 ppm. Paklobutrazol menghambat tanaman purwoceng memproduksi akar pada tahap penyimpanan seperti pada kultur temulawak (Syahid 2007). Konsentrasi NH+ pada media DKW yang rendah menyebabkan sintesis sitokinin berkurang. Pengurangan tersebut dapat mengubah ratio sitokinin terhadap auksin yang menyebabkan pertumbuhan dan perkembangan tumbuhan lebih mengarah ke proses pembentukan akar terutama akar primer (Fabijan et al. 1981). Keadaan ini tidak sama dengan penelitian dimana eksplan bertumbuh lebih mengarah kepada proses pertunasan. Tampaknya respon terhadap perlakuan berbeda pada tanaman berbeda. Tanaman purwoceng dalam kultur in vitro
memiliki kemampuan memproduksi akar yang rendah. Perbedaan ini juga disebabkan oleh adanya GA3 yang lebih mengarahkan pertumbuhan kepada proses pertunasan.
Adanya sorbitol dan paklobutrazol yang menghambat pertumbuhan planlet, perakaran, tinggi dan jumlah tunas tentunya mengurangi bobot basah planlet. Paklobutrazol memiliki sifat translokasi yang lebih baik sehingga lebih berpengaruh dalam menghambat pertumbuhan (Wattimena & Mattjik 1992). Sorbitol mengurangi kandungan air pada sel yang menjadi komponen utama tanaman.
Walaupun kultur telah disimpan selama enam bulan, kultur mengalami pertumbuhan yang cepat pada media regenerasi. Jumlah daun menjadi lebih banyak, jumlah daun layu menjadi lebih sedikit, jumlah tunas meningkat, dan tanaman memiliki tinggi yang merata. Namun, ada perbedaan kecepatan pertumbuhan pada beberapa perlakuan baik pada bulan pertama maupun kedua. Ada beberapa perlakuan tidak menghasilkan bobot basah lebih baik dari kontrol. Hal ini menunjukkan tidak semua kombinasi perlakuan dapat mengatasi pengaruh penghambatan pertumbuhan oleh sorbitol dan paklobutrazol pada tahap penyimpanan. Respon yang berbeda-beda
12
eksplan yang berasal dari mother plant yang bervariasi.
Perlakuan pada tahap penyimpanan tidak menurunkan daya hidup kultur. Hasil penelitian menunjukkan kultur mampu bertahan hidup pada tahap penyimpanan selama enam bulan maupun pada tahap regenerasi selama dua bulan. Perlakuan yang diberikan pada tahap penyimpanan tidak sampai memberikan cekaman pada tanaman. Pengamatan kualitas warna dilakukan karena warna dapat digunakan sebagai bioindikator hidup. Pada umumnya warna daun semuanya berwarna hijau pada S3P1 maupun S1P0. Warna hijau menunjukkan daya hidup kulur yang baik. Paklobutrazol meningkatkan kandungan klorofil (Wang et al. 1999) sehingga S3P1 tampak lebih hijau dan tegak. Tingginya kemampuan kultur purwoceng untuk tumbuh kembali setelah penyimpanan sangat menguntungkan karena masa simpan kultur dapat diperpanjang, lebih efisien dalam penggunaan tenaga, tempat, dan biaya yang dibutuhkan.
Kultur purwonceng tumbuh berbeda pada media S1P0 dan S3P1. Perlakuan yang baik adalah S1P0. Eksplan pada media S1P0 cenderung tumbuh lambat, memiliki tunas lebih banyak, lebih tinggi, lebih bobot, memproduksi akar dan daya kultur lebih baik. Kultur purwoceng pada media S3P1 tampak kerdil, roset dan jumlah akar yang dihasilkan sangat sedikit.
Perlakuan yang baik pada tahap regenerasi untuk ekplan dari S1P0 adalah G1B1 dan G5B0. Perlakuan tersebut menyebabkan tanaman memiliki kecepatan tumbuh yang cepat, subur, tidak kerdil, daya hidup kultur yang baik, memproduksi akar, jumlah tunas dan bobot basah yang cukup. Walaupun eksplan telah disimpan selama enam bulan, masalah penurunan daya regenerasi dan morfolgi yang kerdil dapat diatasi pada tahap regenerasi. Adanya kecenderungan tanaman yang tinggi memliki jumlah tunas yang sedikit terlihat pada perlakuan G1B1 dan G5B0 memiliki rata-rata tinggi yang tinggi tetapi rata-rata jumlah tunas yang sedikit.
SIMPULAN
Kultur purwonceng tumbuh berbeda pada media S1P0 dan S3P1. Eksplan pada media S1P0 lebih baik karena cenderung tumbuh lambat, memiliki jumlah tunas, daun segar dan daun layu lebih banyak; lebih tinggi, lebih berat, memproduksi akar, dan daya
kultur lebih baik. Kultur purwoceng pada media S3P1 tumbuh lebih lambat, kerdil dan jumlah akar yang dihasilkan sangat sedikit. Perlakuan yang baik pada tahap regenerasi untuk eksplan dari S1P0 adalah G1B1 dan G5B0. Perlakuan tersebut menyebabkan tanaman subur, tidak kerdil, daya hidup kultur yang baik, memproduksi akar, jumlah tunas dan bobot basah yang cukup untuk regenerasi. Walaupun eksplan telah disimpan selama enam bulan, masalah penurunan daya regenerasi dan kerdil dapat diatasi pada tahap regenerasi.
SARAN
Penyimpanan kultur perlu dilanjutkan untuk mendapatkan protokol penyimpanan lebih dari enam bulan. Regenerasi juga perlu dilanjutkan untuk mendapatkan protokol regenerasi lebih dari dua bulan.
DAFTAR PUSTAKA
Agustarini R. 2009. Enkapsulasi Untuk Konservasi In Vitro Pimpinella Pruatjan
Molk.: Efek Cahaya dan Kombinasi Media (Sorbitol-Paklobutrazol) [tesis]. Bogor: Program Pascasarjana Institut Pertanian Bogor.
Bessembinder JJE, Stanitsky G, Zandvoort EA .1993. Long-term in vitro storage of
Colocasia esculenta under minimal growth conditions. Plant CelI, Tissue and Organ Culture 33:121-127.
Buchanan BB, Gruissem W, Jones RL. 2000.
Biochemistry & Molecular Biology of Plants. America: American Society of Plant Physiologists.
Caropeboka AM, Lubis I. 1985.Pemeriksaan pendahuluan kandungan bahan kimia dalam akar Pimpinella alpine
(Purwoceng). Prosiding Simposium Penelitian Tanaman Obat I; Bogor, 08-09 Desember 1975. Bogor: Farmakologi-Dept. Fisiologi dan Farmakologi, Fak. Kedokteran Hewan-IPB. hlm 153- 158.
_____, Iskandar, Paridjo P. 1979. Pengaruh Ekstrak Akar Pimpinella alpina Koord.
12
eksplan yang berasal dari mother plant yang bervariasi.
Perlakuan pada tahap penyimpanan tidak menurunkan daya hidup kultur. Hasil penelitian menunjukkan kultur mampu bertahan hidup pada tahap penyimpanan selama enam bulan maupun pada tahap regenerasi selama dua bulan. Perlakuan yang diberikan pada tahap penyimpanan tidak sampai memberikan cekaman pada tanaman. Pengamatan kualitas warna dilakukan karena warna dapat digunakan sebagai bioindikator hidup. Pada umumnya warna daun semuanya berwarna hijau pada S3P1 maupun S1P0. Warna hijau menunjukkan daya hidup kulur yang baik. Paklobutrazol meningkatkan kandungan klorofil (Wang et al. 1999) sehingga S3P1 tampak lebih hijau dan tegak. Tingginya kemampuan kultur purwoceng untuk tumbuh kembali setelah penyimpanan sangat menguntungkan karena masa simpan kultur dapat diperpanjang, lebih efisien dalam penggunaan tenaga, tempat, dan biaya yang dibutuhkan.
Kultur purwonceng tumbuh berbeda pada media S1P0 dan S3P1. Perlakuan yang baik adalah S1P0. Eksplan pada media S1P0 cenderung tumbuh lambat, memiliki tunas lebih banyak, lebih tinggi, lebih bobot, memproduksi akar dan daya kultur lebih baik. Kultur purwoceng pada media S3P1 tampak kerdil, roset dan jumlah akar yang dihasilkan sangat sedikit.
Perlakuan yang baik pada tahap regenerasi untuk ekplan dari S1P0 adalah G1B1 dan G5B0. Perlakuan tersebut menyebabkan tanaman memiliki kecepatan tumbuh yang cepat, subur, tidak kerdil, daya hidup kultur yang baik, memproduksi akar, jumlah tunas dan bobot basah yang cukup. Walaupun eksplan telah disimpan selama enam bulan, masalah penurunan daya regenerasi dan morfolgi yang kerdil dapat diatasi pada tahap regenerasi. Adanya kecenderungan tanaman yang tinggi memliki jumlah tunas yang sedikit terlihat pada perlakuan G1B1 dan G5B0 memiliki rata-rata tinggi yang tinggi tetapi rata-rata jumlah tunas yang sedikit.
SIMPULAN
Kultur purwonceng tumbuh berbeda pada media S1P0 dan S3P1. Eksplan pada media S1P0 lebih baik karena cenderung tumbuh lambat, memiliki jumlah tunas, daun segar dan daun layu lebih banyak; lebih tinggi, lebih berat, memproduksi akar, dan daya
kultur lebih baik. Kultur purwoceng pada media S3P1 tumbuh lebih lambat, kerdil dan jumlah akar yang dihasilkan sangat sedikit. Perlakuan yang baik pada tahap regenerasi untuk eksplan dari S1P0 adalah G1B1 dan G5B0. Perlakuan tersebut menyebabkan tanaman subur, tidak kerdil, daya hidup kultur yang baik, memproduksi akar, jumlah tunas dan bobot basah yang cukup untuk regenerasi. Walaupun eksplan telah disimpan selama enam bulan, masalah penurunan daya regenerasi dan kerdil dapat diatasi pada tahap regenerasi.
SARAN
Penyimpanan kultur perlu dilanjutkan untuk mendapatkan protokol penyimpanan lebih dari enam bulan. Regenerasi juga perlu dilanjutkan untuk mendapatkan protokol regenerasi lebih dari dua bulan.
DAFTAR PUSTAKA
Agustarini R. 2009. Enkapsulasi Untuk Konservasi In Vitro Pimpinella Pruatjan
Molk.: Efek Cahaya dan Kombinasi Media (Sorbitol-Paklobutrazol) [tesis]. Bogor: Program Pascasarjana Institut Pertanian Bogor.
Bessembinder JJE, Stanitsky G, Zandvoort EA .1993. Long-term in vitro storage of
Colocasia esculenta under minimal growth conditions. Plant CelI, Tissue and Organ Culture 33:121-127.
Buchanan BB, Gruissem W, Jones RL. 2000.
Biochemistry & Molecular Biology of Plants. America: American Society of Plant Physiologists.
Caropeboka AM, Lubis I. 1985.Pemeriksaan pendahuluan kandungan bahan kimia dalam akar Pimpinella alpine
(Purwoceng). Prosiding Simposium Penelitian Tanaman Obat I; Bogor, 08-09 Desember 1975. Bogor: Farmakologi-Dept. Fisiologi dan Farmakologi, Fak. Kedokteran Hewan-IPB. hlm 153- 158.
_____, Iskandar, Paridjo P. 1979. Pengaruh Ekstrak Akar Pimpinella alpina Koord.
PENYIMPANAN
IN VITRO
DENGAN TEKNIK PERTUMBUHAN
MINIMAL DAN REGENERASI PASCA PENYIMPANAN KULTUR
PURWOCENG (
Pimpinella pruatjan
Molk.)
ROBERT EDUARD SUEK
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
12
eksplan yang berasal dari mother plant yang bervariasi.
Perlakuan pada tahap penyimpanan tidak menurunkan daya hidup kultur. Hasil penelitian menunjukkan kultur mampu bertahan hidup pada tahap penyimpanan selama enam bulan maupun pada tahap regenerasi selama dua bulan. Perlakuan yang diberikan pada tahap penyimpanan tidak sampai memberikan cekaman pada tanaman. Pengamatan kualitas warna dilakukan karena warna dapat digunakan sebagai bioindikator hidup. Pada umumnya warna daun semuanya berwarna hijau pada S3P1 maupun S1P0. Warna hijau menunjukkan daya hidup kulur yang baik. Paklobutrazol meningkatkan kandungan klorofil (Wang et al. 1999) sehingga S3P1 tampak lebih hijau dan tegak. Tingginya kemampuan kultur purwoceng untuk tumbuh kembali setelah penyimpanan sangat menguntungkan karena masa simpan kultur dapat diperpanjang, lebih efisien dalam penggunaan tenaga, tempat, dan biaya yang dibutuhkan.
Kultur purwonceng tumbuh berbeda pada media S1P0 dan S3P1. Perlakuan yang baik adalah S1P0. Eksplan pada media S1P0 cenderung tumbuh lambat, memiliki tunas lebih banyak, lebih tinggi, lebih bobot, memproduksi akar dan daya kultur lebih baik. Kultur purwoceng pada media S3P1 tampak kerdil, roset dan jumlah akar yang dihasilkan sangat sedikit.
Perlakuan yang baik pada tahap regenerasi untuk ekplan dari S1P0 adalah G1B1 dan G5B0. Perlakuan tersebut menyebabkan tanaman memiliki kecepatan tumbuh yang cepat, subur, tidak kerdil, daya hidup kultur yang baik, memproduksi akar, jumlah tunas dan bobot basah yang cukup. Walaupun eksplan telah disimpan selama enam bulan, masalah penurunan daya regenerasi dan morfolgi yang kerdil dapat diatasi pada tahap regenerasi. Adanya kecenderungan tanaman yang tinggi memliki jumlah tunas yang sedikit terlihat pada perlakuan G1B1 dan G5B0 memiliki rata-rata tinggi yang tinggi tetapi rata-rata jumlah tunas yang sedikit.
SIMPULAN
Kultur purwonceng tumbuh berbeda pada media S1P0 dan S3P1. Eksplan pada media S1P0 lebih baik karena cenderung tumbuh lambat, memiliki jumlah tunas, daun segar dan daun layu lebih banyak; lebih tinggi, lebih berat, memproduksi akar, dan daya
kultur lebih baik. Kultur purwoceng pada media S3P1 tumbuh lebih lambat, kerdil dan jumlah akar yang dihasilkan sangat sedikit. Perlakuan yang baik pada tahap regenerasi untuk eksplan dari S1P0 adalah G1B1 dan G5B0. Perlakuan tersebut menyebabkan tanaman subur, tidak kerdil, daya hidup kultur yang baik, memproduksi akar, jumlah tunas dan bobot basah yang cukup untuk regenerasi. Walaupun eksplan telah disimpan selama enam bulan, masalah penurunan daya regenerasi dan kerdil dapat diatasi pada tahap regenerasi.
SARAN
Penyimpanan kultur perlu dilanjutkan untuk mendapatkan protokol penyimpanan lebih dari enam bulan. Regenerasi juga perlu dilanjutkan untuk mendapatkan protokol regenerasi lebih dari dua bulan.
DAFTAR PUSTAKA
Agustarini R. 2009. Enkapsulasi Untuk Konservasi In Vitro Pimpinella Pruatjan
Molk.: Efek Cahaya dan Kombinasi Media (Sorbitol-Paklobutrazol) [tesis]. Bogor: Program Pascasarjana Institut Pertanian Bogor.
Bessembinder JJE, Stanitsky G, Zandvoort EA .1993. Long-term in vitro storage of
Colocasia esculenta under minimal growth conditions. Plant CelI, Tissue and Organ Culture 33:121-127.
Buchanan BB, Gruissem W, Jones RL. 2000.
Biochemistry & Molecular Biology of Plants. America: American Society of Plant Physiologists.
Caropeboka AM, Lubis I. 1985.Pemeriksaan pendahuluan kandungan bahan kimia dalam akar Pimpinella alpine
(Purwoceng). Prosiding Simposium Penelitian Tanaman Obat I; Bogor, 08-09 Desember 1975. Bogor: Farmakologi-Dept. Fisiologi dan Farmakologi, Fak. Kedokteran Hewan-IPB. hlm 153- 158.
_____, Iskandar, Paridjo P. 1979. Pengaruh Ekstrak Akar Pimpinella alpina Koord.
13
Engelman F. 1991. In vitro conservation of tropical plant germplasm – review.
Euphytica 57: 227-243.
Fabijan D, Yeung E, Mukherjee, Reid DM. 1981. Adventitious rooting in hypocotyls of sunflower (Helianthus annuus) seedling. Physiologia Plantaru
53: 578–588.
Gamborg OL, Philips GC. 1995. Plant Cell Tissue and Organ Culture Fundamental Methods. Germany: Springer.
Heyne K. 1987. Tumbuhan Berguna Jilid III. Jakarta: Balai Penelitian dan Pengembangan Kehutanan.
Lestari EG, Mariska I. 1997. Kultur in vitro
sebagai metode pelestarian tumbuhan obat langka. Buletin Plasma Nutfah 2 (1): 1-8.
Ningsih R. 2009. Penyimpanan dengan pertumbuhan minimal dan regenerasi in vitro purwoceng (Pimpinella pruatjan
Molk.) [tesis]. Bogor: Program Pascasarjana Institut Pertanian Bogor.
Rabbani A, Askari B, Abbasi NA, Bhatti M, Quraishi A. 2001. Effect of growth regulator on in vitro multiplication of potatoes. Internaional Journal of Agriculture and Biology 3 (2): 181- 182.
Rahayu S, Sunarlim N. 2002. Konservasi tumbuhan obat langka purwoceng melalui pertumbuhan minimal. Buletin Plasma Nutfah 8(1): 29 - 33.
Rivai MA, Rugayah, Widjaja EA. 1992. Thirty years of the eroded species medicinal crops. Floribunda. Bogor: Pioneer of Indonesian Taxonomy. hlm 28.
Rostiana O, Raharjo M, Rizal M. 2006. Pengernbangan teknologi budidaya purwoceng dan mimba mendukung penyiapan bahan obat alami secara berkelajutan. Prosiding Seminar Nasional dan Pameran Tumbuhan Obat lndonesia, XXVIII. Bogor. hlm 7-17.
Roest S, Bokelmann GS. 1976. Vegetatif propagation of Solanum tuberosum L.
in vitro. Potato Res 19: 173-178.
Shibli RA, Shatnawi MA, Subaih WS, Ajlouni MM. 2006. In vitro
conservation and cryopreservation of plant genetic resources: a review. World Journal of Agricultural Sciences 2 (4): 372-382.
Salisbury FB, Ross CW. 1992. Fisiologi Tumbuhan. Jilid 3. Lukman DR, Sumaryono, perjemahan; Niksolihin S, editor. Bandung: ITB Press. Terjemahan dai Plant Physiology.
Suwasono H. 1986. Hormon Pertumbuhan. Jakarta: CV. Rajawali.
Syahid SF. 2007. Pengaruh retardan paklobutrazol terhadap pertumbuhan temu lawak (Curcuma xanthorrhiza)
selama konservasi in vitro. Jurnal Lattri
13 (3): 93-97.
Wang HL, Lee PD, Liu LF, Su JC. 1999. Effect of sorbitol induced osmotic stress on the changes of carbohydrate and free amino acid pools in sweet potato cell suspension cultures. Bot Bull Acad. Sin. 40: 219-225
Wattimena GA. 1988. Zat pengatur tumbuh tanaman. Bogor: IPB PAU Bioteknologi. hlm 145.
Wattimena GA. Mattjik NA. 1992. Pemuliaan tanaman secara in vitro. Di dalam Bioteknologi tanaman, tim laboratorium, editor. Bogor: IPB PAU Bioteknologi. hlm 105-109.
Wetherell DF. 1982. Pengantar propagasi tanaman secara in vitro. Koesoemdiyah, penerjemah. New Jersey: Avery Publishing Group.
William RC. 2003. Growth Retardants. Prosiding Tool for Managing Urban Trees; West Lafayette, 09 March 2003. West Lafayette: Department of Forestry and Natural Resources. hlm 1-6.
PENYIMPANAN
IN VITRO
DENGAN TEKNIK PERTUMBUHAN
MINIMAL DAN REGENERASI PASCA PENYIMPANAN KULTUR
PURWOCENG (
Pimpinella pruatjan
Molk.)
ROBERT EDUARD SUEK
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
ROBERT EDUARD SUEK. Penyimpanan In Vitro dengan Teknik Pertumbuhan Minimal dan Regenerasi Pasca Penyimpanan Kultur Purwoceng (Pimpinella pruatjan Molk.). Dibimbing oleh RITA MEGIA dan IRENG DARWATI.
Purwoceng adalah salah satu tumbuhan obat langka Indonesia dengan kategori endangered
atau hampir punah karena eksploitasi tanpa penanaman kembali dan habitat aslinya yang sudah rusak. Ekstrak akarnya berkhasiat obat sebagai diuretik, tonik dan terutama sebagai afrodisiak. Penelitian awal menemukan bahwa purwoceng dapat dikonservasi baik secara in vitro dengan teknik pertumbuhan minimal pada media DKW dengan sukrosa 30 gram, sorbitol 1% tanpa paklobutrazol (S1P0); dan sorbitol 3% dan paklobutrazol 1 ppm (S3P1) pada masa penyimpanan empat dan delapan bulan. Namun, regenerasinya pada media DKW + BA 4 ppm + Thidiazuron (TDZ) 0,4 ppm + Glutamin 100 ppm dengan penambahan GA3 3 ppm selama tiga bulan menunjukkan kultur tersebut mengalami penurunan daya regenerasi dan masih mempertahankan morfologi kerdil pada tahap regenerasi. Pengaruh perlakuan sorbitol dan paklobutrazol selama penyimpanan masih terbawa. Penelitian ini dilakukan melalui penanaman tunas aksilar purwoceng yang ditumbuhkan pada media penyimpanan dengan masa penyimpanan enam bulan. Regenerasi dilakukan selama dua bulan pada media DKW dengan sukrosa 30 gram, kombinasi GA3 (0, 1, 3, 5 ppm) dan BAP (0, 1, 2, 3 ppm). Perlakuan sorbitol dan paklobutrazol yang baik pada tahap penyimpanan adalah S1P0. Perlakuan S1P0 menyebabkan tanaman memiliki pertumbuhan yang cenderung lambat, tampak normal, memproduksi akar dan daya kultur baik sedangkan eksplan dari S3P1 tumbuh lebih lambat, kerdil, roset dan jumlah akar sedikit. Perlakuan yang baik pada tahap regenerasi untuk eksplan dari S1P0 adalah G1B1 (GA3 1 ppm dan BAP 1 ppm) dan G5B0. Perlakuan tersebut menyebabkan tanaman tumbuh subur, tidak kerdil, daya hidup kultur yang normal dan memproduksi akar. Walaupun eksplan telah disimpan selama enam bulan, masalah penurunan daya regenerasi dan morfologi yang kerdil dapat diatasi pada tahap regenerasi.
Kata kunci : in vitro, Pimpinella pruatjan Molk., penyimpanan, regenerasi
ABSTRACT
ROBERT EDUARD SUEK. Storage of In Vitro with Minimal Growth Technique and Regeneration After Storage of Purwoceng Culture (Pimpinella pruatjan Molk.). Supervised by RITA MEGIA and IRENG DARWATI.
Purwoceng is one of the rare medicinal plants of Indonesia which is categorized as endangered plant because of the exploitation without replanting and the damage of natural habitat. Roots extracts of this medicinal plant can be used as diuretics, tonics, and especially as aphrodisiacs. Preliminary research found that purwoceng can be good conserved in vitro with minimal growth technique on DKW medium with 30 grams of sucrose, 1% sorbitol without paklobutrazol (S1P0); and 3% sorbitol and 1 ppm paklobutrazol (S3P1) in the storage period of four months and eight months. However, their regeneration within three months in media DKW + BA 4 ppm + Thidiazuron (TDZ) 0,4 ppm + Glutamin 100 ppm that added with GA3 3 ppm decreased and they maintained their dwarf morphology in the regeneration stage. Effect of sorbitol and paklobutrazol treatment during storage was still brought. This research was conducted by planting of axillary buds purwoceng which was grown on the storage media within six months of storage period. The regeneration was carried out for two months on DKW medium with 30 grams of sucrose, combination of GA3 (0, 1, 3, 5 ppm) and BAP (0, 1, 2, 3 ppm). The good treatment in this storage phase was S1P0. Explants of S1P0 had tend to grow slowly and normally, produced good roots and good condition; whereas explants of S3P1 slow growth rate, dwarf and poor of root. The good combination at regeneration phase from explants of S1P0 was G1B1 (GA3 1 ppm and BAP 1 ppm) and G5B0. The treatment of G1B1 and G5B0 produced fertile and no dwarfts plants which have high growth rate, their culture vitality were normal, and they produce root.
PENYIMPANAN
IN VITRO
DENGAN TEKNIK PERTUMBUHAN
MINIMAL DAN REGENERASI PASCA PENYIMPANAN KULTUR
PURWOCENG (
Pimpinella pruatjan
Molk.)
ROBERT EDUARD SUEK
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Biologi
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul skripsi : Penyimpanan
In Vitro dengan Teknik Pertumbuhan Minimal dan
Regenerasi Pasca Penyimpanan Kultur Purwoceng (Pimpinella
pruatjan Molk.)
Nama
: Robert Eduard Suek
NIM
: G34051544
Menyetujui:
Pembimbing I
Pembimbing II
Dr. Rita Megia, DEA. Dr. Ir. Ireng Darwati
NIP. 19550214 198103 2 001
NIP. 19581128 198603 2 002
Mengetahui:
Ketua Departemen,
Dr. Ir. Ence Darmo Jaya Supena, M.Si.
NIP. 19641002 198901 1 002
PRAKATA
Puji dan syukur penulis panjatkan ke hadirat Tuhan Yang Maha Esa atas segala anugerah-Nya sehingga penulis dapat menyelesaikan penelitian dan penulisan skripsi ini. Judul yang dipilih dalam penelitian yang dilaksanakan sejak Febuari 2009 ini ialah Penyimpanan In Vitro dengan Teknik Pertumbuhan Minimal dan Regenerasi Pasca Penyimpanan Kultur Purwoceng (Pimpinella pruatjan Molk.)
Penulis menyadari bahwa penelitian ini melibatkan banyak pihak yang membantu dalam bantuan teknis dan saran profesional. Terima kasih penulis ucapkan kepada Ibu Dr. Rita Megia, DEA. dan Ibu Dr. Ir. Ireng Darwati selaku pembimbing yang telah memberikan waktu untuk membimbing, mengarahkan dan mendidik saya. Terima kasih kepada Dr. Nunik Sri Ariyanti. M.Si selaku dosen penguji atas kritik dan sarannya untuk kesempurnaan skripsi ini. Di samping itu, Bapak Dr. Ir. Alex Hartana selaku pembimbing akademik penulis. Laboratorium Ekofisiologi Balai Penelitian Tanaman Obat dan Aromatik (Balittro) yang telah menyediakan fasilitas untuk melakukan penelitian. Proyek Kerja Sama Kemitraan Penelitian Pertanian dengan Perguruan Tinggi (KKP3T) yang telah membiayai penelitian ini. Ibu Rosita, Ibu Devi, Bu Rohmah, Mbak Ima, Mbak Susi dan semua yang telah membantu saya di laboratorium. Terima kasih juga penulis sampaikan kepada Frahel, Lamtiur, Luria, Dimest, Adi, Eko, Okto, Joel, Budiman, Rheza, Steward, Daniel, Idho, Tunggul, Hudi, Yano, Ricky, Rully, Jimmy, Benny, Alfred, Aan, Junide, Fitri, Reni, Mei, Bertha, Togi, Debo, Riko, Nuel, Putra, Liber, KPPerz, Gamanusratim, Biologi angkatan 2005, dan semua pihak yang tidak dapat disebutkan satu persatu. Ucapan terima kasih juga disampaikan kepada ayah, ibu, saudara dan seluruh keluarga terkasih di dalam Kristus, atas segala doa, pengorbanan, kesabaran, pengertian, didikan dan kasih sayang kepada saya. Tuhan senantiasa memberkati, melindungi, memberi kasih karunia dan damai sejahtera kepada kita semua, amin.
Semoga karya ilmiah ini bermanfaat.
Bogor, Mei 2011
RIWAYAT HIDUP
Penulis dilahirkan di Kupang pada tanggal 14 Juli 1987 dari ayah Daniel Suek dan ibu Agustina Lonak. Penulis merupakan anak terakhir dari 5 bersaudara.
Tahun 2005 penulis lulus dari SMA Negeri 1 Kupang dan pada tahun yang sama lulus seleksi IPB melalui jalur Undangan Seleksi Masuk IPB. Penulis memilih mayor Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam dan minor Pengolahan Pangan, Fakultas Teknologi Pertanian.
DAFTAR ISI
Halaman
DAFTAR TABEL ... viii
DAFTAR GAMBAR ... viii
DAFTAR LAMPIRAN ... viii
PENDAHULUAN
Latar Belakang ... 1 Tujuan Penelitian ... 2 Hipotesis Penelitian ... 2
BAHAN DAN METODE
Waktu dan Tempat Penelitian ... 2 Bahan dan Alat ... 2 Metode Penelitian ... 2 Sterilisasi alat dan bahan ... 2 Pembuatan media ... 2 Perbanyakan sumber eksplan ... 2 Pertumbuhan minimal selama enam bulan ... 2 Pengujian daya regenerasi pasca penyimpanan selama dua bulan ... 2 Pengamatan ... 3 Kondisi kultur dan anova ... 3
HASIL
Pertumbuhan Minimal Selama Enam Bulan... 3 Pengujian Daya Regenerasi Pasca Penyimpanan Selama Dua Bulan. ... 5
PEMBAHASAN ... 10
SIMPULAN ... 12
SARAN ... 12
DAFTAR PUSTAKA ... 12
LAMPIRAN ... 14
DAFTAR TABEL
Halaman
1 Standar warna kode desimal RGB . ... 3 2 Pengaruh pemberian sorbitol dan paklobutrazol terhadap rata-rata
jumlah daun segar dan jumlah daun layu. ... 4 3 Pengaruh pemberian sorbitol dan paklobutrazol terhadap rata-rata
jumlah akar dan jumlah tunas. ... 4 4 Pengaruh pemberian sorbitol dan paklobutrazol terhadap rata-rata
berat basah dan kualitas warna ... 4 5 Pengaruh kombinasi GA3 dan BAP dari eksplan hasil penyimpanan
perlakuan S1P0 dan S3P1 terhadap rata-rata jumlah daun segar
pada 2 bulan regenerasi ... 6 6 Pengaruh kombinasi GA3 dan BAP dari eksplan hasil penyimpanan
perlakuan S1P0 dan S3P1 terhadap rata-rata jumlah daun layu
pada 2 bulan regenerasi ... 6 7 Pengaruh kombinasi GA3 dan BAP dari eksplan hasil penyimpanan
perlakuan S1P0 dan S3P1 terhadap rata-rata jumlah tunas
pada 2 bulan regenerasi ... 7 8 Pengaruh kombinasi GA3 dan BAP dari eksplan hasil penyimpanan
perlakuan S1P0 dan S3P1 terhadap rata-rata jumlah akar
pada 2 bulan regenerasi ... 8 9 Pengaruh kombinasi GA3 dan BAP dari eksplan hasil penyimpanan
perlakuan S1P0 dan S3P1 terhadap rata-rata jumlah bobot basah
pada 2 bulan regenerasi ... 9 10 Pengaruh kombinasi GA3 dan BAP dari eksplan hasil penyimpanan
perlakuan S1P0 dan S3P1 terhadap rata-rata tinggi tunas
pada 2 bulan regenerasi ... 9 11 Pengaruh kombinasi GA3 dan BAP dari eksplan hasil penyimpanan
perlakuan S1P0 dan S3P1 terhadap rata-rata kualitas warna
pada 2 bulan regenerasi ... 10
DAFTAR GAMBAR
Halaman
1 Morfologi kultur S1P0 pada tahap penyimpanan ... 4 2 Morfologi kultur S3P1 pada tahap penyimpanan ... 5 3 Pengaruh kombinasi GA3 dan BAP dari eksplan hasil penyimpanan
perlakuan S1P0 dan S3P1 terhadap jumlah eksplan yang berakar
pada bulan kedua regenerasi... 7
DAFTAR LAMPIRAN
Halaman
1 Mekanisme penghambatan paklobutrazol terhadap sintesis giberelin... 15 2 Penataan percobaan tahap penyimpanan selama 6 bulan .. ... 16 3 Penataan percobaan tahap regenerasi selama 2 bulan .. ... 17 4 Tabel sidik ragam penyimpanan selama 6 bulan .. ... 18 5 Tabel sidik ragam regenerasi selama 2 bulan .. ... 21 6 Perbandingan formula media dasar MS (Murashige & Skoog) dan DKW (Driver
PENDAHULUAN
Latar Belakang
Tumbuhan obat memiliki potensi dan pemanfaatan yang semakin meningkat melalui industri agromedisin. Hal ini dilihat dari semakin banyaknya penduduk dunia yang kembali beralih pada obat alami. Agromedisin adalah rangkaian proses pengolahan bahan-bahan nabati mulai dari budidaya tumbuhan berkhasiat obat yang kemudian diolah menjadi bahan baku baik berupa simplisia, produk olahan berupa ekstrak, minyak atsiri maupun sediaan obat jadi. Peluang ini sudah dimanfaatkan oleh industri jamu Indonesia. Salah satu tumbuhan obat terkenal adalah purwoceng (Pimpinella pruatjan Molk.). Tumbuhan ini telah lama dimanfaatkan ol