EFEKTIVITAS ISOLAT FAGE LITIK
Shigella
sp.
ISWADI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis Efektivitas Isolat Fage Litik Shigella sp. adalah karya saya dengan arahan dari komisi pembimbing dan belum
diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Juli 2012
I s w a d i
ABSTRACT
ISWADI. Effectiveness of Shigella sp. lytic phage. Under supervision of SRI BUDIARTI and IMAN RUSMANA.
Shigella sp. is the causative agent of shigellosis transmitted through food and water. Bacteriophages are considered as an alternative agent to control this bacterial infection and contamination. The aim of this research is to analyze the effectiveness of lytic phage against Shigella sp. Lytic phages were isolated from household wastewaters of Sindang Barang, Cibeureum and Babakan Darmaga Kabupaten Bogor. One specific phage of Shigella sp. (phage FY51-X) isolated from household wastewaters performed plaque with rounded shape with 1.22 mm in diameter. Number of lytic phage infecting Shigella sp. cells was 1.84 x 108 PFU mL-1. This phage only infected Shigella sp. 51-X of 14 tested bacterial isolates. Phage FY51-X was stable after storage at 20 and 37 °C, but its lytic activity was lost after storage at 60 oC for 60 minutes. Additionaly activity of the phage was lost after incubation for 24 hours in acidic and alkaline conditions. Alkaline condition was more sensitive than acidic condition. Virion of the phage consisted of 8 proteins with molecular weight ranging from 19.65 to 86.18 kDa. Lytic activity of the phage against Shigella sp. 51-X was shown after 4 hours of incubation, however the number of bacterial cells was significantly decreased at 12 hours of incubation.
RINGKASAN
ISWADI. Efektivitas Isolat Fage Litik Shigella sp. Dibimbing oleh SRI BUDIARTI dan IMAN RUSMANA.
Shigellosis merupakan salah satu permasalahan kesehatan bagi masyarakat di negara berkembang yang disebabkan oleh Shigella sp. Penyakit gastroenteritis ini bersifat akut dan menjadi salah satu penyebab paling umum sakit dan kematian pada anak-anak di negara berkembang serta menjadi penyebab signifikan menurunnya produktivitas ekonomi. Penularan penyakit ini dapat terjadi melalui makanan atau air yang terkontaminasi. Penanganan terhadap penyakit shigellosis umumnya menggunakan terapi antibiotik. Beberapa studi di Indonesia melaporkan hasil pengujian pola resistensi Shigella terhadap beberapa jenis antibiotik yang dilakukan secara in vitro dengan hasil yang menunjukkan bakteri ini telah mengalami resistensi terhadap berbagai jenis antibiotik. Peningkatan resistensi bakteri terhadap berbagai jenis antibiotik mendorong aplikasi fage sebagai biokontrol untuk mereduksi bakteri patogen. Penelitian ini bertujuan untuk menguji kisaran inang dan efektivitas fage litik dalam melisis biakan bakteri Shigella sp., serta diharapkan dapat digunakan sebagai biokontrol pencemaran air dan makanan sehingga dapat mencegah penyebaran penyakit shigellosis. Pemanfaatan fage sebagai biokontrol patogen membutuhkan pemahaman yang baik mengenai efek faktor lingkungan terhadap aktivitas fage.
Bakteri yang digunakan untuk isolasi fage dalam penelitian ini ialah Shigella 51-X, sedangkan untuk pengujian kisaran inang digunakan Salmonella p15, p19, p38, p84, dan E. coli nonpatogen yang merupakan koleksi Dr. dr. Sri Budiarti.
Pada penelitian ini diperoleh satu isolat fage, yaitu fage FY51-X dengan bentuk plak bulat, berdiameter 1,22 mm, dan bersifat spesifik inang. Perkiraan jumlah fage yang menginfeksi dan melisis sel inang diukur dengan menghitung jumlah plak yang terbentuk (plaque forming units). Jumlah fage FY51-X yang menginfeksi dan melisis sel inang diperkirakan mencapai 1,84 x 10
Fage diisolasi dari limbah cair rumah tangga Kelurahan Sindang Barang, Cibeureum dan Babakan Darmaga Kabupaten Bogor. Fage hasil isolasi dimurnikan dan dibiakkan, selanjutnya dilakukan penentuan kisaran inang, pengujian stabilitas terhadap suhu dan pH, pengujian berat molekul protein dan diuji efektivitas lisis terhadap sel Shigella sp.
8
Pengujian berat molekul protein fage FY51-X menggunakan sodium dodecyl sulfate-polyacrylamide gel electrophoresis memperlihatkan 8 pita protein pada gel pemisah dengan berat molekul masing-masing 86,18; 58,80; 54,47; 44,42; 38,12; 31,09; 22,89; dan 19,65 kDa. Molekul protein dengan berat tertentu menunjukkan bahwa protein tersebut merupakan penyusun bagian tertentu dari fage seperti kepala, ekor dan serabut ekor. Bagian tertentu dari fage tidak hanya disusun oleh satu molekul protein saja, tetapi dapat tersusun oleh beberapa molekul protein sekaligus. Pengujian efektivitas lisis fage FY51-X terhadap sel Shigella sp. menunjukkan bahwa fage ini efektif melisis bakteri inang 4 jam setelah masa inkubasi dan menjadi waktu optimal dalam melisis inang. Waktu lisis ini relatif lambat jika dibandingkan dengan
© Hak Cipta milik IPB, tahun 2012 Hak Cipta dilindungi Undang-undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
EFEKTIVITAS ISOLAT FAGE LITIK
Shigella
sp.
ISWADI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Mikrobiologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Efektivitas Isolat Fage Litik Shigella sp. Nama : Iswadi
NRP : G351090101
Disetujui Komisi Pembimbing
Dr. dr. Sri Budiarti
Ketua Anggota
Dr. Ir. Iman Rusmana, MSi
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana
Mikrobiologi
Dr. Ir. Gayuh Rahayu Dr. Ir. Dahrul Syah, M.Sc. Agr
PRAKATA
Bismillaahirrahmaanirrahiim
Segala puji bagi Allah, Tuhan semesta alam, yang telah menurunkan Al-Qur’an yang suci dan mulia sebagai penerang dan petunjuk bagi seluruh umat manusia. Shalawat dan salam kepada pembawa risalah kebenaran al-Islam, Rasul Muhammad SAW, juga kepada keluarga, para sahabat dan pengikut beliau hingga akhir zaman. Alhamdulillah atas rahmat dan karunia Allah, penulis dapat menyelesaikan penelitian yang berjudul Efektivitas Isolat Fage Litik Shigella sp.
Terimakasih penulis ucapkan kepada Hibah Penelitian TIM Pascasarjana (HPTP) 2010 yang membiayai penelitian ini melalui Dr. dr. Sri Budiarti sebagai ketua TIM peneliti. Terimakasih juga kepada Ibu Dr. dr. Sri Budiarti dan Bapak Dr. Ir. Iman Rusmana, M,Si. atas bimbingan, saran dan arahan mulai dari penulisan proposal, pelaksanaan penelitian hingga penyempurnaan penulisan ini. Ibu Dr. Ir. Gayuh Rahayu selaku ketua program studi dan Ibu Dr. Nisa Rachmania, M.Si. yang telah berkontribusi dalam penyelarasan tulisan ini. Penulis juga mengucapkan terimakasih kepada Rektor Universitas Syiah Kuala, Dekan Fakultas Keguruan dan Ilmu Pendidikan Universitas Syiah Kuala atas izin dan kesempatan untuk melanjutkan pendidikan di Institut Pertanian Bogor serta terimakasih kepada Direktur Jenderal Pendidikan Tinggi atas beasiswa BPPS dan kepada Pemerintah Daerah Nanggroe Aceh Darussalam (NAD) atas beasiswa NAD selama mengikuti pendidikan S2 di IPB. Ibu Dewi selaku teknisi di Laboratorium Bioteknologi Hewan dan Biomedis, PPSHB, IPB. Bapak Dr. Djufri, M.Si., Dr. M. Ali S, M.Si., Drs. Hasanuddin, M.Si., Dr. Samingan, M.Si., Drs. Supriatno, M.Si., Dr. M. Sayuthi M.Si., Wardiah M.Sc., dan seluruh staf program studi pendidikan biologi FKIP Unsyiah atas motivasinya sehingga penulis dapat menyelesaikan studi Magister di IPB.
Penghargaan yang setulusnya kepada ayahanda M.Yusuf Abdullah (Alm) dan ibunda Bariah Bugeh atas kasih sayang dan doa restunya, serta kepada yang tercinta istri Ida Rasyidah, S.Pd., ananda Jihan Jalila, adik-adikku: Murdahri dan Rosmalinda atas kasih sayang, kesabaran, pengorbanan dan dorongannya telah mengantar penulis hingga bisa menyelesaikan studi S2. Terimakasih kepada sahabatku Sesep Abdul Rosyid (Alm) yang telah berkenan menjadi teman belajar yang siap diajak bertukar pendapat hingga akhir hayatnya. Teman-teman Mikrotropisian2009, FORKUB dan IKAMAPA di Bogor, serta kepada berbagai pihak atas bantuan dan kerjasamanya selama penulis mengikuti pendidikan di Sekolah Pascasarjana IPB Bogor.
Semoga karya ilmiah ini bermanfaat. Semoga Allah memberi rahmat bagi kita semua. Amiin
RIWAYAT HIDUP
DAFTAR ISI
Halaman
DAFTAR GAMBAR ... xiii
DAFTAR TABEL .. ... xiii
PENDAHULUAN Latar Belakang ... 1
Tujuan Penelitian ... 3
Manfaat Penelitian ... 3
TINJAUAN PUSTAKA Karakteristik Bakteri Shigella ... 5
Shigellosis .. ... 6
Definisi dan Karakteristik Bakteriofage ... 7
METODE Alur Penelitian ... 13
Waktu dan Tempat Penelitian ... 14
Peremajaan Bakteri Shigella sp ... 14
Isolasi Fage . ... 14
Penentuan Kisaran Inang Fage ... 15
Stabilitas Fage terhadap Suhu dan pH ... 16
Penentuan Berat Molekul Protein Fage ... 16
Efektivitas Lisis Sel Shigella oleh Fage ... 17
HASIL DAN PEMBAHASAN Isolasi Fage . ... 19
Kisaran Inang Fage ... 21
Stabilitas Fage terhadap Suhu dan pH ... 23
Penentuan Berat Molekul Protein ... 27
Efektivitas Lisis Sel Bakteri Shigella sp. oleh Fage ... 28
KESIMPULAN DAN SARAN Kesimpulan ... 31
Saran ... ... 31
DAFTAR GAMBAR
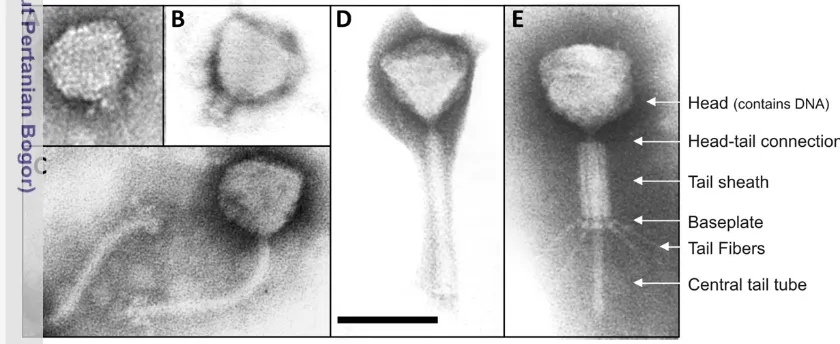
Halaman 1 Beberapa bentuk morfologi fage dari famili (A dan B) Podoviridae,
(C) Siphoviridae, (D dan E) Myoviridae ... 8 2 Diagram alir tahapan metode penelitian ... 13 3 Isolasi fage dengan menggunakan metode dua lapis agar, memperlihatkan
(A) pembentukan plak akibat lisisnya sel inang oleh fage, (B) perlakuan –
kontrol (tanpa infeksi fage) tidak memperlihatkan pembentukan plak ... 19 4 Stabilitas fage FY51-X terhadap suhu inkubasi 20, 37, 43 dan 50 (perlakuan
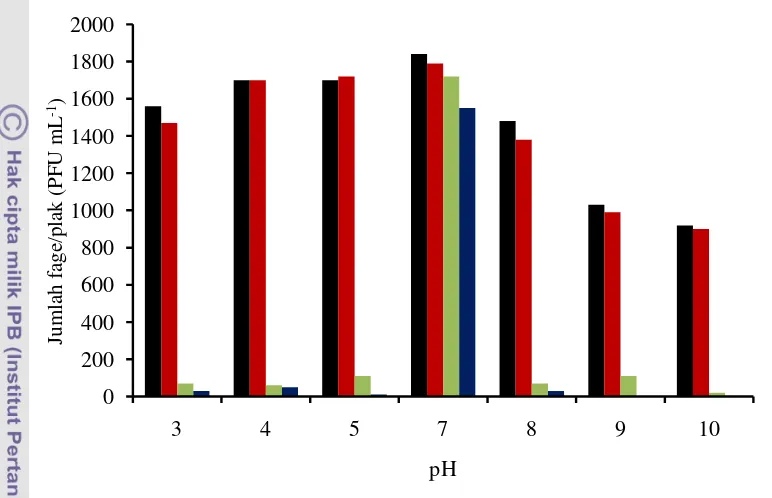
suhu 60 °C tidak menunjukkan aktivitas lisis) selama 10, 30 dan 60 menit ... 24 5 Stabilitas fage FY51-X terhadap pH 3, 4, 5, 7, 8, 9 dan 10; masing-masing
Diinkubasi selama 30, 60, 120 menit dan 24 jam ... 25 6 Profil SDS-PAGE fage FY51-X memperlihatkan 8 pita protein, dengan -
berat molekulberkisar 19,65 sampai 86,18 kDa ... 28 7 Efektivitas lisis sel Shigella oleh fage FY51-X ... 29
DAFTAR TABEL
PENDAHULUAN
Latar Belakang
Shigellosis merupakan salah satu permasalahan kesehatan bagi masyarakat di negara berkembang yang disebabkan oleh Shigella sp. Penyakit gastroenteritis ini bersifat akut dan menjadi salah satu penyebab paling umum tingginya angka kesakitan dan kematian pada anak-anak di negara berkembang. Hosseini et al (2007) melaporkan dari 165 juta kasus yang terjadi di seluruh dunia, sekitar 1,1 juta jiwa meninggal per tahun, dengan korban terbanyak berasal dari kelompok anak-anak usia di bawah 5 tahun.
Penularan penyakit ini dapat terjadi melalui makanan atau air yang terkontaminasi. Gejala awal ditandai dengan timbulnya demam, nyeri abdomen dan diare cair tanpa darah, serta secara umum setelah 3 – 5 hari baru ditemukan adanya darah di dalam feses. Lamanya gejala pada orang dewasa rata-rata adalah 7 hari, pada kasus yang lebih parah menetap selama 3 – 4 minggu (Zein et al. 2004). Kasus dehidrasi berat pada penyakit diare ini relatif sedikit ditemukan yakni sebesar 10%, sedangkan 90% lainnya tidak mengalami dehidrasi tetapi diperlukan terapi antibiotik. Antibiotik terpilih untuk Shigella adalah ampisilin, kloramphenicol dan sulfametoxazol-trimetoprim (Triatmodjo 1993).
Hasil pengujian pola resistensi Shigella terhadap beberapa jenis antibiotik secara in vitro di wilayah Jakarta dan Jawa Barat oleh Triatmodjo (1993), menunjukkan bahwa kanamisin dan kotrimoxazol masih efektif. Di Jakarta tingkat efektivitas kanamisin dan kotrimoxazol seimbang yaitu sebesar 6,2%. Di Jawa Barat kanamisin lebih efektif dari kotrimoxazol, disini tingkat resistensi Shigella terhadap kanamisin 7,1%, sedangkan terhadap kotrimoxazol 14,2%. Ampisilin, tetrasiklin dan kloramfenikol efektivitasnya di bawah kanamisin dan kotrimoxazol. Di Jakarta tingkat resistensi terhadap ketiga jenis antibiotik tersebut berkisar antara 30%-50%, sedangkan di Jawa Barat lebih tinggi lagi yaitu antara 57%-85% (Triatmodjo 1993).
Hasil survey ICDDR,B (2004) di Dhaka menujukkan bahwa secara historis Shigella rentan terhadap tetrasiklin, khloramfenikol dan obat-obatan yang umum
(TMP-SMX), 84% terhadap kloramfenikol, dan 10% terhadap ampisilin. Selanjutnya resistensi terhadap ampisilin meningkat menjadi 52% pada tahun 1985. Pada tahun 1993, semua (100%) isolat Shigella Sd1 resisten terhadap asam nalidixic, 98% terhadap TMP-SMX, dan 95% terhadap ampisilin. Khusus untuk asam nalidixic resistensi meningkat dari 5% pada 1986 menjadi 80% pada tahun 1990, dan 100% pada tahun 1993. Resistensi S. flexneri juga mengalami peningkatan, terutama terhadap asam nalidixic mengalami peningkatan dari 4% pada 1986 menjadi 66% pada tahun 2003
Peningkatan resistensi bakteri terhadap antibiotik mendorong aplikasi fage sebagai biokontrol untuk mereduksi bakteri patogen. Beberapa fage telah diaplikasikan sebagai biokontrol pencemaran makanan, diantaranya fage spesifik E. coli O157 yang diaplikasikan pada permukaan daging (Flynn et al. 2004), fage spesifik Salmonella dan Campylobacter yang diaplikasikan pada kulit ayam (Goode et al. 2003), fage spesifik Lactococcus garviae dan Pseudomonas plecoglossicida
yang diaplikasikan pada pakan mampu menurunkan tingkat kematian ikan secara signifikan (Park et al. 2000; Park & Nakai 2003). Sedangkan terhadap sanitasi air, di Bangladesh telah diaplikasikan fage spesifik E. coli patogen dalam bentuk tablet pada air minum (Ochman & Selander 1984).
.
Tujuan Penelitian
Tujuan dari penelitian ini ialah untuk menguji kisaran inang, stabilitas terhadap suhu dan pH, serta efektivitas fage litik dalam melisis biakan bakteri Shigella sp.
Manfaat Penelitian
TINJAUAN PUSTAKA
Karakteristik Bakteri Shigella
Shigella dikelompokkan ke dalam kelompok bakteri Gram negatif, berbentuk
batang, tidak berspora, respirasi aerob atau fakultatif anaerob, non motil, dan berkerabat dekat dengan E. coli. Berdasarkan antigen-O dan karakteristik biokimianya, bakteri ini diklasifikasikan ke dalam empat spesies yaitu: Shigella dysenteriae, Shigella flexneri, Shigella boydii dan Shigella sonnei (Yang et al. 2005).
Semua spesies Shigella adalah penyebab shigellosis dan menjadi permasalahan kesehatan bagi masyarakat di negara berkembang akibat kemiskinan, sanitasi buruk, rendahnya tingkat kebersihan pribadi dan permasalahan suplai air bersih (Srinivasa et al. 2009). Shigella dapat menginfeksi manusia melalui makanan atau air yang terkontaminasi. Salah satu vektor yang menyebabkan kontaminasi pada makanan adalah lalat.
Patogenesitas Shigella ditentukan oleh kemampuannya menginfeksi dan mengkolonisasi jaringan epitel usus manusia. Patogenesitas merupakan proses multi tahapan yang tergantung pada kemampuan bakteri dalam melintasi mukosa usus melalui sel M yang berasosiasi dengan jaringan gastrointestinal associated lymphoid (GALT). Bakteri menginfeksi sel epitel dan mempunyai kapasitas untuk memprogram ulang sel tersebut sehingga menghasilkan mediator pro-inflamasi, seperti interleukin 8 yang berperan memfasilitasi kuatnya inflamasi untuk invasi bakteri lebih lanjut (Torres 2004). Sebelum masuk ke sel epitel, bakteri terlebih dahulu harus menempel pada sel target dan masuk dengan perantaraan reseptor. Patogenesis Shigella dapat dilihat sebagai proses terganggunya keseimbangan homeostatik usus yang melindungi dirinya sendiri terhadap peradangan dengan kehadiran komensal flora (Sansonetti 2006).
dari pasien penderita diare (50%), dan secara berurutan diikuti oleh S.flexneri (35 %), S. boydii (5 %) dan S. dysenteriae (4 %) (Grimont et al. 2007). Di Indonesia, Agtini
et al. (2005) melaporkan bahwa S. flexneri merupakan spesies yang banyak terisolasi
dari penderita diare yaitu 73% dari keseluruhan isolat yang diisolasi. Herwana et al. (2010) menempatkan S. flexneri diurutan pertama (63,2%) sebagai spesies yang terbanyak menginfeksi penderita diare, diikuti oleh S. sonnei (22,8%). Selanjutnya, Subekti et al (2001) juga menyebutkan bahwa S. flexneri merupakan penyebab utama diare endemik di banyak negara berkembang dan umumnya terkait dengan durasi infeksi yang panjang sehinga ditemukan darah dalam tinja.
Shigellosis
Shigellosis atau bacillary dysentery adalah penyakit yang ditularkan melalui makanan atau air. Organisme Shigella menyebabkan disentri basiler dan menghasilkan respons inflamasi pada kolon melalui enterotoksin dan invasi bakteri. Secara klasik, shigellosis timbul dengan gejala awal terdiri dari demam, nyeri abdomen, dan diare cair tanpa darah, kemudian feses berdarah setelah 3-5 hari. Lamanya gejala rata-rata pada orang dewasa adalah 7 hari, pada kasus yang lebih parah menetap selama 3 – 4 minggu (Zein et al. 2004).
Milliotis & Bier (2003) menjelaskan bahwa shigellosis sering kali diawali oleh diare cair, yang merupakan gejala awal disentri yang khas dan merupakan suatu tahapan gejala yang disebabkan oleh produksi enterotoksin saat bakteri menginfeksi usus halus dan memblokir penyerapan elektrolit dan glukosa. Demam, sakit perut parah, dan kram disertai dengan tinja berdarah dan berlendir adalah gejala lanjutan setelah diare dan berkorelasi dengan peluruhan mukosa usus besar akibat penghambatan sintesis protein yang menyebabkan sel mati. Shigella menembus ke dalam sel epitel yang melapisi usus besar, berkembang biak di dalam sel, dan menyebar dari sel ke sel melalui mukosa. Sel-sel mati akan luruh dan dikeluarkan dalam tinja bersama dengan lendir dan sejumlah besar bakteri. Kehadiran leukosit didalam tinja juga merupakan penampakan dari sifat
Shigellosis merupakan penyakit gastroenteritis akut yang menjadi salah satu penyebab paling umum dari morbiditas dan kematian pada anak-anak di negara berkembang. Sekitar 70% kasus penyakit ini disebabkan oleh makanan yang
terkontaminasi (Widyastuti 2005). Shigella merupakan spesies bakteri patogen paling penting yang bertanggung jawab terhadap wabah penyakit ini. Hosseini et al (2007) melaporkan bahwa dari 165 juta kasus yang terjadi di seluruh dunia, sekitar 1,1 juta jiwa meninggal per tahun, dua per tiga korbannya adalah anak-anak usia di bawah 5 tahun. Di India, penyakit ini umumnya menyerang anak-anak 2-5 tahun dengan persentase mencapai 61,3% dari keseluruhan pasien yang dijadikan sampel (Taneja 2007). Di Iran kasus infeksi ini menyerang masyarakat secara merata dari usia di bawah 5 tahun sampai dengan 65 tahun (Najafi et al. 2008). Mayoritas kasus shigellosis yang menyerang anak-anak juga dilaporkan terjadi di California (Al-Nimri et al. 2009). Sebesar 40% isolat S. sonnei terdeteksi pada anak-anak usia di bawah 5
tahun dan 60% terdeteksi pada anak usia 5-18 tahun. Isolat S. flexneri terdeteksi lebih merata pada semua kelompok umur yaitu 20% pada anak-anak di bawah 5 tahun, 40% pada anak usia 5-18 tahun, dan 40% pada orang dewasa. Di Indonesia sendiri kasus shigellosis paling banyak diteliti di wilayah Jakarta, dampak shigellosis akut umumnya diderita oleh anak-anak berusia 1-2 tahun dengan perbandingan 32/1000 anak/tahun (Agtini et al. 2005).
Definisi dan Karakteristik Bakteriofage
Bakteriofage atau fage adalah nama yang berasal dari bahasa Yunani yaitu “bacteria” dan “fagein” yang bermakna “makan” atau “menelan”. Secara lengkap fage diartikan sebagai virus yang menyerang bakteri dengan cara menginfeksi sel bakteri, mengganggu kegiatan metabolisme dan akhirnya sel bakteri akan lisis (Sulakvelidze et al. 2001). Fage adalah virus yang menginfeksi bakteri dan dapat menghancurkan secara langsung sel bakteri
Partikel
, atau memadukan DNA-nya ke dalam kromosom bakteri (Madigan et al. 1997; Budzik 2000). DNA fage yang terintegrasi ke dalam kromosom sel inang dan tinggal di dalamnya tanpa membahayakan inang dinamakan siklus lisogeni. Disisi lain fage juga dapat melisis sel inang setelah bereproduksi dan keluar dengan sejumlah progeni melalui siklus litik (Watson et al. 1987; Budzik 2000).
kompleks dengan kepala dan ekor (Birge 2006). Umumnya fage dikelompokkan ke dalam ordo Caudovirales dengan DNA utas ganda dan 96% merupakan fage berekor. Fage Caudovirales memiliki kapsid berbentuk ikosahedral dan serabut ekor untuk berinteraksi dengan inang. Fage juga diklasifikasikan ke dalam fage berekor dan fage polyhedral, filamentous, pleomorfik (PFP). Fage berekor dengan genus terbanyak dikelopokkan ke dalam tiga famili yaitu: Siphoviridae dengan serabut ekor panjang non kontraktil; Myoviridae dengan serabut ekor panjang kontraktil; dan Podoviridae dengan serabut ekor pendek non kontraktil (Gambar 1). Fage PFP dikelompokkan ke dalam kelompok kecil yang hanya terdiri dari 10 famili. Fage polyhedral meliputi famili: Microviridae, Corticoviridae, Tectiviridae, Leviviridae, dan Cystoviridae. Fage berserabut meliputi famili: Inoviridae, Lipothrixviridae, dan Rudiviridae. Fage pleomorfik meliputi famili: Plasmoviridae dan Fuselloviridae (Ackermann 2003).
Gambar 1 Beberapa bentuk morfologi fage dari famili (A dan B) Podoviridae, (C) Siphoviridae, (D dan E) Myoviridae (Sabour & Griffiths 2010).
inang, seperti kehadiran profage di dalam sel, sistem modifikasi restriksi DNA dan berbagai gen spesifik penghambat fage (Laskin et al. 2006).
Pola resistensi bakteri terhadap antibiotik terus meningkat setiap tahun dan diperlukan metode terapi alternatif selain antibiotik yang tidak memberikan efek samping. Aplikasi fage merupakan salah satu alternatif yang dianggap tepat sebagai biokontrol pengganti antibiotik untuk mereduksi bakteri patogen. Fage spesifik bakteri dapat ditemukan di hábitat inangnya tumbuh dan berkembang dengan baik, seperti limbah, tinja, tanah atau bahkan di sumber mata air. Dibandingkan dengan antibiotik, terapi fage memiliki beberapa kelebihan (Lorch 1999). Pertama dapat ditinjau dari aspek pengaruh yang terbatas; fage akan bereplikasi selama inangnya tersedia dalam jumlah memadai untuk mendukung reproduksinya dan jumlahnya akan berkurang ketika jumlah inang menurun. Kedua, perkembangan resistensi inang
terhadap fage terbatas; bakteri inang juga akan mengalami resistensi terhadap fage sebagai implikasi dari pertahanan diri, namun fage memiliki kemampuan yang tinggi untuk bermutasi mengimbangi laju mutasi inang sehingga dapat membatasi perkembangan resistensi inang. Kelebihan lainnya adalah spesifisitas target; fage memiliki kisaran inang terbatas sehingga tidak menyebabkan gangguan terhadap keberadaan flora normal usus.
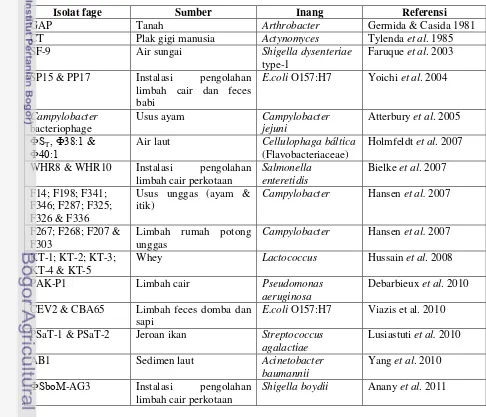
Ongunseitan et al (1992) melaporkan bahwa fage umum ditemukan di lingkungan, terutama pada sampel limbah cair. Limbah merupakan habitat bakteri fekal (coliform) dan diduga di dalam limbah mengandung banyak galur fage bakteri koliform yang beragam (Tabel 1).
Tabel 1 Beberapa laporan penemuan fage dari berbagai sumber
Isolat fage Sumber Inang Referensi
GAP Tanah Arthrobacter Germida & Casida 1981
CT Plak gigi manusia Actynomyces Tylenda et al. 1985
SF-9 Air sungai Shigella dysenteriae
type-1
Faruque et al. 2003
SP15 & PP17 Instalasi pengolahan limbah cair dan feces
Ф40:1 Cellulophaga báltica (Flavobacteriaceae)
Holmfeldt et al. 2007
WHR8 & WHR10 Instalasi pengolahan limbah cair perkotaan
Campylobacter Hansen et al. 2007
F267; F268; F207 & F303
Limbah rumah potong unggas
Campylobacter Hansen et al. 2007
KT-1; KT-2; KT-3; KT-4 & KT-5
Whey Lactococcus Hussain et al. 2008
PAK-P1 Limbah cair Pseudomonas
aeruginosa
Debarbieux et al. 2010
CEV2 & CBA65 Limbah feces domba dan sapi
E.coli O157:H7 Viazis et al. 2010
PSaT-1 & PSaT-2 Jeroan ikan Streptococcus agalactiae
Lusiastuti et al. 2010
AB1 Sedimen laut Acinetobacter
baumannii
Yang et al. 2010
ФSboM-AG3 Instalasi pengolahan limbah cair perkotaan
Beberapa fage telah diaplikasikan sebagai biokontrol pencemaran makanan, seperti fage spesifik E. coli O157 (Flynn et al. 2004), fage spesifik Salmonella dan Campylobacter (Goode et al. 2003), fage spesifik Yersinia enterocolitica (Strauch et
al. 2001a), fage spesifik Lactococcus garviae dan Pseudomonas plecoglossicida
(Park et al. 2000; Park & Nakai 2003). Sedangkan terhadap sanitasi air, di Bangladesh telah diaplikasikan fage spesifik E. coli patogen dalam bentuk tablet pada air minum (Ochman & Selander 1984). Dalam penanganan berbagai penyakit, fage juga telah banyak dipergunakan. Penggunaan fage telah terbukti dapat mencegah dan mengobati infeksi paru-paru yang diakibatkan oleh Pseudomonas aeruginosa et al. 2010). Pada dasarnya penggunaan fage untuk terapi pada manusia telah dilaporkan oleh Slopek et al. sejak tahun 1983 – 1987, fage efektif mengatasi infeksi yang disebabkan oleh beberapa bakteri patogen seperti Staphylococci, Pseudomonas, Escherichia, Klebsiella, dan Salmonella termasuk yang resisten
terhadap antibiotik (Sulakvelidze et al. 2001). Terapi menggunakan fage terhadap pasien dilakukan dengan cara per oral, olesan pada bagian yang terbuka (luka) dan sebagai obat tetes. Terapi yang dilakukan memiliki tingkat keberhasilan sekitar 75 – 100%, dengan durasi waktu terapi 1 – 16 minggu.
Fage juga telah mendapatkan izin untuk dipergunakan sebagai bahan tambahan makanan. Hal ini telah berlaku di Amerika Serikat, pada tahun 2006 FDA telah menyetujui penggunaan fage sebagai bahan tambahan makanan untuk mengontrol dan mencegah Listeria monocytogenes pada produk daging dan unggas siap saji. Otoritas keamanan pangan Eropa (EFSA) pada tahun 2009 juga merilis rekomendasi untuk mendorong penelitian mengenai pemanfaatan fage sebagai bahan tambahan makanan untuk mereduksi bakteri patogen.
METODE
Alur Penelitian
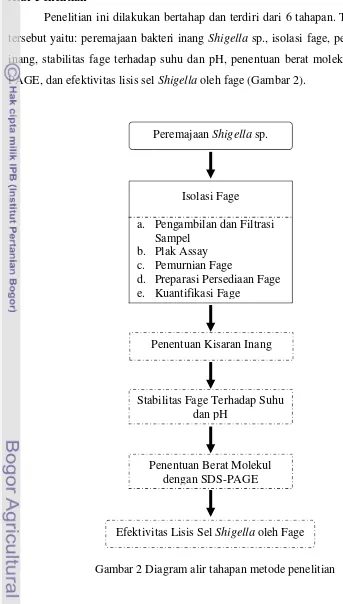
Penelitian ini dilakukan bertahap dan terdiri dari 6 tahapan. Tahapan-tahapan tersebut yaitu: peremajaan bakteri inang Shigella sp., isolasi fage, penentuan kisaran inang, stabilitas fage terhadap suhu dan pH, penentuan berat molekul dengan SDS-PAGE, dan efektivitas lisis sel Shigella oleh fage (Gambar 2).
Gambar 2 Diagram alir tahapan metode penelitian Peremajaan Shigella sp.
Isolasi Fage
a. Pengambilan dan Filtrasi Sampel
b. Plak Assay c. Pemurnian Fage
d. Preparasi Persediaan Fage e. Kuantifikasi Fage
Penentuan Kisaran Inang
Stabilitas Fage Terhadap Suhu dan pH
Penentuan Berat Molekul dengan SDS-PAGE
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan Agustus 2010 sampai dengan Februari 2012. Pengambilan sampel limbah cair rumah tangga dilakukan di Kelurahan Sindang Barang, Cibeureum dan Babakan Darmaga Kabupaten Bogor. Tahapan penelitian lainnya di lakukan di Laboratorium Bioteknologi Hewan dan Biomedis, Pusat Penelitian Sumber Daya Hayati dan Bioteknologi (PPSHB) IPB.
Peremajaan Bakteri Shigella sp.
Bakteri yang digunakan dalam penelitian ini adalah Shigella 51-X, Salmonella p15, p19, p38, p84, dan E. coli non patogen merupakan koleksi Dr. dr. Sri Budiarti. Peremajaan dilakukan secara berkala pada media SS dengan durasi waktu satu atau dua bulan. Sebanyak satu lup bakteri Shigella 51-X digoreskan pada media agar miring SS secara aseptik, kemudian diinkubasi pada suhu 37 °C selama 24 jam, disimpan pada suhu ruang dan diremajakan setiap dua bulan.
Isolasi Fage
Pengambilan dan Filtrasi Sampel. Sampel untuk isolasi fage dikumpulkan dari limbah cair rumah tangga Kelurahan Sindang Barang, Cibeureum dan Babakan Darmaga Kabupaten Bogor yang disentrifugasi pada kecepatan 1052 x g selama 25 menit dan diulang dua kali. Shigella 51-X digunakan sebagai detektor keberadaan fage spesifik untuk Shigella. Sebanyak 5 mL dari sel pada fase logaritmik dari bakteri yang dibiakkan di dalam Nutrient Broth (NB), 10 mL sampel air dan 50 mL NB dicampurkan. Campuran tersebut diinkubasi di dalam inkubator yang diatur pada suhu 37 °C selama 48 jam. Setelah masa inkubasi berakhir, suspensi dijernihkan dengan sentrifugasi 1052 x g selama 25 menit dan dua ulangan. Selanjutnya disaring menggunakan membran selulosa dengan ukuran pori 0,22 µm. Suspensi yang diperkirakan mengandung fage disimpan pada suhu 4 °C.
Asai Fage. Uji plak dua lapis agar (Adams 1959) dilaksanakan sebagai berikut. Sebanyak 100 µL suspensi fage ditambahkan ke dalam 100 µL kultur Shigella 51-X yang telah diinkubasi satu malam pada NB dan dicampur dengan 7 mL
dituang ke atas lempengan Nutrient Agar (NA) dan kemudian diinkubasi satu malam pada suhu 37
Pemurnian Fage. Pemurnian fage dilakukan dengan mengadopsi metode Goodridge et al (2003). Plak tunggal dengan ciri-ciri tersendiri yang berasal dari plak assay dipindahkan dengan menggunakan pipet Pasteur ke dalam tabung, kemudian dicampurkan dengan 2–3 mL pelarut Ringers konsentrasi 25%. Suspensi fage dihomogenkan dan dibiarkan selama 5–10 menit pada suhu ruang. Suspensi tersebut kemudian disentrifugasi dengan kecepatan 1052 x g, suhu 4 °C selama 25 menit dan diulang dua kali. Supernatan difiltrasi menggunakan dengan filter berpori 0,22 µm, untuk selanjutnya disimpan sebagai stok fage.
°C dan diamati pembentukan plak.
Preparasi Persediaan Fage. Sebanyak 10 µL kultur Shigella 51-X (108 CFU mL-1) umur satu malam dan 100 µL fage (108 PFU mL-1
Kuantifikasi Fage. Kuantifikasi fage diukur dengan cara menghitung jumlah plak yang terbentuk (PFU mL
) dicampur dengan 50 mL NB dan diinkubasi di dalam inkubator pengocok yang diatur pada kecepatan 120 rpm, suhu 37 °C selama 9 jam. Suspensi diinkubasi dengan tambahan waktu 10 menit dan dikocok pada suhu 37 °C. Suspensi kemudian disentrifugasi pada 1052 x g selama 25 menit dan diulang dua kali. Supernatannya disaring dengan saringan berpori 0,22 µm. Suspensi fage disimpan pada suhu 4 °C (Goodrigde et al. 2003).
-1
), penentuannya dilakukan berdasarkan metode Foschino et al. (1995). Stok fage diencerkan sampai dengan 1010, kemudian dari masing-masing pengenceran tersebut diambil 100 µL ditambahkan dengan 100 µL kultur bakteri Shigella 51-X yang telah diinkubasi selama 9 jam pada media NB. Suspensi diinkubasi selama 15 menit pada suhu 37 °C. Sebanyak 7 mL soft agar bersuhu 42 °C dicampurkan, selanjutnya dituang ke media NA, diinkubasi pada 37 °C selama 24 jam, diamati pembentukan plak dan dihitung jumlahnya.
Penentuan Kisaran Inang Fage
Sebanyak 7 mL media untuk lapisan atas dipanaskan selama 10 menit agar mencair dan selanjutnya didinginkan hingga mencapai suhu 47 °C. Sebanyak 100 µL suspensi fage (108 PFU mL-1) ditambahkan ke dalam 100 µL bakteri yang berumur satu malam dan diinkubasi 30 menit, selanjutnya ditambahkan 7 mL agar lembut dan diaduk dengan vortex mixer dan dituang ke cawan yang berisikan NA. Media lapisan atas dibiarkan mengeras pada suhu kamar. Cawan tersebut kemudian diinkubasi pada suhu 37 °C selama satu malam dan respon positif ditunjukkan dengan terbentuknya plak pada media agar.
Stabilitas Fage terhadap Suhu dan pH
Teknik dua lapis plak (double layer plaque technique) digunakan untuk mempelajari kestabilan fage spesifik Shigella (Rode et al. 2011). Pengukuran kestabilan fage terhadap suhu dan pH menggunakan filtrat fage (108 PFU mL-1) yang dilarutkan dalam NB dengan perbandingan 1:10. Stabilitas fage terhadap suhu dilakukan dengan menggunakan suhu yang divariasikan yaitu 20, 37, 43, 50, dan 60 °C. Masing-masing diinkubasi selama 10, 30 dan 60 menit di dalam NB dengan pH 7,0. Stabilitas fage terhadap pH dilakukan dengan menginkubasi suspensi fage di dalam NB dengan kisaran pH 3, 4, 5, 7, 8, 9, dan 10. Masing-masing diinkubasi pada suhu 37 °C selama 10, 30, dan 120 menit, serta 24 jam. Teknik dua lapis plak dilakukan untuk menentukan kestabilan fage dan dihitung plak forming unit.
Penentuan Berat Molekul Protein Fage
Efektivitas Lisis Sel Shigella oleh Fage
HASIL DAN PEMBAHASAN
Isolasi Fage
Tiga wilayah di Kabupaten Bogor menjadi lokasi pengambilan sampel limbah cair rumah tangga yaitu: Kelurahan Sindang Barang, Cibeureum dan Babakan Darmaga.
Satu fage spesifik Shigella sp. berhasil diisolasi hanya dari sampel limbah cair rumah tangga Babakan Darmaga dengan inang Shigella 51-X. Hal ini menandakan bahwa di dalam cairan limbah mengandung Shigella 51-X yang merupakan inang bagi fage. Keberhasilan isolasi diperlihatkan dengan terbentuknya plak. Plak mulai dapat teramati setelah masa inkubasi selama 12,5 jam, namun pengamatan setelah masa inkubasi 48 jam pada suhu 37 °C memperlihatkan dampak lisis (plak) lebih jelas (Gambar 3). Morfologi plak memiliki batas yang jelas, tidak disertai pembentukan zona lisis sekunder berupa bayangan. Sel inang mengalami lisis diakhir siklus replikasi fage ketika virion harus keluar dari sel inang untuk menginfeksi sel inang baru (Catalao et al. 2011). Fage yang terisolasi seragam, berukuran kecil dengan bentuk bulat dan rata-rata berdiameter 1,22 mm. Ukuran tersebut tidak jauh berbeda dengan delapan fage spesifik Pseudomonas plecoglossisida yang merupakan patogen terhadap ikan hasil isolasi Park et al (2000)
dengan rata-rata diameter plak 1,4 mm. Fage SF-9 spesifik Shigella dysentriae type 1 juga menghasilkan plak berukuran tidak jauh berbeda, yaitu dengan diameter rata-rata 1 mm (Faruque et al. 2003).
A B
Pertumbuhan inang sangat mempengaruhi pembentukan plak, apabila pertumbuhan inang tidak merata akan mempengaruhi kemampuan infeksi fage dari satu sel ke sel lainnya. Pembentukan plak tidak dapat berlangsung jika hanya beberapa sel terdekat saja dapat diinfeksi. Penggunaan media pendukung pertumbuhan bakteri yang lambat dapat menyebabkan penurunan ukuran ledakan sel yang terinfeksi, sehingga plak yang terbentuk juga akan berukuran kecil (Los et al. 2008)
Pengukuran konsentrasi fage di dalam suatu sampel dilakukan melalui prosedur plak assay. Terbentuknya sejumlah plak mencerminkan jumlah fage yang menginfeksi dan melisis sel inang. Perkiraan jumlah fage FY51-X yang menginfeksi dan melisis sel inang adalah 1,84 x 10
. Hal ini berkaitan dengan kemampuan fage dalam bereplikasi, fage akan bereplikasi dengan baik pada saat sel inang berada dalam kondisi pertumbuhan yang optimal yaitu pada fase eksponensial. Kondisi pertumbuhan optimal akan dicapai oleh inang jika nutrisi yang dibutuhkan tersedia dalam jumlah cukup.
8
PFU mL-1. Hasil tersebut menunjukkan kisaran normal yang dibutuhkan untuk melakukan plak assay bagi jenis fage litik dengan menggunakan metode dua lapis agar. Perkiraan jumlah fage yang menginfeksi dan melisis sel bakteri sebelumnya juga telah dilaporkan oleh Clokie dan Kropinski (2009), yaitu 106 – 1011 PFU mL-1 untuk metode dua lapis agar; 108 – 1010 PFU mL-1 untuk pencawanan langsung; dan 106 – 1011 PFU mL-1
karena fage dianggap sebagai agen alternatif yang tepat untuk mengendalikan bakteri (Yang et al. 2010).
Kisaran Inang Fage
Kisaran inang berkaitan dengan spesifisitas inang yang ditandai oleh pelekatan dan penetrasi fage pada protein luar inang yang berperan sebagai reseptor. Setiap fage memiliki kisaran inang berbeda-beda. Fage yang terisolasi dalam penelitian ini memiliki kisaran inang sempit, hanya menginfeksi Shigella 51-X (Tabel 2). Hal ini menandakan bahwa fage FY51-X memiliki protein sensor yang hanya dapat mengenali protein reseptor pada Shigella 51-X saja, dengan demikian hanya inang ini saja yang bersifat permisif terhadap fage FY51-X dan dapat dipastikan bahwa diantara semua bakteri uji tidak ada yang memiliki homologi reseptor dengan Shigella 51-X. Kaitan ini dapat dijelaskan karena kisaran inang dipengaruhi oleh spesifisitas dan homologi reseptor yang dimiliki masing-masing inang. Reseptor yang dapat dikenali oleh fage terdapat pada komponen penyusun dinding sel inang, dapat berupa protein; karbohidrat; glikoprotein; lipid; dan lipoprotein. Fage menginfeksi inang menggunakan protein spesifik yang akan ditempelkan pada reseptor di membran luar inangnya (Flores et al. 2011) dengan komponen yang berbeda-beda sebagaimana telah disebutkan sebelumnya. Fage memiliki satu atau lebih protein permukaan yang dapat berinteraksi dengan komponen reseptor, sehingga fage memiliki kemungkinan untuk menempel pada beberapa reseptor spesifik pada dinding sel inang.
Tabel 2 Kisaran inang fage FY51-X terhadap beberapa galur bakteri
Galur inang Reaksi Galur inang Reaksi
Shigella 68
Fage hanya dapat bereproduksi di dalam sel inang yang sesuai. Hal ini dapat dikaitkan dengan sifat umum virus yang merupakan parasit intraseluler obligat. Kondisi seperti ini diperkirakan karena fage tidak memiliki perangkat untuk mesintesis protein untuk dirinya sendiri. Inang fage ditentukan oleh sistem pengenalan fage itu sendiri, sehingga fage hanya dapat meginfeksi satu atau beberapa inang tertentu saja. Identifikasi sel inang fage menggunakan kesesuaian antara protein pada bagian luar fage sebagai sensor dengan molekul-molekul reseptor spesifik pada permukaan sel inang. Reseptor tersebut merupakan molekul yang berperan untuk menjalankan fungsi normal tertentu bagi inang. Reseptor untuk fage spesifik bakteri Shigella diduga merupakan protein yang berperan dalam transport besi untuk keperluan metabolisme sel Shigella (Payne 2006), sama halnya dengan reseptor untuk fage T1 dan T5 yang juga merupakan protein transport besi (Langenscheid et al. 2004). Berbeda dengan fage spesifik Shigella serta fage T1 dan T5, reseptor untuk fage lambda adalah protein yang berperan dalam transport maltose (Moldovan 2005). Tanpa reseptor spesifik fage tidak dapat mengadsorbsi dan menginfeksi inang. Perubahan situs reseptor karena mutasi akan menghasilkan inang resisten terhadap infeksi virus, akan tetapi fage juga dapat dengan cepat bermutasi mengimbangi mutasi inang sehingga tetap dapat melekat pada inang yang resisten.
Fage merupakan entitas biologi yang memiliki kemampuan untuk bereplikasi dan tumbuh, serta menginfeksi bakteri inang dengan kisaran relatif sempit. Kemampuan ini tidak dimiliki oleh antibiotik. Potensi yang dimiliki tersebut menjadi keunggulan dan sekaligus kekurangan bagi aplikasi fage dibandingkan antibiotik. Kisaran inang sempit memungkinkan bagi fage hanya menginfeksi dan mengeliminasi bakteri tertentu tanpa harus mengganggu flora normal usus.
bakteri inang. Pada umumnya fage memang memilki kisaran inang sempit, namun sebagaimana dijelaskan bahwa fage memiliki kemampuan untuk berevolusi maka ditemukan beberapa fage seperti fage 7888 spesifik S. sonnei (Strauch et al. 2001b) yang memiliki kisaran inang luas terhadap isolat Shigella lainnya, termasuk S. dysenteriae type 1 dan juga isolat E.coli dengan homologi reseptor inang berupa
lipopolisakarida kasar pada dinding selnya. Kemudian fage lainnya yang memiliki kisaran inang luas yaitu AR1 dan LG1 (Goodridge et al. 2003), yang mampu melisis E. coli dan beberapa enterobakteri; seperti Proteus mirabilis, S. dysenteriae, dan dua
isolat Salmonella.
Stabilitas Fage terhadap Suhu dan pH
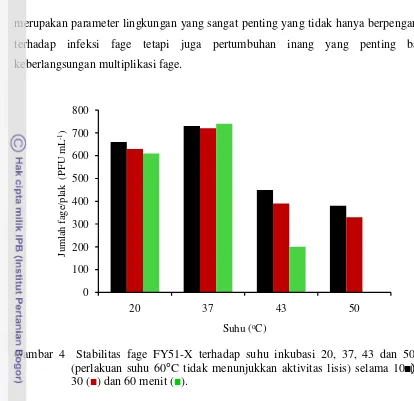
Fage FY51-X relatif stabil pada suhu 20 dan 37 °C pada semua durasi waktu uji. Toleransi fage terhadap suhu berkorelasi dengan suhu optimum pertumbuhan inang, yaitu 37 °C untuk Shigella sp. (Aberoumand 2010). Namun, peningkatan suhu menyebabkan fage mengalami penurunan aktivitas dan bahkan sama sekali tidak memperlihatkan aktivitas yang ditandai oleh tidak adanya plak pada suhu 60 °C (Gambar 4). Kestabilan dapat dilihat dari jumlah hitungan fage relatif. Hitungan fage relatif mengalami reduksi rata-rata sebesar 13,2%; 52,5%; dan 67% masing-masing untuk suhu 20, 43 dan 50 °C. Serta benar-benar mencapai titik terendah pada suhu 60
°C. Selanjutnya, pengujian stabilitas terhadap pH memperlihatkan bahwa fage ini stabil pada pH netral (7) dan lebih toleran terhadap kondisi asam dibandingkan kondisi basa (Gambar 5), dengan hitungan fage relatif rata-rata mengalami reduksi antara 48 – 54% untuk pH 3 – 5; dan di atas 50% untuk pH 8 – 10. Meskipun kisaran pH pertumbuhan fage umumnya luas, berkisar antara 5 – 9; dengan pH optimum 5 – 6, namun rata-rata fage stabil pada pH 7 (Jończyk et al. 2011).
merupakan parameter lingkungan yang sangat penting yang tidak hanya berpengaruh terhadap infeksi fage tetapi juga pertumbuhan inang yang penting bagi keberlangsungan multiplikasi fage.
Gambar 4 Stabilitas fage FY51-X terhadap suhu inkubasi 20, 37, 43 dan 50°C (perlakuan suhu 60°C tidak menunjukkan aktivitas lisis) selama 10 (■), 30 (■) dan 60 menit (■).
Faktor lingkungan, yaitu suhu dan pH merupakan parameter fisik yang memiliki peranan penting dalam kompleksnya mekanisme fisiologi makhluk hidup. Suhu dan pH yang terlalu rendah atau tinggi tidak memungkinkan mikroorganisme untuk tumbuh optimal. Variasi kebutuhan akan kedua faktor lingkungan ini merupakan refleksi kisaran rata-rata habitat dimana mikroorganisme tersebut berada. Peningkatan atau penurunan suhu dan pH berpengaruh terhadap laju reaksi kimia dan ezimatik mikroorganisme, membawa dampak pada laju pertumbuhan, serta dapat menimbulkan perubahan fisiologi protein dan mutasi.
Fage memiliki kemampuan yang berbeda-beda antara satu dan lainnya dalam hal respon terhadap variasi kondisi fisik lingkungan. Chandra et al (2011) melaporkan bahwa fage memiliki kemampuan adaptasi yang cukup baik dan cukup luas terhadap variasi pH yang berkisar antara 4 – 10. Namun, hasil bertolak belakang diperlihatkan pada kestabilan terhadap suhu, fage dapat bertahan pada suhu di bawah
50 °C dan terus menurun seiring dengan peningkatan suhu hingga tidak ditemukan sama sekali adanya aktivitas pada suhu 60 °C.
Gambar 5 Stabilitas fage FY51-X terhadap pH 3, 4, 5, 7, 8, 9 dan 10; masing-masing diinkubasi selama 30(■), 60 (■), 120 (■) menit dan 24 jam (■).
Suhu memegang peranan penting dalam tahapan perkembangbiakan fage, seperti penempelan; penetrasi ke sel inang; multiplikasi dan periode laten. Pada suhu rendah pergerakan fage menjadi lebih lambat untuk mencapai inang, sehingga berpengaruh terhadap penempelan fage ke permukaan sel inang, dengan demikian hanya sedikit fage yang mampu melakukan penetrasi ke sel inang. Hal ini terjadi karena semakin lama fage terpapar dengan suhu yang tidak sesuai maka akan berimplikasi pada semakin banyaknya fage yang mengalami reduksi. Proses reduksi terus berlangsung seiring pertambahan waktu, baik pada suhu di bawah suhu optimum (37 °C) maupun di atasnya, hingga mencapai titik kritis pada suhu terlalu tinggi. Demikian juga dengan pH, di dalam masing-masing unit pH uji dengan semakin lamanya durasi waktu uji akan memperlihatkan reduksi jumlah fage. Sehingga pada akhirnya dapat diprediksi hanya sedikit fage yang akan bermultiplikasi. Hal ini juga dilaporkan oleh Tey et al (2009), dimana dalam percobaan yang dilakukan memperlihatkan bahwa titer fage mencapai jumlah
tertinggi pada pH 7, diikuti pH 6 dan 8. Kemudian, titer fage juga mencapai jumlah tertinggi pada suhu 37 °C, diikuti suhu 27 dan 42 °C.
Kondisi jumlah fage yang mencapai kestabilan pada pH 7 dengan suhu inkubasi 37 °C juga dilaporkan oleh (Verthe et al. 2004). Jumlah fage tersebut kemudian secara bertahap menurun ketika pH meningkat di atas 7, yaitu pada kondisi lingkungan dalam keadaan basa. Ketidakstabilan fage terhadap suhu dan pH diperlihatkan dengan penurunan jumlah plak atau sama sekali tidak terbentuk plak. Suhu dan pH mempengaruhi stabilitas lipid membran, laju sintesis DNA, dan laju sintesis protein (Pope et al. 2004). Sehingga berpengaruh pada struktur dan kesesuaian protein, serta interaksi antara protein dengan protein yang berfungsi sebagai sensor pada fage (Tan et al. 2004). Terganggunya sensor protein akibat ketidakstabilan atau terdenaturasinya protein struktural fage oleh suhu dan pH yang tidak sesuai menyebabkan fage kehilangan kemampuan untuk menginfeksi inang, dan akhirnya gagal memperbanyak diri karena DNA fage tidak terinjeksi ke sel inang.
Di sisi lain, pada suhu tinggi akan memperpanjang periode laten (Burns & Slater 1982), sehingga akan dibutuhkan periode yang panjang dari tahapan infeksi ke tahapan
Selain berpengaruh terhadap kemampuan fage menempel pada permukaan inang, pH lingkungan juga memberikan dampak terhadap aktivitas enzimatik inang dan berefek terhadap reproduksi fage dan laju pertumbuhan inang (Tey et al. 2009). Dampak pH terhadap perkembangan fage dijelaskan oleh Jończyk et al (2011). Pada pH rendah fage akan mengalami koagulasi dan pengendapan. Koagulasi akan terjadi pada pH 2, sedangkan pengendapan akan terjadi pada pH 3 dan 4. Namun, jika fage yang mengalami pengendapan terdapat dalam jumlah banyak metode pengocokan
dapat dipergunakan untuk menghomogenkannya kembali di dalam pelarut, tetapi daya infeksi fage setelah dihomogenkan tidak dijelaskan.
Faktor lingkungan lain yang berpengaruh terhadap aktivitas fage adalah musim. Huynh dan Kory (1993) melaporkan bahwa fage spesifik Pseudomonas lebih sedikit ditemukan pada musim panas dibandingkan fage Enterococcus dan Colifage, konidisi ini dapat disebabkan oleh kerentanan fage terhadap suhu, variasi jumlah inang dan curah hujan. Sedangkan Chibani-Chennoufi et al (2004) melaporkan jumlah titer fage di Norwegia lebih banyak pada musim dingin dibandingkan musim panas. Musim dingin diperkirakan merupakan kondisi lingkungan optimal bagi bakteri inang untuk tumbuh dan berkorelasi terhadap peningkatan jumlah fage.
Penentuan Berat Molekul Protein
Berat molekul protein fage FY51-X dianalisis dengan sodium dodecyl sulfate-polyacrylamide gel electrophoresis. Hasil analisis memperlihatkan sejumlah protein
struktural dari fage ini, sekitar 8 pita protein diperlihatkan pada gel pemisah (Gambar 6), dengan berat molekul masing-masing 86,18; 58,80; 54,47; 44,42; 38,12; 31,09; 22,89; dan 19,65 kDa. Perkiraan ukuran berat molekul protein tersebut berada dalam kisaran berat molekul protein fage SboM-AG3 spesifik Shigella boydii (Anany et al. 2011), yang memiliki 15 pita protein dengan berat molekul sekitar 12,7 – 126,3 kDa. Molekul protein dengan berat tertentu menunjukkan bahwa protein tersebut merupakan penyusun bagian tertentu dari fage seperti kepala, ekor dan serbut ekor.
1 2
Gambar 6 Profil SDS-PAGE fage FY51-X memperlihatkan 8 pita protein, dengan berat molekul berkisar 19,65 sampai 86,18 kDa, (1 = marker, 2 = fage FY51-X)
Protein struktural fage dapat dideterminasi lebih lanjut untuk mendapatkan derajat homologi antar protein struktural penyusun berbagai fage. Hasil determinasi tersebut dapat digunakan untuk melihat hubungan kekerabatan berdasarkan residu asam amino pada sekuen N-terminalnya. Salah satu homologi diperlihatkan antara fage spesifik Pseudomonas fluorescens (Sillankorva et al. 2008) dengan fage BA3 (serabut ekor), ϕYeO3-12 dan T3 (mayor kapsid), homologinya mencapai 80%. Masing-masing bagian dari fage disusun oleh beberapa protein struktural dengan berat molekul berbeda-beda seperti dilaporkan oleh Lu et al (2005). Hasil analisis secara detil protein struktural fage JL-1 memperlihatkan bahwa protein penyusun kepala terdiri dari tiga molekul protein dengan berat masing-masing 34, 45 dan 61 kDa. Protein penyusun ekornya masing-masing dengan berat molekul 28, 50 dan 76 kDa.
Efektivitas Lisis Sel Bakteri Shigella sp. oleh Fage
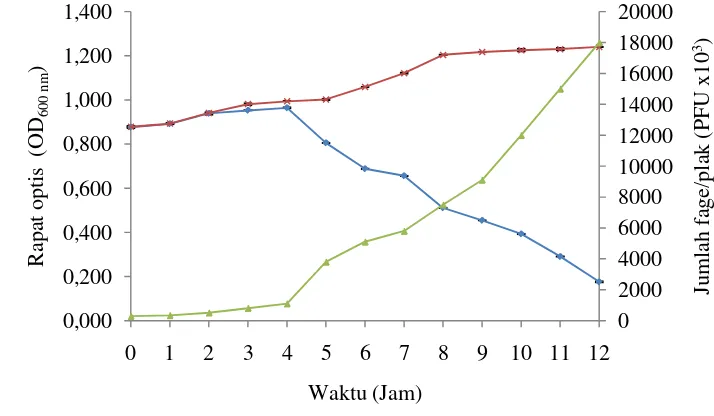
Hasil pengujian efektivitas lisis menunjukkan bakteri yang diinokulasi tanpa fage (kontrol) mulai memperlihatkan peningkatan jumlah sel berdasarkan angka nilai kerapatan optik setelah 1 jam masa inkubasi dan terus meningkat sampai 12 jam. Kultur bakteri yang ditambahkan dengan fage juga menunjukkan pertumbuhan setelah 1 jam masa inkubasi, namun setelah 2 jam pertumbuhannya mulai mengalami
tekanan oleh peningkatan jumlah fage (Gambar 7). Setelah masa inkubasi mencapai 4 jam, jumlah sel bakteri menurun drastis hingga masa inkubasi 12 jam. Penelitian Park et al (2000) memperlihatkan bahwa pertumbuhan bakteri tanpa penambahan fage
mulai mengalami peningkatan jumlah sel setelah 6 jam masa inkubasi. Perlakuan dengan penambahan fage memperlihatkan pertumbuhan bakteri tertekan selama 12 jam setelah 2 jam masa inkubasi dan secara cepat meningkat kembali dalam durasi waktu 24 – 48 jam setelah masa inkubasi. Hasil pada Gambar 4 juga menunjukkan bahwa fage FY51-X efektif melisis bakteri inang Shigella sp. pada 4 jam setelah masa inkubasi. Dengan demikian waktu optimal lisis fage ini adalah 4 jam setelah
inkubasi, relatif lambat jika dibandingkan dengan fage λ (Shao & Wang, 2008)
dengan waktu lisis optimal 29,3 – 68 menit. Waktu lisis dipengaruhi oleh laju adsorbsi. Fage dengan laju adsorbsi tinggi akan memiliki rata-rata waktu lisis pendek (cepat), demikian juga sebaliknya.
Gambar 7 Efektivitas lisis sel bakteri Shigella oleh fage FY51-X; (ж) kontrol Shigella tanpa fage, (♦) Shigella yang diinfeksi fage, (▲) jumlah fage (PFUx103).
Siklus hidup fage sama dengan siklus hidup virus pada umumnya yang terdiri dari tiga tahapan, yaitu fage mencari inang untuk memulai infeksi, memproduksi progeni di dalam sel inang, dan keluar dari sel inang untuk melanjutkan siklus hidup baru. Secara khusus untuk fage litik, tahapan tersebut dapat diringkas menjadi adsorbsi, replikasi, maturasi dan lisis. Infeksi dimulai pertama sekali dengan
menempel pada permukaan inang yang rentan. Adsorbsi dapat berlangsung jika ada kesesuaian protein pada serat ekor fage dengan reseptor pada permukaan sel inang. Kemampuan adsorbsi juga ditentukan oleh kerapatan sel inang. Kemampuan adsorbsi akan menentukan efektivitas lisis.
KESIMPULAN DAN SARAN
Kesimpulan
Fage litik spesifik Shigella sp. hasil isolasi dari sampel limbah cair rumah tangga menghasilkan plak berbentuk bulat dengan diameter 1,22 mm. Hitungan fage relatif yang menginfeksi dan melisis sel inang ialah 1,84 x 108 PFU mL-1, kisaran inang sempit, toleran pada suhu 20 dan 37 oC, sensitif terhadap kondisi suhu yang meningkat sehingga sama sekali kehilangan aktivitas pada suhu 60 oC. Fage juga kehilangan aktivitas pada kondisi asam dan basa, namun lebih sensitif terhadap kondisi basa. Berat molekul protein berkisar 19,65 - 86,18 kDa, efektif melisis bakteri inang 4 jam setelah masa inkubasi,dan mampu menekan pertumbuhan bakteri hingga masa inkubasi 12 jam.
Saran
DAFTAR PUSTAKA
Aberoumand A. 2010. Estimation of microbiological variations in minced lean fish products. World J Fish Marine Sci. 2: 204 – 207.
Ackermann HW. 2003. Bacteriophage observations and evolution. Res Microbiol 154: 245 – 251.
Adams MH. 1959. Bacteriophages. New York: Interscience.
Agtini et al. 2005. The burden of diarrhoea, shigellosis, and cholera in North Jakarta, Indonesia: findings from 24 months surveillance. BMC Infect Dis 5: 89 – 99. Al-Nimri S, Miller WA, Byrne BA, Guibert G, Chen L. 2009. A unified approach to
molecular epidemiology investigations: tools and patterns in California as a case study for endemic shigellosis. BMC Infect Dis 9: 184 – 194.
Anany H et al. 2011. A Shigella boydii bacteriophage which resembles Salmonella phage ViI. Virol J 8:242–252.
Atterbury RJ et al. 2005. Correlation of Campylobacter bacteriophage with reduced presence of hosts in broiler chicken ceca. Appl Environ Microbiol 71:4885– 4887.
Atterbury RJ et al. 2007. Bacteriophage therapy to reduce Salmonella colonization of broiler chickens. Appl Environ Microbiol 73:4543–4549.
Barrow P, Lovell M, Berchieri A Jr. 1998. Use of lytic bacteriophage for control of experimental Escherichia coli, Septicemia and Meningitis in chickens and calves. Clin Diagn Lab Immunol 5:294–298.
Bielke L, Higgins S, Donoghue A, Donoghue D, Hargis BM. 2007. Salmonella host range of bacteriophages that infect multiple genera. Poult Sci 86:2536 – 2540. Birge EA. 2006. Bacterial and Bacteriophage Genetics. New York: Springer.
Budzik JM. 2000. Phage isolation and investigation. Fall J 3: 37 – 43.
Burns RG, Slater H. 1982. Experimental Microbial Ecology. Oxford: Blackwell Scientific Publications.
Chandra M, Thakur S, Narang D, Saxena HM. 2011. Isolation of a bacteriophage against Salmonella Dublin and determination of its physical resistance under varied in vitro conditions. Afr J Microbiol Res 5: 2044 – 2047.
Chibani-Chennoufi S, Bruttin A, Dillmann M, Brussow H. 2004. Phage-host interaction: an ecological perspective. J Bacteriol 186: 3677 – 3686.
Clokie MRJ, Kropinski AM. 2009. Bacteriophages Methods and Protocols, volume 1: Isolation, Characterization, and Interactions. New York: Humana Press.
et al. 2010. Bacteriophages can treat and prevent Pseudomonas aeruginosa lung infections
[EFSA] European Food Safety Authority. 2009. Scientific opinion of the panel on biological hazards on a request from European Commission on the use and mode of action of bacteriophages in food production. EFSA J 1076: 1 – 26. Faruque SM et al. 2003. Shigella dysenteriae type 1-specific bacteriophage from
environmental waters in Bangladesh. Appl Environ Microbiol 69:7028-7031. [FDA] Food and Drugs Administration. 2006. Food additives permitted for direct
addition to food for human consumption; bacteriophage preparation. Fed Reg 71: 47729–47732.
Flores CO, Meyer JR, Valverde S, Farr L, Weitz JS. 2011. Statistical structure of host-phage interaction. PNAS 108: 288–297.
Flynn GO, Ross RP, Fitzgerald GF, Coffey A. 2004. Evaluation of a cocktail of three bacteriofages for biocontrol of Escherichia coli O157:H7. Appl Environ Microbiol 70: 3417-3424.
Forde SE et al. 2008. Understanding the limits to generalizability of experimental
evolutionary models. Nature 455:220–223.
Foschino R, Perrone F, Galli A. 1995. Characterization of two virulent Lactobacillus fermentum bacteriophages isolated from sour dough. J Appl Microbiol 79: 677 – 683.
Germida JJ, Casida LE. 1981. Isolation of Arthrobacter bacteriophage from soil. Appl Environ Microbiol 41:1389–1393.
Goode G, Allen VM, Barrow PA. 2003. Reduction of experimental Salmonella and Campylobacter contamination of chicken skin by application of lytic bacteriophages. Appl Environ Microbiol 69:5032–5036.
Grimont et al. 2007. Identification of a group of Shigella-like isolates as Shigella boydii 20. J Med Microbiol 56:749–754.
Hansen VM, Rosenquist H, Baggesen DL, Brown S, Christensen BB. 2007. Characterization of Campylobacter phages including analysis of host range by selected Campylobacter Penner serotypes. BMC Microbiol 7: 90–98.
Herwana et al. 2010. Shigella-associated diarrhea in children in South Jakarta,
Indonesia. Southeast Asian J Trop Med Public Health 41: 418 – 425.
Holmfeldt K, Middelboe M, Nybroe O, Riemann L. 2007. Large variabilities in host strain susceptibility and phage host range govern interactions between lytic phages and their Flavobacterium hosts. Appl Environ Microbiol 73:6730 – 6739.
Hosseini MJ, Ranjbar R, Ghasemi H, Jalalian HR. 2007. The prevalence and antibiotic resistance of Shigella sp. recovered from patients admitted to Bouali Hospital, Tehran, Iran during 1999-2001. Pak J Biol Sci 10: 2778 – 2780. Hussain K, Masud T, Maqsud S, Mahmood T. 2008. Characterization of Lactococcus
phages from Dahi Whey. Pak J Nut 7: 689 – 694.
Huynh TD, Kory MM. 1993. The seasonal distribution of some bacteriophages in the Akron sewage treatment plant. Ohio J Sci 93: 48 – 50.
[ICDDR,B]
2004.Increasing antibiotic resistance of Shigella species. Health Sci Bull 2: 12 – 14.
Jończyk E, Kłak M, Międzybrodzki R. Górski A. 2011. The influence of external
factors on bacteriophages—review. Folia Microbiol 56: 191–200.
Kasman LM et al. 2002. Overcoming the phage replication threshold: a mathematical model with implications for phage therapy. J Virol 76:5557–5564.
Langenscheid J, Killmann H, Braun V. 2004. A FhuA mutant of Escherichia coli is infected by phage T1-independent of TonB. FEMS Microbiol Let 234:133– 137.
Laskin AI, Sariaslani S, Gadd GM. 2006. Advances in Applied Microbiology, Volume 59. San Diego: Academic Press.
Lorch A. 1999. Bacteriophages: An alternative to antibiotics?. Biotech Develop Mon 39: 14 – 17.
Lu Z et al. 2005. Sequence analysis of the Lactobacillus plantarum bacteriophage ϕJL-1. Gene 348: 45–54.
Lusiastuti AM, Purwaningsih U, Sumiati T. 2010. Isolasi bakteriofaga anti Streptococcus agalactiae dari Ikan Nila (Oreochromis niloticus). J Ris Akuakult 5: 237 – 243.
Madigan MT, Martinko JM, Parker J. 1997. Brock Biology of Microorganism. Upper Saddle River: Prentice Hall.
Milliotis MD, Bier JW. 2003. International handbook of foodborne pathogens. New York: Marcel Dekker Inc.
Moldovan RG. 2005. The interaction between lambda phage and its bacterial host [disertasi]. Pittsburgh: University of Pittsburgh.
Najafi N, Ghasemian R, Shariatzadeh M, Alian S. 2008. Antimicrobial Resistance of Shigella from patients with acute diarrhea, Quaemshahr, Mazandaran, Iran. Res J Biol Sci 3: 332 – 336.
Ochman H, Selander RK. 1984. Standard reference strains of Escherichia coli from natural populations. J Bacteriol 157:690-693.
Ongunseitan OA, Sayler GS, Miller RV. 1992. Aplication of DNA probes to analysis of bacteriofage distribution patterns in the environment. Appl Environ Microbiol 58:2046-2052.
Park SC, Shimamura I, Fukunaga M, Mori KI, Nakai T. 2000. Isolation of bacteriophages specific to a fish pathogen, Pseudomonas plecoglossicida, as a candidate for disease control. Appl Environ Microbiol 66:1416-1422.
Park SC, Nakai T. 2003. Bacteriopahge control of Pseudomonas plecoglossicida infection in ayu Plecoglossus altivelis. Dis Aquat Organ 53:33-39.
Payne SM. 2006. Iron and pathogenesis of Shigella: Iron acquisition in the intracellular environment. BioMetals 19:173–180.
Pope WH, Haase-Pettingell C, King J. 2004. Protein folding failure sets high-temperature limit on growth of phage P22 in Salmonella enterica serovar typhimurium. Appl Environ Microbiol 70:4840–4847.
Rode TM et al. 2011. High stability of Stx2 phage in food and under food-processing conditions. Appl Environ Microbiol 77: 5336–5341.
Sansonetti PJ. 2006. Rupture, invasion and inflammatory destruction of the intestinal barrier by Shigella: The yin and yang of innate immunity. Can J Infect Dis Med Microbiol 17: 117-119.
Shao Y, Wang I. 2008. Bacteriophage adsorption rate and optimal lysis time. Genetics 180: 471-482.
Sillankorva S, Neubauer P, Azeredo J. 2008. Isolation and characterization of a T7-like lytic phage for Pseudomonas fluorescens. BMC Biotechnol 8: 80-90. Srinivasa H, Baijayanti M, Raksha Y. 2009. Magnitude of drug resistant shigellosis: a
report from Bangalore. Indian J Med Microbiol 27: 358 – 360.
Strauch E et al. 2001a. Characterization of enterocoliticin, a fage tail-like bacteriocin, and its effect on pathogenic Yersinia enterocolitica strains. Appl Environ Microbiol 67: 5634-5642.
Strauch E, Lurz R, Beutin L. 2001b. Characterization of a shiga toxin-encoding temperate bacteriophage of Shigella sonnei. Infect Immun 69: 7588-7595. Subekti D et al. 2001. Shigella spp. surveillance in Indonesia: the emergence or
reemergence of S. dysenteriae. Emerg Infect Dis 7: 137 – 140.
Sulakvelidze A, Alavidze Z, Morris JG Jr. 2001. Bacteriophage therapy. Antimicrob Agents Chemother 45: 649 – 659.
Tan WS, Ramanujam P, Nathan S, Yusoff K. 2004. Effect of pH and temperature on the binding of fusion phage to Newcastle Disease Virus. Malay J Biochem Mol Biol 9: 35 – 37.
Taneja N. 2007. Changing epidemiology of shigellosis and emergence of ciprofloxacin-resistant shigellae in India. J Clin Microbiol 45: 678–679.
Tey BT et al. 2009. Production of fusion m13 phage bearing the di-sulphide constrained peptide sequence (C-WSFFSNI-C) that interacts with hepatitis B core antigen. Afr J Biotechnol 8: 268 – 273.
Torres AG. 2004. Current aspects of Shigella pathogenesis: review article. Rev Latin Microbiol 46: 89 – 97.
Triatmodjo P. 1993. Distribusi geografis pola resistensi Shigella terhadap beberapa jenis antibiotik di daerah Jakarta dan Jawa Barat. Cermin Dunia Kedokteran 89: 49-51.
Verthe K, Possemiers S, Boon N, Vaneechoutte M, Verstraete W. 2004. Stability and activity of an enterobacter aerogenes-specific bacteriophage under simulated gastro-intestinal conditions. Appl Microbiol Biotechnol 65: 465–472.
Watson JD, Hopkins NH, Roberts JW, Steitz JA, Weiner AM. 1987. Molecular Biology of the Gene. Menlo Park: Benjamin Cummings Company.
Widyastuti P. 2005. Penyakit Bawaan Makanan: Fokus Pendidikan Kesehatan.
Jakarta: EGC.
Yang et al. 2005. Genome dynamics and diversity of Shigella species, the etiologic agents of bacillary dysentery. Nucleic Acids Res 33: 6445–6458.
Yang H, Liang L, Lin S, Jia S. 2010. Isolation and characterization of a virulent bacteriophage AB1 of Acinetobacter baumannii. BMC Microbiol 10: 1 – 10. Yoichi M et al. 2004. The criterion for selecting effective phage for Escherichia coli
O157:H7 control. Biochem Eng J 19: 221 – 227.
Viazis S, Akhtar M, Feirtag J, Brabban AD, Diez-Gonzalez F. 2010. Isolation and characterization of lytic bacteriophages against enterohaemorhagic Escherichia coli. J Appl Microbiol 110: 1323 – 1331.