UJI PATOGENITAS JAMUR Metarhizium anisopliae DAN
JAMUR Cordyceps militaris TERHADAP LARVA
PENGGEREK PUCUK KELAPA SAWIT
(Oryctes rhinoceros) (Coleoptera; Scarabaeidae)
DI LABORATORIUM
SKRIPSI
Oleh :
WIRDA SUZIANI 070302009
HPT
DEPARTEMEN HAMA DAN PENYAKIT TUMBUHAN
FAKULTAS PERTANIAN
UNIVERSITAS SUMATERA UTARA
MEDAN
UJI PATOGENITAS JAMUR Metarhizium anisopliae DAN
JAMUR Cordyceps militaris TERHADAP LARVA
PENGGEREK PUCUK KELAPA SAWIT
(Oryctes rhinoceros) (Coleoptera; Scarabaeidae)
DI LABORATORIUM
SKRIPSI
Oleh :
WIRDA SUZIANI 070302009
HPT
Skripsi Sebagai Salah Satu Syarat Untuk Dapat Memperoleh Gelar Sarjana Di Departemen Ilmu Hama dan Penyakit Tumbuhan Fakultas Pertanian
Universitas Sumatera Utara, Medan.
Disetujui Oleh :
(Dr. Ir. Hasanuddin, MS.) (Ir. Marheni, MP.) Ketua Pembimbing Anggota Pembimbing
DEPARTEMEN HAMA DAN PENYAKIT TUMBUHAN
FAKULTAS PERTANIAN
UNIVERSITAS SUMATERA UTARA
MEDAN
ABSTRACT
Wirda Suziani, “Test of Pathogenical Metarhizium anisopliae Fungus and
Cordyceps militaris Fungus against Shoots of Palm Weevils Larvae
(O. rhinoceros) (Coleoptera; Scarabaeidae) Mortality in the Laboratory”, under the guidance of Hasanuddin and Marheni. This study aims to examine the
pathogenity of M. anisopliae and C. militaris entomophatogen fungus against
O. rhinoceros larvae in the Laboratory. This study research using completely
randomized design (CRD) nonfactorial with seven treatments and four replication, namely A0 (control), A1, A2, A3 (applied to M. anisopliae fungus each 10, 15, and 20 grams corn media), A4, A5, A6 (applied to C. militaris fungus each 10, 15, 20 grams corn media).
The results showed the highest percentage of mortality larvae found in treatment A3 (applied M. anisopliae fungus on corn media) at 100.00%, and there are the lowest in treatment A4 (applied C. militaris fungus on corn media) at 70.00%. The highest percentage of time emergence of the test fungal colony in larvae infected found in treatment A3 (applied M. anisopliae fungus on corn
media) at 100.00%, and and there are the lowest in treatment A4 (applied
C. militaris fungus on corn media) at 55.00%. The result showed that the
entomophatogen M. anisopliae fungus more effective use in contolling the
O. rhinoceros larvae compared with the C. militaris fungus, but both of them can
ABSTRAK
Wirda Suziani, “Uji Patogenitas Jamur Metarhizium anisopliae dan Jamur
Cordyceps militaris terhadap Larva Penggerek Pucuk Kelapa Sawit
(Oryctes rhinoceros) (Coleoptera; Scarabaeidae) di Laboratorium”, dibawah bimbingan Hasanuddin dan Marheni. Penelitian ini bertujuan untuk menguji patogenitas dari jamur entomopatogen M. anisopliae dan C. militaris terhadap larva O. rhinoceros di laboratorium. Penelitian ini menggunakan rancangan acak lengkap (RAL) nonfaktorial dengan tujuh perlakuan dan empat ulangan yaitu A0 (kontrol), A1, A2, A3 (diaplikasikan jamur M. anisopliae pada masing-masing 10,15 dan 20 gr media jagung), A4, A5, A6 (diaplikasikan jamur C. militaris pada masing-masing 10,15 dan 20 gr media jagung).
Hasil penelitian menunjukkan persentase mortalitas larva tertinggi terdapat pada perlakuan A₃ (diaplikasikan jamur M. anisopliae pada 20 gr media
jagung) sebesar 100.00 %, dan terendah pada perlakuan A₄ (diaplikasikan jamur
C. militaris pada 10 gr media jagung) sebesar 70.00 %. Persentase waktu
munculnya koloni jamur uji pada larva yang terinfeksi tertinggi terdapat pada perlakuan A₃ (diaplikasikan jamur M. anisopliae pada 20 gr media jagung)
sebesar 100.00 % dan terendah pada perlakuan A₄ (diaplikasikan jamur
C. militaris pada 10 gr media jagung) sebesar 55.00 %. Hasil penelitian
menunjukkan bahwa jamur entomopatogen M. anisopliae lebih efektif digunakan
dalam mengendalikan larva O. rhinoceros dibandingkan dengan jamur
RIWAYAT HIDUP
Wirda Suziani lahir pada tanggal 11 November 1989 di Lubuk Pakam dari Ayahanda Sukono dan Ibunda Oni Rahma Nasution. Penulis merupakan anak ke pertama dari dua bersaudara.
Pendidikan formal yang pernah ditepuh penulis yaitu :
- Tahun 2001 lulus dari Sekolah Dasar (SD) Negeri 108306 di Lubuk Pakam. - Tahun 2004 lulus dari Sekolah Lanjutan Tingkat Pertama (SLTP) Negeri 2
Lubuk Pakam.
- Tahun 2007 lulus dari Sekolah Menengah Atas (SMA) Negeri 2 Lubuk Pakam.
- Tahun 2007 lulus dan diterima di Departemen Hama dan Penyakit Tumbuhan Fakultas Pertanian Universitas Sumatera Utara melalui jalur PMP.
Pengalaman Kegiatan Akademis
1. Tahun 2007 - 2011 menjadi anggota Komunitas Muslim (KOMUS) HPT Universitas Sumatera Utara.
2. Tahun 2007 - 2011 menjadi anggota Ikatan Mahasiswa Perlindungan Tanaman (IMAPTAN).
3. Tahun 2008 mengikuti seminar Peringatan 100 Tahun Kebangkitan Nasional FP USU ’’Motivation Training’’
4. Tahun 2008 mengikuti seminar Peranan Pertanian dalam Pembangunan Sumatera Utara.
6. Tahun 2011 melaksanakan Praktek Kerja Lapangan (PKL) pada bulan Januari sampai Februari di Dinas Pertanian Kabupaten Dairi.
KATA PENGANTAR
Puji dan syukur penulis panjatkan kehadirat Tuhan Yang Maha Esa, atas rahamat dan karunia-Nya penulis dapat menyelesaikan skripsi ini tepat pada waktunya.
Adapun judul dari skripsi ini adalah “Uji Patogenitas Jamur Metarhizium anisopliae dan Jamur Cordyceps militaris terhadap Larva
Penggerek Pucuk Kelapa Sawit (Oryctes rhinoceros) (Coleoptera; Scarabaeidae) di Laboratorium” yang disusun sebagai salah satu
syarat untuk dapat memperoleh gelar sarjana di Departemen Hama dan Penyakit Tumbuhan Fakultas Pertanian Universitas Sumatera Utara, Medan.
Pada kesempatan ini penulis mengucapkan terima kasih kepada Komisi pembimbing Dr. Ir. Hasanuddin,MS. selaku Ketua dan Ir. Marheni, MP. selaku Anggota yang telah memberikan bimbingan, mengarahkan dan memberi saran kepada penulis dalam menyelesaikan skripsi ini.
Penulis menyadari bahwa skripsi ini masih jauh dari kesempurnaan, untuk itu penulis mengharapkan saran dan kritik dari pembaca yang bersifat membangun demi kesempurnaan skripsi ini. Akhir kata penulis mengucapkan terima kasih dan semoga skripsi ini bermanfaat bagi kita semua.
Medan, Maret 2011
DAFTAR ISI
Biologi Kumbang Tanduk (O. rhinoceros) ... 6Gejala Serangan Kumbang Tanduk (O. rhinoceros) ………. 8
Jamur M. anisopliae ………..………. 10
Faktor Yang Mempengaruhi Perkembangan M. anisopliae……… 12
Mekanisme Infeksi Jamur M. anisopliae ………. 13
Gejala Serangan Jamur M. anisopliae ………....……. 14
Jamur C. militaris ……….……...……. 15
Faktor Yang Mempengaruhi Perkembangan C. militaris……….... 17
Mekanisme Infeksi Jamur C. militaris ………. 17
Gejala Serangan Jamur C. militaris ………. 18
BAHAN DAN METODE Tempat dan Waktu Penelitian ……….. 19
Bahan dan Alat ……….. 19
Metode Penelitian ……….. 19
Persiapan Penelitian ……….. 21
Pembuatan Media Potato Dextrose Agar (PDA) …….. 21
Pembuatan Media Jagung ……….. 21
Persiapan Media Perlakuan ……….. 23
Penyediaan Larva Serangga Uji ……….. 24
Pengaplikasian ……….. 24
Perameter Pengamatan ……….. 25
Persentase Mortalitas Larva ……….. 25
Persentase Waktu Munculnya Koloni Jamur Uji Pada Larva O. rhinoceros yang Terinfeksi …….……….. 25
Gejala Serangan Larva O. rhinoceros yang Terinfeksi Jamur Entomopatogen ………...…... 26
Foto Mikrograf Jaringan Larva O.rhinoceros Yang Terinfeksi Jamur Entomopatogen ……….. 26
HASIL DAN PEMBAHASAN Persentase Mortalitas Larva O. rhinoceros (%) ……….. 29
Persentase Waktu Munculnya Koloni Jamur Uji Pada Larva O. rhinoceros yang Terinfeksi (%) ……….. 31
Gejala Serangan Larva O. rhinoceros yang Terinfeksi Jamur Entomopatogen ……… 35
Foto Mikrograf Jaringan Larva O. rhinoceros Yang Terinfeksi Jamur Entomopatogen ………... 37
KESIMPULAN DAN SARAN Kesimpulan ……… 42
Saran ……… 43 DAFTAR PUSTAKA
DAFTAR TABEL
No Judul Hlm
1. Beda uji rataan pengaruh aplikasi jamur terhadap mortalitas
larva O. rhinoceros (%) pada pengamatan 10-21 hsa ……….. 29 2. Beda uji rataan pengaruh aplikasi jamur terhadap waktu munculnya
koloni jamur uji pada larva O. rhinoceros yang terinfeksi (%) pada
DAFTAR GAMBAR
9. Koloni jamur C. militaris bewarna kuning keputih-putihan ……… 16
10. Jamur C. militaris ……… 16
11. Grafik garis pengaruh aplikasi jamur entomopatogen terhadap terhadap mortalitas larva O. rhinoceros (%) pada setiap waktu pengamatan ………. 31
12. Grafik garis pengaruh aplikasi jamur entomopatogen terhadap waktu munculnya koloni jamur uji pada larva O. rhinoceros yang terinfeksi (%) pada setiap waktu pengamatan………. 34
13. Gejala serangan larva O. rhinoceros yang terinfeksi jamur M. anisopliae ……….…. 35
14. Gejala Serangan larva O. rhinoceros yang terinfeksi jamur C. militaris ………..………...…. 36
15. Foto mikrograf jaringan larva pada perlakuan kontrol (A0) ……... 37
16. Foto mikrograf jaringan larva pada perlakuan A1 ………... 37
17. Foto mikrograf jaringan larva pada perlakuan A2 dan A3 ……….. 38
DAFTAR LAMPIRAN
18. Data Pengamatan 12 Hsa Waktu Munculnya Koloni Jamur Uji padaLarva O. rhinoceros yang Terinfeksi (%) ………... 64 19. Data Pengamatan 13 Hsa Waktu Munculnya Koloni Jamur Uji pada
Larva O. rhinoceros yang Terinfeksi (%) ………... 65 20. Data Pengamatan 14 Hsa Waktu Munculnya Koloni Jamur Uji pada
21. Data Pengamatan 15 Hsa Waktu Munculnya Koloni Jamur Uji pada
Larva O. rhinoceros yang Terinfeksi (%) ………..………. 67 22. Data Pengamatan 17 Hsa Waktu Munculnya Koloni Jamur Uji pada
Larva O. rhinoceros yang Terinfeksi (%) ………..…. 68 23. Data Pengamatan 18 Hsa Waktu Munculnya Koloni Jamur Uji pada
Larva O. rhinoceros yang Terinfeksi (%) ………... 69 24. Data Pengamatan 19 Hsa Waktu Munculnya Koloni Jamur Uji pada
Larva O. rhinoceros yang Terinfeksi (%) ………... 70 25. Data Pengamatan 20 Hsa Waktu Munculnya Koloni Jamur Uji pada
Larva O. rhinoceros yang Terinfeksi (%) ………... 71 26. Data Pengamatan 21 Hsa Waktu Munculnya Koloni Jamur Uji pada
Larva O. rhinoceros yang Terinfeksi (%) ……… 72 27. Foto Bagan Penelitian ……… 73
ABSTRACT
Wirda Suziani, “Test of Pathogenical Metarhizium anisopliae Fungus and
Cordyceps militaris Fungus against Shoots of Palm Weevils Larvae
(O. rhinoceros) (Coleoptera; Scarabaeidae) Mortality in the Laboratory”, under the guidance of Hasanuddin and Marheni. This study aims to examine the
pathogenity of M. anisopliae and C. militaris entomophatogen fungus against
O. rhinoceros larvae in the Laboratory. This study research using completely
randomized design (CRD) nonfactorial with seven treatments and four replication, namely A0 (control), A1, A2, A3 (applied to M. anisopliae fungus each 10, 15, and 20 grams corn media), A4, A5, A6 (applied to C. militaris fungus each 10, 15, 20 grams corn media).
The results showed the highest percentage of mortality larvae found in treatment A3 (applied M. anisopliae fungus on corn media) at 100.00%, and there are the lowest in treatment A4 (applied C. militaris fungus on corn media) at 70.00%. The highest percentage of time emergence of the test fungal colony in larvae infected found in treatment A3 (applied M. anisopliae fungus on corn
media) at 100.00%, and and there are the lowest in treatment A4 (applied
C. militaris fungus on corn media) at 55.00%. The result showed that the
entomophatogen M. anisopliae fungus more effective use in contolling the
O. rhinoceros larvae compared with the C. militaris fungus, but both of them can
ABSTRAK
Wirda Suziani, “Uji Patogenitas Jamur Metarhizium anisopliae dan Jamur
Cordyceps militaris terhadap Larva Penggerek Pucuk Kelapa Sawit
(Oryctes rhinoceros) (Coleoptera; Scarabaeidae) di Laboratorium”, dibawah bimbingan Hasanuddin dan Marheni. Penelitian ini bertujuan untuk menguji patogenitas dari jamur entomopatogen M. anisopliae dan C. militaris terhadap larva O. rhinoceros di laboratorium. Penelitian ini menggunakan rancangan acak lengkap (RAL) nonfaktorial dengan tujuh perlakuan dan empat ulangan yaitu A0 (kontrol), A1, A2, A3 (diaplikasikan jamur M. anisopliae pada masing-masing 10,15 dan 20 gr media jagung), A4, A5, A6 (diaplikasikan jamur C. militaris pada masing-masing 10,15 dan 20 gr media jagung).
Hasil penelitian menunjukkan persentase mortalitas larva tertinggi terdapat pada perlakuan A₃ (diaplikasikan jamur M. anisopliae pada 20 gr media
jagung) sebesar 100.00 %, dan terendah pada perlakuan A₄ (diaplikasikan jamur
C. militaris pada 10 gr media jagung) sebesar 70.00 %. Persentase waktu
munculnya koloni jamur uji pada larva yang terinfeksi tertinggi terdapat pada perlakuan A₃ (diaplikasikan jamur M. anisopliae pada 20 gr media jagung)
sebesar 100.00 % dan terendah pada perlakuan A₄ (diaplikasikan jamur
C. militaris pada 10 gr media jagung) sebesar 55.00 %. Hasil penelitian
menunjukkan bahwa jamur entomopatogen M. anisopliae lebih efektif digunakan
dalam mengendalikan larva O. rhinoceros dibandingkan dengan jamur
PENDAHULUAN
Latar Belakang
Kelapa sawit (Elaeis guineensis Jacq.) berasal dari Afrika dan Amerika Selatan, tepatnya Brasilia. Di Brasilia tanaman ini dapat ditemukan tumbuh secara liar disepanjang tepi sungai. Namun sekarang kelapa sawit diusahakan sacara komersial di Asia Tenggara, Pasifik Selatan, serta beberapa daerah lain dalam skala yang lebih kecil. Kelapa sawit termasuk dalam subfamily Cocoideae, merupakan tanaman asli Amerika Selatan (Pohan, 2006).
Kelapa sawit (E. guineensis Jacq.) merupakan salah satu tanaman perkebunan di Indonesia yang memiliki masa depan yang cukup cerah. Perkebunan kelapa sawit semula berkembang di daerah Sumatera Utara dan Nanggroe Aceh Darussalam. Namun sekarang telah berkembang ke berbagai daerah seperti Riau, Kalimantan Barat, Kalimantan Timur, Kalimantan Tengah, Sulawesi, Maluku, dan Papua (Sunarko, 2007).
Sejarah dari budidaya kelapa sawit di Indonesia telah lama berlangsung lebih dari 150 tahun. Budidaya kelapa sawit saat ini menghadapi masalah yang
cukup pelik yaitu adanya gangguan hama dan penyakit.
Oryctes rhinoceros Linnaeus merupakan hama utama yang menyerang kelapa
sawit yaitu dengan menggerek pucuk kelapa sawit dan sangat merugikan khususnya di areal replanting yang saat ini sedang dilakukan secara besar-besaran di Indonesia. Hal ini disababkan di areal replanting kelapa sawit banyak tumpukan bahan organik yang sedang mengalami proses pembusukan sebagai tempat berkembang biak hama ini (Tim Penulis PS, 1997).
Kumbang tanduk, O. rhinoceros L. (Coleoptera: Scarabaeidae) merupakan satu dari sekian banyak hama penting yang menyerang tanaman kelapa sawit. Hama ini sering menyebabkan kerugian yang berarti, baik ditinjau secara ekonomis maupun dari kemampuan hama tersebut merusak tanaman. Kerusakan yang ditimbulkan dari tahun ke tahun meningkat sesuai dengan bertambahnya luas areal tanaman kelapa sawit. Hal ini terjadi karena umumnya petani masih kurang memperhatikan akan kebersihan (sanitasi) kebunnya. Batang-batang tua yang ditebang untuk peremajaan seringkali dibiarkan membusuk di sekitar lokasi tanaman, padahal batang yang membusuk tersebut dapat dijadikan sarang untuk tempat O. rhinoceros berkembang biak. Demikian pula kotoran kerbau/sapi, timbunan serbuk gergajian kayu dan tumpukan jerami/sekam padi merupakan
tempat yang disukai untuk O. rhinoceros meletakkan telur dan larvanya (Rismansyah, 2010).
lingkungan. Penggunaan pestisida yang tidak benar mengakibatkan terbentuknya hama yang resisten terhadap bahan kimia tersebut. Terbentuknya strain-strain hama yang resisten terhadap pestisida akibat terjadinya peningkatan detoksifikasi insektisida, penurunan kepekaan tempat sasaran insektisida dan penurunan laju penetrasi insektisida melalui kulit. Salah satu penyebab terbentuknya resistensi hama adalah terjadinya detoksifikasi pestisida di dalam tubuh serangga, sehingga bahan kimia tersebut akan kehilangan daya racunnya. Untuk mengurangi digunakannya bahan kimia telah banyak diupayakan penggunaan musuh alami hama, baik berupa predator, parasitoid maupun patogen (Untung, 1993).
Pengendalian hayati merupakan teknik pengendalian organisme pengganggu tumbuhan (OPT) dengan memanfaatkan organisme hidup (agens hayati) yang bersifat predator, parasit, parasitoid dan patogen. Agens hayati dimaksud meliputi hewan vertebrata, serangga, jamur, nematoda, bakteri dan virus. Secara teknis pengendalian hayati lebih unggul dibandingkan pengendalian secara kimiawi, karena selain efektif dan efisien juga ramah lingkungan. Pengendalian hayati hama kelapa sawit dapat menggunakan entomopatogenik, yaitu multiple nucleopolyhedrovirus (MNPV), dan jamur Cordyceps aff. militaris (Prawirosukarto dkk, 2003).
Cordyceps militaris merupakan salah satu agensia pengendali hayati yang
entomopatogenik dari kelas Ascomycetes, ordo Clavicipitales dan famili Clavicipitaceae (Prawirosukarto dkk, 1996).
Jamur yang dapat digunakan sebagai patogen hama serangga adalah jamur yang dapat menyebabkan penyakit bagi hama tertentu, yang biasa disebut dengan jamur entomopatogen. Menurut Hall (1973) beberapa kelebihan pemanfaatan jamur entomopatogen dalam pengendalian hama adalah mempunyai kapasitas reproduksi tinggi, siklus hidupnya pendek, dapat membentuk spora yang tahan lama di alam walaupun dalam kondisi yang tidak menguntungkan, relatif aman, bersifat selektif, relatif mudah diproduksi, dan sangat kecil kemungkinan terjadi resistensi. Contoh jamur yang telah teruji adalah jamur Metarhizium anisopliae
yang merupakan patogen bagi larva kumbang kelapa O.rhinoceros
(Kusnaedi, 1997).
Jamur M. anisopliae telah dikenal sebagai patogen pada berbagai jenis serangga hama dan dapat diproduksi secara komersial sebagai bioinsektisida. Penelitian penggunaan M. anisopliae terbukti mampu mengendalikan beberapa jenis hama. Beberapa hama penting tanaman kelapa sawit yang dapat diinfeksi
oleh M. anisopliae adalah O. rhinoceros, Thosea monoloncha, Brontispa longissima dan Plesispa reichei. Walaupun jamur ini dapat menginfeksi
begitu banyak serangga, ternyata intensitas serangan terbesar dan inang yang terbaik untuk berkembang biak adalah larva O. rhinoceros. Semua stadia
O. rhinoceros kecuali telur dapat diinfeksi oleh jamur ini. Sifat jamur ini yang
dapat menginfeksi hampir semua stadia O. rhinoceros itulah yang menjadi dasar
Indonesia mempunyai potensi yang luar biasa dalam mengembangkan perkebunan kelapa sawit. Tetapi keberadaan hama O. rhinoceros sering kali menjadi kendala bagi perkembangan perkebunan kelapa sawit. Pestisida kimia yang digunakan untuk mengendalikan hama mempunyai dampak negatif terhadap lingkungan dan tidak jarang menyebabkan hama menjadi resisten. Sehubungan dengan uraian di atas, penulis tertarik untuk melakukan penelitian tentang pengendalian hama O. rhinoceros yang ramah lingkungan dengan menggunakan jamur entomopatogen.
Tujuan Penelitian
Untuk menguji patogenitas dari jamur entomopatogen
M. anisopliae dan C. militaris terhadap larva O. rhinoceros di laboratorium.
Hipotesa Penelitian
Jamur M. anisopliae dan jamur C. militaris patogen terhadap larva
O. rhinoceros.
Kegunaan Penelitian
- Sebagai salah satu syarat untuk dapat memperoleh gelar sarjana di Departemen Hama dan Penyakit Tumbuhan Fakultas Pertanian Universitas Sumatera Utara, Medan.
TINJAUAN PUSTAKA
Biologi Kumbang Tanduk (O. rhinoceros).
Sistematika kumbang tanduk menurut Kalshoven (1981) adalah sebagai berikut:
Kingdom : Animalia Filum : Arthropoda Kelas : Insekta Ordo : Coleoptera Famili : Scarabaeidae Genus : Oryctes
Spesies : O. rhinoceros L.
Kumbang betina mampu memproduksi telur sebanyak 35 sampai 140 butir. Telur-telur akan diletakkan pada sampah-sampah, pada pucuk kelapa yang mati, dan ada pula yang diletakkan pada kotoran-kotoran yang terdapat diantara pelepah-pelepah. Imago betina menghasilkan telur 30 - 70 butir dan menetas setelah ± 12 hari. Telur berwarna putih dengan garis tengah ± 3 mm, lalu bewarna agak kelam dan mendekati penetasan akan bewarna coklat (Kartasapoetra, 1993).
Larva berada di daerah yang membusuk. Ukuran badannya mencapai 7.5 mm dan panjangnya mencapai 60 - 105 mm. Warna larva keputih-putihan tetapi kepalanya bewarna kehitaman dan bagian belakang perutnya bewarna biru keabuan. Tubuhnya samar-samar melengkung membentuk setengah lingkaran. Larva O.
rhinoceros berkaki tiga pasang. Larva hidup dari memakan bahan organik yang
ada di dekatnya. Larva terdiri dari tiga instar. Masa larva instar pertama 12 - 21 hari, instar kedua 21 - 60 hari, dan instar ketiga 60 - 165 hari (Lever, 1969).
Gambar 2: Larva O. rhinoceros
Pupa berada di dalam tanah, berwarna coklat kekuningan berada dalam kokon yang dibuat dari bahan-bahan organik disekitar tempat hidupnya. Pupa jantan berukuran sekitar 3 - 5 cm, yang betina agak pendek. Masa prapupa 8 - 13 hari. Masa pupa berlangsung 18 - 23 hari. Kumbang yang baru muncul dari pupa akan tetap tinggal di tempatnya antara 5 - 20 hari, kemudian terbang keluar (Prawirosukarto dkk, 2003).
Kumbang berwarna hitam, ukuran badan panang 40 mm lebar 20 mm. Kumbang jantan mempunyai cula yang lebih panjang dari yang betina. Kumbang yang baru keluar terbang menuju pohon kelapa memakan dan sambil mencari pasangan kemudian terjadi perkawinan, dan setelah itu kumbang-kumbang betina terbang menuju sampah-sampah/tumpukan limbah untuk bertelur. Telur yang dihasilkan dapat mencapai 35- 70 butir/ekor kumbang betina. Kumbang aktif pada
sore hari sekitar jam 6 - 7 malam dan tertarik pada cahaya. Umur kumbang 4 – 4.5 bulan (Siswanto, 2003).
Gambar 4: Imago O. rhinoceros
Gejala Serangan Kumbang Tanduk (O. rhinoceros)
Stadium hama yang berbahaya adalah stadium imago (dewasa) yang berupa kumbang (Suhardiyono, 1988).
Kumbang dewasa masuk ke dalam daerah titik tumbuh dan memakan bagian yang lunak. Bila serangan mengenai titik tumbuh, tanaman akan mati, tetapi bila makan bakal daun hanya menyebabkan daun dewasa rusak seperti terpotong gunting (Darmadi, 2008).
Tampak guntingan-guntingan/potongan-potongan pada daun yang baru terbuka seperti huruf “V”, gejala ini disebabkan kumbang menyerang pucuk dan pangkal daun muda yang belum membuka yang merusak jaringan aktif untuk pertumbuhan. Serangan ini dapat dilakukan oleh serangga jantan maupun betina (Prawirosukarto dkk, 2003).
Jamur M. anisopliae
Menurut Alexopoulus dkk (1996), klasifikasi M. anasopliae adalah sebagai berikut :
Kingdom : Fungi Phylum : Ascomycota Class : Sordariomycetes Ordo : Hypocreales Family : Clavicipitaceae Genus : Metarhizium Species : M. anisopliae.
M. anisopliae adalah salah satu jamur entomopatogen yang termasuk
dalam divisi Deuteromycotina: Hyphomycetes. Jamur ini biasa disebut dengan
green muscardine fungus dan tersebar luas di seluruh dunia. Koloni jamur
M. anisopliae pada awal pertumbuhannya berwarna putih, kemudian berubah
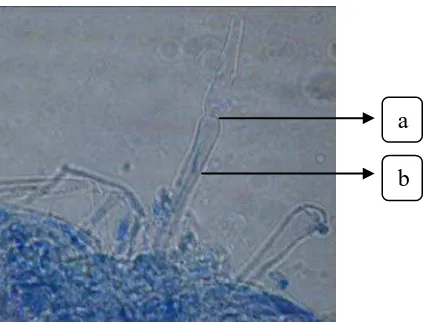
menjadi hijau gelap dengan bertambahnya umur. Miselium bersekat, diameter 1,98 - 2,97 µm, konidiofor tersusun tegak, berlapis, dan bercabang yang dipenuhi dengan konidia. Konidia bersel satu berwarna hialin, berbentuk bulat silinder dengan ukuran 9,94 x 3,96 µm (Alexopoulus dkk,1996).
Jamur ini bersifat parasit pada beberapa jenis serangga dan bersifat saprofit di dalam tanah dengan bertahan pada sisa-sisa tanaman. Cendawan ini pertama kali digunakan untuk mengendalikan hama kumbang kelapa lebih dari 85 tahun yang lalu, dan sejak itu digunakan di beberapa negara termasuk Indonesia.
M. anisopliae telah lama digunakan sebagai agen hayati dan dapat menginfeksi
beberapa jenis serangga, antara lain dari ordo Coleoptera, Lepidoptera, Homoptera, Hemiptera, dan Isoptera. M. anisopliae telah terbukti mampu mematikan Plutella xylostella dari ordo Lepidoptera yang menyerang tanaman kubis. M. anisopliae juga mampu mematikan Ostriania furnacalid Guenee pada tanaman jagung (Van den Bosch dkk, 1973).
Keberhasilan dalam pengendalian hama dengan menggunakan jamur
entomopatogen juga ditentukan oleh konsentari jamur yang diaplikasikan (Hall, 1980). Menurut penelitian yang telah dilakukan di Balai Penelitian
Gambar 7 : Jamur M. anisopliae (a. konidia, b. konidiofor)
Faktor Yang Mempengaruhi Perkembangan M. anisopliae
Jamur M. anisopliae dipengaruhi oleh temperature yang optimum, yaitu berkisar antara 20 – 220C, walaupun beberapa laporan menyebutkan bahwa jamur dapat tumbuh pada temperatur yang sangat dingin. Konidia akan membentuk kecambah pada kelembapan diatas 90%. Namun demikian, konidia akan berkecambah dengan baik dan patogenitas akan meningkat bila kelembapan udara tinggi hingga 100%. Patogenitasnya bisa menurun apabila kelembapan udara di bawah 86 % ( Prayogo, 2006 ).
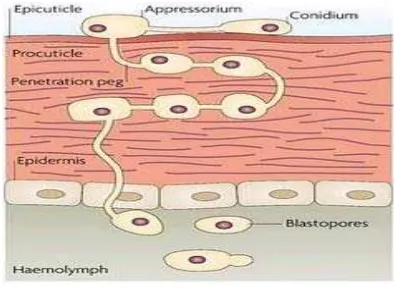
Jamur ini dinamakan sebagai muskardin hijau karena warna sporanya yang hijau terang. Sporanya tidak berkelamin memiliki konidia yang dapat menempel pada serangga, spora ini berkecambah dan hyphanya yang muncul menembus kulit jangat. M. anisopliae dapat berkembang di dalam sarang serangga yang dapat dengan cepat membunuh hanya dalam beberapa hari, efek mematikan sangat membantu dalam memproduksi pemberantas serangga. Kulit jangat serangga yang
a
membentuk akar segera melingkar pada bangkai serangga tersebut berupa spora berwarna hijau (Hosang, 1990).
Mekanisme Infeksi Jamur M. anisopliae
M. anisopliae yaitu lipase, khitinase, amilase, proteinase, pospatase, dan esterase
(Freimoser dkk, 2003).
Gambar 8: Mekanisme Infeksi Jamur M. anisopliae Sumber :
Gejala Serangan Jamur M. anisopliae
Jamur C. militaris
Menurut Holliday dkk (2005), jamur C. militaris dapat diklasifikasikan sebagai berikut :
Kingdom : Fungi Filum : Ascomycota Klass : Ascomycetes Ordo : Hypocreales Famili : Clavicipitaceae Genus : Cordyceps
Spesies : C. militaris Fries.
Cordyceps sp. adalah genus jamur ascomycetes (jamur kantung) yang
mencakup sekitar 750 spesies. Semua jenis Cordyceps adalah endoparasitoid, terutama pada serangga, sehingga mereka disebut sebagai jamur entomopatogen. Jamur ini bersifat soil borne karena infeksi mulai terjadi pada saat larva turun ke tanah untuk berkepompong (Wibowo dkk, 1994).
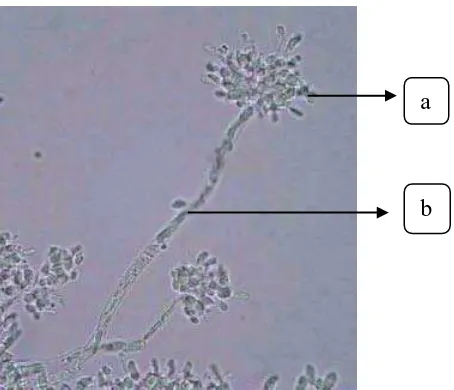
Gambar 9 : Jamur C. militaris pada media PDA
(a. Koloni jamur C. militaris putih; b. fruiting body jamur)
Stroma dan sinemata Cordyceps berasal dari endosklerotium dan biasanya keluar dari mulut dan anus serangga dan dapat berkembang dengan bantuan cahaya. Stroma dan sinemata terdiri dari bundel-bundel yang tersusun rapi dan membentuk garis-garis membujur atau terdiri dari hifa yang saling berjalin dan peritesia yang berkembang semakin ke atas. Struktur badan buahnya dapat mencapai panjang kira-kira 30 cm, dan bewarna kuning, jingga, merah, cokelat, kuning tua, abu-abu, hijau, atau hitam. Peritesia mengandung askus yang panjang dan sempit dengan askospora yang multisepta yang dapat berubah bentuk menjadi semakin besar dalam satu bagian sel tersebut (Tanada dan Harry, 1993).
Gambar 10: Jamur C. militaris (a. septa ; b. askus) a
Faktor Yang Mempengaruhi Perkembangan C. militaris
Hasil penelitian di Balai Penelitian Marihat menunjukkan bahwa pada kondisi
kelembapan yang cukup perkembangan Cordyceps dari mumifikasi sampai terjadinya
emisi askospora sekitar 24 hari. Keadaan yang sedikit gelap akan berpengaruh
terhadap evolusi stromata tetapi cahaya akan merangsang keluarnya peritesia. Waktu
yang diperlukan untuk pembentukan stromata berkisar antara 2 – 4 minggu setelah
inokulasi (Wibowo dkk, 1994).
Media yang dipakai untuk menumbuhkan jamur entomopatogen sangat
menentukan laju pembentukan koloni dan jumlah konidia selama pertumbuhan.
Jumlah konidia akan menentukan keefektifan jamur entomopatogen dalam
mengendalikan serangga. Jamur entomopatogen membutuhkan media dengan
kandungan gula yang tinggi di samping protein. Media dengan kadar gula yang tinggi
akan meningkatkan virulensi jamur entomopatogen. Media dari jagung manis atau
jagung lokal + gula 1% menghasilkan jumlah konidia dan persentase daya kecambah
konidia yang lebih tinggi dibandingkan media yang lain (Prayogo dkk, 2006).
Mekanisme Infeksi Jamur C. militaris
Gejala Serangan Jamur C.militaris
C. militaris dapat menyerang larva instar akhir maupun kepompong yang
ditandai dengan munculnya miselium berwarna putih dan mengalami mumifikasi.
Kepompong yang terinfeksi menjadi keras (mumifikasi), berwarna krem sampai coklat muda, miselium berwarna putih membalut tubuh kepompong di dalam kokon. Miselium berkembang keluar dinding kokon dan terjadi diferensiasi membentuk rizomorf dengan beberapa cabang, berwarna merah muda. Ujung – ujung rizomorf berdiferensiasi membentuk badan buah berisi peritesia dengan askus dan askospora. Infeksi pertama terjadi pada saat larva tua akan berkepompong, tetapi lebih banyak pada fase kepompong. Pada kondisi lapangan,
C. militaris tumbuh baik pada tempat-tempat lembab di sekitar piringan kelapa
BAHAN DAN METODE
Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan di Laboratorium Hama Departemen Ilmu Hama dan Penyakit Tumbuhan Fakultas Pertanian Universitas Sumatera Utara, Medan. Dengan ketinggian tempat ± 25 m di atas permukaan laut. Dilaksanakan mulai bulan Oktober sampai selesai.
Bahan dan Alat
Bahan yang digunakan dalam penelitian ini adalah tanah, air, jamur entomopatogen M. anisopliae dan C. militaris, tandan kosong kelapa sawit, larva
O. rhinoceros instar ke 3, PDA, jagung, alkohol, aquadest, jagung halus, larutan
Bouin, xilol, paraffin, Eosin, balsam kanada dan bahan pendukung lainnya.
Alat-alat yang digunakan adalah stoples plastik, kain kasa, kertas label, tisu, karet gelang, mikroskop, gelas ukur, petridis, timbangan, Haemocytometer, jarum ose, bunsen, cling wrap, aluminium foil, erlenmeyer, objek glass, autoclave, pisau, plastik kecil, alat tulis, dan alat-alat pendukung lainnya.
Metode Penelitian
Penelitian menggunakan Rancangan Acak Lengkap (RAL) nonfaktorial, dengan perlakuan:
A₀ : Tanpa Perlakuan (Kontrol)
A₂ : Diaplikasikan jamur M. anisopliae pada 15 gr media jagung/ stoples
A₃ : Diaplikasikan jamur M. Anisopliae pada 20 gr media jagung/ stoples
A₄ : Diaplikasikan jamur C.militaris pada 10 gr media jagung / stoples
A₅ : Diaplikasikan jamur C.militaris pada 15 gr media jagung/ stoples
A₆ : Diaplikasikan jamur C.militaris pada 20 gr media jagung / stoples
Keterangan: Setiap stoples terdapat 5 larva O. rhinoceros instar ke-3. Masing-masing perlakuan terdiri dari 4 ulangan, dengan rumus: (t-1) (r-1) ≥ 15
(7-1) (r-1) ≥ 15 6 (r-1) ≥ 15 6 r – 6 ≥ 15 6 r ≥ 21 r ≥ 3,5 r ≥ 4
Jumlah Perlakuan : 7 Perlakuan Jumlah ulangan : 4 Ulangan
Jumlah unit Percobaan : 28 Unit Percobaan
Model linier yang digunakan adalah sebagai berikut: Yij = µ + αi + βj + ∑ij
Yij = Respon atau nilai pengamatan pada perlakuan ke-i dan kelompok ke-j. µ = Nilai tengah umum
∑ij = Efek eror karena pengaruh perlakuan pada taraf ke-i dan peda ulangan
ke-j
Apabila hasil analisa sidik ragam menunjukkan nilai berbeda nyata dilanjutkan dengan Uji Jarak Duncan.
Persiapan Penelitian
a. Pembuatan Media Potato Dextrose Agar (PDA)
Media PDA digunakan untuk mengembangbiakkan jamur entomopatogen. Media ini dibuat dengan cara: kentang dikupas dan dicuci bersih lalu ditimbang 250 gr, dipotong dadu berukuran 1 – 2 cm, kemudian kentang dimasak dengan aquades 500 ml selama 30 menit, lalu disaring ekstraknya dengan kain muslin sampai volume 500 ml. Kemudian dextrose dimasukkan sebanyak 20 gr dan agar sebanyak 20 gr ke dalam beaker glass, ditambahkan aquades kedalamnya sebanyak 500 ml, aduk sampai merata. Masukkan ekstrak kentang yang telah disaring tadi (500 ml) kedalam laruran dextrose + agar, aduk hingga homogen dan dididihkan selama 30 menit. Setelah itu masukkan ke dalam Erlenmeyer masing – masing 200 ml. Selanjutnya Erlenmeyer ditutup dengan kapas steril dan aluminium foil lalu balut dengan cling wrap atau isolasi. Selanjutnya masukkan ke dalam autoclave untuk disterilkan selama 30 menit dengan suhu 1210C pada tekanan 1,5 atm.
b. Pembuatan Media Jagung
mempermudah aplikasi jamur entomopatogen (yaitu dengan menaburkan media jagung yang telah ditumbuhi jamur entomopatogen, dimana dosis media jagung yang digunakan sesuai dengan perlakuan masing-masing). Media jagung ini dibuat dengan cara: merendam jagung selama satu jam, kemudian membuang jagung yang mengapung. Setelah itu jagung ditimbang dan dimasukkan ke dalam plastik. Jagung yang telah terbungkus sesuai dosis perlakuan tersebut kemudian dimasukkan ke dalam autoclave untuk disterilkan selama 30 menit dengan suhu 1210C pada tekanan 1,5 atm.
c. Penyediaan Jamur Entomopatogen
Jamur yang digunakan dalam penelitian ini adalah M. anisopliae yang diisolasi dari larva O. rhinoceros yang terserang M. anisopliae. M. anisopliae terlebih dahulu dibiakkan dalam media PDA sebagai biakan murni. Setelah tumbuh kemudian M. anisopliae dibiakkan kembali pada media jagung dengan cara memasukkan sedikit jamur entomopatogen yang telah murni ke dalam jagung yang telah disterilkan.
Sebelum aplikasi terlebih dahulu dihitung kerapatan konidia per gram media jagung dengan menggunakan alat haemocytometer. Penghitungan konidia dilakukan dengan cara: mengambil sedikit jamur yang telah tumbuh pada media jagung (± 1 gram jamur + 9 ml air steril), kemudian dishaker selama setengah jam. Setelah itu cairan tersebut dimasukkan kedalam ruang-ruang haemocytometer dan kemudian ditutup dengan kaca penutup. Setelah itu konidia telah dapat dihitung di bawah mikroskop dengan menggunakan rumus
kotak haemocytometer yang dihitung, d = faktor pengencer, n = jumlah kotak bujur sangkar yang diamati, 0.25 = konstanta. Setelah kerapatan konidia mencapai 107 per gram media jagung, maka jamur entomopatogen telah dapat diaplikasikan untuk mengendalikan larva O. rhinoceros. Konsentrasi konidia dalam biakan M.
anisopliae yang baik adalah mengandung 500 juta ( 5 x 108 ) konidia atau lebih dalam setiap gram jagung (Mahmud, 1989).
Sedangkan jamur C.militaris yang digunakan diperoleh dari PPKS Lonsum. Dimana jamur tersebut telah tersedia dalam bentuk biakan murni, yang kemudian akan dibiakkan lagi guna perbanyakan. Setelah itu diperlakuan sama dengan jamur M.anisopliae, seperti dibiakkan lagi pada media jagung dan dihitung kerapatan konidianya sebelum aplikasi.
d. Persiapan Media Perlakuan
e. Penyediaan Larva Serangga Uji
Larva O. rhinoceros diambil dari lapangan sebanyak 140 larva instar ke-3 yang sehat. Kemudian larva dimasukkan ke dalam stoples, dimana tiap stoples berisi 5 larva. Sebagai makanannya dimasukkan juga tandan kosong kelapa sawit yang telah disterilkan sebelumnya, dimasukkan ke stoples 1 hari sebelum larva dimasukkan ke dalam stoples. Setelah itu stoples ditutup dengan kain kasa.
Pengaplikasian
Peubah Pengamatan
a. Persentase Mortalitas Larva
Pengamatan mortalitas larva dilakukan setiap hari setelah aplikasi. Pengamatan tersebut dilakukan dengan menghitung jumlah larva yang mati dan kemudian dihitung mortalitas larva. Persentase mortalitas larva dapat dihitung dengan menggunakan rumus sebagai berikut:
P = x100%
P = Persentase mortalitas larva a = Jumlah larva yang mati
b = Jumlah larva yang masih hidup
b. Persentase Waktu Munculnya Koloni Jamur Uji Pada Larva O. rhinoceros Yang Terinfeksi
Pengamatan terhadap waktu munculnya koloni jamur entomopatogen pada larva yang terinfeksi dilakukan setiap hari setelah aplikasi. Pengamatan tersebut dilakukan dengan cara melihat dan menghitung larva yang disekitar tubuhnya ditumbuhi oleh koloni jamur entomopatogen. Dimana warna koloni akan berbeda sesuai dengan warna spora jamur yang menginfeksi. Persentase waktu kemunculan koloni jamur entomopatogen pada tubuh larva yang trinfeksi dapat dihitung dengan rumus sebagai berikut:
P = x100%
d c
c
Keterangan:
P = Persentase larva yang telah ditumbuhi koloni jamur entomopatogen c = Jumlah larva yang telah ditumbuhi koloni jamur entomopatogen d = Jumlah larva yang tidak ditumbuhi koloni jamur entomopatogen
c. Gejala Serangan Larva O. rhinoceros Yang Terinfeksi Jamur Entomopatogen
Pengamatan dilakukan setiap hari setelah jamur M. anisopliae dan
C. militaris dipalikasikan ke larva O. rhinoceros. Diamati gejala yang timbul pada
larva yang terinfeksi oleh jamur entomopatogen. Larva yang terinfeksi akan mengalami mumifikasi dan akan muncul koloni jamur disekitar tubuhnya, dimana warna koloni jamur sesuai dengan warna koloni jamur yang menginfeksinya.
d. Foto Mikrograf Jaringan Larva O. rhinoceros Yang Terinfeksi Jamur Entomopatogen
Foto mikrograf jaringan larva yang terinfeksi jamur entomopatogen dapat dilakukan pada larva yang telah mati dan telah menunjukkan gejala dari serangan jamur. Adapun metodologi yang dilakukan adalah sebagai berikut:
- Fiksasi
Diambil larva yang telah terinfeksi dan direndam dalam larutan Bouin selama 24 jam.
- Pencucian dan Dehidrasi
Fiksatif dibuang, dan spesimen kembali direndam dalam alkohol 70, 80, 95 dan 100% selama masing-masing 30 menit.
Alkohol dibuang dan larutan diganti berturut-turut dengan campuran alkohol / xilol dengan perbandingan 3:1, 1:1, dan 1:3 selama masing-masing 30 menit. Kemudian direndam dalam larutan xilol selama 24 jam.
Spesimen tersebut kemudian direndam kembali pada larutan xilol / parafin dengan perbandingan berturut-turut 3:1, 1:1, dan 1:3 selama masing-masing 1 jam dengan temperatur 570C.
- Infiltrasi
Campuran xilol / parafin dibuang, dan diganti dengan parafin murni selama satu jam.
- Penyelubungan
Parafin dibuang, diganti dengan parafin yang baru. Setelah ± 1 jam dibuat blok, yaitu dengan menempel spesimen pada blok kayu.
- Pengirisan
Dibuat irisan-irisan spesimen dengan rotary microtome dengan ketebalan tertentu.
- Perekatan
Irisan spesimen dilekatkan pada objek glass, kemudian diletakkan di atas hot plate dengan temperatur 450C sampai parafin mencair. Setelah itu didingin anginkan dan dibersihkan dengan larutan xilol.
- Pewarnaan
xilol berturut-turut dengan perbandingan 1:3, 1:1, dan 3:1 selama masing-masing 3 menit.
Spesimen kemudian dimasukkan berturut-turut kedalam larutan alkohol absolut I dan alkohol absolut II selama masing-masing 3 menit. Kemudian spesimen direndam lagi menggunakan alkohol 95, 80, 60, 40, dan 20%, berturut-turut selama 3 menit. Kemudian direndam dalam aquades selama 3 menit.
Spesimen kembali direndam dalam Eosin selama 2 jam. Setelah itu dicuci dengan merendamnya ke dalam aquades selama 3 menit. Kemudian spesimen kembali direndam berturut-turut ke dalam alkohol 20, 40, 60, 80, dan 95% selama masing-masing 3 menit. Setelah itu direndam ke dalam alkohol absolut I dan alkohol absolut II selama 3 menit.
Spesimen direndam dalam alkohol / xilol dengan perbandingan berturut-turut 3:1, 1:1, dan 1:3 selama masing-masing 3 menit. Setelah itu spesimen direndam dalam larutan xilol I dan xilol II masing-masing 3 menit.
- Penutupan
Irisan spesimen yang telah diwarnai ditutup dengan gelas penutup kemudian diberi balsam kanada terlebih dahulu. Setelah itu dibersihkan dengan xilol.
- Pengamatan
HASIL DAN PEMBAHASAN
Persentase Mortalitas Larva O. rhinoceros (%)
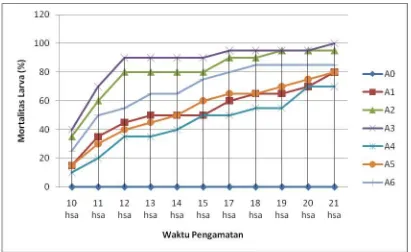
Data pengamatan persentase mortalitas larva O. rhinoceros akibat aplikasi jamur entomopatogen M. anisopliae dan C. militaris dari hasil analisis sidik ragam, dapat dilihat bahwa perlakuan aplikasi jamur pada pengamatan 10 – 21 hari setelah aplikasi berpengaruh nyata terhadap mortalitas larva O. rhinoceros. Untuk mengetahui perlakuan yang berbeda nyata dapat dilihat pada Tabel 1.
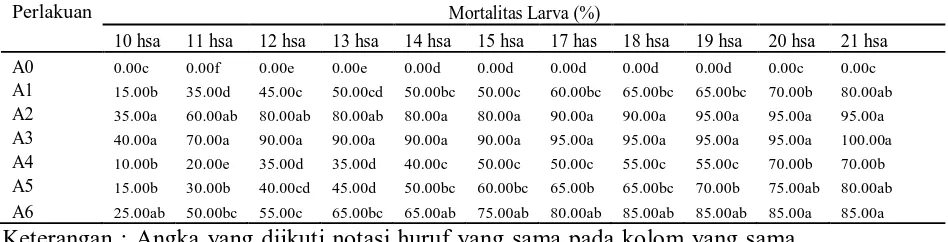
Tabel 1. Beda uji rataan pengaruh aplikasi jamur terhadap mortalitas larva
O. rhinoceros (%) pada pengamatan 10 - 21 hsa.
Perlakuan Mortalitas Larva (%)
10 hsa 11 hsa 12 hsa 13 hsa 14 hsa 15 hsa 17 has 18 hsa 19 hsa 20 hsa 21 hsa Keterangan : Angka yang diikuti notasi huruf yang sama pada kolom yang sama
tidak berbeda nyata pada Uji Jarak Duncan taraf 5%. hsa : hari setelah aplikasi
Tabel 1 menunjukkan bahwa pada pengamatan 10 hari setelah aplikasi mortalitas larva O. Rhinoceros tertinggi terdapat pada perlakuan A3 (diaplikasikan jamur M. anisopliae pada 20 gr media jagung) yaitu sebesar 40.00 % dan terendah pada perlakuan A4 (diaplikasikan jamur C. militaris pada 10 gr media jagung)
sebesar 10.00 %. Pada pengamatan 21 hari setelah aplikasi, mortalitas larva
O. Rhinoceros tertinggi terdapat pada perlakuan A3 (diaplikasikan jamur
perlakuan A4 (diaplikasikan jamur C. militaris pada 10 gr media jagung) sebesar 70.00 %. Hal ini menunjukkan bahwa jamur M. anisopliae lebih efektif digunakan untuk mengendalikan larva O. Rhinoceros dari pada jamur C. militaris. Biasanya jamur entomopatogen bersifat spesifik inang, maksudnya jamur tersebut akan lebih efektif dalam mematikan hama jika hama itu adalah inang sasarannya. Diketahui bahwa jamur M. anisopliae spesifik inang terhadap hama dari ordo Coleoptera terutama O. rhinoceros sedangkan C. militaris spesifik inang terhadap hama ulat api. Hal ini sesuai dengan literatur Prayogo (2006) yang menyatakan bahwa jenis hama yang menyerang tanaman akan menentukan keefektifan cendawan entomopatogen karena setiap jenis cendawan entomopatogen mempunyai inang yang spesifik, walaupun ada pula yang mempunyai kisaran inang cukup luas. Sambiran dan Hosang (2007) menyatakan bahwa walaupun jamur M. anisopliae dapat menginfeksi begitu banyak serangga, ternyata intensitas serangan terbesar dan inang yang terbaik untuk berkembang biak adalah larva O. rhinoceros. Semua stadia O. rhinoceros kecuali telur dapat diinfeksi oleh
jamur ini. Sifat jamur ini yang dapat menginfeksi hampir semua stadia
O. rhinoceros itulah yang menjadi dasar untuk memanfaatkan jamur ini sebagai
agens hayati hama tersebut.
Dari tabel 1 dapat diketahui bahwa jamur M. anisopliae lebih cepat
mematikan larva O. rhinoceros dari pada jamur C. militaris. Hal ini dikarenakan
jamur M. anisopliae dapat berkembang dengan cepat pada inang yang tepat sehingga
jamur ini dapat dengan cepat pula mematikan inang sasarannya. Sesuai dengan
pernyataan Hosang (1990), semua patogen serangga mempunyai spesifik sebaran
mempunyai inang yang sangat spesifik dan ada juga mempunyai sebaran inang yang
luas. Sebaran inang ini penting dalam introduksi patogen tertentu ke habitat baru.
Beda rataan mortalitas larva O. rhinoceros akibat aplikasi jamur entomopatogen M. anisopliae dan jamur C. militaris pada setiap waktu pengamatan dapat dilihat pada grafik garis 1.
Gambar 11: Grafik garis pengaruh aplikasi jamur entomopatogen terhadap mortalitas larva O. rhinoceros (%) pada setiap waktu pengamatan.
Persentase Waktu Munculnya Koloni Jamur Uji Pada Larva O. rhinoceros Yang Terinfeksi
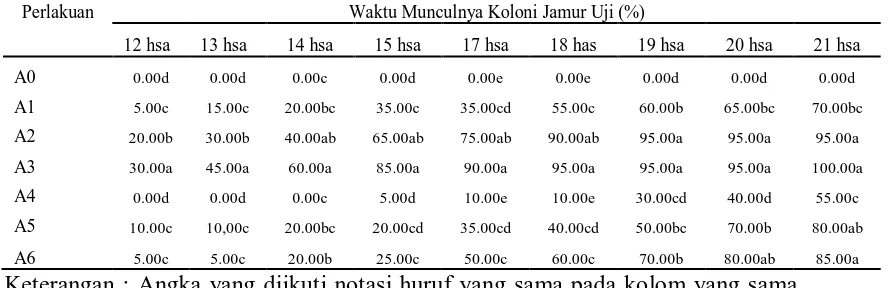
Data pengamatan persentase waktu munculnya koloni jamur uji pada larva
O. rhinoceros yang terinfeksi akibat aplikasi jamur entomopatogen M. anisopliae
terinfeksi. Untuk mengetahui perlakuan yang berbeda nyata tersebut dapat dilihat pada Tabel 2.
Tabel 2. Beda uji rataan pengaruh aplikasi jamur terhadap waktu munculnya koloni jamur uji pada larva O. rhinoceros yang terinfeksi (%) pada pengamatan 12 - 21 hsa.
Perlakuan Waktu Munculnya Koloni Jamur Uji (%)
12 hsa 13 hsa 14 hsa 15 hsa 17 hsa 18 has 19 hsa 20 hsa 21 hsa Keterangan : Angka yang diikuti notasi huruf yang sama pada kolom yang sama
tidak berbeda nyata pada Uji Jarak Duncan taraf 5%. hsa : hari setelah aplikasi
terbentuknya blastospora yang kemudian beredar ke dalam hemolimfa dan membentuk hifa sekunder untuk menyerang jaringan lainnya. Setelah serangga mati, jamur akan terus malanjutkan siklus dalam fase saprofitik, yaitu jamur akan membentuk koloni di sekitar tubuh inang. Setelah tubuh serangga inang dipenuhi oleh koloni jamur, maka spora infektif akan diproduksi.
Tabel 2 menunjukkan bahwa pada pengamatan 12 hari setelah aplikasi, waktu munculnya koloni jamur uji pada larva O. rhinoceros yang terinfeksi tertinggi terdapat pada perlakuan A3 (diaplikasikan jamur M. anisopliae pada 20 gr media jagung) yaitu sebesar 30.00 % dan terendah pada perlakuan A4 (diaplikasikan jamur C. militaris pada 10 gr media jagung) sebesar 0.00%. Pada pengamatan 21 hsa waktu munculnya koloni jamur uji pada larva O. rhinoceros
yang terinfeksi, tertinggi terdapat pada perlakuan A3 (diaplikasikan jamur
M. anisopliae pada 20 gr media jagung) sebesar 100.00 % dan terendah pada
perlakuan A4 (diaplikasikan jamur C. militaris pada 10 gr media jagung) sebesar 55.00 %. Pernyataan diatas menyatakan bahwa koloni dari jamur M. anisopliae lebih cepat muncul, dengan kata lain lebih banyak larva O. rhinoceros yang ditumbuhi jamur M. anisopliae dari pada ditumbuhi jamur C. militaris. Hal ini dikarenakan larva O. rhinoceros merupakan habitat yang cocok untuk jamur
M. anisopliae, sehingga jamur ini dengan cepat memproduksi miseliunya disekitar
tubuh inangnya. Sesuai dengan pernyataan Hosang (1990), yang menyatakan bahwa semua patogen serangga mempunyai spesifik sebaran inang yang mana
mereka bisa survive dan berproduksi.
sesuai dengan warna spora dari jamur yang menginfeksi. Setelah 21 hari setelah aplikasi dapat terlihat jelas bahwa jamur M. anisopliae memunculkan koloni bewarna hijau gelap dan jamur C. militaris memunculkan koloni bewarna putih. Sesuai dengan pernyataan Hosang (1990), yang menyatakan bahwa warna koloni umummya pada serangga inang yang terserang jamur bervariasi, ada yang putih, hijau, merah muda tergantung dari warna spora jamurnya. Inilah ciri dari serangga mati yang terserang jamur.
Untuk melihat beda rataan pengaruh aplikasi jamur terhadap waktu munculnya koloni jamur uji pada larva O. rhinoceros yang terinfeksi pada setiap waktu pengamatan dapat dilihat pada grafik garis 2.
Gejala Serangan Larva O. rhinoceros Yang Terinfeksi Jamur Entomopatogen
Berdasarkan pengamatan yang dilakukan, jamur M. anisopliae
menyebabkan larva O. rhinoceros mati dan terinfeksi. Larva yang mati akibat
aplikasi jamur entomopatogen ini akan mengeras (mumifikasi). Setelah 12 hsa
larva yang terinfeksi akan berubah warna menjadi hijau tua akibat koloni dari
jamur telah tumbuh dan menyebar diseluruh tubuh larva yang telah mengeras. Hal
ini sesuai dengan literatur Ferron (1985) yang menyatakan bahwa pada umumnya semua jaringan dan cairan tubuh seranggga habis digunakan oleh cendawan, sehingga serangga mati dengan tubuh yang mengeras seperti mumi.
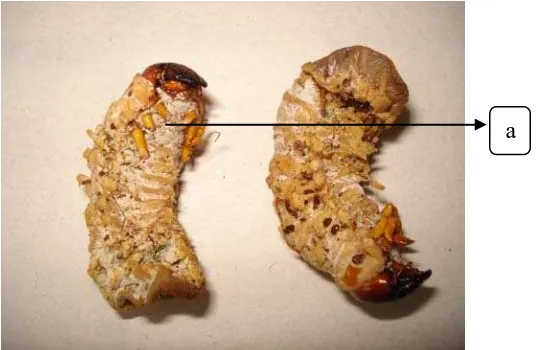
Gambar 13 : Larva O. rhinoceros yang terinfeksi jamur M. anisopliae
(a. Koloni jamur M. anisopliae bewarna hijau tua pada larva
O. rhinoceros yang terinfeksi)
Pada penelitian yang dilakukan larva serangga uji (larva O. rhinoceros)
yang digunakan adalah larva instar akhir (larva instar 3), karena jamur C. militaris
hanya dapat menginfeksi hama dalam stadia kepompong ataupun stadia larva
instar akhir. Larva instar akhir yang terinfeksi juga akan mengalami mumifikasi
dan setelah beberapa hari akan tumbuh koloni jamur bewarna putih disekitar
tubuh larva tersebut. Hal ini sesuai dengan pernyataan Purba dkk (1986) yang
menyatakan bahwa C. militaris dapat menyerang larva instar akhir maupun pupa
yang ditandai dengan munculnya miselium berwarna putih dan mengalami
mumifikasi.
Gambar 14: Larva O. rhinoceros yang terinfeksi jamur C. militaris.
(a. Koloni jamur C. militaris bewarna putih pada larva
O. rhinoceros yang terinfeksi)
Berdasarkan pengamatan yang dilakukan, terlihat bawha larva
O. rhinoceros yang mati akibat jamur entomopatogen ini akan berada pada bagian
atas media makan larva. Hal ini termasuk salah satu ciri larva yang mati akibat pengaplikasian jamur entomopatogen. Sesuai dengan literatur yang dinyatakan oleh Priyanti (2009) yang menyatakan bahwa ada ciri prilaku yang terjadi dikenal sebagai summit disisase, dimana serangga yang mati karena jamur entomopatogen menunjukkan prilaku akan naik ke permukaan atas tanamandan melekatkan diri disana. Fenomena ini oleh beberapa pakar dikatakan sebagai usaha untuk menyelamatkan populasi lain yang sehat dari infeksi jamur entomopatogen.
Foto Mikrograf Jaringan Larva O.rhinoceros Yang Terinfeksi Jamur Entomopatogen
Adapun perbandingan histologi larva O. rhinoceros yang terinfeksi jamur entomopatogen pada perlakuan 21 hsa yang dilihat di bawah mikroskop dengan perbesaran 10 x 40 mewakili semua perlakuan, dapat dilihat pada gambar di bawah ini:
Gambar 15 : Foto mikrograf jaringan larva pada perlakuan kontrol (A0) (a: kutikula larva, b: jaringan epidermis, c: haemolimfa larva)
Pada gambar 15 di atas, dapat dilihat bahwa pada perlakuan A0 (kontrol) keadaan histologi dari larva O. rhinoceros masih dalam keadaan sehat dan masih
utuh. Tampak pada gambar kutikula dari larva, jaringan epidermis hingga ke haemolimfa larva masih dalam keadaan sehat dan bagus. Hal ini dikarenakan pada perlakuan kontrol larva O. rhinoceros tidak diaplikasikan jamur entomopatogen, sehingga larva tetap dalam keadaan sehat sampai diakhir penelitian.
Gambar 16 : Foto mikrograf jaringan larva pada perlakuan A1 (a : konidia, b: miselium, c: kutikula, d: epidermis, e: haemolimfa)
Pada gambar 16 diatas, dapat dilihat bahwa pada perlakuan A1 (diaplikasikan jamur M. anisopliae pada 10 gr media jagung), keadaan histologi larva O. rhinoceros sudah terinfeksi oleh jamur M. anisopliae. Tampak pada histologi larva O. rhinoceros adanya miselium yang telah menyebar dan telah tumbuh konidia dari jamur entomopatogen. Telah terbentuknya konidia dari jamur ini menyatakan bahwa satu siklus hidup dari jamur entomopatogen ini telah terjadi.
Gambar 17 : Foto mikrograf jaringan larva pada perlakuan A2 disebelah kiri (a: konidia yang terlepas, b: miselium, c: kutikula, d: epidermis, e: haemolimfa) dan perlakuan A3 disebelah kanan (a: konidia yang terlepas, b: miselium, c: kutikula,
d: epidermis, e: haemolimfa)
Pada gambar 17 diatas, dapat dilihat bahwa pada perlakuan A2
(diaplikasikan jamur M. anisopliae pada 15 gr media jagung), keadaan larva
O. rhinoceros sudah terinfeksi oleh jamur M. anisopliae. Tampak pada perlakuan
A2 keadaan kutikula hingga ke haemolimfa larva O. rhinoceros sudah terinfeksi dan dalam keadaan rusak, dikarenakan miselium jamur memproduksi enzim yang mampu menghancurkan kutikula serangga. Sedangkan pada perlakuan A3
(diaplikasikan jamur M. anisopliae pada 20 gr media jagung), keadaan larva
O. rhinoceros juga terinfeksi, bahkan dalam keadaan lebih parah, karena miselium
konsentrasi jamur yang diamplikasikan lebih banyak dari pada perlakuan A5. Pada kedua gambar diatas tampak bahwa jamur telah membentuk konidia dan bahkan konidia telah terlepas dan menyebar. Hal ini menyatakan bahwa jamur entomopatogen telah menyelesaikan satu siklus hidupnya dan akan bereproduksi lagi membentuk propagul baru dan propagul ini nantinya akan mencari inang lain, dengan kata lain propagul ini akan kontak dengan inang baru dan akan menginfeksi inang yang baru. Sesuai dengan literatur yang dinyatakan oleh Priyanti (2009), yang menyatakan bahwa untuk menyelesaikan secara lengkap siklus hidupnya, maka kebanyakan pathogen harus kontak dengan iangnya, kemudian masuk ke dalam tubuh inang, bereproduksi di dalam satu atau lebih jaringan inang dan menghasilkan propagul untuk kontak dan menginfeksi inang baru.
Pada perlakuan A4 (diaplikasikan jamur C. militaris pada 10 gr media jagung). Keadaan histologi larva O. rhinoceros pada perlakuan ini telah terinfeksi oleh jamur C. militaris. Tampak pada gambar bahwa terdapat miselium pada kutikula dan epidermis larva, sedangkan jaringan yang lebih dalam hingga ke haemolimfa masih terlihat bagus. Dapat dilihat pada gambar di bawah ini:
Gambar 18: Foto mikrograf jaringan larva pada perlakuan A4 (a: miselium, b: kutikula, c: epidermis, d: haemolimfa)
Pada perlakuan A5 (diaplikasikan jamur C. militaris pada 15 gr media jagung dapat dilihat bahwa miselium jamur entomopatogen telah menyebar pada bagian kutikula, epidermis hingga haemolimfa. Sedangkan pada perlakuan A6 (diaplikasikan jamur C. militaris pada 20 gr media jagung), tampak jelas bahwa
miselium dari jamur lebih banyak menyebar keseluruh jaringan larva
O. rhinoceros, mulai dari kutikula hingga ke jaringan yang paling dalam. Pada
kedua perlakuan ini juga tampak bahwa jamur telah membentuk konidia yang berarti bahwa jamur telah menyelesaikan satu siklus hidupnya dan telah bereproduksi membentuk propagul baru yang telah siap untuk menginfeksi inang yang baru. Dapat dilihat pada gambar di bawah ini:
Gambar 19 : Foto mikrograh jaringan larva pada perlakuan A5 disebelah kiri (a: konidia yang telah terlepas, b: miselium, c: kutikula, d: epidermis, e: haemolimfa) dan pada perlakuan A6 (a: konidia yang telah terlepas,
b: miselium, c: kutikula, d: epidermis)
Dari hasil pengamatan histologi larva O. rhinoceros, dapat dilihat bahwa pada perlakuan A0 (kontrol) jaringan larva masih dalam keadaan normal. Sedangkan pada perlakuan A1, A2, A₃, A4, A₅, A₆ (yang telah diaplikasikan jamur entomopatogen), dapat dilihat pada gambar bahwa jaringan larva telah diinfeksi oleh jamur entomopatogen yang ditandai dengan ditemukannya miselium jamur
KESIMPULAN DAN SARAN
Kesimpulan
1. Persentase mortalitas larva tertinggi akibat aplikasi jamur entomopatogen
pada pengamatan 21 hsa adalah pada perlakuan A3 (diaplikasikan jamur
M. Anisopliae pada 20 gr media jagung)sebesar 100.00 % dan terendah pada perlakuan A4 (diaplikasikan jamur C. Militaris pada 10 gr media jagung) sebesar 70.00 %.
2. Persentase tertinggi waktu munculnya koloni jamur uji pada larva
O. rhinoceros yang terinfeksi pada pengamatan 21 hsa adalah pada perlakuan
A3 (diaplikasikan jamur M. Anisopliae pada 20 gr media jagung) sebesar 100.00 % dan terendah pada perlakuan A4 (diaplikasikan jamur C. Militaris pada 10 gr media jagung) sebesar 55.00 %.
3. Gejala serangan larva O. rhinoceros yang terinfeksi jamur M. anisopliae
yaitu larva mengeras dan akan muncul koloni jamur bewarna hijau tua di sekitar tubuh larva. Sedangkan larva yang terinfeksi jamur C. militaris di sekitar tubuhnya akan muncul koloni jamur bewarna putih.
4. Pada foto mikrograf jaringan larva yang terinfeksi jamur entomopatogen dapat terlihat bahwa miselium jamur telah menyebar di jaringan epidermis larva hingga ke jaringan yang lebih dalam.
Saran
DAFTAR PUSTAKA
Alexopoulus, C. J, C.W. Mims, and M. Blackwell. 1996. Introductory Mycology Fourth Edition. John Wiley and Sons Inc, New York.
Bidochka, M.J., A.M. Kamp. 2000. Insect Pathogenic Fungi: from genes to populations. Fungal Pathol, 171 – 193. Diunduh dari :
tanggal 30 Juni 2010).
Darmadi, Didi. 2008. Pertanian Pembanguan (SPP) N Kepahiang, Bengkulu. Diunduh dari http://mablu.wordpress.com/2008/01/24/hama-dan-penyakit-tanaman-kelapa-sawit. Diakses tanggal 30 Juni 2010.
Fauzi, Yan. Widyastuti, Y.E. Imam Satyawibawa dan Rudi Hartono., 2002. Kelapa Sawit. Edisi Revisi. Penebar Swadaya, Jakarta.
Ferron, P. 1985. Fungal Control. Comprehensive Insect Phisiology. Biochem
Pharmacol. (12) : 313 – 346. Diunduh dari:
tanggal 30 Juni 2010).
Freimoser, F.M., S. Screen, S. Bagga, G. Hu, and R.J. St. Leger. 2003. Expressed Sequence Tag (EST) Analysis of Two Subspecies of Metarhizium
anisopliae Reveals a Plethora of Secreted Proteins with Potential Activity
in Insect Hosts. Diunduh dari: tanggal 30 Juni 2010).
Hall, T.M. 1973. Use of microorganisms in biological control. Dalam Yusmani Prayogo, Wedanimbi Tengkano, dan Marwoto. Prospek Cendawan Entomopatogen Metarhizium anisopliae Untuk Mengendalikan Ulat Grayak Spodoptera litura Pada Kedelai. Balai Penelitian Tanaman Kacang-kacangan dan Umbi-umbian, Malang.
Holliday, J., M. Cleaver, dan S. P. Wasser, 2005. Cordyceps. Encyclopedia of Dietary Supplements, November 2005. pp. 1-13.
Hosang, M. L., 1990. Pengendalian Hayati O. rhinoceros dengan M.anisopliae dalam Prossiding Simposium I Hasil Penelitian dan Pengembangan Tanaman Industri, Badan Penelitian dan Pengembangan Pertanian. Pusat Penelitian dan Pengembangan Tanaman Industri, Bogor. 375 hal.
Kartasapoetra, A.G., 1993. Hama Tanaman Pangan dan Perkkebunan. Bumi Aksara,Jakarta.
Kuo, M., 2006. Cordiceps militaris. Retrived From The Mushroom Expert.com.Website:http//www.mushroomexpert.com/cordyceps_militari s.html. Diakses tanggal 25 Juli 2010.
Kusnaedi, 1997., 1997. Pengendalian Hama Tanpa Pestisida. Penebar Swadaya, Jakarta.
Lever, R.J.A.W., 1969. Pests Of The Coconut Palm. Food and Agriculture Organization Of The United Nations, Rome.
Mahmud Z, 1989. Pengendalian Kumbang kelapa secara terpadu, Balai Penelitian Kelapa, Menado. 29 hal.
Pohan, Iyung. 2006. Panduan Lengkap Kelapa Sawit. Manajemen Agribisnis dari Hulu hingga Hilir. Penebar Swadaya, Jakarta.
Prawirosukarto, S, Aini, Ginting dan Papierok. 1996. Pengembangan
Cordyceps militaris Untuk Pengendalian UPDKS. Jurnal Penelitian
Kelapa sawit Indonesia. Medan.
Prawirosukarto, S., Y.P. Rocetha., U. Condro., dan Susanto., 2003. Pengenalan dan Pengendalian Hama dan Penyakit Tanaman Kelapa Sawit. PPKS, Medan.
Prayogo, Y., 2006. Upaya Memprtahankan Keefektifan Cendawan Entonopatogen Untuk Mengandalikan Hama Tanaman. Jurnal Litbang Pertanian. 25(2):47-54. Balai Penelitian Tanaman Kacang-Kacangan dan Umbi-Umbian, Malang.
Priyanti, Sri. 2009. Kajian Patogenitas Cendawan Metarhizium anisopliae Pada Media Koalin Untuk Pengendalian Hama Oryctes rhinoceros. Dalan Prosiding Simposium I. Badan Penelitian dan Pengembangan Pertanian Pusat Penelitian, Bogor.
Purba, S., A. Sipayung dan R. Desmier de Chenon, 1989. Kemungkinan Pengendalian Serangga Hama Pada Tanaman Kelapa Sawit Secara hayati. Biological Control Posibilities Of Insect Pest Of Oil Palm. Prosiding Temu Ilmu Ilmiah Entomologi Perkebunan Indonesia Cabang Sumatera Utara-Aceh. Pusat Penelitian Marihat, pematang Siantar. Rismansyah, E.A., 2010. Teknik Penentuan Strain Metarizhium anisopliae
Sambiran, W.J dan Hosang, M.L.A., 2007. Patogenisitas Metarhizium anisopliae dari Beberapa Media Air Kelapa Terhadap Oryctes rhinoceros L. Balai Penelitian Tanaman Kelapa dan Palma Lain. Dalam Buletin Palma No. 32.
Schgal, A.K and A. Sagar., 2006. In Vitro Isolation And Influence Of Nutrional Conditions On The Mycelia Growth Of The Enthomopathogenic And Medicinal Fungus Cordyceps militaris. Plant Pathology Journal 5 (3): 315-32.
Siswanto, 2003. Baku Operasional Pengendalian Hama Terpadu (BO-PHT). Dinas Perkebunan Propinsi Jawa Tengah, Ungaran. 40 hal.
Suhardiyono, L., 1988. Tanaman Kelapa. Budidaya dan Pemanfaatannya. Penerbit Kanisius, Yogyakarta.
Sunarko. 2007. Petunjuk Praktis Budidaya & Pengolahan Kelapa Sawit. Agromedia Pustaka, Jakarta.
Tanada, Y and Harry, K.K., 1993. Insect Pathology. Academic Press, inc., New York.
Tim Penulis PS., 1997. Kelapa Sawit. Penebar Swadaya, Jakarta.
Untung, K. 1993. Pengantar Pengelolaan Hama Terpadu. Gadjah Mada University Press.
Van den Bosch, Messenger, P.S, and A.P. Guitierrez., 1973. An Introduction Biological Control. Plenum Press, New York and London.
Wibowo, H., A. Sipayung, dan R. Desimer De Chenon, 1994. Teknik perbanyakan cendawan Cordicep sp. Untuk pengendalian Setothosea
asigna Moore (Lepidoptera; Limacodidae). Buletin PPKS 1994, Vol. 2,