PERANAN ZONA PELUSIDA
DALAM MENAHAN INFEKSI PENYAKIT
PADA KASUS
ESCHERICHIA COLI
K99
I WAYAN BATAN
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
DAFTAR TABEL ix
DAFTAR GAMBAR x
DAFTAR LAMPIRAN xi
1 PENDAHULUAN 1
1.1 Latar Belakang ……… 1
1.2 Tujuan Penelitian……… 4
1.3 Manfaat hasil penelitian………. 4
2 TINJAUAN PUSTAKA 5 2.1 Infeksi embrio oleh agen patogenik………. 6
2.2 E.coli K99 penginfeksi embrio……….. 7
2.3 Zona pelusida pelindung sel-sel embrio……….... 8
2.4 Peranan zona pelusida sebagai barier embrio terhadap bakteri patogen ………... 12
2.5 Kriopreservasi embrio………. 13
2.6 Embrio transfer dan penularan penyakit……….. 15
3 PENGUNGKAPAN PERLEKATAN ESCHERICHIA COLI K99 PADA ZONA PELUSIDA DENGAN TEKNIK ELISA DAN SEM 17 3.1 PENDAHULUAN ………. 17
3.2 MATERI DAN METODE ……… 18
3.2.1 Penyiapan bakteri E.coli K99 dan serum……… 18
3.2.2 Pemanenan embrio……… 18
3.2.3 Penyiapan reagen-reagen ELISA……… 19
3.2.4 Prosedur ELISA………. 20
3.2.5 Prosedur pemeriksaan mikroskop elektron ……….. 21
3.3 HASIL DAN PEMBAHASAN ……….. 22
3.4 SIMPULAN……….. 25
3.5 SARAN ……… 25
4 PERANAN ZONA PELUSIDA SEBAGAI BARIER TERHADAP CEMARAN ESCHERICHIA COLI K99 26 4.1 PENDAHULUAN……….. 26
4.2 MATERI DAN METODE ……….. 27
4.2.1 Superovulasi dan panen embrio ………. 27
4.2.2 Penghilangan zona pelusida ……… 28
4.2.3 Penyiapan bakteri E.coli K99 ……….. 28
4.2.4 Pemaparan embrio terhadap E.coli K99 ……… 28
4.2.5 Rancangan percobaan ………. 29
4.3 HASIL DAN PEMBAHASAN ……… 29
4.4 SIMPULAN ………. 36
4.5 SARAN ………. 36
5 PERKEMBANGAN EMBRIO MENCIT YANG DICEMARI ESCHERICHIA COLI K99 SETELAH PERLAKUAN TRIPSIN ATAU PRONASE 38 5.1 PENDAHULUAN ………. 38
5.2 MATERI DAN METODE ……….. 39
5.2.1 Superovulasi dan panen embrio ………. 39
5.2.2 Penyiapan bakteri E.coli K99 ……….. 39
5.2.3 Pencemaran embrio dengan E.coli K99 ……… 39
5.2.4 Rancangan percobaan... 40
5.3 HASIL DAN PEMBAHASAN ……….. 41
K99 DENGAN METODE KRIOLUP 49
6.1 PENDAHULUAN ………. 49
6.2 MATERI DAN METODE ……….. 50
6.2.1 Superovulasi dan panen embrio ………. 50
6.2.2 Pembuatan cryoloop (Kriolup) ………. 50
6.2.3 Teknik vitrifikasi kriolup ………... 50
6.2.4 Warming blastosis ………... 51
6.2.5 Viabilitas embrio sesudah vitrifikasi ……… 52
6.2.6 Pewarnaan vital ……….... 52
6.2.7 Penyiapan bakteri dan pemaparan embrio terhadap bakteri E.coli K99 ………... 52
6.2.8 Rancangan percobaan ……….... 53
6.3 HASIL DAN PEMBAHASAN ………... 53
6.4 SIMPULAN ……….. 62
6.5 SARAN ……….... 63
7 KEBUNTINGAN HASIL TRANSFER BLASTOSIS MENCIT YANG DIBEKUKAN DENGAN METODE VITRIFIKASI KRIOLUP 64 7.1 PENDAHULUAN ………. 64
7.2 MATERI DAN METODE ……….. 65
7.2.1 Penyiapan donor dan resipien……….. 65
7.2.2 Pembuatan kriolup ……… 66
7.2.3 Teknik vitrivikasi kriolup ……… 66
7.2.4 Warming blastosis ……….. 66
7.2.5 Penilaian viabilitas blastosis... 67
7.2.6 Teknik transfer embrio ……….. 67
7.2.7 Rancangan percobaan……….. 68
7.3 HASIL DAN PEMBAHASAN ………... 68
7.4 SIMPULAN ……….. 72
7.5 SARAN ……….. 72
8 PEMBAHASAN UMUM... 73
9 SIMPULAN... 82
10 DAFTAR PUSTAKA... 84
Tabel 3.1 Rataan kepadatan optik hasil ELISA antara zonapelusida mencit dengan berbagai jenis bakteri
E. coli asal hewan
23
Tabel 4.1 Tingkat perkembangan embrio setelah dicemari bakteri E.coli K99 dan diinkubasi selama 24 jam
33
Tabel 5.1 Perkembangan embrio delapan sel yang dicemari
E.coli K99, kemudian dibasuh dengan pronase, tripsin, atau pronase
42
Tabel 5.2 Tingkat perkembangan embrio yang dicemari E.coli
K99 pascaperlakuan pembasuhan, setelah 48 jam inkubasi
43
Tabel 7.1 Persentase blastosis vitrifikasi yang berkembang ke tahap perkembangan lebih lanjut
Gambar 3.1 Perlekatan E.coli K99 pada zona pelusida melalui
pengamatan SEM (Scanning Electron Microscopy). ... 24
Gambar 4.1 Perkembangan embrio yang tidak dan memiliki zona pelusida (zp) dalam medium kultur yang dicemari
E.coli K99 ... 31
Gambar 4.2 Viabilitas embrio perlakuan selama 24 jam kultur in
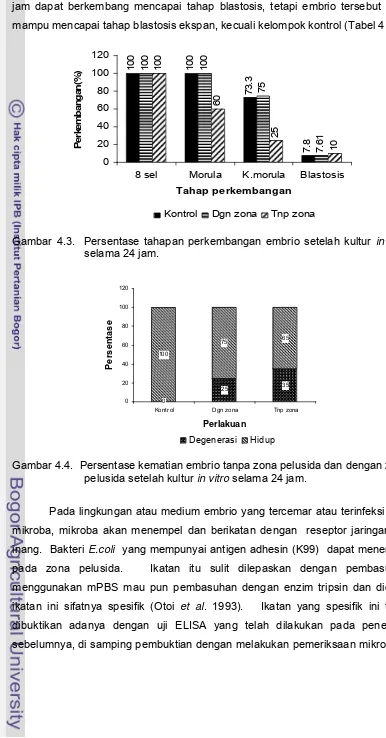
vitro dalam KSOM... 32 Gambar 4.3 Persentase tahapan perkembangan embrio setelah
kultur in vitro selama 24 jam ……… 33
Gambar 4.4 Persentase kematian embrio tanpa zona pelusida dan dengan zona pelusida setelah kultur in vitro selama
24 jam………... 34
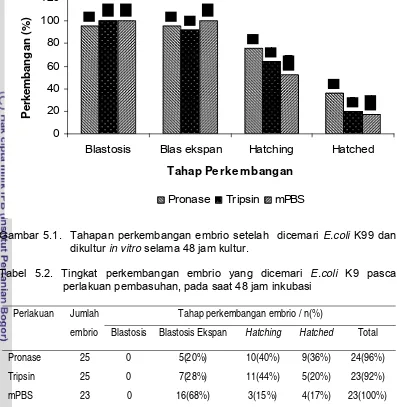
Gambar 5.1 Tahapan perkembangan embrio setelah dicemari
E.coli K99 dan dikultur in vitro selama 48 jam kultur.. 43
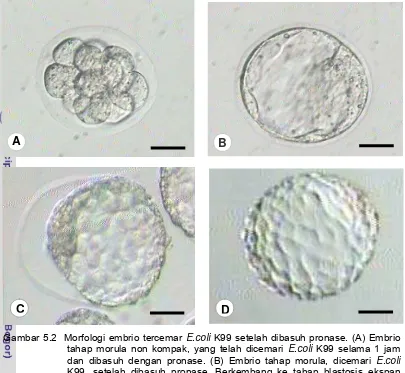
Gambar 5.2 Morfologi embrio tercemar E.coli K99 setelah dibasuh mPBS tripsin atau pronase ... 45
Gambar 6.1 Kriolup yang dipakai dari bahan kawat tembaga, yang
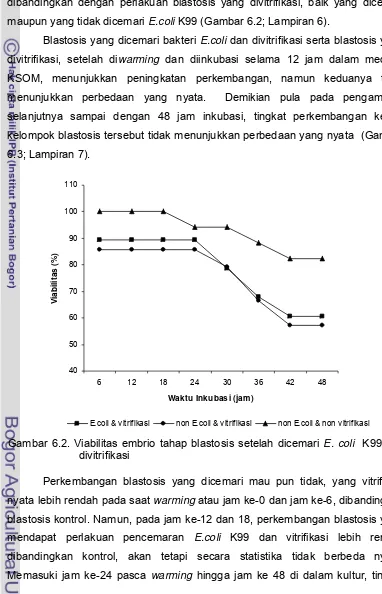
digunakan untuk vitrifikasi ... 51 Gambar 6.2 Viabilitas embrio tahap blastosis setelah dicemari
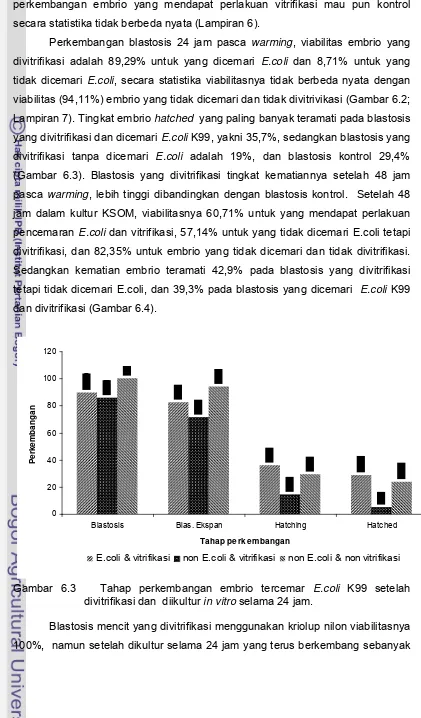
E.coli K99 dan divitrifikasi... 54 Gambar 6.3 Tahap perkembangan embrio tercemar E.coli K99
setelah divitrifikasi dan diikultur in vitro selama 24
jam... 55
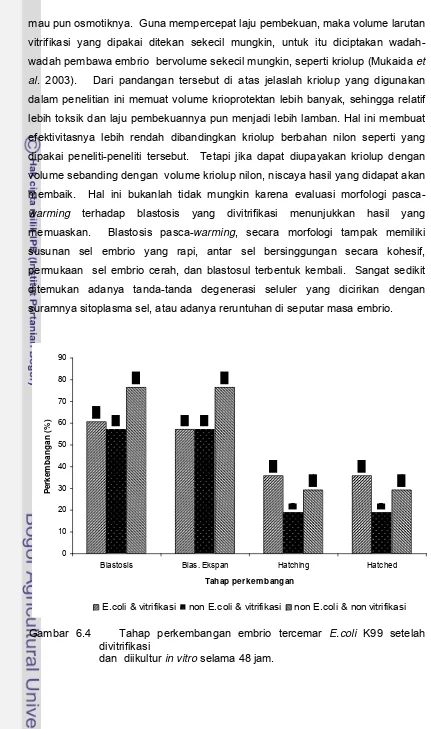
Gambar 6.4 Tahap perkembangan embrio tercemar E. coli K99 setelah divitrifikasi dan diikultur in vitro selama 48
jam... 57
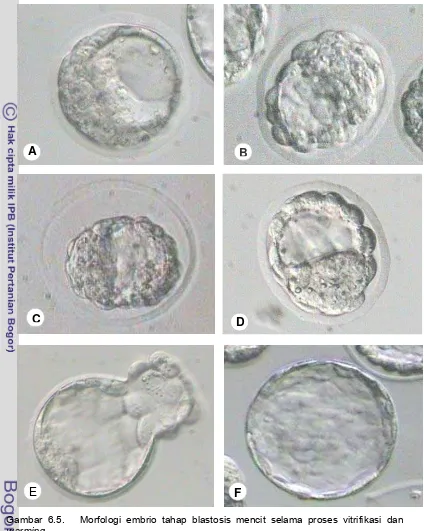
Gambar 6.5 Morfologi blastosis selama proses vitrifikasi dan
warming... 60
Gambar 6.6 Embrio setelah vitrifikasi. Diwarnai dengan pewarna vitalHoechts-propidium iodine. Warna hijau berpendar menandakan sel embrio hidup, sedangkan yang merah menandakan sel embrio tersebut mati. ... 61
Gambar 7.1 Blastosis vitrifikasi yang berkembang ke tahap
selanjutnya...
69
Gambar 7.2 Pewarnaan vital embrio setelah vitrifikasi dengan metode kriolup. Sel-sel embrio yang bertahan hidup
Lampiran 1 Medium kultur embrio in vitro... 95
Lampiran 2 Medium untuk mengembangkan bakteri E.coli K99 97
Lampiran 3 Penyiapan reagen untuk uji ELISA... 98 Lampiran 4 Medium vitrifikasi dan warming... 100
Lampiran 5 Skor perkembangan embrio setelah dicemari E.coli
K99 kemudian dibasuh mPBS, tripsin, dan
pronase... 101
Lampiran 6 Skor perkembangan embrio tahap blastosis yang dicemari E.coli K99 dan divitrifikasi setelah
warming... 101
Lampiran 7 Persentase perkembangan in vitro embrio delapan sel yang tercemar E.coli K99, kemudian dibasuh
dengan pronase, tripsin, atau mPBS... 102 Lampiran 8 Persentase blastosis vitrifikasi yang berkembang
PERANAN ZONA PELUSIDA
DALAM MENAHAN INFEKSI PENYAKIT
PADA KASUS
ESCHERICHIA COLI
K99
I WAYAN BATAN
Disertasi
Sebagai salah satu syarat untuk memperoleh gelar Doktor
pada Program Studi Sains Veteriner
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Disertasi
penyakit, pada kasus
Escherichia coli
K99
Nama
: I Wayan Batan
NIM
: B 161 030 031
Disetujui Komisi Pembimbing
drh Arief Boediono, Ph.D Ketua
Dr.drh. Ita Djuwita, M.Phil Anggota
Prof. Dr. drh. Bibiana W. Lay, M.Sc. Anggota
Dr. Supar, MS. APU Anggota
Diketahui
Ketua Program Studi Sains Veteriner Dekan Sekolah Pascasarjana
Penulis lahir di Bali, beberapa bulan sebelum Gunung Agung meletus. Penulis dilahirkan dari Ibu Ni Luh Rinang, 27 Februari 1960, dan ayah I Made Radin. Pendidikan sarjana ditempuh di Fakultas Kedokteran Hewan (Kampus Taman Kencana) Institut Pertanian Bogor (IPB), lulus pada tahun 1986. Pada tahun 1990 penulis dengan beasiswa Tim Manajemen Program Doktor (TMPD) diterima pada Program Studi Sains Veteriner Program Pascasarjana IPB dan menyelesaikan pendidikannya pada tahun 1993. Penulis kembali diterima dengan beasiswa Bantuan Pendidikan Pascasarjana (BPPS) pada perguruan tinggi yang sama untuk melanjutkan program doktor. Penulis bekerja sebagai pengajar pada Fakultas Kedokteran Hewan (FKH) Universitas Udayana, Bali. Bidang yang diasuh adalah diagnosis klinik dan penyakit dalam.
Selama mengikuti program doktor, penulis setahun mendapat dana penelitian hibah bersaing 13 dari depdiknas. Salah satu artikel penulis yang berjudul: Pemanfaatan ELISA dan SEM guna mengungkap perlekatan bakteri
I WAYAN BATAN. Peranan zona pelusida dalam menahan infeksi penyakit, pada kasus Escherichia coli K99. Di bawah bimbingan: ARIEF BOEDIONO, BIBIANA W. LAY, ITA DJUWITA, dan SUPAR.
Tindakan yang dilakukan untuk membebaskan embrio dari patogen tertentu dapat dilakukan dengan melakukan penapisan terhadap kesehatan donor embrio dengan memberikan perlakuan pembasuhan/pencucian dengan atau tanpa tripsin terhadap embrio yang dipanen. Tindakan sanitasi yang direkomendasikan oleh the International Embryo Transfer Society tidak selalu efektif untuk mengatasi cemaran embrio, hal ini menguatkan dugaan bahwa embrio tersebut menularkan penyakit. Hingga kini di Indonesia belum ada laporan tentang peranan zona pelusida embrio dalam menahan infeksi yang disebabkan oleh E.coli K99. Untuk itu penelitian ini ditujukan untuk: 1) menguji kemampuan E.coli K99 melekat secara spesifik ke permukaan zona pelusida; 2) menguji zona pelusida menahan infeksi E.coli K99; 3) membuktikan efekivitas pencucian enzim terhadap perlekatan E.coli K99, dan 4) menguji metode vitrifikasi kriolup terhadap viabilitas embrio dan E.coli K99 secara in vitro dan in vivo.
Mencit digunakan untuk memproduksi embrio model mamalia. Embrio dicemari dengan E.coli K99 pada konsentrasi 103CFU/ml. Perlekatan E.coli K99 ke permukaan zona pelusida diperiksa dengan ELISA (enzyme linked immunosorbent assay) dan diamati dengan SEM (scanning electron microscopy). Peranan zona pelusida dalam perlindungan embrio terhadap infeksi E.coli K99 diteliti dengan mencemari embrio dalam medium KSOM (kalium simplex optimized medium). Embrio yang dicemari dicuci dengan mPBS (modified phosphate buffer saline), tripsin, atau pronase untuk menghilangkan pencemar. Vitrifikasi kriolup terhadap embrio yang dicemari diteliti dengan mengamati viabilitas embrio dan bakteri secara in vitro dengan mengkultur pada KSOM dan
in vivo dengan teknik embrio transfer.
Perlekatan E.coli K99 ke permukaan zona pelusida ditunjukkan oleh adanya kepadatan optik pada sumuran ELISA yang dilapisi (coating) dengan ekstrak zona pelusida yang nyata lebih tinggi dibandingkan dengan tipe E.coli lainnya. Bukti tersebut didukung pula oleh hasil pemeriksaan SEM, E.coli K99 teramati melekat pada permukaan zona pelusida. Zona pelusida mampu melindungi embrio terhadap bakteri dan E.coli K99 tidak melekat ke sel-sel embrio, berbeda dengan embrio tanpa zona pelusida. E.coli K99 yang melekat ke permukaan zona pelusida embrio dapat dicuci secara efektif dengan enzim pronase (0,25%; 60 detik). Viabilitas embrio yang dicemari E.coli K99 baik in vitro mau pun in vivo pasca vitrifikasi tidak berbeda nyata dengan yang tidak dicemari E.coli K99.
Embrio yang memiliki zona pelusida utuh dan divitrifikasi menggunakan
I WAYAN BATAN. Zona pellucida as a barrier of infectious disease: A case study on K99 Escherichia coli. Under the direction of ARIEF BOEDIONO, BIBIANA W. LAY, ITA DJUWITA, and SUPAR
The production of specific-pathogen free embryo could be done by testing the health status of embryo producing animals before and after embryo collections and or combination of both methods. However, PBS washing and trypsin treating of embryo recomended by the International Embryo Transfer Society are relatively ineffective and still creates transffering pathogens.
The aim of these studies were to observe: 1) the attachment of K99 E.coli
on the surface of embryos zona pellucida; 2) the role of zona pellucida on embryos protection against infectious agent (K99 E.coli); 3) the effect of enzyme washing on attached K99 E.coli on embryo zona pellucida surface; and 4) the effect of cryopreservation using cryoloop vitrification method on in vitro and in vivo viability of embryos and K99 E.coli.
Mice were used to produce embryos. Embryos were contaminated with K99 E.coli at concentration of 103CFU/ml. The E.coli attachment on zona pellucida surfaces were observed by means of scanning electron microscopy (SEM) and enzyme linked immunosorbent assay (ELISA). The presence of embryos protection against E.coli was investigated by culturing contaminated embryos in kalium simplex optimized medium (KSOM). The contaminated embryo, were washed using mPBS, trypsin, or pronase to eliminate the contaminant. The cryoloop vitrification of contaminated embryos were investigated by its viability in vitro by culturing in KSOM as well as in vivo by embryo transfer method. The attachment of K99 E.coli on zona pellucida demonstrated the presence of optical density of ELISA wells coated with zona pellucida were significantly higher than that of the other E.coli types. This was supported by SEM result where E.coli were observed attaching directly on the surface of the zona pellucida. Zona pellucida protects the embryos against bacteria and the bacteria did not attach to the cells of embryos vice versa with the non intact zona pellucida embryos. The attached bacteria on the surface of zona pellucida could effectively washed by pronase (0.25%; 60 seconds). The post vitrification viability of cryopreserved K99 E.coli contaminated embryos were not significantly different with the non contaminated group of embryos.
Embryos with or without zona pellucida contaminated or not contaminated by K99 E.coli and vitrified using copper wire cryoloop could transfered and were delivered healthy. Zona pellucida could protect cells of embryos against K99
Dengan ini saya menyatakan bahwa, disertasi yang berjudul:
“Peranan zona pelusida dalam menahan infeksi penyakit, pada kasus
Escherichia coli K99” adalah karya saya sendiri di bawah arahan komisi
pembimbing dan belum pernah diajukan dalam bentuk apa pun kepada
perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip, baik
dari karya yang diterbitkan mau pun tidak diterbitkan oleh penulis lain, telah
disebutkan dalam naskah dan dicantumkan di dalam daftar pustaka di bagian
akhir dari disertasi ini. Demikian pernyataan ini saya buat dengan penuh rasa
tanggung jawab.
Bogor, Pebruari 2007
Tulisan ini adalah hasil penelitian kami pada paruh waktu terakhir masa sekolah di Sekolah Pascasarjana IPB. Penelitian ini merupakan perpaduan antara embriologi (embrio mencit), bakteriologi (Escherichia coli K99), dan klinik, yang membuka peluang penelitian-penelitian sejenis di Indonesia. Di samping itu penelitian ini bagi kami melahirkan pula banyak masalah yang segera harus dipecahkan dan digarap terutama dalam hal penguasaan teknik manipulasi embrio, penyiapan bakteri, kultur embrio in vitro, menelaah makalah-makalah pada berbagai jurnal, dan mengupayakan dana penelitian. Dengan tulisan ini kami ingin menyumbang sedikit fikiran dengan medium dan cara kami ini, yang tentu saja dengan harapan besar, semoga sumbangsih ini sedikit atau banyak punya arti yang konstruktif bagi bidang kedokteran, khususnya kedokteran hewan di Indonesia.
Tulisan ini menjadi kenyataan karena bantuan dari lembaga dan perseorangan. Pertama-tama kami menyatakan terima kasih kepada Lab Diagnosis Klinik dan Penyakit Dalam, Fakultas Kedokteran Hewan Universitas Udayana Bali, Dekan FKH dan Rektor Unud atas kesempatan yang diberikan, Dirjen Dikti Depdiknas yang membiayai studi kami, Hibah Bersaing XIII yang membiayai sebagian penelitian, Lab Embriologi FKH IPB, Lab Terpadu FKH IPB, Lab Terpadu Kitwan FKH IPB, Lab Mikrobiologi Balai Penelitian Veteriner Bogor, LabBiosains FMIPA Univesitas Indonesia Salemba Jakarta, yang memungkinkan riset ini berlangsung selama masa bersekolah. Ucapan terima kasih juga ditujukan kepada drh Putu Wirat, KG Suaryana, Prof IB Arka, Prof IGP Suweta, Prof NS Dharmawan, Prof DKH Putra, yang telah memberi dorongan dengan caranya masing-masing. Selanjutnya saya menyampaikan terima kasih kepada seluruh staf Klinik Hewan FKH Unud yang telah mengambilalih kewajiban dan tugas-tugas kami selama ditinggal bersekolah.
Saya merasa berhutang budi kepada para pembimbing. Kepada Dr Arief Boediono dan Dr Ita Djuwita yang telah membukakan jalan dan mendorong untuk melakukan eksperimen cemaran embrio. Kepada mereka saya ucapkan terima kasih atas inspirasi yang diberikan beserta bimbingan dalam teknik manipulasi embrio dan kultur embrio. Kepada Dr Supar MS APU, saya merasa sangat dibantu, karena beliau membimbing dengan sepenuh hati dalam pemeriksaan ELISA, di samping dengan hati-hati dan seksama membaca naskah laporan saya. Beliau mengingatkan bagaimana seharusnya menulis dan menggunakan bahasa Indonesia sebagai alat mengekspresikan hasil penelitian agar mereka di luar lingkungan bidang ini dapat memahami hal-hal yang ingin disampaikan. Prof.Dr Bibiana, adalah orang pertama yang melapangkan jalan bagi saya untuk melakukan penelitian dengan bakteri E.coli. Sebelum menggunakan E.coli K99, kami pernah melakukan penelitian gangguan patologi akibat infeksi E.coli patogen unggas yang diinfeksikan langsung ke dalam kantung udara. Saya sungguh merasa sangat beruntung, bahwa beliau-beliaulah yang sebagian besar membentuk dan mengisi diri saya secara akademik.
(Lumajang), Prasetyaningtyas WEP (Grobogan), Chandramaya Cimay Siska Damayanti (Cimekar Bandung), Vitri Garvita & Danang (Cimanggu Bogor), Tomas Tom Mata Hine (Sawu NTT), Bayu Rosadi Baros (Tasikmalaja), Inur Nur Bariah (Banda Atjeh), Cut Mimi Hamni & Bang Dayat (Unsyiah Banda Atjeh), Een Eriani Kartini (Banda Atjeh), Ramadhan (Padang), Petrus Satsuittubun (Papua), Mumu Mutasim Billah (Pekalongan), Rini (Blitar), Takdir Saili (Kendari), K Adnyane Mudite (Lampung), Adi Winarto (Trenggalek), Sharon Ogle (Edinburg Skotlandia), Nining Handayani (Dompu), Tita Yuningsih (Rangkas), Sri Fadjra Satrija (Bogor), Dea Rosaria Indah (KualaTungkal), Sigit Prastowo (Solo), I Wayan Iwa Wisaksana (Tanggerang), Angga Vijaya (Bogor), Jaenuri (Citayam Bogor), Maria Oja Roza Helmita (Padang), Muhhamed Samsi (Purbalingga), Wahyu Wahyudin (Bogor), Bu Hajah Yani Ipin R Manggung (Baranangsiang 4 Bogor), Maman Superman (Maseng), Kusdiantoro Anto Mohammad (Cibeureum Bogor), Ani Sutrisno (Balitvet Bogor), Doktor Bambang (Salemba Jakarta), masing-masing dengan ilmu yang ada padanya telah membantu kami dalam memahami dan menyajikan materi yang telah dikumpulkan selama penelitian.
Kepada keluarga tercinta I Made Bagus G Wiswanata, Ni Putu Chandra P.Jyoti, Luh Putu Herawati, Meme Luh Rinang, Bape Made Radin, Eben, Acup, Kadek, Bape Matua Nyoman Narman, Meme Matua Made Sumani, Bape Jiwe, sapenyaman Batannyuh, para leluhur, dan keluarga lainnya, kami mengucapkan terima kasih atas pengorbanan, pengertian, dorongan, dan doanya yang tiada pernah terputus.
© Hak cipta milik Institut Pertanian Bogor, tahun 2007
Hak cipta dilindungi
Dilarang mengutip dan memperbanyak tanpa izin tertulis
dari Institut Pertanian Bogor,
Batan IW, BoedionoA, DjuwitaI, LayBW, Supar. 2006. Pelacakan perlekatan bakteri Echerichia coli K99 pada zona pelusida embrio mencit dengan metode enzym linked immunosorbent assay (elisa) dan scanning electron microscope (SEM). J Veteriner. 2006 (7): 29-38.
1. PENDAHULUAN
1.1 Latar belakang
1.1.1 Pengembangan dan aplikasi teknologi transfer embrio
Sebelum tahun 1970, pertukaran materi genetik ternak hanya terbatas antar ternak hidup dan semen beku. Kemudian pada pertengahan tahun 1970-an, pengembangan dan aplikasi teknologi transfer embrio sapi dengan metode tanpa bedah (non-surgical) dipandang sangat sesuai untuk menyebarkan genetik sapi ke seluruh dunia (Drost et al. 1976). Satu dekade kemudian dengan kemajuan bioteknologi dapat dihasilkan anak sapi pertama yang dilahirkan dari oosit yang dimatangkan dan difertilisasi secara in vitro (Haneda et al. 1986). Kini transfer embrio sapi baik yang dihasilkan secara in vivo maupun yang diproduksi secara in vitro, menjadi bisnis yang menarik pada industri peternakan di berbagai tempat di dunia (Wrathall 1995). Keberhasilan aplikasi transfer embrio di Indonesia sangat rendah yakni sekitar 16,1% berhasil bunting dan yang berhasil dilahirkan 1,2% (Balai Embrio Transfer 1997), sedangkan secara umum tingkat kelahiran transfer embrio adalah 30% (Peterson & Lee 2003). Banyak faktor yang mempengaruhi keberhasilan transfer embrio, salah satunya adalah cemaran agen infeksius yang mengakibatkan embrio tidak mampu berkembang ke tahap selanjutnya (Bak et al. 1992).
Dengan vitrifikasi, suatu teknik kriopreservasi embrio yang pelaksanaannya relatif lebih mudah, cepat, dan ekonomis (Rall & Fahy 1985), vitrifikasi embrio sapi telah berhasil dilakukan dengan hasil terbaik pada embrio umur tujuh hari (Saha et al. 1996).
ternyata tidak menular secara vertikal, karena diketahui materi virus ini sama sekali tidak tersisipkan (insert) ke dalam genom gamet (Stringfellow et al. 1991). Agen virus seperti bovine viral diarrhea dan bovine herpes virus tipe-1, tidak menembus embrio tapi hanya melekat pada permukaan luar embrio (Vanroose 1999).
Cemaran agen penyebab penyakit pada sel sperma, oosit, dan embrio merupakan jalur penularan horisontal yang penting pada ternak. Pencemaran terhadap embrio berasal dari lingkungan embrio (uterus, oviduk, medium kultur) dan dari tindakan manipulasi sebelum dan pada saat transfer ke resipien. Medium flushing kemungkinan dapat dicemari oleh patogen-patogen usus dan vagina pada saat dilakukan pemanenan embrio (Guerin et al. 1997).
Embrio yang diproduksi secara in vivo, tidak menularkan penyakit viral, jika mengikuti langkah-langkah baku yang disarankan dan dipersyaratkan oleh
The International Embryo Transfer Society (IETS). Langkah-langkah itu seperti mencuci dengan PBS, memberi perlakuan tripsin, dan melakukan kontrol terhadap produk-produk biologik (serum dan albumin) yang digunakan dalam embrio transfer, dan evaluasi terhadap embrio.
Pemrosesan embrio yang umum dilakukan, bertujuan untuk mencegah pencemaran embrio oleh agen-agen penyakit. Namun, tindakan yang disarankan IETS ternyata tidak efektif guna menyingkirkan agen penyakit seperti virus blue tongue, virus penyakit mulut dan kuku, bovine herpes virus-1 dan
bovine viral diarrhea (Vanroose 1999; Stringfellow & Givens 2000; Kafi et al. 2002), begitu pula terhadap bakteri Leptospira borgpetersenii (Bielanski & Surujballi 1996), dan Escherichia coli K99 (Otoi et al. 1993) yang sengaja dipaparkan ke embrio-embrio tersebut. Di samping itu cemaran juga disebabkan oleh Mycoplasma bovigenitalium (Bielanski et al. 2000), dan parasit Trichomonas foetus (Bielanski et al. 2004).
1.1.3. Fungsi dan peranan zona pelusida
selama tahapan oogenesis (Dunbar et al. 1994; Miyano et al. 1994). Zona pelusida membungkus oosit dan embrio hingga implantasi dini. Zona pelusida melindungi sel telur dan embrio dari kerusakan mekanik selama ovulasi dan perjalanan sepanjang saluran reproduksi betina (Wassarman et al. 1999).
Di samping itu zona pelusida memegang peran penting dalam: pengikatan spermatozoa, mencegah fertilisasi polispermia, reaksi akrosom, menyinambungkan pola pembelahan/cleavage yang normal, mencegah perlekatan antar sel telur, dan mencegah terjadinya implantasi dini (Jones et al. 1990; Wassarman et al. 1999). Wu et al. (2004) melaporkan bahwa zona pelusida berperan memberi perlindungan terhadap oosit dan embrio dini dari bahan biologi yang berbahaya seperti infeksi yang disebabkan oleh virus dan bakteri. Zona pelusida merupakan pelapis penting yang menentukan status kesehatan embrio. Zona pelusida mencegah infeksi agen penyakit menular sebelum terjadinya hatching. Kemungkinan terjadinya infeksi dapat saja terjadi dan berlangsung pada proses produksi embrio dengan cara fertilisasi oosit secara in vitro dan transfer embrio (Otoi et al. 1992; Otoi et al. 1993).
1.1.4. Cemaran bakteri Escherichia coli K99
Bakteri E.coli K99 telah terbukti dapat melekat pada permukaan embrio walau pun telah dicuci berulang-ulang dengan pencuci yang baku (Otoi et al. 1993), dan di Indonesia E.coli K99 merupakan bakteri penting karena menyebabkan diare yang mematikan pada anak sapi (Supar 1998). Keberadaan bakteri E.coli K99 yang endemik di Indonesia sangat berpeluang mencemari embrio atau pada proses embrio transfer. Maka dari itu muncul beberapa pertanyaan yakni: apakah agen patogen seperti E.coli K99 dapat bertahan hidup pada embrio yang diproduksi secara in vivo, mampukah embrio yang ditumpangi
E. coli berkembang dengan baik, dan apakah dalam sistem kultur in vitro zona pelusida embrio tercemar tahan terhadap perlekatan dan penetrasi E.coli K99?
1.2. Tujuan penelitian
Dalam upaya mengetahui interaksi antara bakteri E.coli K99 dengan embrio, khususnya zona pelusida, maka dilakukan penelitian dengan tujuan: a. Menguji kemampuan bakteri E.coli K99 melekat ke permukaan zona pelusida
b. Menguji kemampuan zona pelusida embrio berperan sebagai penahan terhadap cemaran E.coli K99.
c. Membuktikan efektivitas pencucian embrio yang tercemari E.coli K99 dengan bahan pencuci seperti PBS, tripsin, dan pronase.
d. Menguji daya tahan hidup secara in vitro dan in vivo embrio yang tercemari
E.coli K99 dan daya tahan hidup E.coli K99 setelah proses vitrifikasi.
1.3. Manfaat hasil penelitian
Hasil penelitian ini diharapkan dapat bermanfaat dalam:
a. Peningkatan kewaspadaan atau pengamanan terhadap kemungkinan adanya cemaran terhadap proses penanganan embrio.
b. Kualitas zona pelusida dapat dipakai sebagai acuan dalam menilai kualitas embrio.
c. Pemanfaatan enzim lain selain tripsin, dapat dipakai sebagai alternatif pembasuh embrio.
2. TINJAUAN PUSTAKA
Produksi embrio pada beberapa jenis hewan ternak, hewan laboratorium (Hogan et al. 1986; Hoshi 2003) dan hewan kesayangan telah banyak dilakukan baik secara in vivo (dengan bantuan superovulasi) maupun in vitro untuk tujuan industri peternakan. Embrio tahap morula dan blastosis banyak digunakan dalam industri peternakan dan secara luas dalam bidang penelitian karena embrio pada tahap perkembangan ini paling mudah diperoleh, lebih tahan dan secara teknis penanganannya lebih mudah dibandingkan tahap perkembangan embrio yang lebih dini, serta memberikan peluang lebih besar dalam keberhasilan transfer embrio.
2.1 Infeksi embrio oleh agen patogen
Dengan berkembangnya teknologi fertilisasi in vitro dan transfer embrio pada sapi, membuat embrio tahap morula dan blastosis yang dibekukan menjadi komoditi perdagangan internasional. Sejalan dengan itu kemungkinan terjadinya penularan penyakit menular bersamaan dengan embrio yang difertilisasi secara
in vitro ataupun yang ditransfer ke induk lainnya menjadi masalah. Pemrosesan embrio dengan mencuci dan memberi perlakukan tripsin pada metode yang disarankan oleh lembaga IETS terbukti tidak efektif untuk menyingkirkan beberapa agen patogen seperti virus bluetongue, foot and mouth disease, dan bakteri leptospira (Otoi et al.1992; Otoi et al.1993). Bakteri leptospira malah mampu menembus zona pelusida secara in vitro, sedangkan Bovine Herpes Virus-1 dan Bovine Viral Diarrhoea Virus secara mekanik terjebak pada zona pelusida. Kedua virus ini hanya mampu menembus 25-50% ketebalan zona pelusida (Stringfellow & Givens 2000). Di samping bakteri leptospira, bakteri
E.coli K99 juga masih ditemukan melekat pada embrio yang dipaparkan ke suspensi kuman yang mengandung 109 colony forming unit per mililiter. Untuk itu, perlu dilakukan kajian lebih lanjut terhadap keamanan embrio dari agen-agen patogen.
E.coli enterotoksigenik memiliki fimbrae K99 dan menyebabkan diare pada pedet sapi dan anak babi. Dalam hal ini ada suatu bahan dari kelompok hidroksil yang memegang peran spesifik dalam perlekatan antara molekul adhesin pada fimbrae bakteri dan gangliosida-GM3 pada mukosa usus. Gangliosida-GM3 terutama ditemukan pada mukosa usus dan kadarnya paling tinggi saat hewan itu dilahirkan dan hanya tinggal 6,25% saja saat hewan itu telah dewasa, hal inilah yang menjelaskan kenapa E.coli menyerang hewan pedet (Abe et al. 1992). E.coli bersama bakteri lainnya seperti Streptococcus agalactie, dan Actinomyces pyogenes telah diketahui menginfeksi saluran reproduksi. E.coli dapat diisolasi dari vagina anjing dan 60% kuman yang ditemukan pada turunannnya ditemukan pula pada induknya (Munnich & Lubke-Becker 2004), begitu pula kuman ini mudah diisolasi dari vagina sapi dara, dan kuman ini menyebabkan terjadinya penurunan tingkat kebuntingan sapi yang dikawinkan dengan inseminasi buatan (Takacs et al. 1990).
2.2 E.coli K99 penginfeksi embrio
Bakteri E.coli termasuk ke dalam famili Enterobacteriaceae dengan genus
Escherichia. Nama genus tersebut mengenang kepeloporan Theodor Escherich, seorang dokter anak asal Jerman, dalam riset tentang bakteri tersebut. Bakteri
E.coli adalah bakteri Gram negatif, berbentuk batang halus dan bersifat fakultatif anaerob. Bakteri E.coli mampu bertahan hidup lama pada lingkungan berair dan dingin (Bertschinger 1999).
Enterotoksigenik E.coli (ETEC) merupakan agen penting penyebab diare akut pada hewan muda dan anak-anak. Perlekatan merupakan langkah pertama ETEC patogen untuk menimbulkan diare. Perlekatan tersebut diperantarai oleh protein polimer berbentuk seperti serabut yang sangat halus pada permukaan bakteri. Struktur permukaan tersebut dikenal sebagai fimbriae atau pili (Bertschinger & Fairbrother 1999). E.coli patogen sebagian besar menghasilkan satu atau beberapa adhesin fimbriae yang melekatkan bakteri tersebut ke reseptor spesifik. Fimbriae E.coli menjulur dari sel bakteri berupa struktur yang terdiri dari subunit-subunit protein yang berperan sebagai penyangga protein perlekatan yang ada pada ujung fimbriae.
Fimbriae diklasifikasikan berdasarkan reaksi serologi, namun adhesin
fimbriae ETEC (Cox & Houvenaghel 1993). dikenal pada ternak neonatal yaitu K88(F4), K99(F5), P987(F6), dan F41. Isolat-isolat ETEC umumnya dapat menghasilkan sejumlah adhesin fimbriae, namun kombinasi adhesin yang kerap dihasilkan adalah F5&F6; F5&F41; F4&F6. Fimbriae F5 dan F41 hanya terekspresikan dengan baik jika dikultur pada media yang rendah kandungan glukosa atau alanin, seperti medium minca (Guinee et al. 1977).
E.coli K99 terutama melekat pada vili usus pada setengah bagian belakang usus halus, sedangkan K99/F41 melekat pada jejunum dan ileum (Cox & Houvenaghel 1993). Bakteri ETEC K99 menghasilkan enterotoksin yang tahan panas. Protein nonimunogen yang memiliki berat molekul 2000 dalton tersebut berikatan dengan guanyl cyclase yang merupakan reseptornya pada usus. Pengaktifan guanilat siklase tersebut akan merangsang dihasilkannya GMP-siklik. Kadar GMP-siklik yang tinggi akan menghambat sistem kotranspor
natrium chloride sehingga mengurangi penyerapan elektrolit dan air dari usus (Fairbrother 1999).
Bakteri E.coli, begitu juga Brucella ovis, Mycobacterium paratuberculosis, Mycoplasma sp, Streptococci sp. dilaporkan dapat mencemari permukaan zona pelusida embrio dan perlekatan sangat kuat sehingga sulit untuk disingkirkan (Wrathall 1995). Di samping bakteri tersebut, Bielanski et al. (2003) melaporkan sejumlah bakteri lainnya yang ditemukan mencemari embrio dan semen yang disimpan dalam waktu lama.
Khusus terhadap E.coli K99, Otoi et al. (1993) telah meneliti pencemaran bakteri tersebut terhadap embrio sapi. Antara E.coli K99 dengan permukaan zona pelusida diduga ada perikatan yang sifatnya spesifik, karena perlekatan tersebut tidak terlepas walaupun telah dicuci dengan tripsin. Pengendalian terhadap cemaran pada embrio tidak begitu banyak dipahami dan betapa rumitnya kalau kita telusuri agen-agen infeksius yang dapat menyebabkan kematian pada embrio. Upaya pengendalian cemaran salah satunya dapat dilakukan dengan penambahan antibiotik pada medium kultur, akan tetapi cara tersebut tidak selalu efektif.
2.3 Zona pelusida pelindung sel-sel embrio
2002). Pada pengamatan secara scanning electron microscopy, permukaan dalam dan permukaan luar zona pelusida mencit memperlihatkan pola yang berbeda. Permukaan luarnya dicirikan dengan adanya banyak bekas perlubangan atau fenestrasi (fenestration), sehingga tampilannya tampak seperti spon atau seperti batu apung, sedangkan permukaan dalamnya relatif lebih lembut dan kompak (Phillips & Shalgi 2001). Dipandang dari permukaan luarnya, ada dua bentuk permukaan zona pelusida, yakni: 1) berbentuk seperti anyaman kawat (mesh like) dan 2) berbentuk kompak terutama ditemukan pada oosit muda atau yang atretik (Familiari et al.1989). Greeve & Wassarman (1985) dan Vanroose (1999) mengemukakan bahwa pada zona pelusida yang memiliki jalinan permukaan luar yang kasar dan longgar menyerupai spon tersebut, ditemukan adanya pori dengan garis tengah lebih besar, sedangkan pada struktur permukaan dalam yang tidak kasar dan kompak garis tengah porinya lebih kecil. Banyaknya pori yang ditemukan pada zona pelusida embrio sapi, berbeda-beda pada berbagai tingkat perkembangan. Pada oosit ditemukan sekitar 1151 pori-pori, sedangkan pada sigot, embrio 8 sel, dan morula, secara berturut-turut ditemukan 1187, 1658, dan 3259 pori-pori. Begitu pula halnya dengan garis tengah pori-pori pada oosit, sigot, embrio 8 sel, dan morula secara berturut-turut adalah 182nm, 223nm, 203nm, dan 155nm (Vanroose 1999).
Permukaan zona pelusida yang kasar pada oosit matang mungkin disebabkan adanya sisa perlekatan sel-sel kumulus dan korona radiata (Suzuki
Glikoprotein zona pelusida pada mencit, monyet, dan manusia disintesis, disekresikan, dan dirakit oleh oosit selama proses oogenesis yang berlangsung sekitar 2-3 minggu dan bukan diproduksi oleh sel-sel granulosa (Eberspaecher et al. 2001; Qi et al. 2002). Selubung ekstraseluler tersebut terdiri dari filamen-filamen dimer panjang terdiri dari ZP2 dan ZP3, dan dipertautkan oleh ZP1. Matriks zona pelusida tersusun dari sambungan-sambungan filamen dengan
panjang sekitar 2-3 μm. Filamen-filamen tersebut memperlihatkan struktur yang berulang setiap 15 nanometer, menandai letak dimer ZP2 dan ZP3 sepanjang filamen. ZP1 adalah struktur yang menghubungkan filamen ZP2 dan ZP3 yang letaknya saling bersebrangan. Ketiga glikoprotein tersebut terikat bersama menjadi zona pelusida oleh ikatan non-kovalen (Greeve & Wassarman 1985; Wassarman 2002), sehingga lapisan zona pelusida tersusun menurut waktu terbentuknya dan lapisan yang paling dalam merupakan lapisan yang paling terakhir dibentuk (Qi et al. 2002).
Ketebalan zona pelusida beragam baik antar spesies mamalia maupun antar setiap mahluk hidup dalam spesies yang sama. Ketebalan zona pelusida berkaitan langsung dengan protein yang dikandung oleh zona pelusida. Semakin tipis zona pelusida membuat oosit lebih mudah dibuahi. Pada manusia zona
pelusida oosit yang mudah dibuahi tebalnya sekitar 16,5 μm sedang yang sulit
dibuahi tebalnya 20,0 μm. Semakin tipis semakin mudah dibuahi, tetapi jika
terlalu tipis (15,1μm) membuat banyak sperma yang dapat membuahi (Bertrand
et al. 1996). Zona pelusida embrio tahap cleavage lebih tipis dibandingkan dengan oosit. Penipisan zona pelusida terjadi secara proporsional, terjadi penipisan baik pada lapisan 1 mau pun lapisan 2, tetapi yang paling menipis adalah lapisan ke tiga atau lapisan terluar. Penipisan terjadi sebagai akibat zona pelusida meregang karena embrio membesar. Di samping itu, penipisan zona pelusida dapat pula terjadi karena lapisan terluar zona pelusida dicerna oleh protease. Secara umum ketebalan zona pelusida dapat dipakai sebagai panduan dalam memilih embrio (Grabielsen et al. 2000). Sesungguhnya zona pelusida memiliki ketebalan yang beragam, begitu pula susunan molekuler, dan ketebalan jaringan yang berada di bawah zona pelusida. Zona pelusida yang tebal akan memperlambat perkembangan embrio (Pelletier et al. 2004).
76 kDa, dan 73 kDa (Shabanowitz & O’Rand 1988). Tebal zona pelusida sekitar 5-10 μm, rasio antara ZP2 dengan ZP3 adalah 1:1, sedangkan ZP1 sekitar 9%
dari keseluruhan jumlah ZP2 ditambah ZP3 (Green 1997). Ke tiga glikoprotein tersebut membentuk jalinan tiga dimensi. Antara heterodimer ZP2 dan ZP3 dipertautkan oleh ZP1, sebaran glikokonjuget tersebut berubah-ubah selama terjadinya proses pematangan oosit (Rankin et al. 2001). ZP3 berperan sebagai reseptor utama dan induktor reaksi akrosom spermatozoa mencit, hamster, dan manusia (Moller et al. 1990; Van Duin et al. 1994) di samping itu ZP3 berperan sebagai glikoprotein struktural merakit zona pelusida bersama ZP2 dan ZP1(Bleil & Wassarman 1986; Wassarman 2002). ZP2 pada sapi berperan sebagai reseptor sekunder terhadap spermatozoa yang telah mengalami reaksi akrosom (Vanroose et al. 2000). Belakangan ini baru diketahui, bahwa agar supaya terjadi fertilisasi pada mencit spermatozoa harus berikatan dengan ZP3 dan ZP2 (Candace et al. 2002). Pada babi glikoprotein yang berperan mengikat spermatozoa adalah ZP3 dan ZP1 (Yurewicz & Sacco 1996), hal yang mirip terjadi pada kelinci (Yamasaki et al. 1995)
Zona pelusida dapat diibaratkan sebagai palang pintu (gatekeeper) terhadap masuknya spermatozoa, karena gamet jantan tersebut harus berikatan dan menerobos zona pelusida supaya dapat bersatu dengan membran plasma oosit selama pembuahan berlangsung (Wassarman 2002). Supaya dapat berikatan, gamet jantan tersebut harus dikenali oleh reseptornya yang ada pada permukaan zona pelusida yang sifatnya komplementer (Miller & Ax 1990; Wassarman 1994). Reseptor untuk spermatozoa tersebut, akan membatasi perlekatannya dengan spermatozoa dari spesies heterolog dengan oosit yang belum dibuahi, atau mencegah perlekatan spermatozoa dari spesies yang homolog dengan oosit yang telah dibuahi (Epifano & Dean 1994).
glukosamin (Parillo & Verini-Suplizi 2001). Perlekatan yang spesifik pada setiap spesies mamalia diperantarai oleh karbohidrat (Wassarman 2002).
Perlekatan antara spermatozoa dengan reseptornya pada zona pelusida mengakibatkan spermatozoa mengalami reaksi akrosom, semacam eksositosis seluler (Epifano & Dean 1994). Reaksi akrosom mendorong terjadinya perlekatan enzim proteolitik yang diperlukan spermatozoa agar bisa menembus matriks zona pelusida, dan mereka ulang (remodelling) permukaan spermatozoa agar tetap terjadi perlekatan dengan zona pelusida untuk selanjutnya dapat menyatu dengan membran oosit (Wassarman 2002). Dalam reaksi akrosom tersebut ada beberapa komponen penghantaran sinyal yang terlibat seperti: protein-G, inositol 3,4,5 triposfat, reseptor IP3, posfolipase-C, Ca++, dan kanal Ca++. Enzim-enzim kortikal yang ada pada kepala spermatozoa akan membuat ZP2 dan ZP3 menjadi ZP2f dan ZP3f, sehingga terjadi perubahan yang dramatik pada permukaan zona pelusida (Vanroose et al. 2000). Perubahan struktur zona pelusida tersebut membuat zona pelusida menjadi lebih kaku dan mengalami pengerasan (hardening). Tingkat kekakuan dan pengerasan yang terjadi sebanding dengan bertambah banyaknya jumlah ikatan menyilang ZP1 yang menautkan ZP2 dengan ZP3 (Familiari et al. 2006). Proses pembuahan yang mengakibatkan ZP berubah sedemikian rupa, membuat spermatozoa yang datang belakangan tidak dapat mengenali dan tidak menempel pada glikoprotein zona pelusida yang telah terbuahi (Wassarman 2002). Matriks zona pelusida tersebut tetap melindungi embrio yang membelah selama perlintasannya menuju uterus di dalam tuba fallopi, sebelum embrio tahap blastosis tersebut hatched
dari zona pelusida menjelang implantasi. (Vanroose et al. 2000).
Di Indonesia pelaporan terhadap cemaran agen infeksius dan upaya memahami peranan zona pelusida embrio sebagai penahan infeksi, dan kemungkinan penularan agen infeksius melalui embrio belum banyak dilaporkan. Untuk itu perlu dilakukan penelitian pencemaran embrio dengan model menggunakan agen infeksius yang umum dan secara ekonomis penting bagi Indonesia, seperti E.coli K99.
kebanyakan spesies hewan, zona pelusida membungkus oosit dan embrio dari beberapa saat setelah oosit terbentuk, hingga embrio mencapai tahap implantasi dini, dan melindungi dari kerusakan mekanik selama ovulasi dan perjalanannya sepanjang saluran reproduksi betina (Wassarman et al. 1999). Zona pelusida mempunyai peran yang spesifik pada tahap awal fertilisasi, seperti pengikatan sperma, penyusupan dan menghambat terjadinya pembuahan polispermia (Jones et al. 1990; Wassarman et al. 1999). Di samping itu, zona pelusida berperan penting sebagai cangkang pelindung sel-sel embrio, namun demikian secara tidak sengaja dapat membawa agen-agen infeksi dalam penyebaran penyakit ternak melalui embrio transfer (Stringfellow & Seidel 1990). Dalam sejumlah studi dilaporkan bahwa embrio yang terbebas dari zona pelusida dapat berkembang secara in vitro (Boediono et al. 1993), namun perkembangan selanjutnya tergantung pada tahap zona pelusida itu disingkirkan, misalnya pada tahap 2, 4, atau 8 sel (Konwinski et al. 1978; Lai et al. 1994). Pada babi dilaporkan bahwa oosit babi yang tidak memiliki zona pelusida dan dilakukan fertilisasi in vitro terhadapnya, dapat berkembang menjadi embrio dan lahir menjadi anak babi yang normal (Wu et al. 2004).
Transfer embrio intact (masih memiliki ZP) yang sebelumnya telah dipaparkan ke agen penyakit, ternyata dapat menyebabkan terjadinya infeksi pada resipien dan janin. Pasca pemaparan zona pelusida secara morfologi dan kimiawi agak mirip, akan tetapi bentuk permukaannya agak beragam. Hal ini terbukti dengan adanya perbedaan tenacity tempat bertautnya agen ke embrio. Pada embrio babi, baik virus beramplop maupun yang tidak, dapat melekat erat ke zona pelusida dan tidak bisa disingkirkan dengan pembasuhan tripsin. Sedangkan embrio domba daya lekatnya lebih lemah dari embrio babi, namun lebih kuat dibandingkan dengan embrio sapi (Wrathall 1995).
2.5 Kriopreservasi embrio
Dalam proses pembekuan atau kriopreservasi digunakan krioprotektan dalam medium pembeku untuk mereduksi pengaruh letal akibat proses kriopreservasi sel, terutama pengaruh kristal es baik intraseluler maupun ekstraseluler. Selama beberapa tahun belakangan ini, untuk peningkatan aplikasi dan efisiensi, embrio dari berbagai spesies mamalia telah dikriopreservasi dengan pengembangan berbagai metode kriopreservasi. Beberapa metode kriopreservasi pada saat ini antara lain: metode konvensional dengan metode pendinginan lambat (slow freezing) dan pendinginan cepat (rapid freezing), serta metode alternatif yang dikenal dengan vitrifikasi. Vitrifikasi adalah proses pemadatan cairan yang mengandung krioprotektan konsentrasi tinggi pada suhu
-196° C tanpa pembentukan kristal es sehingga terlihat seperti kaca (Rall & Fahy 1985). Keuntungan dari vitrifikasi adalah tidak memerlukan mesin khusus dan waktu pengerjaannya relatif mudah, murah, dan singkat. Penggunaan konsentrasi krioprotektan yang tinggi membawa konsekuensi pada tingkat toksisitas. Etilen glikol (EG) merupakan salah satu krioprotektan yang paling rendah tingkat toksisitasnya serta memiliki daya permeasi yang cepat sehingga sangat baik digunakan sebagai krioprotektan. Di samping etilen glikol, krioprotektan yang sering dikombinasikan dengannya untuk vitrifikasi adalah dimetilsulfoksida (DMSO). DMSO lebih toksik dibandingkan EG (Lane et al. 1999; Mukaida et al. 2003; Takahashi et al. 2005). Namun demikian dengan penambahan sukrosa kedalam larutan vitrifikasi selain dapat menurunkan toksisitas juga dapat mengurangi efek dari perubahan tekanan osmotik (osmotic shock). Pada proses vitrifikasi, sebagai carrier embrio dapat digunakan electron microscope grid (Son et al. 2003), straw berdinding tipis (Vajta et al. 1998), hemistraw (Vanderzwalmen et al. 2003), atau kriolup (Takahashi et al. 2005)
Kemajuan di bidang bioteknologi reproduksi atau rekayasa embrio berdampak pada peningkatan kebutuhan terhadap embrio. Namun demikian, terbatasnya daya tahan embrio di luar tubuh induk merupakan salah satu kendala di dalam upaya penyediaan embrio secara berkesinambungan baik untuk keperluan aplikasi mau pun penelitian. Salah satu upaya pengadaan embrio secara berkesinambungan adalah melalui pembuatan bank embrio dengan penerapan teknik kriopreservasi (penyimpanan dengan bentuk beku),
keperluan transfer embrio guna meningkatan produksi ternak, sebagai bahan penelitian secara in vitro, dan penyelamatan plasma nutfah hewan-hewan liar dalam menunjang konservasi atau hewan yang bernilai ekonomis tinggi.
Di samping itu dalam proses vitrifikasi embrio, carrier kriolup yang dipakai umumnya secara komersial terbuat dari bahan nilon. Namun pada penelitian ini, kriolup yang dipakai dibuat dari filamen kawat tembaga yang merupakan hasil modifikasi, dan diupayakan mendekatkan situasinya dengan kriolup yang umum dipakai di negara-negara maju.
2.6 Embrio transfer dan penularan penyakit
Kultur embrio kini mampu mendukung teknologi reproduksi, dan semakin banyak diterapkan pada ternak. Kultur embrio tidak saja mampu secara cepat memperbanyak produksi embrio dengan kualitas genetik sangat bagus, tetapi juga dipakai untuk memproduksi clone dan hewan transgenik. Embrio tersebut agar dapat berkembang lebih lanjut harus ditransfer ke induk resipien, dan tingkat keberhasilan embrio transfer berdasarkan suatu studi yang dilakukan sangat beragam, mulai dari 9% hingga 47% (Peterson & Lee 2003).
Semenjak penyakit sapi gila (bovine spongyform enchephalopaties /BSE) beserta penyakit mulut dan kuku mewabah di Eropa tahun 2001, perekonomian mengalami tekanan, di samping adanya persaingan internasional yang semakin berat. Akibat kesulitan ekonomi tersebut, pemanfaatan teknik-teknik reproduksi dikurangi pada ternak. Peningkatan produksi ternak tidak lagi menjadi prioritas, dan sumberdaya diarahkan ke pertanian ramah lingkungan yang berkelanjutan dan kesejahteraan hewan (animal welfare). Dalam suasana seperti tersebut, arah dan penggunaan teknologi embrio tidak lagi oleh peternak, tetapi oleh perusahan-perusahan yang bergerak dalam bidang genetik dan usaha pembibitan (breeder) yang mengharapkan keuntungan dari penjualan semen, embrio, dan hewan. Masalah ke dua yang dihadapi Eropa adalah sikap khawatir masyarakatnya terhadap produk bioteknologi, dan salah satunya adalah teknologi embrio (Galli et al. 2003).
Anak-anak hewan ternak yang dihasilkan terbebas dari penyakit yang diderita induknya, seperti kejadian penyakit virus bovine viral diarrhea (Bak et al. 1992). Kekhawatiran yang berlebihan masyarakat Eropa terhadap infeksi penyakit hasil embrio transfer, seharusnya dapat dikaji dengan penyakit sapi gila.
Terhadap agen penyakit yang mampu melekat ke permukaan embrio dan tidak terbilas dengan menggunakan mPBS atau tripsin seperti yang disarankan IETS (Otoi et al. 1992; 1993), penelitian perlu dilakukan untuk melihat kemungkinan agen seperti E.coli K99 tersebut ikut ditularkan pada saat embrio transfer, baik menggunakan embrio segar mau pun embrio yang telah dibekukan. Pengawetan embrio salah satunya dapat dilakukan dengan metode vitrifikasi, dan selanjutnya dievaluasi secara in vitro dan in vivo (Lane et al. 1999). Dalam penelitian yang dilakukan kemungkinan dapat dievaluasi perkembangan embrio yang divitrifikasi, baik tercemar atau tidak. Begitu pula evaluasi terhadap perkembangan agen yang mencemari.
Dalam industri peternakan, kriopreservasi embrio mendorong percepatan proses seleksi genetik dan juga menekan biaya program pembibitan karena embrio selalu tersedia pada saat induk resipien secara alami tersedia. Hal ini juga menekan biaya yang diperlukan untuk melakukan penyerentakan birahi pada ternak. Akhirnya teknik kriopreservasi embrio dimanfaatkan pada manusia dalam rangka reproduksi bantuan untuk menyimpan kelebihan produksi embrio, sebagai upaya untuk melakukan kehamilan. Di samping itu kriopreservasi tidak saja berhasil dilakukan pada mencit, manusia dan sapi, tetapi juga pada anjing, kambing, kuda, domba, kelinci, tikus, babi, dan beberapa spesies hewan liar (Wood et al. 2004)
3. PENGUNGKAPAN PERLEKATAN
ESCHERICHIA COLI
K99
PADA ZONA PELUSIDA DENGAN TEKNIK ELISA DAN SEM
3.1 PENDAHULUAN
Zona pelusida (ZP) merupakan membran ekstraseluler oosit dan embrio (Dudkiewicz et al. 1976). ZP membungkus oosit, hingga embrio menjelang implantasi dini pada permukaan uterus. ZP melindungi embrio dari kerusakan mekanik sepanjang perjalanannya menuju uterus (Wassarman et al. 1999). Di samping itu, ZP berperan melindungi oosit dan embrio dari ancaman bahan biologik berbahaya, seperti infeksi oleh virus dan bakteri. Keberadaan ZP penting, karena menentukan status kesehatan embrio, sebab ZP mencegah serbuan agen-agen penyakit sebelum embrio mengalami hatching (Wu et al. 2004). Walaupun begitu, sejumlah agen virus dan bakteri telah diketahui mampu melekat pada ZP (Wrathall 1995).
Beberapa jenis virus dan bakteri mampu melekat pada permukaan ZP antara lain: virus blue tongue, penyakit mulut dan kuku, bovine herpesvirus-1, dan bovine viral diarrhoea (Stringfellow & Givens 2000), bakteri Leptospira spp. (Shisong & Wrathall 1989; Bielanski & Surujballi 1996), Escherichia coli K99, Streptococcus agalactie, Actinomyces pyogenes (Otoi et al. 1992), mikoplasma (Mycoplasma bovis, M bovigenitalium), parasit Tritrichomonas foetus (Bielanski
et al. 2000; Bielanski et al. 2004). Pencemaran dengan agen patogen ini dapat terjadi saat fertilisasi in vitro dan atau pada saat transfer embrio. Di samping itu cakupan infeksi dapat meluas, karena embrio beku kini telah menjadi komoditi perdagangan antar bangsa (Otoi et al. 1992; Otoi et al. 1993). Prosedur yang disarankan oleh lembaga International Embryo Transfer Society (IETS) dengan cara pembasuhan embrio ternyata kurang efektif menyingkirkan agen penyakit seperti bakteri E.coli K99 dari embrio (Otoi et al. 1993).
Bakteri E.coli K99, merupakan agen penyebab penyakit kolibasilosis pada anak babi dan anak sapi. Infeksi bakteri ini menimbulkan kerugian pada industri peternakan babi dan sapi di Indonesia karena menimbulkan diare profus dan kematian anak sapi (Supar 1998).
antigen pili K99. Sedangkan pemeriksaan dengan SEM dimaksudkan agar perlekatan E.coli ke permukaan zona pelusida dapat diamati secara langsung.
3.2 MATERI DAN METODE 3.2.1 Penyiapan bakteri E.coli K99 dan serum
Bakteri E.coli K99 dan serum diperoleh dari Balai Penelitian Veteriner (Balitvet) Bogor. Bakteri E.coli K99 diisolasi dari anak sapi, dibiakkan semalam pada media Minca plus vitox (Oxoid, UK). Setelah inokulasi selanjutnya diinkubasikan pada suhu 370C selama satu malam. Pada suhu tersebut antigen K99 lebih banyak diproduksi dibandingkan dengan suhu di bawah 250C (Guinee
et al. 1977). Setelah diinkubasi, sel-sel bakteri pada permukaan agar dibilas dengan NaCl fisiologis, sel tersebut dicuci tiga kali. Sel dipisah dengan sentrifugasi 4000 rpm selama 20 menit. Endapan sel dari pencucian terakhir kemudian dibuat suspensi dengan kekeruhan setara dengan tabung standar Mc Farland nomor 10 (Supar 1986).
Selain E.coli K99, juga digunakan bakteri E.coli penyebab diare pada anak sapi dan babi yang memiliki antigen perlekatan F41, bakteri E.coli K88 atau F4 adalah bakteri yang menimbulkan diare pada anak babi, bakteri unggas atau –K99, dan isolat TDF1a yang memiliki antigen perlekatan K99 (F5) dan F41 yang menimbulkan diare pada anak sapi (Supar 1996).
Antiserum spesifik K99 diperoleh dari laboratorium E.coli Balitvet. Imuno globulin (IgG) atau anti K99 IgG dari serum tersebut diendapkan dengan amoniumsulfat jenuh (40%) dengan perbandingan 1:1. Endapan dipisahkan dengan sentrifugasi 4000 rpm, dilarutkan dengan NaCl fisiologis dan volumenya disesuaikan dengan volume antiserum semula, kemudian dimasukkan ke dalam kantung dialisis melawan larutan garam NaCl selama satu malam di dalam lemari es. Keesokan harinya dilanjutkan dengan melawan akuades selama satu jam. Setelah dianalisis, suspensi antiK99 IgG dimasukan ke dalam tabung ependorf secara aliquot dan disimpan dalam lemari es atau pada freezer -200C (sampai saatnya dipakai untuk ELISA).
3.2.2 Pemanenan embrio
mare’s serum gonadotropine (PMSG, Folligon, Intervet, Netherland) 5IU secara intraperitoneum (ip) pada pukul 13.00-14.00 (agar tersedia waktu leluasa saat pemanenan embrio). Setelah 48 jam mencit-mencit tersebut diberikan human chorionic gonadotropin (hCG, Chorulon, Intervet, Netherland) 5IU secara ip. Selanjutnya masing-masing mencit betina tersebut dikawinkan dengan satu mencit jantan (Hogan et al. 1994). Keesokan harinya, mencit betina yang menandakan adanya sumbat vagina (vagina plug) dipisahkan dari pejantan. Empat hari kemudian embrio dipanen, dari mencit yang dimatikan dengan cara
dislokasio cervicalis. Embrioakan ditemukan pada kornua uterus. Kornua uterus dipotong dan dipisahkan dari mencit, kemudian ditempatkan pada cawan petri kecil yang telah diisi dengan medium modified Phosphate Buffered Saline/mPBS Selanjutnya lumen uterus dibilas dengan medium mPBS menggunakan alat suntik 1cc. Sambil diamati di bawah mikroskop, embrio dicuci 2-3 kali dengan mPBS yang mengandung bovine serum albumin 2.5% tanpa antibiotik (Otoi et al. 1992)
3.2.3 Penyiapan reagen-reagen ELISA
3.2.3.1 Pembuatan antigen ekstrak zona pelusida untuk ELISA. Ekstrak zona pelusida didapat dari embrio tahap morula dan blastosis. Zona pelusida dipisahkan dari sel-sel embrio dengan cara membelah embrio itu menjadi dua bagian di bawah mikroskop inverted dengan menggunakan micromanipulator
(Nikon Diaphot Japan), atau dengan membiarkan embrio terus berkembang sampai tahap hatched. Embrio yang dibelah dua akan membuat bagian zona pelusida segera terpisah dengan sel-sel embrio. Jika terjadi perlekatan dapat dipisahkan dengan menggetar-getarkan pisau silet pembelah. Zona pelusida yang terlepas dari sel-sel embrio, kemudian dipisahkan dan disonikasi (Bioruptor Ogawa Seiki Ltd Japan). Konsentrasi ekstrak zona pelusida dalam mPBS diukur dengan spektrofotometer.
3.2.3.2 Pembuatan coating buffer 0,1M karbonat bikarbonat. Sebanyak 1,06 g Na2CO3 anhidrous dan 0,84 g NaHCO3 anhidrous dilarutkan dalam 100 ml
3.2.3.3 Pembuatan phosphate buffered saline (PBS) konsentrasi 10X, pH7,2 untuk ELISA. Sebanyak 8,5g NaCl, 2g KCl, 11,5g Na2PO4, dan 2g
KH2PO4 dilarutkan dalam 1000 ml akuades. Setelah larut dimasukkan ke dalam
botol dan disimpan dalam lemari es. Larutan tersebut digunakan untuk melakukan pencucian pada saat melakukan ELISA. Larutan PBS tersebut diencerkan 10 kali dalam akuades, kemudian ditambahkan Tween-20, sehingga konsentrasi akhir PBST ini menjadi 0,05%.
3.2.3.4 Citrate phosphate buffer. Sebanyak 21,01g citrate (C6H607.H2o)
dilarutkan dalam 500 ml akuades, begitu pula 14,2g Na2HPO4 dilarutkan dalam
500 ml akuades. Larutan phosphate dimasukan ke dalam larutan sitrat sedikit demi sedikit, sehingga pH campuran ke dua larutan menjadi 4,2. Setelah pH larutan dapat disesuaikan, larutan disimpan dalam lemari es bersuhu 40C (1-2 minggu).
3.2.3.5 Pembuatan suspensi ABTS. Substrat ABTS dibuat dengan cara melarutkan (286mg dalam 10 ml air suling) sebanyak 200μl dimasukan kedalam 10 ml citric buffer phosphate (24 ml 0,1M asam sitrat ditambahkan 26 ml 0,2M Na2HPO4 dan kemudian dilarutkan dalam 100 ml air suling) yang memiliki pH 4,2
kemudian ditambahkan 30 ml hidrogen peroksida (H202) 10% (Voller & Bidwell
1986).
3.2.4 Prosedur ELISA
Ekstrak zona pelusida konsentrasinya diketahui dengan pemeriksaan spektrofotometer, dipakai untuk melapisi cawan ELISA. Prinsip uji ELISA yang dipakai pada penelitian ini mengikuti prosedur yang ditulis oleh Supar (1986) dengan sedikit modifikasi. Secara singkat sebagai berikut: polysterene mikro-ELISA dilapisi (coating) dengan ekstrak zona pelusida. Konsentrasi zona pelusida dibuat 10-15 μg/ml dalam buffer carbonate bicarbonate pH 9,6 sebanyak 100 μl dimasukkan ke dalam setiap sumuran cawan ELISA. Cawan ditutup dan dibungkus dengan kertas saring yang telah dibasahi air, kemudian dimasukkan kedalam kantung plastik dan diinkubasi pada suhu 370C selama satu sampai dua jam. Selanjutnya disimpan semalam pada suhu 40C.
diisi dengan bakteri E.coli, kontrol negatif, sedangkan sumur nomor 3 dan 4, 5 dan 6, 11 dan 12, kontrol positif. Isi lubang baris A tersebut diencerkan in situ
secara berseri dengan faktor setengah berturut-turut dalam PBST sampai baris G, sedangkan baris H hanya diisi PBST saja. Kemudian diinkubasi selama 10 menit pada suhu 370C. Cawan dicuci tiga kali dengan PBST. Lama pencucian 4-5 menit, kemudian kedalam sumur diisi dengan PBST yang mengandung BSA 0,5% sebanyak 100 ml. Cawan ditutup dan dibungkus, kemudian diinkubasikan pada suhu 370C selama 60 menit (Supar et al. 1993; 2002).
Sumur dicuci lagi dengan PBST sebanyak tiga kali, dan setiap lubang diisi dengan suspensi IgG antiK99 yang dibuat pada kelinci sebanyak 100 μl dengan konsentrasi 10-15 μg/ml dalam PBST. Kemudian diinkubasikan pada 370C selama 30 menit.
Setelah itu sumuran-sumuran kembali dicuci dengan PBST sebanyak tiga kali. Selanjutnya suspensi konjugat enzim antirabbit horseradish peroxidase
dalam PBST dengan pengenceran 1:500 diisikan ke dalam sumur itu dengan volume 100µl. Kemudian diinkubasikan pada suhu 370C selama 60 menit. Setelah diinkubasi, dicuci dengan PBST sebanyak tiga kali. Ke dalam setiap sumur diisi dengan substrat sebanyak 100µl. Substrat yang ditambahkan adalah ABTS / 2’-azino-bis (3ethylbenzithiazoline-6 sulfonic acid). Cawan dibungkus seperti sebelumnya dan diinkubasikan pada suhu kamar selama 45 menit dan diletakkan pada alat pengocok. Reaksi dibaca dengan alat pembaca ELISA mikro pada panjang gelombang 405 nm, guna memperoleh angka pembacaan optikal densitas reaksi ELISA. Dalam uji ELISA ini intensitas warna yang muncul akibat adanya reaksi yang berkaitan langsung dengan kandungan antigen yang terikat partikel zona pelusida yang dicoating ke dasar sumuran (Tizzard 2000). Hasil pembacaan ELISA selanjutnya disusun dalam tabel untuk memudahkan evaluasi.
3.2.5 Prosedur pemeriksaan mikroskop elektron
kemudian embrio direndam dalam asam tanat 2% selama satu jam pada suhu kamar. Setelah itu dilakukan pencucian kembali hingga jernih. Selanjutnya direndam dalam OsO4 1% selama satu jam pada suhu kamar, dan terakhir dicuci
dengan mPBS sebanyak tiga kali.
Preparat tersebut didehidrasi dengan alkohol bertingkat dari konsentrasi 70%, 80%, 90%, 95%, dan 100% masing-masing tingkat sebanyak tiga kali selama 30 menit. Dehidrasi berikutnya dilakukan dalam t-butanol. Pengeringbekuan menggunakan alat freezedryer (VDF-21S t-BOH). Coating
dengan menggunakan platinum paladium dengan alat Giko IB-3 ion coater, dilakukan selama 13 menit dengan muatan listrik 9 ampere. Sampel selanjutnya diperiksa pada scanning electrone microscope (Jeol, JSM-5310 LV) pada 20 kV (Hyttel et al. 1988; Prasetyaningtyas et al. 2005).
3.3 HASIL DAN PEMBAHASAN
Pada pemeriksaan ELISA terlihat bahwa reaksi antara zona pelusida (mencit) dengan bakteri E.coli K99 ditemukan adanya pembacaan kepadatan optik yang lebih tinggi, dibandingkan dengan bakteri E.coli yang memiliki faktor perlekatan bukan K99 seperti F41, K88, -K99 (Tabel 3.1). Hasil pemeriksaan ELISA, menunjukkan bahwa nilai optikal densitas (OD) bakteri yang memiliki pili K99, nilai OD-nya lebih tinggi. Hal ini terlihat pada sampel pili K99, TDF1a, dan K99. dengan rataan nilai OD secara berurutan sebagai berikut: 1,16; 1,62; dan 1;63. Nilai OD tersebut lebih tinggi dibandingkan dengan sampel yang tidak memiliki antigen perlekatan K99, seperti pada sampel F41, K88, dan –K99 (tanpa pili K99), dengan nilai OD secara berurutan sebagai berikut: 0,50; 0,55; dan 0,42. Pada satu jenis bakteri E.coli, selain memiliki satu jenis antigen perlekatan (pili), mungkin saja bakteri tersebut memiliki pili K99 atau F41, seperti yang ditemukan pada bakteri E.coli O101 dan O9 (Supar 1996). Adanya kepadatan optik yang
juga diperantarai oleh manosa, seperti pada E.coli unggas jika bakteri tersebut ditumbuhkan pada media padat (Dozois et al.1985).
Zona pelusida mengandung tiga jenis glikoprotein yakni ZP1, ZP2, dan ZP3. Rantai polipeptida dan oligosakarida dari glikoprotein tersebut berbeda satu dengan yang lain (Wassarman 1999). Kandungan glikoprotein zona pelusida tidaklah banyak dan gugus gula yang umum ditemukan padanya adalah D-manosa, D-glukosa, galaktosa, N-asetil glukosamin (Skutelsky et al. 1994). Gugus gula pada permukaan zona pelusida, berbeda antar jenis hewan. Pada mencit yang umum ditemukan adalah galaktosil, L-fukosa, D-manosa, dan metil manosida (Wassarman 1988). Gugus gula tersebut penting dalam pengikatan spermatozoa pada saat fertilisasi (Miller & Ax 1990). Gugus gula zona pelusida merupakan tempat interaksi yang spesifik. Memahami persebaran gugus gula pada permukaan zona pelusida sangatlah penting guna mengetahui adanya ikatan spesifik (Skutelsky et al. 1994). Adanya manosa pada permukaan spermatozoa justru membuat bakteri E.coli mudah menempel, karena bakteri melekat ke gula manosa. Akibatnya spermatozoa tidak leluasa bergerak guna membuahi oosit (Wolff et al. 1993).
Tabel 3.1 Rataan kepadatan optik hasil ELISA antara zona pelusida mencit dengan berbagai jenis bakteri E. coli asal hewan
Kepadatan Optik Sumuran Pengenceran
(-2log2) F41 K99 Pili K99 K88 -K99 TDF1a
A 0 0.500 1.626 1.162 0.550 0.425 1.617
B 1 0.519 1.155 1.161 0.520 0.419 1.475
C 2 0.439 0.609 0.549 0.505 0.409 0.418
D 3 0.476 0.531 0.481 0.485 0.410 0.424
E 4 0.460 0.490 0.488 0.472 0.428 0.419
F 5 0.448 0.462 0.494 0.478 0.429 0.409
G 6 0.475 0.427 0.480 0.471 0.388 0.427
H PBS 0.538 0.431 0.502 0.495 0.440 0.502
Keterangan: F41= suspensi pili E.coli F41; K99= suspensi E.coli K99, referen ststrain couple
K12K99; Pili K99= suspensi pili murni K99 dari isolat lapang TDF1a; K88 = susupensi
pili E.coli K88; -K99= susupensi pili E.coli bukan pili K99; TDF1a= susupensi E.coli
K99 isolat lapang TDF1a
pelusida ini sulit dilepaskan (Otoi et al. 1992; 1993), disamping itu walau pun embrio yang dicemari oleh bakteri E.coli K99, telah dicuci dengan phosphate buffered saline (PBS) mau pun tripsin, ternyata tidak mampu melepas ikatan yang terjadi.
A
B
Gambar 3.1 Perlekatan E.coli K99 pada zona pelusida melalui pengamatan SEM (Scanning Electrone Microscopy). Bakteri E.coli K99 (panah putih) menempel pada permukaan zona pelusida mencit (A), bakteri E.coli K99 tampak menempel pada zona pelusida dan berukuran di bawah satu mikron (B).
Dalam preparat embrio yang dipaparkan (expose) dengan E.coli K99 menunjukkan adanya perlekatan bakteri E.coli K99 pada permukaan embrio walau pun telah dilakukan pencucian. Dari hasil pengamatan SEM dan ELISA memberikan dugaan adanya pertautan antigen pili pada permukaan embrio atau zona pelusida (Gambar 3.1). Implikasi hasil penelitian ini memberi masukan praktis pada aspek transfer embrio terutama dalam melakukan tindakan pencegahan adanya pencemaran bakteri E.coli K99.
bovigenitalium ke zona pelusida dilaporkan oleh Bielanski et al. (2000), dan perlekatan Trichomonas foetus dilaporkan oleh Bielanski et al. (2004).
Hasil penelitian ini menunjukan adanya perlekatan E.coli ke zona pelusida baik uji secara ELISA maupun secara SEM, uji-uji tersebut belum pernah dilaporkan sebelumnya guna menunjukan adanya perlekatan antara
E.coli K99 dengan zona pelusida.
3.4 SIMPULAN
Penelitian pengembangan ELISA dengan penggunaan ekstrak zona pelusida yang dilapiskan pada sumuran cawan ELISA sebagai penangkap antigen (antigen captured) menunjukkan adanya reaksi ikatan spesifik antara zona pelusida mencit dengan pili K99, tetapi tidak terjadi ikatan antara zona pelusida dengan pili non K99. Reaksi diperkuat dengan pemeriksaan secara SEM, teramati sel utuh E.coli K99 dapat menempel pada permukaan zona pelusida.
3.4 SARAN
Perlu dilakukan penelitian lebih lanjut mengenai pengaruh perlekatan bakteri E.coli K99 pada zona pelusida terhadap perkembangan embrio.
4. PERANAN ZONA PELUSIDA SEBAGAI BARIER TERHADAP
CEMARAN
ESCHERICHIA COLI
K99
4.1 PENDAHULUAN
Zona pelusida merupakan struktur membran ekstraseluler oosit atau embrio praimplantasi. Jaringan zona pelusida sangat kompleks, memiliki kekuatan yang seragam pada seluruh permukaannya dan memiliki pori-pori. Zona pelusida (ZP) terdiri dari glikoprotein yang dikenal sebagai ZP1, ZP2, dan ZP3. Zona pelusida ini sangat beragam di antara spesies yang berbeda (Dudkiewicz et al. 1976). Zona pelusida disintesis oleh oosit selama tahapan oogenesis dan diendapkan di perifer sel-sel tersebut (Dunbar et al. 1994; Miyano
et al. 1994). Zona pelusida membungkus oosit dan embrio hingga menjelang implantasi/hatching. Zona pelusida melindungi sel telur dan embrio dari kerusakan mekanik selama ovulasi dan perjalanan sepanjang saluran reproduksi betina (Wassarman et al. 1999).
Zona pelusida juga memegang peran penting dalam pengikatan spermatozoa, mencegah fertilisasi polispermia, reaksi akrosom, menyinambungkan pola pembelahan/cleavage yang normal, dan mencegah perlekatan antar oosit (Jones et al. 1990; Wassarman et al. 1999). Akan tetapi, peran zona pelusida yang sesungguhnya pada proses fertilisasi dan implantasi tidak sepenuhnya dipahami (Konwinski et al. 1978; Lai et al. 1994). Wu et al. (2004) melaporkan bahwa zona pelusida berperan memberi perlindungan terhadap oosit dan embrio dini terhadap mikroba yang berbahaya seperti infeksi yang disebabkan oleh virus dan bakteri. Zona pelusida merupakan pelapis penting yang menentukan status kesehatan embrio, atau sebagai barier terhadap cemaran atau infeksi agen-agen penyakit menular sebelum keluarnya embrio dari zona pelusida atau hatching. Akan tetapi, sejumlah agen virus dan bakteri mampu melekat pada zona pelusida (Wrathall 1995).
Dalam pemrosesan embrio, seperti tindakan pencucian dengan buffer dan perlakuan tripsin, ternyata tidak efektif menyingkirkan virus blue tongue, virus penyakit mulut dan kuku, bovine herpes virus-1, bovine virral diarrhoea virus. Pada percobaan bakteri Leptospira sp., dan Escherichia coli K99 yang sengaja dipaparkan ke embrio (Stringfellow & Givens 2000; Otoi et al. 1993), bakteri-bakteri itu dapat menempel ke permukaan zona pelusida. Penempelan bakteri-bakteri
mikroskop elektron dan uji ELISA (Batan et al. 2006). Dengan demikian infeksi patogen seperti di atas dapat terjadi dan berlangsung pada proses memproduksi embrio melalui teknik fertilisasi oosit in vitro dan transfer embrio. Embrio beku telah menjadi komoditi perdagangan internasional, bila terjadi infeksi patogen pada proses tersebut di atas maka dapat menginisiasi menyebarkan penyakit (Otoi et al. 1992; Otoi et al. 1993). The International Embryo Transfer Society
(IETS), lembaga yang berperan mengawasi perdagangan embrio yakni,
mensyaratkan adanya pencucian embrio dengan PBS dan tripsin sebelum ditransfer ke resipien. Namun, tindakan ini kurang efektif menyingkirkan salah satu agen penyakit seperti bakteri E.coli K99 dari embrio (Otoi et al. 1993). Hal ini mungkin disebabkan antigen pili K99 dapat menempel pada komponen glikolipid yang mengandung asam muramik, galaktosa, dan glukosa (Isaacson 1985). Oleh karena itu perlu dilakukan penelitian untuk menguji kemampuan zona pelusida sebagai barier atau pelindung embrio terhadap E.coli K99 dan kemampuan hidup embrio yang memiliki zona pelusida utuh dan yang tidak memiliki zona dalam medium kultur embrio yang dicemari bakteri E.coli K99.
4.2 MATERI DAN METODE
4.2.1 Superovulasi dan panen embrio
Mencit betina berumur 12 minggu yang berasal dari koloni bebas penyakit, dirangsang folikulogenesis ovariumnya dengan menyuntikkan hormon
pregnant mare’s serum gonadotropine (PMSG) (Folligon, Intervet, Boxmeer, Holland) 5-IU secara intra peritoneum pada pukul 16.00. Setelah 48 jam penyuntikan PMSG, dilakukan penyuntikan hormon human chorionic gonadotropin (HCG) (Chorulon, Intervet, Boxmeer, Holland) 5-IU secara intraperitoeum. Mencit betina tersebut setelah disuntik HCG langsung dikawinkan dengan mencit jantan dengan perbandingan 1:1. Hari berikutnya, mencit betina yang telah kawin ditandai dengan adanya sumbat vagina (vagina plug) dipisahkan dari pejantan. Tiga hari setelah dipisahkan dengan pejantannya, mencit betina bunting itu dimatikan dengan cara dislokasio os occipitalis. Bagian oviduk atau tuba Falopii diisolasi dan ditempatkan pada medium mPBS (Hogan
4.2.2 Penghilangan zona pelusida
Embrio tahap delapan sel atau morula, zona pelusidanya dihilangkan guna mendapatkan embrio tanpa zona pelusida. Zona pelusida dihilangkan dengan cara merendam embrio tersebut dalam mPBS yang mengandung enzim pronase 0.25% (Sigma St.Louis USA) selama kurang lebih tiga menit dan tetap diamati di bawah mikroskop untuk mengetahui proses peluruhan zona pelusida. Segera setelah zona pelusida menjadi sangat tipis akibat perlakuan pronase, embrio dipindahkan ke larutan mPBS (Boediono et al. 1993), dan dicuci berturut-turut sebanyak tiga kali.
4.2.3 Penyiapan bakteri E.coli K99
Bakteri E.coli diperoleh dari Balai Penelitian Veteriner (Balitvet) Bogor. Bakteri E.coli O9 K99 diisolasi dari anak sa