POTENSI BAKTERI SALURAN PENCERNAAN IKAN NILA
(
Oreochromis niloticus
) SEBAGAI KANDIDAT PROBIOTIK
BERBASIS ENZIM
TESIS
Oleh
UMMI MARDHIAH BATUBARA
117030019/BIO
PROGRAM PASCASARJANA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
POTENSI BAKTERI SALURAN PENCERNAAN IKAN NILA
(
Oreochromis niloticus
) SEBAGAI KANDIDAT PROBIOTIK
BERBASIS ENZIM
TESIS
Diajukan sebagai salah satu syarat untuk memperoleh
gelar Magister Sains dalam Program Studi Magister Ilmu Biologi
pada Program Pascasarjana Fakultas Matematika dan Ilmu
Pengetahuan Alam Universitas Sumatera Utara
Oleh
UMMI MARDHIAH BATUBARA
117030019/BIO
PROGRAM PASCASARJANA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
PENGESAHAN TESIS
Judul Tesis : POTENSI BAKTERI SALURAN
PENCERNAAN IKAN NILA (Oreochromis niloticus) SEBAGAI KANDIDAT PROBIOTIK BERBASIS ENZIM
Nama Mahasiswa : UMMI MARDHIAH BATUBARA
Nomor Induk Mahasiswa : 117030019 Program Studi : Magister Biologi
Fakultas : Matematika dan Ilmu Pengetahuan Alam Universitas Sumatera Utara
Menyetujui Komisi Pembimbing
Pembimbing I, Pembimbing II,
Prof. Dr. Erman Munir, M.Sc Dr. It Jamilah, M.Sc
NIP.19631012 199103 2 003 NIP.19651101 199103 1 002
Ketua program Studi , Dekan,
Prof. Dr. SyafruddinIlyas, M.Biomed Dr. Sutarman, M.Sc
PERNYATAAN ORISINALITAS
POTENSI BAKTERI SALURAN PENCERNAAN IKAN NILA
(
Oreochromis niloticus
) SEBAGAI KANDIDAT PROBIOTIK
BERBASIS ENZIM
TESIS
Dengan ini saya nyatakan bahwa saya mengakui semua karya tesis ini adalah hasil kerja saya sendiri kecuali kutipan dan ringkasan yang tiap satunya telah di jelaskan sumbernya dengan benar.
Medan, 23 Agustus 2013
PERNYATAAN PERSETUJUAN PUBLIKASI
KARYA ILMIAH UNTUK KEPENTINGAN
AKADEMIS
Sebagai sivitas akademika Universitas Sumatera Utara, saya yang bertanda tangan di bawah ini :
Nama : Ummi Mardhiah Batubara
NIM : 117030019
Program Studi : Magister Biologi Jenis Karya Ilmiah : Tesis
Demi pengembangan ilmu pengetahuan, menyetujui untuk memberikan kepada Universitas Sumatera Utara Hak Bebas Royalti Non-Eksklusif (Non-Exclusive Royalty Free Right) atas Tesis saya yang berjudul :
Potensi Bakteri Saluran Pencernaan Ikan Nila (Oreochromis niloticus) Sebagai Kandidat Probiotik Berbasis Enzim
Beserta perangkat yang ada (jika diperlukan). Dengan Hak Bebas Royalti Non-Eksklusif ini, Universitas Sumatera Utara berhak menyimpan, mengalih data, menformat, mengelola dalam bentuk data-base, merawat dan mempublikasikan Tesis saya tanpa meminta izin dari saya selama tetap mencantumkan nama saya sebagai penulis dan sebagai pemegang dan atau sebagai pemilik hak cipta.
Demikian pernyataan ini dibuat dengan sebenarnya.
Medan, 23 Agustus 2013
Telah diuji pada
Tanggal : 23 Agustus 2013
PANITIA PENGUJI TESIS
Ketua
:
Prof. Dr. Erman Munir, M.Sc
Anggota
:
1. Dr. It Jamilah, M.Sc
2. Prof. Dr. Dwi Suryanto, M.Sc
RIWAYAT HIDUP
DATA PRIBADI
Nama Lengkap : Ummi Mardhiah Batubara, S.Si, M.Si
Tempat dan Tanggal Lahir : Kisaran, 14 April 1988
Alamat Rumah : Jl. Tanjung 2 No. 149 Prumnas Helvetia
Medan-20124
Telepon : +6282367924180 / +6285761455090
Email : [email protected]
DATA PENDIDIKAN
SD : Negeri 013858 Kisaran Tamat : 1999
SMP : SMP Negeri 2 Kisaran Tamat : 2002
SMA : SMA Negeri 2 Kisaran Tamat : 2005
Strata-1 : Universitas Sumatera Utara Tamat : 2009
KATA PENGANTAR
Segala puji dan syukur kehadirat Allah SWT Tuhan Yang Maha Esa atas segala limpahan rahmad dan karunia-NYA sehingga penulis dapat menyelesaikan tesis yang berjudul “Potensi bakteri saluran pencernaan ikan nila (Oreochromis niloticus) sebagai kandidat probiotik berbasis enzim”. Dengan selesainya tesis ini, perkenankanlah penulis mengucapkan terima kasih yang sebesar-besarnya kepada:
Rektor Universitas Sumatera Utara, Prof. Dr. dr. Syahril Pasaribu, DTM&H, M.Sc (CTM), Sp. A(K) atas kesempatan yang diberikan kepada penulis untuk mengikuti dan menyelesaikan pendidikan Program Magister. Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam, Dr. Sutarman, M.Sc. Ketua Program Pascasarjana Magister Biologi Prof. Dr. Syafruddin Ilyas, M. Biomed. Sekretaris Program Studi Dr. Suci Rahayu, M.Si dan seluruh Staf Pengajar pada Program Studi Magister Biologi Program Pascasarjana Fakultas MIPA Universitas Sumatera Utara.
Terima kasih yang sebesar-besarnya juga penulis sampaikan kepada Bapak Prof. Dr. Erman Munir M.Sc dan Ibu Dr. It Jamilah M.Sc selaku dosen pembimbing serta Bapak Prof. Dr. Dwi Suryanto M.Sc dan Ibu Dr. Hesti Wahyuningsih, M.Si selaku dosen penguji yang dengan penuh kesabaran menuntun dan membimbing penulis selama proses penelitian dan penyusunan tesis ini.
Ucapan terima kasih kepada Direktorat Jenderal Pendidikan Tinggi (DIKTI) yang telah memberikan beasiswa kepada penulis melalui program Beasiswa Unggulan 2011. Terima kasih juga disampaikan kepada Kepala Unit Pelayanan Teknis Daerah (UPTD) Budidaya Dinas Perikanan dan Kelautan Medan, Kepala Laboratorium dan Staf Laboratorium Mikrobiologi Universitas Sumatera Utara (USU), Direktur Balai Teknis Kesehatan Lingkungan Penanggulangan Penyakit Menular (BTKL-PPM) Kelas I Medan serta teknisi Laboratorium Biologi, Kimia dan Parasitologi pada instansi tersebut.
Terima kasih yang tak terhingga juga penulis sampaikan kepada kedua orang tua yang sangat penulis cintai Ayahanda Drs. H. Hasyim Mahmud, MM dan Ibunda Rosdah, S.Pd, Abangda Awaluddin Batubara, SE dan M. Irfan Batubara, SH, Kakanda Zulfa Khairina Batubara, SE, M.Si, Adinda Hikmah Ramadhani Batubara, SE, Aulia Rahmi Batubara, M. Ihsan Batubara dan Rizki Fadhilah Batubara serta seluruh keluarga besar, sahabat-sahabat terbaik dan rekan-rekan penulis yang telah memberikan segala cinta dan kasih sayang, dukungan dan motivasi, sehingga penulis dapat menyelesaikan tesis ini dengan baik. Dan untuk berbagai pihak yang tidak dapat penulis sebutkan satu persatu, penulis mengucapkan terima kasih. Semoga Allah SWT memberikan balasan datas segala pengorbanan dan budi baik yang telah diberikan. Akhir kata, penulis berharap semoga tesis ini dapat bermanfaat khususnya dalam pengembangan ilmu pengetahuan.
POTENSI BAKTERI SALURAN PENCERNAAN IKAN
NILA (
Oreochromis niloticus
) SEBAGAI KANDIDAT PROBIOTIK
BERBASIS ENZIM
ABSTRAK
Indonesia merupakan negara yang memiliki kekayaan melimpah dengan potensi akuakultur terbesar di dunia. Potensi ini menjadikan sektor perikanan sebagai salah satu sumber devisa negara. Penurunan kualitas perikanan Indonesia mendorong penggunaan probiotik. Studi potensi bakteri saluran pencernaan ikan nila (Oreochromis niloticus) sebagai kandidat probiotik berbasis enzim bertujuan untuk memperoleh bakteri dari organ pencernaan ikan nila yang berpotensi sebagai kandidat bakteri probiotik. Penelitian ini dilakukan dengan mengisolasi bakteri dan mengkultur isolat pada media skim milk agar untuk enzim protease, media garam minimum kitin agar untuk enzim kitinase dan media starch agar untuk enzim amilase pada suhu 28 oC. Kandidat isolat potensial ditetapkan berdasarkan besarnya zona hidrolisis pada media. Dari 59 isolat yang diperoleh dari organ pencernaan 6 varietas ikan nila, diperoleh 12 isolat yang memiliki diameter zona hidrolisis proteolitik ≥ β,5 cm dan diameter zona amilolitik dan kitinolitik ≥ 1 cm dengan karakteristik morfologi dan sifat fisiologi isolat yang bervariasi. Uji in vitro menunjukkan bahwa isolat USp-5 memiliki persentasi penghambatan tertinggi 76 % terhadap Aeromonas hydrophilla, sedangkan isolat UJL-2 dan LSp-2 memiliki persentasi penghambatan tertinggi 91,1 % dan 77 % terhadap Saprolegnia sp. Dua isolat potensial dipilih berdasarkan aktivitas hidrolitik dan kemampuan dalam menghambat pertumbuhan jamur Saprolegnia sp. dan A.hydrophila. Selanjutnya, kedua isolat potensial USp-5 dan LSp-2 diukur aktivitas enzim amilase dan kitinasenya. Hasil yang diperoleh menunjukkan aktivitas enzim amilase isolat USp-5 dan LSp-2 tertinggi adalah 0,075 U/ml dan 0,100 U/ml, sedangkan aktivitas enzim kitinase tertinggi kedua isolat sama yaitu 0,0018 U/ml pada masa inkubasi jam ke-96. Hasil ini menunjukkan bahwa kedua isolat potensial dapat dikembangkan sebagai kandidat probiotik dan agen hayati di perairan.
POTENTIAL OF DIGESTIVE TRACT BACTERIA OF TILAPIA
(
Oreochromis niloticus
) AS A PROBIOTIC CANDIDATE
BASED ON ENZYMES
ABSTRACT
Indonesia is a country that has abundant wealth largest potential of aquaculture in the world. This potency makes the fisheries sector as a source of foreign exchange. The decrease in quality Indonesian fisheries encourage the use of probiotic. Study of potential digestive tract bacterial of tilapia (Oreochromis niloticus) as a probiotic candidate based on enzymes were aimed to obtain the digestive organs of tilapia as a potential probiotic candidate bacteria. This research has been conducted by culturing the isolates on skim milk agar for protease, chitin minimum salt medium for chitinase and starch agar for amylase at temperature 28 °C. The potential candidate was determined based on hydrolysis zone of enzyme in each medium. Fifty nine isolates were obtained from 6 varieties of the tilapia digestive organ and twelve of them have diameter of proteolytic zone ≥ β.5 cm and diameter of amylolytic and chitinolytic zone ≥ 1 cm with various morphology and physiology isolates characteristic. In vitro examination showed that USp-5 isolate has the highest inhibitory index 0,76 in inhibiting the growth of Aeromonas hydrophilla. Meanwhile, UJL-2 and LSp-2 isolates have the highest inhibition rate (91.1% and 77%, respectively) in inhibiting the growth of Saprolegnia sp. Two potential isolates were selected based on the ability to hydrolyze three types of substrate and inhibit the growth of fungus Saprolegnia sp. and A. hydrophila. Subsequently, amylase and chitinase activities of the two potential USp-5 and LSp-2 isolates were measured. The results showed that the highest amylase activity of the USp-5 and LSp-2 isolates were 0.075 U/ml and 0,100 U/ml, respectively while the highest chitinase activity of the two isolates were 0,0018 U/ml at the 96 hour of incubation. The results indicate that both of isolates could be potentially developed as a probiotic candidate and biological control agents in aquaculture.
DAFTAR ISI
Halaman
DAFTAR RIWAYAT HIDUP i
KATA PENGANTAR ii
ABSTRAK iii
ABSTRACT iv
DAFTAR ISI v
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vii
BAB I PENDAHULUAN 1.1 Latar belakang 1.2 Permasalahan 1.3 Tujuan 1.4 Hipotesis 1.5 Manfaat 1 3 4 4 5
BAB II TINJAUAN PUSTAKA 2.1 Komoditas Akuakultur 2.2 Budi daya Ikan Nila
2.3 Penanggulangan Penyakit Ikan 2.4 Saluran Pencernaan Ikan Nila 2.5 Probiotik
6 6 9 9 11
BAB III METODOLOGI PENELITIAN 3.1 Waktu dan Tempat
3.2 Bahan dan Alat
3.3 Pelaksanaan Penelitian
3.3.1 Isolasi dan Seleksi Bakteri Kandidat Probiotik 3.3.2 Karakterisasi Ciri Morfologi dan Sifat Fisiologi 3.3.3 Isolasi Bakteri Asam Laktat (BAL)
3.4 Uji Aktivitas Enzim Secara Kualitatif
3.4.1 Uji Aktivitas Kitinolitik, Proteolitik dan Amilolitik 3.5 Uji In Vitro
3.5.1 Uji Kandidat Bakteri Probiotik Terhadap Aeromonas hydrophila patogen
3.5.2 Uji Kandidat Bakteri Probiotik Terhadap Saprolegnia sp. Patogen
3.6 Uji Aktivitas Enzim Secara Kuantitatif 3.6.1 Produksi Enzim Kitinase 3.6.2 Uji Aktivitas Kitinase 3.6.3 Produksi Enzim Amilase 3.6.4 Uji Aktivitas Amilase
BAB IV HASIL DAN PEMBAHASAN
4.1 Isolat Bakteri Kandidat Probiotik Berdasarkan Aktivitas Enzim
4.1.1 Aktivitas Enzim Secara Kualitatif 4.1.2 Seleksi Isolat Potensial
4.2 Karakteristik Isolat Kandidat Probiotik
4.3 Uji In Vitro Daya Hambat Pertumbuhan Bakteri Isolat Kandidat Probiotik Terhadap Pertumbuhan Jamur Saprolegnia sp. dan Aeromonas hydrophila
4.4 Aktivitas Enzim Kitinase dan Amilase Secara Kuantitatif
22
22 27 28 32
36
BAB V KESIMPULAN DAN SARAN 5.1 Kesimpulan
5.2 Saran
40 40
DAFTAR PUSTAKA 41
DAFTAR TABEL
Nomor Tabel
Judul Halaman
2.1 Beberapa Penyakit yang Umumnya Menginfeksi Nila 8 4.1 Rekapitulasi Jumlah Isolat dan Aktivitas Enzim yang
Dimiliki Setiap Sampel yang Diisolasi dari Saluran Pencernaan Ikan
23
4.2 Ciri Morfologi dan Sifat Fisiologi Beberapa Isolat Kandidat Probiotik dari Saluran Pencernaan Ikan Nila.
31
4.3 Daya Hambat dan Indeks Penghambatan Isolat-Isolat Kandidat Probiotik Terhadap Saprolegnia sp. dan A. hydrophila Secara In Vitro
34
DAFTAR GAMBAR
Nomor Gambar
Judul Halaman
2.1 Skema Pengaruh Pemberian Probiotik Pada Budidaya dan Dihubungkan Dengan Faktor yang Mempengaruhi Terjadinya Infeksi Inang
13
4.1 Zona Hidrolisis Enzim 25
4.2 Diameter Zona Hidrolisis Beberapa Isolat Bakteri Kandidat Probiotik Pada Media Uji
27
4.3 Pewarnaan Gram Bakteri Kandidat Probiotik 29
4.4 Uji In Vitro Bakteri Kandidat Probiotik Dengan Saprolegnia sp.
33
4.5 Uji In Vitro Bakteri Kandidat Probiotik Terhadap Aeromonas hydrophila
35
4.6 Aktivitas Enzim Amilase Isolat LSp-2 dan USp-5 pada Substrat Pati 1 %
36
4.7 Aktivitas Enzim Kitinase Isolat LSp-2 dan USp-5 pada Substrat Koloidal Kitin 1 %
DAFTAR LAMPIRAN
Nomor Lampiran
Judul Halaman
A Alur Kerja Penelitian 49
B Komposisi Media Skim MilkAgar, Preparasi Koloidal
Kitin dan Komposisi Media Garam Minimum Kitin 50 C Pembuatan kurva standar N-asetilglukosamin, Maltosa
dan Pembuatan Larutan 51
D Data Penelitian 52
POTENSI BAKTERI SALURAN PENCERNAAN IKAN
NILA (
Oreochromis niloticus
) SEBAGAI KANDIDAT PROBIOTIK
BERBASIS ENZIM
ABSTRAK
Indonesia merupakan negara yang memiliki kekayaan melimpah dengan potensi akuakultur terbesar di dunia. Potensi ini menjadikan sektor perikanan sebagai salah satu sumber devisa negara. Penurunan kualitas perikanan Indonesia mendorong penggunaan probiotik. Studi potensi bakteri saluran pencernaan ikan nila (Oreochromis niloticus) sebagai kandidat probiotik berbasis enzim bertujuan untuk memperoleh bakteri dari organ pencernaan ikan nila yang berpotensi sebagai kandidat bakteri probiotik. Penelitian ini dilakukan dengan mengisolasi bakteri dan mengkultur isolat pada media skim milk agar untuk enzim protease, media garam minimum kitin agar untuk enzim kitinase dan media starch agar untuk enzim amilase pada suhu 28 oC. Kandidat isolat potensial ditetapkan berdasarkan besarnya zona hidrolisis pada media. Dari 59 isolat yang diperoleh dari organ pencernaan 6 varietas ikan nila, diperoleh 12 isolat yang memiliki diameter zona hidrolisis proteolitik ≥ β,5 cm dan diameter zona amilolitik dan kitinolitik ≥ 1 cm dengan karakteristik morfologi dan sifat fisiologi isolat yang bervariasi. Uji in vitro menunjukkan bahwa isolat USp-5 memiliki persentasi penghambatan tertinggi 76 % terhadap Aeromonas hydrophilla, sedangkan isolat UJL-2 dan LSp-2 memiliki persentasi penghambatan tertinggi 91,1 % dan 77 % terhadap Saprolegnia sp. Dua isolat potensial dipilih berdasarkan aktivitas hidrolitik dan kemampuan dalam menghambat pertumbuhan jamur Saprolegnia sp. dan A.hydrophila. Selanjutnya, kedua isolat potensial USp-5 dan LSp-2 diukur aktivitas enzim amilase dan kitinasenya. Hasil yang diperoleh menunjukkan aktivitas enzim amilase isolat USp-5 dan LSp-2 tertinggi adalah 0,075 U/ml dan 0,100 U/ml, sedangkan aktivitas enzim kitinase tertinggi kedua isolat sama yaitu 0,0018 U/ml pada masa inkubasi jam ke-96. Hasil ini menunjukkan bahwa kedua isolat potensial dapat dikembangkan sebagai kandidat probiotik dan agen hayati di perairan.
POTENTIAL OF DIGESTIVE TRACT BACTERIA OF TILAPIA
(
Oreochromis niloticus
) AS A PROBIOTIC CANDIDATE
BASED ON ENZYMES
ABSTRACT
Indonesia is a country that has abundant wealth largest potential of aquaculture in the world. This potency makes the fisheries sector as a source of foreign exchange. The decrease in quality Indonesian fisheries encourage the use of probiotic. Study of potential digestive tract bacterial of tilapia (Oreochromis niloticus) as a probiotic candidate based on enzymes were aimed to obtain the digestive organs of tilapia as a potential probiotic candidate bacteria. This research has been conducted by culturing the isolates on skim milk agar for protease, chitin minimum salt medium for chitinase and starch agar for amylase at temperature 28 °C. The potential candidate was determined based on hydrolysis zone of enzyme in each medium. Fifty nine isolates were obtained from 6 varieties of the tilapia digestive organ and twelve of them have diameter of proteolytic zone ≥ β.5 cm and diameter of amylolytic and chitinolytic zone ≥ 1 cm with various morphology and physiology isolates characteristic. In vitro examination showed that USp-5 isolate has the highest inhibitory index 0,76 in inhibiting the growth of Aeromonas hydrophilla. Meanwhile, UJL-2 and LSp-2 isolates have the highest inhibition rate (91.1% and 77%, respectively) in inhibiting the growth of Saprolegnia sp. Two potential isolates were selected based on the ability to hydrolyze three types of substrate and inhibit the growth of fungus Saprolegnia sp. and A. hydrophila. Subsequently, amylase and chitinase activities of the two potential USp-5 and LSp-2 isolates were measured. The results showed that the highest amylase activity of the USp-5 and LSp-2 isolates were 0.075 U/ml and 0,100 U/ml, respectively while the highest chitinase activity of the two isolates were 0,0018 U/ml at the 96 hour of incubation. The results indicate that both of isolates could be potentially developed as a probiotic candidate and biological control agents in aquaculture.
BAB I
PENDAHULUAN
1.1. Latar Belakang
Kebutuhan akan ikan dunia mengalami peningkatan setiap tahunnya. Data FAO (2011)
menunjukkan peningkatan produksi perikanan dunia mencapai 114,6 juta metrik ton per
tahun dan 37 % hasil perdagangan dunia dikuasai oleh produk perikanan. Meningkatnya
kebutuhan ikan dipengaruhi oleh kandungan nutrisi ikan yang menjadi sumber protein
dan mikronutrien dalam tubuh. FAO menyatakan bahwa 16,6 % sumber protein
penduduk dunia berasal dari protein hewani dan 6,5 % berasal dari sumber makanan
lain.
Terbatasnya hasil tangkapan ikan di laut menjadi alasan utama berkembangnya
usaha budi daya di dunia. Budi daya ikan merupakan cara cepat dalam memenuhi
kebutuhan pangan masyarakat dunia. Tahun 1999 produksi perikanan dunia didominasi
oleh ikan air tawar (58 %), diikuti oleh ikan air laut (36 %) dan ikan air payau (6 %)
(Van West 2006). Salah satu jenis ikan air tawar yang berpotensi sebagai sumber
protein bernilai ekonomis dan mudah dikembangkan sebagai ikan budi daya adalah ikan
nila. Berdasarkan angka statistik Kementrian Kelautan dan Perikanan (KKP) produksi
perikanan budi daya ikan nila meningkat dari 206.904 ton pada tahun 2007 menjadi
464.191 pada tahun 2010.
Ikan merupakan salah satu komoditas unggulan bagi sektor perikanan dan
merupakan sumber devisa negara. Tercatat produksi perikanan mengalami peningkatan
dari 4,78 juta ton pada tahun 2010 menjadi 7,92 juta ton pada tahun 2011, dengan nilai
sering dihadapi dalam budi daya ikan ialah pertumbuhan ikan yang lambat dan tingkat
kelangsungan hidup yang rendah yaitu hanya mencapai 50 % dari penebaran benih
(Arlia 1994; Mokoginta et al. 1996). Selain itu, infeksi penyakit seperti Saprolegnia sp.
(Bruno & Wood 1999) dan Aeromonas hydrophila (Gibson et al. 1998) di lingkungan
perairan serta tidak tercernanya pakan buatan dalam organ pencernaan dan di
lingkungan perairan juga menjadi faktor menurunnya produksi ikan budi daya.
Salah satu strategi peningkatan nilai gizi pakan dan pengendalian penyakit
akuakultur yang diterapkan ialah penggunaan bakteri probiotik. Saat ini, probiotik
bukan hanya digunakan sebagai agen pencegahan (prophylactic) namun juga sebagai
agen pengobatan (therapeutic) (Cunningham 1994; Marteau et al. 2001; Lisai 2005).
Pengendalian penyakit dan peningkatan produksi pakan dapat dilakukan dengan
memanfaatkan produksi enzim ekstraseluler bakteri probiotik. Enzim ekstraseluler
seperti amilase mampu mengkatalis proses hidrolisis pati menjadi komponen yang
sederhana. Sehingga proses pencernaan karbohidrat akan lebih mudah. Enzim kitinolitik
sangat berpotensi sebagai agen pengendalian hayati jamur patogen Aspergillus sp. dan
Saprolegnia sp. (Malau 2012; Dewi 2011; Muharni & Widjajanti 2011). Komponen
kitin yang terdapat pada dinding sel jamur dapat didegradasi oleh enzim kitinolitik dan
hasilnya akan digunakan bakteri probiotik sebagai sumber karbon dan energi sedangkan
enzim protease dapat meningkatkan nilai gizi pakan sehingga berpengaruh pada
pertumbuhan ikan. Selain itu, enzim protease juga memiliki kemampuan dalam
menghambat pertumbuhan mikroorganisme patogen. Rachmadi (2008) melaporkan
bahwa Proteobakteria dari genus Aeromonas mampu menghambat pertumbuhan
Microcystic aeruginosa melalui sekresi senyawa yang mampu menghancurkan dinding
sel bakteri sehinggga menyebabkan kematian sel.
Enzim ekstraseluler juga memiliki peranan dalam meningkatkan kualitas pakan ikan. Balca’zar et al. (2006) & Vine et al. (2006) melaporkan bahwa enzim proteolitik mampu menghidrolisis senyawa-senyawa yang bersifat protein sehingga daya cerna
pakan dan nilai Food Convertion Ratio (FCR) akan meningkat. Dharmaraj et al. (2009)
tambahan pada ikan Xiphophorus helleri menunjukkan nilai yang signifikan dan efektif
sebagai agen pengendalian patogen pada ikan. Hal ini menunjukkan bahwa penerapan
probiotik dalam akuakultur terbukti mampu meningkatkan resistensi hewan akuatik
terhadap serangan patogen (Rengpipat et al. 2000; Verschure 2000).
Probiotik merupakan salah satu alternatif yang dikembangkan dalam mengatasi
permasalahan di akuakultur. Penggunaan probiotik di akuakultur dapat diaplikasikan
dengan beberapa cara, salah satunya adalah sebagai pakan aditif (feed additives)
(Aslamsyah 2011). Pakan aditif merupakan zat yang ditambahkan dalam jumlah tertentu
yang berperan dalam peningkatan nutrisi pakan, peningkatan laju pertumbuhan dan
melindungi ikan dari serangan patogen. Probiotik merupakan salah satu pakan aditif
yang didefinisikan sebagai mikroba hidup yang berfungsi sebagai makanan suplemen
untuk meningkatkan keseimbangan mikroba usus dan membantu pertumbuhan
(Gatesoupe 1999).
1.2. Permasalahan
Kebutuhan pangan asal laut khususnya ikan secara nasional maupun internasional
mengalami peningkatan yang signifikan. Hal ini merupakan suatu fenomena yang
menguntungkan bagi pemilik usaha budi daya ikan. Peningkatan pasar dunia terhadap
pasokan perikanan diperkirakan akan terus meningkat seiring dengan laju kenaikan dan
pendapatan penduduk. Namun demikian, permasalahan yang dihadapi dalam budi daya
ikan sering kali menyebabkan pertumbuhan yang lambat dan tingkat kelangsungan
hidup yang rendah, akibatnya produksi ikan yang dihasilkan tidak sesuai dengan yang
diharapkan.
Berbagai upaya telah dilakukan untuk menanggulangi permasalahan budi daya
ikan seperti penggunaan antibiotik sintetik (Chlorine, Chloramphenicol dan
Oxytetracycline) atau senyawa kimia lain. Akan tetapi, upaya tersebut tidak efektif
digunakan karena berdampak negatif terhadap daya tahan dan pertumbuhan ikan
Sundana 2002). Adapun cara lain yang digunakan dengan menggunakan bakteri
probiotik. Selain dapat mengendalikan bakteri patogen, probiotik juga mampu
meningkatkan pertumbuhan ikan.
Perkembangan usaha budi daya di bidang perikanan memacu penggunaan
probiotik di akuakultur. Hasil penelitian melaporkan penggunaan bakteri probiotik
mampu memberi kontribusi terhadap perbaikan lingkungan budi daya dan berpengaruh
terhadap peningkatan kesehatan ikan sehingga tahan terhadap serangan penyakit (Balca’zar β006; Rahayu β00λ; Aslamsyah β011). Oleh karena itu, perlu dilakukan eksplorasi bakteri alam dari organ pencernaan ikan nila dan potensinya sebagai kandidat
bakteri probiotik melalui uji aktivitas enzim ekstraseluler yang mampu menghambat
pertumbuhan bakteri patogen Aeromonas hydrophila dan Saprolegnia sp. serta enzim
yang membantu degradasi sisa pakan.
1.3. Tujuan
Tujuan penelitian ini ialah :
a. untuk memperoleh bakteri dari organ pencernaan ikan nila yang potensial dalam
menghambat pertumbuhan bakteri Aeromonas hydrophila dan jamur
Saprolegnia sp.
b. untuk memperoleh bakteri dari organ pencernaan ikan nila yang potensial dalam
mendegradasi kitin, protein dan amilum.
c. untuk mengetahui aktivitas enzim kitinase, protease dan amilase dari isolat
potensial kandidat probiotik.
1.4. Hipotesis
Hipotesis dari penelitian ini ialah :
a. bakteri dari organ pencernaan ikan nila potensial dalam menghambat
pertumbuhan Aeromonas hydrophila dan Saprolegnia sp.
b. bakteri dari organ pencernaan ikan nila potensial dalam mendegradasi kitin,
1.5. Manfaat
Manfaat dari penelitian ini ialah :
a. mendapatkan bakteri potensial yang dapat digunakan sebagai kandidat bakteri
probiotik.
b. memberikan informasi tentang pemanfaatan bakteri probiotik di akuakultur.
BAB II
TINJAUAN PUSTAKA
2.1. Komoditas Akuakultur
Indonesia merupakan negara kepulauan dengan wilayah perairan yang sangat luas
mencakup lebih dari 70 % total wilayah. Kondisi ini menjadikan Indonesia sebagai
salah satu negara yang memiliki kekayaan melimpah dengan potensi produksi
akuakultur terbesar di dunia. Data KKP (2010) menunjukkan bahwa produksi
akuakultur yang dihasilkan hanya mencapai 4,78 juta ton atau sekitar 9,6 % dari total
potensi produksi. Produksi akuakultur Indonesia bersumber dari hasil budi daya laut
(potensi 42 juta ton/tahun), budi daya tambak (potensi 10 juta ton/tahun) dan budi daya
air tawar (potensi 48 juta ton/tahun) (FAO 2011).
Perikanan budi daya di Indonesia merupakan salah satu sumber pemasukan
devisa negara. Sektor perikanan dan kelautan memiliki potensi yang besar untuk
dikembangkan dan dijadikan sebagai prioritas utama dalam pembangunan Indonesia
masa depan dalam rangka menggerakkan kembali roda perekonomian nasional yang
terpuruk akibat krisis ekonomi tahun 1997. Selain itu 70 % hasil budi daya perikanan
seperti ikan merupakan sumber protein hewani yang dikonsumsi rakyat Indonesia.
Dengan demikian, kebutuhan gizi bangsa Indonesia dapat ditingkatkan seiring dengan
tingginya produksi perikanan budi daya (KKP 2011).
2.2. Budi daya Ikan Nila
Ikan nila merupakan spesies yang berasal dari kawasan sungai Nil dan danau di Afrika.
beriklim tropis dan lebih suka hidup di perairan dangkal. Nila memiliki ciri tubuh yang
berbentuk pipih memanjang ke samping, memiliki garis vertikal disepanjang tubuh
dengan mata menonjol dan besar. Nila memiliki daging yang tebal dan tidak berduri.
Jenis nila yang berkembang di Indonesia adalah nila hitam dan merah (Irianto 2003).
Nila merupakan ikan air tawar yang banyak dikembangkan sebagai ikan budi
daya. Nila mempunyai pertumbuhan yang relatif cepat dengan rataan pertumbuhan
harian (Average Daily Growth-ADG) mencapai 4,1 g/hari (Irianto 2003), memiliki
resistensi yang relatif tinggi terhadap kualitas air dan penyakit, memiliki toleransi yang
luas terhadap kondisi lingkungan, memiliki kandungan protein yang tinggi, mudah
hidup pada budi daya intensif, serta dapat beradaptasi pada salinitas tinggi sehingga
mudah beradaptasi pada lingkungan air payau dan air tawar (Aslamsyah 2011; Irianto
2003; KKP 2010).
Pertumbuhan ikan budi daya dipengaruh oleh beberapa faktor. Beberapa
diantaranya ialah kualitas pakan dan infeksi patogen yang berasal dari lingkungan.
Pakan merupakan faktor utama dalam budi daya ikan. Pakan berperan dalam proses
metabolisme, pertumbuhan dan fisiologi ikan. Ikan dapat tumbuh optimal jika
kandungan pakan bermutu baik dengan jumlah yang seimbang. Sumber utama pakan
antara lain protein, lemak, karbohidrat, vitamin dan mineral (Watanabe 1988; NRC
1983). Kekurangan dalam pakan dapat menurunkan aktivitas pertumbuhan dan
berpotensi meningkatkan serangan infeksi pada ikan. Lovell (1988) menyatakan bahwa
protein merupakan nutrisi yang dibutuhkan untuk pemeliharaan tubuh, pengganti
jaringan yang rusak, pertumbuhan jaringan, dan membentuk jaringan tubuh dalam
proses pertumbuhan (Halver 1988). Apabila protein dalam pakan kurang maka protein
di dalam jaringan tubuh akan dimanfaatkan untuk mempertahankan fungsi jaringan
yang penting (Lovell 1988). Sebaliknya apabila protein pakan berlebih dan tidak
digunakan dalam sintesis protein tubuh ikan, maka akan diekskresikan sebagai buangan
nitrogen.
Serangan bakteri patogen juga menjadi ancaman utama keberhasilan budi daya
area terbatas menyebabkan kondisi lingkungan tersebut sangat mendukung
perkembangan dan penyebaran penyakit. Kondisi dengan padat tebar tinggi akan
menyebabkan ikan mudah stres sehingga menyebabkan ikan menjadi mudah terserang
penyakit. selain itu, kualitas air dan alirannya berpengaruh terhadap berkembangnya
suatu penyakit. Populasi yang tinggi akan mempermudah penularan karena
meningkatnya kemungkinan kontak antara ikan yang sakit dengan ikan yang sehat
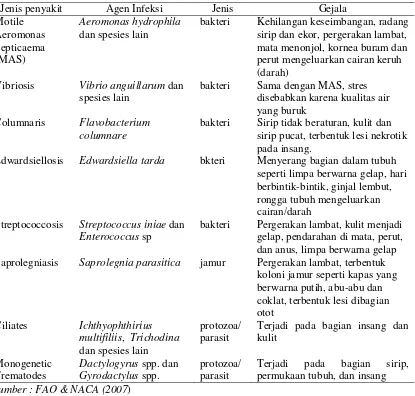
(Irianto 2005) Beberapa penyakit yang umumnya menginfeksi ikan nila dapat dilihat
[image:24.595.96.511.330.726.2]pada Tabel 2.1 dibawah ini.
Tabel 2.1. Beberapa Penyakit Yang Umumnya Menginfeksi Ikan Nila
Jenis penyakit Agen Infeksi Jenis Gejala
Motile Aeromonas Septicaema (MAS)
Aeromonas hydrophila dan spesies lain
bakteri Kehilangan keseimbangan, radang sirip dan ekor, pergerakan lambat, mata menonjol, kornea buram dan perut mengeluarkan cairan keruh (darah)
Vibriosis Vibrio anguillarum dan spesies lain
bakteri Sama dengan MAS, stres disebabkan karena kualitas air yang buruk
Columnaris Flavobacterium columnare
bakteri Sirip tidak beraturan, kulit dan sirip pucat, terbentuk lesi nekrotik pada insang.
Edwardsiellosis Edwardsiella tarda bkteri Menyerang bagian dalam tubuh seperti limpa berwarna gelap, hari berbintik-bintik, ginjal lembut, rongga tubuh mengeluarkan cairan/darah
Streptococcosis Streptococcus iniae dan Enterococcus sp
bakteri Pergerakan lambat, kulit menjadi gelap, pendarahan di mata, perut, dan anus, limpa berwarna gelap Saprolegniasis Saprolegnia parasitica jamur Pergerakan lambat, terbentuk
koloni jamur seperti kapas yang berwarna putih, abu-abu dan coklat, terbentuk lesi dibagian otot
Ciliates Ichthyophthirius multifiliis, Trichodina dan spesies lain
protozoa/ parasit
Terjadi pada bagian insang dan kulit
Monogenetic Trematodes
Dactylogyrus spp. dan Gyrodactylus spp.
protozoa/ parasit
2.3. Penanggulangan Penyakit Ikan
Budi daya ikan nila sering kali mengalami kendala, khususnya diakibatkan oleh
serangan penyakit melalui lingkungan perairan atau pakan yang dikonsumsi.
Pengendalian penyakit pada ikan telah banyak dilakukan. Penggunaan antibiotik sintetik
seperti Chlorine, Chloramphenicol dan Oxytetracycline masih banyak digunakan dalam
budi daya perikanan. Namun demikian, penggunaan antibiotik tidak selalu berdampak
positif dalam budi daya. Penggunaan antibiotik yang tidak tepat akan menurunkan
kualitas pangan dan kesehatan masyarakat yang mengkonsumsinya.
Selain antibiotik, penggunaan vaksin juga telah dilakukan. Vaksin merupakan
suspensi sel utuh yang telah di-inaktivasi dengan formalin. Keberhasilan penggunaan
vaksin telah dibuktikan mampu mencegah serangan A. salmonicida di akuakultur
(Namikoshi et al. 2004). Penambahan vitamin C sebagai makanan tambahan juga
dilaporkan dapat meningkatkan resistensi ikan terhadap penyakit, terutama infeksi yang
disebabkan oleh golongan bakteri gram negatif. Namun aplikasi Vitamin C relatif
bermasalah di lapangan karena sifat dari Vitamin C yang sangat mudah larut dalam air
(highly water soluble) (Atmomarsono 2004).
Berbagai kendala yang dihadapi dalam pengendalian penyakit di akuakultur
menarik minat para peneliti dalam menemukan alternatif lain yang bersifat biologis dan
aman diaplikasikan di lingkungan maupun di usus ikan. Imunostimulan merupakan
senyawa kemoterapik yang terbentuk dari ekstrak agar, β-glukan, lipopolisakarida
(LPS), mikroalga dan lingkungan (Le Moullac & Haffner 2000). Imunostimulan
terbukti mampu meningkatkan daya tahan ikan terhadap penyakit dan menstimulasi
sistem imun terutama dengan meningkatkan aktivitas makrofag dan limfosit (Chang
et al. 1999).
2.4. Saluran Pencernaan Ikan Nila
Secara alamiah tubuh makhluk hidup mengandung berbagai jenis mikrobiota.
mahluk hidup dalam jumlah yang besar dengan aktivitas metabolik beragam serta
memberi pengaruh positif maupun negatif terhadap kondisi tubuh inang. Pada organ
pencernaan keberadaan mikrobiota juga merupakan sumber nutrisi tambahan pada ikan.
Pelczar & Chan (1988) menyatakan bahwa mikrobiota asli saluran pencernaan
mempunyai hubungan mutualisme dengan inangnya. Mikrobiota memanfaatkan inang
sebagai tempat hidupnya, sebaliknya inang mendapatkan keuntungan berupa degradasi
sisa pakan dan bahan buangan, sintesis vitamin oleh mikrobiota, sekresi enzim dan
berperan dalam proses pencernaan makanan. Mikrobiota juga mampu menekan
pertumbuhan bakteri patogen dalam saluran pencernaan dengan meningkatkan produksi
sistem imunitas tubuh inang.
Pada organ pencernaan ikan, proses produksi sari makanan dan hidrolisis nutrisi
dalam pakan terjadi karena adanya enzim eksrtraseluler seperti protease, amilase,
karbohidrase, lipase (Zonneveld et al. 1991). Enzim adalah protein yang mengkatalis
reaksi-reaksi biokimia di dalam tubuh. Enzim ekstraseluler adalah protein yang
disintesis dalam sel dan dikeluarkan dari sel yang membentuknya melalui proses
eksositosis.
Enzim yang terdapat pada saluran pencernaan ikan sangat mempengaruhi daya
cerna ikan terhadap pakan. Proses pencernaan pakan dalam saluran pencernaan ikan
meliputi hidrolisis protein menjadi asam amino, lipid menjadi asam lemak (gliserol),
dan karbohidrat menjadi gula sederhana (monosakarida). Kemampuan daya cerna ikan
pada setiap kelompok ikan berbeda-beda. Helver (2002) menyatakan bahwa pada
kelompok ikan herbivora aktivitas enzim amilase lebih tinggi dari pada enzim protease
dan lipase. Sedangkan pada ikan omnivora dan karnivora aktivitas enzim protease dan
lipase lebih tinggi dari enzim amilase. Perbedaan daya cerna ikan terhadap pakan
dipengaruhi oleh kemampuan mikrobiota dalam saluran pencernaan dalam
mendegradasi pakan. Gatesoupe (1999) menyatakan bahwa bakteri yang masuk melalui
pakan memiliki kemampuan merombak nutrisi makro sehingga makanan akan mudah
2.5. Probiotik
Probiotik merupakan salah satu alternatif yang dikembangkan dalam mengatasi
permasalahan di akuakultur. Beberapa penerapan probiotik dalam akuakultur terbukti
mampu meningkatkan resistensi organisme akuatik seperti larva ikan dan udang, ikan
dan udang dewasa, bivalvia, crustacea, artemia dan rotifera serta hewan akuatik lain
terhadap serangan infeksi (Gatesoupe 1999; Rengpipat et al. 2000; Verschuere et al.
2000).
Istilah "probiotik" pertama kali diperkenalkan pada tahun 1965 oleh Lilley dan
Stillwell. Berbeda dengan antibiotik, probiotik didefinisikan sebagai mikroorganisme
hidup yang dalam jumlah cukup memberikan manfaat positif bagi kesehatan inang
(Reid 1999). Fuller (1989) mendefenisikan probiotik sebagai produk yang tersusun oleh
biakan mikroba atau pakan alami dengan bentuk mikroskopik yang menguntungkan dan
memberikan dampak bagi keseimbangan mikroba saluran usus hewan inang.
Verschuere et al. (2000) mendefenisikan bahwa probiotik sebagai penambahan
mikroorganisme yang memiliki pengaruh menguntungkan bagi inang melalui
modifikasi bentuk asosiasi dengan inang atau komunitas mikroorganisme lingkungan
hidupnya, mengoptimalkan penggunaan pakan atau meningkatkan nilai nutrisinya,
berkompetisi dengan mikroorganisme yang patogen, memperbaiki kualitas air dan
mampu berinteraksi dengan fitoplankton.
Banyak kelompok Bakteri Asam Laktat (BAL) yang digunakan sebagai
probiotik. Namun demikian tidak semua bakteri probiotik merupakan kelompok BAL.
Genus bakteri yang sering digunakan sebagai probiotik adalah Lactobacillus
(Lactobacillus achidophilus, Lactobacillus casei, Lactobacillus fermentum,
Lactobacillus plantarum, Lactobacillus reuteri) (Gatesoupe 1994; Nikoskelainen et al.
2001), Bifidobacterium (Bifidobacterium infantis, Bifidobacterium breve,
Bifidobacterium animalis, Bifidobacterium adolescentis, dan Bifidobacterium longum),
Bacillus (Bacillus subtilis, Bacillus cereus) (Rengpipat et al. 1998; Gullian et al. 2004;
(Irianto & Austin 2002; Feliatra et al. 2004), Leuconostoc dan Pseudomonas (Gram et
al. 1999; Feliatra et al. 2004).
Penggunaan probiotik di akuakultur telah banyak dilakukan dan dilaporkan lebih
aman dibandingkan penggunaan antibiotik sintetik yang dapat menimbulkan resistensi
bakteri terhadap antibiotik yang digunakan. Probiotik dapat memproduksi bakteriosin
yang bersifat selektif. Probiotik juga memproduksi senyawa penghambat seperti asam
laktat, asam asetat, hidrogen peroksida, laktoperoksidase dan lipopolisakarida. Di dalam
tubuh inang probiotik menghasilkan sejumlah nutrisi penting yang berfungsi dalam
metabolisme inang seperti asam folat, kobalamin, biotin dan antioksidan (Balcazar et al.
2006).
Beberapa karakter penting yang digunakan dalam memilih jenis bakteri
probiotik yang akan diaplikasikan dilapangan diantaranya adalah: (1) tidak bersifat
patogen pada inang dan konsumen (jika diproduksi massal), (2) tidak mengganggu
keseimbangan ekosistem usus, (3) bakteri yang digunakan dapat diproduksi dan
memiliki potensi yang tinggi dalam membunuh bakteri patogen, (4) mudah diperbanyak
dan dipelihara, (7) dapat hidup, bertahan dan berkembangbiak di dalam usus inang, (8)
mampu hidup pada kisaran pH yang lebar, (9) dapat hidup dan berkembang didalam
wadah pemeliharaan ikan, (10) dapat disiapkan sebagai produk sel hidup pada skala
industri, (11) dapat bertahan pada waktu yang lama pada penyimpangan maupun
dilapangan (Fuller 1989; Verschuere et al. 2000; Feliatra et al. 2004).
Di Akuakultur probiotik dapat diaplikasikan dalam beberapa cara yaitu: (1)
ditambahkan ke dalam pakan buatan (pelet), (2) ditambahkan ke dalam pakan hidup
(artemia, rotifera), (3) ditambahkan ke dalam air pemeliharaan, dan (4) melalui
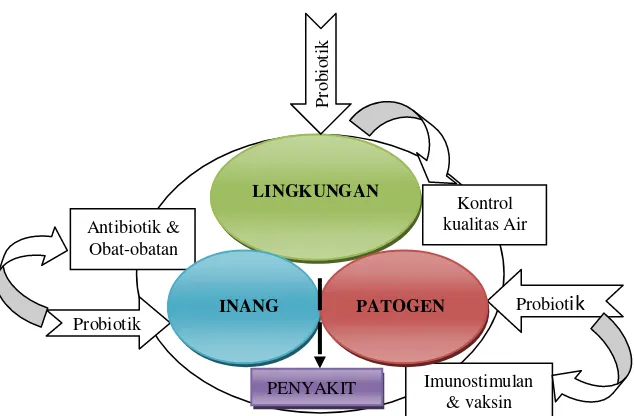
perendaman. Secara skematik mekanisme kerja probiotik (Gambar 2.1) menunjukkan
bahwa probiotik dapat mempengaruhi tiga komponen penting dalam infeksi inang yaitu
melalui produksi komponen penghambat dan kompetisi, memperbaiki kualitas air di
Gambar 2.1 Skema pengaruh pemberian probiotik pada budidaya ikan dihubungkan dengan faktor yang mempengaruhi terjadinya infeksi inang (Sumber: Rahayu 2009; Van de Braak 2002, yang telah dimodifikasi).
Mekanisme kerja (modes of action) dari probiotik bakteria menurut Fuller
(1989); Verschuere et al.(β000) dan Balca’zar et al. (2006) sebagai berikut :
(1) Penghambatan Kompetitif
Kemampuan bakteri probiotik menghasilkan senyawa antimikroba berpengaruh
terhadap pertumbuhan bakteri patogen di saluran pencernaan. Populasi probiotik di usus
diduga mampu memproduksi antimikroba yang dapat menghambat (bakteriostatis) atau
mematikan (bakteriosida) bakteri lain. Beberapa antimikroba yang dihasilkan oleh
bakteri probiotik adalah antibiotik (Fuller 1989), bakteriosin, lisozim, hidrogen
peroksida dan enzim-enzim ekstraseluler (Gatesoupe 1999).
Enzim ekstraseluler yang berperan sebagai antimikroba diantaranya ialah
kitinase. Pada kelompok bakteri, enzim kitinase digunakan sebagai sumber nutrisi dan
parasitisme (Patil et al. 2000). Aktivitas enzim kitinolitik mampu mendegradasi kitin
sehingga dihasilkan N-asetilglukosamin sebagai sumber karbon yang selanjutnya akan
diuraikan kedalam bentuk yang sedehana yaitu energi, CO2 , H2O dan NH3 (Thompson
et al. 2001). Beberapa genus bakteri yang menghasilkan enzim kitinase adalah Bacillus,
Enterobacter, Pseudomonas, Serratia, dan Aeromonas. LINGKUNGAN
Kontrol kualitas Air
P
rob
io
ti
k
Probiotik
Probiotik
Imunostimulan & vaksin Antibiotik &
Obat-obatan
INANG
PATOGEN
[image:29.595.139.456.95.303.2]Protease merupakan kelompok enzim intraseluler yang membentuk kelompok
peptida yang dapat berperan sebagai antibiotik dan antifungi seperti nisin, leusin,
subtilin, serein, dan beberapa peptida lain. Adanya enzim protese diperlukan untuk
mekanisme hidrolisis dinding sel mikroorganisme patogen. Nahar (2004) melaporkan
bahwa enzim kitinolitik dan proteolitik mampu melisiskan hifa jamur patogen yang
terdapat pada kutikula serangga.
Kelompok bakteri probiotik seperti Lactobacillus dan Streptococcus
memproduksi senyawa acidhopilin, acidolin, rutrin dan nisin yang mampu menghambat
pertumbuhan Vibrio parahaemolitycus dan Salmonella (Robetson et al. 2000). Imada et
al. (1985) melaporkan bahwa monastasin yang diproduksi bakteri Alteromonas sp
mampu menghambat bakteri Vibrio anguillarum dan Aeromonas hydrophila yang
patogen pada ikan. Penghambatan lain terbentuk karena adanya kolonisasi bakteri
probiotik dalam saluran pencernaan sehingga mengakibatkan terjadinya kompetisi
nutrisi (glukosa) dan tempat adhesi (penempelan sel bakteri di sel epitel usus).
(2) Peningkatan Respon Imunitas
Imunostimulan merupakan komponen kimia yang mengaktifkan sistem imun pada
organisme sehingga lebih resisten terhadap infeksi bakteri patogen (Rao 1998; Edelman
et al. 2002). Sistem imun non spesifik yang dimiliki ikan dewasa lebih baik dari hewan
invertebrata, crustaceae, artemia, rotifera dan larva ikan. Probiotik memiliki
kemampuan meningkatkan sistem imunitas inang dengan cara meningkatkan aktivitas
makrofag, modulasi profil sitokin pada sel imun sehingga mengaktifkan interferon- ,
menginduksi pembentukan IgA (Saulnier et al. 2007) dan hyporesponsif pada manusia
(Gill & Guarner 2004). Bakteri probiotik umumnya terdiri dari komponen dinding sel
seperti peptidoglikan (30-70 %), polisakarida, asam teikoik yang merangsang aktivitas
adjuvant di permukaan mukosa dinding sel usus inang. Dengan demikian Penggunaan
probiotik di akuakultur yang diberikan pada hewan akuatik diduga mampu
meningkatkan sistem imunitas sehingga inang akan lebih resisten terhadap serangan
Rengpipat et al. (2003) melaporkan kemampuan bakteri Bacillus subtilis dan
Bacillus sp yang diberikan pada hewan akuatik mampu meningkatkan pertumbuhan dan
resisten terhadap infeksi bakteri patogen Vibrio. Hal ini mungkin dipengaruhi oleh
keberadaan bakteri probiotik yang meningkatkan sistem imunitas tubuh inang tersebut.
(3) Memperbaiki Kualitas Air
Aplikasi probiotik di air pemeliharaan telah dilaporkan mampu memperbaiki kualitas
air. Bacillus spp. salah satu contoh bakteri probiotik yang efisien digunakan dalam
budidaya perairan karena mampu mengkonversi bahan organik (sisa pakan) menjadi
CO2 yang digunakan dalam metabolisme sel. Jamilah (2011) melaporkan bahwa
Bacillus cereus memiliki isoenzim yang mampu mendegradasi dan mendetoksifikasi
sisa pakan yang terdapat dikolam budidaya.
Namun demikian, tidak semua bakteri probiotik memiliki kemampuan
memperbaiki kualitas air. Rengpipat et al. (1998) melaporkan bahwa bakteri lain seperti
Nitrobacter, Pseudomonas, Enterobacter, Cellulomonas dan Rhodopseudomonas spp.
hanya mampu melakukan proses nitrifikasi pada kolam pemeliharaan dengan kadar
amoniak tinggi.
(4) Berinteraksi Dengan Fitoplankton
Dalam budi daya perairan fitoplankton memiliki manfaat besar dalam perkembangan
hewan akuatik. Beberapa kelompok hewan akuatik bersifat omnivora yang memakan
organisme kecil diperairan sebagai makanan tambahan, salah satunya adalah
fitoplankton. Beberapa penelitian melaporkan bahwa banyak strain bakteri yang bersifat
patogen terhadap mikroalga. Akibatnya proses rantai makanan antara mikroalga dan
hewan akuatik tingkat tinggi akan terganggu.
Boyd (1998) menyatakan bahwa konsorsium beberapa kelompok bakteri seperti
Bacillus, Nitrobacter, Pseudomonas, Enterobacter, Cellulomonas dan
Rhodopseudomonas spp. mampu menurunkan atau menekan populasi bekteri patogen
Cyanobacteria pada kolam budi daya. Dengan demikian, probiotik mampu
BAB V
KESIMPULAN DAN SARAN
5.1. Kesimpulan
Kesimpulan dari penelitian ini ialah :
a. Dari 59 isolat yang diisolasi dari saluran pencernaan beberapa varietas ikan nila
didapat dua isolat potensial dalam menghambat pertumbuhan jamur Saprolegnia
sp. dan Aeromonas hydrophila yaitu isolat USp-5 dan LSp-2.
b. Isolat USp-5 dan LSp-2 memiliki kemampuan tertinggi dalam menghidrolisis
tiga jenis substrat yaitu protein, amilum dan kitin.
c. Bakteri potensial yang berasal dari saluran pencernaan ikan nila dapat
dikembangkan sebagai kandidat probiotik dan berpotensi sebagai agen hayati
yang mampu menghambat pertumbuhan mikroba patogen di perairan.
5.2. Saran
Perlu dilakukan penelitian lebih lanjut mengenai karakterisasi enzim seperti pH,
suhu dan salinitas dari masing-masing isolat kandidat probiotik. Selain itu, karakterisasi
jenis antimikroba yang dihasilkan isolat kandidat bakteri probiotik juga dapat
DAFTAR PUSTAKA
Anand, S & Reddy, J. 2009. Biocontrol Potential Of Against Plant Pathogens. Int J Agric Sci. 1: 30-39.
Arlia, L. 1994. Pengaruh Kadar Protein Pakan Buatan Terhadap Pertumbuhan Benih Ikan Gurami (Osphronemus gouramy). Tesis. Institut Pertanian Bogor.
Ashger, M., Asad M.J., Rahman S.U & Legge R.L. 2007. A Thermophilic bacillus subtilis Strain for Starch Processing. J Food Eng. 79: 950-955.
Aslamsyah, S. 2011. Penggunaan Mikroflora Saluran Pencernaan Sebagai Probiotik untuk Meningkatkan Pertumbuhan dan Kelangsungan Hidup Ikan Bandeng. Disertasi. Institut Pertanian Bogor.
Atmomarsono, U. 2004. Upaya Menghasilkan Daging Broiler Aman Dan Sehat. Pengukuhan Guru Besar. Diponegoro University Press. Semarang.
Atrih, T., Klaenhammer T.R & Latellier L. 1994. Kinetic Studi On The of Lactacin F.A Bacteriocin Produced By Lactobacillus johnsonni That Forms Poration Complexes In The Cytoplasmic Membrane. Appl Environ Microbiol. 60: 1006-1013.
Austin, B., Stuckey L.F., Robertson P.A.W., Effendi I & Griffith D. R.W. 1995. A Probiotic Strain of Vibrio alginolyticus Effective In Reducing Diseases Caused by Aeromonas salmonicida, and Vibrio ordalii. J Fish Dis. 18: 93-96.
Bairagi, A., Ghosh K.S., Sen S.K & Ray A.K., 2002. Enzyme Producing Bacterial Flora Isolated From Fish Digestive Tracts. Aquaculture international. 10: 109-121.
Balca´zar, J.L., I’de Blas., Zarzuela I.R, Cunningham D., Vendrell D & Muszquiz J.L. 2006. The Role of Probiotic in Aquaculture. Veterinary Microbiology.114: 173-186.
Bernfeld, P. 1955. Amylases, Alpha and Beta. In: Colowick S.p, Kaplan NO (Eds). Methods in Enzymology. Vol.1. New york: Academic press, pp149-158.
Bosah, O., Igeleke C.A & Omorusi V.I. 2010. In vitro Microbial Control Of Pathogenic Sclerotium rolfsii. Int J Agric Biol. 12: 474-476.
Bruno, D.W & Wood B.P. 1999. Saprolegnia and Other Oomycetes. United Kingdom. CABI Publishing.
Cappuccino, J.G & Sherman N. 1996. Microbiology A Laboratory Manual. New York. Rockland Community College Suffern.
Chabot, D.J & Thune R.L., 1991. Protease of The Aeromonas hydrophila Complex : Identification, Characterization and Relation to Virulence In Channel Catfish, Ictalurus punctatus (Rafinesque). J. Fish Diseases. 14: 171-183.
Chang, C.F., Su M.S., Chen H.Y., Lo C.F., Kou G.H & Liao I.C.. 1999. Effect of Dietary Beta-1.3-Glucan on Resistance to White Spot Syndrome Virus (WSSV) in Post Larval and Juvenile Penaeus monodon. Dis Aquat Org. 36: 163-168.
Crueger, W & Crueger A. 1984. Biotechnology-A Text Book of Industrial Microbiology. Sinaeur Associates, Inc. Sunderland
Cunningham, J.G. 1994. Textbook Of Veterinary Physiology. 2nd Ed. Philelphia. Effendi M.I. 2002. Biologi Perikanan. Yogyakarta. Yayasan Pustaka Nusatama.
Dajanta, K. 2010. Production Of High Nutritional Fermented Soybean (Thua nao) by Bacillus subtilis. Ph. D. Tesis. Chiang Mai University. Chiang Mai. Thailand.
Denkin, S.M & Nelson. D.R. 2004. Regulation of Vibrio anguilarum empA metalloprotease expression and its role in virulence. Appl Environ Microbiol. 4193-4204.
Dewi, R.R. 2011. Pengendalian Saprolegnia sp. pada Telur Gurami (Osphronemus gouramii) Menggunakan Isolat Bakteri Kitinolitik. Tesis. Universitas Sumatera Utara.
Dharmaraj, S., Ashokkumar B & Dhevendaran K. 2009. Food-grade Pigments From
Streptomyces sp. Isolated From The Marine Sponge Callyspongia diffusa. Food
Res Int. 42: 487-492.
Djaafar, T.F. 1996. Bakteri Asam Laktat Dari Makanan Tradisional dan Potensi Bakteriosinnya. Tesis. Universitas Gadjah Mada.
Edelman, S., Westerlund-Wikström B., Le skela S., Kettunen H., Rautonen N., Apajalahti J & Korhonen T.K. 2002. In vitro A Dhesion Specifity Of Indigenous Lactobacilli Within The Avian Intestinal Tract. Appl. Environ. Microbiol. 68: 5155-5159.
FAO & NACA. 2007. Diagnosis of Fish disease, with emphasis on the Thilapia (Oreochromis niloticus). Multimedia Asia co ltd.
Feliatra, Efendi I & Suryadi E. 2004. Isolasi dan Identifikasi Bakteri Probiotik dari Ikan Kerapu Macan (Ephinephelus fuscogutattus) dalam Upaya Efisiensi Pakan Ikan. Natur Indonesia. 6: 75-80.
Fuller, R. 1989. Probiotics in Man and Animal. J Appl Bacteriol. 66: 365-378.
Gatesoupe, F.J. 1994. Lactic Acid Bacteria Increase The Resistance Of Turbot Larvae, Scophthalmus maximus, Against Pathogenic Vibrio. Aquat. Living Resour. 7: 277–282.
.1999. The Use Of Probiotics In Aquaculture. A review. Aquaculture. 180: 147-165.
Ghosh, K., Sen S.K & Ray A.K. 2004. Growth and Survival Of Rohu, Labeo rohita (Hamilton) Spawn Fed Diets Fermented With Intestinal Bacterium, Bacillus circulans. Acta Ichthyologica et Piscatoria. 34: 155-165.
Gibson, L.F., Woodworth J & George A.M. 1998. Probiotic Activity of Aeromonas Media on the Pacific Oyster, Crassostrea Gigas, When Challenged with Vibrio tubiashii.Aquaculture. 169: 111–120.
Gill, H.S & Guarner F. 2004. Probiotics and Human Health: A Clinical Prespective. Postgrad Med J. 80: 516-526.
Gohel, V, Singh .A., Vimal.M., Ashwini P & Chhatpar H.S. 2006. Bioprospecting and Antifungal Potential Of Chitinolytic Microorganisms. Afr. J. Biotechnol. 5: 54-72.
Gram, L., Melchiorsen J., Spanggaard B., Huber I & Nielsen T. 1999. Inhibition of Vibrio anguillarum by Pseudomonas fluorescens strain AH2, A Possible Probiotic Treatment of Fish. Appl. Environ. Microbiol. 65: 969–973.
Gullian, M., Thompson F & Rodriguez J. 2004. Selection of Probiotic Bacteria and Study of Their Immunostimulatory Effect In Penaeus vannamei. Aquaculture 233: 1-14.
Halver, J. E. 1988. Fish Nutrition. London. Academic Press, INC.
. 2002. Fish Nutrition. School of Fisheries University Washington. Seattle. Academia Press, INC.
DAFTAR PUSTAKA
Anand, S & Reddy, J. 2009. Biocontrol Potential Of Against Plant Pathogens. Int J Agric Sci. 1: 30-39.
Arlia, L. 1994. Pengaruh Kadar Protein Pakan Buatan Terhadap Pertumbuhan Benih Ikan Gurami (Osphronemus gouramy). Tesis. Institut Pertanian Bogor.
Ashger, M., Asad M.J., Rahman S.U & Legge R.L. 2007. A Thermophilic bacillus subtilis Strain for Starch Processing. J Food Eng. 79: 950-955.
Aslamsyah, S. 2011. Penggunaan Mikroflora Saluran Pencernaan Sebagai Probiotik untuk Meningkatkan Pertumbuhan dan Kelangsungan Hidup Ikan Bandeng. Disertasi. Institut Pertanian Bogor.
Atmomarsono, U. 2004. Upaya Menghasilkan Daging Broiler Aman Dan Sehat. Pengukuhan Guru Besar. Diponegoro University Press. Semarang.
Atrih, T., Klaenhammer T.R & Latellier L. 1994. Kinetic Studi On The of Lactacin F.A Bacteriocin Produced By Lactobacillus johnsonni That Forms Poration Complexes In The Cytoplasmic Membrane. Appl Environ Microbiol. 60: 1006-1013.
Austin, B., Stuckey L.F., Robertson P.A.W., Effendi I & Griffith D. R.W. 1995. A Probiotic Strain of Vibrio alginolyticus Effective In Reducing Diseases Caused by Aeromonas salmonicida, and Vibrio ordalii. J Fish Dis. 18: 93-96.
Bairagi, A., Ghosh K.S., Sen S.K & Ray A.K., 2002. Enzyme Producing Bacterial Flora Isolated From Fish Digestive Tracts. Aquaculture international. 10: 109-121.
Balca´zar, J.L., I’de Blas., Zarzuela I.R, Cunningham D., Vendrell D & Muszquiz J.L. 2006. The Role of Probiotic in Aquaculture. Veterinary Microbiology.114: 173-186.
Bernfeld, P. 1955. Amylases, Alpha and Beta. In: Colowick S.p, Kaplan NO (Eds). Methods in Enzymology. Vol.1. New york: Academic press, pp149-158.
Bosah, O., Igeleke C.A & Omorusi V.I. 2010. In vitro Microbial Control Of Pathogenic Sclerotium rolfsii. Int J Agric Biol. 12: 474-476.
Bruno, D.W & Wood B.P. 1999. Saprolegnia and Other Oomycetes. United Kingdom. CABI Publishing.
Cappuccino, J.G & Sherman N. 1996. Microbiology A Laboratory Manual. New York. Rockland Community College Suffern.
Chabot, D.J & Thune R.L., 1991. Protease of The Aeromonas hydrophila Complex : Identification, Characterization and Relation to Virulence In Channel Catfish, Ictalurus punctatus (Rafinesque). J. Fish Diseases. 14: 171-183.
Chang, C.F., Su M.S., Chen H.Y., Lo C.F., Kou G.H & Liao I.C.. 1999. Effect of Dietary Beta-1.3-Glucan on Resistance to White Spot Syndrome Virus (WSSV) in Post Larval and Juvenile Penaeus monodon. Dis Aquat Org. 36: 163-168.
Crueger, W & Crueger A. 1984. Biotechnology-A Text Book of Industrial Microbiology. Sinaeur Associates, Inc. Sunderland
Cunningham, J.G. 1994. Textbook Of Veterinary Physiology. 2nd Ed. Philelphia. Effendi M.I. 2002. Biologi Perikanan. Yogyakarta. Yayasan Pustaka Nusatama.
Dajanta, K. 2010. Production Of High Nutritional Fermented Soybean (Thua nao) by Bacillus subtilis. Ph. D. Tesis. Chiang Mai University. Chiang Mai. Thailand.
Denkin, S.M & Nelson. D.R. 2004. Regulation of Vibrio anguilarum empA metalloprotease expression and its role in virulence. Appl Environ Microbiol. 4193-4204.
Dewi, R.R. 2011. Pengendalian Saprolegnia sp. pada Telur Gurami (Osphronemus gouramii) Menggunakan Isolat Bakteri Kitinolitik. Tesis. Universitas Sumatera Utara.
Dharmaraj, S., Ashokkumar B & Dhevendaran K. 2009. Food-grade Pigments From
Streptomyces sp. Isolated From The Marine Sponge Callyspongia diffusa. Food
Res Int. 42: 487-492.
Djaafar, T.F. 1996. Bakteri Asam Laktat Dari Makanan Tradisional dan Potensi Bakteriosinnya. Tesis. Universitas Gadjah Mada.
Edelman, S., Westerlund-Wikström B., Le skela S., Kettunen H., Rautonen N., Apajalahti J & Korhonen T.K. 2002. In vitro A Dhesion Specifity Of Indigenous Lactobacilli Within The Avian Intestinal Tract. Appl. Environ. Microbiol. 68: 5155-5159.
FAO & NACA. 2007. Diagnosis of Fish disease, with emphasis on the Thilapia (Oreochromis niloticus). Multimedia Asia co ltd.
Feliatra, Efendi I & Suryadi E. 2004. Isolasi dan Identifikasi Bakteri Probiotik dari Ikan Kerapu Macan (Ephinephelus fuscogutattus) dalam Upaya Efisiensi Pakan Ikan. Natur Indonesia. 6: 75-80.
Fuller, R. 1989. Probiotics in Man and Animal. J Appl Bacteriol. 66: 365-378.
Gatesoupe, F.J. 1994. Lactic Acid Bacteria Increase The Resistance Of Turbot Larvae, Scophthalmus maximus, Against Pathogenic Vibrio. Aquat. Living Resour. 7: 277–282.
.1999. The Use Of Probiotics In Aquaculture. A review. Aquaculture. 180: 147-165.
Ghosh, K., Sen S.K & Ray A.K. 2004. Growth and Survival Of Rohu, Labeo rohita (Hamilton) Spawn Fed Diets Fermented With Intestinal Bacterium, Bacillus circulans. Acta Ichthyologica et Piscatoria. 34: 155-165.
Gibson, L.F., Woodworth J & George A.M. 1998. Probiotic Activity of Aeromonas Media on the Pacific Oyster, Crassostrea Gigas, When Challenged with Vibrio tubiashii.Aquaculture. 169: 111–120.
Gill, H.S & Guarner F. 2004. Probiotics and Human Health: A Clinical Prespective. Postgrad Med J. 80: 516-526.
Gohel, V, Singh .A., Vimal.M., Ashwini P & Chhatpar H.S. 2006. Bioprospecting and Antifungal Potential Of Chitinolytic Microorganisms. Afr. J. Biotechnol. 5: 54-72.
Gram, L., Melchiorsen J., Spanggaard B., Huber I & Nielsen T. 1999. Inhibition of Vibrio anguillarum by Pseudomonas fluorescens strain AH2, A Possible Probiotic Treatment of Fish. Appl. Environ. Microbiol. 65: 969–973.
Gullian, M., Thompson F & Rodriguez J. 2004. Selection of Probiotic Bacteria and Study of Their Immunostimulatory Effect In Penaeus vannamei. Aquaculture 233: 1-14.
Halver, J. E. 1988. Fish Nutrition. London. Academic Press, INC.
. 2002. Fish Nutrition. School of Fisheries University Washington. Seattle. Academia Press, INC.
Herdyastuti, N., Raharjo T.J & Matsjeh. S. 2009. Chitinase and Chitinolytic Microorganism : Isolation, Characterization and Potential. Indo. J. Chem. 9: 37-47
Holt, J.G., Krieg N.R., Sneathm P.H.A., Staley J.T & Williams, S.T. 19λ4. Bergey’s Manual of Determinative Bacteriology 9th edition. Baltimore
Ilmi, M. 2007. Isolasi dan Karakterisasi Enzim Kitinolitik Dari Bakteri Asal Limbah Pengolahan Udang. Tesis. Universitas Indonesia.
Imada, C, Taga N & Maeda M. 1985. Cultivation Conditions For Subtilisin Inhibitor Producing Bacterium And General Properties Of The Inhibitor ‘Marinostatin’. Bull Jpn Soc Sci Fish. 51: 805–810.
Irianto, A. 2003 . Probiotik Aquakultur. Gadjah mada University Press. Yogyakarta.
. 2005 . Patologi Ikan Teleostei. Gadjah mada University Press. Yogyakarta.
Irianto, A & Austin B. 2002. Use of Probiotics to Control Furunculosis in Rainbow Trout, Oncorhynchus mykiss (Walbaum). J. Fish Dis. 25: 333–342.
Jamilah, I. 2011. Penapisan Bacillus dan Karakterisasi Protease dan Amilase Ekstraseluler yang Dihasilkan Untuk Degradasi Sisa Pakan Pada Budidaya Udang. Disertasi. Institut Pertanian Bogor.
Kementrian Kelautan & Perikanan. 2010. Petunjuk Bagi Pengoperasian Unit Usaha Pembenihan Ikan Nila (Oreochromis niloticus). Infis manual.
Kementrian Kelautan & Perikanan. 2011. Statistik Perikanan Tangkap, Perikanan Budidaya dan Ekspor-Impor Setiap Provinsi Seluruh Indonesia. Infis manual.
Lay, B.W. 1994. Analisis Mikroba di Laboratorium. Jakarta. Raja Grafindo Persada.
Le Moullac, G & Haffner P. 2000. Environmental Factors Affecting Immune Responses Crustaceae. Aquaculture. 191: 121-131.
Lesmana, D. 2006. Penapisan Isolat-isolat Bakteri Sebagai Agen pengendali Hayati Jamur Rhizoctonia solani. Tesis. Institut Pertanian Bogor.
Lilley, D.M & Stillwell R.J. 1965. Probiotics: Growth Promoting Factors Produced By Micro-Organisms. Science. 147: 747–748.
Lisai, J.S. 2005. Konsep Probiotik dan Prebiotik Untuk Modulasi Mikrobiota Usus Besar. J. Med. Nus. 4: 256-262.
Lovell, R.T. 1988. Nutrition and Feeding Of Fish. New York. Van Nostrand Reinhold.
Malau, J. 2012. Kemampuan Bakteri Kitinolitik dalam Menghambat Infeksi Aspergillus sp pada Ikan Nila (Oreochromis niloticus). Skripsi. Universitas Sumatera Utara.
Mariyono & Sundana. 2002. Teknik Pencegahan Dan Pengobatan Penyakit Bercak Merah Pada Ikan Air Tawar Yang Disebabkan Oleh Bakteri Aeromonas hydrophila. Buletin Teknik Pertanian. 7: 11-1.
Marteau, P.R., De Vrase M., Cellier C.J & Schrezenmeir J. 2001. Protection from Gastrointestinal Disease With The Use Of Probiotics. Am. J. Nutr. 73: 430-436.
Mokoginta, I., Suprayudi A & Setiawati M. 1996. Kebutuhan Optimum Protein dan Energi Pakan Benih Ikan Gurame (Osphronemus gouramy Lac.). Journal Penelitian Perikanan Indonesia. 11: 82 - 94.
Muharni. 2009. Isolasi dan identifikasi Bakteri Penghasil Kitinase dari Sumber Air Panas Danau Ranau Sumatera Selatan. Jurnal penelitian Sains. 09: 12-15.
Muharni, & Widjajanti H. 2011. Skrining Bakteri Kitinolitik Antagonis Terhadap Pertumbuhan Jamur Akar Putih (Rigidoporus lignosus) dari Rizosfer Tanaman Karet. Jurnal Penelitian Sains. 1: 51-56.
Moriarty, D.J.W. 1999. Disease Control in Shrimp Aquaculture With Probiotic Bacteria. J. Fish Dis. 20:10–15.
Nahar, P.B. 2004. Development of Biocontrol Agents for The Control of Pest In Agricultural Using Chitin Metabolism As Target. Thesis. Division of Biochemical Science National Chemical Laboratory Pune. India.
Namikoshi, A., Wua J.L., Yamashitaa T., Nishizawab T., Nishiokac T., Arimotoc M & Murogaa K. 2004. Vaccination Trials with Penaeus japonicus to Induce Resistance to White Spot Syndrome Virus. Aquaculture. 229: 25-35.
Nikoskelainen, S., Salminen S., Bylund G., & Ouwehand A. 2001. Characterization of The Properties of Human and Dairy-Derived Probiotics For Prevention Of Infectious Diseases in Fish. Appl EnvironMicrobiol. 67: 2430–2435.
Ochoa-Solano, J. L. & Olmos-Soto J. 2006. The Functional Property of Bacillus for Shrimp Feeds. Food Microbiology. 23: 519-525.
Okami Y & Hotta K, 1988. Search and Discovery Of NEW antibiotics. Academic Press, Inc., San Diego, pp. 33-67.
Patil, R.S., Ghormade V & Deshpande M.V. 2000. Chitinolytic Enzymes: An exploration. Enzyme and Microbial Technology 26: 473 – 483.
Pelczar, M.J.Jr & Chan E.C.S. 1988. Dasar-Dasar Mikrobiologi. (diterjemahkan dari bahasa Inggris oleh Hadioetomo, R.S., T. Imas, S.S. Tjitrosomo & S.L. Angka). Jakarta. Universitas Indonesia Press.
Rachmadi, A.T. 2008. Peranan Bakteri Asal Pencernaan Ikan Nila Gift Dalam Menghambat Pertumbuhan Microcytis aeruginosa BT-02. Skripsi. Institut Pertanian Bogor.
Rahayu, T.H. 2009. Kajian Bakteri Probiotik Lokal Untuk Meningkatkan Status Kesehatan Udang Vannamei Litopenaeus vannamei (Boone). Disertasi. Universitas Indonesia.
Rao, J. 1998. The Use Of Immunostimulatory Substances In Fish & Shellfish Feed. Rev. Fish. Sc 4:229-288. In T.W. Flegel (ed). Advanced in Shrimps Biotechnology. Proceedings To The Special Session on Shrimp Biotechnology 5th Asian Fisheries Forum Cheingmai. Thailand.
Ray A.K, Bairagi A, Ghosh K.S & Sen S.K. 2007. Optimation of fermentation condition for cellulase production by Bacillus subtilis CY5 and Bacillus circulans TP3 isolated from fish gut. Acta Ichthyol Piscat. 37: 47-53.
Reid, G. 1999. The Scientific Basis For Probiotic Galurs of Lactobacillus. Appl Environ Microbiol. 65: 3763-3766.
Rengpipat, S., Tunyanun A., Fast A.W., Piyatiratitivorakul S & Menasveta P.. 2003. Enhanced Growth and Resistance To Vibrio Challenge in Pondreared Black Tiger Shrimp Penaeus monodon fed a Bacillus Probiotic. Dis Aquat Org. 55:169-173.
Rengpipat, S., Rukpratanporn S., Piyatiratitivorakul S & Menasaveta P. 2000. Immunity enchacement in black tiger shrimp (Penaeus monodon) by a Probiont Bacterium (Bacillus S11). Aquaculture. 191: 271-288.
Robertson, P., O’Dowd C., Burrells C., Williams P & Austin B.. β000. Use of Carnobacterium sp. As A Probiotic For Atlantic Salmon (Salmo salar L.) and Rainbow Trout (Oncorhynchus mykiss, Walbaum). Aquaculture 185: 235–243.
Saulnier, D.M.A., Molenaar D., De