ABSTRACT
HAFIZ FURQONUL AZIZ. Identification of Parasitic Worms and Bacteria in Gills and Digestive Tract of Nile Tilapia (Oreochromis niloticus). Under direction of RISA TIURIA and USAMAH AFIFF.
The objectives of this research were to identify parasitic worms and bacteria in gills and digestive tract of nile tilapia (Oreochromis niloticus). A group of 10 fishes of nile tilapia were used, each gills and digestive tract was collected. The parasitic worms were colored with KOH and clove oil for semi-permanent staining, and Semichon’s Acetocarmine for permanent staining. The isolated bacteria were identified using Gram staining, Triple Sugar Iron Agar, citrate agar, urea agar, indole, and cabohydrate fermentations. The result showed that there were three kind of parasitic worms in gills of nile tilapia, Dactylogyridae, Dactylogyrus sp., and Pseudodactylogyrus sp. The total amount of Dactylogyridae is 8 worms, Dactylogyrus sp. is 72 worms, and Pseudodactylogyrus is 24 worms. The bacteria were identified and the result showed that Aeromonas sp., Bacillus sp., Escherichia coli, Edwardsiella tarda, Klbesiella pneumoniae, Pasteurella sp., Staphylococcus epidermidis, and Vibrio parahaemolyticus were come from gills. Aeromonas sp., Bacillus sp., Escherichia coli, Enterobacter aerogenes, Klebsiella pneumoniae, Staphylococcus aerus, Staphylococcus epidermidis, Streptococcus sp., and Vibrio parahaemolyticus were come from digestive tract. The relation between the parasitic worms and the bacteria did not significanty obvious. The parasitic worms might predispose the secondary infection caused by bacteria or might be the opposite.
RINGKASAN
HAFIZ FURQONUL AZIZ. Identifikasi Cacing Parasitik dan Bakteri pada Insang dan Saluran Pencernaan Ikan Nila Hitam (Oreochromis niloticus) Dibimbing oleh RISA TIURIA dan USAMAH AFIFF.
Ikan nila adalah ikan yang hidup di air tawar, berasal dari sungai nil dan danau-danau di sekitarnya, dan mulai didatangkan ke Bogor pada tahun 1969. Ikan nila merupakan ikan konsumsi air tawar yang diminati oleh konsumen selain ikan mas dan gurami karena ikan nila memiliki rasa daging yang enak, gurih, dan tidak memiliki banyak duri. Keunggulan dari ikan nila dibandingkan ikan konsumsi lain adalah ikan nila mampu tumbuh cepat hanya dengan pakan yang rendah protein, memijah sepanjang tahun, bersifat omnivora, berdaging tebal, dan rasa dagingnya mirip dengan kakap merah (Suyanto 2009).
Pembudidayaan ikan nila hitam hampir dilaksanakan di seluruh provinsi di Indonesia sehingga produksi ikan nila di Indonesia cukup tinggi. Proses produksi dan budidaya ikan nila memiliki beberapa kendala, salah satunya serangan hama dan penyakit. Agen penyakit yang menyebabkan infeksi diantaranya, virus, bakteri, cendawan, dan parasit. Penyakit parasitik dan bakteri merupakan salah satu penyakit yang dapat menginfeksi hewan, termasuk ikan nila hitam. Kerugian yang ditimbulkan akibat infestasi dari cacing pada ikan tidak sebesar apabila ikan terinfeksi oleh virus atau bakteri, tetapi infestasi cacing dapat menjadi faktor predisposisi terjadinya infeksi oleh agen infeksius yang lainnya, seperti bakteri. Penelitian ini bertujuan untuk mengetahui adanya serta mengidentifikasi jenis cacing parasitik dan bakteri yang terdapat pada insang dan saluran pencernaan ikan nila (Oreochromis niloticus).
Ikan nila hitam dimatikan dengan cara menusuk bagian medial kepala tepat di otak. Insang ikan dan saluran pencernaan (usus dan lambung) kemudian dikeluarkan. Insang dan saluran pencernaan diletakkan ke dalam cawan petri yang telah diisi NaCl fisiologis dan disimpan di dalam refrigerator selama 10 jam. Insang dan saluran pencernaan kemudian diamati di bawah mikroskop stereo untuk mengoleksi cacing. Cacing yang ditemukan difiksasi dalam etanol 70% sebelum diwarnai. Pewarnaan permanen digunakan untuk mengindentifikasi cacing pipih trematoda. Pewarnaan semi permanen menggunakan KOH dan minyak cengkeh diaplikasikan untuk pewarnaan nematoda
Metode isolasi bakteri dilakukan dengan penggerusan insang dan digesta saluran pencernaan setelah ikan dimatikan. Hasil gerusan ditanam pada media agar Mac-Conkey dan agar darah. Selanjutnya media diinkubasi dan dilakukan pewarnaan Gram serta uji-uji biokimiawi untuk mengidentifikasi bakteri.
IDENTIFIKASI CACING PARASITIK DAN BAKTERI PADA
INSANG DAN SALURAN PENCERNAAN IKAN NILA HITAM
(
Oreochromis niloticus
)
HAFIZ FURQONUL AZIZ
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa skripsi dengan judul Identifikasi Cacing Parasitik dan Bakteri pada Insang dan Saluran Pencernaan Ikan Nila Hitam (Oreochromis niloticus) adalah karya saya dengan arahan dari pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, September 2012
ABSTRACT
HAFIZ FURQONUL AZIZ. Identification of Parasitic Worms and Bacteria in Gills and Digestive Tract of Nile Tilapia (Oreochromis niloticus). Under direction of RISA TIURIA and USAMAH AFIFF.
The objectives of this research were to identify parasitic worms and bacteria in gills and digestive tract of nile tilapia (Oreochromis niloticus). A group of 10 fishes of nile tilapia were used, each gills and digestive tract was collected. The parasitic worms were colored with KOH and clove oil for semi-permanent staining, and Semichon’s Acetocarmine for permanent staining. The isolated bacteria were identified using Gram staining, Triple Sugar Iron Agar, citrate agar, urea agar, indole, and cabohydrate fermentations. The result showed that there were three kind of parasitic worms in gills of nile tilapia, Dactylogyridae, Dactylogyrus sp., and Pseudodactylogyrus sp. The total amount of Dactylogyridae is 8 worms, Dactylogyrus sp. is 72 worms, and Pseudodactylogyrus is 24 worms. The bacteria were identified and the result showed that Aeromonas sp., Bacillus sp., Escherichia coli, Edwardsiella tarda, Klbesiella pneumoniae, Pasteurella sp., Staphylococcus epidermidis, and Vibrio parahaemolyticus were come from gills. Aeromonas sp., Bacillus sp., Escherichia coli, Enterobacter aerogenes, Klebsiella pneumoniae, Staphylococcus aerus, Staphylococcus epidermidis, Streptococcus sp., and Vibrio parahaemolyticus were come from digestive tract. The relation between the parasitic worms and the bacteria did not significanty obvious. The parasitic worms might predispose the secondary infection caused by bacteria or might be the opposite.
RINGKASAN
HAFIZ FURQONUL AZIZ. Identifikasi Cacing Parasitik dan Bakteri pada Insang dan Saluran Pencernaan Ikan Nila Hitam (Oreochromis niloticus) Dibimbing oleh RISA TIURIA dan USAMAH AFIFF.
Ikan nila adalah ikan yang hidup di air tawar, berasal dari sungai nil dan danau-danau di sekitarnya, dan mulai didatangkan ke Bogor pada tahun 1969. Ikan nila merupakan ikan konsumsi air tawar yang diminati oleh konsumen selain ikan mas dan gurami karena ikan nila memiliki rasa daging yang enak, gurih, dan tidak memiliki banyak duri. Keunggulan dari ikan nila dibandingkan ikan konsumsi lain adalah ikan nila mampu tumbuh cepat hanya dengan pakan yang rendah protein, memijah sepanjang tahun, bersifat omnivora, berdaging tebal, dan rasa dagingnya mirip dengan kakap merah (Suyanto 2009).
Pembudidayaan ikan nila hitam hampir dilaksanakan di seluruh provinsi di Indonesia sehingga produksi ikan nila di Indonesia cukup tinggi. Proses produksi dan budidaya ikan nila memiliki beberapa kendala, salah satunya serangan hama dan penyakit. Agen penyakit yang menyebabkan infeksi diantaranya, virus, bakteri, cendawan, dan parasit. Penyakit parasitik dan bakteri merupakan salah satu penyakit yang dapat menginfeksi hewan, termasuk ikan nila hitam. Kerugian yang ditimbulkan akibat infestasi dari cacing pada ikan tidak sebesar apabila ikan terinfeksi oleh virus atau bakteri, tetapi infestasi cacing dapat menjadi faktor predisposisi terjadinya infeksi oleh agen infeksius yang lainnya, seperti bakteri. Penelitian ini bertujuan untuk mengetahui adanya serta mengidentifikasi jenis cacing parasitik dan bakteri yang terdapat pada insang dan saluran pencernaan ikan nila (Oreochromis niloticus).
Ikan nila hitam dimatikan dengan cara menusuk bagian medial kepala tepat di otak. Insang ikan dan saluran pencernaan (usus dan lambung) kemudian dikeluarkan. Insang dan saluran pencernaan diletakkan ke dalam cawan petri yang telah diisi NaCl fisiologis dan disimpan di dalam refrigerator selama 10 jam. Insang dan saluran pencernaan kemudian diamati di bawah mikroskop stereo untuk mengoleksi cacing. Cacing yang ditemukan difiksasi dalam etanol 70% sebelum diwarnai. Pewarnaan permanen digunakan untuk mengindentifikasi cacing pipih trematoda. Pewarnaan semi permanen menggunakan KOH dan minyak cengkeh diaplikasikan untuk pewarnaan nematoda
Metode isolasi bakteri dilakukan dengan penggerusan insang dan digesta saluran pencernaan setelah ikan dimatikan. Hasil gerusan ditanam pada media agar Mac-Conkey dan agar darah. Selanjutnya media diinkubasi dan dilakukan pewarnaan Gram serta uji-uji biokimiawi untuk mengidentifikasi bakteri.
© Hak Cipta milik IPB, tahun 2012
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
IDENTIFIKASI CACING PARASITIK DAN BAKTERI PADA
INSANG DAN SALURAN PENCERNAAN IKAN NILA HITAM
(
Oreochromis niloticus
)
HAFIZ FURQONUL AZIZ
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan pada
Fakultas Kedokteran Hewan
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
BOGOR
2012
Judul Tugas akhir : Identifikasi Bakteri dan Cacing Parasitik pada Insang dan Saluran Pencernaan Ikan Nila Hitam
(Oreochromis niloticus) Bentuk Tugas Akhir : Penelitian
Nama Mahasiswa : Hafiz Furqonul Aziz
NIM : B04080073
Disetujui,
Pembimbing I
Dr. drh. Risa Tiuria, MS. NIP. 19630430 198703 2 001
Pembimbing II
drh. Usamah Afiff, M.Sc. NIP. 19600624 198703 1 001
Diketahui, Wakil Dekan
Fakultas Kedokteran Hewan - IPB
drh. Agus Setiyono, MS, Ph.D, APVet NIP. 19630810 198803 1 004
KATA PENGANTAR
Segala puji dan syukur sebesar-besarnya penulis panjatkan kepada Allah SWT atas segala rahmat dan hidayah-Nya yang senantiasa dilimpahkan berupa kekuatan lahir batin sehingga karya ilmiah ini dapat diselesaikan. Judul penelitian yang diambil adalah Identifikasi Cacing Parasitik dan Bakteri pada Insang dan Saluran Pencernaan Ikan Nila Hitam (Oreochromis niloticus). Agen penyakit merupakan salah satu hambatan yang merugikan dalam usaha pembudidayaan ikan juga kepentingannya dalam masalah zoonosis. Agen penyakit yang dapat menyebabkan infeksi diantaranya cacing parasit dan bakteri. Oleh karena itu, penelitian mengenai hal tersebut sangat menarik untuk dilakukan. Skripsi ini juga ditulis sebagai salah satu persyaratan untuk meraih gelar Sarjana Kedokteran Hewan pada Fakultas Kedokteran Hewan Institut Pertanian Bogor.
Penulis ingin mengucapkan terima kasih kepada pihak-pihak yang telah membantu penulis dalam penyelesaian skripsi ini:
1. Orang tua penulis, Abdul Aziz, MB. dan Arti Mukminah atas cinta kasih, doa, dan dukungan yang diberikan kepada penulis selama ini, khususnya selama proses penulisan skripsi ini. Terima kasih juga penulis ucapakan kepada adik tersayang, Cattleya Septariani Aziz, atas dukungan moril dan materilnya yang senantiasa diberikan.
2. Dr. drh. Risa Tiuria, MS. dan drh. Usamah Afiff, M.Sc. selaku dosen pembimbing skripsi, atas bimbingan, arahan, ilmu yang diberikan kepada penulis serta selalu menyediakan waktu bagi penulis selama proses penulisan skripsi ini.
3. Dr. drh. Vetnizah Juniantito dan drh. Kusdiantoro Muhammad, M.Si. selaku dosen penguji yang telah memberikan kritik, masukan, dan ilmu untuk menyempurnakan penulisan skripsi ini.
4. Bapak Eman dan Alm. Bapak Rofiq yang telah senantiasa membantu penelitian ini.
6. Sahabat-sahabat terbaik selama ini, Kristian Edo Zulfamy, Dinie Dianita Bakri, Fahrul Irianto, dan Shanty Nathalia M, SE. atas semangat, persahabatan, tawa, canda, dan air mata yang selama ini diberikan kepada penulis.
7. Teman-teman Keluara Cemara, Inessya Feronica, S.Pt., Susi Handayani, S.Kom., Mudita Natania, Misran, S.TP., Virza M, S.TP., Ivan Taufik, Ivan Daniel, Ryanda Rahmat, dan Anggi Maniur Hutasoit, S.Si. atas semangat yang terus-menerus diberikan kepada penulis.
8. Sahabat-sahabat Paguyuban Avenzoar 45, Awan Subangkit, Jami Ramadhan, Rizal Dwi, Aji Agung Cahyaji, Dian Permana Putra, Ridwan, Mutia Rahim, Intan Junita, Cupu Nara Sumita, Farah Nurul Maulida, Widya Siska, Bagus Seta Chandra, Fatma Dewi, Susi Susilawati, dan Friska Vida, atas doa, semangat, dan dukungan yang diberikan kepada penulis selama proses penelitian dan penulisan skripsi ini, serta atas persahabatan, cerita, suka, dan duka selama berada di FKH 45.
9. Dara Restu Maharani, SE., dan Citra Ayu Oktavia, S.TP. atas kebersamaannya sejak sekolah menengah atas sampai sekarang.
10. Teman-teman Avenzoar 45 atas kebersamaannya selama berada di FKH 45. 11. Setiap pihak yang turut membantu penulis dalam proses penulisan skripsi
dan selama masa perkuliahan di Fakultas Kedokteran Hewan Institut Pertanian Bogor.
RIWAYAT HIDUP
Penulis dilahirkan di Bogor, Jawa Barat pada tanggal 25 Januari 1990 dari ayah Abdul Aziz dan ibu Arti Mukminah. Penulis merupakan putra pertama dari dua bersaudara.
Pendidikan formal penulis dimulai dari SDN Pengadilan 5 Kota Bogor dan lulus pada tahun 2002, yang kemudian dilanjutkan ke SMP Negeri 5 Kota Bogor dan lulus pada tahun 2005. Pendidikan SMA penulis diselesaikan di SMA Negeri 1 Kota Bogor dan lulus pada tahun 2008, kemudian melanjutkan ke Institut Pertanian Bogor pada tahun yang sama melalui jalur Undangan Seleksi Masuk Institut Pertanian Bogor. Mayor yang dipilih penulis adalah kedokteran hewan di Fakultas Kedokteran Hewan Institut Pertanian Bogor
DAFTAR ISI
Halaman
DAFTAR TABEL ………...………... xiii
DAFTAR GAMBAR ... xiv
DAFTAR LAMPIRAN... xv
PENDAHULUAN ………... 1
Latar Belakang ………...………... 1
Tujuan ………...…………... 3
Manfaat ………... 3
TINJAUAN PUSTAKA ………... 4
Ikan Nila Hitam ... 4
Trematoda ... 6
Monogenea ... 7
Dactylogyrus sp. ... 10
Gyrodactylus sp. ... 10
Nematoda ... 11
Cestoda ... 14
Bakteri ... 15
Streptococcus agalactiae ... 16
Aeromonas hydrophila ... 17
Edwardsiella tarda ... 18
BAHAN DAN METODE ………...……... 19
Waktu dan Tempat Penelitian ………... 19
Metode Penelitian ... 19
Teknik Pengambilan Sampel ... 19
Teknik Parasitologi ... 20
Teknik Bakteriologi ………... 22
HASIL DAN PEMBAHASAN ………...…... 28
Identifikasi Cacing Parasitik pada Ikan Nila Hitam ... 29
Cacing Monogenea ... 32
Identifikasi Bakteri pada Ikan Nila Hitam ... 34
Aeromonas sp. ... 34
Bacillus sp. ... 36
Escherichia coli ... 37
Edwardsiella tarda ... 38
Enterobacter aerogenes ... 40
Klebsiella pneumoniae ... 41
Pasteurella sp. ... 43
Staphylococcus aureus ... 44
Staphylococcus epidermidis ... 45
Streptococcus sp. ... 46
Vibrio parahaemolyticus ... 47
SIMPULAN DAN SARAN ………...……... 49
Simpulan ... 49
Saran ... 49
DAFTAR PUSTAKA ... 50
DAFTAR TABEL
Halaman
1 Hasil Identifikasi Cacing Parasitik dan Bakteri pada Ikan Nila Hitam
... 28 2 Hasil Uji Biokimiawi Bakteri pada Ikan Nila
DAFTAR GAMBAR
Halaman
1 Ikan Nila Hitam (Oreochromis Niloticus) ... 4
2 Struktur Umum Cacing Monogenea ... 8
3 Siklus Hidup Cacing Monogenea ... 9
4 Cacing Gyrodactylus sp. (1) Cacing Dactylogyrus sp. (2) ... 10
5 Struktur Umum Cacing Nematoda ... 11
6 Siklus Hidup Tidak Langsung Cacing Nematoda dengan Ikan sebagai Inang Definitif ... 13
7 Siklus Hidup Langsung Cacing Nematoda pada Ikan ... 13
8 Siklus Hidup Tidak Langsung Nematoda dengan Ikan sebagai Inang Antara ... 13
9 Bentuk Umum Cacing Cestoda ... 15
10 Jenis-Jenis Metacestoda ... 15
11 Streptococcus agalactiae ... 16
12 Aeromonas hydrophila ... 17
13 Edwardsiella tarda ... 18
14 Diagram Alir Identifikasi Bakteri ... 22
15 Dactylogyrus sp. ... 29
16 Dactylogyrus sp. ... 30
17 Bagian Anterior Dactylogyrus sp. ... 30
18 Gyrodactylidae dan Dactylogiridae ... 31
19 Pseudodactylogyrus sp. ... 31
20 Dactylogiridae ... 32
22 Infestasi Dactylogyridae pada Insang Ikan Patin ... 33
23 Pembusukan pada Sirip ... 35
24 Aeromonas sp. ... 36
25 Bacillus sp. ... 37
26 Escherichia coli ... 38
27 Infeksi Edwardsiella tarda. Hemoragi pada Kulit dan Fistula di bawah Sirip Dada ... 39
28 Edwarsiella tarda ... 40
29 Enterobacter aerogenes ... 41
30 Klebsiella pneumoniae ... 43
31 Pasteurella sp. ... 44
32 Staphylococcus sp. ... 45
33 Streptococcosis pada Ikan Nila dengan Gejala Tetany-Like Akibat Kontraksi Otot ... 47
34 Streptococcosis pada Ikan Atlantic Menhaden dengan Hemoragi Operkulum ... 47
35 Streptococcus sp. ... 47
PENDAHULUAN
Latar Belakang
Indonesia merupakan negara kepulauan yang terdiri dari sepertiga daratan dan dua pertiga lautan. Hal ini yang menjadikan Indonesia kaya akan keanekaragaman hayati, khususnya ikan. Ikan yang menjadi komoditi utama produksi tidak hanya ikan laut, tetapi juga ikan air tawar. Ikan air tawar yang menjadi komoditas unggulan diantaranya adalah ikan gurami, ikan nila, dan ikan mas.
Ikan nila adalah ikan yang hidup di air tawar dan berasal dari Sungai Nil dan danau-danau sekitarnya. Ikan nila mulai didatangkan ke Bogor pada tahun 1969. Ikan nila merupakan ikan konsumsi air tawar yang diminati oleh konsumen selain ikan mas dan gurami, karena ikan nila memiliki rasa daging yang enak, gurih, dan tidak memiliki banyak duri. Tingginya konsumsi ikan nila menyebabkan budidaya ikan nila mulai dikembangkan. Keunggulan dari ikan nila dibandingkan ikan konsumsi lain adalah ikan nila mampu tumbuh cepat hanya dengan pakan yang rendah protein, memijah sepanjang tahun, bersifat omnivora, berdaging tebal, dan rasa dagingnya mirip dengan kakap merah (Suyanto 2009).
Habitat ikan nila adalah air tawar, seperti sungai, danau, waduk dan rawa-rawa, tetapi karena toleransinya yang luas terhadap salinitas (euryhaline) sehingga dapat pula hidup dengan baik di air payau dan laut (K Kordi 2010). Kemampuan hidup dalam berbagai jenis air membuat ikan nila semakin mudah untuk dibudidayakan. Pembudidayaan ikan nila hampir dilaksanakan di seluruh provinsi di Indonesia sehingga produksi ikan nila di Indonesia cukup tinggi. Produksi ikan nila pada tahun 2010 mencapai 464.191 ton, meningkat dibandingkan pada tahun 2009 (KKP 2011).
Agen penyakit yang menyebabkan infeksi diantaranya, virus, bakteri, cendawan, dan parasit. Penyakit parasitik dan bakteri merupakan salah satu penyakit yang dapat menginfeksi hewan, termasuk ikan nila. Parasit adalah organisme yang hidupnya dapat menyesuaikan diri dengan inangnya namun merugikan bagi organisme yang ditempatinya (Noble ER dan Noble GA 1989). Parasit yang dikenal terdapat dua jenis, yaitu endoparasit dan ektoparasit. Endoparasit adalah parasit yang menyerang pada bagian dalam tubuh inangnya (Kismiyati et al. 2010), sedangkan ektoparasit adalah parasit yang hidupnya menumpang di bagian luar dari tempatnya bergantung atau pada permukaan tubuh inangnya (Hadi 2010). Cacing dan protozoa termasuk ke dalam anggota dari endoparasit, karena sebagian siklus hidupnya berada di dalam tubuh inang. Insekta, arachnida, chilpoda, dan diplopoda termasuk ke dalam anggota dari ektoparasit.
Cacing yang bersifat parasit terbagi ke dalam beberapa klasifikasi. Tiga kelas besar dalam klasifikasi cacing adalah nematoda, trematoda, dan cestoda. Cacing dalam kenyataannya tidak selalu bersifat endoparasit, sub kelas monogenea yang berada dalam kelas trematoda bersifat ektoparasit pada ikan. Monogenea merupakan parasit yang sebagian besar menyerang bagian luar tubuh ikan, jarang menyerang bagian dalam tubuh ikan dan biasanya menyerang kulit dan insang (Kabata 1985).
Kerugian yang ditimbulkan akibat infestasi dari cacing pada ikan tidak sebesar apabila ikan terinfeksi oleh virus atau bakteri, tetapi infestasi cacing dapat menjadi faktor predisposisi terjadinya infeksi oleh agen infeksius lainnya. Bakteri merupakan salah satu agen infeksius dengan jumlah spesies terbanyak. Bakteri dapat bersifat patogen dan non patogen, tetapi dalam kasus yang terjadi bakteri non patogen dapat berubah menjadi patogen akibat dari beberapa faktor. Kerugian yang ditimbulkan oleh penyakit infeksi bakteri cukup besar, terlebih jika bakteri tersebut memiliki virulensi yang cukup tinggi.
kesehatan, karena secara langsung ikan mengalami penurunan kualitas dan bahkan kematian yang menyebabkan penurunan produksi. Bakteri penyebab penyakit yang bersifat zoonotik dapat ditularkan kepada manusia dan menyebabkan gangguan kesehatan.
Tujuan Penelitian
Penelitian ini bertujuan untuk mengetahui adanya serta mengidentifikasi jenis cacing parasitik dan bakteri yang terdapat pada insang dan saluran pencernaan ikan nila hitam (Oreochromis niloticus)
Manfaat Penelitian
TINJAUAN PUSTAKA
Ikan Nila Hitam (Oreochromis niloticus)
Ikan nila merupakan salah satu ikan yang sudah banyak dibudidayakan. Di Indonesia, ikan nila cukup populer karena cara budidayanya yang mudah, rasa daging yang disukai, harga yang relatif terjangkau, dan memiliki toleransi yang luas terhadap lingkungan. Ikan nila yang biasa dikonsumsi oleh masyarakat Indonesia adalah ikan nila hitam dan ikan nila merah.
Menurut Fishbase (2012), ikan nila hitam digolongkan dalam kingdom Animalia, filum Chordata, kelas Actinopterygii, dan ordo Perciformes. Ikan nila hitam termasuk ke dalam famili Cichlidae, sub famili Pseudocrenilabrinae, genus Oreochromis, dan spesiesnya adalah Oreochromis niloticus.
Gambar 1 Ikan Nila Hitam (Oreochromis Niloticus) Sumber: Fishbase (2012)
rongga mulut dan mengasuh sendiri anak-anaknya (Trewavas 1982 dalam Suyanto 2010).
Ikan nila hitam berasal dari Sungal Nil dan danau-danau sekitarnya. Sekarang ikan ini telah tersebar ke negara-negara di lima benua yang beriklim tropis dan subtropis, sedangkan di wilayah yang beriklim dingin, ikan nila hitam tidak dapat hidup baik (Menegristek 2000). Ikan nila pertama kali dibawa dari Taiwan ke Bogor pada tahun 1969. Nila berwarna hitam selanjutnya banyak didatangkan dari Thailand pada tahun 1989 dengan strain Chitralada, dari Filipina pada tahun 1994 dan 1997 dengan strain Genetic Improvement of Farmed Tilapia (GIFT), sedangkan untuk nila berwarna merah didatangkan dari Thailand pada tahun 1989 dengan strain National Inland Fish Institute (NIFI) (Gustiano & Arifin 2010).
Ikan nila hitam masih bersaudara dengan ikan mujair (Oreochromis massambiccus) yang sudah tersebar luas di Indonesia sebelum adanya ikan nila hitam. Ikan mujair kurang digemari baik oleh pembudidaya maupun petani karena pertumbuhannya yang lambat, rakus tetapi tidak gemuk, cepat beranak pinak sehingga mengganggu ikan lain dalam satu kolam (Suyanto 2010). Ikan nila hitam selanjutnya didatangkan untuk mengatasi hal ini karena mempunyai nilai efisiensi yang lebih tinggi.
Amri dan Kahiruman (2003) menjelaskan bentuk tubuh ikan nila hitam, berbentuk panjang dan ramping dengan sisik yang berukuran besar. Matanya besar, menonjol, dan bagian tepinya berwarna putih. Gurat sisi atau linea literalis terputus di bagian tengah badan dan berlanjut kembali tetapi letaknya lebih ke bawah daripada letak garis yang memanjang di atas sirip dada. Sirip punggung, sirip perut, dan sirip dubur mempunyai jari lemah tetapi keras dan tajam seperti duri. Sirip punggung berwarna hitam dan sirip dada juga tampak berwarna hitam, sedangkan bagian pinggir sirip punggung berwarna abu abu (Gambar 1).
terdapat pada perbandingan ukuran tubuh, ikan nila hitam memiliki perbandingan panjang dan tinggi 3:1, sedangkan ikan mujair 2:1 (Amri & Kahiruman 2003).
Habitat ikan nila adalah air tawar, seperti sungai, danau, waduk dan rawa-rawa, tetapi karena toleransinya yang luas terhadap salinitas (euryhaline) sehingga dapat pula hidup dengan baik di air payau dan laut. Salinitas yang cocok untuk nila adalah 0-35 ppt, namun salinitas yang memungkinkan nila tumbuh optimal adalah 0-30 ppt. Ikan nila masih dapat hidup pada salinitas 31–35 ppt, tetapi pertumbuhannya lambat (Ghufran & Kordi 2010).
Trematoda
Trematoda atau cacing pipih merupakan kelas dari filum Platyhelminthes. Cacing trematoda umumnya memiliki bentuk pipih seperti daun dan disebut cacing daun, kecuali Schistosoma sp yang merupakan trematoda darah (Natadisastra & Agoes 2009). Trematoda secara umum berbentuk pipih, tidak bersegmen, bentuk memanjang seperti daun, berbentuk telur, kerucut, silindris, dan mempunyai batil isap kepala dan perut. Trematoda bersifat hermafrodit kecuali pada genus Schistosoma (Muslim 2009). Kelas trematoda terbagi menjadi dua sub kelas utama, yaitu Monogenea dan Digenea. Sub kelas Monogenea memiliki siklus hidup langsung dan tidak membutuhkan inang perantara, sedangkan sub kelas Digenea membutuhkan inang antara dalam siklus hidupnya (Urquhart et al. 1996).
Sistem pencernaan trematoda sangat sederhana, dimulai dari mulut yang kemudian mengarah ke faring, esofagus, dan bercabang menjadi dua bagian sekum yang berakhir buntu. Makanan yang tidak dicerna diregurgitasi kembali ke mulut (Urquhart et al. 1996). Cacing trematoda bersifat hermafrodit, kecuali pada genus Schistosoma. Alat kelamin jantan dimulai dari testis yang biasanya berjumlah dua dan letaknya berurutan tergantung spesies, berbentuk oval dengan permukaan rata, berlobus atau bercabang. Ovarium berbentuk bulat atau oval dengan permukaan rata, berlobus, atau bercabang. Umumnya ovarium terletak di anterior dari testis. Kedua alat kelamin bermuara pada antrum genitale dan keluar melalui lubang porus genitalis yang berdekatan dengan batil hisap posterior (Natadisastra & Agoes 2009).
Monogenea
Monogenea adalah sub kelas dari Trematoda. Cacing Monogenea adalah cacing yang tidak membutuhkan inang antara dalam siklus hidupnya dan umumnya ditemukan sebagai parasit di ikan (Urquhart 1996). Kabata (1985) menjelaskan bahwa cacing Monogenea adalah salah satu parasit yang sebagian besar menyerang bagian luar tubuh ikan, terutama kulit dan insang, jarang menyerang bagian dalam tubuh ikan.
Gambar 2 Struktur Umum Cacing Monogenea Sumber: Smith & Halton (1967)
Dawes (1946) juga menjelaskan bahwa tidak semua cacing monogenea memiliki buccal sucker. Sebagian cacing monogenea yang tidak memiliki buccal sucker, mereka menggunakan faring sebagai sucker. Saluran digesti cacing monogenea terdiri dari tiga bagian, yaitu faring, esofagus, dan usus. Faring dan esofagus berbentuk dan berukuran sama yang selanjutnya bercabang dua menjadi usus yang sederhana dan berakhir buntu (Gambar 2).
Siklus hidup dari monogenea adalah siklus langsung yang tidak membutuhkan inang antara. Cacing dewasa bertipe ovipar mengeluarkan telur ke air kemudian telur menetas dan mencari inang baru. Cacing dewasa bertipe vivipar bertelur dan telur tetap berada di dalam tubuh cacing dewasa hingga menetas. Larva selanjutnya keluar dari tubuh cacing dewasa dan terbawa air untuk mencari inang yang baru (Gambar 3) (Reed et al. 2012). Cacing monogenea tidak dapat hidup sebagai parasit pada lebih dari satu spesies ikan, oleh karena itu cacing monogenea memiliki spesifisitas inang yang sangat tinggi (Williams 1961).
Gambar 3 Siklus Hidup Cacing Monogenea Sumber: Reed et al. (2012)
Dactylogyrus sp.
Dactylogyrus merupakan genus dari famili Dactylogyridae dengan sub famili Dactylogyrinae. Cacing dalam genus ini memiliki ciri khas, yaitu memiliki empat titik mata, sepasang kait besar, dan 16 kait kecil, usus bercabang menjadi dua, testes dan ovarium berbentuk bulat, ovari terletak diatas testes, terdapat vagina, dan bersifat ovovipar (Hoffman 1967). Dactylogyrus hidup sebagai parasit dengan menghisap darah dan dapat menyebabkan kerusakan pada insang jika jumlahnya terlalu banyak. Gejala klinis dari manifestasi Dactylogyrus sering keliru dengan gejala defisiensi oksigen atau infeksi insang lainnya (Robert & Piper 2010).
Gyrodactylus sp.
[image:30.595.245.371.524.704.2]Gyrodactylus merupakan genus dari famili Gyrodactyridae dengan sub famili Gyrodactyrinae. Cacing genus Gyrodactylus tidak memiliki prohaptor, opisthaptor berbentuk lebar dan dilengkapi dengan satu pasang kait besar dan 16 kait kecil, usus bercabang dua, lubang genital berada di tengah, tidak terdapat vagina, tidak terdapat titik mata, ovarium berbentuk V atau berlobus dan terletak di belakang testes, serta bersifat vivipara (Dawes 1946). Parasit ini sangat umum dan sering ditemukan pada hampir semua ikan. Jumlah Gyrodactylus yang terlalu banyak dapat menyebabkan iritasi dan lesio (Robert & Piper 2010).
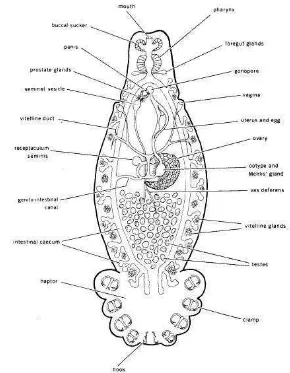
Nematoda
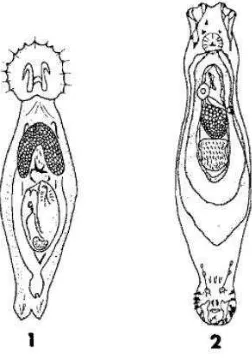
Filum Nemathelminthes terbagi ke dalam enam kelas, tetapi hanya kelas nematoda yang bersifat sebagai parasit. Nematoda disebut sebagai cacing gilig atau round worm karena bentuknya yang bulat jika dipotong secara melintang. Nematoda berbentuk bulat panjang, tidak bersegmen, meruncing di kedua ujungnya, dan tubuhnya dilapisi oleh kutikula. Kutikula diproduksi oleh bagian hipodermis yang pada bagian tersebut tedapat saluran ekskresi dan saraf (Urquhart 1996). Gambar 5 menjelaskan bahwa cacing nematoda memiliki kepala, ekor, dinding dan rongga badan yang disebut pseudoselom, saluran pencernaan, sistem saraf, sistem ekskresi, dan sistem reproduksi terpisah, tetapi tidak memiliki sistem sirkulasi (Natadisastra & Agoes 2009). Muslim (2009) menjelaskan ukuran cacing jantan lebih kecil dari cacing betina dan ujung posterior melengkung ke depan. Spikulum serta bursa kopulasi dimiliki oleh beberapa spesies dari cacing nematoda.
Gambar 5 Struktur Umum Cacing Nematoda Sumber: Sharonapbio-taxonomy (2012)
spesies. Usus berbentuk tabung yang dindingnya dilapisi oleh lapisan tipis syncytium. Lumen ususnya memiliki mikro villi yang meningkatkan kapasitas absorpsi dari sel (Urquhart 1996).
Urquhart (1996) juga menjelaskan bahwa organ reproduksi betina berjumlah sepasang dan terdiri dari ovarium, oviduct, uterus, vagina,dan berakhir pada vulva. Ovejector adalah penghubung antara uterus dan vagina yang berupa otot-otot yang berfungsi dalam penetasan telur. Organ reproduksi jantan terdiri dari satu buah testis berlanjut menjadi vas deferens dan berakhir pada saluran ejakulatori di kloaka. Organ tambahan berupa spikulum yang berfungsi sebagai alat kopulasi dan gubernakulum yang berfungsi mengarahkan spikulum terdapat pada beberapa spesies cacing nematoda.
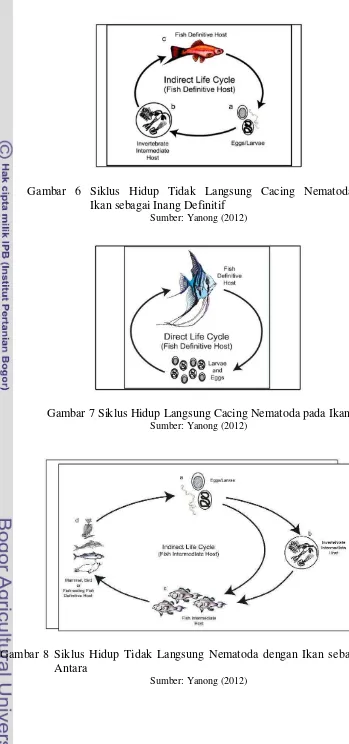
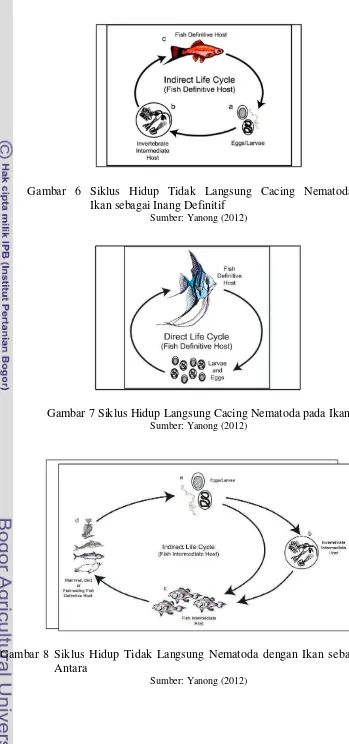
Siklus hidup nematoda terdiri dari tiga stadium, yaitu stadium telur, larva, dan dewasa. Cacing betina dewasa dapat bertelur antara 20-200.000 butir telur per hari (Natadisastra & Agoes 2009). Dalam perkembangan hidupnya, beberapa spesies nematoda menggunakan ikan sebagai inang definitif maupun sebagai inang antara dari siklus hidup nematoda. Siklus hidup nematoda dibagi menjadi dua, yaitu siklus hidup langsung dan siklus hidup tidak langsung. Siklus hidup langsung tidak membutuhkan inang antara dan infeksi dapat terjadi ketika ikan menelan telur atau larva cacing (Yanong 2012).
Gambar 6 Siklus Hidup Tidak Langsung Cacing Nematoda dengan Ikan sebagai Inang Definitif
Sumber: Yanong (2012)
Gambar 7 Siklus Hidup Langsung Cacing Nematoda pada Ikan Sumber: Yanong (2012)
Gambar 8 Siklus Hidup Tidak Langsung Nematoda dengan Ikan sebagai Inang Antara
[image:33.595.113.462.63.807.2]Cestoda
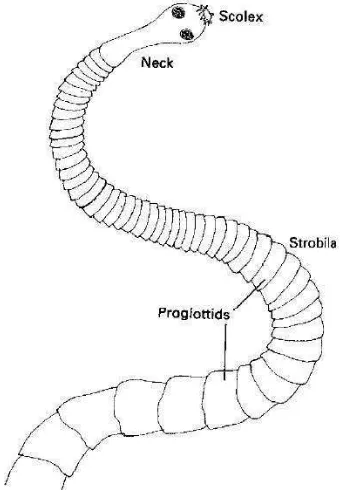
Cestoda adalah kelas dari filum Platyhelminthes. Perbedaan antara cacing kelas Cestoda dengan Trematoda adalah cacing Cestoda memiliki bentuk tubuh yang pipih dan memanjang seperti pita tanpa saluran pencernaan. Bagian tubuhnya bersegmen dan setiap segmen memiliki satu atau lebih sepasang organ reproduksi (Urquhart et al. 1996). Cacing Cestoda dapat digolongkan berdasarkan tempat hidupnya menjadi dua golongan, yaitu Cestoda usus dan Cestoda jaringan. Seluruh Cestoda mempunya inang antara kecuali spesies Hymenolepis nana (Muslim 2009).
Gambar 9 menunjukkan Cestoda dewasa memiliki kepala atau scolex sebagai organ pelekat, leher yang tidak bersegmen, dan untaian segmen yang membentuk pita. Setiap segmen disebut proglotid dan rantai penghubung proglotid disebut strobila. Organ pelekat terdiri dari empat sucker di bagian tepi dan biasanya terdapat kait. Setiap proglotid bersifat hermafrodit dan ketika proglotid menjadi dewasa dan terbuahi bagian internal hilang dan diisi oleh telur-telur Castoda atau gravid. Proglotid garvid akan terlepas dan keluar bersama feses (Urquhart et al. 1996).
Gambar 9 Bentuk Umum Cacing Cestoda Sumber: Urquhart et al. (1996)
Gambar 10 Jenis-Jenis Metacestoda Sumber: Urquhart et al. (1996)
Bakteri
memiliki membran inti. Bakteri terdiri atas sitoplasma yang dikelilingi oleh dinding sel terbuat dari peptidoglikan. Materi genetik, baik DNA maupun RNA, terdapat dalam inti yang diperlukan untuk metabolisme. Bakteri bereproduksi dengan cara aseksual melalui replikasi DNA dan pembelahan sel sederhana. Sebagian besar bakteri membentuk kapsul yang mengelilingi dinding sel sehingga bakteri lebih tahan terhadap kondisi luar (Corwin 2008). Bakteri secara umum terbagi atas bakteri Gram positif dan bakteri Gram negatif.
Bakteri yang sering menginfeksi ikan diantaranya Streptococcus agalactiae, Aeromonas hydrophila, dan Edwardsiella tarda.
Streptococcus agalctiae
Bakteri Streptococcus agalactiae adalah bakteri Gram positif yang berbentuk kokus, berantai pendek, serta secara morfologi mirip dengan S. pyogenes (Parija 2009). Bakteri ini termasuk ke dalam anggota antigen grup B dan memiliki antigen kapsular polisakarida. Kapsul dari S. agalactiae terdiri dari asam sialik yang menyebabkan streptokokus golongan B tahan terhadap opsonofagositosis oleh mekanisme pertahanan tubuh (Shimeld & Rodgers 1998). S. agalactiae termasuk ke dalam kingdom Bacteria, filum Firmicutes, kelas Bacilli, famili Streptococcaceae, genus Streptococcus, dan spesies Streptococcus agalactiae.
Gambar 11 Streptococcus agalactiae Sumber: Vetbact (2011)
menyebabkan hemolisis. CAMP adalah kependekan dari Christie, Atkins, dan Munch-Petersen, penemu protein tersebut (Shimeld & Rodgers 1998).
Aeromonas hydrophila
Aeromonas hydrophila adalah bakteri anaerob fakultatif yang termasuk ke dalam kelompok bakteri Gram negatif. Menurut Corry et al. (1995) Aeromonas hydrophila memiliki flagel pada ujung tubuhnya sehingga bakteri ini bersifat motil. A. hydrophila memiliki kapsul dan mampu memfermentasi glukosa baik secara jalur respirasi maupun secara fermentasi. A. hydrophila hidup bebas di air dan dapat diisolasi dari air asin dan air tawar (Shimeld & Rodgers 1999). A. hydrophila digolongkan ke dalam kingdom Bacteria, filum Proteobacteria. kelas Gammaproteobacteria, dan ordo Aeromonadales. A. hydrophila termasuk ke dalam famili Aeromonadaceae, genus Aeromonas, dan spesies Aeromonas hydrophila.
Gambar 12 Aeromonas hydrophila Sumber: Wikipedia (2012)
Edwardsiella tarda
Edwardsiella tarda merupakan bakteri golongan Gram negatif dan bersifat motil karena memiliki flagela (Austin B dan Austin DA 2007). Kapsul tidak ditemukan pada anggota Edwardsiella, tetapi beberap strain memproduksi substansi berupa lendir. E. tarda diklasifikasikan ke dalam kingdom Bacteria, filum Proteobacteria, kelas Gammaproteobacteria, ordo Enterobacteriales, famili Enterobacteriaceae, genus Edwardsiella, dan spesies Edwardsiella tarda.
Gambar 13 Edwardsiella tarda Sumber: Kushawa et al. (2010)
BAHAN DAN METODE PENELITIAN
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan Juli 2011 hingga bulan Maret 2012 bertempat di Laboratorium Helmintologi Bagian Parasitologi dan Entomologi Kesehatan dan Laboratorium Bakteriologi Bagian Mikrobiologi Medis, Departemen Ilmu Penyakit Hewan dan Kesehatan Masyarakat Veteriner, Fakultas Kedokteran Hewan, Institut Pertanian Bogor.
Bahan dan Alat Penelitian
Bahan yang digunakan dalam penelitian ini adalah sampel ikan nila hitam, NaCl fisiologis, alkohol bertingkat (70%, 85%, 95%, 100%), alkohol absolut, alkohol 70%, kalium hidroksida 10%, minyak cengkeh, pewarna Semichon’s Acetocarmine, entelan, xylol, aquades, agar darah (Blood Agar), agar Mac Conkey Agar (MCA), Nutrient Agar, pewarna Gram, agar miring, glukosa, sukrosa, maltosa, laktosa, manitol, indol, TSIA, sitrat, KOH 10% dan KOH 4%.
Alat yang digunakan pada penelitian ini adalah seperangkat alat bedah, timbangan, cawan petri, pinset, kait, pipet tetes, gunting, botol kaca, spidol, label nama, gelas objek dan kaca penutup, mikroskop cahaya, mikroskop stereo, video mikroskop, bunsen, ose, needle, tabung reaksi dan rak tabung reaksi.
Metode Penelitian
Teknik Pengambilan Sampel
Teknik Parasitologi
Insang dan saluran pencernaan yang sudah dipreparir selanjutnya disimpan dalam refrigerator selama 10 jam untuk merelaksaskikan cacing yang ada. Kemudian insang disisir di bawah mikroskop stereo untuk mengoleksi cacing. Saluran pencernaan dibuka lumennya kemudian diamati di bawah mikroskop stereo untuk mengoleksi cacingnya. Cacing yang ditemukan kemudian difiksasi di dalam alkohol 70% sebelum diwarnai.
Pewarnaan Cacing
Pada penelitian ini digunakan dua jenis teknik pewarnaan, yaitu pewarnaan permanen untuk trematoda dan pewarnaan semi permanen untuk nematoda. Pewarnaan permanen atau dikenal juga dengan pewarnaan
Semichon’s-Acetocarmine biasa digunakan untuk mengindentifikasi cacing pipih
(golongan trematoda). Tahap pertama dalam pewarnaan ini adalah dengan merendam spesimen dalam larutan Semichon’s-Acetocarmine selama 15-20 menit (sampai warna terserap dan spesimen berubah warna menjadi merah cerah). Setelah itu spesimen dibilas dengan menggunakan alkohol 70% kemudian direndam di dalam larutan asam alkohol (99 bagian alkohol 70%, dicampur dengan 1 bagian HCl). Kemudian dilakukan dehidrasi pada spesimen dengan menggunakan alkohol bertingkat (70%, 85%, 95%, 100%) dengan cara merendamnya selama 5 menit pada setiap konsentrasi alkohol. Setelah itu spesimen direndam di dalam xylol sampai spesimen terlihat tembus pandang. Langkah terakhir adalah spesimen di-mounting dengan entelan sebagai media fiksasi (Soulbsy 1982).
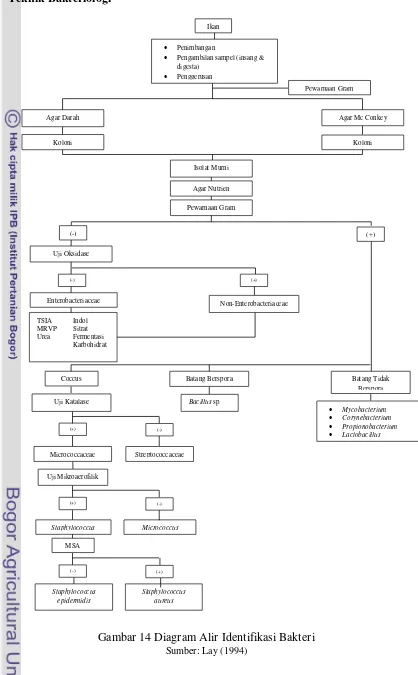
Teknik Bakteriologi
Gambar 14 Diagram Alir Identifikasi Bakteri Sumber: Lay (1994)
Ikan
Penimbangan
Pengambilan sampel (insang & digesta) Penggerusan Pewarnaan Gram Isolat Murni Agar Nutrien Pewarnaan Gram
Agar Mc Conkey Agar Darah
Koloni Koloni
Uji Oksidase Staphylococcus aureus Staphylococcus epidermidis Micrococcus Streptococcaceae
Bacillus sp.
Mycobacterium
Corynebacterium
Propionobacterium
Lactobacillus
Uji Katalase
Coccus Batang Berspora Batang Tidak Berspora TSIA Indol
MRVP Sitrat Urea Fermentasi
Persiapan Bahan
Contoh berupa insang dan organ saluran pencernaan (lambung dan usus) yang berasal dari ikan nila hitam diambil dan diberi perlakuan. Insang diletakan dalam cawan petri steril, dipotong kecil-kecil dan digerus dalam mortar untuk membebaskan bakteri dari tenunan insang. Digesta dari saluran pencernaan dimasukkan ke dalam mortar dan digerus. Aquades steril ditambahkan pada gerusan.
Isolasi Bakteri
Suspensi hasil gerusan ditanam di atas media agar darah dan agar Mac-Conkey untuk menumbuhkan koloni dengan teknik goresan T. Pengerjaan dilakukan secara steril. Media yang telah digores diinkubasi pada inkubator bersuhu 37o C selama kurang lebih 24 jam. Koloni yang tumbuh pada agar darah dan agar Mac-Conkey diambil dan dilakukan karakterisasi berdasarkan persamaan morfologis, yaitu ukuran, warna, bentuk, tepi permukaan, dan transparansi. Koloni terpisah selanjutnya ditanam kembali pada agar nutrient dan diinkubasi selama 24 jam pada suhu 37o C. Selanjutnya dari koloni yang tumbuh dilakukan pewarnaan Gram. Teknik pewarnaan Gram yaitu spesimen yang telah difiksasi ditetesi kristal violet dan didiamkan selama 1 menit kemudian dibilas dengan aquades. Spesimen selanjutnya dibilas dengan larutan pemucat (alkohol) selama 10-20 detik. Tahap terakhir ialah spesimen ditetesi safranin dan didiamkan selama 1 menit kemudian dibilas dengan aquades serta dikeringkan dengan kertas pengering. Koloni tersebut juga dipindahkan ke agar nutrien, kemudian diinkubasi pada inkubator bersuhu 37o C selama 24 jam.
Identifikasi Bakteri
Koloni dengan hasil Gram positif yang berbentuk coccus selanjutnya diuji dengan uji katalase. Katalase adalah enzim yang mengkatalisiskan (H2O2) menjadi
air dan oksigen. Penentuan adanya katalase diuji dengan penambahan 3% H2O2
bersifat katalase positif akan terlihat pembentukan gelembung udara di sekitar koloni. Reaksi kimiawai yang dikatalisasikan oleh enzim katalase terlihat berikut ini:
Bakteri dengan sifat katalase positif selanjutnya dilakukan uji Manitol Salt Agar (MSA) yang mengandung kadar NaCl tinggi, sehingga akan menghambat pertumbuhan bakteri lain namun Staphylococcus tidak dihambat pertumbuhannya. Media ini terutama digunakan untuk membedakan kelompok Staphylococcus yang berifat patogen dan non-patogen. S. aureus pada umumnya bersifat patogen dan menghasilkan warna kuning pada agar. S. epidermidis bersifat tidak patogen dan membentuk zona merah pada agar. Warna kuning disebabkan oleh fermentasi manitol disertai pembentukan asam, sedangkan warna merah disebabkan manitol yang tidak difermentasikan. Bakteri yang bersifat Gram positif dengan bentuk batang terbagi menjadi dua, yaitu batang besar memiliki spora dapat diidentifikasi sebagai Bacillus sp., sedangkan batang yang tidak memiliki spora dapat termasuk bakteri Mycobacterium, Corynebacterium, Propionobacterium, dan Lactobacillus. Uji Oksidase berfungsi untuk menentukan adanya oksidase sitokrom pada mikroorganisme. Uji ini berguna dalam identifikasi mikroorganisme patogen seperti Neisseria gonorrhoea dan Pseudomonas aeruginosa yang menunjukkan hasil positif terhadap uji oksidase. Reagen uji oksidase terdiri dari 1:1 (vol/vol) laruran 1% alpha-naphtol dan 1% dimetil-p-fenillendiamin oksalat. Tahapan dalam uji oksidase ialah dengan pencampuran koloni terpisah dengan reagen. Hasil oksidase positif ditunjukkan dengan warna koloni yang berubah menjadi berwarna hitam setelah 30 menit. Hal ini disebabkan oksidase sitokrom mengoksidasikan larutan reagen (Lay 1994). Hasil positif uji oksidase dapat dilanjutkan dengan proses identifikasi menggunakan media Triple Sugar Iron Agar (TSIA), indol, Methyl Red-Voges proskauer (MRVP), sitrat, urea, uji fermentasi karbohidrat. Uji oksidase yang menunjukkan hasil negatif mengindikasikan jenis bakteri Pseudomonas dan Bordetella.
juga mengandung indikator merah fenol dan FeSO4 untuk memperlihatkan
pembentukan H2S yang ditunjukkan dengan adanya endapan hitam. Konsentrasi
glukosa adalah 1/10 dari konsentrasi laktosa atau sukrosa agar fermentasi glukosa saja dapat terlihat. Media TSIA terdiri dari dua bagian yaitu butt (bawah) dan slant (atas). Tahapan uji TSIA yaitu koloni bakteri diambil dengan menggunakan needle, kemudian ditusukkan pada bagian tengah butt dan langsung dilanjutkan dengan penggoresan di bagian slant. Setelah itu media diinkubasi pada suhu 37o C selama 24-48 jam (Lay 1994).
Reaksi yang dapat terlihat pada media TSIA adalah jika bagian butt bersifat asam dan berwarna kuning dan bagian slant bersifat basa dan berwarna merah,. hal ini menunjukkan adanya fermentasi glukosa. Jika pada keseluruhan media terjadi pembentukan asam sehingga seluruh media berwarna kuning, hal ini menunjukkan terjadi fermentasi laktosa atau sukrosa atau keduanya. Jika terbentuk gas, seperti H2 dan CO2, pada bagian butt media akan terpecah. Jika
seluruh media berwarna merah hal ini berarti ketiga jenis gula tidak difermentasi. Jika terjadi pembentukan H2S, akan terlihat adanya endapan hitam pada butt
(Lay 1994).
Uji indol dilakukan dengan menggunakan media indol yang kaya akan triptofan. Isolat bakteri yang telah diambil dengan menggunakan needle ditusukkan ke bagian tengah media kemudian diinkubasi pada suhu 37o C selama 24-48 jam. Untuk melihat reaksi uji indol dilakukan dengan penambahan reagen Erlich-Bohme sebanyak 2-3 tetes dan ditunggu selama 2-3 menit. Hasil uji positif terlihat dengan terbentuknya warna merah pada permukaan media. Media indol berbentuk semi padat sehingga dapat digunakan untuk mengetahui pergerakan bakteri. Bakteri yang bersifat motil terlihat pertumbuhan koloni di sekitar tusukan dan dipermukaan media (Lay 1994).
berguna dalam mengidentifikasi kelompok bakteri yang menempati saluran pencernaan.
Uji Voges Proskauer digunakan untuk mengidentifikasi mikroorgnisme yang memfermentasi 2,3-butanadiol yang mengakibatkan penumpukan bahan dalam pertumbuhan. Penambahan 10 tetes 40% KOH dan 15 tetes 5% larutan alphanapthol dalam etanol dapat menentukan adanya asetoin (asetilmetilkarbinol), yaitu suatu senyawa pemuka dalam sintesis 2,3-butanadiol. Keberadaan asetoin ditunjukan oleh perubahan warna kaldu menjadi merah muda. Hasil reaksi dapat terlihat paling lambat setelah 30 menit. Perubahan warna kaldu biakan akan lebih jelas pada bagian yang berhubungan dengan udara karena sebagian 2,3-butanadiol dioksidasikan kembali menjadi asetoin sehingga memperjelas hasil reaksi.
Uji sitrat dilakukan dengan menggunakan media Simmon’s citrate yang berbentuk padat dan berwarna hijau. Media merupakan medium sintetik dengan Na sitrat sebagai satu-satunya sumber karbon, NH4+ sebagai sumber N dan brom
thymol blue sebagai indikator pH. Koloni bakteri yang telah diambil dengan menggunakan ose kemudian digoreskan pada permukaan media dan diinkubasi pada suhu 37o C selama 24-48 jam. Hasil uji positif diperlihatkan dengan perubahan warna media dari warna hijau menjadi biru. Hal ini menunjukan kemampuan dari bakteri yang diuji dalam menggunakan sitrat dari media sebagai satu-satunya sumber karbon (Lay 1994).
Uji urea dilakukan dengan menggunakan media urea yang berbentuk padat dan berwarna merah-jingga. Isolat bakteri yang telah diambil dengan menggunakan ose digoreskan pada permukaan media dan diinkubasi pada suhu 37o C selama 24-48 jam. Hasil uji positif terlihat dengan perubahan warna media dari merah-jingga menjadi merah-ungu. Hal ini terjadi karena terjadinya proses hidrolisis urea (Lay 1994).
HASIL DAN PEMBAHASAN
Identifikasi cacing parasitik didasarkan pada Bychowsky (1961) dan Hoffman (1967) dan identifikasi bakteri didasarkan pada Jang, Biberstein, dan Hirsh (1976). Cacing parasitik yang berhasil dikoleksi hanya berasal dari insang dan tidak ditemukan pada saluran pencernaan. Hasil identifikasi cacing parasitik dan bakteri pada ikan nila hitam dapat dilihat pada Tabel 1 berikut:
Tabel 1 Hasil Identifikasi Cacing Parasitik dan Bakteri pada Ikan Nila Hitam
Ikan Cacing (Jumlah) Bakteri
Insang Saluran
Pencernaan
Insang Saluran Pencernaan
1 Dactylogyrus sp (12) Dactylogyridae (1)
- Escherichia coli
Vibrio
parahaemolyticus
Enterobacter aerogenes Escherichia coli
2 - - Escherichia coli
Klebsiella pneumonia
Escherichia coli
3 - - Staphylococcus
epidermidis Bacillus sp.
Staphylococcus aureus Staphylococcus epidermidis
4 Pseudodactylogyrus sp. (9)
- Escherichia coli
Aeromonas sp.
Escherichia coli
5 Dactylogyrus sp. (24)
Pseudodactylogyrus sp. (7)
Dactylogyridae (1)
- Edwardsiella tarda Escherichia coli
6 - - Escherichia coli
Edwardsiella tarda
Escherichia coli Aeromonas sp.
7 - - Escherichia coli
Edwardsiella tarda
Escherichia coli
8 Dactylogyrus sp. (9)
Pseudodactylogyrus sp. (4)
- Sterptococcus sp.
Edwardsiella tarda
Vibrio
parahaemolyticus Bacillus sp. 9 Dactylogyrus sp. (15)
Pseudodactylogyrus sp. (4)
- Edwardsiella tarda
Streptococcus sp.
Pasteurella sp.
Escherichia coli
10 Dactylogyrus sp. (12) - Vibrio
parahaemolyticus Pasteurella sp.
Bacillus sp.
Edwardsiella tarda
Bacillus sp.
Edwardsiella tarda
Identifikasi Cacing Parasitik pada Ikan Nila (Oreochromis niloticus)
[image:48.595.101.520.211.754.2]sedangkan Pseudodactylogyrus sp. berjumlah 24 cacing, dan Dactylogyridae berjumlah 8 cacing.
Cacing parasitik pada insang diidentifikasi sebagai Dactylogyrus sp. karena memiliki ukuran sekitar 0,1 mm, memiliki 14 kait pinggir, dan dua pasang kait utama. Genus Dactylogyrus sp. juga memiliki kitin yang berada di antara kait utama dan memiliki dua pasang spot mata. Bagian anterior Dactylogyrus sp. berlekuk-lekuk sebanyak 1-3 pasang lekukan dengan head organs di dalamnya (Gambar 12, Gambar 13, dan Gambar 14).
Gambar 15 Dactylogyrus sp.
Gambar 16 Dactylogyrus sp.
Keterangan: p=0,66 mm; l=0,13 mm; k=kait utama
Gambar 17 Bagian Anterior Dactylogyrus sp.
Gambar 18 Gyrodactylidae dan Dactylogiridae Sumber: Noga (2010)
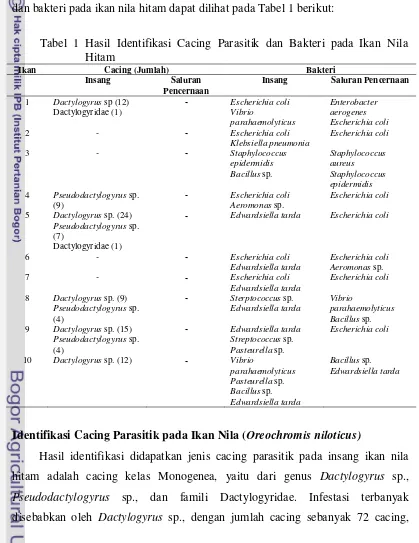
Gambar 19 Pseudodactylogyrus sp. Keterangan: p=0,57 mm; l=0,08 mm.
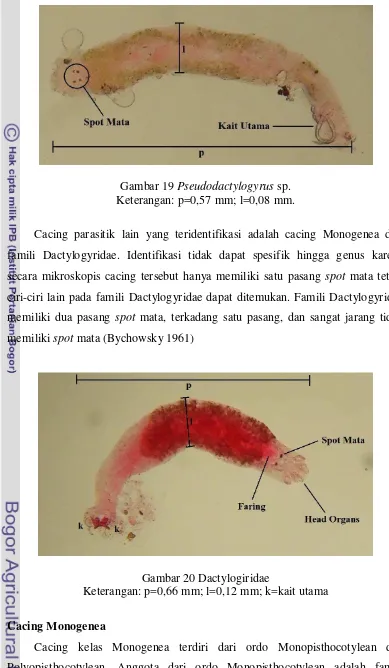
[image:51.595.106.495.80.748.2]Cacing parasitik lain yang teridentifikasi adalah cacing Monogenea dari famili Dactylogyridae. Identifikasi tidak dapat spesifik hingga genus karena secara mikroskopis cacing tersebut hanya memiliki satu pasang spot mata tetapi ciri-ciri lain pada famili Dactylogyridae dapat ditemukan. Famili Dactylogyridae memiliki dua pasang spot mata, terkadang satu pasang, dan sangat jarang tidak memiliki spot mata (Bychowsky 1961)
Gambar 20 Dactylogiridae
Keterangan: p=0,66 mm; l=0,12 mm; k=kait utama
Cacing Monogenea
Dactylogyridae dan Gyrodactyridae, yang sering menyerang ikan, baik ikan air tawar maupun ikan air laut. Dactylogyridae dan Gyrodactyridae umumnya menyerang bagian superfisial kulit dan insang dan mengambil nutrisi dengan melakukan penetrasi ke dalam mukosa.
Kait pinggir, kait utama, dan sucker dari Monogenea berkontak dengan jaringan inang dan menyebabkan kerusakan secara langsung (Woo et al. 2002). Proses pengambilan nutrisi dari cacing Dactylogyridae dan Gyrodactyridae menyebabkan iritasi yang berakibat timbulnya bercak-bercak, fokus kemerahan akibat dari produksi mukus berlebih, hiperplasi epitel, dan hemoragi. Infestasi cacing yang sedikit juga mampu menyebabkan produksi mukus berlebih dan pruritus. Beberapa spesies tertentu dapat menyebabkan luka yang dalam (Noga 2010).
Gambar 21 Bercak Kulit pada Ikan Akibat Produksi Mukus Berlebih Sumber: Noga (2010)
Gambar 22 Infestasi Dactylogyridae pada Insang Ikan Patin Sumber: Noga (2010)
Identifikasi Bakteri pada Ikan Nila (Oreochromis niloticus)
Hasil identifikasi bakteri dari sampel pada insang dan saluran pencernaan diperoleh sepuluh genus bakteri. Identifikasi dilakukan berdasarkan Jang, Biberstein, dan Hirsh (1976). Hasil uji biokimia bakteri dapat dilihat pada Tabel 2 berikut:
Tabel 2. Hasil Uji Biokimiawi Bakteri pada Ikan Nila
Bakteri TSIA Indol Urea Sitrat G Mi Ma L S
Slant Butt Gas
Aeromonas
sp.
K K + + - + + + + + +
Escherichia coli
M K - + - - + - + - +
Enterobacter aerogenes
M K - - + + + + + + +
Edwardsiella tarda
M K + + - + + + + + +
Klebsiella pneumoniae
K K + - + + + + + + +
Pasteurella sp.
[image:53.595.108.509.537.756.2]Vibrio parahaemolyt icus
M K - + - + + + + + +
M = Merah Mi = Manitol S = Sukrosa K = Kuning Ma = Maltosa
G = Glukosa L = Laktosa
Aeromonas sp.
Hasil uji identifikasi didapatkan bakteri ini merubah agar TSIA menjadi kuning pada daerah slant dan butt serta memproduksi gas. Hasil uji urease menunjukkan bakteri tidak mampu mendegradasi urea tetapi mampu menggunakan sitrat sebagai sumber karbon pada uji sitrat. Uji indol menunjukkan hasil yang positif. Hasil uji fermentasi gula-gula didapatkan hasil bahwa bakteri ini mampu memfermentasikan glukosa, manitol, laktosa, sukrosa, dan maltosa. Menurut Woo dan Bruno (2011), Aeromonas sp. mampu memfermentasi fruktosa, galaktosa, maltosa, trehalosa, manitol, sukrosa, glukosa, dextrin dan glikogen, memberikan hasil uji positif pada uji indol, memproduksi gas dari glukosa.
Aeromonas sp adalah bakteri Gram negatif, motil, berbentuk batang, dan menyebabkan penyakit pada ikan. Motile aeromonas septicemia (MAS) atau motile aeromonas infection (MAI) adalah penyakit pada ikan yang disebabkan oleh bakteri Aeromonas sp. (Camus et al. 1998). MAS sering disebabkan oleh A. hydrophila, tetapi jarang disebabkan oleh A. sobria dan A. caviae (Woo et al. 2002).
Aeromonas sp. banyak ditemukan di perairan air tawar, sedikit ditemukan di air payau, dan jarang ditemukan pada air dengan silinitas di atas 15 ppt. Aeromonas sp. hidup pada perairan yang kaya akan zat organik seperti kolam dan sistem pembudidayaan lainnya. Selain hidup secara bebas, Aeromonas sp. dapat diisolasi dari kulit dan saluran pencernaan ikan sehat. Aeromonas sp. dianggap sebagai patogen oportunis karena hanya menyebabkan penyakit pada saat kondisi ikan stres atau menderita penyakit lain (Camus et al. 1998).
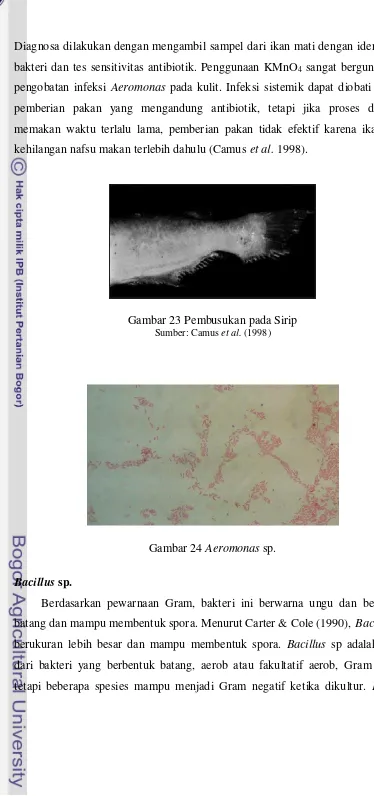
Diagnosa dilakukan dengan mengambil sampel dari ikan mati dengan identifikasi bakteri dan tes sensitivitas antibiotik. Penggunaan KMnO4 sangat berguna untuk
[image:55.595.99.473.46.842.2]pengobatan infeksi Aeromonas pada kulit. Infeksi sistemik dapat diobati dengan pemberian pakan yang mengandung antibiotik, tetapi jika proses diagnosa memakan waktu terlalu lama, pemberian pakan tidak efektif karena ikan akan kehilangan nafsu makan terlebih dahulu (Camus et al. 1998).
Gambar 23 Pembusukan pada Sirip Sumber: Camus et al. (1998)
Gambar 24 Aeromonas sp.
Bacillus sp.
memiliki banyak spesies dan memiliki beragam kemampuan fisiologis sehingga mampu hidup di lingkungan. Bacillus mampu membentuk spora yang tahan terhadap panas, dingin, radiasi, pengawetan, dan disinfektan (Baron 1996). Bacillus terdiri dari spesies yang hidup di lingkungan maupun sebagai patogen. B. cereus, B. mycoides, dan B. subtilis, adalah spesies dari Bacillus yang bersifat patogen pada ikan.
Infeksi Bacillus pada ikan menyebabkan mortalitas sebesar 10-15%. Infeksi ditandai dengan kelemahan, lesu, kurus, dan nekrosa pada bagian kulit, serta kematian setelah beberapa hari pasca infeksi. Edema dan sedikit darah dapat ditemukan pada rongga perut, ptechie dan nekrosa dapat ditemukan pada hati dan ginjal (Austin B dan Austin D 2007)
B. cereus dan B. subtilis biasa ditemukan pada ikan gurami dan berasosiasi dengan penyakit branchionecrosis. B. mycoides dilaporkan pernah menjadi epizootik pada ikan lele dan patin di Alabama pada tahun 1992. Infeksi ditandai dengan warna kulit yang gelap, tidak nafsu makan, ulcer pada bagian dorsal, dan nekrosa otot epaksial (Austin B dan Austin D 2007).
Gambar 25 Bacillus sp.
antibiotik lipopetida termasuk iturins. Iturins membantu B. subtilis untuk bersaing dengan mikroorganisme lainnya dengan membunuh atau menahan pertumbuhannya (NRG 2008)
Beberapa penelitian membuktikan bahwa probiotik pada ikan dan udang tahan terhadap patogen seperti Aeromonas salmonicida dan meningkatkan imunitas (Liu et al. 2010; Irianto 2002; Randelli et al. 2008; Nayak 2010 dalam Mohamed & Refat 2011). Probiotik B. subtilis mampu mengurangi jumlah Vibrio sp. pada kolam budidaya setelah 14 hari pemberian dan meningkatkan protein serum total dan globulin setelah 60 hari (Moriarty 1998; Baleazar & Rojas-Luna 2007; Nayak et al 2007 dalam Mohamed & Refat 2011).
Escherichia Coli
Hasil uji TSIA menunjukkan hasil bakteri ini mampu memfermentasikan semua gula, terlihat pada daerah slant dan butt yang berwarna kuning. Uji urease dan sitrat menujukkan hasil yang negatif. Uji indol memberikan hasil yang positif dan hasil dari uji fermentasi gula menunjukkan bakteri ini mampu memfermentasi glukosa, sukrosa, dan maltosa. Hasil positif didapatkan dari uji Methyl Red dan Voges Proskauer. Percival et al. (2004) menyebutkan bahwa Escherichia coli bersifat motil, dapat tumbuh pada media Mac-Conkey, memberikan hasil positif pada uji Methyl Red, negatif pada uji Voges Proskauer, dan negatif pada uji urease. Menurut Cowan dan Steel (1974), E. coli mampu memfermentasi sukrosa, maltosa, manitol, dan memproduksi gas dari glukosa.
Enteroinvasive E. coli (EIEC), Enteroaggregative E. coli (EAEC), dan Diffusely Adhering E. coli (DAEC) (Bhunia 2008).
Gambar 26 Escherichia coli
Edwardsiella tarda
Hasil uji TSIA menunjukkan slant berwarna merah dengan butt berwarna kuning disertai adanya gas. Hal ini berarti bakteri mampu memfermentasi glukosa dan memproduksi gas. Hasil uji indol menunjukkan hasil yang positif. Uji urease didapatkan hasil yang negatif sedangkan uji sitrat didapatkan hasil yang positif. Uji fermentasi gula didapatkan hasil glukosa, manitol, sukrosa, laktosa, dan maltosa dapat difermentasikan. Woo dan Bruno (2011) menyatakan bahwa Edwardseilla tarda bersifat motil, memberikan hasil positif pada uji indol, uji sitrat, dan memproduksi gas dari fermentasi glukosa.
Edwardsiella tarda merupakan bakteri golongan Gram negatif, bersifat motil karena memiliki flagela (Austin B dan Austin D 2007). Edwarsiella tarda menyebabkan penyakit yang disebut dengan Edwardsiella septicaemia (ES). Edwardsiella tarda menginfeksi berbagai macam jenis ikan, tetapi jenis ikan yang peka adalah belut dan patin (Woo & Bruno 1999).
E. tarda dapat menginfeksi manusia melalui rute oral dan menyebabkan meningitis, abses hati, infeksi pada luka, dan gastroenteritis (Noga 2010).
Gambar 27 Infeksi Edwardsiella tarda. Hemoragi pada Kulit dan Fistula di bawah Sirip Dada
Sumber: Noga (2010)
Predisposisi penyakit ES sering disebabkan stress akibat kondisi lingkungan, karena E. tarda merupakan bakteri yang dapat ditemukan di perairan. ES juga dapat terjadi karena ikan sebelumnya telah terinfeksi oleh bakteri lain, seperti A. hydrophila dan protoza seperti Trichodina (Woo & Bruno 1999)
Sistemik antibiotik berupa oksitetrasiklin perlu dilakukan untuk mengobati penyakir ES karena infeksi ini bersifat sistemik, akan tetapi beberapa strain dari E. tarda resistan terhadap oksitetrasiklin. Perbaikan manajemen air juga menjadi hal penting karena E. tarda adalah bakteri perairan (Noga 2010).
Enterobacter aerogenes
Hasil uji TSIA menunjukkan bahwa bakteri ini mampu memfermentasi glukosa, dengan warna butt kuning. Uji urease dan sitrat didapatkan hasil yang positif, sedangkan uji indol didapatkan hasil negatif. Hasil positif juga ditunjukkan dari hasil uji fermentasi gula, yaitu glukosa, manitol, sukrosa, laktosa, dan maltosa. Carter dan Cole (1990) menyebutkan bahwa Enterobacter aerogenes, pada uji TSIA, memberikan hasil butt berwarna kuning, hasil negatif pada uji indol dan uji urease. Hasil positif pada sitrat, uji fermentasi glukosa, manitol, sukrosa, dan laktosa. Cowan dan Steel (1990) juga menyebutkan E. aerogenes mampu memfermentasi hampir semua jenis gula, diantaranya glukosa, manitol, sukrosa, laktosa, maltosa, adonitol, arabinosa, inositol, rafinosa, rhamnosa, dan trehalosa.
Enterobacter aerogenes berbentuk batang, motil, lebih kecil, dan berkapsul dibandingkan dengan bakteri yang termasuk dalam famili Enterobacteriaceae (Microbewiki 2012). Enterobacter banyak ditemukan di alam, seperti di air, tanah, dan produk peternakan, juga dapat ditemukan pada saluran pencernaan hewan. E. aerogenes adalah oportunistik patogen dan bisa berasosiasi dengan mastitis pada sapi (Carter & Cole 1990). E. aerogenes dapat menyebabkan infeksi nosokomial, yaitu infeksi yang terjadi ketika penderita menjalani perawatan di rumah sakit. Infeksi dapat bersumber dari peralatan operasi dan cairan infus yang terkontaminasi (Grimont F dan Grimont PAD 2006).
Gambar 29 Enterobacter aerogenes
Klebsiella pneumoniae
Hasil uji TSIA memberikan hasil daerah slant dan butt berwarna kuning dan disertai dengan pembentukan gas. Hasil positif didapatkan dari uji urease dan sitrat, sedangkan hasil negatif didapatkan dari uji indol. Uji fermentasi gula, glukosa, manitol, sukrosa, laktosa, dan maltosa, menunjukkan hasil yang posit if dari kelimanya. Menurut Carter & Cole (1990), Klebsiella pneumoniae memberikan hasil negatif pada uji indol, positif pada uji sitrat, negatif pada pembentukan endapan H2S, positif pada uji urease, positif pada uji fermentasi
glukosa, manitol, sukrosa, dan laktosa. Cowan dan Steel (1990) menyebutkan Klebsiella pneumoniae mampu memfermentasi hampir semua jenis gula-gula.
K. pneumoniae adalah bakteri dari famili Enterobacteriaceae. K. pneumoniae merupakan bakteri Gram negatif, berbentuk batang, tidak motil, dan tidak berkapsul (Percival et al. 2004). K. pneumoniae banyak ditemukan di alam, seperti di air, tanah, dan produk yang berasal dari kayu yang digunakan sebagai kandang. K. pneumoniae dapat menyebabkan mastitis yang parah ketika kandang terbuat dari kayu yang terkontaminasi K. pneumoniae. K. pneumoniae juga pernah diisolasi dari infeksi pada hewan, diantaranya pada kasus cervicitis dan metritis pada kuda, luka, septikemia, dan pneumonia pada anjing (Carter & Cole 1990).
kateter. K. pneumonia menyebabkan pneumonia, septikemia, dan meningitis (CDC 2012).
Infeksi K. pneumoniae pada ikan jarang terjadi. Infeksi K. pneumoniae dapat menyebabkan infeksi pada kulit dan perubahan warna kulit dari hitam menjadi pucat. K. pneumoniae bebas yang hidup pada air di kolam perikanan, dapat menurunkan level oksigen pada air sehingga menyebabkan kematian pada ikan akibat hipoksia (Udeze et al. 2012). K. pneumoniae pada ikan dapat berpindah ke manusia akibat mengkonsumsi ikan yang terkontaminasi K. pneumoniae. Selain menyebabkan infeksi pada manusia, hal yang penting lainnya adalah bahwa K. pneumoniae resisten terhadap beberapa antibiotik standar (Ampofo & Clerk 2010). K. pneumoniae mampu memproduksi extended spectrum beta laktamase (ESBL) dan carbapenemase (KPC) sehingga resisten terhadap antibiotik yang memiliki cincin beta laktam dan antibiotik carbapenem (Kumar et al. 2011).
Gambar 30 Klebsiella pneumoniae
Pasteurella sp.
ditunjukkan pada uji indol, kecuali untuk spesies P. multocida. Hasil uji fermentasi glukosa, manitol, sukrosa, laktosa, dan maltosa memberikan hasil positif.
Pasteurella adalah bakteri Gram negatif, tidak motil, anaerob fakultatif, dan berbentuk batang atau kokobasil (Carter & Cole 1990). Pasteurella adalah flora normal yang dapat ditemukan di bagian oral, saluran pernafasan, saluran genital, dan saluran gastrointestinal dari berbagai hewan domestik maupun satwa liar (Microbewiki 2012). Pasteurella skyensis dilaporkan menjadi penyakit emerging pada ikan, terutama salmon. Pertama kali dilaporkan terjadi pada ikan salmon di Skotlandia pada tahun 1995 hingga 1998 (Toranzo et al. 2004). P. skyensis berasal dari pulau Skye di Skotlandia (Birkbeck et al. 2002)
Infeksi P. skyensis menunjukkan lesio katarak dan penu