KEBERADAAN CACING PARASITIK DAN BAKTERI
PADA INSANG SERTA SALURAN PENCERNAAN IKAN
NILA Bogor Enhanced Strain Tilapia (Oreochromis niloticus)
NURHAYATI SUWARTIANI
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
BOGOR
2012
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa skripsi dengan judul Keberadaan Cacing Parasitik dan Bakteri pada Insang dan Saluran Pencernaan Ikan Nila
Bogor Enhanced Strain Tilapia (Oreochromis niloticus) adalah karya saya dengan
arahan dari pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, September 2012
Nurhayati Suwartiani
ABSTRACT
NURHAYATI SUWARTIANI. Presence of Parasitic Worm and Bacteria on Gills and Gigestive Tract of Bogor Enhanced Strain Tilapia Fish
(Oreochromis niloticus). Under direction RISA TIURIA and USAMAH AFIFF.
This study aimed to identify the type of a parasitic worms and bacteria in gills and digestive tract of Bogor Enhanced Strain Tilapia Fish
(Oreochromis niloticus) by conventional methods. A group of 10 fishes of sample
BEST tilapia were used, each gills and digestive tract was collected. The parasitic worms were colored with KOH and clove oil for nematode worm, and Semichon’s Acetocarmine staining for trematode worms. Differentiations and characterizations of variants isolate were based on biochemical reactions and Gram staining technique. Parasitic worms that can be identified from gills were
Dactylogyrus sp. and Pseudodactylogyrus sp., while parasitic worm from
digestive tract was Anisakis sp. The bacteria result shows that the gills and digestive tract of BEST tilapia were predominantly contaminated with Aeromonas
sp. and followed by Staphylococcus epidermidis and Streptococcus sp.
Keywords: Fish of Bogor Enhanced Strain Tilapia, Parasitic worm, Bacteria, Gills, Digestive tract.
NURHAYATI SUWARTIANI. Keberadaan Cacing Parasitik dan Bakteri pada Insang serta Saluran Pencernaan Ikan Nila Bogor Enhanced Strain Tilapia
(Oreochromis niloticus). Dibimbing oleh RISA TIURIA dan USAMAH AFIFF.
Peranan ikan sebagai sumber pangan yang semakin besar menuntut peningkatan produksi perikanan. Kementerian Kelautan dan Perikanan mencanangkan Indonesia sebagai produsen penghasil produk perikanan dan kelautan terbesar di tahun 2015. Pencapaian target produksi perikanan tersebut terus diupayakan dengan peningkatan produksi nasional terutama pada perikanan budidaya sebesar 353%.
Salah satu varietas yang menjadi komoditas unggulan untuk mencapai target peningkatan produksi perikanan budidaya nasional adalah ikan nila
(Oreochromis niloticus). Banyak strain ikan nila telah dikembangkan di
Indonesia. Salah satu strain ikan nila yang berpotensi untuk dikembangkan adalah Ikan nila Bogor Enhanched Strain Tilapia (BEST). Ikan nila BEST dikembangkan dari generasi ke-6 ikan nila GIFT hasil evaluasi Balai Riset Perikanan Budidaya Air Tawar (BRPBAT) dalam kurun waktu 2004-2008. Hasil pengujian menunjukkan bahwa ikan nila BEST lebih unggul dan hasilnya lebih baik dibandingkan dengan ikan nila jenis lainnya. Ikan nila BEST memiliki tingkat produksi, pertumbuhan, dan daya tahan terhadap lingkungan dan penyakit yang lebih baik.
Keberadaan cacing parasitik menyebabkan kerugian secara ekonomi terutama pada penurunan kualitas hasil perikanan dan dapat merugikan kesehatan manusia. Parasit dapat menyebabkan penyakit dengan cara melukai inang, mengambil nutrisi di dalam tubuh inang, meracuni inang, dan memfasilitasi masuknya mikroorganisme patogen ke dalam tubuh inang (Latama 2002). Populasi bakteri pada ikan yang banyak akan menimbulkan penyakit bahkan kematian.
Penelitian ini bertujuan untuk mengidentifikasi keberadaan cacing parasitik dan bakteri pada insang dan saluran pencernaan ikan nila BEST
(Oreochromis niloticus) Selanjutnya, penelitian ini diharapkan dapat menjadi
informasi mengenai jenis cacing dan parasitik sehingga dapat melakukan pencegahan terhadap infeksi yang ditimbulkan oleh cacing parasitik maupun bakteri.
Penelitian ini dilakukan dengan metode identifikasi konvensional. Sejumlah sepuluh ikan nila BEST (Oreochromis niloticus) digunakan dalam penelitian ini. Cacing parasitik kelas trematoda diwarnai dengan pewarnaan permanen mengunakan pewarna acretomicine, sedangkan cacing nematoda diwarnai dengan pewarnaan semi permanen menggunakan KOH dan minyak cengkeh. Identifikasi bakteri Gram positif dilakukan uji katalase, glukosa mikroaerofilik, dan penanaman pada agar MSA. Sedangkan bakteri yang bersifat Gram negatif dilakukan uji oksidase, TSIA, Indol, MRVP, Sitrat, Urea, dan Fermentasi Karbohidrat.
Jumlah cacing parasitik yang ditemukan pada insang dan saluran pencernaan ikan nila BEST sebanyak tiga spesies, yaitu Dactylogyrus sp.,
Gyrodactylus sp., dan Anisakis sp. Sementara itu, jumlah bakteri yang ditemukan
sebanyak 7 spesies yaitu Aeromonas sp., Staphylococcus epidermidis.,
Streptococcus sp., Pseudomonas flourescens, Bacillus sp., Escherichia coli, dan
Edwardsiella tarda. Bakteri yang ditemukan ada yang bersifat patogen pada ikan,
misalnya Aeromonas sp. yang paling banyak ditemukan.
Kata Kunci: Cacing Parasitik, Bakteri, Insang, Saluran Pencernaan, Ikan Nila BEST (Oreochromis niloticus)
© Hak Cipta milik IPB, tahun 2012
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya tulis dalam bentuk apa pun tanpa izin IPB
KEBERADAAN CACING PARASITIK DAN BAKTERI
PADA INSANG SERTA SALURAN PENCERNAAN IKAN
NILA Bogor Enhanced Strain Tilapia (Oreochromis niloticus)
NURHAYATI SUWARTIANI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan pada
Fakultas Kedokteran Hewan
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
BOGOR
2012
(Oreochromis niloticus)
Nama : Nurhayati Suwartiani NIM : B04080038 Disetujui, Pembimbing I Dr. drh. Risa Tiuria, MS. NIP. 19630430 198703 2 001 Pembimbing II drh. Usamah Afiff, M.Sc. NIP. 19600624 198703 1 001 Diketahui,
Wakil Dekan Fakultas Kedokteran Hewan - IPB
drh. Agus Setiyono, MS, Ph.D, APVet NIP. 19630810 198803 1 004
KATA PENGANTAR
Assalamu'alaikum Wr. Wb.
Puji syukur penulis panjatkan ke hadirat Allah SWT, karena hanya dengan limpahan rahmat, izin, dan hidayah-Nya, penulis dapat menyelesaikan penulisan skripsi yang berjudul “Keberadaan Cacing Parasitik dan Bakteri pada Insang dan Saluran Pencernaan Ikan Nila Bogor Enhanced Strain Tilapia
(Oreochromis niloticus)" yang merupakan syarat kelulusan Sarjana Kedokteran
Hewan Institut Pertanian Bogor.
Dengan segala kerendahan hati, penulis juga ingin mengucapkan terima kasih yang sebesar-besarnya kepada Dr. drh. Risa Tiuria, MS selaku pembimbing pertama dan drh. Usamah Afiff, M.Sc. selaku pembimbing kedua atas bimbingan, ilmu, dorongan, motivasi, nasehat, dan waktu yang telah diluangkan selama penelitian hingga selesainya skripsi ini, serta drh. Budhy Jasa Widyananta, MS. Selaku pembimbing akademik yang telah memberikan saran dan motivasi.
Apa, Ibu, Fitri, dan Iki yang luar biasa selalu memberikan cinta, kasih sayang, waktu, dukungan, tenaga, dan doanya selama ini. Teman-teman sepenelitian dan seperjuangan, Anit, Ismi, dan Hafiz atas kerjasama, motivasi, dan dukungannya. Seluruh staf dan pegawai laboratorium Helmintologi dan laboratorium Mikrobiologi yang telah banyak membantu mulai dari awal hingga selesainya penelitian ini dengan lancar. Sahabat-sahabat terbaikku, Ayu, Icha, Vevi, Uni dan teman-teman Avenzoar FKH 45 atas dorongan semangat dan seluruh bantuannya. Pihak-pihak lain yang tidak dapat disebutkan satu-persatu yang telah banyak membantu untuk keberhasilan penulis.
Penulis menyadari banyaknya kekurangan dalam penulisan skripsi ini, oleh karena itu kritik dan saran dari pembaca sangat penulis harapkan dan penulis berharap agar skripsi ini dapat bermanfaat bagi banyak pihak termasuk penulis pribadi.
Bogor, September 2012
Penulis dilahirkan di Sumedang, Jawa Barat pada tanggal 5 Agustus 1990. Penulis merupakan anak pertama dari pasangan drs. Oman Suwarman dan Yanti Suryantini SKM.
Penulis menyelesaikan pendidikan di Taman Kanak-Kanak Murai Sejahtera, Sumedang pada tahun 1995 dan masuk ke Sekolah Dasar Negeri (SDN) Sukamaju, Sumedang pada tahun 1996. Penulis melanjutkan studi ke Sekolah Menengah Pertama Negeri (SMPN) 2 Sumedang pada tahun 2002 dan lulus Sekolah Menengah Atas Negeri (SMAN) 1 Sumedang pada tahun 2008. Penulis diterima sebagai Mahasiswa Fakultas Kedokteran Hewan Institut Pertanian Bogor melalui seleksi USMI (Undangan Seleksi Masuk IPB) pada tahun 2008.
Selama mengikuti perkuliahan di Fakultas Kedokteran Hewan, penulis pernah mengikuti beberapa kepanitiaan dan organisasi. Penulis tercatat pernah menjadi pengurus BEM FKH IPB departemen kominfo kabinet Katalis periode tahun 2010, sekretaris Majalah Vet-zone FKH IPB periode tahun 2009-2010, anggota Himpunan Minat dan Profesi Ruminansia FKH IPB, dan anggota Organisasi Mahasiswa Daerah WAPEMALA.
DAFTAR ISI
Halaman
DAFTAR TABEL ... xiii
DAFTAR GAMBAR ... xiv
PENDAHULUAN Latar Belakang ... 1
Tujuan Penelitian ... 2
Manfaat Penelitian ... 2
TINJAUAN PUSTAKA Ikan Nila BEST (Oreochromis niloticus) ... 3
Morfologi ... 3
Anatomi ... 4
Habitat ... 5
Cacing Parasitik pada Insang dan Saluran Pencernaan Ikan ... 5
Jenis-Jenis Cacing Parasitik pada Insang ... 6
Dactylogyrus sp. ... 6
Gyrodactylus sp ... 7
JenisJenis Cacing Parasitik pada Saluran Pencernaan ... 8
Nematoda ... 9
Cestoda ... 11
Digenea ... 11
Bakteri pada Insang dan Saluran Pencernaan Ikan ... 12
Jenis-Jenis Bakteri pada Insang dan Saluran Pencernaan ... 13
Aeromonas sp. ... 13
Pseudomonas sp. ... 14
Edwardsiella tarda ... 15
Vibrio sp. ... 15
BAHAN DAN METODE Waktu dan Tempet Penelitian ... 17
Metode Penelitian
Pengambilan Sampel Ikan Nila BEST ... 17
Pemeriksaan Cacing Parasitik ... 18
Pemeriksaan Bakteri ... 19
HASIL DAN PEMBAHASAN Cacing Parasitik pada Ikan Nila BEST (Oreochromis niloticus) ... 26
Jenis Cacing Parasitik yang ditemukan pada Insang ... 26
Dactylogyrus sp. ... 26
Pseudodactylogyrus sp. ... 28
Jenis Cacing Parasitik yang ditemukan pada Saluran Pencernaan ... 29
Anisakis sp. ... 29
Bakteri pada Ikan Nila BEST (Oreochromis niloticus) ... 31
Jenis Bakteri yang ditemukan pada Insang dan Saluran Pencernaan ... 32 Pseudomonas flourescens ... 32 Edwarsiella tarda ... 33 Aeromonas sp. ... 34 Streptococcus sp. ... 36 Bacillus sp. ... 37 Staphylococcus epidermidis ... 38 Escherichia coli ... 40 PENUTUP Simpulan ... 42 Saran ... 42 DAFTAR PUSTAKA ... 43
DAFTAR TABEL
Halaman
Halaman
1 Ikan Nila Bogor Enhanced Strain Tilapia (Oreochromis niloticus) ... 3
2 Dactylogyrus sp ... 7
3 Gyrodactylus sp. ... 8
4 Siklus hidup langsung cacing nematoda ... 10
5 Siklus hidup tidak langsung nematoda ... 10
6 Morfologi umum digenea ... 12
7 Pewarnaan Gram Aeromonas sp. ... 14
8 Pewarnaan Gram Pseudomonas sp. ... 14
9 Diagram alir pengujian bakteri ... 24
10 Dactylogyrus sp. ... 27
11 Pseudodactylogyrus sp. ... 29
12 Morfologi Anisakis sp. ... 30
13 Anisakis sp. ... 30
14 Uji biokimia bakteri Pseudomonas flourescens ... 32
15 Uji biokimia bakteri Edwarsiella tarda ... 34
16 Uji TSIA, Urea, dan Sitrat bakteri Aeromonas sp . ... 35
17 Uji fermentasi bakteri Aeromonas sp. ... 35
18 Pewarnaan Gram Streptococcus sp. ... 37
19 Pewarnaan Gram Bacillus sp. ... 38
20 Pewarnaan Gram Staphylococcusepidermidis ... 39
21 Pembentukan zona merah pada agar MSA ... 39
22 Uji indol, sitrat, urea, dan TSIA Eschericia Coli ... 41
PENDAHULUAN
Latar belakang
Peranan ikan sebagai sumber pangan yang semakin besar menuntut peningkatan produksi perikanan. Kementerian Kelautan dan Perikanan (2010), mencanangkan Indonesia sebagai produsen penghasil produk perikanan dan kelautan terbesar di tahun 2015. Pencapaian target produksi perikanan tersebut terus diupayakan dengan peningkatan produksi nasional terutama pada perikanan budidaya sebesar 353%.
Salah satu varietas yang menjadi komoditas unggulan untuk mencapai target peningkatan produksi perikanan budidaya nasional adalah ikan nila
(Oreochromis niloticus). Banyak strain ikan nila telah dikembangkan di
Indonesia. Salah satu strain ikan nila yang berpotensi untuk dikembangkan adalah Ikan nila Bogor Enhanched Strain Tilapia (BEST). Ikan nila BEST dikembangkan dari generasi ke-6 ikan nila GIFT hasil evaluasi Balai Riset Perikanan Budidaya Air Tawar (BRPBAT) dalam kurun waktu 2004-2008. Hasil pengujian menunjukkan bahwa ikan nila BEST lebih unggul dan hasilnya lebih baik dibandingkan dengan ikan nila jenis lainnya. Ikan nila BEST memiliki tingkat produksi, pertumbuhan, dan daya tahan terhadap lingkungan dan penyakit yang lebih baik (Gustiano et al. 2008).
Penurunan kualitas ikan, baik ikan segar maupun ikan olahan dipengaruhi oleh banyak faktor. Salah satu faktor penyebab utama penurunan kualitas ikan adalah stres akibat kualitas perairan yang buruk. Ikan stres merupakan kondisi yang dapat meningkatkan perkembangbiakan cacing parasitik dan bakteri yang cenderung menyerang organ insang dan saluran pencernaan ikan (William dan John 1993). Keberadaan cacing parasitik menyebabkan kerugian secara ekonomi terutama pada penurunan kualitas hasil perikanan dan dapat merugikan kesehatan manusia. Parasit dapat menyebabkan penyakit dengan cara melukai inang, mengambil nutrisi di dalam tubuh inang, meracuni inang, dan memfasilitasi masuknya mikroorganisme patogen ke dalam tubuh inang (Latama 2002). Populasi bakteri pada ikan yang banyak akan menimbulkan penyakit bahkan kematian.
Tujuan Penelitian
Tujuan dari penelitian ini adalah untuk mengidentifikasi jenis cacing parasitik dan bakteri pada sistem pencernaan dan insang ikan nila BEST.
Manfaat Penelitian
Penelitian ini bermanfaat untuk memberikan informasi dan data tentang cacing parasitik dan bakteri yang ditemukan pada insang serta saluran pencernaan ikan nila BEST (Oreochromis niloticus), sehingga dapat melakukan pencegahan infeksi yang disebabkan oleh cacing parasitik ataupun bakteri pada ikan. Penelitian ini juga dapat digunakan sebagai dasar untuk melakukan penelitian di tingkat selanjutnya untuk mengetahui hubungan antara keberadaan cacing parasitik dan bakteri.
TINJAUAN PUSTAKA
Ikan Nila BEST (Oreochromis niloticus)
Ikan nila merupakan jenis ikan konsumsi air tawar yang berasal dari Sungai Nil dan danau-danau sekitarnya. Nila adalah nama khas Indonesia yang diberikan oleh Pemerintah melalui Direktur Jenderal Perikanan. Ikan nila BEST (Gambar 1) merupakan varietas baru ikan nila (Oreochromis niloticus) yang dikembangkan dari generasi ke-6 ikan nila GIFT hasil evaluasi BRPBAT dalam kurun waktu 2004-2008. Ikan nila BEST baru dirilis oleh BRPBAT Bogor pada tahun 2009 (Gustiano et al. 2008). Klasifikasi ikan nila BEST menurut Trewavas (1982), termasuk ke dalam filum Chordata, kelas Osteichtyes, ordo Perchomorphi, famili Chiclidae, genus Oreochromis, spesies Oreochromis niloticus.
Keterangan a. Mata, b. Spiny dorsal fin, c. Soft dorsal fin, d. Caudal fin,
e. Anal fin, f. Pelvic fin, g. Pectoral fin, h. Operkulum
Gambar 1 Ikan Nila BEST (Arifin 2009).
Morfologi
Morfologi ikan nila BEST hampir menyerupai ikan nila hitam pada umumnya. Ikan nila BEST berwarna hitam kehijauan dan semakin ke arah perut semakin terang. Ikan nila BEST memiliki garis vertikal 9-11 buah berwarna hijau kebiruan. Sirip bagian kaudal (ekor) terdapat 16-18 garis melintang ujungnya
a
b
C
d
e
f
g
h
berwarna kemerah-merahan yang dapat digunakan sebagai indikasi kematangan gonad.
Keunggulan ikan nila BEST dibandingkan dengan ikan nila varietas lainnya adalah mampu menghasilkan telur dan benih yang lebih banyak. Produksi 1.500 sampai 2.800 butir telur per ekor dengan berat induk antara 280-400 gram. Ukuran telurnya relatif lebih besar dan seragam dibandingkan dengan ikan nila yang ada di masyarakat. Ikan nila BEST juga mampu memproduksi anakan 3-5 kali lebih banyak dibandingkan varietas lainnya. Selama 40 hari, larva ikan nila BEST mampu tumbuh sebesar 87,5 kali dari bobot awal. Nila lain hanya mampu tumbuh sebesar 17 kali dibandingkan bobot awal (Widiastuti et al. 2008).
Menurut Aththar (2010), ikan nila BEST memiliki tingkat kelangsungan hidup dua kali lipat lebih tinggi dibandingkan dengan ikan nila hitam yang berasal dari Kuningan dan ikan nila lokal merah yang berasal dari Bogor pada salinitas 15 ppt. Kelangsungan hidup ikan nila BEST sebesar 57.5% dan ikan nila lain hanya sebesar 37.5 %. Kelangsungan hidup ikan nila BEST lebih besar 140% dibandingkan ikan nila jenis lain pada uji tentang ketahanan penyakit
Streptococcus sp. (Taufik et al. 2008).
Anatomi
Organ-organ internal ikan nila BEST adalah jantung, sistem pencernaan, alat reproduksi, kandung kemih, dan ginjal. Alat pencernaanya terdiri atas mulut, rongga mulut, faring, esofagus, lambung, pilorus, usus, rektum, pankreas, dan hati. Organ-organ yang berada dalam tubuh ikan tersebut biasanya diselubungi oleh jaringan pengikat yang halus dan lunak yang disebut peritoneum. Peritoneum merupakan selaput (membran) yang tipis berwarna hitam.
Jenis kelamin ikan nila BEST yang masih kecil belum tampak dengan jelas. Perbedaannya dapat diamati dengan jelas setelah bobot badannya mencapai 50 gram. Tanda-tanda ikan nila jantan adalah warna badan lebih gelap dari ikan betina, alat kelamin berupa tonjolan (papila) di belakang lubang anus, dan tulang rahang melebar ke belakang. Tanda-tanda ikan nila betina adalah alat kelamin berupa tonjolan di belakang anus yang terdiri dari 2 lubang. Lubang yang di depan untuk mengeluarkan telur dan lubang belakang untuk mengeluarkan air seni. Perut
5
nila betina akan tampak membesar saat mengandung telur yang masak (Suyanto 2004).
Habitat
Habitat ikan nila BEST menurut Rukmana (1997), adalah di perairan tawar seperti sungai, danau, waduk, rawa, dan dapat beradaptasi di perairan air payau dengan menggunakan teknik adaptasi bertahap.Ikan nila lebih cepat tumbuh besar saat dipelihara di kolam air dangkal daripada di kolam air yang dalam. Kolam yang airnya dangkal akan mempengaruhi kecepatan pertumbuhan tanaman air atau pakan alami bagi ikan nila (Amri dan Khairuman 2003).
Lingkungan tumbuh yang paling ideal bagi ikan nila BEST
(Oreochromis niloticus) adalah perairan air tawar yang memiliki suhu antara
14-38 °C dengan suhu optimal 25-32 °C. Keadaan suhu yang rendah yaitu suhu kurang dari 14 °C atau suhu yang terlalu tinggi di atas 30 °C akan menghambat pertumbuhannya. Ikan nila BEST memiliki toleransi tinggi terhadap perubahan lingkungan hidup. PH optimal untuk pertumbuhan dan perkembangbiakkan adalah 6.5-8.5 (SNI 7550-2009). Ikan nila BEST dapat dibudidayakan untuk perbesaran di perairan payau, tambak dan perairan laut karena ikan nila masih dapat tumbuh dalam keadaan air asin pada salinitas 0-35 ppt (Rukmana 1997).
Cacing Parasitik pada Insang dan Saluran Pencernaan Ikan
Menurut Noble dan Noble (1989), parasit adalah organisme yang hidupnya dapat menyesuaikan diri dengan inang definitif dan merugikan organisme yang ditempelinya. Timbulnya penyakit kecacingan pada ikan sangat dipengaruhi oleh kondisi tubuh ikan itu sendiri. Menurut Daelami (2001), parasit adalah hewan atau tumbuhan yang hidup di dalam tubuh ikan yang mendapat perlindungan dan memperoleh makanan untuk kelangsungan hidupnya.
Jenis parasit yang diketahui dalam dunia kedokteran hewan adalah endoparasit dan ektoparasit. Parasit yang hidup pada bagian permukaan tubuh ikan (kulit, sirip, dan insang) disebut ektoparasit sedangkan parasit yang hidup pada tubuh internal ikan dan otot daging disebut endoparasit (Irawan 2004). Menurut Kabata (1985), parasit yang dapat menginfeksi ikan air tawar adalah dari
golongan Metazoa. Golongan Metazoa tersebut dibagi menjadi beberapa filum yaitu filum Plathyhelminthes, Nemathelminthes dan Acanthocephala. Cacing parasitik ikan pada umumnya cenderung menyerang organ insang dan saluran pencernaan ikan.
Jenis-Jenis Cacing Parasitik yang Terdapat di Insang
Cacing parasitik yang biasa menempel di insang atau di permukaan tubuh ikan adalah cacing monogenea. Monogenea adalah cacing pipih yang tidak bersegmen dengan organ perlekatan berbentuk sucker (batil isap) atau cakram perlekatan. Hampir semua spesies dari subkelas Monogenea berperan sebagai ektoparasit ikan, hanya sebagian kecil yang hidup sebagai endoparasit. Menurut Nabib dan Pasaribu (1989), Monogenea parasit ikan yang terpenting secara ekonomis di perairan tawar antara lain adalah famili Dactylogyridae dan Gyrodactylidae.
Dactylogyrus sp.
Dactylogyrus sp. menginfeksi insang semua jenis ikan air tawar terutama
ukuran benih. Dactylogyrus sp. (Gambar 2) termasuk cacing tingkat rendah (trematoda) yang digolongkan dalam filum Platyhelminthes, ordo Monogenea, dan famili Dactylogyridae. Bagian posterior tubuh cacing terdapat haptor (opisthaptor) sebagai alat penempel. Haptor atau yang sering juga disebut sebagai
posterior sucker tidak memiliki struktur tegumen tetapi memiliki 1-2 pasang kait
besar dan 14 kait marginal yang terdapat pada bagian posterior. Kepala
Dactylogyrus sp. terdiri dari 4 lobus dengan 2 pasang mata yang terletak di daerah
pharynx (Gusrina 2008).
Perpindahan cacing dari ikan ke ikan dapat terjadi melalui kontak langsung. Parasit mempunyai siklus hidup secara langsung atau hidup tanpa inang antara. Cacing dewasa bersifat haemaprodit, yaitu masing-masing memiliki 2 alat reproduksi (jantan dan betina). Dactylogyrus sp. juga bersifat ovipar. Telur dilepaskan ke dalam air kemudian menetas menjadi larva dan berkembang sebelum menemukan inang baru.
7
Penyakit yang disebabkan oleh parasit Dactylogyrus sp. adalah Dactylogylosis atau Gill Flukes dengan gejala klinis insang ikan rusak, luka, perdarahan, sirip ikan menguncup, kadang terjadi kerontokan pada sirip ekor, kulit berlendir, dan berwarna pucat. Irawan (2004) menyebutkan bahwa ikan yang terserang Dactylogyrus sp. biasanya kurus, berenang tersendat-sendat, operkulum tidak dapat menutup dengan sempurna karena insangnya rusak, dan kulit ikan terlihat kusam.
Gambar 2 Dactylogyrus sp. (Abdullah 2009).
Gyrodactylus sp.
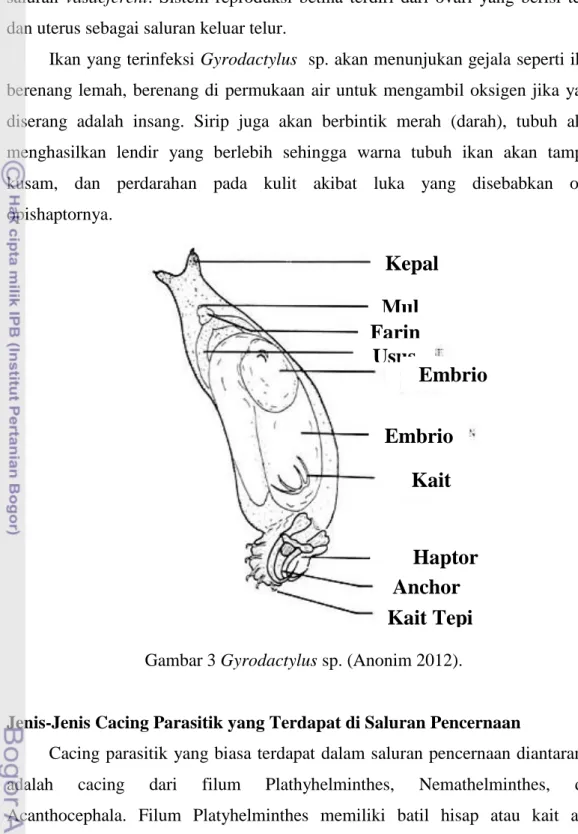
Gyrodactylus sp. merupakan salah satu genus cacing parasit yang
menginfeksi insang ikan air tawar. Menurut David (2010), cacing Gyrodactylus
sp. termasuk anggota dari filum Platlyhelmintes, kelas Trematoda, ordo Monogenea, dan famili Gyrodactylidae. Cacing yang memiliki panjang tubuh 0.5-0.8 mm memiliki bentuk tubuh bilateral simetris, dorsal ventral pipih dan memiliki ophishaptor (Gambar 3). Gyrodactylus sp. dewasa memiliki ophisthaptor yang tidak mengandung batil isap tetapi memiliki sederet kait-kait kecil berjumlah 16 buah di sepanjang tepinya dan kait besar di tengah-tengah (Gusrina 2008).
Siklus hidup Gyrodactylus sp. bersifat langsung dan tidak memerlukan inang antara (Lasee 2004). Telur dikeluarkan oleh cacing dewasa kemudian menetas menjadi larva yang berambut dengan kulit yang halus. Larva tersebut setelah menetas bergerak bebas untuk memperoleh inang baru. Larva berubah menjadi cacing dewasa di tubung inang baru. Gyrodactylus sp. bersifat haemaprodit dan vivipar yang menghasilkan larva lengkap dengan sistem reproduksi. Sistem reproduksi Monogenea jantan terdiri dari testis dan
saluran vasdeferent. Sistem reproduksi betina terdiri dari ovari yang berisi telur dan uterus sebagai saluran keluar telur.
Ikan yang terinfeksi Gyrodactylus sp. akan menunjukan gejala seperti ikan berenang lemah, berenang di permukaan air untuk mengambil oksigen jika yang diserang adalah insang. Sirip juga akan berbintik merah (darah), tubuh akan menghasilkan lendir yang berlebih sehingga warna tubuh ikan akan tampak kusam, dan perdarahan pada kulit akibat luka yang disebabkan oleh opishaptornya.
Gambar 3 Gyrodactylus sp. (Anonim 2012).
Jenis-Jenis Cacing Parasitik yang Terdapat di Saluran Pencernaan
Cacing parasitik yang biasa terdapat dalam saluran pencernaan diantaranya adalah cacing dari filum Plathyhelminthes, Nemathelminthes, dan Acanthocephala. Filum Platyhelminthes memiliki batil hisap atau kait atau keduanya untuk menempel pada inang. Cacing yang termasuk dalam filum Platyhelminthes pada saluran pencernaan ikan adalah kelas Trematoda dan kelas Cestoda.
Karakteristik filum Nemathelminthes adalah simetris bilateral, tidak memiliki segmen yang sesungguhnya. Cacing gilig atau yang disebut juga
Kepal
a
Mul
ut
Farin
g
Usus
Embrio
II
Embrio
I
Kait
Embrio
Haptor
Posterior
Anchor
Kait Tepi
9
nematoda merupakan cacing dari filum Nemathelminthes yang biasa ditemukan pada saluran pencernaan ikan (Storer 1968). Cacing Acanthocepala memiliki banyak kait-kait mirip duri pada probosis yang berbentuk bulat dan silindris. Probosis dilengkapi juga dengan barisan kait atau spina yang membengkok dan berguna untuk melekatkan tubuh cacing pada inangnya.
Nematoda
Nematoda dikenal juga dengan sebutan round worm atau cacing gilig. Nematoda dewasa biasanya ditemukan dalam saluran pencernaan ikan. Semua stadium cacing nematoda dapat ditemukan hampir di seluruh bagian dari tubuh ikan termasuk pada organ dalam seperti gelembung renang, kulit, otot, dan insang (Yanong 2002).
Menurut Buchmann dan Bresciani (2001), nematoda berbentuk panjang, ramping, silindris, tidak bersegmen dengan kedua ujung meruncing, mempunyai mulut serta anus (saluran pencernaan yang lengkap). Mulutnya dikelilingi oleh bibir primitif yang berjumlah 6 (2 subdorsal, 2 lateral, dan 2 subventral). Nematoda juga memiliki rongga tubuh semu yang disebut pseudoselom. Identifikasi nematoda dilakukan berdasarkan bentuk kepala, ekor, susunan daerah peralihan antara esofagus, usus, dan posisi lubang ekskresi.
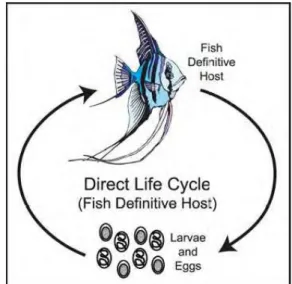
Yanong (2002) membagi siklus hidup nematoda pada ikan menjadi dua kategori utama, yaitu siklus hidup langsung (Gambar 4) dan tidak langsung (Gambar 5). Ikan bertindak sebagai inang definitif bagi nematoda pada siklus hidup langsung. Nematoda tidak memerlukan inang antara, sehingga infeksi dapat langsung disebarkan secara langsung dari satu ikan ke ikan lain melalui telur atau larva infektif yang termakan.
Gambar 4 Siklus hidup langsung cacing nematoda (Yanong 2002).
Ikan dapat menjadi inang definitif dan inang antara pada siklus hidup tidak langsung. Cacing nematoda akan mengalami tahap perkembangan di dalam invertebrata air sebagai inang antara pada saat ikan menjadi inang definitifnya. Selanjutnya, nematoda akan mencapai kematangan kelamin dan bereproduksi dalam ikan sebagai inang definitifnya. Nematoda menggunakan ikan sebagai inang antara saat ikan menjadi perantara sebelum nematoda memasuki inang definitifnya yaitu organisme lain pemakan ikan seperti ikan yang lebih besar, burung, dan mamalia air lainnya (Yanong 2002).
11
Cestoda
Cestoda atau cacing pita pada ikan ditemukan sebagai larva maupun cacing dewasa. Larva cacing pita hidup bebas dan ditemukan dalam rongga perut atau alat tubuh internal seperti hati dan otot. Cacing pita dewasa selalu ditemukan dalam usus ikan. Menurut Natadisastra dan Agoes (2005), cestoda memiliki bentuk tubuh panjang, pipih seperti pita yang terdiri atas 3 daerah kepala yang terdapat scolex sebagi alat pelekat pada inang definitif. Scolex tersebut dilengkapi dengan kait-kait, organ penghisap, atau keduanya. Stuktur scolex terdiri atas proglotida dengan tingkat kematangan yang berbeda pada tiap segmen. Proglotida yang semakin jauh dari leher semakin matang atau dewasa (Levine 1990).
Cestoda tidak memiliki saluran pencernaan dan sistem peredaran darah sehingga pengambilan makanan langsung melalui tegumen ke sistem ekseresi. Cestoda merupakan cacing haemafrodit yaitu memiliki kelamin jantan juga kelamin betina. Setiap proglotid mengandung organ kelamin jantan (testis) dan organ kelamin betina (ovarium). Tiap proglotid dapat terjadi fertilisasi sendiri. Proglotid yang dibuahi terdapat di bagian posterior tubuh cacing.
Cestoda membutuhkan inang antara dalam proses siklus hidupnya. Ikan dapat menjadi inang perantara kedua atau dapat pula menjadi inang definitif. Larva cestoda akan menembus dari saluran pencernaan untuk perkembangan lebih lanjut dan menunggu ikan definitif memakan inang antara cacing tersebut. Cacing dewasa akan hidup dalam saluran pencernaan ikan sebagai inang definitif dan tidak terlalu menimbulkan banyak kerugian. Menurut Afrianto dan Liviawaty (1992), kehadiran cacing dewasa pada saluran cerna dapat menyebabkan penurunan berat badan dan perut menjadi kurus.
Digenea
Digenea ditemukan pada ikan dalam bentuk larva ataupun dewasa. Stadium larva digenea berbentuk kista sebagai metaserkaria dalam jaringan bawah kulit atau di dalam alat tubuh internal (saluran gastrointestinal) dan jarang pada insang atau darah (Nabib dan Pasaribu 1989). Digenea (Gambar 6) memiliki bentuk klasik seperti daun oval yang tebal. Menurut Noble dan Noble (1989), digenea merupakan cacing parasit yang memiliki batil hisap berbentuk mangkuk dan
lubang ekskretoris posterior. Batil hisap digenea ada dua yaitu batil hisap anterior atau batil hisap mulut dan asetabulum yang terletak di tengah tubuh cacing.
Gambar 6 Morfologi umum digenea (Anonim 2008).
Siklus hidupnya di dalam tubuh ikan sebagai inang definitif terjadi secara seksual dengan pembentukan telur. Telur digenea yang menetas menjadi larva bersilia (mirasidium) akan dimakan oleh inang perantara pertama (siput). Mirasidium tersebut akan berubah menjadi sebuah sporosist. Setiap sporosist parasit aseksual menghasilkan banyak larva (redia) yang pada gilirannya menghasilkan larva infektif (serkaria) kemudian akan berenang meninggalkan siput. Serkaria akan menginfeksi inang antara kedua dan menjadi metaserkaria. Metasersaria akan berkembang menjadi cacing dewasa jika menemukan inang definitif (Noga 2000).
Bakteri pada Insang dan Saluran Pencernaan Ikan
Bakteri menurut Dwidjoseputro (1998), adalah mikroorganisme bersel satu, berkembangbiak dengan pembelahan diri, dan berukuran sangat kecil sehingga hanya tampak dengan mikroskop. Kebanyakan bakteri berukuran kecil, biasanya hanya berukuran 0.5-5 µm dengan diameter antara 0.5-2.5 µm (Pelczar dan Chan 1986). Bakteri memiliki sel prokariot yang khas, tanpa inti sel, sitoskeleton, dan organel lain seperti mitokondria dan kloroplas. Bakteri dapat dibagi atas tiga golongan berdasarkan bentuk morfologinya yaitu basil, kokus, dan spiral.
13
Jenis-Jenis Bakeri yang Terdapat di Insang dan Saluran Pencernaan Ikan
Kontaminasi bakteri terhadap ikan konsumsi yang hidup di perairan harus mempertimbangkan ekologiperairan. Bakteri yang biasanya ditemukan pada ikan adalah jenis Pseudomonas spp., Edwarsiella tarda, Vibrio spp., dan Aeromonas
sp. (Noga 2000).
Aeromonas sp.
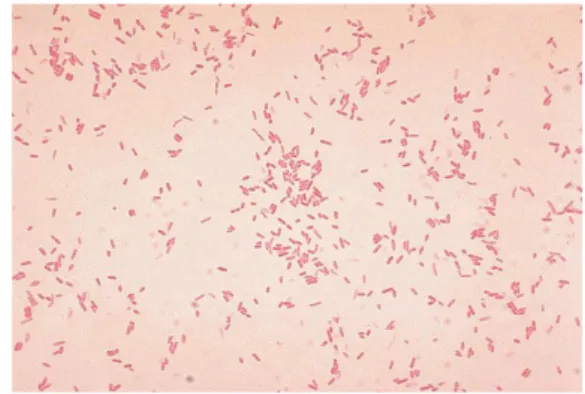
Bakteri Aeromonas sp. merupakan organisme akuatik yang dapat ditemukan di air tawar. Aeromonas termasuk famili Vibrionaceace dalam kelas Gammaproteobakteria dan ordo Aeromonadales. Genus ini terdiri dari 14 spesies yang telah diketahui berhubungan dengan munculnya penyakit. Spesies yang paling penting adalah A. hydrophila, A. caviae, dan A. veronii.
Morfologi koloni Aeromonas sp. permukaannya agak menonjol, berbentuk bulat, mengkilat, krim, dan diameter 2-3 mm. Aeromonas sp. termasuk Gram negatif berbentuk batang dengan ukuran panjang 2-3 µm dan bersifat fakultatif anaerob (Gambar 7). Ciri Aeromonas lainnya adalah tidak berspora, bersifat motil kerena mempunyai flagela, hidup pada suhu 15-30 °C dan pH 5.5-9.0 (Afrianto dan Liviawaty 1992). Karakteristik Aeromonas diantaranya adalah oksidase positif, memproduksi gas dari glukosa, mengasamkan maltosa dan manitol, tidak mengasamkan laktosa, memfermentasikan sukrosa dan ada yang memfermentasikan salicin. Aeromonas tidak menghasilkan indol dan urease. Uji fermentasi dapat dilakukan untuk membedakan setiap spesies.
Menurut Cipriano dan Bullock (2001), motil Aeromonas dapat menyebabkan kondisi patologis yang berbeda-beda. Kondisi patologi yang diakibatkan oleh motil Aeromonas mencakup pemborokan pada lapisan dermal, pembusukan pada sirip, pemborokan mata, dan hemoragi pada kulit (red sore disease).
Gambar 7 Pewarnaan Gram Aeromonas sp. (Chamberlain 2012).
Pseudomonas sp.
Pseudomonas sp. masuk ke dalam famili Pseudomonadaceae dengan filum
Proteobacteria dan ordo Pseudomonadales. Pseudomonas sp. merupakan kelompok bakteri yang memiliki habitat cukup beragam. Bakteri berbentuk batang (Gambar 8) ini dapat ditemukan di tanah, perairan tawar maupun laut, bunga, dan buah (Krueger dan Sheikh 1987). Pseudomonas sp. berukuran 0.5-0.8 µm x 1-3 µm, bersifat Gram negatif, mempunyai flagela tipe polar, aerobik, kemoorganotrof, dan tidak berkapsul. Bakteri Pseudomonas sp. hanya dapat menguraikan glukosa tetapi dapat tumbuh pada semua jenis media, hasil positif pada uji katalase dan oksidase.
Serangan bakteri Pseudomonas sp. membuat tubuh ikan borokan, sisik terkelupas, sirip rusak, perut menggembung, mata rusak, dan insang rusak dengan warna putih kebiruan. Granuloma ditemukan dalam ginjal, hati, dan jantung ikan. Bakteri yang sama telah dilaporkan menyebabkan kematian pada tilapia fry.
Gambar 8 Pewarnaan Gram Pseudomonas sp. (Chamberlain 2012).
15
Edwardsiella tarda
Edwardsiella tarda adalah spesies pertama kali yang berhasil diidentifikasi
dari genus Edwardsiella. Menurut Afrianto dan Liviawaty (1992), E. tarda hidup pada perairan tercemar atau mengandung urin. Morfologi E.tarda adalah gram negatif dengan bentuk basil. E.tarda memiliki banyak sifat yang merupakan ciri khas dari banyak bakteri enterobacteria seperti E.coli, yaitu anaerob fakultatif dan motil dengan peritrichous flagella. Ciri lain yaitu positif pada fermentasi glukosa, negatif pada fermentasi laktosa dan tidak mampu tumbuh pada manitol atau sorbitol, sitokrom oksidase negatif, mereduksi nitrat dan nitrit, indol positif, TSI Agar hasilnya asam pada slant dan basa pada butt (Bergey 1974).
E. tarda biasa ditemukan dalam usus normal ikan dan dapat menjadi
patogen oportunistik pada manusia. Menurut Narwiyani (2011), gejala klinis umumnya sama pada semua ikan berupa anoreksia, berenang lambat, serta lesi kemerahan pada kulit dan pangkal sirip. Salah satu penyakit yang paling umum pada ikan air tawar adalah septicemia hemoragik atau edwardsiellosis yang biasanya menyebabkan kematian ikan.
Vibrio sp.
Vibrio sp. termasuk famili Vibrionaceae dengan genus Vibrio. Vibrio sp.
merupakan bakteri yang dapat menyebabkan penyakit pada ikan air laut, air payau, dan air tawar. Vibrio sp. banyak terdistribusi di air bersih, air terpolusi, air laut kecuali yang salinitasnya tinggi, dan merupakan mikroflora dalam usus, ginjal dan darah ikan. Bakteri ini berbentuk batang berukuran 0.5-2.0 µm dan bersifat gram negatif. Vibrio sp. juga mempunyai kemampuan untuk bergerak karena mempunyai 2-3 flagela polar (Duijn 1973).
Menurut Feliatra (1999), Vibrio merupakan patogen oportunistik yang dalam keadaan normal ada dalam lingkungan pemeliharaan, kemudian berkembang dari sifat yang saprofit menjadi patogenik jika kondisi lingkungannya memungkinkan. Vibrio anguillarum merupakan salah satu vibrio yang menyerang ikan. Infeksi Vibrio anguillarum hampir menyerupai infeksi oleh Aeromonas
waktu 30 menit sejak kontak. Sifat fisik dan biokimia dari bakteri adalah berwarna krem sampai coklat muda, bentuk bulat konveks, tetapi rata dan tanpa pigmen.
Bakteri sering menimbulkan masalah serius pada ikan dan dapat menimbulkan kematian masal dalam waktu yang relatif singkat. Penyakit yang ditimbulkan oleh bakteri Vibrio sp. adalah vibrosis. Gejala klinis penyakit vibriosis bentuk akut pada ikan dewasa ditandai dengan warna kulit kusam disertai hilang nafsu makan, hemoragi dipangkal sirip (kerusakan kulit dengan tepi merah atau putih karena infeksi sekunder jamur).
METODOLOGI PENELITIAN
Waktu dan Tempat Penelitian
Penelitian dilaksanakan pada bulan Juli 2011 sampai Maret 2012 di Laboratorium Helmintologi Bagian Parasitologi dan Entomologi Kesehatan dan Laboratorium Bakteriologi Bagian Mikrobiologi Medis, Departemen Ilmu Penyakit Hewan dan Kesehatan Masyarakat, Fakultas Kedokteran Hewan, IPB.
Alat dan Bahan Penelitian Alat-Alat Penelitian
Alat-alat yang digunakan dalam penelitian ini diantaranya aquarium berukuran 1 x 0.5 x 0.5 m3, timbangan digital, alas bedah berupa gabus yang dilapisi plastik hitam, seperangkat alat bedah (dissecting kit), cawan petri, pinset, kait, pipet tetes, gunting, botol kaca, spidol, label nama, gelas objek dan kaca penutup, kulkas 4 °C, lap, kaca pembesar, mikroskop cahaya, mikroskop stereo, dan video mikrometer, tabung reaksi, ose, needle, inkubator, dan bunsen.
Bahan-Bahan Penelitian
Bahan-bahan yang digunakan dalam penelitian ini diantaranya sampel ikan Nila BEST (Oreochromis niloticus) yang diambil bagian insang dan ususnya, NaCl fisiologis, alkohol bertingkat 70%, 85%, 95%, dan 100%, agar Mac Conkey, agar darah, agar nutrien, agar MSA, kaldu MR-VP (Methyl Red- Voges
Proskauer), larutan H2O2 3%, biakan indol, larutan Ehrlich-Bohme, media TSIA,
agar sitrat, agar urea, media gula-gula (maltosa, manitol, laktosa, sukrosa, dan glukosa), kalium hidroksida 10%, pewarna Semichon’s Acetocarmine, entelan,
xylol, pewarna giemsa10%, alkohol, aquades, kristal violet, lugol, safranin, KOH
10%, minyak cengkeh, dan laktofenol.
Metode Penelitian
Pengambilan Sampel Ikan Nila BEST (Oreochromis niloticus)
Pengambilan sampel ikan nila BEST dilakukan dari peternak daerah Parung. Sebanyak 10 ekor sampel ikan diambil secara acak yang memiliki bobot badan
sekitar 200-250 gram. Sampel ikan dimasukkan ke dalam kantong plastik yang telah ditambah air dan oksigen secukupnya. Sampel selanjutnya dimasukan ke dalam aquarium di laboratorium.
Pemeriksaan Cacing Parasitik
Pengambilan Cacing Parasitik dari Insang dan Saluran Pencernaan
Sampel ikan dimatikan terlebih dahulu dengan cara memotong medulla oblongatanya. Ikan kemudian ditimbang dengan timbangan digital. Ikan dibedah dengan cara dibuat sayatan pada bagian ventral ikan. Sayatan dimulai dari operkulum untuk mengeluarkan insang terlebih dahulu kemudian dilanjutkan ke arah posterior sampai arah kloaka untuk mengeluarkan saluran pencernaan (usus). Insang dan saluran pencernaan ikan dipisahkan dari organ tubuh ikan lainnya. Bagian insang dan saluran pencernaan yang digunakan untuk pemeriksaan cacing diletakkan dalam cawan petri yang berisi NaCl fisiologis 0.9%. Saluran pencernaan ikan disayat terlebih dahulu sebelum dimasukkan ke dalam cawan petri berisi NaCl fisiologis 0.9%. Cawan tersebut disimpan dalam kulkas 4 °C minimal 10 jam agar cacing dapat berelaksasi sehingga cacing tersebut lepas dari organ insang dan saluran pencernaan ikan (Soulsby 1982).
Cacing dari insang dan saluran pencernaan di cawan petri dikoleksi dengan menggunakan mikroskop stereo. Cacing yang ditemukan pada kedua organ tersebut dipindahkan ke dalam NaCl fisiologis pada cawan petri yang berbeda. Spesimen yang didapatkan diawetkan dengan alkohol 70% untuk dianalisis lebih lanjut dengan pewarnaan permanen untuk trematoda dan pewarnaan semi permanen untuk nematoda (Yamaguti 1958).
Metode Pewarnaan Cacing Parasitik Pewarnaan Permanen
Spesimen cacing terlebih dahulu direndam dengan pewarnaan Acetocarmine
selama 30 menit hingga 3 jam sampai spesimen menyerap warna merah cerah. Larutan Acetocarmine terdiri dari 100 ml aquades dicampur dengan 100 ml asam asetat glasial dan ditambahkan bubuk lithium carmine hingga menjadi jenuh.
19
Larutan tersebut dipanaskan pada suhu 90 °C selama 15 menit dan ditambahkan etanol 70% sebanyak 200 ml.
Spesimen cacing selanjutnya dibilas dengan etanol 70% dan direndam dengan larutan asam alkohol yang merupakan 99 bagian etanol 70% dan 1 bagian HCl selama 5-7 menit hingga menjadi warna merah. Spesimen cacing direndam dengan alkohol bertingkat yaitu etanol 70%, 85%, 95% dan alkohol absolut selama masing-masing 5 menit. Perendaman dengan alkohol bertingkat dilakukan bertujuan untuk dehidrasi. Spesimen cacing dibersihkan dari sisa larutan etanol dengan laktofenol. Selanjutnya, cacing direndam dengan xylol
untuk membuat spesimen cacing transparan sehingga memperjelas organ cacing dan direkatkan dengan entelan sebagai media fiksasinya (Yamaguti 1958).
Pewarnaan semi permanen
Pewarnaan struktur morfologi cacing nematoda menggunakan KOH 10% dan minyak cengkeh. Spesimen cacing direndam dalam KOH 10% selama 1-3 menit terlebih dahulu. Perendaman dengan KOH 10% bertujuan untuk menipiskan lapisan kutikula dan epikutikula (tegumen) agar cacing nematoda dapat terlihat transparan. Sampel kemudian dimasukkan ke dalam wadah yang berisi minyak cengkeh selama 30 detik sampai 1 menit. Selanjutnya, sampel cacing yang sudah diwarnai dimasukkan ke dalam alkohol bertingkat, yakni ke dalam alkohol 70%, 85%, 95%, dan alkohol absolut masing-masing selama 15-30 detik. Cacing kemudian difiksasi dengan entelan (Soulsby 1982).
Identifikasi Cacing Parasitik
Identifikasi cacing parasitik dilakukan setelah pewarnaan selesai. Spesimen cacing diamati dengan menggunakan mikroskop stereo dan video mikrometer serta dilakukan identifikasi cacing parasitik terhadap famili hingga genus.
Pemeriksaan Bakteri Persiapan Bahan
Contoh berupa insang dan digesti dari saluran pencernaan yang berasal dari ikan diambil dan diberi perlakuan. Insang yang berasal dari ikan tersebut diletakan
dalam cawan petri steril, dipotong kecil-kecil dan digerus dalam mortar untuk membebaskan bakteri dari tenunan insang ikan. Saluran pencernaan ikan dibagi menjadi 2 bagian, isi dari saluran pencernaan dimasukkan ke dalam mortar dan digerus. Aquades steril dapat ditambahkan pada gerusan. Suspensi hasil gerusan ditanam di atas media agar darah dan agar Mac-conkey untuk menumbuhkan koloni dengan teknik goresan T. Media yang telah digores kemudian diinkubasi selama 24-48 jam pada suhu 37 ºC. Pengerjaannya dilakukan secara aseptis.
Isolasi Bakteri
Koloni terpisah yang tumbuh pada agar darah dan agar Mac-Conkey
dikarakterisasi berdasarkan morfologis, yaitu ukuran, warna, bentuk, tepi permukaan, dan transparansi. Koloni bakteri yang berbeda diambil dan dibiakkan pada agar nutrient sebagai isolat murni pada suhu 37 °C selama 24-48 jam dan dilakukan pewarnaan Gram untuk mengetahui sifat Gram dan morfologi bakteri. Menurut Lay (1994), teknik pewarnaan Gram yaitu spesimen ditetesi kristal violet selama 1 menit dibilas dengan aquades. Setelah itu, spesimen diberi larutan lugol selama 1 menit dan ditetesi dengan larutan pemucat (alkohol) selama 10-20 detik. Tahap terakhir ialah spesimen ditetesi safranin selama 1 menit dibilas dengan aquades serta dikeringkan.
Identifikasi Bakteri
Pengamatan mikroskopik dengan pewarnaan Gram dilakukan kembali untuk memperjelas bentuk dan sifat Gram dari suatu bakteri. Bakteri yang bersifat Gram positif dengan bentuk batang terbagi menjadi dua, yaitu batang besar memiliki spora dan tidak berspora. Batang berspora secara umum terdiri dari genus
Bacillus sp. (aerob) dan Clostridium (anaerob). Bakteri yang berbentuk batang
yang tidak memiliki spora secara umum dibedakan dengan bakteri yang tahan asam yaitu Mycobacterium dan tidak tahan asam yaitu Corynobacterium dan
Listeria.
Koloni dengan hasil Gram positif yang berbentuk coccus, selanjutnya diuji dengan uji katalase. Katalase adalah enzim yang mengkatalisiskan H2O2 menjadi
21
pada koloni terpisah. Uji ini dilakukan untuk membedakan antara bakteri kelompok Micrococcaceae dan Streptococcaceae (Lay 1994). Kelompok Streptococcaceae bersifat katalase negatif, sedangkan kelompok Microcaccaceae bersifat katalase positif. Bakteri yang bersifat katalase positif akan terlihat pembentukan gelembung udara di sekitar koloni. Reaksi kimiawi yang dikatalisasikan oleh enzim katalase terlihat berikut:
H2O2 Katalase H2O + ½ O2
Bakteri dengan sifat katalase positif selanjutnya dilakukan uji glukosa mikroaerofilik. Hasil negatif uji glukosa mikroarofilik menunjukkan bakteri
Micrococcus, sedangkan hasil positif menunjukkan bakteri Staphylococcus.
Bakteri dengan hasil positif kemudian dilakukan uji pada agar Manitol Salt Agar
(MSA) yang mengandung kadar NaCl tinggi, sehingga akan menghambat pertumbuhan bakteri selain Staphylococcus. Media ini terutama digunakan untuk membedakan kelompok Staphylococcus yang berifat patogen dan non-patogen.
S. aureus pada umumnya bersifat patogen dan menghasilkan warna kuning pada
agar. S. epidermidis bersifat tidak patogen dan membentuk zona merah pada agar. Warna kuning disebabkan oleh fermentasi manitol disertai pembentukan asam, sedangkan warna merah disebabkan manitol yang tidak difermentasikan.
Uji Oksidase berfungsi untuk menentukan adanya oksidase sitokrom pada mikroorganisme. Uji ini berguna dalam identifikasi mikroorganisme patogen seperti Neisseria gonoprhoea dan Pseudomonas aeruginosa yang menunjukkan hasil positif terhadap uji oksidase. Reagen uji oksidase terdiri dari 1:1 (vol/vol) laruran 1% alpha-naphtol dan 1% dimetil-p-fenillendiamin oksalat. Tahapan dalam uji oksidase ialah dengan pencampuran koloni terpisah dengan reagen. Hasil oksidase positif ditunjukkan dengan warna koloni yang berubah menjadi hitam setelah 30 menit. Hal ini disebabkan oksidase sitokrom mengoksidasikan larutan reagen (Lay 1994). Hasil uji oksidasi positif dapat dilanjutkan dengan proses identifikasi menggunakan media Triple Sugar Iron Agar (TSIA), indol, MRVP (Methyl Red–Voges proskauer), sitrat, urea, uji fermentasi karbohidrat.
Uji TSIA dilakukan dengan menggunakan Triple Sugar Iron Agar . Media mengandung tiga macam gula yaitu glukosa, laktosa, dan sukrosa, selain itu media juga mengandung indikator merah fenol dan FeSO4 untuk memperlihatkan
pembentukan H2S yang ditunjukkan dengan adanya endapan hitam. Konsentrasi
glukosa adalah 1/10 dari konsentrasi laktosa atau sukrosa agar fermentasi glukosa dapat terlihat. Media TSIA terdiri dari dua bagian yaitu butt (bawah) dan slant
(atas). Tahapan uji TSIA yaitu koloni bakteri diambil dengan menggunakan
needle, kemudian ditusukkan pada bagian tengah butt dan langsung dilanjutkan
dengan penggoresan di bagian slant. Setelah itu media diinkubasi pada suhu 37°C selama 24-48 jam (Lay 1994).
Reaksi yang dapat terlihat pada media TSIA adalah bagian butt bersifat asam dan berwarna kuning sedangkan bagian slant bersifat basa dan berwarna merah akibat dari fermentasi glukosa. Keseluruhan media terjadi pembentukan asam sehingga seluruh media berwarna kuning akibat fermentasi laktosa atau sukrosa atau keduanya. Adanya pembentukan gas pada bagian butt sehingga media terpecah akibat pembentukan gas seperti H2 dan CO2. Seluruh media
berwarna merah karena ketiga jenis glukosa tidak difermentasikan (Lay 1994). Uji indol dilakukan dengan menggunakan media indol yang kaya akan triptofan. Koloni bakteri yang telah diambil dengan menggunakan needle
ditusukkan ke bagian tengah media kemudian diinkubasi pada suhu 37°C selama 24-48 jam. Reaksi uji indol dilakukan dengan penambahan reagen Erlich-Bohme
sebanyak 2-3 tetes dan ditunggu selama 2-3 menit. Hasil uji positif terlihat dengan terbentuknya warna merah pada permukaan media. Media indol berbentuk semi padat sehingga dapat digunakan untuk mengetahui pergerakan bakteri. Bakteri yang bersifat motil terlihat pertumbuhan koloni di sekitar tusukan dan di permukaan media.
Uji Methyl Red digunakan untuk menentukan adanya fermentasi asam
campuran. Fermentasi asam campuran ditentukan dengan cara menumbuhkan mikroorganisme dalam kaldu yang mengandung glukosa dan menambahkan reagens Methyl Red ke dalam kaldu setelah masa inkubasi pada suhu 37 °C selama 24-48 jam. Kaldu biakan akan berubah menjadi merah jika terjadi fermentasi asam campuran, namun kaldu akan tetap berwarna kuning atau jingga jika tidak terjadi fermentasi asam campuran. Uji ini sangat berguna dalam mengidentifikasi kelompok bakteri yang menempati saluran pencernaan.
23
Uji Voges Prokauer digunakan untuk mengidentifikasi mikroorgnisme
yang memfermentasi 2,3-butanadiol yang mengakibatkan penumpukan bahan dalam pertumbuhan. Penambahan 10 tetes 40% KOH dan 15 tetes 5% larutan alphanapthol dalam etanol dapat menentukan adanya asetoin (asetilmetilkarbinol), yaitu suatu senyawa pemuka dalam sintesis 2,3-butanadiol. Keberadaan asetoin ditunjukkan oleh perubahan warna kaldu menjadi merah muda. Hasil reaksi dapat terlihat paling lambat setelah 30 menit. Perubahan warna kaldu biakan akan lebih jelas pada bagian yang berhubungan dengan udara karena sebagian 2,3-butanadiol dioksidasikan kembali menjadi asetoin sehingga memperjelas hasil reaksi.
Uji sitrat dilakukan dengan menggunakan media Simmon’s citrate yang berbentuk padat dan berwarna hijau. Media sitrat merupakan medium sintetik dengan Na sitrat sebagai satu-satunya sumber karbon, NH4+ sebagai sumber N dan
brom thymol blue sebagai indikator pH. Koloni bakteri yang telah diambil dengan
menggunakan ose kemudian digoreskan pada permukaan media dan diinkubasi pada suhu 37 °C selama 24-48 jam. Hasil uji positif diperlihatkan dengan perubahan warna media dari warna hijau menjadi biru. Hal ini menunjukan kemampuan dari bakteri yang diuji dalam menggunakan sitrat dari media sebagai satu-satunya sumber karbon (Lay 1994).
Uji urea dilakukan dengan menggunakan media urea yang berbentuk padat dan berwarna merah-jingga. Koloni bakteri digoreskan pada permukaan media dan diinkubasi pada suhu 37°C selama 24-48 jam. Hasil uji positif terlihat dengan perubahan warna media dari merah-jingga menjadi merah-ungu karena terjadinya proses hidrolisis urea (Lay 1994).
Uji fermentasi karbohidrat dilakukan dengan menggunakan media kaldu karbohidrat yaitu glukosa, sukrosa, laktosa, maltosa, dan manitol yang mengandung indikator merah fenol dan di dalam tabung terdapat tabung durham sebagi indikator pembentukan gas. Koloni bakteri yang telah diambil dengan menggunakan ose diinokulasi ke dalam media kemudian diinkubasi pada suhu 37 °C selama 24-48 jam. Hasil positif uji fermentasi karbohidrat diperlihatkan dengan perubahan warna media dari merah menjadi kuning. Pembentukan gas dapat terlihat dengan adanya gelembung gas pada tabung durham.
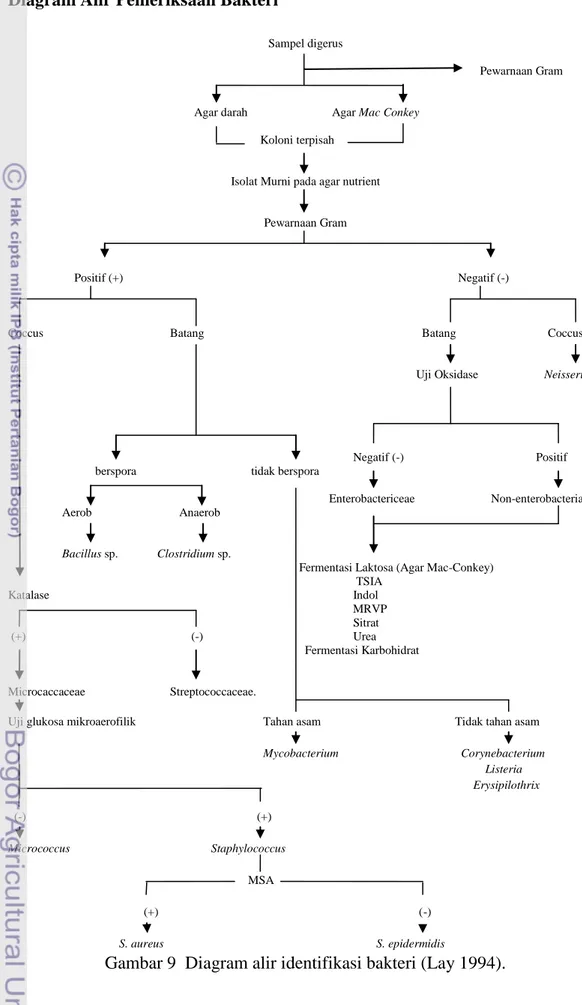
Diagram Alir Pemeriksaan Bakteri
Sampel digerus
Pewarnaan Gram
Agar darah Agar Mac Conkey
Koloni terpisah
Isolat Murni pada agar nutrient
Pewarnaan Gram
Positif (+) Negatif (-)
Coccus Batang Batang Coccus
Uji Oksidase Neisseria
Negatif (-) Positif berspora tidak berspora
Enterobactericeae Non-enterobacteria Aerob Anaerob
Bacillus sp. Clostridium sp.
Fermentasi Laktosa (Agar Mac-Conkey) TSIA Katalase Indol MRVP Sitrat (+) (-) Urea Fermentasi Karbohidrat Microcaccaceae Streptococcaceae.
Uji glukosa mikroaerofilik Tahan asam Tidak tahan asam Mycobacterium Corynebacterium Listeria Erysipilothrix (-) (+) Micrococcus Staphylococcus MSA (+) (-) S. aureus S. epidermidis
HASIL DAN PEMBAHASAN
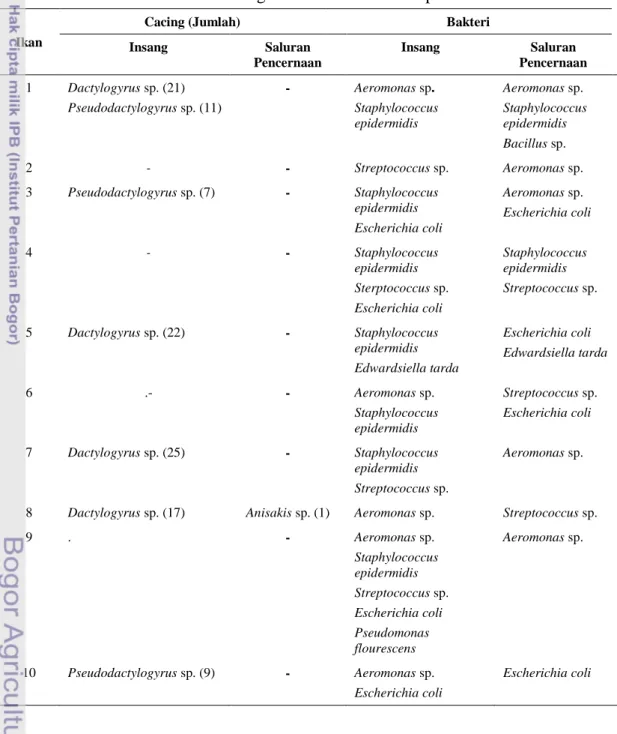
Identifikasi cacing parasitic yang ditemukan pada insang dan saluran pencernaan ikan nila BEST mengacu pada Woo (2006), Noga (2000) dan Hoffman (1967), sedangkan identifikasi bakteri mengacu pada Jang et al. (1976), Cowan (1974), dan Lay (1994). Hasil identifikasi cacing parasitik dan bakteri pada ikan nila dapat dilihat pada Tabel 1.
Tabel 1 Hasil Identifikasi Cacing Parasitik dan Bakteri pada Ikan Nila BEST
Ikan
Cacing (Jumlah) Bakteri
Insang Saluran Pencernaan Insang Saluran Pencernaan 1 Dactylogyrus sp. (21) Pseudodactylogyrus sp. (11) - Aeromonas sp. Staphylococcus epidermidis Aeromonas sp. Staphylococcus epidermidis Bacillus sp. 2 - - Streptococcus sp. Aeromonas sp. 3 Pseudodactylogyrus sp. (7) - Staphylococcus epidermidis Escherichia coli Aeromonas sp. Escherichia coli 4 - - Staphylococcus epidermidis Sterptococcus sp. Escherichia coli Staphylococcus epidermidis Streptococcus sp. 5 Dactylogyrus sp. (22) - Staphylococcus epidermidis Edwardsiella tarda Escherichia coli Edwardsiella tarda 6 .- - Aeromonas sp. Staphylococcus epidermidis Streptococcus sp. Escherichia coli 7 Dactylogyrus sp. (25) - Staphylococcus epidermidis Streptococcus sp. Aeromonas sp.
8 Dactylogyrus sp. (17) Anisakis sp. (1) Aeromonas sp. Streptococcus sp.
9 . - Aeromonas sp. Staphylococcus epidermidis Streptococcus sp. Escherichia coli Pseudomonas flourescens Aeromonas sp. 10 Pseudodactylogyrus sp. (9) - Aeromonas sp. Escherichia coli Escherichia coli
Cacing Parasitik pada Ikan Nila BEST (Oreochromis niloticus)
Hasil penelitian yang dilakukan pada 10 sampel ikan nila BEST
(Oreochromis niloticus) menunjukkan ikan yang terinfeksi cacing parasitik pada
insang sebanyak 6 ekor, sedangkan ikan yang terinfeksi cacing parasitik pada saluran pencernaan hanya 1 ekor. Jumlah cacing parasitik yang ditemukan pada insang berjumlah lebih banyak dibandingkan dengan jumlah pada saluran pencernaan. Hal tersebut dapat terjadi karena saluran pencernaan memiliki kondisi berbeda dengan kondisi insang. Parasit yang mampu hidup pada saluran pencernaan memiliki kemampuan untuk resisten terhadap mekanisme pencernaan baik fisik maupun proses kimiawi, tahan melawan respon imunitas dari inang, dan mampu bertahan di dalam usus yang memperoleh suplai oksigen sedikit (Bryant dan Carolyn 1989).
Keberadaan dan jumlah cacing parasitik dipengaruhi oleh beberapa faktor, yaitu faktor intrinsik dan faktor ekstrinsik. Faktor instrinsik berasal dari kondisi tubuh ikan seperti kekebalan tubuh ikan, umur ikan, dan jenis kelamin. Faktor ekstrinsik adalah faktor yang berasal dari lingkungan ikan misalnya manajemen pemeliharaan ikan kurang baik, yaitu kepadatan ikan dalam kolam tinggi dan fluktuasi kualitas air pada saat penelitian dilakukan.
Menurut Noga (2000), tingkat stres ikan dapat mengganggu mekanisme hemeostatik. Faktor musim dan suhu pada saat dilakukan penelitian juga sangat berpengaruh terhadap pola persebaran parasit pada tubuh ikan. Suhu mempengaruhi kecepatan metabolisme dan respirasi organisme air. Kecepatan metabolisme akan meningkat jika suhu meningkat dan suhu yang terlalu rendah menyebabkan daya tahan tubuh ikan berkurang sehingga ikan akan mudah terinfeksi.
Jenis Cacing Parasitik yang Ditemukan pada Insang Ikan Nila BEST (Oreochromis niloticus)
Dactylogyrus sp.
Dactylogyrus sp. adalah genus terbesar dari parasit monogenea. Famili
Dactylogyridae tidak kurang dari 7 genus dan lebih dari 150 spesies yang banyak terdapat di air tawar. Cacing Dactylogyrus sp. yang ditemukan pada insang ikan
27
nila BEST (Oreochromis niloticus) memiliki panjang berturut turut (Gambar 10) adalah 0.432 mm dan 0.4342 mm, masih termasuk ke dalam kisaran normal panjang tubuh cacing Dactylogyrus sp. yaitu 0.3-2 mm (Noga 2000). Cacing yang memiliki bentuk pipih seperti daun ini memiliki lekukan-lekukan, kelenjar kepala, dan 4 spot mata pada bagian anterior. Lekukan-lekukan yang disertai oleh kelenjar kepala berfungsi sebagai perekat (Paperna 1996). Cacing Dactylogyrus sp. memiliki juga 16 kait pada bagian posterior tubuhnya yang terdiri dari 14 kait tepi dan sepasang kait utama.
Siklus hidup cacing parasitik ini adalah langsung dan bersifat ovipar. Cacing menghasilkan telur yang akan menetas sekitar 2-3 hari dan berkembang menjadi onkomirasidium (fase infektif) selama kurang dari 24 jam. Larva-larva tersebut harus menemukan inang baru untuk tumbuh menjadi cacing dewasa (Noga 2000).
Keterangan: A. Bagian Kepala, B. Spot mata (4 mata), C. Vitelaria, D. Kait utama (2 buah), E. Kait tepi (14 buah), dan F. Faring.
Gambar 10 Dactylogyrus sp. pada pembesaran 40x (penelitian)
Dactylogyrus sp. sering menyerang ikan di kolam dengan kepadatan tinggi
dan ikan yang kekurangan pakan (Irawan 2004). Penyakit ikan yang disebabkan
A
B
C
D
E
A
B
C
F
cacing Dactylogyrus sp. disebut Dactylogyrosis dengan gejala klinis diantaranya adalah pembengkakan pada insang, penonjolan operkulum, dan perubahan warna pada insang. Dactylogyrus sp. memiliki kemampuan memproduksi cairan kental berupa lendir yang berlebihan untuk penempelan maupun pergerakan cacing. Lendir tersebut dapat menyebabkan rusaknya insang sehingga akan mengganggu pertukaran gas oleh insang. Menurut Siregar (1995), perkembangan cacing
Dactylogyrus sp. dapat dicegah dengan meningkatkan kualitas air, memberikan
pakan yang cukup dan bermutu baik, menggunakan peralatan yang bersih, dan melakukan pengendapan serta penyaringan air yang masuk ke dalam kolam.
Pseudodactylogyrus sp.
Pseudodactylogyrus sp. adalah salah satu cacing parasitik monogenea yang
menyerang insang dan banyak menimbulkan masalah pada ikan budidaya (Hoffman 1977). Genus Pseudodactylogyrus termasuk ordo Dactylogyridea dan famili Pseudodactylogyridae. Cacing parasitik yang ditemukan pada ikan nila BEST memiliki panjang 1.017 mm (Gambar 11), masih termasuk ke dalam kisaran panjang Pseudodactylogyrus sp. yaitu 1-1.5 mm (Noga 2000). Cacing yang memiliki 4 spot mata ini memiliki bentuk dan ciri yang hampir sama dengan genus Dactylogyrus. Psedodactylogyrus sp. memiliki opishaptor yang lengkap dengan 14 kait tepi dan 2 kait utama yang terletak lebih ventral dibandingkan dengan Dactylogyrus sp. (Hoffman 1977).
Cacing monogenea seperti Pseudodactylogyrus sp. memiliki siklus hidup sedernana yang terdiri dari telur, larva, dan cacing dewasa. Menurut Noga (2000), temperatur optimum untuk siklus hidup Psedodactylogyrus sp. antara 25-30 °C.
Psedodactylogyrus sp. juga bersifat ovipar dan dapat menghasilkan telur hingga
24 telur per hari. Telur cacing akan menetas menjadi larva (onkomirasidium) dan berenang bebas mencari inang definitif untuk berkembang menjadi cacing dewasa (Buchmann dan Bresciani 2001).
29
Keterangan: A. 4 Spot mata, B. 2 kait utama, dan C. Kait tepi. Gambar 11 Pseudodactylogyrus sp. pada pembesaran 40x (Penelitian).
Cacing memakan sel-sel epitel mukosa yang dapat menyebabkan hiperplasia dan pendarahan pada insang. Mekanisme perusakan insang juga dapat disebabkan akibat kait yang merusak struktur insang ikan. Ikan yang terinfeksi cacing ini memperlihatkan gejala klinis berupa pembengkakan, hiperplasia pada insang, dan warna insang berubah menjadi pucat. Pengobatan pada ikan yang terinfeksi dapat dilakukan dengan perendaman ikan oleh beberapa jenis obat seperti mebendazole (1 ppm) atau praziquantel (10 ppm). Penggunaan predator telur parasit dan onkomirasidium oleh Tubellaria telah dikembangkan menjadi strategi alternatif untuk mengontrol keberadaan cacing parasitik (Noga 2000).
Jenis Cacing Parasitik yang Ditemukan pada Saluran Pencernaan Ikan Nila BEST (Oreochromis niloticus)
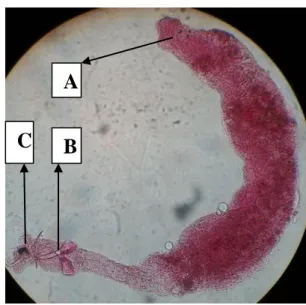
Anisakis sp.
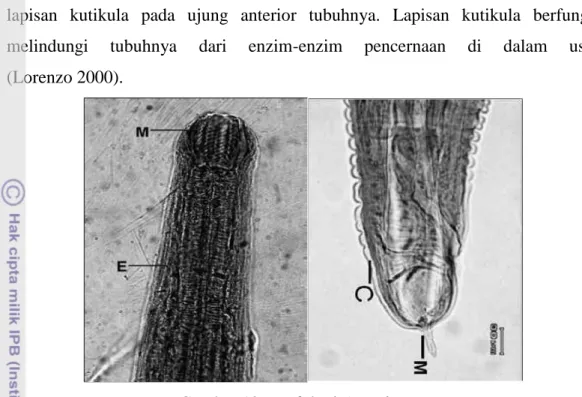
Anisakis sp. adalah genus dari parasit kelas nematoda dengan ordo Ascaridida dan
famili Anisakidae (Anderson 2000). Cacing Anisakis sp. (Gambar 12) dapat menginfeksi berbagai jenis ikan baik ikan laut ataupun ikan air tawar seperti ikan nila BEST (Oreochromis niloticus). Cacing yang ditemukan di saluran pencernaan ikan nila BEST (Oreochromis niloticus) memiliki tubuh bulat panjang berwarna putih transparan dan tampak jelas memiliki bagian kepala yang khas dilapisi oleh
C
A
lapisan kutikula pada ujung anterior tubuhnya. Lapisan kutikula berfungsi melindungi tubuhnya dari enzim-enzim pencernaan di dalam usus (Lorenzo 2000).
Gambar 12 Morfologi Anisakis sp. (Nuchjangreed et al. 2006)
Keterangan: A. Bagian anterior dan B. Bagian posterior Gambar 13 Anisakis sp. pada pembesaran 10x (Penelitian).
Anisakidae memiliki siklus hidup yang kompleks. Cacing dewasa ditemukan di
dalam saluran pencernaan ikan. Produksi telur parasit dewasa dilepaskan keluar melalui feses. Telur parasit yang dikeluarkan tersebut menetas di air. Larva
A
31
stadium kedua yang keluar dari telur akan ditelan oleh inang antara pertama kemudian berkembang menjadi larva stadium ketiga awal. Inang antara pertama dimakan oleh inang antara kedua dan kemudian masuk ke dalam usus. Inang antara kedua selanjutnya dimakan kembali oleh ikan yang lebih besar, mamalia laut, atau manusia dan tumbuh menjadi cacing dewasa (Parker dan Parker 2002).
Infeksi Anisakis sp. dapat menyebabkan penyakit yang disebut anisakiasis. Ikan terinfeksi cacing Anisakis sp. dapat disebabkan akibat memakan ikan yang lebih kecil yang mengandung larva Anisakis sp. Gejala klinis ikan yang terserang parasit ini diantaranya, berenang tidak normal, sisik tampak pucat, frekuensi pernafasan lebih cepat dan memproduksi mukus berlebihan. Pada manusia penyakit anisakiasis menimbulkan gejala yang tidak spesifik bahkan sering tidak terdiagnosa, namun pada saluran pencernaan manusia telah terbentuk ulkus akibat memakan larva hidup cacing Anisakis sp. Tindakan pencegahan kejadian anisakiasis yang paling efektif adalah mencegah penularan dari ikan terinfeksi larva Anisakis yang akan dikonsumsi ke manusia, antara lain tidak memakan ikan yang mentah, pemanasan ikan yang akan dimakan minimal hingga suhu 60 °C, pembekuan hingga suhu -20 °C selama 24 jam, dan penggaraman pada larutan garam pekat selama 10 hari.
Identifikasi Bakteri pada Ikan Nila BEST (Oreochromis niloticus)
Hasil yang didapatkan dari isolasi dan identifikasi bakteri pada sampel ikan nila BEST (Oreochromis niloticus) menunjukkan seluruh ikan nila BEST
(Oreochromis niloticus) terinfeksi bakteri pada insang dan saluran pencernaannya.
Beberapa jenis bakteri yang ditemukan diantaranya ada yang bersifat patogen dan bersifat non patogen pada ikan. Bakteri patogen merupakan bakteri yang dapat menimbulkan penyakit. Bakteri non-patogen merupakan bakteri yang tidak menimbulkan penyakit tetapi dapat hidup pada organisme lain dan tidak menghambat kehidupan inangnya. Menurut Pelczar dan Chan (1986), faktor yang dapat mempengaruhi patogenitas suatu mikroorganisme yaitu kemampuan untuk masuk ke dalam tubuh inang, kekebalan tubuh inang, dan derajat kemampuan untuk menimbulkan penyakit.