STUDI AWAL : HISTOTEKNIK PERFUSI
PBS-FORMALIN DAN GAMBARAN HISTOLOGI ORGAN
HEPAR, PANKREAS DAN GINJAL TIKUS STRAIN
SPRAGUE DAWLEY
Laporan Penelitian ini ditulis sebagai salah satu syarat untuk memperoleh gelar SARJANA KEDOKTERAN
Oleh :
PUTRI JUNITA SARI 1112103000061
PROGRAM STUDI PENDIDIKAN DOKTER FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
UIN SYARIF HIDAYATULLAH JAKARTA
ii
v
KATA PENGANTAR
Assalamualaikum wr.wb.
Alhamdulilahirabbil’alamin, puji serta syukur saya panjatkan kehadirat
Allah SWT, karena atas segala rahmat dan karunia-Nya saya dapat menyelesaikan penelitian ini. Shalawat serta salam semoga tetap tercurah limpahkan pada Nabi besar Muhammad SAW, yang membawa cahaya kebenaran sampai akhir zaman. Penelitian ini tidak dapat terlepas dari bantuan berupa masukan, kritik maupun saran dari berbagai pihak. Untuk itu penulis menyampaikan rasa terima kasih yang sebesar-besarnya kepada:
1. Dr. H. Arif Sumantri, SKM, M.Kes selaku Dekan FKIK UIN Syarif Hidayatullah Jakarta, dr. Achmad Zaki, S.Ked, M.Epid, Sp. OT selaku Ketua Program Studi Program Studi Pendidikan Dokter FKIK UIN Syarif Hidayatullah Jakarta, serta seluruh dosen Program Studi Pendidikan Dokter yang selalu membimbing serta memberikan ilmu kepada saya selama menjalani masa pendidikan di Program Studi Pendidikan Dokter FKIK UIN Syarif Hidayatullah Jakarta.
2. Dr. Devy Ariany, M. Biomed dan Ibu Nurlaely Mida Rachmawati, S.Si, M. Biomed, DMS selaku dosen pembimbing penelitian saya, yang selalu membimbing, mengarahkan, dan menyemangati saya dalam menyelesaikan penelitian ini dengan baik. Juga para dewan penguji
3. Kedua orang tua saya yang tercinta, Bpk. Fahrizal dan Ibu Asma Amir yang selalu memberikan cinta dan kasih sayang, memberikan doa, nasihat, serta semangat dalam hidup saya.
vi
5. Dr. Nouval Shahab, SpU, PhD, FICS, FACS selaku penanggungjawab (PJ) modul riset PSPD 2012. drg. Laifa Annisa Hendarmin, PhD selaku PJ laboratorium Riset. Ibu Nurlaely Mida R, S. Si, M.Biomed, DMS selaku
PJ Animal house. Ibu Endah Wulandari, M. Biomed selaku PJ
laboratorium Biokimia. Ibu Rr. Ayu Fitri Hapsari, M. Biomed selaku PJ laboratorium Histologi yang telah memberikan izin atas penggunaan lab pada penelitian ini.
6. Untuk teman seperjuangan penelitian, Fiizhda Baqarizky, Galang Prahanarendra, Abdul Rasyid, Fakhri Muhammad, Muhammad Azharan Alwi, Imam Kautsar, Faisal Ravif
7. Untuk teman belajar, bermain, dan berorganisasi Binayu, Octa, Firda, Adlin, Ranita, Nadiyah, Putri Auliya, Ega, Reza, Nuraisah, Nafta, Zulfikar, Faruq, Zahro, dan Tanti
8. Seluruh mahasiswa PSPD 2012 yang berjuang bersama meraih mimpi di masa depan.
9. Laboran yang terlibat Mba Din, Ibu Ai, Ibu Lilis, Mba Suryani, Mas Rachmadi. Juga pada Mas Haris dan Mas Panji yang sangat membantu berlangsungnya penelitian ini
Saya sangat mengharapkan kritik dan saran dalam penelitian ini agar dapat terus dilanjutkan dan bermanfaat untuk berbagai pihak Karena Penelitian ini masih jauh dari kesempurnaan, saya sangat mengharapkan kritik dan saran untuk perbaikan dan kelanjutan penelitian ini. Demikian laporan penelitian ini saya tulis, semoga dapat memberikan manfaat bagi penulis khususnya dan para pembaca pada umumnya.
Ciputat, 21 Agustus 2015
vii ABSTRAK
Putri Junita Sari. Program Studi Pendidikan Dokter. Studi Awal : Histoteknik Perfusi PBS-Formalin dan Gambaran Histologi Organ Hepar, Pankreas dan Ginjal Tikus Sprague Dawley. 2015.
Histoteknik adalah metode atau cara untuk membuat sajian histologi dari spesimen tertentu melalui suatu rangkaian proses hingga menjadi sajian yang siap untuk diamati dan dianalisa.1,2,3 Perfusi adalah metode pada histoteknik untuk mendapatkan proses fiksasi ke dalam jaringan dengan waktu yang relatif cepat, sehingga gambaran histologi yang diperoleh mewakili keadaan sesaat sebelum kematian. Metode ini membutuhkan peran pembuluh darah yang akan menyalurkan dan memberikan akses ke setiap jaringan dalam waktu yang cepat.3,4
Phosphate Buffered Saline (PBS) adalah larutan fisiologis yang bersifat isotonik dan tidak beracun terhadap sel serta bertujuan untuk menjaga kadar pH dan mempertahankan osmolaritas sel.5 Formalin yang dilarutkan dalam PBS atau biasa disebut PBS-Formalin merupakan larutan yang direkomendasikan sebagai pilihan agen fiksasi yang terbaik.6 PBS-Formalin paling sering digunakan sebagai agen fiksatif karena sifatnya sebagai agen yang fleksibel. Selain itu, dengan larutan fiksatif PBS-Formalin ini dapat menjadikan organ yang akan diteliti menjadi lebih lama dapat disimpannya dan proses autolisisnya sangat minimal.11
Kata kunci: Perfusi, PBS-Formalin, hepar, ginjal, pankreas.
Putri Junita Sari. Medical Education Study Program. Preliminary Study : Perfusion Histotechnique PBS-Formaline and Histological Overview of Liver, Renal, and Pancreas Sprague Dawley Rats. 2015.
Histotechnique is a method or a way to make a particular histology specimen through a series of processes to be a specimen that is ready to be observed and analyzed.1,2,3 Perfusion is a method of fixation that put the fixatives into the tissue so that the fixation process relatively fast and uniformly preserve tissue in a life like-state. This method through the circulatory system of that the chemical can quickly reach every corner of the organism using the natural vascular network.3,4 Phosphate Buffered Saline (PBS) is a physiological solution that is isotonic and non-toxic to cells and aims to keep the normal pH and maintain cell osmolarity.5 Formalin dissolved in PBS or so-called PBS-Formalin is a solution that is recommended as the best option fixation agent.6 PBS-formalin is most used as a fixative agent because the nature of flexible agent. Other than that, PBS-formaline fixatives can make the organ more sustainable for saved and minimalize the autolysis process.11
ix
2.4 Definisi Operasional ... BAB 3 METODE PENELITIAN
1.1 Desain Penelitian ... 1.2 Waktu dan Tempat Penelitian ...
1.2.1 Waktu Penelitian ... 1.2.2 Tempat Penelitian ... 1.3 Populasi dan Sampel Penelitian ... 1.4 Cara Kerja Penelitian ... 1.4.1 Alat dan Bahan Penelitian ... 1.4.2 Adaptasi Hewan Coba ... 1.4.3 Tahapan Nekropsi (Perfusi)... 1.4.4 Tahapan Pemrosesan Jaringan ... 3.4.4.1. Dehidrasi ... 3.4.4.2. Clearing ... 3.4.4.3. Embedding... 3.4.4.4. Blocking... 1.4.5 Pemotongan Jaringan ... 1.4.6 Tahapan Pewarnaan HE ... 1.4.7 Foto Jaringan ... 1.5 Alur Penelitian ………... BAB 4 HASIL DAN PEMBAHASAN
4.1 Teknik Perfusi ... 4.2 Hepar ... 4.3 Ginjal ... 4.4 Pankreas ... BAB 5 SIMPULAN DAN SARAN
x
DAFTAR GAMBAR
Gambar 2.1 Peralatan perfusi dengan komponen berlabel dan persiapan perfusi I ... Gambar 2.2 Persiapan perfusi II dan peralatan perfusi untuk mengalirkan dapar ... Gambar 2.3 Preparasi hewan coba ... Gambar 2.4 Preparasi perfusi pada hewan coba ... Gambar 2.5 Pengaturan alat dan hewan coba pada proses perfusi dengan dapar ... Gambar 2.6 Pengaturan alat dan hewan coba pada proses perfusi dengan larutan fiksatif ... Gambar 2.7. Gambaran histologis hepar normal ... Gambar 2.8. Gambaran histologis ginjal normal ... Gambar 2.9. Gambaran histologis ginjal tikus normal ... Gambar 4.1.a Alat perfusi ... Gambar 4.1.b Pengaturan sudut pada perfusi ... Gambar 4.1.c Tanda perfusi sudah optimal ... Gambar 4.1.d Perfusi selesai ... Gambar 4.1.a Hepar perfusi PBS-Formalin A 20x ... Gambar 4.2.b Hepar perfusi PBS-Formalin A 40x (insert: hepatosit) ... Gambar 4.3.a Ginjal perfusi PBS-Formalin C 20x ... Gambar 4.3.b Ginjal perfusi PBS-Formalin C 40x (insert: glomerulus) ... Gambar 4.3.c Ginjal perfusi PBS-Formalin C 40x (insert: tubulus) ... Gambar 4.4.a Pankreas perfusi PBS-Formalin A 20x ... Gambar 4.4.b Pankreas perfusi PBS-Formalin A 40x (insert: Langerhans) ... Gambar 4.4.c Pankreas perfusi PBS-Formalin A 40x (insert : asinus) ... Gambar 6.1 Surat Keterangan Tikus Sehat ... Gambar 6.2 Sampel Penelitian ... Gambar 6.3 Anastesi Hewan Coba ... Gambar 6.4 Proses Nekropsi ... Gambar 6.5 Proses Perfusi ... Gambar 6.6 Proses Dehidrasi ... Gambar 6.7 Proses clearing ... Gambar 6.8 Proses Embedding ... Gambar 6.9 Proses Blocking ... Gambar 6.10 Blok PBS-Formalin ... Gambar 6.11 Pemotongan Jaringan ... Gambar 6.12 Set Pewarnaan Hematoksilin Eosin ... Gambar 6.13.a Hepar PBS-F A 20x ... Gambar 6.1.3.b Hepar PBS-F B 20x ... Gambar 6.1.3.c. Hepar PBS-F A 40x ... Gambar 6.13.d. Hepar PBS-F B 40x ... Gambar 6.14.a Ginjal PBS-F A 20x ... Gambar 6.14.b Ginjal PBS-F B20x ... Gambar 6.14.c Ginjal PBS-F C 20x ... Gambar 6.14.d Ginjal PBS-F A 40x (insert: glomerulus) ... Gambar 6.14.e Ginjal PBS-F B 40x (insert: glomerulus) ...
xi
Gambar 6.14.f Ginjal PBS-F C 40x (insert: glomerulus) ... Gambar 6.14.g Ginjal PBS-F A 40x (insert: tubulus) ... Gambar 6.14.h Ginjal PBS-F B 40x (insert: tubulus) ... Gambar 6.14.i Ginjal PBS-F C 40x (insert: tubulus) ... Gambar 6.15.a Pankreas PBS-F A 20x ... Gambar 6.15.b Pankreas PBS-F B 20x ... Gambar 6.15.c Pankreas PBS-F C 20x ... Gambar 6.15.d Pankreas PBS-F D 20x ... Gambar 6.1.5.e Pankreas PBS-F E 20x ... Gambar 6.15.f Pankreas PBS-F F 20x ... Gambar 6.15.g Pankreas PBS-F G 20x ... Gambar 6.15.h Pankreas PBS-F H 20x ... Gambar 6.15.i Pankreas PBS-F A 40x (insert: Langerhans) ... Gambar 6.15.j Pankreas PBS-F B 40x (insert: Langerhans danasinus) ... Gambar 6.15.k Pankreas PBS-F C 40x (insert: Langerhans) ... Gambar 6.15.l Pankreas PBS-F D 40x (insert: Langerhans) ... Gambar 6.15.m Pankreas PBS-F E 40x (insert: Langerhans) ... Gambar 6.15.n Pankreas PBS-F F 40x (insert: Langerhans) ... Gambar 6.15.o Pankreas PBS-F G 40x (insert: Langerhans danasinus) ... Gambar 6.15.p Pankreas PBS-F H 40x (insert: Langerhans) ... Gambar 6.15.q Pankreas PBS-F A 40x (insert: asinus) ... Gambar 6.15.r Pankreas PBS-F C 40x (insert: asinus) ... Gambar 6.15.s Pankreas PBS-F D 40x (insert: asinus) ... Gambar 6.15.t Pankreas PBS-F E 40x (insert: asinus) ... Gambar 6.15.u Pankreas PBS-F F 40x (insert: asinus) ... Gambar 6.15.v Pankreas PBS-F H 40x (insert: asinus) ...
xii
DAFTAR TABEL
xiii
DAFTAR LAMPIRAN
Lampiran 1 Surat Keterangan Tikus Sehat ... Lampiran 2 Gambar Proses Penelitan ... Lampiran 3 Gambar Preparat ... Lampiran 4 Riwayat Penulis ...
BAB 1 PENDAHULUAN 1.1Latar Belakang
Histoteknik adalah metode atau cara untuk membuat sajian histologi dari spesimen tertentu melalui suatu rangkaian proses hingga menjadi sajian yang siap untuk diamati dan dianalisa. Sajian histologi yang baik dapat digunakan untuk riset, guna mempelajari perubahan jaringan dan organ tubuh hewan coba yang mendapat perlakuan tertentu atau mempelajari pertumbuhan dan perkembangan jaringan atau organ tubuh tertentu.1,2,3
Teknik perfusi adalah kombinasi antara teknik euthanasia dan fiksasi. Hewan coba yang telah di euthanasia, akan dialirkan cairan melalui sirkulasi darah. Tindakan ini bertujuan agar proses fiksasi terhadap organ berlangsung lebih cepat. Dasar dari teknik ini yaitu menunda proses autolisis pada jaringan secepat mungkin.3,4 Keuntungan dari teknik perfusi ini yaitu cairan perfusi dapat dengan cepat mencapai setiap sudut jaringan, sehingga jaringan yang dihasilkan kurang lebih sama dengan saat hewan dalam keadaan hidup.4 Cairan perfusi yang digunakan pada penelitian ini adalah Phosphate Buffered Saline (PBS)-Formalin. PBS adalah larutan fisiologis yang bersifat isotonik dan tidak beracun terhadap sel serta bertujuan untuk menjaga kadar pH dan mempertahankan osmolaritas sel.5 Formalin yang dilarutkan dalam PBS atau biasa disebut PBS-Formalin merupakan larutan yang direkomendasikan sebagai pilihan agen fiksasi yang terbaik.6
analisisnya.7 Studi awal adalah penelitian yang bertujuan untuk mengidentifikasi gambaran hasil dan dapat mengevaluasi hasil tersebut sehingga nantinya dapat dijadikan bahan acuan penelitian selanjutnya.8 Laboratorium Animal House di Fakultas Kedokteran UIN Syarif Hidayatullah Jakarta sejak berdirinya tahun 2005 belum mempunyai SOP yang baku mengenai histoteknik khususnya metode perfusi. Maka dari itu, tujuan penelitian ini untuk mendapatkan data dalam penyusunan SOP baku histoteknik yang dapat diterapkan di laboratorium Animal House dan Histologi kampus FKIK UIN Syarif Hidayatullah Jakarta.
1.2Rumusan Masalah
1. Bagaimanakah teknik perfusi pada tikus di laboratorium Animal House
kampus FKIK UIN Syarif Hidayatullah Jakarta?
2. Bagaimana gambaran histologi organ hepar, pankreas dan ginjal tikus yang diperfusi dengan PBS-Formalin?
1.3Tujuan Penelitian 1.3.1 Tujuan Umum
Mendapatkan data untuk menyusun SOP baku histoteknik yang dapat diterapkan di laboratorium Animal House dan Histologi kampus FKIK UIN Syarif Hidayatullah Jakarta
1.3.2 Tujuan Khusus
Mengetahui gambaran histologi organ hepar, ginjal dan pankreas tikus yang diperfusi dengan PBS-Formalin
1.4Manfaat Penelitian 1.4.1 Bagi Peneliti
2. Sebagai salah satu syarat mendapatkan gelar Sarjana Kedokteran di Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri Syarif Hidayatullah Jakarta
1.4.2 Bagi Institusi
1. Untuk menjadi bahan acuan pembuatan SOP histoteknik di Fakultas Kedokteran dan Ilmu Kesehatan UIN Syarif Hidayatullah Jakarta sehingga dapat menjadi rujukan bagi peneliti lain
2. Untuk menjadi bahan acuan untuk penyusunan anggaran pembelian alat perfusi dengan tujuan dapat menunjang penelitian khususnya tentang metode perfusi di laboratorium di Fakultas Kedokteran dan Ilmu Kesehatan UIN Syarif Hidayatullah Jakarta
3. Untuk menambah referensi penelitian di Fakultas Kedokteran dan Ilmu Kesehatan UIN Syarif Hidayatullah Jakarta sehingga dapat digunakan untuk penelitian yang lebih dalam oleh peneliti lain.
4. Untuk meningkatkan kualitas laboratorium Fakultas Kedokteran dan Ilmu
BAB 2
TINJAUAN PUSTAKA 2.1Landasan Teori
2.1.1 Histoteknik
Histoteknik adalah metode atau cara untuk membuat sajian histologi dari spesimen tertentu melalui suatu rangkaian proses hingga menjadi sajian yang siap untuk diamati dan dianalisa. Sajian histologi yang baik dapat digunakan untuk riset, guna mempelajari perubahan jaringan dan organ tubuh hewan coba yang mendapat perlakuan tertentu atau mempelajari pertumbuhan dan perkembangan jaringan atau organ tubuh tertentu.1,2,3
2.1.2 Teknik Nekropsi
Nekropsi adalah teknik yang digunakan untuk mengetahui penyebab kematian pada umumnya. Nekropsi ini selain untuk menentukan penyebab suatu kematian, dapat digunakan juga untuk mengetahui pengaruh suatu penelitian yang dilakukan terhadap organ hewan coba. Prosedur nekropsi cukup rumit dan membutuhkan teknik yang tidak mudah dalam pelaksanannya. Nekropsi dilakukan segera setelah kematian hewan coba agar mencegah terjadinya degenerasi jaringan setelah kematian. Proses autolisis sel terjadi sesaat setelah kematian. Pertama terjadi pada sel epitel saluran cerna, dan sumsum tulang belakang. Kemudian dilanjutkan dengan organ hati, limpa, dan ginjal. Proses ini dipengaruhi juga oleh suhu lingkungan. Semakin tinggi suhunya, semakin mudah suatu organ berdegenerasi.3
2.1.2. Metode Perfusi
Perfusi adalah metode pada histoteknik untuk mengalirkan cairan fiksasi ke dalam jaringan dengan waktu yang relatif cepat, sehingga gambaran histologi yang diperoleh mewakili keadaan sesaat sebelum kematian. Metode ini membutuhkan peran pembuluh darah yang akan menyalurkan dan memberikan akses ke setiap jaringan dalam waktu yang cepat. Sel akan memulai proses autolisis segera setelah proses anoksia (kekurangan oksigen) terjadi. Jadi, semakin cepat larutan fiksatif sampai ke setiap sel, maka proses autolisis pun semakin cepat berhenti.4,9
metode pompa peristaltik yaitu proses mendorong cairannya menggunakan bantuan pompa peristaltik. Dengan menggunakan metode ini hasil yang didapat akan lebih maksimal dan keseragaman hasil akan lebih optimal.4,9
Salah satu kelemahan metode perfusi adalah jaringan yang lunak akan menyusut setelah dilakukan perfusi. Untuk mencegah hal tersebut perlu dijaga perbandingan jumlah cairan di dalam dan di luar sel. Setiap sel memiliki pompa ion pada permukaannya, umumnya berupa pompa natrium. Secara kontinu natrium akan masuk ke dalam sel, dan dipompa keluar agar perbandingan 10:1 antara jumlah di luar dan di dalam sel tetap terjaga. Segala faktor yang dapat mengganggu metabolisme energi sel, contohnya pada perlakuan perfusi ini, dapat menyebabkan rusaknya pompa ion. Akibatnya, sodium, air, dan cairan ekstraselular akan masuk ke dalam sel hingga keseimbangan konsentrasi zat-zat tersebut di luar dan di dalam sel tercapai. Hal tersebut menyebabkan sel membengkak dan menutup ruang ekstra selular. Pada akhir perfusi, permeabilitas membran akan meningkat dan cairan akan keluar dari sel menuju ke pembuluh darah. Selain itu, ruang ekstraseluler tidak memompa ulang dan organ akan kolaps kedalam seluruhnya, sehingga pengkerutan jaringan dapat dihindarkan.4,9
Larutan perfusi dialirkan dengan kecepatan 20-25 ml/menit untuk tikus dewasa. Teknik perfusi juga menggunakan tekanan awal 80 mmHg dan dipertahankan sampai larutan perfusi selesai. Selain itu, tekanan dapat ditingkatkan maksimal sampai 130 mmHg.4,10 Selama perfusi, kecepatan dan tekanan yang dianjurkan harus dipertahankan agar mencegah kerusakan pada organ yang telah dilakukan perfusi sehingga hasil gambaran yang didapat tidak sesuai dengan yang diharapkan.11
2.1.2.1. Langkah-Langkah Metode Perfusi
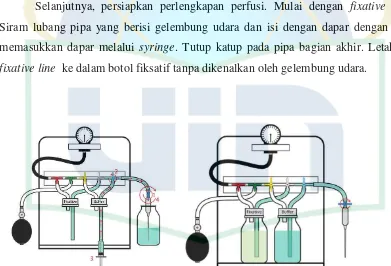
Gambar 2.1. Peralatan perfusi dengan komponen berlabel dan persiapan perfusi I (sumber : Fixation and Fixatives : Popular Fixative Solutions, 2012)4
Selanjutnya, persiapkan perlengkapan perfusi. Mulai dengan fixative line.
Siram lubang pipa yang berisi gelembung udara dan isi dengan dapar dengan cara memasukkan dapar melalui syringe. Tutup katup pada pipa bagian akhir. Letakkan
fixative line ke dalam botol fiksatif tanpa dikenalkan oleh gelembung udara.
sempurna dengan memompa bulb manometer dan melihat pengukurnya. Perlengkapan siap untuk melakukan prosedur fiksasi
Gambar 2.3. Preparasi hewan coba (sumber : Fixation and Fixatives : Popular Fixative Solutions, 2012) 4
Insisi pada lateral melewati integument dan dinding abdomen, dilanjutkan insisi pada diafragma dan potong daerah tersebut untuk mengekspos jantung. Kemudian buat potongan paralel pada kedua sisi tulang iga (costae) hingga tulang
scapulae.
Klem ujung sternum dengan hemostat dan letakkan hemostat di atas kepala tikus. Letakkan jarum perfusi melalui potongan ventrikel menuju aorta asendens kemudian amankan jarum perfusi dengan 1 set hemostat untuk klem jantung. 1 set hemostat yang lain dapat digunakan untuk klem aorta, yaitu kira-kira pada ujung jarum untuk mencegah kebocoran. Selanjutnya gunakan gunting iris untuk membuat insisi kecil pada akhir posterior ventrikel kiri.
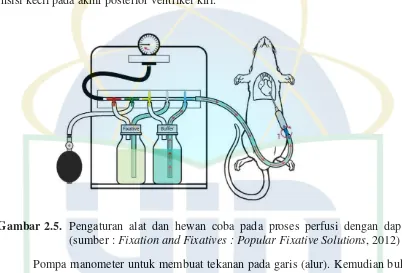
Gambar 2.6. Pengaturan alat dan hewan coba pada proses perfusi dengan larutan fiksatif (sumber : Fixation and Fixatives : Popular Fixative Solutions, 2012) 4
Ketika dapar akan selesai (200 ml), ganti alur katup dapar sehingga cairan fiksatif dapat masuk. Tekanan dapat ditingkatkan hingga 130 mmHg.
2.1.3. Perfusi PBS-Formalin
PBS (Phosphate Buffer Saline) adalah larutan fisiologis yang bisa digunakan dalam prosedur immune-histokimia. Larutan ini bersifat isotonik dan tidak beracun terhadap sel serta bertujuan untuk menjaga kadar pH dan mempertahankan osmolaritas sel.5 Saat ini, PBS sudah banyak digunakan sebagai
1. Immunoassays
2. Prosedur immune-histokimia
3. Prosedur mikrobiologi
4. Prosedur kultur jaringan dan sel 5. Pengenceran suatu sampel5
Formalin merupakan larutan fiksatif, dimana larutan ini digunakan pada proses fiksasi jaringan. Tetapi pada proses perfusi juga dapat digunakan larutan formalin yang dikombinasikan dengan PBS, dengan tujuan mendapatkan hasil yang lebih baik. Formalin yang dilarutkan dalam PBS atau bisa disebut PBS-Formalin merupakan larutan yang direkomendasikan sebagai pilihan agen fiksatif yang terbaik.6 Larutan fiksatif saat ini sedang dikembangkan yang sifat racunnya sangat minimal. PBS-Formalin paling sering digunakan sebagai agen fiksatif karena sifatnya sebagai agen yang fleksibel. Selain itu, dengan larutan fiksatif PBS-Formalin ini dapat menjadikan organ yang akan diteliti menjadi lebih lama dapat disimpannya dan proses autolisisnya sangat minimal.11
2.1.4. Pengolahan Pembuatan Blok
Metode yang digunakan pada penelitian kali ini adalah metode parafin yaitu metode yang paling sering digunakan. Keuntungan menggunakan metode ini yaitu pertama, irisan dapat lebih tipis dibandingkan menggunakan metode lainnya yaitu dapat mencapai ketebalan rata-rata 6 mikrometer. Kedua, irisan yang sifatnya seri dapat dengan mudah dikerjakan. Ketiga, proses pengerjaannya lebih cepat dibandingkan dengan metode seloidin (mikrotom beku). Selain keuntungan tentu ada kerugian dari metode ini yaitu jaringannya akan menjadi keras, mengerut dan mudah patah serta untuk jaringan yang besar akan sulit dikerjakan dan enzim-enzim akan larut pada metode ini.1,2
Proses pengolahan pembuatan blok ini dimulai dari fiksasi, pencucian (washing), dehidrasi, perjernihan (clearing), infiltrasi parafin, penanaman (embedding), penyayatan (section), penempelan (affiksing), deparafinisasi, pewarnaan (staining), penutupan (mounting), dan labeling.1,2
2.1.4.1. Fiksasi
fiksasi ini dharapkan setiap molekul pada jaringan yang hidup tetap berada pada tempatnya dan tidak ada molekul baru yang timbul. Pada prosesnya ini tentu tidak akan berjalan dengan sempurna, apabila timbul molekul asing baru pada jaringannya disebut artefak. 1,2
2.1.4.2. Dehidrasi
Dehidrasi merupakan metode yang digunakan untuk mengeluarkan seluruh cairan yang terdapat dalam jaringan setelah dilakukan proses fiksasi sehingga nantinya dapat diisi dengan parafin untuk membuat blok preparat. Proses dehidrasi ini menggunakan alkohol bertingkat. Mulai dari alkohol 30%, 50%, 70%, 80%, 95%, dan alkohol absolut. Prosesnya, suatu jaringan akan dicelupkan dimasing-masing alkohol dengan kisaran waktu tertentu sampai prosesnya berakhir. 1,2
2.1.4.3. Penjernihan (clearing)
Penjernihan adalah metode yang digunakan mengeluarkan alkohol dari jaringan dan menggantikannya dengan suatu larutan yang berikatan dengan parafin. Pada proses clearing ini sangat krusial karena apabila di jaringan masih tersisa alkohol walaupun sedikit, parafin tidak akan bisa masuk kedalam jaringan. Sehingga jaringan nantinya tidak akan sempurna dalam pembuatan bloking, pemotongan, dan pewarnaan. Proses clearing ini menggunakan bermacam-macam zat penjernih yaitu
xylol atau xylene dan toluol atau toluene yang memiliki kelebihan dan kekurangannya masing-masing. Xylol atau xylene kelebihannya yaitu prosesnya cepat dan harganya tidak terlalu mahal. Kekurangannya yaitu jaringan yang dapat dipindahkan hanya dari alkohol absolut, dan jaringan yang dijernihkan dengan xylene tidak begitu jelas menjadi transparan, sehingga tidak diketahui proses ini berjalan sempurna atau tidak. 1,2
terlihat transparan berarti proses dehidrasi yang sebelumnya belum sempurna. Kekurangannya yaitu jaringan hanya bisa dipindahkan dari alkohol absolut apabila jaringan terlalu lama di toluol akan menyebabkan kerasnya jaringan sehingga sukar untuk dipotong menggunakan mikrotom. 1,2
2.1.4.4. Penanaman (embedding)
Penanaman (embedding) merupakan proses untuk mengeluarkan cairan pembening dari jaringan dan digantikan dengan parafin. Jaringan ini harus terbebas dari cairan pembening karena nantinya akan mengkristal dan sewaktu dipotong jaringan akan mudah robek. Berdasarkan metode prosesnya yaitu jaringan akan di dibenamkan di larutan parafin selama 3x dan dalam jangka waktu tertentu sambil dipanaskan agar parafinnya tidak membeku. Keuntungan menggunakan parafin dengan titik lebur rendah yaitu jaringannya tidak mudah menjadi rapuh. Sedangkan keuntungan memakai paraplast yaitu sifat parafinnya sangat elastis sehingga tidak mudah robek atau rusak ketika dipotong. 1,2
2.1.4.5. Pembuatan blocking
Pemotongan organ dilakukan menggunakan alat khusus dengan pisau yang sangat tipis dan tajam yang disebut mikrotom. Mikrotom adalah alat yang dapat mengiris potongan blok dengan sangat tipis dan sesuai dengan ukuran ketebalan yang kita inginkan.12 Terdapat berbagai jenis mikrotom yaitu :
1. Hand Microtome
Merupakan jenis mikrotom yang sangat simpel dan biasanya digunakan untuk memotong tumbuhan dan jaringan hewan, tetapi mikrotom jenis ini sangat terbatas kemampuannya untuk memotong jaringan setipis mungkin.
2. Rocking microtome
Mikrotom jenis ini merupakan jenis yang hanya bisa memotong jaringan yang lembut dan tingkat kesulitannya rendah. untuk jaringan yang lebih sulit contohnya jaringan yang tingkat kekakuannya tinggi dapat menggunakan jenis
rotary microtome atau base sledge microtome dibandingkan dengan rocking microtome.
3. Rotary microtome
Mikrotom jenis ini memiliki banyak keuntungan dan jenis yang paling cocok dengan metode blok parafin. Mikrotom ini juga dapat memotong jaringan yang sangat besar dan tingkat kesulitan yang besar. Dengan metode ini, blok dapat dipotong hingga ketebalan 0,5 sampai 2 mikrometer.
4. Freezing microtome
Metode ini memiliki banyak keuntungan yaitu diantaranya prosesnya cepat, jaringan yang mengkerut lebih sedikit dibandingkan dengan metode parafin serta hampir semua metode pewarnaan dapat dilakukan menggunakan metode ini. Selain keuntungan ada juga keburukannya yaitu irisan yang tipis dan irisan yang seri sulit untuk diperoleh.
5. Base sledge microtome
kekerasan suatu jaringan. Mikrotom jenis ini cara pengoperasiannya secara hidrolik sehingga memudahkan pemotongan dan dapat memotong bahan yang sangat keras sekalipun.12
2.1.5. Pewarnaan HE
Pewarnaan adalah teknik untuk memberikan warna pada komponen selular dengan tujuan dapat membedakan antar sel tersebut. Warna adalah persepsi dari mata yang dapat dibedakan berdasarkan panjang gelombang. Teknik pewarnaan ini membantu dalam menghasilkan kontras dimana setiap warna memiliki afinitasnya masing-masing. Contohnya pewarnaan sel, yaitu nukleus memiliki afinitas tinggi terhadap pewarnaan hematoksilin. Sedangkan sitoplasma memiliki afinitas tinggi terhadap pewarnaan eosin.13
Pewarnaan dengan menggunakan hematoksilin dan eosin memang metode yang paling banyak digunakan dalam pembuatan preparat histologis. Pewarnaan ini terdiri dari 2 jenis zat warna, yaitu hematoksilin yang fungsinya untuk mewarnai inti sel menjadi biru. Sedangkan eosin fungsinya untuk mewarnai sitoplasma menjadi merah.12
Hematoksilin merupakan zat warna alami yang dapat mengikat inti sel dengan ikatan yang lemah. Ikatan yang lemah ini dapat berubah apabila ditambahkan dengan senyawa lain. Selain itu, hematoksilin harus dioksidasi terlebih dahulu menjadi hematein agar dapat dijadikan sebagai pewarna inti sel. Eosin merupakan zat warna yang fungsinya untuk mewarnai sitoplasma. eosin akan memberikan beberapa corakan pada jaringan. Berbagai corakan pada jaringan ini dapat bertambah bila pewarnaan yang digunakan lebih dari satu.12
Nukleus atau inti sel adalah bagian terbesar dari sel, bentuknya bisa bulat atau lonjong dan terdiri dari atas 3 komponen yaitu selaput inti, kromatin, dan nukleolus. Selaput inti merupakan bagian yang mengelilingi inti yang merupakan bagian dari retikulum endoplasma. Kromatin adalah material kromosom yang terdiri atas pilinan untaian DNA yang terikat protein. Sedangkan nukleolus atau anak inti merupakan struktur yang sangat basofilik yang aktif mengadakan sintesis protein. Komponen nukleus ini akan terwarnai ungu atau biru tua bila diwarnai menggunakan pewarnaan hematoksilin.14,15
2.1.6.2. Sitoplasma
Sitoplasma merupakan bagian sel yang tersusun atas membran sel yaitu sebagai lapisan terluar, badan inklusi sitoplasma yang umumnya merupakan timbunan lipid, karbohidrat atau pigmen, dan sitosol yaitu bagian sitoplasma yang didalamnya terdiri atas struktur metabolik aktif contohnya organel. Dan komponen sitoplasma ini akan terwarnai merah muda bila diwarnai menggunakan pewarnaan eosin. 14,15
2.1.6.3. Hepar
2.3. Kerangka Konsep
Keterangan :
2.4. Definisi Operasional
No. Variabel Definisi
operasional
Alat ukur Cara pengukuran Skala pengukuran
BAB 3
METODE PENELITIAN 3.1. Desain Penelitian
Desain penelitian yang digunakan adalah desain deskriptif.
3.2. Waktu dan Tempat Penelitian 3.2.1. Waktu Penelitian
Penelitian dilaksanakan pada bulan April-Agustus 2014. 3.2.2. Tempat Penelitian
Penelitian dilakukan di Laboratorium Animal House, Laboratorium Biokimia, Laboratorium Biologi, Laboratorium Farmakologi, dan Laboratorium Histologi, Fakultas Kedokteran dan Ilmu Kesehatan Jl. Kertamukti No. 05, Pisangan Ciputat 15419, Tangerang Selatan.
3.3. Populasi dan Sampel Penelitian
Hewan coba yang digunakan pada penelitian ini adalah tikus jantan
strain Sprague-dawley umur 80 hari dengan berat badan 200 gram. Hewan coba tersebut diperoleh dari Departemen Patologi Institut Pertanian Bogor (IPB) (Lampiran 1).22
Pada penelitian ini menggunakan organ hepar, pankreas, dan ginjal sebagai sampel.
3.4. Cara Kerja Penelitian
3.4.1. Alat dan Bahan Penelitian a. Tahap Nekropsi
b. Tahap Perfusi dan Fiksasi
Alat perfusi menggunakan set infus dengan ukuran jarum 23G, PBS
(Phosphate Buffer Saline) dan Formalin. c. Tahap Dehidrasi
Gelas ukur 1000 ml dan 500 ml, Beaker glass 1000 ml dan 250 ml, corong kaca, aquades, alkohol absolut CH3CH2OH Mallinckrodt Chemicals, dan alkohol 95%.
d. Tahap Paraffinisasi
Incubator dan Paraplast Leica Microsystem.
e. Tahap Clearing dan Embedding
Hotplate stirer (sRS 710 HA), vials stopper tools neck.
f. Tahap Blocking
Cetakan blocking dan Spiritus g. Tahap Pemotongan
Bunsen, mikrotom geser, korek api gas, waterbath, kulkas, beaker glass 200 ml, putih telur, gliserin, dan es batu.
h. Tahap Pewarnaan
Object glass, cover glass, staining jar, mikroskop shimadzu T025A, spatula kaca, timer, Hematoksilin, eosin, xylol, canada balsam, aquadest, H2SO4, alkohol absolut CH3CH2OH, alkohol 95%.
i. Tahap Foto Jaringan
Kotak preparat, kamera preparat, komputer lab, DVD foto, mikroskop
Olympus BX41.
j. Tahap keseluruhan Tissue, tissue berpori.
3.4.2. Adaptasi Hewan Coba1,2
3.4.3. Tahapan Nekropsi (Perfusi) 1,2,4
Siapkan alat dan bahan. Lakukan anastesi menggunakan eter. Keberhasilan anastesi dicek dengan memberikan rangsang nyeri pada kaki atau ekor tikus. Tikus diletakkan pada papan nekropsi dan dilakukan pembedahan pada bagian abdominothorakal. Setelah alat perfusi terpasang, suntikan jarum perfusi di bagian vena kava inferior dan potong vena kava inferior di bagian belakang jarum dengan hati-hati. Larutan perfusi formalin 10% dalam PBS (PBS-Formalin), dialirkan dengan kecepatan 20 ml/menit dan tekanan yang diperoleh dari ketinggian permukaan larutan terhadap vena kava inferior sekitar 72,5 cm. Perhatikan hingga pembuluh darah arteri dan vena intercostalis serta hepar menjadi pucat yang menandakan proses perfusi sudah selesai. Lakukan nekropsi organ-organ yang dibutuhkan (hepar, pankreas, ginjal). Organ dipotong dengan ketebalan 0,5 cm dan direndam kedalam larutan formalin 10%.
3.4.4. Tahapan Pemrosesan Jaringan1,2
3.4.4.1.Dehidrasi1,2
Proses dehidrasi menggunakan alkohol dengan variasi konsentrasi 50%, 70%, 80%, 90%. Pengenceran alkohol dilakukan dengan cara penghitungan sebagai berikut:
1. Pengenceran alkohol 50% = 500 ml alkohol 95% + 450 ml aquades 2. Pengenceran alkohol 70% = 700 ml alkohol 95% + 250 ml aquades 3. Pengenceran alkohol 80% = 800 ml alkohol 95% + 150 ml aquades 4. Pengenceran alkohol 90% = 900 ml alkohol 95% + 50 ml aquades
Tahap dehidrasi dimulai dengan memasukkan potongan hepar, ginjal dan pankreas ke dalam pot plastik berlabel I, II, lalu III. Potongan organ direndam selama 15 menit secara berurutan ke dalam larutan alkohol 50%, 70%, 80%, 90% dan 95%.
3.4.4.2.Clearing1,2
Tahapan Clearing bertujuan untuk mengeluarkan alkohol dari jaringan, karena alkohol dan paraffin tidak dapat menyatu, sehingga larutan yang akan dimasukkan ke dalam jaringan dapat berikatan dengan parafin. Pada tahapan ini digunakan larutan toluol:alkohol (1:1) dan toluol murni.
Pertama, potongan organ dimasukan ke dalam larutan toluol:alkohol (1:1) dan direndam selama 25 menit. Kemudian potongan organ tersebut dipindahkan dan direndam kedalam toluol murni selama 60 menit hingga menjadi bening. Perendaman dalam toluol murni diperpanjang sampai potongan menjadi bening. Waktu perendaman dalam toluol murni paling lama selama 120 menit, karena akan menyebabkan pengerasan pada jaringan sehingga sulit untuk dilakukan pemotongan.
3.4.4.3.Embedding1,2
Tahap embedding bertujuan untuk mengeluarkan cairan pada saat proses clearing dan menggantinya dengan paraffin karena cairan saat proses
clearing dapat mengkristal di dalam jaringan dan menyebabkan jaringan mudah robek saat tahap pemotongan.
Pertama, buat larutan toluol : paraffin (50 ml : 50 ml). Kemudian bungkus organ menggunakan tissue berpori lalu rendam dalam larutan tersebut dan diamkan pada suhu ruangan selama 24 jam. Setelah itu cairkan
3.4.4.4. Blocking1,2
Tahapan ini merupakan proses pembuatan blok preparat agar organ dapat dipotong dengan mikrotom. Cairkan paraffin lalu tuangkan sedikit ke dalam cetakan blok. Masukan potongan organ secara perlahan dan kemudian tuangkan kembali paraffin hingga merendam organ.
3.4.5. Pemotongan Jaringan1,2
Pemotongan jaringan dilakukan dengan menggunakan mikrotom. Pertama, rekatkan blok paraffin diatas blok kayu dengan cara memanaskan salah satu sisi blok paraffin hingga sedikit mencair kemudian langsung tempelkan. Letakan blok paraffin dan balok kayu tersebut pada holder (pemegang) di mikrotom dan kencangkan. Lakukan pemotongan jaringan ini dengan ketebalan 6 µm. Jika diperlukan sudut kemiringan pisau mikrotom diatur pada sudut 20-30o.
Hasil potongan blok paraffin kemudian di rendam dalam waterbath
dengan suhu air 37-40o C hingga potongan organ terlihat merengang. Kemudian oleskan putih telur yang dicampur dengan gliserin pada kaca objek secara tipis dan merata. Lalu ambil potongan tersebut menggunakan kaca objek ke dalam
waterbath. Letakan kaca objek tersebut pada hotplate dengan suhu 40-45oC hingga kering. Setelah kering dan potongan melekat dengan kuat pada kaca objek, angkat dari hotplate dan potongan siap untuk diwarnai.
3.4.6. Tahapan Pewarnaan HE1,2
Sebelum memulai proses pewarnaan masukkan xylol, alkohol dengan konsentrasi 70%, 80%, 90%, alkohol absolut, alkohol asam, hematoksilin, eosin dan aquades ke dalam staining jar dengan volume ¾ bagian.
sebanyak 2 kali. Pindahkan dan rendam cawan ke dalam staining jar berisi alkohol konsentrasi 90% selama 1 menit.
Pindahkan dan rendam cawan ke dalam staining jar berisi alkohol konsentrasi 80% selama 1 menit. Pindahkan dan rendam cawan ke dalam
staining jar berisi alkohol konsentrasi 70% selama 1 menit. Pindahkan dan rendam cawan ke dalam staining jar berisi aquades selama 4 menit. Pindahkan cawan tersebut dan rendam ke dalam staining jar yang berisi Hematoksilin dengan durasi hepar 4 menit; ginjal 2 menit; pankreas 1 menit. Selama durasi itu dilakukan pengamatan dibawah mikroskop untuk menghindari terjadinya
overstainning hematoksilin. Lakukan perendaman cawan di dalam staining jar
berisi aquades sebanyak 3 kali dengan durasi 1 menit. Pindahkan dan rendam cawan ke dalam staining jar berisi alkohol asam selama 30 detik.
Kemudian pindahkan dan rendam cawan kedalam staining jar yang sudah dialiri air mengalir selama 1 menit. Pindahkan dan rendam cawan ke dalam staining jar berisi Eosin selama 1 menit. Selama durasi itu dilakukan pengamatan dibawah mikroskop untuk menghindari terjadinya overstainning
eosin.
Lakukan pemindahan dan perendaman cawan di dalam staining jar
berisi aquades sebanyak 3 kali dengan durasi 1 menit. Pindahkan secara berurutan dan rendam cawan ke dalam staining jar yang berisi alkohol dengan konsetrasi meningkat dari 70% sampai alkohol absolut selama 1 menit dan xylol sebanyak 2 kali 3 menit.
3.4.7. Foto Jaringan1,2
Preparat diamati dan difoto dengan menggunakan mikroskop Olympus BX41 dan software Olympus DP2-BSW yang dimulai dari perbesaran 4x, 10x, 20x, dan 40x.
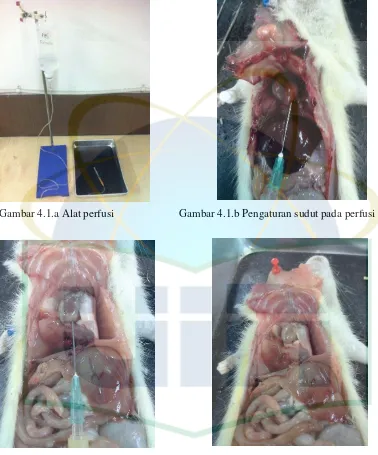
BAB 4 (Gambar 4.1.a). Alat yang seharusnya digunakan berdasarkan teori adalah alat perfusi yang dilengkapi dengan pengukur tekanan dan kecepatan. Kecepatan normalnya biasanya 20-25 ml/menit, sedangkan tekanan yang dibutuhkan diawal adalah 80 mmHg, nantinya akan bertahap meningkat hingga maksimal 130 mmHg. Tujuan dari pengaturan tekanan dan kecepatan tersebut adalah agar hasil organ tikus yang diperfusi dapat maksimal dan keseragaman hasil dapat tercapai. Pada penelitian kali ini menggunakan peralatan yang berbeda dengan teori. Karena faktor dari keterbatasan penyediaan alat tetapi tetap dengan fungsi yang sama. Kecepatan dan tekanan aliran larutan perfusi pada set infus tidak dapat diatur agar tetap konstan, sehingga hasil yang didapat pada beberapa organ tidak maksimal dan kurang memuaskan.4,9,19
Gambar 4.1.a Alat perfusi Gambar 4.1.b Pengaturan sudut pada perfusi
Gambar 4.1.c Tanda perfusi sudah optimal Gambar 4.1.d Perfusi selesai
dikerjakan, maka proses pengambilan organ dapat segera dilakukan (Gambar 4.1.d). 4,9,19
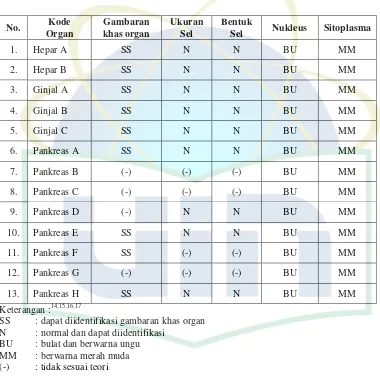
Berikut hasil yang didapatkan pada penelitian ini yaitu daftar preparat jaringan yang diperfusi PBS-Formalin. (Lampiran 3)
Tabel 4.1. Daftar preparat jaringan yang diperfusi dengan PBS-Formalin
No. Kode
Sel Nukleus Sitoplasma
1. Hepar A SS N N BU MM
SS : dapat diidentifikasi gambaran khas organ N : normal dan dapat diidentifikasi
BU : bulat dan berwarna ungu MM : berwarna merah muda (-) : tidak sesuai teori
4.2. Hepar
(a) (b)
Gambar 4.2. Hepar tikus (a) Perfusi Formalin A perbesaran 20x; (b) Perfusi
PBS-Formalin A perbesaran 40x (insert: hepatosit).
Hasil penelitian ini tidak sesuai dengan penelitian Suprianto (2014) dimana didapatkan hasil yang baik pada hepar yang diperfusi PBS-Formalin.20 Hal tersebut dapat diakibatkan oleh faktor teknik perfusi. Pada penelitian ini teknik perfusi dilakukan dengan kecepatan 20 ml/menit dan dengan tekanan yang tidak dapat dibuat konstan. Kecepatan diperoleh dengan ketinggian permukaan larutan terhadap vena kava inferior sekitar 72,5 cm. Kemungkinan cairan perfusi dengan kecepatan dan tekanan tinggi merusak tautan antar sel sehingga hasil pada preparat jaringan tampak renggang. 4,9,19,21
4.3. Ginjal
Pada ginjal perfusi PBS-Formalin (Gambar 4.3.a) gambaran glomerulus dapat dikenali namun tubulus ginjal dominan sulit dikenali, tubulus ginjal pada perfusi PBS-Formalin tidak begitu jelas dan terlihat renggang.
(b) (c)
Gambar 4.3. Ginjal tikus (a.) Perfusi PBS-Formalin C perbesaran 20x; (b.) Perfusi
PBS-Formalin C perbesaran 40x (insert: glomerulus); (c.) Perfusi PBS-Formalin C perbesaran 40x (insert: tubulus)
Bentuk glomerulus pada preparat tampak baik. Sel endotel glomerulus dapat dikenali dan ruang kapsula Bowman masih dalam kondisi baik (Gambar 4.3.b insert). Gambaran pada sel epitel tubulus ginjal yang diperfusi PBS-Formalin tersusun tidak teratur (Gambar 4.3.c insert). Kondisi tersebut disebabkan oleh teknik perfusi. Yaitu pengaruh kecepatan dan tekanan perfusi yang tinggi dapat merusak jaringan dengan mekanisme jejas sel. Ketika sel mendapatkan tekanan tinggi pada perfusi, akan muncul respon adaptasi yang menghasilkan perubahan pada gambaran, jumlah, maupun ukuran pada sel. Sehingga didapatkan gambaran sel epitel tubulus yang tidak tersusun teratur pada ginjal perfusi PBS-Formalin (Gambar 4.3.c). 4,9,19,21
4.4. Pankreas
Pada pankreas perfusi PBS-Formalin sulit dibedakan gambaran pulau Langerhans dan bagian eksokrinnya (Gambar 4.4.a). Kondisi tersebut disebabkan karena faktor teknik perfusi. Kemungkinan cairan perfusi dengan kecepatan dan tekanan tinggi merusak tautan antar sel sehingga hasil pada preparat jaringan pankreas PBS-Formalin lebih renggang.22 Selain itu, pada pankreas PBS-Formalin didapatkan jaringan yang bertumpuk-tumpuk sehingga terlihat sebagai keadaan
pembuatan blok kemungkinan ada tahapan yang dikerjakan kurang maksimal. Hal tersebut dikarenakan konsistensi organ pankreas lebih lunak dibandingkan organ hepar dan ginjal sehingga pada tahapan dehidrasi atau clearing organ pankreas menjadi keras dan sulit untuk dipotong dan menghasilkan gambaran preparat yang bertumpuk-tumpuk. 4,9,19,21
(a)
(b) (c)
Gambar 4.4. Pankreas tikus (a.) Perfusi PBS-Formalin A perbesaran 20x; (b.)
Perfusi PBS-Formalin A perbesaran 40x (insert: pulau Langerhans); (c.) Perfusi PBS-Formalin A perbesaran 40x (insert: asinus)
dideskripsikan. Keadaan tersebut dapat diakibatkan oleh faktor teknik perfusi. Pada penelitian ini teknik perfusi dilakukan dengan kecepatan 20 ml/menit dan dengan tekanan yang tidak dapat diukur. Kemungkinan cairan perfusi dengan kecepatan dan tekanan tinggi merusak tautan antar sel sehingga hasil pada preparat jaringan tampak renggang.22 Hasil penelitian ini sesuai dengan yang dilakukan oleh Fu Tian Du dkk (2012), yaitu gambaran ruang antara lobus interstisial bagian eksokrin pankreas tampak melebar, terlepas, dan membengkak (edema). 4,9,19,21
BAB 5
SIMPULAN DAN SARAN 5.1. Simpulan
Berdasarkan penelitian ini, dapat disimpulkan :
1. Perfusi PBS-Formalin tidak memberikan gambaran yang baik pada organ hepar, pankreas, dan ginjal dikarenakan pengaturan tekanan dan kecepatan yang tidak optimal untuk melakukan perfusi sehingga data yang digunakan pada penelitian ini tidak dapat digunakan sebagai data dalam pembuatan SOP baku histoteknik di laboratorium Animal House dan laboratorium Histologi kampus FKIK UIN Syarif Hidyatullah
2. Organ hepar, ginjal dan pankreas yang diperfusi PBS-Formalin menunjukkan gambaran histologi yang kurang baik. Walaupun gambaran khas masing-masing organ, nukleus dan sitoplasma dapat diidentifikasi dengan baik. Akan tetapi, hubungan atau taut antar sel terlihat renggang akibat dari kurang optimalnya pengaturan kecepatan dan tekanan pada proses perfusi berlangsung.
5.2. Saran
Untuk penelitian ini :
1. Pengadaan alat perfusi yang sesuai dengan standar penelitian harus segera dlakukan.
2. Setelah pengadaan alat terpenuhi, dilakukan uji coba sehingga dapat menghasilkan SOP yang dapat diaplikasikan pada laboratorium Animal House dan laboratorium Histologi FKIK UIN Syarif Hidayatullah Jakarta.
4. Untuk penelitian selanjutnya harus mempunyai hewan kontrol yang sesuai dengan rumus yang berlaku.
DAFTAR PUSTAKA
1. Jusuf, Ahmad Aulia. Histoteknik Dasar. Bagian Histologi Fakultas Kedokteran Universitas Indonesia. 2009
2. Suntoro, Handari. Metode Pewarnaan : Histologi dan Histokimia. Bagian Anatomi dan Mikroteknik Hewan Fakultas Biologi UGM. Jakarta : Penerbit Bhiratara Karya Aksara. 1983
3. Hedrich, Hans. The Laboratory Mouse. Amsterdam, Netherlands : Elsevier. 2004
4. Gage, Gregory J. Klipke, Daryl R. et al. Whole Animal Perfusion Fixations for Rodents. Pubmed. 2012 (65)
5. Medicago, AB. Smartbuffers Phosphate Buffered Saline (PBS) pH 7,4 and 7,2. 2011
6. Buchwalow, Igor B. Bocker, Werner. Immuno-histochemistry. Basic and
Methods. Springer Heidelberg Dordrecht London New York. 2010
7. Kardono. Persyaratan Laboratorium Lingkungan dan Kondisinya di Indonesia. Vol 2 hal 109-120. Peneliti di Pusat Teknologi Lingkungan Badan Pengkajian dan Penerapan Teknologi. 2008
8. Harvey, Lee. Analytic Quality Glossary. Quality Research International.
Updated 12 July, 2014. Available from URL :
http://www.qualityresearchinternational.com/glossary/preliminarystudy.htm
Accessed September 5, 2015
9. Cunningham, Miles. Scouten, Charles W. et al. Sacrifice Perfusion in Animal
Research. Leica Biosystems, Wetzlar, Germany. McLEan Hospital of Harvard
University, Belmont, MA, USA. 2012
11.Rolls, Geoffrey. Fixation and Fixatives : Popular Fixative Solutions. Leica Biosystems, Wetzlar, Germany. 2012
12.Steven, Leary et al. AVMA Guidelines for the Euthanasia of Animals: 2013 Edition. Schaumburg : American Veterinary Medical Association. 2013 13.Waheed, Usman. Histotechniques Laboratory Techniques in Histopathology :
a Handbook for Medical Technologist. LAP LAMBERT Academic
Publishing. 2012
14.Mescher, Anthony L. Histologi Dasar Junqueira Teks dan Atlas. Edisi 12. Penerbit Buku Kedokteran : EGC. Jakarta. 2012
15.Johnson, Kurt E. Quick Review Histologi dan Biologi Sel. Binarupa Aksara Publisher. 2011
16.Gartner, Leslie P. Hiatt, James L. Strum, Judy M.. Biologi Sel dan Histologi. Ed. 6. Binarupa Aksara Publisher. 2012
17.Conti, Claudio J; et al. Atlas of Laboratory Mouse Histology. Texas : The University of Texas M. D. Anderson Cancer Center. 2004
18.Askary, Fadel. Efek Pemberian Ekstrak Nigella sativa Terhadap Kadar Glukosa Darah dan Trigliserida Pada Tikus Diabetes Mellitus yang Diinduksi Streptozotocin. Laporan Penelitian FKIK UIN Syarif Hidayatullah Jakarta. 2014
19.Anonim. Perfusion Systems : Harvard Apparatus Isolated Heart Perfusion Apparatus. 2012 BS4: 50-2864
20.Suprianto, Abang. Perbandingan Efek Fiksasi Formalin Metode Intravital dengan Metode Konvensional pada Kualitas Gambaran Histologis Hepar Tikus. Universitas Tanjungpura Pontianak. 2014
LAMPIRAN
Lampiran 1 Surat Keterangan Tikus Sehat
Lampiran 2 Gambar proses penelitian
Gambar 6.2 Sampel Penelitian
Gambar 6.3 Anastesi Hewan Coba
Gambar 6.4 Proses Nekropsi
Gambar 6.6 Proses Dehidrasi
Gambar 6.7 Proses clearing
Gambar 6.8 Proses Embedding
Gambar 6.9 Proses Blocking
Gambar 6.10 Blok PBS-Formalin
Gambar 6.12 Set Pewarnaan Hematoksilin
Lampiran 3 Gambar hasil preparat
(a) (b)
(c) (d)
(a) (b)
(c) (d)
(g) (h)
(i)
(a) (b)
(c) (d)
(e) (f)
(i) (j)
(k) (l)
(o) (p)
(q) (r)
(u) (v)
Gambar 6.15 a. Pankreas F A 20x; b. Pankreas F B 20x; c. Pankreas PBS-F C 20x; d. Pankreas PBS-PBS-F D 20x; e. Pankreas PBS-PBS-F E 20x; f. Pankreas PBS-PBS-F PBS-F 20x; g. Pankreas PBS-F G 20x; h. Pankreas PBS-F H 20x; i. Pankreas PBS-F A 40x (insert: Langerhans); j. Pankreas PBS-F B 40x (insert: Langerhans dan asinus); k. Pankreas PBS-F C 40x (insert: Langerhans); l. Pankreas PBS-F D 40x (insert:
Langerhans); m. Pankreas PBS-F E 40x (insert: Langerhans); n. Pankreas PBS-F F 40x
Lampiran 4 Riwayat Penulis
Identitas
Nama : Putri Junita Sari
Jenis Kelamin : Perempuan
Tempat, Tanggal Lahir : Jakarta, 14 Juni 1993
Agama : Islam
Alamat : Komp. Paspampres Jl. Kemuning No.9 Kotabatu Bogor 16610
e-Mail : putrijunitasari@gmail.com
Riwayat Pendidikan
1999-2000 : RA Insan Takwa Bogor
2000-2005 : MI Insan Takwa Bogor
2005-2008 : SMPN 7 Bogor
2008-2011 : SMAN 4 Bogor