PENGARUH KONSENTRASI THIDIAZURON DENGAN DAN TANPA BENZILADENIN TERHADAP PERBANYAKAN TUNAS PISANG
KEPOK KUNING DAN EMBRIO PISANG RAJA BULU SECARAIN VITRO
Oleh
MAYASARI
Kultur jaringan merupakan alternatif perbanyakan tanaman pisang dalam jumlah
besar dan seragam dengan penambahan zat pengatur tumbuh. Pemberian zat
pengatur tumbuh sitokinin (TDZ, BA dan kombinasi) tinggi diharapkan dapat
meningkatkan jumlah tunas. Penelitian ini bertujuan untuk mengetahui pengaruh
peningkatan konsentrasi TDZ dan pemberian BA serta kombinasi antara TDZ dan
BA. Eksplan pisang Kepok Kuning berasal dari eksplan primer (bonggol),
sedangkan eksplan pisang Raja Bulu berasal dari embrio hasil kulturin vitro
penelitian sebelumnya. Penelitian ini dilakukan dengan rancangan acak lengkap
yang disusun secara faktorial (4x2). Faktor pertama, empat taraf konsentrasi TDZ
yaitu 0.005 mg/l, 0.01 mg/l, 0.05 mg/l, dan 0.1 mg/l. Faktor kedua, dua taraf
konsentrasi BA yaitu 0 mg/l dan 2 mg/l. Perlakuan yang diujikan yaitu 0,005
mg/l TDZ, 0,01 mg/l TDZ, 0,05 mg/l TDZ, 0,1 mg/l TDZ, 0,005 mg/l TDZ + 2
mg/l BA, 0,01 mg/l TDZ + 2 mg/l BA, 0,05 mg/l TDZ + 2 mg/l BA, dan 0,1 mg/l
nilai tengah dengan BNT 5%. Hasil penelitian pada pisang Kepok Kuning
menunjukkan bahwa peningkatan konsentrasi TDZ hingga 0,1 mg/l dapat
meningkatkan jumlah propagul pisang Kepok Kuning. Media MS + 0,1 mg/l
TDZ menghasilkan jumlah propagul terbanyak dibandingkan perlakuan yang lain,
yaitu 3,5 propagul. Hasil penelitian pada eksplan pisang Raja Bulu dalam media
MS + 0,1 mg/l TDZ menghasilkan propagul terbanyak dibandingkan perlakuan
lain, yaitu 16,16 propagul.
BENZILADENIN TERHADAP PERBANYAKAN TUNAS PISANG KEPOK KUNING DAN EMBRIO PISANG RAJA BULU
SECARAIN VITRO
Oleh MA YA SA RI
Skripsi
Sebagai Salah Satu Syarat Untuk Mencapai Gelar SARJANA PERTANIAN
Pada
Jurusan Agroteknologi
Fakultas Pertanian Universitas Lampung
FAKULTAS PERTANIAN UNIVERSITAS LAMPUNG
Penulis dilahirkan di Desa Nambahrejo, Kecamatan Kota Gajah, Kabupaten
Lampung Tengah, pada 1 Mei 1994. Penulis merupakan anak pertama dari tiga
bersaudara dari pasangan Bapak Budiono dan Ibu Sukini.
Penulis menyelesaikan pendidikan Sekolah Dasar di SD Negeri 1 Nambahrejo
Lampung Tengahpada tahun 2005, Sekolah Menengah Pertama di MTs Ma’arif 1
Punggur Lampung Tengah pada tahun 2008, Sekolah Menengah Atas di SMA
Negeri 1 Punggur Lampung Tengah pada Tahun 2011.
Penulis diterima sebagai Mahasiswa jurusan Agroteknologi, Fakultas Pertanian
Universitas Lampung pada tahun 2011. Selama menempuh pendidikan sarjana,
penulis berkesempatan menjadi asisten praktikum mata kuliah Dasar-dasar Ilmu
Tanah (Semester Ganjil dan Genap tahun ajaran 2012/2013), Fisiologi Tanaman
(Semester Genap 2013/2014), dan Teknik Perbanyakan Tanaman (Semester
Genap 2014/2015). Penulis juga tergabung dalam organisasi kampus sebagai
anggota bidang Biro BBQ FOSI FP (2012/2013), anggota bidang Penelitian dan
Pengembangan PERMA AGROTEKNOLOGI (2012/2013), anggota bidang
Kaderisasi FOSI FP (2013/2014), dan anggota bidang Penelitian dan
Pada Tahun 2014, penulis melaksanakan Kuliah Kerja Nyata (KKN) di Desa
Bumi Rahayu, Kecamatan Bumi Ratu Nuban, Kabupaten Lampung Tengah dan
pada tahun yang sama penulis juga melaksankan Praktik Umum (PU) di
Laboratorium Biak Sel dan Jaringan Tumbuhan Pusat Penelitian Biologi LIPI
Allah menghendaki kemudahan bagimu dan
tidak menghendaki kesulitan bagimu. (QS. Al-Baqarah:185)
Karena sesungguhnya beserta kesulitan itu ada kemudahan.
Sesungguhnya beserta kesulitan itu ada kemudahan.
(QS. Al-Insyirah: 5-6)
Barang siapa yang bertawakal kepada Allah,
niscaya Allah mencukupinya. (QS. Ath-thalaq:3)
Alhamdulillahirobbilalamin, puji syukur kepada Allah SWT yang telah
memberikan kelancaran, rahmat dan petunjuk-Nya sehingga penulis dapat
menyelesaikan skripsi ini. Pelaksanaan penelitian ini tentu tidak terlepas dari
pihak-pihak yang telah memberikan motivasi, bimbingan, saran, dan dukungan.
Pada kesempatan ini, penulis mengucapkan terima kasih kepada:
1. Prof. Dr. Ir. Yusnita, M.Sc., selaku dosen Pembimbing Utama dan pemberi
ide penelitian ini. Terima kasih atas waktu, kesabaran, bimbingan, dan
nasihat-nasihat bijak yang selama ini diberikan kepada penulis, sehingga
penulis dapat menyelesaikan skripsi ini.
2. Dr. Ir. Dwi Hapsoro, M.Sc., selaku dosen Pembimbing Kedua. Terima kasih
atas waktu, bimbingan, kesabaran, dan nasihat bijak selama penelitian
sehingga penulis dapat menyelesaikan skripsi ini.
3. Akari Edy, S.P., M.Si., selaku dosen Penguji. Terima kasih atas saran,
masukan, kritikan, dan bimbingan sehingga penulis dapat menyelesaikan
skripsi ini.
4. Ir. M. A. Syamsul Arif, M.Sc., Ph.D., selaku Pembimbing Akademik atas
motivasi selama penulis menyelesaikan studi.
5. Prof. Dr. Ir. Setyo Dwi Utomo, M.Sc., selaku Ketua Bidang Budidaya
6. Dr. Ir. Kuswanta Futas Hidayat, M.P., selaku Ketua Jurusan Agroteknologi,
Fakultas Pertanian, Universitas Lampung,
7. Prof. Dr. Ir. Wan Abbas Zakaria, M.S., selaku Dekan Fakultas Pertanian,
Universitas Lampung.
8. Mama’ (Ibu Sukini) dan Bapak (Bapak Budiono) serta adik-adikku (Wahyu
Dwi Lestari dan Muhammad Faizal Nugroho). Terima kasih atas doa,
dukungan, dan bantuan moril maupun materi yang telah diberikan kepada
penulis.
9. Habiba Nurul Istiqomah, Oktaviolentina, Defika Dwi Pratiwi, dan Dwi
Safitri, selaku rekan dalam melaksanakan penelitian ini. Terima kasih atas
bantuan dan dukungan yang telah diberikan.
10. Hayane Adelin Warganegara, S.P., M.Si., Anggun Fiolita, Yeni, Yanti,
Rezlinda, Ria, Wiwik, Resti, Vanny, Syanda, Yoga, Rifki, Eldi, Abang
Assad, dan kru Laboratorium yang telah memberikan bantuan, saran, dan
semangat juang selama penelitian dan penulisan skripsi.
11. Teman-tenam Agroteknologi 2011 (Mutia, Peni, Nikmatul, Felix, Edi, Riski,
dan teman-teman yang lain yang tidak penulis sebutkan satu per satu) terima
kasih atas motivasinya.
Semoga Allah SWT memberikan balasan atas semua bantuan yang telah diberikan
dan penulis berharap semoga skrispsi ini dapat bermanfaat bagi seluruh pembaca.
Bandar Lampung, Agustus 2015
Penulis,
Halaman
DAFTAR TABEL………. iv
DAFTAR GAMBAR……… vi
I. PENDAHULUAN………. 1
1.1 Latar Belakangdan Masalah………. 1
1.2 Tujuan Penelitian……….. 4
1.3 Landasan Teori... 5
1.4 Kerangka Pemikiran……….… 8
1.5 Hipotesis………... 10
II. TINJAUAN PUSTAKA……….. 11
2.1 Botani Tanaman Pinang……… 11
2.2 Perbanyakan Tanaman secara Konvenional………. 13
2.3 Perbanyakan Tanaman secaraIn Vitro………. 14
2.4 Zat Pengatur Pertumbuhan………... 17
III. BAHAN DAN METODE………. 20
3.1 Percobaan I. Pengaruh Konsentrasi Thidiazuron dengan dan tanpa Benziladenin terhadap Perbanyakan Tunas Pisang Kepok Kuning secarain vitro…...……….. 20
ii
3.1.2 Metode Penelitian………... 20
3.1.3 Pelaksanaan Penelitian……….. 21
3.1.3.1 Sterilisasi Botol Kultur……… 21
3.1.3.2 Media Kultur………... 22
3.1.3.3 Bahan Tanam……….……….. 23
3.1.3.4 Persiapan Eksplan……… 24
3.1.3.5 Sterilisasi dan Penanaman Eksplan………. 25
3.1.3.6 Pengamatan……….. 26
3.2 Percobaan Lanjutan: Pengaruh TDZ 0,1 mg/l dan TDZ 0,1 mg/l + BA 2 mg/l terhadap Perkembangan Nodul Embrio Pisang KepokKuning………. 27
3.1 Percobaan II. Pengaruh Konsentrasi Thidiazuron dengan dan tanpa Benziladenin terhadap Perbanyakan Embrio Pisang Raja Bulu secarain vitro……… 27
3.3.1 Tempat dan Waktu Penelitian………..………... 27
3.3.2 Metode Penelitian……….. 27
3.3.3 Bahan Tanam………. 28
3.3.4 Penanaman Eksplan……….. 28
3.3.5 Pengamatan……… 29
IV. HASIL DAN PEMBAHASAN………. 30
4.1 Hasil Penelitian….……… 30
3.1 Percobaan I. Pengaruh Konsentrasi Thidiazuron dengan dan tanpa Benziladenin terhadap Perbanyakan Tunas Pisang Kepok Kuning secarain vitro……….………. 30
4.1.1.1 Perkembangan Umum Kultur……….. 30
4.1.1.2 Rekapitulasi Analisis Data………... 33
4.1.1.3 Rata-rata Jumlah Mata Tunas………. 34
4.1.1.4 Rata-rata Jumlah Tunas……… 34
4.1.1.5 Rata-rata Jumlah Propagul………. 35
4.1.2 Percobaan Lanjutan: Pengaruh TDZ 0,1 mg/l dan
TDZ 0,1 mg/l + BA 2 mg/l terhadap Perkembangan Nodul Embrio
Pisang Kepok Kuning……… 38
3.1 Percobaan II. Pengaruh Konsentrasi Thidiazuron dengan dan tanpa Benziladenin terhadap Perbanyakan Embrio Pisang Raja Bulu secarain vitro….……….. 40
4.1.3.1 Perkembangan Umum Kultur……….. 40
4.1.3.2 Rekapitulasi Analisis Data………... 41
4.1.3.3 Penampilan Visual Kultur……… 43
4.2 Pembahasan………. 45
V. KESIMPULAN DAN SARAN……….. 52
5.1 Kesimpulan……….. 52
5.2 Saran……… 53
PUSTAKA ACUAN..………... 54
LAMPIRAN……….. 59
DAFTAR TABEL
Tabel Halaman
1. Perlakuan yang diujikan pada penelitin. .……….. 21
2. Rekapitulasi analisis ragam pengaruh konsentrasi TDZ dan BA pada pertumbuhan dan perkembangan kultur pisang Kepok Kuning
pada umur 10 MSP (minggu setelah perlakuan). ………. 35
3. Rekapitulasi analisis ragam pengaruh konsentrasi TDZ dan BA pada pertumbuhan dan perkembangan kultur pisang Raja Bulu
pada umur 10 MSP (minggu setelah perlakuan). ……….…..…….. 42
4. Formulasi Media Murashige dan Skoog (MS). ……… 60
5. Hasil pengamatan jumlah mata tunas pisang Kepok Kuning
umur 10 MSP (minggu setelah perlakuan). .………... 61
6. Hasil uji Barlet jumlah mata tunas pisang Kepok Kuning
umur 10 MSP (minggu setelah tanam). .……….. 61
7. Analisis ragam untuk rata-rata jumlah mata tunas pada kulturin vitropisang Kepok Kuning umur 10 MSP (minggu setelah perlakuan) sebagai respon
terhadap konsentrasi TDZ dan BA. ..……… 61
8. Rata-rata jumlah mata tunas pisang Kepok Kuning 10 MSP (minggu setelah perlakuan) sebagai respons konsentrasi TDZ dan BA. Nilai tengah yang diikuti huruf yang sama tidak berbeda nyata dengan
uji BNT pada α 0,05. .………. 62
9. Hasil pengamatan jumlah tunas pisang Kepok Kuning
umur 10 MSP (minggu setelah perlakuan). .……….. 62
10. Hasil uji Barlet jumlah tunas pisang Kepok Kuning
11. Analisis ragam untuk rata-rata jumlah tunas pada kulturin vitropisang Kepok Kuning umur 10 MSP (minggu setelah perlakuan) sebagai respon terhadap
konsentrasi TDZ dan BA. ………. 63
12. Rata-rata jumlah tunas pisang Kepok Kuning 10 MSP (minggu setelah perlakuan) sebagai respons konsentrasi TDZ dan BA. Nilai tengah yang diikuti huruf yang sama tidak berbeda nyata
dengan ujiBNT pada α 0,05. .……….. 63
13. Hasil pengamatan jumlah propagul pisang Kepok Kuning
umur 10 MSP (minggu setelah perlakuan). ………. 63
14. Hasil uji Barlet jumlah propagul pisang Kepok Kuning
umur 10 MSP (minggu setelah perlakuan). ………. 64
15. Analisis ragam untuk rata-rata jumlah propaguL pada kulturin vitropisang Kepok Kuning umur 10 MSP (minggu setelah perlakuan) sebagai respon
terhadap konsentrasi TDZ dan BA. ….………. 64
16. Rata-rata jumlah propagul pisang Kepok Kuning 10 MSP (minggu setelah perlakuan) sebagai respons konsentrasi TDZ dan BA. Nilai tengah yang diikuti huruf yang sama tidak berbeda nyata
dengan uji BNT pada α 0,05. ……….……….. 64
17. Hasil pengamatan jumlah propagul pisang Raja Bulu
umur 8 MSP (minggu setelah perlakuan). ………..……. 65
18. Hasil uji Barlet jumlah propagul pisang Raja Bulu
umur 8 MSP (minggu setelah perlakuan). ………... 65
19. Analisis ragam untuk rata-rata jumlah propagul pada kulturin vitropisang Raja Bulu umur
8 MSP (minggu setelah perlakuan) sebagai respon
terhadap konsentrasi TDZ dan BA. ..……… 65
20. Rata-rata jumlah propagul pisang Raja Bulu 8 MSP (minggu setelah perlakuan) sebagai respons konsentrasi TDZ dan BA. Nilai tengah yang diikuti huruf yang sama tidak berbeda nyata
DAFTAR GAMBAR
Gambar Halaman
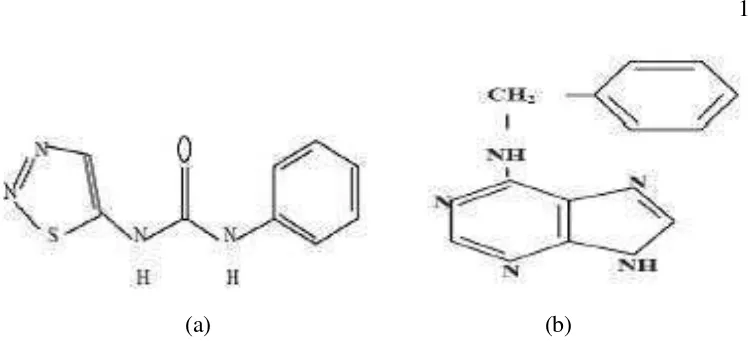
1. Rumus bangun (a) thidiazuron (TDZ) dan (b) benziladenin (BA). .… 19
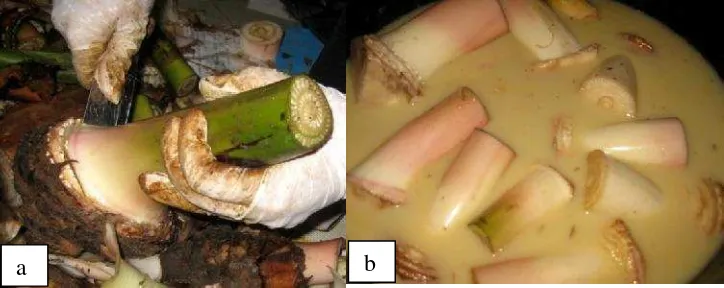
2. Bahan eksplan pisang Kepok Kuning yang digunakan (a) bonggol pisang (umur ± 5 bulan) sebagai sumber
eksplan dan (b) bagian meristem yang diambil. ……… 24
3. Proses pengambilan eksplan pisang Kepok Kuning (a) pembentukan sudut 450dan (b) proses perendaman
dengan larutan fungisida. ……….. 25
4. Proses penanaman ekslpan pisang Kepok Kuning (a) pengecilan eksplan dan (b) penanaman ke
media prekondisi. ………. 26
5. Eksplan embrio somatik pisang Raja Bulu yang
digunakan sebagai bahan tanam. ………..………… 28
6. Proses penanaman eksplan pisang Raja Bulu yaitu (a) pemotongan, (b) penyeragaman ukuran, dan
(c) penanaman. ……….. 29
7. Penampilan eksplan pisang Kepok Kuning pada (a) 0 MST,
dan (b) 4 MST (minggu setelah tanam). …………,,………. 31
8. Penampilanblackningpada eksplan pisang Kepok Kuning
(a) 4 MSPdan (b) 10 MSP (minggu setelah perlakuan). ……….. 31
9. Penampilan eksplan pisang Kepok Kunming (a) pencacahan pada umur 4 MSP dan
(b) mengalami dominansi apikal 6 MSP. .………. 32
10. Penampilan eksplan pisang Kepok Kuning yang menunjukkan respons dengan terbentuknya mata tunas
11. Rata-rata jumlah tunas pisang Kepok Kuning
10 MSP (minggu setelah perlakuan) sebagai respons konsentrasi TDZ. Nilai tengah yang diikuti dengan huruf yang sama tidak berbeda nyata dengan
uji BNT pada α 0,05. ……… 35
12. Rata-rata jumlah propagul pisang Kepok Kuning 10 MSP (minggu setelah perlakuan) sebagai respons konsentrasi TDZ. Nilai tengah yang diikuti dengan huruf yang sama tidak berbeda nyata dengan
uji BNT pada α 0,05. …..………. 36
13. Perkembangan eksplan pisang Kepok Kuning pada umur 10 MSP (a) TDZ 0,005 mg/l,
(b) TDZ 0,005 mg/l + BA 2 mg/l, (c) TDZ 0,01 mg/l, (d) TDZ 0,01 mg/l + BA 2 mg/l, (e) TDZ 0,05 mg/l, (f) TDZ 0,05 mg/l + BA 2 mg/l, (g) TDZ 0,1 mg/l, dan
(h) TDZ 0,1 mg/l + BA 2 mg/l. ………. 37
14. Penampilan eksplan pisang Kpok Kuning yang membentuk nodul embrio somatik pada
(a) TDZ 0,1 mg/l dan (b) TDZ 0,1 mg/l + BA 2 mg/l
umur 10 MSP. ………... 39
15. Penampilan nodul embrio somatik pada
(a) TDZ 0,1 mg/l dan (b) TDZ 0,1 + BA 2 mg/l
umur 4 MST (minggu setelah transfer). ..………. 39
16. Penampilan nodul embrio somatik pisang Kepok Kuning
satuclumumur 20 MST pada media TDZ 0,1 mg/. .………... 39
17. Penampilan embrio somatik pisang Raja Bulu pada
(a) sumber eksplan (b) 0 MST. ……….... 41
18. Penampilan eksplan embrio somatik pisang
Raja Bulu umur 4 MSP dan (b) 8 MSP. ……… 41
19. Rata-rata jumlah propagul pisang Raja Bulu 8 MSP (minggu setelah perlakuan) sebagai respons konsentrasi TDZ dan BA. Nilai tengah yang diikuti dengan huruf yang sama tidak berbeda nyata dengan uji BNT pada
viii
20. Perkembangan embrio somatik pisang Raja Bulu pada umur 8 MSP (a) TDZ 0,005 mg/l,
(b) TDZ 0,005 mg/l + BA 2 mg/l, (c) TDZ 0,01 mg/l, (d) TDZ 0,01 mg/l + BA 2 mg/l, (e) TDZ 0,05 mg/l, (f) TDZ 0,05 mg/l + BA 2 mg/l, (g) TDZ 0,1 mg/l, dan
1.1 Latar Belakang dan Masalah
Pisang (Musasp.) merupakan salah satu komoditas hortikultura yang berasal dari
Asia Tenggara, dan telah tersebar ke seluruh dunia termasuk Indonesia. Tanaman
pisang memiliki ciri-ciri yaitu batang (bonggol) berada di dalam tanah, batang
semu berlapis-lapis, dan daunnya berbentuk lembaran yang lebar, serta bunga dan
buahnya yang tersusun dalam sisiran tandan (Sunarjono, 2002). Buah pisang
sangat digemari oleh masyarakat Indonesia, baik dikonsumsi dalam kondisi segar
maupun dalam berbagai produk olahan. Menurut Prayoga (2010), buah pisang
mengandung gizi yang sangat baik, antara lain energi yang cukup tinggi yaitu 138
kal/100 g buah segar. Buah pisang kaya akan mineral (kalium, magnesium,
fosfor, besi dan kalsium), mengandung vitamin (C, B kompleks, B6) dan
mengandung serotonin yang aktif sebagai neurotransmiter dalam kelancaran
fungsi otak. Bagian yang dapat dimakan dari pisang adalah sebesar 70%,
sementara kandungan zat gizi pisang per 100 gram adalah kalori 92 kkal, protein
1,00 gram dan lemak 0,30 gram (Jatmiko dkk., 2011).
Berdasarkan data FAO 2013, Indonesia menempati urutan ke 6 dengan total
produksi pisang 6.189.052 ton. India menempati urutan pertama dengan total
2
9.225.998 ton, Ekuador dengan 7. 012.244, dan Brasil dengan 6.902.184 ton
(Indian Horticulture Database, 2014). Berdasarkan data Badan Pusat Statistik
(2014) total produksi pisang di Indonesia mencapai 5, 35 juta ton. Namun hasil
tersebut belum dapat memenuhi kebutuhan konsumsi dalam negeri. Hal ini
disebabkan oleh masih rendahnya produksi buah pisang dalam negeri. Lampung
sendiri termasuk penyedia pisang terbesar ketiga setelah Jawa Timur dan Jawa
Barat. Perkembangan konsumsi pisang selama periode 2002-2012 berfluktuasi,
secara umum rata-rata konsumsi rumah tangga pisang selama periode tersebut
mengalami penurunan sebesar 1,71% per tahun atau konsumsi rata-rata sebesar
7,67 kg/kapita/tahun. Pada tahun 2012 produksi pisang mencapai 6.071.043 ton,
akan tetapi terjadi penurunan yang sangat besar pada tahun 2013 dengan produksi
yang dihasilkan yaitu 5.359.126 ton (BPS, 2014).
Ketersediaan bibit pisang yang bermutu tinggi, bebas penyakit, seragam, dan
dalam jumlah besar adalah masalah umum yang dialami petani pisang untuk
meningkatkan produksi pisang guna memenuhi kebutuhan baik dalam negeri
maupun ekspor. Perbanyakan tanaman pisang secara konvensional dengan
bonggol atau anakan akan menghasilkan bibit dalam waktu yang lama dan
jumlahnya terbatas (satu rumpun hanya menghasilkan 5–10 bibit per tahun)
(Semarayani dkk., 2012).
Salah satu upaya untuk mengatasi hal tersebut maka dilakukan perbanyakan
tanaman dengan teknik kultur jaringan. Kultur jaringan adalah suatu metode
untuk mengisolasi bagian-bagian tanaman seperti sel, jaringan atau organ serta
sehingga bagian-bagian tanaman tersebut dapat memperbanyak diri dan
beregenerasi menjadi tanaman lengkap kembali. Prinsip kultur jaringan terdapat
pada teori sel yang dikemukakan oleh dua orang ahli biologi dari Jerman yaitu M.
J. Schleiden dan T. Schwan. Teori sel tersebut biasa dikenal dengan teori
totipotensi sel. Menurut teori ini, setiap sel tanaman hidup mempunyai informasi
genetik dan perangkat fisiologis yang lengkap untuk dapat tumbuh dan
berkembang menjadi tanaman utuh, jika kondisinya sesuai (Yusnita, 2003). Bibit
hasil kultur jaringan diharapkan bersifattrue-to-typeyang tersedia dalam jumlah
besar dan waktu yang relatif singkat.
Salah satu faktor penentu keberhasilan perbanyakan tanaman secara kultur
jaringan adalah penggunaan zat pengatur pertumbuhan (ZPT) yang tepat. ZPT
adalah senyawa organik bukan hara yang dalam konsentrasi rendah dapat
mempengaruhi pertumbuhan dan perkembangan tanaman. ZPT yang banyak
digunakan dalam teknik kultur jaringan adalah golongan sitokinin dan auksin.
Penggunaan sitokinin dalam konsentrasi yang tepat dapat merangsang
terbentuknya tunas pada tanaman. Jenis sitokinin yang banyak digunakan adalah
thidiazuron (TDZ) dan benziladenin (BA) (Yusnita, 2003).
Penelitian Swandra dkk. (2012) menyatakan bahwa jumlah tunas Andalas (Morus
macrouroMiq) terbanyak diperoleh pada konsentrasi 0,5 mg/l TDZ yaitu
sebanyak 12,67. Penambahan 3,0 mg/l BA ke dalam media MS dapat
menginduksi jumlah tunas Piretrum klon Prau-6 sebanyak 6,2 tunas dan 3,0 mg/l
TDZ menginduksi sebnyak 7,6 tunas (Rostiana, 2007). Penggunaan TDZ dengan
4
(Darvary dkk., 2010). Menurut Roy dkk. (2010), penggunaan TDZ dengan
konsentrasi 0,11 mg/l dapat menghasilkan jumlah tunas pisang Malbhog sebanyak
45 tunas per eksplan. Kombinasi 4 mg/l BA dan 0,4 TDZ mg/l dapat
menghasilkan tunas per eksplan sebanyak 29,40±6,10 tunas (Kumar dkk., 2011).
Oleh karena itu dalam penelitian ini akan dipelajari pengaruh pemberian TDZ dan
kombinasi TDZ + BA terhadap perbanyakan tunas pisang Kepok Kuning dan Raja
Bulu secarain vitro. Berdasarkan pembatasan masalah, penelitian ini dilakukan
untuk menjawab masalah yang dirumuskan dalam pertanyaan sebagai berikut:
1. Bagaimana pengaruh peningkatan konsentrasi TDZ terhadap perbanyakan
tunas pisang Kepok Kuning dan embrio pisang Raja Buluin vitro?
2. Berapa konsentrasi TDZ terbaik untuk perbanyakan tunas pisang Kepok
Kuning dan embrio pisang Raja Buluin vitro?
3. Berapa konsentrasi TDZ dengan pemberian BA yang menghasilkan tunas
pisang Kepok Kuning dan embrio pisang Raja Buluin vitroterbaik?
1.2 Tujuan Penelitian
Berdasarkan perumusan masalah, tujuan dari penelitian ini adalah sebagai berikut:
1. Mengetahui pengaruh peningkatan konsentrasi TDZ terhadap perbanyakan
tunas pisang Kepok Kuning dan embrio pisang Raja Buluin vitro.
2. Memperoleh konsentrasi TDZ terbaik untuk perbanyakan tunas pisang Kepok
Kuning dan embrio pisang Raja Bulu secarain vitro.
3. Memperoleh konsentrasi TDZ dengan pemberian BA yang menghasilkan tunas
1.3 Landasan Teori
Sebagian besar kultivar pisang berasal dari dua jenis pisang liar yaituMusa
acuminata(genom A) danMusa balbisiana(genom B), yang terbentuk karena
terjadinya persilangan. Persilangan tersebut terjadi secara hibridisasi alami dan
maupun campur tangan manusia (Yusnita, 2015). Pisang Kepok Kuning dan Raja
Bulu merupakan hasil persilangan antaraM. acuminatadanM. balbisianadiduga
telah mengalami hibridisasi interspesifik alami yang menghasilkan hibrida pisang
yang lebih keras dan tahan kekeringan.
Menurut Sukartini (2007), pisang Kepok Kuning mengandung genom ABB,
pernyataan ini sesuai dengan Yusnita (2003), sedangkan pisang Raja Bulu
mengandung genom AAB (Yusnita, 2015). Pada kultur in vitro, pisang dengan
genom AAA jauh lebih banyak menghasilkan tunas dibandingkan pisang dengan
genom AAB yaitu 14,6 tunas per eksplan (AAB) dan 46 tunas per eksplan (AAA)
(Ismaryati, 2009). Huruf besar “A” dan “B” masing-masing menggambarkan
banyaknya genom (kelompok kromosom) yang berasal dari nenek moyong pisang
diploid yaituM. acuminatadanM. balbisiana(Sunarjono, 2002).
Pisang yang mengandung genom B cenderung lebih sulit untuk berinisiasi dan
menghambat regenerasi tunas. Hal ini disebabkan pisang dengan genom B
menghasilkan senyawa fenol yang lebih banyak. Senyawa fenol ini menyebabkan
terjadinyabrowningatau pencoklatan pada media. Semakin banyak kandungan
genom B pada pisang maka semakin banyak senyawa fenol yang dihasilkan
6
menghambat penyerapan zat makanan dari media. Senyawa fenol terbentuk
akibat dari pelukaan yang terdapat pada permukaan eksplan.
Sitokinin adalah senyawa adenin lain yang memacu pembelahan sel (sitokinesis)
pada sistem jaringan tumbuhan (Salisbury dan Ross, 1995). Sitokinin mendorong
pembelahan sel dalam kultur jaringan dengan cara meningkatkan peralihan dari
fase G2ke fase mitosis yang terjadi karena sitokinin menaikkan laju sintesis
protein (George dkk., 2008; Salisbury dan Ross, 1995). Sintesis protein dapat
ditingkatkan dengan memacu pembentukan mRNA yang menyandikan protein
berupa protein pembangun atau protein yang dibutuhkan untuk mitosis. Produksi
protein inti dipacu oleh sitokinin melalui translasi di sitosol. Selain itu, sitokinin
mengubah tingkat mRNA yang disebabkan transkripsi beberapa gen terpacu dan
transkripsi gen lain tertekan. Sitokinin mempengaruhi jumlah molekul mRNA
yang menyandikan beberapa protein yang sudah dikenal. Namun, sitokinin justru
meningkatkan kestabilan mRNA sehingga mempercapat translasi pesan genetik
menjadi protein. Oleh sebab itu, sitokinin dapat mempengaruhi transkripsi,
kestabilan mRNA, dan translasi pada beberapa spesies dan bagian lain tumbuhan
(Salisbury dan Ross, 1995).
Zat tumbuh bereaksi dengan protein dari plasma membran sehingga bentuk
protein akan berubah yang selanjutnya mengubah sifat-sifat permeabilitas
membran air, ion-ion anorganik, atau molekul-molekul organik akan keluar atau
memasuki sel dan mengubah tekanan osmotik sel. Perubahan ini mempengaruhi
proses-proses biokimia sel dan reaksi-reaksi sekunder yang akhirnya
pembentukan organ tanaman, perubahan komposisi kimia, dan lain-lain. Zat
tumbuh dapat mengikat membran protein yang berpotensi untuk aktivitas enzim.
Pengikatan ini dapat mengaktifkan enzim dan mengubah substrat-substrat menjadi
satu atau beberapa produk baru yang menyebabkan reaksi-reaksi sekunder yang
akhirnya menunjuk kepada respon fisiologis yang dapat dilihat (Wattimena,
1987).
Penambahan sitokinin diharapkan mampu mempercepat terbentuknya tunas baru.
Berdasarkan hasil penelitian Gubbuk dan Pekmezci (2004), jenis sitokinin dan
konsentrasinya sangat berpengaruh terhadap multiplikasi dan perpanjangan tunas
pisang. Penelitian yang dilakukan oleh Lee (2005) menyatakan bahwa
peningkatan konsentrasi TDZ (0.002, 0.02, 0.2, dan 2.0 mg/l) menyebabkan
terjadinya peningkatan jumlah tunas pisang. Sebanyak 7.3 tunas pada kultivar Pei
Chiao (AAA) dan 4.4 tunas Latundan (ABB) yang diberi perlakuan 2.0 mg/l TDZ.
Berdasarkan hasil penelitian Youmbi dkk (2006), perlakuan TDZ dengan
konsentrasi 0.05, 0.1, 0.2, 0.4, 0.8 µM atau 0.01, 0.02, 0.04, 0.08, 0.17 mg/l
menunjukkan proliferasi tunas yang lebih baik. Hasil penelitian Kasutjianingati
dkk. (2010) menyatakan bahwa penambahan TDZ dengan konsentrasi 0,09 mg/l
dalam media MS + 2 mg/l BA + 3 mg/l IAA dapat mempercepat pertumbuhan
tunas aksilar pisang Raja Bulu 1 bulan lebih cepat. Tunas pisang Raja Bulu yang
dihasilkan sebanyak 4,3 tunas per eksplan berasal dari media induksi + TDZ
(Kasutjianingati dkk., 2011).
Pemberian TDZ 0,04 mg/l ke dalam media MS menghasilkan jumlah tunas lebih
8
2008). Penambahan 0,01 mg/l TDZ ke dalam media yang mengandung 2 mg/l
BA dapat meningkatkan jumlah propagul pisang Tanduk sebesar 10 kali lipat.
Peningkatan jumlah propagul pisang Tanduk sebanyak 40 propagul per eksplan
(Yusnita dan Hapsoro, 2013). Berdasarkan penelitian Lisnandar dkk. (2015),
perlakuan BA yang terbaik untuk membentuk nodul pada pisang Kepok adalah 3
mg/l BA dengan rata-rata jumlah nodul 1,93 nodul. Sedangkan untuk pisang Raja
Bulu pada BA konsentrasi 3 mg/l dan 5 mg/l dihasilkan rata-rata 0,3 dan 0,72
nodul.
1.4 Kerangka Pemikiran
Berdasarkan landasan teori yang telah dikemukakan, berikut disusun kerangka
pemikiran untuk memberikan penjelasan terhadap rumusan masalah.
Pisang Kepok Kuning dan Raja Bulu merupakan hasil persilangan alami antara
Musa acuminatadanMusa balbisiana. Hasil persilangan tersebut menghasilkan
kultivar pisang dengan genom AAB dan ABB. Pisang dengan kandungan genom
B sulit untuk diinisiasi dan menghasilkan tunas yang sedikit. Hal ini disebabkan
oleh kandungan senyawa fenol yang tinggi. Senyawa fenol terbentuk akibat
pelukaan yang terjadi pada permukaan eksplan. Senyawa fenol ditandai dengan
munculnya warna cokelat dan hitam di sekitar eksplan yang di tanam pada media
kultur. Senyawa ini bersifat toksik dan mengganggu pertumbuhan dan
perkembangan tanaman. Oleh sebab itu diperlukan komposisi media yang tepat
untuk perbanyakan pisang Kepok Kuning dan Raja Bulu serta mencegah tanaman
Sitokinin merupakan zat pengatur tumbuh yang digunakan untuk perbanyakan
tunas dalam kultur jaringan. Dalam sel sitokinin berperan dalam mendorong
pembelahan sel. Sitokinin menyebabkan transkripsi beberapa gen terpacu
sehingga menyebabkan terjadinya perubahan tingkat mRNA. Namun, sitokinin
juga meningkatkan kestabilan mRNA yang menyebabkan translasi pesan genetik
menjadi protein meningkat. Peningkatan laju translasi menyebabkan laju sintesis
protein meningkat sehingga mempersingkat waktu berlangsungnya fase S dalam
daur sel yaitu pada tahap sintesis DNA. Protein yang terbentuk akan bereaksi
dengan zat tumbuh sehingga mengubah sifat-sifat fisik protein seperti
mengembang dan mengkerut. Selain itu, sitokinin juga mengubah tekanan
osmotik sel yang mempengaruhi proses biokimia dalam sel sehingga
menghasilkan respon tumbuh seperti pembengkokan, pembentukan organ
tanaman (tunas), dan perubahan komposisi kimia.
Thidiazuron (TDZ) dan benziladenin (BA) merupakan jenis sitokinin yang banyak
digunakan dalam kultur jaringan. Beberapa penelitian menunjukkan peningkatan
konsentrasi TDZ dapat meningkatkan jumlah tunas pisang pada perbanyakan
tunas pisangin vitro. Dengan konsentrasi 2,0 mg/l dapat meningkatkan jumlah
tunas, bahkan dengan konsentrasi 0,09 mg/l dapat menghasilkan tunas pisang
sebnyak 4,3 tunas. Beberapa penelitian juga menunjukkan penambahan BA dapat
meningkatkan jumlah tunas pisang. Penambahan BA 3 mg/l ke dalam media
dapat membentuk nodul embrio somatik pada pisang Kepok dan Raja Bulu.
Namun keefektifan TDZ lebih baik dari BA, dengan konsentrasi rendah TDZ
dapat meningkatkan jumlah tunas. Oleh sebab itu, dilakukan tindakan untuk
10
ini terbukti dengan penambahan TDZ 0,01 ke dalam media yang mengandung BA
2 mg/l dapat meningkatkan jumalah propagul 10 kali lipat.
1.5 Hipotesis
Berdasarkan kerangka pemikiran, maka penulis mengajukan hipotesis sebagai
berikut.
1. Peningkatan konsentrasi TDZ tunggal dapat meningkatkan perbanyakan tunas
pisang Kepok Kuning dan embrio pisang Raja Buluin vitro.
2. Pemberian BA dan TDZ dapat menghasilkan jumlah tunas pisang Kepok
Kuning dan embrio pisang Raja Buluin vitrolebih banyak dibandingkan
2.1 Botani Tanaman Pisang
Pisang adalah salah satu komoditas buah unggulan Indonesia yang terdiri atas
lebih dari 200 kultivar pisang (Wibowo dkk., 2009). Pisang memiliki nama yang
berbeda di setiap daerahnya seperti banana untuk Inggris, babanier untuk Prancis,
chuoi untuk Vietnam, dan xiang chiao untuk Cina (Nakasone dan Paull, 2010).
Tanaman ini diduga berasal dari Asia Selatan dan Asia Tenggara dan hingga kini
tersebar luas ke negara beriklim tropis dan subtropis (Suyanti dan Supriyadi,
2008).
Banyak negara mengonsumsi pisang sebagai makanan pokok. Indonesia, Brasil,
Filipina, Panama, Honduras, India, Equador, Thailand, Karibia, Hawai, serta
negara-negara Afrika dikenal sebagai sentra produksi pisang di dunia (Suyanti dan
Supriyadi, 2008). Pisang dapat dikonsumsi segar atau dalam bentuk olahan.
Kualitas buah pisang akan mempengaruhi harga di pasaran. Buah dengan kualitas
baik seperti mulus tanpa cacat, tingkat ketuaan dan kematangan optimal,
penampilan menarik, besar dan padat akan memiliki harga yang lebih tinggi
12
Klasifikasi pisang secara umum menurut Suyanti dan Supriyadi (2008) dan
plantamor (2014) adalah.
Kingdom : Plantae
Subkingdom : Tracheobionta
Divisio : Magnoliophyta
Kelas : Monocotyledone
Subkelas : Commelinidae
Ordo : Zingiberales
Familia : Musaceae
Genus :Musa
Spesies :Musa paradisiacaLinn.
Kandungan vitamin pisang sangat tinggi seperti provitamin A yang berupa
betakaroten sebayak 45 mg dalam 100 g berat kering. Pisang juga mengandung
vitamin B yaitu tiamin, riboflavin, niasin, dan piridoksin sebesar 0,5 mg. Selain
itu pisang juga mengandung mineral yaitu kalium yang diperkirakan
menyumbang 440 mg. Kalium berfungsi untuk menjaga keseimbangan air dalam
tubuh, kesehatan jantung, tekanan darah, dan membantu pengiriman oksigen ke
otak (Suyanti dan Supriyadi, 2008).
Terdapat tiga jenis tanaman pisang di Indonesia yaitu pisang hias, pisang serat dan
pisang buah yang banyak dikonsumsi dan bernilai ekonomi tinggi. Pisang yang
memiliki nilai ekonomi tinggi dan digemari masyarakat yaitu Ambon Kuning
(AAA), Ambon Lumut (AAA), Ambon Putih (AAA), Barangan (AAA), Raja
Pisang kepok merupakan pisang jenisplantain. Bentuk buahnya agak pipih
karenanya sering disebut pisang gepeng dan memiliki kulit tebal. Berat per
tandan dapat mencapai 22 kg, jumlah sisirnya 10-16 sisir. Setiap sisir terdiri dari
12-20 buah. Bila matang warna kulit buahnya kuning penuh. Pisang kepok yang
terkenal diantaranya pisang Kepok Putih dan Kepok Kuning. Pisang Kepok putih
memiliki warna daging buah putih dan pisang Kepok Kuning daging buahnya
berwarna kuning. Pisang Kepok Kuning rasa buahnya lebih enak dibandingkan
Kepok Putih sehingga lebih disukai dan harganya lebih mahal (Prabawati dkk.,
2008).
Pisang Raja Bulu atau dikenal dengan pisang Raja termasuk buah yang dapat
digunakan sebagai buah meja dan bahan baku produk olahan atau campuran
dalam pembuatan kue. Pisang Raja Bulu memiliki bentuk buah lurus agak
melengkung dengan ujung buah sedikit tumpul. Panjang buah berkisar antara
10-17 cm dengan bobot buah 160-10-170 gram. Daging buah berwarna kuning
kemerahan bertekstur lunak dan tidak berbiji serta rasanya sangat manis. Setiap
tandan memiliki berat berkisar 4-22 kg dengan jumlah sisir 6-7 sisir dan jumlah
buah 10-16 setiap sisir. Pisang Raja Bulu mengandung karoten lebih tinggi dan
gula yang rendah dibanding pisang lain. Pisang Raja Bulu baik untuk dikonsumsi
bagi penderita diabetes (Pusat Kajian Buah Tropika, 2005; Prabawati dkk., 2008).
2.2 Perbanyakan Tanaman secara Konvensional
Tanaman pisang memiliki ciri khas berbatang semu, sedangkan batang
sesungguhnya berada di bawah tanah yang biasa disebut dengan bonggol. Batang
14
bonggol terdapat mata-mata tunas yang akan tumbuh menjadi anakan pisang yang
dapat tumbuh dan berkembang menjadi tanaman dewasa (Yusnita, 2015).
Bibit pisang umumnya diperbanyak secara konvensional oleh petani.
Perbanyakan secara konvensional menggunakan anakan (sucker) dan belahan
bonggol (bit). Jumlah bibit yang dapat dihasilkan dari anakan relatif sedikit, yaitu
5-12 anakan/rumpun/tahun. Dengan belahan bonggol ataubitdalam satu rumpun
dengan lima bonggol berdiameter 15 cm dapat dihasilakan 10-20 bibit (Yusnita,
2015).
Menurut Isnaeni (2008), perbanyakan bibit unggul secara konvensional belum
dapat memenuhi kebutuhan bibit pisang skala perkebunan besar. Yusnita (2015)
menyatakan bahwa bibit pisang yang berasal dari anakan dan belahan bonggol
berpotensi membawa inokulum pathogen penyebab berbagai penyakit seperti
cendawanFusarium oxysporumf.sp.cubenseatau bakteri penyebab layu
Ralstonia solanacearum. Selain itu, kelemahan bibit secara konvensional adalah
tidak seragam.
2.3 Perbanyakan Tanaman secaraIn Vitro
Kultur jaringan adalah membudidayakan jaringan tanaman menjadi tanaman kecil
yang mempunyai sifat seperti induknya dalam kondisi aseptik. Teknik kultur
jaringan sangat bermanfaat dalam mengatasi kendala pada perbanyakan tanaman
yang tidak dapat dilakukan secara konvensional seperti tanaman anggrek yang
memiliki biji mikroskopis atau kelapa sawit yang memiliki biji berkulit keras.
alternatif yang tidak dapat dihindari jika penyediaan bibit tanaman harus
dilakukan dalam skala besar dan dalam waktu yang relatif singgkat (Yusnita,
2003). Prinsip dasar kultur jaringan adalah teori totipotensi sel, yaitu kemampuan
suatu sel untuk beregenarasi menjadi tanaman utuh (Iliev dkk., 2010).
Keunggulan teknik perbanyakan tanaman dengan kultur jaringan adalah mampu
menghasilkan bibit tanaman dalam jumlah banyak dengan waktu yang relatif
singkat, bebas patogen, dapat dilakukan sepanjang tahun, tidak memerlukan
tempat yang luas, dan bibit yang dihasilkan bersifattrue-to type(Windiastika,
2013; Yusnita, 2003). Manfaat utama perbanyakan tanaman secara kultur
jaringan adalah untuk perbanyakan vegetatif tanaman yang permintaannya tinggi
tetapi pasokannya rendah, karena laju perbanyakan secara konvensional
diannggap lambat (Yusnita, 2003).
Menurut Yusnita (2003), pembiakan tanaman dengan kultur jaringan dibagi
menjadi beberapa tahap secara berurutan sebagai berikut.
1. Tahap 0, memilih dan menyiapkan tanaman induk untuk eksplan.
2. Tahap 1, inisiasi kultur atauculture establisment.
3. Tahap 2, multiplikasi atau perbanyakan propagul (bahan tanaman yang
diperbanyak seperti tunas atau embrio).
4. Tahap 3, mempersiapkan untuk transfer propagul ke lingkungan eksternal
yaitu pemanjangan tunas, induksi, dan perkembangan akar.
5. Tahap 4, aklimatisasi planlet ke lingkungan luar.
Keberhasilan perbanyakan tanaman dengan kultur jaringan ditentukan oleh
16
eksplan (bentuk regenerasi dalam kultur, genetik, dan umur ontogenetik), metode
pembiakanin vitrodan media tumbuh, zat pengatur tumbuh (ZPT) yang
digunakan, dan lingkungan tumbuh kultur yang mempengaruhi regenerasi
tanaman seperti suhu, panjang dan intensitas penyinaran. Intensitas cahaya
optimum untuk tahap inisiasi adalah 0-1.000 lux, tahap multiplikasi sebesar
1.000-10.000 lux, tahap pengakaran sebesar 10.000-30.000 lux, dan tahap
aklimatisasi sebesar 30.000 lux (Yusnita, 2003; Yuliarti, 2010).
Eksplan adalah bahan tanaman yang akan dikulturkan. Kualitas eksplan
menentukan keberhasilan eksplan. Eksplan yang sehat danvigiorous
memungkinkan untuk menghasilkan kultur yang baik. Bagian tanaman yang
umum digunakan adalah jaringan muda yang sedang tumbuh aktif. Bagian
tanaman yang banyak digunakan sebagai eksplan adalah kalus, sel, protoplas,
tunas pucuk, bunga, potongan daun, potongan akar, umbi, biji atau bagian-bagian
biji seperti aksis embrio atau kotiledon. Pada kulturin vitrotanaman pisang, yang
diambil sebagai eksplan adalah bagian bonggol tempat anakan atau mata tunas
muncul (Yusnita, 2003; Yuliarti, 2010).
Media tumbuh kultur merupakan salah satu syarat agar kultur berjalan baik
(George dkk., 2008). Secara fisik media kultur dibagi menjadi dua yaitu media
cair dan media padat (Yusnita, 2003). Dalam media terkandung komponen yang
mendukung pertumbuhan dan perkembangan eksplan. Komponen dalam media
kultur yaitu hara makro dan mikro, sukrosa sebagai sumber energi, aquades
sebagai pelarut, bahan aktif untuk mengaktifkan pertumbuhan, vitamin, asam
Terdapat beberapa komposisi media kultur untuk mengoptimalkan pertumbuhan
dan perkembangan tanaman, seperti komposisi Knudson C (1946), Heller (1953),
Nitsch dan Nitsch (1972), Gamborg dkk. (1976), Linsmaier dan Skoog-LS (1965),
Murashige dan Skoog-MS (1962) serta woody plant medium-WPM (Lloyd dan
McCown, 1980). Namun media yang banyak digunakan adalah komposisi media
MS (Murashige dan Skoog pada tahun 1962) (Tabel 4 pada Lampiran) (Yusnita,
2003).
2.4 Zat Pengatur Pertumbuhan
Zat pengatur tumbuh merupakan senyawa organik bukan hara yang dalam
konsentrasi rendah dapat mendukung, menghambat dan mengubah proses
fisiologi tanaman (Yusnita, 2003). Penggunaan ZPT dalam kultur jaringan
disesuaikan pada tujuan pertumbuhan kultur yang diinginkan (Lestari, 2011).
Yusnita (2003) menyatakan bahwa konsentrasi dan jenis ZPT menjadi salah satu
komponen yang menentukan keberhasilan perbanyakan kultur jaringan.
Salah satu ZPT yang sering digunakan dalam kultur jaringan adalah sitokinin.
Sitokinin dapat meningkatkan pembelahan, pertumbuhan dan perkembangan
kultur sel tanaman. Beberapa macam sitokinin merupakan sitokinin alami
(kinetin dan zeatin) dan beberapa lainnya merupakan sitokinin sintetik.
Peningkatan konsentrasi sitokinin akan menyebabkan sistem tunas membentuk
cabang dalam jumlah yang lebih banyak (Dewi, 2008).
Beberapa fungsi sitokinin menurut George dkk. (2008) adalah:
18
2. Memacu inisiasi tunas pada kultur jaringan.
3. Melemahkan dominansi apikal.
4. Menunda terjadinya penuan pada daun dengan cara mempertahankan
keutuhan membran tonoplas.
5. Meningkatkan pembukaan stomata pada beberapa spesies tanaman.
TDZ (N-phenyl-N’-1-2-3,-thidiazol-5-ylurea) merupakan sitokinin yang memiliki
efektivitas lebih dibanding dengan sitokinin lain dalam kultur jaringan. Dengan
konsentrasi kurang dari 0,1 µM, TDZ menghasilkan proliferasi tunas aksilar lebih
baik (Lee, 2005). Meskipun TDZ memiliki efektivias yang lebih baik namun di
Indonesia relatif sulit diperoleh dan harganya realtif mahal (Yusnita, 2003). TDZ
memiliki bobot molekul sebesar 220,25 g/mol dengan rumus molekul C9H8N4OS
dan rumus bangun pada Gambar 1.
Selain TDZ, BA juga merupakan jenis sitokinin yang sering kali dipakai dalam
kultur jaringan. BA (6-benzylaminopurine/6-benziladenin) memiliki bobot
molekul sebesar 225,26 g/mol dengan rumus bangun pada Gambar 1. Dengan
konsentrasi 0,5-10 mg/l dapat merangsang multiplikasi tunas aksilar dan relatif
mudah diperoleh serta lebih murah dari TDZ (Yusnita dan Hapsoro, 2002;
Gambar 1. Rumus ba
(a) (b)
III. BAHAN DAN METODE
Penelitian ini terdiri atas dua percobaan utama dan satu percobaan lanjutan, yaitu:
1. Pengaruh konsentrasi thidiazuron dengan dan tanpa benziladenin terhadap
perbanyakan tunas pisang Kepok Kuning, dan Pengaruh TDZ 0,1 mg/l dan
TDZ 0,1 mg/l + BA 2 mg/l terhadap Perkembangan nodul embrio somatik
pisang Kepok Kuning.
2. Pengaruh konsentrasi thidiazuron dengan dan tanpa benziladenin terhadap
perbanyakan embrio somatik pisang Raja Bulu.
3.1. Percobaan I. Pengaruh Konsentrasi Thidiazuron dengan dan tanpa Benziladenin terhadap Perbanyakan Tunas Pisang Kepok Kuning
3.1.1 Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan di Laboratorium Ilmu Tanaman, Jurusan
Agroteknologi, Fakultas Pertanian, Universitas Lampung, Bandar Lampung.
Penelitian ini dilaksanakan dari bulan November 2014 sampai Juni 2015.
3.1.2 Metode Penelitian
Perlakuan diterapkan pada satuan percobaan dalam rancangan acak lengkap
(RAL) yang disusun secara faktorial 4x2. Faktor pertama adalah empat taraf
adalah 0 mg/l dan 2 mg/l BA. Delapan perlakuan tersebut ditambahkan ke dalam
media dasar MS (Murashige and Skoog, 1962). Masing-masing perlakuan
diulang lima kali. Setiap satuan percobaan terdiri dari lima botol kultur satu
eksplan/botol. Homogenitas data diuji dengan uji Barlet. Apabila asumsi
terpenuhi, selanjutnya akan dilakukan anlisis ragam. Pemisahan nilai tengah
dilakukan dengan uji beda nyata terkecil (BNT) dengan taraf 5%.
Perlakuan yang diujikan dalam penelitian ini adalah konsentrasi TDZ dan
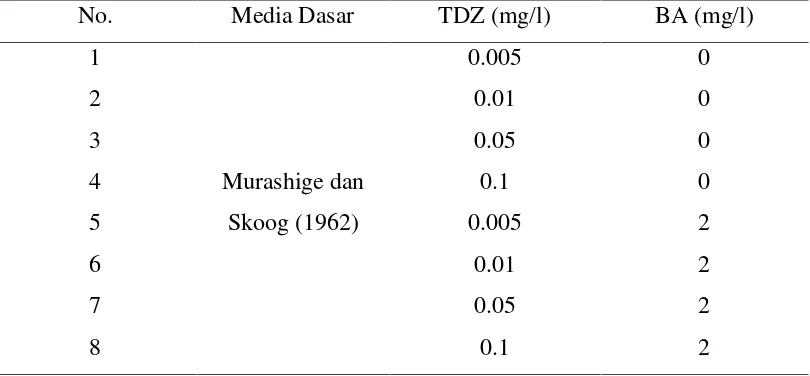
kombinasi antara TDZ dan BA disajikan pada Tabel 1 sebagai berikut.
Tabel 1. Perlakuan yang diujikan pada penelitian.
No. Media Dasar TDZ (mg/l) BA (mg/l)
1
Murashige dan
Skoog (1962)
0.005 0
2 0.01 0
3 0.05 0
4 0.1 0
5 0.005 2
6 0.01 2
7 0.05 2
8 0.1 2
3.1.3 Pelaksanaan Penelitian
3.1.3.1 Sterilisasi Botol Kultur
Sterilisasi botol kultur adalah kegiatan awal yang dilakukan pada teknik kultur
jaringan. Sterilisasi ini dilakukan dengan memasukkan botol kultur ke dalam
autoklaf. Autoklaf yang digunakan adalah autoklaf elektrik. Cara pengoperasian
22
itu kemudian menyusun botol kultur ke dalam autoklaf dengan menggunakan
keranjang hingga penuh. Autoklaf ditutup dan tuas listrik dinaikkan. Waktu
diatur selama 30 menit pada suhu 1210C dengan tekanan 1,2 kg/cm2. Setelah
sterilisasi dengan autoklaf selesai, autoklaf dimatikan dan dibiarkan hingga
tekanan turun menjadi 0 kg/cm2. Botol-botol dikeluarkan dari autoklaf dan
dibersihkan dari media yang ada di dalam botol. Botol kemudian dicuci dengan
menggunakan detergen dan desinfektan (5,25% NaOCl) sebanyak 50%,
selanjutnya dibilas dan direndam dalam larutan detergen dan desinfektan (5,25%
NaOCl) kembali selama satu hari. Keesokan harinya botol-botol dicuci kembali
dan label yang ada pada botol di hilangkan. Setelah itu botol-botol dibilas hingga
bersih dan ditutup dengan plastik dan karet kemudian diautoklaf dengan autoklaf
Tommy selama 30 menit, suhu 121oC dan tekanan 1,2 kg/cm2.
3.1.3.2 Media Kultur
Penelitian ini menggunakan media dasar MS (Murashige and Skoog, 1962).
Terdapat 2 macam media yang digunakan yaitu media prekondisi dan media
perlakuan. Media prekondisi berisi garam-garam MS; 2 mg/l BA; 0,005 mg/l
TDZ; 50 mg/l asam sitrat; dan 150 mg/l asam askorbat. Media perlakuan yang
digunakan adalah media prekondisi dengan dan tanpa 2 mg/l BA serta
penambahan berbagai konsentrasi TDZ sesuai dengan perlakuan.
Pembuatan media dilakukan dengan melarutkan garam-garam MS; 2 mg/l BA;
0,005 mg/l TDZ; 50 mg/l asam sitrat; dan 150 mg/l asam askorbat; serta 30 g/l
sukrosa hingga homogen. Larutan yang telah homogen kemudian ditera dengan
diukur dengan menggunakan pH meter dan ditetapkan menjdi 5,8. Penetapan pH
dilakukan dengan cara menambahkan larutan KOH 1 N jika pH larutan kurang
dari 5,8 dan larutan HCl 1 N jika pH larutan lebih dari 5,8. Larutan yang telah di
pH dimasak dengan 8 g/l agar-agar hingga mendidih. Sebanyak 20 -25 ml media
dituangkan dalam botol berukuran 250 ml kemudian ditutup dengan plastik dan
diikat dengan karet serta diberi label sesuai komposisi media. Media tersebut
kemudian disterilkan dengan autoklaf pada suhu 121oC pada tekanan 1,2 kg/cm2
selama 7 menit. Setelah sterilisasi selesai dan tekanan autoklaf turun menjadi 0
kg/cm2, media dikeluarkan dan disimpan dalam ruang kultur.
3.1.3.3 Bahan Tanaman
Bahan tanaman yang digunakan pada penelitian ini berupa eksplan tunas apikal
yang berasal dari meristem bonggol tanaman pisang. Kultivar yang digunakan
adalah pisang “Kepok Kuning”. Bonggol pisang didapatkan dari Gedong Tataan,
Kabupaten Pesawaran, Lampung Selatan. Bonggol pisang yang digunakan
berupa anakan pisang dengan diameter 10-20 cm. Bonggol anakan pisang diambil
dengan menggunakan sabit dan cangkul yang kemudian dibawa ke lahan sekitar
Gambar 2. Bahan ekspl pisang (um meristem
3.1.3.4 Persiapan Ekspl
Eksplan pisang yang t
Batang semu dibuang
tersisa. Bonggol yang
kemiringan 450(berbe
eksplan berupa 15-20 c
meristematik bonggol
fungisida berbahan akt
menit. Eksplan selanj
permukaan eksplan. a
ksplan pisang Kepok Kuning yang digunakan ( (umur ± 5 bulan) sebagai sumber eksplan dan (b
m yang diambil.
ksplan
g telah berada di lahan sekitar laboratorium dipe
ng beberapa lapis dengan menggunakan pisau hi
ng ada diambil dengan cara menyudutkan pisau de
rbentuk segi 5 dengan ujung runcing) hingga di
20 cm batang semu dengan mata tunas dan jarin
ol. Eksplan tersebut kemudian direndam dalam
n aktif Mankozeb 2 g/l dan 150 mg/l asam askorb
anjutnya dibawa ke dalam laboratorium untuk st
n.
u hingga 2 lapis
Gambar 3. Proses pen sudut 450
3.1.3.5 Sterilisasi dan P
Sebelum sterilisasi pe
cm. Eksplan kemudia
Setelah dicuci eksplan di
eksplan. Eksplan kem
mengandung 5,25% N
sebanyak 5 tetes, kem
dibilas dengan air ster
(LAFC). Eksplan yag t
x 1 cm.
Eeksplan yang telah b
berkonsentrasi 150 m
dengan desinfektan (5,25
10 menit dengan men
lebih hingga bersih. S a
s pengambilan eksplan pisang Kepok Kuning (a) p 450dan (b) proses perendaman dengan larutan fun
dan Penanaman Eksplan
permukaan, eksplan dikecilkan kembali hingga
udian dicuci dengan detergen dan dibilas di air m
ksplan dimasukkan dalam botolschothingga seban
n kemudian disterilkan dengan larutan desinfektan
NaOCl berkonsentrasi 50% yang ditambahTw
emudian dikocok selama 30 menit. Setelah itu ke
steril sebanyak 3 kali di dalamLaminar Air Flow
ag telah bersih dikecilkan kembali hingga berukur
h berukuran kecil direndam dalam larutan asam
150 mg/l selama 15 menit. Eksplan kemudian diste
n (5,25% NaOCl) berkonsentrasi 15% tanpaTwe
enggunakan vakum, kemudian dibilas sebanyak 3
. Sterilisasi tersebut kemudian diulang kembali b
rukuran 1,5 x 1,5
m askorbat
sterilisasi kembali
ween-20 selama
ak 3 kali atau
hingga bersih. Ekspla
prekondisi. Satu botol
ditanam dalam media
Gambar 4. Proses pena eksplan da
3.1.3.5 Pengamatan
Pengamatan eksplan di
pengamatan pada pen
1. Rata-rata jumlah m
tumbuh dari setiap ke
2. Rata-rata jumlah tuna
setiap ketiak bongg
3. Jumlah propagul pe
tunas aksilar.
4. Penampilan visual e
pada saat 0, 4, 8, d
penunjang hasil pe a
ksplan yang sudah bersih kemudian ditanam dalam
u botol media prekondisi berisi satu eksplan. Setel
dia kemudian diberi label nama dan tanggal pen
s penanaman ekslpan pisang Kepok Kuning (a) pe n dan (b) penanaman ke media prekondisi.
n dilakukan sejak munculnya tunas aksilar. Ad
penelitian ini adalah:
h mata tunas aksilar. Mata tunas aksilar adalah t
ap ketiak bonggol eksplan dengan ukuran < 0,5
h tunas aksilar. Tunas aksilar adalah tunas yang
ggol eksplan dengan ukuran≥ 0,5 cm.
ul per eksplan. Propagul adalah jumlah dari mata
sual eksplan. Penampilan visual eksplan di dalam
0, 4, 8, dan 10 MSP. Variabel pengamatan ini diguna
3.2 Percobaan Lanjutan: Pengaruh TDZ 0,1 mg/l dan TDZ 0,1 mg/l + BA 2 mg/l terhadap Perkembangan Nodul Embrio Somatik Pisang Kepok Kuning
Percobaan menggunakan bahan tanam berupa nodul embrio somatik yang terdapat
pada meristem pisang Kepok Kuning. Tujuan percobaan ini adalah untuk melihat
perkembangan nodul embrio somatik pada media kultur yang ditambahkan
dengan TDZ 0,1 mg/l maupun kombinasi TDZ 0,1 mg/l dan BA 2 mg/l. Nodul
embrio somatik yang terdapat pada meristem pisang Kepok Kuning kemudian di
potong dan ditanam pada media kultur yang baru dengan kandungan ZPT yang
sama. Nodul embrio somatik yang telah dipotong kemudian diinkubasi dan
diamati perkembangannya.
3.3 Percobaan II. Pengaruh Konsentrasi Thidiauron dengan dan tanpa Benziladenin terhadap Perbanyakan Embrio Somatik Pisang Raja Bulu
3.3.1 Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan di Laboratorium Ilmu Tanaman, Jurusan
Agroteknologi, Fakultas Pertanian, Universitas Lampung, Bandar Lampung.
Penelitian ini dilaksanakan dari bulan April sampai Juni 2015.
3.3.2 Metode Penelitian
Perlakuan diterapkan pada satuan percobaan dalam rancangan acak lengkap
(RAL) yang disusun secara faktorial 4x2. Faktor pertama adalah empat taraf
konsentrasi TDZ, yaitu 0,005 mg/l, 0,01 mg/l, 0,05 mg/l, 0,1 mg/l. Faktor kedua
media dasar MS (Mur
perlakuan diulang ena
kultur. Homogenitas d
selanjutnya akan dilakuk
dengan uji beda nyata
Perlakuan yang dicob
kombinasi antara TDZ
3.3.3 Bahan Tanam
Bahan tanam yang dig
(nodul embrio somati
AAB). Kulturin vitro
Gambar 5. Eksplan e bahan tana
3.3.4 Penanaman ekspl
Eksplan yang berupa ku
dipotong menjadi beb
Murashige dan Skoog pada tahun 1962). Masing
nam kali. Setiap satuan percobaan terdiri dari
as data diuji dengan uji Barlet. Apabila asumsi
lakukan anlisis ragam. Pemisahan nilai tengah di
ata terkecil (BNT) dengan taraf 5%.
obakan dalam penelitian ini adalah konsentrasi T
DZ dan BA disajikan pada Tabel 1.
digunakan pada penelitian ini berupa eksplan m
atik) yang bersal dari kulturin vitropisang Raja
trotersebut didapatkan dari hasil penelitian Tri
embrio somatik pisang Raja Bulu yang diguna anam pada percobaan II.
ksplan
a kumpulan nodul embrio diseragamkan ukura
beberapaclumpsebesar 0,5 cm. Setiapclumpm
nodul yang berbeda. C
botol berisi satuclump
Gambar 6. Proses pena penyeraga
3.3.5 Pengamatan
Pengamatan eksplan di
variabel pengamatan p
1. Rata-rata jumlah p
Embrio nodul adal
2. Penampilan visual e
pada saat 0, 4, dan 8
penunjang hasil pe
. Clumpkemudian dimasukkan kedalam media
umpberukuran 0,5 cm.
s penanaman eksplan pisang Raja Bulu yaitu (a) pe gaman ukuran, dan (c) penanaman.
n dilakukan sejak bertambahnya nodul embrio. A
n pada penelitian ini adalah:
propagul. Propagul adalah jumlah nodul embr
dalah setiap butir bulatan yang masih berwarna put
sual eksplan. Penampilan visual eksplan di dalam
an 8 MST. Variabel pengamatan ini digunakan se
pengamatan variabel lainnya.
V. KESIMPULAN DAN SARAN
5.1 Kesimpulan
Berdasarkan percobaan yang telah diujikan, maka didapatkan kesimpulan sebagai
berikut:
1. Pada kulturin vitrotanaman pisang “KepokKuning”,benziladenin dan
interaksi benziladenin dan thidiazuron tidak berpengaruh nyata terhadap
jumlah propagul. Peningkatan konsentrasi thidiazuron dari 0,005-0,1 mg/l
mengakibatkan peningkatan jumlah propagul. Jumlah propagul tertinggi
diperoleh pada konsentrasi thidiazuron 0,1 mg/l.
2. Pada kulturin vitrotanaman pisang“Raja Bulu”, peningkatan konsentrasi
thidiazuron dari 0,005-0,1 mg/l tidak berpengaruh nyata terhadap jumlah
propagul. Pemberian 2 mg/l benziladenin menyebabkan penurunan secara
nyata jumlah propagul. Dengan pemberian thidiazuron 0,005-0,1 mg/l tanpa
benziladenin dihasilkan rata-rata 12,5 propagul.
3. Propagul yang dihasilkan dalam penelitian ini adalah berupa tunas, mata
tunas, dan nodul embrio somatik. Pengulturan nodul embrio somatik pada
media yang mengandung 0,1 mg/l thidiazuron menyebabkan nodul embrio
somatik memperbanyak diri dengan cepat. Dalam 3 bulan dihasilkan 433
5.2 Saran
Berdasarkan penelitian yang telah dilaksanakan, penulis menyarankan agar
dilakukan penelitian lanjutan untuk mengetahui konsentrasi BA yang tepat untuk
perbanyakan tunas pisang baik pada pisang Kepok Kuning maupun pada pisang
Raja Bulu, serta mengetahui kombinasi antara TDZ dan BA yang tepat untuk
PUSTAKA ACUAN
Ali, K.S., A. A. ELhasan, S. O. Ehiweris dan H. E. Maki. 2013. Embryogenesis and plantlet regeneration via immature male flower culture of banana (Musa sp.) cv.Grand Nain. Journal of Forest Products and Industries2: (3).
Badan Pusat Statistik. 2014. Produksi Buah-buahan dan Sayuran Tahunan di Indonesia. http://www.bps.go.id/tab_sub/view.php?kat=3&tabel=1& daftar=1&id_ subyek=55¬ab=16. Diakses pada tanggal 15 September 2014.
Cahyono, B. 2009. Pisang, usaha tani dan penanganan pascapanen. Kanisius. Yogyakarta.
Damayanti, F. dan Samsurianto. 2010. Konservasi in vitro plasma nutfah untuk aplikasi di bank gen. Bioprospek7 (2) : 1-6.
Danial, E. 2013. Perbanyakan In Vitro Tanaman Pisang ‘Ambon Kuning’ dan
‘Raja Bulu’. (Tesis). Universitas Lampung. Bandar Lampung.
Darvary, F. M., M. Sariah, M.P. Puad and M. Maziah. 2010. Micropropagation of Some Malaysian banana and plantain (Musa sp.) cultivars using male flowers. Journal of Biotechnology9 (16): 2360-2366.
Dewi, I. R. 2008. Perananan dan fungsi fitohormon bagi pertumbuhan tanaman. (Makalah). Universitas Padjadjaran. Bandung.
George, E. F., M.A. Hall, and G. J. De Klerk. 2008. Plant Propagation by Tissue Culture. 3rd Edition. Volume 1. Spinger. Dordrecht: 205-227.
Gubbuk, H. dan M. Pekmezci. 2004. In Vitro Propagation of Some New Types (Musa spp.). Turk J Agri : 28 (2004) : 353-361.
Guo, B., B. H. Abbasi, A. Zeb, L. L. Xu, dan Y. H. Wei. 2011. Thidiazuron: A multi-dimensional plant growth regulator. African Journal of Biotechnologi Vol.10 (45).
Iliev, I., Gadjosova, G. Libiakova, dan S. M. Jain. 2010. Plant
Indian Horticulture Database. 2014. Indian Hortikulture Database-2013. New Delhi. India.
Ismaryati, T. 2010. Studi Multiplikasi Tunas, Perakaran, dan Aklimatisasi Pada Perbanyakan in Vitro Pisang ‘Raja Bulu’, ‘Tanduk’, dan ‘Ambon Kuning’. (Tesis). Universitas Lampung. Bandar Lampung. 30-56 hlm.
Isnaeni, N. 2008. Pengaruh TDZ terhadap Inisiasi dan Multiplikasi Kultur in Vitro Pisang Raja Bulu ( Musa paradisiaca L. AAB Group). (Skripsi). Fakultas Pertanian. Institut Pertanian Bogor.
Jatmiko, W., W. A. Widodo, Y. A. Rais dan A. Kusumawardani. 2011. Pengaruh suhu terhadap kadar glukosaterbentuk dan konstanta kecepatan reaksi pada hidrolisa kulit pisang. Jurnal Pengembangan Teknologi Kimia untuk Pengolahan Sumber Daya Alam Indonesia3, 357-367.
Kanchanapoom, K. dan K. Promsom. 2011. Micropropagation andin vitro germplasm conservation of endangeredMusa balbisiana‘Kluai Hin’ (BBB
group). African Journal of Biotecnologi. 11 (24). Pp.6464-6469.
Kasutjianingati, R. Poerwanto, N. Khumaida,dan D. Efendi. 2010. Kemampuan pecah tunas dan kemampuan berbiak mother plant pisang Rajabulu (AAB) dan pisang Tanduk (AAB) dalam medium inisiasi in vitro. Agriplus 20:39-46.
Kasutjianingati, R. Poerwanto, Widodo, N. Khumaida, dan D. Efendi. 2011. Pengaruh media induksi terhadap multiplikasi tunas dan pertumbuhan planlet pisang Rajabulu (AAB) dan Pisang Tanduk (AAB) pada berbagai media multiplikasi. Jurnal Agronomi Indonesia, 39 (3): 180-187.
Kumar, K. G., V. Krishna, Vankatesh and K. Pradeep. 2011. High Frequency Regeneration of Planlets from Immature Male Floral Explants of Musa paradisiac cv. Puttabale–AB Genome. Plant Tissue and Biotech21 (2) : 199-205.
Lee, S. W. 2005. Thidiazuron in the improvment of banana micropropagation. Taiwan Banana Research Institute. Acta Hort692.
Lestari, E. G. 2011. Peranan Zat Pengatur Tumbuh dalam Perbanyakan Tanaman Melalui Kultur Jaringan. Agro Biogen7 (1): 63—68.
Lisnandar, D. S., A. Fajarudin, D. Efendi, dan I. Rostika. 2015. Organogenesis bunga aksis pisang bergenom AAB dan ABB (Organogenesis of floral axis of AAB and ABB group banana). J. Hort.25 (1):1-8.
56
Nisa, C. dan Rodinah. 2005. Kultur Jaringan Beberapa Kultivar Buah Pisang (Musa paradisiaca L.) dengan pemberian campuran NAA dan Kinetin. Bioscientiae2 (2) : 23-26.
Plantamor. 2014. Musa paradisiaca. www.plantamor.com/ spesies /musa-paradisiaca. 29 desember 2014.
Prabawati, S. Suyanti dan D. A. Setyabudi. 2008. Teknologi Pascapanen dan Teknik Pengolahan Buah Pinang. Balai Besar Penelitian dan
Pengembangan Pertanian. Badan Penelitian dan Pengembangan Pertanian.
Prayoga, L. dan Sugiyono. 2010. Uji perbedaan media dan konsentrasi BAP terhadap pertumbuhan tunas pisang raja secar kultur in vitro. Jurnal Agritech, XII(2): 89-99.
Pusat Kajian Buah-buahan Tropika. 2005. Riset unggulan strategis nasional pengembangan buah-buahan unggulan Indonesia. Laporan Akhir. Kementrian Negara Riset dan Teknologi Republik Indonesia.
Rainiyati, D. Martino, Gusniwati dan Jasminarni. 2007. Perkembangan pisang raja nangka (Musa sp.) secara kultur jaringan dari eksplan anakan dan meristem bunga. Journal AgronomiVol. 11 No. 1.
Rainiyati, Lizawati, dan M. Kristiana. 2009. Peranan IAA dan BAP terhadap perkembangan nodul pisang (Musa ABB) Raja Nangka secara in vitro. Jurnal AgronomiVol. 13 No. 1.
Rayis, S. A. dan A. A. Abdallah. 2015. Somatic embriogenesis for the genetic improvement of a triploid banana (Musaspp. AAA cv. Barangan) using three different media with different growth regulator. Internasional Journal of Recent Reseach in life sciences.Vol. 2 (1): 55-58.
Roels, S., M. Escalona, I. Cejas, C. Noceda, R. Rodriguez, M. J. Canal, J. Sandoval, and P.Debergh. 2005. Optimization of Plantain (MusaAAB) Micropropagation by Temporary Immersion System.Plant Cell, Tissue, and Organ Culture82: 57—66.
Rostiana, O. 2007. Pengaruh benziladenin dan thidiazuron terhadap
multuiplikassi tunas piretrum (Chrysanthemum cinerariifolium Trev.) klon prau-6 secara in vitro. Jurnal Bahan Alam Indonesia,6 (30).
Roy, O. S., P. Bantawa, S. K. Ghosh, J. A. T. da Silva, P. Deb Ghosh, and T. K. Mondal. 2010. Micropropagation and Field Performance of ‘Malbogh’
Salisbury, F. B. dan C. W. Ross. 1995. Fisiologi Tumbuhan; Jilid 3. Institut Teknologi Bandung. Bandung. 64 hlm.
Sukartini. 2007. Pengelompokan aksesi pisang menggunakan karakter morfologi IPGRI. J. Hort.17 (1): 26-23. Balai Penelitian Tanaman Buah Tropika.
Semaryani, C. I. M., dan D. Diny. 2012. Subkultur Berulang Tunas In Vitro Pisang Kepok Unti Sayang Pada Beberapa Komposisi Media. IPB. Bogor.
Sunarjono, H. 2002. Budidaya Pisang dengan Bibit Kultur Jaringan. Swadaya. Jakarta.
Swandra, E., M. Idris, dan N. W. Surya. 2012. Multiplikasi tunas andalas (Morus macroura Miq. Var. Macroura) dengan menggunakan thidiazuron dan sumber eksplan berbeda secara in vitro. Jurnal biologi Universitas Andalas.
Suyanti dan A. Supriyadi. 2008. Pisang, budidaya, pengolahan, dan prospek pasar. Penebar Swadaya. Jakarta.
Triyani, S. 2014. Pengaruh Konsentrasi Benziladenin Dan Thidiazuron Terhadap Multiplikasi Tunas Pisang ‘Raja Bulu” (Genom AAB) In Vitro. (Skripsi). Universitas Lampung. Bandar Lampung.
Wattimena, G. A. 1987. Zat Pengatur Tumbuh Tanaman. Pusat Antar Universitas, Institut Pertanian Bogor. Bogor.
Wibowo, A., S. Subandiyah, I. M. Soedharma, Y. Supriati, dan Y. Suryadi. 2009. Perakitan tanaman pisang kepok kuning tahan terhadap penyakit darah dan layu fusarium melalui variasi somaklonal dan simbiosis endofitik (Tahun II). Kerjasama Kemitraan Penelitian Pertanian Dengan Perguruan Tinggi.
Windiastika, G. 2013. Peranan Kultur Jaringan dalam Memperoleh Benih Unggul. Balai Besar Perbenihan dan Proteksi Tanaman Perkebunan Surabaya. Surabaya.
Youmbi, E., B. Ella, dan K. Tomekpe. 2006. Effect of thidiazuron on in vitro proliferation capacities of some banana (Musa spp.) cultivars with weak multiplication potential. Akdeniz Universitesi Ziraat Fakultesi Dergisi, 19 (2): 255-259.
Yuliarti, N. 2010. Kultur Jaringan Tanaman Skala Rumah Tangga. Andi Offset. Yogyakarta.
Yusnita. 2003. Kultur jaringan Cara Memperbanyak Tanaman secara Efisien. Agromedia Pustaka. Tangerang.
58
Yusnita dan D. Hapsoro. 2002. Teknik Kultur Jaringan untuk Pembiakan Tanaman.Makalah training kultur jaringan. Institut Pertanian Bogor. Bogor.
Yusnita dan D. Hapsoro. 2013. Eksplorasi, Karekterisasi, Seleksi, dan Perbanyakan Klonal In Vitro untuk mendapatkan Genotipe-Genotipe