DAFTAR PUSTAKA
Akbar, A. W., A. Daud, dan A. Mallongi. 2014. Analisis Resiko Lingkungan Logam Berat Cadmium (Cd) pada Sedimen Air Laut di Wilayah Pesisir Kota Makassar. Bagian Kesehatan Lingkungan Fakultas Kesehatan Masyarakat Universitas Hasanuddin. Makasar.
Amin, B. 2001. Akumulasi dan Distribusi Logam Berat Pb dan Cu pada Mangrove Avicennia marina di Perairan Pantai Dumai. Riau.
Andani, S. dan E. D. Purbayanti. 1981. Fisiologi Lingkungan Tanaman. Gadjah Mada University Press. Yogyakarta.
Arifin, Z., R. Puspitasasi, and N. Miyazaki. 2012. Heavy Metal Contamination in Indonesia Coastal Marine Ecosystems: A Historical Perspective. Journal of Coastal Marine Science. 35 : 227 - 233.
Arisandi, P. 2001. Mangrove Jenis Api-api (Avicennia marina) Alternatif Pengendalian Logam Berat Pesisir. Fakultas Perikanan dan Ilmu Kelautan Universitas Brawijaya. Malang.
Badan Lingkungan Hidup. 2011. Pencemaran Limbah Kota. Badan Lingkungan Hidup Kota Medan.
Chapman, V. J. 1975. Mangrove Biogeography. In Walsh, G. E., S. C. Snedaker and H. J. Teas (Eds.). Proceeding of International Symposium on Biology and Management of Mangrove. Gainseville, University of Florida. Pengetahuan Indonesia, Panitia Nasional MAB. Jakarta.
Dahuri, R. 2003. Keanekaragaman Hayati Laut. Aset Pembangunan Berkelanjutan Indonesia. Gramedia Pustaka Utama. Jakarta.
Darmono. 1995. Logam dalam Sistem Biologi Makhluk Hidup. Universitas Indonesia. Jakarta.
Djuangsih, N., A. K. Benito, dan H. Salim, 1982. Aspek Toksikologi Lingkungan, Laporan Analisis Dampak Lingkungan, Lembaga Ekologi Universitas Padjadjaran. Bandung.
Effendi, H. 2003. Telaah Kualitas Air Bagi Pengelolaan Sumberdaya dan Lingkungan Perairan. Penerbit Kanisius. Yogyakarta.
Fitter, A. H. dan Hay, R. K. M. 1982. Fisiologi Lingkungan Tanaman. Gajah Mada Universitas Press. Yogyakarta.
Fuad, A.N. 2008. Bahaya Timbal (Timah Hitam). Fisly Forum. Surabaya.
Hamzah, F dan Setiawan, A. 2010. Akumulasi Logam Berat Pb, Cu, dan Zn, di Hutan Mangrove Muara Angke, Jakarta Utara. Jurnal Ilmu dan Teknologi Kelautan Tropis. Vol 2 : 41 - 51
Hardiani, H. 2009. Potensi Tanaman dalam Mengakumulasi Logam Cu Pada Media Tanah Terkontaminasi Limbah Padat Industri Kertas. Berita Selulosa 44 (1) : 27 – 40
Hoshika, A., T. Shiozawa, K. Kawana, and T. Tanimoto. 1991. Heavy Metal Pollution in Sediment From the Seto Island, Sea, Japan. Marine Pollution Bulletin. 23 : 101 - 105
IACD/CEDA. 1997. Conventions, Codes, and Conditions : Marine Disporsal. Environmental Aspects of Dredging.
Jonak, C., H. Nakagami, and H. Hirt. 2004. Heavy Metal Stress. Activation Mitogen-Activated Protein Kinase Pathways by Copper and Cadmium. Plant Physiology. 136 : 3276 - 3283.
Kanvel, P. S. 2013. Akumulasi Logam Berat Tembaga (Cu) dan Timbal (Pb) pada Pohon Rhizophora mucronata di Hutan Mangrove Desa Nelayan Kecamatan Medan Labuhan dan Desa Jaring Halus Kecamatan Secanggang. Skripsi. Jurusan Budidaya Hutan. Universitas Sumatera Utara. Medan.
Keputusan Menteri Lingkungan Hidup No.51/Men KLH/I/2004 Tentang Baku Mutu Air Laut.
Kusmana, C. 1995. Manajemen Hutan Mangrove Indonesia. Laboratorium Ekologi Hutan. Jurusan Manajemen Hutan Fakultas Kehutanan. IPB. Bogor.
Mason, C. F. 1981. Biology of Fresh Water Pollution.Longman. New York.
Belawan Provinsi Sumatera Utara. Fakultas Pertanian. Universitas Sumatera Utara. Medan.
Moore, J. W., Ramamoorthy. 1984. Heavy Metal in Natural Waters. Springer-velag.New York, Berlin, Heidelberg. Tokyo.
Mukhtasor. 2007. Pencemaran Pesisir dan Laut. Pradnya Paramita. Jakarta.
Mulyadi, E., R. Laksmono., D. Aprianti. 2007. Fungsi Mangrove sebagai Pengendali Pencemar Logam Berat. Jurnal Ilmiah Teknik Lingkungan. Edisi Khusus.Vol (1).
Nastia, P. 2014. Akumulasi Logam Berat Tembaga (Cu) dan Timbal (Pb) pada Pohon Rhizophora mucronata di Hutan Mangrove Desa Nelayan Kecamatan Medan Labuhan dan Desa Jaring Halus Kecamatan Secanggang. Skripsi. Jurusan Budidaya Hutan. Universitas Sumatera Utara. Medan.
Noor, Y. R., M. Khazali dan I. N. N. Suryadiputra. 1999. Panduan Pengenalan Mangrove di Indonesia. PKA/WI-IF. Bogor.
Nugroho, A. 2006. Bioindikator Kualitas Air. Universitas Trisakti. Jakarta.
Palar, H. 1994. Pencemaran dan Toksikologi Logam Berat. Rineka Cipta. Jakarta,
Rico, L. G., F. C. Felix., R. R. Burguenso., and M. J. Marini, 2002. Determination of Cadmium and Zinc and Its Relathionship to Metalloghionein Level in SwineKidney. Rev. In. Contant Ambient.Vol 18, 157-162.
Rohmawati, 2007. Daya Akumulasi Tumbuhan Avicennia marina terhadap Logam Berat (Cu, Cd, Hg) di Pantai Kenjeran Surabaya. Skripsi. Jurusan Biologi Fakultas Sains Dan Biologi. Universitas Islam Negeri Malang. Malang.
Rumahlatu, D., A. D. Corebima., M. Amin., dan F. Rachman. 2012. Kadmium dan Efeknya terhadap Ekspresi Protein Metallothionein pada Deadema setosum (Echinoidea; Echinodermata). Jurnal Penelitian Perikanan. 1 (1) : 26-35.
Said, I., M. N. Jalaludin., A. Upe., dan A. W. Wahab. 2009. Penetapan Konsentrasi Logam Berat Krom dan Timbal dalam Sedimen Estuaria Sungai Matangpondo Palu. Jurnal Chemica. 10 (2) : 40-47.
Setiawan, H. 2013. Akumulasi dan Distribusi Logam Berat pada Mangrove di Perairan Pesisir Sulawesi Selatan. Jurnal Ilmu Kehutanan. VII (1).
Setiawati, M. D. 2009. Uji Toksisitas Kadmium dan Timbal pada Mikroalga Chaetoceros gracilis. Skripsi. Departemen Ilmu dan Teknologi Kelautan Fakultas Perikanan dan Ilmu Kelautan Institut Pertanian Bogor. Bogor.
Silalahi, S. L. 2014. Bab II Profil Lingkungan XII Kelurahan Medan Belawan I. http://repository.usu.ac.id. Diakses pada tanggal 23 Februari 2016.
Soemirat, J. 2003. Toksikologi Perairan. Gajah Mada University Press. Yogyakarta.
Sudarwin. 2008. Analisis Spasial Pencemaran Logam Berat (Pb dan Cd) pada Sedimen Aliran Sungai dari Tempat Pembuangan Akhir (TPA) Sampah Jatibarang Semarang. Tesis. Program Pasca Sarjana Universitas Diponegoro. Semarang.
Tomlinson, P. B. 1986. The Botany of Mangrove. Cambridge University Press. London.
Wibowo, Y. A. 2011. Ancaman dan Pengendalian Pencemaran Logam Berat di Kawasan Estuaria. Program Studi Oseanografi Universitas Hang Tuah. Surabaya.
METODE PENELITIAN
Lokasi dan Waktu Penelitian
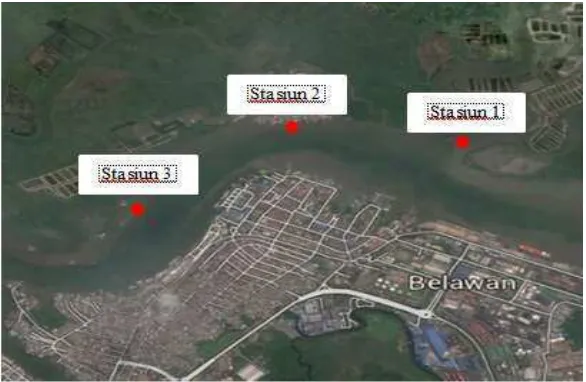
Penelitian ini akan dilaksanakan selama satu bulan yaitu pada bulan
Januari 2015 s/d Februari 2016, di Kampung Nelayan Seberang, Kecamatan
Medan Belawan, Sumatera Utara (Gambar 3). Pengambilan sampel dilakukan di
tiga stasiun pengamatan dan dilakukan pengambilan substrat serta pengukuran
parameter kualitas air pada masing-masing stasiun. Analisis logam berat
dilakukan di Balai Riset dan Standarisasi Industri, Medan, Sumatera Utara.
Rencana jadwal penelitian dapat dilihat pada Lampiran 1.
Gambar 3. Peta Lokasi Penelitian (Google Earth, 2015)
Alat dan Bahan
Alat yang digunakan adalah GPS, timbangan analitik, DO meter, pH
meter, thermometer, refraktometer, kertas Whatman nomor 42, buku identifikasi
mangrove (Noor dkk., 1999), labu Erlenmeyer, alat pemotong, alat tulis, kamera
gelas ukur, hot plate, Spektrofotometri serapan atom, wadah sampel, labu takar,
gelas beaker, oven, corong, pipet tetes, pengaduk kaca, bola hisap, pipet volume.
Bahan yang digunakan adalah akar, batang, dan daun Avicennia marina,
sampel sedimen dan sampel air laut, tally sheet, larutan standar Cd dan Pb, larutan
HNO3 pekat, aquabides, aluminium foil, plastik sampel.
Kondisi Umum Lokasi Penelitian
Letak lokasi Dusun Perkampungan Nelayan atau Kampung Nelayan
berada di Lingkungan XII Kelurahan Belawan I Kecamatan Medan Belawan.
Kelurahan Belawan I memiliki jumlah penduduk berkisar 20.328 orang, dengan
jumlah laki-laki sebanyak 10.447 orang dan perempuan sebanyak 9.881 orang.
Jarak lokasi penelitian dari kota Belawan yaitu ± 1 KM. Untuk sampai ke
lokasi ini, kita harus menyeberang dengan menggunakan boat nelayan.
Masyarakat luar juga sering menyebutnya desa Kampung Nelayan karena
letaknya berada di perairan laut. Kelurahan Belawan I memiliki luas wilayah 2,3
km2 atau sekitar 10,54 % dari total luas Kecamatan Medan Belawan.
Menurut Silalahi (2014), Kampung Nelayan Lingkungan XII Kelurahan
Belawan I Kecamatan Medan Belawan, dengan batas-batas wilayahnya adalah
sebagai berikut :
a. Sebelah utara berbatasan dengan Desa Paluh Kurau, Kabupaten Deli Serdang
b. Sebelah selatan berbatasan dengan Laut Belawan
c. Sebelah timur berbatasan dengan Paluh Nonong, Kabupaten Deli Serdang
Deskripsi Area
Stasiun 1 : Merupakan area hutan mangrove yang dekat dengan bengkel (dok)
kapal, dimana kondisi kerapatan mangrovenya tergolong sedang.
Menurut wawancara dengan masyarakat/nelayan setempat, daerah
ini merupakan daerah bekas empang, yang telah beralih fungsi dan
ditanami mangrove, pada titik koordinat 3º 47’ 5,24” LU sampai 98º
40’ 31,72” BT.
Stasiun 2 : Merupakan area hutan mangrove yang dekat dengan pemukiman
warga, dimana kondisi kerapatan mangrovenya tergolong sedang,
pada titik koordinat 3º 47’ 21,18” LU sampai 98º 40’ 40,18” BT.
Stasiun 3 : Merupakan area hutan mangrove yang dekat dengan muara sungai
(estuari), dimana kondisi kerapatan mangrovenya masih tergolong
tinggi, pada titik koordinat 3º 47’ 40,21” LU sampai 98º 41’ 14,51”
BT.
Prosedur Penelitian
Pengambilan Sampel
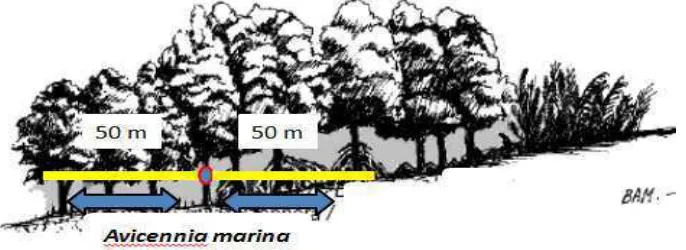
Pengambilan sampel dilakukan saat kondisi surut dengan objek
penelitian adalah tumbuhan mangrove (Avicennia marina) dengan metode transek
tegak lurus garis pantai yang dipilih secara acak (random). Pengambilan sampel
mangrove dilakukan berdasarkan Ulqodry (2001), yaitu mangrove yang diambil
untuk sampel adalah pohon setinggi dada. Jaringan mangrove yang digunakan
adalah akar pasak, daun muda, daun tua, dan kulit batang yang terkena pasang
surut air laut (± 1,3 cm), dari jalur transek tersebut diambil 3 titik pengambilan
Sampel diambil langsung dengan menggunakan alat potong masing-masing 100
gr, kemudian dimasukkan kedalam plastik sampel. Pengambilan sampel air
dilakukan sebanyak tiga kali yaitu pagi sewaktu surut antara pukul 8.00 WIB
hingga pukul 10.00 WIB, siang sewaktu pasang antara pukul 13.00 WIB hingga
15.00 WIB, dan sore setelah pasang antara pukul 16.00 WIB hingga pukul 18.00
WIB. Pengambilan sedimen dilakukan pada kedalaman ± 30 cm, serta pengukuran
kualitas air, yaitu suhu, salinitas, pH pada lokasi pengambilan sampel.
Gambar 3. Pola Pengambilan Sampel A. marina
Preparasi sampel akar pasak, daun, kulit batang dan sedimen.
Sampel akar pasak, daun, kulit batang dan sedimen dihomogenkan
dengan cara menggabungkan sampel yang diambil dari tiga titik pengambilan
pada setiap stasiun pengamatan. Untuk preparasi akar pasak, daun dan kulit
batang sampel dipotong kecil sebelum dihaluskan sedangkan untuk sedimen,
sampel dapat langsung dihaluskan. Setelah itu sampel dikeringkan dalam oven
pada suhu 105ºC sampai kadar air konstan untuk menghilangkan kadar airnya dan
diperoleh berat konstan.
Sampel akar pasak, daun, kulit batang dan sedimen dihomogenkan
plate sampai menjadi arang. Untuk mempercepat terjadinya proses pengarangan
dapat diteteskan sedikit larutan HNO3 secara perlahan untuk menghindari kabut.
Sampel yang telah menjadi arang kemudian dimasukkan ke dalam tanur pada suhu
700º C (pengabuan) sampai menjadi abu. Setelah selesai proses pengabuan sampel
akar pasak, kulit batang, daun dan sedimen, dilarutkan dengan menambahkan 10
ml larutan HNO3 pekat.
Hasil pencampuran larutan tersebut digerus didalam wadah krus porselin
secara merata kemudian disaring ke dalam labu ukur 25 ml dengan menggunakan
kertas saring Whatman ukuran 42. Krus porselin yang selesai digerus dapat dibilas
dengan menggunakan aquabides sebanyak dua kali agar kandungan logam berat
yang diperkirakan masih menempel pada krus porselin dapat larut. Setelah
dilakukan penyaringan ditambahkan aquabides hingga garis tanda batas pada labu
ukur 25 ml. Larutan yang diperoleh siap untuk dianalis dengan menggunakan alat
Atomic Absorption Spectroscopy (AAS).
Preparasi Sampel Air
Sampel air laut disaring menggunakan kertas saring dan kemudian diukur
100 ml. Setelah itu sampel air laut ditambahkan 10 ml larutan HNO3 pekat.
Panaskan dalam wadah Erlenmeyer diatas hot plate sampai volumenya berkurang
menjadi 35 ml, kemudian diendapkan. Larutan yang telah diendapkan kemudian
disaring fasa airnya dengan kertas saring Whatman ukuran 42. Larutan yang
diperoleh siap untuk dianalisis dengan menggunakan alat Atomic Absorption
Pembuatan Larutan Standar Cd dan Pb
Larutan induk Cd dan Pb yang memiliki konsentrasi 1000 ppm dipipet
sebanyak 10 ml lalu dimasukkan ke dalam labu ukur 100 ml. Kemudian
ditambahkan aquabides sampai batas tanda akhir, sehingga larutan yang diperoleh
adalah sebanyak 100 ppm. Dari larutan 100 ppm dipipet sebanyak 10 ml lalu
dimasukkan ke dalam labu ukur 100 ml dengan menambahkan aquabides sampai
garis tanda akhir untuk memperoleh larutan dengan konsentrasi 10 ppm.
Untuk mendapatkan larutan standar dengan konsentrasi 0,2; 0,4; 0,6, 0,8
dan 1 ppm, berturut-turut dipipet sebanyak 2 ml, 4 ml, 6 ml, 8 ml, dan 10 ml dari
larutan 10 ppm lalu masing-masing dimasukkan ke dalam labu ukur 100 ml dan
ditambahkan aquabides hingga garis tanda akhir.
Untuk mendapatkan konsentrasi logam berat sebenarnya pada akar pasak,
kulit batang, daun AvicenniA marina dan air sesuai standar operasional prosedur
pada Laboratorium Penelitian, Fakultas Farmasi, Universitas Sumatera Utara,
maka digunakan rumus:
Konsentrasi sebenarnya (
) =
.mg
kg × r
Untuk mendapatkan konsentrasi logam berat sebenarnya pada air, maka
K.AAS : Konsentrasi yang tertera pada alat AAS K. Sebenarnya : Konsentrasi sebenarnya
Volume Pelarut : Volume pelarut
Larutan Sampel : Volume larutan sampel pada saat pengujian Berat Sampel : Berat sampel yang akan diuji
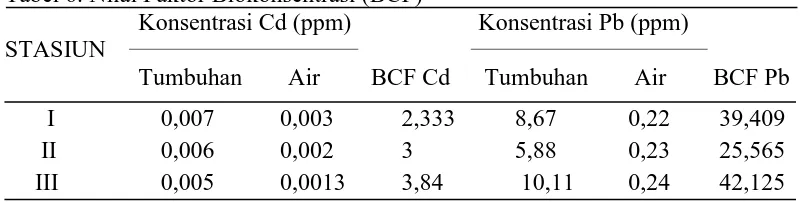
Faktor Biokonsentrasi (BCF)
BCF Cd, Pb (ppm) = [ r /P ]
[ r /P ] r
Keterangan :
BCF > 1000 : Kemampuan Tinggi 1000 > BCF > 250 : Kemampuan Sedang BCF < 250 : Kemampuan Rendah
Analisis Deskriptif
Data yang diperoleh dari pengukuran dianalisis secara deskriptif sesuai
dengan baku mutu lingkungan yang terdapat dalam Kepmen KLH No. 51 Tahun
2004 untuk kualitas air. Sedangkan baku mutu logam berat dalam lumpur atau
sedimen di Indonesia belum ditetapkan, sehingga sebagai acuan digunakan baku
mutu yang dikeluarkan oleh IADC/CEDA (1997) mengenai kandungan logam
HASIL DAN PEMBAHASAN
Hasil
Kondisi Lingkungan Perairan
Kondisi lingkungan perairan yang diperoleh dari hasil pengukuran secara
insitu, menunjukan hasil yang berbeda antar setiap stasiun pengamatan. Suhu dan
salinitas tertinggi terdapat pada stasiun I, sedangkan pH tertinggi terdapat pada
stasiun II. Hasil analisis rata-rata kondisi lingkungan perairan dari tiga stasiun
pengamatan disajikan pada Tabel 3. Data dasar kondisi lingkungan perairan secara
lengkap disajikan dalam Lampiran 5.
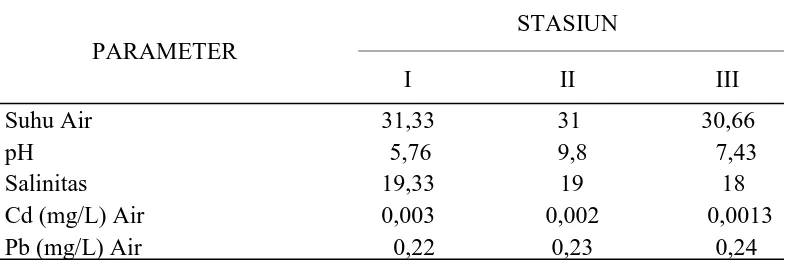
Tabel 3. Rata-rata Nilai Kondisi Lingkungan Perairan pada Ketiga Stasiun.
STASIUN
Kandungan Logam Berat Cd dan Pb pada Akar, Kulit Batang, dan Daun A. marina
Berdasarkan hasil pengukuran rata-rata kandungan logam berat Cd dan
Pb pada akar, kulit batang, dan daun pohon A. marina diperoleh hasil bahwa
akumulasi logam Pb lebih tinggi dibanding logam Cd. Rata-rata kandungan logam
berat Cd dan Pb pada akar, kulit batang dan daun disajikan pada Tabel 4. Data
dasar kandungan logam berat pada akar, kulit batang, dan daun pohon A. marina
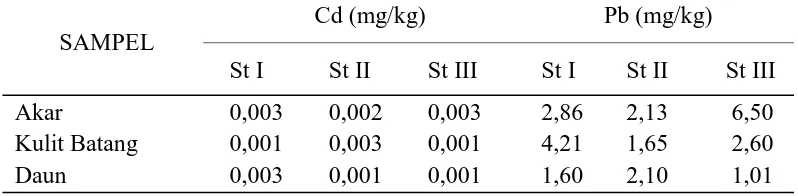
Tabel 4. Rata-rata Kandungan Logam Berat Cd dan Pb pada Akar, Kulit Batang,
Kandungan Logam Berat Cd dan Pb pada Air dan Sedimen
Kandungan logam berat Cd pada air dan sedimen pada setiap stasiun
pengamatan lebih rendah dibanding dengan logam berat Pb. Kandungan logam
berat Pb dalam air yang tertinggi terdapat pada stasiun III dan kandungan logam
berat Pb dalam sedimen yang tertinggi terdapat pada stasiun I. Secara rinci hasil
analisis kandungan logam berat rata-rata pada air dan sedimen disetiap stasiun
pengambilan sampel disajikan pada Lampiran 6, sedangkan Baku Mutu Air Laut
disajikan pada Lampiran 2, dan Baku Mutu Sedimen pada Lampiran 4.
Kandungan logam berat Cd dan Pb pada air dan sedimen disajikan pada Tabel 5.
Tabel 5. Rata-rata Kandungan Logam Berat Cd dan Pb pada Air dan Sedimen Cd (mg/kg) Pb (mg/kg)
Berdasarkan hasil perhitungan nilai faktor biokonsentrasi (BCF)
diketahui bahwa nilai BCF tertinggi adalah logam berat Pb pada stasiun III yaitu
biokonsentrasi (BCF) Cd dan Pb di setiap stasiun pengamatan disajikan pada
Hasil pengukuran kualitas lingkungan perairan pada saat pengambilan
sampel di stasiun I diperoleh suhu air rata-rata yaitu 31,33ºC, pada stasiun II yaitu
31ºC dan Stasiun III adalah 30,66ºC. Suhu air pada stasiun I lebih tinggi
dibandingkan dengan stasiun II dan III, disebabkan karena adanya perbedaan
intensitas cahaya yang masuk kedalam air. Kondisi lingkungan pada stasiun I juga
jarang terdapat vegetasi mangrove atau tingkat kerapatan mangrove yang sedang,
sehingga penetrasi cahaya ke dalam air lebih maksimal. Jumlah vegetasi tutupan
mangrove berpengaruh terhadap proses kimia, fisika, dan biologi badan air.
Berdasarkan hasil pengamatan, suhu perairan dari setiap stasiun pengamatan
masih tergolong baik. Kementrian Lingkungan Hidup (2004) menetapkan kisaran
suhu yang sesuai untuk wilayah mangrove adalah 28-32ºC.
Hasil pengukuran salinitas menunjukan kisaran salinitas rata-rata pada
stasiun I sebesar 19,33 ppt, stasiun II sebesar 19 ppt, dan stasiun III sebesar 18
ppt. Salinitas pada stasiun I lebih tinggi dari stasiun II dan III, karena menerima
tingkat salinitas tinggi. Kedua stasiun ini terletak jauh dari muara sungai dan
langsung berdekatan dengan perairan laut yang banyak dijumpai aktivitas
pelayaran. Stasiun III memiliki tingkat salinitas yang rendah, disebakan lebih
banyaknya pasokan air tawar yang masuk ke perairan akibat kondisi
lingkungannya yang dekat dengan muara sungai atau aliran air sungai sehingga
berpengaruh terhadap rendahnya tingkat salinitas perairannya. Salinitas yang
tinggi dapat menyebabkan rendahnya konsentrasi logam berat dalam perairan dan
sebaliknya. Menurut Mukhtasor (2007), nilai salinitas perairan laut dapat
mempengaruhi faktor konsentrasi logam berat yang mencemari lingkungan laut.
Hasil pengukuran pH air pada setiap stasiun menunjukkan bahwa stasiun
II memiliki nilai pH yang tinggi dengan rata-rata 9,8 dan pH yang terendah
terdapat pada stasiun I dengan rata-rata 5,76 stasiun III sebesar 7,43. Kondisi
asam (seperti pada stasiun I, dimana kisarannya <7) maupun basa (seperti pada
stasiun III, dimana kisarannya >8,5) akan sangat membahayakan kelangsungan
hidup organisme karena dapat menyebabkan terjadinya gangguan metabolisme
dan respirasi. Connell dan Miller (1995), menyatakan bahwa kenaikan pH
diperairan akan diikuti oleh penurunan kelarutan logam berat, sehingga logam
berat meningkat. Nugroho (2006) menyatakan bahwa air yang tercemar memiliki
pH asam atau basa, tergantung dari jenis limbah dan komponen pencemarnya.
Derajat keasaman wilayah mangrove menurut Kementrian Lingkungan Hidup No.
51 Tahun 2004 adalah 7-8,5 dimana masih mendukung kehidupan organisme
yang ada didalamnya. Hal ini disebabkan karena wilayah mangrove dekat dengan
muara sungai yang memiliki perubahan sirkulasi air kearah alkali (pH > 7) dan
Kandungan Logam Berat Cd dan Pb pada Akar A. marina
Hasil pengukuran pada setiap stasiun diperoleh kandungan logam berat
Cd tertinggi pada akar terdapat pada stasiun I dan III, yaitu masing-masing 0,003
mg/kg dan terendah pada stasiun II yaitu 0,002 mg/kg. Kandungan logam berat Pb
tertinggi terdapat pada akar terdapat pada stasiun III yaitu 6,50 mg/kg dan
terendah terdapat pada stasiun II yaitu 2,13 mg/kg.
Kandungan logam berat Cd tertinggi pada stasiun I dan III dan Pb
tertinggi pada stasiun III, disebabkan karena wilayah ini dekat dengan industri dan
tingginya aktivitas masyarakat yang berlangsung disekitar stasiun I dan III.
Limbah industri, pelayaran, dan rumah tangga yang dibuang kedalam badan
perairan akan mengendap pada sedimen dan kemudian diserap oleh akar, yang
seterusnya akan ditransfer ke bagian organ tumbuhan lainnya. Selain menyerap
logam-logam yang terdapat pada sedimen, akar mangrove juga dapat menyerap
logam berat yang terdapat pada kolom air. Mekanisme ini secara terperinci
dijelaskan oleh Hardiani (2009), dimana secara umum tumbuhan melakukan
penyerapan oleh akar, baik yang berasal dari sedimen maupun air, kemudian
terjadi translokasi kebagian tumbuhan yang lain dan lokalisasi atau penimbunan
logam pada jaringan tertentu.
Kandungan Logam Berat Cd dan Pb pada Kulit Batang A.marina
Hasil rata-rata pengukuran logam berat Cd pada setiap stasiun
menunjukkan bahwa kandungan logam berat Cd tertinggi pada kulit batang
terdapat pada stasiun II yaitu 0,003 mg/kg, sedangkan untuk logam berat Pb,
kandungan yang tertinggi pada kulit batang terdapat pada stasiun I yaitu 4,21
Perbedaan kandungan logam berat Cd dan Pb pada setiap stasiun
pengamatan disebabkan oleh diameter batang pohon mangrove yang bervariasi.
Perbedaan diameter batang pohon menentukan banyaknya logam berat dan zat-zat
lain yang terakumulasi didalam pohon tersebut. Semakin besar diameter batang
pohon, maka usia pohon juga semakin tua sehingga akumulasi zat-zat yang
terdapat didalam pohon tersebut semakin besar. Senyawa logam berat yang
terdapat didalam pembuluh pengangkut dan kulit batang tanaman dapat
terlokalisasi dengan baik. Menurut Andani dan Purbayanti (1981), salah satu
gejala lokalisasi sebagai cara untuk penanggulangan ion-ion toksik dalam tanaman
yaitu dengan cara mendistribusikan logam-logam toksik didalam tanaman secara
merata keseluruh bagian tanaman.
Kandungan Logam berat Cd dan Pb pada Daun A.marina
Berdasarkan pengukuran yang dilakukan, kandungan logam berat Cd
tertinggi pada daun terdapat pada stasiun I yaitu 0,003 mg/kg, sedangkan untuk
logam berat Pb, kandungan tertinggi pada daun terdapat pada stasiun II yaitu 2,10
mg/kg.
Perbedaan nilai kandungan logam berat Cd dan Pb pada daun A. marina
pada setiap stasiun pengamatan disebabkan oleh perbandingan daun tua (pada
pangkal dengan ukuran daun yang cukup besar, tebal, dan warna daun adalah
hijau tua) dan daun muda (pada pucuk, ukuran daun kecil, sedikit tipis, dan warna
daun adalah hijau muda) yang dikompositkan. Kanvel (2013), menyatakan
kandungan logam berat pada daun muda lebih sedikit dibandingkan dengan daun
tua. Soemirat (2003) menyatakan bahwa daun yang lebih muda lebih sulit
yang terjadi pada tumbuhan adalah mengakumulasi ion-ion yang berlebih dalam
daun tua, yang akhirnya diikuti dengan abisisi (pengguguran) daun.
Banyaknya akumulasi Cd dan Pb pada bagian daun merupakan usaha
lokalisasi yang dilakukan oleh tumbuhan yaitu mengumpulkannya dalam satu
organ. Dahlan (1986) menyatakan bahwa proses masuknya unsur Cd dan Pb ke
dalam jaringan tumbuhan bisa melalui xylem kesemua bagian tumbuhan sampai
kedaun atau dengan cara penempelan partikel Cd dan Pb pada daun masuk
kedalam jaringan melalui stomata.
Kandungan Logam Berat Cd dan Pb pada Air dan Sedimen.
Kandungan logam berat Cd tertinggi pada air terdapat pada stasiun I
yaitu 0,003 mg/L dan terendah terdapat pada stasiun III yaitu 0,0013 mg/L.
Sedangkan untuk logam berat Pb, kandungan yang tertinggi pada air terdapat pada
stasiun III yaitu 0,24 mg/L dan terendah pada stasiun I yaitu 0,22 mg/L. Pada
sedimen, kandungan logam berat Cd tertinggi terdapat pada stasiun I yaitu 0,003
mg/kg dan terendah pada stasiun III yaitu 0,001 mg/kg. Untuk logam berat Pb,
kandungan yang tertinggi terdapat pada stasiun I yaitu 11,5 mg/kg dan terendah
terdapat pada stasiun II yaitu 7,40 mg/kg.
Kandungan Cd pada stasiun I lebih tinggi disebabkan karena lokasi
stasiun I dekat dengan industri pembangkit listrik, pemukiman padat penduduk,
aktivitas pelayaran dan endapan sampah. Akbar dkk (2014) menyatakan bahwa
asal Cadmium (Cd) di perairan diduga dari limbah plastik, cat pada perahu
nelayan dan tumpahan solar di laut. Akumulasi logam berat diperairan juga
Dari hasil yang didapatkan, logam berat Cd dalam air laut telah melebihi
ambang batas, dimana baku mutu logam berat Cd pada air laut adalah 0,001 ppm
(KEPMEN LH No.51 Tahun 2004). Hal ini disebabkan karena lokasi
pengambilan sampel dekat dengan tempat tinggal masyarakat yang membuang
limbah ke perairan, dan berada pada jalur pelayaran, sehingga bisa tercemar oleh
tumpahan minyak/solar dari kapal. Jika dibandingkan penelitian Melisa (2014),
yang menyatakan bahwa kandungan logam berat Cd di perairan Belawan
Sumatera Utara masih dalam kondisi normal atau belum melebihi baku mutu yang
ditetapkan, yaitu < 0,006 (Limit of Detection : LOD), menunjukkan bahwa
pencemaran logam berat Cd diperairan Belawan mengalami peningkatan.
Kandungan Pb pada stasiun I lebih tinggi disebabkan karena lebih
banyak menerima pasokan limbah yang mengandung Pb berasal dari industri,
transportasi laut, dan kegiatan lainnya. Darmono (1995) menyatakan bahwa bahan
pencemar seperti logam berat memasuki badan air melalui berbagai cara seperti
pembuangan limbah oleh industri, pertanian, domestik, dan perkotaan, dll.
Logam berat Pb pada air berdasarkan hasil pengujian, menunjukkan
bahwa perairan Belawan telah tercemar logam berat logam berat Pb karena telah
melebihi baku mutu yang ditetapkan. Baku mutu logam berat Pb adalah 0,008
ppm (KEPMEN LH No. 51 Tahun 2004). Hasil penelitian Melisa (2004),
menunjukkan bahwa perairan Belawan telah tercemar logam berat Pb. Hal ini
disebabkan lokasi penelitian berada pada jalur pelayaran dan muara sungai
Belawan, dimana disepanjang bantaran sungai Belawan dijumpai industry pipa
Perbedaan kandungan logam berat Cd dan Pb pada air dapat disebabkan
oleh perbedaan waktu pengambilan sampel air, yang dipengaruhi oleh pasang
surut air laut. Hoshika dkk (1991), menyatakan bahwa pola arus mempengaruhi
keberadaan logam berat dalam air karena arus perairan dapat menyebabkan logam
berat terlarut dalam air dari permukaan kesegala arah.
Kandungan logam berat Cd tertinggi pada sedimen yaitu 0,003 mg/kg
pada stasiun I dan logam berat Pb pada stasiun I yaitu 11,50 mg/kg. Menurut
IADC/CEDA (1997), dalam penentuan kadar logam berat yang masih dapat
ditoleransi pada sedimen yaitu untuk Cd sebesar 30 mg/kg dan untuk Pb sebesar
1000 mg/kg. Kandungan logam berat Cd dan Pb pada ketiga stasiun pengamatan
masih dapat ditoleransi. Penelitian Melisa (2004), menunjukkan bahwa
kandungan Logam Berat Cd dan Pb masih dapat ditoleransi, karena kandungannya
tidak melebihi batas atau baku mutu logam berat Cd dan Pb untuk sedimen yang
telah ditentukan.
Kandungan logam berat pada sedimen lebih tinggi dibandingkan dengan
kandungan logam berat pada air. Hal ini dapat terjadi karena adanya pengendapan
pada sedimen pada saat kandungan logam berat pada air tinggi. Kanvel (2013)
menyatakan bahwa, logam berat memiliki sifat yang mudah mengikat bahan
organik dan mengendap didasar perairan dan berikatan dengan partikel-partikel
sedimen, sehingga kandungan logam berat pada sedimen lebih tinggi
dibandingkan kandungan logam berat pada air.
Faktor Biokonsentrasi (BCF)
Faktor biokonsentrasi (BCF) adalah konsentrasi suatu senyawa didalam
medium air satuannya (kg/L). Untuk mendapatkan nilai faktor biokonsentrasi dari
A. marina maka kandungan logam berat Cd dan Pb dari akar, kulit batang dan
daun dibagi dengan konsentrasi logam berat Cd dan Pb yang terdapat pada air.
Faktor biokonsentrasi dihitung untuk melihat kemampuan A. marina dalam
mengakumulasi logam berat Cd dan Pb.
Hasil perhitungan nilai biokonsentrasi untuk logam berat Pb pada stasiun
I dapat disimpulkan bahwa kemampuan A. marina mengakumulasi logam berat
Pb lebih besar dibandingkan logam berat Cd. Untuk stasiun I, nilai BCF logam Pb
sebesar 39,409 ppm dan nilai BCF logam Cd sebesar 2,33 ppm. Stasiun II, nilai
BCF logam Pb sebesar 25,565 ppm dan nilai BCF logam Cd sebesar 3 ppm.
Stasiun III, nilai BCF logam Pb adalah sebesar 42,125 ppm dan untuk logam Cd
sebesar 3,84 ppm. Hasil penelitian Nastia (2014), menunjukkan bahwa pohon
mangrove A. marina, dapat mengakumulasi logam berat Pb diperairan sebesar
39,3915 ppm. Penelitian Setiawan (2013), menunjukkan pohon mangrove A.
marina, juga dapat mengakumulasi logam berat Cd yaitu sebesar 30,90 ppm.
Secara umum, hasil penelitian ini menunjukkan bahwa mangrove A.
marina mempunyai kemampuan dalam mengakumulasi logam berat dalam
jaringan tubuhnya. Hal ini sesuai dengan penelitian yang dilakukan Hamzah dan
Setiawan (2010), yang menyatakan bahwa mangrove jenis A. marina mempunyai
kemampuan mengakumulasi logam berat tinggi dibandingkan dengan mangrove
jenis Sonneratia caseolaris dan Rhizophora mucronata. Hal ini kemungkinan
disebabkan oleh letak A. marina yang berada pada zona terdepan sehingga
merupakan jenis mangrove yang mendapat masukan bahan pencemar yang
KESIMPULAN DAN SARAN
Kesimpulan
1. Kandungan logam berat Cd tertinggi pada akar A. marina terdapat pada stasiun
I dan III yaitu sebesar 0,003 mg/kg, untuk logam berat Pb, yang tertinggi
terdapat pada stasiun III yaitu sebesar 6,50 mg/kg. Kandungan Cd tertinggi
pada daun terdapat pada stasiun I yaitu 0,003 mg/kg, untuk logam Pb pada
daun yang tertinggi adalah pada stasiun II yaitu 2,10 mg/kg. Kandungan logam
Cd tertinggi pada kulit batang adalah pada stasiun II yaitu sebesar 0,003 mg/kg
dan untuk logam Pb terdapat pada stasiun I yaitu 4,21 mg/kg.
2. Kemampuan A. marina dalam mengakumulasi logam berat Pb pada setiap
stasiun pengamatan dikategorikan rendah dengan nilai BCF sebesar 39,409
ppm untuk stasiun I, 25,565 ppm untuk stasiun II dan 42,125 ppm untuk
stasiun III, sedangkan untuk logam Cd adalah stasiun I yaitu 2,33 ppm, stasiun
II adalah 3 ppm, dan stasiun III adalah 3,84 ppm, dikategorikan rendah.
Saran
Dari hasil penelitian yang dilakukan, pohon mangrove A. marina mampu
mengakumulasi logam berat di perairan. Untuk itu perlu dilakukan penelitian
lanjutan secara periodik dan disarankan untuk tetap melindungi vegetasi
mangrove khususnya A.marina karena dapat menjadi akumulator pencemaran
logam berat dan mengurangi toksisitas logam berat di perairan, khususnya
TINJAUAN PUSTAKA
Ekosistem Mangrove
Ekosistem mangrove merupakan mata rantai utama yang berperan
sebagai produsen dalam jaring makanan ekosistem pantai. Selain itu ekosistem
mangrove yang memiliki produktivitas tinggi menyediakan makanan berlimpah
bagi berbagai jenis hewan laut dan menyediakan tempat berkembang biak,
memijah, dan membesarkan anak bagi beberapa jenis ikan, kerang, kepiting dan
udang, sehingga secara tidak langsung kehidupan manusia tergantung pada
keberadaan ekosistem mangrove. Mangrove juga memiliki fungsi fisik bagi pantai
yaitu sebagai pelindung pantai dari hempasan ombak dan angin kencang, penahan
abrasi, penampung air hujan sehingga mencegah banjir, dan penyerap limbah
yang mencemari perairan (Mulyadi dkk., 2007).
Hutan mangrove yang terbentuk tergantung pada kondisi yang
mendukung, yaitu faktor abiotik dan biotik. Menurut Chapman (1975), faktor
abiotik sebagai syarat utama terbentuknya hutan mangrove adalah suhu udara (air
temperature), substrat lumpur (mud substrate), daerah payau (tidal range), arus
air laut, perlindungan (protection), air garam (salt water) dan tepi laut yang
dangkal (shallow shores).
Menurut Arisandi (2001), Mangrove merupakan tempat yang praktis
untuk pembuangan sampah karena wilayah ini jauh dari pemukiman penduduk.
Pemandangan menyedihkan yang biasa ditemui pada ekosistem mangrove adalah
dan tersangkut di akar-akar mangrove. Pembuangan sampah ke dalam ekosistem
ini merupakan indikator rendahnya perhatian masyarakat terhadap ekosistem ini.
Mangrove yang tumbuh di ujung sungai besar berperan sebagai
penampungan terakhir bagi limbah dari industri di perkotaan dan perkampungan
hulu yang terbawa aliran sungai. Limbah padat dan cair yang terlarut dalam air
sungai terbawa arus menuju muara sungai dan laut lepas. Area hutan mangrove
akan menjadi daerah penumpukan limbah, terutama jika polutan yang masuk ke
dalam lingkungan estuari melampaui kemampuan pemurnian alami oleh air.
Mangrove alami berperan efektif dalam melindungi pantai dari tekanan alam dan
erosi (Mulyadi dkk., 2007).
Avicennia marina
Menurut Noor dkk (1999) taksonomi Avicennia marina :
Kingdom : Plantae
Filum : Tracheophyta
Kelas : Magnoliopsida
Ordo : Lamiales
Famili : Acanthaceae
Genus : Avicennia
Spesies : Avicennia marina Forsk.
Menurut Tomlinson (1996), pohon api-api (Avicennia marina) telah
dimasukkan dalam suku tersendiri yaitu Avicenniaceae, setelah sebelumnya
dimasukkan dalam suku Verbenaceae, karena Avicennia memiliki perbedaan
mendasar dalam bentuk organ reproduksi dan cara berkembang biak dengan
Pohon api-api (Avicennia marina) memiliki akar napas (pneumatofore)
yang merupakan akar percabangan yang tumbuh dengan jarak teratur secara
vertikal dari akar horizontal yang terbenam di dalam tanah. Reproduksinya
bersifat kryptovivipary, yaitu biji tumbuh keluar dari kulit biji saat masih
menggantung pada tanaman induk, tetapi tidak tumbuh keluar menembus buah
sebelum biji jatuh ke tanah. Buah berbentuk seperti mangga, ujung buah tumpul
dan panjang 1 cm, daun berbentuk ellips dengan ujung tumpul dan panjang daun
sekitar 7 cm, lebar daun 3-4 cm, permukaan atas daun berwarna hijau mengkilat
dan permukaan bawah berwarna hijau abu-abu dan suram (Arisandi, 2001).
Struktur dan Zonasi Hutan Mangrove
Zonasi merupakan suatu fenomena ekologi yang menarik di perairan
pesisir, yang merupakan daerah yang terkena ritme pasang-surut air laut.
Pengaruh dari pasang-surut air laut yang berbeda untuk tiap zona memungkinkan
berkembangnya komunitas yang khas untuk masing masing zona di daerah ini
(Peterson, 1991).
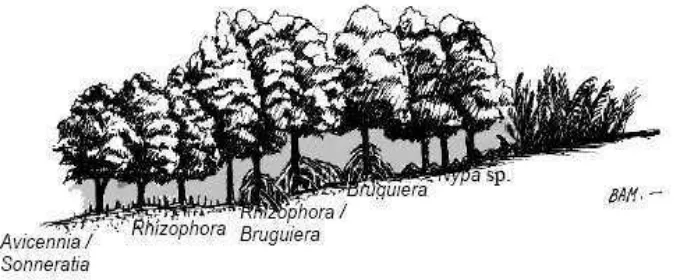
Kusmana (1995), berpendapat bahwa hutan mangrove dapat dibagi
menjadi lima bagian berdasarkan frekuensi air pasang, yaitu zonasi yang terdekat
dengan laut, akan didominasi oleh Avicennia spp dan Sonneratia spp, tumbuh
pada lumpur lunak dengan kandungan organik yang tinggi. Avicennia spp tumbuh
pada substrat yang agak keras, sedangkan Avicennia albatumbuh pada substrat
yang agak lunak; zonasi yang tumbuh pada tanah kuat dan cukup keras serta
dicapai oleh beberapa air pasang. Zonasi ini sedikit lebih tinggi dan biasanya
didominasi oleh Bruguiera cylindrica; ke arah daratan lagi, zonasi yang
Rhyzophora mucronata lebih banyak dijumpai pada kondisi yang agak basah dan
lumpur yang agak dalam. Pohon-pohon yang dapat tumbuh setinggi 35-40 m.
Pohon lain yang juga terdapat pada hutan ini mencakup Bruguiera parviflora dan
Xylocarpus granatum; hutan yang didominasi oleh Bruguiera parviflora
kadang-kadang dijumpai tanpa jenis pohon lainnya; hutan mangrove di belakang
didominasi oleh Bruguiera gymnorrhiza. Pola zonasi mangrove dapat dilihat pada
Gambar 2.
Gambar 2. Pola zonasi mangrove
Tomlinson (1986) membagi flora dan fauna mangrove menjadi tiga
kelompok sesuai dengan kemampuan adaptasinya terhadap lingkungan mangrove,
yakni :
1. Flora mangrove mayor (flora yang sebenarnya), yakni flora yang menunjukkan
kesetiaan terhadap habitat mangrove, berkemampuan membentuk tegakan
murni dan secara dominan mencirikan struktur komunitas, secara morfologi
mempunyai bentuk-bentuk adaptif khusus (bentuk akar dan viviparitas)
mengontrol garam. Contohnya adalah : Avicennia, Rhizophora, Bruguiera,
Ceriops, kandelia, Sonneratia, Lumnitzera, Laguncularia, dan Nypa.
2. Flora mangrove minor, yaitu flora mangrove yang tidak mampu membentuk
tegakan murni, sehingga secara morfologis tidak berperan dominan dalam
struktur komunitas, contohnya: Excoecaria, Xylocarpus, Heritiera, Aegialitis,
Achrostichum, Camptostemon, Schyphipora, Phempis, Osbornia, dan Peliciera.
3. Asosiasi mangrove, contohnya adalah Cerbera, Acanthus, Derris, Hibiscus,
Calamus.
Pengertian Logam Berat
Menurut Sudarwin (2008), Logam berat masih termasuk golongan logam
dengan kriteria - kriteria yang sama dengan logam-logam yang lain. Perbedaan
terletak pada dari pengaruh yang dihasilkan bila logam berat ini masuk atau
diberikan ke dalam tubuh organisme hidup. Istilah logam berat sebetulnya sudah
dipergunakan secara luas, terutama dalam perpustakaan ilmiah, sebagai unsur
yang menggambarkan bentuk dari logam tertentu. Karakteristik dari kelompok
logam berat adalah sebagai berikut:
1. Memiliki spesifikasi grafitasi yang sangat besar (lebih dari 4).
2. Mempunyai nomor atom 22 - 23 dan 40 - 50 serta unsur laktanida dan aktinida.
3. Mempunyai respon biokimia yang khas (spesifik) pada organisme hidup
Menurut Mason (1981) dan Moore dan Ramamoorthy (1984), bahwa
logam berat pada umumnya bersifat toksik dan dapat terakumulasi dalam tubuh
makhluk hidup. Logam berat juga dapat mengakibatkan terganggunya kesehatan
Penyebab utama logam berat menjadi bahan pencemar berbahaya yaitu
logam berat tidak dapat dihancurkan (nondegradable) oleh organisme hidup di
lingkungan dan terakumulasi ke lingkungan, terutama mengendap di dasar
perairan membentuk senyawa komplek bersama bahan organik dan anorganik
secara adsorbsi dan kombinasi (Djuangsih dkk., 1982).
Adanya toksisitas logam berat di dalam ekosistem perairan akan
memberikan dampak negatif pada biota air yang terdapat didalamnya, yakni
proses fisiologi akan terganggu, dapat menyebabkan terjadinya kecacatan
morfologi pada biota air. Hal tersebut terjadi apabila ekosistem perairan
mengalami pencemaran. Selain itu akan mengakibatkan tingginya konsentrasi
logam berat pada air, dengan terjadinya bioakumulasi juga akan menyebabkan
konsentrasi logam berat dalam tubuh hewan air akan jauh lebih tinggi (Riani,
2010).
Semua logam berat dapat dikatakan sebagai bahan beracun yang
akanmeracuni makhluk hidup. Sebagai contoh logam berat air raksa (Hg),
kadmium (Cd), timbal (Pb), dan krom (Cr). Namun demikian, meskipun semua
logam berat dapat mengakibatkan keracunan atas makhluk hidup, sebagian dari
logam - logam berat tersebut dibutuhkan oleh makhluk hidup. Kebutuhan tersebut
dalam jumlah yang sangat kecil/sedikit. Tetapi apabila kebutuhan yang sangat
kecil tersebut tidak terpenuhi dapat berakibat fatal terhadap kelangsungan
makhluk hidup. Karena tingkat kebutuhan yang sangat dipentingkan maka logam -
logam tersebut juga dinamakan sebagai logam - logam esensial tubuh. Bila logam
berubah fungsi menjadi racun. Contoh dari logam berat esensial ini adalah
tembaga (Cu), seng (Zn), dan nikel (Ni), (Sudarwin, 2008).
Cadmium (Cd)
Kegiatan pembangunan, terutama di sektor industri yang pada prinsipnya
adalah untuk meningkatkan kualitas hidup manusia, juga dapat menurunkan
derajat kesehatan masyarakat. Banyaknya industri-industri yang berada di sekitar
perairan, seperti industri pabrik bahan kimia, industri cat, baterai, pabrik pipa
PVC, merupakan salah satu alasan mengapa suatu perairan bisa tercemar
(Mulyadi dkk., 2007).
Semakin cepatnya pergerakan sedimen khususnya yang berasal dari arah
daratan menuju laut disebabkan oleh semakin tingginya aktifitas masyarakat
mapun industri yang lebih memilih membuang limbah kegiatan mereka menuju
sungai sungai yang secara tidak disadari bahwa limbah yang mereka buang akan
mencemari perairan, khususnya wilayah estuaria atau muara. Apalagi
perkembangan dunia industri yang makin berkembang menuntut berbagai pihak
untuk membangun banyak industri untuk menopang perekonomian mereka.
Dalam kaitannya dengan pencemaran lingkungan pesisir dan laut, beberapa
industri yang dimaksud adalah industri pertanian, elektronik, cat, dan bahkan
pertambangan emas dan lain sebagainya. Beberapa industri tersebut membuang
limbah-limbah hasil kegiatan mereka melalui sungai yang secara langsung
mengarah ke kawasan estuaria (Wibowo, 2011).
Kadmium merupakan logam berat yang sangat toksik setelah merkuri
(Hg) (Connel, 1995). Kadmium (Cd) sering digunakan sebagai bahan utama atau
(50-55% konsumsi dunia), pigmen (18-20%), bahan coating (8-12%), bahan
stabilizers dalam industri plastik dan barang sintetis lain (6-10%). Sampai dengan
akhir abad 20, 45 % total pencemaran global adalah logam kadmium (Setiawati,
2009).
Perairan di Indonesia telah tercemar kadmium, diantaranya, di estuari
Sungai Digul dan Laut Arafuru tahun 2001 sebesar 0,001-0,002 ppm di perairan
Pantai Propinsi Banten tahun 2001 sebesar <0,001-0,001 ppmdan di Sungai
Kampar Riau tahun 2006 sebesar 0,035-0,046 ppm. Berdasarkan Keputusan
Menteri Negara Lingkungan Hidup No.51 Tahun 2004 Tentang Baku Mutu Air
Laut, kandungan kadmium pada perairan tersebut melebihi baku mutu untuk biota
laut yaitu 0,001 ppm (Arifin, 2012).
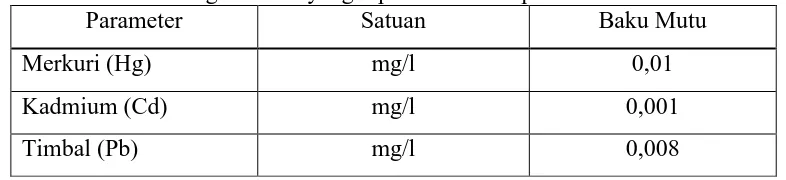
Akumulasi yang berlebihan dari logam berat di perairan akan berdampak
buruk terhadap berbagai kehidupan disana. Kementerian Lingkungan Hidup
menetapkan baku mutu yang menjadi acuan kadar logam berat yang dibolehkan.
Baku mutu logam berat tersebut dapat dilihat pada Tabel 1.
Tabel 1.Baku mutu logam berat yang diperbolehkan diperairan.
Parameter Satuan Baku Mutu
Merkuri (Hg) mg/l 0,01
Kadmium (Cd) mg/l 0,001
Timbal (Pb) mg/l 0,008
Menurut Effendi (2003), secara luas masih banyak sumber logam berat
lainnya yang terdapat dalam perairan dan berpotensi mencemarinya. Akumulasi
yang melebihi batas yang dibolehkan akan merubah fungsi lingkungan dan dapat
membahayakan berbagai ekosistem disana. Kadar logam berat Cd yang terdapat
Tabel 2.Kadar logam berat kadmium diperairan tawar dan laut.
Logam berat kadmium (Cd) bersifat karsinogen, mutagenik dan
teratogenik pada beberapa jenis hewan. Ketika berada di dalam sel, Cd akan
menginduksi berbagai jenis mekanisme signal transduksi serta mengaktifkan
banyak gen. Salah satu efek langsung yang ditimbulkan oleh Cd adalah
mengganggu proses homeostasis sel. Mekanisme homeostasis sel terlaksana
dengan keberadaan protein metallothionine (MT) yang berperan sebagai protein
pengikat logam dan mengurangi efek toksik (Rumahlatu dkk., 2012).
Jonak et al. (2004) menjelaskan bahwa kadmium tidak diketahui
memiliki fungsi biologis di dalam sel tetapi memiliki sifat reaktif yang sangat
tinggi dan dapat menginaktifkan berbagai macam aktivitas enzim yang diperlukan
oleh sel. Setelah diabsorbsi, logam berat kadmium akan terakumulasi di dalam
organ target yang utamanya adalah ginjal kemudian menimbulkan toksisitas (Rico
et al., 2002). Di dalam ginjal, akumulasi kadmium terjadi umumnya di dalam
tubulus proximal serta segmen-segmen nefron lainnya yang hanya terjadi pada
akhir tahap intoksifikasi (Yokouchi et al., 2007).
Timbal (Pb)
Timbal adalah suatu unsur kimia dalam unsur periodic yang memiliki
lambang Pb dan nomor atom 82. Timbal (Pb) adalah logam berat yang terdapat
secara alami didalam kerak bumi. Keberadaan timbal bisa juga berasal dari hasil
alami yang terdapat pada kerak bumi. Pb terkonsentrasi dalam deposit biji logam.
Unsur Pb digunakan dalam bidang industri modern sebagai bahan pembuatan pipa
air yang tahan korosi, bahan pembuat cat, baterai, dan campuran bahan bakar
bensin tetraetil (Kanvel, 2013).
Timbal merupakan salah satu logam berat yang sangat berbahaya bagi
kesehatan manusia serta merupakan unsur logam berat yang tidak dapat terurai
oleh proses alam. Secara alamiah Pb dapat masuk kedalam badan perairan melalui
pengkristalan diudara dengan bantuan air hujan, melalui proses modifikasi dari
batuan mineral akibat hempasan gelombang dan angin. Timbal yang masuk
kedalam badan perairanmerupakan dampak dari aktivitas kehidupan manusia
(Fuad, 2008).
Timbal merupakan logam yang sangat rendah daya larutnya bersifat
pasif, dan mempunyai daya translokasi yang rendah mulai dari akar sampai organ
tumbuhan lainnya. Timbal juga memiliki toksisitas yang tertinggi dan
menyebabkan racun bagi beberapa spesies. Senyawa ini banyak ditemukan dalam
pertambangan-pertambangan diseluruh dunia. Bahaya yang ditimbulkan oleh
penggunaan timah hitam memyebabkan keracunan (Hamzah dan Setiawan, 2010).
Mekanisme Penyerapan Logam Berat oleh Mangrove
Tumbuhan mangrove termasuk jenis tumbuhan air yang mempunyai
kemampuan sangat tinggi untuk mengakumulasi logam berat yang berada pada
wilayah perairan. Proses absorpsi pada tumbuhan terjadi seperti pada hewan
dengan berbagai proses difusi, dan istilah yang digunakan adalah translokasi.
Transport ini terjadi dari sel ke sel menuju jaringan vaskuler agar dapat
Menurut Fitter (1982), analogi ini menunjukkan adanya barier khusus
dalam membran sel yang hanya sesuai untuk suatu ion tertentu dan dapat
menyerap ion tersebut, sehingga pada konsentrasi substrat yang tinggi semua
barier berperan pada laju maksimum hingga mencapai laju pengambilan jenuh.
Sel-sel akar tumbuhan umumnya mengandung konsentrasi ion yang lebih tinggi
dari pada medium di sekitarnya. Sejumlah besar eksperimen menunjukkan adanya
hubungan antara laju pengambilan ion dengan konsentrasi ion yang menyerupai
hubungan antara laju reaksi yang dihantarkan enzim dengan konsentrasi
substratnya.
Soemirat (2003) menyatakan bahwa proses absorpsi dapat terjadi lewat
beberapa bagian tumbuhan, yaitu:
1. Akar, terutama untuk zat anorganik dan zat hidrofilik.
2. Daun bagi zat yang lipofilik.
3. Stomata untuk masukan gas.
Melalui akarnya, vegetasi Avicennia marina dapat menyerap
logam-logam berat yang terdapat pada sedimen maupun air. Mangrove memiliki
kemampuan dalam menyerap bahan-bahan organik dan non organik dari
lingkungannya kedalam tubuh melalui membran sel. Proses ini merupakan bentuk
adaptasi mangrove terhadap kondisi lingkungan yang ekstrim. Mangrove melalui
akarnya, vegetasi ini dapat menyerap logam-logam berat yang terdapat pada
sedimen maupun kolom air (Amin, 2001).
Mekanisme penyerapan dan akumulasi logam berat oleh tanaman dapat
dibagi menjadi tiga proses yang berkaitan, yaitu penyerapan (absorbsi) oleh akar,
dan jaringan. Hal ini bertujuan untuk menjaga agar logam tidak menghambat
metabolisme tanaman. Sebagai upaya untuk mencegah peracunan logam terhadap
sel, tanaman mempunyai mekanisme detoksifikasi, misalnya dengan menimbun
logam di dalam organ tertentu seperti akar. Walaupun masukan sumber pencemar
sangat banyak, mangrove memiliki toleransi yang tinggi terhadap logam berat.
Hal ini menunjukkan bahwa mangrove secara aktif menghindari masukan logam
berat yang berlebih dan berfungsi sebagai penyaring dan memiliki daya treatment
khas secara alami melalui organ akar. Akumulasi logam berat terjadi pada akar
dan dibawa ke jaringan lainnya dan proses ini bisa membatasi masuknya udara ke
dalam jaringan tersebut (Palar, 1994).
Mekanisme masuknya partikel logam ke dalam jaringan daun, yaitu
melalui stomata daun yang berukuran besar dan ukuran partikel logam lebih kecil,
Sehingga logam dengan mudah masuk ke dalam jaringan daun melalui proses
penyerapan pasif. Partikel logam yang menempel pada permukaan daun berasal
dari tiga proses yaitu sedimentasi akibat gaya gravitasi, tumbukan akibat
turbulensi angin dan pengendapan yang berhubungan dengan hujan. Celah
stomata mempunyai panjang sekitar 10 µm dan lebar antara 2-7 µm, oleh karena
ukuran logam yang berukuran kecil, maka partikel logam tidak larut dalam air dan
senyawa terperangkap dalam rongga antar sel sekitar stomata (Deri dkk.,2013).
Satu diantara beberapa spesies mangrove yang memiliki kemampuan
menyerap logam berat adalah Api-api (Avicennia marina). Rohmawati (2007),
mengemukakan bahwa Pohon A. marina memiliki upaya penanggulangan materi
toksik lain diantaranya dengan melemahkan efek racun melalui pengenceran
logam berat dalam jaringan tubuhnya sehingga mengurangi toksisitas logam
tersebut.
Menurut Kanvel (2013), perbandingan antara daun tua (pada pangkal
dengan ukuran yang cukup besar, ketebalan dan warna daun hijau tua) dan daun
muda (pada pucuk, ukuran kecil, belum terlalu tebal dan warna daun hijau muda)
yang dikompositkan. Kandungan logam berat pada daun muda lebih sedikit
dibandingkan dengan daun tua disebabkan daun muda sulit mengabsorbsi
daripada daun yang sudah tua. Mekanisme yang terjadi pada tumbuhan adalah
mengakumulasi ion-ion yang berlebih dalam daun tua, yang akhirnya diikuti
dengan abisisi (pengguguran) daun. Perbedaan diameter batang pohon
menentukan banyaknya logam berat dan zat-zat lain yang terakumulasi didalam
pohon tersebut. Senyawa yang larut dalam air diambil oleh akar bersama air,
PENDAHULUAN
Latar Belakang
Aktivitas kehidupan manusia yang sangat tinggi telah menimbulkan
banyak efek buruk bagi kehidupan dan lingkungan hidup manusia. Kegiatan
pembangunan, terutama di sektor industri yang pada prinsipnya adalah untuk
meningkatkan kualitas hidup manusia, juga dapat menurunkan derajat kesehatan
masyarakat (Sinaga dkk., 2013)
Meningkatnya industri memberikan dampak meningkatnya pelepasan
limbah ke lingkungan sekitar termasuk didalamnya lingkungan perairan laut.
Buangan limbah yang masuk ke perairan laut dapat melalui aliran run off maupun
aliran sungai. Salah satu limbah industri yang dilepaskan ke perairan laut adalah
logam berat. Telah diketahui bahwa sekitar 70 % wilayah Indonesia adalah
perairan laut yang merupakan sumberdaya yang sangat besar untuk dapat
dimanfaatkan bagi kesejahteraan manusia. Peningkatan konsentrasi logam berat di
lingkungan perairan laut menimbulkan kekhawatiran masyarakat. Kekhawatiran
ini disebabkan tingkat toksisitas logam berat yang sangat tinggi bagi makhluk
hidup terutama bila terjadi bioakumulasi pada rantai makanan, (Purbonegoro,
2008).
Wilayah pesisir merupakan ekosistem yang paling mudah terkena
dampak kegiatan manusia dan kegiatan pembangunan. Perairan pesisir Belawan
merupakan salah satu perairan yang tercemar logam berat. Kampung Nelayan
berada didekat kawasan industri yang membuang limbah ke perairan, sehingga
di laut yang berpotensi mencemari lingkungan pesisir dan laut antara lain:
Perkapalan, dumping di laut, pertambangan, eksplorasi dan eksploitasi minyak,
budidaya laut, dan perikanan.
Hasil kajian Badan Lingkungan Hidup (2011), terdapat ± 50 industri
yang beroperasi disekitar sungai Deli, yang bermuara ke Belawan. Keseluruhan
industri tersebut diperkirakan membuang langsung limbahnya ke sungai. Selain
limbah dari industri, pencemaran air sungai Deli juga akibat penumpukan sampah.
Beberapa industri seperti pewarnaan, kertas, minyak dan industri pelapisan
melepaskan sejumlah tembaga di Sungai Deli yang langsung bermuara di
Belawan. Beberapa pabrik industri yang diketahui beroperasi di sekitar belawan
adalah, PT. Canang Indah, PT. Indofood, PT. Growth Sumatera Industry, PT.
Putra Baja Deli, PT. Industri Karet Deli, dll.
Salah satu indikator gangguan lingkungan di laut adalah kandungan
logam berat dalam perairan pesisir yang berasal dari kegiatan industri maupun
alam. Logam berat yang berada di perairan akan diserap oleh organisme hidup
melalui proses biologis dan akhirnya terakumulasi. Kandungan logam berat yang
menumpuk pada air laut dan sedimen akan masuk kedalam sistem rantai makanan
dan berpengaruh pada kehidupan organisme perairan (Said dkk., 2009).
Pencemaran perairan ditandai dengan adanya perubahan sifat fisik, kimia
dan biologi perairan. Bahan pencemar berupa logam berat di perairan akan
membahayakan kehidupan organisme, maupun efeknya secara tidak langsung
terhadap kesehatan manusia. Salah satu jenis logam berat yang memasuki perairan
dan bersifat toksik adalah Cadmium (Cd) dan Timbal (Pb). Cadmium (Cd) dan
dihancurkan (non degradable) oleh organisme hidup dan dapat terakumulasi ke
lingkungan, terutama mengendap di dasar perairan membentuk senyawa kompleks
bersama bahan organik dan anorganik. Sumber utama timbal adalah berasal dari
makanan dan minuman.
Organisme perairan merupakan kelompok organisme yang pertama kali
mengalami dampak secara langsung dari pengaruh limbah atau pencemaran
logam berat di perairan. Salah satu organisme perairan yang menerima dampak
langsung pencemaran logam berat adalah tanaman mangrove. Mangrove banyak
dijumpai di wilayah pesisir yang terlindung dari gempuran ombak dan daerah
yang landai. Mangrove tumbuh optimal di wilayah pesisir yang memiliki muara
sungai besar dan delta yang aliran airnya banyak mengandung lumpur. Sedangkan
di wilayah pesisir yang tidak bermuara sungai, pertumbuhan vegetasi mangrove
tidak optimal. Mangrove tidak atau sulit tumbuh diwilayah pesisir yang terjal dan
berombak besar dengan arus pasang surut kuat, karena kondisi ini tidak
memungkinkan terjadinya pengendapan lumpur yang diperlukan sebagai substrat
bagi pertumbuhannya (Dahuri, 2003).
Satu diantara beberapa spesies mangrove yang memiliki kemampuan
menyerap logam berat adalah Api-api (Avicennia marina). Pohon mangrove ini
memiliki upaya penanggulangan materi toksik lain diantaranya dengan
melemahkan efek racun melalui pengenceran (dilusi), yaitu dengan menyimpan
banyak air untuk mengencerkan konsentrasi logam berat dalam jaringan tubuhnya
sehingga mengurangi toksisitas logam tersebut.
Berdasarkan kondisi itu maka perlu untuk dilakukan tindakan sebaik
Salah satu cara adalah dengan mengetahui penyebab dan ancaman serta
bagaimana melakukan pengendalian terhadap keberadaan logam berat tersebut.
Dengan begitu baik keberlangsungan kegiatan masyarakat dan industri tetap
berjalan serta yang paling utama agar kelestarian lingkungan baik darat dan laut
juga tetap terjaga.
Perumusan Masalah
Kontaminasi logam berat terhadap ekosistem perairan telah menjadi
masalah dalam kesehatan lingkungan selama beberapa dekade. Kontaminasi
logam berat pada ekosistem perairan secara intensif berhubungan dengan
pelepasan logam berat oleh limbah domestik, industri dan aktivitas manusia
lainnya. Kontaminasi logam berat dapat menyebabkan efek mematikan terhadap
organisme laut dan menyebabkan ketidakseimbangan ekologis dan
keanekaragaman organisme laut.
Perairan pesisir merupakan salah satu dari lingkungan perairan yang
banyak mendapat pengaruh dari buangan limbah, baik yang berasal dari daratan
maupun di laut lepas. Kenyataannya perairan pesisir dalam menampung dan
mengurai limbah yang terbatas menimbulkan penumpukkan limbah yang lambat
laun menimbulkan pencemaran. Salah satu organisme perairan yang menerima
dampak langsung pencemaran logam berat diwilayah pesisir adalah tanaman
mangrove.
Berdasarkan uraian pada latar belakang diatas, maka permasalahan yang
dikaji dalam penelitian ini dapat dirumuskan sebagai berikut:
1. Bagaimana kemampuan akar pasak, kulit batang dan daun Avicennia marina
2. Bagaimana kandungan logam berat Cd dan Pb yang terdapat pada jaringan akar
pasak, kulit batang, dan daun Avicennia marina di Desa Kampung Nelayan
Seberang?
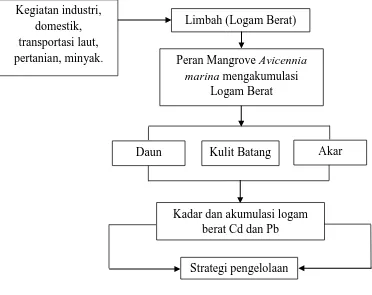
Kerangka Pemikiran
Pencemaran logam berat yang terus-menerus terjadi dapat
mengakibatkan kerusakan lingkungan dan juga dapat berpengaruh terhadap
organisme yang ada diwilayah pesisir. Penelitian ini dilakukan untuk mengetahui
kadar logam berat disuatu perairan dengan menguji kandungannya terhadap
jaringan tumbuhan (akar, kulit batang, daun) Avicennia marina, sehingga dapat
dilakukan kegiatan pengelolaan wilayah pesisir (lingkungan maupun organisme)
terhadap kerusakan akibat pencemaran logam berat. Secara ringkas, kerangka
Tujuan Penelitian
Tujuan dari penelitian ini adalah :
1. Untuk mengetahui kandungan logam berat kadmium dan timbal pada akar,
batang, dan daun Avicenia marina.
2. Mengetahui kemampuan A. marina dalam mengakumulasi logam berat Cd dan Pb.
Manfaat Penelitian
Penelitian ini bermanfaat untuk dapat memberikan informasi tentang
kadar logam berat disuatu perairan yang diuji kandungannya pada jaringan akar
dan daun Avicennia marina, sehingga dapat dilakukan kegiatan pengelolaan
ABSTRAK
VINCES AGRIANI LASE : Daya Serap Pohon Mangrove A. marina Terhadap Logam Berat Kadmium (Cd) dan Timbal (Pb) di Kampung Nelayan Kecamatan Medan Belawan Sumatera Utara. Dibawah bimbingan YUNASFI dan DESRITA.
Banyaknya aktivitas masyarakat maupun industri yang terjadi di Kampung Nelayan dapat menyebabkan tingginya kandungan logam berat dilingkungan perairan, dan juga dapat berpengaruh terhadap organisme yang hidup diperairan. Tujuan penelitian ini adalah untuk mengetahui kandungan logam berat Cd dan Pb pada akar, kulit batang, daun dan mengetahui kemampuan Avicennia marina dalam mengakumulasi logam berat. Pengambilan sampel dilakukan di Kampung Nelayan Kecamatan Medan Belawan, dengan tiga stasiun pengamatan. Analisis logam berat dilakukan di Balai Riset dan Standarisasi Industri Medan Sumatera Utara dengan menggunakan metode Atomic Absorption Spectrofotometer (AAS). Hasil penelitian menunjukkan kandungan logam berat Pb pada akar, kulit batang, dan daun Avicennia marina lebih besar dibandingkan dengan kandungan logam berat Cd. Kemampuan Avicennia marina dalam mengakumulasi logam berat Pb dan Cd dikategorikan rendah.
ABSTRACT
VINCES AGRIANI LASE. Accumulation of Heavy Metals Cadmium (Cd) and Plumbum (Pb) on Mangrove Avicennia marina in Nelayan Village, District of Medan Belawan, North Sumatera. Under academic supervision by YUNASFI and DESRITA.
Many activity by human and industry in Nelayan Village can be support the present of heavy metal in acuatiq environmental and can put on effect to aquatic organism. The purpose of researching in to analyze the content of heavy metals Cadmium (Cd) and Plumbum (Pb) on roots, barks, leaves and knowing the ability of Avicennia marina in accumulating heavy metals. The sample was located in Nelayan Village, District of Medan Belawan. The analysis of heavy metals Cd dan Pb is carried out in a Balai Riset dan Standarisasi Industri Medan, by using the metod Atomic Absorption Spectrofotometer (AAS). The results of this research indicated that the heavy metal content of Pb in the roots, barks, and leaves is larger more than Cd. Based on the bioconcentration factor, the ability of Avicennia marina in accumulate heavy metals Cd and Pb categorized low.
DAYA SERAP POHON MANGROVE Avicennia marina TERHADAP
LOGAM BERAT CADMIUM (Cd) DAN TIMBAL (Pb) DI
KAMPUNG NELAYAN KECAMATAN MEDAN
BELAWAN SUMATERA UTARA
VINCES AGRIANI LASE
120302046
PROGRAM STUDI MANAJEMEN SUMBERDAYA PERAIRAN
FAKULTAS PERTANIAN
DAYA SERAP POHON MANGROVE Avicennia marina TERHADAP
LOGAM BERAT CADMIUM (Cd) DAN TIMBAL (Pb) DI
KAMPUNG NELAYAN KECAMATAN MEDAN
BELAWAN SUMATERA UTARA
SKRIPSI
VINCES AGRIANI LASE
120302046
PROGRAM STUDI MANAJEMEN SUMBERDAYA PERAIRAN
FAKULTAS PERTANIAN
DAYA SERAP POHON MANGROVE Avicennia marina TERHADAP
LOGAM BERAT CADMIUM (Cd) DAN TIMBAL (Pb) DI
KAMPUNG NELAYAN KECAMATAN MEDAN
BELAWAN SUMATERA UTARA
SKRIPSI
VINCES AGRIANI LASE
120302046
Skripsi Sebagai Satu diantara Beberapa Syarat Untuk Memperoleh Gelar Sarjana Perikanan di Program Studi Manajemen Sumberdaya Perairan
Fakultas Pertanian Universitas Sumatera Utara
PROGRAM STUDI MANAJEMEN SUMBERDAYA PERAIRAN
FAKULTAS PERTANIAN
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER
INFORMASI
Saya yang bertanda tangan dibawah ini :
Nama : Vinces Agriani Lase
NIM : 120302046
Menyatakan bahwa skripsi saya yang berjudul “Daya Serap Pohon Mangrove
Avicennia marina terhadap Logam Berat Cadmium (Cd) dan Timbal (Pb) di Kampung Nelayan Kecamatan Medan Belawan Sumatera Utara” adalah
benar hasil karya saya sendiri dan belum dijadikan dalam bentuk apapun kepada
perguruan tinggi manapun. Semua sumber data dan informasi yang berasal atau
dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah
disebutkan didalam teks dan dicantumkan dalam bagian akhir skripsi ini.
Medan, April 2016
LEMBAR PENGESAHAN
Judul Penelitian : Daya Serap Pohon Mangrove Avicennia marina terhadap Logam Berat Cadmium (Cd) dan Timbal (Pb) di Kampung Nelayan Kecamatan Medan Belawan Sumatera Utara
Nama : Vinces Agriani Lase
NIM : 120302046
Program Studi : Manajemen Sumberdaya Perairan
Disetujui Oleh Komisi Pembimbing
Dr. Ir.Yunasfi, M.Si Desrita, S.Pi, M.Si Ketua Anggota
Mengetahui
Dr. Ir. Yunasfi, M.Si
ABSTRAK
VINCES AGRIANI LASE : Daya Serap Pohon Mangrove A. marina Terhadap Logam Berat Kadmium (Cd) dan Timbal (Pb) di Kampung Nelayan Kecamatan Medan Belawan Sumatera Utara. Dibawah bimbingan YUNASFI dan DESRITA.
Banyaknya aktivitas masyarakat maupun industri yang terjadi di Kampung Nelayan dapat menyebabkan tingginya kandungan logam berat dilingkungan perairan, dan juga dapat berpengaruh terhadap organisme yang hidup diperairan. Tujuan penelitian ini adalah untuk mengetahui kandungan logam berat Cd dan Pb pada akar, kulit batang, daun dan mengetahui kemampuan Avicennia marina dalam mengakumulasi logam berat. Pengambilan sampel dilakukan di Kampung Nelayan Kecamatan Medan Belawan, dengan tiga stasiun pengamatan. Analisis logam berat dilakukan di Balai Riset dan Standarisasi Industri Medan Sumatera Utara dengan menggunakan metode Atomic Absorption Spectrofotometer (AAS). Hasil penelitian menunjukkan kandungan logam berat Pb pada akar, kulit batang, dan daun Avicennia marina lebih besar dibandingkan dengan kandungan logam berat Cd. Kemampuan Avicennia marina dalam mengakumulasi logam berat Pb dan Cd dikategorikan rendah.