PENGARUH SUKROSA DAN 2-ISOPENTENILADENINA
TERHADAP
PEMBENTUKAN DAN PERTUMBUHAN UMBI MIKRO
KENTANG (
Solanum tuberosum
L.)
SKRIPSI
OLEH: ASMA UL HUSNA
090301188/PEMULIAAN TANAMAN
PROGRAM STUDI AGROEKOTEKNOLOGI FAKULTAS PERTANIAN
PENGARUH SUKROSA DAN 2-ISOPENTENILADENINA
TERHADAP
PEMBENTUKAN DAN PERTUMBUHAN UMBI MIKRO
KENTANG (
Solanum tuberosum
L.)
SKRIPSI
OLEH: ASMA UL HUSNA
090301188/PEMULIAAN TANAMAN
Skripsi Sebagai Salah Satu Syarat Untuk Mendapatkan Gelar Sarjana di Fakultas Pertanian Universitas Sumatera Utara, Medan
PROGRAM STUDI AGROEKOTEKNOLOGI FAKULTAS PERTANIAN
Judul Skripsi : Pengaruh Sukrosa dan 2-Isopenteniladenina Terhadap Pembentukan dan Pertumbuhan Umbi Mikro Kentang (Solanum tuberosum L.)
Nama : Asma Ul Husna
NIM : 090301188
Program Studi : Agroekoteknologi
Minat : Pemuliaan Tanaman
Disetujui oleh Komisi Pembimbing
(Luthfi A. M. Siregar, SP., MSc., PhD) (Ir. Yusuf Husni)
Ketua Anggota
Mengetahui :
ABSTRAK
ASMA UL HUSNA : Pengaruh Sukrosa dan 2-Isopenteniladeina Terhadap Pembentukan
dan Pertumbuhan Umbi Mikro Kentang (Solanum tuberosum L.), dibimbing oleh Luthfi A. M. Siregar dan Yusuf Husni.
Penelitian ini bertujuan untuk menentukan konsentrasi sukrosa dan 2-isopentenilaenina (2-ip) yang sesuai untuk pembentukan dan pertumbuhan umbi
mikro kentang (Solanum tuberosum L.) Penelitian ini dilaksanakan di Laboratorium Kultur Jaringan, Fakultas Pertanian Universitas Sumatera Utara, Medan dari Juni hingga September 2013. Rancangan yang digunakan adalah Rancangan Acak Kelompok (RAK) dengan dua faktor perlakuan. Faktor pertama
adalah konsentrasi sukrosa yang terdiri dari 4 taraf yaitu 35 g/l; 50 g/l; 65 g/l; 80 g/l. Faktor kedua adalah konsentrasi 2-ip dengan 5 taraf yaitu 0 mg/l; 2 mg/l; 4
mg/l; 6 mg/l; 8 mg/l.
Hasil penelitian menunjukkan bahwa konsentrasi sukrosa berpengaruh nyata terhadap jumlah nodus akhir kondisi gelap dan jumlah umbi mikro per planlet. Sementara konsentrasi 2-ip berpengaruh nyata hanya terhadap jumlah nodus akhir kondisi terang. Interaksi konsentrasi sukrosa dan 2-ip belum berpengaruh nyata terhadap semua peubah amatan. Keadaan visual umbi yang terbentuk umumnya lonjong, berwarna kuning atau coklat dengan permukaan berkeriput.
ABSTRACT
ASMA UL HUSNA: The Effect of Sucrose and 2-Isopenteniladenine to Formation and Growth of Potato (Solanum tuberosum L.) Microtuber, supervised by Luthfi A. M. Siregar and Yusuf Husni.
The research aimed to get a best concentration of sucrose and 2-isopentenilaenine (2-ip) for formation and growth of potato (S. tuberosum L.)
microtuber. The research was carried out in the Tissue Culture Laboratory, agriculture’s Faculty of North Sumatera University from June to September 2013. This research used Randomized Block design with two factors. First factor was sucrose concentration consist of four level: 35 g/l; 50 g/l; 65 g/l; 80 g/l. The second factor was 2-iP concentration consist of five level are 0 mg/l; 2 mg/l; 4 mg/l; 6 mg/l; 8 mg/l.
The result showed that sucrose conentration gave signifiantly effect only to number of nodes after darkness condition and number of nodes each planlet parameter. 2-ip concentration give significantly effect only on number of nodes after lighting condition but have no significantly effect on the number of nodes after darkness condition, number of microtubers of each planlet and fresh weight of microtubers. Interaction of sucrose and 2-ip have no effect significantly to all parameters. The microtubers is oval, yellow or brown with wrinkled structure.
RIWAYAT HIDUP
Asma Ul Husna dilahirkan di Rantau, NAD pada 06 April 1991, putri dari
pasangan Ali Leo dan Nurlas, merupakan anak pertama dari empat bersaudara.
Pendidikan formal yang pernah ditempuh yaitu SD N Ade Irma Suryani
Kuala Simpang lulus pada tahun 2003, SMP N 1 Kuala Simpang lulus tahun
2006, tahun 2009 penulis lulus dari SMA N 1 Kejuruan Muda dan di tahun yang
sama, lulus seleksi penerimaan mahasiswa baru melalui jalur SNMPTN (Seleksi
Nasional Masuk Perguruan Tinggi Negeri) pada program studi Agroekoteknologi,
Fakultas Pertanian Universitas Sumatera Utara, Medan.
Pengalaman organisasi pernah penulis peroleh melaui organisasi BKM
(Badan Kenadziran Mushala) tahun 2010-2011. Selama mengikuti perkuliahan
penulis juga pernah berkesempatan membantu dosen dalam menjalankan
praktikum Teknologi Benih pada tahun 2011-2012, Dasar Pemuliaan Tanaman
pada tahun 2013, Bioteknologi Pertanian pada tahun 2013, Perbanyakan Vegetatif
Tanaman pada tahun 2013 dan Kultur Jaringan Tanaman tahun 2013.
Penulis melaksanakan Paktek Kerja Lapangan (PKL) di PTPN IV Unit
Usaha Adolina, Kabupaten Serdang Bedagai Provinsi Sumatera Utara pada
KATA PENGANTAR
Puji dan syukur penulis panjatkan kehadirat Allah SWT karena atas rahmat
dan karunian-Nya penulis dapat menyelesaikan skripsi yang berjudul “Pengaruh
Sukrosa dan 2-Isopenteniladenina Terhadap Pembentukan dan
Pertumbuhan Umbi Mikro Kentang (Solanum tuberosum L.)”, yang
merupakan salah satu syarat untuk mendapatkan gelar sarjana di Fakultas
Pertanian Universitas Sumatera Utara, Medan.
Dalam kesempatan ini penulis mengucapkan terima kasih yang
sebesar-besarnya kepada Bapak Luthfi A. M. Siregar, SP., MSc., PhD dan Bapak
Ir. Yusuf Husni selaku ketua dan anggota dari komisi pembimbing yang telah
membimbing, memberikan arahan serta masukan kepada penulis sehingga dapat
menyelesaikan skripsi ini. Ucapan terima kasih juga diperuntukkan kepada
ayahanda Ali Leo dan ibunda Nurlas, adik-adik penulis Alfi Syahrin, Aldi Rinaldi
dan Al Attar Annaafi serta abangda Ahmad Atho’ur rahman atas segala kasih
sayang, doa dan dukungannya. Penghargaan penulis sampaikan kepada Laboran
Asni, SP, dan juga kepada teman-teman Agroekoteknologi 2009 atas segala
bantuan dan motivasi yang telah diberikan kepada penulis selama menjalankan
penelitian.
Penulis menyadari bahwa skripsi ini masih jauh dari kesempurnaan
penulisan. Oleh karena itu penulis mengharapkan kritik dan saran yang sifatnya
membangun demi kesempurnaan skripsi ini. Akhir kata penulis mengucapkan
terima kasih. Semoga skripsi dapat bermanfaat.
Medan, Desember 2013
DAFTAR ISI
Bahan dan Alat Penelitian ... 17
Metode Penelitian ... 17
PELAKSANAAN PENELITIAN Sterilisasi Alat ... 20
Pembuatan Media ... 20
Persiapan Ruang Tanam ... 21
Penanaman Eksplan ... 22
Pemeliharaan Eksplan ... 22
Peubah Amatan Persentase Pertumbuhan Eksplan ... 22
Pertambahan Jumlah Nodus ... 23
Waktu Muncul Umbi ... 23
Jumlah Umbi Mikro Per Planlet ... 23
Keadaan Visual Umbi ... 23
HASIL DAN PEMBAHASAN Hasil ... 24
Persentase Pertumbuhan Eksplan ... 24
Jumlah Nodus Jumlah Nodus Akhir Kondisi Terang ... 24
Jumlah Nodus Akhir Kondisi Gelap ... 26
Waktu Muncul Umbi ... 27
Jumlah Umbi Mikro Per Planlet ... 28
Bobot Basah Umbi ... 29
Keadaan Visual Umbi ... 29
Pembahasan ... 30
KESIMPULAN DAN SARAN Kesimpulan ... 38
Saran ... 38
DAFTAR PUSTAKA
DAFTAR TABEL
No. Hal
1. Pengaruh konsentrsi sukrosa dan 2-ip terhadap persentase pertumbuhan eksplan ... 24
2. Pengaruh konsentrsi sukrosa dan 2-ip terhadap jumlah nodus akhir kondisi terang (buah) ... 24
3. Pengaruh konsentrsi sukrosa dan 2-ip terhadap jumlah nodus akhir kondisi gelap (buah) ... 26
4. Pengaruh konsentrsi sukrosa dan 2-ip terhadap waktu muncul umbi (hari) . ... 27
5. Pengaruh konsentrsi sukrosa dan 2-ip terhadap jumlah umbi mikro per planlet (buah) ... 28
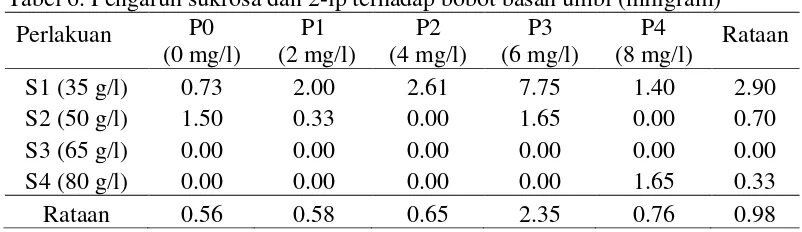
6. Pengaruh konsentrsi sukrosa dan 2-ip terhadap bobot basah umbi (miligram)
... 28
DAFTAR GAMBAR
No. Hal
1. Hubungan konsentrasi 2-ip terhadap jumlah nodus akhir kondisi
terang ... 25
2. Hubungan konsentrasi sukrosa terhadap jumlah nodus akhir kondisi
gelap ... 27
3. Hubungan konsentrasi sukrosa terhadap jumlah nodus akhir kondisi
gelap ... 29
DAFTAR LAMPIRAN
No. Hal
1. Data pengamatan persentase pertumbuhan eksplan (%) ... 43
2. Data pengamatan jumlah nodus akhir kondisi terang (4 MST) (buah) ... 44
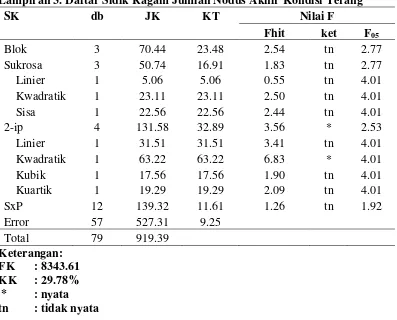
3. Daftar sidik ragam jumlah nodus akhir kondisi terang ... 45
4. Data pengamatan jumlah nodus akhir kondisi gelap (12 MST) (buah) ... 46
5. Daftar sidik ragam jumlah nodus akhir kondisi gelap ... 46
6. Data pengamatan waktu muncul umbi (hari) ... 47
7. Data transformasi waktu muncul umbi √(X+0.5) ... 48
8. Daftar sidik ragam waktu muncul umbi ... 48
9. Data pengamatan jumlah umbi mikro per planlet (buah) ... 49
10. Data transformasi jumlah umbi mikro per planlet √(X+0.5) ... 50
11. Daftar sidik ragam jumlah umbi mikro per planlet ... 50
12. Data pengamatan bobot basah umbi (miligram) ... 51
13. Data transformasi bobot basah umbi √(X+0.5) ... 52
14. Daftar sidik ragam bobot basah umbi ... 52
15. Foto hasil penelitian ... 54
16. Deskripsi tanaman kentang kultivar granola ... 56
17. Komposisi media Murashige dan Skoog (1962) ... 57
18. Bagan penelitian ... 58
ABSTRAK
ASMA UL HUSNA : Pengaruh Sukrosa dan 2-Isopenteniladeina Terhadap Pembentukan
dan Pertumbuhan Umbi Mikro Kentang (Solanum tuberosum L.), dibimbing oleh Luthfi A. M. Siregar dan Yusuf Husni.
Penelitian ini bertujuan untuk menentukan konsentrasi sukrosa dan 2-isopentenilaenina (2-ip) yang sesuai untuk pembentukan dan pertumbuhan umbi
mikro kentang (Solanum tuberosum L.) Penelitian ini dilaksanakan di Laboratorium Kultur Jaringan, Fakultas Pertanian Universitas Sumatera Utara, Medan dari Juni hingga September 2013. Rancangan yang digunakan adalah Rancangan Acak Kelompok (RAK) dengan dua faktor perlakuan. Faktor pertama
adalah konsentrasi sukrosa yang terdiri dari 4 taraf yaitu 35 g/l; 50 g/l; 65 g/l; 80 g/l. Faktor kedua adalah konsentrasi 2-ip dengan 5 taraf yaitu 0 mg/l; 2 mg/l; 4
mg/l; 6 mg/l; 8 mg/l.
Hasil penelitian menunjukkan bahwa konsentrasi sukrosa berpengaruh nyata terhadap jumlah nodus akhir kondisi gelap dan jumlah umbi mikro per planlet. Sementara konsentrasi 2-ip berpengaruh nyata hanya terhadap jumlah nodus akhir kondisi terang. Interaksi konsentrasi sukrosa dan 2-ip belum berpengaruh nyata terhadap semua peubah amatan. Keadaan visual umbi yang terbentuk umumnya lonjong, berwarna kuning atau coklat dengan permukaan berkeriput.
ABSTRACT
ASMA UL HUSNA: The Effect of Sucrose and 2-Isopenteniladenine to Formation and Growth of Potato (Solanum tuberosum L.) Microtuber, supervised by Luthfi A. M. Siregar and Yusuf Husni.
The research aimed to get a best concentration of sucrose and 2-isopentenilaenine (2-ip) for formation and growth of potato (S. tuberosum L.)
microtuber. The research was carried out in the Tissue Culture Laboratory, agriculture’s Faculty of North Sumatera University from June to September 2013. This research used Randomized Block design with two factors. First factor was sucrose concentration consist of four level: 35 g/l; 50 g/l; 65 g/l; 80 g/l. The second factor was 2-iP concentration consist of five level are 0 mg/l; 2 mg/l; 4 mg/l; 6 mg/l; 8 mg/l.
The result showed that sucrose conentration gave signifiantly effect only to number of nodes after darkness condition and number of nodes each planlet parameter. 2-ip concentration give significantly effect only on number of nodes after lighting condition but have no significantly effect on the number of nodes after darkness condition, number of microtubers of each planlet and fresh weight of microtubers. Interaction of sucrose and 2-ip have no effect significantly to all parameters. The microtubers is oval, yellow or brown with wrinkled structure.
PENDAHULUAN
Latar BelakangDi dunia terdapat sekitar 4.000 varietas kentang yang dapat dikonsumsi.
Sebagian besar dari jumlah tersebut ditemukan di daerah Andes, Amerika Selatan.
Kentang merupakan bahan makanan terpenting ketiga di dunia setelah padi dan
gandum dalam memenuhi kebutuhan manusia. Lebih dari milyaran orang di dunia
mengkonsumsi kentang, dan total produksi tanaman kentang secara global telah
melebihi 300 juta metrik ton. Oleh sebab itu, kentang menjadi tanaman penting
dalam hal ketahanan pangan untuk menghadapi pertumbuhan penduduk dan
tingkat kelaparan yang terus meningkat (International Potato Center, 2013).
Pentingnya kentang sebagai komoditi pangan dunia, tentu didasarkan pada
kandungan gizi yang dimiliki oleh tanaman ini. BPTP Jawa Tengah (2011)
menyebutkan zat gizi yang terkandung dalam 100 g kentang yaitu kalori sebesar
347 kal, protein 0,3 g, lemak 0,1 g, karbohidrat sebesar 85,6 g, kalsium (Ca) 20 g,
posfor (P) 30 g, besi (Fe) 0,5 mg dan vitamin B sebesar 0,04 mg. Mereka juga
menambahkan bahwa di Indonesia, kentang digemari oleh banyak orang karena
dapat digunakan sebagai bahan sayuran dan makanan ringan.
Akantetapi, kapasitas produksi kentang saat ini semakin menjadi perhatian
khusus. Menurut data BPS (2011), produksi kentang di Sumatera Utara terus
mengalami penurunan dari tahun 2009-2011. Tercatat, produksi kentang di tahun
2009 sebesar 129.587 ton dengan produktivitas sebesar 16,17 ton/ha, tahun 2010
turun menjadi 126.203 ton dengan produktivitas sebesar 15,83 ton/ha dan di tahun
2011 produksi hanya sebesar 123.078 ton dengan produktivitas sebesar 17,09
Sedangkan Warnita (2008) mengungkapkan produksi kentang tersebut ternyata
belum mampu mencukupi kebutuhan kentang saat ini. Demikian pula, kebutuhan
akan bahan French fries dan chip masih di impor dari Australia karena produksi
Indonesia baru mencukupi 20% dari kebutuhan Indonesia. Ketersediaan bibit kentang
bermutu merupakan salah satu kendala dalam peningkatan produksi kentang di negara
ini. Penyediaan kentang bermutu sangat terbatas karena perbanyakannya yang sangat
lambat dan adanya penyakit yang menyerang bibit sehingga menurunkan hasil panen.
Oleh sebab itulah, salah satu cara yang dapat digunakan untuk menjawab
tantangan dan kendala diatas yakni melalui teknik in vitro. Karjadi (2006)
menyatakan penggunaan teknik in vitro untuk tujuan perbanyakan vegetatif
merupakan areal/bidang yang paling maju dalam teknik kultur jaringan.
Umbi mikro (umbi yang dikembangkan secara in vitro) adalah benih
kentang miniatur yang merupakan fase intermediet antara planlet in vitro dengan
umbi mini. Umbi mikro adalah generasi pertama benih kentang dari hasil kultur
jaringan, yang digunakan untuk memecahkan masalah aklimatisasi (transplanting)
planlet dari kondisi in vitro ke kondisi in vivo. Produksi umbi mikro merupakan
metode yang efisien untuk memperoleh bahan tanaman yang sehat dan
mengurangi proses produksi benih bermutu sekitar 3 - 4 tahun (Nistor et al, 2010)
Karbohidrat memainkan peran penting dalam kultur in vitro sebagai
sumber energi dan karbon. Untuk kegiatan kultur pada umumnya, baik itu kultur
sel, jaringan atau organ, penting untuk memasukkan sumber karbon ke dalam
medium. Sukrosa adalah bahan yang umumnya digunakan untuk tujuan
mikropropagasi karena manfaatnya sangat umum dalam kultur jaringan. Gula
Kehadiran sukrosa dalam media kultur jaringan secara khusus menghambat
pembentukan klorofil dan fotosintesis serta menyebabkan pertumbuhan autroropik
kurang baik (Thorpe et al, 2008).
Tidak hanya sukrosa atau karbohidrat saja yang berperan penting. Banyak
komponen lainnya yang juga mampu mendukung terbentuknya umbi mikro ini,
salah satunya adalah sitokinin. Karjadi dan Buchory (2008) mendefenisikan
sitokinin adalah senyawa turunan adenine dan berperan dalam pengaturan
pembelahan sel dan morfogenesis. Sitokinin digunakan untuk merangsang
terbentuknya tunas, berpengaruh dalam metabolisme sel, dan merangsang sel
dorman serta aktivitas utamanya adalah mendorong pembelahan sel. Staden et al
(2008) menambahkan beberapa komponen sitokinin yang digunakan dalam
kegiatan kultur jaringan diantaranya adalah (1) kinetin, sitokinin pertama yang
ditemukan, (2) trans zeatin (4-hydroxy-3-methyl-trans-2-butenylaminopurin), (3)
iP (N6-Δ2isopentenyladenin) dan dihydrozeatin
(6-(4-hydroxy-3-methyl-trans-2-butenyl)aminopurine).
Begitu banyak penelitian yang membahas mengenai peran sukrosa dan
sitokinin dalam pembentukan umbi mikro kentang. Hasil penelitian Ebadi dan
Iranbakhsh (2011) mengungkapkan bahwa penggunaan 10 mgl-1 BAP dan 80 gl-1
sukrosa memberikan hasil terbaik terhadap persentase pembentukan umbi mikro,
rataan jumlah umbi mikro yang terbentuk, bobot basah dan bobot kering umbi
serta ratio bobot kering terhadap bobot basah umbi mikro. Sedangkan Ni’mah et
al (2012) menyatakan bahwa media MS yang mengandung 80 g/l sukrosa dan 7
mg/l kinetin memberikan hasil optimum untuk penginduksian umbi mikro
Akan tetapi belum banyak penelitian yang menggunakan
2-isopenteniladenina (2-ip) sebagai sumber sitokinin yang dikombinasikan dengan
sukrosa dalam pembentukan dan pertumbuhan umbi mikro kentang ini. Dari
sinilah penulis tertarik untuk melakukan penelitian yang membahas bagaimana
pengaruh sukrosa dan 2-ip terhadap pembentukan dan pertumbuhan umbi mikro
kentang.
Tujuan Penelitian
Untuk menentukan konsentrasi sukrosa dan 2-ip serta kombinasi dari
keduanya yang sesuai untuk pembentukan dan pertumbuhan umbi mikro kentang.
Hipotesa Penelitian
Ada perbedaan pengaruh dalam pembentukan dan pertumbuhan umbi
mikro kentang akibat penggunaan tingkat konsentrasi sukrosa dan 2-ip yang
berbeda serta interaksi dari kedua faktor perlakuan tersebut.
Kegunaan Penelitian
Penelitian ini berguna untuk mendapatkan data penyusunan skripsi sebagai
salah satu syarat untuk mendapatkan gelar sarjana pertanian di Fakultas Pertanian
Universitas Sumatera Utara, Medan dan sebagai bahan informasi bagi pihak yang
TINJAUAN PUSTAKA
Botani tanamanHartus (2001) mengungkapkan bahwa kentang masih satu famili dengan
cabai, tomat, terung, paprika, dan tembakau. Kentang masuk dalam divisi
Spermatophyta, subdivisi Angiospermae, kelas Dicotyledonae, Ordo Tubiflorae,
Famili Solanaceae, genus Solanum, dan spesies Solanum tuberosum L.
Kentang adalah tanaman dikotil tahunan berumur pendek yang biasanya
ditanam sebagai tanaman setahun untuk diambil umbi bawah tanahnya yang dapat
dimakan. Tanaman kentang yang dihasilkan secara aseksual dari umbi, memiliki
akar serabut dengan percabangan halus, agak dangkal dan akar adventif
yang berserat yang menyebar. Sedangkan tanaman yang tumbuh dari biji
membentuk akar tunggang ramping dengan akar lateral yang banyak
(Rubatzky dan Yamaguchi, 1998).
Batang muncul pada permulaan tiap musim tumbuh dari umbi yang
dihasilkan pada tahun sebelumnya, atau dikenal dengan umbi induk. Umbi
kentang merupakan modifikasi batang yang berada di bawah tanah, bukan dari
pembengkakan akar. Tiap “mata” pada umbi kentang adalah tunas batang, sama
dengan tunas yang terdapat pada buku batang. Batang bisa berwarna hijau
hingga keunguan atau campuran bintik dari warna-warna tersebut dan seolah
memiliki “sayap” (mirip benjolan yang tumbuh keluar dari batang)
(Spooner dan Salas, 2006).
Daun menyirip majemuk, dengan lembar daun bertangkai memiliki
ukuran, bentuk, dan tekstur yang beragam (Rubatzky dan Yamaguchi, 1998).
dari batang di atas tanah. Diantara batang dan daun (daun aksilar), cabang atau
bunga (inflorescencens) diproduksi.
Bunga kentang berdiameter 3-4 cm dan memiliki lima sepal dan petal serta
dua sel ovary dengan single style dan stigma bilobed. Ukuran corolla bervariasi
sesuai cultivar. Warna corolla bervariasi dari keunguan hingga mendekati putih.
Petal bersatu dengan tubular. Stamen tumbuh hingga ke tabung corolla dan
membentuk anther. Anther berwarna kuning mencolok kecuali pada tanaman yang
mengalami mandul jantan (male sterility), yang memiliki warna kuning cerah atau
kuning kehijauan (Sleper dan Poehlman, 2006).
Biji pipih kecil, sebanyak beberapa butir hingga beberapa ratus biji,
berbentuk oval atau jantung, berwarna kuning atau coklat kekuningan, terbungkus
di dalam pulp. Umbi adalah batang pendek, tebal, dan berdaging dengan daun
yang berubah menjadi kerak atau belang, berdampingan dengan tunas samping
(aksilar), yang dikenal dengna mata. Permukaan umbi dapat halus atau kasar.
Warna daging umbi biasanya kuning muda atau putih. Bentuk umbi beragam,
memanjang, kotak, bulat atau pipih (Rubatzky dan Yamaguchi, 1998).
Perbanyakan tanaman kentang sendiri dapat dilakukan melalui beberapa
cara diantaranya dengan menggunakan tunas umbi, bagian batang, umbi utuh,
umbi dibelah, biji botani dan penggunaan metode in vitro yakni kultur jaringan
(mikropropagasi). Dalam perbanyakan in vitro umumnya menggunakan nodal
cutting, apical cutting dan microtubers (Kusmana, 2012).
Penggunaan umbi mikro sebagai salah satu propagul kentang memiliki
beberapa keuntungan antara lain: (1) propagul umbi mikro berasal dari eksplan bebas
akan menghasilkan tanaman yang seragam dan umur panen sama dengan umbi biasa,
(3) kebutuhan umbi mikro hanya 4 – 5 kg /Ha dibandingkan dengan umbi biasa yang
memerlukan 1 - 2 ton bibit/Ha, (4) mudah dalam penyimpanan, transportasi dan
pengiriman, (5) mudah memenuhi persyaratan karantina untuk lalu lintas propagul
baik dalam atau luar negeri (Wattimena, 2000).
Teknik In Vitro
Kultur jaringan merupakan salah satu cara perbanyakan tanaman secara
vegetatif. Kultur jaringan merupakan teknik perbanyakan tanaman dengan cara
mengisolasi bagian tanaman seperti daun, mata tunas, serta menumbuhkan
bagian-bagian tersebut dalam media buatan secara aseptik yang kaya nutrisi dan
zat pengatur tumbuh dalam wadah tertutup yang tembus cahaya sehingga bagian
tanaman dapat memperbanyak diri dan bergenerasi menjadi tanaman lengkap.
Prinsip utama dari teknik kultur jaringan adalah perbanyakan tanaman dengan
menggunakan bagian vegetatif tanaman menggunakan media buatan yang
dilakukan di tempat steril (Departemen Kehutanan, 2011).
Prinsip-prinsip dasar mengenai kultur jaringan diantaranya:
(1) Teori totipotensi sel yang dikemukakan oleh Schwan dan Schleiden (1838).
Menurut teori ini, setiap sel tanaman yang hidup mempunyai informasi
genetik dan perangkat fisiologis yang lengkap untuk dapat tumbuh dan
berkembang menjadi tanaman utuh, jika kondisinya sesuai.
(2) Konsep Skoog dan Miller (1957) yang mengemukakan bahwa regenerasi
tunas dan akar in vitro dikontrol secara hormonal oleh ZPT sitokinin dan
(3) Sifat kompeten, dediferensiasi, dan determinasi sel atau jaringan eksplan.
Suatu sel atau jaringan dikatakan kompeten jika sel atau jaringan tersebut
mampu memberikan tanggapan terhadap signal lingkungan dan hormonal.
Dediferensiasi sel-sel eksplan yang sebelumnya sudah terdiferensiasi berarti
berubahnya sel-sel eksplan yang tadinya sudah terspesialisasi menjadi tidak
terspesialisasi dan kembali ke kondisi meristematik. Determinasi terjadi jika
sel-sel atau jaringan tersebut terus berkembang menjadi organ atau embrio,
walaupun diletakkan di lingkungan baru yang bebas dari signal penyebab
organogenesis dan morfogenesis (Yusnita, 2003).
Kultur jaringan dimulai dari potongan tubuh tanaman. Organ yang
berukuran kecil ataupun potongan jaringan yang digunakan dalam kultur jaringan
disebut eksplan. Bagian eksplan (baik itu pada tanaman stok atau tanaman induk)
dari tiap eksplan yang diperoleh, bergantung pada (1) jenis kultur inisiasi,
(2) tujuan pengkulturan, (3) spesies tanaman yang digunakan. Eksplan dapat
menghasilkan berbagai bentuk yang berbeda. Pemilihan bahan eksplan yang tepat
merupakan hal yang penting untuk dapat mencapai kesuksesan dalam kultur
jaringan (George, 2008).
Kebutuhan nutrisi untuk pertumbuhan kultur in vitro yang optimal
bervariasi antar spesies ataupun antar varietas. Bahkan, jaringan yang berasal dari
bagian tanaman yang berbeda pun akan berbeda kebutuhan nutrisinya. Oleh
karena itu, tidak ada satu pun medium dasar yang berlaku universal untuk semua
jenis jaringan dan organ. Meskipun demikian, medium dasar MS yang direvisi
adalah yang paling luas penggunaannya dibandingkan dengan media dasar lainnya
Ada dua cara pembiakan kentang secara mikro yaitu melalui tunas mikro
dan umbi mikro. Efisiensi pengumbian mikro kentang seperti sukrosa, sitokinin,
growth retardant, growth inhibitors, nitrogen, CO2, pH dan komponen-komponen
lainnya. Produksi umbi mikro juga tergantung dari metode pemindahan tunas
mikro, yaitu dari media perbanyakan ke media pengumbian. Tunas mikro dapat
dibiakkan di media perbanyakan padat ataupun cair dan kemudian dipindah ke
media pengumbian. Media pengumbian ini juga dapat berbentuk padat atau cair,
sehingga akan terbentuk suatu sistem pengumbian padat, padat-cair, cair-cair
ataupun cair subtitusi cair (Wattimena et al, 1983).
Sukrosa
Gula digunakan sebagai sumber energi dalam media kultur, karena
umumnya bagian tanaman atau eksplan yang dikulturkan tidak autrotof dan
mempunyai laju fotosintesis sangat rendah. Gula yang paling sering digunakan
adalah sukrosa. Untuk itu, gula pasir yang digunakan sehari-hari dapat dipakai
karena mengandung 99,9% sukrosa. Glukosa dan fruktosa dapat digunakan, tetapi
harganya lebih mahal dan hasilnya tidak selalu lebih baik daripada sukrosa.
Konsentrasi sukrosa yang digunakan berkisar 1-5% (10-50 g/l), tetapi untuk
kebanyakan pengkulturan, 2-3% sukrosa umumya merupakan konsentrasi yang
optimum (Yusnita, 2003).
Sukrosa memiliki beberapa peran penting dalam media, yaitu sebagai
sumber karbon, sumber energi, pengatur tekanan osmotik, mengatur stabilisasi
membran, dan berperan sebagai pelindung terhadap stres. Peran sukrosa dalam
mengatur tekanan osmotik mempengaruhi kemampuan jaringan dalam
berarti banyak terdapat molekul-molekul, sehingga arah gerakan difusi ialah ke
tempat yang kekurangan molekul atau yang berkonsentrasi rendah. Keadaan
demikian menyebabkan sel-sel pada jaringan eksplan yang ditumbuhkan pada
media dengan penambahan sukrosa tinggi dapat cepat menerima unsur-unsur hara
yang diperlukan bagi perkembangannya (Ni’mah et al, 2012).
Sukrosa sebagai sumber karbohidrat perlu ditambahkan selama
pembentukan bibit mikro kentang. Konsentasi sukrosa yang optimum untuk
pengumbian in vitro berkisar antara 6–8% (Wang dan Hu, 1982).
Sementara Smith (2000) menyatakan bahwa penggunaan sukrosa di dalam
pembibitan in vitro ini adalah untuk menciptakan ketahanan dari bibit mikro
kentang itu sendiri. Konsentrasi sukrosa yang optimum untuk pertumbuhan in
vitro berkisar antara 2 –5 %.
Lakitan (1996) mengungkapkan faktor internal yang mempengaruhi
pertumbuhan umbi mikro adalah laju dan kuantitas fotosintat yang dipasok dari
tajuk tanaman. Pada tanaman kentang, ukuran umbi rata-rata berbanding langsung
dengan pertumbuhan tajuk dan berbanding terbalik dengan jumlah umbi yang
terbentuk dimana pertumbuhan umbi akan terhenti jika tajuk tanaman mati karena
pasokan fotosintat untuk menopang pertumbuhan umbi terhenti. Laju
pertambahan berat umbi lebih ditekan oleh fotosintat yang dihasilkan selama
periode perkembangan umbi yang bersangkutan.
Laju pemanjangan batang berbeda antara spesies dan dipengaruhi oleh
lingkungan di mana tanaman tersebut tumbuh. Faktor lingkungan yang besar
pengaruhnya terhadap pemanjangan batang adalah suhu dan intensitas cahaya
Zulkarnain (2009) menyatakan bahwa semua medium kultur in vitro
dilengkapi sumber karbon dan energi. Sukrosa ataupun D-glukosa biasanya
diberikan pada konsentrasi 20.000-30.000 mg L-1, namun konsentrasi yang lebih
tinggi kadang diberikan untuk tujuan-tujuan tertentu. Hampir semua kultur
memperlihatkan respons pertumbuhan yang optimum dengan pemberian
disakarida dalam sukrosa. Sukrosa bersifat labil terhadap pemanasan, sterilisasi
senyawa ini menggunakan otoklaf akan menghasilkan sukrosa, glukosa, dan
D-fruktosa. Ia juga menambahkan bahwa konsentrasi yang tepat dari sukrosa dan
garam-garam mineral merupakan faktor yang penting untuk diperhatikan supaya
mendapatkan laju mikropropagasi yang optimum.
Hasil penelitian dari Ratna (2010) menunjukkan bahwa perlakuan dengan
pemberian 40 g/l sukrosa pada media dapat mempercepat munculnya umbi mikro
13-18 hst, sedangkan perlakuan dengan 70 g/l sukrosa pada media memberikan
produksi umbi mikro terbanyak dengan rataan bobot basah sebesar 0,075 g.
Sitokinin (2-ip)
Jenis sitokinin yang sering dipakai adalah BA (benziladenin) karena
efektivitasnya tinggi dan harganya relatif murah. Sitokinin jenis lain yang dapat
digunakan adalah kinetin (furfuril-aminopurin) dan 2-ip. Namun, kedua jenis
sitokinin ini harganya lebih mahal dan efektivitasnya lebih rendah daripada BA.
Penggunaan sitokinin BA, kinetin, dan 2-ip sering berkisar pada konsentrasi
0,5-10 mg/l (Yusnita, 2003).
Sitokinin yang berasal dari akar merangsang pertumbuhan daun. Hal ini
dibuktikan dengan penelitian di mana semua akar atau sebagian akar pada
lebih lambat, tetapi pemberian sitokinin pada daun dapat mengembalikan
kemampuan daun untuk tumbuh (Lakitan, 1996).
Sitokinin mampu menggantikan sebagian faktor yang dibutuhkan akar
untuk menunda penuaan, dan kandungan sitokinin dapat menggantikan efek
cahaya dengan menunda penuaan helai daun yang meningkat berlipat ganda
ketika akar liar terbentuk. Cara sitokinin memperlambat penuaan pada daun oat
yang dipetik yaitu daun tersebut mulai menua, yang mula-mula dicirikan dengan
terurainya protein menjadi asam amino kemudian hilangnya klorofil. Penuaan ini
terjadi jauh lebih cepat di tempat gelap daripada di tempat terang dan sitokinin
yang ditambahkan pada larutan tempat daun tadi diapungkan dapat menggantikan
efek cahaya dengan menunda penuaan (Salisbury dan Ross, 1995).
Sama halnya dengan penambahan sitokinin yang berlebihan akan
menghambat pertumbuhan vegetatif tanaman (jumlah tunas dan jumlah nodus).
Lakitan (2011) menambahkan, pertumbuhan batang tanaman tidak membutuhkan
sitokinin dalam konsentrasi yang tinggi atau membutuhkan sitokinin eksogen
dalam konsentrasi yang rendah, karena kandungan sitokinin endogen sudah
mencukupi. Akibatnya penambahan sitokinin eksogen tidak lagi berpengaruh,
bahkan dapat menghambat pertumbuhan karena konsentrasi sitokinin menjadi
eksesif (supra optimal). Jumlah tunas akan mempengaruhi jumlah nodus dan umbi
mikro yang akan terbentuk.
Sitokinin akan merangsang pembelahan sel sehingga menghasilkan
ruangan yang dapat digunakan sebagai tempat akumulasi zat tepung. Semakin
banyak jumlah umbi mikro yang dihasilkan, maka berat basah umbi mikro juga
hubungan korelasi yang positif. Pada media umbi mikro, sitokinin mendorong
terbentuknya umbi mikro pada tunas dan nodus dari eksplan tanaman kentang
secara in vitro (Ni’mah et al, 2012).
Pada penelitian pucuk tanaman anggur yang dikulturkan pada medium
yang diformulasikan oleh Murashige pada tahun 1974 dan dilengkapi dengan 100
mgL-1 tiamin-HCl; 3-4 mgL-1 BAP; dan 30 gL-1 sukrosa diperoleh regenerasi
pucuk adventif yang terjadi dua kali lipat lebih banyak pada medium dengan
konsentrasi garam 3
4 dibandingkan medium dengan konsentrasi 1
2 atau konsentrasi
penuh. Perbedaan tersebut hilang bila medium ditambahkan 80 mgL-1 adenin
sulfat (suatu sitokinin). Hal itu menunjukkan bahwa konsentrasi medium menjadi
faktor penting bila sitokinin tidak diberikan pada tingkat konsentrasi yang
optimum. Dengan demikian, dapat dikemukakan bahwa untuk mendapatkan hasil
yang maksimum dari perlakuan zat pengatur tumbuh maka komponen medium
lainnya harus berada pada kadar yang optimum (Zulkarnain, 2009).
Pembentukan Umbi Mikro
Stolon adalah bagian yang keluar dari Collum (batang akar atau akar
utama). Pada stadia awal tumbuhnya, stolon sepintas seperti akar biasa. Warnanya
lebih putih dan biasanya lebih panjang daripada akar cabang. Ukurannya juga
lebih besar. Stolon amat lunak dan berisi lebih banyak cairan dibandingkan akar.
Setelah mencapai panjang maksimal, stolon akan menggembung pada ujungnya.
Stolon ini akan terus membesar sejalan dengan bertambahnya umur sampai suatu
saat dapat dipanen sebagai umbi kentang (Hartus, 2001).
Pertumbuhan awal stolon dapat terjadi bahkan sebelum pucuk berdaun
berlangsung dalam rentang suhu dan panjang hari yang lebar, tapi perkembangan
stolon menjadi umbi biasanya memerlukan kondisi yang lebih khusus.
Tampaknya, untuk pertumbuhan awal stolon diperlukan kadar giberelin yang
tinggi dan kadar sitokinin yang tidak terlalu tinggi (Salisbury dan Ross, 1995).
Media MS yang diperkaya dengan konsentrasi sukrosa hingga 6% dapat
menyebabkan pengumbian pada beberapa kultivar kentang. Dalam menginduksi
pengumbian secara in vitro pada sebagian besar kultivar kentang, sukrosa mampu
menginduksi hanya pada kondisi di bawah short-day (hari pendek). Penyinaran
hari pendek diketahui meningkatkan level sitokinin endogen pada kultur kentang
dan kebutuhan kondisi hari pendek untuk pengumbian secara in vitro dapat
menghasilkan hubungan yang negatif, setidaknya sebagian diantaranya, akibat
pengaplikasian sitokinin. Menariknya, hampir sebagian besar kultivar kentang
yang diuji, kemampuan menginduksi umbi mikro akibat pemberian sukrosa dan
sitokinin diekspresikan secara maksimal dalam kultur yang dipelihara pada
kondisi gelap (Taji et al, 2001).
Faktor penting yang mempengaruhi pembentukan umbi adalah suhu,
fotoperiodisme, nitrogen, sitokinin, retardan dan inhibitor. Dalam pembentukan
umbi mikro secara in vitro dibutuhkan keadaan tanpa cahaya dan suhu yang
rendah (15-20oC) (Artati, 1989).
Pembentukan umbi kentang biasanya terjadi dalam kultur berumur 3-4
minggu di bawah kondisi induktif. Pembentukan umbi sering terjadi senescence,
dan ini dapat diatasi dengan penambahan sukrosa dan sitokinin
Ada tiga fase pembentukan umbi, yaitu (1) inisiasi, yaitu terjadinya
diferensiasi tunas pada stolon menjadi primordia umbi, (2) pembesaran umbi,
ditandai dengan pembelahan sel yang cepat dibarengi dengan penumpukan pati,
dan (3) pematangan umbi, yang terjadi ketika umbi memasuki fase dorman.
Pembesaran umbi dapat mengalahkan pertumbuhan vegetatif dan inisiasi
umbi baru. Bersamaan dengan pematangan umbi, terjadi senescence daun
(Rubatzky dan Yamaguchi, 1998).
Pada organ penyimpanan, pati ditimbun pada amiloplas. Sintesis pati pada
amiloplas menggunakan bahan baku sukrosa atau bentuk karbohidrat sederhana
lainnya yang dikirim dari daun. Pembentukan pati umumnya berlangsung melalui
proses yang sama secara berulang-ulang dengan menggunakan glukosa dari
glukosa yang mirip dengan UDPG yang disebut ADPG. Pembentukan ADPG
berlangsung dalam kloroplas atau plastida lainnya menggunakan ATP dan
glukosa-1-P. Reaksi tersebut dipacu oleh enzim pati sintetase (Lakitan, 2011).
Pada sel-sel yang berklorofil, sukrosa tersusun pada waktu fotosintesis atau
segera setelah fotosintesis. Akan tetapi di dalam daun itu juga terjadi penyusunan
sukosa dalam gelap, asal saja ke alam daun itu diberikan glukosa dan fruktosa
(Dwidjoseputro, 1980). Lakitan (2011) menambahkan, pada siang hari, pati akan
terakumulasi dalam daun jika laju fotosintesis melampaui laju respirasi dan
translokasi fotosintat keluar dari daun. Pada malam hari, pati yang terakumulasi
ini akan diurai kembali melalui proses respirasi dan diangkut keluar dari daun.
Salisbury dan Ross (1955) juga menambahkan bahwa saat itulah daun harus
mendeteksi fotoperiodisme maupun suhu, dan harus mengirim senyawa
Hari pendek mengakibatkan menurunnya kadar giberellinn dalam
tumbuhan, dan hal ini mungkin menyebabkan stolon berhenti memanjang.
Penghambatan pemanjangan stolon dapat dilakukan tanpa menghambat
pembesarannya (yang membentuk umbi). Terdapat juga bukti yang kuat tentang
adanya seyawa penginduksi umbi yang terbentuk di daun beberapa kultivar
sebagai respon hari pendek. Pembentukan umbi paling baik pada suhu malam
sekitar 12oC (Salisbury dan Ross, 1995).
Eksplan yang mempunyai jumlah umbi yang banyak terjadi proses
distribusi asimilat yang menyebar ke setiap umbi, tetapi pada eksplan yang
mempunyai umbi sedikit distribusi asimilat lebih terfokus pada pertumbuhan
umbinya sehingga umbi yang terbentuk berukuran besar (Warnita, 2008).
Serangkaian hasil penelitian mengenai pembentukan umbi mikro kentang
akibat interaksi diantara sukrosa dan sitokinin (baik BAP dan kinetin) telah
banyak dilakukan. Imani et al (2010) menyebutkan bahwa media yang
mengandung 60 g/l sukrosa dan 15 g/l BAP memberikan hasil maksimum pada
jumlah umbi mikro yang terbentuk, akan tetapi interaksi 60 g/l sukrosa dengan 12
g/l BAP memberikan hasil maksimum pada ukuran umbi mikro yang dihasilkan.
Aslam dan Iqbal (2010), media dengan 5 mg BA dan 8% sukrosa memberikan
hasil terbaik terkait induksi dan rataan dari jumlah umbi mikro per eksplan buku
tunggal, media dengan 6 mg BA dan 7% sukrosa tertinggi dalam rataan bobot
basah umbi per eksplan untuk kultivar Diamant dan media dengan 2 mg kinetin
dan 6% sukrosa terbaik untuk induksi, rataan jumlah dan bobot basah umbi mikro
BAHAN DAN METODE
Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan di Laboratorium Kultur Jaringan Tanaman,
Fakultas Pertanian, Universitas Sumatera Utara, Medan sejak Juni–September
2013.
Bahan dan Alat Penelitian
Bahan tanaman yang digunakan merupakan planlet kentang kultivar
Granola berusia 3 minggu yang diperoleh dari UPT-BBI (Balai Benih Induk)
Dinas Pertanian Gedung Johor, Medan. Bahan tanaman tersebut dipelihara dalam
media MS + ekstrak air kelapa 10 ml/l dan disubkultur setiap 2 bulan. Bahan
eksplan yang digunakan diambil dari stek buku (nodus) ganda (terdiri dari dua
tunas dan dua ketiak daun). Planlet tersebut dipotong sepanjang + 3 cm dan
digunakan sebagai eksplan pada penanaman selanjutnya. Dalam penelitian ini
juga digunakan bahan penyusun media MS, 2-ip, alkohol 96%, akuades, agar serta
bahan pendukung lainnya.
Dalam penelitian ini juga menggunakan beberapa alat, diantaranya botol
kultur dengan volume 250 ml dan diameter 5 cm, autoklaf, Laminar Air Flow
(LAF), scalpel, bunsen, timbangan analitik, hot plate, gelas ukur, pipet tetes,
batang pengaduk, pH meter atau kertas lakmus, erlenmeyer, petridish, oven serta
alat-alat pendukung lainnya.
Metode Penelitian
Penelitian ini menggunakan Rancangan Acak Kelompok, dengan dua
Faktor I : Tingkat konsentrasi sukrosa dalam media dengan 4 taraf
S1 : 35 g/l (3,5%)
S2 : 50 g/l (5%)
S3 : 65 g/l (6,5%)
S4 : 80 g/l (8%)
Faktor II : Tingkat konsentrasi 2-ip dalam media dengan 5 taraf
P0 : 0 mg/l (tanpa 2-ip)
P1 : 2 mg/l
P2 : 4 mg/l
P3 : 6 mg/l
P4 : 8 mg/l
Sehingga diperoleh kombinasi perlakuan sebagai berikut:
S1P0 S2P0 S3P0 S4P0
S1P1 S2P1 S3P1 S4P1
S1P2 S2P2 S3P2 S4P2
S1P3 S2P3 S3P3 S4P3
S1P4 S2P4 S3P4 S4P4
Jumlah perlakuan : 20
Jumlah ulangan : 4
Jumlah sampel : 80
Jumlah eksplan per botol : 1
Adapun model linier dari sidik ragam penelitian adalah sebagai berikut:
Yijk = µ + αi + βj + (αβ)ij + Bk + ε ijk
i = 1, 2, 3, 4 j = 1, 2, 3, 4, 5 k = 1, 2, 3, 4
Keterangan:
Yijk :data pengamatan pada unit percobaan akibat pengaruh sukrosa ke-i dan
2-ip ke-j dan blok ke-k
µ : nilai tengah
αi : pengaruh sukrosa ke-i
βj : pengaruh 2-ip ke-j
(αβ)ij : nilai tambah pengaruh interaksi sukrosa ke-i dan 2-ip ke-j
Bk : pengaruh blok ke-k εijk : galat percobaan
Apabila hasil analisis sidik ragam menunjukkan signifikansi, maka
dilanjutkan ke tahap uji beda rataan dengan menggunakan uji jarak berganda
PELAKSANAAN PENELITIAN
Sterilisasi AlatSterilisasi bermanfaat untuk membersihkan seluruh alat-alat yang akan
digunakan selama penelitian agar tidak menjadi salah satu sumber kontaminan
bagi eksplan. Alat-alat seperti botol kultur, gelas ukur, petridis, erlenmeyer,
pinset, scapel, dan alat-alat gelas lainnya direndam dalam detergen terlebih
dahulu, kemudian dicuci dengan air, hingga bersih dan dikeringkan. Selanjutnya
alat-alat seperti scapel, pipet ukur, pinset dan petridish dibungkus dengan kertas
sampul sedangkan erlenmeyer dan gelas ukur ditutup dengan aluminium foil pada
bagian permukaannya. Setelah itu, semua botol kultur dan alat-alat disterilkan
dalam autoklaf pada suhu 121°C dengan tekanan 17,5 psi selama 60 menit.
Kemudian alat-alat tersebut dimasukkan ke dalam oven, kecuali botol kultur.
Pembuatan Media
Media yang digunakan dalam penelitian ini adalah media Murashige dan
Skoog (MS) padat. Tahap pertama dalam pembuatan media adalah membuat
larutan stok bahan kimia hara makro dengan pembesaran 20x, hara mikro dengan
pembesaran 200x, larutan iron dengan pembesaran 100x, larutan vitamin dengan
pembesaran 200x. Tahap berikutnya, sukrosa dimasukkan ke dalam beaker glass
yang telah berisi akuades 500 ml sesuai taraf perlakuan, lalu diaduk dengan
menggunakan magnetic stirrer sebagai pengaduk. Kemudian ditambahkan
myo-inositol sebanyak 0,1 gr dan diaduk hingga larut. Dimasukkan unsur hara
makro 50 ml, larutan stok hara mikro 5 ml, iron 10 ml dan vitamin 5 ml.
Kemudian larutan ditepatkan menjadi 750 ml. Larutan dibagi dalam lima
ditambahkan 2-ip tiap perlakuan. Kemudian masing-masing larutan tersebut
ditepatkan menjadi 200 ml. Keasaman diukur dengan pH meter, pH yang
dikehendaki adalah 5,8. Untuk mengatur pH yaitu menaikkan atau menurunkan
pH dapat digunakan larutan NaOH dan HCl 1 N.
Agar sebanyak 1.4 gr ditambahkan ke dalam erlenmeyer setiap
perlakuan, kemudian dipanaskan diatas hot plate dengan pengaduk magnetic
stirer sampai larutan menjadi bening (semua agar telah larut). Kemudian kelima
erlenmeyer dibagi empat sehingga diperoleh 20 botol kultur diantara tiap
perlakuan sukrosa dan media siap dipindahkan ke dalam botol kultur berdiameter
5 cm sebanyak + 50 ml/botol. Dilakukan dengan tahap yang sama untuk
masing-masing perlakuan sukrosa sehingga diperoleh seratus botol kultur. Kemudian
botol kultur tersebut ditutup dengan aluminium foil dan diberi label sesuai dengan
perlakuan. Media dalam botol tersebut disterilisasikan di dalam autoklaf dengan
tekanan 17,5 Psi, suhu 121°C selama 30 menit. Selanjutnya media tersebut dapat
disimpan dalam ruang kultur sebelum digunakan.
Persiapan Ruang Tanam
Sebelum digunakan, LAF dibersihkan terlebih dahulu dengan cara
menyemprotkan alkohol 96% lalu di lap dengan kain bersih. Selanjutnya
dilakukan sterilisasi dengan sinar Ultra Violet selama satu jam sebelum kegiatan
penanaman dilakukan. Scalpel dan alat tanam lainnya harus direndam dahulu
dalam alkohol 96%. Sedangkan alat-alat lainnya harus disemprot terlebih dahulu
dengan alkohol 96% sebelum dimasukkan ke dalam LAF. Hal ini bertujuan untuk
Penanaman Eksplan
Eksplan yang digunakan adalah tunas dari planlet kentang yang telah
dikulturkan dalam media MS + ekstrak air kelapa 10 ml/l (media subkultur).
Planlet dikeluarkan dari botol kultur dengan menggunakan pinset. Kemudian
nodus-nodus pada planlet tersebut dipotong sepanjang + 3 cm dengan
menggunakan gunting yang steril. Eksplan yang akan dikulturkan ke dalam media
tanam diletakkan di petridis. Kemudian eksplan ditanamkan ke dalam botol media
sesuai dengan perlakuan, setiap botol kultur terdiri dari 1 eksplan. Botol kultur
diletakkan di rak kultur dalam kondisi terang selama 4 minggu dan dilanjutkan
dengan kondisi gelap (tanpa cahaya) selama 8 minggu (Ni’mah et al, 2012).
Pemeliharaan Eksplan
Botol-botol kultur yang telah ditanami eksplan diletakkan dalam ruang
kultur. Ruangan ini diusahakan bebas dari bakteri, cendawan ataupun semut untuk
menghindari kontaminasi pada kultur. Botol-botol kultur disemprot setiap hari
dengan alkohol 96%. Dalam penelitian ini suhu ruangan kultur yang digunakan
+ 18-20°C.
Peubah Amatan
Persentase Pertumbuhan Eksplan (%)
Kultur dapat dikatakan tumbuh apabila berwarna hijau dan secara visual
mengalami penambahan ukuran dan perubahan morfogenesis. Parameter ini
dihitung pada akhir penelitian dengan menggunakan rumus:
Jumlah Nodus (buah)
Jumlah nodus erat kaitannya dengan jumlah umbi yang dapat dihasilkan
oleh satu planlet. Parameter ini diamati sebanyak 2 kali yakni pada akhir kondisi
terang dan akhir kondisi gelap dengan menghitung banyaknya nodus yang
terdapat dalam satu planlet/sampel pada masing-masing perlakuan.
Waktu Muncul Umbi (hari)
Waktu kemunculan umbi dihitung saat planlet telah menghasilkan umbi
mikro pertama pada masing-masing sampel. Penentuan waktu kemunculan umbi
dilakukan dengan menghitung lamanya waktu yang diperlukan planlet untuk
membentuk umbi mikro pertama sejak tanggal penanaman dimulai.
Jumlah Umbi Mikro Per Planlet (buah)
Umbi mikro yang dihasilkan oleh satu planlet dihitung secara individual
pada tiap sampel dalam botol kultur. Perhitungan ini dilakukan pada akhir
penelitian.
Bobot Basah Umbi (miligram)
Selanjutnya, umbi-umbi mikro tersebut ditimbang menggunakan
timbangan analitik untuk mengetahui bobot basah dari umbi yang dihasilkan oleh
masing-masing perlakuan.
Keadaan Visual Umbi
Pengamatan pada parameter ini dilakukan dengan melihat kenampakan
secara visual dari umbi mikro yang dihasilkan. Kriteria yang diamati dalam
parameter ini diantaranya bentuk umbi, warna umbi, tekstur umbi dan kerusakan
HASIL DAN PEMBAHASAN
HasilDari hasil analisis data yang dilakukan, diketahui bahwa pemberian
sukrosa memberikan pengaruh yang nyata terhadap jumlah nodus akhir kondisi
gelap. Sedangkan pemberian 2-ip memberikan pengaruh yang nyata hanya pada
parameter jumlah nodus akhir kondisi terang. Untuk interaksi antara sukrosa dan
2-ip belum memberikan pengaruh yang nyata pada seluruh parameter yang diuji.
Persentase Pertumbuhan Eksplan (%)
Data hasil pengamatan terhadap persentase pertumbuhan eksplan dapat
dilihat pada Lampiran 1. Rataan persentase pertumbuhan eksplan akibat
pemberian sukrosa dan 2-ip dapat dilihat pada Tabel 1.
Tabel 1. Pengaruh konsentrasi sukrosa dan 2-ip terhadap persentase pertumbuhan eksplan (%)
Berdasarkan Tabel 1 diatas, dapat diketahui bahwa persentase eksplan
yang hidup untuk semua perlakuan konsentrasi sukrosa dan 2-ip sebesar 100%.
Jumlah Nodus
1. Jumlah Nodus Akhir Kondisi Terang
Hasil pengamatan serta sidik ragam terhadap parameter jumlah nodus pada
akhir kondisi terang disajikan pada Lampiran 2-3. Dari tabel sidik ragam tersebut
parameter ini, akan tetapi pemberian perlakuan sukrosa dan interaksi dari kedua
perlakuan ini belum memberikan pengaruh yang nyata.
Rataan jumlah nodus akhir kondisi terang akibat pemberian sukrosa dan
2-ip dapat dilihat pada Tabel 2.
Tabel 2. Pengaruh konsentrasi sukrosa dan 2-ip terhadap jumlah nodus akhir kondisi terang (4 MST)
Keterangan: Angka-angka yang diikuti huruf yang sama pada baris yang sama menunjukkan tidak berbeda nyata pada Uji Jarak Berganda Duncan pada taraf 5 %.
Berdasarkan Uji Duncan pada Tabel 2, jumlah nodus tertinggi terdapat
pada perlakuan 8 mg/l 2-ip (12.63) dan berbeda nyata terhadap perlakuan lainnya
yakni kontrol (10.19), 2 mg/l (9.38), 4 mg/l (9.94) dan 6 mg/l (8.94). Sedangkan
data terendah terdapat pada perlakuan 6 mg/l 2-ip (8.94). Hubungan konsentrasi
2-ip terhadap jumlah nodus akhir kondisi terang tersebut dapat dilihat pada
Gambar 1.
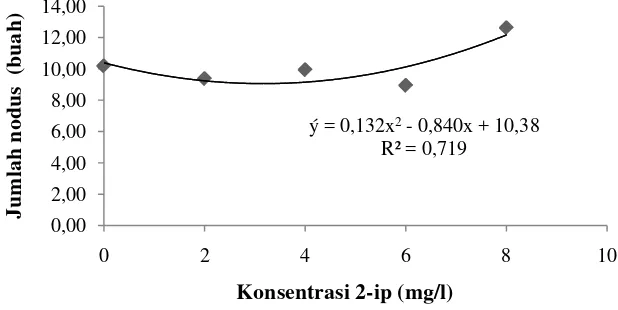
Gambar 1. Hubungan konsentrasi 2-ip terhadap jumlah nodus akhir kondisi terang
Dari Gambar 1 tersebut diperoleh persamaan regresi kwadratik
ý = 0.0132x2 - 0.840x + 10.38 dengan koefisien determinasi (R2) = 0.719. Hal ini
mengindikasikan bahwa penambahan 2-ip ke dalam media memberikan pengaruh
yang mula-mula meningkat kemudian menurun terhadap jumlah nodus akhir
kondisi terang dan keragaman jumlah nodus akhir kondisi terang dipengaruhi oleh
2-ip sebesar 71.90%. Dari persamaan kuadratik tersebut diatas, maka diperoleh
dosis 2-ip optimum sebesar 3.18 mg/l.
2. Jumlah Nodus Akhir Kondisi Gelap
Data hasil pengamatan dan sidik ragam terhadap parameter jumlah nodus
akhir kondisi gelap disajikan pada Lampiran 4-5. Dari tabel sidik ragam diketahui
bahwa sukrosa berpengaruh nyata, sedangkan 2-ip dan interaksi diantara
keduanya belum menunjukkan pengaruh yang nyata. Adapun rataan jumlah nodus
akhir kondisi gelap akibat pemberian perlakuan sukrosa dan 2-ip dapat dilihat
pada Tabel 3.
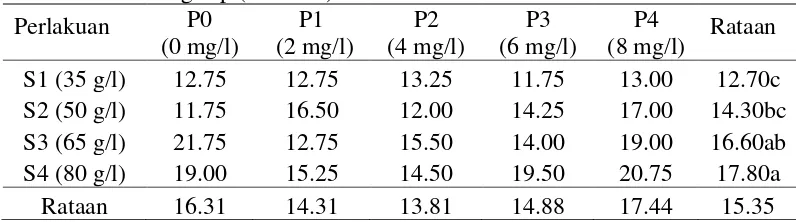
Tabel 3. Pengaruh konsentrasi sukrosa dan 2-ip terhadap jumlah nodus akhir kondisi gelap (12 MST)
Keterangan: Angka-angka yang diikuti huruf yang sama pada baris yang sama menunjukkan tidak berbeda nyata pada Uji Jarak Berganda Duncan pada taraf 5 %.
Berdasarkan Uji Duncan pada Tabel 3, jumlah nodus tertinggi terdapat
pada perlakuan 80 mg/l sukrosa (17.80) dan berbeda nyata terhadap perlakuan
sukrosa terhadap jumlah nodus akhir kondisi gelap tersebut dapat dilihat pada
Gambar 2.
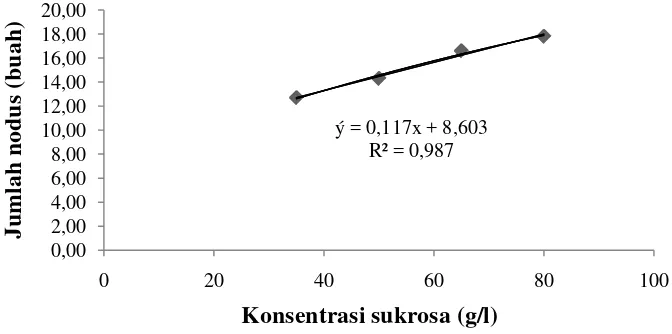
Gambar 2. Hubungan konsentrasi sukrosa terhadap jumlah nodus akhir kondisi gelap
Dari Gambar 2 diatas diperoleh persamaan linier ý = 0.117x + 8.603
dengan koefisien determinasi (R2) = 0.987. Hal ini mengindikasikan bahwa
penambahan sukrosa ke dalam media memberikan pengaruh yang terus meningkat
terhadap jumlah nodus akhir kondisi gelap seiring peningkatan konsentrasi
sukrosa yang diberikan dan keragaman yang ditunjukkan oleh peubah amatan
jumlah nodus akhir kondisi gelap yang dipengaruhi oleh sukrosa adalah sebesar
98.70%.
Waktu Muncul Umbi (Hari)
Data hasil pengamatan dan sidik ragam terhadap parameter waktu muncul
umbi disajikan pada Lampiran 6-8. Dari tabel sidik ragam diketahui bahwa
sukrosa, 2-ip dan interaksi diantara keduanya belum menunjukkan pengaruh yang
nyata. Adapun rataan waktu muncul umbi akibat pemberian sukrosa dan 2-ip
dapat dilihat pada Tabel 4.
Tabel 4. Pengaruh konsentrasi sukrosa dan 2-ip terhadap waktu muncul umbi
Jumlah Umbi Mikro Per Planlet (Buah)
Data hasil pengamatan dan sidik ragam terhadap parameter jumlah umbi
mikro per planlet disajikan pada Lampiran 9-11. Dari tabel sidik ragam diketahui
bahwa sukrosa berpengaruh nyata. Sedangkan 2-ip dan interaksi diantara
keduanya belum menunjukkan pengaruh yang nyata. Adapun rataan jumlah umbi
mikro per planlet akibat pemberian sukrosa dan 2-ip dapat dilihat pada Tabel 5.
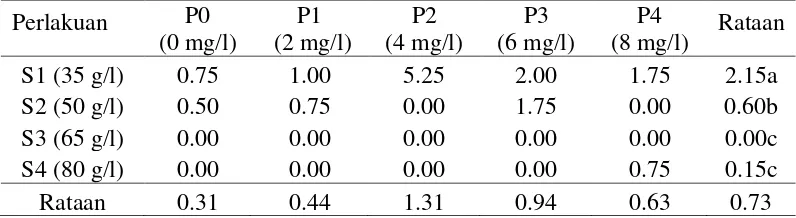
Tabel 5. Pengaruh sukrosa dan 2-ip terhadap jumlah umbi mikro per planlet (buah)
Keterangan: Angka-angka yang diikuti huruf yang sama pada baris yang sama menunjukkan tidak berbeda nyata pada Uji Jarak Berganda Duncan pada taraf 5 %.
Berdasarkan Uji Duncan pada Tabel 5, jumlah umbi tertinggi terdapat
pada perlakuan 35 mg/l sukrosa (2.15) dan berbeda nyata terhadap perlakuan
lainya yakni 50 g/l (0.60), 65 g/l (0.00), 80 g/l (0.15). Hubungan konsentrasi
Gambar 3. Hubungan konsentrasi sukrosa terhadap jumlah umbi mikro per planlet
Dari Gambar 3 diatas diperoleh persamaan linier ý = -0.044x + 3.255
dengan koefisien determinasi (R2) = 0.750. Hal ini mengindikasikan bahwa
penambahan sukrosa ke dalam media memberikan pengaruh yang terus menurun
terhadap jumlah umbi mikro seiring peningkatan konsentrasi sukrosa yang
diberikan dan keragaman yang ditunjukkan oleh peubah amatan jumlah umbi
mikro yang dipengaruhi oleh sukrosa adalah sebesar 75%.
Bobot Basah Umbi (Miligram)
Data hasil pengamatan dan sidik ragam terhadap parameter bobot basah
umbi disajikan pada Lampiran 12-14. Dari tabel sidik ragam diketahui bahwa
sukrosa, 2-ip dan interaksi diantara keduanya belum menunjukkan pengaruh yang
nyata. Adapun rataan bobot basah umbi akibat pemberian perlakuan sukrosa dan
2-ip dapat dilihat pada Tabel 6.
Tabel 6. Pengaruh sukrosa dan 2-ip terhadap bobot basah umbi (miligram)
Keadaan Visual Umbi
Data hasil pengamatan terhadap keadaan visual umbi dapat dilihat pada
Tabel 7.
Tabel 7. Pengaruh sukrosa dan 2-ip terhadap keadaan visual umbi
Perlakuan Keadaan Visual Umbi
S1P0 Lonjong, kuning kecoklatan, permukaan keriput
S1P1 Lonjong, coklat kekuningan, permukaan keriput
S1P2 Lonjong, kuning kecoklatan, permukaan keriput
S1P3 Lonjong, kuning, keriput
S1P4 Lonjong, kuning kecoklatan, keriput
S2P0 Lonjong, kuning, keriput
S2P1 Lonjong, kuning kecoklatan, keriput
S2P3 Lonjong, kuning, cenderung keriput
S4P4 Bulat dengan sebagian umbi lainnya lonjong, kuning, keriput
Keterangan: untuk perlakuan lainnya tidak menghasilkan umbi mikro
(a) (b)
Gambar 4. Planlet kentang tanpa umbi mikro (a); dengan umbi mikro (b)
Pembahasan
Pengaruh sukrosa terhadap pembentukan dan pertumbuhan umbi mikro
Dari hasil analisis data dan daftar sidik ragam diketahui bahwa pada
peubah amatan jumlah nodus akhir kondisi terang menunjukkan sukrosa belum
nodus tertinggi yang dapat dicapai akibat pemberian sukrosa terdapat pada
perlakuan S2 (50 g/l) yaitu sebanyak 11.35 nodus dan data terendah terdapat pada
perlakuan S1(35 g/l) yaitu sebanyak 9.10 nodus. Sedangkan pada perlakuan S3
(65 g/l) dan S4 (80 g/l) menunjukkan pertumbuhan nodus yang tidak jauh berbeda
yaitu masing-masing 10.15 dan 10.25 nodus. Sukrosa memang bertindak sebagai
sumber karbon, sumber energi, mampu mempengaruhi kemampuan jaringan
dalam penyerapan air dari media ke dalam tanaman (Ni’mah et al, 2012) akan
tetapi dalam kondisi terang, pertumbuhan eksplan masih bertujuan untuk
membentuk planlet, bukan untuk membentuk umbi. Oleh sebab itu, penggunaan
sukrosa dengan konsentrasi yang terlalu tinggi diduga dapat menyebabkan stress
tanaman dan berakibat terhadap penurunan jumlah nodus yang dihasilkan.
Pada peubah amatan jumlah nodus akhir kondisi gelap, rataan tertinggi
dari jumlah nodus yang dapat dihasilkan oleh planlet terdapat pada konsentrasi
perlakuan S4 (80 g/l) yaitu sebanyak 17.80 nodus dan terus menurun seiring
penurunan konsentrasi sukrosa yakni S3 (65 g/l) sebanyak 16.60 nodus,
S2 (50 g/l) sebanyak 14.30 nodus dan S1 (35 g/l) sebanyak 12.70 nodus. Hal ini
menunjukkan perbedaan yang nyata bila dibandingkan dengan jumlah nodus yang
terbentuk selama masa kondisi terang (yang mengalami penurunan jumlah nodus
pada konsentrasi sukrosa > 50 g/l). Peningkatan jumlah nodus seiring peningkatan
konsentrasi sukrosa ini sesuai dengan pernyataan Ni’mah et al (2012) bahwa
sukrosa bertindak sebagai sumber karbon, sumber energi dan pengatur tekanan
osmotik yang dapat mempengaruhi kemampuan jaringan dalam penyerapan air
dari media ke dalam tanaman. Media dengan konsentrasi pekat berarti banyak
kekurangan molekul atau yang berkonsentrasi rendah. Keadaan demikian
menyebabkan sel-sel pada jaringan eksplan yang ditumbuhkan pada media dengan
penambahan sukrosa tinggi dapat cepat menerima unsur-unsur hara yang
diperlukan bagi perkembangannya (Ni’mah et al, 2012) sehingga semakin tinggi
konsentrasi sukosa menjadikan pertumbuhan dan penyerapan hara menjadi
semakin meningkat pula karena dalam fase gelap, planlet kentang sudah mulai
menggunakan sukrosa untuk membentuk umbi dengan menyimpan sukrosa dalam
daun (Lakitan, 2011) untuk dipindahkan pada ruang kosong di ujung stolon untuk
meningkatkan ukuran umbi. Disamping itu, menurut Lakitan (1995) pada awal
perkembangan daun muda pada tanaman dikotil itu sangat tergantung terhadap
banyaknya karbohidrat yang dikirim oleh daun tua ke daun muda yang dapat
menyebabkan daun muda terus terbentuk sedangkan daun tua mengalami
senescens.
Untuk peubah amatan waktu mucul umbi, jumlah umbi mikro dan bobot
basah umbi memiliki pola yang berbeda. Dimana pada konsentrasi sukrosa 35 g/l,
50 g/l dan 65 g/l pertumbuhan dan kemunculan umbi terus menurun seiring
penambahan konsentrasi sukrosa dan kembali meningkat pada konsentrasi 80 g/l.
Untuk peubah amatan jumlah umbi mikro, sukrosa memberikan pengaruh yang
nyata dan hasil terbaik ditunjukkan oleh pemberian sukrosa 35 g/l (S1) sedangkan
pada pemberian sukrosa yang lebih tinggi, jumlah umbi mikro menurun. Umbi
kentang merupakan peristiwa penggemukan batang atau stolon yang berada di
permukaan tanah. Dimana dalam memunculkan umbi kentang jelas dipengaruhi
oleh faktor-faktor tertentu, seperti sumber karbon sebagai pengisi/penyusun
bagian-bagian tanaman lainnya, termasuk tajuk tanaman. Pada planlet kentang
baik yang mampu atau tidak dalam memunculkan umbi mikro, ada sejumlah
organ yang menguning, bahkan mati baik itu bagian daun, batang dan tajuk
tanaman yang pada umumnya diakibatkan oleh penuaan (senescens). Sedangkan
menurut Lakitan (1996), faktor internal yang mempengaruhi pertumbuhan umbi
adalah laju dan kuantitas sumber karbon yang dipasok dari tajuk tanaman. Oleh
sebab itu, kemunculan umbi, jumlah umbi dan bobot basah umbi sangat
bergantung dengan keadaan tajuk planlet. Dimana, ukuran umbi rata-rata
berbanding lurus dengan pertumbuhan tajuk dan berbanding terbalik dengan
jumlah serta bobot basah umbi yang dihasilkan oleh masing-masing planlet
tersebut. Jika tajuk planlet mati sebelum memunculkan umbi, maka umbi
mungkin juga tidak akan terbentuk.
Untuk peubah amatan jumlah umbi mikro, pemberian sukrosa memberikan
pengaruh yang nyata.
Pada pengamatan keadaan visual umbi untuk tiap perlakuan yang berhasil
menghasilkan umbi mikro, pada umumnya bentuk umbi dominan lonjong
meskipun ada perlakuan yang menghasilkan sebagian umbi yang berbentuk bulat.
Tekstur umbi dominan keriput, warna umbi kuning kecoklatan atau sebaliknya
dan tidak ditemukan adanya kerusakan pada umbi. Sukrosa berperan dalam
menyusun agregat umbi melalui perubahan bentuk dari sukrosa ke amilum.
Dwidjoseputro (1980) menjelaskan pada umumnya, suatu butir tepung itu terdiri
atas beberapa lapis yang mengelilingi suatu pusat atau hilum. Dimana amilum itu
terdiri atas dua bagian, yaitu amilosa dan amilopektin yang berkaitan erat dengan
Dari hasil penelitian ini tidak semua perlakuan mampu menghasilkan umbi
mikro hingga akhir penelitian. Tidak munculnya umbi mikro tersebut diduga
karena pertumbuhan stolon pada perlakuan-perlakuan ini mungkin terhenti akibat
kondisi lingkungan yang kurang optimum akibat media dengan sukrosa yang
tinggi menyebabkan kepekatan media sehingga pertumbuhan stolon yang terdapat
di bawah media tersebut terganggu.
Pengaruh 2-ip terhadap pembentukan dan pertumbuhan umbi mikro
Dari hasil analisis data, diketahui bahwa pemberian 2-ip pada berbagai
konsentrasi menunjukkan pengaruh yang nyata hanya pada peubah amatan jumlah
nodus di akhir kondisi terang. Sedangkan pada peubah amatan lainnya belum
menunjukkan pengaruh yang nyata.
Pada peubah amatan jumlah nodus akhir kondisi terang, perlakuan terbaik
terdapat pada pemberian konsentrasi 2-ip sebesar P4 (8 mg/l) yaitu 12.63 nodus
dan berbeda nyata (berdasarkan Uji Duncan) dengan perlakuan lainnya yaitu P0
(kontrol) sebesar 10.19 nodus, P1 (2 mg/l) sebesar 9.38, P2 (4 mg/l) sebesar 9.94
nodus dan data terendah terdapat pada perlakuan P3 (6 mg/l) sebesar 8.94 nodus
dengan konsentrasi optimum sebesar 3.18 mg/l. Hal ini diduga karena dalam
pembentukan daun, eksplan membutuhkan sitokinin sebagai bahan dasar pemacu
pembelahan sel (Salisbury dan Ross, 1995) yang terjadi pada 3 lapisan sel terluar
pada permukaan batang, yang merupakan tanda awal perkembangan daun (nodus
kentang). Lakitan (1996) menambahkan bahwa sitokinin yang di translokasikan
dari akar dapat merangsang pertumbuhan daun, dimana dalam hal pertumbuhan
kentang, keberadaan satu daun setara dengan keberadaan satu nodus. Sehingga
daun. Pada tiap nodus planlet kentang terdapat mata tunas aksiler yang dapat di
dorong untuk membentuk tunas, stolon atau umbi mikro tergantung dari
komposisi media dan kondisi lingkungan tumbuhnya.
Akan tetapi, pada peubah amatan jumlah nodus akhir kondisi gelap,
pemberian 2-ip tidak memberikan pengaruh yang nyata. Data tertinggi tetap
terdapat pada perlakuan P4 (8 mg/l) yaitu sebesar 17.13 nodus akan tetapi data
terendah terdapat pada perlakuan P2 (4 mg/l) yaitu sbebesar 13.81 nodus.
Pertumbuhan jumlah nodus selama masa gelap ternyata mengalami penurunan.
Karena dalam masa ini, planlet lebih menekan pertumbuhan nodus dan memacu
diri untuk membentuk umbi melalui tunas dan nodus-nodus pada planlet dengan
cara menumbuhkan stolon. Menurut Ni’mah et al (2012), pada media umbi mikro,
sitokinin mendorong terbentuknya umbi mikro pada tunas dan nodus dari eksplan
tanaman kentang secara in vitro. Oleh sebab itu, dapat dikatakan bahawa
pertumbuhan planlet (sebelum terbentuknya umbi) bukanlah untuk pertumbuhan
nodus melainkan untuk menumbuhkan stolon.
Untuk peubah amatan waktu muncul umbi akibat pemberian sitokinin 2-ip,
waktu kemunculan umbi tercepat terdapat pada perlakuan P4 (8 mg/l) yaitu
selama 3.94 hari. Masalah mengenai waktu kemunculan umbi secara jelas
tergantung pada tingkat kemampuan stolon pada tiap planlet untuk segera
berkembang menjadi umbi pada kondisi lingkungan yang khusus (seperti suhu
dan intensitas cahaya). Salisbury dan Ross (1995) telah menjelaskan bahwa
pertumbuhan awal stolon memerlukan kadar giberelin yang tinggi dan kadar
konsentrasi sebesar 4 mg/l ternyata lebih baik dibandingkan perlakuan lainnya
dalam hal memunculkan umbi mikro.
Perbandingan diantara jumlah umbi mikro per planlet dan bobot basah
umbi dapat diketahui bahwa jumlah umbi terbanyak terdapat pada perlakuan P2
(4 mg/l) yaitu 1.31 buah namun bobot basah umbi yang mampu dihasilkan adalah
sebesar 0.65 mg. Sedangkan bobot basah umbi terbaik terdapat pada perlakuan P3
(6 mg/l) yaitu 2.35 mg namun jumlah umbi mikro yang dapat dihasilkan hanyalah
0.74 buah. Hal ini diduga berkaitan erat dengan besarnya proporsi distribusi
asimilat yang diterima oleh masing-masing umbi yang dihasilkan tiap planlet. Hal
ini diperkuat dengan pernyataan Warnita (2008) yang menyebutkan bahwa
eksplan yang mempunyai jumlah umbi yang banyak terjadi proses distribusi
asimilat yang menyebar ke setiap umbi, tetapi pada eksplan yang mempunyai
umbi sedikit distribusi asimilat lebih terfokus pada pertumbuhan umbinya
sehingga umbi yang terbentuk berukuran besar.
Pada sejumlah perlakuan, tidak ditemukannya pertumbuhan umbi mikro
akan tetapi pada organ daun masih terlihat segar dan berwarna hijau. Pada
dasarnya, dalam memacu pertumbuhan umbi, tanaman kentang akan mengalami
penuaan (senescens daun) yang ditandai dengan menguningnya bagian daun dan
menyebabkan tanaman mati. Taji et al (2001) mengungkapkan dalam
pembentukan umbi sering terjadi senescence, dan ini dapat diatasi dengan
penambahan sukrosa dan sitokinin pada medium. Adapun mekanisme penundaan
senescens daun telah dijelaskan oleh Salisbury dan Ross (1995) yang
mengungkapkan bahwa cara sitokinin memperlambat penuaan pada daun diawali
klorofil dimana penuaan ini terjadi jauh lebih cepat di tempat gelap daripada di
tempat terang dan sitokinin yang ditambahkan pada larutan tempat daun tumbuh,
dapat menggantikan efek cahaya dan menunda penuaan.
Pengaruh interaksi konsentrasi sukrosa dan 2-ip terhadap pembentukan dan pertumbuhan umbi mikro
Berdasarkan hasil analisis data yang telah dilakukan, interaksi antara
sukrosa dan 2-ip belum memberikan pengaruh yang nyata terhadap semua peubah
amatan. Namun untuk peubah jumlah nodus akhir kondisi terang, perlakuan S2P4
(50 g/l sukrosa dan 8 mg/l 2-ip) menghasilkan jumlah nodus paling banyak yaitu
sebanyak 15.75 nodus dan nodus terendah terdapat pada perlakuan S1P1 (35 g/l
sukrosa dan 0 mg/l 2-ip) yaitu sebesar 7.00 nodus. Seperti telah dikemukakan
pada pembahasan sebelumnya bahwa dalam memacu pertumbuhan nodus dimulai
sejak eksplan hingga membentuk planlet, maka konsentrasi sukrosa tidak melebihi
5% sedangkan 2-ip bekerja maksimal untuk melakukan pembelahan sel yang
memang dibutuhkan untuk perkembangan daun (nodus). Zulkarnain (2009)
menambahkan bahwa konsentrasi medium menjadi faktor penting bila sitokinin
tidak diberikan pada tingkat konsentrasi yang optimum. Dengan demikian, dapat
dikemukakan bahwa untuk mendapatkan hasil yang maksimum dari perlakuan zat
pengatur tumbuh maka komponen medium lainnya harus berada pada kadar yang
optimum.
Sedangkan pada jumlah nodus akhir kondisi gelap, nodus tertinggi
dihasilkan oleh perlakuan S3P0 (65 g/l sukrosa dan 0 mg/l 2-ip) yaitu sebanyak
21.75 nodus dan terendah pada perlakuan S2P0 (50 g/l sukrosa dan 0 mg/l 2-ip)
dan S2P3 (50 g/l sukrosa dan 6 mg/l 2-ip) yaitu sebanyak 11.75 nodus. Dalam
karena kondisi ini ditujukan untuk menghasilkan umbi mikro. Oleh sebab itu,
kemungkinan keberadaan sitokinin eksogen diduga dapat menghambat
pertumbuhan nodus dalam kondisi gelap dan keadaan planlet yang teretiolasi.
Untuk peubah amatan waktu muncul umbi, hasil terbaik terdapat pada
perlakuan S1P2 (35 g/l sukrosa dan 4 mg/l 2-ip) yaitu selama 15.75 hari
sedangkan untuk peubah amatan jumlah umbi mikro per planlet, hasil terbaik
terdapat pada perlakuan S1P2 (35 g/l sukrosa dan 4 mg/l 2-ip) yaitu sebesar 5.25
umbi. Sedangkan bobot basah umbi terbaik diperoleh dari hasil kombinasi S1P3
KESIMPULAN DAN SARAN
Kesimpulan
Pemberian sukrosa 35-80 g/l, 2-ip 0-8 mg/l dan interaksi keduanya tidak
memberikan pengaruh terhadap pembentukan umbi mikro, akan tetapi pemberian
sukrosa memberikan pengaruh terhadap peubah jumlah nodus pada akhir kondisi
gelap dan jumlah umbi mikro per planlet sedangkan pemberian 2-ip memberikan
pengaruh terhadap peubah amatan jumlah nodus pada akhir kondisi terang.
Saran
Perlu dilakukan penelitian lanjutan yang terkait dengan faktor-faktor yang
mampu menstimulasi pembentukan umbi mikro kentang, seperti temperatur dan