TERHADAP STABILITAS ENZIM SELULASE DARIBacillus subtilis ITBCCB148
Oleh Sundari Riawati
Penelitian ini bertujuan untuk mempelajari pengaruh penambahan gliserol dan sorbitol terhadap stabilitas enzim selulase dari Bacillus subtilis ITBCCB148. Untuk mencapai tujuan tersebut dilakukan produksi, isolasi, dan pemurnian enzim. Pemurnian enzim selulase dilakukan dengan menggunakan kromatografi kolom filtrasi gel Sephadex G-100. Enzim hasil pemurnian kemudian ditambahkan gliserol dan sorbitol. Penentuan aktivitas enzim selulase dilakukan dengan metode Mandels sedangkan pengukuran kadar protein dilakukan dengan metode Lowry.
Hasil penelitian menunjukkan bahwa enzim hasil pemurnian memiliki aktivitas spesifik sebesar 4,6458 U/mg, meningkat 4,93 kali dibandingkan ekstrak kasar enzim dengan perolehan 12,60%. Enzim ini memiliki pH optimum 5,5; suhu optimum 50oC; ki = 0,0121 menit-1;t1/2= 57,27 menit; dan∆Gi= 102,19 kJ mol-1.
Enzim setelah penambahan gliserol 0,5; 1,0; dan 1,5 M memiliki pH optimum dan suhu optimum yang sama dengan enzim hasil pemurnian. Uji stabilitas termal enzim setelah penambahan gliserol 0,5 M pada suhu 50oC selama 100 menit memiliki t1/2= 72,19 menit, ki = 0,0096 menit-1 dan ∆Gi = 102,82 kJ stabilitas termal enzim setelah penambahan sorbitol 0,5 M pada suhu 50oC selama 100 menit memiliki t1/2= 90,00 menit, ki = 0,0077 menit-1 dan ∆Gi = 103,41 kJ
mol-1; sorbitol 1,0 M memiliki t1/2= 99,00 menit, ki = 0,0070 menit-1dan ∆Gi=
103,66 kJ mol-1; dan sorbitol 1,5 M memiliki t1/2 = 92,40 menit, ki = 0,0075
menit-1dan∆Gi= 103,48 kJ mol-1.
Walaupun suhu optimum dan pH optimum enzim setelah penambahan gliserol dan sorbitol tidak mengalami perubahan, tetapi terjadi peningkatan stabilitas termal karena adanya penurunan nilai ki serta peningkatan waktu paruh
dan∆Gi.
TOWARD STABILITY OF CELLULASE ENZYME FROMBacilus subtilis ITBCCB148
By
Sundari Riawati
This research aims to study the effect of addition glycerol and sorbitol toward stability cellulase enzyme from Bacilus subtilisITBCCB148. To approach this aims, the production, isolation and purification of the enzyme were done. The purification of cellulase enzyme was done by using gel filtration chromatography column of Sephadex G-100. The pure enzyme is added by glycerol and sorbitol. Determination of cellulase enzyme activity performed by the method of Mandels while the measurement of protein levels performed by the method of Lowry.
The results showed that the pure enzyme has specific activity 4,6458 U/mg, the pureness increase 4,93 times than native enzyme with the result 12,60%. This enzyme has optimum pH 5,5; optimum temperature 50°C; ki =
0,0121 min-1; t1/2= 57,27 min; and Δ Gi= 102,19 kJ mol-1.
Enzyme after addition glycerol 0,5; 1,0; and 1,5 M have optimum pH and temperature same with pure enzyme. The test of thermal stability of the enzyme after addition glycerol 0,5 M at temperature 50°C for 100 min has t1/2 = 72,19
min, ki= 0,0096 min-1and Δ Gi = 102,82 kJ mol-1; glycerol 1,0 M has t1/2= 82,50
min, ki = 0,0084 min-1 and Δ Gi = 103,17 kJ mol-1; and glycerol 1,5 M has t1/2 =
80,58 min, ki= 0,0086 min-1and Δ Gi= 103,11 kJ mol-1.
Enzyme after addition sorbitol 0,5; 1,0; and 1,5 M have optimum pH and temperature same with pure enzyme. The test of thermal stability of the enzyme after addition sorbitol 0,5 M at temperature 50°C for 100 min has t1/2= 90,00 min,
ki = 0,0077 min-1 and Δ Gi= 103,41 kJ mol-1; sorbitol 1,0 M has t1/2 = 99,00 min,
ki = 0,0070 min-1 and Δ Gi = 103,66 kJ mol-1, and sorbitol 1,5 M has t1/2= 92,40
min, ki= 0,0075 min-1and Δ Gi= 103,48 kJ mol-1.
Although the optimum pH and temperature of the enzyme after addition glycerol and sorbitol have not changed, but an increase in thermal stability due to a decrease in the value of kias well as increase halflife and Δ Gi.
A. Latar Belakang
Selulosa merupakan senyawa organik yang setiap tahun terkumpul dalam jumlah yang melimpah sebagai limbah pertanian, industri, dan hutan serta sampah kota (Tymoczko and Stryer, 2002). Selulosa dibentuk dari monomer glukosa yang
diikat oleh ikatan β-1,4-glikosida yang merupakan komponen utama penyusun dinding sel tanaman (Wenet al.,2005). Dengan jumlah selulosa yang melimpah tersebut, sangat potensial untuk memanfaatkannya.
Pemanfaatan selulosa biasanya melalui suatu proses hidrolisis. Hidrolisis selulosa dengan menggunakan asam memerlukan suhu yang tinggi dan konsentrasi asam yang besar untuk meningkatkan kecepatan hidrolisis (Mandelset al., 1976). Hal tersebut dapat menyebabkan dekomposisi dari glukosa yang telah terbentuk.
Banyak peneliti yang mengungkapkan bahwa terdapat beberapa mikroorganisme yang memiliki kemampuan untuk menghasilkan enzim selulase, seperti fungi
Trichoderma viride,Streptomycessp., dan beberapa spesies bakteri dari genus
reaksi kimiawi spesifik tanpa pembentukan senyawa samping, produktivitas tinggi, dan produk akhir umumnya tidak terkontaminasi sehingga mengurangi biaya purifikasi dan efek kerusakan terhadap lingkungan (Chaplin and Bucke, 1990).
Enzim selulase umumnya diaplikasikan di dalam dunia industri, terutama dalam industri pakan ternak, tekstil, air limbah, pembuatan bir dan anggur. Bahkan dengan terjadinya kekurangan bahan bakar minyak bumi, peningkatan gas rumah kaca dan polusi udara akibat pembakaran yang tidak sempurna dari bahan bakar fosil, maka saat ini terjadi peningkatan minat dunia dalam produksi bioetanol dengan menggunakan enzim selulase (Coughlan, 1990; Beguin and Aubert, 1994; Zaldivaret al., 2001).
Terdapat beberapa syarat tertentu untuk enzim yang digunakan dalam dunia industri, diantaranya harus stabil pada suhu tinggi (termostabil) dan tahan pada kondisi pH yang ekstrim (Suhartono, 1989). Syarat tersebut dapat terpenuhi dengan cara mengisolasi enzim langsung dari organisme yang hidup dalam keadaan ekstrim (Weagen, 1984), atau dengan teknik imobilisasi, modifikasi kimia, rekayasa molekuler, dan penambahan zat aditif. Penggunaan zat aditif lebih sering dipilih karena relatif lebih mudah dan biayanya relatif lebih murah (Suhartono, 1993).
Secara umum, senyawa aditif digolongkan ke dalam subsrat dan sejenis; golongan senyawa bermuatan dan polimer; serta golongan senyawa organik kecil tak
tersebut adalah gliserol dan sorbitol. Senyawa tersebut menimbulkan hidrasi air sehingga konformasi protein terjaga dari kemungkinan membuka. Kelebihan golongan alkohol ini adalah meningkatkan stabilitas (daya awet) enzim, sifatnya yang menarik air (hidrofilik) dapat menurunkan aktivitas air, dan penambahan senyawa alkohol dapat meningkatkan interaksi hidrofobik di antara molekul protein enzim dan dapat bertindak sebagai penangkap atau pengikat senyawa radikal bebas sehingga mengurangi kemungkinan oksidasi enzim (Suhartono, 1989). Oleh karena itu, pada penelitian ini dipelajari pengaruh penambahan gliserol dan sorbitol terhadap stabilitas enzim selulase dariBacillus subtilis
ITBCCB148.
B. Tujuan Penelitian
Tujuan dari penelitian ini adalah:
1. Memperoleh enzim selulase dari Bacillus subtilis ITBCCB148 dengan aktivitas dan tingkat kemurnian yang tinggi.
2. Mempelajari pengaruh penambahan gliserol dan sorbitol terhadap stabilitas enzim selulase dariBacillus subtilisITBCCB148.
C. Manfaat Penelitian
Manfaat yang dapat diambil dari penelitian ini adalah:
1. Enzim selulase yang mempunyai kemurnian dan aktivitas yang tinggi, dapat digunakan untuk konversi enzimatis selulosa menjadi glukosa secara optimal. 2. Memberikan informasi mengenai pengaruh penambahan gliserol dan sorbitol
A. Enzim
Enzim merupakan unit fungsional dari metabolisme sel, bekerja dengan urutan-urutan yang teratur, mengkatalisis ratusan reaksi bertahap yang menyimpan dan mentransformasikan energi kimiawi, serta membuat makromolekul sel dan prekusor sederhana (Lehninger, 1982). Menurut Martoharsono (1981), enzim tersusun atas asam amino-asam amino yang melipat-lipat membentuk globular, dimana substrat yang dikatalisis bisa masuk dan bersifat komplementer.
Enzim berfungsi sebagai katalis yang sangat efisien, selain itu mempunyai derajat kekhasan yang tinggi. Enzim berperan sebagai katalis proses biokimia yang terjadi di dalam maupun di luar sel. Seperti katalis lainnya, enzim dapat
menurunkan energi aktivasi suatu reaksi kimia. Suatu enzim dapat mempercepat reaksi 108sampai 1011kali lebih cepat dibandingkan dengan reaksi yang
dilakukan tanpa katalis (Poedjiadi, 1994).
1. Klasifikasi enzim
dan nomor klasifikasi dari tiap enzim melukiskan reaksi yang dikatalisis berdasarkan IUPAC:
a. Oksidoreduktase yang mengkatalisis berbagai macam reaksi oksidasi-reduksi yang menggunakan koenzim seperti nikotinamid adenin
dinukleotida (NAD+), nikotinamid adenin dinukleotida fosfaat (NADP+), flavin adenin dinukleotida (FAD+) atau lipoat. Nama trivial yang umum lainnya adalah dehidrogenase, oksidase, peroksidase dan reduktase.
b. Transferase yang mengkatalisis berbagai perpindahan gugus seperti amino, karbonil, metil, asil, glikosil atau fosforil. Nama trivial yang umum lainnya adalah aminotransferase (transaminase), karnitin asil transminase dan transkarboksilase.
c. Hidrolase yang mengkatalisis pemutusan ikatan antara karbon dengan berbagai atom lain dengan adanya penambahan air. Nama trivial yang umum lainnya adalah esterase, peptidase, amilase, fosfatase, urease, pepsin, tripsin dan kimotripsin.
d. Liase yang mengkatalisis pemecahan ikatan karbon, karbon-sulfur, dan karbon-nitrogen (tidak termaksuk ikatan peptida). Nama trivial lainnya adalah dekarboksilase, aldolase, sintase, sitratliase dan dehidratase.
f. Ligase yang mengkatalisis pembentukan ikatan oksigen, karbon-sulfur, karbon-nitrogen, dan karbon-atom lainnya. Energi yang
diperlukan untuk pembentukan ikatan diperoleh dari hidrolisis ATP. Nama trivial lainnya adalah tiokinase dan karboksilase (Montgomery, 1993).
2. Sifat katalitik enzim
Sifat-sifat katalitik khas dari enzim ialah sebagai berikut:
a. Enzim mampu meningkatkan laju reaksi pada kondisi biasa (fisiologik) dari tekanan, suhu dan pH.
b. Enzim berfungsi dengan selektifitas tinggi terhadap substrat (substansi yang mengalami perubahan kimia setelah bercampur dengan enzim) dan jenis reaksi yang dikatalisis.
c. Enzim memberikan peningkatan laju reaksi yang tinggi dibanding dengan katalis biasa (Page, 1989).
3. Faktor yang mempengaruhi kerja enzim
Berikut ini adalah faktor-faktor yang mempengaruhi kerja enzim:
a. Konsentrasi enzim
selama konsentrasi enzim jauh lebih sedikit dari pada konsentrasi substrat (Page, 1989).
b. Konsentrasi substrat
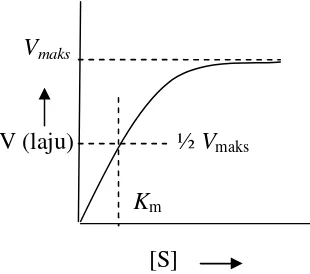
Jika konsentrasi substrat diturunkan dan konsentrasi enzim tetap, maka laju reaksi menjadi lambat, sehingga kompleks enzim-substrat terbentuk sedikit. Hal ini karena tidak semua substrat diikat oleh enzim. Jika konsentrasi substrat dinaikkan dan kadar enzim tetap, maka kecepatan reaksi akan naik sampai dicapai kondisi konstan, yaitu ketika semua substrat sudah diikat oleh enzim (Poedjiadi, 1994). Hubungan antara konsentrasi substrat dengan laju reaksi enzim dtunjukkan dalam Gambar 1.
Gambar 1. Hubungan konsentrasi substrat dengan laju reaksi enzim (Shahib, 2005)
c. Inhibitor
Menurut Wirahadikusumah (1997) inhibitor merupakan suatu zat kimia tertentu yang dapat menghambat aktivitas enzim. Pada umumnya cara kerja inhibitor adalah dengan menyerang sisi aktif enzim sehingga enzim
½Vmaks
Km
[S] V (laju)
tidak dapat lagi berikatan dengan substrat sehingga fungsi katalitiknya terganggu (Winarno, 1989).
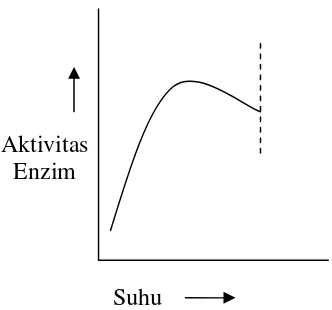
d. Suhu
Suhu dapat meningkatkan laju reaksi enzimatik sampai batas tertentu. Suhu yang terlalu tinggi (jauh dari suhu optimum suatu enzim) akan menyebabkan enzim terdenaturasi (Poedjiadi, 1994). Pada suhu 0oC enzim tidak aktif (tidak rusak) dan dapat kembali aktif pada suhu normal (Lay dan Sugyo, 1992). Hubungan antara aktivitas enzim dengan suhu ditunjukkan dalam Gambar 2.
Gambar 2. Hubungan suhu dengan aktivitas enzim (Shahib, 2005)
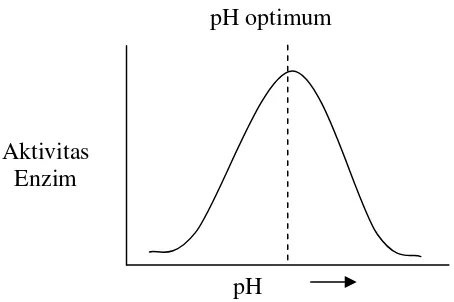
e. pH
Perubahan pH dapat mempengaruhi perubahan asam amino kunci pada sisi aktif, sehingga menghalangi sisi aktif membentuk kompleks dengan substratnya (Page, 1989). Secara umum pengaruh pH terhadap aktivitas enzim ditunjukkan pada Gambar 3. Pada beberapa enzim memiliki aktivitas maksimum pada kisaran pH antara 4,5-8,0 (Winarno, 1989).
Suhu Aktivitas
Gambar 3. Hubungan pH dengan aktivitas (Shahib, 2005)
f. Kofaktor logam
Kofaktor adalah suatu faktor yang membantu keaktifan enzim. Ikatan antara kofaktor dan enzim dapat sangat kuat dan ada pula yang tidak terikat dengan kuat (Poedjiadi, 1994).
g. Pelarut organik
Penggunaan pelarut dalam reaksi enzimatik memberikan keuntungan antara lain ialah kelarutan substrat-organik dan enzim lebih tinggi dibandingkan dengan air serta meningkatkan kestabilan enzim dengan pelarut (Kwon and Rhee, 1986).
4. Teori pembentukan enzim-substrat
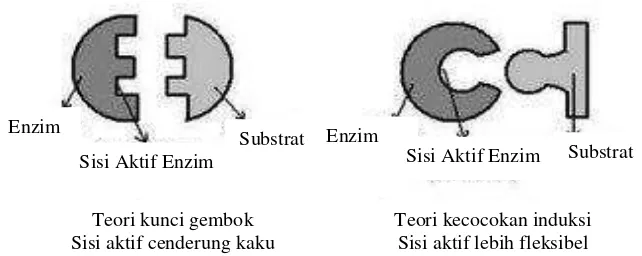
Enzim bekerja dengan dua mekanisme reaksi yaitu teori kunci gembok (lock and key theory)yang diterangkan oleh Emil Fisher dan dan teori kecocokan induksi(induced fit theory)oleh Daniel Koshland (Shahib, 2005), yang ditunjukkan dalam Gambar 4.
pH optimum
pH Aktivitas
Gambar 4.Teori kunci gembok dan teori kecocokan induksi (Yandriano, 2006)
Menurut teori kunci gembok, terjadinya reaksi antara substrat dengan enzim karena adanya kesesuaian bentuk ruang antara substrat dengan situs aktif dari enzim, sehingga sisi aktif enzim cenderung kaku. Substrat berperan sebagai kunci masuk ke dalam situs aktif, sehingga terjadi kompleks enzim-substrat. Pada saat ikatan kompleks enzim-substrat terputus, produk hasil reaksi akan dilepas dan enzim akan kembali pada konfigurasi semula. Berbeda dengan teori kunci gembok, menurut teori kecocokan induksi reaksi antara enzim dengan substrat berlangsung karena adanya induksi substrat terhadap situs aktif enzim sedemikian rupa sehingga keduanya menjadi struktur yang komplemen atau saling melengkapi. Menurut teori ini sisi aktif tidak bersifat kaku, tetapi lebih fleksibel (Yandriano, 2006).
B. Enzim Selulase
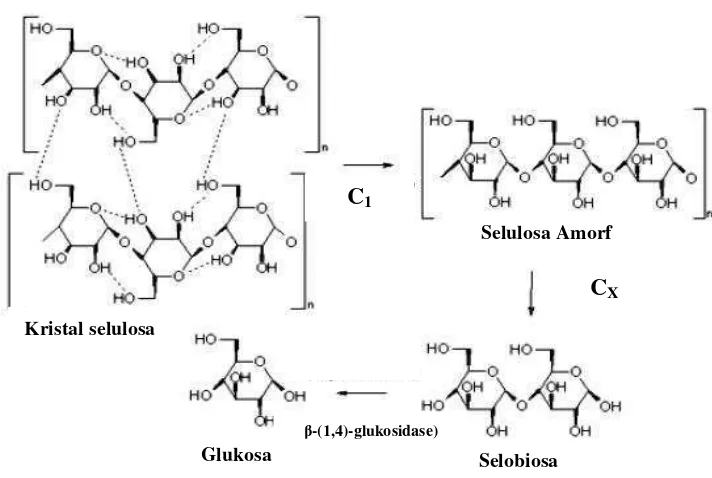
Selulase adalah enzim induksi yang disintesis oleh mikroorganisme selama ditumbuhkan dalam medium selulosa (Lee and Koo, 2001). Selulase termasuk sistem multienzim yang terdiri dari tiga komponen. Untuk menghidrolisis selulosa yang tidak larut atau selulosa kristal diperlukan kerja sinergistik dari
ketiga komponen enzim tersebut. Mekanisme hidrolisis selulosa oleh enzim selulase dapat dilihat dalam Gambar 5.
Gambar 5.Mekanisme hidrolisis selulosa oleh enzim selulase
Adapun ketiga komponen enzim tersebut yaitu:
1) Ekso-β-(1,4)-glukanase dikenal sebagai faktor C1.
Faktor ini diperlukan untuk menghidrolisis selulosa dalam bentuk kristal 2) Endo-β-(1,4)-glukanase dikenal sebagai faktor Cx.
Faktorini diperlukan untuk menghidrolisis ikatan β-(1,4)-glukosida (selulosa amorf).
3) β-(1,4)-glukosidase menghidrolisis selobiosa menjadi glukosa (Reese, 1976).
Aktivitas selulase disebabkan oleh enzim C1, hidrolisis selulosa yang telah
diaktifkan dilakukan oleh enzim Cx. Menurut hipotesa ini, mikroba yang tumbuh pada selulosa kristal membentuk C1, sedangkan mikroba yang hanya dapat
CX Selulosa Amorf
Selobiosa Glukosa
Kristal selulosa
C1
menguraikan selulosa yang telah dilonggarkan oleh asam fosfat atau selulosa tersubstitusi akan kekurangan enzim C1, tetapi banyak menghasilkan enzim Cx
(Muchtadiet al., 1992).
Enzim selulase memiliki aplikasi yang luas dan potensial dalam bidang pangan, pakan ternak, tekstil, bahan bakar, industri kimia, industri pulp dan kertas, pengolahan limbah, industri farmasi, produksi protoplas, dan teknik genetik (Coughlan, 1985; Mandels, 1985; Beguin and Aubert, 1994; Tarek and Nagwa, 2007).
C. Bacillus subtilis
Bakteri merupakan suatu kelompok mikroorganisme prokariotik bersel tunggal yang sangat beragam dan terdapat dalam air, udara, maupun tanah. Hal tersebut dikarenakan bakteri mampu membentuk spora untuk mempertahankan diri.
Bacillus subtilisadalah bakteri yang mempunyai spora berbentuk oval atau silinder dan lebarnya tidak melebihi dari sel induknya. Mikroorganisme ini bersifat gram positif dan aerob (Schelege and Schmidt, 1994). GambarBacillus subtilisditunjukkan pada Gambar 6.
Berikut ini adalah klasifikasiBacillus subtilismenurut Madigan (2005): Kingdom : Bacteria
Filum : Firmicutes Kelas : Bacilli Ordo : Bacillales Famili : Bacillaceae Genus :Bacillus
Spesies :Bacillus subtilis
D. Selulosa
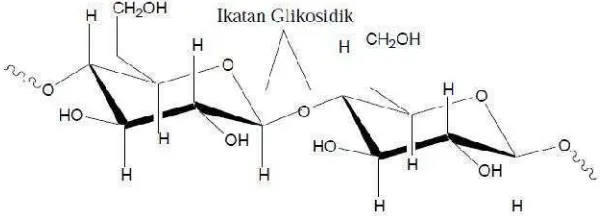
Selulosa adalah polimer glukosa yang membentuk rantai linier dan dihubungkan
oleh ikatan β-1,4-glikosidik. Struktur linier ini menyebabkan selulosa bersifat kristalin dan tidak mudah larut. Selulosa tidak mudah didegradasi secara kimia maupun mekanis. Umumnya selulosa di alam berasosiasi dengan polisakarida lain seperti hemiselulosa atau lignin membentuk kerangka utama dinding sel tumbuhan (Holtzapple, 1993).
Gambar 7.Struktur selulosa
Secara umum selulosa sulit dihidrolisis karena mempunyai tingkat sturktur kristal yang tinggi dan lapisan lignin yang menyelubungi jaringan selulosa merupakan suatu penghalang. Bagian selulosa yang mudah dihidrolisis adalah bagian amorf. Umumnya selulosa mengandung 15% bagian amorf dan 85% bagian kristalin (Tsaoet al., 1978).
E. Kinetika Reaksi Kimia
Parameter dalam kinetika reaksi enzim adalah konstanta Michaelis-Menten (KM)
dan laju reaksi maksimum (Vmaks). Kinetika enzim adalah salah satu cabang
enzimologi yang membahas faktor-faktor yang mempengaruhi kecepatan reaksi enzimatis. Salah satu faktor yang mempengaruhi aktivitas enzim adalah
konsentrasi substrat. Konsentrasi substrat ini dapat divariasikan untuk mempelajari mekanisme suatu reaksi enzim, yakni bagaimana tahap-tahap terjadinya pengikatan substrat oleh enzim maupun pelepasan produknya (Suhartono, 1989).
sedemikian kecilnya hingga mendekati garis maksimum, walaupun beberapa substrat ditambahkan. Pada kondisi ini, semua sisi aktif enzim telah terisi dengan substratnya dan tidak dapat lagi berfungsi lebih cepat (Lehninger, 1982).
Setiap enzim memiliki sifat dan karakteristik yang spesifik seperti yang ditunjukkan pada sifat spesifisitas interaksi enzim terhadap substrat yang
dinyatakan dengan nilai tetapan Michaelis-Menten (KM). Nilai KMdidefinisikan
sebagai konsentrasi substrat tertentu pada saat enzim mencapai kecepatan setengah kecepatan maksimum. Setiap enzim memiliki nilai Vmaksdan KMyang
khas dengan substrat spesifik pada suhu dan pH tertentu (Kameliaet al.,2005). Nilai KMyang kecil menunjukkan bahwa kompleks enzim-substrat sangat mantap
dengan afinitas tinggi terhadap substrat, sedangkan jika nilai KMsuatu enzim
besar maka enzim tersebut memiliki afinitas rendah terhadap substrat (Page, 1989).
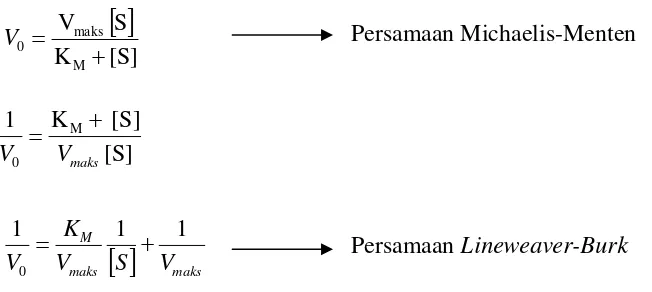
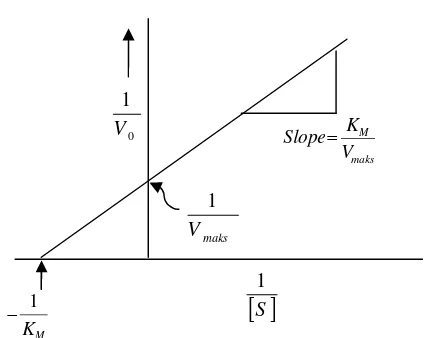
Nilai KMsuatu enzim dapat dihitung dengan menggunakan persamaan
Lineweaver-Burkyang diperoleh dari persamaan Michaelis-Menten yang kemudian dihasilkan suatu diagramLineweaver-Burkyang ditunjukkan dalam Gambar 8 ( Page, 1989).
Gambar 8. DiagramLineweaver-Burk(Suhartono, 1989)
F. Stabilitas Enzim
Stabilitas enzim adalah kestabilan aktivitas enzim selama penyimpanan dan penggunaan enzim tersebut, serta kestabilan terhadap berbagai senyawa yang bersifat merusak enzim seperti pelarut tertentu (asam atau basa) dan oleh pengaruh suhu dan pH yang ekstrim atau kondisi non fisiologis lainnya (Wiseman, 1985).
Terdapat dua cara yang dapat ditempuh untuk mendapatkan enzim yang
1. Stabilitas termal enzim
Pada suhu yang terlalu rendah kemantapan enzim tinggi, tetapi aktivitasnya rendah, sedangkan pada suhu yang terlalu tinggi aktivitas enzim tinggi, tetapi kemantapannya rendah. Kenaikan suhu enzim akan mempengaruhi kecepatan laju reaksi, namun hanya sampai batas tertentu dan dapat menyebabkan denaturasi protein. Daerah suhu saat kemantapan dan aktivitas enzim cukup besar disebut suhu optimum untuk enzim tersebut (Wirahadikusumah, 1997). Dalam industri, pada proses reaksinya biasanya menggunakan suhu yang tinggi. Penggunaan suhu yang tinggi bertujuan untuk mengurangi tingkat kontaminasi dan masalah-masalah viskositas serta meningkatkan laju reaksi. Namun, suhu yang tinggi ini merupakan masalah utama dalam stabilitas enzim, karena enzim umumnya tidak stabil pada suhu tinggi.
Proses inaktivasi enzim pada suhu tinggi berlangsung dalam dua tahap, yaitu: a. Adanya pembukaan partial (partial unfolding) struktur sekunder, tersier
dan atau kuartener molekul enzim.
b. Perubahan struktur primer enzim karena adanya kerusakan asam amino-asam amino tertentu oleh panas (Ahern and Klibanov, 1987).
Air memegang peranan penting pada kedua tahap di atas. Oleh karena itu, dengan menggunakan air seperti pada kondisi mikroakueus, reaksi inaktivasi oleh panas dapat diperlambat dan stabilitas termal enzim akan meningkat.
Stabilitas termal enzim akan jauh lebih tinggi dalam kondisi kering
konformasi suatu molekul enzim menjadi sangat fleksibel, sehingga bila air dihilangkan molekul enzim akan menjadi lebih kaku (Virdianingsih, 2002).
2. Stabilitas pH enzim
Stabilitas enzim dipengaruhi oleh banyak faktor seperti suhu, pH, pelarut, kofaktor dan kehadiran surfaktan (Eijsinket al.,2005). Dari faktor-faktor tersebut, pH memegang peranan penting. Diperkirakan perubahan keaktifan pH lingkungan disebabkan terjadinya perubahan ionisasi enzim, substrat atau kompleks enzim-substrat. Enzim menunjukkan aktivitas maksimum pada kisaran pH optimum enzim dengan stabilitas yang tinggi (Winarno, 1989).
Pada reaksi enzimatik, sebagian besar enzim akan kehilangan aktivitas katalitiknya secara cepat danirreversibelpada pH yang jauh dari rentang pH optimum untuk reaksi enzimatik. Inaktivasi ini terjadi karenaunfolding
molekul protein sebagai hasil dari perubahan kesetimbangan elektrostatik dan ikatan hidrogen (Kazanet al.,1997).
G. Isolasi dan Pemurnian Enzim
Enzim dapat diisolasi secara ekstraseluler dan intraseluler. Enzim ekstraseluler merupakan enzim yang bekerja di luar sel, sedangkan enzim intraseluler
merupakan enzim yang bekerja di dalam sel. Ekstraksi enzim ekstraseluler lebih mudah dibandingkan ekstraksi dari intraseluler, karena tidak memerlukan
1. Sentrifugasi
Sentrifugasi merupakan tahap awal pemurnian enzim. Metode ini digunakan untuk memisahkan enzim ekstraseluler dari sisa-sisa sel. Sentrifugasi akan menghasilkan supernatan yang jernih dan endapan yang terikat kuat pada dasar tabung, kemudian dipisahkan secara manual. Sel-sel mikroba biasanya mengalami sedimentasi pada kecepatan 5000 g selama 15 menit (Scopes, 1982; Walsh and Headon, 1994).
Prinsip sentrifugasi berdasarkan pada kenyataan bahwa setiap partikel yang berputar pada laju sudut yang konstan akan memperoleh gaya keluar (F).
Besar gaya ini bergantung pada laju sudut ω (radian/detik) dan radius
pertukarannya (sentimeter).
F = ω2r
Gaya F dipengaruhi oleh gaya gravitasi bumi, karena itu dinyatakan sebagai gaya sentrifugal relatif (RCF dengan satuan g (gravitasi)).
RCF =
980
2
r
ω
Dalam praktiknya, alat sentrifugasi dioperasikan dengan laju rpm. Oleh sebab itu, harga rpm dikonversikan kedalam bentuk radian menggunakan persamaan:
2. Fraksinasi garam ammonium sulfat
Fraksinasi merupakan proses pengendapan secara bertahap. Pengendapan ini dapat dilakukan dengan penambahan garam seperti natrium klorida, natrium sulfat atau ammonium sulfat. Pada umumnya garam yang sering digunakan adalah ammonium sulfat karena (1) kebanyakan enzim tahan terhadap garam ini, (2) memiliki kelarutan yang besar dalam air, (3) mempunyai daya
pengendapan besar, dan (4) mempunyai efek penstabil terhadap kebanyakan enzim. Konsentrasi garam dapat mempengaruhi kelarutan enzim
(Wirahadikusumah, 1997).
Menurut Suhartono (1989), penambahan senyawa elektrolit menurunkan kelarutan protein, karena kelarutannya dipengaruhi oleh kekuatan ion. Dengan meningkatnya kekuatan ion, kelarutan enzim akan semakin besar atau disebut dengan peristiwasalting in, setelah mencapai suatu titik tertentu kelarutannya akan semakin menurun atau disebut peristiwasalting out. Pada kekuatan ion rendah, protein akan terionisasi sehingga interaksi antar protein akan menurun dan kelarutan akan meningkat. Peningkatan kekuatan ion ini meningkatkan kadar air yang terikat pada ion, dan jika interaksi antar ion kuat, kelarutannya menurun akibatnya interaksi antar protein lebih kuat dan kelarutannya menurun (Agustien dan Munir, 1997).
3. Dialisis
molekul-molekul kecil seperti garam. Proses dialisis berlangsung karena adanya perbedaan konsentrasi zat terlarut di dalam dan di luar membran. Difusi zat terlarut bergantung pada suhu dan viskositas larutan. Meskipun suhu tinggi dapat meningkatkan laju difusi, namun sebagian besar protein dan enzim stabil pada suhu 4-8oC sehingga dialisis harus dilakukan di dalam ruang dingin (Pohl, 1990).
4. Kromatografi kolom
Kromatografi kolom merupakan metode yang banyak digunakan untuk isolasi dan pemurnian enzim. Pada kromatografi kolom suatu fluida dialirkan ke dalam kolom yang mengandung matriks bahan pengisi dan molekul yang ingin dipisahkan menjadi beberapa komponen dengan adanya perbedaan daya ikat terhadap bahan pengisi. Pada proses isolasi dan pemurnian enzim
dikenal tiga jenis kromatografi, yaitu kromatografi filtasi gel, kromatografi afinitas, dan kromatografi ion. Namun, dalam penelitian ini dilakukan pemurnian enzim selulase dengan mengunakan kromatografi filtrasi gel.
Kromatografi filtrasi gel digunakan untuk memisahkan protein yang
memasukinya sedangkan protein yang lebih besar tidak dapat memasukinya sehingga akan keluar terlebih dahulu.
Kromatogafi filtrasi gel merupakan teknik pemurnian yang kapasitasnya lemah. Namun, metode ini efektif dalam pemisahan enzim dari pelarut penggumpal, larutan garam dan buffer yang tidak dikehendaki. Kapasitas sampelnya cukup tinggi dan efesien filtrasi gel meningkat dengan semakin tingginya kolom (Suhartono, 1989).
H. Pengujian aktivitas selulase dengan metode Mandels
Pengujian aktivitas selulase dilakukan dengan metode Mandels (Mandelset al., 1976), yaitu berdasarkan pembentukan produk glukosa dimana karboksimetil selulosa sebagai substratnya. Semakin tinggi absorbansi sampel maka semakin baik aktivitas enzim tersebut.
I. Penentuan kadar protein dengan metode Lowry
Penentuan kadar protein bertujuan untuk mengetahui bahwa protein enzim masih terdapat pada tiap fraksi pemurnian (tidak hilang dalam proses pemurnian) dengan aktivitas yang tetap baik. Salah satu metode untuk menentukan kadar protein adalah metode Lowry. Metode ini bekerja pada kondisi alkali dan ion tembaga (II) akan membentuk kompleks dengan protein. Ketika reagenfolin-ciocalteau
Pada metode ini, pengujian kadar protein didasarkan pada pembentukan kompleks Cu2+dengan ikatan peptida yang akan tereduksi menjadi Cu+pada kondisi basa. Cu+dan rantai samping tirosin, triftofan, dan sistein akan bereaksi dengan reagen
folin-ciocalteau. Reagen bereaksi dengan menghasilkan produk tidak stabil yang tereduksi secara lambat menjadi molibdenum atautungesteen blue. Protein akan menghasilkan intensitas warna yang berbeda tergantung pada kandungan triftofan dan tirosinnya.
Metode ini relatif sederhana dan dapat diandalkan serta biayanya relatif murah. Namun, metode ini mempunyai kelemahan yaitu sensitif terhadap perubahan pH dan konsentrasi protein yang rendah. Untuk mengatasinya adalah dengan cara menggunakan volume sampel yang sangat kecil sehingga tidak mempengaruhi reaksi ( Lowryet al.,1951).
J. Senyawa Aditif
Senyawa aditif digolongkan menjadi beberapa kelompok yaitu substrat, senyawa hidrofilik, larutan garam dan gula, ion logam, anion, polianion, polilakton, protein dan polimernya, inhibitor, senyawa pengkelat, anti buih serta senyawa pereduksi dan antioksidan.
Golongan alkohol polihirat termasuk ke dalam senyawa hidrofilik. Senyawa hidrofilik akan menimbulkan hidrasi sehingga konformasi protein terjaga dari
antara molekul protein enzim sehingga diduga meningkatkan kestabilannya. Senyawa ini dapat bertindak sebagai penangkap atau pengikat radikal bebas sehingga mengurangi kemungkinan oksidasi terhadap enzim (Schwimmer, 1981).
K. Poliol (Alkohol Polihidrat)
Poliol dikenal juga sebagai gula alkohol, polihidrik alkohol, atau polialkohol adalah bentuk hidrogenasi dari karbohidrat, dimana gugus karbonil (aldehid atau keton, gula pereduksi) telah tereduksi menjadi gugus hidroksil primer atau
sekunder. Poliol biasanya digunakan untuk menggantikan sukrosa dalam makanan (Hartet al., 2003).
Semakin besar berat molekul poliol maka makin tinggi pengaruhnya terhadap stabilitas enzim. Pada penelitian akan dipelajari pengaruh penambahan gliserol dan sorbitol terhadap stabilitas enzim selulase dariBacillus subtilisITBCCB148. Gliserol ialah suatu trihidroksi alkohol yang terdiri atas 3 atom karbon. Jadi tiap atom karbon mempunyai gugus–OH. Satu molekul gliserol dapat mengikat satu, dua, tiga molekul asam lemak dalam bentuk ester, yang disebut monogliserida, digliserida dan trigliserida. Adapun rumus molekul gliserol dapat ditunjukkan pada Gambar 9.
Sifat fisik dari gliserol merupakan cairan tidak berwarna, tidak berbau, cairan kental dengan rasa yang manis, densitas 1,261 g.cm-3, titik lebur 18,2ºC, titik didih 290ºC. Gliserol juga digunakan sebagai penghalus pada krim cukur, sabun, dalam obat batuk dan sirup atau untuk pelembab (Hartet al., 2003).
Gliserol larut baik dalam air dan tidak larut dalam eter. Gliserol digunakan dalam industri farmasi dan kosmetika sebagai bahan dalam preparat yang dihasilkan. Di samping itu gliserol berguna bagi kita untuk sintesis lemak di dalam tubuh.
Gliserol yang diperoleh dari hasil penyabunan lemak atau minyak adalah suatu zat cair yang tidak berwarna dan mempunyai rasa yang agak manis, larut dalam air dan tidak larut dalam eter (Poedjiadi, 1994).
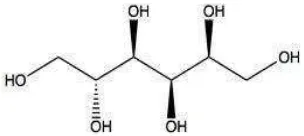
Sorbitol yang biasanya dikenal sebagai glusitol adalah gula alkohol yang metabolismenya lambat dalam tubuh. Sorbitol dihasilkan oleh reduksi glukosa dengan penggantian gugus aldehid dengan gugus hidroksil. Sorbitol digunakan dalam berbagai sirup obat batuk, sebagai pengganti gula dalam makanan diet dan permen karet bebas gula, dan sering digunakan dalam kosmetik modern sebagai penghilang noda. Sorbitol memiliki titik leleh 95ºC, titik didih 296ºC, massa molekul sebesar 182,17 g.mol-1, densitas sebesar 0,68 g.cm-3, dengan nama IUPAC heksana-1,2,3,4,5,6-heksaon (Hartet al., 2003). Struktur sorbitol dapat dilihat pada gambar 10.
A. Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan April-Juli 2012 di Laboratorium Biokimia Jurusan Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Lampung, Laboratorium Biologi Molekular Jurusan Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Lampung, dan Laboratorium Biomassa Terpadu Universitas Lampung.
B. Alat dan Bahan
Alat-alat yang digunakan penelitian ini antara lain alat-alat gelas, jarum ose, pembakar spirtus, autoklaf model S-90N,laminar air flowCURMA model 9005-FL, neraca analitik, shaker incubator,sentrifuga, lemari pendingin, mikropipet Eppendorff, waterbath,kolom kromatografi,freeze dry, dan spektrofotometer
UV-VISCarry Win UV 32.
Bahan-bahan yang akan digunakan adalah NA(Nutrien Agar),CMC
(Carboxymethyl Cellulose), pepton,ammonium sulfat, akuades, alkohol, Na2CO3,
NaOH, MgSO4, CaCl2, CuSO4.5H2O, KH2PO4,urea, FeSO4.7H2O, MnSO4.H20,
ZnSO4.7H2O, CoCl2, reagenfolin ciocelteau,Na(K) tartarat, NaCl, NaH2PO4,
gliserol, dan sorbitol. Bakteri penghasil enzim selulase pada penelitian ini adalah
Bacillus subtilisITBCCB148 yang diperoleh dari Laboratorium Mikrobiologi dan Teknologi Bioproses Jurusan Teknik Kimia, Institut Teknologi Bandung.
C. Prosedur Penelitian
1. Penentuan kondisi optimumBacillus subtilisITBCCB148 untuk memproduksi enzim selulase
a. Pembuatan media inokulum dan fermentasi
Media inokulum dan fermentasi yang digunakan terdiri dari (g.L-1) (NH4)2SO4,1,4; KH2PO4,2,0; Urea, 0,3; CaCl2,0,3; MgSO4,0,3;
FeSO4.7H2O, 0,005; ZnSO4.7H2O, 0,0014; CoCl2,0,002; CMC, 7,5;
pepton, 0,75; pH 5,5-6,0; kemudian disterilkan dalam autoklaf pada suhu 121ºC, tekanan 1 atm, selama 15 menit (Sternberg, 1976).
b. InokulasiBacillus subtilisITBCCB148
Sebanyak 5 oseBacillus subtilisITBCCB148 dari media agar miring dipindahkan ke dalam 100 mL media inokulum secara aseptis lalu dikocok dalamshaker incubator,dengan kecepatan 150 rpm pada suhu 35ºC selama 48 jam.
c. Penentuan pH optimum media fermentasi
fermentasi secara aseptis dan dikocok dalamshaker incubatordengan kecepatan 150 rpm pada suhu 35ºC. Lalu diuji aktivitas enzim selulase dengan metode Mandels pada interval waktu tertentu.
2. Produksi dan isolasi enzim selulase
a. Produksi enzim selulase
Produksi enzim selulase dilakukan pada kondisi optimum yang diperoleh pada tahap sebelumnya.
b. Isolasi enzim selulase
Setelah media fermentasi yang berisiBacillus subtilisITBCCB148 dikocok menggunakanshaker inkubatorpada suhu 35ºC selama waktu fermentasi optimum, selanjutnya dipisahkan enzim selulase dari komponen sel lainnya menggunakan sentrifuga dengan kecepatan putaran 5000 rpm, pada suhu 4ºC selama 25 menit. Filtrat yang diperoleh merupakan ekstrak kasar enzim selulase yang selanjutnya diuji aktivitasnya dengan metode Mandels dan diukur kadar protein dengan metode Lowry.
3. Pemekatan enzim selulase
Sebelum dipekatkan, ekstrak kasar enzim selulase hasil isolasi
telah beku selanjutnya dikeringbekukan menggunakanfreeze dryhingga volume enzim berkurang dan enzim semakin pekat yang ditandai dengan perubahan warna ekstrak kasar enzim dari tak berwarna menjadi kuning.
4. Pemurnian enzim selulase dengan kromatografi kolom filtrasi gel
Pada penelitian akan dilakukan pemurnian enzim dengan kromatografi kolom filtrasi gel menggunakan Sephadex G-100 sebagai matriks. Proses pengerjaannya sebagai berikut:
a. Pengembangan dan penstabilan gel
Sephadex G-100 disuspensikan dalam akuades dan dibiarkan mengembang pada suhu ruang selama 2 hari. Partikel halus dihilangkan dengan cara dekantasi. Gel yang telah mengembang sempurna disetimbangkan dengan buffer fosfat pH 6.
b. Penyiapan kolom gel
Kolom berukuran 1,5 x 50 cm dibubuhi kapas pada ujung bawah. Kolom dipasang tegak lurus, bubur gel yang telah mengembang selanjutnya dimasukkan ke dalam kolom dan diusahakan jangan sampai ada gelembung udara dalam kolom gel. Kran pengatur tetesan dibuka sedemikian sehingga kecepatan tetes 15-20 mL/jam.
c. Penempatan cuplikan ke dalam kolom
d. Penampungan eluen
Eluen ditampung dengan volume 5 mL. Fraksi pertama dimulai pada saat cuplikan enzim telah dimasukkan.
e. Pengukuran eluen
Setiap fraksi diukur kadar proteinnya dengan spektrofotometerUV-Vis
pada panjang gelombang 280 nm. Selanjutnya, absorbansi setiap fraksi diplotkan terhadap nomor fraksinya.
f. Pengukuran aktivitas enzim
Setiap fraksi pada puncak protein yang diperoleh dari pengukuran eluen ditentukan aktivitasnya. Semua fraksi yang menunjukkan aktivitas enzim dikumpulkan menjadi satu, kemudian ditentukan aktivitas unit dan aktivitas spesifiknya.
5. Uji aktivitas enzim selulase
a. Pembuatan pereaksi untuk pengujian aktivitas enzim selulase metode Mandels (Mandelset al.,1976)
Ke dalam labu ukur 100 mL, dimasukkan 1% NaOH, 1 mL Na(K) tartarat 40%, 1% DNS (dinitrosalisilic acid), 0,2% fenol dan 0,05% Na2SO3kemudian dilarutkan dengan 100 mL akuades hingga tanda
b. Pengujian aktivitas enzim selulase metode Mandels
Metode ini berdasarkan glukosa yang terbentuk (Mandelset al,1976). Sebanyak 0,25 mL enzim, 0,25 mL larutan CMC 0,5% dalam buffer fospat pH 5,0 dicampur lalu diinkubasi selama 60 menit pada suhu 50ºC. Kemudian ditambahkan 1 mL pereaksi DNS (dinitrosalisilic acid) dididihkan selama 10 menit pada penangas air dan didinginkan. Setelah dingin, campuran ditambahkan akuades sebanyak 1,5 mL dan diukur absorbansinya menggunakan spektrofotometerUV-Vispada panjang gelombang 510 nm. Kadar glukosa yang terbentuk ditentukan dengan menggunakan kurva standar glukosa.
6. Penentuan kadar protein enzim selulase
a. Pembuatan pereaksi untuk penentuan kadar protein enzim selulase metode Lowry
Pereaksi A : 2 gram Na2CO3dilarutkan dalam 100 mL
NaOH 0,1 N.
Pereaksi B : 5 mL larutan CuSO4.5H2O 1% ditambahkan
ke dalam 5 mL larutan Na(K) tartarat 1%. Pereaksi C : 2 mL pereaksi B ditambahkan 100 mL
pereaksi A.
Pereaksi D : reagenfolin ciocelteau diencerkan dengan akuades 1 : 1.
b. Penentuan kadar protein enzim selulase metode Lowry
Kadar protein enzim ditentukan dengan metode Lowry (Lowryet al., 1951). Penentuan kadar protein ini bertujuan untuk mengukur aktivitas spesifik dari protein enzim selulase. Sebanyak 1 mL enzim selulase direaksikan dengan 5 mL pereaksi C dan diaduk rata
kemudian dibiarkan selama 10 menit pada suhu ruang. Setelah itu ditambahkan dengan cepat 0,5 mL pereaksi D dan diaduk dengan sempurna, didiamkan selama 30 menit pada suhu kamar. Untuk kontrol, 1 mL enzim diganti dengan 1 mL akuades, selanjutnya perlakuannya sama seperti sampel. Serapannya diukur menggunakan spektrofotometerUV-Vispada panjang gelombang 750 nm. Untuk menentukan konsentrasi protein enzim yang digunakan kurva standar BSA (Bovine Serum Albumin).
7. Penambahan gliserol dan sorbitol
Larutan gliserol dan sorbitol dengan perbedaan konsentrasi 0,5 M; 1,0 M; dan 1,5 M masing-masing ditambahkan kepada enzim hasil pemurnian dengan perbandingan 1:1.
8. Karakterisasi enzim (sebelum dan setelah penambahan gliserol dan sorbitol)
Karakterisasi enzim sebelum dan setelah penambahan gliserol dan sorbitol meliputi: penentuan pH dan suhu optimum, penentuan data kinetika (KM
a. Penentuan pH dan suhu optimum 1) Penentuan pH optimum
Untuk mengetahui pH optimum enzim sebelum dan sesudah penambahan gliserol dan sorbitol digunakan buffer fosfat 0,05 M dengan variasi pH sebagai berikut: 5,0; 5,5; 6,0; 6,5; 7,0; 7,5; dan 8,0. Suhunya tetap dijaga pada 50ºC, kemudian dilanjutkan dengan pengujian aktivitas enzim dengan metode Mandels.
2) Penentuan suhu optimum
Untuk mengetahui suhu optimum kerja enzim dilakukan dengan variasi suhu yaitu 40; 45; 50; 55; 60; 65; dan 70ºC, pH tetap dijaga pada pH optimum. Selanjutnya diuji aktivitas enzim dengan metode Mandels.
b. Penentuan data kinetika enzim (nilai KMdan Vmaks)
Konstanta Michaelis-Menten (KM) dan laju reaksi maksimum (Vmaks)
enzim sebelum dan sesudah penambahan gliserol dan sorbitol ditentukan dari kurvaLineweaver-Burk. KurvaLineweaver-Burk
dibuat dengan menguji aktivitas enzim selulase dengan variasi
c. Uji stabilitas termal dan pH enzim (Yanget al.,1996)
Penentuan stabilitas termal dan pH enzim dilakukan dengan mengukur aktivitas sisa enzim setelah diinkubasi selama periode waktu 100 menit pada suhu 50ºC dan pH 5,5. Caranya adalah dengan mengukur aktivitas enzim setelah proses pemanasan setiap interval waktu 10 menit. Aktivitas awal enzim (tanpa proses pemanasan) diberi nilai 100%. perubahan energi akibat denaturasi (∆Gi)
Penentuan nilai ki(konstanta laju inaktivasi termal) enzim selulase
hasil pemurnian dan setelah penambahan gliserol dan sorbitol
dilakukan dengan menggunakan persamaan kinetika inaktivasi orde 1 (Kazanet al., 1997) dengan persamaan:
ln (Ei/E0) = - kit
Sedangkan untuk perubahan energi akibat denaturasi (∆Gi) enzim
hasil pemurnian dan hasil modifikasi kimia dilakukan dengan menggunakan persamaan (Kazanet al.,1997):
∆Gi= - RT ln (kih/kBT)
Keterangan :
ki = konstanta laju inaktivasi termal
h = konstanta Planck (6,63 x 10-34J det) kB = konstanta Boltzmann (1,381 x 10-23J K-1)
A. Simpulan
Berdasarkan hasil penelitian yang telah dilakukan, dapat disimpulkan bahwa: 1. Kondisi optimumBacillus subtilisITBCCB148 dalam memproduksi
enzim selulase adalah pada pH 6 dengan waktu inkubasi selama 72 jam. 2. Aktivitas spesifik fraksi Sephadex G-100 sebesar 4,6355 U/mg,
meningkat 4,93 kali dibanding ekstrak kasar dengan perolehan 12,60%. Enzim ini memiliki pH optimum 5,5 dan suhu optimum 50°C.
3. Fraksi Sephadex G-100 setelah penambahan poliol 0,5; 1,0; dan 1,5 M mempunyai pH dan suhu optimum yang sama dengan fraksi Sephadex G-100 tanpa poliol.
4. Fraksi Sephadex G-100 setelah penambahan poliol 0,5; 1,0; dan 1,5 M mengalami penurunan nilai KMdan Vmaksbila dibandingkan dengan
fraksi Sephadex G-100 tanpa poliol.
5. Hasil penentuan nilai ki, t1/2dan∆Gimenunjukkan bahwa terjadi
B. Saran
(Skripsi)
Oleh
SUNDARI RIAWATI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS LAMPUNG
PENDIDIKAN FORMAL (SD s.d S1)
PENGALAMAN ORGANISASI
PENGALAMAN KERJA PENGALAMAN PKL
Tahun 1995–2001 : SD Negeri 1 Leuwimalang Bogor Tahun 2001–2004 : SMP Negeri 1 Ciawi Bogor
Tahun 2004–2008 : Sekolah Menengah Analis Kimia Bogor (SMAKBo) Tahun 2008–sekarang : Jurusan Kimia FMIPA, Universitas Lampung
Periode 2008-2009 : Kader Muda HIMAKI FMIPA UNILA
Periode 2009-2010 : Anggota Bidang Sains dan Penalaran Ilmu Kimia HIMAKI FMIPA UNILA
Periode 2010-2011 : Sekretaris Umum HIMAKI FMIPA UNILA
Desember–Januari
2008 :
Melakukan analisis kimia dan mikrobiologi di PT. Cisarua Mountain Dairy Bogor
September–November
2011 :
Menentukan kondisi optimum pertumbuhanBacillus subtilisITBCCB148 dalam memproduksi enzim selulase di Laboratorium Biokimia FMIPA Unila
NAMA
: Sundari Riawati
Tempat, Tanggal Lahir : Bogor, 20 November 1988
Jenis Kelamin : Perempuan
Agama : Islam
Status Penikahan : Belum menikah Tinggi / Berat Badan : 156 cm/45 Kg Kewarganegaraan : Indonesia
Alamat Rumah : Komplek PT.RPB, LK.II, RT.009, Campang Raya, Tanjung Karang Timur, Bandar Lampung, Indonesia
No. HP : 085841063716
E-Mail : [email protected]
Maret - Juli 2008 : Staff quality control di PT. Hexpharm Jaya Cipanas Jawa Barat Juli - Desember 2011 : Asisten praktikum Biokimia I dan II Jurusan Kimia FMIPA Unila Januari–Juni 2012 : Asisten praktikum Kimia Dasar Jurusan Kimia FMIPA Unila Juli-Agustus 2012 : Asisten praktikum Biokimia Jurusan S1 Keperawatan Stikes
HOBI
PELATIHAN YANG PERNAH DIIKUTI ITBCCBI48
Membaca novel komedi
Sesungguhnya bersama kesulitan
ada kemudahan
(Q.S Al-Insyirah ; 6)
Maka ketika benih telah disebar, air telah disiram,
pupuk telah ditebar, berdoalah. Lalu apapun yang dihasilkan,
terimalah dengan ketulusan sebagai karunia Zat yang mengeluarkan
Bacillus subtilisITBCCB148
Nama Mahasiswa :Sundari Riawati
No. Pokok Mahasiswa : 0817011059
Jurusan : Kimia
Fakultas : Matematika dan Ilmu Pengetahuan Alam
MENYETUJUI
Ketua Jurusan Kimia Pembimbing
Andi Setiawan, Ph.D. Dr. Ir. Yandri A.S., M.S.
1. Tim Penguji
Ketua :Dr. Ir. Yandri A.S., M.S. ………
Penguji
Bukan Pembimbing :Dra. Aspita Laila, M.S. ………
Penguji
Bukan Pembimbing :Mulyono, Ph.D. ………
2. Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
Prof. Suharso, Ph.D. NIP.196905301995121001
Oleh
SUNDARI RIAWATI
Skripsi
Sebagai Salah Satu Syarat untuk Mencapai Gelar SARJANA SAINS
Pada Jurusan Kimia
Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Lampung
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS LAMPUNG
Kedua Orang tua ku,
Ibu yang menjadi motivator utamaku terimakasih atas doa dan kasih
sayang tulus yang kau berikan sehingga mampu menguatkan diri ini di
saat-saat sulit dan Bapak yang selalu menjaga dan memberikan nasihat
dan mengarahkanku menjadi lebih baik. Aku sadar skripsi ini bukanlah
apa-apa jika dibandingkan pengorbanan kalian untukku tapi izin kan aku
untuk membagi kebahgiaan ini bersama kalian.
Ketiga adikku:
Penulis dilahirkan di Bogor pada tanggal 20 November, sebagai anak pertama dari empat bersaudara, yang merupakan putri dari Bapak M. Khabib dan Ibu Iyus Rusmini.
Penulis menyelesaikan pendidikan Taman Kanak-Kanak di TK Al-Barokah Cisarua Bogor pada tahun 1995 dan Sekolah Dasar di SDN Leuwimalang pada tahun 2001. Sekolah Lanjutan Tingkat Pertama di SLTPN 1 Ciawi Bogor pada tahun 2004 dan Sekolah Menengah Analis Kimia Bogor (SMAKBo) pada tahun 2008. Pada tahun yang sama Penulis terdaftar sebagai Mahasiswa Jurusan Kimia FMIPA Unila melalui jalur SNMPTN (Seleksi Nasional Masuk Perguruan Tinggi Negeri).
Assalamualaikum Wr. Wb.
Alhamdulillah puji dan syukur penulis ucapkan kehadirat Allah S.W.T, serta sholawat dan salam selalu tercurah pada Nabi Muhammad S.A.W, atas segala rahmat dan karunia-Nya penulis dapat menyelesaikan skripsi ini dengan judul,
”Studi Pengaruh Penambahan Gliserol dan Sorbitol terhadap Stabilitas Enzim Selulase dari Bacillus subtilis ITBCCB148”. Pada kesempatan ini penulis menyampaikan terima kasih kepada:
1. Bapak Dr. Ir. Yandri A.S., M.S., selaku Pembimbing Penelitian dan Pembimbing Akademik yang telah banyak memberikan ilmu pengetahuan, gagasan, bimbingan, bantuan, dukungan, arahan, saran dan kritik kepada penulis dalam proses perencanaan dan pelaksanaan studi serta saat penelitian. 2. Ibu Dra. Aspita Laila, M.S., selaku Pembahas I atas kesediaan memberikan
arahan, koreksi, saran dan kritik.
3. Bapak Mulyono, Ph.D., selaku Pembahas II atas kesediaan memberikan arahan, koreksi, saran dan kritik.
4. Bapak Andi Setiawan, Ph.D., selaku Ketua Jurusan Kimia FMIPA Unila. 5. Bapak Prof. Suharso, Ph.D., selaku Dekan Fakultas Matematika dan Ilmu
7. Ibunda Iyus Rusmini dan Bapak M. Khabib tersayang, terimakasih selalu kudengar namaku kau sebut dalam doa-doamu, serta terimakasih juga atas perhatian, kasih sayang, nasihat, kepercayaan dan dukungan yang tiada henti-hentinya.
8. Adik-adikku Asti Dwi Rimawanti, Muhamad Ahsannul Irhamdi dan Ahmad Syahri Ramdhani yang selalu memberikan keceriaan, tawa dan canda di kala penat.
9. Sahabat yang selama empat tahun ini menjadi tempat berbagi suka dan duka serta tak jarang membuat marah, kesal, sedih, lalu kita tertawa bersama lagi menertawai kebodohan kita. Terimakasih banyak yaa Ani Sulistriani, Elianasari, Ni Putu Yuliastri, Retno Dwi Palupi, Miftasani, Harnita Yuniar dan Shoffa Nur Fauziah.
10. Sahabat dari SMAKBo, Fuguh Prastiyo, Nurul Ishofah, S.Si., Ahmad Zaki Zikrullah, dan Neli Rosnita Dewi. Terimakasih untuk semangat, bantuan, dan persahabatan yang begitu indah serta semakin mendewasa selama delapan tahun ini.
12. Tim penelitian di Laboratorium Biokimia, Putri Amalia, S.Si., Hade Sastra Wiyana, S.Si., Dwi Fitrian Saputro, Ni Putu Yuliastri, M. Ramdhan Nugraha, Adek Purnawati, M. Amin, dan Vivi Dwi Elianasari yang telah memberikan banyak bantuan baik motivasi, tenaga, dan kehangatan kekeluargaan.
13. Teman-teman Jurusan Kimia angkatan 2005, 2006, 2007, 2009, 2010, dan 2011.
14. Seluruh staff dan karyawan Jurusan Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Lampung.
15. Semua pihak yang tidak dapat disebutkan satu-persatu yang telah memberikan bantuannya, sehingga penulis dapat menyelesaikan skripsi ini dengan baik.
Semoga Allah SWT membalas semua kebaikan yang telah mereka berikan kepada penulis. Penulis menyadari bahwa skripsi ini masih jauh dari kesempurnaan, akan tetapi sedikit harapan semoga skripsi yang sederhana ini dapat berguna dan bermanfaat khususnya bagi rekan-rekan mahasiswa dan para pembaca umumnya. Aamiin.
Bandar Lampung, 2 Agustus 2012