Universitas Tanjungpura, Pontianak Hal. 330 - 338
ISOLASI, PEMURNIAN DAN KARAKTERISASI ENZIM SELULASE DARI Bacillus subtilis ITBCCB148
Yandri*, Putri Amalia, Tati Suhartati, dan Sutopo Hadi Jurusan Kimia FMIPA, Universitas Lampung,
Jalan Soemantri Brojonegoro No. 1, Bandar Lampung 35145
*E-mail: [email protected]
ABSTRACT
Cellulase enzyme from the bacteria Bacillus subtilis local ITBCCB148 have been isolated, and purified. Isolation of the enzyme was done using cold centrifuge to separate the enzyme from the cell mixture. The purification of enzyme was done by the use ammonium sulfate fractionation and dialysis. The purified enzyme was characterization include: the determination of the optimum temperature, optimum pH, substrate concentration and thermal stability. The cellulase enzyme activity was determined by the Mandels method and protein content was determined by Lorwy method. The results showed that the purified enzyme has specific activity of 16.2 U mg-1, this was an increase of 3.6 times than the raw enzyme extract. The temperature optimum of the purified enzyme was 55 ° C, the optimum pH was 6, the KM and V max values were 3.82 mg mL-1 substrate, and
204.08 mL mol-1 min-1. Thermal stability of the purified enzyme for 60 minutes at 55oC showed a half-life of 19.5 min.
Keywords: cellulase, Bacillus subtilis ITBCCB148
ABSTRAK
Enzim selulase dari bakteri lokal Bacillus subtilis ITBCCB148 telah berhasil diisolasi, dan dimurnikan. Isolasi enzim dilakukan menggunakan sentrifuga dingin untuk memisahkan enzim dari campuran sel. Pemurnian enzim dilakukan dengan fraksinasi menggunakan ammonium sulfat dan dialisis. Terhadap enzim selulase hasil pemurnian telah dilakukan karakterisasi meliputi: penentuan suhu optimum, pH optimum, konsentrasi substrat dan stabilitas termal. Aktivitas enzim selulase ditentukan dengan metode Mandels sedangkan penentuan kadar protein dengan metode Lorwy. Hasil penelitian menunjukkan bahwa aktivitas spesifik enzim hasil pemurnian 16,2 U/mg, meningkat 3,6 kali dibandingkan dengan ekstrak kasar enzim. Enzim hasil pemurnian memiliki suhu optimum 55oC, pH optimum 6, harga KM = 3,82 mg mL-1 substrat, dan harga Vmaks = 204,08 µmol mL-1 menit-1. Uji
stabilitas termal enzim hasil pemurnian selama 60 menit pada suhu 55oC menunjukkan waktu paruh sebesar 19,5 menit.
1. PENDAHULUAN
Seiring dengan perkembangan bioteknologi enzim telah banyak digunakan dalam industri pangan dan non pangan [1]. Enzim selulase adalah salah satu enzim yang banyak dimanfaatkan untuk mengolah limbah industri berselulosa menjadi glukosa [2], dan enzim ini banyak menarik minat dunia untuk memproduksi bioetanol, jika terjadi kekurangan bahan bakar minyak bumi [3], [4], [5]. Penggunaan enzim dalam industri menuntut persyaratan tertentu antara lain enzim harus stabil pada suhu tinggi dan tahan pH ekstrim [6]. Untuk mendapatkan enzim yang mempunyai stabilitas dan aktivitas yang tinggi pada kondisi ekstrim, dapat dilakukan isolasi langsung dari organisme yang ada di alam dan hidup pada kondisi tersebut (ekstrimofilik) atau dengan modifikasi kimia terhadap enzim yang berasal dari organisme yang hidup pada kondisi tidak ekstrim (mesofilik) [7]. Menurut Mozhaev dan Martinek 1984 modifikasi kimia merupakan metode yang dapat dipilih untuk mendapatkan enzim yang stabil [8].
Pada penelitian ini telah dilakukan karakterisasi pada enzim hasil pemurnian dengan variasi suhu, pH, substrat dan stabilitas termal untuk mengetahui suhu optimum, pH optimum, data kinetika dan stabilitas termalnya. Selanjutnya untuk meningkatkan kestabilan enzim akan dilakukan modifikasi kimia terhadap enzim selulase hasil pemurnian, sehingga enzim selulase hasil pemurnian dapat memenuhi persyaratan dalam dunia industri dan dapat dimanfaatkan.
2. BAHAN DAN METODE PENELITIAN 2.1 Bahan
Bahan-bahan yang digunakan dalam penelitian ini adalah yang mempunyai derajat proanalisis. Bacillus subtilis ITBCCB148 yang diperoleh dari Laboratorium Mikrobiologi dan Teknologi Bioproses Jurusan Teknik Kimia Institut Teknologi Bandung.
2.2 Alat
Alat-alat yang digunakan dalam penelitian ini adalah alat-alat gelas, mikropipet Eppendroff, autoklaf model S-90N, laminar air flow CRUMA model 9005-FL, sentrifuga WIFUG LABOR-50M, shaker watebath incubator GFL1092, Magnetic Stirrer STUART CB 161, incubator PRECISTERM, penangas PRECISTERM, waterbath incubator HAAKE dan spektrofotometer UV-VIS Cary Win UV 32.
Universitas Tanjungpura, Pontianak Hal. 330 - 338
2.3 Prosedur Penelitian
2.3.1 Pembuatan media inokulum dan fermentasi
Media inokulum dan fermentasi yang digunakan (gL-1) terdiri dari Urea 3; (NH4)2SO4 1,4;
KH2PO4 0,5; CaCl2 0,1; MgSO4 0,2; pepton 5; Yeast extract 5 dan CMC 5 dilarutkan dalam
buffer fosfat pH 6, 0,1M (Yandri et al., 2010). Media ini disterilisasi pada suhu 121oC, tekanan 1 atm, selama kurang lebih 15 menit dalam autoclave.
2.3.2 Produksi enzim selulase
Sebanyak 3 ose biakan Bacillus subtilis ITBCCB148 dari media agar miring diinokulasi dalam media inokulum secara aseptis, lalu dikocok dalam shaker watebath incubator dengan kecepatan 130 rpm pada suhu 40oC selama 24 jam. Selanjutnya media inokulum (5% dari volume media fermentasi) dipindahkan ke dalam media fermentasi dan dikocok dengan kecepatan 130 rpm pada suhu 400C selama 72 jam [9].
2.3.3 Isolasi enzim selulase
Biakan disentrifugasi pada 4500 rpm dan suhu 4oC selama 20 menit. Filtrat yang diperoleh merupakan ekstrak kasar enzim selulase.
2.3.4 Pemurnian enzim selulase
Pemurnian dilakukan dengan cara fraksinasi menggunakan garam ammonium sulfat pada derajat kejenuhan yaitu 0-90% dan didialisis selama 24 jam.
2.3.5 Uji aktivitas dan penentuan kadar protein enzim
Uji aktivitas selulase menggunakan pereaksi asam dinitrosalisilat[10]. Kadar protein enzim ditentukan dengan metode [11].
2.3.6 Penentuan suhu optimum
Penentuan suhu optimum enzim dilakukan dengan memvariasikan suhu yaitu 40, 45, 55, 60, 65, 70, 75 dan 80 oC.
2.3.7 Penentuan pH optimum
Penentuan pH optimum enzim dilakukan dengan memvariasikan pH yaitu 5; 5,5; 6; 6,5; 7; 7,5; 8; 8,5; 9.
2.3.8 Penentuan KM dan Vmaks
Nilai Michaelis-Menten (KM) dan laju reaksi maksimum (Vmaks) enzim dilakukan dengan
memvariasikan konsentrasi substrat (larutan pati) yaitu 0,25; 0,5; 0,75; 1,0; dan 1,25%.
2.3.9 Uji stabilitas termal enzim
Stabilitas termal enzim dilakukan dengan cara mengukur aktivitas sisa enzim setelah diinkubasi selama 0, 10, 20, 30, 40, 50, dan 60 menit.
2.3.10 Penentuan waktu paruh (t1/2), konstanta laju inaktivasi (ki), dan perubahan
energi akibat denaturasi (∆Gi)
Penentuan nilai ki (konstanta laju inaktivasi termal) enzim menggunakan persamaan
kinetika inaktivasi orde 1 [12] dengan persamaan: ln (Ei/E0) = - ki t
Untuk perubahan energi akibat denaturasi (∆Gi) enzim menggunakan persamaan:
∆Gi = - RT ln (ki h/kB T)
3. HASIL DAN PEMBAHASAN
3.1 Pemurnian Enzim Selulase
Skema pemurnian enzim selulase dari bakteri lokal Bacillus subtilis ITBCCB148 dapat dilihat pada Tabel 1.
Tabel 1. Skema pemurnian enzim selulase dari Bacillus subtilis ITBCCB148
Tahap Volume enzim (mL) Aktivitas unit (U/mL) Aktivitas Total (U) Kadar protein (mg/mL) Aktivitas spesifik (U/mg) Perolehan (%) Kemurnian (kali) Ekstrak kasar 870 0,907 789,09 0,2015 4,5 100 1 Fraksinasi ammonium sulfat hasil dialisis 103 2,7835 286,7 0,1719 16,2 36,33 3,6
Dari tabel diatas, dapat dilihat bahwa aktivitas unit ekstrak kasar enzim selulase sebesar 0,907 U/mL dengan kadar protein 0,2015 mg/mL. Enzim selulase fraksinasi ammonium sulfat hasil dialisis mempunyai aktivitas unit sebesar 2,7835 U/mL dengan kadar protein 0,1719 mg/mL. Enzim fraksinasi ammonium sulfat hasil dialisis mempunyai
Universitas Tanjungpura, Pontianak Hal. 330 - 338
dialisis. Pada Tabel 1 tidak ditampilkan data-data enzim hasil fraksinasi menggunakan ammonium sulfat karena ammonium sulfat menganggu pada penentuan aktivitas enzim berdasarkan terbentuknya gula pereduksi, yaitu metode Mandels yang menggunakan salah satu campuran reaksinya adalah NaOH, yang akan bereaksi dengan ammonium sulfat membentuk garam, sehingga aktivitas enzim tidak teramati.
3.2 Penentuan Suhu Optimum
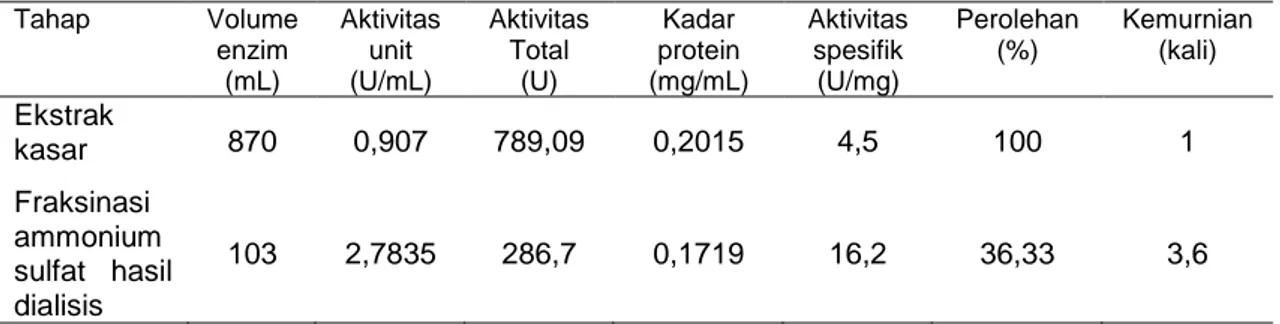
Pada Gambar 1 dapat dilihat bahwa suhu optimum enzim hasil pemurnian yaitu 55ºC. Terjadi penurunan aktivitas enzim hasil pemurnian yang tinggi terutama pada suhu di atas 60 0C dan enzim ini belum memenuhi syarat untuk digunakan dalam industri yang memerlukan enzim yang dapat bekerja pada suhu antara 60 – 125 0C [13]. Perlu dilakukan peningkatan kestabilan enzim terhadap suhu.
Gambar 1. Suhu optimum enzim hasil pemurnian
3.3 Penentuan pH Optimum
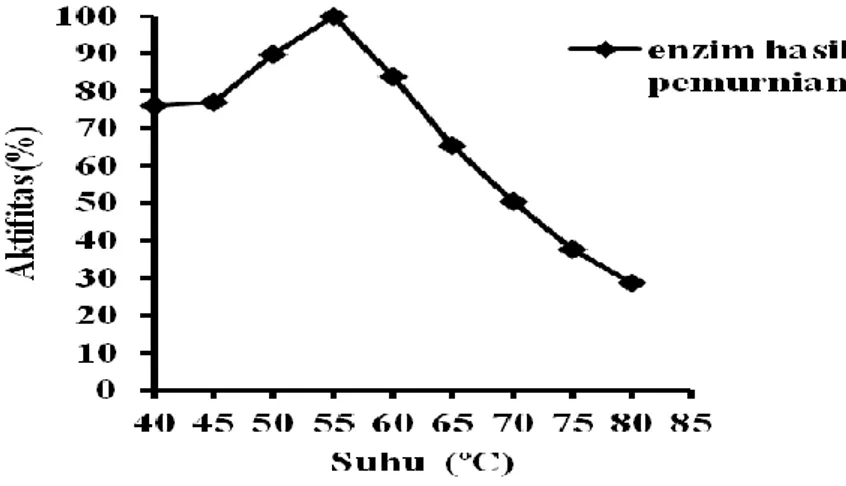
pH optimum enzim hasil pemurnian dapat dilihat pada Gambar 2 yaitu pada pH 6. Gambar 2 menunjukkan enzim hasil pemurnian cukup stabil pada pH asam dengan aktivitas sisa di atas 90% pada pH 5,0. Sedangkan pada pH basa enzim menunjukkan penurunan aktivitas sisa yang cukup besar yaitu pada pH 8,0 enzim mempunyai aktivitas sisa di bawah 60%. Perlu peningkatan rentang pH kerja enzim agar dapat digunakan dalam industry [13].
Gambar 2. pH optimum enzim hasil pemurnian
3.4 Penentuan KM dan Vmaks
Dari persamaan Lineweaver-Burk dapat ditentukan nilai Vmaks enzim hasil pemurnian
sebesar 204,08 μmol mL-1 menit-1 dan harga K
M sebesar 3,82 mg/mL substrat.
Gambar 3.Grafik Lineweaver-Burk enzim hasil pemurnian
3.5 Penentuan Stabilitas Termal Enzim
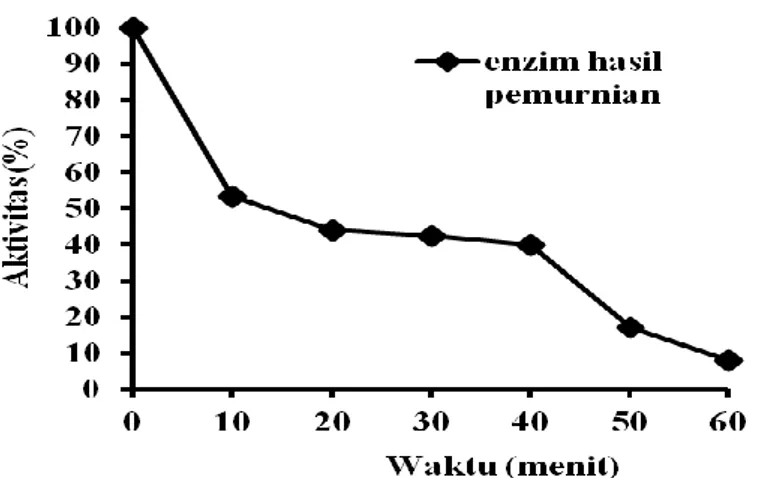
Pada Gambar 4 dapat dilihat bahwa enzim hasil pemurnian mempunyai aktivitas sisa (%) setelah diinkubasi pada suhu 55oC selama 60 menit yaitu 8,0707%. Gambar 4 menunjukkan terjadi penurunan aktivitas sisa enzim yang besar setelah penyimpanan selama 40 menit. Penurunan yang besar ini terjadi karena pusat aktif dan sisi aktif enzim tidak ada yang melindungi dan mudah mengalami perubahan konformasi, sehingga
Universitas Tanjungpura, Pontianak Hal. 330 - 338
Gambar 4. Enzim hasil pemurnian pada suhu 55ºC terhadap waktu
3.6 Waktu paruh (t1/2), Konstanta Inaktivasi Termal (ki), danPerubahan Energi
Akibat Denaturasi (ΔGi)
Konstanta laju inaktivasi termal (ki), waktu paruh (t1/2), dan perubahan energi akibat
denaturasi (ΔGi) enzim hasil pemurnian dapat dilihat pada Tabel 2.
Tabel 2. Perubahan konstanta laju inaktivasi (ki), waktu paruh (t1/2), dan energi akibat
denaturasi (ΔGi) enzim hasil pemurnian
Enzim ki (menit-1) t1/2 (menit ) ΔGi (kJ/mol) Enzim hasil pemurnian 0,0355 19,5 102,449
Data pada Tabel 2 menunjukkan waktu paruh (t1/2) enzim hasil pemurnian yaitu 19,5 menit
dengan nilai ki sebesar 0,0355 menit-1 dan energi akibat denaturasi (ΔGi) sebesar
102,449. Hasil ini menunjukkan enzim hasil pemurnian cukup stabil dengan memperlihatkan waktu paruh 19,5 menit [14]. Untuk penggunaan dalam industri perlu untuk meningkatkan waktu paruh enzim, yang dapat dilakukan dengan modifikasi kimia terhadap enzim hasil pemurnian.
4. KESIMPULAN DAN PROSPEK KESIMPULAN
Berdasarkan hasil penelitian yang telah dilakukan, maka dapat disimpulkan bahwa enzim hasil pemurnian mempunyai suhu optimum 55oC dan pH optimum 6. Nilai Vmaks = 204,08
μmol mL-1 menit-1 K
M = 3,82 mg/mL substrat dan uji stabilitas termal selama 60 menit pada
PROSPEK
Kestabilan enzim hasil pemurnian masih kurang mendukung untuk digunakan dalam industri. Untuk itu perlu dilakukan peninggkatan kestabilan enzim, dengan modifikasi kimia atau proses amobilisai
UCAPAN TERIMA KASIH
Pada kesempatan ini penulis menyampaikan terima kasih kepada Direktorat Jenderal Pendidikan Tinggi Kementrian Pendidikan dan Kebudayaan, atas dukungan dana dalam bentuk Penelitian Hibah Kompetensi dengan Nomor kontrak: 300/UN26/8/PL/2014 Tanggal 2 Juni 2014
DAFTAR PUSTAKA
[1] Maarel, M., Van der Veen, B., Uitdeehag, H., Lee, H.H. and Dijkhvizen, L. Properties and application of starch converting enzymes α- amylase familly. J. Biotechnol. 2002; 94. 137-155.
[2] Chalal, D. S. Growth characteristic of microorganism in solid state fermentation for upgrading of protein values of lignocelluloses and cellulose production. American Chemical Society. 1983; p. 205-310.
[3] Coughlan, M. Cellulose degradation by fungi. Microbiol Enzymes and Biotechnology. 1990; 1-36.
[4] Beguin, P. And Aubert, J.P. The biological degradation of cellulose. FEMS Microbiology Reviews. 1994; 13: 25-58.
[5] Zaldivar, J., Nielsen, J., and Olsson, L. Fuel ethanol production from lignocellulose: a challenge for metabolic engineering and process integration. Applied Microbiology and Biotechnology. 2001; 56: 17-34.
[6] Goddete, D.W., C. Terri, F.L Beth, L. Maria, R.M. Jonathan, P. Christian, B.R. Robert, S.Y. Shiow, and C.R. Wilson. Strategy and implementation of a system for protein engineering. J.Biotechnology. 1993; 28: p. 41 – 54.
[7] Wagen ES. Strategies for Increasing The Stability of Enzymes, in Enzyme Engineering. The New York Academy of Sciences, New York.1984; 7: 1-19.
[8] Mozhaev, V.V., K. Martinek. 1984. Structure Stability Relationship in Proteins: New Approaches to Stabilizing Enzymes. Enzym Microb. Technol., 6 : 50-59.
-Universitas Tanjungpura, Pontianak Hal. 330 - 338
[10] Mandels, M., A. Raymond, and R. Charles. Measurement of saccharifying cellulose. Biotech. & Bioeng. Symp, 6. John Wiley & Sons Inc. 1976.
[11] Lowry, O. H., Rosebrough N. J., Farr A. L., and Randall, R. J. Protein measurement with the folin phenol reagent. J. Biol. Chem. 1951; 193: p. 265-275.
[12] Kazan, D., H. Ertan, and A. Erarslan. Stabilization of Escherichia coli Penicillin G Acylase agains thermal Inactivation by cross-linking with dextran dialdehyde polymers. Applied. Microbiol Biotechnol,1997; 48: p. 191-197.
[13] Vieille, C. and J. G. Zeikus. Thermozymes: Identifying molecular determinant of protein structural and functional stability, Tibtech. 1996; 14 (6), 183-189.
[14] Stahl, S. Thermophilic microorganisms: The biological background for thermophily and thermoresistance of enzymes in Thermostability of Enzymes (Gupta, M.N. editor), Springer Verlag, New Delhi. 1999; 59-60.