ABSTRAK
ANALISIS VOLTAMMOGRAM SIKLIK SENYAWA KLORAMBUSIL PADA VARIASI SUHU MENGGUNAKAN PERANGKAT LUNAK
POLAR 4.2
Oleh
Harniyati SN
Telah dilakukan analisis voltammogram siklik senyawa klorambusil pada variasi suhu menggunakan perangkat lunak Polar 4.2 untuk mendapatkan nilai konstanta laju reaksi kimia majunya yang lebih teliti. Klorambusil merupakan zat pengalkil yang banyak digunakan dalam pengobatan kanker. Diketahuinya nilai konstanta laju reaksi kimia maju (kf) klorambusil, maka reaktifitas kimianya dapat ditentukan.
Metode penelitian yang digunakan adalah pembuatan voltammmogram siklik tiruan dengan cara simulasi menggunakan perangkat lunak Polar 4.2 pada beberapa variasi suhu (20oC, 25oC, 30oC, 40oC). Simulasi dilakukan dengan
I. PENDAHULUAN
A.Latar Belakang
Klorambusil adalah salah satu zat pengalkil yang banyak digunakan dalam pengobatan kanker dan merupakan suatu senyawa kimia reaktif, yang secara langsung atau tidak langsung memberikan suatu gugus alkilnya pada senyawa lain yang bersifat nukleofil dengan reaksi yang tidak spesifik (Wheeler, 1974; Remers, 1991). Dalam bidang kedokteran zat pengalkil digunakan dalam kemoterapi sebagai zat antikanker. Zat pengalkil adalah senyawa kimia reaktif yang dapat memberikan gugus alkilnya kepada senyawa lain yang bersifat nukleofil dengan reaksi yang tidak spesifik. Klorambusil termasuk dalam jenis obat yang
digolongkan sebagai zat pengalkil (Wheeler, 1974).
Daya antikanker zat pengalkil disebabkan oleh efek sitotoksik terhadap sel kanker, yaitu dengan terjadinya reaksi alkilasi basa DNA sel membentuk ikatan kovalen yang bersifat tak reversibel. Namun zat pengalkil ini tidak hanya bekerja pada sel kanker saja, tetapi juga dapat menyerang sel yang sehat atau bersifat karsinogen, oleh karena itu akan menimbulkan kanker sekunder pada sel DNA setelah proses penyembuhan (Wheeler, 1974; Lawley, 1994). Efek antikanker dan efek
pengalkil (Silverman, 1992). Dengan mengetahui nilai konstanta laju reaksi kimia maju (kf), maka reaktifitas kimia suatu zat pengalkil dapat ditentukan. Konstanta laju reaksi kimia maju (kf) dapat ditentukan dengan beberapa metode analisis kimia, salah satu diantaranya adalah analisis voltammetri siklik.
Zat pengalkil klorambusil telah ditentukan nilai konstanta laju reaksi kimia majunya (kf) pada berbagai variasi suhu (20oC, 25oC, 30oC, dan 40oC) berturut-turut yakni 3,639/s, 4,509/s, 5,108/s, dan 1,960/s dengan voltammetri siklik menggunakan metode Nicholson-Shain yang berdasarkan pada data nilai banding arus puncak katodik (ipc) dengan arus puncak anodik (ipa) (Apriani, 2008). Ada beberapa cara lain untuk menentukan nilai banding arus puncak katodik (ipc) dengan arus puncak anodik (ipa), yaitu dengan persamaan ipc/ipa terkoreksi dan teknik tumpang tindih serta simulasi (tiruan) teknik tak-tumpang tindih pada voltammogram siklik (Huang, 2000).
teknik tak-tumpang tindih pada voltammogram siklik menggunakan perangkat lunak Polar 4.2 dan Persamaan Nicholson-Shain.
B.Tujuan Penelitian
Tujuan dari penelitian ini adalah :
1. Menentukan nilai banding arus puncak katodik (ipc) dengan arus puncak anodik (ipa) dari senyawa klorambusil pada variasi suhu menggunakan metode
simulasi (tiruan) tak-tumpang tindih pada voltammogram siklik menggunakan perangkat lunak Polar 4.2.
2. Menghitung nilai konstanta laju reaksi kimia maju (kf) senyawa klorambusil dengan menggunakan perangkat lunak Polar 4.2 dan Persamaan Nicholson-Shain.
C.Manfaat Penelitian
II. TINJAUAN PUSTAKA
A.Klorambusil
Klorambusil adalah salah satu zat pengalkil yang paling banyak digunakan dalam pengobatan kanker dan merupakan zat pengalkil dwifungsi yakni zat yang
mempunyai lebih dari satu gugus fungsi aktif pada molekulnya dan merupakan turunan mustar nitrogen yang aktif melawan penyakit kanker pada manusia. Klorambusil (asam 4-[p-(bis[2-kloroetil]amino)fenil]butirat) merupakan bubuk kristal putih sedikit berbau dengan berat molekul 304,23. Memiliki titik lebur berkisar antara 64oC sampai 69oC. Klorambusil hampir tidak larut dalam air tetapi larut dalam alkali hidroksida encer, alkohol, aseton, dan kloroform. Klorambusil mengalami hidrolisis dengan adanya air. Laju hidrolisisnya
berlangsung paling cepat dan tidak tergantung pada pH pada daerah pH antara pH 4,5 dan 10 (Connors., et al, 1992).
Struktur molekul dari senyawa klorambusil ditunjukkan pada Gambar 1.
Zat pengalkil merupakan senyawa kimia yang telah lama dikenal untuk
kemoterapi dan dipakai sebagai antineoplastik. Zat antineoplastik adalah zat yang digunakan sebagai obat antikanker. Pada pemakaiannya zat pengalkil tersebar ke semua jaringan kecuali system syaraf pusat, zat ini bersifat toksis terhadap sumsum tulang, dan dapat menurunkan kekebalan serta bersifat karsinogenik dan mutagenik (Kauffman and Foye, 1996). Sebagai zat antineoplastik maka zat pengalkil sangat potensial mempunyai sifat sitotoksik yang menyebabkan mutagenik, karsinogenik, dan teratogenik. Reaksi alkilasi suatu nukleofil biasa berlangsung dalam dua tahap, yaitu pembentukan karbokation berlangsung lambat dan reaksi karbokation dengan nukleofil berlangsung cepat. Reaktifitas kimia karbokation berhubungan erat dengan konstanta laju reaksi kimianya (Fessenden and Fessenden, 1990).
Adapun beberapa syarat zat pengalkil yang dapat ditentukan nilai kf atau reaktifitas kimianya dengan metode voltammetri siklik adalah sebagai berikut : 1. Larut dan stabil dalam pelarut dengan elektrolit pendukungnya.
2. Memiliki jendela potensial pada waktu dielektrolisis.
3. Voltammogram sikliknya memberikan nilai ipc, ipa, potensial puncak katodik (Epc), dan potensial puncak anodic (Epa) dengan ipc/ipa tidak sama dengan satu pada laju selusur potensial yang lambat.
pada suatu atom dalam keadaan valensi rendah. Mekanisme kerja zat pengalkil terhadap DNA tergantung pada kestabilannya. Efek sitotoksik zat pengalkil yang disebabkan oleh subtituen gugus alkil pada atom N-7 guanin DNA mengalami tautan silang dengan zat pengalkil dwifungsi, yaitu mempunyai lebih dari satu gugus fungsi aktif pada molekulnya. Adanya alkilasi pada N-7 guanin DNA merupakan petunjuk adanya efek antikanker, sedangkan alkilasi pada O-6 guanin DNA menunjukkan efek karsinogen (Lawley, 1994).
Penggantian hidrogen pada suatu atom dengan gugus alkil disebut alkilasi. Alkilasi suatu asam nukleat atau protein akan melibatkan reaksi substitusi dimana atom nukleofilik (Nu) biopolymer mengganti gugus yang dipindahkan dari zat pengalkil. Reaksinya adalah sebagai berikt :
Nu–H + Alkil-Y Alkil-Nu + H+ + Y
-Laju reaksi bergantung pada nukleofilisitas atom yang bertambah besar jika nukleofil terionkan. Perbedaan laju tergantung pada protonasi dan konjugasi dengan gugus fungsional. Guanin adalah nukleofilik kuat pada N-7 DNA. Zat pengalkil yang sangat berpotensi mutagen menyerang DNA dengan membentuk kation reaktif yang tidak sangat stabil. Pada reaktifitas yang sangat tinggi hidrolisis dipercepat sebelum target DNA tercapai. Orde reaksi tergantung pada struktur dari zat pengalkil. Klorambusil termasuk senyawa mustar nitrogen yang relatif stabil pada pembentukan ion aziridinium, dikarenakan cincin aromatis mengurangi nukleofilisitas atom nitrogen (Wheeler, 1974).
pelaksanaan siklus intramolekuler untuk membentuk ion ethilleneimonium, secara langsung atau melalui pembentukan ion karbonium yang mentransfer kelompok alkil ke konstituen seluler. Situs penting alkilasi didalam basa DNA adalah posisi N-7 guanin, akan tetapi banyak basa lain yang juga dialkilasi, termasuk
N-1 dan N-3 adenin, N-3 sitosin, dan O-6 guanin, serta atom-atom fosfat dan protein yang terkait dengan DNA. Interaksi ini terjadi pada rantai tunggal atau pada kedua rantai DNA melalui rangkai-silang (cross-linking), dengan dua gugus reaktif (Katzung, 2001).
Reaksi alkilasi nukleofil basa DNA (Gambar 2) pada sel kanker biasanya berlangsung dalam dua tahap, yaitu pembentukan karbokation dari zat pengalkil yang berlangsung lambat, kemudian karbokation yang terbentuk bereaksi dengan basa DNA yang berlangsung cepat dengan kecepatan yang tergantung pada sifat susbtituen yang terdapat pada senyawa pengalkil. Substituen yang bersifat penarik elektron menghambat laju alkilasi. Reaktivitas karbokation dapat ditentukan dengan mengukur konstanta laju reaksi kimianya (Wheeler, 1974).
Mekanisme alkilasi guanine pada DNA disajikan pada Gambar 2.
Bis(kloroetil)amin membentuk ion ethilleneimonium dan ion karbonium yang bereaksi dengan basa guanin N-7 dalam DNA, yang menghasilkan purin
teralkilasi. Alkilasi residu guanin kedua menyebabkan rangka-silang rantai DNA (Katzung, 2001).
B.Voltammetri siklik
Voltametri merupakan salah satu metode elektroanalitik dengan prinsip dasar elektrolisis. Teknik voltammetri ini dapat digunakan untuk menganalisis senyawa kimia yang bersifat elektroaktif, mempelajari proses reduksi dan oksidasi
diberbagai medium, proses adsorbsi pada permukaan, dan mempelajari laju transfer elektron di permukaan elektroda. Hasil analisis dengan menggunakan teknik ini dapat diketahui dari voltammogram yang terbentuk. Voltametri terbagi atas beberapa jenis, diantaranya adalah polarografi, voltametri pulsa normal, voltametri pulsa diferensial, voltammetri gelombang persegi, dan voltammetri siklik (Wang, 2000).
Penentuan nilai kf dari senyawa klorambusil dapat dihitung menggunakan metode Nicholson-Shain, yang dikaji berdasarkan voltammogram siklik yang mengikuti mekanisme EC (reaksi elektrokimia (E) yang diikuti dengan reaksi kimia (C)). Mekanisme pada E menunjukkan proses transfer elektron yang berlangsung disekitar permukaan elektroda kerja. Dari E akan diperoleh perbandingan arus puncak anodik dengan katodik (ipc/ipa) yang digunakan untuk menghitung nilai kf klorambusil.
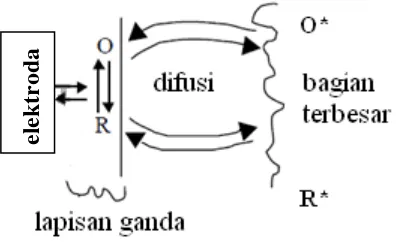
Gambar 3. Transfer elektron pada sistem elektrokimia (Bioanalytical, 2000).
Pada awal eksperimen larutan hanya mengandung bentuk R*, tidak ada perubahan dari bentuk reduksi R* ke bentuk oksidasi O* (Gambar 3). Ketika arus dialirkan ke larutan melalui elektroda acuan menyebabkan terjadinya reduksi. Bersamaan dengan terjadinya reduksi (R), suatu lapisan ganda terbentuk. Saat potensial reduksi tercapai, arus anodik naik secara eksponensial terhadap potensial. Saat R* berubah menjadi O*, terdapat konsentrasi R* dan O* disekitar elektroda kerja sehingga terjadi difusi yang akan menurunkan konsentrasi keduanya. Laju reduksi elektroda dibatasi oleh difusi sehingga arus akan turun. Pada puncak anodik, potensial redoks cukup positif, semua R yang mencapai permukaan elektroda teroksidasi menjadi O. Selusur arus sekarang tergantung kepada laju transfer massa ke permukaan elektroda. Pada titik reduksi dari R ke O, selusur
elektr
od
berbalik menghasilkan suatu arus katodik. Selusur arus terus turun sampai
potensialnya mendekati potensial redoks yang akhirnya menghasilkan arus puncak katodik (Paisley, 2000).
Potensial yang diberikan (antara elektroda kerja-elektroda acuan) dikendalikan oleh potensiostat yang menyebabkan arus mengalir diantara elektroda kerja dan elektroda bantu guna mempertahankan potensial yang dikehendaki. Eksperimen dimulai dengan memilih jendela potensial yang dibatasi oleh potensial awal dan potensial akhir. Zat elektroaktif mula-mula dioksidasi kemudian direduksi atau sebaliknya. Selusur potensial dengan laju konstan (v=dE/dt), dimulai dari potensial awal (Es) sepanjang jendela potensial sampai potensial akhir (Ef). Kemudian arah laju selusur potensial (v) kembali ke potensial awal (Gambar 4) (Rudolph et al., 1993)
Reaksi kimia yang diamati terjadi pada permukaan elektroda kerja. Arus listrik pada elektroda kerja yang dibangkitkan oleh transfer elektron disebut arus faraday. Sebuah elektroda bantu dipasang pada sirkuit potensiostatik untuk
menyeimbangkan proses faraday pada elektroda kerja untuk transfer elektron pada arah yang berlawanan (jika pada elektroda kerja terjadi reduksi, maka pada
elektroda bantu terjadi oksidasi). Arus faraday pada elektroda kerja mengalami perubahan pada keluaran potensial yang sensifitasnya dipilih, dinyatakan dalam ampere per volt dan direkam dalam bentuk analog atau digital (Heineman, 1984). Respon voltammeter siklik dinyatakan sebagai arus lawan potensial, yang disebut voltammogram siklik.
Proses-proses yang terjadi disekitar permukaan elektroda kerja meliputi reaksi elektrokimia, proses difusi, dan reaksi kimia. Reaksi elektrokimia atau proses transfer elektron adalah proses pemindahan elektron dari permukaan elektroda kerja ke zat elektroaktif atau sebaliknya. Perpindahan zat elektroaktif dari larutan induk ke permukaan elektroda dan sebaliknya disebut proses difusi, proses ini terjadi karena adanya perbedaan konsentrasi. Bila hasil proses elektrokimia menghasilkan suatu radikal ion yang reaktif terhadap pelarut maka reaksi kimia dapat terjadi (Gosser, 1993).
luas permukaan elektroda, dan konstanta laju reaksi kimia (Gosser, 1993; Rudolph
et al, 1994).
Saat analisis voltammetri siklik, senyawa pengalkil dalam larutan asetonitril mengalami reaksi elektro oksidasi membentuk suatu radikal karbokation. Hal ini dapat dilihat pada Gambar 5.
ks
Gambar 5. Reaksi elektrokimia zat pengalkil yang diikuti oleh reaksi kimia (ks = konstanta transfer elektron heterogen standar, kf = konstanta laju reaksi kimia maju, kb = konstanta laju reaksi kimia balik, v = laju selusur potensial) (Hardoko, 1999).
Reaksi elektrokimia zat pengalkil yang diikuti oleh reaksi kimia karbokation yang terbentuk akan diserang oleh nukleofil yang ada dalam larutan yaitu asetonitril dengan laju reaksi kimia maju (kf) tertentu dan saat selusur potensial dibalik dapat tereduksi kembali pada katoda yang ditunjukkan dengan adanya arus puncak katodik (ipc). Reaksi elektrokimia yang berlangsung pada permukaan elektroda diikuti dengan reaksi kimia.
yang besarnya dipengaruhi oleh subtituen yang terdapat pada zat pengalkil. Satu-satunya metode yang dapat digunakan untuk teknik pengkajian kompetitif ini adalah voltammetri siklik.
C.Metode Polar 4.2
Polar berasal dari kata polarography yang merupakan salah satu perangkat lunak elektrokimia. Secara analitik dan digital, program ini mensimulasikan
voltammogram dari beberapa mekanisme transfer elektron secara virtual pada beberapa bentuk geometri elektroda (planar, spiral, semispiral, cylindris,
microdisc, thin film dan rotating electrodes) dalam beberapa teknik (linear sweep and cyclic voltammetry, direct current, normal pulse, differential pulse,and square wave).
Berikut adalah cara kerja Program Polar 4.2 :
1. Diaktifkan program Simulasi Digital Polar 4.2 pada komputer, dipilih menu
Help, dipilih submenu Logon, dimasukkan Pasword dan diklik Ok, ditampilkan pada Gambar 6.
2. Dipilih menu Input, dipilih submenu Technique, pilih No.1 Linear Sweepand Cyclic Voltammetry, lalu diklik Ok ( Gambar 7).
3. Kembali ke menu Input, lalu dipilih submenu Mechanism, diklik Digital Simulation, tulis Fe2+ pada kolom Chemical Reaction, dipilih Ok (Gambar 8). 4. Kembali ke menu Input, lalu dipilih submenu Instrument, diisikan kondisi
eksperimennya. Pengisian data pada submenu ini disesuaikan dengan data pada voltammogram siklik eksperimen yang telah diperoleh. Kemudian dipilih
Ok (Gambar 9).
5. Kembali ke menu Input, lalu dipilih submenu Chemicals, diisikan data dalam submenu yang sesuai dengan kondisi eksperimennya. Nilai parameter ks, α, E0
, D, dan kf diisi dengan merubah nilai-nilainya (Gambar 10).
6. Setelah data pada submenu Instrument dan Chemicals diisi, kemudian dipilih menu Run lalu klik submenu Simulate. Voltammogram siklik yang dihasilkan pada laju selusur potensial (v) harus sesuai dengan data voltammogram siklik eksperimen (Gambar 11).
7. Jika voltammogramnya terbalik, dipilih menu Analysis, dipilih submenu Y Data, dan dipilih –Y (Gambar 12).
8. Dipilih menu Analysis, dipilih submenu Find Peak, diperoleh data nilai ipa, ipc, Epa, Epc dan ΔEp dari voltammogram siklik (Gambar 14).
Simulasi dilakukan berulang-ulang hingga diperoleh nilai ipa, ipc, Epa, Epc dan ΔEp sama atau mendekati dengan eksperimen (acuan). Selanjutnya dilakukan simulasi pada laju selusur potensial yang lain. Bila didapat keadaan
pertamakali : nilai ipa simulasi > nilai ipa acuan dan nilai ipc simulasi > nilai ipc acuan, maka nilai kf diatur naik atau apabila nilai ipa simulasi < nilai ipa acuan dan nilai ipc simulasi < nilai ipc acuan, maka nilai kf diatur turun.
D.Metode Nicholson-Shain
Untuk mekanisme reaksi elektrokimia yang reversibel (Er) dan reaksi kimia yang reversibel (Cr) atau tak-reversibel (Ci) dapat ditentukan dengan melihat hubungan perbandingan arus puncak katodik dengan arus puncak anodik pada perubahan laju selusur potensial yang merupakan hasil perhitungan kf dari senyawa zat pengalkil yang diperbandingkan nilai ipc dan ipa nya (Nicholson-Shain, 1965). Persamaan Nicholson-Shain diperoleh dari data pembuatan kurva kerja :
ipc/ipa = 0,506 − 0,433 log kft
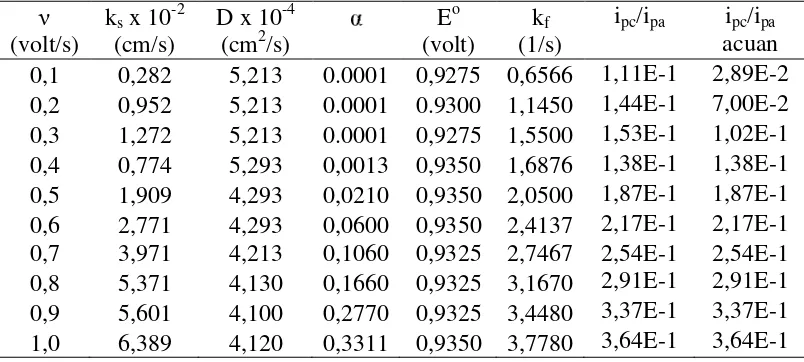
Pada penelitian Apriani (2008) data nilai kf klorambusil berdasarkan kurva kft terhadap t pada suhu yang di variasi disajikan pada Tabel 1.
Tabel 1. Data nilai kf klorambusil berdasarkan kurva kft lawan t pada variasi suhu (20oC, 25oC, 30oC, dan 40oC).
Suhu (oC) kf
20 3,639
25 4,509
30 5,108
40 1,960
III.METODOLOGI PENELITIAN
A. Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan Juli - September 2010, bertempat di Laboratorium Kimia Analitik Jurusan Kimia Fakultas MIPA Universitas Lampung.
B. Alat dan Bahan
Alat-alat yang digunakan dalam penelitian ini adalah seperangkat komputer yang dilengkapi dengan program Polar 4.2 beserta alat printer.
C. Prosedur Penelitian
1. Penentuan nilai banding ipc dengan ipa dari senyawa klorambusil menggunakan Perangkat lunak Polar 4.2.
1. Diaktifkan program Simulasi Digital Polar 4.2 pada komputer, dipilih menu
Help, dipilih submenu Logon, dimasukkan Pasword dan klik Ok, ditampilkan pada Gambar 6.
Gambar 6. Tampilan Program Polar 4.2
2. Dipilih menu Input, dipilih submenu Technique, pilih No.1 Linear Sweep and Cyclic Voltammetry, lalu klik Ok (Gambar 7).
3. Kembali ke menu Input, lalu dipilih submenu Mechanism, klik Digital Simulation, tulis RCl pada kolom Chemical Reaction, dipilih Ok (Gambar 8).
Gambar 8. Tampilan submenu Mechanism Program Polar 4.2 4. Kembali ke menu Input, lalu dipilih submenu Instrument, diisikan kondisi
eksperimennya. Pengisian data pada submenu ini disesuaikan dengan data pada voltammogram siklik eksperimen yang telah diperoleh. Kemudian dipilih
Ok (Gambar 9).
5. Kembali ke menu Input, lalu dipilih submenu Chemicals, diisikan data dalam submenu yang sesuai dengan kondisi eksperimennya. Nilai parameter ks, α, Eo, D, dan kf diisi dengan merubah nilai-nilainya (Gambar 10).
Gambar 10. Tampilan submenu Chemicals Program Polar 4.2 6. Setelah data pada submenu Instrument dan Chemicals diisi, kemudian
dipilih menu Run lalu klik submenu Simulate (Gambar 11).
7. Jika voltammogramnya terbalik, dipilih menu Analysis, dipilih submenu Y Data, dan dipilih –Y (Gambar 12).
Gambar 12. Tampilan submenu Y Data Program Polar 4.2
Selanjutnya dipilih menu Display, dipilih submenu Option, tanda Check
pada X Direction dihilangkan dengan memilihnya, dan klik Ok (Gambar 22).
8. Dipilih menu Analysis, dipilih submenu Find Peak, diperoleh data nilai ipa, ipc, Epa, Epc dan ΔEp dari voltammogram siklik (Gambar 14).
Gambar 14. Tampilan submenu Find Peak Program Polar 4.2 Voltammogram siklik yang dihasilkan pada laju selusur potensial (ν) harus sesuai dengan data voltammogram siklik eksperimen. Simulasi dilakukan berulang-ulang hingga diperoleh nilai ipa, ipc, Epa, dan Epc sama atau mendekati dengan eksperimen (acuan). Selanjutnya dilakukan simulasi pada laju selusur potensial yang lain. Bila didapat keadaan pertamakali : nilai ipa simulasi > nilai ipa acuan dan nilai ipc simulasi > nilai ipc acuan, maka nilai kf diatur naik atau apabila nilai ipa simulasi < nilai ipa acuan dan nilai ipc simulasi < nilai ipc acuan, maka nilai kf diatur turun.
2. Penentuan nilai konstanta laju reaksi kimia maju (kf) senyawa klorambusil menggunakan metode Nicholson-Shain.
2. Dihitung nilai potensial elektroda acuan (Eo) senyawa klorambusil. Eo=(Epc+Epa)/2.
3. Dihitung waktu reaksi (t) pada tiap perubahan nilai laju selusur potensial (ν) senyawa klorambusil.
t = (Ef – Eo)/ν.
4. Diintrapolasikan nilai banding ipc dengan ipa terkoreksi dengan tiap perubahan nilai laju selusur potensial (ν) pada kurva kerja sehingga diperoleh nilai kft pada tiap perubahan nilai laju selusur potensial (ν). ipc/ipa = 0,506 – 0,433 log kft. Berikut ini adalah kurva kerja untuk perbandingan arus puncak katodik dengan arus puncak anodik sebagai fungsi log kft.
Gambar 15. Kurva perbandingan arus puncak katodik (ipc) dengan arus puncak anodik (ipa) untuk transfer elektron reversibel yang diikuti dengan reaksi kimia (ErCi).
IV. HASIL DAN PEMBAHASAN
A.Analisis Voltammogram Siklik Senyawa Klorambusil
1. Pembuatan voltammogram siklik senyawa klorambusil menggunakan perangkat lunak Polar 4.2
Voltammogram siklik senyawa klorambusil dibuat berdasarkan data eksperimen yang berupa file data yang divariasikan suhu (Apriyani, 2008) dengan kondisi konsentrasi 5mM, diameter permukaan elektroda kerja 1 mm, jendela potensial 0,5 – 1,5 V, laju selusur potensial (ν) 0,1 – 1,0 volts/s, elektroda kerja Pt, konsentrasi elektrolit 0,1 M dengan pelarut asetonitril.
16 dan 17. Sedangkan bentuk voltammogram siklik pada berbagai laju selusur potensial (ν) dan suhu yang divariasi disajikan pada Lampiran 2.
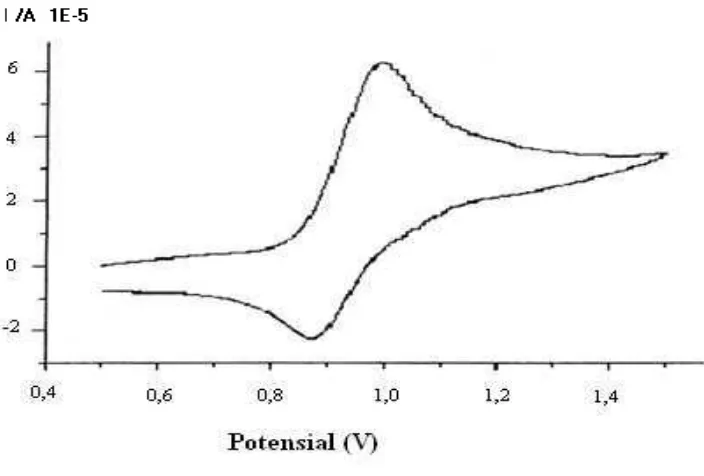
Gambar 16. Voltammogram siklik tiruan hasil simulasi pada laju selusur potensial (ν) 1,0 volts/s (20oC)
Gambar 17. Voltammogram siklik klorambusil acuan pada laju selusur potensial (ν) 1,0 volts/s (20o
2. Penentuan nilai banding arus puncak katodik (ipc) dengan arus puncak anodik (ipa) senyawa klorambusil menggunakan perangkat lunak Polar 4.2
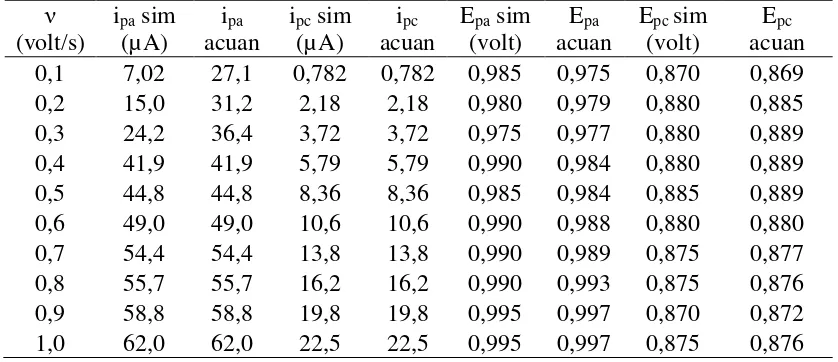
Metode perangkat lunak Polar 4.2 dapat digunakan sebagai metode simulasi untuk pembuatan voltammogram siklik. Simulasi dilakukan berulang-ulang hingga diperoleh nilai ipa, ipc, Epa, dan Epc sama atau mendekati dengan eksperimen (acuan). Hasil simulasi voltammogram siklik senyawa klorambusil ditunjukkan dalam berbagai nilai parameter ks, D, , Eo, kf, ipc/ipa yang disajikan pada
Tabel 2-5. Sedangkan nilai Epc, ipc, Epa, dan ipc hasil simulasi yang dibandingkan dengan acuan disajikan pada Tabel 6-9.
Tabel 3. Parameter hasil simulasi voltammogram siklik terhadap nilai ks, D, , Eo,
Tabel 5. Parameter hasil simulasi voltammogram siklik terhadap nilai ks, D, , Eo,
Tabel 6. Parameter hasil simulasi Voltammogram siklik terhadap nilai ipc, ipa, Epa, dan Epc dengan variasi ν pada voltammogram siklik klorambusil
Tabel 7. Parameter hasil simulasi Voltammogram siklik terhadap nilai ipc, ipa, Epa, dan Epc dengan variasi ν pada voltammogram siklik klorambusil
eksperimen dan simulasi Polar 4.2 (25oC; 5 mM; 1 mm).
Tabel 8. Parameter hasil simulasi Voltammogram siklik terhadap nilai ipc, ipa, Epa, dan Epc dengan variasi ν pada voltammogram siklik klorambusil
Tabel 9. Parameter hasil simulasi Voltammogram siklik terhadap nilai ipc, ipa, Epa, dan Epc dengan variasi ν pada voltammogram siklik klorambusil
eksperimen dan simulasi Polar 4.2 (40oC; 5 mM; 1 mm).
3. Penentuan Konstanta laju reaksi kimia Maju (kf) Senyawa Klorambusil
1. Penentuan konstanta laju reaksi kimia maju (kf) berdasarkan hasil simulasi Perangkat Lunak Polar 4.2
Gambar 20. Kurva kf terhadap ν (30o
C; 5 mM; 1 mm).
Tabel 10. Data nilai kf klorambusil pada ν = 1,0 volts/s yang divariasi suhu 20o C; 25oC; 30oC; 40oC berdasarkan hasil simulasi program Polar 4.2
Suhu (oC) kf
20 3,807
25 4,060
30 4,066
40 ―
2. Penentuan konstanta laju reaksi kimia maju (kf) berdasarkan Persamaan Nicholson-Shain
Nilai ipc/ipa yang diperoleh dari hasil simulasi dengan acuan voltammogram siklik eksperimen menggunakan perangkat lunak Polar 4.2 selanjutnya digunakan untuk menentukan konstanta laju reaksi kimia maju (kf) senyawa klorambusil. Nilai ipc/ipa tersebut disajikan pada Tabel 8−10.
Tabel 13. Hasil perhitungan nilai ipc/ipa, Eo, t, dan kft senyawa klorambusil pada
Tabel 14. Data nilai kf berdasarkan persamaan Nicholson-Shain pada suhu 20oC; 25oC; 30oC; 40oC.
Suhu (oC) kf
20 5,821
25 7,855
30 7,287
40 ―
B.Pembahasan
Senyawa klorambusil merupakan salah satu zat pengalkil turunan mustar nitrogen, yang daya kerjanya dipengaruhi oleh reaktifitas kimianya. Reaktifitas kimia suatu zat pengalkil dipengaruhi oleh nilai konstanta laju reaksi kimia majunya (kf). Nilai konstanta laju reaksi kimia maju dapat ditentukan jika nilai perbandingan arus puncak katodik dengan arus puncak anodik (ipc/ipa) diketahui. Nilai ipc/ipa yang teliti dapat ditentukan dengan metode simulasi menggunakan perangkat lunak Polar 4.2.
dapat dibedakan pada berbagai laju selusur potensial karena adanya kompetisi antara reaksi kimia susulan dan laju selusur potensial. Sehingga dari perbedaan tersebut dihasilkan nilai perbandingan ipc/ipa yang meningkat pada laju selusur potensial yang tinggi.
Upaya simulasi menggunakan perangkat lunak Polar 4.2 dilakukan dengan mengatur nilai parameter (ks, D, , Eo, dan kf) tahap demi tahap. Sebagai acuan dipakai voltammogram siklik eksperimen dengan zat yang konsentrasinya
diketahui dan laju selusur potensial tertentu, yang menghasilkan parameter ipa, ipc, Epa, Epc dan Eo pada jendela potensial awal dan potensial akhir eksperimen. Simulasi ini dilakukan tahap demi tahap hingga diperoleh nilai banding ipc/ipa seperti yang disajikan pada Tabel 15−17.Sedangkan nilai kf yang tertera pada data masukan parameter simulasi merupakan nilai kf untuk perangkat lunak Polar 4.2 (Lampiran 1).
Tabel 15. Nilai ipc/ipa menggunakan perangkat lunak Polar 4.2 (20oC) v
(volt/s)
ipc/ipa
0,4 1,38E-1
0,5 1,87E-1
0,6 2,17E-1
0,7 2,54E-1
0,8 2,91E-1
0,9 3,37E-1
Tabel 16. Nilai ipc/ipa menggunakan perangkat lunak Polar 4.2 (25oC)
Tabel 17. Nilai ipc/ipa menggunakan perangkat lunak Polar 4.2 (30oC) v
Adapun beberapa nilai parameter pada metode simulasi menggunakan perangkat lunak Polar 4.2 yang mempengaruhi bentuk voltammogram siklik senyawa klorambusil yaitu :
keterangan i : arus puncak (µA)
n : jumlah elektron yang ditransfer
ks : konstanta transfer elektron heterogen standar : koefisien transfer elektron reduksi
A : luas area elektroda
2. Eo (potensial elektroda standar), mempengaruhi nilai Epa dan Epc. Nilai Eo merupakan hasil dari penjumlahan nilai Epa dan Epc eksperimen yang kemudian dimasukkan ke program dan diubah agar Epa dan Epc sesuai. Nilai Epa dan Epc dapat berubah jika ks dinaikkan/diturunkan, dan dapat disesuaikan kembali dengan mengubah nilai .
3. (koefisien transfer elektron reduksi), mempengaruhi nilai ipc dan ipa. Juga dapat mempengaruhi nilai Epa dan Epc, semakin tinggi nilai maka nilai ipa dan ipc akan meningkat dan sebaliknya. Ini sesuai dengan persamaan Randles-Sevcik, dimana nilai berbanding lurus dengan arus puncaknya.
⁄ ⁄ ⁄
keterangan ip : arus puncak (µA)
n : jumlah elektron yang ditransfer : koefisien transfer elektron reduksi A : luas area elektroda (cm2)
C : Konsentrasi (mM) (Wang, 2000).
5. D (koefisien difusi zat), parameter nilai D dibuat konstan yaitu sebesar 10-4. Nilai D ketika dinaikkan akan meningkatkan nilai ipa. Jadi nilai parameter dijaga tetap untuk tiap laju selusur potensialnya. Hal ini dilakukan agar dapat diketahui pengaruh suhu terhadap nilai arus puncak baik pada proses oksidasi maupun reduksi, ini sesuai dengan persamaan Randles-Sevcik :
⁄ ⁄ ⁄ ⁄
keterangan ip : arus puncak (µA)
n : jumlah elektron yang ditransfer D : koefisien difusi zat
ν : laju selusur potensial A : luas area elektroda
Voltammogram siklik hasil simulasi yang dihasilkan berbentuk landaian yang terdiri dari puncak anodik dan puncak katodik. Pada puncak anodik terjadi proses oksidasi sedangkan puncak katodik terjadi proses reduksi, sehingga dua puncak yang dihasilkan saling berlawanan. Puncak oksidasi menunjukkan terjadinya proses oksidasi senyawa klorambusil membentuk senyawa karbokation, sedangkan puncak reduksi menunjukkan bahwa senyawa karbokation tersebut tereduksi kembali menjadi senyawa klorambusil. Tetapi tidak semua senyawa karbokation hasil oksidasi senyawa klorambusil tereduksi seluruhnya, karena ada yang bereaksi dengan senyawa nukleofil. Pada voltammogram siklik ini
dihasilkan beberapa nilai parameter salah satunya adalah nilai kf yang selanjutnya dapat digunakan untuk menentukan nilai konstanta laju reaksi kimia maju
Saat dilakukan analisis voltammogram siklik senyawa klorambusil dalam larutan asetonitril mengalami reaksi elektro oksidasi membentuk suatu radikal
karbokation. Hal ini sesuai yang dimodelkan pada Gambar 5.
Reaksi elektrokimia zat pengalkil yang diikuti oleh reaksi kimia karbokation yang terbentuk akan diserang oleh nukleofil yang ada dalam larutan yaitu asetonitril dengan laju reaksi kimia maju (kf) tertentu dan saat selusur potensial dibalik dapat tereduksi kembali pada katoda yang ditunjukkan dengan adanya arus puncak katodik (ipc). Reaksi elektrokimia yang berlangsung pada permukaan elektroda diikuti dengan reaksi kimia.
Menurut Gosser, karakteristik reaksi elektrokimia terlihat dari nilai konstanta transfer elektron heterogen standar (ks), sedangkan karakteristik reaksi kimia terlihat dari nilai konstanta laju reaksi kimia maju (kf) dan konstanta laju reaksi kimia balik (kb).
taraf nyata α = 0,05 tidak terdapat perbedaan nilai kf yang signifikan dari senyawa klorambusil pada suhu yang divariasi (Lampiran 3). Sedangkan dari hasil uji Sbt (selisih berarti terkecil) diperoleh nilai hitung sebesar 1,4338 dan selisih nilai kf (kf2 – kf1), (kf3 – kf1), (kf3 – kf2) berturut-turut adalah 0,253; 0,259; 0,006. Karena selisih nilai kf (Δkf) lebih kecil dari nilai hitung, maka uji Sbt diterima. Artinya pada taraf nyata α = 0,05 tidak terdapat perbedaan nilai kf yang signifikan (Lampiran 4). Penentuan nilai konstanta laju reaksi kimia maju (kf) selain
dilakukan dengan metode simulasi menggunakan perangkat lunak Polar 4.2 dapat ditentukan menggunakan persamaan Nicholson-Shain.
Persamaan Nicholson-Shain merupakan persamaan yang digunakan untuk menentukan nilai konstanta laju reaksi kimia maju (kf) yang berdasarkan nilai banding ipc/ipa. Dari nilai ipc/ipa tersebut dapat dihitung nilai kft dan t dari senyawa klorambusil. Nilai kft dan nilai t semakin menurun pada laju selusur potensial (ν) yang tinggi. Hal ini akan mempengaruhi nilai konstanta laju reaksi kimia
majunya (kf). Nilai konstanta laju reaksi kimia maju (kf) senyawa klorambusil ditentukan dengan cara mengalurkan nilai kft dengan nilai t dalam bentuk kurva persamaan regresi linear. Dari kurva tersebut didapat slope yang merupakan nilai kf dari senyawa klorambusil. Pengaluran nilai kft dengan nilai t disajikan pada Tabel 8-10.
Tabel 18. Data nilai kf klorambusil yang divariasi suhu 20oC; 25oC; 30oC; 40oC berdasarkan Nicholson-Shain (belum terkoreksi), Polar 4.2 dan Nicholson-Shain (terkoreksi)
Suhu (oC) kf (Nicholson-Shain belum terkoreksi)*
kf (Nicholson-Shain terkoreksi) kf (polar 4.2)
20 3,639 5,821 3,1107
25 4,509 7,855 3,3201
30 5,108 7,287 3,2289
40 1,960 ― ―
*(Apriani, 2008)
Pada simulasi menggunakan perangkat lunak Polar 4.2 jenis karakterisitik reaksi elektrokimia (ExCx) dapat ditentukan, dimana x pada E adalah reversibel, kuasi-reversibel atau kuasi-reversibel, juga x pada C menyatakan kuasi-reversibel atau tak-reversibel. Karakterisasi x pada mekanisme ini diketahui dengan menghitung nilai ks yang diperoleh. Berdasarkan simulasi perangkat lunak Polar 4.2 nilai ks yang diperoleh adalah > 2,5 x 10-5ν1/2 cm/s artinya reaksi elektrolisis zat pengalkil antikanker ini pada permukaan elektroda kerja mengikuti mekanisme Eq. Sedangkan reaksi kimia susulannya (Cx) mengikuti Ci karena reaksi kimianya satu arah (kb=0).
V. SIMPULAN DAN SARAN
A.Simpulan
Berdasarkan hasil penelitian, maka dapat disimpulkan bahwa :
1. Nilai banding arus puncak katodik dengan arus puncak anodik (ipc/ipa) senyawa klorambusil pada laju selusur potensial dan suhu yang divariasi berdasarkan Perangkat Lunak Polar 4.2 dapat disimulasi jika nilai ipc/ipa > 0,12.
2. Nilai konstanta laju reaksi kimia maju (kf) senyawa klorambusil berdasarkan Perangkat Lunak Polar 4.2 adalah 3,1107/s (20oC), 3,3201/s (25oC), 3,2289/s (30oC).
3. Uji statistik menunjukkan bahwa nilai kf yang divariasi suhunya pada penelitian ini tidak terdapat perbedaan yang signifikan.
B.Saran
ANALISIS VOLTAMMOGRAM SIKLIK SENYAWA KLORAMBUSIL PADA VARIASI SUHU MENGGUNAKAN PERANGKAT LUNAK
POLAR 4.2
(Skripsi)
Oleh
Harniyati SN
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS LAMPUNG
ANALISIS VOLTAMMOGRAM SIKLIK SENYAWA KLORAMBUSIL PADA VARIASI SUHU MENGGUNAKAN PERANGKAT LUNAK
POLAR 4.2
Oleh
Harniyati SN
Skripsi
Sebagai Salah Satu Syarat untuk Mencapai Gelar SARJANA SAINS
Pada Jurusan Kimia
Fakultas Matematika dan Ilmu Pengetahuan Alam
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS LAMPUNG
Judul Penelitian : Analisis Voltammogram Siklik Senyawa Klorambusil Pada Variasi Suhu Menggunakan Perangkat Lunak Polar 4.2
Nama Mahasiswa : Harniyati SN
Nomor Pokok Mahasiswa : 0617011035
Jurusan : Kimia
Fakultas : Matematika dan Ilmu Pengetahuan Alam
MENYETUJUI 1. Komisi Pembimbing
Dr. Hardoko Insan Qudus, M.S. Dian Septiani Pratama, M.Si NIP 19610203 198703 1 002 NIP 19800908 200912 2 003
2. Ketua Jurusan Kimia
MENGESAHKAN
1. Tim Penguji
Ketua : Dr. Hardoko Insan Qudus, M.S.
Sekretaris : Dian Septiani P, M.Si.
Penguji
Bukan Pembimbing : Irwan Ginting Suka, M.Sc.
2. Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
Dr. Sutiyarso, M.Biomed. NIP 19570424 198703 1 001
DAFTAR ISI
D. Metode Nicholson-Shain ... 15
III. METODELOGI PENELITIAN ... 17
A. Waktu dan Tempat Penelitian ... 17
B. Alat dan Bahan ... 17
1. Alat-alat yang digunakan ... 17
2. Bahan-bahan yang digunakan ... 17
C. Prosedur Penelitian ... 18
1. Penentuan nilai banding ipc dengan ipa dari senyawa klorambusil menggunakan perangkat lunak Polar 4.2 ... 18
2. Penentuan nilai konstanta laju reaksi kimia maju (kf) senyawa klorambusil menggunakan metode Nicholson-Shain ... 22
IV. HASIL DAN PEMBAHASAN ... 24
A. Analisis Voltammogram Siklik Senyawa Klorambusil ... 24
anodik (ipa) senyawa klorambusil menggunakan Perangkat lunak Polar
4.2 ... 26
3. Penentuan konstanta laju reaksi kimia maju (kf) senyawa klorambusil ... 30
1. Penentuan konstanta laju reaksi kimia maju (kf) berdasarkan hasil simulasi Perangkat Lunak Polar 4.2 ... 30
2. Penentuan konstanta laju reaksi kimia maju (kf) berdasarkan Persamaan Nicholson-Shain ... 32
B. Pembahasan ... 36
V. SIMPULAN DAN SARAN ... 42
A.Simpulan ... 43
B. Saran ... 43
DAFTAR GAMBAR
Gambar Halaman
1. Struktur senyawa klorambusil ... 4
2. Mekanisme alkilasi guanin pada DNA ... 7
3. Transfer elektron pada sistem elektrokimia ... 9
4. Voltammogram siklik ... 10
5. Reaksi elektrokimia zat pengalkil yang diikuti oleh reaksi kimia ... 12
6. Tampilan Program Polar 4.2 ... 18
7. Tampilan submenu Technique Program Polar 4.2 ... 18
8. Tampilan submenu Mechanism Program Polar 4.2 ... 19
9. Tampilan submenu Instrument Program Polar 4.2 ... 19
10. Tampilan submenu Chemicals Program Polar 4.2 ... 20
11. Tampilan submenu Simulate Program Polar 4.2 ... 20
12. Tampilan submenu Y Data Program Polar 4.2 ... 21
13. Tampilan submenu Option Program Polar 4.2 ... 21
14. Tampilan submenu Find Peak Program Polar 4.2 ... 22
15. Kurva perbandingan arus puncak katodik (ipc) dengan arus puncak anodik (ipa) untuk transfer elektron reversibel yang diikuti dengan reaksi kimia (ErCi) ... 23
volts/s (20oC) ... 25
26. Bentuk kurva voltammogram siklik tiruan pada ν = 1,0 volts/s ... 48
27. Hasil pencocokan ipc, ipa, Epc, Epa, dan ipc/ipa pada ν = 1,0 volts/s ... 48
28. Voltammogram siklik tiruan pada ν 0,4 volts/s (20o C) ... 49
29. Voltammogram siklik tiruan pada ν 0,5 volts/s (20oC) ... 49
30. Voltammogram siklik tiruan pada ν 0,6 volts/s (20oC) ... 50
31. Voltammogram siklik tiruan pada ν 0,7 volts/s (20o C) ... 50
32. Voltammogram siklik tiruan pada ν 0,8 volts/s (20oC) ... 51
33. Voltammogram siklik tiruan pada ν 0,9 volts/s (20oC) ... 51
34. Voltammogram siklik tiruan pada ν 1,0 volts/s (20oC) ... 52
35. Voltammogram siklik tiruan pada ν 0,5 volts/s (25oC) ... 52
36. Voltammogram siklik tiruan pada ν 0,6 volts/s (25o C) ... 53
37. Voltammogram siklik tiruan pada ν 0,7 volts/s (25oC) ... 53
38. Voltammogram siklik tiruan pada ν 0,8 volts/s (25o C) ... 54
39. Voltammogram siklik tiruan pada ν 0,9 volts/s (25oC) ... 54
42. Voltammogram siklik tiruan pada ν 0,7 volts/s (30oC) ... 56 43. Voltammogram siklik tiruan pada ν 0,8 volts/s (30oC) ... 56 44. Voltammogram siklik tiruan pada ν 0,9 volts/s (30o
DAFTAR TABEL
Tabel Halaman
1. Data nilai kf klorambusil berdasarkan kurva kft terhadap t pada beberapa variasi suhu (20oC, 25oC, 30oC, dan 40oC) ... 16 2. Parameter hasil simulasi voltammogram siklik terhadap nilai ks, D, , Eo, dan
kf pada laju selusur potensial (ν) yang di variasi (20o
C; 5 mM; 1 mm) ... 26 3. Parameter hasil simulasi voltammogram siklik terhadap nilai ks, D, , Eo, dan
kf pada laju selusur potensial (ν) yang di variasi (25o
C; 5 mM; 1 mm) ... 27 4. Parameter hasil simulasi voltammogram siklik terhadap nilai ks, D, , Eo, dan
kf pada laju selusur potensial (ν) yang di variasi (30o
C; 5 mM; 1 mm) ... 27 5. Parameter hasil simulasi voltammogram siklik terhadap nilai ks, D, , Eo, dan
kf pada laju selusur potensial (ν) yang di variasi (40oC; 5 mM; 1 mm) ... 28 6. Parameter hasil simulasi Voltammogram siklik terhadap nilai ipc, ipa, Epa, dan
Epc dengan variasi ν pada voltammogram siklik klorambusil eksperimen dan simulasi Polar 4.2 ... 28 7. Parameter hasil simulasi Voltammogram siklik terhadap nilai ipc, ipa, Epa, dan
Epc dengan variasi ν pada voltammogram siklik klorambusil eksperimen dan simulasi Polar 4.2 (25oC; 5 mM; 1 mm) ... 29 8. Parameter hasil simulasi Voltammogram siklik terhadap nilai ipc, ipa, Epa, dan
Epc dengan variasi ν pada voltammogram siklik klorambusil eksperimen dan simulasi Polar 4.2 (30oC; 5 mM; 1 mm) ... 29 9. Parameter hasil simulasi Voltammogram siklik terhadap nilai ipc, ipa, Epa, dan
Epc dengan variasi ν pada voltammogram siklik klorambusil eksperimen dan simulasi Polar 4.2 (40oC; 5 mM; 1 mm) ... 30 10. Data nilai kf klorambusil yang divariasi suhu 20oC; 25oC; 30oC; 40oC
berdasarkan hasil simulasi program Polar 4.2 ... 32 11. Hasil perhitungan nilai ipc/ipa, Eo, t, dan kft senyawa klorambusil pada ν yang
divariasi (25oC; 5 mM; 1 mm) ... 33
13. Hasil perhitungan nilai ipc/ipa, Eo, t, dan kft senyawa klorambusil pada ν yang di variasi (30oC; 5 mM; 1 mm) ... 34
14. Data nilai kf berdasarkan persamaan Nicholson-Shain pada suhu 20oC; 25oC; 30oC; 40oC. ... 36
15. Nilai ipc/ipa menggunakan perangkat lunak Polar 4.2 (20oC) ... 37
16. Nilai ipc/ipa menggunakan perangkat lunak Polar 4.2 (25oC) ... 38
17. Nilai ipc/ipa menggunakan perangkat lunak Polar 4.2 (30oC) ... 38
18. Data nilai kf klorambusil yang divariasi suhu 20oC; 25oC; 30oC; 40oC berdasarkan Shain (belum terkoreksi), Polar 4.2 dan Nicholson-Shain (terkoreksi) ... 43
DAFTAR PUSTAKA
Apriani, Y. 2008. Analisis Voltammogram Siklik Senyawa Klorambusil Pada Variasi Suhu. (Skripsi). Universitas Lampung. Bandar Lampung.
Bioanalytical.com.2000. Digital Simulaion of Cyclic Voltammetry.
(http://www.biosciences.ac.uk./macro/Enzime_Electrode/Chapter1/Cyclic Voltammetry1.htm). Diakses pada tanggal 28 April 2010 Pukul 11 : 42 WIB.
Boot, A. W. 1997. A Comparison of Cyclic Voltammetry and Cyclic Staircase Voltammetry. Bioanalytical Systems. West Lafayette.
Connors, K. A. G. L, Amindon and V. J, Stella. 1992. Stabilitas Kimiawi Sediaan Farmasi. diterjemahkan oleh Didik Gunawan. IKIP Semarang Press.
Semarang. 410-415.
Fessenden, R. J and J. S. Fessenden. 1986. Kimia Organik. Diterjemahkan oleh Aloysius Hadyana Pudjaatmaka. Erlangga. Jakarta.
Gosser, D.K. 1993. Cyclic Voltammetri : Simulation Analysis of Reaction Mechanism. Wiley-VCH Inc. New York. 1-154.
Hardoko, I. Q., Kosasih, S. Kurnia, F. dan Buchari. 1999. Kajian Reaktivitas Kimia Semustin, Karmustin dan Lomustin yang Digunakan pada Kemoterapi Kanker dengan Metode Voltammetri siklik. Jurnal Acta Pharmaceutica. Institut Teknologi Bandung. Bandung.
Heineman, W. R. 1984. Voltammetry : Basic Concepts and Hydrodinamic
Huang, W. 2000. Polar 4.2 for Windows, Electrochemical Simulation and Data Analysis. Eastern Avenue. Sydney.
Katzung, B. G. 2001. Farmakologi Dasar dan Klinik. Diterjemahkan oleh Bagian Farmakologi Fakultas Kedokteran Universitas Airlangga. Salemba Medika. Jakarta.
Kauffman, J and M, Foye. 1996. Principles of Medicinal Chemistry. Lea & Febigner. London.
Lawley, P.D. 1994. Fluororescense Spectra to Mutational Spectra, a historical overview of DNA reactive Compounds, in DNA adduct. IARC. Lyon.
Nicholson, R. S and I. Shain. 1964. Theory of Stationary Electrode Polarography: Single Scan and Cycle Methods Applied to Reversible, Irreversible and Kynetic System. Anal. Chem. 36. 706-723.
Paisley, A. A. 2000 a. EC_mechanism.
(http://www.biol.paisley.ac.uk/macro/Enzime_Electrode/Chapter1/Cyclic_Vo ltammetry1.htm) diakses pada 26 April 2010 Pukul 14:10 WIB.
Reamers, W. A. 1991. Antineoplastics Agents, in Wilson and Gisvold’s Textbook of Organic Medicinal and Pharmaceutical Chemistry. Ninth Edition.
Lippincot Company. Philadelpia. 313-358.
Rudolph, M., D.P. Reddy and S. W. Felberg. 1994. A simulator for Cyclic Voltammetric Responses. Anal. Chem., 66, No. 10, 589A-600A.
Silverman, R. B. 1992. The Organic Chemistry of Drug Design and Drug Action. Academic Press. San Diego. 220-275.
Wang, J. 2000. Analitical Chemistry. Willey-VCH. New York. 67-74.
Judul Penelitian : Analisis Voltammogram Siklik Senyawa Klorambusil Pada Variasi Suhu Menggunakan Perangkat Lunak Polar 4.2
Nama Mahasiswa : Harniyati SN
Nomor Pokok Mahasiswa : 0617011035
Jurusan : Kimia
Fakultas : Matematika dan Ilmu Pengetahuan Alam
MENYETUJUI 1. Komisi Pembimbing
Dr. Hardoko Insan Qudus, M.S. Dian Septiani P, M. Si NIP 19610203 198703 1 002 NIP 19800908 200912 2 003
2. Ketua Jurusan Kimia
Langkah pertama dan yang paling penting menuju kesuksesan
adalah merasakan bahwa kita bisa sukses.
~ Nelson Boswell
Cukuplah seseorang dikatakan berilmu jika ia takut kepada Allah,
dan cukuplah seseorang dikatakan bodoh jika ia bangga dengan
amalnya
~Arni Wijaya
Sukses adalah sebuah perjalanan, bukan tujuan akhir
~ Ben Sweetland
Untuk mencapai kesuksesan, kita jangan hanya bertindak, tapi juga
perlu bermimpi, jangan hanya berencana, tapi juga perlu untuk
percaya.
Persembahan
Karya kecil ku ini kupersembahkan untuk :
Orang-orang yang kucintai dan kusayangi
Bapak dan ibuku yang senantiasa menyayangi,
mencintai dan mendoakanku
Adikku tersayang atas doa dan dukungannya
Teman-temanku
RIWAYAT HIDUP
Penulis dilahirkan di Metro, Lampung pada tanggal 17 Februari 1989, sebagai anak pertama dari dua bersaudara, pasangan bapak Drs. H. Sunardi dan ibu Hj. Suharni dan seorang adik bernama Alfian Kamil SN.
Pendidikan dimulai dengan memasuki jenjang pendidikan Madrasah Ibtidaiyah (MI) di MI Raudlatul Huda, Trimurjo Lampung Tengah, yang diselesaikan pada tahun 2000. Sekolah Lanjutan Tingkat Pertama (SLTP) di SLTP Al-Qur’an Metro pada tahun 2003, dan Sekolah Menengah Atas (SMA) di SMA Negeri 3 Metro, pada tahun 2006.
Pada tahun 2006, penulis terdaftar sebagai mahasiswa di Jurusan Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam (FMIPA) Universitas Lampung, melalui jalur Seleksi Penerimaan Mahasiswa Baru (SPMB). Selama menjadi mahasiswa, penulis mengikuti organisasi di Himpunan Mahasiswa Kimia (HIMAKI) FMIPA Universitas Lampung sebagai anggota Biro Kesekretariatan periode T.A.
2007/2008.
Matematika dan Ilmu Pengetahuan Alam dan Kimia Analitik II periode T.A. 2009/2010 bagi mahasiswa Jurusan Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam, Kimia Analitik III periode T.A. 2009/2010 bagi mahasiswa Jurusan Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam.
Pada bulan Juli-Agustus 2009, penulis melakukan Praktek Kerja Lapangan (PKL) di Unit Pelaksanaan Teknis Dinas (UPTD) Balai Laboratorium Kesehatan
SANWACANA
Segala puja dan puji syukur hanyalah milik Allah SWT, karena atas rahmat, hidayah, dan kehendak-Nya penulis bisa menyelesaikan skripsi dengan judul :
Analisis Voltammogram Siklik Senyawa Klorambusil Pada Variasi Suhu Menggunakan Perangkat Lunak Polar 4.2
Shalawat teriring salam selalu tercurah kepada Nabi Muhammad SAW, beserta keluarga, sahabat, dan para pengikutnya hingga akhir zaman nanti.
Bersamaan dengan selesainya skripsi ini, penulis mengucapkan terima kasih kepada :
1. Bapak Dr. Hardoko Insan Qudus, M.S., selaku Pembimbing Utama atas kesediaanya untuk memberikan ilmu, bimbingan, kritik dan saran dalam proses penyelesaian skripsi ini.
2. Ibu Dian Septiani pratama, M.Si selaku pembimbing kedua yang telah memberikan bimbingan, masukan dan kritikan dalam proses penyelesaian skripsi ini.
5. Bapak Andi Setiawan, Ph.D., selaku Ketua Jurusan Kimia Fakultas MIPA Universitas Lampung.
6. Bapak Dr. Sutyarso, M.Biomed., selaku Dekan Fakultas MIPA Universitas Lampung.
7. Bapak Prof. Dr. Ir. H. Sugeng P. Harianto, M.S., selaku Rektor Universitas Lampung.
8. Seluruh staf dosen dan karyawan di Jurusan Kimia Fakultas MIPA Univertas Lampung.
9. Kedua orang tua dan adikku tercinta dan tersayang, atas curahan kasih sayang, do’a, dukungan moral dan materil serta bimbingan yang tak ternilai harganya.
10. Teman satu grup penelitian “Voltammogram Siklik” Ekawati dan Nurma
Hayati. Terimakasih atas segala bantuan dan kerjasamanya.
11. Teman-teman angkatan 2006 : yana, inda, nini, putri, ekawati, ekating, uma, devy, lince, reni, tutik, asep, triana, idra, uyun, muti, okta, paul, dwi, nina, ferali, mega, sifa, sinta, Rr. Ari, rika, nindya, ayu, edwin, awan, prio, alex, tomi, slem, roni, trimakasih atas kebesamaannya.
12. Dan teman-teman kimia angkatan 2004, 2005, 2006, 2007, 2008, dan 2009. 13. Serta seluruh orang yang telah membantu dalam proses penyelesaian skripsi
bermanfaat bagi kita semua. Amiin.
Bandar Lampung, November 2010 Penulis