MIKROENKAPSULASI Lactobacillus DENGAN METODE EMULSI DAN APLIKASINYA PADA DODOL SIRSAK
ANIS USFAH PRASTU JATI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI DISERTASI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Mikroenkapsulasi Lactobacillus dengan Metode Emulsi dan Aplikasinya pada Dodol Sirsak adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Mei 2015
RINGKASAN
ANIS USFAH PRASTU JATI. Mikroenkapsulasi Lactobacillus dengan Metode Emulsi dan Aplikasinya pada Dodol Sirsak. Dibimbing oleh SRI LAKSMI SURYAATMADJA dan SULIANTARI.
Permintaan akan pangan probiotik saat ini semakin meningkat seiring dengan meningkatnya pengetahuan konsumen mengenai manfaat probiotik. Manfaat kesehatan yang diperoleh dari konsumsi probiotik adalah ketika berada di dalam saluran pencernaan dalam keadaan hidup dan jumlah yang cukup. Pangan probiotik berbasis non susu mulai dikembangkan melalui produk pangan berbasis buah. Probiotik mengalami tingkat kerusakan atau kematian yang cukup tinggi apabila berada dalam kondisi-kondisi tertentu, yakni pada kondisi penyimpanan dan pengolahan pangan serta dalam saluran pencernaan. Tujuan dari penelitian ini adalah untuk meningkatkan karakteristik dua jenis probiotik (L. acidophilus 2B4 dan L. rhamnosus R23) dengan menerapkan teknik mikroenkapsulasi melalui metode emulsi dan mengevaluasi aplikasinya dalam dodol sirsak. Penelitian ini terdiri dari dua tahap. Tahap pertama adalah pembuatan mikrokapsul probiotik dengan metode emulsi menggunakan minyak kedelai dan bahan enkapsulan alginat. Kemudian diuji ketahanannya terhadap panas, pH rendah dan garam empedu serta kemampuan antimikroba terhadap E. coli. Tahap kedua dilakukan pembuatan dodol sirsak dengan penambahan probiotik dan selanjutnya dilakukan penyimpanan (selama 4 minggu) pada suhu ruang.
Hasil penelitian menunjukkan bahwa mikroenkapsulasi dengan metode emulsi menghasilkan sintasan yang tinggi (95-96%) pada kedua strain probiotik Lactobacillus sp. Mikroenkapsulasi dapat memperbaiki sintasan L. acidophilus 2B4 dan L. rhamnosus R23 secara signifikan (p<0.05) selama pemaparan panas (60, 65, dan 70 oC selama 20 menit) dimana sintasan sel meningkat masing-masing sebesar 2.3 dan 1.7 log cfu g-1 dari jumlah sel bebas yang dipanaskan pada suhu 60 oC. Semakin meningkat suhu pemanasan, penurunan jumlah sel terenkapsulasi juga semakin besar namun tetap lebih kecil dibandingkan sel bebas. Mikroenkapsulasi juga dapat memperbaiki sintasan L. acidophilus 2B4 dan L. rhamnosus R23 pada pH 2 yaitu sebesar 2.4 dan 1.6 log cfu g-1. Selain itu, mikroenkapsulasi juga mampu memperbaiki sintasan L. acidophilus 2B4 dan L. rhamnosus R23 pada kondisi garam empedu (0.5%) sebesar 3.4 dan 2.1 log cfu g -1
. Mikroenkapsulasi tidak menurunkan kemampuan kedua strain probiotik dalam menghambat pertumbuhan E. coli ATCC 25922 secara signifikan (p>0.05), dimana sel bebas mampu menurunkan jumlah E. coli sebesar 0.9-1.0 log cfu g-1 demikian halnya dengan probiotik terenkapsulasi. Hasil studi penyimpanan menunjukkan bahwa L. acidophilus 2B4 dan L. rhamnosus R23 terenkapsulasi lebih stabil selama penyimpanan dodol sirsak juga secara siginfikan (p<0.05) dalam jumlah yang diperlukan (106 cfu g-1) masing-masing selama 3 minggu dan 2 minggu, dibandingkan dengan sel bebas hanya mampu bertahan selama 1 minggu.
SUMMARY
ANIS USFAH PRASTU JATI. Microencapsulation of Lactobacillus by Emulsion Method and Its Application in Soursop Sweet Cakes. Supervised by SRI LAKSMI SURYAATMADJA and SULIANTARI.
Probiotic consumption progressively increasing by the increase of consumer knowledge about the health benefits of probiotics that can provided either in the form of milk-based food or non-dairy food, such as fruit-based food products. Among others, soursop sweet cakes can be developed as probiotic food. To exert health benefit, probiotic should be alive and in adequate number when it reached the disgestive tract. However, probiotics are usually affected by the gastric conditions (low pH and bile salt), food processing and storage conditios. Therefore, it should be protected in order to reach the colon in sufficient amount. Microencapsulation by emulsion method is a well-known technique commonly applied to probiotics to improve their survival. The objectives of this study were to evaluate the effect of microencapsulation by emulsion method on the characteristics of microencapsulated probiotics (L. acidophilus 2B4 and L. rhamnosus R23) and also to determine the viability of probiotics in the soursop sweet cakes during storage. This study was divided into two stages. The first stage was the preparation of the microcapsules probiotics with emulsion method using sodium alginate as encapsulating material, then characterization of the encapsulated probiotic properties including the heat resistance, the resistance to low pH and bile salts and also the antimicrobial activity toward E. coli. The last stage was the viability of probiotics in soursop sweet cakes was further examined during storage at room temperatures for 4 weeks.
Applied of microencapsulation by emulsion method resulted in excellent survival (95-96%) of both Lactobacillus sp. Encapsulation also improved the survival of L. acidophilus 2B4 and L. rhamnosus R23 significantly (p<0.05) during exposure to heat (60, 65, and 70 oC for 20 min) with number of surviving cells at 60 oC were increase as much as 2.3 and 1.7 log cfu g-1, respectively. Number of surviving cells were decrease at higher temperatures (65 and 70 oC) although still lower than the free cells. Microencapsulation can also improve the survival of probiotic cells during exposure at low pH (pH 2) significantly (p<0.05) with the number of surviving cells were 2.4 and 1.6 log cfu g-1 for L. acidophilus 2B4 and L. rhamnosus R23, respectively. During exposure in bile salt (0.5%), encapsulated probiotics were higher than free cells with the number of surviving of encapsulated probiotics (L. acidophilus 2B4 and L. rhamnosus R23) were 3.4 and 2.1 log cfu g-1, respectively. Microencapsulation did not significantly (p>0.05) affect the ability of L. acidophilus 2B4 and L. rhamnosus R23 to inhibit the E. coli ATCC 25922 growth by approximately 1.0 log cfu g-1. The result of storage study showed that viability of L. acidophilus 2B4 and L. rhamnosus R23 encapsulated more stable and differ significantly (p<0.05) in soursop sweet cakes during storage at the required amount (106 cfu g-1) for 3 and 2 weeks, respectively, compared with the free cells that can survive less than 1 week.
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
MIKROENKAPSULASI Lactobacillus DENGAN METODE EMULSI DAN APLIKASINYA PADA DODOL SIRSAK
ANIS USFAH PRASTU JATI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Pangan
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Maret sampai Oktober 2014 ini ialah mikroenkapsulasi probiotik, dengan judul Mikroenkapsulasi Lactobacillus dengan Metode Emulsi dan Aplikasinya pada Dodol Sirsak.
Terima kasih penulis ucapkan kepada Ibu Prof Dr Ir Sri Laksmi Suryaatmadja, MS dan Ibu Dr Dra Suliantari, MS selaku pembimbing. Ungkapan terima kasih juga disampaikan kepada DIKTI atas beasiswa yang diberikan selama studi, juga kepada bapak, ibu, suami, anak serta seluruh keluarga tercinta, juga teman-teman atas segala doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Mei 2015
DAFTAR ISI
DAFTAR TABEL x
DAFTAR GAMBAR x
DAFTAR LAMPIRAN xi
PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 3
Tujuan Penelitian 3
Manfaat Penelitian 3
TINJAUAN PUSTAKA 4
Isolat Probiotik Lokal 4
Mikroenkapsulasi Probiotik 5
Sirsak 9
Dodol 9
METODE 11
Tempat dan Waktu Penelitian 11
Bahan dan Alat 11
Metode Penelitian 11
Persiapan kultur probiotik dan produksi biomassa 12
Mikroenkapsulasi probiotik 12
Bentuk dan ukuran mikrokapsul probiotik 13
Pengujian sintasan probiotik 13
Pengujian ketahanan panas probiotik 13
Ketahanan probiotik terhadap pH 2 dan garam empedu 0.5% 13
Pembuatan dodol sirsak probiotik 14
Pengukuran aw dan pH dodol sirsak probiotik 15 Pengukuran kadar gula dengan metode Luff Schoorl 16 Pengukuran kadar air dengan metode Oven 17 Pengukuran viabilitas probiotik dan total kapang khamir selama
penyimpanan dodol sirsak probiotik 17
HASIL DAN PEMBAHASAN 18
Bentuk dan Ukuran Mikrokapsul Probiotik 18
Rendemen Sel Probiotik Setelah Enkapsulasi 19 Sintasan Probiotik Selama Pemaparan Panas 20 Ketahanan Probiotik terhadap pH Rendah dan Garam Empedu 21 Aktivitas Antimikroba Probiotik terhadap E. coli ATCC 25922 23 Viabilitas Probiotik pada Dodol Sirsak selama Penyimpanan 24
SIMPULAN DAN SARAN 28
DAFTAR PUSTAKA 29
RIWAYAT HIDUP 42
DAFTAR TABEL
1 Syarat mutu dodol sirsak 10
2 Batas maksimum cemaran mikroba dalam dodol 10
3 Karakteristik dodol sirsak 24
4 pH dodol sirsak probiotik selama penyimpanan 25 5 Nilai aw dodol sirsak probiotik selama penyimpanan 25
DAFTAR GAMBAR
1 Skema emulsifikasi 7
2 Diagram alir penelitian 12
3 Diagram alir proses pembuatan dodol sirsak probiotik 15
4 Bentuk mikrokapsul probiotik 18
5 Sebaran ukuran mikrokapsul probiotik 19
6 Viabilitas sel probiotik L. acidophilus 2B4 dan L. rhamnosus R23 setelah mikroenkapsulasi menggunakan natrium alginat dengan metode emulsi 20 7 Sintasan probiotik selama pemaparan panas L. acidophilus 2B4 dan
L. rhamnosus R23 bebas dan terenkapsulasi 21
8 Sintasan probiotik selama berada pada kondisi: (a) pH 2 dan (b) garam
9 Aktivitas antimikroba probiotik terhadap pertumbuhan E. coli ATCC
25922 24
10 (a) Viabilitas probiotik di dalam dodol sirsak dan (b) Total kapang khamir pada dodol sirsak probiotik selama penyimpanan pada suhu ruang 277
DAFTAR LAMPIRAN
1 Bentuk mikrokapsul probiotik hasil emulsi 34 2 Bentuk mikrokapsul probiotik di bawah mikroskop cahaya 34 3 Bentuk dan ukuran mikrokapsul probiotik di bawah mikroskop okuler 34 4 Perhitungan ukuran mikrokapsul probiotik 35
5 Hasil pengukuran kadar gula 35
6 Hasil pengukuran kadar air 35
7 Hasil analisis statistik RE probiotik dengan metode emulsi 366 8 Hasil analisis statistik pengujian ketahanan panas probiotik pada suhu 60,
65, dan 70 oC 36
9 Hasil analisis statistik pengujian ketahanan probiotik terhadap pH 2 37 10 Hasil analisis statistik pengujian ketahanan probiotik terhadap garam
empedu 0.5% 388
11 Hasil analisis statistik pengujian aktivitas antimikroba probiotik terhadap
E. coli ATCC 25922 38
12 Perhitungan koloni 399
1
PENDAHULUAN
Latar Belakang
Aplikasi probiotik ke dalam produk pangan kini semakin meningkat seiring dengan meningkatnya kesadaran masyarakat akan manfaat kesehatan yang diperoleh setelah mengonsumsi probiotik, khususnya terhadap kesehatan pencernaan. Produk-produk probiotik merupakan pangan fungsional yang kini menjadi sorotan yakni terdapat sekitar 65% dalam pasar pangan fungsional dunia (Agrawal 2005) dan diperkirakan pangsa pasar produk-produk probiotik tersebut akan terus berkembang (Jankovic et al. 2010). Hal tersebut juga didukung oleh data nilai penjualan produk probiotik di pasar global yang mengalami peningkatan pada tahun 2007 sebesar US $14.9 milyar, menjadi US $15.9 milyar pada tahun 2008 dan dengan pertumbuhan sebesar 4.3% per tahun diperkirakan target penjualan pada tahun 2013 akan mencapai US $19.6 milyar (Anonim 2013).
Angka penjualan tersebut didominasi oleh produk probiotik berbasis susu yakni yoghurt serta produk probiotik lainnya seperti keju, es krim, dan susu formula untuk bayi (Granato et al. 2010).
Definisi probiotik menurut FAO/WHO (2002) adalah mikroorganisme hidup yang apabila dikonsumsi oleh manusia atau hewan dalam jumlah yang cukup, mampu bertahan hidup ketika melewati kondisi lambung dan saluran pencernaan serta bermanfaat meningkatkan kesehatan inangnya. Mikroorganisme probiotik umumnya berasal dari bakteri asam laktat (BAL). Lactobacillus merupakan genus terbesar dari kelompok bakteri asam laktat (BAL) yang digunakan sebagai probiotik, yakni sebanyak 61.9% dari total penjualan berbagai produk probiotik pada tahun 2007 (Anonim 2013). Isolat BAL lokal yang berpotensi sebagai probiotik telah banyak diteliti, diantaranya isolat BAL yang diisolasi dari daging sapi segar yaitu strain probiotik L. acidophilus 2B4 yang telah terbukti efektif mencegah diare yang disebabkan oleh EPEC (Enterophatogenic Escherichia coli) dengan cara meningkatkan total BAL pada tikus, serta menurunkan total E. coli pada mukosa dan isi sekum (Arief et al. 2010). Isolat BAL kandidat probiotik yang diisolasi dari air susu ibu (ASI) telah teridentifikasi yaitu L. rhamnosus R23 memiliki potensi terbaik untuk mencegah diare dengan menekan jumlah E. coli pada feses tikus yang diberi asupan E. coli K1.1 (Nuraida et al. 2012a).
2
untuk mempertahankan viabilitas probiotik adalah dengan mengaplikasikan metode mikroenkapsulasi. Mikroenkapsulasi merupakan suatu teknologi yang telah banyak dikembangkan untuk diaplikasikan dalam industri pangan sebagai upaya perlindungan terhadap sel bakteri (Borgogna et al. 2010). Selain itu mikroenkapsulasi juga bermanfaat dalam menjaga sintasan probiotik selama penyimpanan dan melewati saluran pencernaan. Homayouni et al. (2008) melaporkan bahwa penambahan mikrokapsul probiotik umumnya tidak mempengaruhi sifat sensori produk pangan seperti pada es krim sinbiotik.
Probiotik telah banyak diaplikasikan ke dalam berbagai macam produk pangan, seperti pada yoghurt (Capela et al. 2006), es krim (Cruz et al. 2009), dan juga coklat hitam (Nebesny et al. 2006). Kebanyakan dari produk pangan yang disuplementasi dengan probiotik adalah produk pangan berbasis susu. Saat ini konsumsi produk probiotik non susu juga cukup meningkat karena adanya tren terkait vegetarian, kandungan kolesterol dalam susu, dan juga gangguan pencernaan seperti intoleransi laktosa (Granato et al. 2010). Beberapa penelitian telah melaporkan aplikasi probiotik ke dalam produk pangan berbasis non susu, anatar lain penambahan beberapa strain probiotik ke dalam jus apel dan jus jeruk (Ding dan Shah 2008), penambahan Lactobacillus casei dan Bifidobacterium bifidum pada saus mayones (Fahimdanesh et al. 2012), serta penambahan Lactobacillus acidophilus pada saus mayones (Mohammadi et al. 2013).
Indonesia dikenal kaya akan sumber daya lokal seperti buah tropis yang potensial untuk dikembangkan sebagai basis pangan fungsional yakni dengan penambahan probiotik, sehingga dapat meningkatkan nilai tambah produk. Salah satu jenis buah lokal yakni sirsak dapat diperoleh dalam jumlah yang relatif besar hampir sepanjang tahun, sehingga tidak ada kendala ketersediaan bahan baku. Oleh karena itu pangan probiotik berbasis sirsak mempunyai potensi untuk dikembangkan. Jenis olahan sirsak yang sudah lama dikenal adalah dodol sirsak yang merupakan salah satu jenis produk IMF (Intermediate Moisture Food).
IMF merupakan produk pangan semi basah yang dibuat dengan tujuan pengawetan, dimana produk pangan tersebut dibuat sedemikian rupa sehingga memiliki nilai aktivitas air (aw) yang lebih rendah yakni hingga mendekati 0.65-0.90 dan umumnya mengandung air sekitar 20-50 % (b/b) (Vermeulen et al. 2012). Hal tersebut bertujuan agar hampir seluruh mikroorganisme khususnya mikroorganisme perusak makanan tidak dapat tumbuh di dalamnya (Sych 2003) sehingga produk pangan tersebut memiliki masa simpan yang relatif lebih lama pada penyimpanan suhu ruang. Penelitian yang melaporkan mengenai penambahan gliserol dengan beberapa konsentrasi pada edible coating jenang dodol, menunjukkan bahwa jenang dodol kontrol (tanpa edible coating) memiliki aw sekitar 0.92. Penambahan gliserol sebanyak 2.0% pada edible coating yang diaplikasikan pada jenang dodol yang disimpan selama 12 hari terbukti dapat menurunkan aw jenang dodol tersebut menjadi 0.89 (Sari et al. 2013).
3
Perumusan Masalah
Sirsak merupakan salah satu jenis buah tropis yang terdapat di Indonesia dalam jumlah yang cukup banyak dan tersedia sepanjang tahun. Sirsak telah banyak diolah menjadi produk pangan, tetapi belum dikembangkan menjadi produk pangan fungsional seperti dodol sirsak probiotik. Isolat probiotik asal Indonesia yang dapat dimanfaatkan untuk tujuan ini yaitu isolat BAL yang diisolasi dari daging sapi yakni L. acidophilus 2B4 dan isolat BAL yang diisolasi dari ASI yakni L. rhamnosus R23. Untuk meningkatkan sintasan probiotik dalam produk dapat dilakukan dengan membuat mikrokapsul probiotik dengan metode emulsi. Produk dodol sirsak probiotik ini merupakan produk pangan fungsional baru yang belum ada di pasaran, sehingga penambahan probiotik ke dalam produk masih perlu diteliti. Sintasan probiotik dapat mengalami penurunan saat aplikasi pada sistem pangan, selama penyimpanan produk hingga probiotik tersebut dikonsumsi dan masuk ke dalam saluran pencernaan. Selain itu probiotik juga tidak tahan panas, sedangkan jumlah probiotik hidup menentukan manfaat kesehatan bagi inangnya yaitu probiotik harus mampu bertahan hidup minimal sebanyak 106 cfu mL-1 atau g-1 saat dikonsumsi. Oleh karena itu probiotik perlu diproteksi dengan metode enkapsulasi agar dapat memenuhi jumlah minimal hingga berada dalam saluran pencernaan. Salah satu metode enkapsulasi probiotik yang sesuai untuk diaplikasikan pada dodol sirsak ini adalah metode emulsi dimana selain melindungi probiotik juga dapat memberikan tekstur lembut ketika diinkorporasikan ke dalam produk (Zanjani et al. 2012). Lama penyimpanan juga akan mempengaruhi stabilitas probiotik terutama selama berada di dalam produk pangan, sehingga hal tersebut juga perlu diteliti.
Tujuan Penelitian Penelitian ini bertujuan untuk :
1. Mengetahui pengaruh mikroenkapsulasi terhadap karakteristik dua jenis probiotik (L. acidophilus 2B4 dan L. rhamnosus R23)
2. Mengetahui viabilitas probiotik terenkapsulasi selama penyimpanan dodol sirsak
Manfaat Penelitian
1. Mikroenkapsulasi probiotik dapat diaplikasikan dalam rangka diversifikasi produk pangan fungsional berbasis non susu berisi probiotik L. acidophilus 2B4 dan L. rhamnosus R23
4
Hipotesis
1. Mikroenkapsulasi dapat memberi ketahanan probiotik terhadap panas
2. Mikroenkapsulasi dapat memperbaiki ketahanan probiotik selama berada dalam kondisi pH rendah (2) dan garam empedu (0.5%)
3. Mikroenkapsulasi dapat mempertahankan viabilitas probiotik selama penyimpanan dodol sirsak pada suhu ruang
TINJAUAN PUSTAKA
Isolat Probiotik Lokal
Probiotik menurut FAO/WHO (2002) adalah mikroorganisme hidup yang apabila dikonsumsi oleh manusia atau hewan dalam jumlah yang cukup, mampu bertahan hidup ketika melewati kondisi lambung dan saluran pencernaan serta bermanfaat bagi sel inangnya dengan cara meningkatkan kesehatan bagi inangnya. Mikroorganisme probiotik umumnya berasal dari bakteri asam laktat (BAL). Probiotik yang berasal dari kelompok BAL antara lain L. acidophilus, L. casei, Streptococcus lactis, Enterococcus faecium, B. adolescentis, dan B. coagulans. Salminen et al. (2004). Semyonov et al. (2011) menambahkan bahwa Lactobacillus dan Bifidobacterium merupakan spesies yang paling sering digunakan sebagai probiotik di dalam pangan karena dapat memberikan manfaat kesehatan bagi manusia secara signifikan dengan mengonsumsi mikroorganisme tersebut.
Secara keseluruhan, probiotik dapat ditemukan dan tersedia dalam berbagai bentuk produk pangan seperti kapsul, sachet atau tablet. Hal tersebut bertujuan untuk mempertahankan daya tahan hidup probiotik selama berada dalam kondisi saluran pencernaan dan memperbaiki keseimbangan mikroflora yang berada di dalam saluran pencernaan manusia. Mikroflora usus dapat melawan mikroorganisme patogen bila terdapat dalam jumlah atau proporsi yang seimbang atau bahkan lebih banyak dari mikroba patogen agar memperoleh fungsi saluran pencernaan yang baik (Burgain et al. 2011). Untuk mendapatkan manfaat yang potensial dari probiotik, probiotik harus tetap hidup selama melewati kondisi asam dan kondisi enzimatik di dalam saluran pencernaan, serta mampu berkoloni dan tumbuh pada epitelium kolon dengan jumlah populasi yang cukup. Berdasarkan peraturan yang dikeluarkan oleh FAO/WHO (2002) bahwa probiotik harus berada pada kondisi yang aktif dalam jumlah minimum 106-107 cfu g-1 atau mL-1 (Lotfipour et al. 2012). BAL termasuk kelompok bakteri baik bagi manusia dan umumnya memenuhi status GRAS (Generally Recognize As Safe) (Semyonov et al. 2011), yaitu aman bagi manusia sehingga jumlah konsumsinya tidak dibatasi dengan ketat secara regulasi.
5
sehat. Oleh karena itu L. acidophilus menjadi mikroorganisme yang paling banyak diaplikasikan untuk produk-produk probiotik. Ezpinoza et al. (2010) juga menambahkan bahwa isolat ini dapat tumbuh pada suhu yang mencapai 45 oC, dimana suhu optimum pertumbuhannya adalah pada kisaran 35-40 oC. Isolat tersebut dapat tumbuh pada media yang memiliki pH 4.5-6.4, namun pertumbuhannya akan berhenti pada pH 3.6-4.0. L. acidophilus juga dapat tumbuh pada pH optimum 5.5-6.0.
Lactobacillus acidophilus 2B4 yang diisolasi dari daging sapi telah terbukti efektif mencegah diare yang disebabkan oleh EPEC dengan cara meningkatkan total BAL di mukosa dan isi sekum, serta mampu menurunkan total E.coli pada mukosa dan isi sekum (Arief et al. 2010). L. acidophilus adalah bakteri heterofermentatif yang dapat menfermentasi gula menjadi asam laktat.
L. acidophilus terdapat secara alami pada saluran pencernaan dan saluran reproduksi manusia. L. acidophilus La5 yang dienkapsulasi dengan bahan enkapsulan pektin-whey dapat bertahan selama berada pada kondisi lambung yakni pH 1.2 dan 3.0 dan kondisi usus halus yakni pada pH 7.0, juga tahan terhadap panas. Hal tersebut ditunjukkan dengan sintasan L. acidophilus La5 yang tidak berubah yakni sebanyak 108 cfu g-1 setelah diuji pada simulasi lambung dan usus halus selama 120 dan 300 menit (Gebara et al. 2013). L. acidophilus terenkapsulasi dapat meningkatkan ketahanannya terhadap kondisi asam (pH 2.81), hal ini dibuktikan dengan jumlah sel L. acidophilus terenkapsulasi di dalam jus jeruk dan jus apel yang hidup masih sebanyak lebih dari 105 cfu mL-1 (Ding dan Shah 2008).
Isolat probiotik lokal lain yang digunakan dalam penelitian ini adalah L. rhamnosus R23 yang diisolasi dari air susu ibu (ASI) dan memiliki potensi untuk mencegah diare dengan menekan jumlah E. coli pada feses segera setelah tikus diberi asupan E. coli K1.1 (Nuraida et al. 2012). L. rhamnosus R23 merupakan BAL yang bersifat homofermentatif. Selain itu, L. rhamnosus R23 dapat tumbuh dengan baik pada media yang mengandung prebiotik seperti FOS dan GOS dengan memanfaatkannya sebagai sumber karbon dan sumber gula untuk pertumbuhannya (Nuraida et al. 2011). Gerez et al. (2012) melaporkan bahwa isolat L. rhamnosus CRL 1505 yang dienkapsulasi dengan mikropartikel protein pektin-whey mampu bertahan hidup pada kondisi asam yakni pada pH 1.2 dan 2.0. L. rhamnosus terenkapsulasi mampu bertahan pada kondisi asam yakni pada jus apel dan jus jeruk dengan pH 2.81 jumlah sel hidup lebih dari 105 cfu mL-1 selama 6 minggu penyimpanan pada suhu 4 oC (Ding dan Shah 2008). Weinbreck et al. (2010) melaporkan bahwa L. rhamnosus GG yang tidak dienkapsulasi dan disimpan pada suhu 37 oC di dalam bubuk susu formula bayi dengan kondisi aw dan kadar oksigen yang berbeda menunjukkan bahwa jumlah sel hidupnya pada kondisi aw 0.7 berkurang hingga lebih dari 1010 cfu mL-1.
Mikroenkapsulasi Probiotik
6
tersebut, diperlukan teknologi-teknologi baru dan salah satunya adalah dengan mikroenkapsulasi (Gebara et al. 2013).
Definisi enkapsulasi menurut Chen dan Chen (2007) adalah sebagai proses fisikokimia atau mekanik yang bertujuan untuk memerangkap suatu zat dalam suatu bahan pengemas sehingga menghasilkan partikel atau kapsul dengan beberapa ukuran diameter yang berbeda yakni mulai dari nanometer hingga milimeter, tergantung pada bahan dan metode yang digunakan. Kapsul merupakan bahan yang bersifat semipermeabel, tipis, berbentuk bulat dan kuat dengan diameter bervariasi dari beberapa mikrometer hingga millimeter. Kapsul tersebut mempunyai kemampuan untuk memodifikasi serta meningkatkan bentuk dan sifat substansi yang diperangkapnya. Kapsul juga berfungsi untuk mengawetkan substansi dan melepaskan substansi tersebut ketika diperlukan. Enkapsulasi digunakan dalam berbagai aplikasi dalam industri makanan antara lain dalam mengendalikan reaksi oksidasi, perubahan rasa, warna dan bau serta memperpanjang umur simpan
Zuidam dan Shimoni (2010) melaporkan proses enkapsulasi dapat dilakukan dengan beberapa metode antara lain metode pengeringan semprot (spray drying), fluid bed coating, pendinginan semprot (spray chilling), melt injection, melt extrusion, emulsi, dan metode pengeringan beku (freeze drying) atau pengeringan vakum. Pemilihan metode yang akan digunakan tergantung dari beberapa faktor, antara lain komponen pangan yang akan dienkapsulasi, bahan enkapsulan, serta biaya yang akan dikeluarkan.
Penelitian ini menggunakan mikroenkapsulasi dengan metode emulsi, dimana dalam penerapannya metode emulsi menggunakan fase cair yang berisi sel probiotik dan suspensi polimer (dalam fase terpisah) dengan volume yang kecil, kemudian ditambahkan ke dalam fase organik seperti minyak (Kaliasapathy 2002). Minyak yang sering digunakan adalah minyak sayur yang berasal dari kedelai, bunga matahari, jagung, ataupun minyak parafin. Larutan tersebut akan dibuat menjadi campuran yang homogen menggunakan pengadukan yang tepat hingga terbentuk emulsi air dalam minyak atau disebut water in oil (W/O). Setelah terbentuk gel, hasil campuran enkapsulasi dituangkan ke dalam air untuk memisahkan minyak dari fase W/O tersebut (Krasaekoopt et al. 2003).
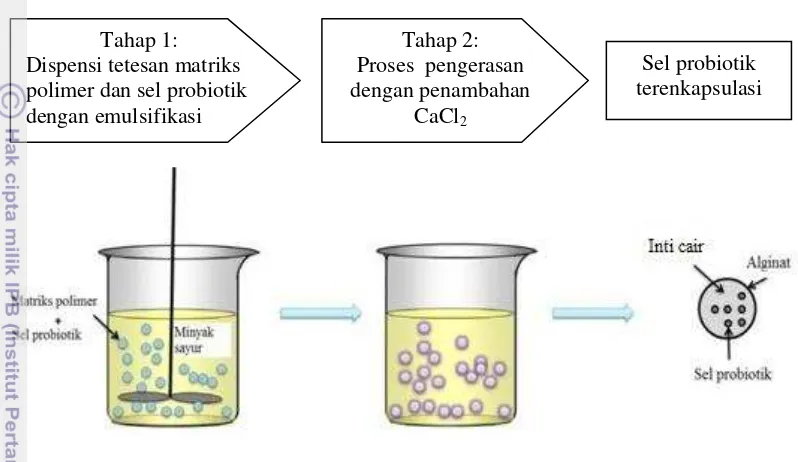
Burgain et al. (2011) melaporkan bahwa emulsifikasi merupakan teknik kimia yang digunakan untuk mengenkapsulasi sel probiotik hidup dengan menggunakan hidrokoloid seperti alginat, karagenan dan pektin sebagai enkapsulan. Metode emulsi dilakukan dengan membuat larutan yang berisi matriks polimer dan sel probiotik dalam volume kecil kemudian larutan tersebut ditambahkan ke dalam minyak sayur dengan volume besar. Campuran tersebut selanjutnya dihomogenisasi menjadi bentuk emulsi air dalam minyak. Ketika emulsi air dalam minyak telah terbentuk, polimer larut air harus dibuat tidak larut untuk membentuk partikel-partikel gel kecil dalam fase minyak. Skema pembuatan mikrokapsul dengan metode emulsifikasi tersebut dapat dilihat pada Gambar 1.
7
pengeras dalam larutan emulsi tersebut dapat menjadikan struktur kapsul atau manik-manik yang terbentuk menjadi lebih stabil dan efek perlindungan terhadap probiotik juga lebih tinggi sehingga viabilitas sel probiotik yang dihasilkan juga tinggi.
Gambar 1 Skema emulsifikasi (Burgain et al. 2011)
Kapsul yang dihasilkan dari metode emulsi ini memiliki diameter kecil namun kekurangan dari metode ini adalah ukuran dan bentuk mikrokapsul yang dihasilkan beragam. Hal ini disebabkan karena variasi dari ukuran yang dihasilkan tersebut dapat dipengaruhi oleh kecepatan agitasi dan perbandingan air dan minyak yang digunakan (Kailasapathy 2009). Beberapa hasil penelitian yang menunjukkan variasi ukuran diameter mikrokapsul diantaranya penelitian yang dilakukan oleh Hansen et al. (2002), bahwa mikrokapsul yang dihasilkan dengan metode emulsi menggunakan campuran probiotik dan natrium alginat serta minyak sayur lalu ditambah CaCl2 sebagai pengeras kapsul, memiliki ukuran diameter berkisar 20-70μm. Penelitian serupa melaporkan bahwa metode emulsi dapat menghasilkan mikrokapsul dalam jumlah yang cukup banyak dengan ukuran mikrokapsul yang dihasilkan berdiameter 25μm-2mm (Krasaekoopt et al. 2003), 0.2-5000μm dengan daya tampung mikrokapsul berkisar antara 1-100% (Zuidam dan Shimoni 2010), dan 70-500μm (Zanjani et al. 2012). Namun, metode ini membutuhkan biaya yang lebih tinggi bila dibandingkan dengan metode ekstrusi, karena metode emulsi menggunakan minyak sayur untuk pembentukan emulsi (Krasaekoopt et al. 2003). Diameter mikrokapsul yang dihasilkan berpengaruh penting terhadap viabilitas sel probiotik, kecepatan metabolismenya serta karakteristik sensori dari produk yang dihasilkan. Selain itu, ukuran dari diameter mikrokapsul juga dapat mempengaruhi distribusi serta kualitas dispersi dari mikrokapsul di dalam produk (Picot dan Lacroix 2003). Kailasapathy (2009) juga menambahkan bahwa proses penyalutan dapat dilakukan dua kali untuk membuat lapisan pembungkus yang selain dapat melindungi sel juga dapat memperbaiki sifat organoleptik produk.
Tahap 1: Dispensi tetesan matriks polimer dan sel probiotik dengan emulsifikasi
Tahap 2: Proses pengerasan dengan penambahan
CaCl2
8
Dibutuhkan jumlah sel probiotik hidup dalam mikrokapsul yang cukup tinggi untuk dapat memberikan efek kesehatan bagi tubuh. Efek kesahatan akan diperoleh setelah mengonsumsi sejumlah probiotik. Hal tersebut juga dipengaruhi oleh strain probiotik yang digunakan. Namun secara umum, probiotik dapat memeberikan manfaat kesehatan bagi tubuh apabila dikonsumsi sekitar 106-107 cfu g-1 per hari (Krasaekoopt et al. 2003). Mikroenkapsulasi pada L. acidophilus dan L. rhamnosus menggunakan metode emulsi dapat menghasilkan mikrokapsul dengan populasi sekitar 108-109 cfu mL-1 jus apel serta dapat memperbaiki viabilitas probiotik hingga 6 minggu dengan penurunan jumlah sel probiotik terenkapsulasi yang kecil yaitu menjadi 105-107 cfu mL-1 jus apel yang disimpan pada suhu 4 oC (Ding dan Shah 2008).
Perlindungan probiotik dengan metode mikroenkapsulasi dapat dilakukan dengan berbagai jenis enkapsulan, salah satunya adalah dengan alginat. Alginat merupakan bahan yang paling baik digunakan untuk mikroenkapsulasi karena dapat memperbaiki viabilitas probiotik di dalam produk pangan fungsional. Selain itu, alginat sering digunakan sebagai bahan enkapsulasi karena kelebihannya yakni memiliki sifat non toksik dan tersedia dalam jumlah yang cukup banyak dan cukup murah (Krasaekoopt et al. 2003). Alginat merupakan polisakarida anionik yang terdiri dari ikatan kopolimer 1,4 α-L-asam guluronat dan residu β-D-asam manuronat (Wandrey et al. 2010). Alginat diperoleh dari ekstrak rumput laut. Alginat digunakan oleh industri makanan karena sifat unik koloidnya yang meliputi pengental, penstabil, pensuspensi, pembentuk film, pembentuk gel dan penstabil emulsi. Kegunaan alginat didasari pada tiga sifat utamanya yaitu kemampuan larut dalam air, kemampuan membentuk gel dimana gel akan terbentuk ketika garam kalsium ditambahkan ke dalam larutan sodium alginat., serta kemampuan membentuk film dari sodium atau kalsium alginat dan serat dari kalsium alginat.
Alginat merupakan bahan enkapsulan yang dapat meningkatkan viabilitas probiotik selama penyimpanan pada suhu rendah, dalam pH rendah dan dalam garam empedu. Alginat telah banyak diaplikasikan sebagai bahan enkapsulan pada berbagai komponen pangan. Alginat berbentuk bubuk kering dan secara komersial diproduksi dari alga laut coklat, dan juga disintesis dari beberapa bakteri. Mandal et al. (2006) melaporkan bahwa alginat telah berhasil meningkatkan viabilitas probiotik. L. acidophilus yang dienkapsulasi dengan alginat dapat bertahan hidup lebih lama sebanyak 2% dan meningkat menjadi 4% ketika konsentrasi alginat ditingkatkan. Selain itu, mikroenkapsulasi dengan alginat juga dapat mencegah tekanan yang mengakibatkan kerusakan pada sel bakteri, dan dapat diaplikasikan dalam jumlah atau volume yang cukup besar (Ding dan Shah 2008).
9
bulan. Mortazavian et al. (2007) menambahkan bahwa L. acidophilus dan bifidobacteria yang dienkapsulasi dengan kalsium alginat dapat bertahan hidup saat disimpan pada refrigerator selama 8 minggu.
Sirsak
Sirsak (Annona muricata) adalah tanaman tropis yang berasal dari Amerika Tengah. Sirsak dapat tumbuh diberbagai negara yang beriklim tropis. Di Indonesia sendiri, tanaman sirsak menyebar dan tumbuh baik mulai dari dataran rendah beriklim kering sampai daerah basah dengan ketinggian 1000 meter di atas permukaan laut. Produksi sirsak di Indonesia dari tahun 2010 hingga 2012 berturut-turut sebesar 60 754 ton, 59 844 ton dan 51 809 ton per tahun, sedangkan produksi sirsak di Provinsi Jawa Barat pada tahun 2012 sebesar 123 085 Kw (BPS 2013).
Secara umum, sirsak terdiri dari 67.5% daging buah, 20% kulit buah, 8.5% biji, dan 4% duri-duri lunak, dari total berat buah. Daging buah berwarna putih dan sebagian besar kandungannya adalah air, yakni sebesar 80-81% (Badrie et al. 2009). Daging sirsak juga mengandung 1% protein, 18% karbohidrat, vitamin B1, B2, dan vitamin C, 24.73% serat serta kaya akan mineral seperti fosfor, kalsium, magnesium, dan kalium (Degnon et al. 2013). Sirsak memiliki kadar air yang cukup tinggi, namun rendah lemak dan juga rendah protein per 100 g daging buah, serta memiliki karakteristik fisikokimia yakni pH daging buah mencapai 4.56 dan total padatan sebesar 15 oBrix (Badrie et al. 2009).
Daging sirsak dapat dikonsumsi dengan dicampurkan pada es krim atau susu dan juga dapat dijadikan sebagai bahan baku pembuatan jelly fruit, jus, dodol, selai, permen dan sirup (Sukara 2007). Vitamin C yang terkandung di dalam sirsak tersebut bermanfaat sebagai antioksidan alami yang mampu menangkal radikal bebas, serta baik untuk meningkatkan daya tahan tubuh dan dapat memperlambat proses penuaan. Selain itu, sirsak juga memiliki manfaat kesehatan yakni untuk pengobatan herbal sebagai obat antiplasmodik (pereda kejang otot usus) dan antiemetik (pengurang mual atau muntah) (Badrie et al. 2009).
Dodol
10
Tabel 1 Syarat mutu dodol sirsak (SNI 1996)
No. Jenis Uji Satuan Persyaratan 1. Keadaan : Badan Pengawas Obat dan Makanan Republik Indonesia (BPOM 2009) dan dapat dilihat secara lebih rinci pada Tabel 2.
Tabel 2 Batas maksimum cemaran mikroba dalam dodol (BPOM 2009) Jenis cemaran mikroba Batas maksimum
ALT (30oC, 72 jam) 1x104 koloni g-1
APM koliform 20 g-1
APM Escherichia coli < 3 g-1
Salmonella sp Negatif/25 g
Staphylococcus aureus 10 koloni g-1
Bacillus cereus 1x102 koloni g-1
Kapang dan khamir 2x102 koloni g-1
11
METODE
Tempat dan Waktu Penelitian
Penelitian dilaksanakan pada bulan Februari hingga Oktober 2014 di Laboratorium Mikrobiologi Pangan dan Laboratorium Pengolahan Pangan Departemen Ilmu dan Teknologi Pangan Institut Pertanian Bogor (IPB) dan Laboratorium Mikrobiologi Pangan Southeast Asian Food and Agricultural Science and Technology (SEAFAST) Center IPB.
Bahan dan Alat
Bahan baku buah yang digunakan pada penelitian ini adalah sirsak matang yang diperoleh dari Pasar di sekitar Bogor. Isolat probiotik yang digunakan adalah L. acidophilus 2B4 (koleksi Fakultas Peternakan IPB), L. rhamnosus R23 dan E. coli ATCC 25922 yang diperoleh dari Laboratorium Mikrobiologi Pangan SEAFAST CENTER IPB. Pengolahan dodol sirsak juga menggunakan bahan-bahan tambahan-bahan seperti gula pasir, gula merah, tepung ketan, dan santan kelapa. Bahan enkapsulan yang digunakan adalah natrium alginat PA yang diperoleh dari Departemen Ilmu dan Teknologi Pangan IPB.
Bahan kimia yang digunakan untuk analisis antara lain air destilata (akuades), larutan fisiologis NaCl 0.85%, CaCl2 0.1 M, HCl 0.1 M, garam empedu, alkohol 70%, spiritus, buffer phospat, sodium sitrat dan asam tartarat. Media pertumbuhan bakteri asam laktat yang digunakan adalah media MRSA (de Man Rogosa Sharpe Agar) dan MRSB (de Man Rogosa and Sharpe Broth). Untuk analisis kapang dan khamir menggunakan media PDA (Potato Dextrose Agar) dan PDB (Potato Dextrose Broth).
Peralatan yang digunakan untuk analisis dan proses mikroenkapsulasi antara lain sentrifus suhu rendah, refrigerator, pemanas bertekanan (otoklaf), penangas air, laminar air flow, inkubator, neraca digital, pHmeter, magnetik stirer, vorteks, mikropipet, alat gelas, ose dan bunsen. Untuk pembuatan dodol sirsak menggunakan peralatan seperti kompor, blender, wajan, panci, pengaduk, tempat cetakan, pisau, wadah atau loyang, sendok, timbangan kue, plastik untuk alas.
Metode Penelitian
12
Gambar 2 Diagram alir penelitian
Persiapan kultur probiotik dan produksi biomassa (Harmayani et al. 2001) Sebanyak satu ose probiotik ditumbuhkan pada media MRSB (Oxoid Ltd., England) kemudian diinkubasi selama 24 jam pada suhu 37 oC. Selanjutnya diambil sebanyak 10 mL untuk ditumbuhkan kembali dalam 1 liter MRSB (Oxoid Ltd., England) (1:100) yang akan digunakan untuk produksi biomassa. Biomassa dapat dipanen menggunakan alat sentrifugasi (Himac CR 21G, Hitachi, Tokyo, Japan) 5000 x g selama 20 menit pada 4 oC. Kemudian biomassa dicuci sebanyak dua kalimenggunakan buffer fosfat (Merck, Germany) 0.1 M dengan cara disentrifugasi kembali dengan kecepatan 5000 x g selama 20 menit pada 4 oC. Biomassa biasanya mengandung sekitar 1.0x1010 hingga 1011 cfu mL-1.
Mikroenkapsulasi probiotik (Mandal et al. 2006)
Biomassa sel sebanyak 4 mL dimasukkan ke dalam 20 mL larutan natrium alginat (Sigma-Aldrich Pte. Ltd., Singapore) (3%) steril lalu dihomogenkan dengan cara digoyang-goyangkan. Minyak kedelai (Mazola, Canada) sebanyak 100 mL yang mengandung 0.2% Tween 80 (emulsifier), dimasukkan ke dalam gelas piala dan campuran aginat dengan sel bebas ditambahkan dengan cara diteteskan sambil diputar dengan pengaduk magnet. Setelah 5 menit, larutan emulsi yang terbentuk ditambahkan dengan CaCl2 (Merck, Germany) 0.1 M (100 mL) secara cepat untuk mengeraskan mikrokapsul dan memecah emulsi. Kapsul-kapsul yang telah terbentuk kemudian dipisahkan dari minyak menggunakan alat
Enkapsulasi probiotik
(L. acidophilus 2B4 dan L. rhamnosus R23) dengan enkapsulan alginat
Analisis :
Sintasan probiotik Ketahanan panas
Ketahanan pH rendah (2) Ketahanan garam empedu 0.5% Antimikroba terhadap E. coli
Dodol sirsak probiotik
Penyimpanan pada suhu ruang Analisis :
Viabilitas probiotik Total kapang khamir
Penentuan suhu penambahan probiotik
ke dalam dodol sirsak
Pembuatan dodol sirsak dengan penambahan
13
sentrifugasi (Hermle Z383K, Hermle Labortechnik, Germany) kecepatan 350 x g selama 10 menit pada suhu 4 oC dan dicuci dua kali dengan akuades. Manik-manik dipisahkan dengan kertas saring, lalu dipindahkan ke dalam cawan petri steril dan disimpan dalam refrigerator.
Bentuk dan ukuran mikrokapsul probiotik
Untuk mengetahui bentuk mikrokapsul digunakan mikroskop cahaya sedangkan untuk menghitung ukuran mikrokapsul digunakan mikroskop okuler yang dilengkapi dengan mikrometer. Perhitungan ukuran mikrokapsul dilakukan pada kurang lebih 30 butir dengan pembacaan sebanyak 3 kali pada setiap butir (Lampiran 4). Diameter mikrokapsul yang terbaca kemudian dimasukkan ke dalam rumus berikut:
Ukuran mikrokapsul (µm) =
Pengujian sintasan probiotik (Gebara et al. 2013)
Sintasan probiotik ditentukan dengan menghitung jumlah sel sebelum dan setelah proses mikroenkapsulasi. Mikrokapsul probiotik sebanyak 1 g didisintegrasikan ke dalam 9 mL (b/v) larutan natrium sitrat (Merck, Germany) 2% steril (pH 7.0) kemudian dihomogenisasi menggunakan vorteks (Vortex Genie 2, Scientific Industries Inc., USA) selama 5 menit (Krasaekoopt et al. 2004). Selanjutnya probiotik yang sudah keluar dari mikrokapsul lalu dihitung menggunakan metode BAM (2001) dan dinyatakan sebagai rendemen enkapsulasi (RE). RE merupakan jumlah sel bakteri yang dapat bertahan hidup selama proses mikroenkapsulasi dan selama berada di dalam mikrokapsul yang dihitung dengan rumus berikut (Zanjani et al. 2014):
RE (%) = (N/N0) x 100 Keterangan :
N : jumlah sel probiotik hidup dalam cfu g-1 mikrokapsul N0 : jumlah sel probiotik hidup dalam cfu mL-1 kultur
Pengujian ketahanan panas probiotik (Mandal et al. 2006)
Pengujian ketahanan panas terhadap probiotik bebas dan terenkapsulasi dilakukan dengan menambahkan sel probiotik masing-masing sebanyak 1 mL sel bebas dan 1 g mikrokapsul ke dalam 9 mL akuades steril dan dihomogenisasi menggunakan vorteks (Vortex Genie 2, Scientific Industries Inc., USA).
Selanjutnya larutan tersebut dipanaskan pada suhu 60, 65, dan 70 oC dengan waterbath selama 20 menit, lalu didinginkan pada suhu ruang. Selanjutnya sintasan probiotik dianalisis berdasarkan prosedur Gebara et al. (2013).
Ketahanan probiotik terhadap pH 2 dan garam empedu 0.5% (Modifikasi Nuraida et al. 2012b)
Sebanyak 1 mL sel probiotik bebas dan 1 g mikrokapsul masing-masing ditambahkan ke dalam tabung yang berisi 9 mL MRSB pH rendah (pH 2) dengan menambahkan larutan HCl (Merck, Germany) 0.1 M kemudian dihomogenisasi dengan menggunakan vorteks (Vortex Genie 2, Scientific Industries Inc., USA),
14
untuk pengujian ketahanan terhadap pH rendah. Selanjutnya tabung-tabung tersebut diinkubasi selama 5 jam pada suhu 37 oC. Perhitungan jumlah koloni probiotik dilakukan pada jam ke 0 dan jam ke 5 berdasarkan prosedur Gebara et al. (2013). Prosedur yang sama juga dilakukan untuk pengujian ketahanan probiotik terhadap garam empedu (Merck, Germany) 0.5%.
Pengujian aktivitas antimikroba probiotik terhadap E. coli ATCC 25922 (Modifikasi Nuraida et al. 2012a)
Uji aktivitas antimikroba probiotik dilakukan dengan metode kontak. Sampel sel probiotik terenkapsulasi sebelumnya dikeluarkan terlebih dahulu dari mikrokapsul dengan cara dilarutkan dalam larutan natrium sitrat (Merck, Germany) 2%. Sebanyak 0.2 mL E. coli ATCC 25922 (105 cfu mL-1) dan 0.2 mL probiotik bebas (1010 cfu mL-1) dan terenkapsulasi (1010 cfu mL-1) masing-masing diinokulasikan ke dalam 20 mL larutan susu skim (Sunlack, Malay) steril dalam erlenmeyer 50 mL. Sehingga di dalam susu mengandung 103 cfu mL-1 E. coli ATCC 25922 dan 108 cfu mL-1 probiotik. Selanjutnya seluruh erlenmeyer tersebut dihomogenisasi dengan cara digoyang-goyangkan secara manual hingga merata, lalu diinkubasi selama 24 jam pada suhu 37 oC. Jumlah E. coli ATCC 25922 dan probiotik dihitung pada waktu kontak 0 dan 24 jam waktu inkubasi dengan metode tuang cawan masing-masing menggunakan media tumbuh EMBA (Oxoid Ltd., England) dan MRSA (Oxoid Ltd., England).
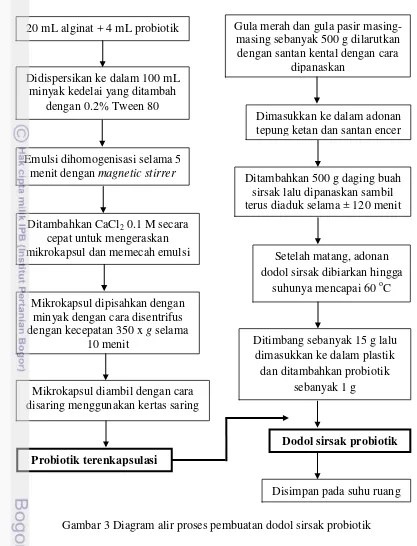
Pembuatan dodol sirsak probiotik
15
Gambar 3 Diagram alir proses pembuatan dodol sirsak probiotik
Pengukuran aw dan pH dodol sirsak probiotik (SNI 1992)
Dodol sirsak probiotik kemudian diukur nilai aw dan pH nya. Pengukuran aw dilakukan dengan menggunakan aw meter yang telah dikalibrasi sebelumnya. Sampel ditimbang seberat kurang lebih 1 g dan diletakkan dalam cawan pengukur lalu alat ditutup dan dikunci, alat dioperasikan sampai menunjukkan tanda selesai (completed)kemudian nilai aw dapat dibaca.
Pengukuran pH dodol sirsak probiotik dilakukan dengan menggunakan alat pH-meter. Sebelum digunakan, alat pH meter distandarisasi terlebih dahulu menggunakan larutan buffer pH 4 dan pH 7. Sekitar 15 g sampel dodol sirsak terus diaduk selama ± 120 menit
16
dihancurkan terlebih dahulu lalu dimasukkan ke dalam gelas piala yang berisi akuades sebanyak 50 mL. Elektroda pH meter ditancapkan ke dalam gelas piala yang berisi larutan sampel tersebut, kemudian dilakukan pembacaan pH sampel hingga mencapai nilai yang tetap.
Pengukuran kadar gula dengan metode Luff Schoorl (SNI 1992)
Tahapan Luff Schoorl terdiri dari pembuatan larutan Luff, standardisasi larutan natrium tiosulfat, dan pengujian sampel.
Pembuatan Larutan Luff
Sebanyak 25 g CuSO4·5H2O ditambah dengan 100 mL akuades dicampur dengan 50 g asam sitrat yang sudah dilarutkan dengan 50 mL akuades. Kemudian disiapkan 143.8 g Na2CO3 anhidrat dan ditambahkan dengan 300 mL akuades. Selanjutkan dilakukan pencampuran larutan CuSO4·5H2O dan larutan sitrat ke dalam larutan Na2CO3 secara perlahan sambil dihomogenisasi dengan melakukan pengadukan. Larutan dibiarkan semalam sebelum digunakan.
Standardisasi Tiosulfat
Dimulai dengan penimbangan 0.5 g K2CrO7 untuk ditepatkan pada labu takar dengan penambahan 100 mL akuades. Selanjutnya sebanyak 25 mL larutan diambil dan dimasukkan ke dalam erlenmeyer, lalu ditambah 10 mL KI, 25 mL HCl dan akuades sampai volume keseluruhan mencapai 200 mL. Selanjutnya dilakukan titrasi dengan natrium tiosulfat sebagai titran sampai warna larutan berubah menjadi warna kuning. Kemudian larutan yang sama ditambahkan indikator pati dan dititrasi kembali dengan larutan natrium tiosulfat sampai terjadi perubahan warna larutan menjadi hijau toska. Tahapan ini dilakukan sebanyak tiga kali ulangan.
Pengujian Sampel
Sampel dodol ditimbang kurang lebih sebanyak 5 g dan ditambahkan larutan HCl 5 % sebanyak 50 mL, kemudian dididihkan dengan suhu tetap selama 3 jam. Sampel yang telah dididihkan selanjutnya dinetralkan terlebih dahulu. Pemeriksaan kenetralan sampel dilakukan menggunakan pH meter dan dapat dilakukan penambahan NaOH 0.1 N serta asam lemah seperti asam asetat 0.1 N sampai kisaran pH 7. Selanjutnya sampel disaring. Diambil 10 mL larutan sampel dan ditambahkan 25 mL larutan Luff. Sampel ini kemudian dididihkan selama 13 menit hingga dihasilkan endapan merah yang merupakan hasil reduksi CuO menjadi Cu2O. Sebelum tahapan titrasi, sampel ditambahkan dengan 15 mL larutan KI 20% dan 25 mL larutan H2SO4 25 % yang menyebabkan perubahan warna dari warna biru menjadi warna coklat kegelapan. Titrasi secepatnya dengan larutan natrium tiosulfat. Penambahan indikator amilum pada pertengahan proses titrasi menyebabkan perubahan warna dari warna coklat kegelapan menjadi biru kehitaman. Setelah dititrasi warna larutan akan berubah menjadi warna putih susu. Tahapan ini dilakukan sebanyak dua kali ulangan.
Untuk menentukan mg gula yang terkandung pada 1 mL natrium tiosulfat yang digunakan, dihitung dengan rumus berikut:
17
Keterangan:
W1 : Glukosa yang terkandung untuk mL tiosulfat yang dipergunakan (mg) a : Jumlah mL natrium tiosulfat 0.1 N
V2 : Volume natrium tiosulfat dalam pengukuran blanko V1 : Volume natrium tiosulfat dalam pengukuran sampel
Δb : Selisih dengan nilai glukosa sebelumnya b : Nilai glukosa pada tabel Luff Schoorl
Kadar gula dalam sampel dihitung menggunakan rumus berikut(Lampiran 5):
Keterangan:
W1 : Glukosa yang terkandung pada 1 mL tiosulfat yang dipergunakan (mg)
W : Bobot sampel (mg) FP : Faktor pengenceran
Pengukuran kadar air dengan metode Oven (AOAC 1995)
Cawan alumunium yang digunakan untuk mengukur sampel terlebih dahulu dikeringkan dengan oven. Cawan alumunium yang telah kering kemudian didinginkan dengan cara dimasukkan ke dalam desikator lalu ditimbang. Sampel dodol sebanyak kurang lebih 5 g dimasukkan ke dalam cawan kemudian dikeringkan menggunakan oven pada suhu 100 oC selama 6 jam atau sampai berat sampel konstan. Selanjutnya cawan beserta sampel didinginkan menggunakan desikator lalu ditimbang. Kadar air dapat dihitung dengan rumus berikut (Lampiran 6):
Pengukuran viabilitas probiotik dan total kapang khamir selama penyimpanan dodol sirsak probiotik (Modifikasi BAM 2001)
18
sebanyak 14 mL liter-1 dan diinkubasi selama 5 hari pada suhu ruang (kurang lebih 30 oC).
Analisis data
Data merupakan nilai rata-rata dari dua ulangan dan dikonversi menjadi log cfu ml-1 atau g-1. Data dianalisis menggunakan analisis sidik ragam atau ANOVA (Analysis of variance) dengan software SPSS 15. Apabila hasil ANOVA menunjukkan adanya perbedaan pada perlakuan maka dilanjutkan dengan uji beda nyata Duncan pada taraf nyata 5%.
HASIL DAN PEMBAHASAN
Bentuk dan Ukuran Mikrokapsul Probiotik
Mikrokapsul probiotik yang dibuat dengan metode emulsi menggunakan minyak kedelai dan alginat selanjutnya dilihat bentuk dan sebaran ukuran setiap butir menggunakan mikroskop cahaya yang dilengkapi dengan mikrometer pada lensa okulernya atau disebut juga mikroskop okuler. Bentuk mikrokapsul dapat dilihat pada Gambar 4. Mikrokapsul probiotik yang terlihat dari mikroskop okuler dengan perbesaran 20 kali, memiliki bentuk yang cenderung bulat. Mortazavian et al. (2007) melaporkan bahwa setiap mikrokapsul terdiri dari lapisan hidrokoloid yang menyelimuti sel. Mikrokapsul secara geometri biasanya berbentuk bulat hingga bulat panjang, sehingga dapat disebut microsphere.
Gambar 4 Bentuk mikrokapsul probiotik di bawah mikroskop okuler (perbesaran 20x)
19
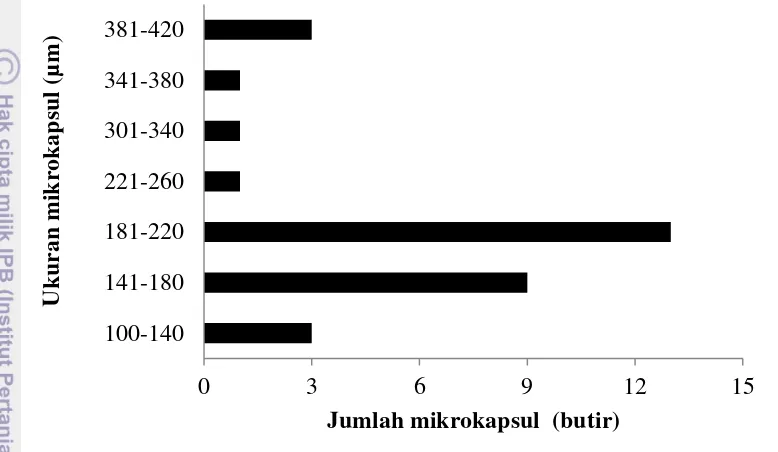
lainnya berukuran 100-180µm dan sisanya (sekitar 35.3%) berukuran 221-380µm. Seperti yang dilaporkan oleh beberapa penelitian sebelumnya bahwa mikrokapsul yang dihasilkan dari proses mikroenkapsulasi dengan metode emulsi menggunakan campuran probiotik dan natrium alginat serta minyak sayur kemudian ditambah CaCl2 sebagai pengeras kapsul, memiliki kisaran ukuran diameter antara 70-500μm (Zanjani et al. 2012).
Gambar 5 Sebaran ukuran mikrokapsul probiotik
Rendemen Sel Probiotik Setelah Enkapsulasi
Gambar 6 menunjukkan bahwa rendemen enkapsulasi (RE) sel probiotik dengan metode emulsi menggunakan natrium alginat sebanyak 3%, menghasilkan rendemen yang tinggi baik untuk L. acidophilus 2B4 maupun L. rhamnosus R23 yaitu sebesar 95.4-95.6%. Rendemen enkapsulasi (RE) dihitung berdasarkan jumlah sel probiotik yang hidup setelah proses mikroenkapsulasi dibagi dengan jumlah sel bebas yang ditambahkan pada campuran biopolimer selama proses mikroenkapsulasi. Berdasarkan hasil analisis statistik (Lampiran 7), viabilitas probiotik sebelum dan setelah proses mikroenkapsulasi tidak berpengaruh secara nyata (p>0.05) terhadap jumlah sel probiotik.
Hal tersebut menunjukkan bahwa mikroenkapsulasi tidak menyebabkan penurunan jumlah sel probiotik secara signifikan terhadap sel probiotik karena mikroenkapsulasi dengan metode emulsi ini tidak menggunakan bahan-bahan perlakuan dan dapat mempengaruhi sintasan sel probiotik. Mikroenkapsulasi merupakan suatu proses dimana sel probiotik dilindungi dengan cara penyalutan membran untuk mengurangi sel yang hilang. Selain itu, mikroenkapsulasi dengan metode emulsi juga dapat meningkatkan RE probiotik hingga 80-95% (Krasaekoopt et al. 2003). Sebagai perbandingan, enkapsulasi L. casei menggunakan natrium alginat dengan metode ekstrusi yang dilakukan oleh Sandoval et al. (2010) menghasilkan angka efisiensi enkapsulasi yang lebih
20
rendah yaitu antara 54.3-79.2%. Zanjani et al. (2014) juga melaporkan dimana mikroenkapsulasi dengan metode emulsi pada strain probiotik L. casei dan Bifidobacterium bifidum yang dienkapsulasi dengan natrium alginat menggunakan metode emulsi menghasilkan rendemen sebesar 97.4%.
Gambar 6 Viabilitas sel probiotik L. acidophilus 2B4 dan L. rhamnosus R23 setelah mikroenkapsulasi menggunakan natrium alginat dengan metode emulsi. Batang histogram yang sama yang diikuti oleh huruf yang sama (a) menunjukkan tidak ada perbedaan yang nyata pada taraf 5% (p>0.05).
Sintasan Probiotik Selama Pemaparan Panas
Perlakuan pemanasan (60, 65, dan 70 oC) selama 20 menit memberikan pengaruh yang berbeda terhadap sintasan probiotik bebas dan terenkapsulasi. Gambar 7 menunjukkan bahwa mikroenkapsulasi dengan metode emulsi dapat meningkatkan sintasan L. acidophilus 2B4 dan L. rhamnosus R23 selama pemaparan dengan panas.
21
dilihat bahwa paparan panas dengan suhu 60 oC menyebabkan penurunan jumlah sel yang cukup besar pada probiotik bebas baik pada L. acidophilus 2B4 maupun pada L. rhamnosus R23 yaitu sebesar 4.0 dan 3.9 log cfu g-1. Demikian pula pada pemaparan suhu 65 dan 70 oC yang juga menyebabkan penurunan jumlah sel yang lebih besar terhadap probiotik bebas. Hal tersebut menunjukkan bahwa semakin tinggi suhu pemaparan panas terhadap probiotik bebas menyebabkan penurunan sintasan yang semakin besar. Mikroenkapsulasi dengan metode emulsi dapat meningkatkan sintasan probiotik (Gambar 7) bahwa sintasan probiotik terenkapsulasi yang mendapat paparan panas dengan suhu 60 oC baik pada L. acidophilus 2B4 maupun L. rhamnosus R23 penurunan jumlah sel yang hidup masing-masing sebesar 2.7 dan 3.2 log cfu g-1. Dari data tersebut dapat dilihat bahwa strain L. acidophilus 2B4 terenkapsulasi memiliki ketahanan terhadap panas yang lebih baik dibandingkan dengan L. rhamnosus R23.
Gambar 7 Sintasan probiotik selama pemaparan panas L. acidophilus 2B4 dan L. rhamnosus R23 bebas dan terenkapsulasi. Batang histogram yang sama yang diikuti oleh huruf yang berbeda (a-c) berbeda nyata (p<0.05) pada strain yang sama dan suhu yang berbeda. Batang histogram yang sama yang diikuti oleh huruf yang berbeda (p-r) berbeda nyata (p<0.05) pada suhu yang sama dan strain yang berbeda.
Ketahanan Probiotik terhadap pH Rendah dan Garam Empedu
22
(a)
(b)
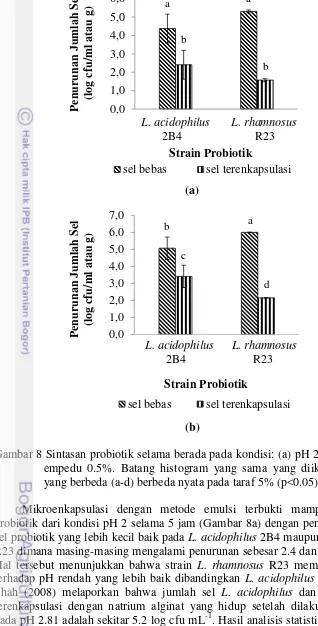
Gambar 8 Sintasan probiotik selama berada pada kondisi: (a) pH 2 dan (b) garam empedu 0.5%. Batang histogram yang sama yang diikuti oleh huruf yang berbeda (a-d) berbeda nyata pada taraf 5% (p<0.05).
Mikroenkapsulasi dengan metode emulsi terbukti mampu melindungi probiotik dari kondisi pH 2 selama 5 jam (Gambar 8a) dengan penurunan jumlah sel probiotik yang lebih kecil baik pada L. acidophilus 2B4 maupun L. rhamnosus R23 dimana masing-masing mengalami penurunan sebesar 2.4 dan 1.6 log cfu g-1. Hal tersebut menunjukkan bahwa strain L. rhamnosus R23 memiliki ketahanan terhadap pH rendah yang lebih baik dibandingkan L. acidophilus 2B4. Ding dan Shah (2008) melaporkan bahwa jumlah sel L. acidophilus dan L. rhamnosus terenkapsulasi dengan natrium alginat yang hidup setelah dilakukan pengujian pada pH 2.81 adalah sekitar 5.2 log cfu mL-1. Hasil analisis statistik (Lampiran 9) menunjukkan bahwa perlakuan mikroenkapsulasi berpengaruh nyata (p<0.05) terhadap sintasan probiotik pada kondisi pH 2. Hal tersebut dikarenakan jaringan
23
hidrogel (alginat) yang dibentuk oleh bahan enkapsulan dapat mereduksi kecepatan difusi asam ke dalam mikrokapsul (Shi et al. 2013).
Mikroenkapsulasi juga mampu melindungi probiotik ketika berada pada kondisi garam empedu 0.5% selama 5 jam (Gambar 8b), dimana pada kondisi tersebut L. acidophilus 2B4 dan L. rhamnosus R23 terenkapsulasi mengalami penurunan sintasan yang lebih kecil dari sel bebas, masing-masing sebesar 3.4 dan 2.1 log cfu g-1. Hasil analisis statistik (Lampiran 10) menunjukkan bahwa probiotik terenkapsulasi memiliki ketahanan yang lebih baik (p<0.05) terhadap garam empedu 0.5% selama 5 jam dibandingkan dengan probiotik bebas. Mandal et al. (2006) yang menggunakan konsentrasi garam empedu lebih tinggi dari penelitian ini yaitu sebanyak 1% selama 12 jam juga mengungkapkan bahwa mikroenkapsulasi menggunakan alginat dengan metode emulsi dapat memperbaiki viabilitas sel dibandingkan sel bebas (jumlah sel bebas menurun dari 9.45 menjadi 7.29 log cfu mL-1).
Kim et al. (2008) melaporkan hal serupa, dimana mikroenkapsulasi dengan metode pengeringan beku menggunakan natrium alginat dapat meningkatkan sintasan L. acidophilus ATCC 43121 yaitu pada sel probiotik bebas sintasannya menurun dari 7.1 x106 menjadi 9.2x105 cfu mL-1 pada konsentrasi garam empedu 0.5% selama 24 jam, sedangkan sel yang dienkapsulasi tidak mengalami penurunan dari jumlah sel awal yaitu sekitar 7.1x106 cfu mL-1. Mokarram et al. (2009) juga melaporkan bahwa formasi hidrogel yang menyelimuti sel probiotik diduga menjadi basis perlindungan sel, dimana larutan asam dan garam empedu perlu menembus melewati lapisan gel tersebut terlebih dahulu sebelum mencapai sel probiotik.
Aktivitas Antimikroba Probiotik terhadap E. coli ATCC 25922
24
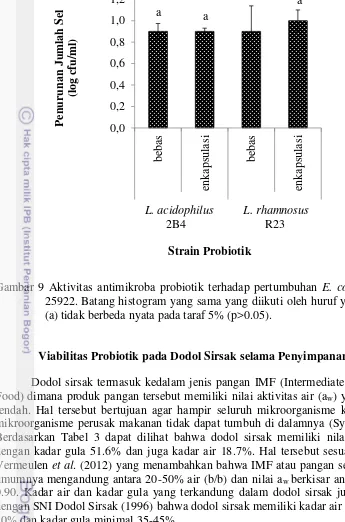
Gambar 9 Aktivitas antimikroba probiotik terhadap pertumbuhan E. coli ATCC 25922. Batang histogram yang sama yang diikuti oleh huruf yang sama (a) tidak berbeda nyata pada taraf 5% (p>0.05).
Viabilitas Probiotik pada Dodol Sirsak selama Penyimpanan
Dodol sirsak termasuk kedalam jenis pangan IMF (Intermediate Moisture Food) dimana produk pangan tersebut memiliki nilai aktivitas air (aw) yang lebih rendah. Hal tersebut bertujuan agar hampir seluruh mikroorganisme khususnya mikroorganisme perusak makanan tidak dapat tumbuh di dalamnya (Sych 2003). Berdasarkan Tabel 3 dapat dilihat bahwa dodol sirsak memiliki nilai aw 0.77 dengan kadar gula 51.6% dan juga kadar air 18.7%. Hal tersebut sesuai dengan Vermeulen et al. (2012) yang menambahkan bahwa IMF atau pangan semi basah umumnya mengandung antara 20-50% air (b/b) dan nilai aw berkisar antara 0.65-0.90. Kadar air dan kadar gula yang terkandung dalam dodol sirsak juga sesuai dengan SNI Dodol Sirsak (1996) bahwa dodol sirsak memiliki kadar air maksimal 20% dan kadar gula minimal 35-45%.
Tabel 3 Karakteristik dodol sirsak
25
Sesuai dengan metode penelitian, dodol sirsak yang telah matang selanjutnya diinkorporasi dengan probiotik baik probiotik bebas maupun probiotik terenkapsulasi kemudian dilakukan analisis terhadap perubahan nilai pH, aw, viabilitas probiotik serta total kapang khamir selama penyimpanan 4 minggu. Hasil pengujian perubahan pH dan aw dodol sirsak probiotik dapat dilihat pada Tabel 4 dan 5.
Kisaran nilai pH dodol sirsak (Tabel 4) dengan penambahan probiotik dibandingkan dengan kontrol tidak berbeda secara signifikan, berkisar antara 4.4-4.6. Hal tersebut menunjukkan bahwa penambahan probiotik ke dalam pangan tidak mempengaruhi pH dari pangan tersebut. Menurut Fahimnadesh et al. (2012) perubahan pH yang tidak signifikan pada produk pangan yang telah ditambah dengan mikrokapsul probiotik, dapat disebabkan oleh adanya dinding kapsul alginat yang mengakibatkan proses penyerapan nutrisi untuk proses metabolisme probiotik menjadi lambat sehingga proses rilis senyawahasil metabolit yang dapat menyebabkan perubahan pH pada produk juga ikut melambat.
Tabel 4 pH dodol sirsak probiotik selama penyimpanan
Perlakuan Lama Penyimpanan (minggu)
Perubahan aw dodol sirsak probiotik dan kontrol selama penyimpanan dapat dilihat pada Tabel 5. Data pada Tabel 5 tersebut menunjukkan bahwa probiotik yang berada di dalam dodol sirsak tidak mempengaruhi perubahan aw secara signifikan. Dodol sirsak memiliki aw rendah yaitu berkisar antara 0.77-0.85, dimana kisaran nilai tersebut merupakan kondisi yang dapat memicu pertumbuhan kapang dan khamir selama penyimpanan.
26
Tabel 5 Nilai aw dodol sirsak probiotik selama penyimpanan
Perlakuan Lama Penyimpanan (minggu) memiliki sensitivitas yang berbeda pula terhadap kondisi lingkungannya terutama untuk mikroorganisme yang diinkorporasi ke dalam produk pangan, yakni dalam hal keasaman atau pH produk pangan, proses metabolisme produk pangan itu sendiri, suhu, kadar air, hingga pangan tersebut berada dalam kondisi saluran pencernaan. Telah dilaporkan pula oleh Ezpinoza et al. (2010) bahwa suhu optimum untuk probiotik dapat bertahan hidup adalah pada kisaran suhu 35-40 oC. Hal tersebut yang diduga menjadi salah satu penyebab menurunnya jumlah sel probiotik ketika diinkorposari ke dalam dodol sirsak.
Penurunan jumlah sel probiotik bebas yang cukup besar pada minggu pertama penyimpanan diduga karena sel bebas tidak mampu bertahan hidup di dalam kondisi lingkungan dodol sirsak yang memiliki karakteristik seperti kadar gula tinggi (51.6%), kadar air rendah (18.6%) dan aw yang rendah yakni sekitar 0.81. Probiotik bebas hanya mampu bertahan dalam kondisi dengan keberadaan gula sederhana, kadar air tinggi dan juga nilai aw diatas 0.9. Sehingga hal tersebut menjadi salah satu faktor yang dapat menyebabkan penurunan jumlah sel probiotik selama penyimpanan dodol sirsak. pH dodol sirsak probiotik cenderung stabil selama penyimpanan yaitu pada kisaran angka 4.4-4.6 sehingga dapat dipastikan bahwa kondisi tersebut tidak mengganggu probiotik selama berada dalam dodol sirsak karena probiotik mampu hidup pada kisaran pH tersebut. Ezpinoza et al. (2010) melaporkan bahwa Lactobacillus acidophilus berperan penting dalam saluran pencernaan dan merupakan kelompok lactobacilli yang paling banyak terdapat di dalam saluran pencernaan manusia sehat. Oleh karena itu L. acidophilus menjadi mikroorganisme yang paling banyak diaplikasikan untuk produk-produk probiotik. Selain itu, isolat ini dapat tumbuh pada media yang memiliki pH 4.5-6.4, namun pertumbuhannya akan berhenti pada pH 3.6-4.0.
27
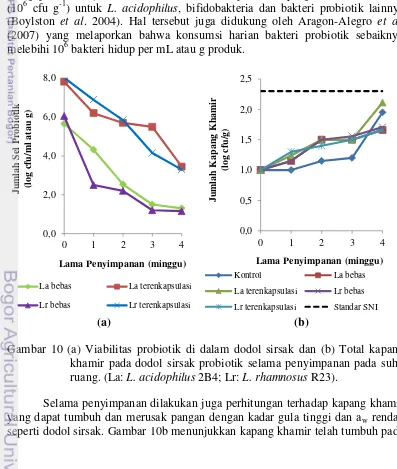
Mikroenkapsulasi dapat melindungi sel probiotik bebas selama berada dalam kondisi ekstrim seperti pada dodol sirsak yang mengandung kadar gula tinggi. Gambar 10a menunjukkan bahwa probiotik terenkapsulasi hanya mengalami penurunan sebesar 1.4 log cfu g-1 pada L. acidophilus 2B4 dan 2.2 log cfu g-1 pada L. rhamnosus R23 dari jumlah awal yang ditambahkan sebesar 9.2 dan 10.2 log cfu g-1 pada masing-masing strain sehingga jumlah sel yang hidup dalam dodol sirsak menjadi 7.9 dan 8.0 log cfu g-1. Jumlah sel probiotik selama penyimpanan dodol sirsak mengalami penurunan setiap minggunya, akan tetapi probiotik terenkpasulasi cenderung lebih stabil dibandingkan dengan probiotik bebas. Gambar 10a juga memperlihatkan bahwa dodol sirsak probiotik hanya dapat dikonsumsi dengan jumlah yang dibutuhkan (sekitar 106 cfu g-1) hingga umur 3 minggu untuk strain L. acidophilus 2B4 dan 2 minggu untuk strain L. rhamnosus R23. Hal tersebut sesuai dengan Krasaekoopt et al. (2003) dimana untuk mendapatkan manfaat kesehatan probiotik yaitu dengan jumlah sel yang hidup minimal 106-107 cfu g-1 per hari. Umumnya, industri pangan telah mengaplikasikan jumlah minimum konsumsi probiotik yang direkomendasikan (106 cfu g-1) untuk L. acidophilus, bifidobakteria dan bakteri probiotik lainnya (Boylston et al. 2004). Hal tersebut juga didukung oleh Aragon-Alegro et al. (2007) yang melaporkan bahwa konsumsi harian bakteri probiotik sebaiknya melebihi 106 bakteri hidup per mL atau g produk.
(a) (b)
Gambar 10 (a) Viabilitas probiotik di dalam dodol sirsak dan (b) Total kapang khamir pada dodol sirsak probiotik selama penyimpanan pada suhu ruang. (La: L. acidophilus 2B4; Lr: L. rhamnosus R23).
Selama penyimpanan dilakukan juga perhitungan terhadap kapang khamir yang dapat tumbuh dan merusak pangan dengan kadar gula tinggi dan aw rendah seperti dodol sirsak. Gambar 10b menunjukkan kapang khamir telah tumbuh pada
28
minggu pertama penyimpanan, bahkan meningkat dari 1.0-2.1 log cfu g-1 hingga akhir penyimpanan (minggu keempat). Hal tersebut menunjukkan bahwa dengan adanya probiotik di dalam dodol sirsak, tidak mampu menghambat pertumbuhan kapang khamir. Kapang khamir umumnya dapat tumbuh di dalam produk pangan dengan kadar gula tinggi dengan kisaran aw 0.85 atau kurang, juga mampu bertahan hidup pada kondisi pH 2 hingga diatas 9 dan dapat hidup pada kisaran suhu 10-35 oC (SNI 2009).
Pertumbuhan kapang khamir tersebut juga dapat menunjukkan umur simpan dodol sirsak probiotik itu sendiri. Gambar 10b juga menunjukkan bahwa umur simpan dodol sirsak probiotik hanya dapat bertahan hingga 3 minggu dengan total kapang khamir sekitar 2 log cfu g-1. Batasan cemaran mikroba pada dodol menurut SNI (2009) dan BPOM (2009) untuk kapang khamir adalah maksimal 2x102 cfu g-1. Jumlah kapang khamir yang terhitung dalam dodol sirsak probiotik tersebut masih berada dibawah batas aman cemaran kapang khamir pada dodol, sehingga produk tersebut masih aman untuk dikonsumsi. Kerusakan pada dodol tidak hanya dapat disebabkan karena adanyakapang khamir namun dodol juga dapat mengalami kerusakan seperti ketengikan akibat proses oksidasi senyawa aldehid dan peroksida yang berasal dari santan (Triwarsita et al. 2013).
SIMPULAN DAN SARAN
Mikroenkapsulasi dengan metode emulsi dapat meningkatkan sintasan probiotik baik terhadap suhu pemanasan (60, 65, dan 70 oC), pH rendah (pH 2), maupun garam empedu (0.5%). Mikroenkapsulasi juga dapat meningkatkan stabilitas probiotik yang ditambahkan ke dalam dodol sirsak selama penyimpanan pada suhu ruang. Mikroenkapsulasi dapat melindungi probiotik terhadap panas, dengan sintasan terbaik ditunjukkan oleh L. acidophilus 2B4 terenkapsulasi yang memiliki penurunan jumlah sel hidup lebih sedikit dibandingkan dengan L. rhamnosus R23. L. acidophilus 2B4 dan L. rhamnosus R23 terenkapsulasi juga memiliki ketahanan yang lebih baik pada kondisi pH 2 dan garam empedu 0.5% serta memiliki kemampuan aktivitas antimikroba yang sama terhadap E. coli ATCC 25922 dibandingkan dengan probiotik bebas. Probiotik terenkapsulasi dalam produk dodol sirsak jumlahnya lebih stabil dibandingkan dengan sel bebas. Jumlah probiotik yang dienkapsulasi dapat dipertahankan pada jumlah yang diperlukan (106 cfu g-1) selama 3 minggu untuk strain L. acidophilus 2B4 dan 2 minggu untuk strain L. rhamnosus R23, sedangkan probiotik bebas hanya mampu bertahan kurang dari 1 minggu.