STABILITAS TRANSGEN DAN EKSPRESI GEN
B11
PADA
TANAMAN TEMBAKAU TRANSGENIK GENERASI T
3TRI RATNASARI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul “Stabilitas Transgen dan Ekspresi Gen B11 pada Tanaman Tembakau Transgenik Generasi T3” adatlah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak terbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2015
Tri Ratnasari
RINGKASAN
TRI RATNASARI. Stabilitas Transgen dan Ekspressi Gen B11 pada Tanaman Tembakau Transgenik Generasi T3. Dibimbing oleh MIFTAHUDIN dan
ARIS TJAHJOLEKSONO.
Ion aluminium (Al3+) mendominasi tanah masam yang memiliki pH<5 dan toksik bagi akar tanaman karena selain dapat mengkelat unsur hara, Al3+ dapat merusak sistem perakaran sehingga menyebabkan tanaman mengalami defisiensi usunr hara dan menurunkan produksi tanaman. Beberapa varietas tanaman memiliki mekanisme toleransi terhadap cekaman Al. Tanaman pertanian seperti gandum memiliki mekanisme toleransi terhadap cekaman Al dengan melibatkan pelepasan asam organik seperti asam malat dan asam sitrat dari akar. Asam organik yang dilepaskan akan mengkelat dan mendetoksifikasi Al di zona rhizosfer. Padi merupakan tanaman serealia yang toleran terhadap cekaman Al. Roslim (2011) telah mempelajari dan mengidentifikasi bahwa padi lokal Indonesia var. Hawara Bunar berpotensi sebagai sumber gen toleran Al. Gen penyandi toleransi terhadap cekaman Al, yakni gen B11, telah berhasil diisolasi dari tanaman padi var. Hawara Bunar dan telah berhasil diintroduksikan ke dalam tanaman tembakau di bawah promotor 35S CaMV yang kemudian menghasilkan tanaman tembakau transgenik pembawa gen B11. Uji stabilitas tanaman tembakau transgenik pembawa gen B11 menunjukkan bahwa tanaman tembakau transgenik generasi pertama (T1) membawa copy gen B11 dan analisis fungsi gen B11 pada
tembakau transgenik T1 menunjukkan gen B11 dapat meningkatkan toleransi
tanaman tembakau terhadap cekaman Al. Tujuan dari penelitian ini adalah untuk memperoleh tanaman tembakau transgenik yang memiliki transgen B11 yang stabil pada generasi T2 dan T3 serta menganalisis ekspresi gen B11 dan gen-gen
lain (STOP1, ALMT1, MATE) yang terkait dengan toleransi terhadap cekaman Al. Biji tanaman tembakau transgenik diseleksi pada media MS yang mengandung higromisin selama 28 hari. Tanaman yang toleran selanjutnya di cek stabilitasnya dengan PCR menggunakan primer gen B11 dan hpt. Ekspresi relatif dari gen B11 dan gen-gen lain (STOP1, ALMT1, MATE) yang terkait dengan toleransi Al dianalisis dengan teknik qPCR.
Hasil penelitian menunjukkan bahwa 24 dari 26 nomor tanaman transgenik terpilih yang diseleksi mampu tumbuh pada medium selektif dengan rasio 3:1 untuk toleran:sensitif terhadap hygromicin. Di antara semua nomor yang diuji, terdapat dua nomor T3 secara konsisten menunjukkan 100% tumbuh pada media
selektif. Hal ini menunjukkan bahwa kedua nomor tersebut telah homozigot untuk gen hpt. Karena gen hpt terletak dekat dengan left border downstream gen B11, maka hal ini mengindikasikan bahwa gen B11 juga telah homozigot untuk kedua nomor tersebut. Analisis stabilitas genetik tanaman tembakau transgenik menunjukkan bahwa tanaman tembakau transgenik telah membawa gen B11
sampai generasi T3. Analisis ekspresi menunjukkan bahwa peningkatan ekspresi
gen B11 diikuti oleh peningkatan ekspresi dari gen STOP1, ALMT1 dan MATE, mengindikasikan adanya hubungan regulasi di antara gen-gen tersebut dalam merespon cekaman Al.
SUMMARY
TRI RATNASARI. Transgene Stability and the Expression of B11 Gene in T3 Generation of Transgenic Tobacco. Supervised by MIFTAHUDIN and ARIS
TJAHJOLEKSONO.
Aluminum (Al) is an abundant metal in the soil. Al3+ dominates in acid soil under pH<5 and is toxic to root plants due to Al3+ chelats nutrients and damages the root system, which causes the plants are susceptible to stress and mineral deficiency. Several varieties of agricultural crops have Al tolerance mechanisms. For example, wheat (Triticum aestivum L.) has Al stress tolerance mechanisms involving organic acids release such as malic acid and citric acid. The released of organic acid will chelate and detoxify Al in the rhizosphere thus prevent it to enter into the roots. Rice is an Al tolerant cereal crop. Roslim (2011) have studied and identified an Indonesian local rice var. Hawara Bunar that had potential as a source of Al tolerance gene. Al stress tolerance, called B11 gene, was isolated from rice var. Hawara Bunar and successfully introduced into tobacco plants under 35S CaMV promoter. The stability test to the transgenic tobacco carrying the B11 gene indicated that the first generation transgenic tobacco plants (T1)
carrying a copy of the gene. The gene function analysis in transgenic tobacco T1
showed that the B11 gene can increase the tolerance of the transgenic tobacco to Al stress. The objectives of the research were to obtain T3 stable transgenic
tobacco lines carrying homozygous B11 alleles and test the B11 role in regulating the expression of other genes (STOP1, ALMT1, MATE) that associated with Al tolerance.
The transgenic seeds were selected on hygromycin containing MS media for 28 days. The tolerant plants were then verified with PCR analysis using primers developed from the B11 gene sequence and hpt gen. The expressions of the B11
gene and the other genes were analyzed using qPCR technique.
The result showed that 24 lines out of 26 selected lines able to grow on selective medium with ratio of 3:1 for hygromicin tolerant to sensitive. Among these lines, 2 number of T3 lines showed consistently 100 % grow on selective
medium, which was indicated that both lines were homozygous for the htp gene. Since hpt gene is locates near the left border downstream the B11 gene, it is suggested that the B11 gene has also been homozygous for both lines. Genetic stability analysis in T2 and T3 transgenic tobacco plants shows that the transgenic
tobacco plants carried the B11 gene as well as the hpt gene. The gene expression analysis shows that the increasing expression of the B11 gene is followed by the increase of the expression of the STOP1, ALMT1 and MATE genes, which indicates that there is a regulation relationship between these four genes. The
STOP1 gene is suggested to be the regulator gene for the expression of the
ALMT1 and MATE, whereas the ALMT1 and MATE are the genes controlling malate and citrate secretion for the roots respectively. It is suggested that the B11
gene expression regulates the expression of the STOP1, ALMT1 ad MATE genes.
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
STABILITAS TRANSGEN DAN EKSPRESI GEN
B11
PADA
TANAMAN TEMBAKAU TRANSGENIK GENERASI T
3TRI RATNASARI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Biologi Tumbuhan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala rahmat dan karuniaNya, sehingga penulis dapat menyelesaikan karya ilmiah ini dengan judul Stabilitas Transgen dan Ekspresi Gen B11 pada Tanaman Tembakau Transgenik Generasi T3. Pada kesempatan ini, penulis mengucapkan terima kasih
kepada Dr. Ir. Miftahudin, M.Si dan Dr. Ir. Aris Tjahjoleksono, DEA selaku komisi pembimbing yang telah memberikan bimbingan dan arahan serta dorongan semangat selama proses penelitian sehingga karya ilmiah ini dapat diselesaikan dengan baik. Ungkapan terima kasih juga penulis ucapkan kepada seluruh dosen dan staf Program Studi Biologi Tumbuhan, rekan kerja laboratorium Fisiologi dan Genetika Tumbuhan, dan seluruh rekan BOT 2011.
Penelitian ini terselenggara atas biaya dari Hibah Penelitian Kerjasama Luar Negeri dan Publikasi Internasional tahun 2014-2015 dari DP2M DIKTI, Kementerian Riset, Teknologi dan Pendidikan Tinggi atas nama Dr. Ir. Miftahudin, MSi. Atas dana yang diberikan kami ucapkan terima kasih.
Ucapan terima kasih yang tak terhingga kepada Ibu, Ayah, dan suami saya Hendy Wahyu Kusuma Aji, serta seluruh keluarga atas segala doa dan dukungan selama penulis menjalani program Magister Sains di Institut Pertanian Bogor.
Akhir kata, semoga karya ilmiah ini bermanfaat.
Bogor, Agustus 2015
Tri Ratnasari
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 3
TINJAUAN PUSTAKA 4
Tanah Masam dan Keracunan Aluminium pada Tanaman 4 Mekanisme Toleransi Aluminium pada Tanaman 5
Gen Toleran Aluminium 6
Tembakau sebagai Model Tanaman untuk Mempelajari Fungsi Gen 7
Real time PCR 8
BAHAN DAN METODE 10
Tempat dan Waktu Penelitian 10
Bahan Penelitian 10
Metode 10
Seleksi Biji dan Pembentukan Tanaman T3 10
Perlakuan Cekaman Al 10
Identifikasi Stabilitas Transgen Tanaman Transgenik 11
Isolasi total RNA 11
Reverse Transcription-Polymerase Chain Reaction (RT-PCR) 11
Real-Time PCR (qPCR) 12
Validitas Quantitative Real Time PCR untuk Analisis Ekspresi Gen 12
Analisis Data 12
HASIL DAN PEMBAHASAN 13
Seleksi Biji Tembakau Transgenik Generasi T2 dan T3 13
Stabilitas Transgen pada Generasi T2 dan T3 16
Analisis Cekaman Aluminium pada Tanaman Tembakau Transgenik
Generasi T3 18
Analisis Ekspresi Gen pada Tanaman Tembakau Transgenik Generasi T3 20
SIMPULAN 24
Simpulan 24
DAFTAR PUSTAKA 25
LAMPIRAN 31
DAFTAR TABEL
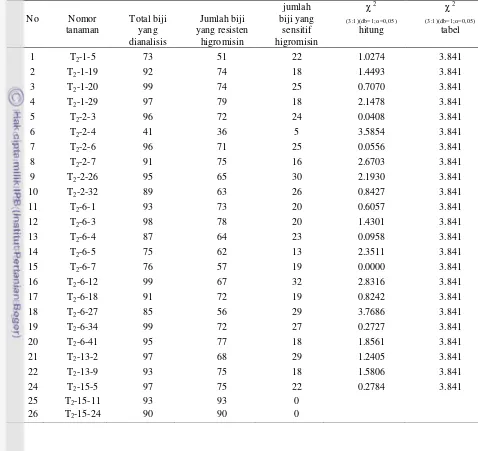
1 Rasio pewarisan sifat resisten higromisin dari 26 nomor tembakau
transgenik T2 15
2 Rasio pewarisan sifat resisten higromisin pada T3 dari 17 nomor
tembakau transgenik 16
DAFTAR GAMBAR
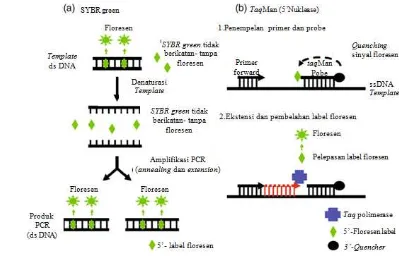
1 Prinsip kerja SBYR green (a) dan TaqMan probe (b) 9 2 Peta linier vektor ekspresi pGWB5 pembawa gen B11 10 3 Seleksi antibiotik pada media MS + VitB5 + 50 µg/ml higromisin 14 4 Profil hasil PCR 20 nomor T2 terpilih menggunakan primer gen B11 16
5 Profil hasil PCR 20 nomor T2 terpilih menggunakan primer gen hpt 17
6 Profil hasil PCR 5 nomor T3 terpilih menggunakan primer gen B11 (A)
dangen hpt (B) 18
7 Respon tembakau tipe liar (TL) dan transgenik (T) terhadap cekaman 8.1 ppm Al pada pH 4.1 selama 21 hari 19 8 Tembakau tipe liar tanpa cekaman (TL-Al), tembakau tipe liar dicekam
Al 21 hari (TL+Al), tembakau transgenik tanpa cekaman (T-Al),
tembakau transgenik dicekam Al 21 hari (T+Al) 19 9 Ekspresi relatif gen B11 pada tanaman tembakau transgenik tanpa
cekaman (T-Al), dan tanaman tembakau transgenik dicekam Al 8,1 ppm
selama 24 jam (T+Al) 21
10 Ekspresi relatif gen ALMT1 (A), MATE (B), STOP1(C) 22
DAFTAR LAMPIRAN
PENDAHULUAN
Latar Belakang
Aluminium (Al) merupakan logam yang melimpah di dalam tanah. Ketika pH tanah < 5 Al akan menjadi lebih terlarut sehingga menjadi toksik bagi tanaman. Aluminium merupakan salah satu faktor utama yang membatasi pertumbuhan tanaman pada tanah masam, sehingga dapat menurunkan produksi tanaman pertanian (Samac dan Tesfaye 2003). Delhaize dan Ryan (1995) mengatakan bahwa unsur hara seperti fosfor (P) yang terkelat oleh Al akan sulit atau bahkan tidak dapat diserap oleh akar tanaman, sehingga tanaman kekurangan hara tersebut dan pertumbuhan menjadi terhambat. Penelitian lain melaporkan bahwa Al dapat menghambat pembelahan sel dan pemanjangan akar (Kochian 1995; Ma dan Hiradate 2000). Hal ini berkaitan dengan kemampuan Al dalam berinteraksi dengan komponen di dalam dinding sel akar. Selain itu Al juga dapat menghentikan proses mitosis (Matsumoto 2000). Akibat selanjutnya Al dapat menurunkan dan merusak sistem perakaran yang menyebabkan tanaman rentan terhadap cekaman kekeringan dan mengalami defisiensi unsur hara (Kochian 1995; Samac dan Tesyafe 2003; Kochian et al. 2004).
Di sisi lain, ada beberapa varietas tanaman yang toleran terhadap cekaman Al. Tanaman ini menunjukkan pertumbuhan akar yang baik ketika ditumbuhkan pada tanah berkelarutan Al tinggi. Tanaman pertanian seperti gandum (Triticum aestivum L.) memiliki mekanisme toleransi cekaman Al yang melibatkan pelepasan asam organik seperti asam malat (Delhaize et al. 1993) dan asam sitrat (Li et al. 2000). Asam organik yang dilepaskan akan mengkelat dan mendetoksifikasi Al pada rhizosfer sehingga mencegahnya masuk ke dalam akar tanaman gandum (Delhaize et al. 1993; Sasaki et al. 2002). Pelepasan asam organik dari akar dikendalikan secara genetik. ALMT1 (aluminum activated malat transpoter) dan MATE (multidrug and toxic compound extrusion) berturut-turut adalah gen-gen yang berperan dalam pengeluaran asam malat dan asam sitrat dari akar. Kedua gen tersebut merupakan gen yang terlibat dalam toleransi cekaman Al pada beberapa tanaman. Hal ini terkait dengan kemampuan asam malat dan asam sitrat dalam mendetoksifikasi Al di rhizosfer (Ma et al. 2014). Selain kedua gen tersebut, pada tanaman Arabidopsis terdapat gen STOP1 (sensitive to proton rhizotoxicity1) yang diidentifikasi sebagai gen yang berperan dalam toleransi terhadap cekaman Al dan mampu meregulasi ekspresi gen ALMT1 dan MATE
pada tanaman (Ohyama et al 2013).
2
STAR1 dan STAR2 menyandikan domain transmembran dari protein transporter ABC. Protein ini membentuk suatu kompleks protein transporter ABC yang mentranspor UDP-glukosa dalam memodifikasi dinding sel sehingga menurunkan akumulasi Al pada dinding sel (Huang et al. 2009). OsFRDL4 adalah gen yang berperan dalam pelepasan asam sitrat pada tanaman padi (Yokosho et al. 2011).
OsCDT3 terletak pada plasma membran yang berperan dalam menghentikan masuknya Al ke dalam sel akar. Ekspresi OsCDT3 meningkat pada tanaman yang dicekam Al dan tidak demikian pada cekaman logam lain dan pH rendah (Xia et al. 2013). Xia et al. (2010) melaporkan bahwa Nart1 adalah famili dari Narmp, berperan dalam transpor Al3+ menuju vakuola untuk detoksifikasi. OsALS1 terletak pada tonoplas, berperan dalam membawa Al trivalen dari sitoplasma ke dalam vakuola (Huang et al. 2012). Banyaknya gen yang mengendalikan toleransi cekaman Al pada padi membuat studi terhadap toleransi Al pada tanaman tersebut semakin kompleks.
Miftahudin et al. (2005) melaporkan bahwa terdapat homologi antara daerah Alt3 (gen yang mengendalikan toleransi Al) pada tanaman rye dengan klon BAC kromosom 3 padi. Penapisan marka berdasarkan sekuen BAC kromosom 3 padi pada rye menghasilkan 2 marka terpilih (B11 dan B26) yang mengalami ko-segregasi dengan lokus Alt3 yang mengindikasikan bahwa gen Alt3 berjarak sangat dekat dengan kedua marka tersebut. Gen Alt3 terletak di antara B11 dan B26, atau bahkan dapat merupakan B11 atau B26 itu sendiri. Roslim (2011) telah mengidentifikasi dan mempelajari padi lokal Indonesia var. Hawara Bunar yang toleran Al dan berpotensi sebagai sumber gen toleran Al. Dari varietas padi tersebut telah berhasil diisolasi kandidat gen toleransi cekaman Al, disebut gen
B11.
Untuk mempelajari lebih lanjut peran dari gen tersebut, selanjutnya B11
diintroduksikan ke dalam tanaman tembakau sebagai tanaman model yang kemudian menghasilkan tanaman tembakau transgenik pembawa gen B11. Hal yang perlu diperhatikan dalam perakitan tanaman transgenik adalah dihasilkannya tanaman transgenik yang stabil, yaitu memiliki transgen yang telah terintegrasi ke dalam genom dan diwariskan ke generasi berikutnya (Kempken dan Jung 2010). Analisis keberadaan transgen pada tanaman tembakau transgenik pembawa gen
B11 menunjukkan bahwa tanaman tembakau transgenik generasi pertama (T1)
telah membawa gen B11 dan analisis fungsi gen B11 pada tembakau transgenik T1
menunjukkan gen B11 dapat meningkatkan toleransi tanaman tembakau terhadap cekaman Al. Pengujian stabilitas integrasi gen B11 ke dalam genom tembakau transgenik sampai generasi T3 dan seleksi biji untuk mendapatkan tanaman
homozigot pembawa gen B11 perlu dilakukan agar diperoleh bahan tanaman transgenik yang stabil dan homozigot untuk keperluan pengujian-pengujian fungsi gen B11 selanjutnya.
Tujuan Penelitian
Penelitian ini bertujuan untuk memperoleh tanaman tembakau transgenik generasi T3 dengan trasngen B11 yang stabil serta mengetahui hubungan antara
4
TINJAUAN PUSTAKA
Tanah Masam dan Keracunan Aluminium pada Tanaman
Indonesia memiliki tanah masam yang tersebar luas di berbagai wilayah seperti di beberapa wilayah pulau Jawa, Sumatera, Kalimantan, Sulawesi, dan Papua (Lynch dan St. Clair 2004). Mulyani et al. (2004) menyebutkan bahwa sekitar 54,6% dari total lahan di Indonesia adalah tanah masam. Tanah masam menjadi tidak menguntungkan karena selain miskin unsur hara juga mengandung Al terlarut dalam konsentrasi yang tinggi. Toksisitas Al pada tanah masam sangat dominan mempengaruhi pertumbuhan dan produksi tanaman (Samac dan Tesfaye 2003). Pada kondisi asam Al berbentuk ion Al3+ terlarut yang toksik bagi akar tanaman. Selain itu ion Al3+ juga memiliki kemampuan mengkelat hara mineral yang tinggi (Ryan et al. 1993), sehingga menjadi tidak tersedia bagi tanaman.
Akar adalah organ yang langsung melakukan kontak dengan tanah, sehingga akar merupakan organ pertama yang mengalami kerusakan akibat cekaman Al. Berdasarkan beberapa hasil penelitian, target utama cekaman Al adalah jaringan akar tanaman terutama pada ujung akar (Ryan et al. 1993, Delhaize dan Ryan 1995). Pada umumnya konsentrasi Al pada akar lebih besar dari pada konsentrasi Al pada tajuk. Hal ini disebabkan Al terkelat oleh asam organik pada akar sehingga Al tidak dapat atau sedikit ditranspor ke tajuk. Sebagian besar Al yang diserap tanaman berada pada daerah apoplas (Taylor et al. 2000) meskipun juga ditemukan pada daerah simplas (Yamamoto et al. 2001)
Keracunan Al3+ pada tanaman padi mengakibatkan kerusakan pada daerah ujung akar (Miftahudin et al. 2007). Secara morfologi akar tanaman padi yang dicekam Al pertumbuhannya terhambat. Hal ini diperlihatkan oleh akar yang lebih pendek dibandingkan dengan akar normal. Selain itu Al dapat menyebabkan penghambatan pembentukan dan pertumbuhan akar adventif (Miftahudin et al. 2007). Respon yang terlihat pada tanaman barley yang tercekam Al adalah terhambatnya pertumbuhan ujung akar (Hossain et al. 2005). Al juga mampu menyebabkan rusaknya membran sel akar, penebalan, penggulungan dan pemendekan akar (Delhaize dan Ryan 1995).
Efek cekaman Al yang terlihat pada daun beberapa jenis tanaman secara umum adalah tanaman akan terlihat kerdil, daun sempit dan berwarna hijau tua, tulang daun berwarna keunguan, dan ujung daun berwarna kekuningan. Hal ini terjadi karena adanya defisiensi fosfor. Cekaman Al juga akan mengurangi jumlah klorofil dan laju fotosintesis, namun laju transpirasi akan meningkat. Pada tingkat kejenuhan Al yang tinggi, tanaman yang sensitif Al mempunyai tinggi tanaman lebih pendek dari pada yang toleran Al (de Lima dan Copeland 1994). Akumulasi Al dapat menekan aktivitas dan mempengaruhi fungsi motikondria kemudian memicu produksi Reactive Oksigen Species (ROS). Produksi ROS menghambat respirasi sel sehingga menghambat pertumbuhan akar karena defisiensi ATP yang dialami oleh sel (Yamamoto et al. 2002). Selain itu, ROS juga dapat menyebabkan terjadinya peroksidasi lipid dari membran sel yang dapat menyebabkan fungsi membran sel terganggu (Wahyuningsih 2009).
plasma. Kerusakan membran plasma ini kemudian menghambat sistem transpor ion yang seharusnya melewati membran tersebut (Sivaguru et al. 2002).
Masuknya Al dalam simplas mempengaruhi sistem metabolisme tanaman yang berakibat mempengaruhi pembelahan dan pemanjangan sel (Delhaize dan Ryan 1995). Akumulasi Al yang tinggi pada sel-sel akar varietas padi yang sensitif Al akan menyebabkan jaringan epidermis pada ujung akar menebal dan rusak (Wahyuningsih 2009).
Mekanisme Toleransi Aluminium pada Tanaman
Beberapa tanaman menunjukkan perbedaan respon terhadap cekaman Al. Mekanisme toleransi tanaman terhadap cekaman Al dikelompokkan menjadi 2 strategi, yaitu toleransi dan ekslusi. Mekanisme toleransi merupakan mekanisme tanaman dengan membiarkan Al trivalen masuk ke dalam jaringan kemudian didetoksifikasi melalui pembentukan kompleks Al dalam organel tertentu sehingga tidak berbahaya bagi tanaman (Ryan et al. 2011).
Akumulasi Al pada tanaman bisa terjadi di dalam akar (Delhaize et al.
1993) maupun pada tajuk (Watanabe dan Osaki 2001). Tanaman menahan dan mengakumulasi Al di dalam akar, terutama di dalam jaringan korteks dan epidermis akar. Pada jaringan muda yang belum mempunyai epidermis, Al bisa lolos masuk ke tajuk melalui pembuluh akar. Pada tanaman gandum jika Al sudah melebihi ambang batas yang bisa ditolerir oleh sitoplasma, maka Al yang diakumulasi di dalam akar akan dikeluarkan. Protein yang terlibat dalam pengeluaran Al dari akar tanaman gandum dikendalikan oleh gen Alt1 (Delhaize
et al. 1993). Ada juga tanaman yang disebut sebagai akumulator Al, yaitu tanaman yang mampu mengakumulasikan Al di dalam tajuk, seperti Melastoma malabathricum L, teh (Camelia sinsensis) dan bakau (Rhizophora mangle) (Watanabe dan Osaki 2001).
Mekanisme ekslusi merupakan sebuah mekanisme pertahanan tanaman terhadap cekaman Al melalui pencegahan/penghindaran, dan atau mengurangi masuknya Al ke dalam jaringan. Mekanisme ini dilakukan dengan cara mengeluarkan eksudat akar berupa asam organik untuk mengkelat Al sehingga Al tidak diserap oleh tanaman. Beberapa asam organik yang dikeluarkan akar untuk stategi ini antara lain malat, sitrat, oksalat (Li et al. 2000, Ryan et al. 2011).
Li et al. (2000) menyebutkan bahwa, asam organik yang disekresikan untuk merespon toleransi terhadap cekaman Al, berbeda pada setiap tanaman Tanaman tembakau akan segera mensekresikan asam organik sesaat setelah tercekam oleh Al (Delhaize et al. 2001), demikian juga gandum (Ryan et al. 1995) dan buckwheat (Zheng et al. 2005). Pada tanaman rye (Secale cereale L.) sekresi asam organik terjadi beberapa jam setelah cekaman Al (Li et al. 2000). Sekresi asam malat pada gandum tidak dihambat oleh suhu rendah tetapi hal ini menyebabkan terjadinya penghambatan pada sekresi asam sitrat pada rye.
6
al. 2004) dan MATE (Magalhaes et al. 2007). Famili gen tersebut menyandikan protein membran yaitu suatu transporter pada membran yang membantu pengeluaran malat dan sitrat melintasi membran plasma.
Gen Toleransi Aluminium
Mekanisme toleransi terhadap cekaman Al berbeda antar tanaman dan antar varietas dalam spesies. Toleransi tanaman terhadap cekaman Al dikontrol baik oleh gen tunggal maupun sejumlah gen. Ryan et al. (2011) menyebutkan bahwa toleransi cekaman Al pada beberapa species tanaman serealia merupakan karakter multigenik. Pada tanaman gandum (Delhaize dan Ryan 1995; Li et al.
2000), rye (Miftahudin et al. 2002), dan barley (Hordeum vulgare L) (Minella dan Sorrells 1992) toleransi terhadap cekaman Al dikendalikan oleh gen tunggal,pada Triticale toleransi terhadap cekaman Al merupakan karakter kualitatif dengan pewarisan yang sederhana (Delhaize et al. 1993). Pada padi dan Arabidopsis, toleransi terhadap cekaman Al merupakan karakter kuantitatif dengan pewarisan yang kompleks (Kochian et al. 2004). Beberapa QTL (quantitative trait loci) untuk karakter toleransi terhadap cekaman Al pada padi telah dilaporkan berada pada kromosom 1 dan 3 (Wu et al. 2000; Nguyen et al. 2001).
Gen-gen yang terekspresi oleh induksi cekaman Al dipercaya sebagai gen-gen yang terlibat dalam toleransi cekaman Al. Pada gandum, gen-gen wali1, wali4, wali3, wali5 merupakan gen-gen yang terinduksi saat terjadi cekaman Al (Swonden et al. 1995). Pada tanaman rye toleransi terhadap cekaman Al dikendalikan oleh lokus Alt3 (Miftahudin et al. 2002). Gen yang terdeteksi berperan dalam toleransi celkaman Al pada gandum adalah Alt1 (TaALMT1) yang mengontrol sekresi asam malat dan TaMATE yang mengontrol pengeluaran asam sitrat dari akar (Delhaize et al. 1993, Ryan et al. 2008).
dalam vakuola (Huang et al. 2012). Secara eksternal, mekanisme toleransi terhadap cekaman Al dikendalikan oleh gen OsFRDL4 yang termasuk kelompok
MATE efflux protein yang berperan dalam sekresi asam sitrat (Yokhoso et al.
2011).
Penemuan gen-gen yang responsif terhadap Al memberikan pengetahuan mengenai respon tanaman menjadi toleran terhadap cekaman Al. Gen B11
merupakan salah satu kandidat gen toleransi Al yang berhasil diisolasi dari padi lokal Indonesia varietas Hawara Bunar (toleran Al). Tingkat ekspresi B11 jauh lebih tinggi pada genotipe toleran Al dibandingkan dengan genotipe sensitif Al ketika berada pada cekaman 15 ppm Al (Roslim 2011).
Tembakau sebagai Model Tanaman untuk Mempelajari Fungsi Gen
Meskipun banyak spesies di bumi, hanya beberapa spesies yang terpilih sebagai subyek penelitian biologi secara intensif. Hal ini dikarenakan spesies terpilih memiliki karakter yang menonjol pada aspek tertentu sehingga menarik keinginan peneliti untuk mempelajarinya lebih lanjut. Ketertarikan dalam mempelajari fungsi gen tertentu terhadap spesies terpilih terkadang mengalami kendala dalam sebuah penelitian jika spesies tersebut masih memiliki sedikit informasi dan sulit di perlakukan pada penelitian yang dikehendaki. Karena itu peneliti lebih memilih melakukan penelitian pada spesies model sebelum pada spesies terpilih.
Tanaman Zea mays, Arabidopsis thaliana, Nicotiana tabaccum dan Nicotiana bentamiana, merupakan tanaman yang sering digunakan sebagai tanaman model untuk mempelajari fungsi gen tertentu. Tanaman-tanaman tersebut dipilih sebagai tanaman model karena, Z. mays memiliki kromosom yang mudah diobservasi dibawah mikroskop. A. thaliana merupakan tanaman model yang paling popular, ukurannya yang kecil, menyerbuk sendiri, jumlah kromosom yang sedikit membuat Arabidopsis dijadikan sebagai pilihan mudah untuk mempelajari berbagai mekanisme yang terjadi pada tanaman (Meinke et al. 1998). Keberhasilan transformasi genetik N. tabaccum telah digunakan untuk berbagai tujuan seperti mengungkap regulasi sistem biologi tanaman (Langbecker et al. 2004) dan tanaman model untuk pengujian cekaman biotik (Waigmann et al. 2000).
N. tabaccum (Mayo et al. 2006) dan N. benthamiana (Anggraito 2012) merupakan jenis tembakau yang sering digunakan dalam transformasi genetik. Pada jenis N. tabaccum seperti Xanthi (Su 2012) dan SRI (Bhatti dan He 2009) telah berhasil dilakukan transformasi melalui perantara Agrobacterium tumefaciens. Mudahnya tanaman tembakau untuk dikultur pada teknik kultur jaringan sebagai perantara transformasi genetik menjadikannya semakin popular sebagai model tanaman dalam mempelajari fungsi gen yang kebanyakan melalui proses transformasi genetik yang yang diperantarai oleh A. tumefaciens. Hampir semua bagian tanaman tembakau dapat secara mudah digunakan sebagai eksplan dalam proses kultur jaringan pada transformasi genetik. Daun muda (Su et al.
8
dan merupakan tanaman dikotil inang alami untuk A. tumefaciens (Mayo et al. 2006).
Real Time PCR
Polymerase Chain Reaction (PCR) merupakan suatu teknik amplifikasi DNA secara enzimatik tanpa menggunakan organisme. PCR ditemukan pada tahun 1983 oleh Kary Mullis, dan karena penemuannya Mullis mendapatkan nobel pada tahun 1993. Dengan teknik ini sekuen tertentu dari template DNA atau cDNA akan diamplifikasi ribuan bahkan jutaan kali dengan menggunakan primer spesifik dan enzim Taq polimerase yang tahan suhu tinggi dan siklus termal. Deteksi hasil dari proses PCR baru dapat dilakukan ketika siklus selesai dengan media gel agarosa dan pewarna ethidium bromida. Real Time PCR adalah suatu metode analisis yang dikembangkan dari reaksi PCR. Real Time PCR yang juga dikenal sebagai quantitative real time polymerase chain reaction (qPCR), adalah suatu teknik PCR untuk mengamplifikasi sekaligus menghitung (kuantifikasi) jumlah DNA target hasil amplifikasi tersebut. Dalam real time PCR, produk PCR diukur secara kuantitatif pada setiap siklus dan dapat diamati selama siklus eksponensial sedang berlangsung (Nolan et al. 2013). Metode deteksi didasarkan pada perubahan fluoresensi yang sebanding dengan peningkatan produk PCR. Fluoresensi dimonitor selama siklus PCR melakukan amplifikasi yang memungkinkan peneliti untuk mengikuti reaksi secara real time (Vandesompele 2008).
Cara kerja Real Time PCR mengikuti prinsip umum reaksi PCR, utamanya adalah DNA yang telah diamplifikasi dihitung setelah diakumulasikan dalam reaksi secara real time sesudah setiap siklus amplifikasi selesai. Terdapat 2 metode kuantifikasi yang umum digunakan antara lain:
a. SYBR Green adalah pewarna yang paling umum digunakan untuk deteksi dalam real time PCR. Untai ganda DNA hasil PCR akan terwarnai dengan cara SYBR Green mengikatkan diri pada untai tersebut. Pewarna yang berfluoresensi terikat dengan DNA. Pewarna memancarkan fluoresen pada 520 nm dan fluoresensi yang dipancarkan dapat dideteksi untuk menghitung jumlah produk yang dihasilkan. Kekurangan dari teknik ini adalah bahwa SYBR Green akan mengikat setiap dsDNA. Akibatnya, jika ada dimer primer atau produk tidak spesifik bisa membuat bias dalam kuantifikasi tersebut (Nolan et al. 2013).
b. Probe yang berasal dari hasil modifikasi DNA oligonukleotida yang akan berpendar (flourensensi) ketika terhibridisasi dengan DNA komplemen, misalnya probe TaqMan. Probe oligonukleotida dikonstrukasi mengandung reporter pewarna fluorescent di ujung 5' dan pewarna quencher di ujung 3'. Jika sekuen target terdeteksi, probe menempel pada daerah hilir dari salah satu situs primer dan ketika primer mengalami perpanjangan akan menabrak
daerah ujung 5’ dari probe. Kemudian jika telah mencapai ujung 3’ dari
probe, ujung lima probe yang merupakan reporter yang mengandung flouresen akan berpendar. Memisahkan pewarna reporter dari pewarna
secara keseluruhan. Penggunaan probe akan memperoleh hasil yang spesifik, artinya hanya target yang diinginkan yang terbaca oleh pendeteksi flouresensi. Flouresen akan berpendar ketika sudah melewati satu amplifikasi komplit. Dalam setiap pengamatan proses PCR, sinyal fluoresensi yang dipancarkan akan meningkat secara proporsional setiap siklus PCR telah berhasil dilakukan sejalan dengan bertambahnya produk DNA yang dihasilkan (Nolan et al. 2013).
10
BAHAN DAN METODE
Waktu dan Tempat Penelitian
Penelitian dilaksanakan pada bulan Desember 2013 sampai bulan Mei 2015 di labolatorium Fisiologi dan Biologi Molekular Tumbuhan dan rumah kaca Departemen Biologi IPB. Penelitian juga dilakukan di laboratorium Bioteknologi SEAMEO BIOTROP.
Bahan Penelitian
Bahan tanam yang digunakan pada penelitian ini adalah biji tanaman tembakau transgenik toleran Al (pembawa gen B11) generasi T2 yang diperoleh
dari hasil transformasi dengan plasmi pGWB5_B11 oleh Roslim (2011, Gambar 2).
Gambar 2 Peta linier vektor ekspresi pGWB5 pembawa gen B11 (Roslim 2011)
Metode
Seleksi Biji dan Pembentukan Tanaman T3
Biji tanaman diseleksi pada media seleksi MS (Murashige and Skoog 1962) (Lampiran 1) + 112 mg/L Vitamin B5 + 50 µg/ml higromisin pada pH 5.8. Biji ditumbuhkan pada suhu 25 ᵒ C, dengan lama penyinaran 12 jam dalam sehari selama 28 hari. Tanaman yang lolos seleksi dipindahkan ke dalam botol dengan media MS + Vitamin B5 dan dipelihara dalam kondisi yang sama selama 14 hari (Roslim 2011). Tanaman in vitro hasil seleksi diaklimatisasi pada media aklimatisasi berupa campuran pasir dan media tanam siap pakai dengan perbandingan 1:1 selama 14 hari, selanjutnya ditanam di rumah kaca pada media tanam campuran tanah dan kompos dengan perbandingan 3:1 sampai menghasilkan biji yang selanjutnya disebut biji T3. Biji T3 selanjutnya diseleksi
dengan antibiotik higromisin mengikuti prosedur sekeksi biji T2. Perlakuan Cekaman Al
Tanaman T3 terpilih yang lolos seleksi antibiotik ditumbuhkan pada media
Identifikasi Stabilitas Transgen Tanaman Transgenik
Uji stabilitas tanaman tembakau transgenik T2 dan T3 dilakukan dengan
teknik PCR. DNA total diisolasi dari 0.2 g daun segar tanaman tembakau dengan metode CTAB (Sanghai-Maroof et al. 1984). Kuantitas DNA diukur dengan menggunakan elektroforesis pada 1 % gel agarose dalam 1x buffer TBE pH 8.0, tegangan 65 volt selama 45 menit. DNA hasil isolasi kemudian digunakan sebagai
template untuk amplifikasi B11 menggunakan teknik PCR dengan primer
B11_EXP (forward: 5’- CACCATGGCGGCGGCGGCGGGTTGGTC -3’,
reverse:5’-TTATGAGCTTGAGTCGCC GGGGTTCCCT-3’) dan HPT (forward:
5’-GATGTTGGCGACCTCGTATT-3’, reverse: 5’-GATGTAGGAGGGCGTG GATA-3’) dan kit KAPA2G™ Fast ReadyMix (2x) (Kapa Biosystems, USA). Komposisi PCR yang digunakan adalah 100 ng DNA template, masing-masing 0.50 µM primer forward dan reverse, 12.5 ul KAPA2G™ Fast ReadyMix (1x), dan dH2O sampai volume total 25 µl. Program PCR yang digunakan adalah
pra-denaturasi 95 °C 3 menit; diikuti oleh 35 siklus pra-denaturasi 95 °C 15 detik; penempelan primer 65 °C (B11), 60 °C (HPT) 15 detik; pemanjangan 72 °C 15 detik; dan diakhiri dengan pasca-PCR 72°C 10 menit; dan penyimpanan 4 °C 30 menit. Hasil amplifikasi dimigrasikan pada 1% gel agarose dalam 1X buffer TBE, pada 65 volt selama 45 menit dengan 5 µg/ml pewarna ethidium bromida. Gel hasil elektroforesis visualisasi di atas lampu UV ( WiseUv WUV-M20, Daihhan Scientific) dan direkam menggunakan foto gel (WiseDoc©Gel Documentation System).
Isolasi Total RNA
Sebanyak 0.1 g ujung akar (<1cm) dipotong dan dimasukkan ke dalam microtube 2 ml (dalam keadaan segar) dan digerus menggunakan stainless steel stick sambil sesekali dicelupkan dalam nitrogen cair. Isolasi RNA selanjutnya dilakukan dengan reagen Trizol mengikuti instruksi pabrik (Invitrogen®, USA). Total RNA diberi perlakuan enzim DNaseI untuk menghilangkan DNA yang mungkin mengkontaminasi. Komposisi reaksi adalah 1 µl buffer DNase1 10x, 1 µg RNA total, 1 U DNase 1 dan 0.01 % air DEPC (diethil polycarbonate) hingga total volume 10 µl. Campuran tersebut kemudian diinkubasi pada suhu 37 °C selama 30 menit. Untuk menginaktifasi enzim DNaseI, ditambahkan 1 µl 50 mM EDTA pH 8.0 ke dalam campuran lalu diinkubasi pada suhu 65 °C selama 10 menit. Tabung segera ditempatkan di atas es selama 30 menit lalu diambil 1 µl untuk dielektroforesis pada 1 % gel agarose, pada 65 volt selama 1 jam.
Reverse Transcription-Polymerase Chain Reaction (RT-PCR)
12
Real-Time PCR (qPCR)
cDNA hasil RT-PCR digunakan sebagai template, dan primer yang digunakan antara lain: B11_EXP primers (Forward: 5’-CACCATGGC GGCGGCGGCGGGTTGTC-3’, Revese: 5’-TTATGAGCTTGAGTCGCCGGG GTTCCCT-3’), STOP1 (Forward: 5’-CAAAGCCGTCTTCATCTGGC-3’, Revese: 5’-CCTCCTTCTCCAACTGCAGA-3’), ALMT (Forward: 5’-GACACA CTTGGGAAAGGAGT-3’ , Revese: 5’-ATGTAGATCTTCACCAGCCC-3’) dan MATE (Forward: 5’-CACGAAAGCAAGTCAGGACC-3’ , Reverse: 5’-CCACA TCCAAGTGTGAGTGC-3’). Endogenous gen diamplifikasi menggunakan primer untuk gen Actin (Forward: 5’-CCTCTTAACCCGAAGGCTAA-3’, Revese: 5’-GAAGGTTGGAAAAGGACT-3’). qPCR dilakukan dengan menggunakan KAPA SYBR® FAST qPCR Kit dengan komposisi 10 ng cDNA
template, 10 µl 2x KAPA SYBR® FAST qPCR master mix, masing-masing 0.4 µl 10 µM primer forward dan reverse, 0.4 µl 50 x ROX High dan PCR grade water sampai volume 20 µl. Program qPCR yang digunakan adalah aktivasi enzim 95 °C 3 menit; denaturasi 95 °C 3 detik; penempelan primer 64 °C (B11 dan STOP1), 60 °C (ALMT1), 56 °C (Actin dan MATE) selama 30 detik; dalam 40 siklus.
Validitas Quantitative Real Time PCR untuk Analisis Ekspresi Gen
Untuk melakukan analisis qPCR dengan perhitungan menggunakan metode 2-ΔΔCt diperlukan syarat pembuatan slope antara normalizer dan gen target menggunakan sampel yang sama untuk menentukan apakah rentang penyimpangan bisa diterima. Slope akan diterima apabila rentang nilai ΔCt (Ct
normalizer-Ct target) pada beberapa pengenceran menghasilkan nilai slope < 0.1. Pengenceran dilakukan sebanyak 5 tingkat dengan masing masing pengenceran adalah 1x, 2x, 10x, 100x dan 1000x. Pembuatan slope ini dilakukan pada seluruh sampel dengan masing-masing 3 ulangan biologi dengan 2 ulangan teknis.
Analisis Data
HASIL DAN PEMBAHASAN
Seleksi Biji Tembakau Transgenik Generasi T2 dan T3
Seleksi biji tembakau transgenik dilakukan untuk memilih tanaman T2 dan
T3 yang konsisten membawa gen B11. Pada penelitian ini, seleksi dilakukan
dengan menggunakan antibiotik higromisin. Sifat resistensi terhadap higromisin dikendalikan oleh gen hpt yang merupakan salah satu marka antibiotik yang terdapat pada plasmid rekombinan pembawa B11 (Gambar 2). Gen hpt merupakan salah satu contoh marka seleksi yang dapat membunuh sel sel yang peka, sedangkan sel sel yang tertransformasi akan bertahan hidup. Konsentrasi antibiotik higromisin untuk seleksi ditentukan berdasarkan hasil percobaan pendahuluan dengan cara mengaplikasikan beberapa tingkat konsentrasi antibiotik pada tanaman tipe liar. Bila tanaman tipe liar menunjukkan ciri-ciri sensitif pada konsentrasi tertentu, maka konsentrasi tersebut digunakan untuk proses seleksi. Konsentrasi yang efektif digunakan untuk seleksi adalah konsentrasi terendah yang mampu menekan pertumbuhan sel-sel peka sehingga tidak menyebabkan efek yang negatif pada pertumbuhan sel-sel yang tertransformasi (Bhasir et al. 2004).
Pada konsentrasi 50 g/ml selama 3-4 minggu tanaman tipe liar menunjukkan sensitivitas terhadap antibiotik dengan ciri-ciri mempunyai akar pendek (kurang dari 1cm) dan hanya memiliki 2 helai daun berwarna hijau yang setelah 4 minggu akan mulai berwarna putih (Gambar 3A). Setelah 7-8 minggu tanaman tipe liar yang diseleksi dengan antibiotik higromisin seluruh bagian tubuhnya akan berwarna putih dan mati (Gambar 3B). Tanaman tembakau transgenik yang resisten higromisin pada minggu ke 4 menunjukkan pertumbuhan dengan citi-ciri memiliki lebih dari 2 helai daun yang berwarna hijau dan panjang akar lebih dari 1 cm (Gambar 3C). Pada minggu ke 8 tembakau transgenik menunjukkan pertumbuhan yang baik dengan daun menjadi lebih lebar dan akar lebih panjang (Gambar 3D).Higromisin merupakan antibiotik yang sangat beracun bagi tanaman . Higromisin meracuni tanaman dengan cara menghambat proses sintesis protein, mengganggu tRNA untuk menempel pada ribosom. Pada tanaman yang mengandung gen hpt mempunyai kemampuan untuk menghasilkan protein
14
A B
C D
Gambar 3 Seleksi antibiotik pada media MS + VitB5 + 50 µg/ml higromisin. Tanaman tembakau tipe liar umur 4 minggu (A), Tanaman tembakau tipe liar umur 8 minggu (B), Tanaman tembakau transgenik umur 4 minggu (C), Tanaman tembakau transgenik umur 8 minggu (D). Hasil seleksi antibiotik menunjukkan bahwa sebagian besar biji tanaman tembakau transgenik terbukti resisten terhadap antibiotik higromisin. Uji Khi-kuadrat memperlihatkan bahwa sifat resisten tanaman tembakau transgenik terhadap higromisin diturunkan dari generasi T1 ke T2. Sebanyak 24 dari 26
nomor tanaman tembakau transgenik memiliki rasio pewarisan 3:1 (Tabel 1), sedangkan 2 nomor lainya yakni T2-15-11, T2-15-24 menunjukkan resistensi 100
persen terhadap antibiotik higromisin. Hasil ini menunjukkan gen resisten higromisin telah terintegrasi ke dalam genom tanaman tembakau transgenik. Rasio segregasi sifat resisten:sensitif higromisin diasumsikan mengikuti pewarisan gen tuggal karena mengikuti pola pewarisan 3:1.
Demikian juga pada tanaman tembakau transgenik generasi T3, uji
Khi-kuadrat memperlihatkan bahwa sifat resisten tanaman tembakau transgenik terhadap antibiotik higromisin juga masih ada yang bersegregasi dari generasi T2
ke T3 dengan rasio pewarisan 3:1 (Tabel 2). Dalam hal ini, 8 dari 17 nomor
tanaman tembakau transgenik memiliki rasio pewarisan 3:1, sedangkan 9 nomor lainnya menunjukkan resistensi 100 persen terhadap antibiotik higromisin. Rasio pewarisan 3:1 pada tanaman tembakau transgenik menunjukkan bahwa nomer tersebut belum homozigot, sedangkan pada nomor-nomor yang menunjukkan resistensi 100 persen menunjukkan bahwa genotipe nomor-nomor tersebut sudah homozigot untuk gen hpt.
Karena gen hpt difusikan dengan gen B11 pada daerah T-DNA pada konstruksi plasmid pembawa gen tersebut, maka gen B11 diwariskan bersama-sama ke generasi berikutnya sehingga jumlah gen B11 yang terintegrasi di generasi T2 dan T3 tembakau transgenik adalah satu copy. Untuk mengkonfirmasi
bahwa tanaman tembakau T2 dan T3 yang resisten antibiotik higromisin
16
Tabel 2 Rasio pewarisan sifat resisten higromisin pada T3 dari 17 nomor
tembakau transgenik
Stabilitas Transgen pada Generasi T2 dan T3
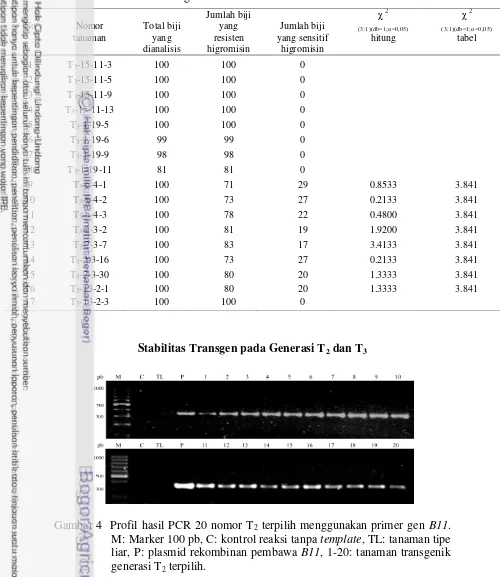
Gambar 4 Profil hasil PCR 20 nomor T2 terpilih menggunakan primer gen B11.
M: Marker 100 pb, C: kontrol reaksi tanpa template, TL: tanaman tipe liar, P: plasmid rekombinan pembawa B11, 1-20: tanaman transgenik generasi T2 terpilih.
Stabilitas tanaman tembakau transgenik dideteksi dengan teknik PCR. Hasil verifikasi sisipan gen B11 pada tanaman tembakau transgenik T2 yang lolos
seleksi antibiotik higromisin ditunjukkan oleh Gambar 4. Amplifikasi DNA tanaman transgenik T2 yang diuji menunjukkkan pita dengan posisi migrasi yang
sama dengan hasil amplifikasi plasmid pGWB5-B11 (342 pb) sebagai kontrol positif, sedangkan tanaman tembakau tipe liar tidak menunjukkan pita tersebut. Hasil PCR tersebut menunjukkan bahwa seleksi antibiotik yang dilakukan sudah efektif karena tanaman yang lolos seleksi juga menunjukkan adanya pita DNA
B11. Profil hasil PCR tersebut menunjukkan bahwa tanaman transgenik generasi T2 masih membawa gen B11.
Gambar 5 Profil hasil PCR 20 nomor T2 terpilih menggunakan primer gen hpt.
M: marker 100 pb, C: kontrol reaksi tanpa template, P: plasmid rekombinan pembawa B11, TL: tanaman tipe liar, 1-20 : tanaman transgenik generasi T2 terpilih.
Stabilitas tanaman tembakau transgenik T2 juga dideteksi dengan salah
satu marka antibiotik yang terdapat pada plasmid pembawa B11 yaitu hpt. Tanaman transgenik generasi T2 yang lolos seleksi antibiotik higromisin
kemudian diamplifikasi dengan menggunakan primer yang dibuat berdasarkan sekuen gen hpt. Hasil amplifikasi menunjukkkan pita hpt (570 pb) dimiliki oleh semua tanaman transgenik yang lolos seleksi, sedangkan tanaman tembakau tipe liar tidak menunjukkan pita tersebut. Hasil PCR tersebut juga menunjukkan bahwa gen hpt yang merupakan marka antibiotik yang terdapat pada konstrak plasmid pembawa B11 terintegrasi ke dalam genom tanaman tembakau transgenik. Hal ini menunjukkan stabilitas tanaman transgenik pembawa gen B11
pada generasi T2, dimana tanaman tembakau transgenik generasi T2 masih
18
A
B
Gambar 6 Profil hasil PCR 5 nomor T3 terpilih menggunakan primer gen B11 (A)
dan primer gen hpt (B). M: marker 100 pb, C: tanpa template, P: plasmid rekombinan pembawa B11, TL: tanaman tipe liar, 1-5 : tanaman transgenik generasi T3 terpilih.
Stabilitas tanaman tembakau transgenik T3 yang dideteksi dengan teknik
PCR dengan primer B11 dan hpt menunjukkan semua tanaman transgenik generasi T3 yang diuji memiliki pita B11 (342 pb) dan hpt (570 pb) seperti pada
plasmid pembawa gen B11 (P) sebagai kontrol positif, sedang tanaman tembakau tipe liar tidak menunjukkan pita tersebut. Hasil PCR tersebut menunjukkan stabilitas integrasi gen B11 pada tembakau transgenik sampai generasi T3.
Hal yang menarik dari hasil analis PCR tersebut adalah tidak muculnya pita hasil PCR dengan primer gen B11 pada tembakau tipe liar. Hal ini mungkin disebabkan oleh dua hal. kemungkinan pertama adalah bahwa gen B11 tidak ditemukan pada tanaman tembakau tipe liar. Kedua, jika ada gen yang ortholog dengan B11 pada tanaman tembakau tipe liar, kemungkinan primer yang digunakan tidak dapat menempel pada DNA tanaman tembakau tersebut sehingga gen tidak dapat teramplifikasi.
Analisis Cekaman Aluminium pada Tanaman Tembakau Transgenik Generasi T3
Salah satu nomor tanaman tembakau transgenik generasi T3 yang lolos
seleksi higromisin yakni nomor T3-15-11-3 serta tanaman tipe liar (kontrol)
Al pada tanaman tembakau transgenik ini diduga terkait dengan ekspresi dari gen
B11 yang ada pada tanaman tembakau transgenik.
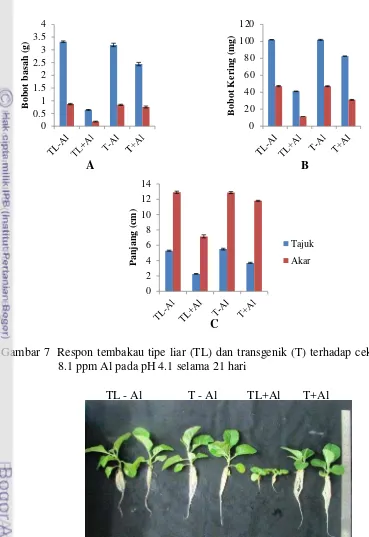
Gambar 7 Respon tembakau tipe liar (TL) dan transgenik (T) terhadap cekaman 8.1 ppm Al pada pH 4.1 selama 21 hari
Gambar 8 Tembakau tipe liar tanpa cekaman (TL-Al), tembakau tipe liar dicekam Al 21 hari (TL+Al), tembakau transgenik tanpa cekaman (T-Al), tembakau transgenik dicekam Al 21 hari (T+Al)
20
Cekaman oleh Al pada tanaman dapat menyebabkan tudung akar dan zona pemanjangan akar rusak sehingga akar terhambat untuk memanjang. Terhambatnya pemanjangan akar pada tanaman yang tercekam oleh Al juga dikarenakan gagalnya pembelahan sel (Panda et al. 2009). Aluminium dapat membentuk ikatan elektrostatik dengan karboksil atau fosfat, sehingga pektin dinding sel dan lapisan luar membran plasma menjadi target utama Al. Kemampuan Al dalam berinteraksi dengan dinding sel menyebabkan perubahan pada dinding sel, yaitu dinding sel menjadi kaku. Hal ini dikarenakan terjadinya lignifikasi pada dinding sel sehingga plastisitas dinding sel dan permeabilitas membran sel menurun. Al dapat mengikat kuat komponen lipid pada membran plasma sehingga memran plasma menjadi kaku (Jones dan Kochian 1997). Kondisi tersebut di atas menyebabkan sel-sel yang seharusnya mengalami pembelahan dan pemanjangan menjadi gagal membelah dan memanjang karena tidak adanya penyisipan massa sel sehingga sel tidak dapat mencapai ukuran untuk membelah (Milla et al. 2002).
Salah satu strategi pertahanan tanaman terhadap cekaman Al adalah dengan cara mencegah akumulasi ion trivalen dalam simplas dan meminimalisasi interaksi antara Al dengan dinding sel serta membran plasma atau target lain di apoplas. Mekanisme ini dilakukan dengan cara mengeluarkan eksudat akar berupa anion organik untuk mendetoksifikasi ion Al dengan mengikat dan mengeluarkan ion Al dari dalam sel (Delhaize 2001). Asam organik yang disekresikan oleh akar tanaman antara lain asam malat dan asam sitrat (Li et al 2000; Ryan et al. 1995).
Analisis Ekspresi Gen pada Tanaman Tembakau Transgenik Generasi T3
Analisis ekspresi gen dilakukan teknik qPCR menggunakan metode perhitungan ekspresi relatif 2-ΔΔCt. Syarat yang harus dipenuhi dalam menggunakan perhitungan 2- ΔΔCt adalah nilai slope normalizer dan gen target dari ΔCt (Ct normalizer-Ct target) < 0.1. Pada percobaan ini, dari nilai ΔCt yang diperoleh, nilai slope pada masing-masing percobaan menunjukkan nilai < 0.1 (Lampiran 2). Dengan demikian nilai Ct yang diperoleh pada analisis ekspresi dapat dihitung dengan menggunakan metode 2-ΔΔCt untuk mendapatkan nilai ekspresi relatif pada gen yang dianalisis.
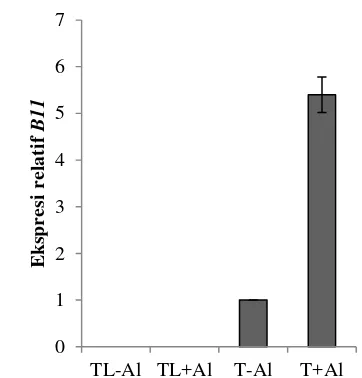
Hasil analisis ekspresi menunjukkan pada tembakau tipe liar tidak dijumpai ekspresi gen B11 baik pada kondisi tanpa maupun dengan cekaman Al. Tetapi ekspresi gen B11 pada tanaman tembakau transgenik yang dicekam Al 5.4 kali lebih tinggi dibandingkan dengan tanaman tembakau transgenik tanpa cekaman Al (Gambar 8). Hal ini menunjukkan bahwa ekspresi gen B11, meskipun dikendalikan oleh promotor kuat CaMV35S, masih dipengaruhi atau diinduksi oleh Al.
Gambar 9 Ekspresi relatif gen B11 pada tanaman tembakau transgenik tanpa cekaman (T-Al), dan tanaman tembakau transgenik dicekam Al 8,1 ppm selama 24 jam (T+Al)
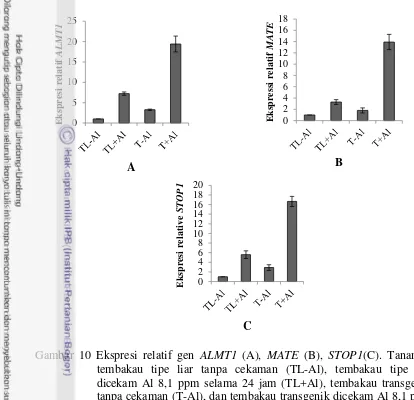
Hasil analisis ekspresi gen-gen yang terkait dengan toleransi Al menunjukkan pola yang sama dengan ekspresi gen B11. Ekspresi gen ALMT1 dan
MATE lebih tinggi pada tanaman tembakau transgenik yang dicekam Al dibanding ekpresinya pada tanaman tembakau transgenik tanpa cekaman dan tanaman tembakau tipe liar (Gambar 10A dan B). Ekspresi relatif gen ALMT1
pada tembakau transgenik yang dicekam Al meningkat 5.8 kali lebih tinggi dari ekspresinya pada tanaman tembakau transgenik tanpa cekaman. Sementara ekspresi tanaman tembakau transgenik yang dicekam Al meningkat 2.3 kali lebih tinggi dari tanaman tipe liar dengan cekaman Al. Hal serupa juga terjadi pada ekspresi gen MATE, ekspresi relatif gen MATE tanaman tembakau transgenik yang dicekam Al meningkat 7.7 kali lebih tinggi dari ekspresinya pada pada tanaman transgenik tanpa cekaman Al, dan meningkat 4.3 kali dari tanaman tipe liar dengan cekaman Al. Data tersebut menunjukkan bahwa gen ALMT1 dan
MATE diinduksi oleh adanya cekaman Al, dan penyisipan B11 pada tanaman tembakau transgenik mampu meningkatkan ekspresi dari kedua gen tersebut.
ALMT1 dan MATE dilaporkan terlibat dalam detoksifikasi Al pada beberapa species tanaman (Ma et al. 2014). ALMT1 merupakan gen yang terkait dengan pengeluaran asam malat, sedangkan MATE merupakan gen yang terkait dengan pengeluaran asam sitrat oleh tanaman. Knockout atau knockdown gen
AtALMT1 and AtMATE menunjukkan penurunan toleransi terhadap Al pada tanaman Arabidopsis, sebaliknya over ekspresi dari TaALMT mampu meningkatkan toleransi terhadap cekaman Al pada tanaman wheat (Pereira et al.
2010) dan barley (Delhaize et al. 2004). OverexspresiMATE pada tanaman wheat and barley juga meningkatkan toleransi tanaman tersebut pada cekaman Al (Zhou
22
Gambar 10 Ekspresi relatif gen ALMT1 (A), MATE (B), STOP1(C). Tanaman tembakau tipe liar tanpa cekaman (TL-Al), tembakau tipe liar dicekam Al 8,1 ppm selama 24 jam (TL+Al), tembakau transgenik tanpa cekaman (T-Al), dan tembakau transgenik dicekam Al 8,1 ppm selama 24 jam (T+Al).
TaALMT1 terletak pada protein plasma membran dengan enam transmembran domain yang memediasi pengeluaran asam malat (Sasaki et al. 2004). Protein ALMT1 mengandung enam transmembran domain dengan asam amino dan karboksil yang terletak pada bagian ekstraseluler dari plasma membran (Motoda et al. 2007). MATE terletak pada plasma membran dengan sembilan transmembran domain, memediasi transport asam sitrat (Furukawa et al. 2007). Ohyama et al.(2013) melaporkan bahwa tingkat ekspresi dari NtMATE berkorelasi secara positif dengan kapasitas pengeluaran asam sitrat. Meskipun aktivitas MATE diaktivasi oleh Al, namun mekanismenya masih belum diketahui sampai sekarang. Tingkat ekspresi ALMT1 dan MATE lebih tinggi pada tanaman yang toleran dari pada yang sensitif, hal ini mengindikasikan bahwa toleransi terhadap Al diregulasi oleh tingkat ekspresi dari ALMT1 dan MATE. Tanaman tembakau transgenik pembawa B11 dalam cekaman Al memiliki ekspresi gen STOP1 paling tinggi dibandingkan tanaman tembakau transgenik tanpa cekaman dan tanaman tipe liar. Ekspresi relatif gen STOP1 pada tanaman tembakau transgenik dengan cekaman Al meningkat 5,7 kali dari ekspresinya pada tanaman tembakau transgenik tanpa cekaman Al. Ekspresi gen STOP1 pada tanaman tembakau transgenik dengan cekaman Al meningkat 3 kali lebih tinggi dari ekspresinya pada
tanaman tembakau tipe liar dengan cekaman Al. Hal ini menunjukkan bahwa
STOP1 berperan dalam toleransi terhadap cekaman Al, dan penyisipan B11 pada tanaman tembakau transgenik mampu meningkatkan ekspresi dari gen STOP1.
Peningkatan ekspresi gen B11 diikuti dengan peningkatan ekspresi gen
STOP1, ALMT1 dan MATE.Liu et al. (2009) dan Sawaki et al. (2009) melaporkan bahwa pada Arabidopsis thaliana, STOP1 meregulasi ekspresi dari ALMT1 dan
MATE. Knockout atau knockdown gen tersebut menunjukan penurunan ekspresi dari ALMT1 dan MATE (Ohyama et al. 2013). Mekanisme toleransi cekaman aluminium diregulasi oleh faktor transkripsi AtSTOP1 pada tanaman Arabidopsis (Sawaki et al. 2009) dan ART1 pada padi (Yamaji et al. 2009), dimana AtSTOP1
dan ART1 holomog dalam Cis-2-His-2 zinc-finger domain. Penekanan ekspresi dari STOP1 dengan RNAi pada tanaman tembakau mampu meningkatkan sensitifitas tanaman terhadap pH rendah dan cekaman Al (Ohyama et al. 2013). Selanjutnya Ohyama et al. (2013) melaporkan ekspresi NtMATE menurun pada tanaman tembakau yang mengalami knockdown pada STOP1 (NtSTOP1-KD). Penurunan ekspresi NtMATE ternyata berkorelasi dengan penurunan sekresi asam sitrat. Sejalan dengan itu, pada tanaman padi ART1 juga meregulasi ekspresi dari gen OsFRDL4 yang merupakan gen yang berperan dalam sekresi asam sitrat pada padi (Yokosho et al., 2011). Yamaji et al. (2009) melaporkan bahwa ART1 tidak diinduksi oleh Al, namun ekspresi gen-gen downstream dari ART1 meningkat oleh induksi Al. Dengan adanya homologi antara ART1 dan STOP1, maka dapat diusulkan bahwa ekspresi gen B11 dapat meregulasi ekspresi gen STOP1 dan selanjutnya meregulasi ekspresi gen ALMT1 dan MATE. Gen-gen tersebut berkontribusi dalam toleransi terhadap cekaman Al pada tanaman tembakau transgenik. Jika diujikan pada padi yang overekspresi gen B11 diharapkan gen
B11 dapat meregulasi ekspresi gen ART1 yang selanjutnya dapat meregulasi gen-gen downstream ART1 yang terlibat dalam mekanisme toleransi tanaman padi terhadap cekaman Al.
24
SIMPULAN
Analisis stabilitas genetik tanaman tembakau transgenik menunjukkan bahwa tanaman tembakau transgenik membawa gen B11 sampai generasi T3 dan
DAFTAR PUSTAKA
Anggraito YU. 2012. Transformasi genetik Nicotiana benthamiana L. dan kedelai dengan gen MaMt2 penyandi metallothionein tipe II dari Melastoma malabathricum L [Disertasi]. Bogor (ID): Program Pascasarjana Institut Pertanian Bogor.
Bashir K, Rafiq M, Fatima T, Husnain T, Riazuddin S. 2004. Hygromycin based selection of transformants in local inbreed line of Zea mays L. Pak J Biol Sci 7(3):318-323.
Bhatti KH, He C. 2009. Agrobacterium mediated tobacco transformation with rice fae gene and segregation analysis of T1 generation. Pak J Bot 41(1):403-412.
de Lima ML, Copeland L. 1994. Changes in the ultrastructure of the root tip of wheat following exposure to aluminium. Aust J Plant Physiol 21:85-94. Delhaize E, Hebb DM, Ryan PR. 2001 Expression of Pseudomonas aeruginosa
citrate synthase gene in tobacco is not associated with either enhanced citrate accumulation of efflux. Plant Physiol 125: 2059-2067.
Delhaize E, Ryan PR, Hebb DM, Yamamoto Y, Sasaki T, Matsumoto H. 2004. Engineering high level aluminum tolerance in barley with the ALMT1gene.
Proc Natl Acad Sci USA 101(42):15249-15254.
Delhaize E, Ryan PR, Randall PJ. 1993. Aluminum tolerance in wheat (Triticum aestivum L.): II. Aluminum stimulated excretion of malic acid from root apices. Plant Physiol 103: 695-702.
Delhaize E, Ryan PR. 1995. Aluminum toxicity and tolerans in plant. Plant Physiol 107: 315-321.
Ezaki B, Gardner RC, Ezaki Y, Matsumoto H, 2000. Expression of aluminum induced genes in transgenic arabidopsis plants can ameliorate aluminum stress and/or oxidative stress. Plant Physiol 122:657-665.
Furukawa J, Yamaji N, Wang H, Mitani N, Murata Y, Sato K, Katsuhara M, Taked K, Ma JF. 2007. An aluminum activated citrate transporter in barley.
Plant Cell Physiol 48:1081-1091.
Hossain M, Zhou MX, Mendham NJ. 2005. A reliable screening system for aluminium tolerance in barley cultivars. Aust J Agric Res 56(5):475-482. Huang Cf, Yamaji N, Chen Z, Ma JF. 2012. A tonoplast-localized half-size ABC
transporter is required for internal detoxification of aluminum in rice. Plant Cell 69:857-867.
Huang Cf, Yamaji N, Mitani N, Yano M. 2009. A bacterial-type ABC transporter is involved in aluminum tolerance in rice. Plant Cell 21:655-667.
Jones DL, Kochian LV. 1997. Aluminum inhibition of the inositol 1,4,5-triphosphate signal transduction pathway in wheat roots: A role in aluminum toxicity. Plant Cell 7:1913-1922.
Kempken F, Jung C. 2010. Genetic Modification of Plants: Agriculture, Horticulture and Forestry. New York (US): Springer.
26
Kochian LV, Hoekenga OA, Piñeros MA. 2004. How do crop plants tolerant acid soils? Mechanisms of aluminum toxicity and phosphorus efficiency. Annu Rev Plant Biol 55:459-93.
Kochian LV. 1995. Cellular mechanisms of aluminum toxicity and resistance in plants. Annu Rev Plant Physiol Mol Biol 46: 237-260.
Langbecker CL, Ye GN, Broyles DL, Duggan LL, Xu Cw, Hajdukiewixz PT, Armstrong L, Staub JM. 2004. High frequency transformation of undeveloped plastids in tobacco suspension cell. Plant Physiol 135:139-149. Li Xf, Ma JF, Matsumoto H. 2000. Pattern of aluminum-induced secretion of organic acids differs between rye and wheat. Plant Physiol 123:1537-1543. Liu J, Magalhaes JV, Shaff J, Kochian LV. 2009. Aluminum activated citrate and
malate transporters from the MATE and ALMT families function independently to confer Arabidopsis aluminum tolerance. Plant J 57:389-399.
Lynch JP, St. Clair SB. 2004. Mineral Stress: the missing link in understanding how global climate change will affect plants in real word soils. Filed Crops Research 90: 101-115.
Ma JF, Chen ZC, Shen RF. 2014. Molecular mechanisms of Al tolerance in gramineous plants. Plant soil 381:1-12.
Ma JF, Hiradate S. 2000. Form of Aluminim for uptake and translocation in buckwheat (Fagopyrum esculentum Moench). Planta 211:355-360.
Magalhaes JV, Liu J, Guimara CT, Lana UGP, Wang Y, SchaVert RE, Hoekenga OA, Shaff JE, Klein PE, Carneiro NP, Coelho CM, Trick HN, Kochian LV. 2007. A gene in the multidrug and toxic compound extrusion (MATE) family confers aluminum tolerance in sorghum. Nature Genet 39:1156– 1161.
Mao C, Yi K, Yang L, Zheng B, Wu Y, Liu F, Wu P. 2004. Identification of aluminum-regulated genes by cDNA-AFLP in rice (Oriza sativa L.): aluminum-regulated genes for the metabolism of cell wall components. J Exp Bot 55(394):137-143.
Matoda H, Sasaki T, Kano Y, Ryan PR, Delhaize E, Matsumoto H, Yamamoto Y. 2007. The membrane topology of ALMT1, an aluminum activated matale transport protein in wheat. Plant Signal Behav 2:467-472.
Matsumoto H. 2000. Cell biology of aluminum toxicity and tolerance in higher plants. Int Rev Cytol 200:1-46.
Mayo KJ, Gonzalez BJ, Mason HS. 2006. genetic transformation of tobacco NT1 cell with Agrobacterium tumefaciens. Nature Protocol 1(3): 1105-1111. McCoy LS, Xie Y, Tor Y. 2011. Antibiotics that target protein synthesis. Wiley
Interdisciplinary 2(2):209-232.
Meinke DW, Cherry JM, Rounsly SD. 1998. Arabidopsis thaliana: A model plant for genome analysis. Genome 282:661-682.
Miftahudin, Chikmawati T, Ross K, Scoles GJ, Gustafson JP. 2005. Targeting the aluminum tolerance gene Alt3 region in rye, using rice/rye micro-colinearity. Theor Appl Genet 110:906-913.
Miftahudin, Scoles GJ, Gustafson JP. 2002. AFLP markers tightly linked to the aluminum-tolerance gene Alt3 in rye (Secale cereale L.). Theor Appl Genet
104:626-631.
Milla MAR, Butler E, Huete AR, Wilson CF, Anderson O, Gustafson JP. 2002. Expressed sequence tag-based gene expression analysis under aluminum stress in rye. Plant Physiol 130:1706-1716.
Minella E, Sorrells ME.1992. Aluminum tolerance in barley: genetic relationship among genotypes of diverse origin. Crop Sci 32:593-598.
Mulyani A, Rachmad A, Dairah A. 2009. Penyebaran lahan masam, potensi, dan ketersediaannya untuk lahan pertanian. Bogor (ID): Balai Penelitian Tanah. Murashige T, Skoog F. 1962. A revised medium for rapid groTLh and bioassays
with tobacco tissue cultures. Physiol Plant 15: 473-497.
Nguyen VT, Burow MD, Nguyen HT,Le BT, Le TD, Paterson AH. 2001. Molecular mapping of genes coffering aluminum tolerance in rice (Oryza sativa L.). Theor Appl Genet 102:1002-1010.
Nolan T, Huggett J, Sanchez E. 2013. Good Practice Guide for the Application of Quantitative PCR (qPCR). Freising (DE): LGC.
Ohyama Y, Ito H, Kobayashi Y, Ikka T, Morita A, Komatsu K, Sakata Y, Iuchi S, Koyama H. 2013. Characterization of AtSTOP1 orthologous genes in tobacco and other plant species. Plant Physiol 162:1937-1946.
Panda SK, Baluska F, Matsumoto H. 2009. Aluminum stress signaling in plants.
Plant Signaling Behavior 4(7):592-597.
Pardon JM, Malparatida F, Roco ML, Jimenes A.1985. Biochemical basic of resistance to hygromycin B in Streptomyces hygroscopicus-the producing organism. J General Mocrobiol 13(6):1289-1298.
Pereira JF, Zhou G, Delhaize E, Richadson T, Zhou M, Ryan PR. 2010. Engineering greater aluminium resistance in wheat by over-expressing TaALMT. Ann Bot 106:205-214.
Quiros-Fiqueroa FR, Rojas-Herrera, Galaz-Avalos, Loyola-Vargas. 2006. Embryo production through somatic embryogenesis can be used to study cell differentiation in plants. Plant Cell Tis Org Cult 86: 285-301.
Roslim DW. 2011. Isolasi dan karakterisasi gen toleran aluminium dari tanaman padi [Disertasi]. Bogor (ID): Program Pascasarjana Institut Pertanian Bogor. Ryan PR, Delhaize E, Randall PJ. 1995. Characterization of Al-stimulated efflux
of malate from the pices of Al-tolerant wheat roots. Planta 196:103-110. Ryan PR, Raman H, Gupta S, Horst WJ, Delhaize E. 2008. A second mechanism
for aluminum resistance in wheat relies on the constitutive efflux of citrate from roots. Plant Physiol 149:340-351.
Ryan PR, Tomaso JM, Kochian LV. 1993. Aluminum toxicity in roots: an investigation of spatial sensitivity and the role of the root cap. J Exp Bot
44:437-446.
Ryan PR, Tyerman SD, Sasaki T, Furuichi T, Yamamoto Y, Zhang WH, Delhaize E. 2011. The identification of aluminium-resistance genes provides opportunities for enhancing crop production on acid soils. J Exp Bot
62(1):9–20.
28
chromosomal location and population dynamics. Proc Natl Acad Sci
81:8014-8018.
Samac DA, Tesfaye M. 2003. Review: Plant improvement for tolerance to aluminum in acid soils. Plant Cell Tiss Org 75: 189-207.
Sasaki T, Ezaki B, Matsumoto H. 2002. A gene multidrug resistance (MDR)-like protein is induced by aluminum inhibitors of calcium flux in wheat. Plant Cell Physiol 43:177-185.
Sasaki T, Yamamoto Y, Ezaki B, Katsuhara M, Ahn SJ, Ryan PR, Delhaize E, Matsuoto H, 2004. A wheat gene encoding an aluminum-activated malate transporter. Plant J 37:645-653.
Sawaki Y, Iunchi S, Kobayashi Y, Ikka T, Sakurai N, Shinozaki K, Kobayashi M, Koyama H. 2009. STOP1 regulates multiple genes that protect Arabidopsis from proton and aluminum toxicities. Plant Physiol 150:281-294.
Sivaguru M, Pike S, Gassmann W, Baskin TI. 2002. Aluminum rapidly depolymeries cortical microtubules and depolarizes the plasma membrane: evidence that these responses are mediated by a glutamate receptor. Plant Cell Physiol 44:667-75.
Su G, Park S, Lee S, Murai N.2012. Low co-cultivation temperature at 20˚C resulted in the reproducible maximum increase in both the fresh weight yield and stable expression of gus activity after Agrobacterium tumefaciens -mediated transformation of tobacco leaf disks. Amer. J. Plant Sci 3:537-545. Swonden KC, Rhicards KD, Cardner RC. 1995. Aluminum-induced genes: induction by toxic metals, low calcium, and wounding and pattern of expression in root tips. Plant Physiol 107:341-348.
Taylor GJ, Stephens JL, Hunter DB, Bertsch PM, Elmore D, Rengel Z, Reid R. 2000. Direct measurement of aluminum uptake and distribution in single cells of Chara corallina. Plant Physiol 123:987-996.
Vandesompele J. 2008. qPCR Guide. New York (US): Anaspec
Wahyuningsih E. 2009. Peroksidasi lipid, aktivitas SOD, dan sekresi asam sitrat pada padi lokal Indonesia selama mendapat cekaman Al [Tesis]. Bogor: Program Pascasarjana Institut Pertanian Bogor.
Waigmann E, Chen M, Bachmair R, Ghoshroy S, Cotovsky V. 2000. Regulation of plasmodesmal transport by phosporilation of tobacco mozaic virus cell-to-cell movement protein. EMBO J 19:4875-4884.
Watanabe T, Osaki M. 2001. Influence of aluminum and posphorus on groTLh
Xia JX, Yamaji N, Kasai T, Ma JF 2010. Plasma membrane localized transporter for aluminum in rice. Proc Natl Acad Sci USA 107:18381-18385.
Xia JX, Yamaji N, Ma JF. 2013. A plasma membrane-localized small peptide is involved in rice aluminum tolerance. Plant J 76:345-355.