SITOTOKSISITAS FRAKSI TERAKTIF KEMEDANGAN POHON
PENGHASIL GAHARU JENIS
Aquilaria microcarpa
PADA SEL KANKER PAYUDARA MCF-7
HANNA SEFTIANA
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Sitotoksisitas Fraksi Teraktif Kemedangan Pohon Penghasil Gaharu Jenis Aquilaria microcarpa pada Kanker Payudara MCF-7 adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2015
Hanna Seftiana
ABSTRAK
HANNA SEFTIANA. Sitotoksisitas Fraksi Teraktif Kemedangan Pohon Penghasil Gaharu Jenis Aquilaria microcarpa pada Sel Kanker Payudara MCF-7.
Dibimbing oleh DUDI TOHIR dan ERDY SANTOSO.
Gaharu mengandung senyawa metabolit sekunder dan secara tradisional dimanfaatkan sebagai obat antikanker. Penelitian ini bertujuan menentukan sitotoksisitas fraksi kemendangan pohon penghasil gaharu jenis Aquilaria microcarpa. Sampel dimaserasi menggunakan pelarut etil asetat untuk mengambil senyawa semipolar. Ekstrak difraksionasi menggunakan kromatografi kolom menghasilkan 15 fraksi. Penapisan menggunakan uji letalitas larva udang menunjukkan fraksi 6, 11, 12, dan 13 bersifat toksik. Sitotoksisitas ekstrak kasar etil asetat, 2 fraksi dengan LC50 terendah, yaitu fraksi 11 dan 13, serta doksorubisin sebagai kontrol positif diujikan pada sel lestari MCF-7. Dihasilkan nilai IC50 berturut-turut 0.81, 1.07, 3.44, dan 0.49 µg/mL. Berdasarkan hasil ini, kedua fraksi yang diuji memiliki aktivitas sitotoksik dan berpotensi antikanker. Kedua fraksi masih berupa campuran senyawa, maka diperlukan fraksionasi lebih lanjut untuk mendapatkan senyawa murni yang lebih aktif sebagai antikanker daripada doksorubisin.
Kata kunci:antikanker, fraksionasi, kemedangan, sitotoksisitas
ABSTRACT
HANNA SEFTIANA. Cytotoxicity of The Most Active Fraction from a
Kemedangan of Aquilaria microcarpa Agarwood-Producing Trees against MCF-7 Breast Cancer Cell. Supervised by DUDI TOHIR dan ERDY SANTOSO.
Agarwood contain secondary metabolites that are traditionally used as an anticancer drug. This study aimed to determine cytotoxicity fraction from a
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Kimia
SITOTOKSISITAS FRAKSI TERAKTIF KEMEDANGAN POHON
PENGHASIL GAHARU JENIS
Aquilaria microcarpa
PADA SEL KANKER PAYUDARA MCF-7
HANNA SEFTIANA
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah dengan judul Sitotoksisitas Fraksi Teraktif Kemedangan Pohon Penghasil Gaharu Jenis Aquilaria microcarpa pada Sel Kanker Payudara MCF-7 berhasil diselesaikan. Karya ilmiah ini dilaksanakan pada bulan Desember 2014−Mei 2015 di Laboratorium Kimia Organik, Departemen Kimia dan Pusat Studi Satwa Primata, IPB.
Terima kasih penulis ucapkan kepada Bapak Drs Dudi Tohir, MS dan Dr Erdy Santoso, MS atas bimbingan dan ilmu yang telah diberikan, Bapak Sabur, Ibu Yenni, dan Ibu Nia atas segala motivasi, nasihat, dan pembelajaran selama di laboratorium. Ungkapan terima kasih yang teramat dalam penulis ucapkan kepada kedua orang tua dan seluruh keluarga yang senantiasa mendoakan dan mendukung penulis. Selain itu, terima kasih penulis sampaikan kepada Dyra, keluarga Kimia Organik dan keluarga besar Kimia angkatan 48 yang telah banyak membantu penulis.
Penulis berharap karya ilmiah ini dapat bermanfaat bagi pembaca pada umumnya dan penulis pada khususnya.
Bogor, Agustus 2015
DAFTAR ISI
DAFTAR TABEL vii
DAFTAR GAMBAR vii
DAFTAR LAMPIRAN vii
PENDAHULUAN 1
METODE 2
Waktu dan Tempat 2
Bahan dan Alat 2
Preparasi Sampel 2
Penentuan Kadar Air 2
Ekstraksi 3
Uji Fitokimia 3
Penentuan Eluen Terbaik 4
Fraksionasi Ekstrak Etil Asetat dengan Kromatografi Kolom 4 Uji Toksisitas Terhadap Larva Udang A. salina (BSLT) 4
Uji Sitotoksisitas dengan Metode MTT 5
HASIL DAN PEMBAHASAN 5
Kadar Air dan Hasil Ekstraksi 5
Fitokimia Ekstrak Etil Asetat 6
Fraksi Ekstrak Etil Asetat 6
Toksisitas Ekstrak Etil Asetat dan Fraksi-fraksi Hasil Kromatografi
Kolom 9
Sitotoksisitas Ekstrak Etil Asetat dan Fraksi-fraksi Hasil Kromatografi
Kolom 10
SIMPULAN DAN SARAN 12
Simpulan 12
Saran 12
DAFTAR PUSTAKA 12
LAMPIRAN 15
DAFTAR TABEL
1 Rendemen ekstrak etil asetat 6
2 Nilai Rf ekstrak etil asetat pada beberapa eluen tunggal di bawah sinar UV
pada 254 dan 366 nm 7
3 Nilai Rf ekstrak etil asetat pada berbagai nisbah eluen n-heksana:etil asetat
di bawah sinar UV pada 254 dan 366 nm 8
DAFTAR GAMBAR
1 Kemedangan A. microcarpa 6
2 Profil noda pencarian eluen terbaik ekstrak etil asetat eluen aseton (A), etil asetat (B), diklorometana (C), metanol (D), dan n-heksana (E) di bawah
sinar UV pada 254 dan 366 nm 7
3 Profil noda pencarian eluen terbaik ekstrak etil asetat campuran n -heksana-etil asetat dengan nisbah 9:1 sampai 1:9 di bawah sinar UV pada 254 dan
366 nm 8
4 Kromatogram 15 fraksi etil asetat 9
5 LC50 ekstrak etil asetat dan hasil fraksionasi 10
6 Reaksi pembentukan formazan 11
7 IC50 ekstrak etil asetat, fraksi 11, fraksi 13, dan doksorubisin pada sel
kanker payudara MCF-7 11
DAFTAR LAMPIRAN
1 Bagan alir penelitian 15
2 Kadar air simplisia 16
3 Hasil uji fitokimia ekstrak etil asetat 16
4 Rendemen dan Rf hasil fraksionasi menggunakan kromatografi kolom 17 5 Toksisitas hasil fraksionasi ekstrak etil asetat 17 6 Hasil uji sitotoksisitas ekstrak etil asetat, fraksi 11, dan fraksi 13 terhadap
sel kaker payudara MCF-7 22
7 Hasil uji sitotoksisitas doksorubisin pada sel kanker payudara MCF-7 24 8 Profil mikroskopik penghambatan sel kanker payudara MCF-7 kontrol
negatif (A), ekstrak etil asetat (B), fraksi 11 (C), fraksi 13 (D), dan kontrol
PENDAHULUAN
Pohon penghasil gaharu berasal dari famili Thymelaeceae dengan genus
Aquilaria dan Gyrinops (Tarigan 2004), disebut juga agarwood, eaglewood, atau
karas (Novriyanti 2009). Gaharu merupakan hasil hutan bukan kayu berupa resin aromatik yang memiliki harga jual yang tinggi (Bhuiyan et al. 2009). Pembentukan gaharu terjadi melalui proses kimia dan fisika akibat respons terhadap infeksi jamur pada pohon penghasil gaharu. Gaharu berbentuk padat, berwarna cokelat kehitaman sampai hitam, berbau harum, dan biasanya terdapat pada bagian kayu atau akar. Warna cokelat kehitaman dihasilkan dari akumulasi senyawa metabolit sekunder yang terbentuk pada pohon penghasil gaharu di bagian gubal (Santoso et al. 2007). Kemedangan gaharu sendiri adalah kayu dari pohon penghasil gaharu yang berwarna putih keabu-abuan hingga kecokelatan dan memiliki kandungan damar wangi serta aroma yang lemah.
Gaharu mengandung senyawa metabolit sekunder yang digunakan sebagai pertahanan diri dari serangan luar. Senyawa metabolit sekunder yang terkandung pada gaharu meliputi kelompok seskuiterpena (Novriyanti 2008) dengan komponen utama berupa furanoid seskuiterpena (α-agarofuran, (−)-10-epi-β -agarospirol) (Burfield 2005), steroid (Annas 2014), flavonoid, alkaloid, fenolik (Ramadhan 2013; Annas 2014), dan triterpenoid (Ramadhan 2013). Menurut Muntaqo (2012), senyawa penciri pada gaharu adalah seskuiterpena. Kandungan metabolit sekunder pada gaharu secara tradisional dimanfaatkan sebagai obat penenang, obat pencernaan, penahan rasa sakit (Yagura et al. 2005), obat antikanker, obat malaria, stimulasi kerja syaraf, dan obat sakit perut (Mega dan Swastini 2010).
Ekstrak etil asetat kemedangan Aquilaria microcarpa memiliki konsetrasi mematikan 50% (LC50) sebesar 18.77 ppm sehingga dimungkinkan memiliki konsentrasi penghambatan 50% (lC50) yang baik pula dan berpotensi menghambat sel kanker (Sari 2013). Menurut American Cancer Society (2011), suatu bahan atau ekstrak memiliki aktivitas antikanker apabila nilai LC50 kurang dari 30
g/mL. Kanker merupakan penyebab kematian kedua setelah penyakit jantung dan di Indonesia sendiri diperkirakan setiap tahun terdapat 100 penderita kanker baru dari 100 ribu penduduk (Sukardiman et al. 2006). WHO (2014) melaporkan bahwa pada tahun 2012, kanker payudara di wilayah Asia Tenggara merupakan penyebab kematian ketiga setelah kanker paru-paru dan kanker mulut. Pengobatan kanker secara medis yang selama ini umumnya dilakukan adalah melalui pembedahan (operasi), penyinaran (radiasi), dan terapi kimia (kemoterapi).
2
METODE
Waktu dan Tempat
Penelitian dilaksanakan pada bulan Desember 2014−Mei 2015 mengikuti diagram alir (Lampiran 1) di Laboratorium Kimia Organik, Departemen Kimia, Institut Pertanian Bogor (IPB) dan Laboratorium Mikrobiologi, Pusat Studi Studi Satwa Primata (PSSP) IPB, Bogor.
Bahan dan Alat
Bahan-bahan yang digunakan pada penelitian ini antara lain kemedangan gaharu jenis A. microcarpa yang diambil dari Kawasan Hutan dengan Tujuan Khusus (KHDTK) Carita, Banten, akuades, n-heksana, etil asetat, metanol, air laut, larva udang Artemia salina Leach, HCl pekat, n-amil alkohol, aseton, diklorometana, pereaksi Lieberman-Buchard, kloroform-amonia, H2SO4 2 M, pereaksi Mayer, Dragendorf, Wagner, serbuk Mg, pereaksi FeCl3 1%, NaOH 10%, dimetil sulfoksida (DMSO), pelat silika gel 60 GF254, silika gel 60 (0.040−0.063 mm), sel lestari kanker payudara MCF-7 koleksi PSSP IPB, doksorubisin, etanol 96%, media Rosewell Park Memorial Institute (RPMI), dan 3-(4,5-dimetiltiazol-2-il)2,5- difeniltetrazolium bromida (MTT). Alat yang digunakan antara lain alat-alat kaca, neraca analitik, penguap putar, radas distilasi, kolom kromatografi, lampu ultraviolet (UV), pelat tetes, mikropipet dan tip, aerator, serta seperangkat alat uji antikanker termasuk spektrofotometer ELISA microplate reader dan inkubator CO2.
Preparasi Sampel
Sampel kemedangan dikeringkan di dalam oven sampai kadar air kurang dari 10% pada suhu tidak lebih dari 50 °C. Sampel yang telah dikeringkan kemudian digiling hingga menjadi serbuk berukuran sekitar 60 mesh yang selanjutnya disebut simplisia.
Penentuan Kadar Air (AOAC 2006)
Kadar air % = ( − ) × %
Keterangan: A = bobot awal (g)
B = bobot akhir (g)
Ekstraksi
Metode ekstraksi yang digunakan adalah maserasi menggunakan pelarut etil asetat. Nisbah pelarut dengan simplisia adalah 8:1, dimaserasi selama 3 × 24 jam, kemudian fitrat dipisahkan dari residunya, dan dipekatkan dengan penguap putar (Sari 2013). Persen rendemennya ditentukan berdasarkan nisbah bobot ekstrak setelah dipekatkan dengan bobot sampel awal.
Rendemen % = x − × % ekstrak kasar kemudian disaring. Filtrat ditambahkan dengan beberapa tetes H2SO4 2 M, kemudian dikocok hingga terbentuk 2 lapisan. Lapisan asam tidak berwarna dibagi ke dalam 3 tabung reaksi untuk ditambahkan pereaksi Mayer, Wagner, dan Dragendorf ke dalam tabung reaksi berbeda. Uji positif alkaloid ditandai dengan terbentuknya endapan putih, cokelat, dan merah jingga pada penambahan setiap pereaksi.
Uji Triterpenoid dan Steroid
Campuran 0.1 g ekstrak kasar dengan 2.5 mL etanol dipanaskan pada suhu 50 °C kemudian disaring. Filtrat yang diperoleh lalu dipekatkan, lalu dilarutkan dengan eter. Lapisan eter diteteskan di atas pelat tetes dan dikeringudarakan, lalu ditetesi pereaksi Lieberman Buchard. Warna merah menunjukkan uji positif triterpenoid, sedangkan warna hijau atau biru menunjukkan uji positif steroid.
Uji Fenol dan Flavonoid
4
1 mL n-amilalkohol lalu dikocok. Terbentuknya warna merah, kuning, atau jingga menunjukkan uji positif flavonoid.
Uji Saponin dan Tanin
Lima mL akuades ditambahkan dengan 0,1 g ekstrak kasar lalu dididihkan selama 5 menit. Larutan kemudian disaring dan dibagi menjadi 2. Uji saponin dilakukan dengan mendinginkan sebagian filtrat dan dikocok hingga berbusa. Uji positif saponin ditunjukkan dengan tidak hilangnya busa setelah 10 menit. Uji tanin dilakukan dengan menambahkan filtrat dengan larutan FeCl3 1%. Warna biru tua atau hijau kehitaman menandakan uji yang positif.
Penentuan Eluen Terbaik
Pelat KLT jenis silika gel dipotong dengan lebar 1 cm, tinggi 5 cm, dan garis tepi 0,5 cm. Ekstrak etil asetat yang telah dilarutkan dalam pelarut ekstraksi ditotolkan pada pelat KLT. Setelah kering, pelat tersebut dielusi dalam bejana berisi eluen tunggal yang telah dijenuhkan. Eluen tunggal yang digunakan terdiri atas n-heksana, aseton, diklorometana, etil asetat, dan metanol. Elusi dilakukan hingga eluen mencapai garis batas atas pada pelat, kemudian pelat diangkat dan dikeringkan. Noda pemisahan diamati di bawah sinar UV pada 254 dan 366 nm. Eluen campuran yang digunakan, yaitu berbagai nisbah dari n-heksana, diklorometana, dan etil asetat.
Fraksionasi Ekstrak Etil Asetat dengan Kromatografi Kolom
Sebanyak 300 g silika gel digunakan untuk pemisahan 2.98 g ekstrak pekat eltil asetat menggunakan kolom kromatografi dengan diameter 5 cm dan tinggi 100 cm. Ekstrak dilarutkan dalam etil asetat, lalu dipisahkan dengan sistem campuran eluen terbaik dengan kepolaran yang semakin meningkat mulai dari n-heksana hingga etil asetat. Eluat dari kolom ditampung setiap 5 mL pada tabung reaksi dan pola pemisahannya dipantau menggunakan KLT. Noda hasil elusi diamati di bawah sinar UV pada 254 dan 366 nm. Eluat yang menghasilkan jumlah dan pola noda yang sama digabungkan menjadi 1 fraksi. Tiap fraksi dipekatkan menggunakan penguap putar.
Uji Toksisitas terhadap Larva Udang A. salina
Seujung sudip (50−100 mg) telur A. salina dimasukkan ke dalam wadah berisi air laut yang dialiri udara menggunakan aerator.Telur ditetaskan pada suhu 25−30 °C dan pH 6−7 di bawah pencahayaan lampu agar menetas sempurna. Larva siap digunakan untuk uji toksisitas setelah berumur 48 jam. Larutan stok konsentrasi 1000 g/mL dibuat dengan melarutkan ekstrak dengan air laut dan ditambahkan sedikit DMSO untuk membantu melarutkan ekstrak.
25, 50, 100, 150, 200, dan 500 g/mL. Setiap konsentrasi diuji 3 kali ulangan. Persen kematian A. salina diperoleh berdasarkan persamaan berikut:
Kematian larva % = ( . ������ mati sampel − blangkoJumlah . ������ uji ) × %
Persen kematian yang diperoleh dikonversi ke dalam nilai probit. Blangko
(0 g/mL) yang digunakan ialah air laut berisi 10 ekor A. salina dengan penambahan DMSO. Nilai LC50 diperoleh dari persamaan regresi grafik hubungan logaritma konsentrasi sampel uji dengan nilai probit.
Uji Sitotoksisitas dengan Metode MTT (Zackary 2003)
Pengujian dilakukan pada sel kanker payudara MCF-7. Sel MCF-7 diinokulasi pada pelat 96-sumur dalam media RPMI dengan jumlah media penumbuh 100 L/sumur yang mengandung 5000 sel/sumur. Sebanyak 100 L ekstrak aktif dengan konsentrasi 12.5, 25, 50, 100, 200, dan 400 g/mL ditambahkan pada inokulan, kemudian diinkubasi selama 48 jam dalam inkubator CO2 5% pada suhu 37 °C. Selanjutnya setiap sumur ditambahkan 100 L MTT dan diinkubasi kembali selama 4 jam dalam inkubator CO2 5%. Sel hidup akan bereaksi dengan MTT membentuk formazan yang berwarna biru.
6
air yang baik adalah kurang dari 10 % sehingga memberikan ketahanan terhadap mikrob yang baik selama proses penyimpanan.
Gambar 1 Kemedangan A. microcarpa
Simplisia yang telah diketahui kadar airnya diekstraksi secara maserasi menggunakan pelarut etil asetat. Teknik ekstraksi maserasi lazim digunakan untuk mengekstraksi jaringan tanaman yang belum diketahui kandungan senyawanya sehingga mengurangi kemungkinan rusaknya komponen yang bersifat tidak tahan panas. Kekurangan metode ekstraksi ini adalah banyaknya pelarut yang dibutuhkan serta waktu yang relatif lama (Harborne 1987). Pelarut etil asetat akan menarik senyawa semipolar didasarkan pada prinsip kelarutan, yaitu like dissolve like. Sari (2013) melaporkan bahwa ekstrak etil asetat A. microcarpa memiliki LC50 sebesar 18.77 µg/mL, sehingga dimungkinkan memiliki lC50 yang baik pula dan berpotensi menghambat sel kanker.
Rendemen dari ekstrak etil asetat basah dan kering berturut-turut adalah 0.31% dan 0.32% (Tabel 1). Rendemen pada ekstrak etil asetat yang diperoleh jauh lebih kecil dibandingkan laporan Sari (2013), yaitu sebesar 1.05%. perbedaan ini dipengaruhi oleh banyaknya kandungan gaharu dalam sampel.
Tabel 1 Rendemen ekstrak etil asetat Ekstrak
kasar
Bobot (g) Rendemen (%) Sampel Ekstrak Basah Kering Etil asetat 1000.00 3.0931 0.31 0.32
Fitokimia Ekstrak Etil Asetat
meratanya proses metabolisme sehingga metabolit sekunder tidak tersebar merata (Sari 2013).
Fraksi Ekstrak Etil Asetat
Fraksionasi adalah proses pemisahan senyawa-senyawa dalam suatu ekstrak menjadi fraksi-fraksi berdasarkan kepolarannya (Harvey 2000). Suatu teknik pemisahan yang umum digunakan ialah kromatografi. Kromatografi merupakan suatu teknik pemisahan berdasarkan distribusi antara fase gerak dan fase diam (Harvey 2000). Beberapa metode kromatografi yang umum digunakan adalah KLT, kromatografi kolom, kromatografi kertas, kromatografi gas, dan kromatografi cair kinerja tinggi (KCKT). Fraksionasi dilakukan menggunakan campuran eluen terbaik.
Eluen terbaik untuk ekstrak etil asetat A. microcarpa dipilih menggunakan teknik KLT dengan fase diam silika gel dan fase gerak (eluen) metanol, diklorometana, n-heksana, aseton, dan etil asetat. Campuran eluen terbaik ditentukan berdasarkan jumlah noda dan keterpisahannya. Menurut Suirta et al.
(2007), eluen yang baik mampu memisahkan noda dalam jumlah banyak dan jarak yang berjauhan.
Hasil KLT (Gambar 2) menunjukkan bahwa eluen etil asetat dan diklorometana dapat menghasilkan jumlah noda yang lebih banyak dibandingkan eluen lain. Sedangkan, eluen n-heksana dapat menahan pergerakan pemisahan sampel sehingga hanya sedikit noda yang dihasilkan (Tabel 2). Berdasarkan hal tersebut dipilihlah ketiga eluen tersebut untuk dikombinasikan guna mendapatkan eluen terbaik yang dapat memisahkan dengan jumlah yang banyak dan terpisah dengan baik di bawah sinar pada UV 254 dan 366 nm.
Gambar 2 Profil noda pencarian eluen terbaik ekstrak etil asetat eluen aseton (A), etil asetat (B), diklorometana (C), metanol (D), dan n-heksana (E) di bawah sinar UV pada 254 dan 366 nm
Tabel 2 Nilai Rf ekstrak etil asetat pada beberapa eluen tunggal di bawah sinar UV pada 254 dan 366 nm
Eluen Rf
Aseton 0.20, 0.70
Etil asetat 0.12, 015, 0.25, 0.32, 0.51, 0.52, 0.65, 0.75, 0.82, 0.89 Diklorometana 0.05, 0.14, 0.18, 0.32, 0.39, 0.47, 0.54, 0.62, 0.67, 0.88, 0.96 Metanol 0.02, 0.33, 0.61, 0.71, 0.83
n-Heksana 0.04, 0.27, 0.70
A B C D E
8
Eluen-eluen tersebut kemudian dikombinasikan dengan berbagai nisbah termasuk menggunakan simplex centroid designs (SCD) tetapi, tidak didapatkan pemisahan yang baik. Eluen n-heksana−etil asetat dibuat dengan berbagai komposisi (9:1 hingga 1:9) untuk mendapatkan komposisi yang menghasilkan pemisahan terbaik (Gambar 3). Tabel 3 menunjukkan eluen n-heksana-etil asetat dengan nisbah 7:3 menghasilkan noda paling banyak dan terpisah dengan baik dibandingkan nisbah eluen lain, maka eluen ini dipilih sebagai campuran eluen terbaik.
Gambar 3 Profil noda pencarian eluen terbaik ekstrak etil asetat menggunakan campuran n-heksana-etil asetat dengan nisbah 9:1 sampai 1:9 (A-I) di bawah sinar UV pada 254 dan 366 nm
Tabel 3 Nilai Rf ekstrak etil asetat pada berbagai nisbah eluen n-heksana:etil asetat di bawah sinar UV pada 254 dan 366 nm
Eluen (n-heksana:etil asetat) Rf 1:9 0.32, 0.68, 0.82
2:8 0.11, 0.53
3:7 0.23, 0.57, 0.72, 0.82, 0.92 4:6 0.38, 0.65, 0.75, 0.86, 0.9130 5:5 0.50, 0.80, 0.91
6:4 0.41, 0.71, 0.80, 0.92
7:3 0.10, 0.21, 0.41, 0.58, 0.77, 0.83, 0.91 8:2 0.59, 0.26, 0.36, 0.50, 0.72, 0.80
9:1 0.11
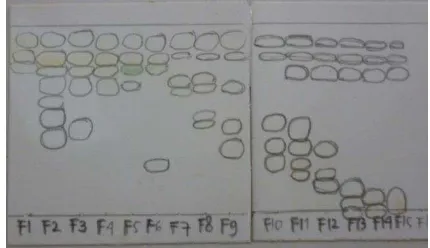
Fraksionasi ekstrak etil asetat dilakukan menggunakan sistem elusi step gradien dan menghasilkan 15 fraksi dengan nilai Rf yang berbeda (Lampiran 4). Terlihat pada Gambar 4 bahwa belum ada fraksi yang mengandung senyawa murni, semuanya masih berupa campuran. Semua fraksi tersebut selanjutnya diuji toksisitasnya.
Gambar 4 Kromatogram 15 fraksi ekstrak etil asetat
Toksisitas Ekstrak Etil Asetat dan Fraksi-fraksi Hasil Kromatografi Kolom
Uji toksisitas menggunakan larva udang atau lebih dikenal sebagai uji letalitas larva udang (BSLT) lazim digunakan untuk mendeteksi senyawa yang memiliki toksisitas. Toksisitas dinyatakan dengan menggunakan nilai LC50, yaitu konsentrasi yang dibutuhkan untuk membunuh 50% populasi hewan uji. Uji toksisitas ini memiliki spektrum farmakologi yang luas, dengan prosedur yang dapat dipercaya, cepat, dan tidak memerlukan biaya besar (Mclaughlin et al.
1998). Metode ini sering digunakan terkait dengan identifikasi senyawa antikanker dari tumbuhan.
Beberapa faktor yang memengaruhi ketepatan uji aktivitas ini adalah konsentrasi ekstrak uji yang konstan selama pengujian, penambahan DMSO sebagai pelarut ekstrak, serta ketepatan dan ketelitian dalam menghitung jumlah larva awal dan akhir sehingga dapat memberikan nilai ketepatan uji yang tinggi (Septina 2005). Senyawa kimia dikatakan aktif dan bersifat toksik bila memiliki nilai LC50 kurang dari 1000 ppm yang didapat dari persamaan garis hubungan antara logaritma konsentrasi dan nilai probit (Meyer et al. 1982).
Uji toksisitas dilakukan pada ekstrak etil asetat dan 15 fraksi hasil fraksionasi. Larva udang yang digunakan berumur 48 jam, karena pada kondisi ini daya tahan yang dimiliki terhadap lingkungan paling rendah. Apabila lebih dari 48 jam, faktor lain dapat ikut berpengaruh seperti kandungan oksigen, kebutuhan nutrisi, dan cahaya. Terdapat 2 cara yang menyebabkan kematian larva udang, yaitu melalui inhalasi dan difusi. Inhalasi merupakan masuknya zat yang bersifat toksik ke dalam tubuh larva udang melalui pernapasan, sedangkan difusi terjadi melalui jaringan tipis kulit larva (Sukardiman et al. 2004)
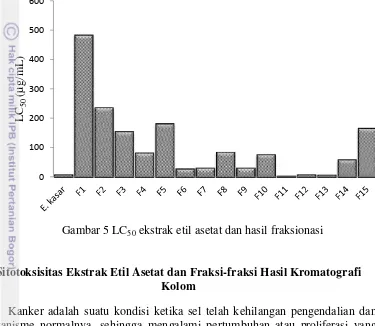
Jumlah larva udang yang mati ditunjukkan pada Lampiran 5. Ekstrak etil asetat memiliki nilai LC50 sebesar 7.6 µg/mL nilai ini lebih rendah daripada yang dilaporkan Sari (2013), yaitu sebesar 18.77 µg/mL. Perbedaan nilai LC50 ini mungkin akibat perbedaan letak pengambilan sampel, iklim, dan umur sampel. Nilai LC50 untuk 15 fraksi menunjukkan nilai yang sangat beragam (Gambar 5, Lampiran 5). Hal ini memperlihatkan bahwa metode fraksionasi dapat memisahkan senyawa dengan cukup baik, sehingga ada fraksi yang memiliki toksisitas yang sangat tinggi, yaitu fraksi 11 dengan nilai LC50 sebesar 3.42 µg/mL sampai yang paling rendah, yaitu fraksi 1 dengan nilai LC50 sebesar 483.24 µg/mL walaupun kromatogram belum menunjukkan adanya senyawa murni.
10
Menurut American Cancer Society (2011) suatu bahan atau ekstrak memiliki aktivitas antikanker apabila nilai LC50-nya kurang dari 30 µg/mL. Berdasarkan acuan tersebut ekstrak etil asetat dan sebanyak 4 fraksi, yaitu fraksi 6, 11, 12, dan 13 dengan nilai LC50 berturut-turut 27.99, 3.42, 7.33, dan 7.12 µg/mL merupakan ekstrak teraktif yang diduga memiliki potensi antikanker dan mungkin memiliki nilai IC50 yang baik pula.
Gambar 5 LC50 ekstrak etil asetat dan hasil fraksionasi
Sitotoksisitas Ekstrak Etil Asetat dan Fraksi-fraksi Hasil Kromatografi Kolom
Kanker adalah suatu kondisi ketika sel telah kehilangan pengendalian dan mekanisme normalnya, sehingga mengalami pertumbuhan atau proliferasi yang tidak normal, cepat, dan tidak terkendali. Obat antikanker yang ideal akan lebih cepat membunuh sel kanker tanpa membahayakan jaringan normal. Pada penelitian ini, uji aktivitas antikanker dilakukan terhadap sel kanker payudara MCF-7 untuk mengetahui potensi penghambatan pertumbuhan sel dengan menggunakan 2 fraksi teraktif yang memiliki rendemen paling besar, yaitu fraksi 11 dan 13(Lampiran 4), ekstrak etil asetat, dan doksorubisin sebagai kontrol positif. Sel MCF-7 merupakan sel kanker payudara yang berasal dari sel epitel duktus payudara (Kumala et al. 2009). Sel tersebut ditumbuhkan pada media RPMI-1640 yang mengandung Fetal bovine serum (FBS) 5% dan antibiotik Penicillin streptomycin (PS) 1%. Kultur sel diinkubasi pada suhu 37 °C dalam inkubator CO2 5% untuk menjaga suhu dan pH fisiologis sel (Rachmani et al. 2012).
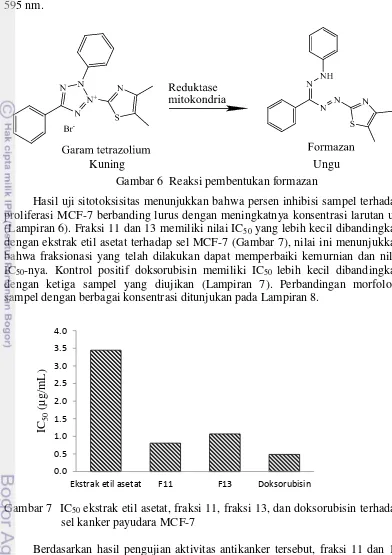
Metode MTT lazim digunakan untuk pengujian sitotoksisitas. Teknik ini menggunakan garam tetrazolium yang berwarna kuning menjadi formazan yang berwarna ungu dalam suatu metabolisme yang melibatkan enzim suksinat dehidrogenase, pada sel hidup di dalam mitokondria sel (Gambar 6). Reaksi pembentukan formazan dihentikan menggunakan larutan etanol 96% yang akan mendenaturasi struktur 3 dimensi protein menjadi unit polipeptida. Intensitas
warna yang dihasilkan kemudian dianalisis menggunakan ELISA reader pada
595 nm.
Kuning Ungu
Gambar 6 Reaksi pembentukan formazan
Hasil uji sitotoksisitas menunjukkan bahwa persen inhibisi sampel terhadap proliferasi MCF-7 berbanding lurus dengan meningkatnya konsentrasi larutan uji (Lampiran 6). Fraksi 11 dan 13 memiliki nilai IC50 yang lebih kecil dibandingkan dengan ekstrak etil asetat terhadap sel MCF-7 (Gambar 7), nilai ini menunjukkan bahwa fraksionasi yang telah dilakukan dapat memperbaiki kemurnian dan nilai IC50-nya. Kontrol positif doksorubisin memiliki IC50 lebih kecil dibandingkan dengan ketiga sampel yang diujikan (Lampiran 7). Perbandingan morfologi sampel dengan berbagai konsentrasi ditunjukan pada Lampiran 8.
Gambar 7 IC50 ekstrak etil asetat, fraksi 11, fraksi 13, dan doksorubisin terhadap sel kanker payudara MCF-7
Berdasarkan hasil pengujian aktivitas antikanker tersebut, fraksi 11 dan 13 memiliki IC50 tidak jauh berbeda. Hal ini terjadi karena proses pemisahan belum dapat memisahkan senyawa dengan sempurna sehingga masih terdapat komponen aktif yang sama. Kedua fraksi tersebut masih memiliki nilai Rf yang sama.
merujuk pada ACS (2011) semua sampel yang diujikan berpotensi sebagai antikanker karena memiliki IC50 kurang dari 30 µg/mL. Walaupun demikian hasil yang diperoleh belum sebaik kontrol positif doksorubisin pada sel kanker
12
payudara MCF-7. Nilai IC50 hasil uji sitotoksisitas menunjukkan pula hubungan searah antara uji toksisitas BSLT dan uji sitotoksisitas MTT.
SIMPULAN DAN SARAN
Simpulan
Ekstrak etil asetat kemedangan A. microcarpa bersifat toksik terhadap larva
A. salina dengan LC50 sebesar 7.61 µg/mL. Fraksionasi ekstrak tersebut menggunakan kromatografi kolom menghasilkan 15 fraksi (F1−F15). Fraksi paling toksik ditunjukan oleh fraksi 11 dengan nilai LC50 sebesar 3.42 µg/mL. Uji sitotoksisitas pada ekstrak etil asetat, fraksi 11, dan 13 juga menunjukan sitotoksisitas tertinggi pada fraksi 11. Potensi antikanker pada sel kanker payudara MCF-7 terlihat pada ekstrak etil asetat, fraksi 11, dan fraksi 13 dengan IC50 masing-masing 3.44, 0.81, dan 1.07 µg/mL. Sehingga dapat disimpulkan bahwa fraksi kemedangan pohon penghasil gaharu jenis A. microcarpa bersifat sitotoksik dan mampu menghambat pertumbuhan sel kanker payudara MCF-7.
Saran
Perlu adanya pengujian sitotoksik pada sel normal (sel Vero) sehingga dapat diperoleh konsentrasi sampel uji yang tepat untuk sel kanker tanpa merusak sel normal. Selain itu, diperlukan pemisahan lebih lanjut menggunakan kromatografi cair kinerja tinggi (KCKT) preparatif untuk memperoleh senyawa murni.
DAFTAR PUSTAKA
[ACS] American Cancer Society. 2011. Breast CancerFacts and Figures 2011-2012. Atlanta (US): ACS. Tersedia pada: http://www.cancer.org/acs/groups
/content/@epidemiologysurveilance/documents/document/acspc-027765.pdf
[AOAC] Association of Official Analytical Chemist. 2006. Official Methods of Analysis. Ed ke-18. Washington DC (US): AOAC.
Annas D. 2014. Fraksionasi ekstrak kemedangan gaharu Aquilaria microcarpa
hasil inokulasi berpotensi antioksidan [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Astuti E, Pranowo D, Puspitasari SD. 2006. Uji sitotoksisitas ekstrak daging dan biji buah Phaleria macrocarpa (Scheff.) Boerl terhadap sel mononuklir normal perifer manusia. Indones. J. Chem. 6(2),212–218.
Burfield T. 2005. Agarwood chemistry [Internet]. [diacu 2014 Sept 14]. Tersedia pada: http://www.cropwatch.org/agarchem.htm.
Harborne JB. 1987. Metode Fitokimia: Penentuan Cara Modern Menganalisis Tumbuhan. Padmawinata K, Soediro I, penerjemah. Bandung (ID): Institut Teknologi Bandung. Terjemahan dari: Phytochemical Methods.
Harvey D. 2000. Modern Analytical Chemistry. New York (US): McGraw Hill. Houghton PJ, Raman A. 1998. Laboratory Handbook for The Fractionation of
Natural Extract. London (GB): Chapman and Hall.
Kumala S, Septisetyani EP, Meiyanto E. 2009. Fraksi n-butanolik kapang endofit buah makasar meningkatkan efek apoptosis doxorubusin pada sel MCF-7 [artikel]. Maj Farm Indones. 20(1):42-47.
Lisdawati V, Broto S. 2006. Aktivitas antioksidan dari berbagai fraksi ekstrak daging buah dan kulit biji mahkota dewa (Phaleria macrocarpa) [artikel].
Media Litbang Kesehatan. 16(4).
Mega IM, Swastini DA. 2010. Screening fitokimia dan aktivitas antiradikal bebas ekstrak metanol daun gaharu (Gyrinops versteegii). J Kim. 4(2):187-192. McLaughlin JL, Roggers LL, Anderson JE. 1998. The use of biological assays to
evaluate botanical. Drug Inform J. 32: 513-524.
Meyer BN, Ferigni NR, Putnam JE, Jacobsen RE, Nicholas, McLaughin JL. 1982. Brine shrimp: a convenient general bioassay for active plant constituent.
Planta Med. 45:31-34. doi: 10.1055/s-2007-971236.
Muntaqo FA. 2012. Korelasi kadar seskuiterpena dengan mutu gaharu Standar Nasional Indonesia [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Novriyanti E. 2008. Peranan zat ekstraktif dalam pembentukan gaharu pada
Aquilaria crassna Pierre ex Lecomte dan Aquilaria microcarpa Baill [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Novriyanti E. 2009. Kajian kimia gaharu hasil inokulasi Fusarium sp. pada
Aquilaria microcarpa. Di dalam: Siran SA, Turjaman M, editor.
Pengembangan Teknologi Produksi Gaharu Berbasis Pemberdayaan Masyarakat Sekitar Hutan; 2009 Apr 29; Bogor, Indonesia. Bogor (ID): Pusat Penelitian dan Pengembangan Hutan dan Konservasi Alam bekerja sama dengan ITTO PD 425/06 Rev.(1). hlm 23-38.
Rachmani EPN, Suhesti TS, Widiastuti R, Aditiyono. 2012. The breast of anticancer from leaf extract of Annona muricata against cell line in T47D.
Int J Appl Sci Technol. 2(1):157-164.
Ramadhan PM. 2013. Aktivitas antioksidan ekstrak kemedangan pohon penghasil gaharu hasil inokulasi jenis Aquilaria microcarpa dan Gyrinops verstegii
[skripsi]. Bogor (ID): Institut Pertanian Bogor.
Santoso E, Agustini L, Sitepu IR, Turjaman M. 2007. Efektivitas pembentukan gaharu dan komposisi senyawa resin gaharu pada Aquilaria spp. J Penelitian Hutan dan Konservasi Alam. 4(6):543-551. doi: 4607543551. Sari MK. 2013. Uji aktivitas antikanker ekstrak kemedangan pohon penghasil
gaharu hasil inokulasi[skripsi]. Bogor (ID): Institut Pertanian Bogor.
Septina YA. 2005. Identifikasi dan uji toksisitas asam tanat dalam ekstrak daun ketapang (Terminalia catappa L) [skripsi]. Semarang (ID): Universitas Diponegoro.
14
Sukardiman, Ekasari W, Hapsari PP. 2006. Aktivitas antikanker dan induksi apoptosis fraksi kloroform daun pepaya (Carica papaya L) terhadap kultur sel kanker mieloma. Media Kedokteran Hewan. 22(2).
Sukardiman, Rahman A, Pratiwi FN. 2004. Uji praskrining aktivitas antikanker ekstrak eter dan ekstrak metanol Marchantia cf planiloba Steph. dengan metode uji kematian larva udang dan profil densitometri ekstrak aktif.
Airlangga J Pharm. 4(3):7-10.
Tarigan 2004. Profil Pengusahaan (Budidaya) Gaharu. Jakarta (ID): Pusat Bina Penyuluhan Kehutanan, Departemen Kehutanan.
Yagura T, Shibayama N, Ito M, Kiuchi F, Honda G. 2005. Three novel diepoxy tetrahydrochromones from agarwood artificially produced by intentional wounding. Tetrahedron Lett. 46:4395-4398. doi : 10.10106/j.tetlet.2005.04. 072
Winarno FG. 2002. Kimia Pangan dan Gizi. Jakarta (ID): Gramedia.
[WHO] World Health Organization. 2014. Global Health Estimates 2014 Summary Table: Death by Cause, Age and Sex, by WHO Region, 2000-2012
[Internet]. [diacu 2015 juni 14]. Tersedia pada:http://www.who.int/health info/global_ burder_disease/en/.
Lampiran 1 Bagan alir penelitian
16
Lampiran 2 Kadar air simplisia
Ulangan Bobot sampel (g) Bobot air (g) Kadar air (%) Basah Kering
1 1.0001 0.9678 0.0323 3.23
2 1.0007 0.9767 0.0240 2.40
3 1.0008 0.9724 0.0284 2.84
Rerata 2.82
Standar deviasi 0.42
Contoh perhitungan kadar air (ulangan 1);
Kadar air =Bobot sampel basah − Bobot sampel keringBobot sampel basah × %
= [ . g − .. g g] × %
Kadar air = . %
Rerata kadar air =Kadar air ulangan + ulangan + ulangan
= . % + . % + . %
Rerata kadar air = . %
Lampiran 3 Hasil uji fitokimia ekstrak etil asetat Uji
Fenolik Flavonoid Steroid
Lampiran 4 Rendemen dan Rf hasil fraksionasi menggunakan kromatografi
Lampiran 5 Toksisitas hasil fraksionasi ekstrak etil asetat Fraksi Konsentrasi
(µg/mL)
Larva mati % Kematian larva
18
lanjutan lampiran 5 Fraksi Konsentrasi
(µg/mL)
Larva mati % Kematian larva
lanjutan lampiran 5 Fraksi Konsentrasi
(µg/mL)
Larva mati % Kematian larva
20
lanjutan lampiran 5 Fraksi Konsentrasi
(µg/mL)
Larva mati % Kematian larva
lanjutan lampiran 5 Fraksi Konsentrasi
(µg/mL)
Larva mati % Kematian larva
Rerata LC50
Contoh perhitungan ekstrak kasar etil asetat; Konsentrasi 10 µg/mL
Rerata larva mati =larva mati + larva mati + larva mati
= + +
Rerata larva mati = .
% Kematian larva =Jumlah larva dalam tiap vial ×Rerata larva mati %
= . × %
0.00 0.50 1.00 1.50 2.00 2.50 3.00
22
Lampiran 6 Hasil uji sitotoksisitas ekstrak etil asetat, fraksi 11, dan fraksi 13 terhadap sel kanker payudara MCF-7
Contoh perhitungan ektrak kasar etil asetat; Konsentrasi 50 µg/mL
Rerata serapan =ulangan + ulangan + ulangan
= . + . + .
lanjutan lampiran 6
% penghambatan =Serapan kontrol negatif − sampelserapan kontrol negatif × %
= . .− , × %
% penghambatan = . %
Persamaan logaritmik : y = 2.7966 ln│ x│+ 1.5411 IC50 diperoleh saat y = 5, maka
5 = 2.7966 │ x│+ 1.5411 ln x =1.2368
IC50 = �� = � . 68
= 3.4447 µg/mL
y = 2.7966ln(x) + 1.5411 R² = 0.9291
3 4 5 6 7 8
3.00 4.00 5.00 6.00 7.00
N
il
ai
Pr
o
b
it
ln Konsentrasi
24
Lampiran 7 Hasil uji sitotoksisitas doksorubisin pada sel kanker payudara MCF-7
Konsentrasi Serapan Rerata %
inhibisi
% penghambatan =serapan kontrol negatif − kontrol positifKontrol negatif × %
= . .− , × %
-1.00 -0.80 -0.60 -0.40 -0.20 0.00 0.20 0.40
lanjutan lampiran 7
Persamaan regresi linear : y = 2.6276x + 5.821 IC50 diperoleh saat y = 5, maka
5 = 2.6276x + 5.821
x = - 0.3125
log Konsentrasi = - 0.3125 IC50 = Anti log x
= Anti log (- 0.3125) = 0.4870 µg/mL
Lampiran 8 Profil mikroskopik penghambatan pertumbuhan sel kanker payudara MCF-7 kontrol negatif (A), ekstrak etil asetat (B), fraksi 11 (C), fraksi 13 (D), dan
kontrol positif doksorubisin (E)
0 µg/mL
A. Kontrol negatif/blangko
50 µg/mL 100 µg/mL
200 µg/mL 400 µg/mL
B. Ekstrak etil asetat
26
lanjutan lampiran 8
12.5 µg/mL 25 µg/mL 50 µg/mL
100 µg/mL 200 µg/mL 400 µg/mL
Fraksi 11 (C)
12.5 µg/mL 25 µg/mL 50 µg/mL
lanjutan lampiran 8
0.125 µg/mL 0.25 µg/mL 0.5 µg/mL
1 µg/mL 2 µg/mL
Kontrol positif doksorubisin (E)
28
RIWAYAT HIDUP
Penulis lahir di Bogor pada 15 September 1993 dari ayah Endang Diana dan ibu Titin Agustini. Penulis merupakan anak pertama dari 4 bersaudara. Tahun 2011, penulis lulus dari SMA Negeri 1 Cigombong dan pada tahun yang sama penulis lulus Seleksi Nasional Masuk Perguruan Tinggi Negeri (SNMPTN) di Departemen Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.