OPTIMASI MEDIA PRODUKSI β-GLUKANASE DARI BAKTERI
PENGHAMBAT CENDAWAN PATOGEN KELAPA SAWIT
DENGAN
RESPONSE SURFACE METHODOLOGY
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2015
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul “Optimasi Media Produksi β-Glukanase dari Bakteri Penghambat Cendawan Patogen Kelapa Sawit dengan Response Surface Methodology” adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Februari 2015
Rike Tri Kumala Dewi
RINGKASAN
RIKE TRI KUMALA DEWI. Optimasi Media Produksi β-Glukanase dari Bakteri Penghambat Cendawan Patogen Kelapa Sawit dengan Response Surface Methodology. Dibimbing oleh NISA RACHMANIA MUBARIK dan MAGGY THENAWIJAYA SUHARTONO.
Enzim β-glukanase dapat mendegradasi polisakarida β-glukan menjadi oligomer sakarida dan monomer glukosa. Aplikasi dari enzim ini salah satunya digunakan sebagai agens biokontrol karena kemampuannya dalam mendegradasi β-glukan yang merupakan senyawa terbesar kedua (setelah kitin) pada dinding sel cendawan patogen. Curvularia affinis dan Colletotrichum gloeosporioides adalah cendawan patogen yang menyebabkan bercak daun dan antraknosa pada saat fase pembibitan kelapa sawit yang dapat menurunkan nilai jual. Beberapa bakteri dikenal mampu menghasilkan enzim β-glukanase yang dapat menghambat pertumbuhan cendawan patogen. Produksi β-glukanase bergantung pada sumber nutrisi serta kondisi fisik pada saat proses kultivasi. Penelitian ini bertujuan untuk mendapatkan kondisi optimum media pada produksi enzim β-glukanase dari bakteri penghambat cendawan patogen kelapa sawit dengan menggunakan
Response Surface Methodology (RSM). Pengendapan β-glukanase dengan amonium sulfat juga dilakukan untuk mengetahui efektivitas β-glukanase dalam menghambat cendawan patogen.
Hasil seleksi isolat bakteri menunjukkan bahwa isolat SAHA 32.6 memiliki indeks glukanolitik terbesar (6.50) dari kedelapan isolat dan mampu menghambat pertumbuhan kedua cendawan patogen dengan persentase 82.78% terhadap
C. gloeosporioides dan 60.60% terhadap C. affinis. Sekuen gen penyandi 16S rRNA menunjukkan bahwa isolat SAHA 32.6 memiliki kemiripan 99% dengan
Bacillus subtilisgalur SCKB1444. Isolat SAHA 32.6 mensekresikan β-glukanase pada awal fase logaritmik dan aktivitas spesifiknya mencapai nilai maksimum pada saat sel mulai memasuki fase stasioner yaitu pada jam ke-12 inkubasi dengan nilai sebesar 0.242 U mg-1, setelah itu aktivitas spesifiknya menurun. Optimasi media produksi β-glukanase isolat SAHA 32.6 menggunakan RSM dengan rancangan percobaan Central Composite Design (CCD) pada tiga variabel (β-glukan oat, ekstrak khamir, dan inokulum bakteri) dan lima taraf kombinasi. Hasil analisis statistik menunjukkan bahwa produksi β-glukanase isolat SAHA 32.6 sangat dipengaruhi oleh inokulum bakteri dibandingkan β-glukan oat dan ekstrak khamir. Produksi β-glukanase isolat SAHA 32.6 maksimum pada media dengan konsentrasi β-glukan oat 2.99%, ekstrak khamir 0.28%, dan inokulum 3.28%, dengan prediksi aktivitas spesifik β-glukanase sebesar 0.365 U mg-1, dan nilai aktual 0.360 U mg-1. Pengendapan menggunakan amonium sulfat 60% dapat meningkatkan aktivitas spesifik β-glukanase sebesar 0.515 U mg-1. β-Glukanase yang diproduksi pada media yang telah dioptimasi dapat menghambat kedua cendawan patogen, namun β-glukanase hasil pengendapan amonium sulfat menunjukkan penghambatan yang lebih baik terhadap kedua cendawan patogen.
SUMMARY
RIKE TRI KUMALA DEWI. Medium Optimization of β-Glucanase Production by Bacteria Used as Biocontrol for Oil Palm Pathogenic Fungi Using Response Surface Methodology. Supervised by NISA RACHMANIA MUBARIK and MAGGY THENAWIJAYA SUHARTONO.
β-Glucanase enzyme can degrade β-glucan polysaccharide to saccharide oligomers and glucose monomers. One application of this enzyme is used as a biocontrol agent for its ability to degrade β-glucan which is the second major polysaccharide (after chitin) in the cell wall of fungal pathogens. Curvularia affinis and Colletotrichum gloeosporioides are fungal pathogens that cause leaf spot and anthracnose during the nursery phase of oil palm which decrease its economic value. Some bacteria have known produce β-glucanase which could inhibit the growth of fungal pathogens. β-Glucanase production depends on nutrition sources and physical conditions during the cultivation process. The aim of this study was to determine optimum media for the production of β-glucanase enzyme by bacteria used as biocontrol for oil palm pathogenic fungi by using Response Surface Methodology (RSM). Precipitation of β-glucanase with ammonium sulphate was also conducted to determine the effectiveness of β-glucanase in inhibiting the fungal pathogens.
The selection of bacterial isolates result indicated that isolate SAHA 32.6 showed the largest of glucanolytic index (6.50) from eight isolates, and able to inhibit the growth of fungal pathogens C. gloeosporioides and C. affinis with percentage respectively 82.78% and 60.60%. Sequence of genes encoding 16S rRNA showed that isolate SAHA 32.6 has 99% similarity with Bacillus subtilis
strain SCKB1444. Isolate SAHA 32.6 secreted β-glucanase in the beginning of logarithmic phase and the specific activity achieved maximum at the time of the cell began to enter the stationary phase, i.e. at 12 h incubation with a value of 0.242 U mg-1, furthermore the specific activity decreased. Medium optimization of β-glucanase production by isolate SAHA 32.6 was carried out using RSM with Central Composite Design (CCD) on three variables (oat β-glucan, yeast extract, and bacterial inoculum) and five level combinations. Statistical analysis showed that β-glucanase production of isolate SAHA 32.6 strongly influenced by bacterial inoculum than oat β-glucan and yeast extract. β-Glucanase production of isolate SAHA 32.6 maximum at 2.99% oat β-glucan, 0.28% yeast extract, and 3.28% bacterial inoculum, resulting in β-glucanase predicted specific activity of 0.365 U mg-1, and the actual value of 0.360 U mg-1. Precipitation using 60% ammonium sulphate was able to increase β-glucanase specific activity to 0.515 U mg-1. β-Glucanase produced by optimum media could inhibit these fungal pathogens, but the precipitated β-glucanase could inhibit these fungal pathogens better.
Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
RIKE TRI KUMALA DEWI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Bioteknologi
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2015
OPTIMASI MEDIA PRODUKSI β-GLUKANASE DARI BAKTERI
PENGHAMBAT CENDAWAN PATOGEN KELAPA SAWIT
Judul Tesis
Nama NIM
: Optimasi Media Produksi P-Glukanase dari Bakteri Penghambat Cendawan Patogen Kelapa Sawit dengn Response Surface Methodology
: Rike Tri Kumala Dewi :P051120091
Ketua
Disetujui oleh
Komisi Pembimbing
Diketahui oleh
Ketua Program Studi Bioteknologi
Prof Dr r Suharsono, DEA Dr lr Dahrul S yah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Februari 2014 sampai Desember 2014 ini ialah Optimasi Produksi Enzim β-glukanase dari bakteri Penghambat Cendawan Patogen Kelapa Sawit denganResponse Surface Methodology.
Terima kasih penulis ucapkan kepada Dr Nisa Rachmania Mubarik, MSi sebagai ketua komisi pembimbing dan Prof Dr Ir Maggy T Suhartono sebagai anggota komisi pembimbing yang telah banyak memberikan nasehat, saran, motivasi, waktu konsultasi, serta solusi dari setiap permasalahan yang dihadapi penulis selama melaksanakan penelitian dan penyusunan karya ilmiah ini. Selain itu penulis ucapkan terima kasih kepada penguji luar komisi Dr I Made Artika, MappSc dan Wakil Ketua Program Studi Bioteknologi IPB Prof Dr Ir Khaswar Syamsu, MSc yang telah memberikan masukan pada saat ujian sidang tesis, serta kepada Prof. Dr. Ir. Suharsono, DEA selaku ketua Program Studi Bioteknologi IPB yang telah banyak memberikan motivasi selama studi. Kepada DIKTI melalui Beasiswa Unggulan selama menempuh pendidikan pascasarjana di IPB, dan terima kasih atas hibah penelitian ABS Funds dari kerjasama CRC-IPB tahun 2014 a.n. Dr Nisa Rachmania Mubarik MSi sehingga penelitian yang penulis lakukan dapat terlaksana dengan baik.
Penulis juga mengucapkan terima kasih kepada Ibu Heni dan Bapak Jaka selaku staf Laboratorium Mikrobiologi IPB, Nurleni, Nur Antriana, Nezharia, Asril, Eliya, Hadi, Dina, Fentri, Zulvia, Desy, Ismi, Nurtika, Asahedi, serta seluruh teman-teman di Laboratorium Mikrobiologi IPB, atas dukungan, motivasi, dan bantuannya selama penelitian ini. Ucapan terima kasih tak terhingga juga penulis ucapkan kepada ayah Sunyoto, ibu Dedeh Mulyaningsih, kakak tercinta Ratna Furi Noviani, SE, dan Rani Dwi Safitri, AMd, serta saudara kembar Rika Tri Kumala Sari, SE tersayang, atas doa, dukungan, kasih sayang, dan semangat yang diberikan. Terima kasih untuk teman-teman seperjuangan di Sekolah Pascasarjana Bioteknologi IPB angkatan 2012 serta seluruh pihak yang telah memberikan doa dan dukungannya, penulis ucapkan terima kasih.
Semoga karya ilmiah ini bermanfaat.
Bogor, Februari 2015
DAFTAR ISI
DAFTAR TABEL viii
DAFTAR GAMBAR viii
DAFTAR LAMPIRAN viii
PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Manfaat Penelitian 2
Ruang Lingkup Penelitian 2
TINJAUAN PUSTAKA 3
Penyakit pada Kelapa Sawit 3
Struktur Dinding Sel Cendawan Patogen 4
β-Glukan 5
Enzim β-Glukanase 6
Bakteri Glukanolitik dan Perannya sebagai Agens Biokontrol 7
Response Surface Methodology 7
METODE 9
Kerangka Penelitian 9
Waktu dan Tempat Penelitian 9
Ekstraksi β-Glukan dari Oat 10
Peremajaan Isolat Bakteri dan Cendawan Patogen 10 Seleksi Isolat Bakteri Glukanolitik 10 Uji Antagonis Isolat Bakteri tehadap Cendawan Patogen 10
Identifikasi Bakteri Terpilih 11
Pembuatan Kurva Pertumbuhan dan Produksi β-Glukanase Ekstrak Kasar 12 Pengukuran Aktivitas β-Glukanase dan Kadar Protein 12 Optimasi Media Produksi β-Glukanase 13 Pengendapan β-Glukanase dengan Amonium Sulfat 14
HASIL DAN PEMBAHASAN 14
Hasil 14
Pembahasan 23
SIMPULAN 28
DAFTAR PUSTAKA 29
LAMPIRAN 34
DAFTAR TABEL
1 Faktor-faktor yang mempengaruhi produksi enzim β-glukanase dari berbagai mikrob denganResponse Surface Methodology
2 Kisaran dan tingkat variabel independen yang diuji dalam matriks rancangan komposit terpusat (Central Composite Design)
3 Seleksi bakteri glukanolitik dan kemampuannya dalam menghambat cendawan patogen pada kondisi pH 7 dan suhu 30 ºC
4 Analisis homologi sekuen gen 16S rRNA isolat SAHA 32.6 dengan data padaGeneBankmenggunakan program BLAST-N
5 Hasil pengendapan protein β-glukanaseB. subtilisSAHA 32.6 6 Perbandingan aktivitas β-glukanase yang dihasilkan beberapa bakteri
DAFTAR GAMBAR
1 Peranan MAP kinaseCMK1dan cAMP-protein kinaseCST1dalam proses infeksi tanaman inang oleh cendawan patogen 3
2 Struktur dinding sel cendawan 4
3 Struktur β-glukan yang terdiri atas ikatan β-1,3 dan β-1,6-glikosidik 5 4 Tahapan yang terjadi pada dinding sel cendawan: pembentukan,
perpanja-ngan, dan pendegradasian rantai glukan 6
5 Kerangka penelitian 9
6 Zona bening yang dihasilkan isolat bakteri 15 7 Pita gen 16S rRNA dan hasil pewarnaan Gram isolat SAHA 32.6 15 8 Konstruksi pohon filogenetik isolat SAHA 32.6 menggunakan metode
Neighbour Joiningdengan nilai ulanganbootstrap1 000 kali 16 9 Pertumbuhan sel dan produksi β-glukanase isolat SAHA 32.6 pada media
produksi 1% glukan cair 17
10 Respons permukaan 3D dan plot kontur aktivitas spesifik β-glukanase isolat SAHA 32.6 sebagai respons dari interaksi dua variabel, variabel
lainnya berada tetap di levelcentre point 19 11 Pengaruh penambahan konsentrasi amonium sulfat terhadap pengendapan
β-glukanaseB. subtilisSAHA 32.6 20 12 Peningkatan aktivitas spesifik β-glukanaseB. subtilisSAHA 32.6 21 13 Efektivitas penghambatan pertumbuhanC. affinisdanC. gloeosporioides
oleh β-glukanase B. subtilisSAHA 32.6 pada media PDA yang diinkubasi
selama 7 hari 22
14 Penghambatan pertumbuhan cendawan patogen oleh β-glukanase
B. subtilisSAHA 32.6 22
DAFTAR LAMPIRAN
1 Skema metode aktivitas β-glukanase 34 2 Prosedur pembuatan reagen yang digunakan dalam penelitian 35 3 Skema metode pengukuran kadar protein 36 4 Penentuan batas atas dan batas bawah variabel berdasarkan
metode konvensional (one factor at a time) 36 5 Rancangan CCD (Central Composite Design) untuk aktivitas
β-glukanase isolat SAHA 32.6 37
6 Indeks glukanolitik pada media glukan dan persentase penghambatan
pertumbuhan cendawan patogen 37
7 Hasil amplifikasi dari gen penyandi 16S rRNA isolat SAHA 32.6 38 8 Nilai log sel, aktivitas β-glukanase, dan kadar protein isolatB. subtilis
SAHA 32.6 berdasarkan waktu inkubasi 38 9 Analisis ragam model kuadratik terhadap aktivitas enzim β-glukanase
B. subtilisSAHA 32.6 39
10 Pengaruh konsentrasi amonium sulfat terhadap aktivitas spesifik
β-glukanaseB. subtilisSAHA 32.6 39 11 Penghambatan pertumbuhan cendawan patogen oleh kultur sel dan
PENDAHULUAN
Latar Belakang
Enzim β-glukanase adalah enzim hidrolitik yang dapat mendegradasi polisakarida β-glukan menjadi monomer glukosa ataupun oligomer (Pitson et al.
1993). Salah satu aplikasi dari enzim ini dapat digunakan sebagai agens biokontrol terhadap beberapa cendawan patogen karena kemampuannya dalam mendegradasi β-glukan. β-Glukan adalah senyawa polisakarida utama yang menyusun dinding sel cendawan setelah kitin (Pitson et al. 1993), dan terdapat pada semua cendawan kecuali kelompok Oomycetes yang memiliki selulosa sebagai komponen utama penyusun dinding selnya (Lorraqueet al.2012).
Curvularia affinis dan Colletrotrichum gloeosporioides adalah cendawan patogen yang menyebabkan bercak daun dan antraknosa pada saat fase pembibitan kelapa sawit. Serangan kedua cendawan ini menyebabkan bibit menjadi kerdil, memperlama umur pembibitan, dan meningkatkan kematian saat penanaman sehingga menurunkan nilai jual (Solehudin et al. 2012). Penyakit bercak daun pada kelapa sawit dilaporkan pertama kali di Indonesia pada tahun 1920 dan semakin menyebar secara masif ke seluruh wilayah Indonesia (Suwandi
et al. 2012). Selain itu, penyakit antraknosa dilaporkan telah menyerang India sejak 10 tahun terakhir (Gautam 2014).
Enzim β-glukanase dihasilkan oleh sejumlah bakteri, diantaranya Bacillus circulans (Aono et al. 1995), Bacillus subtilis (Tang et al. 2004; Manjula dan Podile 2005; Leelasuphakul et al. 2006), Bacillus halodurans(Akita et al. 2005), Bacillus licheniformis(Chaariet al.2012),Bacillus clausii(Miyanishiet al.2003),
Arthrobactersp. (Panget al.2004),Pseudomonas cepacia(Fridlenderet al.1993). Beberapa penelitian menyebutkan enzim β-glukanase yang diproduksi bakteri dapat secara efektif menghambat pertumbuhan cendawan patogen (Aono et al.
1995; Manjula dan Podile 2005; Leelasuphakulet al. 2006). Bacillus subtilisdan
Pseudomonas adalah bakteri yang biasa digunakan sebagai agens biokontrol berbagai penyakit tanaman yang disebabkan cendawan (Saharan dan Nehra 2011).
β-Glukan dan ekstrak khamir merupakan nutrisi penting bagi bakteri dalam peningkatan produksi β-glukanase (Tanget al.2004; Khare dan Uphadyay 2011), demikian pula dengan konsentrasi inokulum (He et al. 2003), serta kondisi fisik dan kimia seperti pH, aerasi, dan suhu. Optimasi kondisi diperlukan untuk meningkatkan produktivitas enzim β-glukanase supaya dapat mendegradasi dinding cendawan patogen lebih baik. Optimasi dengan metode konvensional banyak menghabiskan waktu dan biaya, tidak dapat melihat pengaruh interaksi antar variabel, dan tidak dapat mencapai nilai optimum yang sebenarnya (Heet al.
2
Patelet al. 2011; Jabasingh dan Nachiyar 2012; Kaharet al. 2014). Narasimhanet al. (2013) melakukan optimasi produksi β-glukanase untuk agens biokontrol namun hanya melalui pendekatan konvensional (one-factor at a time). Penelitian mengenai optimasi produksi enzim β-glukanase yang dihasilkan bakteri sebagai agens biokontrol dengan RSM belum banyak dilaporkan sehingga sangat menarik untuk dikaji.
Perumusan Masalah
β-Glukan adalah komponen terbesar kedua setelah kitin pada dinding sel cendawan patogen. Enzim β-glukanase yang dihasilkan bakteri dapat dijadikan agens biokontrol terhadap cendawan patogen penyebab bercak daun dan antraknosa kelapa sawit berdasarkan kemampuannya dalam mendegradasi β-glukan. Produktivitas enzim β-glukanase bergantung pada ketersediaan sumber nutrisi, dan kondisi fisik lingkungan pada proses kultivasi. Penelitian mengenai optimasi produksi enzim β-glukanase yang dihasilkan bakteri sebagai agens biokontrol denganResponse Surface Methodologybelum banyak dilakukan.
Tujuan Penelitian
Penelitian ini bertujuan untuk mendapatkan kondisi optimum media produksi enzim β-glukanase dari bakteri penghambat cendawan patogen kelapa sawit dengan menggunakanResponse Surface Methodology.
Manfaat Penelitian
Penelitian ini diharapkan dapat memberikan informasi mengenai bakteri yang dapat menghasilkan enzim β-glukanase dan kondisi optimum media produksi enzim β-glukanase yang dihasilkannya. Manfaat penelitian ini bagi masyarakat antara lain kelak dapat diaplikasikan untuk mengendalikan cendawan patogen penyebab penyakit bercak daun dan antraknosa pada kelapa sawit.
Ruang Lingkup Penelitian
Ruang lingkup dalam penelitian ini meliputi seleksi isolat bakteri yang potensial menghasilkan enzim β-glukanase dan mampu menghambat pertumbuhan cendawan patogen; identifikasi secara morfologi dan molekuler bakteri terpilih; optimasi media untuk produksi enzim β-glukanase dengan
3
TINJAUAN PUSTAKA
Penyakit pada Kelapa Sawit
Perkembangan perkebunan kelapa sawit di Indonesia mengalami banyak hambatan, diantaranya karena hama dan penyakit. Mikrooganisme yang biasa menyerang kelapa sawit berasal dari cendawan, yaitu Phytium sp., Fussarium,
Alternaria spp., Cladosporium, Penicillium sp., Ganoderma, Curvularia,
Colletrotrichum, Ceratocyctis paradoxa (Omamor et al. 2007; Suwandi 2012).
Curvularia dan Colletotrichumadalah cendawan patogen yang serangannya telah lama menyebar di Indonesia sejak tahun 1920 (Suwandi et al. 2012) dan di India sejak 10 tahun terakhir (Gautam et al.2014). Penyakit ini menyerang daun ketika kelapa sawit sedang dalam fase pembibitan. Curvularia menyebabkan bercak daun dengan gejala berupa bercak kecil seperti tombak berwarna kuning transparan dan semakin meluas (Lubis dan Widanarko 2011). Colletotrichum
penyebab penyakit antraknosa yang menyebabkan bintik-bintik cekung pada daun kelapa sawit yang menyebabkan nekrosis sehingga tidak dapat berfotosintesis; muncul warna coklat dan hitam di antara tulang daun (Agrios 2005; Gautam 2014).
Infeksi cendawan pada tanamang inang dimulai dari tahap penempelan spora, germinasi, pembentukan apresorium, penetrasi, dan kolonisasi pada tanaman inang (Kubo et al. 2005). Cendawan dapat mengenali tanaman inang karena adanya feromon/sinyal nutrien berupa asam lemak alifatik yang ditangkap oleh reseptor pasangan protein G (G-protein coupled resceptor /GPCRs) (Knogge 1998). Sinyal tersebut merupakan secondary messengers bagi cendawan untuk meregulasi ekspresi gen virulensi sebagai respons seluler (Gao et al. 2014). Pada mulanya spora menempel pada jaringan tanaman inang dengan gaya adesif yang lemah, ketika spora bergeminasi gaya adhesifnya menjadi kuat (Kan 2005).
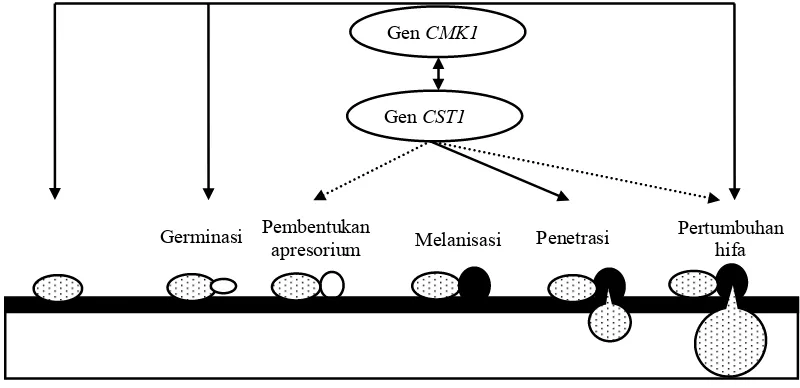
Gambar 1 Peranan MAP kinase CMK1 dan cAMP-protein kinase CST1 dalam proses infeksi tanaman inang oleh cendawan patogen (Kubo et al.
2005)
GenCMK1
GenCST1
4
Spora menempel kuat pada tanaman inang disebabkan senyawa mucilage
dan hidrofobin yang dikeluarkan oleh patogen sebelum terbentuknya tabung germinasi (germ tube) (Yoder dan Turgeon 1996). Tabung germinasi tersusun dari matriks fibrillar yang berfungsi melindungi spora dari dehidrasi dan sistem pertahanan tanaman inang (Kan 2005). Pembentukan apresorium diatur oleh gen pembentuk MAP kinase (Mitotic Activated Protein kinase), yaitu PMK1 atau
CMK1, dan kemampuan berpenetrasinya diatur oleh gen pembentuk cAMP dependent protein kinase, yaitu CST1 (Gambar 1) (Kubo et al. 2005; Gao et al.
2014). Kemampuan berpenetrasi juga dibantu oleh melanin yang berfungsi memberikan tekanan turgor bagi apresorium (Kuboet al.2005). Selama penetrasi spora patogen mengeluarkan enzim kutinase yang mendegradasi kutikula inang, kemudian mengkolonisasi jaringan tanaman inang dengan mengeluarkan enzim pendegradasi dinding sel tanaman inang (selulase, pektinase, protease, amilase, xilanase, mannosidase, rhamnosidase) yang produk hidrolisisnya digunakan sebagai sumber nutrisi bagi patogen (Mendgen dan Hahn 2002; Gao et al.2014) sehingga sel tanaman inang mengalami nekrosis dan muncul bercak-bercak coklat pada selnya (Kan 2005).
Struktur Dinding Sel Cendawan
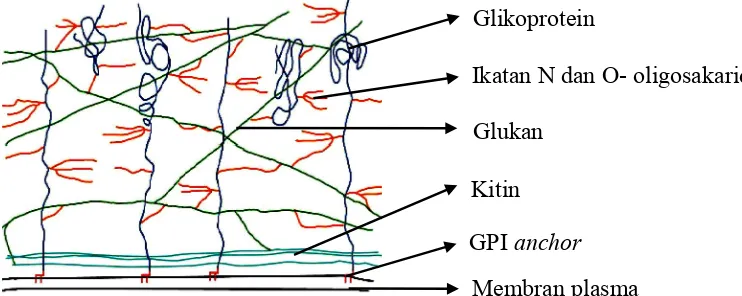
Dinding sel cendawan terdiri atas polisakarida berupa kitin dan glukan sebagai komponen penyusun utama, dan glikoprotein sebagai komponen minor (Bowman dan Free 2006) kecuali kelompok cendawan Oomycetes yang memiliki selulosa sebagai komponen utama penyusun dinding selnya (Lorraque 2012; Pitson et al. 1993). Cendawan patogen Curvularia dan Colletotrichum termasuk ke dalam kelompok Ascomycota sehingga komponen dinding selnya sebagian besar terdiri atas kitin, dan glukan. Cendawan Ascomycota memiliki 39% kitin, 29% glukan, 7% protein, dan 6% lemak pada dinding selnya (Webster dan Weber 2007). Komponen glukan, kitin, dan glikoprotein saling berikatan sehingga membentuk ikatan kompleks yang membentuk struktur dasar dinding sel cendawan (Gambar 2). Kitin berada dekat membran plasma, glukan membentang diagonal di sepanjang dinding sel, dan glikoprotein berada vertikal dan terikat pada membran plasma melalui GPI (Glicosylphosphatidyl-inositol) (Bowman dan Free 2006).
Gambar 2 Struktur dinding sel cendawan (Bowman dan Free 2006) Glikoprotein
Glukan
Kitin
Membran plasma
Ikatan N dan O- oligosakarida
5
β-Glukan
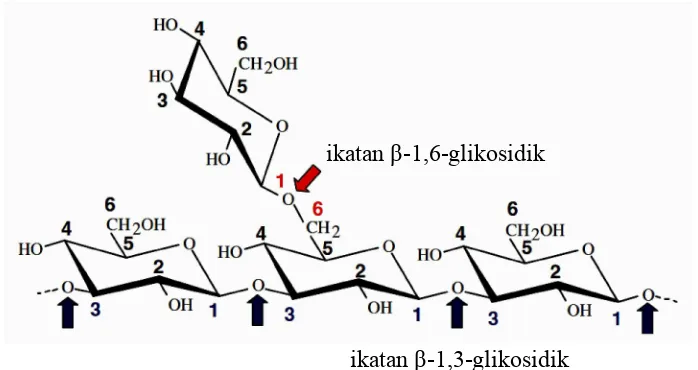
Jumlah glukan pada cendawan sekitar 50-60% dari bobot keringnya, 65-90% diantaranya berupa β-1,3-glukan dan 0-6% diantaranya berupa β-1,6-glukan (disebut callosa/laminarin) (Bowman dan Free 2006). Beberapa cendawan memiliki jenis glukan lainnya seperti β-1,6-glukan (disebut pustulan), β-1,3-1,4-glukan (disebut lichenan), α-1,3- dan α-1,4-β-1,3-1,4-glukan (Gambar 3) (Tobisch et al.
1997; Bowman dan Free 2006; Muskhazali et al. 2009). Beberapa studi menyebutkan bahwa dinding sel khamir memiliki β-1,3-glukan sebagai rantai utama dan β-1,6-glukan sebagai rantai samping, sedangkan untuk cendawan berfilamen hanya memiliki β-1,3-glukan (Bowman dan Free 2006; Muskhazali et al.2009).
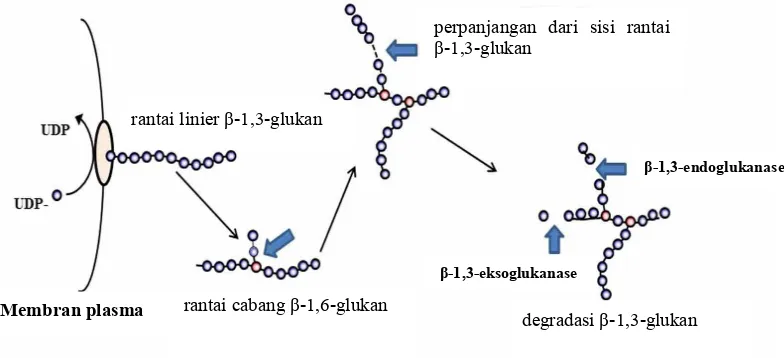
β-Glukan adalah homopolimer dari D-glukosa yang membentuk rantai linier dengan konfigurasi beta (Pitson et al. 1993). β-1,3-Glukan pada cendawan disintesis oleh kompleks enzim glukan sintase yang terikat pada membran plasma menggunakan UDP-glukosa (Uridin difosfat-glukosa) sebagai substrat. Rantai β-1,3-glukan yang terbentuk kemudian ditransfer ke sepanjang dinding sel melalui ruang periplasma (Gambar 4) (Mouynaet al.2013). Rantai β-1,3-glukan memiliki tiga struktur heliks yang menyebabkan dinding sel cendawan menjadi rigid (Kim dan Yun 2006). Namun jika berikatan dengan rantai glukan lainnya menyebabkan pengerutan sehingga mengubah sifat fisiknya seperti kelarutannya dalam air, dan stabilitasnya (Pitson et al. 1993). Selain terdapat pada cendawan, β-glukan juga banyak ditemukan pada beberapa sereal seperti oat, barley, wheat, rye dengan jenis β-1,3-1,4-glukan (Beer et al. 1996). β-Glukan sereal adalah polisakarida linier yang terdiri atas 70% unit β-1,4-glukopiranosil dan 30% unit β-1,3-glukopiranosil. Sebagian besar β-1,3-glukan pada sereal terikat dengan unit selotriosil dan selotetraosil (Wood 2007).
Gambar 3 Struktur βglukan yang terdiri atas ikatan β1,3 dan 1,6 -glikosidik (Martinet al.2007)
ikatan β-1,6-glikosidik
6
Enzim β-glukanase
Glukanase diklasifikasikan ke dalam famili glukosil hidrolase 16 (GH16) (Panget al. 2004; Mouyna et al. 2013). Penggolongan enzim ini cukup beragam, salah satunya berdasarkan jenis ikatan glikosidik yang dihidrolisisnya. Enzim β-glukanase yang menghidrolisis ikatan β-1,3 dikenal sebagai laminarinase, yang menghidrolisis ikatan β-1,3-1,4 dikenal sebagai lichenase (Pang et al. 2004), sedangkan yang menghidrolisis ikatan β-1,4 dikenal sebagai selulase (Samiet al.
2008). Enzim ekstraseluler β-1,3-glukanase yang berasal dari Bacillus circulans
IAM1165 memiliki berat molekul sebesar 28, 42, dan 91 kDa (Aonoet al.1995), enzim selulase yang berasal dariB. subtilisYJ1 memiliki bobot molekul 32,5 kDa (Yin et al. 2010), dan enzim lichenase yang berasal dari Paecilomyces thermophila memiliki berat molekul sebesar 38,6 kDa (Yang et al. 2008). Baik laminarin (β-1,3-glukan) maupun lichenan (β-1,3-1,4-glukan) dapat digunakan sebagai substrat untuk aktivitas enzim β-glukanase dalam menghidrolisis β-1,3-glukan (Aonoet al.1995).
Berdasarkan mekanisme kerjanya, enzim β-1,3-glukanase diklasifikasikan menjadi 2, yaitu: enzim β-1,3-eksoglukanase (β-1,3-glukan glukanohidrolase EC 3.2.1.58), dan enzim β-1,3-endoglukanase (β-1,3-glukan glukanohidrolase EC 3.2.1.6 atau EC 3.2.1.39) (de la Cruzet al.1995). Enzim β-1,3-endo-glukanase bekerja secara random menghidrolisis rantai β-1,3-glukan menjadi 2 sampai 6 unit glukosa, sedangkan enzim eksoglukanase menghidrolisis rantai β-1,3-glukan dengan melepaskan monomer glukosa dari sisi nonreduktif (Pitson et al.
1993). Ikatan yang dilepas pada saat hidrolisis adalah ikatan β-1,3-glukosidik (Gambar 4). Mayoritas enzim ini ialah jenis endoglukanase (Aono et al. 1995). Enzim ini dapat berperan sebagai agens biokontrol; digunakan untuk mengkarakterisasi β-glukan yang berperan sebagai immunomodulator antikanker; meningkatkan nutrisi pakan ternak; berperan dalam pembuatan bir pada proses penggilingan, fermentasi dan penyimpanan; dan berperan dalam sintesis oligosakarida (Pitsonet al.1993).
Gambar 4 Tahapan yang terjadi pada dinding sel cendawan: pembentukan, perpanjangan, dan pendegradasian rantai glukan (Mouynaet al.2013)
Membran plasma
rantai linier β-1,3-glukan
rantai cabang β-1,6-glukan
perpanjangan dari sisi rantai β-1,3-glukan
degradasi β-1,3-glukan
β-1,3-endoglukanase
7
Bakteri Glukanolitik dan Perannya sebagai Agens Biokontrol
Bakteri glukanolitik merupakan bakteri yang memiliki aktivitas enzim glukanase yakni kemampuan mendegradasi glukan. Glukanase yang dihasilkan bakteri bersifat inducible dan disekresikan pada saat fase stasioner pertumbuhan bakteri (Aono e al. 1995; Tang et al. 2004). Glukan digunakan bakteri sebagai sumber karbon alternatif ketika ketersediaan glukosa terbatas (de La Cruz et al.
1995). Glukan didegradasi B. subtilis oleh produk dari gen licS menjadi tetrasakarida yang ditangkap melalui PTS (Sugar Phosphotransferase System) (Tobish et al. 1997). PTS adalah sistem penyerapan spesifik (specific uptake system) pada bakteri yang berkaitan dengan protein transpor gula dan sistem fosforilasi PEP (phosphoenolpyruvate) supaya produk dari hidrolisis glukan dapat ditranspor ke dalam sel (Tobishet al.1999).
Bakteri glukanolitik berperan sebagai agens biokontrol karena aktivitas glukanolitiknya yang mendegradasi β-glukan pada dinding sel cendawan patogen sebagai sumber nutrisi baginya. Oligomer yang dilepas dari rantai β-1,3-glukan cendawan sebagian ditransportasikan ke dalam bakteri melalui sistem penyerapan spesifik (specific uptake system) dan masuk ke jalur metabolisme (Tobisch et al.
1999), sebagiannya lagi berfungsi sebagai elisitor yang merangsang tanaman inang untuk mengeluarkan fitoaleksin (senyawa antimikrob) sebagai sistem pertahanan lebih lanjut dari serangan patogen sehingga membuat bagian tanaman yang belum terinfeksi menjadi lebih tahan terhadap serangan patogen (Shettyet al.
2009; Leubner-Metzger dan Meins 1999). Elisitor terkecil dari rantai β-1,3-glukan ialah β-1,3-β-1,6-heptaglukosida (Leubner-Metzger dan Meins 1999; Klarzynski 2000).
Beberapa bakteri yang dapat mensekresikan β-glukanase ialah Bacillus cepacia untuk merusak integritas dinding sel dari Rhizoctonia solani, Sclerotium roflsii, dan Pythium ultimum (Compant et al. 2005); B. subtilis NSRS 89-24 menghasilkan enzim β-1,3-glukanase yang efektif menghambat pertumbuhan cendawan patogen Pyricularia grisea (Leelasuphakul et al. 2006); Pseudomonas aeruginosa C32a menghasilkan β-1,3-glukanase yang dapat menghambat pertumbuhan cendawan patogen Pyricularia oryzae (Suryadi et al. 2013);
B. subtilis menghasilkan enzim β-1,3-glukanase yang dapat menghambat pertumbuhan cendawan patogen Colletotrichum gloeosporiodes OGC1 (Ashwini dan Srividya 2014).
Response Surface Methodology(RSM)
8
menentukan titik-titik optimum agar dapat ditemukan respons yang maksimum. Rancangan faktorial diperlukan untuk mengombinasikan taraf terendah dan taraf tertinggi masing-masing variabel bebas, sedangkan rancangan titik pusat diperlukan untuk mengombinasikan nilai tengah dari variabel bebas (Dewi et al.
2013).
Optimasi dalam produksi enzim sangat penting dilakukan untuk mencari nilai-nilai optimum variabel yang dapat menghasilkan respons maksimum.. Hubungan tersebut dapat dijelaskan dengan RSM melalui persamaan polinomial yang terdiri atas efek linier, efek kuadratik, dan efek interaksi antar variabel (Haliza et al. 2007). Produksi enzim oleh mikrob tergantung pada senyawa penginduksi (inducer), sumber nutrisi dan kondisi fisik pada saat proses kultivasi. Karbon dan nitrogen merupakan sumber nutrisi bagi bakteri agar dapat tumbuh.
Inducermerupakan senyawa yang dapat menginduksi dihasilkannya suatu enzim, dalam kasus tertentu dapat berperan juga sebagai sumber karbon. Kondisi pH, suhu, dan aerasi juga berpengaruh terhadap produksi enzim dalam hal stabilitas. Beberapa penelitian menjelaskan bahwa produksi β-glukanase dipengaruhi oleh faktor-faktor tersebut (Tabel 1).
Tabel 1 Faktor-faktor yang mempengaruhi produksi enzim β-glukanase dari berbagai mikrob denganResponse Surface Methodology
Bakteri Faktor yang
dioptimasi berpengaruhFaktor yang Referensi
Bacillus subtilis
ZJF-1A5 Usia inokulumKonsentrasi inokulum
ZJF-1A5 TepungTepung jagungbarley Tepung kedelai
harzianumRifai Waktu inkubasipH Aerasi
Waktu
9
METODE
Kerangka Penelitian
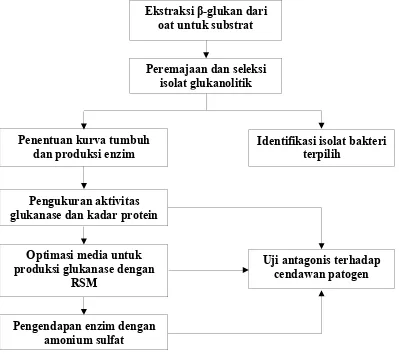
Kerangka penelitian meliputi seleksi isolat penghasil enzim β-glukanase, identifikasi isolat terpilih, optimasi produksi enzim β-glukanase serta pengujian efektivitas β-glukanase dari isolat terhadap cendawan patogen secara in vitro. Pengendapan enzim dengan amonium sulfat juga dilakukan.
Gambar 5 Kerangka penelitian
Waktu dan Tempat
Penelitian ini dilakukan pada bulan Februari 2014-Desember 2014 di Laboratorium Mikrobiologi, Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Ekstraksi β-glukan dari oat untuk substrat
Peremajaan dan seleksi isolat glukanolitik
Penentuan kurva tumbuh
dan produksi enzim Identifikasi isolat bakteriterpilih
Pengukuran aktivitas glukanase dan kadar protein
Uji antagonis terhadap cendawan patogen Optimasi media untuk
produksi glukanase dengan RSM
10
Ekstraksi β-Glukan dari Oat
β-Glukan oat diekstraksi dari bubuk oat berdasarkan metode Beer et al.
(1996) menggunakan larutan basa Na2CO3 20%. Sebanyak 6 g bubuk oat dilarutkan dalam 90 mL air pada suhu 40 ºC. pH larutan diatur hingga mencapai 10 dengan Na2CO320% diaduk selama 30 menit. Kemudian disentrifugasi pada kecepatan 5 000 x g pada suhu 4 ºC selama 15 menit. Filtrat ditambahkan HCl 1 M sampai pH nya mencapai 4.5, disentrifugasi 6 000 x g pada suhu 4 ºC selama 25 menit. Filtrat ditambahkan etanol absolut dan diaduk dengan kecepatan tinggi pada suhu 10 ºC, diendapkan semalam. Filtrat disentrifugasi kembali pada kecepatan 6 000 x g pada suhu 4 ºC selama 25 menit. Pelet diambil dan disimpan dalam bufer fosfat 50 mM pH 7 suhu 10 ºC.
Peremajaan Isolat Bakteri dan Cendawan Patogen
Isolat bakteri (SAHA 3.5, SAHA 2.2, SAHA 12.17, SAHA 2.1, SAHA 3.6, SAHA 3.4, SAHN 13.26, dan SAHA 32.6) dan isolat cendawan patogen (Curvularia affinis dan Colletotrichum gloeosporioides) yang digunakan adalah isolat koleksi IPBCC (Institut Pertanian Bogor Culture Collection) hasil isolasi dari tanah perkebunan kelapa sawit Jambi (Purnamasari 2013). Isolat bakteri diremajakan pada media nutrient agar (NA) yang disuplementasi 1% β-glukan selama 24 jam pada suhu 37 ºC dan disimpan pada suhu 4 ºC sebagai stok. Isolat cendawan patogen diremajakan pada media Potato Dextrose Agar (PDA) dan diinkubasi pada suhu ruang selama 7 x 24 jam.
Seleksi Isolat Bakteri Glukanolitik
Isolat bakteri hasil peremajaan ditotolkan dengan menggunakan tusuk gigi steril ke dalam cawan petri yang berisi media agar glukan yang terdiri atas: 1% β-glukan; 0.15% KH2PO4; 0.065% K2HPO4; 0.25% NaCl; 0.05% (NH4)2SO4; 0.012% MgSO4.7H2O; 0.15% ekstrak khamir; dan 2% agar-agar bacto. Kemudian diinkubasi pada suhu ruang selama 48 jam. Pembentukan zona bening dideteksi dengan larutan pewarnacongo-red(0,1% b/vcongo-red: 1 gcongo-reddalam 1 L alkohol 96%) selama 15 menit, kemudian dicuci dengan 1 M larutan NaCl selama 15 menit (Teather dan Wood 1982). Zona bening yang terbentuk menunjukkan adanya aktivitas enzim β-glukanase, kemudian dihitung indeks glukanolitiknya. Indeks glukanolitik dihitung dengan menggunakan rumus: (A − B) B-1, A adalah diameter zona bening, dan B adalah diameter koloni bakteri.
Uji Antagonis Isolat Bakteri terhadap Cendawan Patogen
11
menggunakan akuades sebagai pengganti bakteri yang dihadapkan dengan cendawan patogen. Persentase penghambatan pertumbuhan cendawan patogen oleh bakteri dihitung dengan mengukur jari-jari cendawan ke arah tepi cawan (R1), dan mengukur jari-jari cendawan ke arah bakteri (R2). Persentase Penghambatan dihitung menggunakan rumus = (R1 – R2) R1-1 x 100%. Ekstrak kasar enzim β-glukanase dari isolat bakteri juga dilakukan uji antagonisme terhadap cendawan patogen dengan metode agar well diffusion. Ekstrak kasar β-glukanase diambil pada waktu inkubasi yang memiliki aktivitas tertinggi.
Identifikasi Bakteri Terpilih
Bakteri ditumbuhkan pada media NA selama 24 jam, kemudian diamati morfologinya yang meliputi bentuk, tepian, dan elevasi koloninya serta bentuk dan jenis sel dengan pewarnaan Gram. Analisis genotipe isolat yang sudah diseleksi diidentifikasi secara molekuler dilakukan berdasarkan analisisDeoxyribo Nucleic Acid (DNA) secara parsial pada ribosomal DNA khususnya pada daerah 16S rRNA (Marchesiet al.1998).
Isolat ditumbuhkan pada media NB selama 24 jam pada suhu 37 ºC. Proses ekstraksi DNA total mengikuti prosedur PrestoTM Mini gDNA Bacteria Kit (Geneaid). Tahap preparasi dimulai dengan 1.5 mL kultur bakteri disentrifugasi pada kecepatan 12 000 rpm (Eppendorf MiniSpin dengan rotor jenis F-45-12-11) selama 1 menit, pelet ditambahkan 180 µL GT bufer lalu diresuspensi, ditambahkan 20 µL proteinase K, diinkubasi pada suhu 60 ºC selama 10 menit dengan dibolak-balik setiap tiga menit sekali. Tahap lisis dilakukan dengan menambahkan 200 µL GB bufer pada larutan DNA yang diinkubasi tadi, lalu dikocok dengan vorteks selama 10 detik dan diinkubasi kembali pada suhu 70 ºC selama 10 menit dengan dibolak-balik setiap 3 menit sekali. Sementara itu bufer
pre-heated disiapkan dengan menginkubasinya pada suhu 70 ºC. Tahap pengikatan DNA dilakukan dengan menambahkan 200 µL etanol absolut secara cepat dan dibolak-balik pada larutan yang diinkubasi tadi, kemudian campuran dituang ke GD kolom yang dimasukkan ke dalam tabung koleksi, disentrifugasi pada kecepatan 12 000 rpm selama 2 menit. Tabung koleksi diganti dengan yang baru. Tahap pencucian dilakukan dengan menambahkan 400 µL WI bufer ke dalam GD kolom kemudian disentrifugasi pada kecepatan 12 000 rpm selama 30 detik. Cairan dibuang, lalu diletakkan GD kolom pada tabung koleksi kembali, kemudian disentrifugasi kembali pada kecepatan 12 000 rpm selama 3 menit. Tahap elusi dilakukan dengan memindahkan GD kolom pada tabung baru lalu ditambahkan 30 µL bufer pre-heated, diamkan selama 3 menit, lalu disentrifugasi pada kecepatan 12 000 rpm selama 30 menit. Didapatkan pelet berupa DNA.
DNA template diamplifikasi dengan Polymerase Chain Reaction (PCR) (EBSCO) menggunakan dua primer universal spesifik untuk bakteri yaitu 63f (5’-CAG GCC TAA CAC AGG CAA GTC) dan 1387r (5’-GGG CGG WGT GTA CAA GGC). Volume reaksi PCR yang digunakan sebanyak 25 µL yang terdiri atas 12.5 µL Go Taq Green Master Mix 2X (Promega, Madison, W1, USA); 2.5 µL primer 63f dan 1387r; 1 µL DNAtemplate; dan 6.5 µL Nuclease Free Water,
12
(95 °C, 1 menit), annealing (55 °C, 1 menit), elongation (72 °C, 1.5 menit),
extension(72 °C, 10 menit) sebanyak 30 siklus. Hasil PCR kemudian divisualisasi dengan elektroforesis 0.8% gel agarosa untuk memeriksa keberadaan DNA. Sebanyak 1 µL sampel DNA dimasukkan ke dalam sumur gel agarosa, dielektroforesis dengan voltase 80 V selama 45 menit. Visualisasi DNA dilakukan di atas UV tarnsluminator menggunakan pewarna Ethidium Bromida (EtBr).
Data sekuens diperoleh dari hasil sekuensing DNA yang dikirim ke1st base
Singapura. Data mentah hasil sekuensing selanjutnya disejajarkan dengan data
GeneBank menggunakan program BLAST-N (Basic Alignment Search Tool-Nucleotide) pada situs online NCBI (National Center for Biotechnology Information). Konstruksi pohon filogenetik dilakukan dengan menggunakan program MEGA 6.06 (MegaSoftware, Inc, Tempe, Arizona, USA)dengan metode
Neighbour Joining(NJ) dengan bootstrap1 000 kali.
Pembuatan Kurva Pertumbuhan dan Produksi β-Glukanase Ekstrak Kasar
Kultur starter disiapkan dengan menginokulasikan isolat bakteri terpilih ke dalam 50 mL kultur media β-glukan cair, diinkubasi pada suhu 37 ºC dan agitasi 130 rpm hingga kepadatan sel bakterinya mencapai 108 CFU mL-1. Selanjutnya, sebanyak 1% inokulum dikultivasi ke dalam 100 mL media produksi β-glukan cair pH 7 pada suhu 37 ºC dan agitasi 130 rpm. Setiap 3 jam sekali selama 24 jam dilakukan pengambilan kultur sel untuk diukur densitas selnya pada panjang gelombang 580 nm. Lalu nilai absorbansinya dimasukkan ke dalam persamaan kurva standar sel. Sebanyak 6 mL kultur sel yang sama disentrifugasi dengan kecepatan 10 000 rpm (Eppendorf MiniSpin dengan rotor jenis F-45-12-11) selama 15 menit, supernatan yang diperoleh merupakan enzim ekstrak kasar kemudian dipindahkan ke tabung mikro untuk diukur aktivitas enzim dan kadar proteinnya.
Pengukuran Aktivitas β-Glukanase dan Kadar Protein
13
Optimasi Media Produksi β-Glukanase
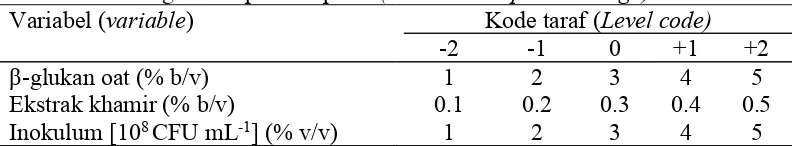
Response Surface Methodology (RSM) digunakan dalam mengoptimasi kondisi untuk produksi enzim β-glukanase yang dihasilkan dari bakteri terpilih. Konsentrasi β-glukan oat (A), ekstrak khamir (B), dan konsentrasi inokulum (C) dijadikan variabel independen pada percobaan yang didesain dengan rancangan komposit terpusat (Central CompositeDesign) dengan 4 ulangan pada titik sentral (center point) yang menghasilkan 18 total unit percobaan (Lampiran 4). Respons yang diamati ialah aktivitas spesifik β-glukanase. Setiap variabel dipelajari pada 5 kode level (-2, -1, 0, +1, +2) (Tabel 2). Central composite design (CCD) digunakan untuk menentukan model kuadratik, mengevaluasi efek kuadratik, dan menggunakan titik sentral untuk mengestimasi variabel independen yang mempengaruhi respon (produksi β-glukanase).
Uji pendahuluan secara konvensional (one factor at a time) dilakukan untuk mengetahui kondisi variabel produksi β-glukanase sehingga dapat menentukan nilai batas atas dan batas bawah. Dalam metode tersebut tiap variabel dicari nilai optimumnya pada berbagai kisaran sementara variabel lainnya diatur pada nilai yang tetap. Batas atas (+1) dan batas bawah (-1) konsentrasi β-glukan oat yang digunakan adalah 2% dan 3%, sedangkan konsentrasi ekstrak khamir yang digunakan adalah 0.2% dan 0.4%. Hasil uji pendahuluan menunjukkan bahwa penambahan β-glukan oat terbaik sebesar 3% dan ekstrak khamir sebesar 0.3% (Lampiran 5). Batas atas dan batas bawah inokulum bakteri ditentukan berdasarkan penelitian He et al. (2003). Inokulum bakteri asal tanah pada penelitian He et al. (2003) optimum pada konsentrasi 3.82% sehingga batas atas ditentukan 2% dan batas bawah ditentukan 4% pada penelitian ini.
Tabel 2 Kisaran dan tingkat variabel independen yang diuji dalam matriks rancangan komposit terpusat(Central Composite Design)
Variabel (variable) Kode taraf (Level code)
-2 -1 0 +1 +2
β-glukan oat (% b/v) 1 2 3 4 5
Ekstrak khamir (% b/v) 0.1 0.2 0.3 0.4 0.5 Inokulum [108CFU mL-1] (% v/v) 1 2 3 4 5
Hubungan antara variabel independen dengan respons dijelaskan dengan persamaan polinomial berikut:
Y = β0+∑ βixi+∑ βijxixj+∑ βiixi2
Y adalah respons (aktivitas spesifik enzim β-glukanase), β0 adalah koefisien intersep, βi(k)adalah koefisien untuk efek linier, βij(k)adalah koefisien untuk efek interaksi, dan βii(k) adalah koefisien untuk efek kuadratik. Xi, Xj, ...., Xk adalah variabel independen yang diuji.
14
disentrifugasi pada kecepatan 10 000 rpm selama 15 menit. Lalu dianalisis aktivitas enzimnya. Komputasi rancangan dilakukan dengan menggunakan
softwarestatistik Design Expert versi 9.03.1 (Stat-Ease Inc., Minneapolis, USA). Koefisien regresi kuadrat (R2) diperoleh dari analisis ketepatan model persamaan tersebut. Level optimum untuk ketiga variabel independen tersebut ditentukan dari analisis persamaan regresi dan 3-D plot respon permukaan. Setelah dilakukan pengolahan data berdasarkan rancangan penelitian menggunakan RSM, selanjutnya dilakukan validasi kondisi optimum yang diperoleh berdasarkan solusi terbaik yang direkomendasikan sotftware secara empiris dan enzim diujikan kembali aktivitasnya pada cendawan patogen.
Pengendapan β-Glukanase dengan Amonium Sulfat
Pengendapan enzim ini dilakukan untuk memperoleh kondisi optimum fraksinasi dengan berbagai persentase kejenuhan amonium sulfat (Scopes 1994). Persentase amonium sulfat yang digunakan ialah pada kisaran (NH4)2SO40-80% (b/v) (Leelasuphakul et al. 2006). Enzim diendapkan dalam keadaan dingin sambil diaduk perlahan menggunakan pengaduk megnetik selama 1 jam. Enzim ekstrak kasar disimpan dalam tabungsentrifugeselama semalam pada suhu 10 ºC. Enzim selanjutnya disentrifugasi pada kecepatan 6 000 rpm, suhu 4 °C selama 30 menit (sentrifuge Hermle dengan rotor 220.97). Endapan enzim dilarutkan dalam bufer fosfat 50 mM pH 7, lalu diukur aktivitas dan kadar proteinnya. Setelah itu endapan dengan aktivitas tertinggi diujikan pada cendawan patogen.
HASIL DAN PEMBAHASAN
Hasil
Seleksi isolat glukanolitik dan penapisan antagonis terhadap cendawan patogen
15
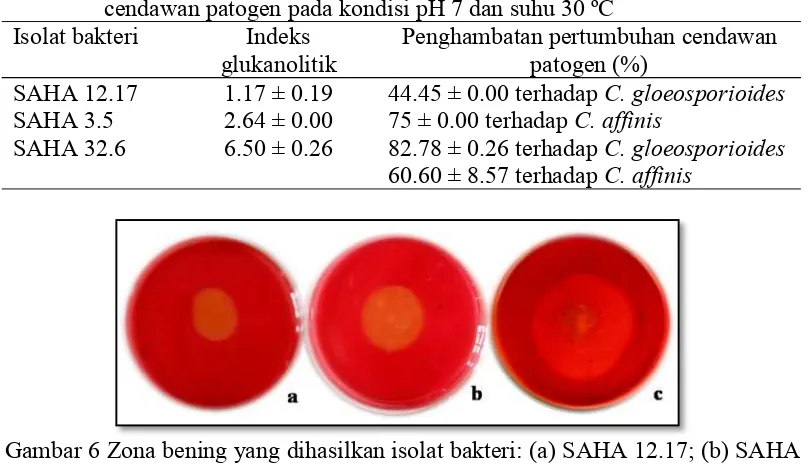
Tabel 3 Seleksi bakteri glukanolitik dan kemampuannya dalam menghambat cendawan patogen pada kondisi pH 7 dan suhu 30 ºC
Isolat bakteri Indeks
glukanolitik Penghambatan pertumbuhan cendawanpatogen (%) SAHA 12.17 1.17 ± 0.19 44.45 ± 0.00 terhadapC. gloeosporioides
SAHA 3.5 2.64 ± 0.00 75 ± 0.00 terhadapC. affinis
SAHA 32.6 6.50 ± 0.26 82.78 ± 0.26 terhadapC. gloeosporioides
60.60 ± 8.57 terhadapC. affinis
Gambar 6 Zona bening yang dihasilkan isolat bakteri: (a) SAHA 12.17; (b) SAHA 3.5; (c) SAHA 32.6 pada media β-glukan hasil ekstraksi bubuk oat pH 7 suhu 30 ºC yang diinkubasi selama 24 jam
Identifikasi bakteri isolat SAHA 32.6
Secara morfologi, isolat SAHA 32.6 memiliki koloni dengan bentuk tidak beraturan dan menyebar, tepian yang berlekuk-lekuk, elevasi yang datar, dan berwarna putih keruh. Hasil pewarnaan Gram menunjukkan Gram positif dan memiliki bentuk sel batang dengan ukuran 4 µm (Gambar 7b). Hasil visualisasi amplifikasi gen penyandi 16S rRNA pada gel agarosa 0.8% menghasilkan produk pita DNA dengan ukuran ±1300 pasang basa (Gambar 7a, Lampiran 7). Analisis sekuen gen penyandi 16S rRNA dengan data pada GeneBank pada program BLAST-N menunjukkan bahwa isolat SAHA 32.6 termasuk ke dalam genus
Bacillusdengan nilai homologi sebesar 99%.
Gambar 7 (a) Pita gen 16S rRNA berukuran ±1300 bp, dan (b) Hasil pewarnaan Gram (perbesaran 1 000 x) isolat SAHA 32.6
750 bp
250 bp 500 bp 1500 bp 1000 bp
±1300 bp
(a) (b)
16
Konstruksi pohon filogenetik dilakukan untuk mengetahui kekerabatan isolat SAHA 32.6 dengan data pada GeneBank. Hasil konstruksi menunjukkan bahwa isolat SAHA 32.6 berada dalam satu klad dengan Bacillus subtilis galur SCKB1444 (no akses KM922583.1) dan Bacillus subtilis galur B2 (no. akses FJ445405.1) (Tabel 4). Hal ini menunjukkan bahwa isolat SAHA 32.6 memiliki hubungan yang dekat denganBacillus subtilis(Gambar 8).
Tabel 4 Analisis homologi sekuen gen 16S rRNA isolat SAHA 32.6 dengan data padaGeneBankmenggunakan program BLAST-N
Nama spesies Homologi
(%) E-value No akses
B. subtilisgalur SCKB 1444 99 0.0 KM922583.1
B. subtilisgalur B2 99 0.0 FJ445405.1
B. subtilisgalur Bp-1 99 0.0 KP229430.1
B. subtilisgalur IC3 99 0.0 KM823958.1
B. subtilisgalur BD1 99 0.0 KM458977.1
Gambar 8 Konstruksi pohon filogenetik isolat SAHA 32.6 menggunakan metode
Neighbour Joiningdengan nilai ulanganbootstrap1 000 kali
Kurva pertumbuhan dan produksi β-glukanase isolat SAHA 32.6
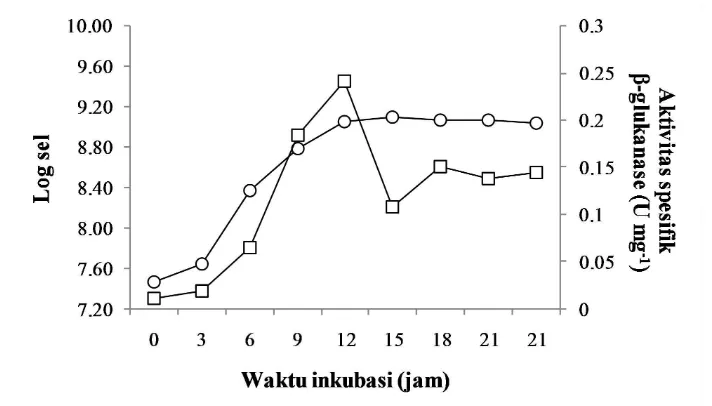
17
Enzim β-glukanase sudah mulai diproduksi pada fase awal eksponensial, yaitu pada jam ke-3. Aktivitas spesifiknya terus meningkat sampai mencapai titik maksimum ketika sel memasuki mulai memasuki fase stationer, yaitu pada jam ke-12 dengan nilai sebesar 0.242 U mg-1 protein. Kemudian pada jam ke-15 aktivitasnya menurun. Namun pada jam ke-18 aktivitasnya naik kembali dan relatif stabil hingga jam ke-24 (Gambar 9, Lampiran 8).
Gambar 9 Pertumbuhan sel (−○−) dan produksi β-glukanase (−□−) isolat SAHA 32.6 pada media produksi 1% glukan cair
Optimasi produksi β-glukanase
Produksi enzim β-glukanase dievaluasi dengan 18 percobaan yang dilakukan dengan 4 kali ulangan padacentre point (Lampiran 4). Proses kultivasi dilakukan selama 12 jam, sesuai dengan waktu inkubasi yang menunjukkan aktivitas tertinggi pada kurva produksi β-glukanase. Data hasil observasi (Lampiran 4) dikomputasi dalam program Design Expert 9.03. Model kuadratik disarankan oleh program tersebut untuk mencari nilai optimum media produksi enzim β-glukanase.
Ketepatan model kuadratik diuji dengan analisis ragam ANOVA (Lampiran 9). Dari analisis tersebut diperoleh bahwa model yang digunakan dengan nilai
probability (prob>F) < 0.0001 sangat signifikan terhadap respon (aktivitas β-glukanase). Pengujian ketidaktepatan model lack of fit dilakukan untuk melihat ketidakcocokkan antara model dengan rancangan kuadratik. Hasilnya menunjukkan data yang tidak signifikan karena nilai p (prob>F) lebih dari taraf α 0.05, artinya model yang diperoleh memiliki kecocokkan dengan rancangan kuadratik. Nilai koefisien regresi kuadrat (R-Squared) R2 = 0.9807 menunjukkan bahwa 98.07% percobaan dapat dijelaskan oleh model. NilaiCoefficient Variation
(CV) yang rendah menunjukkan ketepatan dan reabilitas percobaan yang tinggi, nilai CV pada percobaan ini menunjukkan 17.76%. Adequate precision
18
Predicted (Pred) R2 tidak lebih dari 0.2, hal ini mengindikasikan bawa model tersebut dapat menentukan kondisi optimum variabel yang berpengaruh pada produktivitas enzim β-glukanase. Persamaan model tersebut ialah sebagai berikut:
Y = 0.35910 − 0.00463 A − 0.01713 B + 0.03300 C − 0.00225 AB + 0.00975 AC − 0.02775 BC − 0.08198 A2− 0.08798 B2− 0.06610 C2
A adalah konsentrasi β-glukan oat, B adalah konsentrasi ekstrak khamir, dan C adalah konsentrasi inokulum. Signifikansi tiap koefisien ditentukan dengan rendahnya nilai probability (Lampiran 9). ANOVA memperlihatkan bahwa efek kuadratik variabel β-glukan oat, ekstrak khamir, dan inokulum sangat signifikan (p< 0.0001) dibandingkan dengan efek liniernya. Lebih khusus, variabel inokulum menunjukkan hasil yang sangat signifikan pada efek linier dan kuadratik. Efek linier inokulum adalah satu-satunya faktor yang memberikan pengaruh positif pada produksi β-glukanase. Hal ini menandakan bahwa inokulum memberikan pengaruh yang sangat nyata pada produksi β-glukanase. Efek interaksi BC (interaksi antara konsentrasi ekstrak khamir dan konsentrasi inokulum) berpengaruh nyata terhadap aktivitas enzim β-glukanase karena nilai p di bawah taraf α 0.05, sedangkan efek interaksi AC (interaksi antara β-glukan oat dan inokulum) dan AB (interaksi antara β-glukan oat dan ekstrak khamir) tidak berpengaruh nyata.
19
(a)
(b)
(c)
Gambar 10 Respons permukaan 3D dan plot kontur aktivitas spesifik β-glukanase
20
Efek masing-masing variabel terhadap aktivitas spesifik β-glukanase menunjukkan bahwa β-glukan diperlukan dalam jumlah dengan kisaran level
centre point, ekstrak khamir diperlukan dalam jumlah sedikit, sedangkan inokulum diperlukan dalam jumlah banyak. Prediksi nilai maksimum produksi β-glukanase setelah 12 jam inkubasi ialah 0.365 U mg-1 protein pada konsentrasi β-glukan oat 2.99%, ekstrak khamir 0.28%, dan inokulum 3.28%. Hasil tersebut meningkat 1.52 kali jika dibandingkan dengan produksi di media tanpa optimasi yang memiliki aktivitas spesifik β-glukanase sebesar 0.242 U mg-1 protein. Validasi kondisi optimum dilakukan secara empiris di dalam laboratorium, dengan perolehan nilai aktivitas spesifik β-glukanase sebesar 0.360 U mg-1protein atau meningkat 1.50 kali dari kondisi media tanpa optimasi (Gambar 12). Nilai dari hasil validasi tersebut mendekati nilai prediksi. Dengan demikian, model regresi yang digunakan ideal untuk produksi β-glukanase dari isolat B. subtilis
SAHA 32.6.
Pengendapan β-glukanase oleh amonium sulfat
Hasil pengendapan menggunakan amonium sulfat menunjukkan bahwa pada konsentrasi 50-60% amonium sulfat mampu mengendapkan protein dan meningkatkan aktivitas spesifik β-glukanase yang sudah dioptimasi dari isolat
B. subtilis SAHA 32.6 (Gambar 11, lampiran 10). Hasil tersebut menunjukkan bahwa kemurnian enzim meningkat sebesar 1.43 kali dari sebelumnya (Tabel 5).
Gambar 11 Pengaruh penambahan konsentrasi amonium sulfat terhadap pengendapan β-glukanaseB. subtilisSAHA 32.6
21
Tabel 5 Hasil pengendapan protein β-glukanaseB. subtilisSAHA 32.6 Enzim Volume
(mL) proteinTotal (mg)
Total aktivitas
(U)
Aktivitas spesifik (U mg-1)
Tingkat kemurnian
(kali)
Perolehan (%)
Ekstrak
kasar 390 12.48 4.48 0.359 1 100 Amonium
sulfat 60% 10 0.114 0.0586 0.515 1.43 1.31 .
Gambar 12 Peningkatan aktivitas spesifik β-glukanase B. subtilis SAHA 32.6. Keterangan: A. Sebelum dioptimasi, B. Setelah dioptimasi dengan RSM, C. Setelah diendapkan amonium sulfat 60% (b/v)
Uji antagonis β-glukanase terhadap cendawan patogen
Penghambatan secarain vitropertumbuhan cendawan patogenC. affinisdan
C. gloeosporioides menggunakan enzim ekstrak kasar β-glukanase sebelum dan sesudah dioptimasi, dan hasil pengendapan oleh amonium sulfat. Enzim β-glukanase yang belum dioptimasi menunjukkan tidak adanya daya hambat terhadap kedua cendawan, enzim yang dioptimasi menunjukkan sedikit penghambatan, sedangkan hasil pengendapan enzim menunjukkan penghambatan yang lebih baik (Gambar 13).
22
Gambar 13 Efektivitas penghambatan pertumbuhan C. affinis (atas) dan
C. gloeosporioides (bawah) oleh β-glukanase B. subtilis SAHA 32.6 pada media PDA yang diinkubasi selama 7 hari. Keterangan: (a), (e) kontrol negatif dengan akuades steril; (b), (f) enzim ekstrak kasar sebelum dioptimasi; (c), (g) enzim ekstrak kasar setelah dioptimasi dengan RSM; (d), (h) enzim yang dioptimasi hasil pengendapan amonium sulfat 60% (b/v); (i), (j) kultur bakteri 12 jam
Gambar 14 Penghambatan pertumbuhan cendawan patogen oleh β-glukanase
23
Pembahasan
Serangan cendawan patogen terhadap tanaman inang akan berakibat pada berkurangnya nilai produktivitas tanaman. Ketergantungan terhadap fungisida berbahan kimia menimbulkan banyak masalah di kemudian hari. Penggunaan biokontrol merupakan cara alternatif untuk mengurangi masalah tersebut. Mekanisme antagonisme biokontrol terhadap cendawan patogen dapat dilakukan dengan cara kompetisi, parasitisme, dan antibiosis (El-Katatny 2000; Compant et al. 2005). Parasitisme melibatkan enzim-enzim litik yang dapat mendegradasi dinding sel cendawan patogen, seperti kitinase, β-glukanase, dan protease.
Pada umumnya, substrat yang digunakan dalam produksi β-glukanase untuk menghambat pertumbuhan cendawan patogen adalah β-1,3-glukan atau lebih dikenal dengan laminarin (callosa) karena dinding cendawan patogen berfilamen memiliki glukan dengan ikatan β-1,3-glikosidik (Bowman dan Free 2006). Laminarin dihasilkan dari ekstrak alga Laminaria digitata dan memiliki harga yang relatif mahal. Beberapa penelitian terdahulu menggunakan β-glukan dari berbagai sumber sebagai substrat untuk produksi β-glukanase, yaitu ekstrak dinding sel cendawan berfilamen (β-1,3-glukan) Botrytis cinerea, Giberella fujikuroi, Phytophtora syringae,Rhizoctonia solani, dan Trichoderma harzianum
(de la Cruz et al. 1995), ekstrak dinding sel khamir (β-1,3-1.6-glukan) (Blӓttel
et al. 2011), ekstrak dinding sel Basidiomycetes Agaricus blazei (Carneiro et al.
2011). Ada pula yang menggunakan laktosa, pullulan dan kitin sebagai substrat (Jayus et al.2005; Leelasuphakul et al. 2006; de Marco dan Felix 2007). Suryadi
et al. (2013) menggunakan bubuk oat sebagai substrat dalam produksi β-glukanase yang dihasilkan bakteri dan digunakan untuk menghambat pertumbuhan cendawan patogen. Hal ini yang mendasari penggunaan bubuk oat sebagai substrat produksi β-glukanase dalam penelitian ini. β-Glukan yang berasal dari biji-biji sereal seperti oat memiliki ikatan β-1,3-1,4-glikosidik (Beer et al. 1996) dan mudah larut dalam larutan basa.
Aktivitas enzim glukanase secara kualitatif ditandai dengan terbentuknya zona bening di sekitar koloni bakteri pada media yang mengandung substrat glukan setelah penambahan pewarna merah kongo 0,1% dan pembilasaan dengan NaCl 1 M. Isolat bakteri yang memiliki aktivitas glukanase dapat menghidrolisis ikatan β-glikosidik pada media glukan menjadi glukosa. Pewarna congo-redakan mendeteksi ikatan nonpolar hidrogen β-glikosidik pada polisakarida dengan memberi warna merah. Deteksi tersebut disebabkan adanya interaksi hidrofob van der walls yang kuat antara pewarna dengan polisakarida yang mengandung ikatan nonpolar hidrogen (Teather dan Wood 1982; Mazeau dan Wyszomirski 2012). Jika ikatan pada polisakarida itu terputus, maka terbentuk monomer-monomer yang tidak terwarnai dan menjadi bening. Pewarna congo-red dapat tercuci dengan mudah menggunakan NaCl 1 M agar bagian polisakarida yang telah terhidrolisis menjadi lebih jernih atau bening.
Isolat SAHA 32.6 menghasilkan β-glukanase yang mampu menghidrolisis substrat β-glukan juga dapat menghambat cendawan patogen C. affinis dan
C. gloeosporioides. β-Glukanase yang dihasilkan isolat tersebut diduga men-degradasi β-glukan yang ada pada dinding sel kedua cendawan patogen. Isolat SAHA 32.6 berupa Gram positif dan teridentifikasi sebagai Bacillus subtilis
24
(Thakaew dan Niamsup 2013). B. subtilis dikenal sebagai agens biokontrol beberapa cendawan penyebab penyakit pada tanaman karena metabolit yang dikeluarkannya memiliki banyak manfaat.B. subtilismemiliki enzim litik kitinase, β-glukanase, protease, lipase, dan selulase yang dapat mendegradasi dinding sel berbagai cendawan patogen, dan memiliki lipopeptida antifungi berupa fengcyin, iturin A, dan surfaktin (Cazorla et al. 2007). B. subtilisjuga dapat memproduksi senyawa bacilibactin, sejenis senyawa pengkelat besi (siderofor) sehingga dapat bersaing dengan cendawan patogen dalam pengambilan unsur besi di tanah (Saharan dan Nehra 2011). Compant et al. (2005). mengatakan senyawa organik folatil yang dikeluarkan B. subtilis di lingkungannya memicu sistem pertahanan terinduksi (Induced Systemic Resistance) pada tanaman inang sehingga mampu bertahan dari serangan cendawan patogen.
Dalam penelitian ini, β-glukanase B. subtilis SAHA 32.6 mulai diproduksi pada fase logaritmik dan aktivitas tertinggi dicapai saat sel mulai memasuki fase stasioner, yaitu pada jam ke-12 inkubasi. Aktivitas enzim masih terlihat hingga jam ke-24 namun lebih rendah dari jam ke-12. Hasil ini tidak sesuai dengan penelitian Stülke et al. (1993), Aono et al. (1995), dan Tang et al. (2004) yang mengatakan bahwa β-glukanase diproduksi ketika sel-sel berada di pertengahan fase stasioner. Lebih lanjut, Stülkeet al.(1993) mengatakan peningkatan aktivitas β-glukanase terjadi jika sel berhenti tumbuh dalam kondisi glukosa dan sumber nitrogen yang terbatas. Glukosa bertindak sebagai carbon catabolite repression
yang menekan ekspresi gen β-glukanase ketika glukosa masih tersedia dan gen akan aktif bila glukosa habis (carbon catabolite activation) (Fujita 2009). Oleh karena itu beberapa penelitian melaporkan aktivitas β-glukanase tertinggi
B. subtilisterjadi pada 2-6 hari inkubasi (Manjula dan Podile 2005; Leelasuphakul
et al. 2006; Narasimhan et al. 2013), sedangkan dalam penelitian ini pasokan sumber karbon hanya berasal dari β-glukan. Tidak ada glukosa yang ditambahkan ke dalam media sehingga β-glukan digunakan sebagai satu-satunya sumber karbon sekaligus inducer yang menyebabkan aktivitas tertinggi β-glukanase
B. subtilis SAHA 32.6 terjadi pada fase logaritmik. Hal ini terjadi juga pada penelitian Giese et al. (2011b) yang menyatakan bahwa β-glukanase yang dihasilkan cendawan Botryosphaeria rhodina disekresikan pada fase stasioner ketika media terdiri atas glukosa dan disekresikan pada fase logaritmik ketika media hanya terdiri atas botryosphaeran (β-glukan) sebagai sumber karbon. Masa inkubasi 12 jam digunakan dalam tahap optimasi media untuk produksi β-glukanase.
Optimasi kondisi kultivasi merupakan aspek yang sangat penting dalam bidang mikrobiologi dan bioteknologi karena dapat menentukan nilai optimum variabel yang dicari. Optimasi dengan metode one factor at a time tidak dapat menentukan nilai optimum yang sebenarnya karena tidak diketahui interaksi antar variabel. Teknik desain secara statistik merupakan alat yang berguna untuk membantu penentuan nilai optimum yang pasti karena interaksi antar variabel pada berbagai taraf dapat diketahui, selain itu dapat membantu perhitungan taraf optimum dari setiap variabel dengan cepat.Response surface methodology(RSM) banyak diaplikasikan pada optimasi media untuk meningkatkan produksi enzim dalam industri biomedik, pangan, pakan, dan bioenergi (Heet al.2003; Tanget al.
25
belum banyak dilaporkan. Desain percobaan yang digunakan dalam penelitian ini adalah rancangan komposit terpusat (Central Composite Design/CCD). CCD merupakan suatu rancangan percobaan yang terdiri dari rancangan faktorial dan ditambahkan dengan beberapa center point danaxial point yang dapat digunakan untuk optimasi dan evaluasi efek linier, efek interaksi, dan efek kuadratik dari variabel independen (Halizaet al.2007).
Konsentrasi β-glukan, ekstrak khamir, dan inokulum menunjukkan nilai yang sangat signifikan pada efek kuadratik. Hal ini menandakan bahwa ketiga variabel berpengaruh nyata terhadap produksi β-glukanase, terutama inokulum karena menunjukkan nilai yang sangat signifikan pada efek interaksi dan kuadratik. Hal ini sesuai dengan penelitian Aono (1995), de la Cruzet al. (1995), dan Tang et al. (2004) yang mengatakan bahwa konsentrasi dan jenis inducer
pada substrat memberikan pengaruh yang nyata terhadap peningkatan produksi β-glukanase, begitupun dengan ekstrak khamir (Khare dan Uphadyay 2011), dan inokulum (Heet al.2003).
Aktivitas β-glukanase semakin meningkat seiring dengan meningkatnya konsentrasi β-glukan, ekstrak khamir, dan inokulum. Namun, penurunan aktivitas terjadi ketika konsentrasi ketiga variabel tersebut semakin tinggi. β-Glukan diperlukan dalam jumlah yang cukup karena pada suatu konsentrasi substrat tertentu enzim tidak mengalami peningkatan aktivitas lagi akibat semua bagian sisi aktif enzim telah jenuh oleh substrat (Aono et al. 1995). Ekstrak khamir merupakan sumber nitrogen yang mendukung pertumbuhan bakteri dan diperlukan dalam jumlah sedikit karena dalam jumlah yang sedikit ekstrak khamir akan memacu produksi β-glukanase. Sumber nitrogen yang terbatas akan membuat bakteri tidak dapat lagi menangkap nitrogen sebagai sumber nutrisi, dan kemudian mensekresi β-glukanase untuk mendegradasi β-glukan sebagai sumber nutrisi alternatif (Stülke et al. 1993). Berbeda dengan β-glukan dan ekstrak khamir, konsentrasi inokulum 5% masih menunjukkan tingginya aktivitas β-glukanase. Hal ini sesuai dengan yang dikatakan Stanburry et al.(1995) bahwa konsentrasi inokulum yang baik dalam produksi metabolit berada pada kisaran 3-10%.
Kondisi optimum yang dicapai pada penelitian He et al. (2003) ialah β-glukan barley 6.3%, inokulum B. subtilis 3.82%, dan tepung jagung 4.4% selama 16 jam inkubasi pada agitasi 210 rpm, suhu 37 ºC, pH 7 dengan aktivitas β-glukanase sebesar 275.25 U mL-1. Xuang (1994) juga melaporkan kondisi optimum pada produksi β-glukanase yang dihasilkan B. subtilis ialah barley 7%, dan soybean 5% selama 3 hari inkubasi pada suhu 37 ºC, pH 7 dengan aktivitas β-glukanase sebesar 154 U mL-1. Kondisi optimum pada penelitian menunjukkan tidak adanya perbedaan yang jauh dengan penelitian He et al. (2003). Hal ini disebabkan isolatB. subtilisyang digunakan sama-sama berasal dari tanah, namun aktivitas β-glukanase yang dicapai berbeda jauh. Kondisi fisik dan kimia tanah yang berbeda membuat aktivitas metabolit mikroba yang dihasilkan juga berbeda.
26
lalu terendapkan. Endapan ini akan terus bertambah seiring dengan penambahan amonium sulfat dan akan jenuh pada konsentrasi amonium sulfat optimum (Scopes 1994).
Persentase kejenuhan amonium sulfat untuk setiap β-glukanase berbeda-beda. Tingkat kejenuhan pengendapan berkisar 40-80% (Miyanishi et al. 2003; Leelasuphakul et al. 2006; Yang et al. 2008). Konsentrasi optimum amonium sulfat yang ditambahkan untuk mengendapkan β-glukanase dariB. subtilis SAHA 32.6 ialah 60% (b/v) (Gambar 8). Yang et al. (2008) melaporkan bahwa β-glukanase dari Paecilomyces thermophilla J18 mampu terendapkan dengan penambahan amonium sulfat sebesar 60% (b/v). Enzim β-glukanase saat ini diutamakan dalam pengendalian hayati cendawan patogen saat ini selain kitinase karena kemampuannya mendegradasi β-glukan pada dinding sel cendawan. Penelitian ini dilakukan untuk menganalisis kemampuan dari enzim ekstrak kasar β-glukanase sebelum dan sesudah dioptimasi, serta enzim β-glukanase hasil optimasi yang telah diendapkan. Dari ketiga perlakuan, hanya enzim β-glukanase yang diendapkan yang dapat menghambat pertumbuhan cendawan patogen (C. affinis dan C. gloeosporioides) dengan baik. Hal ini menunjukkan bahwa enzim yang bebas dari pengotor memiliki aktivitas yang lebih tinggi dari sebelumnya dan mampu bekerja dengan baik sebagai agens biokontrol. β-Glukanase sebelum dioptimasi tidak mampu menghambat pertumbuhan cendawan patogen karena masih berupa ekstrak kasar, dan masih memungkinkan adanya protease yang dapat memotong protein fungsional enzim β-glukanase sehingga tidak mampu bekerja baik dalam menghambat pertumbuhan cendawan patogen.
β-Glukanase hasil optimasi dapat menghambat cendawan
C. gloeosporioidesdengan jelas daripada cendawan C. affinis. β-Glukanase hasil pengendapan juga lebih mampu menghambat pertumbuhan cendawan
C. gloeosporioidesdaripadaC. affinis. Hal ini diduga bahwa kandungan β-glukan pada cendawan C. gloeosporioides lebih banyak sehingga pertumbuhannya lebih banyak dihambat oleh β-glukanase. Odabasi et al. (2006) mengatakan bahwa kandungan β-glukan pada cendawan berbeda-beda. Namun demikian, β-glukanase yang dihadapkan pada cendawan C. affinis memberikan dampak berupa berkurangnya pigmen hitam dari cendawan tersebut (Gambar 13a dan 13d).
Curvularia diketahui memiliki pigmen berupa DHN-melanin (dihydroxy-naphthalene) yang berwarna hitam pada miselianya (Rižner dan Wheeler 2003). DHN-melanin pada cendawan patogen bukan faktor esensial dalam pertumbuhan dan perkembangan selnya, namun dapat membuat cendawan bertahan dan kompetitif di lingkungan ekstrem. Selain itu melanin memberikan perlindungan terhadap sklerotia dan spora dari lisis, memberikan tekanan turgor bagi apresoria untuk berpenetrasi ke daun tanaman inang, dan berperan dalam proses transfer elektron dan transduksi sinyal (Beltrán-Garcia et al. 2014). Melanin ini terlokalisasi pada dinding sel cendawan patogen dan terikat secara cross-linked
pada polisakarida (Beltrán-Garcia et al. 2014). β-Glukan merupakan salah satu jenis polisakarida pada dinding sel cendawan. Dengan demikian, diduga β-glukanase secara tidak langsung juga mendegradasi DHN-melanin yang terikat pada β-glukan sehingga pigmen pada miselia cendawanCurvulariaberkurang.
27
amonium sulfat (60%) (Tabel 6). Hal ini disebabkan penggunaan substrat yang berbeda pada proses produksi enzim. Thakaew dan Niamsup (2013) menggunakan ekstrak miselia cendawan patogen dalam proses produksi β-glukanase sebagai sumber karbon. Miselia cendawan tidak hanya terdiri dari glukan saja namun juga kitin dan galaktomanan yang terikat secara cross-linked (Adam 2004) sehingga pada proses produksinya bakteri mendapat sumber C tidak hanya dari glukan, tetapi juga dari kitin dan mannan. Dengan adanya sumber karbon yang cukup, maka pertumbuhan sel akan cepat dan menyebabkan aktivitas β-glukanase yang dihasilkan tinggi.
Metode analisis gula pereduksi yang digunakan oleh Miyanishiet al.(2003), Leelasuphakul et al. (2006), dan Thakaew dan Niamsup (2013) adalah metode Miller (1959) dengan menggunakan DNS dan substrat laminarin. Dalam penelitian ini dan penelitian Suryadi et al. (2013), juga menggunakan metode DNS namun substrat yang digunakan adalah ekstrak β-glukan dari oat. Perbedaan substrat dalam analisis gula pereduksi merupakan salah satu faktor yang menentukan beragamnya nilai aktivitas β-glukanase. Meskipun aktivitas β-glukanase dalam penelitian ini tidak tinggi, namun hasil pengendapan β-glukanase dari B. subtilis SAHA 32.6 sudah dapat menghambat pertumbuhan cendawan. Hal ini terjadi juga pada penelitian Suryadi et al. (2013), aktivitas tertinggi β-glukanase yang dihasilkan Pseudomonas aeroginosa hanya sebesar 0.04 U mg-1 dapat menghambat pertumbuhan cendawan patogen Pyricularia
oryzaedanRhizoctonia solani.
Tabel 6 Perbandingan aktivitas β-glukanase yang dihasilkan beberapa bakteri Jenis bakteri Substrat Aktivitas
spesifik (U mg-1)
Sumber
B. subtilisSAHA 32.6 Oat
(β-1,3-1,4-glukan) 0.515 Hasil penelitian
B. subtilisNSRS 89-24 Kitin 0.19 Leelasuphakulet al.
(2006)
B. subtilisBCC 6327 Ekstrak miselia cendawan
Aspergillus niger
2.29 Thakaew dan Niamsup (2013)
B. clausiiNM-1 Laminarin
(β-1,3-glukan) 0.05 (2003)Miyanishiet al.
Pseudomonas
aeroginosaC32a glukan)Oat (β-1,3-1,4- 0.04 Suryadiet al.(2013)
28
menjadi lebih tahan terhadap serangan cendawan patogen (Compant et al. 2005). Manfaat lain dari enzim β-glukanase yaitu tidak hanya digunakan sebagai agens biokontrol, tetapi juga dapat digunakan dalam proses industribrewing(pembuatan bir) untuk mengurangi viskositas bahan baku pada saat filtrasi dan mencegah terbentuknya endapan bergelatin pada tahap finishing (Calestino et al. 2006); dalam proses pembuatan pakan ternak untuk meningkatkan kualitas gizi (Mathlouthi et al.2011); dalam proses pembuatan imunomodulator (Pitson et al.
1993); serta dalam sintesis oligosakarida (Pitsonet al.1993).
SIMPULAN
Optimasi media menggunakan Response Surface Methodology mampu meningkatkan produksi β-glukanase yang dihasilkanBacillus subtilisSAHA 32.6. Media yang digunakan dalam produksi enzim β-glukanaseBacillus subtilisSAHA 32.6 optimum pada konsentrasi β-glukan oat 2.99%, konsentrasi ektrak khamir 0.28%, dan konsentrasi inokulum bakteri 3.28%, dengan nilai prediksi aktivitas spesifik β-glukanase 0.365 U mg-1protein dan nilai validasi 0.360 U mg-1 protein selama 12 jam inkubasi. β-Glukananse yang sudah dioptimasi menunjukkan peningkatan produktivitas 1.50 kali lebih besar dari kondisi yang belum dioptimasi dan 2.13 kali lebih besar setelah diendapkan dengan amonium sulfat 60%.Bacillus subtilis SAHA 32.6 yang telah diendapkan dengan amonium sulfat 60% dapat menghambat pertumbuhan cendawan patogen Curvularia affinis dan