KINERJA PROBIOTIK Bacillus sp. PADA PENDEDERAN
BENIH IKAN LELE (Clarias sp.) YANG DIINFEKSI Aeromonas
hydrophila
MUHAMAD MUFTHI RAFSYANZANI
DEPARTEMEN BUDIDAYA PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Kinerja Probiotik
Bacillus sp. pada Pendederan Benih Ikan Lele (Clarias sp.) yang Diinfeksi
Aeromonas hydrophila adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Januari 2016
Muhamad Mufthi Rafsyanzani
ABSTRAK
M.MUFTHI RAFSYANZANI. Kinerja Probiotik Bacillus sp. pada Pendederan Benih Ikan Lele (Clarias sp.) yang Diinfeksi Aeromonas hydrophila. Dibimbing oleh SUKENDA dan RAHMAN.
Penelitian ini bertujuan untuk menguji efektifitas kinerja probiotik Bacillus
sp. dalam pakan pada benih ikan lele (Clarias sp.) yang diinfeksi bakteri
Aeromonas hydrophila. Kandungan probiotik dalam pakan pada setiap perlakuan berturut-turut yaitu 0 (K+, K-) ; 1%; 2%. Penelitian ini menggunakan rancangan acak lengkap dengan 4 perlakuan dan 2 ulangan. Ikan yang digunakan adalah ikan lele dengan bobot rata-rata 3,22±0,15 g/ekor yang dipelihara dalam kolam terpal berukuran 1,5 x 2,8 x 0,5 m3 dengan kepadatan 800 ekor/kolam. Ikan dipelihara selama 30 hari dengan frekuensi pemberian pakan 3 kali sehari sebanyak 8% dari jumlah bobot ikan. Hari ke-31 benih lele diinjeksi bakteri A. hydrophila sebanyak 0,1 mL/ekor dengan kepadatan bakteri 106 cfu/mL. Pemeliharaan setelah diinfeksi
dilakukan selama 10 hari dengan kepadatan 10 ekor/akuarium. Hasil penelitian menunjukkan ikan yang diberi probiotik 2% memperlihatkan kinerja probiotik terbaik dengan tingkat kelangsungan hidup ikan lele setelah diinfeksi dengan A. hydrophila sebesar 83,33%, laju pertumbuhan harian sebesar 5,40%, dan konversi pakan 0,75.
Kata kunci: probiotik, Bacillus sp., A. hydrophila, benih lele, pertumbuhan.
ABSTRACT
MUHAMAD MUFTHI RAFSYANZANI. Performance of Bacilus sp. probiotic in catfish ( Clarias sp.) infected by Aeromonas hydrophila. Supervised by SUKENDA and RAHMAN.
This experiment was conducted to assess performance of Bacillus sp. probiotic on catfish juvenile infected by A. hydrophila. The probiotic content in the diets were 0 (K+,K-); 1; 2 %. This experiment used randomized design with 4 treatments and 2 replications. Juveniles with average body weight of 3.22±0.15 g/fish were reared in the 1.5 x 2.8 x 0.5 m pond tarp with density of 800 fish/pond tarp. Fish were reared for 30 days and fed three times a day at rate 8% of total body weight. At day 31, catfish were challenged by A. hydrophila 0.1 mL (106 cfu/mL). Post infection observation was carried out 10 days with density 10 fish/aquaria. The result showed that fish fed diet containing 2% probiotic gave the best probiotic performance with survival rate of catfish 83.33% after challenged, spesific growth rate 5.40%, and 0,75 of feed conversion ratio.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan
Departemen Budidaya Perairan
KINERJA PROBIOTIK Bacillus sp. PADA PENDEDERAN
BENIH IKAN LELE (Clarias sp.) YANG DIINFEKSI Aeromonas
hydrophila
DEPARTEMEN BUDIDAYA PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
Judul Skripsi : Kinerja probiotik Bacillus sp. pada pendederan benih ikan lele (Clarias sp.) yang diinfeksi Aeromonas hydrophila
Nama : Muhamad Mufthi Rafsyanzani
NIM : C14110082
Program Studi : Teknologi dan Manajemen Perikanan Budidaya
Disetujui oleh
Dr Ir Sukenda, MSc Pembimbing I
Rahman, SPi, MSi Pembimbing II
Diketahui oleh
Dr Ir Sukenda, MSc Ketua Departemen
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Juni sampai Juli 2015 ini berjudul Kinerja Probiotik pada Pendederan Benih Lele (Clarias sp.) yang Diinfeksi Aeromonas hydrophila.
Ucapan Terima kasih penulis sampaikan kepada beberapa pihak di bawah ini, yaitu:
1. Bapak Dr Ir Sukenda, M.Sc dan Bapak Rahman SPi, M.Si selaku dosen pembimbing yang telah banyak memberikan saran.
2. Ibu Dinamella Wahjuningrum selaku dosen pembimbing akademik yang telah banyak memberikan bantuan serta motivasi selama masa perkuliahan di Departemen Budidaya Perairan.
3. Bapak Tata dan Ibu Yayah selaku orang tua tercinta yang telah banyak memberi motivasi serta dukungan dalam menyelesaikan penelitian ini.
4. Kak Dendi Hidayatullah dan Bapak Ranta, selaku Keluarga Laboratorium Kesahatan Ikan (LKI) yang telah membantu proses pengamatan sehingga berjalan lancar dan telah banyak memberikan saran dalam penelitian ini.
5. Mas Aang Sutisna dan Bapak Hadi selaku teknisi lapang atas bantuannya selama masa pemeliharaan ikan yang bertempat di Kecamatan Ciampea, Bogor.
6. May S, Hana N, Ridahana, D.M, Kiki A, Dyah A, dan Andini Y, selaku teman-teman seperjuangan Lab LKI yang telah banyak membantu selama proses penelitian berlangsung.
Bogor, Januari 2016
DAFTAR ISI
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vii
PENDAHULAN 1
Latar Belakang 1
Tujuan Penelitian 1
METODE 2
Parameter Penelitian 3
Hematologi Ikan 4
HASIL DAN PEMBAHASAN 5
Hasil 5
Pembahasan 9
KESIMPULAN 11
DAFTAR PUSTAKA 11
LAMPIRAN 14
DAFTAR GAMBAR
1 Kelangsungan hidup selama pemeliharaan dan setelah uji tantang pada perlakuan pakan tanpa probiotik dan injeksi PBS (K-), pakan tanpa probiotik dan injeksi A. hydrophila (K+), pakan diberi probiotik 1% dan injeksi A. hydrophila (A), dan pakan diberi probiotik 2% dan injeksi A. hydrophila (B). Huruf yang berbeda di setiap bar menunjukkan adanya perbedaan antar perlakuan (P<0,05) 6 2 Laju pertumbuhan harian selama pemeliharaan pada perlakuan pakan
tanpa probiotik (K-), pakan tanpa probiotik (K+), pakan diberi probiotik 1% (A), dan pakan diberi probiotik 2% (B). Huruf yang berbeda di setiap bar menunjukkan adanya perbedaan antar perlakuan
(P<0,05) 6
3 Konversi pakan selama pemeliharaan pada perlakuan pakan tanpa probiotik (K-), pakan tanpa probiotik (K+), pakan diberi probiotik 1% (A), dan pakan diberi probiotik 2% (B). Huruf yang berbeda di setiap bar menunjukkan adanya perbedaan antar perlakuan (P<0,05) 7 4 Total eritrosit selama pemeliharaan hari ke-0, 15, 30, dan setelah uji
tantang pada perlakuan pakan tanpa probiotik dan injeksi PBS (K-), pakan tanpa probiotik dan injeksi A. hydrophila (K+), pakan diberi probiotik 1% dan injeksi A. hydrophila (A), dan pakan diberi probiotik 2% dan injeksi A. hydrophila (B). Huruf yang berbeda di setiap bar pada hari yang sama menunjukkan adanya perbedaan antar perlakuan
(P<0,05) 7
5 Total leukosit selama pemeliharaan hari ke-0, 15, 30, dan setelah uji tantang pada perlakuan pakan tanpa probiotik dan injeksi PBS (K-), pakan tanpa probiotik dan injeksi A. hydrophila (K+), pakan diberi probiotik 1% dan injeksi A. hydrophila (A), dan pakan diberi probiotik 2% dan injeksi A. hydrophila (B). Huruf yang berbeda di setiap bar pada hari yang sama menunjukkan adanya perbedaan antar perlakuan
(P<0,05) 8
6 Kadar hemoglobin selama pemeliharaan hari ke-0, 15, 30, dan setelah uji tantang pada perlakuan pakan tanpa probiotik dan injeksi PBS (K-), pakan tanpa probiotik dan injeksi A. hydrophila (K+), pakan diberi probiotik 1% dan injeksi A. hydrophila (A), dan pakan diberi probiotik 2% dan injeksi A. hydrophila (B). Huruf yang berbeda di setiap bar pada hari yang sama menunjukkan adanya perbedaan antar perlakuan
(P<0,05) 8
7 Kadar hematokrit selama pemeliharaan hari ke-0, 15, 30, dan setelah uji tantang pada perlakuan pakan tanpa probiotik dan injeksi PBS (K-), pakan tanpa probiotik dan injeksi A. hydrophila (K+), pakan diberi probiotik 1% dan injeksi A. hydrophila (A), dan pakan diberi probiotik 2% dan injeksi A. hydrophila (B). Huruf yang berbeda di setiap bar pada hari yang sama menunjukkan adanya perbedaan antar perlakuan
DAFTAR LAMPIRAN
1 Anova hasil uji tukey konversi pakan 14
2 Anova hasil uji tukey tingkat kelangsungan hidup 14 3 Anova hasil uji tukey laju pertumbuhan harian 14 4Anova hasil uji tukey tingkat kelangsungan hidup uji tantang 15 5 Anova hasil uji tukey kadar eritrosit uji tantang 15
6 Anova hasil uji tukey total leukosit 15
1
PENDAHULAN
Latar Belakang
Ikan lele merupakan komoditas ikan air tawar yang banyak diminati di daerah Jawa dan sekitarnya. Permintaan pasar yang tinggi menarik minat para pembudidaya untuk membudidayakan ikan lele. Ikan lele juga termasuk salah satu komoditas air tawar unggulan KKP untuk ditingkatkan produksinya. Menurut KKP (2014) produksi ikan lele pada tahun 2013 mencapai 543.774 ton dan meningkat pada tahun 2014 menjadi 613.119 ton.
Sejalan dengan meningkatnya produksi dalam budidaya ikan lele terdapat kendala seperti penyakit, salah satunya adalah MAS (Motile Aeromonad Septicemia) yang disebabkan oleh Aeromonas hydrophila. Bakteri A. hydrophila
adalah bakteri gram negatif berbentuk batang dan menyerang ikan saat kondisi tertentu. Bakteri A. hydrophila menurut Kabata (1985) mampu menyebabkan kematian pada benih ikan lele mencapai 90%, dengan demikian perlu dilakukan pencegahan agar ikan dalam wadah budidaya tidak terinfeksi oleh A. hydrophila. Upaya pencegahan menggunakan antibiotik akan menyebabkan terjadinya resistensi bakteri terhadap jenis antibiotik tersebut (Azhar 2013). Selain itu sisa-sisa antibiotik pada ikan komersial yang tidak terdeteksi tersebut dapat menyebabkan terjadinya alergi dan keracunan yang dapat merugikan para konsumen (Cabello et al. 2006)
Menurut Verschuere et al. (2000), probiotik merupakan agen mikroba hidup yang memberikan keuntungan terhadap inangnya dengan cara memodifikasi komunitas mikroba atau berasosiasi dengan inangnya, meningkatkan respons terhadap penyakit, memperbaiki nutrisi, dan pemanfaatan pakan. Probiotik memiliki sifat meningkatkan efisiensi pakan serta meningkatkan imun non spesifik pada ikan. Sehingga memungkinkan ikan lele mencapai pertumbuhan optimal dan meningkatkan imunitas terhadap penyakit, terutama MAS.
Beberapa studi menunjukkan bahwa pemberian probiotik dapat meningkatkan sintasan udang (Wang et al. 2005), konversi pakan ikan nila (Marzouk et al. 2008), sistem imun ikan mas (Septiarini 2012), dan efisiensi pakan pada ikan patin (Setiawati et al. 2013). Salah satu keunggulan probiotik adalah tidak menyebabkan resistensi patogen seperti antibiotik, sehingga aman dan ramah terhadap lingkungan. Kelompok bakteri yang dapat menjadi kandidat probiotik adalah Lactobacillus sp., Photobacterium sp., dan Bacillus sp.. Bakteri yang digunakan pada penelitian ini adalah probiotik komersil dengan kandungan Bacillus
sp..
Tujuan Penelitian
Penelitian ini bertujuan untuk menguji efektifitas kinerja probiotik Bacillus
2
METODE
Persiapan Wadah dan Ikan Uji
Wadah yang digunakan adalah kolam terpal berukuran 1,5 x 2,8 x 0,5 m3 dan akuarium berukuran 90 x 50 x 40 cm3. Persiapan wadah yang dilakukan meliputi pencucian kolam dan pengisian dengan air tandon yang sudah diendapkan. Kemudian air kolam tersebut didesinfeksi dengan Virkon 1,2 ppm dan dibiarkan selama satu hari. Ikan uji yang digunakan memiliki bobot rata-rata 3,22±0,15 g. Ikan uji yang telah diadaptasikan dimasukkan pada wadah yang telah disiapkan. Pemeliharaan tidak menggunakan sistem aerasi, dan dilaksanakan di tempat terbuka. Kepadatan ikan uji pada setiap kolam adalah 800 ekor/kolam. Selanjutnya untuk uji tantang ikan uji yang dipelihara diambil secara acak sebanyak 10 ekor setiap perlakuan kemudian diadaptasikan pada akuarium dan dipuasakan selama satu hari. Pencampuran Pakan dengan Probiotik
Pakan komersial dimasukkan ke dalam baskom. Kemudian sebelum probiotik dicampurkan, ditimbang terlebih dahulu sebanyak 1% dan 2%. Lalu probiotik ditambahkan putih telur sebagai binder sebanyak 2%. Setelah itu probiotik dicampurkan kedalam pakan dan diaduk hingga merata. Pencampuran pakan dengan probiotik dilakukan satu kali sehari selama pemeliharaan. Putih telur tetap diberikan pada perlakuan kontrol tanpa pemberian probiotik (K-, K+).
Perbanyakan Bakteri A. hydrophila
Bakteri yang diuji diregenerasi terlebih dahulu sebelum digunakan. Bakteri stok berasal dari BRBPAT Sempur, Bogor. Kultur primer diambil sebanyak satu ose untuk dibiakkan dalam cawan petri dan diinkubasi selama 24 jam pada suhu 27
ºC dalam inkubator. Bakteri yang berumur 24 jam diambil sebanyak satu ose dan
diinokulasikan ke dalam wadah yang berisi 25 mL media Trypticase Soy Broth
(TSB) dan diinkubasi selama 24 jam dalam inkubator bergoyang (water bath shaker). Selanjutnya dilakukan pengenceran berseri yaitu bakteri hasil kultur di media TSB diambil 1 mL suspensi dan dimasukkan ke dalam tabung mikrodengan menggunakan pipet mikro, kemudian disentrifugasi 3000 rpm sekitar 5 menit dan dibuang supernatannya. Endapan yang diperoleh dicuci dengan PBS sebanyak 2x. Kemudian ke dalam endapan ditambahkan 1 mL PBS dan divorteks sampai tercampur rata, setelah itu diambil 0,1 mL dan dimasukkan ke dalam tabung mikro yang berisi 0,9 mL PBS, dilakukan hal yang sama hingga pengenceran yang diinginkan
Penentuan Nilai LD50
Uji LD50 merupakan penentuan tingkat virulensi bakteri dengan melihat
konsentrasi bakteri yang dapat mematikan sekitar 50% populasi ikan uji. Uji LD50
dilaksanakan pada akuarium berukuran 90 x 50 x 40 cm3. Penyuntikan bakteri dengan kepadatan 105 sampai 107 cfu/mL secara intramuskuler sebanyak 0,1
mL/ekor pada 10 ekor ikan lele. Pengamatan dilakukan dengan menghitung jumlah ikan yang masih hidup dan yang mati sampai hari tujuh. Kemudian dilakukan penghitungan untuk mengetahui LD50 yaitu konsentrasi yang dapat menyebabkan
3 Uji Tantang
Uji tantang dilaksanakan untuk menentukan pengaruh penambahan probiotik pada pakan komersial terhadap kelangsungan hidup ikan lele setelah diinfeksi A. hydrophila dan menentukan dosis yang paling efektif dalam pencegahan penyakit MAS. Uji tantang dilakukan setelah pemeliharaan benih dilakukan selama 30 hari. Penginfeksian A. hydrophila dilakukan pada setiap perlakuan, kecuali pada perlakuan K- yang disuntikkan dengan larutan PBS dengan cara diinjeksi di bagian punggung ikan pada hari ke-31. Selanjutnya dilakukan pemeliharaan dan pengamatan tingkat kelangsungan hidup benih ikan selama 10 hari pada setiap perlakuan. Wadah selama uji tantang menggunakan akuarium dengan kepadatan ikan 10 ekor/akuarium.
Rancangan Penelitian dan Analisis Data
Penelitian dirancang dengan metode eksperimental, data diolah menggunakan Microsoft Excel 2013 dan dibahas secara deskriptif.Penelitian ini terdiri dari 4 perlakuan dan 2 ulangan selama pemeliharaan serta 4 perlakuan dan 3 ulangan saat uji tantang :
Perlakuan K(-) : Pakan tanpa probiotik, diinjeksi PBS
Perlakuan K(+) : Pakan tanpa probiotik, diinjeksi, A. hydrophila
Perlakuan A : Pakan diberi probiotik 1%, diinjeksi A. hydrophila
Perlakuan B : Pakan diberi probiotik 2%, diinjeksi A. hydrophila
Parameter Penelitian
Tingkat Kelangsungan Hidup
Kelangsungan hidup ikan diamati setiap hari selama pemeliharaan dan setelah uji tantang. Perhitungan kelangsungan hidup dihitung berdasarkan persamaan (Huissman 1987):
Untuk mengetahui laju pertumbuhan harian, bobot ikan ditimbang saat awal dan akhir perlakuan kemudian dihitung bobot rata-ratanya. Laju pertumbuhan
harian (α) ikan dapat dihitung menggunakan rumus (Huissman 1987):
α (%)= √Wt Wo t
− x 100
Keterangan : α = Laju pertumbuhan harian (%)
4
Konversi Pakan
Konversi pakan selama pemeliharaan dihitung dengan mengunakan rumus ( Huissman 1987).
Parameter kualitas air yang diamati yaitu suhu, pH, DO (oksigen terlarut) dan TAN (Tabel 1). Pengukuran parameter suhu dilakukan setiap hari, TAN, DO, dan pH diukur setiap 10 hari sekali.
Tabel 1Parameter kualitas air
Parameter Kualitas air selama
pemeliharaan hingga mencapai skala 101. Kemudian digoyangkan seperti angka delapan selama 3-5 menit. Setelah itu dibuang satu tetes. Lalu darah diamati di mikroskop dengan perbesaran 100 kali. Kemudian hasil hitungan dimasukkan ke dalam rumus ( Blaxhalll dan Daisley 1973) :
SDM= � ℎ ℎ
� ℎ � 5 �
1 � �� � � �� ���
Total Leukosit
Darah diambil hingga skala 0,5 kemudian ditambahkan larutan turk hingga mencapai skala 11. Kemudian digoyangkan seperti angka 8 selama 3-5 menit. Setelah itu dibuang 1 tetes. Lalu darah diamati di mikroskop dengan perbesaran 400 kali. Kemudian hasil hitungan dimasukkan ke dalam rumus (Blaxhalll dan Daisley 1973).
SDP = Ʃ �� ��ℎ� � � 1 � �� � � �� ��� Kadar Hemoglobin
5 dipindahkan kedalam tabung Hb-meter yang telah diisi HCL 0,1 N. Lalu ditambahkan aquades hingga warna darah serupa dengan skala tabung sahli yang dilihat pada skala kuning.
Kadar Hematokrit
Bahan yang digunakan crytoceal dan darah ikan uji. Tabung mikrohematokrit diisi darah hingga 3/4 bagian tabung. Ujung tabung ditutup
menggunakan crytoceal. Tabung di sentrifugasi dengan kecepatan 5000 rpm selama 5 menit. Kadar hematokrit dihitung dengan rumus :
HC(%)= �
Keterangan : Hc = Kadar hematokrit
a = Darah yang mengendap pada tabung b = Panjang total volume darah pada tabung
Analisis Data
Rancangan yang digunakan dalam penelitian ini yaitu RAL (rancangan acak lengkap) dengan empat perlakuan dan dua ulangan selama permeliharaan, kemudian empat perlakuan dan tiga ulangan setelah uji tantang. Data yang telah diperoleh kemudian ditabulasi dan dianalisis menggunakan program Ms. Excel (Ms. Office 2013) dan Minitab 16. Analisis menggunakan program Minitab 16 digunakan untuk menjelaskan nilai dari tingkat kelangungan hidup laju pertumbuhan harian, konversi pakan, dan gambaran darah.
HASIL DAN PEMBAHASAN
Hasil
Kelangsungan Hidup
6
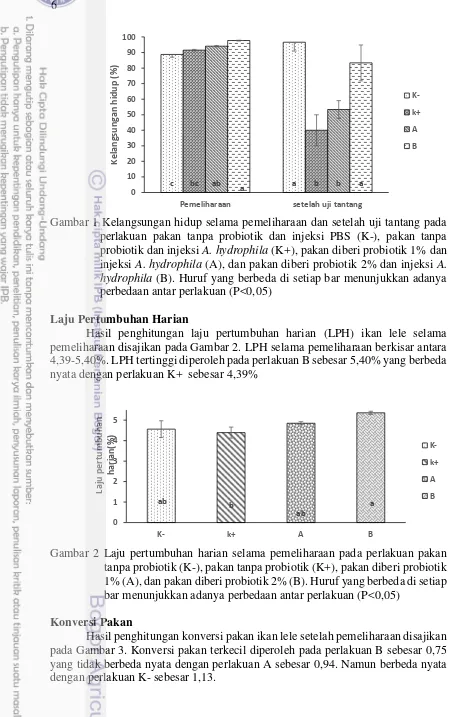
Gambar 1 Kelangsungan hidup selama pemeliharaan dan setelah uji tantang pada perlakuan pakan tanpa probiotik dan injeksi PBS (K-), pakan tanpa probiotik dan injeksi A. hydrophila (K+), pakan diberi probiotik 1% dan injeksi A. hydrophila (A), dan pakan diberi probiotik 2% dan injeksi A. hydrophila (B). Huruf yang berbeda di setiap bar menunjukkan adanya perbedaan antar perlakuan (P<0,05)
Laju Pertumbuhan Harian
Hasil penghitungan laju pertumbuhan harian (LPH) ikan lele selama pemeliharaan disajikan pada Gambar 2. LPH selama pemeliharaan berkisar antara 4,39-5,40%. LPH tertinggi diperoleh pada perlakuan B sebesar 5,40% yang berbeda nyata dengan perlakuan K+ sebesar 4,39%
Gambar 2 Laju pertumbuhan harian selama pemeliharaan pada perlakuan pakan tanpa probiotik (K-), pakan tanpa probiotik (K+), pakan diberi probiotik 1% (A), dan pakan diberi probiotik 2% (B). Huruf yang berbeda di setiap bar menunjukkan adanya perbedaan antar perlakuan (P<0,05)
Konversi Pakan
Hasil penghitungan konversi pakan ikan lele setelah pemeliharaan disajikan pada Gambar 3. Konversi pakan terkecil diperoleh pada perlakuan B sebesar 0,75 yang tidak berbeda nyata dengan perlakuan A sebesar 0,94. Namun berbeda nyata dengan perlakuan K- sebesar 1,13.
7
Gambar 3 Konversi pakan selama pemeliharaan pada perlakuan pakan tanpa probiotik (K-), pakan tanpa probiotik (K+), pakan diberi probiotik 1% (A), dan pakan diberi probiotik 2% (B). Huruf yang berbeda di setiap bar menunjukkan adanya perbedaan antar perlakuan (P<0,05)
Total Eritrosit
Hasil perhitungan total eritrosit ikan lele disajikan pada Gambar 4. Total eritrosit pada awal pemeliharaan sebesar 0,69 x106 sel/mm3 setiap perlakuan. Nilai total eritrosit hari ke-15 berkisar antara 1,34-1,40 x 106 sel/mm3 yang tidak berbeda nyata pada setiap perlakuan. Nilai total eritrosit pada hari ke-30 pemeliharaan berkisar antara 1,37-1,91 x 106 sel/mm3 yang berbeda nyata pada perlakuan B sebesar 1,91 x 106 sel/mm3 terhadap setiap perlakuan. Setelah uji tantang, total eritrosit pada K+ turun menjadi 0,63 x 106 sel/mm3 yang berbeda nyata terhadap perlakuan K- dan perlakuan B.
Gambar 4 Total eritrosit selama pemeliharaan hari ke-0, 15, 30, dan setelah uji tantang pada perlakuan pakan tanpa probiotik dan injeksi PBS (K-), pakan tanpa probiotik dan injeksi A. hydrophila (K+), pakan diberi probiotik 1% dan injeksi A. hydrophila (A), dan pakan diberi probiotik 2% dan injeksi A. hydrophila (B). Huruf yang berbeda di setiap bar pada hari yang sama menunjukkan adanya perbedaan antar perlakuan (P<0,05)
a ab ab b
H-0 H-15 H-30 setelah uji tantang
8
Total Leukosit
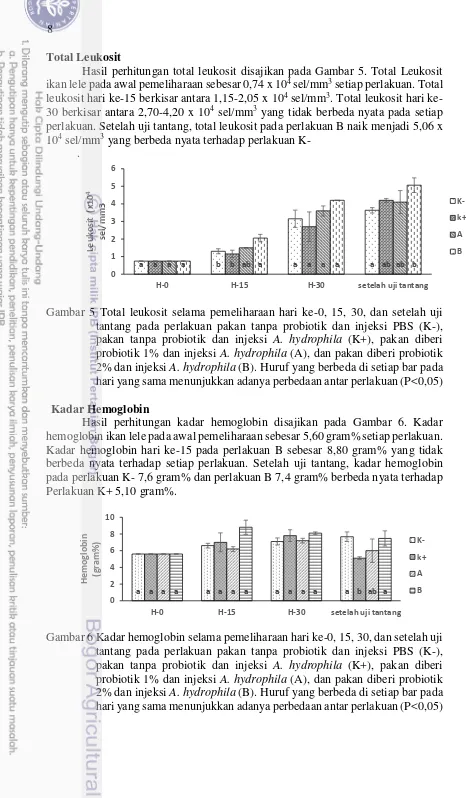
Hasil perhitungan total leukosit disajikan pada Gambar 5. Total Leukosit ikan lele pada awal pemeliharaan sebesar 0,74 x 104 sel/mm3 setiap perlakuan. Total leukosit hari ke-15 berkisar antara 1,15-2,05 x 104 sel/mm3. Total leukosit hari ke-30 berkisar antara 2,70-4,20 x 104 sel/mm3 yang tidak berbeda nyata pada setiap
perlakuan. Setelah uji tantang, total leukosit pada perlakuan B naik menjadi 5,06 x 104 sel/mm3 yang berbeda nyata terhadap perlakuan K-
.
Gambar 5 Total leukosit selama pemeliharaan hari ke-0, 15, 30, dan setelah uji tantang pada perlakuan pakan tanpa probiotik dan injeksi PBS (K-), pakan tanpa probiotik dan injeksi A. hydrophila (K+), pakan diberi probiotik 1% dan injeksi A. hydrophila (A), dan pakan diberi probiotik 2% dan injeksi A. hydrophila (B). Huruf yang berbeda di setiap bar pada hari yang sama menunjukkan adanya perbedaan antar perlakuan (P<0,05) Kadar Hemoglobin
Hasil perhitungan kadar hemoglobin disajikan pada Gambar 6. Kadar hemoglobin ikan lele pada awal pemeliharaan sebesar 5,60 gram%setiap perlakuan. Kadar hemoglobin hari ke-15 pada perlakuan B sebesar 8,80 gram% yang tidak berbeda nyata terhadap setiap perlakuan. Setelah uji tantang, kadar hemoglobin pada perlakuan K- 7,6 gram% dan perlakuan B 7,4 gram% berbeda nyata terhadap Perlakuan K+ 5,10 gram%.
Gambar 6 Kadar hemoglobin selama pemeliharaan hari ke-0, 15, 30, dan setelah uji tantang pada perlakuan pakan tanpa probiotik dan injeksi PBS (K-), pakan tanpa probiotik dan injeksi A. hydrophila (K+), pakan diberi probiotik 1% dan injeksi A. hydrophila (A), dan pakan diberi probiotik 2% dan injeksi A. hydrophila (B). Huruf yang berbeda di setiap bar pada hari yang sama menunjukkan adanya perbedaan antar perlakuan (P<0,05)
a a a a b b ab a a a a a a ab ab b
H-0 H-15 H-30 setelah uji tantang
Leu
H-0 H-15 H-30 setelah uji tantang
9 Kadar Hematokrit
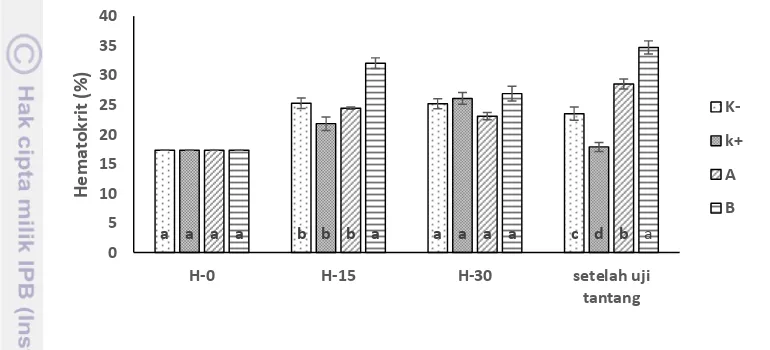
Hasil perhitungan kadar hematokrit disajikan pada Gambar 7. Kadar hematokrit ikan lele pada awal pemeliharaan sebesar 17,3% setiap perlakuan. Kadar hematokrit hari ke-15 pada perlakuan B sebesar 32,06% yang berbeda nyata terhadap setiap perlakuan. Kadar hematokrit hari ke-30 berkisar antara 23,07-26,90% yang tidak berbeda nyata pada setiap perlakuan. Setelah uji tantang, kadar hematokrit pada perlakuan B sebesar 34,71% berbeda nyata terhadap setiap perlakuan.
Gambar 7 Kadar hematokrit selama pemeliharaan hari ke-0, 15, 30, dan setelah uji tantang pada perlakuan pakan tanpa probiotik dan injeksi PBS (K-), pakan tanpa probiotik dan injeksi A. hydrophila (K+), pakan diberi probiotik 1% dan injeksi A. hydrophila (A), dan pakan diberi probiotik 2% dan injeksi A. hydrophila (B). Huruf yang berbeda di setiap bar pada hari yang sama menunjukkan adanya perbedaan antar perlakuan (P<0,05)
Pembahasan
Tingkat kelangsungan hidup ikan lele selama 30 hari pemeliharaan berkisar antara 88,75-97,68% yang berbeda nyata yaitu pada perlakuan B (penambahan probiotik 2%) sebesar 97,68% terhadap K- (tanpa penambahan probiotik) sebesar 88,75%. Kelangsungan hidup saat uji tantang menunjukkan bahwa ikan lele yang diberi probiotik pada perlakuan B dengan nilai 83,33% menunjukkan hasil yang berbeda nyata terhadap perlakuan K+ sebesar 40%. Hal ini dikarenakan probiotik memiliki pengaruh terhadap komunitas mikroba lingkungan usus dan memberikan keuntungan bagi inangnya (Verschuere et al. 2000). Probiotik dapat meningkatkan respons imun non spesifik pada ikan lele. Menurut Agustono et al. (2012), Bacillus
sp. dapat memproduksi antibiotik untuk melawan Vibrio sp. pada ikan kerapu yang menitikberatkan pada efek multifaktor probiotik seperti produksi enzim, kompetisi nutrien dan ruang sehingga meningkatkan tingkat kelangsungan hidup.
Pertumbuhan merupakan pertambahan bobot, panjang, dan volume dalam satuan waktu tertentu. Nilai laju pertumbuhan harian ikan yang dipelihara selama 30 hari berkisar antara 4,39-5,40%. Perlakuan B memiliki nilai LPH tertinggi dengan nilai 5,40% yang berbeda nyata dengan perlakuan K+ sebesar 4,39%. Hal ini dikarenakan probiotik yang diberikan pada ikan lele diduga meningkatkan
10
populasi Bacillus sp. dalam usus ikan. Prinsip dasar kerja probiotik yaitu memanfaatkan kemampuan mikroorganisme dalam memecah rantai panjang karbohidrat, protein, dan lemak karena adanya enzim-enzim khusus yang dimiliki oleh mikroba untuk memecah ikatan tersebut (Hendrianto et al. 2009). Sehingga molekul kompleks yang masuk ke dalam usus diubah menjadi molekul sederhana yang akan mempermudah penyerapan oleh saluran pencernaan ikan. Bakteri probiotik Bacillus sp. memiliki kemampuan mengekskresikan enzim protease, lipase, dan amilase. Enzim eksogenustersebut dapat membantu enzim endogenus pada inang untuk menghidrolisis nutrien pakan sehingga meningkatkan ketersediaan nutrien yang siap diserap dari saluran pencernaan untuk masuk ke pembuluh darah untuk proses metabolisme selanjutnya (Widanarni et al. 2012).
Konversi pakan ikan lele setelah 30 hari pemeliharaan berkisar antara 0,75-1,13. Perlakuan B memiliki nilai konversi pakan terkecil sebesar 0,75 yang berbeda nyata dengan perlakuan K- sebesar 1,13. Nilai konversi pakan dipengaruhi oleh protein pakan dan jumlah pakan yang diberikan. Hal ini dikarenakan nilai efisiensi pakan berkaitan dengan laju pertumbuhan. Semakin tinggi laju pertumbuhan maka semakin besar nilai efisiensi pakan yang didapat (Shafrudin et al. 2013). Penelitian ini menunjukan pemberian dosis probiotik dapat memberikan pengaruh yang nyata terhadap nilai konversi pakan. Hal ini dikarenakan adanya probiotik dalam usus yang diduga bekerja meningkatkan kandungan protein pakan dan membantu proses pencernaan. Hasil yang sama ditunjukan pada ikan trout yang diberi probiotik mampu meningkatkan konversi pakan (Mohapatra et al. 2012).
Efektivitas pemberian probiotik melalui pakan terhadap respon imun ikan dapat dilihat juga melalui gambaran darah. Parameter gambaran darah yang diamati meliputi kadar eritrosit (SDM), total leukosit (SDP), kadar hemoglobin (Hb), dan kadar hematokrit (Hc). Eritrosit merupakan salah satu indikator dari perubahan kondisi kesehatan ikan. Kadar eritrosit dari awal pemeliharaan hingga akhir pemelihaan berkisar antara 0,69-1,91 x 106 sel/mm3. Kadar eritrosit ikan normal
berkisar antara 0,2-30 x 106 sel/mm3 (Lagler et al. 1977). Nilai eritrosit pada perlakuan B memiliki kadar eritrosit sebesar 1,91 x 106 sel/mm3 yang berbeda nyata terhadap setiap perlakuan. Kadar eritrosit pada setiap perlakuan mengalami peningkatan selama pemeliharaan. Hal ini dikarenakan jumlah eritrosit dipengaruhi oleh kondisi nutrisi, aktivitas fisik, dan umur (Dellman & Brown 1989). Setelah uji tantang, kadar eritrosit pada setiap perlakuan mengalami penurunan kecuali perlakuan K- yang tidak disuntik A. hydrophila. Kadar eritrosit terkecil diperoleh perlakuan K+ sebesar 0,63 x 106 sel/mm3 yang berbeda nyata terhadap setiap perlakuan. Hal ini diduga karena A. hydrophila mampu menghasilkan enzim eksotoksin, salah satunya hemolisin yang dapat melisiskan sel darah merah dan melepaskan hemoglobin dari sel darah (Triyaningsih et al. 2014). Hal ini juga yang menyebabkan pendarahan pada ikan dan menyebabkan kematian.
Total leukosit hari ke-30 berkisar antara 2,7-4,2 x 104 sel/mm3. Menurut
11 Kadar hemoglobin (Hb) dari awal hingga akhir pemeliharaan berkisar antara 5,6-8,80 gram%. Nilai hemoglobin yang didapat masih didalam kisaran normal. Menurut Takashima & Hibiya (1995) kadar hemoglobin ikan normal berkisar antara 6-10 gram%. Kadar hemoglobin hari ke-30 tetap meningkat yaitu berkisar antara 7,10-8,10 gram% yang tidak berbeda nyata terhadap setiap perlakuan. Setelah uji tantang, kadar hemoglobin berkisar antara 5,10-7,66 gram%. Pada perlakuan B sebesar 7,46 gram% berbeda nyata terhadap perlakuan K+ sebesar 5,10 gram%. Kadar hemoglobin terkait dengan jumlah eritrosit, semakin rendah kadar eritrosit maka semakin rendah kadar hemoglobin (Royan et al. 2014). Fungsi dari hemoglobin adalah mengikat oksigen untuk proses katabolisme yang akan menghasilkan energi. Kadar hemoglobin rendah pada perlakuan K+ diduga karena kadar eritrosit yang menurun akibat dari infeksi A. hydrophila. Menurut Blaxhall (1973) kadar hemoglobin merupakan indikator dari ikan mengalami anemia atau kekurangan darah.
Kadar hematokrit pada awal pemeliharaan hingga akhir pemeliharaan berkisar antara 17,30-32,06%. Nilai hematokrit yang didapat masih didalam kisaran normal. Menurut Bond 1979 nilai hematokrit normal berkisar antara 20-48%. Setelah uji tantang kadar hematokit pada perlakuan B sebesar 34,71% yang berbeda nyata terhadap perlakuan K+ sebesar 17,87%. Rendahnya kadar hematokrit pada perlakuan K+ diduga karena ikan mengalami anemia. Menurut Alamanda et al.
(2007) rendahnya hematokrit merupakan salah satu indikator ikan mengalami anemia. Hal ini juga yang menyebabkan ikan menjadi stres dan menyebabkan kematian. Lalu kadar hematokrit pada perlakuan B mengalami peningkatan dengan nilai 34,71%, Hal ini menunjukan pemberian probiotik mampu menstabikan kadar hematokrit pada benih yang terinfeksi A. hydrophila.
KESIMPULAN
Ikan lele (Clarias sp.) yang diberi probiotik Bacillus sp. 2% memperlihatkan kinerja probiotik terbaik dengan tingkat kelangsungan hidup setelah diinfeksi dengan A. hydrophila sebesar 83,33%, laju pertumbuhan harian sebesar 5,40%, dan konversi pakan 0,75.
DAFTAR PUSTAKA
Agustono, Syprapto H, Muhajir. 2012. Strategi bakteri probiotik untuk menekan pertumbuhan bakteri patogen didalam pencernaan kerapu Chromileptes altivelis dengan memproduksi beberapa bakterial substansi. Jurnal Ilmiahp Perikanan dan Kelautan. 4(2):199-205.
Alamanda IE, Handajani NS, Budiharjo A. 2007. Penggunaan metode hematologi dan pengamatan endoparasit darah untuk penetapan kesehatan ikan lele dumbo (Clarias gariepinus) di kolam budidaya desa Mangkubumen Boyolali.
12
Azhar F. 2013. Pengaruh probiotik dan prebiotik terhadap performan juvenile ikan kerapu bebek (Comileptes altivelis). BuletinVeteriner Udayana. 6(1): 1-9. Blaxhall PC. 1973. The haematological assesment of the health of fresh water fish.
a review of selected literature. Journal Fish Biology.4:593-608. Bond C. 1979. Biology of Fishes. Philadelphia: Saunders Colege Publishing. Cabello C, Felipe. 2006. Heavy use of prophylactic antibiotics in aquaculture: a
growing problem for human and animal health and for environment.
Enviromental Microbiology. 8(7): 1131-1144.
Dellman HD, Brown EM. 1989. Buku teks histologi veteriner 1. UI Press:Jakarta. Hendrianto, Zaeni A. 2009. Aplikasi imuno-probiotik dalam pendederan kerapu
macan (Ephinephelus fuscoguttatus) dan dampaknya terhadap imunitas dan tingkat kelulushidupan. Riau: Balai Budidaya Laut Batam.
Huissman EA. 1987. Principles of fish nutrition. Department of Fish Culture and Fisheries. Netherlands: Wageningen Agriculture Univ Pr.
Kabata, Z. 1985. Parasites and Disease of Fish Cultured in the Tropics. London: Taylor and Francis Press.
[KKP]. 2014. Perikanan budidaya Indonesia. Direktorat Jendral Perikanan Budidaya. Kementerian Kelautan dan Perikanan. [Internet]. Diacu [2015 Februari 2]. Tersedia dari: http://www.djpb.kkp.go.id/berita.php?id=847. Kurniawan Adhi, Sarjito, Prayitno SB. 2014. Pengaruh pemberian ekstrak daun
binahong (Anredera cordifolia) pada pakan terhadap kelulushidupan dan profil darah lele dumbo (Clarias gariepinus) yang diinfeksi Aeromonas caviae. Journal of Aquaculture Management and Technology. 3(3): 76-85. Lagler KF, JE Bardach, RR Miller, Passino. 1977. Ichtyology. John Willey & Sons.
New York. 506p.
Marzouk MS, Nermeen M, Mohamed M. 2008. The influence of some probiotics on the growth performance and intestinal microbial flora O. niloticus. Egypt: Cairo university.
Mohapatra, Chakraborty, Kumar V, Deboeck, Mohanta KN. 2012. Aquaculture and stress management: a review of probiotic intervention. Journal of Animal Physiology and Animal Nutrition. 405-430.
Royan F, Rejeki S, Haditomo C. 2014. Pengaruh salinitas yang berbeda terhadap profil darah ikan nila (Oreochromis niloticus). Journal of Aquaculture Management and Technology. 3(2): 109-117.
Salasia S, Sulanjari, Ratnawati A. 2001. Studi hematologi ikan air tawar. Biologi. 2(12):710-723.
Sartika, Y. 2011. Efektivitas fitofarmaka dalam pakan untuk pencegahan infeksi bakteri Aeromonas hydrophila pada ikan lele dumbo Clarias sp. [skripsi]. Bogor: Institut Pertanian Bogor.
Septiarini, Harpeni E, Wardiyanto. 2012. Pengaruh waktu pemberian probiotik terhadap respon imun non-spesifik ikan mas (Cyprinus carpio) yang diuji tantang dengan bakteri Aeromonas salmonicida. e-Jurnal Rekayasa dan Teknologi Budidaya Perairan. 1(1): 39-46
13 Shafrudin D, Yuniarti, Setiawati M. 2013. Pengaruh penambahan probiotik pada pakan dengan dosis berbeda terhadap pertumbuhan, kelulushidupan, efisiensi pakan, dan retensi protein ikan patin (Pangasius hypophthalamus).
e-Jurnal Rekayasa dan Teknologi Budidaya Perairan. 1(2):151-162
[SNI] Standar Nasional Indonesia. 2000. Produksi induk ikan lele dumbo (Clarias gariepinus x C.fuscus) kelas induk pokok (Parent stock). 01-6484.3-2000
Takashima F, Hibiya T. 1995. An Atlas of Fish Histology: Normal and Pathogical Features. 2nd ed. Tokyo: Kodansha Ltd.
Triyaningsih, Sarjito, Prayinto B. 2014. Patogenisitas Aeromonas hydrophila yang diisolasi dari lele dumbo (Clarias gariepinus) yang berasal dari Boyolali.
Journal of Aquaculture Management and Technology. 3(2):11-17.
Verschuere L. Rombaut G, Sorgeloos P, Verstraete W. 2000. Probiotic bacteria as biological control agents in aquaculture. Microbial Mol Biol rev. 64(4):655-671.
Wang YB, Xu R, Xia MS. 2005. The effectiveness of commercial probiotics in northern white shrimp Panaeus vannamei ponds. Fisheries Science. 71: 1036-1041
Widanarni, Wahjuningrum D, Puspita F. 2012. Aplikasi bakteri probiotik melalui pakan buatan untuk meningkatkan kinerja pertumbuhan udang windu
14
LAMPIRAN
Lampiran 1 Anova hasil uji tukey konversi pakan
Source DF SS MS F P
P 3 0,15973 0,05324 6,61 0.050
Error 4 0,03222 0,00806
Total 7 0,19195
S=0,0170 R-Sq=21,21% R-Sq(adj)=0,00%
Perlakuan N Mean Grouping
1 2 1,13451 A
2 2 1,04626 AB
3 2 0,94549 AB
4 2 0,75462 B
Lampiran 2 Anova hasil uji tukey tingkat kelangsungan hidup
Source DF SS MS F P
P 3 86,459 28,820 32,15 0.003
Error 4 3,586 0,896
Total 7 90,045
S=0,9468 R-Sq=96,02% R-Sq(adj)=93,03%
Perlakuan N Mean Grouping
4 2 97,688 A
3 2 94,063 AB
2 2 91,563 BC
1 2 88,750 C
Lampiran 3 Anova hasil uji tukey laju pertumbuhan harian
Source DF SS MS F P
P 3 1,1856 0,3952 5,67 0.053
Error 4 0,2473 0,0618
Total 7 1,4329
15
Perlakuan N Mean Grouping
4 2 5,4066 A
3 2 4,8492 AB
1 2 4,5640 AB
2 2 4,3917 B
Lampiran 4 Anova hasil uji tukey tingkat kelangsungan hidup uji tantang
Source DF SS MS F P
P 3 6166,7 2055,6 27,41 0.000
Error 8 600,0 75,0
Total 11 6766,7
S=8,660 R-Sq=91,13 % R-Sq(adj)=87,81%
Perlakuan N Mean Grouping
1 2 96,667 A
4 2 83,333 A
3 2 53,333 B
2 2 40,000 B
Lampiran 5 Anova hasil uji tukey kadar eritrosit uji tantang
Source DF SS MS F P
P 3 1,1913 0,638 5,34 0.026
Error 8 0,955 0,119
Total 11 2,867
S=0,3454 R-Sq=66,71% R-Sq(adj)=54,23%
Perlakuan N Mean Grouping
1 2 1,6300 B
4 2 1,5367 A
3 2 1,4567 AB
2 2 0,6300 B
Lampiran 6 Anova hasil uji tukey total leukosit
Source DF SS MS F P
P 3 3,523 1,174 7,38 0.011
Error 8 1,273 0,159
Total 11 4,797
16
Perlakuan N Mean Grouping
4 3 5,0667 A
2 3 4,4000 AB
3 3 4,10000 AB
1 3 3,5667 B
Lampiran 7 Anova hasil uji tukey kadar hematokrit uji tantang
Source DF SS MS F P
P 3 463,372 154,457 162,58 0.000
Error 8 7,600 0,950
Total 11 470,973
S=0,9747 R-Sq=98,39% R-Sq(adj)=97,78%
Perlakuan N Mean Grouping
4 3 34,713 A
3 3 28,517 B
1 3 23,500 C
2 3 17,873 D
Lampiran 8 Anova hasil uji tukey kadar hemoglobin uji tantang
Source DF SS MS F P
P 3 13,476 4,492 5,73 0.022
Error 8 6,273 0,784
Total 11 19,749
S=0,8855 R-Sq=68,23% R-Sq(adj)=56,32%
Perlakuan N Mean Grouping
1 3 7,6667 A
4 3 7,4667 A
3 3 6,00000 AB
17
RIWAYAT HIDUP
Penulis lahir di Bogor, pada tanggal 15 juli 1993, yang dilahirkan dari ayah Tata Sutisna dan ibu Yayah Rodiah. Penulis adalah putra ketiga dari empat bersaudara. Penulis mengikuti pendidikan Sekolah dasar di SDN Ciampea 01 Bogor hingga tahun 2005. Kemudian penulis melanjutkan sekolah menengah pertama di SMPN 6 Bogor hingga tahun 2008. penulis lulus dari SMA Negeri 10 Bogor dan pada tahun yang sama penulis lulus seleksi masuk Institut Pertanian Bogor (IPB) melalui jalur UTM dan diterima di Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan.