7
II. TINJAUAN PUSTAKA
A. Karakteristik Teh (Camellia sinensis)
Tanaman teh tergolong tanaman perdu, sistem perakaran teh adalah akar
tunggang. Bunganya kuning-putih berdiameter 2,5–4 cm dengan 7 hingga 8 petal,
berkelamin dua dan terdapat di ketiak daun. Kelopak bentuk mangkok, hijau,
benang sari membentuk lingkaran, pangkal menyatu, melekat pada daun mahkota,
pada bagian dalam lepas. Tangkai sari kurang lebih 1 cm, berwarna putih
kekuningan. Kepala sari berwarna kuning, Tangkai putik bercabang tiga,
panjangnya kurang lebih 1 cm dan berwarna hijau kekuningan. Daun teh
merupakan daun tunggal dan memiliki panjang 4–15 cm dan lebar 2–5 cm. Helai
daun berbentuk lanset dengan ujung meruncing dan bertulang menyirip. Pangkal
daun runcing dan tepinya lancip bergerigi. Daun muda yang berwarna hijau muda
lebih disukai untuk produksi teh. Daun teh mempunyai rambut-rambut pendek
putih di bagian bawah daun. Daun tua berwarna lebih gelap (Magambo & Cannell,
1981).
Menurut Graham (1984), tanaman teh Camellia sinensis diklasifikasikan
sebagai berikut :
Kerajaan : Plantae
Divisi : Spermatophyta (tumbuhan biji)
Sub divisi : Angiospermae (tumbuhan biji terbuka) Kelas : Dicotyledoneae (tumbuhan biji belah) Sub Kelas : Dialypetalae
Bangsa : Guttiferales (Clusiales)
Suku : Camelliaceae (Theaceae)
Marga : Camellia
B. Kandungan Senyawa Kimia Teh
Zat bioaktif yang ada dalam teh, terutama merupakan golongan flavonoid.
Berdasarkan strukturnya flavonoid digolongkan menjadi 6 kelas, yaitu flavone,
flavaonone, isoflavone, flavonol, flavanol, dan antosianin. Adapun flavonoid yang
ditemukan di dalam teh berupa flavanol dan flavonol. Selain flavonoid di dalam
teh juga terdapat asam amino bebas yang disebut sebagai L-theanin (Hartoyo,
2003).
Senyawa kimia dalam teh yang merupakan salah satu kelas flavanol adalah
katekin. Jumlah atau kandungan katekin bervariasi untuk masing-masing jenis teh.
Katekin teh memiliki sifat tidak berwarna, larut dalam air serta membawa sifat
pahit dan sepat pada seduhan teh.
Flavonol terdapat dalam bentuk glikosida (berikatan dengan molekul gula)
dan sedikit dalam bentuk aglikonnya. Jumlah flavonol teh bervariasi tergantung
suhu dan cara ekstraksi yang digunakan. Menurut Hartoyo (2003), jumlah
flavonol teh dapat dilihat pada Tabel 1.
Tabel 1. Jumlah Flavonol Teh Hitam dan Teh Hijau
Jenis Flavonol Jumlah (g/kg) Teh Hijau Teh Hitam Mrycetin 0,83 – 1,59 0,24 – 0,52
Quercetin 1,79 – 4,05 1,04 – 3,03
Kaempferol 1,56 – 3,31 1,72 – 2,31 Sumber : Hartoyo, 2003
Quercetin mempunyai rumus kimia 3,3′,4′,5,7-Pentahydroxyflavone dan
dapat melebur pada suhu 316,50C. Quercetin tidak larut dalam air dan eter, tetapi
larut dalam alkohol dan aseton. Quercetin merupakan antioksidan yang paling
antibakteri, anti kanker dan anti-inflamasi (Lide, 1997). Sebagai senyawa
antibakteri, quercetin mampu berikatan dengan dengan DNA girase bakteri yang
berperan dalam replikasi DNA. Quercetin mengganggu kerja enzim girase
sehingga proses replikasi DNA terhenti. (Plaper et al., 2003).
Kaempferol merupakan kristal padat berwarna kuning dengan titik lebur
276-278 ° C. Senyawa ini tidak larut dalam air tetapi larut dalam etanol dan dietil
eter. Kaempferol memiliki berbagai aktivitas farmakologi, termasuk antioksidan,
anti-inflamasi, antibakteri, antikanker, antidiabetes, dan anti-osteoporosis
(Calderon et al., 2011). Kaempferol terbukti mempunyai aktivitas antibakteri
namun belum diketahui pasti bagaimana mekanismenya. Struktur kaempferol
hampir mirip dengan quercetin sehingga dapat diasumsikan bahwa mekanisme
hambatnya terhadap pertumbuhan bakteri sama dengan quercetin yaitu
menghambat sintesis DNA (Lim et al., 2007).
Gambar 1. Struktur quercetin dan kaempferol (Richard et al., 2008)
Selain senyawa flavonoid, terdapat satu senyawa bioaktif dalam teh yang
memiliki manfaat bagi tubuh, yaitu L-theanin. L-theanain adalah sebuah asam
amino yang unik pada tanaman teh dan merupakan komponen utama yang
ditemukan pada tanaman teh serta jamur Xeromonas badius. Jumlah L-theanin
dalam daun teh adalah berkisar antara 1-2% berat kering (Hartoyo, 2003).
Menurut Hidayat (2009), ekstrak kasar daun teh mengandung beberapa
senyawa seperti alkaloid, flavonoid, tanin, dan saponin yang mempunyai sifat
bakteriolitik terhadap Micrococcus luteus dan Pseudomonas fluorescens. Menurut
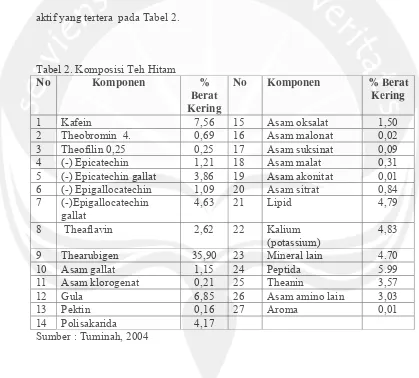
Tuminah (2004), selain flavonoid teh hitam mengandung berbagai macam zat
aktif yang tertera pada Tabel 2.
Tabel 2. Komposisi Teh Hitam
No Komponen %
Sumber : Tuminah, 2004
C. Jerawat dan Bakteri Penyebab Jerawat
Jerawat adalah kondisi abnormal kulit akibat terjadi gangguan berlebihan
saluran folikel rambut dan pori-pori kulit. Jerawat dapat timbul di permukaan kulit
muka, bagian dada dan atas lengan (Dewi, 2009).
Menurut Dewi (2009) ada 3 tipe jerawat yang sering dijumpai. Tipe yang
pertama adalah komedo. Komedo adalah pori-pori yang tersumbat, bisa terbuka
atau tertutup. Komedo yang terbuka disebut sebagai blackhead, terlihat seperti
pori-pori yang membesar dan menghitam. Berwarna hitam sebenarnya bukan
kotoran tetapi merupakan penyumbat pori yang berubah warna karena teroksidasi
dengan udara. Komedo yang tertutup atau whiteheads, biasanya memiliki kulit
yang tumbuh di atas pori-pori yang tersumbat maka terlihat seperti tonjolan putih
kecil-kecil di bawah kulit. Jerawat jenis ini disebabkan sel-sel kulit mati dan
kelenjar minyak yang berlebihan pada kulit (Dewi, 2009).
Tipe yang kedua adalah Jerawat biasa atau klasik. Jenis jerawat klasik ini
mudah dikenal yaitu terdapat tonjolan kecil berwarna pink atau kemerahan. Hal
ini terjadi karena pori-pori yang tersumbat terinfeksi dengan bakteri yang terdapat
di permukaan kulit, kuas make-up, dan jari tangan. Stress, hormon, dan udara
yang lembab dapat memperbesar kemungkinan infeksi jerawat karena
menyebabkan kulit memproduksi minyak yang merupakan tempat
berkembang-biaknya bakteri. Pengobatan pada tipe ini dapat diatasi dengan menghambat
pertumbuhan bakteri penyebab jerawat dengan suatu zat antibakteri misalnya
benzoil peroksida, tetrasiklin, dll (Dewi, 2009).
Kadar benzoil peroksida 2,5-10% sangat aktif dalam melawan bakteri
penyebab jerawat, namun kerugian utama antibakteri ini adalah dapat
yang diberikan dengan dosis 500mg, rutin dua hari sekali selama 2 bulan terbukti
efektif mengobati jerawat. Demikian pula dengan Erythromycin dengan dosis
250-500mg 2 kali sehari secara rutin juga efektif mengobati jerawat (Anonim,
1996).
Tipe yang ketiga adalah Cystic Acne (Jerawat Batu atau Jerawat Jagung).
Biasanya jerawat ini besar dengan tonjolan-tonjolan yang meradang hebat dan
berkumpul di seluruh wajah. Penderita jerawat ini dikarenakan faktor genetik
yang memiliki banyak kelenjar minyak sehingga pertumbuhan sel-sel kulit tidak
normal dan tidak dapat mengalami regenerasi secepat kulit normal (Dewi, 2009).
Menurut Loveckova dan Havlikova (2002), jerawat dapat disebabkan oleh
aktivitas bakteri seperti Propinium acne, Staphylococcus epidermidis, dan
Staphylococcus auerus. Staphylococcus epidermidis tumbuh cepat pada kondisi
kulit yang anerob yaitu pada saat pori-pori kulit tersumbat akibat adanya produksi
kelenjar minyak yang berlebih. Bakteri ini juga dapat mensintesis enzim lipase
yang dapat mengubah triasigliserol pada kelenjar minyak menjadi asam lemak
bebas yang memacu terjadinya infeksi pada kulit. Infeksi ini membuat jerawat
makin bertambah parah dan berwana kemerahan (Oakley, 2009).
D. Bakteri Staphylococcus epidermidis
Staphylococcus epidermidis merupakan bakteri Gram positif, mempunyai
morfologi koloni berbentuk sirkuler, morfologi sel bakteri berbentuk bulat,
bersifat motil, dan katalase positif. Pada uji biokimia bakteri ini akan dapat
nitrat dan menghidrolisis pati (Breed et al. 2001). Klasifikasi Staphylococcus
epidermidis menurut Nilsson et al. (1998) adalah :
Gambar 2. Bakteri Staphylococcus epidermidis (Anonim, 2011)
E. Metode Eksktrasi
Ekstraksi merupakan proses pemisahan bahan campurannya dengan
menggunakan pelarut. Ekstrak adalah sediaan yang diperoleh dengan cara
ekstraksi tanaman obat dengan ukuran partikel tetentu dan menggunakan medium
pengekstraksi (menstrum) yang tertentu pula (Agoes, 2007)
Menurut Voigt (1995) pada dasarnya terdapat dua prosedur untuk
membuat sediaan obat tumbuhan, salah satunya dengan cara ekstraksi. Cara
ekstraksi yaitu bahan segar yang telah dikeringkan dan dihaluskan, diproses Kerajaan: Bacteria
Devisi : Firmicutes
Kelas : Bacilli
Bangsa : Bacilliales
Suku : Staphylococcaceae
Marga : Staphylococcus
dengan suatu cairan pengekstraksi. Jenis ekstraksi yang digunakan tergantung dari
kelarutan bahan yang terkandung dalam tanaman serta stabilitasnya. Menurut
(Harborne, 1987), ekstraksi yang tepat tergantung pada tekstur dan kandungan air
bahan tumbuhan yang diekstraksi dan pada jenis senyawa yang diisolasi.
Proses ekstraksi merupakan proses penarikan zat pokok yang diinginkan dari
bahan mentah obat dengan menggunakan pelarut yang dipilih dengan zat yang
diinginkan larut (Voigt, 1995). Kandungan kimia dari suatu tanaman yang
berkhasiat obat umumnya mempunyai sifat kepolaran yang berbeda-beda,
sehingga perlu untuk memisahkan secara selektif menjadi kelompok-kelompok
tertentu. Serbuk simplisia diekstraksi berturut-turut dengan pelarut yang berbeda
polarisnya (Harborne, 1987).
Metode dasar dari ekstraksi obat adalah maserasi (Proses M) dan perkolasi
(Proses P). Biasanya metode ekstraksi dipilih berdasarkan beberapa faktor seperti
sifat dari bahan mentah obat dan daya penyesuaian dengan tiap macam metode
ekstraksi serta kepentingan dalam memperoleh ekstrak yang sempurna atau
mendekati sempurna dari obat (Voigt, 1995). Sifat bahan mentah obat merupakan
faktor utama yang harus dipertimbangkan dalam memilih metode ekstraksi.
Beberapa obat tidak dapat diperkolasi yang mengisyaratkan bahwa zatnya harus
digiling sehingga menjadi serbuk yang rata dan dimasukkan ke dalam perkolator
(Voigt, 1995).
Maserasi berasal dari bahasa latin macerace yang artinya merendam. Proses
ini merupakan cara paling tepat karena obat yang sudah halus memungkinkan
sehingga zat-zat yang mudah larut akan melarut (Voigt, 1995). Maserasi
dilakukan dengan cara merendam serbuk simplisia dalam cairan penyari. Cairan
penyari akan menembus dinding sel dan masuk ke dalam rongga sel yang
mengandung zat aktif dan zat aktif akan larut (Anonim, 1986).
Pembuatan ekstrak dengan metode maserasi mengikuti syarat farmakope,
yaitu bahan tumbuhan dihaluskan dengan cara dipotong-potong atau
diserbukkasarkan, kemudian disatukan dengan bahan pengekstraksi (Voigt, 1995).
Semakin kecil ukuran partikel dari bahan, maka akan semakin mudah cairan
pengekstrak menarik senyawa kimia yang terkandung dalam bahan tersebut
(Sudarmadji et al., 1989).
Tanaman obat yang akan diekstraksi ditempatkan pada wadah yang
bermulut lebar, bersama menstrum yang telah ditetapkan, kemudian bejana ditutup
rapat, dan isinya dikocok berulang-ulang selama 2-14 hari, namun maserasi sudah
memadai selama 5 hari (Voigt, 1995). Lamanya harus cukup supaya dapat
memasuki rongga dari struktur bubuk tanaman obat dan melarutkan semua zat
yang mudah larut (Ansel, 1989). Metode ini tidak menggunakan pemanasan,
sehingga zat aktif yang terkandung dalam simplisia tidak rusak. Selama maserasi
bahan disimpan dan terlindungi dari cahaya langsung untuk mencegah reaksi
perubahan warna (Voigt, 1995).
Waktu maserasi pada umumnya 5 hari, setelah waktu tersebut
keseimbangan antara bahan yang diekstraksi pada bagian dalam sel dengan luar
ekstraksi lebih cepat dalam cairan. Keadaan diam selama maserasi menyebabkan
turunnya perpindahan bahan aktif (Voight, 1995).
F. Jenis dan Sifat Pengekstrak
Pelarut organik berdasarkan konstanta elektrikum dapat dibedakan menjadi
dua yaitu pelarut polar dan pelarut non-polar. Konstanta dielektrikum dinyatakan
sebagai gaya tolak menolak antara dua pertikel yang bermuatan listrik dalam suatu
molekul. Semakin tinggi konstanta dielektrikumnya maka pelarut bersifat semakin
polar (Sudarmadji et al, 1989). Konstanta dielektrikum dari beberapa pelarut yang
dapat dilihat pada Tabel 3.
Tabel 3. Konstanta dielektrikum pelarut organik
Pelarut Besarnya
Ekstraksi dapat menggunakan pelarut tunggal dan pelarut campuran. Pelarut
campuran yang biasa digunakan yaitu campuran air dan etanol, campuran air dan
metanol, campuran air dan eter (Agoes, 2007). Menurut Guenther (1987), syarat
pelarut yang digunakan pertama harus bersifat bersifat selektif artinya pelarut harus
dapat melarutkan semua senyawa dengan cepat. Syarat kedua harus mempunyai titik
didih yang cukup rendah. Hal ini supaya pelarut mudah dapat diuapkan tanpa
akan mengakibatkan kehillangan akibat penguapan. Syarat ketiga bersifat inert
artinya pelarut tidak bereaksi dengan komponen minyak. Syarat keempat carilah
pelarut yang murah dan mudah didapatkan.
Pemilihan menstrum yang akan digunakan dalam ekstraksi dari bahan
mentah obat tertentu berdasarkan pada daya larut zat aktif dan zat tidak aktif serta
zat yang tidak diinginkan juga tergantung pada tipe preparat farmasi yang
diperlukan sebagai contoh yang mengandung air, hidroalkoholik atau alkoholik
(Ansel, 1989).
Pelarut yang diplih pada penelitian ini adalah etanol, metanol, dan aquades.
Aquades merupakan air murni hasil destilasi. Aquades memiliki kemampuan yang
baik untuk mengekstraksi sejumlah bahan simplisia (Voigt, 1995). Etanol
merupakan pelarut yang serbaguna, dapat menyatu dengan air dengan sebagian
besar bahan organik yang bersifat cair termasuk zat cair, termasuk zat cair
non-polar seperti hidrokarbon alifatik. Etanol juga digunakan sebagai pelarut dalam
melarutkan bahan obat-obatan. Etanol (etil alkohol) mempunyai rumus kimia
C2H5OH,mudah terbakar, memiliki titik cair -114,30C dan titik didih 78,40C
(Anonim, 2000).
Metanol sering disebut metil alkohol, mempunyai rumus kimia CH3OH dan
merupakan pelarut yang tak berwarna. Menurut sejarahnya, metanol disebut
alkohol kayu (Fessenden dan Fessenden, 1997). Pada Tabel 4 konstanta dielektrik
metanol menunjukkan nilai yang paling tinggi sehingga dapat dipilih sebagai
pelarut untuk mengekstrak ampas seduhan teh. Hasil penelitian Akroum et al.
bahwa pelarut metanol merupakan pengekstrak yang baik untuk mengekstak
senyawa antimikrobia pada tumbuhan teh.
G. Pertumbuhan Bakteri dan Metode Pengukurannya
Pertumbuhan pada bakteri dapat diartikan sebagai penambahan jumlah sel
bakteri. Pada dasarnya terdapat empat fase pertumbuhan bakteri ketika
ditumbuhkan pada batch culture, yaitu sebagai berikut:
1) Fase Lag (fase adaptasi)
Menurut Purwoko (2007), pada fase ini sel beradaptasi dengan mensintesis
enzim baru yang sesuai dengan medium serta pemulihan terhadap
metabolit yang bersifat toksik. Pada fase ini tidak dijumpai penambahan
jumlah sel, namun terdapat penambahan volume sel. Lama fase ini dapat
ditentukan oleh umur inokulan dan medium yang digunakan.
Pembentukan enzim-enzim baru diinduksi oleh substrat baru (Schlegel dan
Schmid, 1994).
2) Fase Log
Setelah sel memperoleh kondisi ideal maka sel melakukan pembelahan.
Sel melakukan konsumsi nutrient dan proses fisiologis lainnya sehingga
dihasilkan beberapa senyawa yang diekskresikan oleh sel bakteri, yaitu
etanol, asam laktat dan asam organik lainnya, asam lemak, asam amino
dan lainnya. Di fase ini perbanyakan sel meningkat sampai jumlah tertentu
(Purwoko, 2007). Kecepatan pembelahan bersifat spesifik pada
kering meningkat dengan kecepatan sama, kesediaan substrat berkurang,
kerapatan sel bertambah dan produk-produk metabolisme tertimbun
(Schlegel dan Schmid, 1994).
3) Fase Stationer
Pada fase ini sel berjuang terhadap kondisi ketersediaan nutrient yang
makin menipis, akumulasi metabolit toksik (misalnya: alkohol, asam,
basa), penurunan kadar oksigen serta penurunan kadar aw atau
ketersediaan air, sehingga menghasilkan antibiotik dan antioksidan.
(Purwoko, 2007).
4) Fase Kematian
Penyebab utama kematian bakteri adalah autolisis sel dan penurunan
energi seluler. Ada bakteri yang mampu bertahan hingga puluhan tahun
dengan mengubah sel menjadi spora. Namun ada pula bakteri yang tidak
mampu bertahan selama itu (Purwoko, 2007). Kurva pertumbuhan bakteri
dapat dilihat pada Gambar 2.
Gambar 3. Kurva Pertumbuhan bakteri pada batch culture
Metode pengukuran pertumbuhan sel bakteri yang sering digunakan
adalah metode turbidimeter. Secara rutin jumlah sel bakteri dapat dihitung dengan
mengukur tingkat kekeruhan kultur. Semakin keruh suatu kultur, semakin banyak
jumlah selnya. Prinsip dasar metode turbidimeter adalah jika cahaya mengenai sel,
maka sebagian cahaya diserap dan sebagian cahaya diteruskan. Jumlah cahaya
yang diserap berbanding lurus dengan jumlah bakteri (Jutono et al., 1980).
H. Aktivitas Anti Bakteri dan Efeknya
Antibakteri adalah senyawa yang digunakan untuk mengendalikan
pertumbuhan bakteri yang bersifat merugikan. Pengendalian pertumbuhan
mikroorganisme bertujuan untuk mencegah penyebaran penyakit dan infeksi,
membasmi mikrobia pada inang yang terinfeksi, dan mencegah pembusukan serta
perusakan bahan oleh mikrobia (Sulistyo, 1971). Antimikrobia meliputi golongan
antibakteri, antimikotik, dan antiviral (Ganiswara, 1995).
Pengujian daya antimikrobia terhadap spesies bakteri dapat dilakukan
dengan beberapa cara, yaitu menggunakan metode dilusi dan metode difusi
(Jutono et al, 1980). Metode umum lain yang sering digunakan untuk mempelajari
aktivitas antimikrobia adalah Metode Difusi Agar. Cawan petri yang berisi
medium agar, diinokulasi dengan bakteri uji. Ekstrak atau senyawa yang memiliki
sifat antimikrobia ditambahkan pada paper disc, yang diletakkan di permukaan
agar. Selama inkubasi, ekstrak akan berdifusi dari paper disc ke agar (Madigan,
Menurut Madigan (2000), berdasarkan sifat toksisitas selektifnya, senyawa
antimikrobia mempunyai 3 macam efek terhadap pertumbuhan mikrobia yaitu :
1. Bakteriostatik memberikan efek dengan cara menghambat pertumbuhan tetapi
tidak membunuh. Senyawa bakterostatik seringkali menghambat sintesis
protein atau mengikat ribosom. Hal ini ditunjukkan dengan penambahan
antimikrobia pada kultur mikrobia yang berada pada fase logaritmik. Setelah
penambahan zat antimikrobia pada fase logaritmik didapatkan jumlah sel total
maupun jumlah sel hidup adalah tetap.
2. Bakteriosidal memberikan efek dengan cara membunuh sel tetapi tidak terjadi
lisis sel atau pecah sel. Hal ini ditunjukkan dengan penambahan antimikrobia
pada kultur mikrobia yang berada pada fase logaritmik. Setelah penambahan
zat antimikrobia pada fase logaritmik didapatkan jumlah sel total tetap
sedangkan jumlah sel hidup menurun.
3. Bakteriolitik menyebabkan sel menjadi lisis atau pecah sel sehingga jumlah
sel berkurang atau terjadi kekeruhan setelah penambahan antimikrobia. Hal ini
ditunjukkan dengan penambahan antimikrobia pada kultur mikrobia yang
berada pada fase logaritmik. Setelah penambahan zat antimikrobia pada fase
logaritmik, jumlah sel total maupun jumlah sel hidup menurun.
Menurut Jawetz et al. (1982), mekanisme penghambatan antibakteri dapat
dikelompokkan menjadi 4 yaitu :
1. Penghambatan sintesis dinding sel bakteri
Langkah pertama kerjanya berupa pengikatan pada reseptor sel. Kemudian
Mekanisme diakhiri dengan pembuangan atau penghentian aktivitas
penghambat enzim autolisis pada dinding sel. Contoh antibakteri dengan
mekanisme kerja diatas adalah penicilin, sefalosporin, vankomisin, basitrasin,
sikloserin, dan ampisilin.
2. Merusak membran sel bakteri
Sitoplasma semua sel hidup dibatasi oleh membran sel yang bekerja sebagai
penghalang dengan permeabilitas selektif, melakukan fugsi pengangkutan
aktif sehingga dapat mengendalikan susunan sel. Bila integritas fungsi selaput
sitoplasma terganggu misalnya oleh zat bersifat surfaktan permeabilitas
dinding sel akan berubah atau bahkan menjadi rusak, sehingga komponen
penting, seperti protein, asam nukleat, nukleotida, dan lain-lain keluar dari sel
dan sel berangsur-angsur mati. Amfoterisin, kolistin, poimiksin, imidazol, dan
polien menunjukkan mekanisme karja tersebut.
3. Penghambatan sintesis protein bakteri
Umumya senyawa penghambat akan berikatan dengan enzim atau salah satu
komponen yang berperan dalam tahapan sintesis, sehingga akhirnya reaksi
akan terhenti karena tidak ada substrat yang direaksikan dan protein tidak
dapat terbentuk. Kloramfenikol, eritromisin, linkomisin, tetrasiklin, dan
aminoglikosida bersifat menghambat sintesis protein sel bakteri.
4. Penghambatan sintesis asam nukleat
Antibakteri dapat mengganggu proses replikasi dan transkripsi sehingga
pertumbuhan dan pembelahan sel bakteri terhambat. Pada umumnya
interaksi dengan benang heliks ganda DNA sehingga replikasi dan transkripsi
terganggu. (2) kombinasi dengan polimerase yang terlibat dalam biosintesis
DNA atau RNA.
Daya anti bakteri diukur secara in vitro agar dapat ditentukan kemampuan
suatu zat antimikrobia (Jawetz et al., 1982). Adanya fenomena ketahanan
tumbuhan secara alami terdapat mikrobia menyebabkan pengembangan sejumlah
senyawa yang berasal dari tanaman yang mempunyai kandungan antibakteri dan
antifungi (Griffin, 1981).
I. Antibiotik Streptomisin
Streptomisin dihasilkan oleh streptomyces griseus, suatu bakteri tanah
yang diisolasi oleh Waksman dan rekan-rekannya, yang melaporkan mengenai
aktivitas antibiotik pada tahun 1994. Streptomisin menjadi antibiotik utama untuk
kemoterapi tuberkolosis, namun resistensinya berkembang sangat cepat terhadap
antibiotik ini (Pelczar dan Chan, 1988).
Streptomisin merupakan salah satu antibiotika aminoglikosida yang
mampu menghambat sintesis protein, berpengaruh bakterisidal pada sejumlah
besar organisme Gram positif dan negative. Gugusan guanidine sangat basa yang
terdapat dalam streptomisin menyebabkan berbagai efek terhadap bakteri yang
tidak khas seperti keluarnya kalium dari sel bakteri, dan penggumpalan bakteri.
Efek bakterisidal yang khas tergantung pada kemampuannya untuk terikat pada
pembacaan yang salah pada mRNA dan mencegah gerakan ribosom setelah terikat
pada asam amino pertama pembentuk protein (Volk dan Wheeler, 1993).
J. Konsentrasi Hambat Minimum (KHM)
Minimum Inhibitory Concentration (MIC) atau dalam bahasa indonesia
sering disebut Konsentrasi Hambat Minimum (KHM) adalah konsentrasi terendah
dari antibakteri yang dapat menghambat pertumbuhan bakteri tertentu
(Greenwood, 1995). Efektivitas senyawa antimikroba dapat dilihat pada pengujian
antimikroba dengan menentukan konsentrasi terkecil agar pertumbuhan organisme
uji dapat terhambat. Menurut Bauman et al. (2007), pengujian antimikroba dengan
menentukan konsentrasi terkecil dapat dilakukan dengan teknik tube dilution.
Menentukan KHM dengan tube dilution dilakukan dengan membuat variasi
konsentrasi kemudian mengujinya dalam suatu media cair dengan mengamati
tingkat kejernihan yang ditimbulkan.
Menurut penelitian Maharini (2008), penentuan variasi konsentrasi yang
digunakan dalam penentuan KHM dapat dimulai dari konsentrasi 10mg/ml
sampai 25mg/ml. Bila nilai KHM pada konsentrasi tersebut belum diperoleh,
maka variasinya bisa ditingkatkan lagi. Dalam menghambat pertumbuhan bakteri
genus Staphylococcus, ekstrak Gigartiana sp. yang juga memiliki senyawa
K. Hipotesis
Hipotesis dalam penelitian ini adalah :
1. Metanol merupakan pelarut terbaik untuk mengekstrak senyawa antibakteri
dalam ampas teh hitam
2. Luas zona hambat yang ditimbulkan antibakteri ampas teh hitam lebih kecil
dari streptomisin.
3. Sifat antibakteri ampas seduhan teh hitam bersifat bakteriolitik.
4. Konsentrasi hambat minimum bakteri penyebab jerawat Staphylococcus