EFEK PEMBERIAN EKSTRAK DAUN MAHKOTA DEWA
(
Phaleria macrocarpa
) TERHADAP PERTUMBUHAN SEL-SEL
OTAK BESAR ANAK TIKUS SECARA
IN VITRO
ANI MURTISARI
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
ABSTRACT
ANI MURTISARI. The Effect of “Mahkota Dewa” Leaf Extracts (Phaleria macrocarpa) on the Newborne Rat Cerebrum Cells In Vitro Growth. Under direction of ITA DJUWITA and MIN RAHMINIWATI.
Research has been conducted on in vitro culture of three days old rat (Sprague Dawley) cerebrum cells in DMEM (Dulbecco’s Modified Eagle’s Medium) containing 10% NBCS (Newborne Calf Serum) and 50 µg/mL gentamycin (mDMEM), with and without mahkota dewa leaf extracts (MD). There are five groups of treatment consisted of positive control (mDMEM+30 µg/mL asiaticoside (AC)), negative control (mDMEM), concentration 1 (mDMEM+100 ppm MD), concentration 2 (mDMEM+200 ppm MD), and concentration 3 (mDMEM+400 ppm MD). Culture was done in 5% CO2 incubator
at 37oC for six days. The parameters observed were Population Doubling Time (PDT), neuron and glia composition, and the length of axon and dendrite, were done based on calculation using hemocytometer, Hematoxylin Eosin (HE) staining, and measured using micrometer, respectively. Data were analyzed using ANOVA and Duncan. The results showed that mahkota dewa leaf extracts concentration 400 ppm inhibited the neuronal cells proliferation (P<0,05). However, at concentration 200 ppm and 400 ppm increased the axon and dendrite length growth, respectively.
RINGKASAN
ANI MURTISARI. Efek Pemberian Ekstrak Daun Mahkota Dewa(Phaleria macrocarpa) terhadap Pertumbuhan Sel-Sel Otak BesarAnak Tikus secara In Vitro. Dibimbing oleh ITA DJUWITA dan MIN RAHMINIWATI.
Mahkota dewa merupakan salah satu tanaman obat yang dapat mengatasi kanker, kencing manis, hepatitis, asam urat, radang kulit, dan ekzema. Bagian mahkota dewa yang sering digunakan adalah buah dan daunnya. Berdasarkan penelitian, ekstrak daun mahkota dewa bersifat antiproliferatif terhadap sel hati normal.
Otak besar merupakan bagian dari otak yang berperan dalam penyimpanan memori. Efek ekstrak daun mahkota dewa terhadap otak besar belum diketahui sehingga dilakukan penelitian untuk mengevaluasi efek ekstrak daun mahkota dewa terhadap pertumbuhan sel-sel otak besar.
Penelitian ini dilakukan secara in vitro menggunakan sel-sel otak besar anak tikus (Sprague Dawley) umur tiga hari dalam medium dasar DMEM (Dulbecco’s Modified Eagle’s Medium) yang mengandung NBCS (Newborne Calf Serum) 10% dan gentamisin 50 µg/ml (mDMEM) dengan dan tanpa penambahan ekstrak daun mahkota dewa (MD). Terdapat lima kelompok perlakuan yang terdiri dari kontrol positif (mDMEM+asiaticoside (AC) 30µg/ml), kontrol negatif (mDMEM), konsentrasi 1 (mDMEM+MD 100 ppm), konsentrasi 2 (mDMEM+MD 200 ppm), dan konsentrasi 3 (mDMEM+MD 400 ppm). Kultur dilakukan dalam inkubator CO2 5% dan suhu 37oC selama enam hari. Parameter
yang diamati adalah Population Doubling Time (PDT), komposisi sel saraf dan sel glia, serta panjang akson dan dendrit masing-masing berdasarkan penghitungan menggunakan hemositometer, pewarnaan HE, dan pengukuran sel saraf menggunakan mikrometer. Data dianalisis menggunakan uji statistik ANOVA dan Duncan.
Hasil penelitian menunjukkan nilai PDT pada medium yang ditambahkan ekstrak daun mahkota dewa 100 ppm, 200 ppm, dan 400 ppm berturut-turut adalah 3,93 ± 0,49hari, 4,33 ± 0,28hari, dan 6,63 ± 1,27 hari, sedangkan nilai PDT pada kontrol positif dan negatif adalah 3,28 ± 0,26hari dan 3,78 ± 0,51hari. Pemberian ekstrak daun mahkota dewa pada medium kultur sel saraf memiliki nilai PDT lebih tinggi dibandingkan kontrol positif dan negatif. Hal ini menunjukkan bahwa pemberian ekstrak daun mahkota dewa pada medium kultur sel saraf dapat menghambat proliferasi sel saraf. Medium yang ditambahkan ekstrak daun mahkota dewa konsentrasi 200 ppm memiliki akson paling panjang yaitu 32,79 ± 8,19 µm, sedangkan dendrit paling panjang pada konsentrasi 400 ppm yaitu 23,25 ± 4,31µm. Dari hasil penelitian ini dapat disimpulkan bahwa ekstrak daun mahkota dewa dapat menghambat proliferasi sel saraf, namun mampu meningkatkan pertumbuhan akson pada konsentrasi 200 ppm dan dendrit pada konsentrasi 400 ppm.
EFEK PEMBERIAN EKSTRAK DAUN MAHKOTA DEWA
(
Phaleria macrocarpa
) TERHADAP PERTUMBUHAN SEL-SEL
OTAK BESAR ANAK TIKUS SECARA
IN VITRO
ANI MURTISARI
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan pada
Fakultas Kedokteran Hewan
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI
DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa skripsi Efek Pemberian Ekstrak Daun Mahkota Dewa(Phaleria macrocarpa) terhadap Pertumbuhan Sel-Sel Otak BesarAnak Tikus secara In Vitro adalah karya saya dengan arahan dari dosen pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, Oktober 2011
Ani Murtisari
© Hak Cipta milik IPB, tahun 2011
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah, dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
Judul : Efek Pemberian Ekstrak Daun Mahkota Dewa (Phaleria macrocarpa) terhadap Pertumbuhan Sel-Sel Otak Besar Anak Tikus secara In Vitro
Nama : Ani Murtisari NIM : B04070129
Disetujui
Dr. Drh. Hj. Ita Djuwita, M.Phil Pembimbing I
Drh. Min Rahminiwati, MS, Ph.D Pembimbing II
Diketahui,
Dr. Nastiti Kusumorini
Wakil Dekan Fakultas Kedokteran Hewan Institut Pertanian Bogor
RIWAYAT HIDUP
Penulis dilahirkan di Boyolali pada tanggal 6Juli 1989.Penulis adalah anak ketiga dari tiga bersaudara dari keluarga Bapak Sugiarto dan Ibu Nanik Ismawarti. Penulis memulai pendidikan taman kanak-kanak di TK Siwi Peni II pada tahun 1994.Pada tahun 1995, penulis memulai pendidikan sekolah dasar di SD Kiringan II.Tahun 2001 penulis melanjutkan sekolah di SMPN 1Boyolali sampai tahun 2004. Penulis melanjutkan SMA di SMAN 1 Boyolali dan lulus pada tahun 2007.
PRAKATA
Puji syukur kehadirat Allah SWT yang telah melimpahkan rahmat dan hidayahnya sehingga penulis dapat menyelesaikan penelitian dan penulisan skripsi
yang berjudul “Efek Pemberian Ekstrak Daun Mahkota Dewa (Phaleria macrocarpa) terhadap Pertumbuhan Sel-Sel Otak Besar Anak Tikus secara In Vitro”.
Penulis menyadari bahwa dalam penyusunan skiripsi ini tidak dapat diselesaikan dengan baik tanpa bantuan dan bimbingan dari berbagai pihak. Oleh karena itu, penulis mengucapkan terima kasih kepada:
Dr. Drh. Hj. Ita Djuwita, M.Phil dan Drh. Min Rahminiwati, MS, Ph.D
selaku dosen pembimbing yang telah memberikan pengarahan, bimbingan, dan pendampingan sejak persiapan penyusunan usulan penelitian, pelaksanaan penelitian, sampai penulisan skripsi ini selesai.
Dr. Drh. Susi Soviana, M.Si selaku dosen pembimbing akademik atas
semua bimbingan dan arahannya.
Seluruh dosen dan staf Laboratorium Embriologi FKH IPB yang telah memberikan bantuan ilmunya dalam pelaksanaan penelitian.
Laboratorium Pusat Studi Biofarmaka LPPM IPB Bogor yang telah
menyediakan ekstrak daun mahkota dewa.
Keluarga tercinta (Ayah, Ibu, dan keluarga besar) yang selalu memberikan dukungan dan doa yang tiada hentinya.
Teman-teman sepenelitian (Yunita dan Irma) atas kerjasama, semangat,
dan suka duka selama melaksanakan penelitian.
Kak Devi, Kak Yeni, Disa, Bu Eka, Pak Wahyudin, atas bantuan selama
pelaksanaan penelitian.
Bakhtiar Hidayat Harahap, S.KH atas semangat dan doa yang selalu diberikan.
Teman-teman di Chevana C2 (Archi, Chaca, Eka, Vully, Ningrum) atas
kebersamaan dan dukungannya.
Kepada semua pihak yang tidak dapat penulis sebutkan satu per satu yang
telah membantu dalam penelitian dan penulisan skripsi ini.
Penulis menyadari masih banyak kekurangan dalam penulisan skripsi ini. Penulis sangat mengharapkan kritik dan saran untuk melengkapi skripsi ini. Semoga tulisan ini bermanfaat bagi penulis, pembaca, dan semua pihak yang berkepentingan.
Bogor, Oktober 2011
DAFTAR ISI
Halaman
DAFTAR TABEL ... i
DAFTAR GAMBAR ... ii
DAFTAR LAMPIRAN ... iii
PENDAHULUAN Latar Belakang ... 1
Tujuan ... 3
Manfaat ... 3
TINJAUAN PUSTAKA Mahkota Dewa ... 4
Otak Besar (Cerebrum) ... 6
Sel Saraf ... 7
Kultur In Vitro ... 9
Kultur Sel Otak ... 10
METODE PENELITIAN Waktu dan Tempat ... 12
Alat dan Bahan ... 12
Metode ... 12
Ekstrak Daun Mahkota Dewa ... 12
Persiapan KulturSel Saraf ... 12
Isolasi dan Kultur Sel Saraf Otak Besar ... 13
Evaluasi Hasil Kultur Sel Saraf... 13
Tingkat Proliferasi BerdasarkanPDT ... 13
Diferensial Sel untuk Menentukan Sel Glia dan Sel Saraf ... 14
Pertumbuhan Panjang Akson dan Dendrit ... 14
Rancangan Percobaan ... 14
Analisis Data ... 15
HASIL DAN PEMBAHASAN Tingkat Proliferasi Berdasarkan Population Doubling Time ... 16
Kompisisi Jumlah Sel Glia dan Sel Saraf ... 17
Pertumbuhan Panjang Akson dan Dendrit ... 20
SIMPULAN DAN SARAN Simpulan ... 21
Saran ... 21
DAFTAR PUSTAKA ... 22
DAFTAR TABEL
DAFTAR GAMBAR
Halaman
1. Tanaman mahkota dewa ... 4
2. Sel saraf bipolar, unipolar, dan multipolar ... 7
3. Sel saraf multipolar dilihat dengan mikroskop elektron ... 8
4. Sel saraf bipolar pada kontrol negatif dan MD 400 ppm... 17
DAFTAR LAMPIRAN
PENDAHULUAN
Latar Belakang
Otak merupakan organ tubuh yang sangat penting. Menurut Aspinall &
O’Reilly (β004), fungsi otak antara lain untuk mengontrol dan mengoordinasi
semua aktivitas normal tubuh dan berperan dalam menyimpan memori. Seperti halnya dengan organ-organ yang lain, otak juga dapat mengalami kerusakan. Menurut Jackson et al. (2010) sejumlah cedera sistem saraf pusat (SSP) dan penyakit neurodegeneratif dapat mengakibatkan berbagai tingkat kematian sel dan neuroinflamasi.
Sel utama pada sistem saraf adalah sel saraf atau neuron. Kerusakan pada sel saraf dapat menyebabkan kelemahan memori (Colville & Bassert 2002), namun kelemahan memori juga dapat terjadi akibat fungsi otak yang lemah misalnya penurunan jumlah neurotransmitter utama (asetilkolin) yang berperan dalam proses penyimpanan memori (Taepavarapruk & Song 2010). Asetilkolin dapat diinaktivasi oleh enzim asetilkolinesterase menjadi asetil dan kolin (Denikrisna 2011).Untuk mempertahankan asetilkolin tetap tinggi maka penguraian asetilkolin menjadi asetil dan kolin oleh enzim asetilkolinesterase harus dihambat.
Tanaman obat (herbal medicine) merupakan salah satu metode pengobatan secara alami (back to nature) yang sedang digemari masyarakat dunia dan juga Indonesia. Mahkota dewa (Phaleria macrocarpa) merupakan salah satu contoh tanaman obatyang dapat mengatasi kanker, kencing manis (diabetes melitus), hepatitis, asam urat, radang kulit, dan ekzema (Wijayakusuma 2005). Bagian mahkota dewa yang sering dipakai untuk pengobatan adalah kulit buah, daging buah, dan daunnya.
organ tubuh yang lain seperti pada sel otak besar belum diketahui sehingga dilakukan penelitian untuk melihat efek ekstrak daun mahkota dewa terhadap pertumbuhan sel-sel otak besar. Kultur sel merupakan salah satu teknik yang dapat digunakan untuk mengukur kepekaan sel dalam menanggapi rangsang dan pengujian obat baru (Baum 2006) sehingga pada penelitian ini digunakan teknik kultur sel untuk menguji efek ekstrak daun mahkota dewa terhadap pertumbuhan sel-sel otak besar. Otak besar yang digunakan adalah otak besar anak tikus putih (Rattus norvegicus) yang berumur 3 hari.
Asiaticoside merupakan senyawa bioaktif yang berasal dari tanaman
Centella asiatica.Asiaticoside terbukti dapat melindungi sel saraf dari stres oksidatif dan mencegah terjadinya apoptosis (Mook-Jung et al. 1999) sehingga asiaticoside digunakan sebagai kontrol positif. Dosis optimum pemberian
asiaticoside pada kultur sel adalah ≤ 100 µg/mL (Musalmah et al. 2006), berdasarkan informasi ini maka asiaticoside yang digunakan pada penelitian ini sebanyak 30 µg/mL.
Zat-zat yang bersifat neurotoksik dapat menyebabkan kematian sel-sel saraf, degenerasi akson, dan peningkatan jumlah sel glia (Maezawa et al. 2006; Janis et al. 2008; Woehrling et al. 2010).Kematian sel-sel saraf dapat menyebabkan kelemahan memori (Colville & Bassert 2002), sedangkan degenerasi akson dapat menghambat penyaluran impuls (Messonnier 2002). Untuk melihat kemungkinan adanya efek negatif ekstrak daun mahkota dewa terhadap sel saraf, parameter yang diamati dalam penelitian ini adalah tingkat proliferasi sel saraf berdasarkan
Tujuan
Tujuan penelitian ini adalah untuk mengevaluasi efek pemberian ekstrak daun mahkota dewa (Phaleria macrocarpa) terhadap pertumbuhan sel saraf yang ditumbuhkan secara in vitro pada beberapa tingkatan konsentrasi ekstrak daun mahkota dewa (Phaleria macrocarpa).
Manfaat
TINJAUAN PUSTAKA
Mahkota Dewa
Di daerah Sumatera (Melayu), mahkota dewa dikenal dengan nama buah simalakama sedangkan di pulau Jawa mahkota dewa dikenal dengan nama makuto dewo (Habsari 2010). Sistematika tanaman mahkota dewa yaitu:
divisi : Spermatophyta subdivisi : Angiospermae kelas : Dicotyledoneae bangsa : Thymelecales suku : Thymelaceae marga : Phaleria
jenis : Phaleria macrocarpa (Scheff.) Boerl
Gambar 1 Tanaman mahkota dewa (Winarto 2009).
mengenal musim, dan biasanya banyak muncul saat musim penghujan. Buah mahkota dewa terdiri dari kulit, daging, cangkang, dan biji (Winarto 2009).
Daun mahkota dewa termasuk daun tunggal dengan tangkai daun berbentuk bulat yang panjangnya sekitar 3-5 mm. Daun mahkota dewa berwarna hijau yang permukaannya licin, tidak berbulu, dan pertulangan daunnya menyirip. Helaian daun ini berbentuk oval, ujung dan pangkal daun runcing dengan tepi rata. Panjang daun sekitar 7-10 cm dan lebar 3-5 cm. Daun yang sudah tua berwarna lebih gelap dibandingkan daun yang masih muda. Daun mahkota dewa termasuk bagian tanaman yang sering dimanfaatkan untuk obat disentri dan alergi. Sebagai obat, daun tersebut harus direbus terlebih dahulu. Penggunaan mahkota dewa yang melebihi dosis dan mengonsumsinya dalam keadaan mentah dapat menimbulkan gejala keracunan seperti bibir menjadi bengkak dan pecah-pecah, timbul luka di rongga mulut, pusing, mual, dan muntah (Winarto 2009).
Menurut Wijayakusuma (2005), mahkota dewa memiliki kandungan kimia alkaloid, terpenoid, saponin, resin, senyawa lignan (polifenol), dan flavanoid. Alkaloid merupakan senyawa organik yang berfungsi sebagai detoksikan yang menetralisir racun-racun di dalam tubuh. Saponin merupakan senyawa yang bersifat antibakteri dan antivirus, meningkatkan sistem kekebalan tubuh, mengurangi kadar gula darah, dan mengurangi penggumpalan darah. Flavanoid adalah suatu antioksidan alam yang mempunyai aktivitas biologis, antara lain sebagai antioksidan yang dapat menghambat berbagai reaksi oksidasi, serta mampu bertindak sebagai pereduksi radikal hidroksil, superoksida, dan radikal peroksil. Flavanoid dapat mencegah pertumbuhan kanker dan antiperadangan (Anonim 2011).Menurut Pawiroharsono (2001) flavanoid bermanfaat untuk antiinflamasi, antikanker, antivirus, antialergi, dan antikolesterol.
pertumbuhan sel kanker servik, penelitian yang serupa juga dilakukan oleh Kintoko & Pihie (2007). Efek antiploriferasi dan proapoptosis ekstrak daun mahkota dewa terhadap sel kanker payudara telah dibuktikan oleh penelitian Tjandrawinata et al. (2010).
Otak Besar (Cerebrum)
Otak terbagi menjadi 3 daerah utama yaitu forebrain (otak depan), midbrain
(otak tengah), dan hindbrain (otak belakang). Otak depan terdiri dari cerebrum, thalamus, dan hipothalamus. Cerebrum (otak besar) adalah bagian terbesar dari otak depan dan mengandung hampir 90% sel saraf yang ada di sistem saraf pusat
(Colville & Bassert β00β; Aspinall & O’Reilly β004). Cerebrum merupakan
bagian dari otak yang memberikan respon terhadap kebiasaan, belajar, inteligen, dan kesadaran (Colville & Bassert 2002).
Cerebrum bertugas menerima dan menginterpretasikan informasi sensoris; menginisiasi rangsangan secara sadar pada otot rangka; dan mengintegrasikan aktivitas neuron yang secara normal berhubungan dengan komunikasi, ekspresi respon emosional, belajar, memori dan daya ingat, dan kebiasaan lainnya yang dilakukan secara sadar (Colville & Bassert 2002).
Bagian luar dari cerebrum tersusun oleh gray matter yang menyelubungi
white matter di bagian dalamnya. Permukaan cerebrum berbentuk berlekuk-lekuk karena ada gyri (tonjolan) dan sulci (lekukan) (Messonnier 2000). Cerebrum terdiri dari dua bagian yang disebut hemisphere. Hemisphere terdiri dari hemisphere kanan dan hemisphere kiri, masing-masing hemisphere tersebut terdapat satu hippocampus. Hippocampus merupakan bagian dari otak yang berfungsi membentuk memori, mengorganisir memori, dan menyimpan memori. Hippocampus bekerja sebagai memory indexer yaitu mengirimkan memori ke bagian hemisphere dari otak besar untuk disimpan dalam waktu yang lama dan dapat mengeluarkan memori apabila dibutuhkan (Bailey 2011). Jika bagian ini mengalami kerusakan dan tidak berfungsi karena kekurangan oksigen, keracunan, atau blood clots (stroke), hewan akan dapat mengalami kegagalan untuk menyimpan ataupun mengingat suatu informasi (Colville & Bassert 2002). Allen
berkorelasi dengan tingkat memory deficits (amnesia). Berdasarkan fungsi otak besar yang berperan dalam memori, maka pada penelitian ini digunakan otak besar sebagai bahan coba untuk melihat efek ekstrak daun mahkota dewa terhadap sel-sel otak besar yang nantinya berpengaruh terhadap memori.
Sel Saraf
Sel saraf adalah unit dasar dari sistem saraf (Ribchester 1986). Sel saraf terdiri dari 3 bagian penting yaitu badan sel, dendrit, dan akson (Colville & Bassert 2002). Dendrit merupakan bagian yang menerima rangsangan dari sel saraf yang lain dan meneruskan rangsangan menuju badan sel saraf. Akson adalah bagian yang bertugas meneruskan rangsangan dari badan sel saraf menuju dendrit dari sel saraf lain, badan sel otot, atau badan sel glandular (Messonnier 2000; Colville & Bassert 2002).
Gambar 2 Sel saraf unipolar, bipolar, dan multipolar (Sriwulan 2005).
selnya dan setiap penjuluran dapat bercabang secara ekstensif (Ribchester 1986). Sel saraf unipolar dan multipolar dalam perkembangannya mula-mula terekspresi dari sel saraf bipolar(Ribchester 1986). Morfologi sel saraf multipolar dapat dilihat pada Gambar 3.
Gambar 3 Sel saraf multipolar dilihat dengan mikroskop elektron (BMC 2010).
Kultur In Vitro
Kultur primer yaitu menumbuhkan sel dari sel yang berasal dari jaringan hewan secara langsung (Paul 1972; Butler 2004). Sel kultur primer adalah sel yang diperoleh dari suspensi sel yang pertama kali dikultur. Jika sel-sel tersebut bermultiplikasi berulang kali maka sel-sel tersebut dapat dipasase, yaitu dipisahkan kembali kemudian dikultur ulang (Paul 1972). Kultur sel membutuhkan sel untuk dapat ditumbuhkan, sel didapatkan dari jaringan yang diisolasi kemudian dilakukan pemisahan jaringan untuk mendapatkan sel yang terpisah-pisah (Paul 1972; Freshney 2006). Biasanya pemisahan jaringan untuk mendapatkan sel menggunakan enzim tripsin atau kolagenase (Paul 1972; Freshney 2006).Kelangsungan hidup sel dapat ditingkatkan dengan melakukan
coating substratuntuk meningkatkan daya lekat sel ke substrat menggunakan gelatin, kolagen, laminin, atau fibronectin (Butler 2004; Freshney 2005). Kultur sel yang melekat pada substrat disebut kultur monolayer (Jakoby & Pastan 1979).
Eagle’s Minimal Essential Medium (MEM) dan Dulbecco’s Modified
Eagle’s Medium (DMEM) merupakan pengembangan dari Eagle’s Basal Medium (BME) dengan meningkatkan konsentrasi bahan penyusunnya. DMEM mengandung konsentrasi asam amino 2 kali lipat dan vitamin 4 kali lipat lebih banyak daripada MEM(Freshney 2005). Kandungan unsur pokok yang lebih baik ini menyebabkan DMEM menjadi medium yang biasa dipakai untuk kultur sel. Medium DMEM sangat cocok digunakan dalam berbagai kultur sel termasuk sel-sel yang berasal dari manusia, monyet, hamster, tikus, mencit, ayam, dan ikan (Pombinho et al. 2004, diacu dalam Riyacumala 2010).
Lingkungan yang terbaik untuk pertumbuhan sel adalah lingkungan yang kondisinya mendekati keadaan in vivo (Paul 1972; Malole 1990). PH yang baik untuk pertumbuhan sel adalah sekitar 7,4 (Paul 1972; Freshney 2005). Phenol red
dapat digunakan sebagai indikator pH dalam medium yaitu berwarna merah pada pH 7,4, orange pada pH 7,0, kuning pada pH 6,5, kuning lemon pada pH 6,5, pink pada pH 7,6, dan ungu pada pH 7,8 (Fresheny 2005). Pengaturan pH medium dapat dilakukan dengan sistem buffer karbondioksida-karbonat sehingga pada medium dilakukan penambahan NaHCO3 dan inkubasi pada CO2 (Malole 1990;
gluthathione, 2-mercaptoethanol atau dithiothreitol sebagai antioksidan ke dalam medium (Freshney 2005).
Suhu yang direkomendasikan untuk kultur sel hewan mamalia adalah 37oC atau disesuaikan dengan suhu tubuh sel hewan (Paul 1972; Pollard & Walker 1990; Freshney 2005). Medium untuk kultur sebaiknya dihindarkan dari pembentukan busa. Pembentukan busa pada medium dapat menyebabkan denaturasi protein dan meningkatkan resiko kontaminasi apabila busa medium mencapai bagian atas dari petri dish (Freshney 2005).
Istilah complete medium merupakan medium yang mengandung semua unsur pokok dan telah ditambahkan suplemen yang cukup sesuai standar yang ditetapkan seperti glutamin, serum, growth factors, danhormon (Freshney 2005). Serum mengandung growth factor yang meningkatkan proliferasi sel dan juga faktor adhesi dan aktivitas antitripsin yang mendukung perlekatan sel. Serum juga mengandung mineral, lipid, hormon. Calf serum (CS) dan fetal bovine serum (FBS) merupakan serum yang paling banyak digunakan akhir-akhir ini, terutama untuk cell line dan kloning (Freshney 2005). Antibiotik daoat ditambahkan pada medium kultur untuk mencegah kontaminasi.
Media untuk perkembangan sel mengandung nutrisi yang tinggi tidak hanya bagi sel hewan tetapi bakteri dan fungi. Kebanyakan mikroorganisme ini memiliki laju pertumbuhan yang lebih cepat dibandingkan sel kultur dan terkadang menghasilkan toksin yang dapat mematikan sel. Cara terbaik untuk mencegah kontaminasi pada media kultur adalah dengan menerapkan teknik aseptis (Paul 1972). Untuk mencegah kontaminasi maka peralatan untuk kultur, operator, ruangan kultur, dan bahan-bahan untuk kultur harus steril. Reagen liquid untuk kultur sel disterilisasi dengan teknik filtrasi untuk meyaring bakteri menggunakan membran filter berukuran 0,22 µm (Jakoby & Pastan 1979).
Kultur Sel Otak
Terkadang jumlah sel-sel glia lebih banyak dibandingkan sel saraf sehingga menyulitkan untuk menggambarkan sel-sel saraf dan mengukur aktivitas mereka terhadap sel-sel glia (Baum 2006). Kunci utama melakukan kultur sel saraf adalah melakukan kontrol yang ketat terhadap lingkungan sel saraf (Malin et al. 2007). Sel yang berasal dari embrionik dan neonatal membutuhkan faktor pertumbuhan terutama nerve growth factor (NGF) yang ditambahkan ke dalam media kultur standar untuk bertahan hidup. Sel yang berasal dari hewan dewasa dapat ditumbuhkan tanpa diberikan faktor pertumbuhan pada media kultur yang mengandung suplemen vitamin (Malin et al. 2007).
Medium kultur yang umum digunakan untuk menumbuhkan sel saraf adalah
Dulbecco’s Modified Eagle’s Medium (DMEM) yang ditambahkan serum 10%. Kultur sel saraf akan tumbuh dengan baik ketika hidup pada pH fisiologis yaitu sekitar 7,3 dan akan mati pada pH lebih dari 8,5. Untuk mendapatkan pertumbuhan yang lebih optimal, maka dibuat sistem buffer yang mirip dengan sistem buffer di dalam darah (karbondioksida-karbonat) dengan cara mengatur keseimbangan antara CO2 dari inkubator (5%) dengan ion bicarbonat (NaHCO3)
yang ditambahkan dari medium (Potter & DeMarse 2001).
Sel saraf biasanya menempel pada substrat, tetapi akson dapat bermigrasi keluar dari badan saraf (Paul 1972). Sel saraf dapat bertahan pada kultur sel sampai beberapa bulan (Paul 1972). Kultur in vitro sel saraf menghasilkan jaringan saraf yang menggambarkan prinsip dasar aktifitas otak yang dapat digunakan untuk menganalisis perkembangan elektrofisiologi dan kualitas hubungan antar sel saraf yang berasal dari sumber sel yang berbeda serta reaksi sel-sel tersebut terhadap reaksi farmakologi oleh senyawa aktif (Illes et al. 2009).
METODE PENELITIAN
Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Januari 2011 sampai dengan bulan Juli 2011 di Laboratorium Embriologi Departemen Anatomi, Fisiologi, dan Farmakologi Fakultas Kedokteran Hewan, Institut Pertanian Bogor.
Alat dan Bahan
Alat-alat yang digunakan antara lain peralatan bedah steril, cawan petri steril, pinset, spuit, tabung konikal, tabung mikro, gelas beaker, gelas ukur, mikropipet, tip, mikrofilter, clean bench, object glass, cover glass, hemositometer, mikroskop, inkubator, sentrifuge, dan timbangan digital.
Bahan yang digunakan antara lain otak besar tikus putih (Rattus norvegicus) umur tiga hari (newborn); gelatin 0,1%; larutan pencuci phosphate buffered saline
(PBS)yang ditambahkangentamisin 50 µg/mL dan newborn calf serum (NBCS) 0,1% (mPBS); medium kultur mDMEM yaitu DMEM (Dulbecco’s Modified
Eagle’s Medium) yang dimodifikasi dengan penambahan asam amino non-esensial (AANE) 10%, gentamisin 50 µg/mL, sodium bikarbonat 3,7 µg/mL,dan
newborn calf serum (NBCS) 10%; asiaticoside (AC) 30 µg/mL; ekstrak daun mahkota dewa (MD); tripsin 0,1%; dan pewarna Hematoksilin Eosin (HE).
Metode
Ekstrak Daun Mahkota Dewa
Ekstrak daun mahkota dewa yang dipakai pada penelitian ini merupakan ekstrak siap pakai yang berasal dari Laboratorium Pusat Studi Biofarmaka LPPM IPB, Bogor.Ekstrak ini dibuat dengan metode maserasi dengan pelarut etanol 30%.
Persiapan Kultur Sel Saraf
2 mL dan diinkubasi selama minimal satu jam ke dalam inkubator CO2 5% pada
suhu 37oC.
Isolasi dan Kultur Sel Saraf Otak Besar
Sel saraf diisolasi dari otak besar tikus (Rattus norvegicus) umur 3 hari.Otak besar dipotong kecil-kecil dan disuspensi menggunakan spuit 1 cc di dalam larutan mPBS. Suspensi otak besar disentrifugasi dengan kecepatan 210 g selama 10 menit, pencucian ini dilakukan dengan mPBS sebanyak empat kali dan mDMEM sebanyak satu kali. Sebelum dikultur, jumlah sel dihitung menggunakan hemositometer.Sel dengan konsentrasi 6,5x104 sel/mL dimasukkan ke dalam cawan petri yang berisi mDMEM dan perlakuan sebanyak 2 mL. Setiap kultur dilakukan duplo, terdiri dari cawan yang dilapisi dan tidak dilapisi cover glass. Cawan yang dilapisi cover glass digunakan untuk pewarnaan HE.Kultur diinkubasi di dalam inkubator CO2 5% pada suhu 37oC.Medium mDMEM dan
perlakuan diganti setiap 2 hari sekali sebanyak 2 mL setiap penggantian.Kultur dilakukan sampai hari keenam.
Evaluasi Hasil Kultur Sel Saraf
Tingkat Proliferasi Berdasarkan Population Doubling Time (PDT)
Tingkat proliferasi ditentukan dengan menghitung jumlah sel pada saat sebelum dikultur dan setelah kultur hari keenam. Sel hari keenam dibuang mediumnya lalu dicuci dengan PBS kemudian dimasukkan larutan tripsin 0,1% dalam PBS sebanyak 1 mL. Sel diinkubasi selama 5 menit sampai sel terlihat soliter dan diamati di bawah mikroskop. Pemipetan berulang dapat dilakukan untuk mempermudah disosiasi sel. Sel yang telah terdisosiasi disentrifugasi di dalam mPBS, selanjutnya sel dihitung total selnya menggunakan hemositometer Improved Neubauer.
Total sel (sel/mL) = jumlah sel pada 5 kotak x faktor pengenceran x 104
Population Doubling Time (PDT) dihitung menggunakan rumus: 1
Diferensial Sel untuk Menentukan Sel Glia dan Sel Saraf
Jumlah sel dihitung dengan metode pewarnaan HE.Kultur sel yang ditumbuhkan di atas cover glass dicuci dengan PBS kemudian difiksasi dalam larutan buffer paraformaldehid 4% selama 24 jam.Kultur yang telah difiksasi disimpan dalam alkohol 70% sampai dilakukan pewarnaan HE. Pewarnaan dimulai dengan merendam hasil kultur ke dalam alkohol 50% selama 3 menit. Setelah itu direndam dalam aquades selama 5 menit, hematoksilin 10 menit, dan dibilas dengan aquades selama 5 menit. Selanjutnya dilakukan perendaman dalam eosin selama 5 menit, dibilas dengan aquades selama 5 menit, dan dilakukan dehidrasi bertingkat menggunakan alkohol 70%, 80%, 90%, 96%, 100% (absolut) tiga kali, masing-masing selama 10 menit dan dilanjutkan dalam xylol dua kali ulangan masing-masing selama 10 menit, kemudian cover glass ditempelkan di atas object glass menggunakan entelan dan diamati dibawah mikroskop dengan perbesaran 10x10 untuk dihitung jumlah sel-sel saraf dan sel-sel glia.
Pertumbuhan Panjang Akson dan Dendrit
Panjang akson dan dendrit diukur dengan cara mengamati kultur hari keenam. Kultur tersebut difoto sebanyak 4 lapang pandang secara acak dengan mikroskop perbesaran 10x10.Akson dan dendrit pada foto tersebut diukur menggunakan software ImageJ.
Rancangan Percobaan
Analisis Data
HASIL DAN PEMBAHASAN
Tingkat Proliferasi Berdasarkan Population Doubling Time (PDT)
Population Doubling Time (PDT) adalah waktu yang diperlukan oleh populasi sel untuk menjadikan jumlahnya dua kali dari jumlah semula. Hasil PDT kultur sel saraf yang diberi perlakuan ekstrak daun mahkota dewa dibandingkan dengan kontrol disajikan pada Tabel 1.
Tabel 1 Tingkat PDT sel saraf yang tumbuh dalam medium yang diberi ekstrak daun mahkota dewa
Kontrol positif
Kontrol negatif
Konsentrasi MD (ekstrak daun mahkota dewa)
100 ppm 200 ppm 400 ppm
3,28 ± 0,26a 3,78 ± 0,51ab 3,93 ± 0,49ab 4,33 ± 0,28b 6,63 ± 1,27c Ket: Huruf superscript yang berbeda pada baris yang sama menunjukkan adanya perbedaan nyata
(P<0,05). Kontrol positif (mDMEM+asiaticoside (AC) 30 µg/ml); kontrol negatif (mDMEM); MD 100 ppm (mDMEM+MD 100 ppm); MD 200 ppm (mDMEM+MD 200 ppm); MD 400 ppm (mDMEM+MD 400 ppm).
Menurut Martin (1994), sel saraf memiliki PDT sekitar 3-4 hari. Proliferasi sel yang cepat ditunjukkan dari PDT yang rendah. Nilai PDT pada MD 400 ppm secara nyata lebih besar dibandingkan kontrol positif dan negatif yaitu 6,63 ± 1,27 (P<0,05), sedangkan MD 100 ppm dan 200 ppm tidak berbeda nyata tetapi tetap lebih besar daripada kontrol positif dan negatif. Berdasarkan hasil tersebut, pemberian ekstrak daun mahkota dewa dapat menyebabkan proliferasi sel yang lebih lambat. Semakin tinggi konsentrasi ekstrak daun mahkota dewa yang diberikan, efek antiproliferasinya semakin besar.
proliferasi sel-sel hati normal. Berdasarkan penelitian Tjandrawinata et al. (2010) mahkota dewa memiliki efek antiinflamasi, antiangiogenesis, antiproliferasi, dan proapoptosis pada kultur sel kanker payudara.
A
akson
badan sel
dendrit
B
akson
badan sel
[image:31.595.104.512.99.828.2]dendrit
Gambar 4 Sel saraf bipolar pada kontrol negatif (A) dan sel saraf bipolar pada MD 400 ppm yang selnya mengalami degenerasi (B). Bar: 10µm.
Bentuk degenerasi sel saraf dapat dilihat pada kultur sel saraf MD 400 ppm. Gambar 4 memperlihatkan perbandingan bentuk sel saraf pada kontrol negatif dan MD 400 ppm secara natif. Sel saraf pada kontrol negatif terlihat utuh sedangkan sel saraf pada MD 400 ppm mengalami degenerasi. Menurut Shearer dan Fawcett (2001), terjadinya kerusakan pada sel saraf dapat mengakibatkan terjadinya degenerasi akson.
Dardanela (2005) telah melakukan penelitian mengenai toksisitas dari ekstrak buah mahkota dewa terhadap larva udang Artemia salina Leach, dari hasil penelitian tersebut nilai toksisitas LC50 mahkota dewa adalah sebesar 541,76 ppm.
Komposisi Jumlah Sel Glia dan Sel Saraf
Sel glia merupakan sel-sel yang menjaga, memelihara, dan mendukung sel saraf. Terdapat empat macam sel glia di sistem saraf pusat yaitu astrosit, oligodendrosit, mikroglia, dan sel ependimal. Astrosit berfungsi memberikan nutrisi pada sel saraf serta memperbaiki dan mencegah jaringan saraf dari kerusakan. Oligodendrosit merupakan sel glia yang melapisi akson dengan
[image:31.595.110.499.169.369.2]myelin. Mikroglia melindungi sistem saraf pusat dengan mekanisme fagosit. Sel ependimal merupakan sel epitel yang melapisi dinding ventrikel, membentuk, memonitor, dan membantu sirkulasi cairan cerebrospinal (Kuntarti 2007). Menurut Shearer dan Fawcett (2001), terjadinya toksisitas pada sistem saraf secara in vivo dapat menyebabkan infiltrasi sel glia. Sel glia pertama yang berespon adalah astrosit, kemudian mikroglia, dan disusul oleh oligodendrosit.
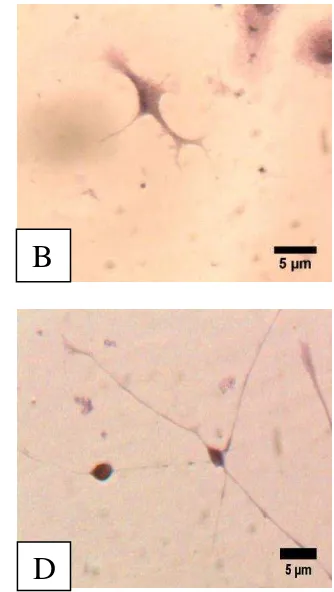
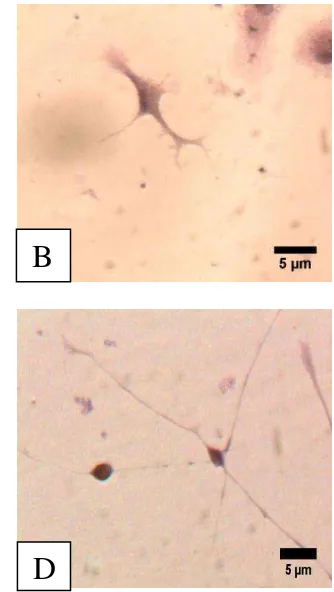
Sel glia yang ditemukan pada kultur sel saraf adalah astrosit, oligodendrosit, dan mikroglia. Bentuk ketiga sel ini mirip dengan sel saraf. Morfologi sel glia dan sel saraf dapat disajikan pada Gambar 5. Sel ependimal tidak terlihat pada kultur sel saraf karena sel ependimal melapisi dinding ventrikel.
Gambar 5 Sel glia astrosit (A), oligodendrosit (B), mikroglia (C), dan sel saraf multipolar (D). Pewarnaan HE. Bar: 5µm.
Perbandingan sel saraf dengan sel glia pada kondisi in vivo adalah 1:10 (Junqueria & Carnerio 2005). Persentase sel saraf dan sel glia pada masing-masing perlakuan pada penelitian ini dapat dilihat pada Tabel 2.
A
B
[image:32.595.339.506.312.608.2]Tabel 2 Persentase sel saraf dan sel glia pada masing-masing perlakuan (%) Jenis sel Kontrol positif Kontrol negatif Konsentrasi MD
100 ppm 200 ppm 400 ppm
Sel saraf 69,03 ± 3,47c 47,19 ± 9,94b 52,46 ± 5,23b 46,75 ± 4,49b 27,33 ± 4,93a Sel glia 30,97 ± 3,47a 52,81 ± 9,94b 47,54 ± 5,23b 53,25 ± 4,49b 72,67 ± 4,93c Ket: Huruf superscript yang berbeda pada baris yang sama menunjukkan adanya perbedaan nyata
(P<0,05).
Persentase sel saraf dan sel glia pada kontrol negatif adalah 41,50% dan 58,50%. Hasil ini hampir sama dengan penelitian Riyacumala (2010) yang memberikan hasil persentase sel saraf dengan sel glia pada medium DMEM yang ditambahkan serum 10% adalah 48,50% dan 51,50%. Sel glia memiliki jumlah yang lebih banyak karena digunakan untuk membantu pertumbuhan sel saraf. Pada penelitian ini, persentase sel glia tertinggi adalah pada MD 400 ppm sebanyak 76,00%.
Berdasarkan penelitian Dardanela (2005) ekstrak kasar buah mahkota dewa pada konsentrasi 100 ppm, 200 ppm, dan 300 ppm dapat menghambat enzim tirosin kinase. Penghambatan terbesar adalah pada konsentrasi 300 ppm yaitu sebanyak 72,11%. Enzim tirosin kinase adalah enzim yang berperan penting dalam mengatur pertumbuhan dan diferensiasi sel. Aktivitas tirosin kinase sebagai reseptor pertumbuhan sangat penting bagi proliferasi sel (Salim 2006). Jika enzim ini dihambat, pertumbuhan sel menjadi terhambat sehingga proliferasi sel juga terhambat.
Pertumbuhan Panjang Akson dan Dendrit
Akson dan dendrit merupakan penjuluran sel saraf yang berfungsi untuk menghantarkan impuls. Panjang akson dan dendrit pada penelitian ini disajikan pada Tabel 3.
Tabel 3 Panjang akson dan dendrit pada masing-masing perlakuan (µm) Kontrol
positif
Kontrol
negatif
Konsentrasi MD
100 ppm 200 ppm 400 ppm
Akson 21,50 ± 3,37ab 18,11 ± 2,25a 16,09 ± 5,29a 32,79 ± 8,19c 28,55 ± 3,60bc Dendrit 9,27 ± 3,60a 10,28 ± 2,19a 7,89 ± 2,03a 13,07 ± 0,96a 23,25 ± 4,31b Ket: Huruf superscript yang berbeda pada baris yang sama menunjukkan adanya perbedaan nyata
(P<0,05).
Sel-sel saraf yang memiliki ukuran akson paling panjang secara nyata adalah pada perlakuan MD 200 ppm yaitu 32,79 ± 8,19 µm, sedangkan dendrit pada perlakuan MD 400 ppm yaitu 23,25 ± 4,31 µm. Semakin panjang dan banyak jumlah dendrit maka semakin besar kemungkinan untuk terjadinya sinaps dengan sel saraf yang lain. Dengan semakin banyaknya sinaps, maka kemampuan otak untuk menampung informasi menjadi lebih besar (Affari 2011).
Sel saraf berkembang dari progenitor saraf atau neuroblast yang memiliki kemampuan membelah dan melakukan diferensiasi menjadi sel-sel saraf (Kim et al. 2008). Neuroblast memiliki penjuluran yang nantinya akan berkembang menjadi akson dan dendrit (Kalverbour et al. 1999). Pada penelitian Riyacumala (2010) panjang akson dan dendrit dari sel-sel saraf yang ditumbuhkan pada medium dasar (mDMEM) selama sebelas hari berkisar 167,7 µm dan 102,5 µm. Pada penelitian ini, kultur dilakukan selama enam hari. Panjang akson dan dendrit yang didapat lebih pendek dibandingkan dengan hasil penelitian Riyacumala (2010) yaitu berkisar 18,11 µm dan 10,28 µm. Hal ini disebabkan karena penjuluran sel-sel saraf masih berkembang sehingga panjang penjuluran sel-sel saraf ini pada hari kesebelas akan lebih panjang dibandingkan hari keenam.
SIMPULAN DAN SARAN
Simpulan
Ekstrak daun mahkota dewa memiliki efek antiproliferasi terhadap sel-sel otak besar secara nyata pada konsentrasi 400 ppm, tetapi ekstrak daun mahkota dewa dapat meningkatkan pertumbuhan akson pada konsentrasi 200 ppm dan dendrit pada konsentrasi 400 ppm.
Saran
DAFTAR PUSTAKA
Affari L. 2011. Otak tambah pintar dengan bersepeda. http://b2w-indonesia.or.id/bacanote/otak_tambah_pintar_dgn_bersepeda_tinjauan_scie nties [10 Oktober 2011].
Allen JS, Tranel D, Bruss J, Damasio H. 2006. Correlations between regional brain volumes and memory performance in anoxia. Journal of Clinical and Experimental Neuropsychology 28:457–476.
Anonim. 2011. Jerawat hilang karena mahkota
dewa???.http://lilymoo.wordpress.com/2011/03/28/jerawat-hilang-karena-mahkotadewa/ [21 April 2011].
Aspinall V, O’Reilly M. 2004. Introduction to Veterinary Anatomy and Physiology. China: Elsevier.
Bailey R. 2011. Hippocampus.http://biology.about.com/od/anatomy /p/hippocampus.htm [20 Juli 2011].
Baum M. 2006. Neuronal cell cultures kept on the straight and narrow. http://www.nist.gov/mml/cell_052506.cfm [1Februari 2011].
[BMC] Biologi Media Centre. 2010. Foto-Foto mikroskop elektron (1) : Sel dan jaringan makhluk hidup. http://biologi mediacentre.com/foto-foto-mikroskop-elektron-1-sel-dan-jaringan-makhluk -hidup-4/ [30 Juni 2011]. Butler M. 2004. Animal Cell Culture & Technology. Cornwall UK: Bios Scientific
Publishers.
Colville T, Bassert JM. 2002. Clinical Anatomy & Physiology for Veterinary Technicians. United States of America: Mosby Inc.
Dardanela D. 2005. Penapisan beberapa tanaman asli Indonesia yang berpotensi sebagai antikanker secara enzimatis [Skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam Institut Pertanian Bogor.
Denikrisna. 2011. Obat pada sistem syaraf parasimpatik.
http://denikrisna.wordpress.com/2011/01/05/obat-pada-sistem-syaraf-parasi mpatik/ [20 Juli 2011].
Freshney RI. 2005. Culture of Animal Cells, a Manual of Basic Technique5th Ed. Hoboken NJ: John Wiley & Sons.
Freshney RI. 2006. Culture of Cells for Tissue Engineering. New York: John Wiley & Sons Inc.
putih jantan yang diinduksi potassium oxonate [Skripsi]. Surakarta: Fakultas Farmasi Universitas Muhammadiyah Surakarta.
Illes S, Theiss S, Hartung HP, Siebler M, Dihné M. 2009. Niche-dependent development of functional neuronal networks from embryonic stem cell-derived neural populations. Biology Media Centre Neuroscience 10:93. Jackson JS, Golding JP, Chapon C, Jones WA, Bhakoo KK. 2010. Homing of
stem cells to sites of inflammatory brain injury after intracerebral and intravenous administration: a longitudinal imaging study. Stem Cell Research and Therapy 1:17.
Jakoby WB, Pastan IH, editor. 1979. Cell Culture. USA: Academic Press Inc. Janis KL et al. β008. Effects of sildenafil on nigrostriatal dopamine neurons in a
murine model of parkinson’s disease. Journal of Alzheimer’s Disease
15:97–107.
Junqueria LC, Carneiro J. 2005. Basic Histology 11th Ed. USA: The McGraw-Hill Companies Inc.
Kalverbour AF, Genta ML, Hopkins JB. 1999. Current Issues in Developmental Psychology. Netherlands: Kluwer Academic Publishers.
Kim SJ, Son TG, Park HR, Park M, Kim MS, Kim HS, Chung HY, Mattson MP, Lee J. 2008. Curcumin stimulates poliferation of embryonic neural progenitor cells and neurogenesis in the adult hippocampus. The Journal of Biologal Chemistry 21: 14497-14505.
Kintoko, Pihie AHL. 2007. Efek antiproliferasi ekstrak kloroform dari Phaleria macrocarpa (Scheff.) Boerl. pada titisan sel kanker manusia. Jurnal Ilmiah Farmasi 4:1-9.
Kuntarti. 2007. Anatomi sistem saraf. http://staff.ui.
ac.id/internal/1308050290/material/anatomisaraf.pdf [1 Februari 2011]. Maezawa I et al. 2006. Apolipoprotein E isoform-dependent dendritic recovery of
hippocampal neurons following activation of innate immunity. Journal of Neuroinflammation 3:21.
Malin SA, Davis BM, Molliver DC. 2007. Production of dissociated sensory neuron cultures and considerations for their use in studying neuronal function and plasticity.Nature Protocols 9:152.
Malole MBM. 1990. Kultur Sel dan Jaringan Hewan. Bogor: Departemen Pendidikan dan Kebudayaan, Direktorat Jenderal Pendidikan Tinggi Pusat Antaruniversitas Bioteknologi, Institut Pertanian Bogor.
Mook-Jung Iet al. 1999.Protective effects of asiaticoside derivatives against beta-amyloid neurotoxicity.Journal Neuroscience Research 58(3):417-25.
Mori H et al. 2001. Cell proliferation in cancer prevention: effects of preventive agents on estrogen-related endometrial carcinogenesis model and on an in vitro model in human colorectal cells. Mutation Research 480-481:201-201.
Musalmah M, Then SM, Mat TG, Wan NWZ. β006. Comparative effects of α
-tocopherol and -tocotrienol against hydrogen peroxide induced apoptosis on primary-cultured astrocytes. Journal Neurology Science243:5-12.
Pawiroharsono S. 2001. Prospek dan manfaat isoflavon untuk kesehatan. http://www.tempo.co.id/medika/arsip/042001/pus-2.htm [17 April 2011]. Paul J. 1972. Cell and Tissue Culture4th Ed. London: E. & S. Livingstone Ltd. Pollard JW, Walker JM. 1990. Animal Cell Culture. USA: The Humana Press Inc. Pombinho AR, Laizé V, Molha DM, Marques SM, Cancela ML. 2004. Development of two bone-derrived cell lines from the marine teleost Sparus aurata evidence for extracellular matrix mineralization and cell-type-specific expression of matrix Gla protein and osteocalcin. Cell Tissue Research 315(3): (393-406). Dalam Riyacumala V. 2010. Kultur in vitro
sel-sel otak besar (cerebrum) anak tikus [Skripsi]. Bogor: Fakultas Kedokteran Hewan Institut Pertanian Bogor.
Potter SM, DeMarse TB. 2001. A new approach to neural cell culture for long-term studies. Journal of Neuroscience Methods 110:17–24.
Ribchester R. 1986. Molecule, Nerve and Embryo. Glasgow: Blackie & Son Ltd. Riyacumala V. 2010. Kultur in vitro sel-sel otak besar (cerebrum) anak tikus
[Skripsi]. Bogor: Fakultas Kedokteran Hewan Institut Pertanian Bogor. Salim. 2006. Penentuan daya inhibisi ekstrak air dan etanol daging buah mahkota
dewa (Phaleria macrocarpa (Scheff.) Boerl) terhadap aktivitas enzim tirosin kinase secara in vitro [Skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam Institut Pertanian Bogor.
Shearer MC, Fawcett JW. 2001. The astrocyte/meningeal cell interface – a barrier to successful nerve regeneration?. Cell Tissue Research 305:267–273. Sriwulan W. 2005. Sel Saraf.
http://blog-biologiku.blogspot.com/2009/09/sistem-saraf-manusia_05.html [17 Agustus 2011].
Sumastuti R. 2002b. Efek sitotoksik ekstrak buah dan daun mahkotadewa [Phaleria macrocarpa (scheff) boerl.] terhadap sel hela.http://www.tempo.co.id/medika/arsip/122002/art-3.htm [27Juli 2011]. Taepavarapruk P, Song C. 2010. Reductions of acetylcholine release and nerve
growth factor expression are correlated with memory impairment induced by interleukin-1 administrations: effects of omega-3 fatty acid EPA treatment. Journal Neurochemical 112:1054-1064.
Tjandrawinata RR, Arifin PF, Tandrasasmita OM, Rahmi D, Aripin A. 2010. DLBS1425, a Phaleria macrocarpa (Scheff.) Boerl. extract confers anti proliferative and proapoptosis effects via eicosanoid pathway. Journal of Experimental Therapeutics and Oncology 8:187–201.
Voigt P et al. 1996. Neural and glial-mediated effects of growth factors acting via tyrosine kinase receptors on luteinizing hormone-releasing hormone neurons. Endocrinology 137(6):2593-605.
Wijayakusuma H. 2005. Atasi Kanker dengan Tanaman Obat. Cet. 1. Jakarta: Puspa Swara.
Winarto WP. 2009. Mahkota Dewa: Budi Daya dan Pemanfaatan untuk Obat.
Cet. 7. Jakarta: Penebar Swadaya.
Woehrling EK, Hill EJ, Coleman ED. 2010. Evaluation of the importance of astrocytes when screening for acute toxicity in neuronal cell systems.
Lampiran 1 Hasil analisis ANOVA dan Duncan PDT
ONEWAY PDT BY perlakuan /STATISTICS DESCRIPTIVES /MISSING ANALYSIS
/POSTHOC=DUNCAN ALPHA(0.05).
Oneway
[DataSet0]
Descriptives
PDT
N Mean
Std.
Deviation Std. Error
95% Confidence Interval
for Mean
Minimum Maximum Lower
Bound Upper Bound
1 3 3.7800 .51029 .29462 2.5124 5.0476 3.40 4.36
2 3 3.2767 .26274 .15169 2.6240 3.9294 3.12 3.58
3 3 3.9333 .48881 .28221 2.7191 5.1476 3.40 4.36
4 3 4.3333 .28095 .16221 3.6354 5.0313 4.04 4.60
5 3 6.6333 .54930 .31714 5.2688 7.9979 6.02 7.08
Total 15 4.3913 1.26677 .32708 3.6898 5.0928 3.12 7.08
ANOVA
PDT
Sum of Squares Df Mean Square F Sig.
Between Groups 20.568 4 5.142 27.090 .000
Within Groups 1.898 10 .190
Total 22.466 14
Homogeneous Subsets
PDT
Duncan
perlaku
an N
Subset for alpha = 0.05
1 2 3
2 3 3.2767
1 3 3.7800 3.7800
3 3 3.9333 3.9333
4 3 4.3333
5 3 6.6333
Sig. .108 .168 1.000
PDT
Duncan
perlaku
an N
Subset for alpha = 0.05
1 2 3
2 3 3.2767
1 3 3.7800 3.7800
3 3 3.9333 3.9333
4 3 4.3333
5 3 6.6333
Lampiran 2 Hasil analisis ANOVA dan Duncan komposisi sel saraf dan sel glia
ONEWAY saraf glia BY komposisi /STATISTICS DESCRIPTIVES /MISSING ANALYSIS /POSTHOC=DUNCAN ALPHA(0.05). Oneway [DataSet0] Descriptives
N Mean
Std.
Deviation Std. Error
95% Confidence
Interval for Mean
Minimum Maximum Lower
Bound
Upper
Bound
saraf 1 3 47.1900 9.94210 5.74007 22.4925 71.8875 41.40 58.67
2 3 69.0300 3.46743 2.00192 60.4164 77.6436 65.28 72.12
3 3 52.4600 5.23267 3.02108 39.4613 65.4587 49.30 58.50
4 3 46.7533 4.49436 2.59482 35.5887 57.9179 41.67 50.20
5 3 27.3333 4.93288 2.84800 15.0794 39.5873 24.00 33.00
T
ot
al
15 48.5533 14.72460 3.80187 40.3991 56.7075 24.00 72.12
glia 1 3 52.8100 9.94210 5.74007 28.1125 77.5075 41.33 58.60
2 3 30.9700 3.46743 2.00192 22.3564 39.5836 27.88 34.72
3 3 47.5400 5.23267 3.02108 34.5413 60.5387 41.50 50.70
4 3 53.2467 4.49436 2.59482 42.0821 64.4113 49.80 58.33
5 3 72.6667 4.93288 2.84800 60.4127 84.9206 67.00 76.00
T
ot
al
15 51.4467 14.72460 3.80187 43.2925 59.6009 27.88 76.00
Sum of Squares Df Mean Square F Sig.
saraf Between Groups 2669.829 4 667.457 18.258 .000
Within Groups 365.564 10 36.556
Total 3035.393 14
glia Between Groups 2669.829 4 667.457 18.258 .000
Within Groups 365.564 10 36.556
Total 3035.393 14
Post Hoc Tests
Homogeneous Subsets
Saraf
Duncan
kompos
isi N
Subset for alpha = 0.05
1 2 3
5 3 27.3333
4 3 46.7533
1 3 47.1900
3 3 52.4600
2 3 69.0300
Sig. 1.000 .296 1.000
Means for groups in homogeneous subsets are displayed.
Glia
Duncan
kompos
isi N
Subset for alpha = 0.05
1 2 3
2 3 30.9700
3 3 47.5400
1 3 52.8100
4 3 53.2467
5 3 72.6667
Sig. 1.000 .296 1.000
Lampiran 3 Hasil analisis ANOVA dan Duncan panjang akson dan dendrit
ONEWAY akson dendrit BY Perlakuan /STATISTICS DESCRIPTIVES
/MISSING ANALYSIS
/POSTHOC=DUNCAN ALPHA(0.05).
Oneway
[DataSet0]
Descriptives
N Mean
Std.
Deviation Std. Error
95% Confidence
Interval for Mean
Minimum Maximum Lower
Bound
Upper
Bound
akson 1 3 18.1130 2.24539 1.29638 12.5351 23.6909 16.67 20.70
2 3 21.4963 3.36567 1.94317 13.1356 29.8571 18.22 24.95
3 3 16.0923 5.29380 3.05638 2.9418 29.2429 11.73 21.98
4 2 32.7905 8.18759 5.78950 -40.7721 106.3531 27.00 38.58
5 2 28.5500 3.60624 2.55000 -3.8508 60.9508 26.00 31.10
Total 13 22.2912 7.28692 2.02103 17.8878 26.6947 11.73 38.58
dendrit 1 3 10.2757 2.19615 1.26795 4.8201 15.7312 7.95 12.31
2 3 9.2697 3.60111 2.07910 .3240 18.2153 6.11 13.19
3 3 7.8930 2.03201 1.17318 2.8452 12.9408 6.02 10.06
4 2 13.0685 .96379 .68150 4.4092 21.7278 12.39 13.75
5 2 23.2500 4.31335 3.05000 -15.5039 62.0039 20.20 26.30
ANOVA
Sum of Squares df Mean Square F Sig.
akson Between Groups 468.361 4 117.090 5.548 .019
Within Groups 168.829 8 21.104
Total 637.190 12
dendrit Between Groups 337.210 4 84.303 10.642 .003
Within Groups 63.374 8 7.922
Total 400.584 12
Post Hoc Tests
Homogeneous Subsets
Akson
Duncan
Perlaku
an N
Subset for alpha = 0.05
1 2 3
3 3 16.0923
1 3 18.1130
2 3 21.4963 21.4963
5 2 28.5500 28.5500
4 2 32.7905
Sig. .243 .124 .332
Dendrit
Duncan
Perlaku
an N
Subset for alpha = 0.05
1 2
3 3 7.8930
2 3 9.2697
1 3 10.2757
4 2 13.0685
5 2 23.2500
Sig. .090 1.000
Means for groups in homogeneous subsets are
EFEK PEMBERIAN EKSTRAK DAUN MAHKOTA DEWA
(
Phaleria macrocarpa
) TERHADAP PERTUMBUHAN SEL-SEL
OTAK BESAR ANAK TIKUS SECARA
IN VITRO
ANI MURTISARI
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
ABSTRACT
ANI MURTISARI. The Effect of “Mahkota Dewa” Leaf Extracts (Phaleria macrocarpa) on the Newborne Rat Cerebrum Cells In Vitro Growth. Under direction of ITA DJUWITA and MIN RAHMINIWATI.
Research has been conducted on in vitro culture of three days old rat (Sprague Dawley) cerebrum cells in DMEM (Dulbecco’s Modified Eagle’s Medium) containing 10% NBCS (Newborne Calf Serum) and 50 µg/mL gentamycin (mDMEM), with and without mahkota dewa leaf extracts (MD). There are five groups of treatment consisted of positive control (mDMEM+30 µg/mL asiaticoside (AC)), negative control (mDMEM), concentration 1 (mDMEM+100 ppm MD), concentration 2 (mDMEM+200 ppm MD), and concentration 3 (mDMEM+400 ppm MD). Culture was done in 5% CO2 incubator
at 37oC for six days. The parameters observed were Population Doubling Time (PDT), neuron and glia composition, and the length of axon and dendrite, were done based on calculation using hemocytometer, Hematoxylin Eosin (HE) staining, and measured using micrometer, respectively. Data were analyzed using ANOVA and Duncan. The results showed that mahkota dewa leaf extracts concentration 400 ppm inhibited the neuronal cells proliferation (P<0,05). However, at concentration 200 ppm and 400 ppm increased the axon and dendrite length growth, respectively.
RINGKASAN
ANI MURTISARI. Efek Pemberian Ekstrak Daun Mahkota Dewa(Phaleria macrocarpa) terhadap Pertumbuhan Sel-Sel Otak BesarAnak Tikus secara In Vitro. Dibimbing oleh ITA DJUWITA dan MIN RAHMINIWATI.
Mahkota dewa merupakan salah satu tanaman obat yang dapat mengatasi kanker, kencing manis, hepatitis, asam urat, radang kulit, dan ekzema. Bagian mahkota dewa yang sering digunakan adalah buah dan daunnya. Berdasarkan penelitian, ekstrak daun mahkota dewa bersifat antiproliferatif terhadap sel hati normal.
Otak besar merupakan bagian dari otak yang berperan dalam penyimpanan memori. Efek ekstrak daun mahkota dewa terhadap otak besar belum diketahui sehingga dilakukan penelitian untuk mengevaluasi efek ekstrak daun mahkota dewa terhadap pertumbuhan sel-sel otak besar.
Penelitian ini dilakukan secara in vitro menggunakan sel-sel otak besar anak tikus (Sprague Dawley) umur tiga hari dalam medium dasar DMEM (Dulbecco’s Modified Eagle’s Medium) yang mengandung NBCS (Newborne Calf Serum) 10% dan gentamisin 50 µg/ml (mDMEM) dengan dan tanpa penambahan ekstrak daun mahkota dewa (MD). Terdapat lima kelompok perlakuan yang terdiri dari kontrol positif (mDMEM+asiaticoside (AC) 30µg/ml), kontrol negatif (mDMEM), konsentrasi 1 (mDMEM+MD 100 ppm), konsentrasi 2 (mDMEM+MD 200 ppm), dan konsentrasi 3 (mDMEM+MD 400 ppm). Kultur dilakukan dalam inkubator CO2 5% dan suhu 37oC selama enam hari. Parameter
yang diamati adalah Population Doubling Time (PDT), komposisi sel saraf dan sel glia, serta panjang akson dan dendrit masing-masing berdasarkan penghitungan menggunakan hemositometer, pewarnaan HE, dan pengukuran sel saraf menggunakan mikrometer. Data dianalisis menggunakan uji statistik ANOVA dan Duncan.
Hasil penelitian menunjukkan nilai PDT pada medium yang ditambahkan ekstrak daun mahkota dewa 100 ppm, 200 ppm, dan 400 ppm berturut-turut adalah 3,93 ± 0,49hari, 4,33 ± 0,28hari, dan 6,63 ± 1,27 hari, sedangkan nilai PDT pada kontrol positif dan negatif adalah 3,28 ± 0,26hari dan 3,78 ± 0,51hari. Pemberian ekstrak daun mahkota dewa pada medium kultur sel saraf memiliki nilai PDT lebih tinggi dibandingkan kontrol positif dan negatif. Hal ini menunjukkan bahwa pemberian ekstrak daun mahkota dewa pada medium kultur sel saraf dapat menghambat proliferasi sel saraf. Medium yang ditambahkan ekstrak daun mahkota dewa konsentrasi 200 ppm memiliki akson paling panjang yaitu 32,79 ± 8,19 µm, sedangkan dendrit paling panjang pada konsentrasi 400 ppm yaitu 23,25 ± 4,31µm. Dari hasil penelitian ini dapat disimpulkan bahwa ekstrak daun mahkota dewa dapat menghambat proliferasi sel saraf, namun mampu meningkatkan pertumbuhan akson pada konsentrasi 200 ppm dan dendrit pada konsentrasi 400 ppm.
EFEK PEMBERIAN EKSTRAK DAUN MAHKOTA DEWA
(
Phaleria macrocarpa
) TERHADAP PERTUMBUHAN SEL-SEL
OTAK BESAR ANAK TIKUS SECARA
IN VITRO
ANI MURTISARI
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan pada
Fakultas Kedokteran Hewan
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI
DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa skripsi Efek Pemberian Ekstrak Daun Mahkota Dewa(Phaleria macrocarpa) terhadap Pertumbuhan Sel-Sel Otak BesarAnak Tikus secara In Vitro adalah karya saya dengan arahan dari dosen pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, Oktober 2011
Ani Murtisari
© Hak Cipta milik IPB, tahun 2011
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah, dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
Judul : Efek Pemberian Ekstrak Daun Mahkota Dewa (Phaleria macrocarpa) terhadap Pertumbuhan Sel-Sel Otak Besar Anak Tikus secara In Vitro
Nama : Ani Murtisari NIM : B04070129
Disetujui
Dr. Drh. Hj. Ita Djuwita, M.Phil Pembimbing I
Drh. Min Rahminiwati, MS, Ph.D Pembimbing II
Diketahui,
Dr. Nastiti Kusumorini
Wakil Dekan Fakultas Kedokteran Hewan Institut Pertanian Bogor
RIWAYAT HIDUP
Penulis dilahirkan di Boyolali pada tanggal 6Juli 1989.Penulis adalah anak ketiga dari tiga bersaudara dari keluarga Bapak Sugiarto dan Ibu Nanik Ismawarti. Penulis memulai pendidikan taman kanak-kanak di TK Siwi Peni II pada tahun 1994.Pada tahun 1995, penulis memulai pendidikan sekolah dasar di SD Kiringan II.Tahun 2001 penulis melanjutkan sekolah di SMPN 1Boyolali sampai tahun 2004. Penulis melanjutkan SMA di SMAN 1 Boyolali dan lulus pada tahun 2007.
PRAKATA
Puji syukur kehadirat Allah SWT yang telah melimpahkan rahmat dan hidayahnya sehingga penulis dapat menyelesaikan penelitian dan penulisan skripsi
yang berjudul “Efek Pemberian Ekstrak Daun Mahkota Dewa (Phaleria macrocarpa) terhadap Pertumbuhan Sel-Sel Otak Besar Anak Tikus secara In Vitro”.
Penulis menyadari bahwa dalam penyusunan skiripsi ini tidak dapat diselesaikan dengan baik tanpa bantuan dan bimbingan dari berbagai pihak. Oleh karena itu, penulis mengucapkan terima kasih kepada:
Dr. Drh. Hj. Ita Djuwita, M.Phil dan Drh. Min Rahminiwati, MS, Ph.D
selaku dosen pembimbing yang telah memberikan pengarahan, bimbingan, dan pendampingan sejak persiapan penyusunan usulan penelitian, pelaksanaan penelitian, sampai penulisan skripsi ini selesai.
Dr. Drh. Susi Soviana, M.Si selaku dosen pembimbing akademik atas
semua bimbingan dan arahannya.
Seluruh dosen dan staf Laboratorium Embriologi FKH IPB yang telah memberikan bantuan ilmunya dalam pelaksanaan penelitian.
Laboratorium Pusat Studi Biofarmaka LPPM IPB Bogor yang telah
menyediakan ekstrak daun mahkota dewa.
Keluarga tercinta (Ayah, Ibu, dan keluarga besar) yang selalu memberikan dukungan dan doa yang tiada hentinya.
Teman-teman sepenelitian (Yunita dan Irma) atas kerjasama, semangat,
dan suka duka selama melaksanakan penelitian.
Kak Devi, Kak Yeni, Disa, Bu Eka, Pak Wahyudin, atas bantuan selama
pelaksanaan penelitian.
Bakhtiar Hidayat Harahap, S.KH atas semangat dan doa yang selalu diberikan.
Teman-teman di Chevana C2 (Archi, Chaca, Eka, Vully, Ningrum) atas
kebersamaan dan dukungannya.
Kepada semua pihak yang tidak dapat penulis sebutkan satu per satu yang
telah membantu dalam penelitian dan penulisan skripsi ini.
Penulis menyadari masih banyak kekurangan dalam penulisan skripsi ini. Penulis sangat mengharapkan kritik dan saran untuk melengkapi skripsi ini. Semoga tulisan ini bermanfaat bagi penulis, pembaca, dan semua pihak yang berkepentingan.
Bogor, Oktober 2011
DAFTAR ISI
Halaman
DAFTAR TABEL ... i DAFTAR GAMBAR ... ii DAFTAR LAMPIRAN ... iii PENDAHULUAN
Latar Belakang ... 1 Tujuan ... 3 Manfaat ... 3 TINJAUAN PUSTAKA
Mahkota Dewa ... 4 Otak Besar (Cerebrum) ... 6 Sel Saraf ... 7 Kultur In Vitro ... 9 Kultur Sel Otak ... 10
METODE PENELITIAN
Waktu dan Tempat ... 12 Alat dan Bahan ... 12 Metode ... 12 Ekstrak Daun Mahkota Dewa ... 12 Persiapan KulturSel Saraf ... 12 Isolasi dan Kultur Sel Saraf Otak Besar ... 13 Evaluasi Hasil Kultur Sel Saraf... 13 Tingkat Proliferasi BerdasarkanPDT ... 13
Diferensial Sel untuk Menentukan Sel Glia dan Sel
Saraf ... 14 Pertumbuhan Panjang Akson dan Dendrit ... 14 Rancangan Percobaan ... 14 Analisis Data ... 15
HASIL DAN PEMBAHASAN
Tingkat Proliferasi Berdasarkan Population Doubling Time ... 16 Kompisisi Jumlah Sel Glia dan Sel Saraf ... 17 Pertumbuhan Panjang Akson dan Dendrit ... 20
SIMPULAN DAN SARAN
Simpulan ... 21 Saran ... 21
DAFTAR PUSTAKA ... 22
DAFTAR TABEL
DAFTAR GAMBAR
DAFTAR LAMPIRAN
PENDAHULUAN
Latar Belakang
Otak merupakan organ tubuh yang sangat penting. Menurut Aspinall &
O’Reilly (β004), fungsi otak antara lain untuk mengontrol dan mengoordinasi
semua aktivitas normal tubuh dan berperan dalam menyimpan memori. Seperti halnya dengan organ-organ yang lain, otak juga dapat mengalami kerusakan. Menurut Jackson et al. (2010) sejumlah cedera sistem saraf pusat (SSP) dan penyakit neurodegeneratif dapat mengakibatkan berbagai tingkat kematian sel dan neuroinflamasi.
Sel utama pada sistem saraf adalah sel saraf atau neuron. Kerusakan pada sel saraf dapat menyebabkan kelemahan memori (Colville & Bassert 2002), namun kelemahan memori juga dapat terjadi akibat fungsi otak yang lemah misalnya penurunan jumlah neurotransmitter utama (asetilkolin) yang berperan dalam proses penyimpanan memori (Taepavarapruk & Song 2010). Asetilkolin dapat diinaktivasi oleh enzim asetilkolinesterase menjadi asetil dan kolin (Denikrisna 2011).Untuk mempertahankan asetilkolin tetap tinggi maka penguraian asetilkolin menjadi asetil dan kolin oleh enzim asetilkolinesterase harus dihambat.
Tanaman obat (herbal medicine) merupakan salah satu metode pengobatan secara alami (back to nature) yang sedang digemari masyarakat dunia dan juga Indonesia. Mahkota dewa (Phaleria macrocarpa) merupakan salah satu contoh tanaman obatyang dapat mengatasi kanker, kencing manis (diabetes melitus), hepatitis, asam urat, radang kulit, dan ekzema (Wijayakusuma 2005). Bagian mahkota dewa yang sering dipakai untuk pengobatan adalah kulit buah, daging buah, dan daunnya.
organ tubuh yang lain seperti pada sel otak besar belum diketahui sehingga dilakukan penelitian untuk melihat efek ekstrak daun mahkota dewa terhadap pertumbuhan sel-sel otak besar. Kultur sel merupakan salah satu teknik yang dapat digunakan untuk mengukur kepekaan sel dalam menanggapi rangsang dan pengujian obat baru (Baum 2006) sehingga pada penelitian ini digunakan teknik kultur sel untuk menguji efek ekstrak daun mahkota dewa terhadap pertumbuhan sel-sel otak besar. Otak besar yang digunakan adalah otak besar anak tikus putih (Rattus norvegicus) yang berumur 3 hari.
Asiaticoside merupakan senyawa bioaktif yang berasal dari tanaman
Centella asiatica.Asiaticoside terbukti dapat melindungi sel saraf dari stres oksidatif dan mencegah terjadinya apoptosis (Mook-Jung et al. 1999) sehingga asiaticoside digunakan sebagai kontrol positif. Dosis optimum pemberian
asiaticoside pada kultur sel adalah ≤ 100 µg/mL (Musalmah et al. 2006), berdasarkan informasi ini maka asiaticoside yang digunakan pada penelitian ini sebanyak 30 µg/mL.
Zat-zat yang bersifat neurotoksik dapat menyebabkan kematian sel-sel saraf, degenerasi akson, dan peningkatan jumlah sel glia (Maezawa et al. 2006; Janis et al. 2008; Woehrling et al. 2010).Kematian sel-sel saraf dapat menyebabkan kelemahan memori (Colville & Bassert 2002), sedangkan degenerasi akson dapat menghambat penyaluran impuls (Messonnier 2002). Untuk melihat kemungkinan adanya efek negatif ekstrak daun mahkota dewa terhadap sel saraf, parameter yang diamati dalam penelitian ini adalah tingkat proliferasi sel saraf berdasarkan
Tujuan
Tujuan penelitian ini adalah untuk mengevaluasi efek pemberian ekstrak daun mahkota dewa (Phaleria macrocarpa) terhadap pertumbuhan sel saraf yang ditumbuhkan secara in vitro pada beberapa tingkatan konsentrasi ekstrak daun mahkota dewa (Phaleria macrocarpa).
Manfaat
TINJAUAN PUSTAKA
Mahkota Dewa