i
PENAPISAN BAKTERI RESISTEN TERHADAP MERKURI
SEBAGAI ALTERNATIF AGEN BIOREMEDIASI PADA
PENCEMARAN TANAH PERTAMBANGAN
ARENA YOGI PRATIWI
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
ARENA YOGI PRATIWI. Penapisan Bakteri Resisten Terhadap Merkuri sebagai
Alternatif Agen Bioremediasi pada Pencemaran Tanah Pertambangan Dibimbing
oleh EMAN KUSTAMAN dan DIMAS ANDRIANTO.
Pencemaran logam berat merkuri (Hg) pada tanah dan air sangat
membahayakan lingkungan dan kesehatan manusia. Senyawa merkuri dalam
bentuk Hg(II) dapat terikat pada residu sistein protein manusia/binatang sehingga
protein kehilangan aktivitasnya. Penelitian ini dapat membantu memberikan
solusi terhadap masalah lingkungan yang disebabkan oleh pencemaran merkuri
khususnya lingkungan yang berada di sekitar industri yang menggunakan merkuri
dan sebagai informasi terhadap jenis bakteri yang resisten terhadap merkuri
.Bakteri resisten merkuri merupakan agen biologis yang mampu mendegradasi
merkuri dari Hg
2+menjadi Hg
yang mempunyai sifat tidak berbahaya bagi
lingkungan dan kesehatan. Dua bakteri resisten merkuri telah diisolasi dari daerah
pembuangan limbah pertambangan emas PT. ANTAM. Bakteri tersebut
dibudidayakan pada media padat yang ditambahkan 1 µg/mL dan 10 µg/mL
HgCl
2. Identifikasi kedua bakteri resisten merkuri dilakukan melalui uji morfologi
dan uji aktivitas biokimia dan dibandingkan dengan
Bergey’s Manual of
Determinative Bacteriology.
Enterobacter
sp. menurunkan kadar HgCl
2pada
media sebesar 3.3 ppm setelah inkubasi tiga hari, sedangkan
Bacillus
sp.
menunjukkan penurunan sebesar 0.9 ppm
.Bacillus
sp. lebih baik dari pada
Enterobacter
sp. sebagai agen bioremediasi karena tingkat resistensi terhadap
antibiotik lebih rendah sehingga mudah pengendaliannya.
ABSTRACT
ARENA YOGI PRATIWI. Screening of Mercury-Resistant Bacteria an
Alternative Bioremediation Agent on Soil Pollution in Mining Industry. Under
the supervision of EMAN KUSTAMAN and DIMAS ANDRIANTO.
Heavy metal pollution of mercury (Hg) in soil and water are very harmful
to the environment and human health. Mercury compounds in the form of Hg (II)
can be bound to the cysteine residues of proteins of human / animal so that the
protein loses its activity. This research was expected to help provide solutions to
environmental problems caused by environmental pollution, especially mercury
around industries that use mercury and as information on the type of bacteria that
were resistant to mercury. Mercury-resistant bacteria are a biological agent that
can degrade the mercury from Hg
2+to Hg
which has un harmful properties to the
environment and health. There are two mercury-resistant bacteria that had isolated
from gold mine waste disposal areas of PT.ANTAM. The bacteria were cultivated
on solid media supplemented with 1
μ
g/mL and 10
μ
g/mL HgCl
2. Identification of
two mercury-resistant bacteria had through the morphology test and biochemical
assay, were compared with the
Bergey's Manual of Determinative Bacteriology
.
Enterobacter
sp. decreased consentration of HgCl
2in the media of 3.3 ppm after
three days incubation, whereas the
Bacillus
sp. showed a decrease of 0.9 ppm
.Bacillus
sp. better than the
Enterobacte
r sp. as a bioremediation agent for the level
of resistance to antibiotics lower so it was easy to control.
PENAPISAN BAKTERI RESISTEN TERHADAP MERKURI
SEBAGAI ALTERNATIF AGEN BIOREMEDIASI PADA
PENCEMARAN TANAH PERTAMBANGAN
ARENA YOGI PRATIWI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Biokimia
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul Skripsi
: Penapisan Bakteri Resisten Terhadap Merkuri sebagai
Alternatif Agen Bioremediasi pada Pencemaran Tanah
Pertambangan
Nama
: Arena Yogi Pratiwi
NIM :
G84080026
Disetujui
Komisi Pembimbing
Ir. Eman Kustaman
Dimas Andrianto, S.Si. M.Si
Ketua
Anggota
Diketahui
Dr. Ir. I Made Artika, M.App.Sc
Ketua Departemen Biokimia
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT yang telah
memberikan kemampuan kepada penulis untuk merampungkan penelitian yang
berjudul “Penapisan Bakteri Resisten Terhadap Merkuri sebagai Alternatif Agen
Bioremediasi pada Pencemaran Tanah Pertambangan” sehingga bisa selesai tepat
pada waktunya. Penelitian ini berlangsung selama enam bulan mulai dari Februari
sampai Juni 2012. Tempat pelaksanaan penelitian di Laboratorium Biokimia,
Fakultas Matematika dan Ilmu Pengetahuan Alam Institut Pertanian Bogor
(FMIPA IPB), Laboratorium Mikrob dan Bioproses Balai Penelitian Bioteknologi
Perkebunan Indonesia, dan Laboratorium Kimia, FMIPA IPB untuk pengukuran
AAS
(
Atomic Absorbtion Spectrofotometre)
.
Penulis mengucapkan terima kasih kepada Ir. Eman Kustaman dan Dimas
Andrianto,MSi selaku pembimbing, atas bimbingan dan arahan yang diberikan
selama pelaksanaan penelitian ini. Penulis juga mengucapkan terima kasih kepada
Ir. Suharyanto, M.Si, Mba Trisning, Mba Uci, Mba Wulan, Yudieta, dan Mas
Haryo dari Laboratorium Mikrob dan Bioproses Balai Penelitian Bioteknologi
Perkebunan Indonesia untuk isolasi dan identifikasi bakteri, bapak Wawan dari
Departemen Kimia untuk analisis AAS. Selain itu, tidak lupa kepada ibu dan alm.
ayah tercinta, adik Dian Indah Pratiwi dan Aulia Rochmah Pratiwi, seluruh
keluarga, Tia, Putri, Tati, Azizah, Yudith, Sari, Riris, Elin, Lupy, Puspa, Rahmi,
Nissa, Dayu, Wulan, Ihsan, Mas Erwin, Arif, Agus, Mba Dian, Vita, Januar, Syifa
dan teman-teman yang senantiasa memberikan motivasi dan doa. Penulis berharap
semoga penelitian ini bisa bermanfaat, baik bagi penulis pribadi maupun
pembaca.
Bogor,
Juni
2012
RIWAYAT HIDUP
Penulis dilahirkan pada 6 Oktober 1989 di Kebumen, Jawa Tengah dari
ayahanda Alm. Harjito dan ibunda Supriyati, BA. Penulis merupakan anak
pertama dari tiga bersaudara. Penulis menempuh pendidikan di Kebumen, pada
tahun 2008 penulis lulus dari SMA Negeri 1 Gombong dan diterima di Institut
Pertanian Bogor melalui jalur Ujian Seleksi Masuk IPB (USMI). Penulis tercatat
sebagai mahasiswa Departemen Biokimia, Fakultas Matematika dan Ilmu
Pengetahuan Alam.
Selama mengikuti perkuliahan penulis aktif di beberapa organisasi dan
kegiatan kampus. Penulis sempat aktif dalam kepengurusan Organisasi
Mahasiswa Daerah (OMDA) Kebumen. Selain itu, penulis pernah aktif sebagai
staf anggota Event Organizer Koperasi Mahasiswa (Kopma) IPB. Penulis juga
pernah aktif dalam organisasi keprofesian, yaitu CREBs (
Community of Research
and Education in Biochemistry
) sebagai Sekretaris Umum. Selain aktif di
organisasi, penulis juga aktif dalam kepanitian diantaranya Pesta Sains Nasional
(2009), kegiatan Even Organiser (EO) Kopma IPB, SPIRIT “Sport Competition
and Art Festival on MIPA Faculty” (2010), Masa Perkenalan Departemen (MPD)
Biokimia (2010), Biokimia Expo (2010), Siang Keakraban Biokimia (2012).
DAFTAR ISI
Halaman
DAFTAR TABEL ... ix
DAFTAR GAMBAR ... ix
DAFTAR LAMPIRAN ... x
PENDAHULUAN ... 1
TINJAUAN PUSTAKA
Isolasi Bakteri ... 1
Bioremediasi ... 2
Merkuri... 3
Bakteri Resisten Merkuri ... 3
Dampak Pencemaran Merkuri ... 4
BAHAN DAN METODE
Alat dan Bahan ... 5
Metode Percobaan ... 5
HASIL DAN PEMBAHASAN
Isolat Bakteri Resisten Merkuri ... 7
Hasil Uji Morfologi dan Uji Aktivitas Biokimia Bakteri Resisten
Merkuri... 8
Resistensi Antibiotik Bakteri Resisten Merkuri... 10
Pengujian Bakteri sebagai Bioremediasi... 11
SIMPULAN DAN SARAN
Simpulan ... 11
Saran... 12
DAFTAR PUSTAKA ... 12
DAFTAR TABEL
Halaman
1 Hasil isolasi bakteri resisten merkuri ... 7
2
Uji morfologi bakteri resisten merkuri ... 8
3 Uji aktivitas biokimia ... 10
4
Hasil uji resistensi antibiotik ... 11
5
Pengujian penurunan kadar Hg dengan isolat bakteri ... 11
DAFTAR GAMBAR
Halaman
1 Struktur dan bentuk molekul metil merkuri ... 3
2 Mekanisme bakteri resisten merkuri ... 4
3 Daerah penambangan limbah PT. ANTAM ... 7
DAFTAR LAMPIRAN
Halaman
1 Alur penelitian... 15
2 Hasil Analisis Kadar Hg pada Sampel Tanah di PT. ANTAM ... 16
3 Hasil isolasi bakteri awal ... 16
4
Bakteri murni ... 18
5
Bakteri yang tumbuh pada media yang mengandung HgCl
2... 18
6 Uji pewarnaan Gram bakteri resisten merkuri (uji morfologi) ... 18
7 Uji aktivitas biokimia (uji fermentasi karbohidrat) ... 19
8 Uji aktivitas biokimia (uji indol, uji produksi H
2S, uji pembentukan sitrat,
dan uji urease) ... 20
9 Uji resistensi antibiotik ... 21
10 Kurva pertumbuhan bakteri ... 22
1
PENDAHULUAN
Suatu permasalahan yang besar dalam era industrilisasi global saat ini adalah terkontaminasinya air, tanah, air tanah, air permukaan dan udara, oleh bahan kimia yang berbahaya dan beracun. Hal ini merupakan suatu konsekuensi pembangunan industri. Di negara maju telah terjadi lebih dahulu langkah untuk mengurangi atau menghilangkan bahan kimia yang berbahaya dan beracun serta mewaspadai kerusakan lingkungan secara terus menerus. Sebaiknya hal tersebut tidak terulang lagi di negara sedang berkembang seperti halnya negara Indonesia. Selain penanganan konvensional yang saat ini sedang berjalan, perlu dikembangkan suatu terobosan teknologi baru yang menuju pada detoksifikasi dan pengancuran kontaminan bahan kimia yang berbahaya dan beracun untuk menangani masalah tersebut.
Pencemaran logam berat merkuri (Hg) pada tanah dan air sangat membahayakan lingkungan dan kesehatan manusia. Senyawa merkuri dalam bentuk Hg(II) dapat terikat pada residu sistein protein manusia/binatang sehingga protein kehilangan aktivitasnya (Rugh et al. 2000 dalamNofiani & Guzrisal 2004). Fraksi Hg2+ terbentuk dalam beberapa menit saja di dalam larutan tanah. Fraksi utama, senyawa anorganik dan organik lainnya akan terikat dalam mineral tanah atau dijerap pada permukaan tanah.
Sumber pencemaran merkuri dapat disebabkan oleh proses geologi dan biologi. Senyawa merkuri yang terdapat pada batu dan tanah dikikis oleh hujan dan angin. Salah satu usaha untuk detoksifikasi merkuri dapat dilakukan menggunakan mikroorgansime resisten merkuri, misalnya bakteri resisten merkuri. Mikroorganisme yang terdapat pada daerah tercemar merkuri berperan utama untuk detoksifikasi merkuri. Apabila bakteri tersebut dapat beradaptasi pada lingkungan dengan tingkat kontaminasi logam berat yang tinggi, maka diasumsikan bahwa penggunaan bakteri tersebut sangat efektif dalam meningkatkan reduksi logam berat. Oleh karena itu, mikroorganisme yang terdapat pada daerah tercemar merkuri merupakan sumber untuk isolasi bakteri resisten merkuri.
Kemampuan bakteri merupakan agen biologi penting yang dapat digunakan untuk bioremediasi. Sejumlah bakteri resisten terhadap merkuri telah diisolasi umumnya termasuk dalam kelompok baik bakteri Gram negatif maupun Gram positif (Nascimento & Chartone-Souza 2003). Bakteri ini memiliki
mekanisme untuk mendetoksifikasi merkuri berdasarkan pada mekanisme reduksi intraselular Hg2+ menjadi bentuk non-toksik Hg oleh enzim merkuri reduktase. Beberapa bakteri yang telah diketahui dapat resisten terhadap merkuri adalah bakteri aerobik dan fakultatif yang mengkatalisasi proses reduksi Hg(II) menjadi Hg(0) seperti bakteri jenis Bacillus, Pseudomonas, Corynebacterium, Micrococcus, dan Vibrio. Reduksi oleh bakteri tersebut dapat digunakan sebagai strategi remediasi untuk endapan terkontaminasi (Mullen 1998). Percepatan laju reduksi Hg(II) oleh bakteri sangat memungkinkan untuk digunakan dalam teknik bioremediasi in situ di tanah atau air yang tercemar (Barkay et al. 1991; Goldstein et al. 1988). Oleh karena itu, penelitian mengenai keberadaan bakteri lain yang resisten terhadap merkuri sangat penting bagi kesehatan dan dunia industri pertambangan itu sendiri. Penelitian ini bertujuan mengidentifikasi bakteri yang resisten terhadap merkuri pada tanah pertambangan yang tercemar merkuri pada daerah pertambangan PT. ANTAM. Bakteri yang telah teridentifikasi dapat digunakan sebagai salah satu cara untuk detoksifikasi merkuri sehingga dapat mengurangi efek berbahaya yang ditimbulkan oleh merkuri pada tanah sekitar pertambangan. Hipotesis pada penelitian ini yaitu adanya isolat bakteri yang resisten terhadap merkuri dan mampu digunakan sebagai agen bioremediasi
.
Hasil penelitian ini diharapkan dapat memberikan informasi adanya bakteri yang dapat digunakan sebagai agen bioremediasi pada tanah pertambangan yang tercemar merkuri.TINJAUAN PUSTAKA
Isolasi Bakteri
2
dapat dipelajari dengan metode yang amat keras dengan hasil yang sangat akurat karena pengaruh sel hidup yang lain dapat ditiadakan.
Isolasi bakteri adalah proses mengambil bakteri dari medium atau lingkungan asalnya dan menumbuhkannya di medium buatan sehingga diperoleh biakan yang murni. Bakteri dipindahkan dari satu tempat ke tempat lainnya harus menggunakan prosedur aseptik. Aseptik berarti bebas dari sepsis, yaitu kondisi terkontaminasi karena mikroorganisme lain. Teknik aseptik ini sangat penting bila bekerja dengan bakteri. Beberapa alat yang digunakan untuk menjalankan prosedur ini adalah bunsen dan laminar air flow. Bila tidak dijalankan dengan tepat, ada kemungkinan kontaminasi oleh mikroorganisme lain sehingga akan mengganggu hasil yang diharapkan. Teknik aseptik juga melindungi laboran dari kontaminasi bakteri (Singleton dan Sainsbury 2006).
Beberapa metode untuk menginokulasi bakteri sesuai dengan jenis medium tujuannya. Pada medium agar tegak, dilakukan metode tusuk menggunakan jarum ose. Pada medium agar miring, dilakukan metode gores dengan menggunakan loop ose. Pada medium petridisk, dapat digunakan metode streak plate (metode gores), pour plate (metode tuang) atau spread plate (metode sebar). Setelah inokulasi, dilakukan proses inkubasi, yaitu menyimpan medium pada alat atau kontainer ada temperatur tertentu dan periode tertentu, sehingga tercipta lingkungan yang menyediakan kondisi cocok untuk pertumbuhan bakteri (Harley dan Presscot 2002).
Bioremediasi
Bioremediasi merupakan suatu proses pemulihan polutan dengan memanfaatkan jasa makhluk hidup seperti mikroba (bakteri, fungi, khamir), tumbuhan hijau atau enzim yang dihasilkan oleh proses metabolisme
(Aleander 1997 dalam Widyawati 2006).
Beberapa metode yang telah dan sedang dikembangkan untuk bioremediasi tanah dan air yang terkontaminasi, yaitu termasuk
didalamnya pengomposan, landfarming,
bioreaktor, fase padat, dan perlakuan in situ (Turco & Sadowsky 1995). Keberhasilan bioremediasi di tanah dipengaruhi tiga faktor independen, namun saling terkait yaitu kontaminan, mikroorganisme, dan lingkungan.
Bioremediasi memiliki beberapa keuntungan menurut Mullen (1998), antara lain relatif kurang berbahaya, proses berlangsung secara alamiah, dan tidak berdampak pada lingkungan serta tidak menghasilkan bahan sisa. Sedangkan menurut Gunalan (1998), bioremediasi dipilih sebagai teknologi remediasi unggulan karena teknologi ini memiliki beberapa keuntungan dan dapat menyelesaikan permasalahan pencemaran lingkungan secara murah dan tuntas.
Prinsip bioremediasi dilakukan dengan menurunkan aktivitas kontaminan tersebut dalam lingkungan, baik dengan cara pembentukan senyawa yang mempunyai kelarutan yang rendah, pembentukan senyawa atau unsur yang mempunyai sifat meracun (toksisitas) lebih rendah, atau menurunkan konsentrasi kontaminan tersebut (Sklandany & Metting 1992). Dalam kaitannya dengan logam berat penurunan konsentrasi tersebut harus dikaitkan dengan proses serapan oleh organisme mengingat logam berat tersebut umumnya larut dalam lemak dan dapat terakumulasi dalam tubuh organisme (Mullen 1998).
Berdasarkan agen, teknik, dan proses biologis, bioremediasi dibagi menjadi lima
kelompok, yaitu bioremediasi ex situ,
bioremediasi in situ, bioaugmentasi,
3
metabolisme tumbuhan dan hubungan positif antara tumbuhan dengan mikroorganisme.
Merkuri
Merkuri adalah salah satu jenis logam yang banyak ditemukan di alam dan tersebar di bebatuan, biji tambang, air dan udara sebagai senyawa organik dan non organik. Merkuri dalam keadaan normal berbentuk cairan berwarna abu-abu, tidak berbau dengan berat molekul 200.59 g/mol (Elberger & Brody 1993).
Gambar 1 Struktur dan bentuk molekul metil merkuri
Merkuri tidak larut dalam air, alkohol, eter, asam hidroklorida, hidrogen bromida dan hidrogen iodida. Namun, merkuri larut dalam asam nitrat, asam sulfat panas, dan lipid. Merkuri juga tidak tercampurkan dengan oksidator, halogen, bahan-bahan yang mudah terbakar, logam, asam, karbid dan amin (Elberger & Brody 1993). Toksisitas merkuri berbeda sesuai bentuk kimianya, misalnya merkuri anorganik bersifat toksik pada ginjal, sedangkan merkuri organik seperti metil merkuri bersifat toksis pada sistim syaraf pusat (Ellenhorn et al. 1997).
Merkuri terbagi jenis di alam yakni merkuri elemental (Hg) yang sering kita jumpai dalam gelas termometer, tensimeter air raksa, almagam gigi, alat elektrik, batu baterai dan cat. Selain itu, merkuri juga digunakan sebagai katalisator dalam produksi soda kaustik dan desinfektan serta untuk produksi klorin dari sodium klorida. Lalu yang ke dua yakni merkuri anorganik, yaitu dalam bentuk Hg++ dan Hg+ misalnya yang sering dijumpai
pada merkuri HgCl2 termasuk dalam Hg
anorganik yang sangat toksik, kaustik, dan digunakan sebagai desinfektan, mercurous
chloride (HgCl) yang digunakan untuk
pemutih gigi yang bersifat mudah terbakar. Lalu yang ke tiga merkuri organik, yaitu
terdapat dalam beberapa bentuk, antara lain metil merkuri dan etil merkuri yang keduanya termasuk bentuk alkil rantai pendek dijumpai sebagai kontaminan logam di lingkungan. Misalnya memakan ikan yang terkena zat tersebut dapat menyebabkan gangguan neurologis dan kongenital (Ellenhorn et al. 1997).
Metil merkuri (Gambar 1) adalah merkuri organik yang berbentuk serbuk putih dan berbau seperti belerang pada sumber air panas. Senyawa ini mudah terserap oleh organ pencernaan dan dibawa oleh darah ke dalam otak, liver, dan ginjal bahkan ke dalam janin (Warouw 2008).
Bakteri Resisten Merkuri
Tanaman dan bakteri merupakan agen biologi penting yang dapat digunakan untuk bioremediasi, maka beberapa tahun terakhir ini bidang mikrobiologi terapan dan biologi molekuler menjadi dasar pengembangan teknologi bioremediasi dengan memanfaatkan bakteri yang dapat mereduksi merkuri. Hasil
penelitian Benyehuda et al. (2003)
menunjukkan respon penghambatan pertumbuhan yang sangat bervariasi dari bakteri aerob kemoheterotrop yang diisolasi dari dasar permukaan sedimen di dalam medium pepton – tripton – yeast – glukosa (PTG) dengan kertas cakram yang mengandung 2 μmol Cr(VI), 50 nmol Hg(II), dan 500 nmol Pb(II). Hal ini diduga karena bakteri Gram positif dan Gram negatif secara prinsip memiliki perbedaan satu dengan lainnya dalam hal interaksi dengan logam (Giller et al. 1998).
Bakteri Gram negatif menunjukkan toleransi terhadap logam yang lebih besar dibandingkan Gram positif karena memiliki struktur dinding sel yang lebih kompleks yang mampu mengikat dan mengimobilisasi ion logam termasuk Hg2+. Ahmad et al. (2005) mengemukakan bahwa kemampuan bakteri menghasilkan polisakarida ekstraseluler dapat melindungi sel dari pengaruh toksik logam berat. Hasil penelitiannya memberikan indikasi bahwa bakteri heterotrof yang ditumbuhkan di dalam medium yang mengandung merkuri konsentrasi 150-200 μg/g akan mengalami penurunan viabilitas setelah 21 hari inkubasi.
4
Gram positif (Nascimento & Chartone-Souza 2003). Bakteri ini memiliki mekanisme mendetoksifikasi merkuri berdasarkan adanya mekanisme reduksi intraseluler Hg2+ menjadi bentuk tidak toksin Hg0 oleh enzim merkuri reduktase.
Pilot plant untuk pengembangan teknologi bioremediasi merkuri pada limbah industri dilaporkan oleh Dobler (2003) dengan
memanfaatkan Pseudomonas putida.
Beberapa bakteri aerobik dan fakultatif mengkatalisasi proses reduksi Hg(II) menjadi
Hg seperti Bacillus, Pseudomonas,
Corynebacterium, Micrococcus, dan Vibrio. Pseudomonas malthopilia dapat mereduksi Cr6+ yang bersifat mobile dan toksik menjadi bentuk immobile dan tidak toksik Cr3+serta meminimumkan mobilitas ion toksik lainnya di lingkungan seperti Hg2+, Pb2+, dan Cd2+ (Blake et al. 1993, Park et al. 1999). Reduksi oleh bakteri tersebut dapat digunakan sebagai strategi remediasi untuk endapan terkontaminasi (Mullen 1998).
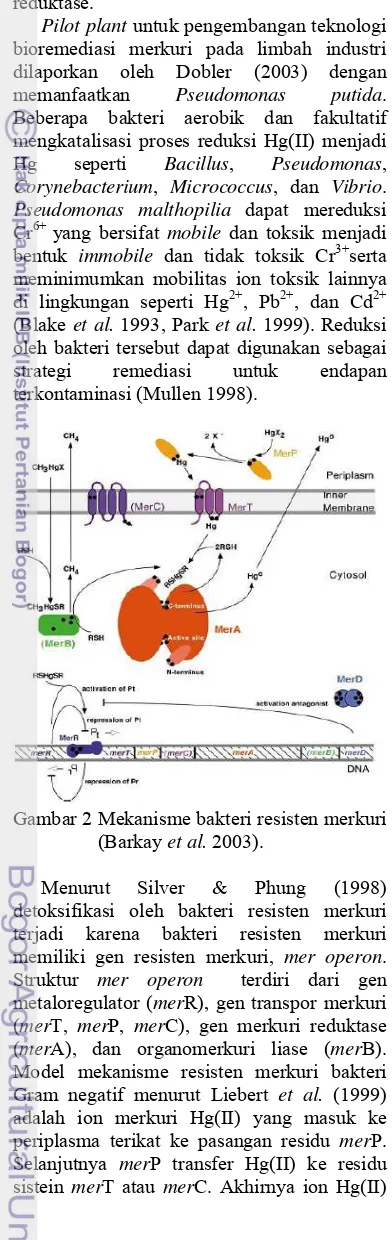
Gambar 2 Mekanisme bakteri resisten merkuri (Barkay et al. 2003).
Menurut Silver & Phung (1998) detoksifikasi oleh bakteri resisten merkuri terjadi karena bakteri resisten merkuri memiliki gen resisten merkuri, mer operon.
Struktur mer operon terdiri dari gen
metaloregulator (merR), gen transpor merkuri (merT, merP, merC), gen merkuri reduktase (merA), dan organomerkuri liase (merB). Model mekanisme resisten merkuri bakteri Gram negatif menurut Liebert et al. (1999) adalah ion merkuri Hg(II) yang masuk ke periplasma terikat ke pasangan residu merP. Selanjutnya merP transfer Hg(II) ke residu sistein merT atau merC. Akhirnya ion Hg(II)
menyeberang membran sitoplasma melalui proses reaksi pertukaran ligan menuju sisi aktif flavin disulfida oksida reduktase, merkuri reduktase (merA). Merkuri reduktase mengkatalisis reduksi Hg(II) menjadi Hg(0) berdifusi di lingkungan sel untuk selanjutnya dikeluarkan dari sel (Gambar 3).
Dampak Pencemaran Merkuri
Dampak merkuri terhadap lingkungan dapat terakumulasi dilingkungan dan dapat meracuni hewan, tumbuhan, dan mikroorganisme. Permukaan air yang asam dapat mengandung signifikan jumlah raksa. Bila nilai pH adalah antara lima dan tujuh, maka konsentrasi raksa di dalam air akan meningkat karena mobilisasi raksa dari dalam tanah. Setelah raksa telah mencapai permukaan air atau tanah, mikrorganisme dapat mengkonversi raksa ke bentuk metil merkuri. Metil merkuri merupakan suatu zat yang dapat diserap oleh sebagian besar organisme dengan cepat dan diketahui menyebabkan kerusakan saraf.
Sebagian besar merkuri yang terdapat di alam ini dihasilkan oleh sisa industri dalam jumlah 10.000 ton setiap tahunnya. Penggunaan merkuri sangat luas di mana 3000 jenis kegunaan dalam industri pengolahan bahan-bahan kimia, proses pembuatan obat-obatan yang digunakan oleh manusia serta sebagai bahan dasar pembuatan insektisida dalam pertanian (Christian & Fedelman 1970).
5
mempengaruhi dan merugikan perkembangan otak serta perkembangan system syaraf anak. Merkuri dapat mengurangi kemampuan kognitif dan berpikir, memori, perhatian, penguasaan bahasa, keterampilan motorik halus dan keterampilan ruang visual.
Efek toksisitas merkuri pada manusia bergantung pada bentuk komposisi merkuri, jalan masuknya ke dalam tubuh, dan lamanya berkembang. Contohnya adalah bentuk HgCl2 lebih toksik daripada bentuk HgCl dikarenakan bentuk divalen lebih mudah larut daripada monovalen. Disamping itu, bentuk HgCl2 juga cepat dan mudah diadsorpsi sehingga daya toksisitasnya lebih tinggi (Alfian 2001).
Kasus pencemaran Hg yang pernah terjadi pada tahun 1930 yang disebabkan oleh pabrik-pabrik yang membuang limbah yang mengandung senyawa merkuri yaitu metil merkuri klorida ke Teluk Minamata di pantai barat pulau Kyushu, Jepang. Sejak sekitar 15 tahun sejak dimulainya pembuangan limbah pabrik tersebut, tragedi yang dikenal dengan ‘Minamata Diseases’ mulai terlihat pada penduduk yang bermukim di sekitar Teluk Minamata dan pulau-pulau disekitarnya, berupa cacat mental dan cacat syaraf terutama pada anak-anak. Setelah 25 tahun kemudian, barulah pemerintah Jepang menghentikan pembuangan Hg, melakukan rehabilitasi penduduk yang terkena dampak menahun (kronis). Kejadian ini membuat Jepang membayar mahal, jauh melebihi keuntungan pengoperasian Perusahaan Chisso Corporation (Lasut 2002).
BAHAN METODE
Alat dan Bahan
Alat-alat yang digunakan dalam penelitian ini adalah botol selai, aluminium foil, sekop, icebox, labu Erlenmeyer, autoklaf, sudip, batang pengaduk, laminar, kaca preparat, loop, bak tempat menampung air, mikroskop, kamera, botol fermentasi, air lock, tabung reaksi, pipet tetes, pipet volumetrik, penangas air 100oC, oven, cawan Petri, plastic
wrapping, spektrofotometer, dan AAS
(Atomic Absorbtion Spectrofotometre).
Bahan-bahan yang digunakan dalam penelitian ini antara lain sampel tanah dari PT. ANTAM, yeast extract, beef extract, pepton, NaCl 0.85%, kristal violet, iodin, etanol 95%, safranin, BTB (brom timol blue), glukosa 1%, laktosa 1%, manitol 0.5%, maltose 1%,
sukrosa 2%, pereaksi benedict, reagen Kovac, fero ammonium sulfat, natrium tiosulfat, agar, media TSIA (triple sugar iron agar), media Simmon’s citrate agar, nutrient agar, ampisilin, tetrasiklin, kloramfenikol, rifampisin, merkuri, dan akuades.
Metode Penelitian
Pengambilan sampel bakteri dan persiapan media isolasi
Sampling dilakukan dengan mengambil sampel 1-5 cm dari permukaan tanah di daerah PT. ANTAM. Sampel sedimen dilakukan pada 3 lokasi, yaitu: lokasi I berada tepat di daerah yang diduga telah tercemar merkuri yang berada dekat dengan penambangan (M), lokasi II diambil menjauhi tempat pertama dengan jarak 100 meter (1M), dan lokasi III diambil menjauhi tempat pertama dengan jarak 200 meter (2M). Sehingga lokasi yang diambil berjarak 0 meter, 100 meter, dan 200 meter. Sampel sedimen setiap titik pada setiap lokasi dicampur sehingga diperoleh sampel komposit (Nofiani & Gusrizal 2004). Sampel komposit disuspensikan ke dalam bufer NaCl 0.85%. Isolasi bakeri resisten merkuri diawali dengan melakukan pengenceran 1:10 yaitu 10 gram tanah ditambahkan 90 mL NaCl 0.85% (Fardiaz 1993). Pengenceran ini untuk masing-masing komposit yaitu M, 1M, dan 2M. Perlakuan pengenceran diperlukan sebelum ditumbuhkan pada medium, agar di dalam cawan Petri terbentuk koloni dalam jumlah yang dapat dihitung setelah diinkubasi, jumlah yang terbaik adalah diantara 30 dan 300 (Fardiaz 1993). Bakteri diinokulasi pada media nutrient agar (yeast extract 2 g/L, bacto pepton 5 g/L, NaCl 5 g/L, agar-agar,air) setelah pengenceran dan diinkubasi pada temperatur 30oC selama 12-16 jam. Teknik perbanyakan kultur bakteri M digunakan juga untuk perbanyakan kultur bakteri 1M dan 2M. Hasil inokulasi bakteri yang telah diencerkan diambil pada tiap cawan Petri yang diisolasi secara acak.
6
Penapisan bakteri
Penapisan bakteri dilakukan dengan cara uji pewarnaan Gram dan uji biokimia yang akan dicocokkan hasil ujinya dengan Bergey’s Manual of Determinative Bacteriology. Penapisan ini berupa apakah tanah tersebut mengandung bakteri yang resisten terhadap merkuri. Teknik yang dilakukan dengan pewarnaan Gram dan juga melihat pohon filogenik untuk memastikan bakteri apa yang didapat. Uji biokimia yang dilakukan meliputi uji fermentasi karbohidrat, uji pembentukan indol, uji produksi H2S, uji penggunaan sitrat, dan uji urease.
Uji pewarnaan Gram. Uji pewarnaan
Gram (Cappuccino & Sherman 1983) dilakukan dengan cara isolat bakteri resisten merkuri ditambahkan kristal violet selama 1 menit kemudian dicuci dengan air mengalir. Setelah itu, 1 tetes Gram’s iodine mordant ditambahkan selama 1 menit, kemudian dicuci dengan air mengalir. Selanjutnya ditambah etil alkohol 95% sampai kristal violet tidak larut lagi dan pada akhirnya isolat bakteri ditambahkan safranin selama 45 detik dan dicuci dengan air mengalir, kemudian dikeringkan dan diperiksa warna dan bentuk sel bakteri dengan mikroskop.
Uji fermentasi karbohidrat. Substrat
yang digunakan untuk tes fermentasi karbohidrat adalah glukosa, laktosa, manitol, maltosa, dan sakarosa. Uji fermentasi karbohidrat dengan substrat glukosa dilakukan dengan menginokulasi bakteri resisten merkuri ke 50 mL media pepton water yang mengandung 0.5 mL bromthymol blue 0.4% dan glukosa 1%, diinkubasi 24-48 jam pada temperatur 300C (Collins & Lyne 1985). Hasil positif ditandai dengan terbentuk warna kuning dan tes negatif ditandai dengan warna biru. Tes fermentasi karbohidrat dengan substrat laktosa, manitol, maltosa dan sakarosa. Konsentrasi substrat yang digunakan adalah laktosa, manitol, maltosa, dan sakarosa.
Uji pembentukan indol. Uji
pembentukan indol dilakukan dengan menginokulasi bakteri resisten merkuri ke media water tripton atau SIM selama 24-48 jam pada temperatur 30°C, kemudian
ditambah 0.5 mL Kovac’s reagent
(Cappuccino & Sherman 1983; Collins & Lyne 1985). Reaksi positif ditandai dengan terbentuknya warna merah.
Uji produksi H2S. Uji produksi H2S
dilakukan dengan menginokulasi bakteri resisten merkuri ke media TSIA (triple sugar iron agar) selama 24-48 jam pada temperatur
30°C (Cappuccino & Sherman 1983). Reaksi positif ditandai dengan terbentuknya endapan hitam.
Uji penggunaan sitrat. Uji penggunaan
sitrat dilakukan dengan menginokulasi bakteri resisten merkuri ke media Simmon’s citrate agar (Sigma) dan diinkubasi 24-48 jam pada temperatur 30°C (Cappuccino &Sherman 1983). Reaksi positif ditandai dengan terbentuknya warna biru.
Uji urease. Uji urease dilakukan dengan
menginokulasi bakteri resisten merkuri ke media padat urea Christensen (Sigma) selama 24-48 jam pada temperatur 30°C (Cappuccino & Sherman 1983). Reaksi positif ditandai dengan terbentuknya warna merah.
Uji resisten antibiotik. Uji resisten
antibiotik dilakukan dengan menginokulasi bakteri resisten merkuri pada 2 macam media seleksi padat. Pertama, media seleksi padat yang mengandung antibiotik dan diinkubasi pada suhu 30°C selama 16-24 jam. Kedua, media seleksi padat yang mengandung antibiotik dan HgCl2 10 µg/mL dan diinkubasi pada suhu 30 oC selama 16-24 jam. Antibiotik yang digunakan untuk uji resisten antibiotik pada kedua media adalah ampisilin dengan konsentrasi 50.25 µg/mL (Ausubel et al. 1995), tetrasiklin dengan konsentrasi 200.25 µg/mL (Smit et al. 1998), kloramfenikol dengan konsentrasi 50.25 µg/mL (Smit et al. 1998) dan rifampisin dengan konsentrasi 150.25 µg/mL (Smith et al. 1998).
Kultivasi bakteri
Bakteri yang telah diidentifikasi tersebut kemudian dibiakkan dengan metode penggoresan sehingga bakteri tersebut didapat jumlah yang banyak dan akan dipergunakan dalam percobaan. Kultivasi bakteri dilakukan dengan agar miring, media cair, dan media padat. Media yang digunakan adalah nutrient agar (NA) dan LB yang telah ditambahkan HgCl2.
7
inkubasi, bakteri ditumbuhkan pada media nutrient broth (NB) yang mengandung HgCl2 5 ppm selama 72 jam (waktu bakteri sampai fase stasioner, Lampiran 10). Sebelumnya media kontrol diukur terlebih dahulu kadar merkurinya sehingga diketahui kadar merkuri awal dengan spektrum AAS. Setelah itu, sampel yang telah ditumbuhkan selama tiga hari tersebut kembali diukur kadar merkuri dengan spektrum AAS. Diharapkan kadar merkuri dalam sampel tersebut memiliki kadar yang lebih kecil dari kadar merkuri pada
media kontrol yang menunjukkan bakteri
tersebut mampu mereduksi Hg (merkuri).
HASIL DAN PEMBAHASAN
Isolat Bakteri Resisten Merkuri Merkuri merupakan bahan teratogenik. Karena sifatnya yang sangat beracun maka U.S Food & Drug Administration (FDA) menentukan nilai ambang batas kadar merkuri yang ada dalam jaringan tubuh ataupun di badan air atau dalam pertambangan adalah 0.005 mg/L atau 0.005 ppm. Sedangkan baku mutu air limbah berdasarkan standar air
penerima (Stream standard) untuk sungai
golongan IV (tidak digunakan oleh penduduk untuk keperluan) adalah sebesar 0.01 ppm. Berdasarkan hasil uji kadar merkuri awal pada sampel tanah (Lampiran 2) yang diukur menggunakan AAS diperoleh kadar merkuri sebesar 0.030 ppm untuk jarak 0 meter (M), 0.017 ppm pada jarak (1M), dan 0.010 ppm pada jarak 200 meter (2M). Hal tersebut menunjukkan bahwa kadar merkuri yang berada di tanah pembuangan limbah pertambangan PT. ANTAM masih di ambang batas kadar merkuri yang seharusnya ada di pertambangan. Oleh karena itu perlu dilakukan isolasi bakteri resisten merkuri untuk mengolah limbah tersebut supaya tidak berbahaya.
Gambar 3 Daerah pembuangan limbah PT. ANTAM
Kondisi lokasi pertambangan (Gambar 3) yang digunakan untuk pengambilan sampel
tanah merupakan daerah pembuangan limbah. Kondisi pengambilan sampel tanah di sekitar kolam pembuangan limbah. Sampel tanah yang diperoleh hanya diukur kadar Hg saja. Selanjutnya diisolasi bakteri yang tumbuh di tanah tersebut dan diuji bakteri yang tahan merkuri.
Tabel 1 Hasil isolasi bakteri resisten merkuri
Sampel Isolat bakteri Resistensi
merkuri
M M1 -
M2 - 1M 1M1 +
2M
1M2 - 2M1 - 2M2 - 2M3 +
Keterangan: + : bakteri resisten merkuri - : bukan bakteri resisten merkuri
Hasil isolasi bakteri dengan metode pengenceran, diperoleh 7 koloni bakteri (Tabel 1), diantaranya 2 koloni dari kultur bakteri M (0 meter dari titik limbah), 1 koloni dari kultur bakteri 1M (100 meter dari titik limbah), dan 4 koloni dari kultur 2M (200 meter dari titik limbah). Ketujuh isolat bakteri tersebut diambil pada tiap cawan Petri yang diisolasi secara acak yang menunjukkan penampakan visual yang berbeda dari setiap
jarak. Kode M1 dan M2 merupakan isolat
bakteri yang diambil dari kultur M, isolat 1M1 dan 1M2 diambil dari kultur 1M, sedangkan bakteri 2M1, 2M2, dan 2M3 merupakan isolat bakteri yang diambil dari kultur 2M.
Ketujuh bakteri tersebut ditumbuhkan pada media seleksi yang digunakan untuk isolasi bakteri resisten merkuri adalah media menurut Canstein et al. (2002). Media seleksi ini dapat mengurangi penggunaan konsentrasi HgCl2 karena media seleksi Canstein et al. (2002) tidak mengurangi toksisitas Hg (merkuri) terhadap bakteri. Pada media kaya asam amino terutama asam amino sistein, toksisitas Hg berkurang, karena gugus sulfihidril dapat mengikat Hg.
8
Ketiga, adanya plasmid yang mengandung gen reisten merkuri yang masuk dalam sel (Smith et al. 1998).
Tujuh koloni yang diisolasi dalam media seleksi menunjukkan bahwa hanya ada dua isolat yang merupakan bakteri resisten merkuri. Isolat yang tumbuh dalam media mengandung 1 µg/mL dan 10 µg/mL adalah 1M1 dan 2M3. Menurut Nofiani & Gusrizal (2004), bakteri yang dapat hidup untuk konsentrasi HgCl2 10 µg/mL diduga hanya bakteri yang mengandung gen resisten merkuri. Sedangkan yang masih dapat hidup dalam konsentrasi 1 µg/mL menurut Nofiani & Gusrizal (2004) kemungkinan hanya memiliki mekanisme respon cara menghambat metabolisme sel atau sistem (Smith et al. 1998) atau multidrug, multication, atau nodulation signal efflux yang merupakan sistem yang dapat memompa keluar beberapa jenis obat-obatan, kation divalent atau nodulationsignal lipooligosakarida.
Siklus dasar reaksi merkuri di dalam tanah dilakukan oleh bakteri dan hasilnya meliputi transformasi aerobik dan anaerobik yaitu dari Hg(II) ke monometil Hg dan selanjutnya menjadi metana dan Hg(0). Proses metilasi ini merupakan awal proses detoksifikasi bagi bakteri bersangkutan yang kemudian dilanjutkan dengan proses reduksi Hg(II) menjadi Hg(0) (Barkay et al. 1991; Goldstein et al. 1988).
Hasil Uji Morfologi dan Uji Aktivitas Biokimia Bakteri Resisten Merkuri Penapisan ini meliputi dua tahap yakni uji morfologi dan uji biokimia. Uji morfologi dilakukan dengan pewarnaan Gram sedangkan identifikasi bakteri berdasarkan uji aktivitas biokimia dilakukan dengan cara membandingkan aktivitas biokimia setiap bakteri. Aktivitas biokimia setiap jenis bakteri berbeda. Hal ini disebabkan karena setiap bakteri mempunyai akivitas enzimatik yang berbeda. Kedua isolat bakteri diidentifikasi
dengan sistem Bergey’s Manual of
Determinative Bacteriology.
Berdasarkan hasil dari Tabel 1, diperoleh dua isolat bakteri yaitu isolat bakteri dengan kode 1M1 dan 2M3. Kedua isolat tersebut diuji morfologi dan aktivitas biokimia untuk mengetahui jenis bakteri tersebut. Hasil uji morfologi berdasarkan pewarnaan Gram pada kedua bakteri resisten merkuri yang diperiksa menggunakan mikroskop, menunjukkan sel berwarna merah untuk kode 1M1 sehingga dikategorikan bakteri Gram negatif, sedangkan kode 2M3 berwarna ungu sehingga
dikategorikan bakteri Gram positif. Menurut Purves & Sadava (2003), bakteri Gram positif adalah jenis bakteri dengan dinding peptidoglikan yang tebal, sementara bakteri Gram negatif adalah jenis bakteri dengan dinding peptidoglikan yang tipis (seperlima dari bakteri Gram positif). Perbedaan ketebalan dinding ini mengakibatkan perbedaan kemampuan afinitas dengan pewarna Gram. Dinding peptidoglikan memiliki afinitas yang kuat dengan pewarna Gram, sehingga bakteri dengan dinding peptidoglikan tebal akan mengikat pewarna Gram dengan kuat, sehingga disebut bakteri Gram positif. Sebaliknya, dinding peptidoglikan tipis pada bakteri Gram negatif tidak memiliki afinitas yang tinggi dengan pewarna Gram, sehingga disebut bakteri Gram negatif. Hasil pewarnaan Gram adalah bakteri Gram positif akan berwarna ungu gelap, sementara bakteri Gram negatif akan berwarna dadu atau merah.
Tabel 2 Uji morfologi bakteri resisten merkuri
Kode Isolat
Hasil Uji Morfologi Pewarnaan
Gram Bentuk Sel
1M Bakteri Gram
negatif
Batang pendek
2M Bakteri Gram
positif
Batang panjang
Uji biokimia yang dilakukan meliputi uji fermentasi karbohidrat, uji indol, uji produksi H2S, uji pembentukan sitrat, dan uji urease. Uji-uji ini dilakukan untuk mengidentifikasi bakteri dengan melihat reaksi positif atau negatif yang dihasilkan. Setelah diperoleh hasil reaksinya, kemudian hasil reaksi tersebuk akan dicocokan dengan sistem Bergey’s Manual of Determinative Bacteriology.
9
sederhana. Selain itu, metabolisme seringkali menghasilkan hasil sampingan yang dapat digunakan untuk identifikasi.
Uji aktivitas biokimia tersebut selain bertujuan untuk membantu mengidentifikasi dan mengkarakterisasi bakteri juga bertujuan untuk mengetahui ikatan karbon (C) dan nitrogen (N) pada bakteri dengan uji urease, asam amino yang ada di bakteri seperti uji indol, dan mengetahui sumber energi lain selain glukosa atau laktosa contohnya sitrat. Uji fermentasi karbohidrat dilakukan dengan menggunakan substrat glukosa, laktosa, manitol, maltosa, dan sukrosa. Fermentasi merupakan proses degradasi anaerob molekul gula (karbohidrat) atau nutrien lain untuk mendapatkan energi pada kondisi anaerob. Produk yang dihasilkan oleh fermentasi karbohidrat adalah alkohol dan
karbondioksida (CO2). Uji fermentasi
karbohidrat (Tabel 3) menunjukan bakteri resisten merkuri dengan kode 1M1 dan 2M3 mampu melakukan fermentasi karbohidrat dan
menghasilkan gas CO2 dengan substrat
glukosa, laktosa, manitol, maltosa, dan sukrosa, kecuali substrat laktosa bakteri kode 2M3 tidak mampu melakukan fermentasi kabohidrat dan menghasilkan gas CO2. Kemampuan bakteri resisten merkuri melakukan fermentasi karbohidrat ditandai dengan adanya produksi asam organik (asam asetat, asam laktat, asam formiat, dan asam suksinat) dan gas (karbondioksida dan hidrogen) (Cappucinno & Sherman 1983). Produksi asam organik menyebabkan pH media fermentasi menurun sehingga indikator yang terdapat pada media berubah dari merah menjadi kuning. Adanya gas CO2 ditunjukkan dengan terbentuknya gelembung pada tabung Durgham.
Uji aktivitas biokimia selanjutnya adalah uji indol. Uji pembentukan indol bakteri bertujuan untuk memeriksa kemampuan bakteri mendegradasi asam amino esensial triptofan (Cappuccino & Sherman 1983). Enzim yang berperan dalam proses ini adalah triptopanase. Produk metabolit triptopan adalah indol, asam piruvat, dan amonia. Keberadaan indol dideteksi dengan Kovac’s reagent yang menyebabkan terbentuknya warna merah. Warna merah terjadi karena terbentuknya komplek antara indol dan p-dimetilaminobenzaldehid dari Kovac’s reagent. Kedua isolat bakteri resisten merkuri (Tabel 3) menunjukkan hasil yang negatif dengan terbentuknya warna kuning, hal tersebut menunjukkan bahwa bakteri 1M1 dan
2M3 tidak mampu mendegradasi asam amino esensialtriptofan.
Medium TSIA (triple sugar iron agar) mengandung 3 macam gula, yaitu glukosa, laktosa, dan sukrosa, terdapat juga indikator fenol merah, serta FeSO4 untuk memperlihatkan pembentukan H2S yang ditunjukkan dengan adanya endapan hitam. Kemampuan bakteri menghasilkan H2S digunakan juga untuk melihat aktivitas biokimia bakteri resisten merkuri karena beberapa bakteri mampu mereduksi sulfur organik yang terdapat pada asam amino sistein (Cappuccino & Sherman 1983). Reaksi ini dibantu oleh enzim sistein desulferase. Berdasarkan uji produksi H2S (Tabel 3) diperoleh hasil negatif untuk kedua bakteri resisten merkuri yang ditandai dengan tidak terbentuknya endapan hitam, hal tersebut menunjukkan bakteri resisten merkuri tidak memiliki enzim sistein desulferase sehingga tidak mampu menghasilkan H2S.
Uji biokimia selanjutnya adalah uji pembentukan sitrat yang menunjukkan hasil positif (Tabel 3) ditandai dengan terbentuknya warna biru pada kedua isolat bakteri (Lampiran 8). Bakteri coliform dapat menggunakan sitrat sebagai sumber energi apabila tidak ada glukosa atau laktosa. Hal ini dapat terjadi jika bakteri coliform memiliki enzim sitrat permease (Cappuccino & Sherman 1983; Barnet & Venghaus 1989). Sitrat permease berperan dalam membawa sitrat dari luar sel ke dalam sel. Sitrat yang telah berada di dalam sel akan masuk ke dalam siklus Krebs. Pada siklus Krebs, sitrat akan diubah menjadi asam oksaloasetat dan asam asetat dengan bantuan enzim sitrase. Selanjutnya asam oksaloasetat dan asam asetat diubah menjadi asam piruvat dan karbondioksida. Karbondioksida bereaksi dengan air dan natrium yang terdapat pada
media Simmon’s citrate agar sehingga
membentuk natrium bikarbonat. Keberadaan natrium bikarbonat mengakibatkan media bersifat basa sehingga merubah warna indikator bromthymol blue dari hijau menjadi biru. Tes penggunaan sitrat positif ditandai dengan adanya enzim sitrat permease pada bakteri.
10
Tabel 3 Uji aktivitas biokimia
Kode Isolat
Hasil Uji Biokimia
Uji Fermentasi Karbohidrat Pembentukan
Indol
Produksi H2S
Penggunaan Sitrat Urease Glukosa Laktosa Manitol Maltosa Sukrosa
1M1 + + + + + - - + +
2M3 + - + + + - - + +
Keterangan: (+):hasil tes positif dan terbentuknya gas, (-):hasil tes negatif
Urease merupakan suatu enzim pemecah ikatan karbon dan nitrogen pada senyawa amida. Senyawa amida yang dapat digunakan untuk tes urease adalah urea (Cappucino & Sherman 1983; Barnett & Venghaus 1989). Urea dengan adanya enzim urease akan
diubah menjadi CO2 dan amoniak.
Keberadaan enzim dideteksi dengan perubahan warna media cair urea menjadi merah. Sehingga kedua bakteri resisten merkuri memiliki enzim urease.
Identifikasi genus dari kedua bakteri
resisten merkuri dilakukan dengan cara mencocokkan hasil uji morfologi dan uji aktivitas biokimia yang terdapat pada Bergey’s Manual of Determinative Bacteriology. Hasil identifikasi kedua bakteri resisten merkuri menunjukkan bahwa bakteri dengan kode 1M1 diduga adalah bakteri jenis Enterobacter, sedangkan bakteri dengan kode 2M3 diduga adalah jenis bakteri Bacillus sp.
.
(a) (b)
Gambar 4 Hasil pewarnaan Gram (a) bakteri Gram negatif kode 1M1 (b) bakteri Gram positif kode 2M3.
Berdasarkan penelitian Nofiani & Gusrizal (2004), jenis Enterobacter yang ditemukan resisten terhadap merkuri adalah Enterobacter hafniae dan Enterobacter cloacae. Jenis bakteri 2M3 ini dapat teridentifikasi atau diduga Bacillus sp. karena memiliki beberapa ciri yang menunjukkan bahwa bakteri kode
2M3 merupakan Bacillus sp. khususnya
Bacillus subtilis. Hal tersebut dilihat Dari morfologinya ketika dilihat menggunakan mikroskop (Gambar 4) dan bakteri tersebut tahan panas pada suhu sampai 80oC. Ciri Bacillus subtilis menurut Purve & Sadava (2003) adalah bakteri yang umum diitemukan di tanah. Bacillus subtilis tidak tergolong
bakteri patogen bagi manusia. Bakteri ini memiliki flagella sehingga dapat bergerak cepat untuk ukuran bakteri. Bacillus subtilis juga umum digunakan sebagai organisme model dalam mikrobiologi, terutama untuk model studi bakteri Gram positif. Bacillus subtilis memiliki karakteristik Gram positif, oleh karena itu tampak berwarna ungu kebiruan setelah dilakukan uji dengan
pewarnaan Gram dan B. subtilis tampak
memiliki bentuk batang panjang (Tabel 1), dapat soliter ataupun membentuk koloni bergandengan yang memanjang.
Resistensi Antibiotik Bakteri Resisten Merkuri
Uji resisten adalah suatu pengujian kepekaan bakteri terhadap antibiotik. Tujuan pengujian resistensi antibiotik adalah untuk mengetahui bahwa bakteri resisten merkuri yang diperoleh mudah pengendaliannya dan menunjukkan bahwa bakteri Gram negatif lebih resisten terhadap obat-obatan dibandingkan dengan bakteri Gram positif. Telah diketahui bahwa antibiotik merupakan obat yang cukup representatif untuk
membunuh bakteri.
Pada umumnya suatu
jenis antibiotik mempunyai spesifikasi dalam menghambat atau membunuh suatu mikroba atau bakteri, terdapat antibiotik yang resisten terhadap bakteri tertentu. Untuk mengetahui bakteri-bakteri yang resisten terhadap antibiotik, maka uji resisten ini dilakukan. Menurut Nikaido (1996) dan Hernandez et al. (1998), bakteri Gram negatif lebih resisten terhadap obat-obatan dibandingkan dengan bakteri Gram positif. Karena bakteri Gram negatif mempunyai sistem effluks aktif untuk obat-obatan, yaitu sistem yang dapat memompa keluar beberapa jenis obat-obatan,
kation divalent atau nodulation signal
11
Hasil uji resistensi antibiotik dengan dua jenis media seleksi yang mengandung antibiotik dan media seleksi yang mengandung antibiotik dan HgCl2 menunjukkan tidak ada perbedaan (Tabel 4). Contohnya strain bakteri yang resisten terhadap ampisilin dalam media seleksi yang mengandung ampisilin menunjukkan resisten ampisilin juga terhadap media seleksi yang mengandung 1 µg/mL dan ampisilin. Hasil uji menunjukkan 1 isolat resisten ampisilin, 2 isolat resisten terhadap tetrasiklin, 1 isolat resisten kloramfenikol, dan 1 isolat sensitif terhadap rifampisin. Kedua isolat memiliki resistensi berbeda terhadap antibiotik resistensi yang berbeda terhadap antibiotik ampisilin, rimfapisin, dan kloramfenikol. Hal tersebut dimungkinkan adanya perbedaan jenis plasmid yang masuk ke dalam sel. Perbedaan jenis plasmid yang masuk biasanya ditandai dengan adanya penanda antibiotik (Nofiani & Gusrizal 2004). Hasil uji resistensi antibiotik menunjukkan bahwa bakteri Gram negatif lebih resisten terhadap obat-obatan dibandingkan dengan bakteri Gram positif.
Tabel 4 Hasil uji resistensi antibiotik
Resistensi Strain
1M1 2M3
Amp + -
Tetra + +
Rif + -
Chlo + -
HgCl2 + Amp + -
HgCl2 +Tetra + +
HgCl2 +Rif + -
HgCl2 +Chlo + -
Keterangan: Amp: ampisilin, Tetra: tetrasiklin, Rif: Rifampisin, Chlo: kloramfenikol. +: resisten terhadap antibiotik, -: sensitif terhadap antibiotik
Pengujian Bakteri sebagai Agen
Bioremediasi
Bioremediasi sebenarnya telah dikembangkan dan diuji coba di berbagai negara sejak tahun 1980-an, khususnya di Amerika Serikat. Di Indonesia, aplikasi bioremediasi masih dalam tahap pengembangan yang menggunakan agen bioremediasi tumbuhan. Saat ini diperkenalkan teknologi bioremediasi kearah metil merkuri agen bakteri merB pada active site bersandikan Eschericia coli (R831b), yang dapat mendegradasi metil merkuri dari senyawa berbahaya menjadi senyawa yang tidak berbahaya (Warouw 2008).
Proses pengujian bakteri sebagai bioremediasi dilakukan dengan menumbuhkan
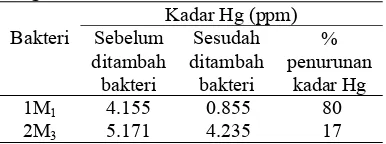
bakteri pada media yang mengandung HgCl2 selama 3 hari. Pengujian ini dilakukan untuk mengetahui bakteri yang bisa menurunkan kadar HgCl2. Hasil pengujian penurunan kadar Hg pada media yang telah diberi bakteri
kode 1M1 (Enterobacter sp.) dan 2M3
(Bacillus sp.) menunjukkan (Tabel 5) bahwa penurunan konsentrasi Hg pada media yang
ditambahkan Enterobacter sp.
memperlihatkan penurunan Hg yang tinggi yaitu sebesar 3.3 ppm, sedangkan media yang ditambahkan bakteri yang diduga Bacillus sp. menunjukan penurunan Hg yang kecil yaitu sebesar 0.9 ppm. Hal tersebut menunjukkan bahwa bakteri dengan kode 1M1 atau yang diduga Enterobacter sp. mampu melakukan penurunan yang tinggi hampir 80% kadar Hg didalam media. Sedangkan bakteri 2M3 yang diduga Bacillus sp. menunjukkan penurunan yang sedikit sebesar 17%, tetapi bakteri inlah yang akan digunakan sebagai agen bioremediasi karena bakteri tersebut hanya resisten pada beberapa jenis antibiotik (Tabel 4) sehingga mudah pengendaliannya apabila mencemari makhluk hidup sekitarnya khususnya manusia.
Tabel 5 Pengujian penurunan kadar Hg dengan isolat bakteri
Bakteri
Kadar Hg (ppm) Sebelum ditambah bakteri Sesudah ditambah bakteri % penurunan kadar Hg
1M1 4.155 0.855 80
2M3 5.171 4.235 17
SIMPULAN DAN SARAN
Simpulan
Kandungan merkuri di daerah pembuangan limbah pertambangan PT. ANTAM diperoleh kadar merkuri sebesar 0.030 ppm untuk jarak 0 meter (M), 0.017 ppm pada jarak (1M), dan 0.010 ppm pada jarak 200 meter (2M). Berdasarkan hasil uji morfologi dan uji aktivitas biokimia, bakteri resisten merkuri yang diperoleh adalah jenis Enterobacter sp. dan Bacillus sp. Hasil uji resistensi antibiotik menunjukkan Enterobacter sp. resisten antibiotik ampisilin, tertrasiklin, kloramfenikol, dan rimfapisin.
Sedangkan Bacillus sp. hanya resisten
12
Saran
Penelitian ini menyarankan bakteri dengan kode 2M3 atau yang diduga Bacillus sp. yang digunakan sebagai agen bioremediasi karena bakteri tersebut hanya resisten terhadap antibiotik tetrasiklin sehingga tidak begitu berbahaya bagi masyarakat sekitar walaupun hanya mampu melakukan penurunan Hg lebih sedikit dari Enterobacter sp. Sedangkan, bakteri Enterobacter sp. berbahaya karena resisten terhadap semua antibiotik walaupun menurunkan kadar Hg dalam jumlah besar. Perlu dilakukan penelitian lebih lanjut utuk mengidentifikasi bakteri resisten merkuri yang diperoleh hingga tahap spesies.
DAFTAR PUSTAKA
Ahmad I, Hayat S, Ahmad A, Inam A, Samiullah. 2005. Effect of heavy metal on survival of certain groups of indigenous soil microbial population. J Appl Sci Environ Mgt 9:115-121.
Alfian Z. 2001. Analisis Unsur Toksin Kadmium Menggunakan Metode Tabung pada Spektrofotometer Serapan Atom (SSA). Majalah Akademika: 4-8.
Ausubel F, Brent R, Kingston RE, Moore, DD, Seidman JG, Sith JA, Struhl K. 1995. Short Protocols in Molecular Biology. New York: John Wiley.
Barkay T, Miller SM. 2003. Bacterial mercury resistance from atoms to ecosystems. FEMS Microbiology Reviews 27:355-384.
Barkay T, Turner RR, vanden Brook A, Liebert C . 1991. The relationship of Hg(II) volatilization from a freshwater pond to the abundance of mer genes in the gene pool of the indigenous microbial community. Microb.Ecol 21:151-161.
Barnet ME, Venghaus JD. 1989. Microbiology Laboratory Exercise. Lowa: Brown Publisher.
Basset J, Denney RC, Jeffery GH, Mendham J. 1994. Buku Ajar Vogel Kimia Analisis Kuantitatif Anorganik. Jakarta: EGC.
Benyehuda G, Coombs J, Ward PL, Balkwill D, Barkay J. 2003. Metal resistance among aerobic chemoheterotrophic bacteria from
the deep terrestrial subsurface. Can J Microbial 49:151-156.
Blake RC, DM Choate, Bardhan S, Revis N, Barton LL, Zocco BG. 1993. Chemical transformation of toxic metals by Pseudomonas strain from a toxic water site. Environ Toxic Chem 12:1365-1376.
Braun RD. 1982. Introduction To Chemical Analysis. New York: Mc Graw – Hill Book Company.
Canstein HV, Li Y, Leonhauser J, Haase E, Felske , Deckwer WD, Dobler IW. 2002. Spatially oscillating activity and microbial succession of mercury-reducing biofilms in a technical-scale bioremediation system. Appl. Environ. Microbiol 68: 1938-1946.
Cappuccino JG, Sherman N. 1983. Microbiology: A Laboratory Manual. California: Addison-Wesley.
Christian GD, Feldeman FJ. 1970. Atomic Absorption Spectroscopy Application in Agriculture. Biology and Medicine Inc :360.
Collins CH, Lyne PM. 1985. Microbiological Methods. London: Butterworth & Co.
Dobler IW. 2003. Pilot plant for bioremediation of mercury-containing
industrial wastewater. Appl Microbial
Biotechnol 62:124-133.
Elberger ST, Brody GM. 1993. Cadmium,
Mercury, and Arsenic, in: Viccellio P, (Editor). Handbook of Medical Toxicology. Boston.Little Brown and Co.
Ellenhorn MJ, Schonwald S, Ordog G, Wasserberger J.1997. Ellenhorn’s Medical Toxicology Diagnosis & Treatment of Human Poisoning.Baltimore.Williams & Wilkins.
Fardiaz S. 1993. Analisis Mikrobiologi Pangan. Jakarta: Raja Grafindo Persada.
Giller KE, Witter E, McGrath SP. 1998. Toxicity of heavy metals ti microorganisms and microbial processes in agricultural soils [a review]. Soil Biol Biochem 30:1389-1414.
13
regulation of mercury biogeochemical cycling. Environ.Technol. Lett 9: 957-964.
Gunalan. 1998. Penerapan Bioremediasi pada Pengolahan Limbah Pemulihan Lingkungan Tercemar Polutan Hidrokarbon Petrolium [tesis]. Sumatera Selatan: Fakultas Pertanian UNSRI.
Harley dan Presscot. 2002. Laboratory
Exercise in Microbiology. New York : McGraw-Hill Publisher.
Hernandez A, Mellado RP. & Martinez, JL. 1998. Metal accumulation and vanadium-induced multidrug resistance by environmental isolates of Escherichia hermanii and Enterobacter cloacae. Appl. Environ. Microbiol 64:4317-4320.
Khopkar SM. 1990. Konsep Dasar Kimia
Analitik. Jakarta: UI Press.
Lasut MT. 2002. ‘Metallothionein’:Suatu parameter Kunci yang Penting dalam PenetapanBaku Mutu Air Laut (BMAL) Indonesia. EKOTON 2 1:61-68.
Liebert CA, Hall RM. & Summers AO. 1999. Transposon Tn21, flagship of the floating genome. Microbiol.Mol. Biol.Rev 63:507-522.
Mullen MD. 1998. Transformations on other elements. In: DM Sylvia, JJ Fuhrmann, PE Hartel, DA Zuberer, editor. Principles and Applications of Soil Microbiology. New Jersey: Upper Saddle River.
Nikaido H. 1996. Multidrug efflux pumps of
gram-negative bacteria. J. Bacteriol
178:5853-5859.
Nascimento AMA, Chartone-Souza E. 2003. Operon mer: Bacterial resistance to mercury and potential for bioremediation of contaminated environments. Genet Mol Res 2:92-101.
Nofiani, Gusrizal. 2004. Bakteri Resisten Merkuri Spektrum Sempit dari Daerah Bekas Penambangan Emas Tanpa Izin (PETI) Mandor, Kalimantan Barat. Jurnal Natur Indonesia 6: 67-74
Park CH, Keyhan M, Matin A. 1999. Purification and characterization of
chromate reductase in Pseudomonas
putida. Abs Gen Meet American Soc Microbial 99:536-540
Pelczar MJ, Chan ECS. 1986. Dasar-Dasar Mikrobiologi 1. Hadioetomo RS, Imas T, Tjitrosomo SS, Angka SL, penterjemah; Jakarta UI Pr. Terjemahan dari: Elements of Microbiology.
Purves B, Sadava D. 2003. Life The Science of Biology 7th Edition. New York : Sinauer Associates Inc.
Roger AR, Lawrence HK. 1984. Water
Analysis: Inorganic Spesies 2nd Ed. Orlando Florida: Academic Press.
Silver S, Phung LT. 1996. Bacterial heavy metal resistance:new suprises. Annu. Rev. Microbiol 50:753-789.
Singleton dan Sainsbury. 2006. Dictionary of Microbiology and Molecular Biology 3rd Edition. England : Sussex.
Smith E, Wolters A, Elsas JDV. 1998. Self-transmissible mercury resistance plamids with gene mobilizing capacity in soil bacterial populations: influence of wheat roots and mercury addition. Appl. Environ. Microbiol. 64: 1210-1219.
Skladany JG, Metting Jr. 1992. Bioremediation of contaminated soil. In: Metting Jr. (Ed.) Soil Microbial Ecology: Applications in Agricultural and Environmental Management. Marcel Dekker, New York. pp: 483–513.
Turco RF, Sadowsky M. 1995. The Microflora of Bioremediation p:87-89. In: Skipper HD and R.F Turc (eds). Bioremediation Science and Aplication. America.
Warouw ZMW. 2008. Bioremediation Technology as Cleaner of Area Polluted
By Methyl Mercury. Jurnal FORMAS
1:284-291
Widyawati E. 2006. Bioremediasi Tanah
Bekas Tambang Batubara dengan Sludge
14
LAMPIRAN
15
Lampiran 1 Alur penelitian
uji
fermentasi
karbohidrat
uji
pembentukan
indol
uji
produksi
H
2S
uji
penggunaan
sitrat
uji
urease
uji
pewarnaan
gram
Bakteri terpilih
Kultivasi bakteri
Pengujian bakteri sebagai
bioremediasi
Identifikasi bakteri yang diperoleh
dengan beberapa uji
Pengambilan sampel bakteri dari
daerah tercemar
16
Lampiran 2 Hasil Analisis Kadar Hg pada Sampel Tanah di PT. ANTAM
Jarak Hasil
(ppm)
Rata-rata
0 meter (M)
0.037
0.030
0.029
0.025
100 meter (M
1)
0.020
0.017
0.014
0.016
200 meter (M
2)
0.014
0.010
0.009
0.008
Lampiran 3 Gambar hasil isolasi bakteri awal
(a) (b) (c)
(d) (e) (f)
Keterangan : (a) dan (b) sampel dari jarak 0 meter, (c) sampel dari jarak 100
meter, (d), (e), dan (f) sampel dari jarak 200 meter
17
Lanjutan
(a) (b) (c)
(d) (e) (f)
(g)
18
Lampiran 4 Bakteri murni
Lampiran 5 Bakteri yang tumbuh pada media yang mengandung HgCl
2(a)
(b)
Keterangan: Bakteri yang tumbuh pada media padat yang dicampur HgCl
21
µL/mg : (a) bakteri 1M (b) bakteri 2M
Lampiran 6 Uji pewarnaan Gram bakteri resisten merkuri (uji morfologi)
(a)
(b)
Keterangan : (a) bakteri 1M
1Gram negatif (merah), (b) bakteri 2M
3Gram positif
19
Lampiran 7 Uji aktivitas biokimia (uji fermentasi)
Sebelum inkubasi
Sesudah inkubasi dan telah diberi bakteri resisten merkuri (terjadi perubahan
warna)
(a)
(b) (c)
(e) (f)
Keterangan: Perubahan warna media setelah dimasukkan bakteri dan diinkubasi
pada beberapa media yang diberi substrat karbohidrat. Substrat karbohidrat yang
digunakan: (a) glukosa (b)laktosa (c) sukrosa (d) maltosa (e) manitol.
Keterangan: media uji fermentasi yang
berisi substrat karbohidrat. Media
tersebut sebelum di masukkan bakteri
resisten merkuri dan sebelum inkubasi.
2M3 1M1
1M1 2M3
1M1 2M2
1M1
2M3
1M1 2M3
20
Lampiran 8 Uji aktivitas biokimia
Uji aktivitas biokimia
Sebelum uji
Sesudah uji
Tes Indol
Tes produksi H
2S
Tes penggunaan Sitrat
21
Lampiran 9 Uji resisten antibiotik
resistensi ampisilin
resistensi HgCl
2+ ampisilin
resistensi tetrasiklin
resistensi HgCl
2+ tetrasiklin
resistensi rifampicin
resistensi HgCl
2+ rifampicin
22
Lampiran 10 Kurva pertumbuhan bakteri
Keterangan: bulat merah adalah fase stasioner pertumbuhan bakteri
Lampiran 11 Gambar uji suhu untuk
Bacillus
sp.
Keterangan: tumbuh pada suhu 70
oC-80
oC
0 0.2 0.4 0.6 0.8 1 1.2 1.4 1.6 1.8
0 20 40 60 80 100 120
absorban
(A)