PENGARUH HORMON TESTOSTERON UNDEKANOAT (TU) DAN MEDROKSIPROGESTERON ASETAT (MPA) TERHADAP KONSENTRASI SPERMATOZOA DAN SPERMATOGENESIS TIKUS
JANTAN (Rattus novergicus L.) GALUR SPRAGUE DAWLEY
SKRIPSI
Diajukan Sebagai Syarat Guna Memperoleh Gelar Sarjana Farmasi (S.Far)
Oleh :
LANDUNG HARI SUTRISNO NIM : 106102003411
PROGRAM STUDI FARMASI
FAKULTAS KEDOKTERAN & ILMU KESEHATAN
UNIVERSITAS ISLAM NEGERI (UIN) SYARIF HIDAYATULLAH JAKARTA
LEMBAR PERSETUJUAN SKRIPSI
NAMA : LANDUNG HARI SUTRISNO
NIM : 106102003411
JUDUL : PENGARUH HORMON TESTOSTERON UNDEKANOAT
(TU) DAN MEDROKSIPROGESTERON ASETAT (MPA)
TERHADAP KONSENTRASI SPERMATOZOA DAN
SPERMATOGENESIS TIKUS JANTAN (Rattus novergicus L) GALUR SPRAGUE DAWLEY
Disetujui oleh:
Pembimbing I
Azrifitria, M.Si, Apt NIP. 197211272005012004
Pembimbing II
Rr. Ayu Fitri Hapsari, M.Biomed NIP. 197204062003121001
Mengetahui,
Ketua Program Studi Farmasi FKIK UIN Syarif Hidayatullah Jakarta
LEMBAR PENGESAHAN SKRIPSI Skripsi dengan judul
PENGARUH HORMON TESTOSTERON UNDEKANOAT (TU) DAN MEDROKSIPROGESTERON ASETAT (MPA) TERHADAP KONSENTRASI SPERMATOZOA DAN SPERMATOGENESIS TIKUS
JANTAN (Rattus novergicus L) GALUR SPRAGUE DAWLEY Telah disetujui, diperiksa dan dipertahankan dihadapan tim penguji oleh
Landung Hari Sutrisno NIM: 106102003411
Menyetujui,
Pembimbing:
1. Pembimbing I Azrifitria, M.Si, Apt. ... 2. Pembimbing II Rr. Ayu Fitri Hapsari, M.Biomed ...
Penguji:
1. Ketua Penguji Drs. M. Yanis Musdja, M.Sc, Apt. ... 2. Anggota Penguji I Drs. M. Yanis Musdja, M.Sc, Apt. ... 3. Anggota Penguji II Nurmeilis, M.Si, Apt. ... 4. Anggota Penguji III Eka Putri, M.Si, Apt. ...
Mengetahui,
Dekan Fakultas Kedokteran Dan Ilmu Kesehatan UIN Syarif Hidayatullah Jakarta
LEMBAR PERNYATAAN
DENGAN INI SAYA MENYATAKAN BAHWA SKRIPSI INI BENAR-BENAR HASIL KARYA SENDIRI YANG BELUM PERNAH DIAJUKAN SEBAGAI SKRIPSI ATAU KARYA ILMIAH PADA PERGURUAN TINGGI ATAU LEMBAGA LAIN.
Jakarta, September 2010
ABSTRAK
Judul : Pengaruh Hormon Testosteron Undekanoat (TU) Dan Medroksiprogesteron Asetat (MPA) Terhadap Konsentrasi Spermatozoa dan Histologi Spermatogenesis Tikus Jantan (Rattus Novergicus L) Galur Sprague Dawley
Testosteron Undekanoat (TU) dan Medroksiprogesteron Asetat (MPA) merupakan hormon kontrasepsi pria yang sedang dikembangkan. Tujuan penelitian adalah untuk mengetahui penyuntikan formulasi tunggal (TU+MPA) dan formulasi kombinasi (mikroemulsi (TU/MPA) dan kosolven (TU/MPA)) yang paling efektif dalam menekan spermatogenesis hingga azoospermia. Penelitian dilakukan dengan penyuntikan formulasi tunggal (TU 2,5mg + MPA 1,25mg, TU 5mg + MPA 0,75mg, TU 5mg + MPA 1,125mg) dan formulasi kombinasi (mikroemulsi TU 2,5mg/MPA 1,25mg, mikroemulsi TU 5mg/MPA 0,75mg, mikroemulsi TU 5mg/MPA 1,125mg, kosolven TU 2,5mg/MPA 1,25mg) pada tikus jantan (Rattus novergicus L) galur Sprague Dawley yang dibagi menjadi 8 kelompok selama tiga bulan. Penyuntikan dilakukan sebanyak dua kali pada minggu ke-0 dan minggu ke-8, kemudian dibedah minggu ke-12. Berdasarkan analisa data, menunjukkan bahwa berat badan kelompok formulasi tunggal dan formulasi kombinasi tidak terdapat perbedaan bermakna (p ≥ 0,05) dengan kontrol normal. Hasil analisa data konsentrasi spermatozoa, baik formulasi tunggal, formulasi kombinasi dan kontrol normal memperlihatkan perbedaan bermakna (p ≤ 0,05), dimana formulasi tunggal (TU 5mg + MPA 1,125mg) dan formulasi kombinasi (mikroemulsi TU 2,5mg/MPA 1,25mg) paling baik menekan konsentrasi spermatozoa hingga mencapai oligozoospermia berat (rata-rata konsentrasi spermatozoa 1 juta/ml). Hasil analisa data penilaian histologi spermatogenesis menunjukkan perbedaan bermakna (p ≤
0,05) antara formulasi tunggal, formulasi kombinasi dan kontrol normal. Formulasi tunggal (TU 5mg + MPA 1,125mg) dan formulasi kombinasi (mikroemulsi TU 2,5mg/MPA 1,25mg) paling berpengaruh terhadap perkembangan spermatogenesis dimana banyak sel spermatogenik yang tidak berkembang.
ABSTRACT
Title : Effect of Hormone Testosterone Undecanoate (TU) and Medroxyprogesterone Acetate (MPA) concentrations on Spermatozoa and spermatogenesis Histology Male Rats (Rattus Novergicus L) strain of Sprague Dawley
Testosterone Undekanoat (TU) and Medroxyprogesterone Acetate (MPA) is a hormonal male contraceptive is being developed. The purpose of this study is to find a single injection of formulations (TU+MPA), combination formulations (microemulsions (TU/MPA) and kosolven (TU/MPA)) are most effective in suppressing spermatogenesis to azoospermia. This research carried out by injecting a single formulation (TU 2,5mg + MPA 1,25mg, TU 5mg + MPA 0,75mg, TU 5mg + MPA 1,125mg) and combination formulations (microemulsions TU 2,5 mg/MPA 1,25 mg, microemulsion TU 5mg/MPA 0,75mg, microemulsion TU 5mg/MPA 1,125 mg, kosolven TU 2.5 mg/MPA 1.25 mg) in male rats (Rattus novergicus L) Sprague Dawley strain were divided into 8 groups for three months. Injecting done twice at week 0 and week 8, then dissected the 12th week. Based on data analysis, showed that the weight loss group single formulation and formulation combinations there were no significant differences (p
≥ 0.05) with normal controls. Results of data analysis the concentration of spermatozoa, either a single formulation, formulation combination and normal controls showed significant differences (p≤ 0.05), where a
single formulation (TU 5mg + MPA 1,125mg) and formulations combination (microemulsion TU 2,5 mg/MPA 1,25 mg) best reduce the concentration of spermatozoa to reach severe oligozoospermia (mean sperm concentration of 1 million/ml). Results Histological assessment of spermatogenesis data analysis shows significant differences (p ≤ 0.05) between single formulation, formulation and
combination of normal controls. Single formulation (TU 5mg + MPA 1,125mg) and combination formulations (microemulsions TU 2,5mg/MPA 1,25 mg), the most influential on the development of spermatogenesis in which many cells that are not developing spermatogenic.
KATA PENGANTAR
Alhamdulillah, puji dan syukur kehadirat Allah SWT yang telah melimpahkan rahmat dan karunia-Nya serta shalawat dan salam selalu tercurah kepada junjungan kita Nabi Muhammad SAW karena dengan segala rahmat dan karunia-Nya penulis dapat menyelesaikan penelitian dan penulisan skripsi dengan judul “Pengaruh Hormon Testosteron Undekanoat (TU) dan Medroksiprogesteron Asetat (MPA) Terhadap Konsentrasi Spermatozoa dan Spermatogenesis Tikus Jantan (Rattus novergicus L.) Galur Sprague Dawley”. Skripsi ini disusun untuk memenuhi tugas akhir sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi pada Fakultas Kedokteran dan Ilmu Kesehatan Program Studi Farmasi UIN Syarif Hidayatullah, Jakarta.
Pada kesempatan ini perkenankanlah penulis menyampaikan ucapan terima kasih yang sebesar-besarnya kepada:
1. Bapak Prof. DR. (hc). dr. M.K. Tadjudin Sp. And, selaku Dekan Fakultas Kedokteran dan Ilmu Kesehatan UIN Syarif Hidayatullah Jakarta.
2. Bapak. Drs. M. Yanis Musdja M.Sc, Apt, selaku Ketua Program Studi Farmasi.
3. Azrifitria, M.Si, Apt, selaku pembimbing I yang telah memberikan ilmu dan bimbingan selama penulisan skripsi ini.
4. Rr. Ayu Fitri Hapsari, M.Biomed, selaku pembimbing II yang telah memberikan ilmu dan bimbingan selama penulisan skripsi ini.
6. Bapak dan Ibu dosen yang telah memberikan ilmu dan pengetahuan hingga
8. Para karyawan program studi farmasi, Mas Opik, Mas Toni yang telah banyak membantu selama penelitian.
9. Kepada sahabat sepenelitian Indira Irma Anggraeni dan Rico, terima kasih atas bantuan, motivasi dan kebersamaannya selama penelitian.
10.Rista Prihatini dan Silma Awalia yang telah menjadi pembimbing III hingga penulis dapat dengan baik menyelesaikan skripsi ini.
11.Nadia Kristina, Zuliana Mufarihah, Suny Koswara, Laili Latifah untuk kebersamaan, dukungan, motivasi, semangat serta bantuannya selama penelitian.
12.Sebelas pejuang (Amalia, Sheila, Elli, Ardian, Irma, Tiwi, Hilda, Yayah, Rico, Lisna dan penulis) atas perjuangan dan keyakinan sehingga dapat sidang dan wisuda tepat waktu.
13.Serta semua pihak yang tidak dapat disebutkan satu persatu yang turut membantu menyelesaikan skripsi ini.
Penulis menyadari bahwa penyusunan skripsi ini masih belum sempurna. Oleh karena itu kritik dan saran yang bersifat membangun sangat penulis harapkan guna tercapainya kesempurnaan skripsi ini.
Akhirnya, dengan segala kerendahan hati, penulis berharap semoga hasil penelitian ini dapat bermanfaat baik bagi kalangan akademis, khususnya bagi mahasiswa farmasi, masyarakat pada umumnya dan bagi dunia ilmu pengetahuan.
DAFTAR ISI
2.5 Peranan Hormon Pada Spermatogenesis ... 18
2.6 Testosteron Undekanoat ... 21
2.7 Medroksiprogesteron Asetat ... 22
BAB III KERANGKA KONSEP ... 25
BAB IV METODOLOGI PENELITIAN ... 26
4.1 Lokasi dan Waktu Penelitian ... 26
4.2.1 Alat ... 26
4.2.2 Bahan ... 26
4.3 Prosedur Penelitian ... 27
4.4 Perlakuan Hewan Percobaan ... 28
4.4.1 Hewan Perlakuan ... 28
4.4.2 Cara dan Dosis Perlakuan ... 29
4.4.3 Pembuatan Preparasi ... 29
4.4.4 Pengukuran Konsentrasi Spermatozoa ... 31
4.4.5 Pengukuran Histologi Spermatogenesis ... 33
4.5 Analisa Data ... 34
BAB V HASIL DAN PEMBAHASAN ... 35
5.1 Hasil Penelitian ... 35
5.1.1 Hasil Pengukuran Berat Badan Tikus ... 35
5.1.2 Pengukuran Konsentrasi Spermatozoa ... 37
5.1.3 Pengukuran/Penilaian Histologi Spermatogenesis ... 39
5.2 Pembahasan ... 41
BAB VI KESIMPULAN DAN SARAN ... 49
6.1 Kesimpulan ... 49
6.2 Saran ... 50
DAFTAR PUSTAKA ... 51
DAFTAR GAMBAR
Gambar Halaman
1. Anatomi sistem reproduksi tikus jantan ... 6
2. Testis dan spermatogenesis dalam tubulus seminiferus ... 8
3. Tahapan pembentukan spermatogenesis ... 12
4. Tahapan perkembangan sel spermatogenik dalam tubulus seminiferus ... 17
5. Mekanisme pengaturan hormon spermatogenesis ... 19
6. Rumus bangun Testosteron Undekanoat ... 21
7. Rumus bangun Medroksiprogesteron Asetat ... 23
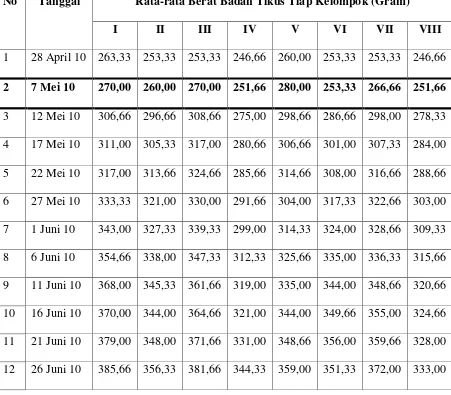
8. Grafik rata-rata berat badan tikus tiap kelompok ... 36
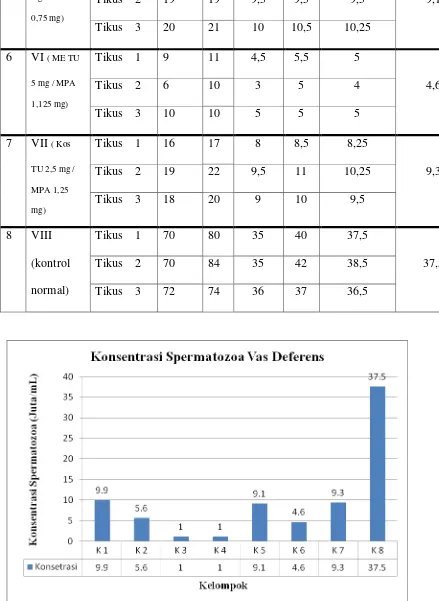
9. Grafik konsentrasi spermatozoa vas deferens setelah perlakuan ... 38
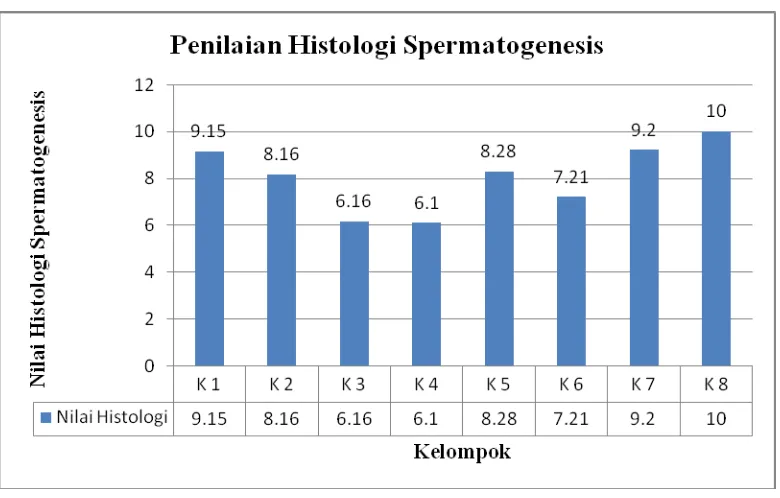
10.Grafik penilaian histologi spermatogenesis ... 40
11.Nebido ... 58
17.Kamar hitung hemasitometer ... 59
18.Mikroskop cahaya ... 59
19.Penimbangan tikus ... 60
20.Pengambilan Depo Progestin ... 60
21.Pengambilan Nebido ... 60
22.Pengambilan mikroemulsi ... 60
23.Penyuntikan TU dan MPA ... 60
24.Pembiusan tikus ... 60
25.Persiapan hewan yang akan dibedah ... 61
26.Pembedahan ... 61
27.Pengambilan jaringan/organ ... 61
28.Testis dan vas deferens ... 61
29.Vas deferens ... 61
30.Testis ... 61
31.Penampungan spermatozoa ... 62
32.Pengawetan testis ... 62
33.Pengambilan larutan george ... 62
34.Pengenceran spermatozoa dengan larutan george ... 62
35.Spermatozoa pada kamar hemasitometer ... 62
DAFTAR TABEL
Tabel Halaman
1. Rancangan Percobaan ... 27
2. Pengenceran yang Dilakukan dan Kotak yang Dihitung ... 31
3. Cara Pengenceran ... 31
4. Rumus Konsentrasi Spermatozoa ... 32
5. Nilai Histologi Spermatogenik ... 33
6. Rata-rata Berat Badan Tikus Tiap Kelompok ... 35
7. Konsentrasi Spermatozoa Vas Deferens Setelah Perlakuan ... 37
8. Pengukuran/Penilaian Histologi Spermatogenesis ... 39
9. Dosis TU dan MPA pada Manusia ... 63
10.Dosis TU dan MPA pada hewan percobaan (Tikus) ... 65
11.Berat Badan Tikus Tiap Kelompok ... 85
12.Hasil uji Normalitas Berat Badan Tikus Jantan ... 96
13.Hasil uji Homogenitas Berat Badan ... 98
14.Hasil uji Kruskall Wallis Berat Badan Tikus Jantan ... 99
15.Hasil uji LSD Berat Badan Tikus Jantan ... 100
16.Hasil uji normalitas konsentrasi spermatozoa ... 135
17.Hasil uji Homogenitas Konsentrasi Spermatozoa ... 136
18.Hasil uji Kruskall Wallis Konsentrasi Spermatozoa ... 137
19.Hasil uji LSD Konsentrasi Spermatozoa ... 137
20.Hasil uji Normalitas Histologi Spermatogenesis ... 140
21.Hasil uji Homogenitas Histologi Spermatogenesis ... 141
22.Hasil uji LSD Histologi Spermatogenesis ... 142
DAFTAR LAMPIRAN
Lampiran Halaman
1. Surat Keterangan Hewan Uji ... 56
2. Sertifikat Bahan Uji Medroksiprogestin Asetat (MPA) ... 57
3. Bahan dan Alat Penelitian ... 58
4. Kegiatan Penelitian ... 60
5. Perhitungan Dosis ... 63
6. Perhitungan Penyuntikan pada Hewan Percobaan ... 67
7. Skema Kerja Pembuatan Preparasi ... 76
8. Perhitungan Konsentrasi Spermatozoa Vas Deferens ... 78
9. Berat Badan Tikus Jantan ... 85
10.Spermatozoa pada Kamar Hitung Hemasitometer ... 87
11.Histologi Spermatogenesis ... 92
12.Uji Normalitas Terhadap Berat Badan Tikus Jantan ... 96
13.Uji Homogenitas Terhadap Berat Badan Tikus Jantan ... 98
14.Uji Kruskal Wallis dan Uji LSD Terhadap Berat Badan Tikus Jantan... 99
15.Uji Normalitas Konsentrasi Spermatozoa ... 135
16.Uji Homogenitas Konsentrasi Spermatozoa ... 136
17.Uji Kruskal Wallis dan Uji LSD Terhadap Konsentrasi Spermatozoa ... 137
18.Uji Normalitas Histologi Spermatogenesis ... 140
19.Uji Homogenitas Histologi Spermatogenesis ... 141
BAB I PENDAHULUAN
1.1 Latar Belakang
Alat kontrasepsi pria yang pertama kali dikembangkan adalah alat kontrasepsi yang dapat mencegah spermatozoa bertemu dengan ovum. Keadaan tersebut dapat dilakukan dengan cara mekanis, yaitu dengan pemakaian kondom atau vasektomi. Kontrasepsi dengan menggunakan kondom dan teknik vasektomi ditemukan banyak kekurangannya sehingga saat ini dikembangkan metode kontrasepsi hormonal pria (Reddy, 2000). Telah dilakukan penelitian yang menjelaskan metode kontrasepsi pria dapat dilakukan dengan cara pemberian hormon, dimana proses spermatogenesis dikendalikan melalui hipotalamus-hipofisis-testis (Moeloek, 1991). Tujuan utama kontrasepsi hormonal pada pria adalah untuk menekan spermatogenesis sampai tercapai kondisi azoospermia yang bersifat sementara tanpa efek samping (Kamischke, 2000).
pembentukan testosteron yang diperlukan untuk perkembangan normal sel dari keturunan spermatogenik. Follicle Stimulating Hormone (FSH) diketahui bekerja pada sel Sertoli yang merangsang spermatogenesis dan memudahkan sintesis dan sekresi protein pengikat androgen (Junqueira, 2007). Adapun kontrasepsi hormonal yang dapat menekan produksi spermatozoa, diantaranya analog gonadotropin releasing hormone
(GnRH), hormon-hormon steroid seperti androgen, progestin, dan estrogen (Moeloek, 1991).
Kombinasi Testosteron Undekanoat (TU) dan Medroksiprogesteron Asetat (MPA) merupakan kontrasepsi hormonal yang paling efektif dalam menginduksi spermatogenesis sehingga mencapai azoospermia. Penggunaan Testosteron Undekanoat (TU) dan Medroksiprogesteron Asetat (MPA) memiliki masa kerja yang panjang, sehingga mempunyai efek farmakokinetik dan farmakodinamik lebih baik dibandingkan dengan bahan lain, seperti kombinasi Testosteron Enantat (TE) dan Medroksiprogesteron Asetat (MPA) (Gu, 2004).
Medroksiprogesteron Asetat (MPA) dengan interval 8 minggu dapat menekan spermatogenesis sampai azoospermia pada pria Cina. Hal ini membuktikan bahwa penggunaan kombinasi Testosteron Undekanoat (TU) dan Medroksiprogesteron Asetat (MPA) dapat mempengaruhi proses spermatogenesis karena terjadi hambatan sekresi gonadotropin (Follicle Stimulating Hormone (FSH) dan Luteinizing Hormone (LH)) sehingga menghambat spermatogenesis dan cukup berpotensi untuk dikembangkan menjadi alat kontrasepsi hormonal pada pria (Gu, 2004).
aktif (Testosteron Undekanoat (TU) dan Medroksiprogesteron Asetat (MPA)) dan lebih praktis dalam pemberian.
Penelitian dilakukan untuk mengetahui formulasi tunggal dan formulasi kombinasi yang paling efektif pengaruhnya terhadap konsentrasi spermatozoa dan spermatogenesis tikus jantan (Rattus novergicus L.) galur Sprague Dawley.
1.2 Perumusan Masalah
1. Bagaimanakah pengaruh penyuntikan formulasi tunggal dan formulasi kombinasi Testosteron Undekanoat (TU) dan Medroksiprogesteron Asetat (MPA) terhadap konsentrasi spermatozoa tikus jantan (Rattus novergicus L.) galur Sprague Dawley?
2. Apakah terdapat perbedaan spermatogenesis antara penyuntikan formulasi tunggal dan formulasi kombinasi Testosteron Undekanoat (TU) + Medroksiprogesteron Asetat (MPA)?
1.3 Hipotesa
1. Terjadi penurunan jumlah konsentrasi spermatozoa setelah penyuntikan formulasi tunggal dan formulasi kombinasi Testosteron Undekanoat (TU) dan Medroksiprogesteron Asetat (MPA)
1.4 Tujuan Penelitian
1. Menguji pengaruh formulasi tunggal dan formulasi kombinasi Testosteron Undekanoat (TU) dan Medroksiprogesteron Asetat (MPA) terhadap konsentrasi spermatozoa dan spermatogenesis tikus jantan (Rattus novergicus L.) galur Sprague Dawley.
2. Mencari formulasi tunggal dan formulasi kombinasi Testosteron Undekanoat (TU) dan Medroksiprogesteron Asetat (MPA) yang paling efektif menghambat spermatogenesis dan konsentrasi spermatozoa.
1.5 Manfaat Penelitian
1. Mengetahui pengaruh formulasi tunggal dan formulasi kombinasi Testosteron Undekanoat (TU) dan Medroksiprogesteron Asetat (MPA) terhadap konsentrasi spermatozoa dan spermatogenesis tikus jantan (Rattus novergicus L.) galur Sprague Dawley.
BAB II
TINJAUAN PUSTAKA
2.1 Sistem Reproduksi Hewan Jantan
Sistem reproduksi hewan jantan terdiri atas testis, epididimis, duktus deferens, kelenjar aksesori (kelenjar vesikulosa, prostat dan bulbouretralis), uretra dan penis. Pada hewan yang melakukan fertilisasi secara interna organ reproduksinya dilengkapi dengan adanya organ kopulatori, yaitu suatu organ yang berfungsi menyalurkan spermatozoa dari organisme jantan ke betina. Peranan hewan jantan dalam hal reproduksi terutama adalah memproduksi spermatozoa dan sejumlah kecil cairan untuk memungkinkan sel spermatozoa masuk menuju rahim. (William, 2005).
2.2 Testis
2.2.1 Anatomi Testis
Testis merupakan sepasang struktur berbentuk oval dan sedikit gepeng. Testis terletak dalam skrotum dan dikelilingi oleh simpai tebal jaringan ikat kolagen, yaitu tunika albuginea. Tunika albuginea menebal pada permukaan posterior testis dan membentuk mediastinum testis, yaitu tempat penjuluran yang membagi kelenjar menjadi sekitar 250 kompartemen piramid yang disebut lobulus testis. Setiap lobulus dihuni oleh 1-4 tubulus seminiferus. Dinding pada rongga yang memisahkan testis dengan epididimis disebut tunika vaginalis. Tunika vaginalis dibentuk dari peritoneum saat testis masih berada dalam rongga abdomen. Sedangkan permukaan posterior menjadi tempat masuknya pembuluh darah, pembuluh limfe, dan saraf. Skrotum memiliki peran penting dalam memelihara testis pada suhu di bawah suhu intra abdomen, yaitu sekitar 4°C-7°C (Manika, 1991).
2.2.2 Fisiologi Testis
Testis merupakan organ yang berfungsi untuk menghasilkan spermatozoa dan menghasilkan hormon (testosteron). Sekitar 80%, testis terdiri dari tubulus seminiferus yang berkelak-kelok, yang di dalamnya berlangsung spermatogenesis. Tubulus yang berkelak-kelok dalam lobulus semua duktusnya kemudian meninggalkan testis dan masuk ke dalam epididimis (Heffner, 2008).
dekat membran basal ini terdapat sel progenitor untuk produksi spermatozoa. Epitel yang mengandung spermatozoa yang sedang berkembang disepanjang tubulus disebut epitel seminiferus atau epitel germinal. Pada potongan melintang testis, spermatosit dalam tubulus berada dalam berbagai tahap pematangan. Di antara spermatosit terdapat sel Sertoli. Sel ini berperan secara metabolik dan struktural untuk menjaga spermatozoa yang sedang berkembang. Sel Sertoli memfagosit sitoplasma spermatid yang telah dikeluarkan. Sel ini juga berfungsi pada proses aromatisasi prekursor androgen menjadi estrogen, suatu produk yang menghasilkan pengaturan umpan balik lokal pada sel Leydig yang memproduksi androgen. Selain itu sel Sertoli juga menghasilkan protein pengikat androgen. Produksi androgen sendiri terjadi di dalam kantong dari sel khusus (sel Leydig) yang terdapat di daerah interstitial antara tubulus-tubulus seminiferus (Heffner, 2008).
2.3 Epididimis dan Duktus (Vas) Deferens
2.3.1 Anatomi Epididimis dan Duktus (Vas) Deferens
Epididimis merupakan suatu struktur berbentuk koma yang menahan batas posterolateral testis. Epididimis dibentuk oleh saluran berkelok-kelok secara tidak teratur yang disebut duktus epididimis. Duktus epididimis diperkirakan mempunyai tiga regio : kaput (kepala), korpus (badan), dan kauda (ekor). Permukaan sel epitel duktus ini ditutupi oleh mikrovili panjang yang bercabang dan tidak teratur yang biasa disebut stereosilia. Epitel duktus epididimis turut serta dalam pengambilan dan pencernaan badan-badan residu yang dikeluarkan selama proses spermatogenesis berlangsung. Duktus-duktus epididimis dari setiap testis menyatu untuk membentuk sebuah saluran berdinding tebal dan berotot yang disebut duktus (vas) deferens. Dari setiap testis duktus deferens berjalan keluar dari kantong skrotum dan kembali ke dalam rongga abdomen dan berakhir di ureter di bagian leher kandung kemih. Dinding duktus deferens tebal dan berotot dengan lubang kecil sehingga terasa padat dan dapat diraba (lewat kulit) di bagian leher skrotum dan dapat diikat atau dipotong pada saat vasektomi (Fawcett, 2002).
2.3.2 Fisiologi Epididimis dan Duktus (Vas) Deferens
testis, spermatozoa belum mampu bergerak atau membuahi (belum matang secara fisiologis). Spermatozoa memperoleh kedua kemampuan tersebut selama perjalanannya melintasi epididimis. Proses pematangan ini dirangsang oleh testosteron yang tertahan di dalam cairan tubulus oleh protein pengikat androgen. Kapasitas spermatozoa untuk membuahi semakin ditingkatkan ketika disekresikan ke dalam saluran reproduksi wanita, yang disebut kapasitasi (Sherwood, 2001).
2.4 Spermatogenesis
2.4.1 Tahap-Tahap Spermatogenesis
Spermatogenesis merupakan proses pembentukan spermatozoa. Proses ini dimulai dengan sel benih primitif, yaitu spermatogonium. Pada saat terjadinya perkembangan sel kelamin, sel ini mulai mengalami mitosis, dan menghasilkan generasi sel-sel yang baru. Sel-sel yang baru dibentuk dapat mengikuti satu dari dua jalur. Sel-sel ini dapat terus membelah sebagai sel induk, yang disebut spermatogonium tipe A, atau dapat berdeferensiasi selama siklus mitosis yang progresif menjadi spermatogonium B. Spermatogonium B merupakan sel progenitor yang akan berdeferensiasi menjadi spermatosit primer. Segera setelah terbentuk, sel-sel ini memasuki tahap profase dari pembelahan meiosis pertama. Spermatosit primer merupakan sel terbesar dalam garis keturunan spermatogenik ini dan ditandai dengan adanya kromosom dalam berbagai tahap proses penggelungan di dalam intinya (Fawcett, 2002).
menghasilkan sel dengan jumlah kromosom haploid. Dengan adanya pembuahan, sel memperoleh kembali jumlah diploid yang normal (Junqueira, 2007).
Gambar 3. Tahapan pembentukan spermatogenesis (Junqueira, 2007).
2.4.2 Sel Spermatogenik
Proses perkembangan tersebut dibagi menjadi tiga tahap:
a. Spermatositogenesis: Diferensiasi spermatogonia menjadi spermatosit primer.
b. Meiosis: perkembangan sel, dimana spermatosit primer memiliki kromosom diploid membentuk spermatid haploid.
c. Spermiogenesis: Transformasi spermatid menjadi spermatozoa (sperma).
Diferensiasi Spermatogonia
Spermatogonia yang terletak di lapisan paling luar tubulus secara terus menerus membelah dengan cara mitosis dimana sel baru yang terbentuk identik dengan sel induk. Peristiwa ini disebut proliferasi mitotik. Proliferasi ini menghasilkan pasokan kontinyu sel-sel germinativum baru.
Menurut gambaran inti selnya, pada manusia dikenal tiga jenis spermatogonia :
a. Spermatogonia gelap tipe A, dengan inti sel lonjong berwarna gelap. Sel-sel tersebut membelah diri secara berkala untuk mempertahankan jumlah spermatogonia dan juga untuk membentuk spermatogonia pucat tipe A yang memiliki inti lonjong pucat.
b. Spermatogonia pucat tipe A, membelah diri secara mitosis untuk menjadi spermatogia B (menjadi spermatogonia pucat tipe A yang lain).
membelah diri dengan cara mitosis, sel tersebut menghasilkan sel-sel anak yang sel-seluruhnya berdiferensiasi menjadi spermatosit primer (Leeson, 1996).
Setelah pembelahan mitosis spermatogonia, salah satu sel anak tetap berada diluar tubulus sebagai spermatogonium yang tidak berdiferensiasi untuk mempertahankan lapisan sel germinativum. Sementara itu, sel-sel anak lainnya berkembang menjadi spermatosit primer. Spermatosit primer masuk ke fase istirahat selama kromosom mengalami duplikasi dan untai-untai ganda tetap bersatu sebagai persiapan untuk pembelahan meiosis pertama (Sherwood, 2001).
Pembelahan Meiosis Spermatosit
Pembelahan meiosis pertama dari spermatosit primer, diikuti dengan pembelahan meiosis kedua spermatosit sekunder, dimana jumlah kromosom berkurang dan DNA spermatid menjadi haploid (n).
Profase I pada pembelahan meiosis pertama melibatkan empat tahap:
1. Leptoten 2. Zigoten 3. Pakiten 4. Diakinase
Metafase I, pasangan kromosom homolog berbaris di garis khatulistiwa. Setiap pasangan kromosom berpisah dan bermigrasi ke kutub yang berlawanan dari sel pada anafase I, dan sel-sel terpisah membentuk dua spermatosit sekunder selama telofase I spermatosit sekunder adalah sel yang relatif kecil, dan karena mereka berumur pendek, mereka tidak mudah terlihat di epitel seminiferus. Selama mitosis spermatogonia dan meiosis dari spermatosit, pembelahan melibatkan dua komponen : pembelahan nukleus dan pembelahan sitoplasma (sitokinesis) (Gartner, 2007).
Spermiogenesis
Spermiogenesis merupakan tahap akhir produksi spermatozoa. Spermiogenesis adalah proses transformasi spermatid menjadi spermatozoa, yaitu sel yang sangat dikhususkan untuk menyampaikan DNA jantan kepada ovum. Tidak terjadi pembelahan sel selama proses ini berlangsung (Junqueira, 2007).
Spermiogenesis dapat dibagi menjadi tiga fase : a. Fase golgi
Sitoplasma spermatid mengandung kompleks Golgi di dekat inti, mitokondria, sepasang sentriol, ribosom bebas, dan tubulus retikulum endosplasma halus. Granula proakrosom berkumpul di kompleks Golgi dan kemudian menyatu membentuk satu granula akrosom yang terdapat dalam vesikel akrosom.
b. Fase akrosom
Vesikel dan granula akrosom menyebar untuk menutupi belahan anterior inti yang memadat yang dikenal akrosom. Akrosom mengandung beberapa enzim hidrolitik, seperti hialuronidase, asam fosfatase, neuraminidase, dan protease. Jadi, akrosom berfungsi sebagai lisosom.
c. Fase pematangan
Sitoplasma residu dibuang dan difagositosis oleh sel Sertoli dan spermatozoa dilepaskan ke dalam lumen tubulus (Junqueira, 2007). 2.4.3 Siklus Epitel Seminiferus
hari). Sedangkan satu siklus spermatogenesis (spermatogonia menjadi spermatozoa) adalah 51,6 hari (sekitar 8 minggu). Sehingga dapat dikatakan bahwa satu siklus spermatogenesis memerlukan 4 siklus epitel seminiferus. Pada potongan melintang tubulus seminiferus testis tikus tipe asosiasi sel dibagi dalam 14 tahapan. Setiap asosiasi sel, terdiri dari sekumpulan sel spermatogenik yang selalu tersusun teratur dari spermatogonia, spermatosit dan spermatid yang terdapat pada berbagai tingkat perkembangan (Franca, 1998).
Tahapan spermatogenesis tersusun dari susunan antara spermatogonia A, spermatogonia intermedia, spermatogonia B, spermatosit primer dalam berbagai tahap profase (leptoten, zigoten, pakiten, diploten dan diakinase) dan spermatid dengan 19 langkah spermatogenesis (Franca, 1998).
Pada manusia, satu siklus epitel seminiferus membutuhkan waktu 16 hari dan waktu yang diperlukan untuk satu siklus spermatogenesis 64 hari (sekitar 8 minggu). Sedangkan satu siklus spermatogenesis memerlukan 4-5 siklus epitel seminiferus dimana tipe asosiasi sel dibagi dalam 6 tahapan (Weinbauer, 1999). Pentingnya mengidentifikasi tahapan spermatogenesis berkaitan dengan sifat siklus dan proses biokimia yang terjadi selama pematangan epitel spermatogenik (Heninger, 2004).
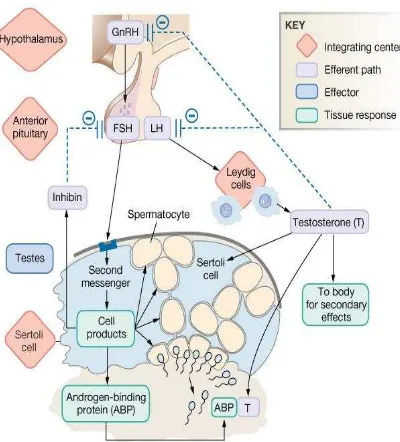
2.5 Peranan Hormon Pada Spermatogenesis
Gambar 5. Mekanisme pengaturan hormon spermatogenesis (Dee, 2004)
Maka, dapat disimpulkan bahwa hormon memiliki peranan yang penting terhadap terbentuknya spermatogenesis. Adapun hormon yang terlibat diantaranya testosteron, Follicle Stimulating Hormone (FSH),
Luteinizing Hormone (LH), estrogen, dan hormon pertumbuhan lainnya (Naz, 2006).
A. Testosteron
perkembangan organ reproduksi pria dan tanda seks sekunder pada pria berupa pembesaran laring, perubahan suara, pertumbuhan rambut ketiak, pubis, dada, kumis dan jenggot serta untuk pertumbuhan otot dan tulang (Ascobat, 2008).
B. Luteinizing Hormone (LH) dan Follicle Stimulating Hormone(FSH)
Luteinizing Hormone (LH) disekresikan oleh sel karminofil dari kelenjar hipofisis bagian anterior. Berperan dalam stimulasi sel-sel Leydig untuk memproduksi testosteron, juga berperan dihasilkannya estradiol.
Follicle Stimulating Hormone (FSH) merangsang pertumbuhan testis dan mempertinggi produksi protein pengikat androgen (ABP) oleh sel Sertoli. Peningkatan ABP ini menyebabkan tingginya konsentrasi testosteron yang penting bagi pembentukan dan pematangan spermatozoa pada proses spermatogenesis. Dengan demikian Follicle Stimulating Hormone (FSH) bekerja menyiapkan kadar androgen yang cukup untuk sel germinal dan memacu pendewasaan spermatozoa di dalam epididimis (Junqueira, 2007). C. Estrogen
Dibentuk oleh sel-sel Sertoli ketika sedang distimulasi oleh
D. Hormon pertumbuhan lainnya
Seperti juga pada sebagian besar hormon lainnya diperlukan untuk mengatur latarbelakang fungsi metabolisme testis. Hormon pertumbuhan secara khusus meningkatkan pembelahan awal spermatogenesis (Sherwood, 2001).
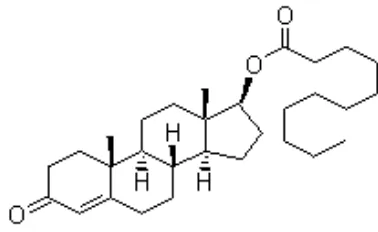
2. 6 Testosteron Undekanoat
Testosteron Undekanoat (TU) (hydroxy-4androsten-3-one 17-undecanoate) merupakan testosteron ester golongan asam lemak alifatik yang mempunyai rantai samping panjang, sehingga lebih bersifat lipofilik. Esterifikasi testosteron menghasilkan molekul yang kurang polar dan dapat larut dalam minyak dan jaringan lemak. Testosteron Undekanoat (TU) merupakan suatu bentuk ester dari testosteron alami. Bentuk aktif testosteron dihasilkan dari hidrolisis esternya. Testosteron Undekanoat (TU) mempunyai waktu paruh yang panjang yakni 6-10 minggu. Hal ini disebabkan karena rantai samping alifatik yang panjang, semakin panjang rantai karbon maka waktu paruhnya akan memanjang pula (Woferst, 2007).
Testosteron Undekanoat (TU) yang dikembangkan untuk kontrasepsi pria digunakan dalam bentuk injeksi (liquid). Sediaan tersebut diberikan dengan cara injeksi secara intramuskular. Efek utama dari testosteron hasil hidrolisis Testosteron Undekanoat (TU) tersebut terjadi setelah adanya ikatan testosteron terhadap reseptor spesifiknya yang membentuk kompleks homon-reseptor. Kompleks hormon-reseptor tersebut masuk ke dalam inti sel dimana ia akan memodulasi transkripsi gen-gen tertentu setelah terikat dengan DNA. Tujuan utama pemberian Testosteron Undekanoat (TU) adalah mempertahankan tingginya kadar testosteron jangka panjang pada pria yang ikut dalam kotrasepsi pria (Ilyas, 2008).
2.7 Medroksiprogesteron Asetat
Gambar 7. Rumus bangun Medroksiprogesteron Asetat (Andajaningsih, 1995).
Medroksiprogesteron Asetat (MPA) adalah suatu progesteron sintetik yang memiliki efek kerja panjang (long acting) di dalam tubuh bila diberikan secara intramuskular. Penggunaan progesteron pada pria didasari oleh prinsip kerja yang sama pada wanita, yaitu menekan sekresi gonadotropin hipofisis yang menghambat produksi Follicle Stimulating Hormone (FSH) dan Luteinizing Hormone (LH) melalui umpan balik negatif dan selanjutnya akan menekan spermatogenesis sehingga dapat digunakan sebagai kontarsepsi pria. Pada pria progesteron dihasilkan oleh testis dan kelenjar adrenal testis sebagai hasil antara biosintesis androgen testis dan kortiko steroid meskipun dalam jumlah relatif sedikit (Moeloek, 1991).
Sprague-Dawley adalah dosis 1,25 mg. Sedangkan untuk menekan produksi hormon Follicle Stimulating Hormone (FSH) dan Luteinizing Hormone (LH) pada pria dan wanita adalah dosis 150 mg dan dosis ini dapat bertahan di dalam tubuh selama tiga bulan ( Yurnadi, 2008). Pemberian kombinasi 500 mg Testosteron Undekanoat (TU) dengan 250 mg Medroksiprogesteron Asetat (MPA) dapat menekan spermatogenesis sampai azoospermia (Gu, 2004).
BAB III
KERANGKA KONSEP
Pembuatan preparasi
Penyuntikan minggu ke 8 Penyuntikan minggu ke 0
Penimbangan
Pengamatan histologi spermatogenesis
Pengukuran konsentrasi spermatozoa
Pembedahan minggu ke 12
Penimbangan
Penimbangan
Testis Vas deferens
BAB IV
METODOLOGI PENELITIAN
4.1 Lokasi dan Waktu Penelitian
Penelitian ini dilakukan di Laboratorium Farmasi UIN Syarif Hidayatullah Jakarta dan Laboratorium Biologi Universitas Indonesia. Penelitian berlangsung selama 5 bulan, terhitung dari bulan Mei 2010 sampai dengan September 2010.
4.2 Alat dan Bahan 4.2.1 Alat
Gelas piala, cawan arloji, kaca objek dan penutupnya, tabung reaksi, wadah pembiusan, timbangan analitik (Precisa XT 220A), Hemositometer Improved Neubeur, mikroskop cahaya (motic), alat bedah, botol minuman, kandang, alat bedah 1 set, mikropipet, Spuit Therumo Syringe 1 ml, kapas, sarung tangan, masker.
4.2.2 Bahan
4.3 Prosedur Penelitian
Penelitian ini bersifat eksperimental yang terdiri atas 8 kelompok perlakuan dengan masing-masing terdiri dari 3 ekor tikus jantan (Rattus novergicus L.) galur Sprague Dawley.
Hal ini memenuhi rumus Federer, yaitu : (n-1) (t-1) ≥ 15 keterangan :
6 K6 FK ME
5 1,125 0 8 minggu 12
7 K7 FK
Kos
2,5 1,25 0 8 minggu 12
8 Kontrol normal
minggu 12
Ket : K = Kelompok
FT = formulasi tunggal FK = formulasi kombinasi
N = Nebido (Testosteron Undekanoat (TU))
DP = Depo progestin (Medroksiprogesteon Asetat (MPA)) ME = Mikro Emulsi ( TU/MPA)
Kos = Kosolven (TU/MPA)
4.4 Perlakuan Hewan Percobaan 4.4.1 Hewan Perlakuan
4.4.2 Cara dan Dosis Perlakuan
Tikus disuntik dengan formulasi tunggal (TU + MPA) dan formulasi kombinasi (TU/MPA) sesuai dengan dosis rancangan percobaan. Penyuntikan dilakukan sebanyak 2 kali pada minggu 0 dan minggu ke-8 secara IM (intra muskular) pada bagian paha kanan dan pada paha kiri. Penyuntikan dilakukan sebanyak 2 kali agar kombinasi TU + MPA efektif dalam menghambat sekresi hormon gonadotropin (LH dan FSH) (Yurnadi, 2008). Tikus yang telah mendapat perlakuan kemudian dipelihara dan dirawat sampai minggu ke-12 untuk dipreparasi.
4.4.3 Pembuatan Preparasi
Setelah minggu ke-12, tikus dibius dengan eter, kemudian dibedah. Diambil bagian testis dan duktus (vas) deferens, lalu dibuat preparasi. Jaringan testis yang telah diambil, difiksasi dalam larutan Bouin dan dibiarkan selama kurang lebih 24 jam. Kemudian dilakukan pencucian, yaitu mencuci organ dengan alkohol 70% yang dilakukan berulang-ulang selama kurang lebih 30 menit. Hal ini bertujuan agar warna kuning (larutan Bouin) berkurang atau tampak jernih. Jaringan didehidrasi dalam larutan alkohol bertingkat dari alkohol 70%, 80%, 96% dan alkohol absolut selama kurang lebih 1 jam untuk menarik molekul air yang keluar dari jaringan. Selanjutnya jaringan dijernihkan dengan larutan benzil benzoat selama 24 jam, lalu dalam benzol sebanyak 2 kali 15 menit sampai jaringan tampak jernih atau transparan (Ilyas, 2007).
selama 60 menit, dan parafin III selama 90 menit. Infiltrasi dilakukan dalam oven dengan suhu 56°C-58°C. Perlakuan berikutnya adalah penanaman jaringan yang telah diinfiltrasi dalam parafin cair lalu diletakkan dalam kotak kertas sesuai dengan ukuran masing-masing jaringan yang akan ditanam. Kotak kertas yang telah berisi jaringan dimasukkan dalam lemari es dan dibiarkan membeku (Kusmana, 2001).
Selanjutnya, pemotongan jaringan setebal 3-6µm dengan menggunakan pisau mikrotom putar dan hasil irisan ditempelkan pada kaca objek. Preparat pada kaca objek dipanaskan sampai jaringan mengembang dengan sempurna. Sebelum jaringan diwarnai, sediaan direndam dalam xilol selama 5 menit sebanyak 2 kali. Hal tersebut bertujuan agar sisa parafin yang masih merekat pada jaringan dapat dihilangkan. Xilol dihilangkan dengan merendam jaringan pada larutan alkohol bertingkat dari konsentrasi tinggi turun secara bertahap (100%, 90%, 80%, dan 70%) masing-masing selama 3 menit. Untuk pewarnaan dilakukan dengan hematoksilin dan eosin (HE). Jaringan yang telah diwarnai dijernihkan dengan xilol selama 5 menit agar jaringan tampak lebih cerah. Pada tahap akhir, jaringan testis pada kaca objek diberi entelan dan ditutup dengan kaca penutup sehingga dapat dilakukan pengamatan (Woferst, 2007).
4.4.4 Pengukuran Konsentrasi Spermatozoa
Pengukuran konsentrasi spermatozoa dilakukan dengan cara mengambil spermatozoa pada duktus (vas) deferens. Spermatozoa yang didapat diletakkan pada kaca arloji yang berisi cairan NaCl sebanyak 250 µ L. Spermatozoa dimasukkan kedalam bilik hitung Neubauer (Hemasitometer) sampai kamar Neubauer terisi rata. Kemudian dihitung jumlah spermatozoa pada salah satu kamar. Setelah diketahui jumlah spermatozoa, maka dapat dilakukan pengukuran untuk menentukan konsentrasi spermatozoa (yang dinyatakan dalam juta/mL) sesuai dengan tabel dibawah ini (Ilyas, 2007).
Bila dari 1 kotak didapat :
Tabel 2. Pengenceran yang Dilakukan dan Kotak yang Dihitung No Jumlah Spermatozoa Pengenceran Kotak yang Dihitung
1 > 40 50 kali 5 kotak
2 15-40 20 kali 10 kotak
3 <15 10 kali 25 kotak
Dari jumlah spermatozoa yang diketahui, maka dilakukan pengenceran
spermatozoa berdasarkan jumlah spermatozoa yang terhitung (Ilyas, 2007).
Tabel 3. Cara Pengenceran
No Pengenceran Pembuatan Pengenceran
2 20 kali 950 µ L lar. George + 50 µ L spermatozoa 3 10 kali a. 900 µ L lar. George + 100 µ L spermatozoa
b. 450 µ L lar. George + 50 µ L spermatozoa
Setelah dilakukan pengenceran, dilakukan perhitungan spermatozoa
dengan jumlah kotak yang dihitung sesuai dengan jumlah spermatozoa dan cara pengenceran pada tabel diatas. Kemudian dilakukan pengukuran spermatozoa sesuai rumus di bawah ini (Ilyas, 2007).
Tabel 4. Rumus Konsentrasi Spermatozoa No Kotak Rumus konsentrasi spermatozoa
1 5 n x 10.000 x faktor pengenceran (50) x 5 2 10 n x 10.000 x faktor pengenceran (20) x 2,5 3 25 n x 10.000 x faktor pengenceran (10)
Ket : n = jumlah spermatozoa setelah pengenceran
Dari perhitungan jumlah spermatozoa, dapat dihitung pula frekuensi timbulnya azoospermia. Azoospermia adalah suatu keadaan dimana tidak ada spermatozoa dalam cairan semen. Sedangkan oligozoospermia adalah suatu keadaan dimana terdapat sedikit spermatozoa dalam cairan semen (spermatozoa ≤ 20 juta/mL) (WHO, 1999). Penetapan timbulnya azoospermia dilakukan dengan cara membagi banyaknya individu yang mengalami azoospermia (Az) dengan banyaknya individu dalam satu kelompok (n) dikalikan 100% (Kusmana, 2001).
4.4.5 Pengukuran/Penilaian Histologi Spermatogenesis
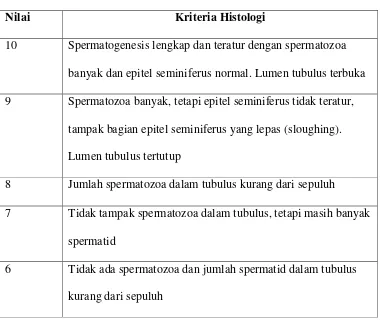
Pengukuran dilakukan untuk mengetahui spermatogenesis dalam tubulus seminiferus. Metode yang dapat digunakan untuk menilai spermatogenesis adalah dengan menggunakan tabel Johnsen (1970). Penilaian dilakukan dengan cara menjumlahkan nilai tiap tubulus dalam sediaan kemudian dibagi dengan jumlah tubulus yang dinilai. Angka rata-rata yang didapat merupakan nilai akhir untuk sediaan tersebut. Cara ini mempunyai keuntungan cepat untuk dilakukan, dapat dibandingkan dengan antara perlakuan yang satu dan yang lain serta memberi gambaran tentang spermatozoa (Kusmana, 2001).
Tabel 5. Nilai Histologi Spermatogenik
Nilai Kriteria Histologi
10 Spermatogenesis lengkap dan teratur dengan spermatozoa banyak dan epitel seminiferus normal. Lumen tubulus terbuka 9 Spermatozoa banyak, tetapi epitel seminiferus tidak teratur,
tampak bagian epitel seminiferus yang lepas (sloughing). Lumen tubulus tertutup
8 Jumlah spermatozoa dalam tubulus kurang dari sepuluh
7 Tidak tampak spermatozoa dalam tubulus, tetapi masih banyak spermatid
5 Tidak ada spermatozoa dan spermatid dalam tubulus, tetapi masih banyak spermatosit
4 Tidak ada spermatozoa dan spermatid dalam tubulus dan jumlah spermatosit kurang dari lima
3 Sel kelamin dalam tubulus hanya terdiri atas spermatogonia 2 Dalam tubulus tidak ada sel kelamin, hanya sel Sertoli 1 Dalam tubulus tidak ada sel
4.5 Analisa Data
Data hasil penelitian dianalisa untuk melihat adanya perbedaan berat badan, konsentrasi spermatozoa dan spermatogenesis dari masing-masing kelompok perlakuan. Data-data yang diperoleh dianalisa menggunakan program pengolahan data statistik SPSS 17 yang meliputi uji homogenitas, uji kenormalan, uji parametrik (Anova) atau non parametrik (Kruskall Wallis).
Hipotesis :
Ho: tidak ada perbedaan yang bermakna antara setiap kelompok Ha : terdapat perbedaan yang bermakna antara setiap kelompok Kriteria pengujian :
Bila nilai sig ≤ 0,05 Ho ditolak, berarti terdapat perbedaan.
Bila nilai sig ≥ 0,05 Ho diterima, berarti tidak terdapat perbedaan
BAB V
HASIL PENELITIAN DAN PEMBAHASAN
5.1 Hasil Penelitian
5.1.1 Hasil Pengukuran Berat Badan Tikus
Hasil pengukuran berat badan tikus baik pada kelompok formulasi tunggal maupun formulasi kombinasi serta kelompok yang tidak mendapat perlakuan menunjukkan peningkatan berat badan.
Tabel 6. Rata-rata Berat Badan Tikus Tiap Kelompok
No Tanggal Rata-rata Berat Badan Tikus Tiap Kelompok (Gram)
I II III IV V VI VII VIII
1 28 April 10 263,33 253,33 253,33 246,66 260,00 253,33 253,33 246,66
2 7 Mei 10 270,00 260,00 270,00 251,66 280,00 253,33 266,66 251,66 3 12 Mei 10 306,66 296,66 308,66 275,00 298,66 286,66 298,00 278,33 4 17 Mei 10 311,00 305,33 317,00 280,66 306,66 301,00 307,33 284,00 5 22 Mei 10 317,00 313,66 324,66 285,66 314,66 308,00 316,66 288,66 6 27 Mei 10 333,33 321,00 330,00 291,66 304,00 317,33 322,66 303,00 7 1 Juni 10 343,00 327,33 339,33 299,00 314,33 324,00 328,66 309,33 8 6 Juni 10 354,66 338,00 347,33 312,33 325,66 335,00 336,33 315,66
13 1 Juli 10 394,33 368,66 394,66 355,00 377,33 381,66 392,33 355,33
14 2 Juli 10 398,33 379,00 399,00 368,33 372,00 393,33 389,00 368,66 15 7 Juli 10 394,33 373,66 397,33 354,66 375,66 387,66 379,00 365,33 16 12 Juli 10 397,33 384,66 389,33 352,00 348,00 370,33 358,00 365,66 17 17 Juli 10 396,00 381,66 398,33 351,33 346,00 369,66 379,33 373,33 18 22 Juli 10 402,33 388,66 406,33 359,66 352,66 395,66 393,00 384,33 19 27 Juli 10 408,33 396,33 412,66 366,00 363,66 406,33 408,33 390,00 20 30 Juli 10 446,66 399,66 413,66 369,66 370,33 407,00 410,66 396,33
5.1.2 Perhitungan Konsentrasi Spermatozoa
Hasil perhitungan/pengukuran konsentrasi spermatozoa dapat dilihat pada tabel berikut :
mg / MPA
5.1.3 Pengukuran/Penilaian Histologi Spermatogenesis
Hasil perhitungan/pengukuran histologi spermatogenesis dapat dilihat pada tabel berikut :
5 mg / MPA 1,125 mg)
Tikus 2 7 7,2 7,1
Tikus 3 7,4 7,4 7,4
7 VII (Kos TU 2,5 mg + MPA 1,25 mg)
Tikus 1 9 9,1 9,05 9,2
Tikus 2 9,3 9,2 9,25
Tikus 3 9,2 9,4 9,3
8 VIII (Kontrol normal)
Tikus 1 9,75 10 10
10
Tikus 2 10 10 10
Tikus 3 9,625 9,75 10
Keterangan : Penilaian histologi spermatogenesis dapat dilihat pada tabel 5 Bab IV.
5.2 Pembahasan
Hasil uji normalitas dan homogenitas berat badan menunjukkan bahwa data terdistribusi normal (p ≥ 0,05). Namun terdapat data yang tidak homogen (p ≤ 0,05) dan homogen (p ≥ 0,05), sehingga analisa dilanjutkan dengan uji ANOVA (untuk data yang terdistribusi normal (p≥
0,05) dan homogen (p ≥ 0,05)) dan uji nonparametrik Kruskal Wallis (untuk data yang terdistribusi normal (p ≥ 0,05) dan tidak homogen (p ≤
0,05)). Hasil uji ANOVA dan uji nonparametrik Kruskal Wallis menunjukkan terdapat perbedaan yang bermakna antara setiap kelompok perlakuan (p ≤ 0,05) sehingga dilanjutkan dengan uji LSD. Berdasarkan analisa data berat badan antara kelompok perlakuan baik formulasi tunggal ((TU 2,5mg + MPA 1,25mg), (TU 5mg + MPA 0,75mg), (TU 5mg + MPA 1,125mg)) dan formulasi kombinasi ((ME TU 2,5mg/MPA 1,25mg), (ME TU 5mg/MPA 0,75mg), (ME TU 5mg/MPA 1,125mg), (Kosolven TU 2,5mg/MPA 1,25mg)) dengan kontrol normal menunjukkan tidak ada perbedaan bermakna (p ≥ 0,05) (analisa data dapat dilihat pada lampiran 12, 13 dan 14).
Beberapa data memang mendukung bahwa pemberian Testosteron Undekanoat (TU) dan Medroksiprogesteron Asetat (MPA) dapat merangsang pertambahan berat badan, akan tetapi dapat kembali normal. Gu (2004), telah melakukan penelitian yang menunjukkan bahwa dengan pemberian Testosteron Undekanoat (TU) dan Medroksiprogesteron Asetat (MPA) (1000mg TU + 150mg MPA) pada manusia selama 48 minggu, rata-rata berat badan bertambah pada semua kelompok dengan kenaikan maksimum 1,4 kg selama perlakuan, tetapi kembali normal secara bertahap ke arah nilai awal setelah periode injeksi. Zhang (1999), juga melakukan penelitian dengan menggunakan Testosteron Undekanoat ( TU) dosis 500mg dan 1000mg pada manusia selama 36 minggu. Dari hasil penelitiannya rata-rata berat badan bertambah 4,1% selama perlakuan dan kembali normal setelah pemulihan.
Penelitian yang dilakukan oleh Yurnadi (2009) dengan pemberian dosis minimal 1,25mg Medroksiprogesteron Asetat (MPA) pada tikus jantan (setara dengan 150mg pada manusia) selama 48 minggu menyebutkan rata-rata berat badan terjadi penambahan sebanyak 2,6% dari masing kelompok, akan tetapi dari hasil uji ANOVA menunjukkan bahwa berat badan tidak memperlihatkan perbedaan yang bermakna (p ≥ 0,05) antara kelompok kontrol dan kelompok perlakuan Medroksiprogesteron Asetat (MPA).
Medroksiprogesteron Asetat (MPA) tetapi tidak terdapat perbedaan yang bermakna (p ≥ 0,05) dengan kontrol normal.
Hasil uji normalitas dan homogenitas konsentrasi spermatozoa menunjukkan bahwa data terdistribusi tidak normal (p ≤ 0,05). Namun homogen (p ≥ 0,05), sehingga analisa dilanjutkan dengan uji nonparametrik Kruskal Wallis. Hasil uji tersebut menunjukkan bahwa terdapat perbedaan yang bermakna antara setiap kelompok perlakuan (p≤
0,05) sehingga dilanjutkan dengan uji LSD. Berdasarkan analisa data konsentrasi spermatozoa antara formulasi tunggal ((TU 2,5mg + MPA 1,25mg), (TU 5mg + MPA 0,75mg), (TU 5mg + MPA 1,125mg)) maupun formulasi kombinasi ((ME TU 2,5mg/MPA 1,25mg), (ME TU 5mg/MPA 0,75mg), (ME TU 5mg/MPA 1,125mg), (Kosolven TU 2,5mg/MPA 1,25mg)) dengan kontrol normal menunjukkan terdapat perbedaan bermakna (p ≤ 0,05) (analisa data dapat dilihat pada lampiran 15, 16 dan 17).
Penyuntikan formulasi tunggal (TU + MPA) dan formulasi kombinasi (mikroemulsi (TU/MPA) dan kosolven (TU/MPA)) bertujuan untuk mengetahui sediaan yang paling efektif dalam menghambat spematogenesis hingga mencapai azoospermia.
spermatozoa hingga mencapai oligozoospermia. Dari tujuh kelompok perlakuan, kelompok formulasi tunggal (TU 5mg + MPA 1,125mg) dan kelompok formulasi kombinasi (ME TU 2,5mg/MPA 1,25mg) yang paling berpengaruh menekan produksi spermatozoa, dimana rata-rata jumlah konsentrasi spermatozoa untuk kedua kelompok tersebut hanya 1 juta/ml (data dapat dilihat pada tabel 7).
Penurunan konsentrasi spermatozoa terjadi karena penyuntikan Testosteron Undekanoat (TU) + Medroksiprogesteron Asetat (MPA) dapat mempengaruhi spermatogenesis dimana terjadi hambatan sekresi hormon gonadotropin Follicle Stimulating Hormone (FSH) dan Luteinizing Hormone (LH) sehingga menekan spermatogenesis dan produksi spermatozoa (Yurnadi, 2008). Selain itu perbedaan penggunaan dosis dari masing-masing kelompok juga menyebabkan perbedaan hasil pada penelitian yang telah dilakukan.
Testosteron Undekanoat (TU) berfungsi sebagai hormon pengganti yang mempertahankan tingginya kadar serum testosteron (>710 ng/dl) sehingga menyebabkan terjadinya umpan balik negatif terhadap hipotalamus dan hipofisis anterior serta menurunkan sekresi gonadotropin (Luteinizing Hormone (LH) dan Follicle Stimulating Hormone (FSH)) yang sangat diperlukan dalam spermatogenesis dan produksi spermatozoa (Gu, 2009). Sedangkan Medroksiprogesteron Asetat (MPA) dapat menginduksi sekresi gonadotropin (Luteinizing Hormone (LH) dan
Penelitian yang telah dilakukan juga membuktikan dengan penyuntikan Testosteron Undekanoat (TU) dosis 1000mg dengan Medroksiprogesteron Asetat (MPA) dosis 150mg atau 300mg dapat menekan spermatogenesis hingga mencapai azoospermia tanpa terlihat adanya efek samping (Gu, 2004).
Nasikin (2007), melakukan studi praklinik pada tikus jantan galur Sprague Dawley dengan penyuntikan 2,5mg Testosteron Undekanoat (TU)+1,25mg Medroksiprogesteron Asetat (MPA). Hasilnya, kombinasi Testosteron Undekanoat (TU) + Medroksiprogesteron Asetat (MPA) dapat menekan produksi spermatozoa hingga mencapai oligozoospermia. Meskipun belum mencapai azoospermia, tetapi dari hasil penelitiannya memperlihatkan bahwa telah terjadi peristiwa apoptosis akibat penyuntikan Testosteron Undekanoat (TU) + Medroksiprogesteron Asetat (MPA) (Nasikin, 2007). Apoptosis atau proses kematian sel secara terprogram pada saat perkembangan sel spermatogenik dapat disebabkan dari akumulasi penyuntikan Testosteron Undekanoat (TU) + Medroksiprogesteron Asetat (MPA) yang panjang (Ilyas, 2007). Peningkatan apoptosis sejalan dengan penekanan testosteron endogen atau intratestiskular (Lee, 1999).
Undekanoat (TU) dan Medroksiprogesteron Asetat (MPA)) memiliki keuntungan dibandingkan formulasi tunggal karena lebih praktis dalam pemberian, sehingga dapat dilakukan penelitian lebih lanjut sebagai hormon kontrasepsi pria.
Hasil uji normalitas dan homogenitas histologi spermatogenesis menunjukkan bahwa data terdistribusi normal (p≥ 0,05) dan homogen (p
≥ 0,05), sehingga analisa dilanjutkan dengan uji ANOVA. Hasil uji
tersebut menunjukkan bahwa terdapat perbedaan yang bermakna antara setiap kelompok perlakuan (p ≤ 0,05) sehingga dilanjutkan dengan uji
LSD. Berdasarkan analisa data uji LSD histologi spermatogenesis antara kelompok perlakuan baik formulasi tunggal ((TU 2,5mg + MPA 1,25mg), (TU 5mg + MPA 0,75mg), (TU 5mg + MPA 1,125mg)) maupun formulasi kombinasi ((ME TU 2,5mg/MPA 1,25mg), (ME TU 5mg/MPA 0,75mg), (ME TU 5mg/MPA 1,125mg), (Kosolven TU 2,5mg/MPA 1,25mg)) dengan kontrol normal menunjukkan terdapat perbedaan bermakna (p ≤ 0,05) (analisa data dapat dilihat pada lampiran 18, 19 dan 20).
MPA 1,125mg) dan formulasi kombinasi ( ME TU 2,5mg/MPA 1,25mg) lebih rendah dibandingkan dengan kelompok lain (dapat dilihat pada tabel 8). Hal ini berbanding lurus dengan jumlah konsentrasi spermatozoa pada kedua kelompok tersebut yang memiliki jumlah rata-rata konsentrasi spermatozoa lebih rendah dibandingkan dengan kelompok lain. Perubahan yang terlihat tampak dari sel spermatogenik (spermatogonia dan spermatid) yang tidak berkembang atau sedikit jumlahnya sehingga spermatozoa tidak terbentuk (gambar perbedaan histologi spermatogenesis dapat dilihat pada lampiran 11).
BAB VI
KESIMPULAN DAN SARAN
6.1. Kesimpulan
1. Penyuntikan formulasi tunggal dan formulasi kombinasi Testosteron Undekanoat (TU) dan Medroksiprogesteron Asetat (MPA) dapat menekan konsentrasi spermatozoa. Berdasarkan analisa data konsentrasi spermatozoa antara formulasi tunggal maupun formulasi kombinasi dengan kontrol normal menunjukkan terdapat perbedaan bermakna (p ≤ 0,05). Formulasi tunggal (TU 5mg + MPA 1,125mg) dan formulasi kombinasi (ME TU 2,5mg + MPA 1,25mg) lebih baik dalam menghambat produksi spermatozoa dibandingkan dengan sediaan yang lain. Rata-rata konsentrasi spermatozoa formulasi tunggal (TU 5mg + MPA 1,125mg) dan formulasi kombinasi (ME TU 2,5mg+MPA 1,25mg) adalah 1 juta/ml.
6.2. Saran
DAFTAR PUSTAKA
Andajaningsih. 1995. Farmakope Indonesia Edisi IV. Departemen Kesehatan Republik Indonesia. Jakarta
Ascobat P. 2008. Androgen, antiandrogen & Anabolik Steroid. Dalam : Farmakologi dan Terapi edisi 5 FKUI. Gaya Baru. Jakarta: 456-466
Dee S. U. 2004. Human Physiology An Integrated Approach Edition Third. Chapter 26, part b. dalam Reduction and Development
Dunkel L., Hirvonen V., Erkkila K. 1997. Clinical aspects of male germ cell apoptosis during testis development and spermatogenesis. Cell Death and Differ No.4 171-179
Fawcett, Don W. 2002. Buku Ajar Histologi. Jakarta: EGC 423-501
Franca L. R., Takehiko Ogawa, Mary R. A., Ralph l. B. and Lonnie D. Russell. 1998. Germ Cell Genotype Controls Cell Cycle during Spermatogenesis in the Rat. Biology of Reproduction No.59 1371-1377
Francavilla S., D’Abrizio P., Cordeschi G., Pelliccione F., Necozione S., Ullise S., Propersi G., Francavilla F. 2002. Fas Expression Correlates with Human Germ Cell Degeneration in Melotic and Post Meiotic Arrest of Spermatogenesis. Mol Hum Reprod No.8 213-220
Gu YQ, Jian-sun Tong, Ding-zhi Ma, Xing-hai Wang, Dong Yuan, Wen-hao Tang and William J. Bremner. 2004. Male Hormonal Contraception: Effects of Injections of Testosterone Undecanoate and Depot Medroxyprogesterone Acetate at Eight-Week Intervals in Chinese Men. The Journal of Clinical Endocrinology & Metabolism Vol. 89. No. 5. 2254-2262
Gu YQ, Xiaowei Liang, Weixiong Wu, Minli Liu, Shuxiu Song, Lifa Cheng, Liwei Bo, Chengliang Xiong, Xinghai Wang, Xiaozhang Liu, Lin Peng, and Kangshou Yao. 2009. Multicenter Contraceptive Efficacy Trial of Injectable Testoterone Undecanoate in Chinese Men. The Journal of Clinical Endocrinol & Metabolism Vol. 94. No. 6. 1910-1915
Heffner L. J. dan Danny J. Schust. 2008. At A Glance Sistem Reproduksi Edisi Kedua. Jakarta: Erlangga. Hal 24, 25, 26, 37
Heninger N. L., Stauh C., Blanchard T. L., Johnson L., Varner D. D., Forrest D. W. 2004. Germ Cell Apoptosis in the Testes of Normal Stallions. Theriogenology No. 62 283-297
Henzl M. R. 1991. Contraceptive hormones and their clinical use. Reproductive Endocrinology. Philadelphia : Saunders Company. P 807-829
Ilyas, S. 2007. Azoospermia dan Pemulihannya Melaui Regulasi Apoptosis Sel Spermatogenik Tikus (Rattus sp) Pada Penyuntikan Kombinasi TU &
MPA. Disertasi. Program doktor Ilmu Biomedik FKUI
Ilyas, S. 2008. Efektivitas Kontrasepsi Hormonal Pria Yang Menggunakan
Kombinasi Testosteron Undekanoat dan Noretisteron Enantat. Dalam
Jurnal Biologi Sumatera. Vol. 3. No. 1. 23-28
Kamischke, A., Venherm S., Ploger D., von Eckardstein S., Nieschlag E. 2000.
Intramuscular testosterone undecanoate and norethisterone enanthate in a clinical trial for male contraception. J Clin Endocrinology Metab. Vol. 86. No. 1. 303-309
Kerr J. B. 1992. Spontaneous degeneration of germ cells in normal rat testis : assessment of cell typesand frequency during the spermatogenic cycle. J. Reprod. Fert No.95 825-830
Kusmana, D. 2001. Pengaruh Penyuntikan Kombinasi Hormon Testoteron Enathat (TE) dan Depot Medroksiprogesteron Asetat Terhadap Spermatogenesis Beruk Jantan (Macaca nemestrina) yang Diberi Pakan Berkadar Protein, Lemak, dan Karbohidarat Berbeda. Disertasi. Program pasca Sarjana FKUI
Lee J., John H. Richburg, Elizabeth B. Shipp, Marvin L. Meistrich and Kim Boekelheide. 1999. The Fas System, a Regulator of Testicular Germ Cell Apoptosis, Is Differentially Up-Regulated in Sertoli Cell Versus Germ Cell Injury of the Testis. Endocrinology Vol. 140 No. 2 852-858
Leeson R. C. 1996. Buku Ajar Histologi. Jakarta: EGC. Hal 511-533
Manika W., Tomaszewska, I Ketut Sutama, I Gede Putu, dan Thamrin D Chaniago. 1991. Reproduksi, Tingkah Laku Dan Reproduksi Ternak Di Indonesia. Jakarta: PT. Gramedia Pustaka Utama
Moeloek, N. H. 1991. Penurunan Kesuburan Pria Pada Penyuntikan Testoteron Enanthat+DMPA dan 19 Nortestoteron Heksiloksifenilpropionat (19 Nt) + DMPA. Disertasi. Program Pasca Sarjana FKUI
Nasikin. 2007. Ekspresi Protein Fas Pada Sel Germinal Testis Tikus setelah Penyuntikan Testosteron Undekanoat (TU) dan Medroksiprogesteron Asetat (MPA). Tesis. Magister Program Studi Ilmu Biomedik FKUI
Naz R. K. and Rajendran Sellamuthu. 2006. Receptor In Spermatozoa : Are They Real?. Journal of Andrology Vol. 7 No. 25
Reddy PRK. 2000. Hormonal contraception for human males. Asian J. Androl No. 2. 46-50
Sherwood L. 2001. Fisiologis manusia ; dari sel ke sistem ed. 2. Jakarta : EGC. Hal. 691-705
Suckow, M. A., Steven H. W., Craig L. F. 2006. The Laboratory Rat Second Edition. USA : American College of Laboratory Animal Medicine Series
Suherman S.K. 2008. Estrogen dan Progestin, Agonis dan Antagonisnya. Dalam: Farmakologi dan Terapi edisi 5 FKUI. Gaya Baru. Jakarta: 455-467
Weinbauer G. F., Nieschlag E. 1999. Testicular physiology of primates. In : Reproduction in nonhuman primates. Waxman, Muenster 13-26
WHO Laborhandbuch zur Untersuchung des menschlichen Ejakulats und der Spermien-Zervikalschhleim-Interaktion. 1999. Ubersetzung von: Nieschlag E., Nieschlag S., Bals-Pratsch M., Behre H. M., Knuth U. A., Meschede D., Niemeier M., Schick A., 4th edn. Springer, Berlin Heidelberg New York
Woferst, R. 2007. Pengaruh Penyutikan Kombinasi Testoteron Undekanoat Dan Depot Medroksiprogesteron Asetat Terhadap Aktivitas Protein Caspase-3 Sel Germinal Testis Tikus. Tesis. Program Pasca Sarjana FKUI
Yurnadi, Asmida Y, Suryandari D.A., Wahjoedi B., Moeloek N. 2008. Penentuan Dosis Minimal Depot Medroksi Progesteron Asetat serta Pengaruhnya terhadap Viabilitas Spermatozoa dan Kadar Hormon Testosteron Tikus. Majalah Kedokteran Indonesia, Vol. 58, No. 6. 192-199
Yurnadi, Dwi A. Y., Moeloek N. 2009. Pengaruh Penyuntikan Dosis Minimal Depot Medroksiprogesteron Asetat (DMPA) terhadap Berat Badan dan Kimia Darah Tikus Jantan Galur Spague Dawley. Makara Sains Vol. 13 No. 2. 189-194
Zhang Y., Yi-qun Gu, Xing-hai Wang, Yu-gui Cui and William J. Bremner.1999.
Lampiran 3. Bahan dan Alat Penelitian
Gambar 11. Nebido Gambar 12. Depo Progestin
Gambar 15. Larutan George Gambar 16. Tikus jantan
Lampiran 4. Kegiatan Penelitian
Gambar 19. Penimbangan tikus Gambar 20. Pengambilan Depo Progestin
Gambar 21. Pengambilan Nebido Gambar 22. Pengambilan mikroemulsi
Gambar 25. Persiapan hewan yang Gambar 26. Pembedahan akan dibedah
Gambar 27. Pengambilan jaringan/organ Gambar 28. Testis dan vas deferens
Gambar 31. Penampungan spermatozoa Gambar 32. Pengawetan testis
Gambar 33. Pengambilan lar. George Gambar 34. Pengenceran spermatozoa dengan lar. George
Gambar 35. Spermatozoa pada Gambar 36. Pengamatan dengan mikroskop kamar hemasitometer
Lampiran 5. Perhitungan Dosis
Untuk pemberian pada tikus, dosis yang digunakan dikonversikan berdasarkan perhitungan menggunakan berat badan yang berasal dari penelitian sebelumnya (Ilyas, 2004).
Berat badan manusia : 50 kg Berat badan tikus : 0,25 kg Perhitungan sebagai berikut :
Tabel 9. Dosis TU dan MPA pada Manusia
N = Nebido (Testosteron Undekanoat (TU))
DP = Depo progestin (Medroksiprogesteon Asetat (MPA)) ME = Mikro Emulsi ( TU/MPA)
Kos = Kosolven (TU/MPA)
Perhitungan Dosis Uji
1. Kelompok 1
Dosis Nebido (Testosteron Undekanoat) :
Dosis hewan = 2,5 mg
Dosis Depo progestin (Medroksiprogesteron Asetat) :
Dosis hewan = 1,25 mg
2. Kelompok 2
Dosis Nebido (Testosteron Undekanoat) :
Dosis hewan = 5 mg
Dosis Depo progestin (Medroksiprogesteron Asetat) :
Dosis hewan = 0,75 mg
3. Kelompok 3
Dosis Nebido (Testosteron Undekanoat) :
Dosis hewan = 5 mg
Dosis Depo progestin (Medroksiprogesteron Asetat) :
Dosis hewan = 1,125 mg
4. Kelompok 4
Mikroemulsi (TU/MPA) :
Dosis hewan (TU) = 2,5 mg
Mikroemulsi (TU/MPA) :
5. Kelompok 5
8. Kelompok 8 tidak mendapat perlakuan.
Tabel 10. Dosis TU dan MPA pada hewan percobaan (Tikus)
4 K4 FK ME
2,5 1,25
5 K5 FK
ME
5 0,75
6 K6 FK
ME
5 1,125
7 K7 FK
Kos
2,5 1,25
Lampiran 6. Perhitungan Penyuntikan pada Hewan Percobaan
Untuk penyuntikan pada hewan percobaan, perhitungan berdasarkan perhitungan menggunakan berat badan yang berasal dari penelitian sebelumnya (Ilyas S.,2004). Adapun perhitungannya sebagai berikut :
Perhitungan Penyuntikan Minggu ke-0 1. Kelompok 1 (N+DP)
Diketahui : Nebido = 1000 mg/4ml Depo progestin = 50 mg/ml
Dosis TU = 2,5 mg/250gr MPA = 1,25 mg/250gr Tikus I
Testosteron Undekanoat (Nebido = 1000 mg/4 ml)
Medroksiprogesteron Asetat (Depo progestin = 50 mg/ml)
Tikus II
Testosteron Undekanoat (Nebido = 1000 mg/4 ml)
Medroksiprogesteron Asetat (Depo progestin = 50 mg/ml)
Tikus III
Testosteron Undekanoat (Nebido = 1000 mg/4 ml)
2. Kelompok 2 (N+DP)
Diketahui : Nebido = 1000 mg/4ml Depo progestin = 50 mg/ml
Dosis TU = 5 mg/250gr
MPA = 0,75 mg/250 gr Tikus I
Testosteron Undekanoat (Nebido = 1000 mg/4 ml)
Medroksiprogesteron Asetat (Depo progestin = 50 mg/ml)
Tikus II
Testosteron Undekanoat (Nebido = 1000 mg/4 ml)
Medroksiprogesteron Asetat (Depo progestin = 50 mg/ml)
Tikus III
Testosteron Undekanoat (Nebido = 1000 mg/4 ml)
Medroksiprogesteron Asetat (Depo progestin = 50 mg/ml)
3. Kelompok 3 (N+DP)
Diketahui : Nebido = 1000 mg/4ml Depo progestin = 50 mg/ml
Dosis TU = 5 mg/250gr