F
/Tl tV),00'0
011£-\
ISOLASI PEPTON SECARA EKSTRAKSI ENSIMA TIS MENGGUNAKAN LIMBAH PERIKANAN
Oleh
ANDRl RENO SUSETYO 1'03495085
2000
FAKULTAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOGOR
[SOLASl PEPTON SECARA EKSTRAKSI ENSIIVIATIS MENGGliNAKAN
LIIVIBAH PERIKANAN
Oleh
ANDRl RENO SUSETYO
F03495085
SKRlPSI
Sebagai salah satu syarat untuk memperoleh gelar
SARJANA TEKNOLOGI PERTANIAN
pacla Jurusan Teknologi lnclustri Pertanian Fakultas Teknologi Pertanian
Institut Pertanian Bogor
2000
FAKliL TAS TEKNOLOGI PERTANIAN
[NSTITUT PERTANIAN BOGOR
INSTITUT PERTANIAN BOGOR
FAKULTAS TEKNOLOGI PERTANIAN
ISOLASI PEPTON SECARA EKSTRAKSI ENSIMA TIS
MENGGUNAKAN LlMBAH PERIKANAN
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar
SARJANA TEKNOLOGI PERTANIAN
pada Jumsan Teknologi Tndustri Pertanian Fakultas Teknologi Pertanian
lnstitut Pertanian Bogor
Olel!
ANDRIRENOSUSETYO
F03495085
Dilahirkan di Yogyakarta pada Tanggal 22 Juni 1977
Tanggal Lulus: 2 November 2000 Disetujui,
Bogor,
Andri Reno Susetyo, F0349S08S. Isolasi Pepton SeCaNt Ekstraksi Ensimatis Menggunakan Limbah Perikanan, di bawah bimbingan Erliza Noor dan Endang Sri Heruwati.
RINGKASAN
Seiring dengan perkembangan mikrobiologi di dunia, kebutuhan akan substrat nitrogen sebagai media pertumbuhan mikroorganisme semakin meningkat. Pepton merupakan salah satu sumber nitrogen bagi pertumbuhan mikroorganisme, yang dapat diekstrak dari bahan-bahan yang mengandung protein. Limbah perikanan merupakan sumber protein potensial yang dapat digunakan sebagai bahan baku pepton. Produksi pepton dapat menjadi salah satu alternatifpengolahan limbah perikanan sehingga dapat meningkatkan nilai tambah limbah tersebut.
Penelitian ini bertujuan untuk memperoleh teknologi ekstraksi pepton kasar dari limbah perikanan, mempelajari pengaruh r:arameter fisik (suhu dan waktu) dan parameter kimia (pH dan konsentrasi ensim) terhadap proses ekstraksi, serta membandingkan kualitas pepton yang dihasilkan terhadap beberapa jenis pepton komersial dalam mendukung pertumbuhan mikroorganisme.
Tahap pertama dari penelitian ini adalah produksi pepton secara autolisis dan hidrolisis. Autolisis merupakan metoda hidrolisis protein daging dengan menggunakan katalis ensim internal (endogenous enzylJl). Limbah pengolahan ikan yang berupa isi perut mengandung beberapa endogenous ensim antara lain pepsin dan trypsin. Ensim pepsin dapat diaktifkan dengan penambahan asam. Teknik tersebut dikenal sebagai ensilasi (silase). Penambahan HCI pekat dilakukan sampai pH bahan 2-3 di mana selang pH tersebut merupakan kondisi pH optimal aktifitas ensim pepsin, dan suhu yang digunakan adalah 40°C dan suhu kamar. Metoda ekstraksi pepton yang kedua adalah hidrolisis protein dengan menambahkan ensim proteolisis kepada bahan yang tidak mengandung endogenolls enzYI1l. Di dalam penelitian ini ensim proteolisis yang digunakan adalah ensim alcalase (Subtilisin Carlsberg) 2,4 L yang diproduksi oleh Novo. Ensim tersebut merupakan proteosa bakteri Bacillus licheniforlJlis. Konsentrasi ensim yang digunakan dalam penelitian ini adalah 0,2 %, 0,4 %, dan 0,6 % (v/b). Suhu yang digunaknan dalam penelitian ini adalah SOnC, 60°C dan 70°C. Waktu pengamatan dilakukan pada jam ke-2, 4, 6, dan 8.
Tahap ke dua penelitian adalah pengujian pepton sebagai media pertumbuhan mikroorganisme. Pepton komersial yang digunakan sebagai pembanding adalah merek Difco, Oxoid dan Merck. Media pertumbuban dibuat sehingga konsentrasi protein pepton dalam media sebesar 0,5 % (b/v). Mikroorganisme yang digunakan dalam uji ini adalah
E.
coli, B. subtilis, S. aurellS, S. cel'evisiae, A. niger, kultur campuran isolasi dari susu, kultur campuran dari telur serta kultur campuran dari daging ikan.konsentrasi ensim 0,2 persen (v/b) dan waktu ekstraksi (hidrolisis) 8 jam pada pH bahan 6,6-6,7. Pada kondisi tersebut sekitar protein bahan (limbah pengolahan ikan tuna berupa kepala tuna) telah terhidrolisis sekitar 70-80 persen.
KATA PENGANTAR
Alhamdulillahi rabbilalamin, segal a puji dan syukur penulis panjatkan kehadirat Allah SWT, karena atas rahmat, karunia dan petunjuk-Nya penulis dapat menyelesaikan penulisan skripsi ini. Skripsi ini adalah hasil penelitian penulis yang berjudul "Isolasi Pepton secara Ekstraksi Ensimatis Menggunakan Limbah Perikanan", yang merupakan proyek dari Balai Penelitian Perikanan. Penelitian tersebut dilaksanakan di Balai Penelitian Perikanan, Instalasi Penelitian Perikanan Laut, Slipi, Jakarta mulai bulan Juni 1999 sal11pai dengan Mei 2000. Dalal11 kegiatan ini, penulis l11erasa banyak mendapatkan pengetahuan, wawasan serta pengalaman baru yang sangat berharga.
Se1ama pelaksanaan penelitian dan penulisan skripsi ini penulis telah banyak mendapat bantuan baik secara moril maupun l11ateril dari berbagai pihak. Oleh karena itu pada kesel11patan ini penulis ingin l11engucapkan rasa terima kasih dan penghargaan yang setinggi-tingginya kepada :
1. Almarhum bapak, ibu, mas Jalu dan dik Aji atas perhatian, dorongan semangat, kasih sayang serta doa restu yang tiada henti-hentinya kepada penulis.
2. Dr. Ir. Erliza Noor, selaku pembimbing akadel11ik penulis atas bimbingan dan dorongan semangat serta perhatian yang diberikan baik selama pelaksanaan penelitian dan penulisan skripsi maupun selal11a penu!is menjadi mahasiswa bil11bingan di TIN.
3. Dr. Ir. Endang Sri Heruwati, selaku pel11bil11bing penelitian atas bimbingan, araban dan perhatian selama pelaksanaan penelitian dan penulisan skripsi.
4. Dr. Hj. Tatit 1<.. Bunasor, MSc., selaku dosen penguji atas kesediaan dan masukan yang diberikan untuk memperbaiki skripsi ini.
6. Seluruh keluarga besar Balitkan, Inlitkanlut, Slipi, Jakarta, terutama kepada ibu Rosmawati P. selaku kepala Balai yang telah memberikan ijin kepada penulis untuk melaksanakan penelitian di Balitkan, Inlitkanlut. 7. Ternan-ternan seperjuangan Indra, Maya, Lulu, Mardiah, Abo, Arya,
Imin, Akbar, Ugi dan Dendin untuk semua dukugan moralnya.
8. Ternan sepenelitian Budi dan Yuyun atas semua bantuannya baik selama penelitian dan di luar penelitian.
9. Semua pihak yang telah membantu penulis dalam menyelesaikan skripsi ini yang tidak dapat penulis sebutkan satu persatu.
Penulis menyadari bahwa skripsi ini masih jauh dari kesempurnaan. Penulis akan sangat menghargai semua masukan serta kritik yang membangun bagi skripsi ini. Terakhir, penulis berharap semoga karya tulis ini bisa bermanfaat bagi semua pihak yang membutuhkan.
Bogor, November 2000
DAFTAR lSI
Kata Pengantar ... . Daftar lsi ... . ... 11l
Daftar Tabel ... ... v
Daftar Gambar ... . .. ... VI Daftar Lampiran ... Vlll 1. Pendahuluan A. Latar Belakang ... . B. Ruang Lingkup ... 2
C. Tujuan ... 2
II. Tinjauan Pustaka A. Limbah Perikanan ... .. 3
B. Protein ... 4
C. Ensim ... 5
D. Ekstraksi Secara Hidrolisis dan Autolisis ... ... 9
E. Penelitian Terdahulu ... 11
III. Metodologi A. Bahan dan Alat ... 12
B. Metoda Penelitian ... .. 12
C. Prosedur Analisis ... . . ... 18
D. Perhitungan ... 19
IV. Hasil dan Pembahasan
A. Autolisis ... .. B. Hidrolisis Ensimatis ... ..
C. Kllalitas Ekstrak Pepton Hasil Alltolisis dan Hidrolisis D. Uji Pert1l1l1bllhan fvIikroorganis1l1e ...
v.
Kesil1lplilan dan SaranA Kesimpllian B. Saran
Daftar Pllstaka Lampiran
37
4)
45
47 4')
DAFTAR TABEL
Tabel I. Hasil anal isis proksimat usus dan lambung ikan pari. Tabel 2. Hasil anal isis proksimat kepala tuna ... ..
Tabel3. Komposisi kimia ekstrak pepton dan pepton komcrsial.
Tabel4. Perbandingan komposisi asam amino (g/IOO g protein) ekstrak pepton terhadap pepton komersial ..
Tabel5. Perbandingan total pertumbuhan mikroorganisme .. Tabel 6. Perbandingan laju pertumbuhan J11ikroorganisJ11c .
Tabel7. Perbandingan total produksi J11assa sel mikroorganisme setelah
22
i.()
34
36
38
41
DAFTAR GAMBAR
Gambar I. Stabilitas substilisin carlsberg pad a suhu yang bcrbcda ... X Gambar 2. Diagram alir proses isolasi pepton dengan hidrolisis Ensim
internal (autolisis) ... 14 Gambar 3. Diagram alir proses isolasi pepton dengan hidrolisis Ensim
eksternal ... I 5 Gambar 4. Penampakan usus dan lambung ibn pari ( Ti-ygoll -'"Pi segaL.. セ@ I Gambar 5. Grafik nitrogen terlarut / nitrogen total bahan ckslraksi pcplon
isi perut ik.an pari secm'a autolisis .. ... ... ... ... ... .... 23
Gambar 6. Grafik perubahan nilai pH pad a proses ekstraksi pcpton isi
perut ikan pari seem·a autolisis... 24
Gmnbar 7. Cairan ekstrak pepton isi perut ikan pari. ... ... ... ... ... 25
Gat11bul' 8. Penampakan kcpaln ikan tuna... 2()
Gambar 9. Pengaruh suhu terhadap rasio N tolal terlarul / N lolal bah an
pada ekstraksi pepton kepala tuna ... ,... 2R
Gambar 10. Grafik pengaruh waktu hidrolisis terhadap rasio N lotal
terlarlll / N Iota I bahan pada suhu
sone ... ... ... ... ... ... ...
29 Gambar I I. Pengaruh konsenlrasi terhadap rasio N total lcrlarul / N tolalbahan pad a suhu 50"e ... }() Gambar 12. Grafik perubahan nilai pH pada proses ekstraksi peplon
kepala tuna ... . Gambar 13. Penampakan ekstrak pepton kepala tuna ... . Gambar 14. Hasil produksi ekstrak pepton pari dan ekstrak ]lepton
l<epala tl1113 ... 35
Gambar 15. Total pertumbuhan mikroorganisme pada medium
sederhana dari beberapajenis pepton ... 38
Gambar 16. Grafik pertumbuhan mikroorganisme pada medium
VI!
Gambar 17. Laju pertumbuhan mikroorganisme pada medium sederhana dari beberapajenis pepton ... 41 Gambar 18. Grafik produksi mass a selmikroorganislllc yang
DAFTAR LAMP IRAN
Lampiran 1. Spesilikasi Ensim Alkalase... .j'l
Lampiran 2. Metoda Analisis Protein... 50
Lampiran 3. Data Nitrogen Total Terlarut / Nitrogen Totaillahan pada Optimasi Silase (Pepton lsi Perut Ikan Pari) ... 51
Lampiran 4. Data nilai pH pada proses ekstraksi pepton isi penn ikan pari 5J Lampiran 5. Data Nitrogen Total Terlarut / Nitrogen Total Bahan pada Optimasi Hidrolisis Ensimatis (Pepton Kepala Tuna) ... 54
Lampiran 6. Data Nilai pH pada Optimasi Hidrolisis Ensimatis (Pepton I(epala rruna ... ,... 55
Lampiran 7. Basil Analisis Asam Amino Larutan Protein Slantim Menggunakan High Performance Liquid Chromatography (BPLC) ... 56
Lampiran 8. 1-Iasil Analisis Asam Amino Pepton lsi Perul Ikan Pari Menggunakan High Performance Liquid (,hrol11<llography (BPLC) ... 57
Lampiran 9. Basil Analisis Asam Amino Pepton Kepala Tuna Menggu-nakan High Performance Liquid Chromatography (I-IPL(,).. 5X Lampiran 10. Data Total I'ertumbuhan Mikroorganisme (Absorbansi pada 24 Jam) ... 59
Lampiran 11. Data absorbansi pertumbuhan mikroorganismc... 60
Lampiran 12. Data Laju Pertumbuhan Mikroorganisme... 63
I. PENDAHlJ LUAN
A. LATAR BELAKANG
Nitrogen merupakan salah satu lil1S11r yang sang,rl penting bagi
pertumbuhan mikroorganisme. Sumber nitrogen bagi mikroorganisme dapat diperoleh dari senyawa organik maupun senyawa anorg<wik. Salah satu sumber nitrogen dalam media mikrobiologi yang paling utama adalah pepton. Pepton merupakan senyawa turunan sekunder dari protein, yang dapat diperoleh dengan l11enghidrolisis protein hewani seperti daging, organ tubuh bagian dalam, gelatin, susu dan kasein. Sumber nitrogen dari senyawa organik lebih baik digunakan dalam media pertumbuhan mikroorganisl11e dibanding sumber nitrogen dari senyawa anorganik kareqa senyawa organik
masih memiliki gugus as am amino yang langsung dapat digunakan oleh mikroorganisme.
Sumber nitrogen merupakan bahan utama sekaligus yang paling mahal dalam media mikrobiologi. Harga pepton komersial dan sumber nitrogen organik lainnya di Indonesia sangat mahal karen a masih harus diill1por dari
luar negeri. Menurut Biro Pusat Statistik (1998) impor pepton dan
turunannya dari tahun ke tahun sell1akin meningkat. Pada tahun 1997 ImIX)I' pepton dan tumnannya sebesar 1.602.415 kg dengan nilai sebesar US $ 3.362.761. Sedangkan dari bulan Janua\'i sampai bulan Agustus 1998 Impor pepton Indonesia sebesar 862.123 kg dengan nilai sebesar US $ 3.759.272. Perkembangan bioteknologi di Indonesia baik di tingkat penelitian 1l1aupun di tingkat komersial saat ini sangat pesat, oleh karena itu diperlukan pepton yang berkualitas tinggi dengan harga yang murah.
2
diharapkan dapat menjadi salah satu alternatif pengolahan limbah perikanan serta dapat lebih meningkatkan nilai tambah dari limbah perikanan tersebut.
B. RUANG LlNGKUP
Penelitian ini dilakukan dalam dua tahap. Tahap pertama adalah penentuan kondisi optimal ekstraksi pepton dari limbah perikanan dengan teknik autolisis dan hidrolisis. Parameter yang digunakan yaitu suhu, pH, clan lama proses hidrolisis, serta konsentrasi enzim. Kondisi ekstraksi optimal dicirikan oleh kandungan nitrogen terlarut tertinggi, mengindikasikan semakin tingginya kandungan pepton.
Tahap kedua penelitian adalah pengujian kinerja pepton yang dihasilkan pada kondisi optimal sebagai media p;ortumbuhan mikroorganisme, dibandingkan dengan kinerja pepton komersial yang tersedia di Indonesia sepe!ti Oxoid, Difco, dan Merck. Mikroorganisme yang akan digunakan dipilih yang dapat mewakili berbagai jenis dan sifat mikroorganisme yang sering digunakan dalam lIji mikrobiologi seperti sitat terhadap pewarnaan gram, keblltllhan oksigen, pembentukan spora, atau produksi gas, antibiotik
dan sebagainya.
C. TUJUAN PENELlTIAN
Penelitian ini bertujuan :
l. Memperoleh teknologi ekstraksi pepton kasar dari limbah perikanan. 2. Mempelajari pengaruh parameter flSik (sllhu dan waktu) dan parameter
kimia (pH dan konsentrasi enzim) pada proses ekstraksi pepton.
3. Membandingkan kualitas pepton yang dihasilkan terhadap bebe! apa Jen!s pepton komersial dalam mendukung pertllm bll han berbagai
II. TlNJAUAN PUSTAKA
A. L11YIBAH PERIKANAN
/
Dalam industri pengolahan ibn, hasil samping yang sang at penting adalah kotoran (ojlitl) yang terdiri dari sel11ua bagian limbah seperti kepala, usus, ekor, sirip dan lain-lain, yang terbuang dari proses pengirisan (jilielilllf,). pengalengan dan pengawetan ikan dengan pengasapan (Gllvindan, 1985).
Jumlah limbah ikan cukup banyak dan nilainya sangat rendah. Bila tidak dimanfaatkan, limbah ikan sangat berpotensi sebagi sumber pencemaran karena sangat mudah dan cepat membusuk. Peluang pemanfaatan menj ad i sumber nutrisi bagi pertumbuhan mikroorganisme cukup besar, namun barll sedikit yang dimanfaatkan (Clausen, e/ al., 1985)
JU1111ah ikan dan hew an invertebrata laut lainnya di dunia mencapai 100 juta ton, dari jumlah tersebut sebanyak 20 persen diolah llntuk pangan
Kurang lebih 30 persen dari jumlah tersebut dikonsumsi dan sisanya dibllang sebagai lil11bah. Limbah tersebllt secara umum telah dapat dikurangi dengan diproses menjadi tepung dan minyak ikan, silase atau protein konsentrat dan atau protein hidrolisat (Shahidi, 1994). Berdasarkan perhitungan tersebut.. jUl111ah limbah perikanan di Indonesia cukup besar. Menurlll Ditjenkan (1997) produksi perikanan laut di Indonesia tahun 1995 mencapai 2.752.838 ton dan setiap tahun mengalami kenaikan rata-rata 8,0 persen.
Penelitian mengenai pemanfaatan limbah perikanan sebagai media pel1Ul11buhan mikrobiologi telah banyak dilakukan di manca negara. Mikroorganisl11e yang telah diteliti pertumbuhannya pada media tersebut antara lain mikroorganisme anaerob dan mikroorganisme penyebab penyakit pada ikan. Sebagai contoh pemanfaatan limbah pengalengan ibn sal mOll.
,I
B. PROTEIN
l. Protein Ikan
Menurut Shahidi (1994), kandungan protein pada ikan umumnya antara 11-27 persen. Protein bahan pangan laut dapat digolongkan menjadi tiga yaitu sarcoplasmic, myoflbrillar dan stroma. Sarcoplasmic protein, terutama albumin kurang lebih 30 persen dari total protein, myofibrillar protein kurang lebih 40-60 persen dan sisanya digolongkan sebagai stroma protein.
Adapun menurut Peterson dan Johnson (1978), pada umulllnya daging ikan mengandung 18-22 gralll protein per 100 gralll bahan yang dapat dimakan. Kandungan protein pada berbagai bagian tubuh ikan tidak selalu sama. Nilai nutrisi protein ikan sama atau lebih baik dari pada protein susu, kasein. Nilai ProteiJl 4l.fh.:ieJlcy Ratio (PER) dari konsentrat protein ikan sebanding atau sedikit lebih baik daripacla PER kasein dan sekitar 60 persen lebih tinggi dari PER tepung kedelai.
Protein Illerupakan komponen yang sangat penting dari ikan karena mempengaruhi nilai nutrisi pada ikan. Pada berbagai sum bel' pangan. jumlah protein biasanya ditunjukkan oleh protein kasar ulllumnya 6,25 dari total nitrogen. Untuk daging dan ikan jumlah protein kasar sekitar
5,72-5,82 kali total nitrogen. Jumlah tersebut tennasuk kandLlllgan nitrogen non-protein. Pada beberapa bahan pang an jumlah nitrogen non protein sekitar 25 persen dari total nitrogen. Protein kasar pada isi perut ikan sekitar 7,5-23,9 persen bobot basah (Sikorski, 1994).
2. Pepton
5
Pepton adalah campuran larut air dari proteosa dan as am amino turunan dari albumin, daging atau susu. Pepton digunakan sebagai nutrisi media dalam bakteriologi (Peterson dan Johnson, 1978).
Adapun menurut Pelczar dan Chan (i 986) pepton merupakan produk yang dihasilkan dari bahan-bahan yang mengandung protein seperti daging, kasein dan gelatin. Penguraian bahan-bahan protein tersebut dapat dilakukan dengan asam atau ensim. Pepton mempunyai kemampuan yang berbeda dalam menunjang pertumbuhan bakteri, tergantung pada jenis protein yang digunakan dan proses ekstraksinya. Pepton sebagai sumber nitrogen organik dapat mengandung vitamin dan ada pula yang mengandung karbohidrat.
Pepton merupakan bahan yang berupa bubuk dan kering yang diperoleh dari penguraian protein menggunakan ensim pepsin. Pepsin mengkatalis hidrolisis protein komplek menjadi larutan campuran polipeptida, dipeptida, dan asam amino yang secara keseluruhan disebut pepton. Komposisi kimia pepton tidak diketahui secara tepat.
Produk lain yang serupa pepton adalah trypton yang dihasilkan dengan cara yang sarna akan tetapi ensim yang digunakan adalah trypsin, yang bekerja pada kondisi netral atau basa. Selain pepton dan trypton, . hidrolisat protein hasil hidrolisis protein oleh asam dapat juga digunakan sebagai sumber nitrogen organik terlarut bagi mikroorganisme (Sarles el
at.
,1956).Beberapa penelitian telah membuktikan bahwa pepton merupakan sumber nitrogen yang penting dalam media pertumbuhan mikroorganisme. Penelitian tersebut antara lain Erwin, el al. (1993) membuktikan bahwa pepton merupakan sumber nitrogen terbaik dalam memproduksi Lignolitik Peroksidase (LiP).
C. ENSIM
6
ensnll adalah reversibel (dapat balik) tetapi ada ensnll yang mempercepat reaksi satu arah. Pada umumnya ensim mempercepat tiga jenis reaksi yaitu hidrolitik, respiratori, dan sintetik (Sarles, et al., 1956).
Adapun menurut Lehninger (1982) ensim merupakan unit fungsional dari metabolisme sel. Ensim memiliki tenaga katalitik yang luar biasa dari pada katalisator sintetik. Beberapa sifat ensim antara lain spesifitas ensim sangat tinggi terhadap substratnya, mempercepat reaksi kimiawi spesifik tanpa pembentukan produk samping, dan berfungsi di dalam larutan encer pada suhu dan pH normal.
Karakteristik ensim menurut Sarles, et al. (1956) yaitu:
1. Kerja ensim spesifik, ensim hanya dapat mengkatalis reaksi tertentu. 2. Aktifitas ensim dipengaruhi oleh suhu.
3. Aktifitas ensim dipengaruhi oleh pH.
4. Aktifitas ensim mungkin dipengaruhi oleh ion tertentu misalnya PO/-, M g,ataua. 2+ C 2+
5. Dalam kondisi yang optimum aktifitas ensim juga dipengaruhi oleh waktu
Berbagai jenis ensim telah dipelajari oleh ilmuwan pang an "ntara lain ensim protease dari ikan. Beberapa tahun terakhir telah banyak penelitian mengenai recovery ensim pencernaan proteolitik dari limbah pengolahan ikan (Haard, 1994).
Barth, et at. (1995) telah meneliti isi perut (viscera) ikan sebagai bahan yang kaya akan ensim proteolitik, ekso dan endopeptidase. Dari penelitian tersebut ditemukan tujuh ensim dalam gastl'o intestinal (sistem lambung usus) dari ikan tilapia dan carp, yaitu endoprolypeptidase, leucinaminopeptidase, cysteinaminopeptidase, prolylaminopep/idasl!, trypsin,
chymotrypsin, dan aminopeptidase B.
7
Protease lain yang terdapat pada ikan adalah pepsin. Pepsin termasuk dalam aspartik proteinase dalam kelenjar getah lambung hewan vertebrata. Pepsin ikan dapat ditunjukkan oleh empat atau lebih isoensim tetapi pada umumnya terdapat dua isoensim utama yaitu pepsin I dan pepsin II. Pepsin ikan memiliki pH optimal 3,5, kestabilan terhadap suhu rendah dan aktifitas molekulnya tinggi pada suhu rendah (Haard, 1994).
Menurut Poernomo (1997) ensim pepsin yang diekstrak dari isi perut ikan pari memiliki suhu optimal 35-45°C. Pepsin isi pemt ikan pari memiliki pH optimal antara 1,5-2. Aktifitas pepsin akan menumn dengan cepat pada pH di atas 4.
Selain dari hewan protease juga dapat diperoleh dari tumbuhan. Salah satu protease tumbuhan adalah papain, yang mempakan kurang dari 10 persen dari total aktifitas proteolitik getah pepaya. Ensim ini mempunyai berat molekul 23000, tidak aktif pada pH rendah (pH 2), memiliki pH optimal yang relatif besar dengan aktifitas maksimum pada pH 6-8 dan memiliki titik isoelektrik pada pH 8,75, serta dapat diinaktifkan pada suhu antara 60-70oC. Ensim papain relatif tidak lamt dan mudah terpresipitasi oleh penambahan NaCl encer, serta dapat l11elakukan ban yak aktifitas dalam l11endegradasi protein dan menghidrolisis peptida, ikatan al11ida dan ester (Peterson dan Johnson, 1978).
Adapun menurut Liener (1980) dalam Syahrial (1991), papam memiliki kestabilan yang relatif tinggi terhadap faktor suhu dan pH. Aktifitas papain berada pada selang pH 3-11 dengan suhu sal11pai 75°C. Suhu optimal papain adalah 50-60°C dan pH optimal 5-7. Papain relatif lebih tahan terhadap panas jika dibandingkan dengan ensim proteolitik lainnya.
Rose (1980) menerangkan bahwa Subtilisin Carlsberg adalah enSlm yang diproduksi oleh B. licheniformis. B. lichenijbrmis merupakan Bacillus
saprofit yang lebih mirip dengan B. slIhtilis. Ensim Subtilisin Carlsberg tidak diproduksi pada kondisi anaerobik, nilai pH optimum tergantung pada substrat dan kondisi reaksi, dan mudah terinaktifasi dengan cepat di bawah pH 5 dan di atas pH 11, serta memiliki kestabilan aktitltas yang tinggi pada suhu 50°C. Ensim ini telah diproduksi secara komersial oleh perusahaan Denmark, Novo Industri AJS sejak tahun 1960 dengan nama dagang Alcalase. Novo mengembangkan ensim ini sebagai ensim pencuci yang dicampurkan ke dalam detergen. Novo memproduksi ensim tersebut kurang lebih 500 ton pertahun.
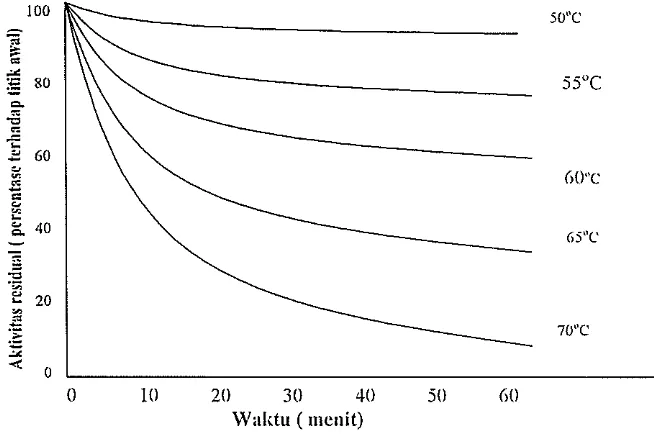
Rose (1980) menyatakan bahwa aktifitas alcalase mencapaJ maksimum pada suhu 60°C dalam waktu 10 menit. Pada suhu 50°C aktifitas alcalase lebih stabil dari pada suhu 60°C dan 70°C dalam waktu 60 menit hidrolisis (Gambar 1). Semakin lama waktu hidrolisis maIm aktifitas ensim semakin menurun. Kecepatan hidrolisis tergantung dari satuan aktifitasnya yang dinyatakan dalam anson units/ml.
100 50"C
;:;
;.
=
""
;§ 80 Q.
セ@
"0
セ@
"i:
-" 60
GO"c
G5"C
セ@
セ@
セ@20
セ@
セ@
. .@
.:: 70"C
"
<{0
0 10 20 30 40 50 GO
Waktu ( II1cnit)
[image:21.595.155.482.441.660.2]9
D. EKSTRAKSI SECARA HIDROLISIS DAN AUTOLISIS
1. Hidrolisis Protein
Pepton dapat diekstraksi dengan metoda hidrolisis dan autolisis dari bahan yang mengandung protein (Stephens, et aI., 1976). Reaksi hidrolisis merupakan reaksi penambahan air pada senyawa kompleks dan memotong senyawa tersebut menjadi senyawa yang sederhana dan menjadi produk yang lebih larut (Sarles,
e/ at.
,1956).Menurut Somaatmadja (1975), dalam reaksi hidrolisis ikatan peptida, protein akan diuraikan menjadi peptida-peptida sederhana dan asam-asam amino. Turunan protein primer adalah protean, metaprotean dan protein terkoagulasi, sedangkan turunan protein sekunder yaitu proteosa, pepton dan peptida.
Proses hidrolisis protein dapat dilakukan dengan menggunakan asam, alkali (basa), atau ensim untuk menghasilkan as am ammo penyusunnya. Penguraian protein dengan metoda bidrolisis asam paling sering digunakan dalam penganalisisan komposisi asam amino dari hidrolisat protein. Pada pembuatan hidrolisat tersebut, protein dicampur dengan 6 N HCI dan dialirkan pada suhu mendidih selama 9-12 jam (Peterson dan Johnson, 1978).
Hidrolisis protein dan peptida sederhana dengan asam atau basa akan menghasilkan suatu campuran asam amino bebas. Tiap jenis protein menghasilkan campuran atau proporsi jenis-jenis asam amino yang khas setelah melalui proses hidrolisis (Lehninger, 1982).
10
Govindan (1985) menjelaskan pembuatan pepton bakterial dari daging ikan dengan metoda hidrolisis. Pertama ikan dibersihkan, tulang, kulit dan isi perut dibuang. Daging ikan di masak kemudian dip eras (kandungan air dibuang). Lemak ikan dibersihkan dengan pelarut aeeton. Aeeton-Iemak dihilangkan dengan pemerasan dan sisanya diuapkan. Daging bebas lemak dieampur dengan air dengan perbandingan I: I dan pH 6,5. Papain ditambahkan dengan perbandingan I :30 (nitrogen ensim : nitrogen substrat), kemudian diaduk dan dipanaskan pada suhu 50-55°C
selama 8 sampai 10 jam, sehingga hidrolisis sempurna. Produk dikeringkan dalam ruang hampa, sehingga didapatkan pepton berbentuk bubuk higroskopis.
2. Autolisis Protein
Autolisis merupakan proses pemecailan sebagian at au total dari jaringan otot, sel atau bahan penyusunnya (protein) oleh ensim internal. Protein, lemak dan karbohidrat jaringan otot (glikogen) serta asam nukleat perlahan terpeeah menjadi molekul yang lebih kecil. Autolisis biasanya menghasilkan substrat yang baik untuk pertumbuhan mikroba, dim ana peptida dan as am amino yang terbentuk langsung dapat digunakan oleh mikroorganisme dari pada protein yang molekulnya lebih besar (Peterson dan Johnson, 1978).
Adapun menurut Sarles, el a/. (1956) autolisis merupakan hasil aktifitas lanjutan dari ensim dalam sel setelah sel tersebut mati. Ensim tersebut mengkatalis reaksi hidrolisis yang mungkin dapat mendekomposisi senyawa penyusun sel ketika sel tersebut mati.
II
Lo, e/ al. (1993) menerangkan pembuatan silase ikan dari bagian tubuh ikan yang mati dengan penambahan asam sitrat, format, dan propionat atau kombinasinya. Ensilasi dengan as am format biasanya dilakukan pada pH 3,5-4,0 dan dengan as am propionat pada pH 4,5. Selama proses ensilasi, protein dipecah oleh ensim dan nitrogen dalam silase menjadi lebih laru!. Kelarutan nitrogen pada silase meningkat pada awal proses dan menurun setelah 10 hari ensilasi. Konsentrasi asam format yang ditambahkan biasanya 3 persen (volume per berat).
E. PENELITIAN TERDAHULU
Penelitian tentang pembuatan pepton dari limbah perikanan sebagai nutrisi media pertumbuhan mikroorganisme telah banyak dikembangkan di manca negara. Stephens, el al. (1976) meneliti kemllngkinan penggunaan limbah pengolahan udang sebagai bahan pembuatan pepton secara autolisis. Hasil pepton tersebut kemudian diuji kemampuannya membantu pertumbuhan mikroorganisme dan dibandingkan dengan lima jenis pepton komersial.
Clausen, et al. (1985) mempelajari penggunaan isi perut ikan dari limbah ikan di Troms6, Norwegia untllk memproduksi peptida dan asam amino terlarut sebagai sumber nitrogen bagi bakteri. Page dan Cornish (1993) telah mempelajari penggunaan pepton ikan sebagai media pertumbuhan Azotobacter vinelandii untllk memprodllksi PHB (poli 13 hydroksibutirat).
Ill. METODOLOGI
A. BAHAN DAN ALAT
Bahan baku utama yang digunakan pada penelitian ini adalah limbah perikanan berupa kepala tuna (Thull/ills .Ip.) yang merupakan limbah pengolahan ikan tuna PT Bonecom, Muara Baru, Jakal1a dan isi perui ikan pari (li'ygO/l .IV) yang diperoleh dari industri pengolahan hasil perikan tradisional di Muara Angke, Jakarta, dan industri pengolahan ikan pari eli Labuhan Maringgai, Lall1pung. Ensil11 eksternal yang digunakan untuk menghidrolisis protein adalah Alcalase 2,4 L (Novo). Deskripsi lengkap tentang ensim ini diberikan di Lampiran 1. Bahan kill1ia yang ditambahkan pada proses autolisis adalah HCl 37 % p.a. Merck. Bahan yang digunakan untuk uji pel1umbuhan mikroorganisme yaitu dextrose (Difco), pepton komersial (Merck, Difco, Oxoid), agar (Difco), saline 0,85 % (b/v) (Difco), HCI 1 N dan NaOH 1 N.
Peralatan yang digunakan adalah bejana (wadah) untuk ll1enghidrolisis protein, ovenlinkubator, pH meter, peralatan sentrifugasi (Beckman .12-21), peralatan analisis proksil11at, lemari pendingin, serra peralatan Ut I
mikrobiologi seperti cawan petri, tabung reaksi, erlenmeyer, spektrofotllmeter (Shimadzu UV-120 I), inkubator shaker dan lain-lain.
B. METODA PENELlTlAN
13
1. Tahap Autolisis dan Hidrolisis
a. Hidrolisis secara autolisis (Poernomo, 1997)
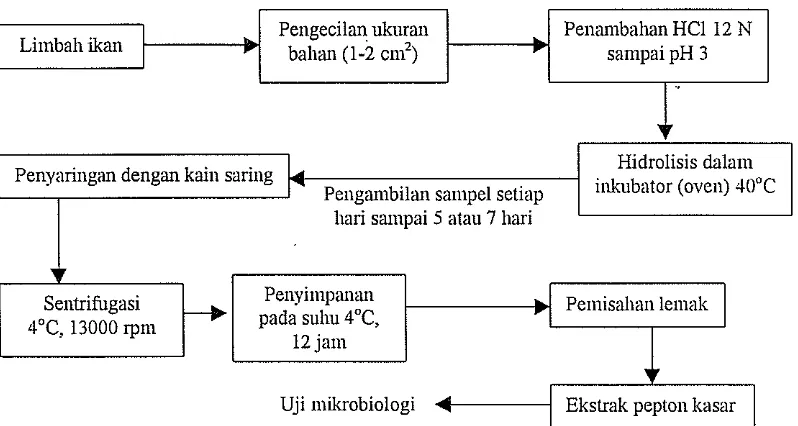
Bahan yang digunakan adalah isi perut ikan pari. Bahan yang diambil dari PHPT Muara Angke dan atau Lampung, dibawa ke temp at penelitian dalam suhu di bawah O°C dengan menggunakan kemasan transpor berpendingin atau dengan menambahkan es batu ke dalam kemasan tersebut. Setelah sampai di tempat penelitian semua kotoran yang ada dalam bahan dikeluarkan dan bahan tersebut dicuci bersih dengan air agar tidak terdapat bakteri coliform yang dapat mengganggu proses autolisis. Jika bahan belum akan digunakan maka bahan harus disimpan dalam keadaan beku di dalam freezer. Apabila terdapat perubahan fisik (warn a dan bau) pada bahan maka bahan dianggap tidak layak untuk digunakan karena diduga telah mengalami perubahan kandungan proteinnya. Berdasarkan pengamtan isi perut ikan pari mengalami perubahan fisik setelah disimpan selama I sampai 1,5 bulan. Bahan dipotong kecil-kecil (1 cm2) dimasllkkan ke dalam wadah
14
Pengeeilan ukuran Penanlbahan HCI 12 N Limbah ikan : • bahan
(1-2
em2) , sampaipH 3
'.
Penyaringan dengan kain saring
L.
Hidrolisis dalam inkubator (oven) 40'C Pengambilan sampel setiaphari sampai 5 atau 7 hari
Sentrifugasi
セ@
Penyimpanan 'I PemisahanlemakI
pada suhu 4°C,4'C, 13000 rpm
[image:27.595.98.497.88.301.2]12 jam
Gambar 2.
Uji mikrobiologi Ekstrak pepton kasar
I
Diagram alir proses isolasi pepton dengan hidrolisis ensim internal (Autolisis) (Poernomo, 1997)
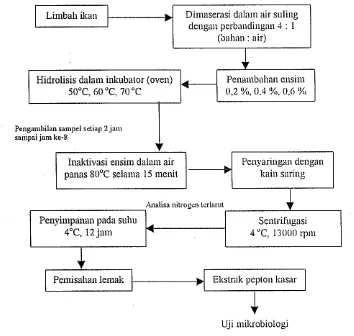
b. Hidrolisis menggunakan ensim eksternal (Balitkan, 1999)
Kepala tuna yang diambil dari PT Bonecom, dibawa ke tempat penelitian dalam suhu di bawah O°C dengan menggunakan kemasan transpor seperti pada kemasan transpor bahan ikan pari. Setelah sampai di tempat penelitian bahan tersebut dicuci dengan air bersih dan dicacah untuk memudahkan penyimpanan. Jika bahan belum akan digunakan maka bahan harus disimpan dalam keadaan beku di dalam freezer.
Kepala tuna dicacah dan dicampur dengan air suling dan diaduk hingga rata (dimaserasi) dengan perbandingan bahan : air yaitu 4: 1 , kemudian pH bahan diukur. Apabila pH bahan baku sudah masuk selang pH optimal ensim (6-8) maka tidak diperlukan penyesuaian pH. Campuran tersebut dimasukkan ke dalam wadah sebanyak 50 gram untuk setiap perlakuan. Kemudian ensim alcalase ditambahkan ke dalam campuran tersebut dengan perbandingan 0.2 %, 0.4 % dan 0.6 % (volumelbobot). Campuran tersebut kemudian ditempatkan pada inkubator oven bersuhu 50, 60 dan 70°C.
15
enSlm lalu disaring dengan kain dan disentrifugasi. Sentrifugasi dilakukan pada suhu 4°C kecepatan 10000 g (J 3000 rpm) selama 10 menil. Fasa cair diambil dan dilakukan anal isis kandungan nitrogen. Kondisi hidrolisis yang menghasilkan kandungan nitrogen tertinggi merupakan kondisi optimal hidrolisis dan akan digunakan untuk memproduksi ekstrak pepton dalam jumlah lebih besar pada tahap kedua. Diagram alir proses ini ditunjukkan pada Gambar 3.
I
Limbah ikanI
I
Hidrolisis dalam inkubator (oven) 50°C, 60
'c,
70'c
gambilan snmpeJ setinp 2 jam
P'n
sam paijam ke-8
..
lnaktivasi ensim dalam air panas 80°C selama 15 menitDimHserasi daliJlll air suling dengan perbandingan 4 : 1
(hahan : air)
+
セ@ Penambahan ensim
セ@
0,2 %, 0.4 ex), 0,6 %
Penyarillgan dengan kain saring
A.nalisa nitrog.,m terlarut
セ@
Penyimpanan pada suIll! Senlrifugasi
4°C, 12 jam 4
'c,
13000 rpmセ@
I
Pemisahan lemaki
,; i
Ekstmk peptoll kasarI
Uji mikrobiologi
[image:28.595.121.475.243.579.2]16
2. Tahap Uji Mikrobiologi Pepton (Poernomo, 1997)
Tahap kedua diawali dengan produksi peplon clalal1l .illmlah besar. Pada proses produksi ini, fasa cair setelah disenlrifugasi disimpan pmla suhu 4°C selama satll mal am (24 jam) untuk mell1isahkan lemak yang ikul terhidrolisis. Fraksi lemak yang berada di atas cairan dibuang sebelum pep ton digunakan llntuk uji mikrobiologi.
Pengujian kemampuan pepton sebagai sllmber nitrogen clalam medium pertumbuhan mikroorganisme dilakukan dengan l1lenggunakall berbagai .ienis mikroorganisme dengan karakteristik yang beragam. Mikroorganisme yang digunakan berasal dari isolat mUrt11 yaitu
Escherichia coli (ATCC 25922), /3ucillus suh/ilis (ATCC 6(33).
S/aphyiococclis aurem' (A TCe 25923). Saccharomyces cerevisiae (llCC F.0074) dan Aspergillus niger (BCe F.0075) serta bakteri hasil isolasi cJari ikan, susu dan tellir. Sebagai pembanding kemall1puan pepton 、ゥァセャQQ。ォ。ョ@
pepton impor yang tersedia di Indonesia. yaitu pcptlln yang cliprllduksi oleh Oxoid, Dileo clan Merck.
Medium pertllll1buhan dibuat sesederhana mungkin (terdiri cLu'i air. pepton, dan dextrose) dengan asumsi apabila pepton berhasil mendukullg pertull1buhan mikroorganisme dengan komposisi medium yang sederhal1<l. l1laka pepton akan Jcbih baik bila digunakllll dlJilllll mediulll 'llllg diperkaya. Medium perlllmbuhan dibllat dcngan I11Clarlltkan ckstrak pepton sebanyak ± 4.5 mililiter ditambah air hingga 100 milililer sehinggn konsentrasi protein di dalam medium sebesar 0.5 % (b/v). Seciangkan untuk pepton komersial diambil 0,5 gram dan dilarulkan ke cialam 100 milililer air. Masing masing medium pepton ditamhnh dengan cJeXl["()se sebesar 0,1 % (b/v) untuk medium bakteri dan I % (h/v) ullluk mediulll kapang dan khamir. Sebelum disterilisasi meciium eli alur pH nya ciengan Hel I N atau NaOH I N. untuk bakteri pH 7,00
±
0.0 1 cian untuk kapung dan khamir pH 5.50 ± 0,01.17
Agar). Kultur murni dari A Tee berbentuk kultur kering di elalam lop yang terbungkus oleh film yang mudah larut. Inokulasi propagasl dilakukan dengan memotong lop dan dimasukkan ke nutrient broth yang bersuhu 37"C. Inkubasi elilakukan paela suhu 37"e seiama 24 jam eli dalam inkubator shaker rotasi ISO rpm. Kultur murni khamir dari BeC
berbentuk kultur kering di dalam ampul. lnokulasi propagasi dilakukan dengan melarutkan kultur dalam saline solution O.SS
'x,
steril sebanyak±
5 mililiter kel11udian dimasukkan ke medium nutrient broth bersuhu 2S"C.Inkubasi dilakukall pada suhu 25"e selama 24 jam. 150 rpm. Sedallgkall kultur kapang (A. niger) seperti pad a khamir. larutall kultur elalam saline solution diillokulasikall ke medium PDA metoda luang.
dilakukan pada suhu kama!" selama 48 jam.
Inkubasi
Illokulasi kultur murni pada medium pepton c1ilakukan ciengan mengambil satu mililiter kultur propagasi dan dimasukkan ke masing-masing medium pepton. Untuk kultur murni kapang. perl11ukaan meciium propagasi dibilas dengan saline solution steril sebanyak
±
20 milililer. kemudian diambil satu mililiter dan dimasukkan ke maslllg-m<lslllg medium pepton. Setiap mikroorganisme diinkubasi di dalam inkubalor shaker pacia suhu 37"C untuk bakteri dan 25-30"C untuk kapang clan khamir, pada kecepatan 150 rpm.Kultur campuran yang berasal c1ari susu diinnkulasi tanpa perlakuan propagasi kultur. Susu segar diinokulasikan ke medium pepton musil1g-l11asing sebunyak satu mililiter. Kultur campuran yang berasal clari tclur juga tidak dipropagasi terlebih clulu. Kuning teiur clan I:utih telm dicampur dalam mixer steril kel1luclian cliinokulasikan kc medium p'"pton
masing-111Hsing sebanyak satu mililiter. Sedangknn tinging ibm dicacah
lembut dan dimascrasi dalam saline solution (l.XS % steril. lalu cliinokulasikan ke meclium pepton masing-masing satu mililitcr. SCI11U<l kultur campuran ciiinkubasi dalam inkubator shaker 150 rpm pacla suhu 37"e selama 24 jam.
18
medium calr pepton menggunakan spektrofotometer pada panJang gelombang 650 nm (Said, 1987), serta dengan pengukuran jumlah massa sel mikroorganisme pada jam ke-24.
C. PROSEDUR ANALISIS
I. Analisis Proksimat (Lampiran 2)
a. Protein. Analisis protein dilakukan dengan metoda kjeldah!. lumlah protein adalah 6,25 kali jumlah nitrogen yang terukur.
..
b. Kadar air, abu, dan lemak masing-masing dianalisis dengan metoda gravimetri
2. Nilai pH
Pengukuran pH larutan dilakukan dengan menggunakan alat pH meter.
3. Suhu
Pengukuran suhu dilakukan dengan thermometer.
4. Analisis Mineral (Balitbio, Bogor)
Sampel ditimbang sebanyak 1-2 gram, kemudian ditambah 10 mililiter larutan asam (RN03 pekat : HCI04 pekat : HCI pekat ; 6 : 6 : I).
Campuran didestruksi sampai menjadi jenih, kemudian diencerkan dengan aquades hingga 100 mililiter, lalu disaring dengan kertas saring biasa. Filtrat dianalisis dengan Atomic Absorbtion Spectrophotometer (AAS) (pada panJang gelombang tertentu tergantung JelllS logam) dan dibandingkan dengan grafik mineral standar.
5. Total Pertumbuhan Mikroorganisme
19
Kemudian ranking setiap medium dijumlah. lumlah keseluruhan ranking terkecil mengindikasikan yang terbaik.
6. Laju Pertumbuhan Mikroorganisme
Pengamatan laju pertumbuhan sel dilakukan dengan spektrofotometer. Pengambilan sampel dilakukan satu jam sekali pada tiga jam awal selanjutnya setiap tiga jam hingga total waktu 24 jam. Pembandingan laju pertumbuhan dilakukan dengan metoda perankingan (Poernomo, 1997) untuk setiap jenis mikroorganisme pada setiap medium yang diujikan. Kemudian ranking setiap medium dijumlah. lumlah keseluruhan ranking terkecil mengindikasikan yang terbaik.
7. Produksi Massa Sel Mikroorganisme
Masing-masing kultur yang telah diinkubasi selama 24 jam dipanen, kemudian disentrifugasi pada kecepatan 4000 rpm, suhu 4°e, selama 15 menit. Setelah itu dilakukan dekantasi, endapan yang terpisah dari cairan kemudian dikeringkan di dalam oven pada suhu loooe selama 24 jam, setelah itu ditimbang. Pembandingan produksi massa sel di lakukan dengan metoda perankingan (Stephens e/ al., 1976) untuk setiap jenis mikroorganisme pada setiap medium yang diujikan. Kemudian ranking setiap medium dijumlah. lumlah keseluruhan ranking terkecil mengindikasikan yang terbaik.
D. PERHITUNGAN
1. Nitrogen total terlarut sampel / nitrogen total bahan
NTTINTB = mg/ml N sampel x 1111 sal11pel setelah sentrifugasi
% N bahan x I11g bahan
NTT Nitrogen total terlarut; NTB : Nitrogen total bahan
2. Laju Pertumbuhan Mikroorganisl11e
20
IV. HASIL DAN PEMBAHASAN
A. Autolisis
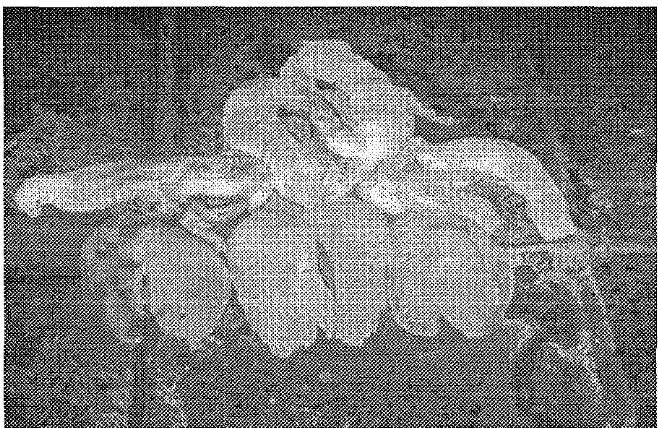
Bahan yang digunakan dalam ekstraksi pepton secara autolisis adalah
usus dan lambung ikan pari yang masih segar. Usus dan lambung ikan pari digunakan dalam proses autolisis karena bahan tersebut mengan.dung ensim protease, seperti pepsin dan trypsin (Poernomo, 1997). Penampakan usus dan lambung ikan pari dapat dilihat pada Gambar 4.
Gambar 4. Penampakan usus dan lambung ikan pari (Trygon sp.) segar.
[image:34.599.164.493.289.503.2]22
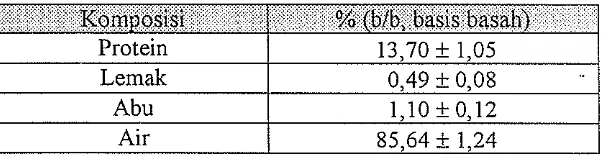
Tabel 1. Hasil analisis komposisi kimia usus dan lambung ikan pari.
Autolisis kondisi as am dilakukan di dalam penelitian ini kan,na karena kondisi asam (nilai pH yang rendah) selain membantu mengaktifkan ensim juga untuk menghindari kemungkinan terjadinya pembusukan yang disebabkan adanya kontaminasi oleh mikroorganisme. Hampir seluruh mikroorganisme sangat mudah tumbuh pada pH yang tinggi (pH 5 -8) sedangkan pada pH rendah mikroorganisme tidak dapat tumbuh kecuali beberapa mikroorganisme tertentu.
Pengkondisian asam dilakukan dengan penambahan asam. HCI pekat (12 N) dengan konsentrasi 2 % (v/b). Pada konsentrasi tersebut ternyata pH bahan telah turun sampai 1,5-2. Pada penelitian Poernomo (1997) asam HCI 12 N yang ditambahkan pada proses autolisis hampir dua kali lipat yaitu sebesar 3-4 % (v/b) dan inipun hanya menurunkan pH bahan hingga 3. Perbedaan ini mungkin disebabkan oleh faktor kesegaran bahan. Bahan baku yang segar memiliki pH sekitar 6, sedangkan bahan baku yang sudah membusuk cenderung memiliki pH ke arah netral (7-8). Kenaikan pH tersebut disebabkan pada proses pembusukan dihasilkan NH3 (amoniak) yang bersifat basa.
[image:35.595.153.460.118.197.2]23
pada suhu kamar sehingga protein bahan lebih banyak terhidrolisis pada suhu 40°C.
2 :c cc 2
-
a.::;:
en
2 0,8
0,7 セ@
::::::--0,6--0,5 0,4
0,3
0,2 ..
0,1
°
1 2 3 4 5 6 7HARI
I-+-kamar __
40 CI
J
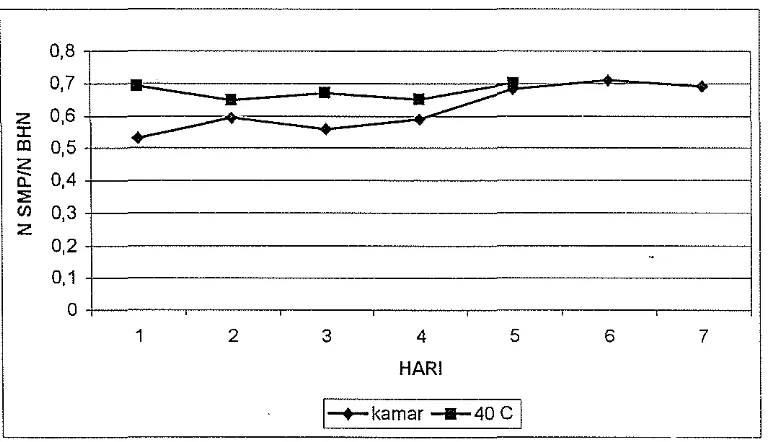
Gambar 5. Grafik N total terlarut I N total bahan ekstraksi pep ton isi perut ikan pari secara autolisis, data diberikan pada Lampiran 3.
Rasio N total terlarut I N total bahan setiap hari (dari h,ari pertama sampai hari kelima) dari hasil proses autolisis pada suhu 40°C cenderung tetap. Hasil tersebut menunjukkan bahwa kondisi optimal proses autolisis tercapai pada hari pertama. Pada hari pertama rasio N total terlarut I N total bahan telah mencapai 0,692. Hasil tersebut tidak menunjukkan perbedaan yang nyata terhadap rasio N total terlarut I N total bahan tertinggi 0,701 yaitu pada hari kelima. Proses autolisis protein berlangsung dengan cepat sebelum hari pertama dan setelah itu proses autolisis berlangsung lambat sehingga penambahan rasio N total terlarut I N total bahan sangat kecil. Hasil ini sesuai dengan Poernomo (1997) yang menyatakan bahwa kondisi optimal autolisis pada suhu 40°C tercapai sebelum hari kelima.
[image:36.597.120.504.124.345.2]24
proses autolisis masih berlangsung agak cepat setelah hari pertama hingga hari keenam meskipun tidak secepat pada proses sebelum hari pertama. Sedangkan setelah hari keenam proses autolisis berlangsung lambat.
Hasil tersebut di atas juga menunjukkan bahwa proses autolisis sangat dipengaruhi oleh suhu. Pada suhu kamar proses autolisis berj alan lebih lamb at dari pada proses autolisis pada suhu 40°C. Faktor suhu mempengaruhi aktifitas ensim pepsin yang terdapat pada isi perut ikan pari pada proses autolisis. Aktifitas ensim pepsin lebih tinggi pada suhu 40°C dari pada suhu kamar karena suhu 40°C merupakan suhu optimal dari ensil11 peps1l1.
Selain faktor suhu, faktor pH bahan juga berpengaruh pada proses autolisis. Di dalam proses autolisis nilai pH sampel mel11iliki kecenderungan semakin lama akan semakin l11eningkat seperti ditunjukkan pada ?al11bar 6.
pH 3.50
3.00
2.50
2.00
1.50
1.00
0.50
0.00
/ '
/
セ@
o
2
-"'-セ@ セ@
- ,
.
-3 4 5 6 7
Waktu Oam) セ@ 40"C ---m-kal11ar
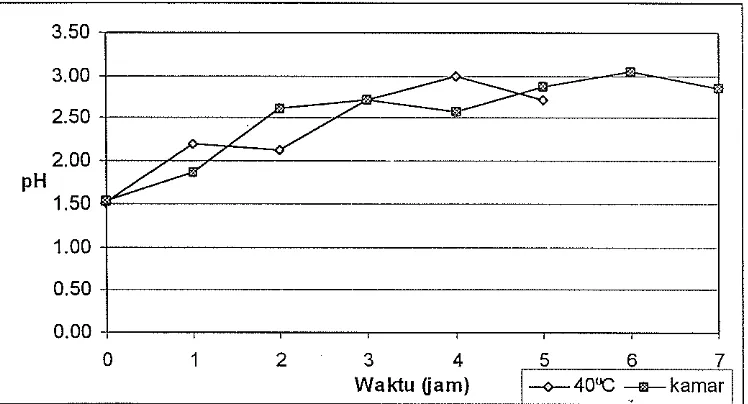
Gambar 6. Grafik perubahan nilai pH pada proses ektraksi pepton isi perut ikan pari secara autolisis, data diberikan pada Lampiran 4.
[image:37.595.132.506.361.563.2]25
menaikkan nilai pH sam pel. Semakin banyak asam amino yang terurai akan semakin tinggi nilai pH sampel. Manurut Alder (1986) proses hidrolisis protein disertai oleh pelepasan atau penyerapan H+, nilai pH campuran berubah, kecuali pada daerah sekitar pH 5-6 di mana penyerapan dan pelepasan proton tidak terjadi lagi.
Kenaikan pH dalam sam pel akan megakibatkan penurunan aktifitas ensim pepsin. Dengan demikian proses autolisis akan menjadi le.bih lambat. Selain itu nilai pH yang tinggi memberi peluang adanya kontaminasi mikroorganisme pada bahan. Sehingga proses autolisis tidak efektif lagi dan proses pembusukan akan lebih dominan yang dapat mempengaruhi mutu ekstrak pepton yang dihasilkan. OIeh karena itu proses autolisis harus dihentikan bila nilai pH sampel mendekati pH pertumbuhan mikroorganisme as am (3-5) agar hasil pepton yang didapatkan masih
bail,-Berdasarkan hasil keseluruhan di atas dapat disimpulkan bahwa kondisi proses autolisis yang optimal adalah pada suhu 40°C selama satu hari. Penampakan ekstrak pepton isi perut ikan pari hasil proses autolisis dapat dilihat pada Gambar 7. Proses autolisis yang baik akan menghasilkan cairan yang jernih setelah mengalami proses penyaringan dan sentrifugasi pada kecepatan ]3000 rpm dan suhu 4°C seperti yang terlihat pada Gambar 7.
[image:38.597.159.445.483.682.2]26
B. Hidrolisis Ensimatis
Bahan yang digunakan dalam ekstraksi pepton secara hidrolisis ensim eksternal adalah limbah pengolahan ikan berupa kepala ikan tuna. Penampakan kepala ikan tlma dapat dilihat pada Gambar 8. Kepala merupakan bagian ikan yang tidak memiliki ensim internal sehingga tidak dapat digunakan dalam proses silase. Hasil analisis komposisi kimia bahan kepala tuna adalah sebagai berikut :
[image:39.600.130.442.263.719.2]Tabel 2. Hasil analisis komposisi kimia kepala tuna
... ... Komposisi ... .. ·%(blb,basis.basah) .
Protein 16,00
Lemak 6,27
Air 71,57
Abu 6,01
[image:39.600.197.399.395.679.2]Pada awal penelitian ensim yang akan digunakan dalam proses ini aclalah papam. Ensim papain sangat mudah dijumpai eli pasaran sebagai zat pengempuk daging. Akan tetapi ensim papain kllmcrsial lersebul banyak mengandung garam. Garam dikhawatirkan dapat menjadi I'aklor penghambal pertumbuhan mikroorganisme. Oleh karena itu dalam penelitian ini ensim papam komersial tidak digunakan. Alternatif penggunaan ensim yang lebih murah pada awal penelitian dilakukan dengan menggllnakan papain dari pepaya mentah. Tetapi aktifltas hidrolisis papain dar'l pepaya tersebul terlalll kecil sehingga tidak mampu menghidrolisis protein ibm Ekstrak pepl<)n hasil hidrolisis oleh ensim tersebut mudah terkontaminasi mikroorganisme sebelum seluruh bahan terhidrolisis.
Selanjutnya ensim yang digunakan dalam penelitian ini adalah emim alcalase. Selain ensim alcalase relatif lebih Illllrah dari pada ensilll papain
murni yang bebas garam, penggunaan ensim ini diharapkan agar pepton yang
didapatkan bisa lebih Illenllnjang pertumbuhan Illikroorganisme karena ensill1 ini diproduksi oleh bakteri Bacillus iichellijiml1is
I. Pengaruh Suhu Terhadap Rasio N Total Terlarut/ N Total Bahan
Faktor utailla yang mempengaruhi kerja ensilll adalah suhu. Rasio N total terlarut / N total bahan yang dipengaruhi oleh sllhll dapat dilihal pada Gambar 9. Dari gaillbar tersebut dapat diketahlli bahwa raslo N tutal terlarut / N total bah an tettinggi dicapai pada SUllLl )0"(' Suhll optimal ensim alcalase menllrut Rose (1980) adalah 60"C, seelangkan bcrdasarkan Novo adalah sekitar 55 sampai 60°C.
Rasio N total terlarut / N total bahan teninggi pada suhu 50"(' karena aktititas cnslm alcalase pada suhu tersebut lebih stabi\. Aktititas ensilll alcalase dapat bertahan lebih lama pad a sllhu terseblll sebingga dapal menghidrolisis protein bahan lebih banyak. [V\enurut Rose (I ')80) pacla suhu 50G
e
kestabilan aktifitas hidrolisis ensim alcalase tetap di at as 90 %
1X
pada sunu 60°C kestabilan aktifitas hidrolisis ensill1 alcalase akan ll1enllrlln hingga di bawah 80 % setelah proses berlangsung selama 60 menit.
0.9
0.8 0.7 0.6
f- 0.5
z
f:: 0.4
f-z
0.3 0.2 0.1
0
50 60 70
SUHU 50G
e
Gambar 9. Pengaruh suhu terhadap rasio N total terlarut / N total bahan pada ekstraksi pepton kepala tuna (konsentrasi ensi m 0,2 %.
waktu hidrolisis 8 jam). NTT: N total terlarut: NTB : N total bahan, data diberikan pada Lampiran 5.
2. Pengaruh Waktu Terhadap Rasio N Total Terlamt / N Total Bahan
Selain faktor suhu, proses hidrolisis juga clipengaruhi oleh エセャォエHIイ@
\-vaktu. ''''aktu Illcrupakan salah satu faktor yang penling bagi kinerj,1
enSlm. Faktor waktu mempengaruhi kestabilan kinerja ensim. Rata-rata rasio N tdtal teriarut / N total bahan yang dipengaruhi oleh faktor waktu dapat dilihat pada Gambar 10.
[image:41.600.156.481.128.326.2]29
subtilisin Carlsberg semakin menurun sejalan dengan bertambahnya waktu proses hidrolisis. Rose menggambarkan bahwa beberapa jenis substrat protein yang dihidrolisis dengan ensim alcalase mencapai titik stasioner (waktu optimal) pada jam keempat.
0.9 0.8
/
0.7
0.6
/
<0 セ@ セ@
/
..I- 0.5
z
/
セ@. /
j::: 0.4
I-z
0.3 0.2 0.1 0
2 4 6 8
WAKTU (JAM)
Gambar 10. Grafik pengaruh waktu hidrolisis terhadap rasio N total terlarutl N total bahan pada suhu 50°C, konsentrasi ensim 0,2 %. NTT: N total terlarut; NTB : N total bahan, data diberikan pada Lampiran 5.
Penurunan rasio N total terlarut I N total hahan setelah waktu empat jam lebih dipengaruhi oleh kehomogenan bahan baku yang digunakan. Bahan baku yang digunakan adalah kepala tuna yang banyak mengandung tulang yang tidak dapat dihidrolisis oleh ensim. Selain itu pencampuran ensim dengan bahan kurang merata karena pengadukan hanya dilakukan setiap satu jam sekali secara manual.
[image:42.595.161.497.174.369.2]yang khas dari hidrolisis daging ikan di mana tcrclapat sekitar 20 persen dari total nitrogen yang tidak larut meskipun sejumlah ensi m ditambahkan secara berlebih. Hasil yang sama dilaporkan oleh Sahidi el aJ. (\995) pad a hidrolisis protein capel in. Tidak adanya penambahan protein terlarul dari hidrolisis capelin dipastikan ketika sejumlah proteolitik ellS]1ll ditambahkan setelah proses hidrolisis mencapai rase slasioner. fvlereka menduga bahwa hidrolisis mungkin dihambat oleh produk hidrolisis atau adanya c/eC/va);e pada semua ikatan peptida yang dapat dihidrolisis oleh enslm.
3. Pengaruh Konsentrasi Terhadap Rasio N Total Terlarul / N Total Bahan
Pengaruh konsentrasi terhadap rasio N total teriarut sampel / N total bahan baku dapat dilihat pada Gambar II. Pada gralik lersebut terlihat bahwa perlakuan konsentrasl cenderung memiliki nilai rasio yang sama pada tiap perlakuan konsentrasi. Oleh karena itu tilklor konsentrasi ensilll tidak terlalu berpengaruh terhadap hasil ekstraksi.
0.9 0.8
0.7
III 0.6
f-z 0.5
;::
f-z 0.4
0.3
0.2
0.1
0.2 0.4
KONSENTRAStl%)
.
0.6
[image:43.608.108.487.467.679.2]31
Peningkatan konsentrasi ensim tidak bisa meningkatkan rasio N total terlarut / N total bahan pada akhir proses. Hal ini dapat terjadi karena pada setiap pedakuan konsentrasi, setelah bahan dihisrolisis selama 8 jam, rasio N total tedarut / N total bahan hampir mencapai titik stasioner hidrolisis yaitu 0,8. Oleh karen a itu, pemilihan konsentrasi terendah (0,2%) secara ekonomis paling baik.
4. Pengaruh pH Terhadap Proses Hidrolisis
Selain ketiga faktor di atas, faktor lain yang mempegaruhi proses hidrolisis adalah pH. Faktor pH juga merupakan salah satuJaktor yang mempengaruhi kinerj a ensim. Nilai pH yang digunakan dalam penelitian ini adalah pH bahan yaitu sekitar 6-7. Nilai pH tersebut sudah masuk dalam selang pH optimal ensim a!calase, sehingga tidak perlu mendapatkan perlakuan pengaturan pH dengan menggunakan larutan buffer. Hal ini dapat mengurangi biaya penanganan bahan sebelum proses ekstraksi. Di dalam proses ekstraksi pepton pH sampel semakin meningkat seiring pertambahan waktu. Perubahan nilai pH sampel dalam ekstraksi dapat dilihat pada Gambar 12.
Kenaikan nilai pH pada proses ektraksi ini terjadi karena as am amino yang sudah terbentuk ada yang terhidrolisis menjadi amoniak yang bersifat basa dalam air. Pada nilai pH netral ini peluang terkontaminasi oleh mikroorganisme cukup besar, oleh karena itu proses ekstraksi ini harus dilakukan dalam waktu singkat.
Pada penelitian hidrolisis ikan dengan protease bakteri, Rebecca e/ af.
8
7,5
6
5,5 '
5
8
7,5
7
セ@ 6,5
6
5,5
5
8
7,5
7 o
•
0
2
2
4
jam
; - - 0,20% -B-0,40% --6-0,60% - - ' - - ,
4
jam
Suiw SII"C
6 8
Sultu <>0"('
6 8
Suiw 711"('
セ@ 6,5 セN@ _ _ _ _ ]セYAGヲャ]]]]MMMG@ MMMM]]NL]]セセMMセ@
6
5,5
5
o 2 4
jam
: - - 0,20% -B-0,40% Mセ@ 0,60%
, MMMMMセ@ -
[image:45.599.130.485.94.658.2]-6 8
Secara keseluruhan dapat disimpulkan bahwa tinggi remlahnya rasi" N total terlarut / N total bahan lebih tergantung pada faktor SUhll dan waktu Kecepatan hidrolisis ensill1 sangat tergantllng dari kestabilan aktitilHs cilsim yang dipengarllhi oleh sllhll dan waktu hidrolisis. Untllk ll1enghiclrolisis seluruh protein bahan yang dapat terhidrolisis dibutllhkan waktu yang lama mengingat aktititas hidrolisis ensim yang terbatas. .Iadi kestabilan aktiiitas ensim dalam waktu yang lama menjadi faktor yang sangat penting c1alam proses hidrolisis.
Dari hasil penelitian c1apat dilihat bahwa kondisi terbaik untuk ekstraksi pepton adalah pacla suhu
sone,
dengan konsentrasi ensill1 0,2 % clan waktll B Jam. Pada kondisi tersebllt rasio N total teriarut / N total bahan sall1pelsebesar 0,792. Nilai rasio tersebut telah ll1endekati titik stasioner ll1enurut Mackie (1982), dan Sahidi (1995) yaitu sebesar 80 perserl Hasil ekstrak pepton kepala tuna c1apat dilihat pada Gall1bar 13.
[image:46.602.185.416.401.577.2]C. Kualitas Ekstrak Pepton Hasil Autolisis dan Hidrolisis
Produksi ekstrak pepton dilakukan pada kondisi terbaik optimasi yaitu hidrolisis selama 24 jam pada suhu 40°C untuk autolisis isi perut ikan pari dan selama 8 jam pada suhu 50°C untuk hidrolisis kepala tuna menggunakan 0,2 % (v/b) ensim alcalase 2,4 AU/g. Hasil anal isis proksimat dan mineral ekstrak pepton yang dihasilkan dan pepton komersial yang cligunakan dapal dilihat pada Tabel 3
Tabel 3. Komposisi kimia ekstrak pepton.
koャjャャャッウゥセゥ@ DiFcO 0:;<010 '1i,I<siPllqIClli011 EI<strak ]leptoll
(hasiskGlil)g)
• IsIllCl"Ut il"lO. ()ari kcpaJ:t tuna
Air Ir;, UO S,20 80,0}(b.b) X3.97(b,b)
Abu {XI ), 10 6,20 6,91 4.93
-Lemak % IUO 0,30 2.25 2A3
----_.-_.
-"---_
.. "-.Total N t% 15,SO IS,30 7,86 11. III
Sp,gravity - - 1.02 l.1I.\
Mineral I
I
(mgilOOg)en
oJ.3D 7,20 20,00 120,00Mg 6UO 36,30 10,00 50,011
Fe 3,:i0 7S,OO 2,20 2,20
Cu 2.30 2.30 TId Il, 10
Zn .\,110 2,gO 2,80 .\,61l
--- - - " -
-Mn 0.811 L80 TId l.SIl
Pb 2, I 0 UO TId Tiel
*) Tid : tIdak lerdeleks! b.b : baSIS basah
[image:47.617.122.483.295.593.2]35
[image:48.607.191.414.278.441.2]tersebut larut ke dalam cairan ekstrak pepton pada suhu kamar dan dapat dipisahkan pada suhu rendah (4°C). Pemisahan lemak yang dilakukan adalah metode pemisahan secara fisik karena pemisahan lemak secara kimiawi ini dikhawatirkan dapat mengakibatkan perubahan atau kerusakan pada ekstrak pepton dan hal ini harus dihindari. Selain itu pemisahan lemak secara fisik lebih mudah serta kemungkinan kerusakan produk lebih kecil. Basil produksi ekstrak pepton isi perut ikan pari dan pepton kepala tuna dapat diliha( pada Gambar 14.
Pepton isi perut ikan pari
Pepton kepala tuna
Gambar 14. Basil produksi ekstrak pepton isi perut ikan pari dan pepton kepala tuna
Kandungan mineral yang terukur pada kedua ekstrak pepton pada umumnya lebih kecil dari pepton komersial kecuali kandungan kalsi urn pada ekstrak pepton kepala tuna. Sebagian besar bahan baku ekstrak pepton kepala tuna yang berupa tulang kepala ikan tuna bisa menjadi penyebab utama kadar kalsium dalam ekstrak pepton menjadi tinggi.
ada beberapa Jems pepton dan penggunaannya antara lain pepton bakteriologikal khusLis digunakan untuk bakteri dan pepton ll1ikologikal yang khusus untuk pertull1buhan fungi (kapang dan khall1ir).
Tabel 4. Perbandingan kOll1posisi asall1 amino (gil 00 g protein (b.k)) pepton.
Asam a.lillartat l.01 o .-I() 7.71l 7.S0
aセGQャQQ@ glutamat 0.8J 0 . .\ :; 12. III 11.00
AmonLa O.3() 0.70
Scrin 0.1 I 1l.IlX 1.90 2. セo@
Glisin O.-lS o.m I (>..I1l 5J)O
Histitlin 1.52 0.07 O. SIl 1.50
Arginin 1.07 1.5S X.6() S.oO
Thrconin I.7Il 2.50 2.()O
Alanin (UI Il.O I 7.71l 7.1l1l
Prolin IU2 1),25
tセGイッウゥャャ@ 1.7" Il. セiャ@ l.SIl.
Valin Il. \3 2J).\ 2.HO 3.GO
Mcthionin 1l.32 Il.n O.SIl I All
Cystcin 0,35 1l.1l7 O.21l O.SIl
hnlcusin 0.12 1.81l 2AO
Lcusin 0.0 I 2.3G .\.-Ill 5.00
Phcnilalanin 1l.-l3 UI 2J)() 2.30
Lysin 0.]7 .\.71l ).SO
Tr)'ptoJlhanc 0.3"'
*) Direo Man"a\.
I) Pocrnoillo (I セセWI@
[image:49.615.143.467.195.610.2]37
asam amino) yang dapat dilihat pada grafik analisis asam ammo menggunakan HPLC (Lampiran 7-9),
D. Uji Pertumbuhan Mikroorganisme
Medium uji pertumbuhan mikroorganisme yang dibuat dari pepton komersial dengan konsentrasi 0,5 % (b/v) dan ekstrak pepton dengan konsentrasi protein 0,5 % (b/v) mempunyai nilai absorbansi berurutan untuk Merck, Difco, Oxoid, ekstrak pepton tuna, dan ekstrak pepton pari yaitu 0,004; 0,005; 0,005; 0,043; dan 0,017, Kedua ekstrak pepton lebih keruh dari pada pepton komersial karena kandungan lemak pada ekstrak pepton lebih besar dari pepton komersial.
1, Total Pertumbuhan Mikroorganisme
Total pertumbuhan mikroorganisme berdasarkan nilai absorbansi kultur dapat dilihat pada Gambar 15. Pengukuran absorban dilakukan pada jam ke-24 kecuali kultur E. coli, B, subtilis, dan S. aureus, Dari gambar tersebut terlihat bahwa jumlah total mikroorganisme, yang ditunjukkan oleh nilai absorban, tertinggi pada umumnya adalah kultur yang ditumbuhkan pada medium ekstrak pepton isi perut ikan pari dan diikuti medium ekstrak pepton kepala tuna, Hal ini menunjukkan bahwa ekstrak pepton yang dihasilkan lebih baik dalam menumbuhkan sel mikroorganisme dibanding medium dari pepton komersial.
イMMMMMMMMMMMMMMMMセMMM
TOTAL PERTUMBUHAN
2.500 - , - - - ,
2.000 KMMMMMMMMMMセ@
c
セ@ 1.500 + - - - : =
<;
セ@
セ@ 1.000 0.500
0.000
38
Gambar 15. Total pertumbuhan mikroorganisme pada medium sederhana dari beberapa jenis pepton ( M : merk, D : difco, 0 : oxoid, CT : pepton kepala tuna, CS : pepton isi perut ikan pari ), data diberikan pada Lampiran 10.
Tabel 5. Perbandingan total pertumbuhan mikroorganisme
MIKROORGANISME ABSORBAN 24 JAM
M r 0 r 0 r CT r CS r
E.coli 0,412 4 1,105 2 0,366 5 0,935 3 1,373 1
B.subtilis 0,462 4 0,699 2 0,380 5 0,757 1 0,661 3
S.aureus 0,735 5 1,287 3 0,856 4 1,410 2 1,739 1
S.cerevisiae 2,047 1 1,641 5 1,716 4 1,746 3 1,913 2
Jml. ranking 14 12 18 9 7
Telur 1,531 2 1,281 4 1,066 5 1,440 3 1,992 1
Susu 1,851 3 1,294 5 1,544 4 1,871 2 1,926 1
Ikan 1,389 1 0,916 3 0,861 4 1,122 2 0,833 5
Jml. ranking 6 12 13 7 7
JUMLAH RANKING
K1
m
Ps1
m
Pt-Urutan terbaik *)
..
M : Merck; D : Difco : 0 : OXOld : CT : Pelon kepala tuna: CS : Pepton 151 perul Ikan Pan
r: ranking
*) Jumlah ranking lerkecil yang terbaik
[image:51.595.131.475.65.263.2] [image:51.595.112.506.406.635.2]2. Laju Pertu111buhan Mikroorganisme
Grafik pertumbuhan mikroorganisme yang dinyatakan dalam nilai absorban terhadap waktu dapat dilihat pada Gambar 16. Laiu pertumbuhan mikroorganisme dihitung berdasarkan gradien garis dari logaritma nilai absLlrban kultur terhadap waktu (jam) pada masa pertumbuhan logaritmik. Pada grallk tersebut tcrlilwt bahwa ralH-J"i\W masa logaritmik bakteri antma jam ke-3 sampai ."Iam ke-12. 111,lsa logaritmik khamir ( S. cerevisiae) antma jam ke-6 sampai jam ke-18. Pada umumnya masa logaritmik kultur campuran dari susu clan kultur eampuran clari telur antara jam ke-9 sampai jam ke-18. Sedangkan masa logaritmik kultur campuran yang berasal clari daging ikan antma jam kc-3 sampai jam ke-12. Hasil tersebut mcnunjukkan bahwa khamir Icbih clominan IXld'l kultur campuran yang berasal clari susu dan telur. sedangkan bakteri Icbill dominan pada kultur campuran yang berasal dari ikan.
Laju pertumbuhan kapang ticlak dapat dihitung dengan menggunakan metocla spektrofotometri. Kapang (A. niger) merupakan 111ikroorganisme miselia yang mudah mcmbentuk koloni besm pada medium cair dan sukar untuk dipecah oleh karena itu pembacaan absorbansi sulit dilakukan. Said (1985) menyatakan bahwa metoda spektrofotometri kurang baik untuk pengukuran pertumbuhan mikroorganisme miselia kecuali kultur tcrsebut dihomogenisasi terlebih dulu. Fada penelitian, mcskipun klll1ur kapang pada medium pepton slldah dihomogenisasi dengam vortex. masih terclapat koloni kapang yang ticlak dapat terpecah sehingga pcngamatan terganggu.
Perbandingan laju pertumbuhan mikroorganisme yang ditllmbuhkun pada beberapa jenis pep ton dapat dilihat pada Gambar 17. Berdasarkan perhitungan laju pertllmbllhan untuk Escherichia coli antma 0,03 saillpai 0,08 log(absorban) per jam, Bacillus sub/iii.\" antma 0.17 saillpai O.2-l.
S/apylococclfs aurell.\" antara 0,23 sampai 0,27. Sacchuromyces cerel'isiuc
<:mRKA3m.MaJ-III
Es::herichia coli
<:mRKA3m.MaJ-III BadllusSlbtilis ffiIIRK PffifLMELI-I'.N Staphylococcusaureus <:mRKA3m.MEI.H'.N Saccharomycescerevisiae
2,0Xl r , - - - , 2,0Xl . r - - - ,
2,0Xl r . - - - ,
2,000 1
セ@
セ@ 1,9X)
.c
o
1,W)w
セ@ a,S»
PLPxャセ@
fij 1,EaJ
QセZZQセ@
0,0Xlセ@ 1,:m
.c
o
1,@w
セ@ Q,Ea)
0.0Xl I;...L---'
a
セ@ 1,fJJJ .c
o
i,ax>w セ@ oLYIIlセ@
oNoooセセMMM
a 3 6 9 12 15 18 21 24
a 3 6 9 セ@ 15 18 セ@ セ@ a 3 6 9 12 15 18 21 24 3 6 9 12 15 18 セ@ セ@
jam j<m
j<m jam
--+-M --{]- 0 -6-0 --*-cr -.1<-cs -+-M --{]- 0 -6-0 --*-cr -.1<-cs -+-M --{]- 0 -t:r-0 セ@ cr --><-cs --+-M--{]- 0 - 6 -0 --*-cr -.1<-cs
<:mRKA3m.MEI.H'.N
Mikroorgcnisme cJa-i Telur
2 , o o o l f
c 150) ./"
ro ,
.c (; 1,000 w
セ@ 0,500
0,000* ... •
_rI
セ@a 3 6 9 12 15 18 21 24 jan
--+-M --{]- 0 -6-0 --*-cr ...:- cs
ffiIIRKPffifLMELI-I'.N
Mikroorganisme dari Susu
15
'M
1,500j
7l
.c
is 1,CCO
セ@セZZ@
セ@
.
.
a 3 6 9 12 15 18 21 24
jam
-+-M - 0 -0 -t:r-0 セ@ cr ...:- cs
<:mRKA3m.MEI.H'.N
Mikroorgcnisme dc:ri IkCfi
2,000 I I MMMMMMセ@
@ 1,9))
ェセ@
.c
o
1,(XXJw
セセZZセzc]]@
a 3 6 9 12 15 18 21 24
jam