POTENSI TOMATO YELLOW LEAF CURL VIRUS (TYLCV)
ISOLAT LEMAH SEBAGAI AGENS PENGENDALI
PENYAKIT DAUN KERITING KUNING PADA
TANAMAN TOMAT
DONNARINA SIMANJUNTAK
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS
DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis “Potensi Tomato yellow leaf curl virus (TYLCV) Isolat Lemah Sebagai Agens Pengendali Penyakit Daun Keriting Kuning pada Tanaman Tomat” adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Februari 2010
Donnarina Simanjuntak
ABSTRACT
DONNARINA SIMANJUNTAK. Potential Mild Isolate of Tomato yellow leaf curl virus (TYLCV) as Natural Agents to Control Yellow Leaf Curl Disease on Tomato Plants. Under direction of GEDE SUASTIKA, ALI NURMANSYAH, and DEWI SARTIAMI.
Tomato yellow leaf curl virus (TYLCV, genus Begomovirus, family Geminiviridae), vectored by the whitefly Bemisia tabaci, is one of the tomato infecting viruses which is inducing the most obvious symptoms. The severe growth reduction of the plants and the typical yellowing and curling of the leaves due to TYLCV infection is easily detected by farmers, even not being familiar with those symptoms. Control measures in infected areas usually rely on seclusion of the whitefly vector, mainly through multiple applications of insecticides or physical barriers. Due to the large populations of whiteflies, and their ability to develop pesticide resistance, vector seclusion is not an ideal way of fighting the spread and damage induced by TYLCV. Hence, cross protection using mild isolate of TYLCV is the best solution for the virus problem, since it requires no chemical input and/or plant seclusion. The first step towards the development of cross protection is searching for mild isolate of TYLCV from the naturally infected tomato plants in endemic area of yellow leaf curl disease in West Jawa. Assessment by using enzyme linked immunoassay to 1.102 cutting samples from tomato plants showing no any disease symptoms collected from Bogor, Cianjur and Garut revealed that 13 cuttings contained TYLCV. Assessment by planting the TYLCV-contained tomato plant cuttings in the field found 6 TYLCV isolates having stable mild penotipic character (consistently induce no any symptom on tomato plant). But among them, only 4 isolates of TYLCV having potencies of cross protection to the challenge inoculation of TYLCV severe isolates in tomato plants. These mild and protective isolates of TYLCV were able to be transmitted to tomato seedlings to give protection against yellow leaf curl diseases during its growth in the field.
iii
RINGKASAN
DONNARINA SIMANJUNTAK. Potensi Tomato yellow leaf curl virus
(TYLCV) Isolat Lemah Sebagai Agens Pengendali Penyakit Daun Keriting Kuning pada Tanaman Tomat. Dibimbing oleh GEDE SUASTIKA, ALI NURMANSYAH, DEWI SARTIAMI.
Tomato yellow leaf curl virus (TYLCV), penyebab penyakit daun keriting kuning, sudah banyak dilaporkan mengakibatkan kehilangan hasil yang cukup besar pada berbagai komoditas sayuran di banyak negara tropis dan subtropis di seluruh dunia. Di Indonesia, serangan penyakit daun keriting kuning yang terjadi terutama pada tanaman cabai dan tomat sudah dirasakan sejak tahun 2005. Di Sleman (Yogyakarta) dan Magelang (Jawa Tengah), contohnya, tingkat infeksi TYLCV diestimasi berkisar antara 20 hingga 100%. Kerugian yang ditimbulkan oleh penyakit ini bervariasi dan tercatat dapat mencapai lebih dari 85%. TYLCV memiliki partikel berbentuk ikosahedral kembar, bergenom DNA utas tunggal berukuran sekitar 2,6-2,8 kb, merupakan salah satu anggota dari Begomovirus dari famili Geminiviridae. TYLCV ditularkan oleh serangga vektornya, kutukebul
Bemisia tabaci. Mobilitasnya yang sangat tinggi dan inangnya yang banyak serta dapat menularkan virus (TYLCV) secara persisten menyebabkan kutukebul memegang peranan penting dalam epidemiologi penyakit daun keriting kuning, mungkin hal ini pula yang menyebabkan usaha pengendalian penyakit ini yang dilakukan dengan cara menekan populasi serangga vektor menggunakan insektisida kurang berhasil. Di samping itu, efek samping penggunaan insektisida terhadap kesehatan lingkungan seperti residu pada buah tomat dan matinya musuh alami hama dan patogen sudah menjadi perhatian semua pihak. Cara lain yang pernah diterapkan untuk mengendalikan penyakit daun keriting kuning yaitu dengan menggabungkan pengendalian kutukebul dengan musuh alami, seperti parasitoid; predator; dan varietas tomat tahan terhadap Begomovirus juga belum dapat memberikan hasil yang diharapkan. Salah satu alternatif pengendalian yang cukup memberi harapan keberhasilan dan memenuhi persyaratan untuk kesehatan lingkungan adalah dengan melakukan proteksi silang (cross protection). Proteksi silang dalam penelitian ini adalah penggunaan isolat lemah suatu virus (TYLCV) untuk melindungi tanaman (tomat) dari kerusakan ekonomis yang ditimbulkan oleh infeksi isolat ganas virus yang sama (TYLCV). Keberhasilan pengendalian melalui proteksi silang sudah banyak dilaporkan terhadap berbagai jenis virus pada berbagai komoditas tanaman. Namun demikian, penelitian mengenai proteksi silang pada interaksi TYLCV dengan tanaman tomat belum pernah dilakukan di Indonesia maupun di negara lain. Untuk itu dilakukan penelitian mengeksplorasi TYLCV isolat lemah dari populasi alami dan menguji potensinya sebagai agens pengendali penyakit daun keriting kuning pada tanaman tomat.
[T
iv
Kegiatan yang dilakukan terdiri dari: (1) survei kejadian penyakit daun keriting kuning pada pertanaman tomat di daerah Bogor dan Cianjur yang mempunyai degradasi ketinggian tempat mulai dari 176 m sampai lebih dari 1300 m dpl; (2) pemeliharaan kutukebul B. tabaci; (3) eksplorasi TYLCV isolat lemah; (4) deteksi virus dengan ELISA; (5) deteksi TYLCV dengan PCR; (6) seleksi TYLCV isolat lemah stabil; (7) pengujian proteksi silang; (8) inokulasi TYLCV isolat lemah protektif pada bibit tomat.
Pengamatan langsung di lapangan menunjukkan bahwa tanaman tomat yang terserang penyakit daun keriting kuning mengalami gejala klorosis berat sehingga nampak kuning. Daun-daun pucuk berukuran jauh lebih kecil dari normal, sedangkan daun-daun bawah menjadi keriting, pertumbuhan tanaman sangat terhambat sehingga menjadi kerdil dan umumnya tidak menghasilkan buah. Kejadian penyakit daun keriting kuning pada tanaman tomat berdasarkan hasil survei di daerah Bogor dan Cianjur berkisar antara 20-100% dan kutukebul yang umum dijumpai adalah Bemisia tabaci dan umumnya semua varietas tomat yang dibudidayakan petani, terutama di daerah Bogor dan Cianjur, diamati rentan terhadap infeksi TYLCV.
Dari hasil eksplorasi TYLCV isolat lemah dari kebun-kebun tomat di daerah Bogor, Cianjur, Garut yang 80% lebih populasi tanamannya memperlihatkan gejala penyakit daun keriting kuning, telah didapatkan 1.102 stek pucuk dari seluruh individu tanaman tomat yang tidak memperlihatkan gejala penyakit dan secara konsisten di lapangan sampai sebulan lamanya, hanya ada 6 stek tanaman yang tidak memperlihatkan gejala penyakit (T33, T105, T122, T131, T134, T146). Keenam stek ini mengandung TYLCV isolat lemah (karena tidak menginduksi gejala penyakit) yang bersifat stabil.
Hasil deteksi dengan PCR menunjukkan bahwa, keenam stek tomat tersebut masing-masing menghasilkan pita PCR berukuran 760 bp yang sesuai dengan desain primer yang digunakan. Dengan demikian sudah dikonfirmasi dengan lebih cermat keberadaan masing-masing isolat TYLCV pada masing-masing stek tomat tersebut.
Hasil pengujian inokulasi stek tanaman tomat yang sudah mengandung TYLCV isolat lemah dengan TYLCV isolat ganas melalui kutukebul B. tabaci
v
Inokulasi TYLCV isolat lemah pada 36 bibit tomat dengan menggunakan 60 ekor imago B. tabaci dalam tray tertutup (sekitar ± 2 ekor kutukebul/bibit tanaman) memberikan hasil tingkat penularan yang cukup tinggi yaitu 85%. Hasil ini sesuai dengan hasil penelitian Cohen & Lapidot (2007) yang mendapatkan bahwa efisiensi penularan TYLCV melalui 3 ekor imago B. tabaci adalah sekitar 83%. Hasil penularan ini sudah dianggap mencukupi untuk memberikan perlindungan tanaman bila ditanam di lapangan. Perlindungan tanaman tomat melalui virus isolat lemah pada stadia bibit (sebelum ditanam di lapangan) merupakan saat yang tepat karena infeksi TYLCV isolat ganas melalui B. tabaci
di lapangan dapat terjadi pada saat tanaman baru ditanam di lapangan (bahkan dapat terjadi di pembibitan bila dilakukan pada tempat terbuka) sampai tanaman tomat dewasa. Pengurangan produksi akan semakin tinggi bila semakin muda tanaman tomat terinfeksi oleh TYLCV isolat ganas.
© Hak Cipta milik
Institut Pertanian Bogor
, tahun 2010
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar bagi IPB.
POTENSI TOMATO YELLOW LEAF CURL VIRUS (TYLCV)
ISOLAT LEMAH SEBAGAI AGENS PENGENDALI
PENYAKIT DAUN KERITING KUNING PADA
TANAMAN TOMAT
DONNARINA SIMANJUNTAK
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Mayor Fitopatologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Potensi Tomato yellow leaf curl virus (TYLCV) Isolat Lemah Sebagai Agens Pengendali Penyakit Daun Keriting Kuning pada Tanaman Tomat
Nama : Donnarina Simanjuntak NIM : A352070051
Disetujui
Komisi Pembimbing
Dr. Ir. Gede Suastika, M.Sc. Ketua
Dr. Ir. Ali Nurmansyah, M.Si. Dra. Dewi Sartiami, M.Si. Anggota Anggota
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana Mayor Fitopatologi
Dr. Ir. Sri Hendrastuti Hidayat, M.Sc. Prof. Dr. Ir. Khairil A. Notodiputro, M.S.
x
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah Bapa atas segala berkat dan penyertaan-Nya hari lepas hari sehingga karya ilmiah yang berjudul “Potensi
Tomato yellow leaf curl virus (TYLCV) Isolat Lemah Sebagai Agens Pengendali Penyakit Daun Keriting Kuning pada Tanaman Tomat” dapat diselesaikan.
Terima kasih kepada Hibah Kompetitif Penelitian Sesuai Prioritas Nasional (DITJEN DIKTI DEPDIKNAS) No. 343/SP2H/PP/DP2M/VI/2009 dan Utsunomiya University, Japan atas kerjasamanya yang telah turut membantu mendanai penelitian ini.
Ucapan terima kasih setulus hati kepada bapak Dr. Ir. Gede Suastika, M.Sc., Dr. Ir. Ali Nurmansyah, M.Si., dan ibu Dra. Dewi Sartiami, M.Si. atas bimbingan, saran, bantuan, koreksi, dan nasihat selama saya melakukan penelitian dan proses penulisan tesis.
Terima kasih kepada ibu Dr. Ir. Sri Hendrastuti Hidayat, M.Sc. (Kepala Laboratorium Virologi Tumbuhan) atas saran dan nasihat yang diberikan selama penulis bekerja di Laboratorium dan kepada bapak Dr. Ir. R. Yayi Munara Kusumah, M.Si. (Dosen Penguji Luar Komisi pada Ujian Tesis) atas saran dan koreksi yang diberikan pada saat berlangsungnya Ujian Tesis.
Ungkapan terima kasih atas kasih sayang beserta doa yang tulus tiada berhenti ditujukan kepada kedua orangtuaku : bapak Ir. D. Simanjuntak dan ibu R. Tampubolon. Terima kasih atas doa dan dukungan Nangboru Sinambela, Mami, dan kak Duma.
Ucapan terima kasih penulis tujukan kepada David Parulian Sinambela, S.P. untuk dukungan doa, semangat, dan kesabaran yang telah dijalani selama enam tahun ini.
Dalam melakukan kegiatan penelitian yang mencakup pengambilan contoh stek tomat di lapangan, pengerjaan penelitian di laboratorium, dan penulisan tesis, Penulis mendapatkan banyak sekali bantuan, saran, dan semangat dari teman-teman. Oleh karena itu, saya mengucapkan terima kasih dan salam persahabatan yang tulus kepada:
1. Eva Dwi Fitriasari, M.Si., Dohar Simanjuntak, dan Dedi Hutapea, S.P. yang telah membantu sebagian proses pengambilan contoh stek dan atas semangat yang telah diberikan selama penelitian.
2. Pak Ateng, Pak Ing, Pak Sohib yang telah membantu perawatan stek tomat selama di Pacet, kabupaten Cianjur dan Saung Mirwan, kabupaten Bogor. 3. Teknisi Laboratorium Biosistematika Serangga :
Ibu Aisyah, yang telah membantu pada saat identifikasi kutukebul. 4. Rekan-rekan Entomologi-Fitopatologi 2007 :
Ibu Rika Meliansyah, M.Si., bu Heri Harti, Weni Wilia, M.Si., Wartono, M.Si., Bruce O’Chieng atas semangat yang telah diberikan selama penelitian dan penyelesaian tesis.
5. Teman, sahabat di Laboratorium Virologi dan Entomologi-Fitopatologi:
xi
Juliandi, M.Si., Sri Maria atas semangat dan bantuan yang telah diberikan selama penelitian dan penyelesaian tesis.
6. Adek angkatan, teman satu kost-an sekaligus sebagai sahabat penulis menemani dalam suka dan duka selama belajar dan melakukan penelitian di IPB: Jessi Linar Tambunan, S.Si., Ruly Duma Simanjuntak, S.TP., Rina Patrycia, S.Hut., Setripa Silaban, S.P., Kade Kusuma Dewi, S.P., Mayang Hayuning Astuti, S.TP., Sri Rahayu, Eka Rahelia Purba S.TP., dan Wulan.
Akhir kata, semoga karya ilmiah ini bermanfaat bagi kepentingan pendidikan dan penelitian.
RIWAYAT HIDUP
Donnarina Simanjuntak, dilahirkan di Jakarta pada tanggal 29 Januari 1985 dari ayah D. Simanjuntak dan ibu R. Tampubolon. Penulis merupakan anak ketiga dari lima bersaudara.
DAFTAR ISI
Survei Kejadian Penyakit Daun Keriting Kuning pada Pertanaman Tomat ... 15
Pemeliharaan Kutukebul Bemisia tabaci ... 15
Eksplorasi Tomato Yellow Leaf Curl Virus Isolat Lemah ... 16
Prosedur ELISA ... 16
Ekstraksi DNA ... 17
Prosedur PCR ... 18
Seleksi TYLCV Isolat Lemah Stabil ... 19
Pengujian Proteksi Silang ... 19
Inokulasi TYLCV Isolat Lemah Protektif pada Bibit Tomat ... 19
HASIL DAN PEMBAHASAN ... 21
Penyakit Daun Keriting Kuning pada Tanaman Tomat ... 21
Eksplorasi TYLCV Isolat Lemah ... 23
TYLCV Isolat Lemah Sebagai Agens Pengendali Penyakit Daun Keriting Kuning pada Tanaman Tomat ... 27
KESIMPULAN DAN SARAN ... 30
DAFTAR TABEL
Halaman 1 Kejadian penyakit daun keriting kuning pada tanaman tomat menurut
ketinggian tempat di daerah Bogor dan Cianjur ... 23 2 Koleksi tanaman tidak bergejala dari lapangan yang epidemi penyakit
keriting kuning di wilayah Bogor dan sekitarnya ... 25 3 Analisa sifat protektif isolat-isolat lemah TYLCV terhadap inokulasi
isolat ganas ... 28 4 Tingkat penularan TYLCV isolat lemah protektif pada bibit tomat
DAFTAR GAMBAR
Halaman 1 Gejala penyakit daun keriting kuning pada tanaman tomat terinfeksi
Tomato yellow leaf curl virus (TYLCV) dan imago Bemisia tabaci ... 21 2 Penanaman stek pucuk tomat yang mengandung TYLCV isolat lemah
dalam media tumbuh dalam tray ... 24 3 Pita hasil deteksi dengan PCR menggunakan primer spesifik TYLCV
1
PENDAHULUAN
Latar Belakang
Geminivirus merupakan salah satu virus patogen tanaman yang sangat
merugikan yang banyak dijumpai pada pertanaman tomat (Sudiono et al. 2004). Di Indonesia, telah dilaporkan bahwa serangan geminivirus pada tanaman tomat di daerah Bogor dan sekitarnya dapat mencapai 50 – 70% (Aidawati & Hidayat 2002). Serangan virus patogen ini pada tanaman tomat menimbulkan penyakit
daun keriting kuning (Direktorat Perlindungan Hortikultura 2008).
Gejala yang timbul karena infeksi geminivirus pada tanaman tomat sangat bervariasi, bergantung pada strain virus, kultivar tomat, umur tanaman pada waktu terinfeksi dan lingkungan yang mendukung terjadinya penyakit. Pada umumnya
gejala yang ditimbulkan akibat infeksi geminivirus yaitu adanya kombinasi mosaik kuning pada daun, belang-belang klorotik, klorotik pada ujung daun, daun berkerut, daun mengecil, bunga cepat rontok, dan secara keseluruhan tanaman menjadi kerdil (Polston & Anderson 1997). Di Indonesia, infeksi geminivirus pada tanaman tomat menimbulkan gejala yaitu berupa penebalan tulang daun, lamina daun berkerut-kerut, daun menguning, tepi daun melengkung ke atas, daun
menjadi keriting, dan tanaman menjadi kerdil (Aidawati & Hidayat 2002). Penyakit daun keriting kuning tidak dapat ditularkan melalui biji, tetapi dapat menular melalui penyambungan dan melalui serangga vektor kutukebul (Direktorat Perlindungan Hortikultura 2008).
Menurut Torres Pacheco et al. (1996), salah satu spesies virus dari kelompok geminivirus yang menyebabkan penyakit daun keriting kuning pada
2
Tingkat kejadian penyakit ini bervariasi bergantung kepada beberapa faktor seperti misalnya ketersediaan sumber inokulum virus, tingkat populasi serangga
vektor dan tingkat kerentanan tanaman tomat. Di Sleman (Yogyakarta) dan Magelang (Jawa Tengah), contohnya, tingkat infeksi TYLCV diestimasi berkisar antara 20 – 100% (Rahayu 2004). Demikian juga kerugian yang ditimbulkan oleh penyakit ini bervariasi dan tercatat dapat mencapai lebih dari 85% (Sumardiyono
et al. 2003).
TYLCV adalah virus yang memiliki partikel berbentuk ikosahedral kembar berukuran 20 x 30 nanometer dan bergenom DNA utas tunggal sekitar 2,6-2,8 kb. Virus ini merupakan salah satu anggota dari genus Begomovirus dari famili Geminiviridae (Tsai et al. 2006) yang ditularkan oleh kutukebul, Bemisia tabaci
Genn. (Bedford et al. 1994; Harrison & Robinson 1999). Mobilitasnya yang sangat tinggi dan inangnya yang banyak serta dapat menularkan virus (TYLCV) secara persisten menyebabkan kutukebul memegang peranan penting dalam epidemiologi penyakit daun keriting kuning (Nakhla & Maxwell 1998), mungkin hal ini pula yang menyebabkan usaha pengendalian penyakit ini yang dilakukan
dengan cara menekan populasi serangga vektor menggunakan insektisida (Denholm et al. 1998; Palumbo et al. 2001) kurang berhasil. Di samping itu, efek samping penggunaan insektisida terhadap kesehatan lingkungan seperti residu
pada buah tomat dan matinya musuh alami hama dan patogen (Trabolsi 1994; Elbert & Nauen 2000) sudah menjadi perhatian semua pihak. Cara lain yang pernah diterapkan untuk mengendalikan penyakit daun keriting kuning yaitu dengan menggabungkan pengendalian kutukebul dengan musuh alami (parasitoid,
predator, cendawan) dan varietas tomat tahan terhadap Begomovirus (Gerling et al. 2001; Hiljie et al. 2001) juga belum dapat memberikan hasil yang diharapkan.
Salah satu alternatif pengendalian yang cukup memberi harapan keberhasilan dan memenuhi persyaratan untuk kesehatan lingkungan adalah
3
Keberhasilan pengendalian melalui proteksi silang sudah banyak dilaporkan terhadap berbagai jenis virus pada berbagai komoditas tanaman (Costa & Muller
1980; Yeh et al. 1988; Lecoq et al. 1991; Van Vuuren et al. 1993; Yeh & Gonsalves 1994; Mahmood & Rush 1999; Gal-On 2000; Sayama et al. 2001; Sambade et al. 2002). Namun demikian, penelitian mengenai proteksi silang pada interaksi TYLCV dengan tanaman tomat belum pernah dilakukan di Indonesia
maupun di negara lain.
Tujuan Penelitian
Penelitian ini bertujuan untuk mengeksplorasi TYLCV isolat lemah dari populasi alami dan menguji potensinya sebagai agens pengendali penyakit daun
4
TINJAUAN PUSTAKA
Tomat (Lycopersicon esculentum L.)
Lycopersicon esculentum L. atau yang sinonim dengan Solanum lycopersicum L. merupakan tanaman hortikultura dari famili Solanaceae. Tomat merupakan tumbuhan asli berasal dari Amerika Tengah dan Selatan, dari Meksiko
sampai Peru. Tomat merupakan tumbuhan siklus hidup singkat (semusim), dapat tumbuh setinggi 1 sampai 3 meter (Smith 1994), ditanam sebagai tanaman buah di
ladang, pekarangan, atau ditemukan liar pada ketinggian di antara 1-1600 meter di atas permukaan laut (Anonim 2009).
Tomat termasuk tanaman yang tidak tahan hujan, sinar matahari terik, serta menghendaki tanah yang gembur dan subur. Tanaman setahun ini tumbuh tegak
atau bersandar pada tanaman lain, bercabang banyak, berambut, dan berbau kuat. Batang bulat, menebal pada buku-bukunya, berambut kasar warnanya hijau keputihan. Daun majemuk menyirip, letak berseling, bentuknya bulat telur sampai memanjang, ujung runcing, pangkal membulat, helaian daun yang besar tepinya berlekuk, helaian yang lebih kecil tepinya bergerigi, panjang 10 – 40 cm,
warnanya hijau muda. Bunga majemuk, berkumpul dalam rangkaian berupa tandan, bertangkai, mahkota berbentuk bintang, warnanya kuning. Buahnya buah buni, berdaging, kulitnya tipis licin mengilap, beragam dalam bentuk maupun ukurannya, warnanya kuning atau merah. Bijinya banyak, pipih, warnanya kuning kecokelatan (Anonim 2009).
Geminivirus Morfologi
Geminivirus merupakan golongan virus tumbuhan yang tergolong dalam famili Geminiviridae. Bentuk partikel geminivirus yaitu isometrik ganda, yang dalam keadaan tunggal umumnya berdiameter 18 – 20 nanometer dan sebagian besar virus ini terdapat dalam keadaan berpasangan dengan ukuran 20x30
5
acid/ ss DNA) berukuran sekitar 2,6-2,8 kb (Tsai et al. 2006) dan terselubung dalam virion ikosahedral kembar (geminate) (Bock 1982).
Gejala Infeksi Geminivirus pada Tanaman Tomat
Gejala penyakit yang timbul akibat infeksi geminiviruspada tanaman tomat sangat bervariasi, tergantung kepada strain virus, kultivar inang, umur tanaman
pada saat terinfeksi, vektor, dan kondisi lingkungan yang mendukung perkembangan vektor dan penyakit. Di Indonesia, tanaman tomat yang terinfeksi geminivirus menunjukkan gejala yang berbeda-beda. Gejala umum yang terlihat berupa daun berkerut, daun menjadi kecil, daun berkerut dan keriting, daun menguning, daun mengecil dan cupping (daun arahnya melengkung ke atas), penebalan tulang dan anak tulang daun, penguningan lamina daun, dan tanaman menjadi kerdil (Aidawati 2006).
Menurut Direktorat Perlindungan Hortikultura (2008), gejala serangan geminivirus pada tanaman tomat yaitu helai daun mengalami vein clearing, dimulai dari daun-daun pucuk berkembang menjadi warna kuning yang jelas,
tulang daun menebal dan daun menggulung ke atas (cupping). Infeksi lanjut dari geminivirus dapat menyebabkan daun-daun mengecil dan berwarna kuning terang, tanaman menjadi kerdil, bahkan ada yang tidak mampu menghasilkan buah.
Butter & Rataul (1977) melaporkan bahwa tanaman tomat yang terinfeksi
tomato leaf curl virus (TLCV) menunjukkan gejala daun keriting, daun menggulung (rolling), perubahan bentuk daun, daun menjadi berkerut (puckering), dan terdapat enasi pada permukaan bawah daun. Gejala TLCV strain Australia berupa daun keriting, kuning, daun menggulung ke atas. Tanaman yang terinfeksi pada saat umur muda menjadi tidak berbuah dan kerdil (Conde & Connelly 1994).
Infeksi TYLCV pada tanaman tomat menyebabkan daun-daun menjadi
6
Di Indonesia, infeksi geminivirus pada tanaman tomat menimbulkan gejala berupa penebalan tulang daun, lamina daun berkerut-kerut, daun menguning, tepi
daun melengkung ke atas, daun menjadi keriting, dan tanaman menjadi kerdil (Sugiarman & Hidayat 2000).
Menurut Matthews (1992) munculnya gejala pada tanaman tomat yang terinfeksi geminivirus sangat dipengaruhi oleh konsentrasi virus, faktor
lingkungan, dan faktor genetik tanaman. Perbedaan waktu munculnya gejala pada beberapa kultivar tomat yang berbeda yang terinfeksi geminivirus menyebabkan munculnya gejala yang berbeda pada kultivar-kultivar tersebut. Tanaman yang terinfeksi oleh geminivirus pada awal fase pertumbuhan cenderung mengalami kerusakan lebih besar dibandingkan dengan tanaman yang terinfeksi setelah fase
generatif (Brown & Bird 1992). Selain itu, kesuburan tanah dan iklim atau musim juga berpengaruh terhadap keanekaragaman gejala dan pemencaran populasi serangga vektor kutukebul di lapangan (Matthews 1992).
Penularan Geminivirus
Geminivirus pada umumnya dapat ditularkan dengan dua cara, yaitu melalui penyambungan bagian tanaman yang terinfeksi dan melalui serangga vektor kutukebul, akan tetapi virus ini tidak dapat ditularkan melalui biji maupun secara
mekanik dengan inokulasi cairan perasan tanaman sakit. Penularan dan pemencaran geminivirus di lapangan sangat ditentukan oleh aktivitas dan kemampuan terbang serangga vektornya B. tabaci (Harrison & Robinson 1999). Kutukebul dapat menularkan geminivirus secara persisten (yaitu bila kutukebul
menghisap dari tanaman tomat yang mengandung geminivirus, maka selama hidupnya serangga ini akan mampu menularkan virus tersebut ke tanaman tomat lain) (Direktorat Perlindungan Hortikultura 2008).
Tingginya persentase infeksi geminivirus pada tanaman tomat disebabkan
7
tanaman inangnya, geminivirus dikelompokkan menjadi empat genus yaitu
Mastrevirus, Curtovirus, Begomovirus, dan Topocuvirus (Hull 2002).
Mastrevirus merupakan geminivirus dengan tanaman inang dari kelompok monokotil, ditularkan oleh wereng daun dan memiliki genom monopartit.
Mastrevirus memiliki lebih dari 10 jenis virus yang sudah diketahui, dengan tanaman inang dari famili Graminea, yaitu chlorosis striate mosaic virus
(CSMV), wheat dwarf virus (WDV), maize streak virus (MSV), dan digitaria strak virus (DSV). Curtovirus adalah geminivirus dengan tanaman inang dikotil, yang ditularkan oleh vektor wereng daun, dan genomnya monopartit. Anggota
Curtovirus di antaranya yaitu tobacco yellow dwarf virus (TYDV) dengan vektor
Orosius argentatus (Hemiptera: Cicadellidae) dan beet curly top virus (BCTV) dengan vektor Circulifer tenellus (Hemiptera: Cicadellidae) (Hull 2002).
Kelompok lain dari geminivirus adalah Begomovirus. Virus ini menyerang tanaman inang dikotil seperti tomat dan cabai yang ditularkan oleh vektor kutukebul B. tabaci. Begomovirus memiliki genom bipartit atau monopartit. Berdasarkan daerah asal genus tersebut anggota Begomovirus terbagi menjadi kelompok yang berasal dari Old World (benua Eropa, Asia, Afrika) dan kelompok
New World (benua Amerika). Anggota Begomovirus yang memiliki genom bipartit di antaranya african cassava mosaic virus (ACMV), bean dwarf mosaic virus (BDMV), bean golden mosaic virus (BGMV), abutilon mosaic virus
(AbMV), cotton leaf crumple virus (CLCV), squash leaf curl virus (SLCV),
tomato golden mosaic virus (TGMV), potato yellow mosaic virus (PYMV),
mungbean yellow mosaic virus (MYMV), euphorbia mosaic virus (EuMV), dan
indian cassava mosaic virus (ICMV), sedangkan yang memiliki genom monopartit yaitu tomato leaf curl virusdan tomato yellow leaf curl virus (Navas-Castillo et al. 1999).
8
Bemisia tabaci
Taksonomi
Bemisia tabaci termasuk ke dalam ordo Hemiptera, subordo Sternorrhyncha, superfamili Aleyrodoidea dan famili Aleyrodidae. Serangga ini memiliki beberapa sebutan antara lain cotton whitefly, sweet potato whitefly, atau
tobacco whitefly (Martin 1999). Sosromarsono et al. (2007) memberi nama umum B. tabaci dengan sebutan kutukebul tembakau yang bersifat polifag.
Bioekologi
Kutukebul B. tabaci memiliki perkembangan siklus hidup dengan lama waktu sekitar dua sampai tiga minggu. Serangga ini dapat bereproduksi secara
seksual atau partenogenetik. Siklus hidup dari serangga ini melalui beberapa fase perkembangan, yaitu telur, nimfa, pupa, dan imago. Imago serangga ini merupakan serangga yang berukuran sangat kecil dengan aktifitas menghisap cairan tanaman di saluran pembuluh floem (Kalshoven 1981).
Kutukebul tidak dapat diidentifikasi melalui karakter morfologi pada
imagonya, tetapi genus dan spesiesnya lebih mudah diketahui melalui struktur nimfa instar akhir (prepupa) atau dapat diketahui juga melalui struktur kantung pupa (pupal case) (Mound & Halsey 1978). Perbedaan bentuk dan ukuran pupa antara B. tabaci dengan Trialeurodes vaporariorum dipengaruhi oleh kutikula tanaman inangnya. Telur B. tabaci bentuknya lonjong (oval), berwarna putih bening ketika baru diletakkan, kemudian menjadi kecoklatan menjelang akan menetas (Hirano et al. 2002).
Nimfa dan pupa B. tabaci berwarna keputih-putihan dan bentuknya bervariasi tergantung pada substratnya, memiliki panjang mencapai 0,7 mm (Kalshoven 1981). B. tabaci memiliki tiga instar nimfa. Nimfa instar pertama berbentuk bulat panjang, berwarna hijau cerah dengan bulu-bulu halus dan lapisan
9
± 0,33 hari. Secara umum, nimfa menghisap cairan tanaman di saluran pembuluh floem tanaman (Badri 1983).
Panjang pupa mencapai 0,7 mm, memiliki sepasang bintik merah yang kemudian berfungsi sebagai mata setelah menjadi imago. Pupa berbentuk elips dengan bagian toraks yang agak melebar dan cembung serta berwarna kuning. Ruas abdomen pada pupa tampak jelas. Bagian pinggir pupa tidak rata. Pada
tahap pupa terdapat ornamen lilin di sisi tubuhnya (Badri 1983).
Imago B. tabaci berwarna kuning, disertai sayap yang ditutupi oleh sekresi berupa tepung berwarna putih. Panjang tubuh imago berkisar antara 1-1,5 mm. Lama hidup imago sekitar 6 hari. Sayapnya terdiri dari dua pasang dan bersifat transparan. Imago dapat terbang sampai beberapa ratus meter pada jarak
ketinggian ± 4 meter, dapat juga terbawa melalui angin (Kalshoven 1981).
Kutukebul B. tabaci merupakan kutu tanaman yang memiliki lebih dari 1.000 spesies inang yang banyak menimbulkan kerusakan di daerah tropis maupun subtropis (Hill 1987). Kutukebul ini pertama kali ditemukan pada tanaman tembakau di Yunani pada tahun 1889 (Horowitz 1986). Kutukebul ini
memiliki daerah penyebaran yang cukup luas, antara lain terdapat di India, Afrika, dan Amerika Selatan (Cock 1986). Kalshoven (1981) mencatat bahwa serangga ini baru ditemukan di Indonesia pertama kali di Pulau Jawa dan Sumatera.
Daerah penyebaran lainnya, meliputi Hawaii, Meksiko, Columbia, Amerika Utara, Amerika Tengah, dan Asia (Cock 1986).
Menurut Cock (1986) B. tabaci merupakan hama utama tanaman hias di rumah kaca, walaupun tanaman utama yang diproduksi di rumah kaca seperti
tomat, cabai, buncis, terong, dan mentimun juga ikut terserang. Di Amerika Serikat, pertama kali dilaporkan bahwa B. tabaci menyebabkan kerusakan pada tanaman hias di rumah kaca. Serangga tersebut sangat cepat penyebarannya dan sangat sulit untuk dikendalikan (Price et al. 1986).
10
lebih tinggi terhadap tanaman inang yang daunnya berbulu, seperti tomat dan terong, dan kurang menyukai daun tanaman inang yang tidak berbulu (Butler &
Wilson 1984; Indrayani & Sulistyowati 2005).
Berkembangnya sistem tanam tumpang sari kapas dan palawija, kedelai dan kacang hijau, terutama dengan tomat atau cabai, akan memberi peluang semakin meluasnya penyebaran B. tabaci di berbagai sentra pertanian. Penanaman tanaman sejenis dengan pola tanam monokultur yang dilakukan secara terus-menerus, serta penggunaan insektisida kimia sintetis golongan piretroid secara intensif juga sangat potensial menyebabkan peningkatan populasi B. tabaci seperti yang terjadi di daerah sentara penanaman kapas di Lamongan, Jawa Timur pada tahun 2002 (Indrayani & Sulistyowati 2005).
Cohen & Berlinger (1986) menyatakan bahwa serendah apapun populasi B. tabaci cukup efektif menyebabkan kerusakan langsung maupun tidak langsung. Virus tanaman yang ditularkan oleh hama penusuk-pengisap ini dapat menyebabkan lebih dari 40 penyakit pada tanaman sayuran di seluruh dunia.
Kutukebul B. tabaci dikenal sebagai vektor penyakit geminivirus pada tanaman kapas, cabai, dan tomat (Cohen & Berlinger 1986; Byrne & Houck 1990; Harrison 1999). Selain menyerang pada tanaman kapas, cabai, dan tomat, B. tabaci juga dilaporkan mulai meningkat populasinya pada tanaman kedelai dan kacang hijau di berbagai wilayah di dunia sejak tahun 1962 hingga 1982 (Kogan & Turnipseed 1987, Samudra & Naito 1991, Tengkano et al. 1991).
Menurut Nakhla & Maxwell (1998) beberapa faktor yang mendukung perkembangan dan penyebaran penyakit yang disebabkan oleh geminivirus adalah
populasi vektor B. tabaci yang tinggi, kultivar tomat yang rentan, penanaman tomat secara terus-menerus, migrasi vektor dari tanaman yang ada di dekatnya, dan infeksi tomat di persemaian yang tidak dilindungi. Berbagai macam gulma juga dapat menjadi inang alternatif penularan geminivirus. Tanaman Babadotan
(Ageratum conyzoides) adalah gulma yang sering terdapat di pertanaman cabai yang dapat menjadi inang alternatif geminivirus dan umumnya kutukebul B. tabaci juga umum ditemukan pada gulma tersebut (Aidawati et al. 2001).
11
leaf curl virus (ToLCV) yang merupakan spesies dari geminivirus adalah 31 menit dengan periode makan inokulasi selama 24 jam. Semakin lama periode
makan akuisisi penularan geminivirus semakin meningkat, sedangkan periode makan inokulasi minimum kutukebul tersebut untuk dapat menularkan ToLCV adalah 32 menit dengan periode makan akuisisi selama 24 jam. B. tabaci mampu mengakuisisi virus dari kotiledon tanaman tomat yang terinfeksi, tetapi infeksi
tidak terjadi ketika serangga virulifer tersebut dipindahkan ke kotiledon tanaman yang sehat. B. tabaci mampu menularkan ToLCV dengan efisiensi tertinggi apabila periode makan akuisisi dan periode makan inokulasi dilakukan pada daun muda. Kutukebul mampu menularkan ToLCV sebesar 38% apabila makan akuisisi dilakukan pada sumber inokulum berumur 2 bulan, sedangkan akuisisi
yang dilakukan pada sumber inokulum yang berumur 11 bulan hanya menyebabkan infeksi sebesar 8%.
Hasil penelitian Aidawati (2006) menunjukkan bahwa, B. tabaci yang dikumpulkan dari beberapa daerah di Indonesia, akan semakin meningkat kemampuannya dalam menularkan geminivirus pada tanaman tomat apabila
periode akuisisinya diperpanjang. Efektifitas penularan geminivirus Bogor yang maksimum sebesar 100% dapat dicapai oleh B. tabaci biotipe non B Jawa Barat melalui periode makan akuisisi minimum selama 180 menit.
Teknik Pengendalian
Pengendalian B. tabaci secara tepat dapat mengurangi resiko kehilangan hasil. Akan tetapi, ada beberapa aktivitas manusia yang justru menyebabkan
peningkatan populasi serangga vektor ini, antara lain penanaman tanaman sejenis secara terus-menerus (monokultur), keterlambatan waktu tanam, dan penggunaan insektisida berbahan kimia sintetis yang kurang rasional (Christiansen 2002).
Kecepatan atau laju reproduksi yang tinggi dan banyaknya tanaman inang
12
Pengendalian B. tabaci secara konvensional dengan menggunakan insektisida kimia seringkali kurang efektif. Hal ini disebabkan karena fase
pradewasa dan dewasa serangga kutukebul ini hidup pada permukaan bawah daun sehingga sulit terjangkau oleh insektisida, dan mulai terjadi resistensi terhadap insektisida tertentu. Di Hawaii, penggunaan beberapa macam insektisida kimia, seperti asefat, carbaryl, diazinon, endosulfan, kinoprene, malathion, methomyl,
oxamyl, phosdrin, dan telstar dilaporkan telah menyebabkan resistensi pada B. tabaci (Johnson et al. 1992). Hasil penelitian menunjukkan bahwa imago B. tabaci sudah mulai resisten terhadap pengaruh insektisida kimia dan pengendalian secara intensif dengan insektisida kimia mengakibatkan resurgensi hama yang lain (Naranjo et al. 2002).
Menurut Kalshoven (1981), salah satu predator B. tabaci yang dijumpai di Indonesia adalah dari famili Coccinellidae (Scymnus sp.). Kelembaban lingkungan yang tinggi dan pelepasan predator cukup efektif menyebabkan kematian pada nimfa B. tabaci instar pertama, tetapi tidak demikian terhadap instar berikutnya (Indrayani & Sulistyowati 2005).
Proteksi Silang
Istilah proteksi silang (cross protection) secara spesifik berlaku untuk perlindungan tumbuhan dengan virus strain lemah terhadap infeksi oleh virus yang sama dengan strain yang lebih virulen yang menyebabkan gejala lebih berat. Proteksi silang merupakan fenomena yang terjadi di antara strain-strain virus. Proteksi silang dengan menggunakan Tobacco mosaic virus strain lemah dan
Citrus tristeza virus strain lemah telah berhasil diterapkan dalam mengendalikan penyakit mosaik dan vein clearing pada tanaman tembakau dan jeruk (Agrios 2004).
Pada prinsipnya, proteksi silang adalah preinokulasi tanaman dengan virus
13
Agens pengendali penyakit tanaman yang disebabkan oleh virus dapat diperoleh dengan cara pseudorekombinasi genetik dan rekombinasi genetik.
Pseudorekombinasi atau reassortment genetik adalah pertukaran fragmen RNA antara dua atau tiga macam strain/ ras patogen yang sudah diketahui sifatnya. Pseudorekombinasi dapat terjadi secara alami atau buatan. Fragmen RNA yang dipertukarkan adalah fragmen yang berperan antara lain dalam menentukan (a)
macam gejala yang diinduksi pada inang tertentu; (b) kemampuannya ditularkan oleh serangga vektor; atau (c) jenis dan kisaran inang (Wahyuni 2005).
Rekombinasi genetik yaitu proses alami penggantian (penambahan atau pengurangan) fragmen DNA atau RNA dari dan antarmolekul DNA/RNA yang berbeda, dapat terjadi pada virus, prokariota atau eukariota. Rekombinasi DNA
juga dapat direkayasa in vitro dengan cara mengurangi atau menambah sekuensi nukleotida dari fragmen–fragmen DNA/RNA suatu jenis virus. DNA target dirakit dengan pendekatan kloning DNA rekombinan dan restriksi endonuklease melalui vektor plasmid DNA dari eukariota (Wahyuni 2005).
Karakteristik yang dipersyaratkan agar suatu virus dapat dimanfaatkan
sebagai agens pengendali yaitu (a) gejala yang diinduksi oleh mild virus harus bersifat sistemik, sangat lemah dan tidak mengubah kualitas produk; (b) mempunyai sifat genetik yang stabil sehingga tidak berubah menjadi strain yang
ganas; (c) tidak dengan sangat mudah disebarkan oleh vektor; (d) sifat protektif tidak hanya ditujukan kepada satu macam virus sekerabat, tetapi juga satu sampai tiga virus sekaligus, meskipun tidak selalu sekerabat; (e) inokulum virus protektif harus mudah diproduksi, tetap murni dan stabil dalam tanaman dan vektor (Hull
2002).
Teknik aplikasi proteksi silang dapat dilakukan dengan (1) spray gun
bertekanan tinggi pada bibit, tetapi cara ini tidak efektif untuk tanaman semusim, (2) penyambungan untuk propagasi vegetatif tanaman berkayu (Wahyuni 2005).
Mekanisme terjadinya proteksi silang yaitu adanya: (a) kompetisi dalam
replication sites karena melibatkan kombinasi subunit-subunit sandi antara inang dan virus (misalnya dalam proses sintesis replikasi), karena semua replication sites sudah ditempati oleh virus pelindung (mild virus); (b) precursor exhaustion
14
nukleotida penyandi milik inang dan virus yang berfungsi sebagai pensintesis DNA/ RNA dari virus pelindung (virus strain lemah) dan virus yang ditantang
(virus strain ganas), macam-macam metabolit esensial yang diperebutkan berbeda antar virus yang sekerabat dan tidak sekerabat; (c) coat protein sequestration yaitu protein mantel mild virus akan mengenkapsidasi RNA/ DNA virus lain yang masih sejenis, sehingga RNA/ DNA virion yang dirakit dalam sel inang tidak
mampu menginisiasi untuk melakukan replikasi; (d) perubahan metabolisme inang yaitu mild virus lebih dulu berhasil mengubah metabolisme inang untuk keperluan dirinya; (e) spesific inhibitor yaitu mild virus menghasilkan substansi yang mampu menghambat secara spesifik keberadaan virus lain yang masih sejenis, tetapi tidak demikian terhadap virus yang tidak sejenis, (f) terjadinya
kompetisi translasi RNA antara virus strain lemah dan virus strain ganas, akan tetapi fenomena ini tidak berlaku untuk tanaman transgenik yang mengekspresikan gen protein mantel (Wahyuni 2005).
Proteksi silang telah berhasil diterapkan untuk mengendalikan CMV pada
Capsicum sp. di Cina dalam skala percobaan lapangan, dan pada tomat di Italia Selatan. Inokulum pertama yang digunakan adalah CMV strain lemah yang dipseudorekombinasi dengan sat-RNA asal strain lain, akibatnya Capsicum
(tanaman tomat) dapat menahan serangan virus kedua yang lebih ganas (virus
15
BAHAN DAN METODE
Tempat dan Waktu Penelitian
Penelitian berlangsung sejak Agustus 2008 sampai Desember 2009.
Dilaksanakan di Saung Mirwan, kabupaten Bogor; Lahan pertanian milik petani daerah Pacet, kabupaten Cianjur; Laboratorium Virologi Tumbuhan; Laboratorium Biosistematika Serangga, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor, Jawa Barat.
Metode Penelitian
Survei Kejadian Penyakit Daun Keriting Kuning pada Pertanaman Tomat Sebelum dilakukan eksplorasi TYLCV isolat lemah, maka terlebih dahulu
dilakukan survei pemetaan kejadian penyakit daun keriting kuning pada pertanaman tomat untuk menentukan daerah eksplorasi. Kegiatan survei dilakukan di daerah Bogor dan Cianjur yang mempunyai degradasi ketinggian tempat mulai dari 176 meter di atas permukaan laut (m dpl) sampai lebih dari 1300 m dpl. Pada setiap rentang ketinggian tempat diamati empat sampai enam kebun tomat petani. Pada setiap kebun diamati jenis varietas tomat yang ditanam
dan gejala penyakit daun keriting kuning dan kejadian penyakitnya dihitung dengan membagi jumlah tanaman contoh yang memperlihatkan gejala dengan jumlah tanaman yang diamati. Di samping itu, diamati juga kutukebul yang mengkoloni pertanaman tomat setempat dan kemudian diidentifikasi melalui morfologi kantung pupa mengikuti prosedur Martin (1999).
Pemeliharaan Kutukebul Bemisia tabaci
Untuk mendapatkan imago kutukebul yang bebas virus yang akan digunakan dalam pengujian penularan virus, maka terlebih dahulu dilakukan pengambilan pupa kutukebul dari pertanaman tomat di daerah Bogor dan Cianjur.
Imago-16
imago hasil pemeliharaan ini merupakan kutukebul yang sudah bebas virus dan siap digunakan untuk pengujian selanjutnya.
Eksplorasi Tomato Yellow Leaf Curl Virus (TYLCV) Isolat Lemah
Contoh tanaman tomat berupa bahan stek pucuk diambil dari tanaman tomat yang tidak bergejala untuk mendapatkan TYLCV isolat lemah. Stek yang diambil
segera ditanam pada media tumbuh berupa campuran kompos, sabut kelapa dan arang sekam (1:1:1) dan dipelihara pada kelembaban cukup tinggi dalam kondisi rumah kaca dengan naungan lebih dari 80%. Untuk merangsang perakaran, stek dicelupkan terlebih dahulu pada Rootone-F sebelum ditanam. Bersamaan dengan penyetekan, dilakukan deteksi TYLCV pada setiap stek tomat melalui enzyme linked immunosorbent assay (ELISA) dan polymerase chain reaction (PCR). Hanya stek-stek tomat yang mengandung TYLCV saja yang diteruskan untuk penelitian lebih lanjut.
Prosedur ELISA
Pengujian diawali dengan melakukan penggerusan contoh daun tanaman dalam kantung plastik tebal dengan menggunakan pistil, sebelumnya ke dalam kantung plastik tersebut ditambahkan bufer ekstrak (perbandingan 1:10 dengan
daun). Kemudian ekstrak daun hasil penggerusan (sap) dimasukkan ke dalam sumuran plat mikrotiter sebanyak 100 µl untuk setiap sumuran. Selanjutnya plat mikrotiter tersebut diletakkan dalam kotak yang lembab dan diinkubasi semalaman dalam lemari pendingin (suhu 4ºC). Keesokan harinya, plat mikrotiter
dicuci dengan PBST (phosphate buffer saline-tween) sebanyak 3 sampai 5 kali dan dilanjutkan dengan pengeringan menggunakan kertas tisu atau kain kering yang bersih. Selanjutnya dimasukkan antibodi TYLCV (Utsunomiya University, Japan) yang sebelumnya telah diencerkan dengan perbandingan 1:2000 (v/v) dalam bufer konjugat sebanyak 100 µl untuk setiap sumuran plat mikrotiter dan diinkubasi semalaman lagi dalam lemari pendingin (4ºC). Keesokan harinya, plat mikrotiter dicuci kembali dengan PBST sebanyak 5 kali dan dikeringkan dengan kertas tisu bersih. Selanjutnya ke dalam plat mikrotiter tersebut dimasukkan
17
konjugat) sebanyak 100 µl untuk setiap sumuran. Kemudian diinkubasi dalam inkubator pada suhu 37ºC selama 3 jam. Setelah itu, plat mikrotiter dicuci
kembali dengan PBST sebanyak 5 kali dan dikeringkan. Selanjutnya dimasukkan substrat pNP (5 mg pNP dalam 5 ml bufer substrat) sebanyak 100 µl untuk setiap sumuran plat. Kemudian diinkubasikan pada suhu ruang selama 15-60 menit sambil diamati terjadinya perubahan warna. Pembacaan absorbansi dilakukan
dengan mesin ELISA reader BIO-RAD model 550 pada panjang gelombang 405 nanometer. Kemudian contoh daun yang positif mengandung virus, namun tanamannya tidak bergejala penyakit dideteksi kembali dengan tekhnik PCR.
Ekstraksi DNA
Sebelum dilakukan amplifikasi DNA dengan tekhnik PCR, dilakukan terlebih dahulu ekstraksi DNA total dari jaringan contoh daun tanaman tomat dengan mengikuti prosedur Doyle & Doyle (1990).
Proses ekstraksi diawali dengan memanaskan terlebih dahulu 10 ml bufer ekstraksi/ CTAB bufer (banyaknya bufer disesuaikan dengan kebutuhan contoh
daun) yang mengandung 1% merkaptoetanol dalam waterbath pada suhu 65ºC. Sementara itu contoh daun digerus menggunakan mortar dan ditambah nitrogen cair. Selanjutnya ekstrak daun hasil penggerusan dimasukkan dalam tabung
mikro (eppendorf) ukuran 1,5 ml dan ditambahkan 500 µl bufer ekstraksi yang sudah dipanaskan sebelumnya, kemudian dicampur dengan merata. Selanjutnya campuran hasil gerusan contoh daun dan bufer ekstraksi diinkubasi pada suhu 65ºC (dalam waterbath) selama 60 menit dan setiap 10 menit tabung mikro dibolak-balik untuk membantu proses lisis. Setelah 60 menit, campuran diambil dari waterbath dan didiamkan sebentar (± 2 menit) pada suhu ruang, kemudian ditambahkan 500 µl campuran Chloroform:Isoamilalkohol (CI) dengan perbandingan 24:1. Penambahan ini dilakukan dalam fumehood (ruang asap). Campur dengan baik dengan vorteks selama 5 menit, kemudian di-sentrifuse
18
dengan merata. Setelah itu ditambahkan lagi ke dalamnya dengan 2/3 x volume isopropanol atau 2,5 x volume etanol absolut untuk propsipitasi DNA dan campur
dengan membolak-balik tabung mikro secara perlahan. Selanjutnya diinkubasi semalaman dalam lemari pendingin (suhu -20ºC). Keesokan harinya, tabung mikro tersebut di-sentrifuse kembali pada kecepatan 12000 rpm selama 10 menit untuk mengendapkan DNA. Selanjutnya cairan (yang ada di lapisan paling atas
dalam tabung mikro) dibuang dan endapan DNA (yang ada di lapisan paling bawah dalam tabung mikro) dicuci dengan etanol 70%, kemudian di-sentrifuse
lagi selama 5 menit. Setelah itu cairan (yang ada di lapisan paling atas dalam tabung mikro) dibuang dan endapan DNA dikeringkan di atas kertas tisu bersih. Setelah kering, endapan DNA dilarutkan kembali dengan 100 µl bufer TE (pH 8).
Selanjutnya DNA total yang sudah didapat bisa digunakan untuk proses amplifikasi PCR (setelah sebelumnya dilakukan pengenceran).
Prosedur PCR
Amplifikasi sebagian genom TYLCV dilakukan menggunakan forward primer (3’-TAATTCTAGATGTCGAAGCGACC CGCCGA-5’) dan reverse primer (3’-GGCCGAATTCTTAATTTTGAACAGAATCA-5’).
Diawali dengan menyiapkan tabung mikro (eppendorf) ukuran 200 µl,
kemudian ke dalamnya dimasukkan bufer PCR 10x + Mg2+ (sebanyak 2,5 µl), sukrosa 10x (sebanyak 2,5 µl), deoksiribonukleotida triphosphat (dNTP) 10 mM (sebanyak 0,5 µl), forward primer (sebanyak 2 µl), reverse primer (sebanyak 2 µl), Taq DNA polymerase (sebanyak 0,5 µl), ddH2O (sebanyak 14 µl), template
DNA hasil ekstraksi (sebanyak 1 µl).
Reaksi PCR dilakukan dalam volume 25 µl menggunakan mesin Gene Amp
PCR system 9700 yang bekerja 30 siklus yaitu denaturasi pada suhu 94ºC selama 1 menit, penempelan primer pada suhu 50ºC selama 1 menit dan sintesis DNA
19
Seleksi TYLCV Isolat Lemah Stabil
Untuk mengetahui bahwa TYLCV yang terkandung dalam contoh stek
tomat merupakan isolat lemah yang stabil (atau tidak menginduksi gejala penyakit daun keriting kuning) maka stek tersebut ditanam di lapangan (dalam penelitian ini di daerah Pacet, Cianjur). Stek yang sudah tumbuh akar ditanam pada lahan yang telah diolah dan diberi pupuk organik dan NPK secukupnya tepat pada
lubang mulsa plastik yang dibuat dengan jarak sekitar 40 cm x 50 cm. Tanaman dipelihara sebaik-baiknya dan diamati kemunculan gejala penyakit daun keriting kuning setiap hari. Pada saat berumur satu bulan sudah banyak muncul pucuk-pucuk baru, tanaman yang tidak memperlihatkan gejala penyakit daun keriting kuning diperbanyak melalui stek pucuk untuk pengujian proteksi silang.
Pengujian Proteksi Silang
Potensi proteksi silang yang mungkin dimiliki oleh TYLCV isolat lemah diuji dengan menginokulasi tanaman tomat yang sudah mengandung TYLCV isolat lemah dengan TYLCV isolat ganas. Sumber TYLCV isolat ganas disiapkan
dari tanaman tomat yang memperlihatkan gejala penyakit daun keriting kuning yang sangat parah dan virus yang terkandung telah dideteksi melalui ELISA atau PCR. Inokulasi dilakukan melalui penularan dengan imago B. tabaci sekitar 10 ekor per tanaman uji dengan 24 jam makan akuisisi dan 48 jam makan inokulasi.
Untuk pembandingnya dengan kontrol, akuisisi B. tabaci tetap dilakukan pada tanaman tomat sumber TYLCV isolat ganas, akan tetapi inokulasi dilakukan pada tanaman tomat sehat.
Tanaman uji dipelihara sebaik-baiknya pada kondisi rumah plastik di Saung Mirwan, Bogor. Pengamatan terhadap perkembangan gejala yang mungkin terjadi dilakukan setiap hari sampai sekitar dua minggu setelah inokulasi.
Inokulasi TYLCV Isolat Lemah Protektif pada Bibit Tomat
20
tomat sumber TYLCV isolat lemah selama 24 jam dan kemudian dipindahkan seluruhnya ke dalam tray yang sudah diberi sungkup plastik dan dibiarkan makan inokulasi pada ke 36 bibit tomat tersebut selama 48 jam. Perlakuan yang sama dilakukan terhadap 4 tray bibit tomat sebagai ulangan.
Untuk pembandingnya dengan kontrol negatif, makan akuisisi B. tabaci
dilakukan pada tanaman tomat sehat. Inokulasi dilakukan pada saat bibit tomat
sudah berdaun dua melalui B. tabaci. Sebanyak 60 ekor imago B. tabaci
dibiarkan makan akuisisi pada tanaman tomat sehat selama 24 jam dan kemudian dipindahkan seluruhnya ke dalam tray yang sudah diberi sungkup plastik dan dibiarkan makan inokulasi pada ke 36 bibit tomat selama 48 jam. Perlakuan yang sama dilakukan terhadap 4 tray bibit tomat sebagai ulangan.
Untuk pembandingnya dengan kontrol positif, makan akuisisi B. tabaci
dilakukan pada tanaman tomat bergejala berat penyakit daun keriting kuning. Inokulasi TYLCV isolat ganas dilakukan pada saat bibit tomat sudah berdaun dua melalui B. tabaci. Sebanyak 60 ekor imago B. tabaci dibiarkan makan akuisisi pada tanaman tomat sumber TYLCV isolat ganas selama 24 jam dan kemudian
dipindahkan seluruhnya ke dalam tray yang sudah diberi sungkup plastik dan dibiarkan makan inokulasi pada ke 36 bibit tomat selama 48 jam. Perlakuan yang sama dilakukan terhadap 4 tray bibit tomat sebagai ulangan.
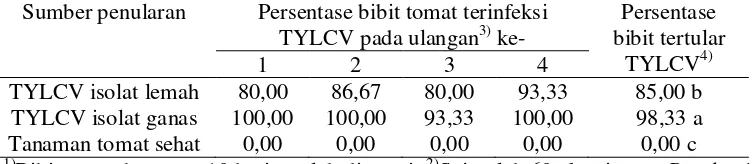
Keberhasilan penularan TYLCV isolat lemah, kontrol negatif, dan penularan TYLCV isolat ganas (sebagai pembanding: kontrol positif) diverifikasi melalui ELISA pada saat 15 hari setelah inokulasi.
Tingkat penularan TYLCV antara isolat lemah dan isolat ganas dianalisis
dengan analisis ragam satu arah (Oneway ANOVA) untuk menentukan pengaruh perbedaan jenis isolat terhadap penularan TYLCV. Perbedaan rata-rata persentase bibit tertular diuji dengan uji Kisaran Ganda Duncan pada taraf nyata 5%.
21
HASIL DAN PEMBAHASAN
Penyakit Daun Keriting Kuning pada Tanaman Tomat
Berdasarkan pengamatan langsung di lapangan, tanaman tomat yang
terserang penyakit daun keriting kuning mempunyai beberapa ciri-ciri khas seperti terlihat pada Gambar 1. Daun tomat mengalami klorosis berat sehingga nampak kuning. Daun-daun pucuk berukuran jauh lebih kecil dari normal, sedangkan daun-daun bawah menjadi keriting. Pertumbuhan tanaman sangat terhambat
sehingga menjadi kerdil dan umumnya tidak menghasilkan buah. Gejala penyakit daun keriting kuning ini sama dengan yang terjadi di negara lain (Moriones & Navas-Castillo 2000; Ribeiro et al. 2003). Berdasarkan keparahan penyakit yang ditimbulkannya, TYLCV (yang berasosiasi dengan penyakit ini setelah
diverifikasi melalui ELISA) yang ada di Indonesia dikategorikan sebagai virus isolat ganas.
Gambar 1 Gejala penyakit daun keriting kuning pada tanaman tomat terinfeksi
22
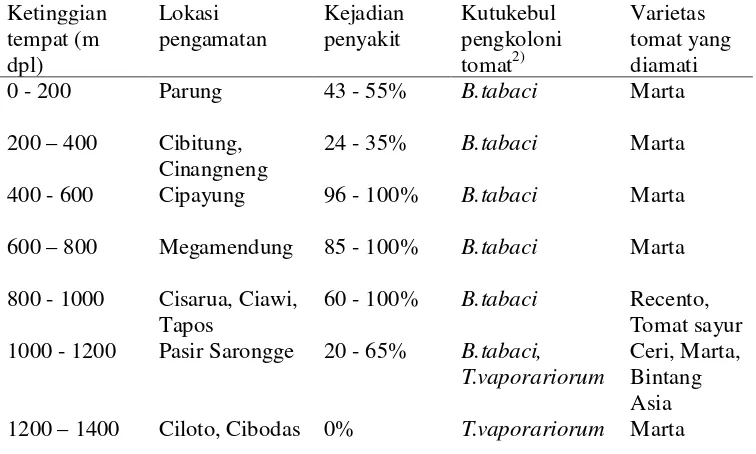
Penyebaran penyakit ini di lapangan terjadi dengan laju yang tinggi (Varma & Malathi 2003; Isakeit et al. 2007) sehingga insiden penyakit menjadi sangat luas bahkan pada beberapa kebun petani yang diamati mengalami kejadian penyakit sampai 100% (Tabel 1). Hal ini tidak mengherankan karena B. tabaci
dapat menularkan TYLCV secara persisten (Morin et al. 2000; Ghanim et al. 2001; Sulandari et al. 2007) dan mempunyai mobilitas yang sangat tinggi (Simon
et al. 2003a). Pada umumnya B. tabaci menyebar di daerah dengan suhu yang agak hangat sampai panas (Simon et al. 2003b). Namun, mungkin karena pengaruh akibat dari pemanasan global, B. tabaci (Gambar 1) saat ini sudah ditemukan di daerah dataran tinggi sampai pada ketinggian 1200 m dpl (Tabel 1) di Jawa Barat dan mungkin juga di daerah lain di Indonesia. Demikian pula
penyakit daun keriting kuning juga sudah ditemukan menyerang pertanaman tomat yang ditanam pada daerah dataran tinggi (Tabel 1), mengikuti penyebaran serangga vektornya. Hal yang sama juga sudah dilaporkan oleh peneliti lain (Moriones & Navas-Castillo 2000; Davino et al. 2006; Xie et al. 2006). Peranan penyakit daun keriting kuning dalam budidaya tomat di Indonesia menjadi
semakin penting karena semua varietas tomat yang dibudidayakan petani, terutama di daerah Bogor dan Cianjur, diamati rentan terhadap infeksi TYLCV (Tabel 1).
Seiring dengan perkembangan zaman dalam hal budidaya tanaman, berkembangnya sistem tanam tumpang sari antara tanaman tomat dengan cabai, dan kapas dengan palawija, kedelai, kacang hijau, dan terong; penanaman tanaman sejenis dengan pola tanam monokultur yang dilakukan secara
23
sehingga berdampak besar terhadap meluasnya penyebaran penyakit daun keriting kuning di lapangan.
Tabel 1 Kejadian penyakit daun keriting kuning pada tanaman tomat menurut ketinggian tempat di daerah Bogor dan Cianjur1)
Ketinggian 1200 – 1400 Ciloto, Cibodas 0% T.vaporariorum Marta 1)
Merupakan hasil pengamatan dari 4 - 6 kebun petani tomat pada setiap kriteria ketinggian tempat;
2)
Penentuan spesies kutukebul berdasarkan pengamatan langsung pada ukuran dan/atau cara hinggap imago kutukebul
Eksplorasi TYLCV Isolat Lemah
Secara alami virus tanaman diketahui mengalami mutasi pada laju yang relatif lebih tinggi dibandingkan dengan organisme lain. Hal ini karena virus termasuk entitas yang sangat sederhana dan juga tidak mempunyai mekanisme
proof-reading untuk memperbaiki kesalahan dalam proses replikasinya (Hanley-Bowdoin et al. 2000). Demikian juga varian TYLCV yang tidak menginduksi gejala penyakit daun keriting kuning dapat ditemukan di antara populasi TYLCV
24
mempertinggi kemungkinan mendapatkannya, kegiatan koleksi TYLCV isolat lemah dilakukan pada kebun-kebun tomat yang 80% atau lebih populasi
tanamannya memperlihatkan gejala penyakit daun keriting kuning.
Pada penelitian ini, pengumpulan (koleksi) TYLCV isolat lemah dilakukan melalui stek pucuk tanaman tomat karena virus ini tidak dapat ditularkan secara mekanik atau dengan cairan perasan (Morin et al. 2000).
Gambar 2 Penanaman stek pucuk tomat yang mengandung TYLCV isolat lemah dalam media tumbuh dalam tray (kiri) sampai sekitar dua minggu yaitu saat perakarannya sudah mencukupi (tengah) dan kemudian dipindahkan ke dalam pot individu (kanan) untuk selanjutnya ditanam di lapangan
Eksplorasi TYLCV isolat lemah telah dilakukan beberapa kali selama kurun
waktu dari bulan Januari sampai Maret 2009 dari beberapa lokasi di daerah Bogor, Cianjur dan Garut dengan jumlah contoh stek mencapai 1.102 stek pucuk dari
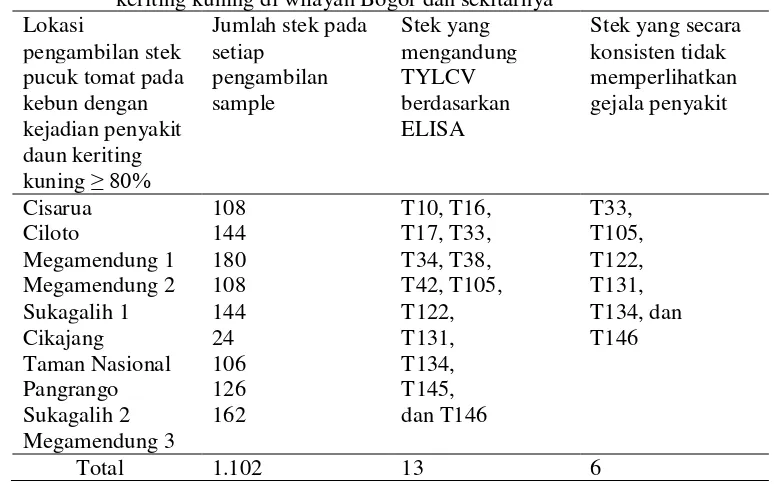
seluruh individu tanaman tomat yang tidak memperlihatkan gejala penyakit (dapat dilihat pada Tabel 2). Deteksi melalui ELISA menggunakan antiserum TYLCV (Utsunomiya University, Japan) memastikan bahwa 13 stek, dari semua contoh stek yang telah dikoleksi, mengandung TYLCV (Tabel 2). Suatu probabilitas
yang cukup tinggi yaitu sekitar 1,18% untuk mendapatkan TYLCV isolat lemah dari lingkungan alami. Stek-stek tomat yang telah diketahui mengandung TYLCV kemudian ditanam dalam tray selama sekitar dua minggu sampai tumbuh cukup akar untuk dipindahkan ke dalam pot individu dan dipelihara sekitar seminggu lagi untuk kemudian dipindah-tanamkan ke lapangan (Gambar 2).
Untuk mengetahui fenotipe dari setiap isolat TYLCV, maka selama pertumbuhan stek diamati perkembangan kondisi tanaman setiap hari terutama
25
tujuh stek memperlihatkan gejala penyakit daun keriting kuning (Tabel 2), yang berarti bahwa setiap stek tomat ini mengandung TYLCV isolat ganas dan oleh
karenanya tidak digunakan dalam penelitian selanjutnya. Enam stek sisanya tidak menunjukkan gejala penyakit sampai sebulan lamanya dipelihara di lapangan.
Tabel 2 Koleksi tanaman tidak bergejala dari lapangan yang epidemi penyakit keriting kuning di wilayah Bogor dan sekitarnya
Lokasi menginduksi gejala penyakit) yang bersifat stabil. Keenam isolat tersebut masing-masing diberi nama sebagai TYLCV-T33, -T105, -T122, -T131, -T134 dan -T146 (Tabel 2). Untuk lebih meyakinkan, keenam TYLCV isolat lemah stabil ini dideteksi lagi melalui PCR menggunakan primer spesifik terhadap TYLCV.
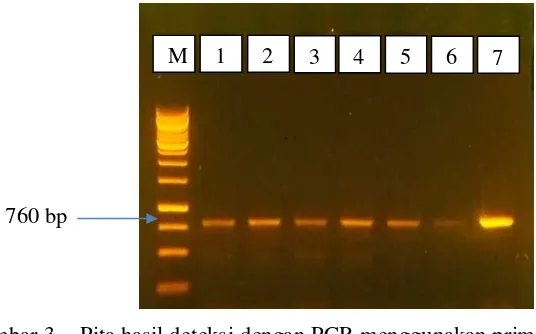
Seperti yang ditampilkan pada Gambar 3, masing-masing stek tomat tersebut memhasilkan pita PCR berukuran 760 bp yang sesuai dengan desain primer yang digunakan. Dengan demikian sudah dikonfirmasi dengan lebih cermat keberadaan masing-masing isolat TYLCV pada masing-masing stek tomat tersebut. Keenam TYLCV isolat lemah ini kemudian diuji potensi protektifnya
26
Gambar 3 Pita hasil deteksi dengan PCR menggunakan primer spesifik TYLCV terhadap sample stek no 105, 146, 122, 134, 33 dan 131 (masing-masing pada lajur ke 1, 2, 3, 4, 5 dan 6) dan kontrol positif yaitu contoh stek yang memperlihatkan gejala penyakit daun keriting kuning (pada lajur ke 7). Sedangkan M adalah 1 kb DNA leader
(Qiagen, Germany)
Menurut Torres et al. 1996, ada beberapa faktor yangdapat mempengaruhi keberhasilan isolasi DNA geminivirus, antara lain umur jaringan contoh tanaman; kesegaran contoh daun tanaman yang digunakan; jenis dan tekstur contoh tanaman yang digunakan; lamanya waktu infeksi virus pada contoh tanaman; dan metode isolasi/ ekstraksi DNA yang digunakan. Pada daun tomat terkandung metabolit sekunder dan zat penghambat yang dapat menjadi salah satu faktor yang
mempengaruhi keberhasilan isolasi DNA dan menghambat proses amplifikasi DNA dalam reaksi PCR nantinya. Oleh karena itu, setelah diambil dari lapangan, daun tomat harus segera digunakan, dapat juga disimpan dalam lemari pendingin (suhu -80ºC) agar tidak terjadi kerusakan jaringan pada contoh daun yang akan digunakan.
Keberhasilan PCR juga sangat ditentukan oleh beberapa faktor, yaitu (1) deoksiribonukleotida triphosphat (dNTP); (2) oligonukleotida primer; (3) DNA
template (cetakan); (4) komposisi larutan bufer PCR; (5) jumlah siklus reaksi; (6) enzim Taq DNA polymerase; dan (7) kebersihan, adanya kontaminasi alat-alat yang digunakan (Yuwono 2006). Oleh karena itu, pada penelitian ini diperlukan sekali ketepatan volume bahan-bahan pereaksi dan kebersihan alat dan tempat
yang digunakan dalam proses amplifikasi DNA sehingga deteksi TYLCV dengan tekhnik PCR dapat berhasil dilakukan.
1 2 3 4 5 6 7 M
27
TYLCV Isolat Lemah Sebagai Agens Pengendali Penyakit Daun Keriting Kuning pada Tanaman Tomat
Setiap TYLCV yang telah diidentifikasi sebagai isolat lemah yang stabil (Tabel 2) yaitu TYLCV-T33, -T105, -T122, -T131, -T134 dan -T146 dianalisa sifat protektifnya terhadap isolat TYLCV yang secara alami menginduksi gejala daun keriting kuning berat (untuk seterusnya disebut TYLCV isolat ganas).
Analisa dilakukan dengan menginokulasi stek tanaman tomat yang sudah mengandung TYLCV isolat lemah dengan TYLCV isolat ganas melalui kutukebul
B. tabaci (challenge inoculation). Dalam menginokulasikan TYLCV isolat ganas, jumlah kutukebul yang digunakan sebanyak sepuluh ekor imago untuk memberikan tingkat penularan yang maksimal (Brown & Czosnek 2002) dan
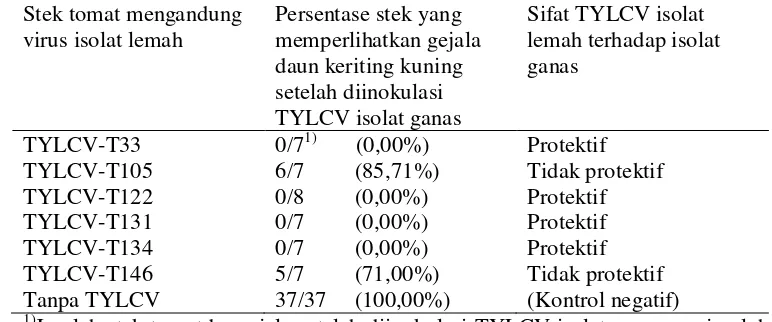
tujuan ini telah terlihat dari persentase kemunculan gejala yang mencapai 100% bila stek-stek tomat yang tidak mengandung TYLCV isolat lemah diinokulasi (Tabel 3). Hasil pengujian ini memperlihatkan bahwa tidak semua isolat lemah yang diuji mempunyai sifat protektif terhadap isolat ganas, seperti misalnya dua isolat TYLCV yaitu T105 dan T146 memperlihatkan hasil yang berbeda. Kedua
isolat virus ini tidak mempunyai kemampuan perlindungan terhadap stek tomat dan membiarkan lebih dari 70% stek tomat menjadi sakit dengan gejala daun keriting kuning yang parah setelah diinokulasi TYLCV isolat ganas (dapat dilihat
pada Tabel 3). Empat isolat lainnya, yaitu TYLCV-T33, -T122, -T131 dan -T134, memperlihatkan kemampuan protektif karena mampu melindungi stek tomat dari infeksi TYLCV isolat ganas dan mencegah kemunculan gejala daun keriting kuning. Fenomena proteksi silang nampak dengan jelas diperlihatkan oleh
TYLCV-T33, -T122, -T131 dan –T134 ini (Tabel 3).
Syarat-syarat yang harus dipenuhi agar suatu virus dapat dimanfaatkan sebagai agens pelindung adalah: (i) gejala yang diinduksi oleh isolat lemah atau virus strain lemah harus bersifat sistemik, sangat lemah; (ii) tidak mengubah
28
Tabel 3 Analisa sifat protektif isolat-isolat lemah TYLCV terhadap inokulasi isolat ganas
Jumlah stek tomat bergejala setelah diinokulasi TYLCV isolat ganas per jumlah stek yang diinokulasi
Beberapa mekanisme proteksi silang sudah dipostulatkan oleh beberapa peneliti sebelumnya. Contohnya, Goregaoker et al. (2000) dan Hallan & Gafni (2001) menemukan peran penting dari protein mantel (coat protein/ CP) dalam peristiwa proteksi silang. Dikatakan bahwa CP dari virus isolat lemah, yang konsentrasinya sudah tinggi dan dominan dalam sel inang, menyelubungi asam
nukleat (RNA atau DNA) virus isolat ganas segera setelah uncoating sehingga tidak ada kesempatan berlangsungnya replikasi. Hasil penelitian Briddon et al. (2004), Saeed et al. (2005) dan Briddon & Stanley (2006) menemukan bahwa
DNA satellite selain dapat mengubah fenotipe isolat virus yang berasosiasi dengannya, juga dapat menghambat proses infeksi isolat lain dalam proteksi
silang. Penelitian yang lebih mutahir (Dong et al. 2003; Pooggin et al. 2003; Cui
et al. 2005; Vanitharani et al. 2005; Bisaro 2006) memperlihatkan bahwa proses
gene silencing juga terlibat dalam mekanisme proteksi silang.
Pada interaksi tanaman dengan virus tertentu, lebih dari satu mekanisme
mungkin terlibat dalam proteksi silang. Untuk virus-virus yang termasuk dalam kelompok Geminiviridae, termasuk TYLCV ini, telah dilaporkan bahwa beberapa
isolatnya mempunyai DNA satellite yang mungkin berperan dalam proteksi silang (Briddon et al. 2004).
![Gambar 1 Gejala penyakit daun keriting kuning pada tanaman tomat terinfeksi Tomato yellow leaf curl virus (TYLCV) [diambil dari daerah endemik di Bogor, Jawa Barat] (kiri); dan imago B](https://thumb-ap.123doks.com/thumbv2/123dok/571144.435405/37.612.129.507.370.595/gambar-gejala-penyakit-keriting-terinfeksi-tomato-diambil-endemik.webp)