PENGARUHNYA TERHADAP PERTAHANAN DAN GAMBARAN
HISTOPATOLOGI USUS HALUS AYAM PETELUR
UMMU BALQIS
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa disertasi Purifikasi dan Karakterisasi
Protease dari Ekskretori/Sekretori Stadium L3Ascaridia galli dan Pengaruhnya
Terhadap Pertahanan dan Gambaran Histopatologi Usus Halus Ayam Petelur
adalah karya saya sendiri dengan arahan komisi pembimbing dan belum diajukan
dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang
berasal atau dikutip dari karya yang diterbitkan manapun tidak diterbitkan dari
penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di
bagian akhir disertasi ini.
Bogor, Agustus 2007
Ummu Balqis
UMMU BALQIS. Purifikasi dan Karakterisasi Protease dari Ekskretori/Sekretori Stadium L3 Ascaridia galli dan Pengaruhnya Terhadap Pertahanan dan Gambaran Histopatologi Usus Halus Ayam Petelur. Dibawah bimbingan RISA TIURIA PRIOSOERYANTO, BAMBANG PONTJO PRIOSOERYANTO, dan MAGGY THENAWIJAYA SUHARTONO.
Infeksi cacing nematoda parasitik Ascaridia galli berlangsung di dalam usus halus unggas. Penelitian ini dilakukan untuk memurnikan dan menganalisa karakter protease dari ekskretori/sekretori stadium L3 A. galli sebagai pemicu pertahanan mukosa berdasarkan proliferasi dan hiperplasia sel goblet, sel mast mukosa, sel eosinofil pada usus halus ayam petelur. Dosis 6000 L2 diberikan langsung ke dalam oesofagus 100 ekor ayam, dan tujuh hari kemudian larva yang sudah menetas (L3) diambil kembali dari dalam usus halus. L3 dikultur secara in vitro dalam medium Rosswell Park Memorial Institute (RPMI 1640), pH 6,8, tanpa merah fenol dalam inkubator pada temperatur 37oC dan 5% CO2 selama 3 hari. Ekskretori/sekretori dipreparasi dari produk metabolisme L3 yang dilepaskan ke dalam medium kultur. Protease dimurnikan dengan ammunium sulfat, dialisis yang diikuti dengan kromatografi filtrasi gel matriks sephadex G-100. Matriks DEAE sephadex A-50 digunakan untuk pemurnian protease melalui kromatografi anion exchange. Aktivitas protease diuji pada kasein 2%. Aktivitas protease dikaji terhadap sensitivitas inhibitor, temperatur, dan pH. Konsentrasi protein dihitung mengikuti metode Bradford. Berat molekul protease diestimasi melalui sodium dodecyl sulphate polyacrylamide gel electrophoresis (SDS PAGE).
Ayam diimunisasi dengan dosis 80 μg (dengan aktivitas enzim 0,0098 U/ml pada crude dan 0,877 U/ml pada pure) protease serin hasil ekskresi cacing yang dicampur dengan Fruend Adjuvant Complete. Imunisasi diulang tiga kali dengan dosis 60 μg (dengan aktivitas enzim sebesar 0,0074 U/ml pada crude dan 0,657 U/ml pada pure setiap kali imunisasi) protease serin yang dicampur dengan Freund Adjuvant Incomplete dalam interval waktu satu minggu secara intra muskular. Satu minggu kemudian, ayam ditantang dengan dosis 1000 L2 A. galli, dan dinekropsi dua minggu pascatantang. Respons sel eosinofil, sel goblet dan sel mast mukosa diamati dan dihitung jumlahnya pada usus halus ayam petelur. Larva A. galli yang ditemukan di dalam usus halus dihitung jumlahnya.
Hasil penelitian menunjukkan bahwa aktivitas enzim pada fraksi 31 kromatogram filtrasi gel lebih tinggi dibandingkan dengan anion exchange. Stadium L3 A. galli melepaskan protease serin yang dihambat oleh PMSF. Temperatur dan pH optimum enzim berturut-turut 70oC dan 7. Aktivitas dan aktivitas spesifik enzim adalah 0,625 U/ml dan 4x10-3 U/mg. Estimasi berat molekul enzim pada 28 kDa. Imunisasi dapat meningkatkan jumlah sel goblet, sel mast, dan sel eosinofil secara signifikan (P < 0,05). Imunisasi dapat menurunkan secara signifikan jumlah larva yang bertahan di dalam usus halus ayam petelur setelah dua minggu infeksi dosis 1000 L2A. galli. Protease serin dapat memicu pertahanan mukosa terhadap penyakit parasitik yang disebabkan oleh A. galli.
UMMU BALQIS. Purification and Characterization Protease from Excretory/ Secretory of Ascaridia galli L3 Stage and it’s effect against Defense and Histopathology of Intestine in Laying Hens. Under the guidance of RISA TIURIA PRIOSOERYANTO, BAMBANG PONTJO PRIOSOERYANTO, and MAGGY THENAWIJAYA SUHARTONO.
The parasitic nematode Ascaridia galli occurs in the small intestine of the poultry. A study was carried out to purify and characterize protease from exretory/secretory of A. galli L3 stage to trigger mucosal responses based on proliferation and hyperplasia goblet, mucosal mast cells, and eosinophil in laying hens. A. galli L3 were recovered from intestines of 100 heads chickens 7 days after oesophagus inoculation with 6000 L2. L3 recovered in this manner were cultured (5 – 10 ml-1) in flasks containing rosswell park memorial institute (RPMI) 1640 media, pH 6.8, without phenol red. Cultures were incubated at 370C in 5% CO2 and culture fluid was collected after 3 days in culture. Excretory/secretory was prepared from metabolic product of L3 released in culture medium. Protease purified using ammonium sulphate, dialysis and matrix sephadex G-100 gel filtration chromatography. Matrix DEAE sephadex A-50 were used to purified protease by mean of anion exchangechromatography. The protease activity was assayed against casein. Inhibitor sensitivity, temperature, and pH optimum on protease activity were studied. Protein concentration were counted as described in Bradford method. The molecular weight of protease was determined with sodium dodecyl sulphate polyacrylamide gel electrophoresis (SDS PAGE).
The chickens immunized with 80 µg (with enzyme activity 0,0098 U/ml in crude and 0,877 U/ml in pure)mixed with Fruend Adjuvant Complete and repeated three times with dose of each 60 µg (with enzyme activitity 0,0074 U/ml in crude and 0,657 U/ml in pure of each immunization) protease of A. galli L3 mixed with Freund Adjuvant Incomplete with an interval of one week intra muscularly. One week later, the chickens were challenged with 1000 L2 of A. galli, and necrop two weeks post challenged. Goblet, mucosal mast cells, and eosinophil reaction were observed in intestinal of laying hens immunized with the purity of protease. A. galli larvae recovered from intestines were counted.
The result showed that enzyme activity after chromatography gel filtration more highly compared anion exchange. L3 released serine protease which is inhibited by PMSF. Temperature and pH optimum of the enzyme are 70oC and 7, respectively. The enzyme activity and protease specific activity are 0,625 U/ml and 4x10-3 U/mg, the molecular weight is estimate on 28 kDa. Immunization was able to increased significantly (P < 0,05) goblet, mast, and eosinophil cells proliferation on duodenum, jejunum, and ileum. A. galli larvae recovered in intestinal of immunized laying hens were decreased significantly at two weeks post infection of 1000 L2 A. galli. This reseach concluded that the protease was able to trigger mucosal responses against parasitic diseases caused by A. galli.
© Hak Cipta milik IPB, tahun 2007 Hak Cipta dilindungi Undang-undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumber
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah
b. Pengutipan tidak merugikan kepentingan yang wajar IPB
PENGARUHNYA TERHADAP PERTAHANAN DAN GAMBARAN
HISTOPATOLOGI USUS HALUS AYAM PETELUR
UMMU BALQIS
Disertasi
sebagai salah satu syarat untuk memperoleh gelar Doktor pada
Program Studi Sains Veteriner
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Histopatologi Usus Halus Ayam Petelur
Nama Mahasiswa : UMMU BALQIS
Nomor Pokok : B063040051
Program Studi : SAINS VETERINER
Disetujui :
Komisi Pembimbing
Dr. drh. Risa Tiuria Priosoeryanto, MS. Ketua
Dr. drh. Bambang P. Priosoeryanto, MS Prof.Dr. Ir. Maggy Thenawijaya Suhartono Anggota Anggota
Diketahui
Ketua Program Studi Sains Veteriner Dekan Sekolah Pascasarjana
Dr. drh. Bambang P. Priosoeryanto,MS Prof. Dr.Ir. Khairil Anwar Notodiputro,MS
Tanggal Ujian: 17 September 2007 Tanggal Lulus:
melimpahkan rahmat dan hidayah-Nya sehingga penulis dapat menyelesaikan penulisan Disertasi yang berjudul: Purifikasi dan Karakterisasi Protease dari Ekskretori/Sekretori Stadium L3 Ascaridia galli dan Pengaruhnya Terhadap
Pertahanan dan Gambaran Histopatologi Usus Halus Ayam Petelur.
Ucapan terima kasih penulis sampaikan kepada Dr. drh. Risa Tiuria Priosoeryanto, MS sebagai ketua komisi pembimbing, Dr. drh. Bambang Pontjo Priosoeryanto, MS dan Prof. Dr. Ir. Maggy Thenawijaya Suhartono, masing-masing sebagai anggota komisi pembimbing yang telah memberikan bimbingan, arahan, dan dorongan sejak awal penulis mengikuti pendidikan. Penulis menyampaikan terima kasih kepada Dr. drh. Wiwin Winarsih, MSi. dan drh. Suhardono, MSc., Ph.D., APU. yang bertindak selaku Penguji Luar Komisi yang telah memberikan masukan dan koreksi untuk penyempurnaan karya ini.
Terima kasih dan penghargaan yang setinggi-tingginya disampaikan kepada Dekan Fakultas Kedokteran Hewan, dan Rektor Universitas Syiah Kuala yang telah memberi kesempatan kepada penulis untuk mengikuti pendidikan program Doktor pada program studi Sains Veteriner Institut Pertanian Bogor. Terima kasih juga disampaikan kepada Direktorat Jenderal Pendidikan Tinggi, Departemen Pendidikan Nasional Republik Indonesia, dan Pemerintah Daerah Nanggroe Aceh Darussalam yang telah memberikan bantuan beasiswa masing-masing melalui Beasiswa Pendidikan Program Pascasarjana (BPPS) dan Bantuan Beasiswa Nanggroe Aceh Darussalam (BB NAD). Penulis mengucapkan terima kasih kepada Kementrian Negara Riset dan Teknologi yang telah mendanai penelitian ini melalui Riset Unggulan Terpadu XII. Ucapan terima kasih dan penghargaan yang setinggi-tingginya penulis sampaikan kepada semua pihak yang telah turut serta membantu dalam penyelenggaraan pendidikan, persiapan, perencanaan, pelaksanaan, dan pengolahan data penelitian serta penulisan Disertasi ini.
Kepada ayahanda Alm. H. Razali Ahmad, ibunda Alm. Hj. Siti Hawa, ayahanda dan ibunda mertua Kamaruzzaman dan Fatimah, saudaraku dr. Muhammad Iqbal, Sp.A., Dr. drh. Muhammmad Hambal dan Muhammad Syaibal, S.Sos, serta kepada kakak dan adik ipar, penulis mengucapkan terima kasih atas segala doa, dukungan dan dorongan semangat yang telah diberikan. Kebanggaan penulis kepada suami tercinta, Dr. drh. Darmawi, MSi. yang senantiasa setia menanamkan kesabaran dan selalu dapat memberi opsi terbaiknya dalam menghadapi setiap masalah. Perhatian dan rasa tanggung jawab yang kakanda curahkan sangat berarti. Terima kasih kepada putra dan putri tersayang, Rahi Abdurrahman dan Rania Samira, yang telah memberikan kesejukan hati dan pengertian sehingga sangat memudahkan penulis menempuh studi.
Penulis menyadari bahwa karya ini masih banyak yang harus disempurnakan. Oleh karena itu, kritik dan saran yang dapat menyempurnakan tulisan ini kiranya dapat disampaikan kepada penulis, semoga Disertasi ini dapat memberikan sumbangan ilmu pengetahuan terutama dalam dunia kedokteran hewan.
Bogor, Agustus 2007 Wassalam,
Ummu Balqis
Penulis dilahirkan di Banda Aceh pada tanggal 13 januari 1970, sebagai anak
ketiga dari empat saudara dari pasangan ayahnda Alm. H. Razali Ahmad dan ibunda
Alm. Hj. Siti Hawa. Pendidikan sarjana dan profesi dokter hewan ditempuh pada
Fakultas Kedokteran Hewan Universitas Syiah Kuala (FKH-UNSYIAH), lulus tahun
1996. Sejak tahun 1998, penulis diangkat sebagai staf pengajar pada
FKH-UNSYIAH. Pada tahun 2001, penulis mendapat kesempatan mengikuti pendidikan
program Magister pada program studi Sains Veteriner Institut Pertanian Bogor, lulus
pada tahun 2003. Pada tahun 2004, penulis melanjutkan pendidikan program Doktor
pada program studi dan perguruan tinggi yang sama. Beasiswa pendidikan
pascasarjana diperoleh dari Direktorat Jenderal Pendidikan Tinggi, Departemen
Pendidikan Nasional Republik Indonesia melalui Beasiswa Pendidikan Program
Pascasarjana (BPPS) dan Bantuan Beasiswa Pemerintah Daerah Nanggroe Aceh
Darussalam (BB NAD).
Halaman
HALAMAN PENGESAHAN ……… i
PRAKATA ………. ii
RIWAYAT HIDUP ………... iii
DAFTAR ISI ... iv
DAFTAR TABEL ……….. vii
DAFTAR GAMBAR ... viii
DAFTAR LAMPIRAN ... ix
PENDAHULUAN ……… . 1
Latar Belakang ………. 1
Tujuan Penelitian ………. 4
Hipotesis ……… 4
Manfaat Penelitian ……… 4
TINJAUAN PUSTAKA ... 5
Cacing Ascaridia galli ... 5
Enzim Protease Pada Eksretori/Sekretori Cacing ... 6
Peranan Sel Goblet Pada Kekebalan Terhadap Cacing ... 9
Peranan Sel Mast Pada Kekebalan Terhadap Cacing ... 10
Peranan Sel Eosinofil Pada Kekebalan Terhadap Cacing ... 10
Struktur Usus Halus Unggas ... 11
DISAIN PENELITIAN ... 13
PURIFIKASI PROTEASE DARI EKSKRETORI/SEKRETORI STADIUM L3Ascaridia galli ... 14
Abstrak ... 14
Abstract ... 14
Pendahuluan ... 15
Metode Penelitian ... 16
Kesimpulan ... 27
KARAKTERISASI PROTEASE DARI EKSKRETORI/SEKRETORI STADIUM L3Ascaridia galli ... 28
Abstrak ... 28
Abstract ... 28
Pendahuluan ... 29
Metode Penelitian ... 30
Hasil Penelitian ... 34
Pembahasan ... 37
Kesimpulan ... 40
RESPONS PERTAHANAN MUKOSA USUS HALUS AYAM PETELUR YANG DIIMUNISASI DENGAN PROTEASE DAN DITANTANG DENGAN DOSIS L2Ascaridia galli... 41
Abstrak ... 41
Abstract ... 41
Pendahuluan ... 42
Metode Penelitian ... 43
Hasil Penelitian ... 45
Pembahasan ... 56
Kesimpulan ... 61
GAMBARAN HISTOPATOLOGI USUS HALUS AYAM PETELUR YANG DIIMUNISASI DENGAN PROTEASE DAN DITANTANG DENGAN DOSIS 1000 L2Ascaridia galli... 62
Abstrak ... 62
Abstract ... 62
Pendahuluan ... 63
Metode Penelitian ... 64
Kesimpulan ... 74
PEMBAHASAN UMUM ………...……… 75
KESIMPULAN UMUM ………. 85
SARAN ……….. 85
DAFTAR PUSTAKA ……….. 86
LAMPIRAN ……… 92
Nomor Halaman
1. Purifikasi protease dari ekskretori/sekretori L3A. galli dengan gel filtrasi 22
2. Purifikasi protease dari ekskretori/sekretori L3A. galli dengan anion exchange ... 24
3. Prosedur pengukuran aktivitas protease mengikuti metode Bergmeyer .... 31
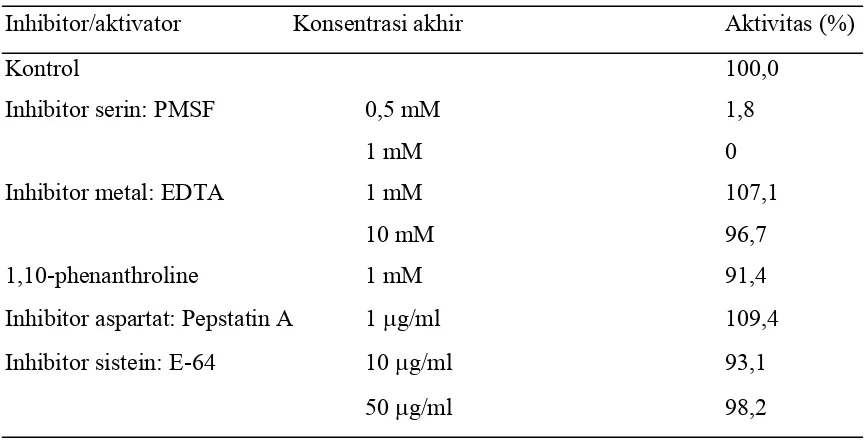
4. Pengaruh inhibitor atau aktivator terhadap aktivitas protease ... 36
5. Rata-rata jumlah sel goblet pada 1000 sel absorbtif usus halus ... 46
6. Rata-rata jumlah sel mast pada 10 VCU mukosa usus halus ... 47
7. Rata-rata jumlah sel eosinofil pada 10 lapang pandang ... 55
8. Rata-rata jumlah L3 yang ditemukan dalam usus halus dua minggu pascainfeksi ... 56
9. Rata-rata kerapatan villi per mm pada usus halus ayam petelur ... 70
10.Rata-rata luas permukaan villi (mm2) usus halus ... 71
11.Karakteristik protease dari parasit ... 70
Nomor Halaman
1. Aktivitas enzim crude ekskretori/sekretori stadium L3 A. galli pada
buffer dan pH yang berbeda ... 20
2. Optimasi aktivitas enzim crude ekskretori/sekretori stadium L3A. galli dengan pengendapan ammunium sulfat ... 21
3. Kromatogram gel filtrasi matriks sephadex G-100 ... 23
4. Kromatogram anion exchange matriks DEAE sephadex A-50 ... 23
5. Pengaruh temperatur terhadap aktivitas enzim crude ekskretori/sekretori stadium L3A. galli ... 34
6. Pengaruh pH terhadap aktivitas enzim ... 35
7. Visualisasi pita-pita protein ... 36
8. Rata-rata jumlah sel goblet pada 1000 sel absorbtif usus halus ... 46
9. Rata-rata jumlah sel mast pada 10 VCU mukosa usus halus ... 48
10.Proliferasi sel goblet duodenum ... 49
11.Proliferasi sel mast duodenum ... 52
12.Gambaran histopatologi duodenum masing-masing kelompok ayam percobaan ... 67
13.Rata-rata kerapatan villi per mm pada usus halus ayam petelur ... 70
14.Rata-rata luas permukaan villi (mm2) usus halus ... 71
Nomor Halaman
1. Larutan yang digunakan pada medium RPMI 1640 ... 92
2. Pembuatan Reagen SDS PAGE …..………. 93
3. Pembuatan Reagen Pewarnaan PAS dan HE ... 95
4. Prosedur Pewarnaan Khusus (Periodic Acid Schiff) ... 96
5. Prosedur Pewarnaan Hematoxylin Eosin ... 97
6. Pembuatan Reagen Pewarnaan Sel Mast ... 98
7. Prosedur Pewarnaan Sel Mast ... 99
PENDAHULUAN
Latar Belakang
Masalah kecacingan yang disebabkan oleh Ascaridia galli pada ayam petelur
masih saja terjadi, akibatnya dapat menimbulkan kerugian ekonomi yang sangat
berarti. Meskipun jarang menimbulkan kematian, namun ayam petelur mengalami
penurunan produksi yang sangat signifikan karena sifat penyakit yang berjalan kronis
(Kanwar et al. 1998). Cacing yang survive di dalam saluran cerna menjadi pengganggu
pertumbuhan sehingga dapat menurunkan 30% bobot badan dan penurunan produksi
telur yang mencapai 63% (Tiuria et al. 2001). Infeksi A. galli dapat menimbulkan lesio
patologis seperti deskuamasi, hiperemi dan hemoragi (Balqis 2004), dan juga ulserasi
intestinal yang kadang-kadang berakhir dengan kematian (Taiwo et al. 2002).
Sampai saat ini metode pengendalian ascaridiosis masih mengandalkan pada
pemberian anthelmintika. Senyawa ini hanya berfungsi mengeluarkan cacing dewasa
dari dalam lumen saluran cerna, sedangkan larva yang hidup dalam fase jaringan tidak
terjangkau. Keburukan lainnya akibat pemberian anthelmintika secara terus-menerus
dalam jangka waktu yang lama dapat menimbulkan resistensi cacing terhadap
anthelmintika. Oleh sebab itu harus dicari metode alternatif pengganti anthelmintika.
Untuk mendapatkan metode pengendalian alternatif yang tepat dan akurat,
haruslah dipahami mekanisme interaksi parasit dan inang definitif. Interaksi cacing
dengan inang definitif ditentukan oleh faktor invasif berupa suatu substansi bioaktif
yang dieksresi/sekresikan oleh cacing selama bersarang di dalam tubuh inang definitif.
Ekskretori/sekretori cacing nematoda mengandung protease yang berperan sebagai
pemecah barier pertahanan selaput lendir (mukosa) saluran cerna dan bersifat antigenik
(Rhoads et al. 1997; Harnett et al. 1997; dan Vervelde et al. 2003). Untuk menjalani fase
jaringan, stadium L3 A. galli melepaskan protease ekstraselular yang dapat memecah
jaringan inang definitif sehingga cacing bertahan (survive) mencapai dewasa.
Ekskretori/sekretori A. galli dewasa yang dihasilkan melalui metabolisme cacing dapat
ditanggapi oleh inang definitif sebagai antigen yang dapat memicu terjadinya
Penelitian ini dirancang untuk purifikasi dan karakterisasi protease yang akan
diaplikasikan sebagai antigen pemicu respons pertahanan selaput lendir mukosa saluran
cerna ayam petelur. Pemanfaatan protease yang dilepaskan larva A. galli sebagai antigen
untuk merangsang respons imunitas inang definitif sangat prospektif diterapkan. Seperti
laporan peneliti terdahulu telah membuktikan bahwa ekskretori/sekretori yang
dilepaskan cacing nematoda seperti Ostertagia circumcincta dan Onchocerca gipsoni
pada sapi (Harnett et al., 1997), Ascaris suum pada babi (Rhoads et al., 2001),
Haemonchus contortus pada domba (Vervelde et al., 2003) mengandung protease yang
berperan sebagai molekul biologik aktif pemicu respons imunitas inang definitif.
Penelitian yang menunjukkan prospek pengendalian helminthosis secara
imunoprofilaksis telah banyak dikembangkan. Tiuria et al. (2000) melaporkan bahwa
respons imunitas dapat dipicu oleh pemberian larva infektif. Aplikasi 380 μg protein ekskretori/sekretori A. galli dewasa dapat merangsang proliferasi sel mast mukosa
(Darmawi 2003) dan proliferasi sel goblet (Balqis 2004) sehingga mengurangi ancaman
infeksi A. galli pada ayam petelur. Cacing A. galli memiliki antigen somatis, antigen
permukaan dan antigen ekskretori/sekretori (Tiuria et al. 2003). Antigen
ekskretori/sekretori terbukti mengandung konsentrasi protein yang lebih tinggi
dibandingkan antigen lainnya (Darmawi 2003 dan Balqis 2004a). Visualisasi pita protein antigen ekskretori/sekretori stadium L2 dan stadium dewasa A. galli pada uji Sodium Dodecyl Sulphate Polyacrylamide Gel Electrophoresis (SDS-PAGE) menunjukkan berat
molekul masing-masing protein adalah 35 dan 40 – 66 kDa (Tiuria et al. 2003). Namun,
hingga saat ini belum pernah dilakukan purifikasi dan karakterisasi protease yang
dilepaskan oleh stadium L3 A. galli, dan belum juga diketahui potensinya sebagai
pemicu respons pertahanan mukosa intestinum terhadap ascaridiosis.
Protease dipilih menjadi fokus penelitian karena senyawa aktif tersebut berperan
sebagai faktor invasif yang memudahkan invasi larva ke jaringan. Protease juga
berpotensi sebagai pemicu respons imunitas karena dianggap sebagai benda asing oleh
inang definitif. Dengan demikian, protease memfasilitasi interaksi antara cacing A. galli
sebagai parasit dengan ayam petelur sebagai inang definitif dan bersifat antigenik yang
strategi pengendalian ascaridiosis dengan cara memutus rantai siklus hidup cacing pada
stadium transisi L3 dapat dilakukan, maka larva gagal bertahan di jaringan, sehingga
larva A. galli dapat dikeluarkan secara cepat (worm expulsion).
Respons imunitas selaput lendir saluran cerna inang definitif terhadap infeksi
cacing nematoda dapat dibangkitkan oleh antigen cacing tersebut (Tizard 1995).
Vervelde et al. (2003) melaporkan bahwa antigen ekskretori/sekretori dapat memicu
peningkatan respons sel T helper 2 (Th-2). Roitt dan Delves (2001) menyatakan bahwa
reaksi sel Th-2 dapat menggertak pelepasan sitokin terutama interleukin (IL-3, IL-4 dan
IL-5). Menurut Tizard (1995) IL-3 merangsang sel mast berdegranulasi untuk
melepaskan mediator peradangan, senyawa vasoaktif dan kemoatraktan yang berfungsi
untuk merekrut sel eosinofil. IL-5 merangsang aktivasi sel eosinofil untuk melepaskan
mediator kimia seperti enzim hidrolitik dan zat sitotoksik. Aktivasi sitokin yang
dilepaskan oleh sel Th-2 merangsang proliferasi, hiperplasia, dan pelepasan mukus yang
bersifat viscoelastic gel oleh sel goblet. Mukus melindungi permukaan usus halus dari
ancaman invasi, dan membatasi gerakan cacing dengan cara menutupi kutikulanya.
Mekanisme pengeluaran cacing dari dalam tubuh dijelaskan oleh Roitt dan
Delves (2001) bahwa kutikula cacing nematoda Nipprostrongylus brasiliensis dirusak
oleh antibodi yang disekresikan ke dalam lumen intestinal tikus. Tizard (1995)
menyatakan bahwa untuk melawan infeksi cacing nematoda Toxocara canis, antibodi
spesifik menutupi oral dan saluran anal (secretory pores) cacing nematoda tersebut.
Cacing dijerat melalui fragment antibodi (Fab), sedangkan fragment constant (Fc)
antibodi tertanam ke dalam reseptor FcєRI yang terdapat pada permukaan sel mast mukosa dan sel eosinofil. Transduksi sinyal dari rantai γ pada reseptor FcєRI menyebabkan degranulasi sel mast mukosa untuk melepaskan senyawa faktor
kemotaktik, faktor vasoaktif, histamin dan serotinin. Histamin memicu kontraksi otot
pada usus halus, dan serotonin menyebabkan vasokontriksi sehingga meningkatkan
tekanan darah. Kontraksi usus halus dan sel eosinofil melepaskan major basic protein
Tujuan Penelitian
1. Untuk mendapatkan protease murni yang dipurifikasi dari ekskretori/sekretori
stadium L3 Ascaridia galli asal Bogor.
2. Untuk mengetahui karakter protease yang dilepaskan melalui ekskretori/sekretori
stadium L3 A. galli.
3. Untuk mengetahui potensi protease sebagai pemicu respons kekebalan mukosa
berdasarkan proliferasi sel goblet, sel mast mukosa serta migrasi sel eosinofil ke
jaringan mukosa usus halus ayam petelur.
4. Untuk mengetahui pengaruh pemberian protease dan infeksi A. galli terhadap
perubahan patologi usus halus ayam petelur.
Hipotesis
1. Diduga bahwa ekskretori/sekretori stadium L3A. galli mengandung protease. 2. Diduga bahwa ekskretori/sekretori stadium L3 A. galli memiliki karakter
protease.
3. Diduga bahwa protease dari ekskretori/sekretori stadium L3 A. galli berpotensi sebagai pemicu respons kekebalan mukosa berdasarkan hiperplasia dan
proliferasi sel goblet, sel mast mukosa serta migrasi sel eosinofil ke jaringan
mukosa usus halus ayam petelur.
4. Diduga bahwa pemberian protease dapat berpengaruh terhadap perubahan
patologi usus halus ayam petelur yang diinfeksi dengan A. galli.
Manfaat Penelitian
Manfaat Akademik
1. Untuk menambah informasi bahwa protease serin bersifat imunogenik.
2. Untuk melengkapi data mengenai sumber protease serin yang sudah diketahui
pada spesies lain.
Manfaat Operasional
Protease serin diharapkan dapat diaplikasikan sebagai salah satu alternatif untuk
TINJAUAN PUSTAKA
Cacing Ascaridia galli
Menurut Soulsby (1982) cacing Ascaridia galli mempunyai sinonim
Ascaridia lineata dan Ascaridia perspiculum yang diklasifikasikan ke dalam kelas
Nematoda, sub kelas Secernentea, ordo Ascaridia, superfamili Ascaridiodea, famili
Ascarididae, dan genus Ascaridia. Cacing A. galli merupakan cacing terbesar dalam
kelas nematoda pada unggas. Tampilan cacing dewasa adalah semitransparan,
berukuran besar, dan berwarna putih kekuning-kuningan. A. galli memiliki kutikula
ekstraseluler yang tebal untuk melindungi membran plasma hipodermal nematoda
cacing dewasa (Bankov dan Barrett 1993). Pada bagian anterior terdapat sebuah
mulut yang dilengkapi dengan tiga buah bibir, satu bibir terdapat pada dorsal dan dua
lainnya pada lateroventral. Pada kedua sisi terdapat sayap yang sempit dan
membentang sepanjang tubuh (Calneck 1997). Permin dan Hansen (1998)
mengatakan bahwa cacing jantan dewasa berukuran panjang 51 – 76 mm dan cacing
betina dewasa 72 – 116 mm. Cacing jantan memiliki preanal sucker dan dua spicula
berukuran panjang 1 – 2,4 mm, sedangkan cacing betina memiliki vulva
dipertengahan tubuh. Telur A. galli berbentuk oval, berkerabang lembut, dan
berukuran 73–92 x 45–57μm.
Siklus hidup A. galli bersifat langsung yaitu pematangan seksual berlangsung
di dalam traktus gastrointestinal inang definitif dan stadium infektif (L2) berlangsung
di dalam telur resisten berembrio di lingkungan bebas. Telur dikeluarkan bersama
feses inang definitif dan akan mencapai stadium infektif dalam waktu 10 – 20 hari
atau tergantung kepada temperatur serta kelembaban lingkungan (Permin dan Hansen
1998). Daur hidup disempurnakan ketika L2 tertelan oleh inang definitif melalui
makanan atau air terkontaminasi. Telur mengandung larva L2 secara mekanik
terbawa ke duodenum atau jejunum hingga menetas setelah 24 jam kemudian.
Selama penetasan gelungan larva muncul dari ujung anterior telur melewati celah
terbuka keluar ke dalam lumen intestinal untuk menjadi L3. Menurut Permin dan
Hansen (1998) larva L3 A. galli melanjutkan fase histotropik dengan cara
menanamkan dirinya pada lapisan mukosa duodenum (fase jaringan). Durasi fase
kali molting, L5 (cacing muda) akan tumbuh dan mencapai dewasa di dalam lumen
duodenum (fase lumen). Periode prepaten cacing A. galli berlangsung dalam waktu 5
– 8 minggu (Soulsby 1982), dan 11 – 15 minggu (Athaillah 1999).
Permin et al. (1998) juga mengatakan bahwa sifat penyakit parasitik cacing
A. galli biasanya berjalan kronis sehingga menimbulkan gejala sakit yang perlahan
atau subklinis. Kecacingan tidak menyebabkan mortalitas tetapi menghasilkan
morbiditas. Infeksi A. galli pada ayam normal umumnya singkat dan jarang
menyebabkan kerusakan permanen (Permin et al. 1998), karena tubuh ayam
memiliki suatu sistem kekebalan yang dapat melindungi tubuhnya dari unsur-unsur
patogen (Tizard 1996). Namun, Taiwo et al. (2002) melaporkan bahwa Ascaridiosis
yang telah berlangsung dalam waktu yang lama (infeksi kronis) dapat menyebabkan
gastroenteritis ulseratif, hepatitis nekrotik dan nepritis yang dapat berakhir dengan
kematian.
Enzim Protease Pada Eksretori/Sekretori Cacing
Protease adalah enzim yang menghidrolisis ikatan peptida pada protein.
Untuk melakukan aktivitasnya, protease membutuhkan air sehingga dikelompokkan
ke dalam kelas hidrolase. Protease berperan dalam sejumlah reaksi biokimia seluler.
Selain diperlukan untuk degradasi senyawa protein nutrien, protease terlibat dalam
sejumlah mekanisme patogenisitas, sejumlah proses pasca translasi protein, dan
mekanisme ekspresi protein ekstraseluler (Rao et al. 1998).
Pelepasan protease oleh cacing nematode parasitik mempunyai peranan
penting pada proses reaksi biologik seperti metabolisme protein, hatching, molting,
patogenesis, dan respons imun. Aktivitas protease mempunyai korelasi yang
signifikan pada saat cacing parasitik menjalani penetrasi ke jaringan diantaranya
Ascaris suum pada babi (Rhoads et al. 1997), Ostertagia ostertagi pada sapi (Cock et
al. 1993), Ostertagia circumcincta, Haemonchus contortus, Trichostrongylus spp.
pada ruminansia (Knox dan Jones 1990), Onchocerca gibsoni pada sapi (Harnett et
al. 1997), Trichinella spiralis pada mamalia dan manusia (Todorova 2000), dan
Anisakis simplex pada ikan (Iglesias et al. 2005), Onchocerca volvulus pada manusia
Hasil identifikasi Rhoads et al. (1997) membuktikan bahwa A. suum
mensekresikan aminopeptidase. Aktivitas protease diidentifikasikan di dalam cairan
kultur yang dikoleksi selama perkembangan larva stadium transisi L3 –L4. Substrat
peptida flurogenik yang tidak menghambat N-terminal secara spesifik dihidrolisa
yang mengidentifikasi aktifitas aminopeptidase. Cairan kultur tidak menghidrolisa
substrat peptida fluorogenik yang dihambat N-terminal (endopeptidase substrat).
Aktifitas aminopeptidase dihambat oleh 1,10-phenanthrolin (metalloprotease
inhibitor), amastatin, dan bestatin (aminopeptidase inhibitor). Berat molekul
aminopeptidase 293 kDa diestimasi dengan densitas gradient sentrifugasi.
Aminopeptidase tersebut menunjukkan keasaman dengan titik isoelektrik pada 4,7.
Pelepasan aminopeptidase dianggap esensial sebagai perantara proses perkembangan
dan survival parasit, seperti penetasan telur, molting, excystment, dan merupakan
interaksi yang kritis antara inang dan parasit sebagai pemecah jaringan inang untuk
menfasilitasi invasi, migrasi, dan modulasi mekanisme imun inang. Produk yang
dilepaskan selama perkembangan larva stadium transisi L3–L4 A. suum berpotensi
digunakan dalam strategi pengendalian imunoprofilaksis infeksi cacing parasitik.
Beberapa enzim yang bercirikan proteinase berukuran 25 – 55 kDa
diidentifikasi pada larva Trichinella spiralis melalui substrat gel elektroforesis dan
dikarakterisasi berdasarkan pH optimum, spesifisitas substrat, dan sensitivitas
inhibitor dengan menggunakan uji azocasein. Aktivitas serine, sisteine, dan
metalloproteinase diidentifikasi pada pH 5 – 7. Proteinase serine yang dilepaskan
pada stadium larva T. spiralis diketahui menghasilkan respons antibodi lebih
menonjol. Aktivitas proteinase dihambat oleh IgG yang diisolasi dari mencit yang
diinfeksi dengan T. spiralis. Aktivitas azolitik dan elastolitik kemungkinan sebagai
implikasi penetrasi ke jaringan. Interaksi host-parasit yang dikaji oleh Todorova
(2000) tersebut menerangkan relevansi pengembangan vaksin anti trichinellosis.
Nagano et al. (2004) membuktikan bahwa protease sistein yang diekspresikan
oleh Clonorchis sinensis dapat diaplikasikan sebagai perangkat diagnostik pada uji
enzyme linked immunosorbant assay (ELISA) untuk imunodiagnosis terhadap
clonorchiasis. Aplikasi protease sistein yang dihasilkan oleh Haemonchus contortus
dapat memberikan imunoproteksi terhadap haemonchosis pada kambing (Ruiz et al.
cathepsin-L protease sistein dari ekskretori/sekretori Fasciola gigantica dapat
digunakan sebagai antigen dalam uji ELISA untuk mendeteksi fasciolosis selama
empat minggu pascainfeksi pada kerbau dan domba.
Menurut komisi tatanama Internasional Union of Biochemist and Molecular
Biologist, protease termasuk kedalam kelompok III sub kelompok IV, yaitu golongan
hidrolase pemecah substrat protein (Thenawijaya 1989). Protease dapat
dikelompokkan berdasarkan jenis reaksi yang dikatalisis, sifat kimiawi sisi aktif
enzim dan hubungan evolusi struktur enzim. Protease dibagi atas 2 golongan besar,
yaitu peptidase dan proteinase. Golongan peptidase terdiri atas aminopeptidase,
karboksipeptidase dan omega peptidase, sedangkan golongan proteinase berdasarkan
kerjanya terdiri atas protease serin, protease sistein atau sulfhidril, protease metal dan
protease asam (Suhartono 2000).
Protease serin adalah enzim yang mempunyai residu serin pada lokasi
aktifnya. Enzim ini bersifat endopeptidase misalnya tripsin, kimotripsin, elstase, dan
subtilisin. Aktivitas protease golongan ini dihambat dengan kuat oleh
disoprofilfluorophosphate (DFP) karena adanya reaksi DFP dengan gugus hidroksil
dari residu serin pada sisi aktif (Armas-Serra et al. 1993). Nagano et al. (2004)
menyatakan bahwa protease sistein disebut juga sulfhidril atau protease tiol yaitu
enzim yang aktivitasnya tergantung pada adanya satu atau lebih residu sulfhidril pada
sisi aktifnya. Aktivitas enzim ini menurut Ruiz et al. (2004) dapat dihambat oleh
adanya senyawa oksidator, alkilator, dan ion-ion logam berat yang akan mengikat
grup tiolnya. Protease yang termasuk golongan ini adalah papain, fisin, dan bromelin.
Menurut Armas-Serra et al. (1993) protease metal adalah protease yang
aktivitasnya tergantung pada adanya ion logam. Biasanya terdapat hubungan
stoikiometri yaitu satu mol logam per mol enzim. Logam-logam yang dapat
mengaktifkan enzim-enzim golongan ini adalah Mg, Zn, Co, Mg, Cd, dan Cu.
Aktivitas protease golongan ini dihambat oleh sianida dan logam berbahaya serta
senyawa EDTA karena senyawa ini dapat mengkelat logam sehingga aktivitasnya
akan berkurang. Protease yang termasuk ke dalam golongan ini adalah karboksi
peptidase A dan beberapa amino peptidase. Protease asam adalah enzim yang
aktivitasnya disebabkan oleh adanya dua gugus karboksil pada sisi aktifnya.
Protease yang termasuk golongan ini adalah pepsin, renin, dan protease yang aktif
pada pH rendah antara 2 sampai 4.
Peranan Sel Goblet Pada Kekebalan Terhadap Cacing
Sel goblet adalah sel yang berbentuk seperti piala yang terletak diantara sel
absobtif pada saluran cerna. Sel goblet menghasilkan lendir intestinal yang berfungsi
sebagai media pertahanan yang penting terhadap infeksi cacing. Menurut McKeand
et al. (1995) sel goblet mensintesis granula-granula yang bersifat netral yang
mengandung musin glikoprotein dan asam sialat. Mukus yang dihasilkan bersifat
protektif terhadap pengeluaran atau penjeratan cacing, menghalangi kontak langsung
dengan mukosa sehingga mencegah establishment bagi cacing. Lendir juga berfungsi
sebagai pelindung bagi epitel dari aktifitas enzim yang dihasilkan oleh bakteri
patogen serta terlibat dalam mekanisme self cure terhadap cacing nematoda
(Takeyama et al.1998).
Tizard (1996) mengatakan bahwa sel goblet berasal dari stem sel yang
terdapat pada dasar kripta, berdiferensiasi dan bermigrasi dari dasar kripta ke bagian
atas villi yaitu lamina propria selanjutnya disalurkan ke dalam lumen. Daya hidup sel
ini berlangsung 2-3 hari, tetapi secara konstan terus-menerus digantikan dengan sel
yang baru. Adanya cacing parasitik menyebabkan proses stimulasi sistem kekebalan
dan merangsang respon kekebalan humoral dan selular. Respon ini ditunjukkan pada
proliferasi sel goblet pada permukaan tubuh (Tiuria et al. 2000).
Nematoda parasitik yang berhabitat dalam saluran cerna inang definitif
menyebabkan proliferasi sel goblet. Aktivitas sel goblet dipicu oleh beberapa reaksi;
didahului oleh adanya antigen nematoda yang mengaktifkan limfosit B dan limfosit
T. IgE yang dihasilkan oleh limfosit B akan merangsang respon inflamasi dan juga
memicu IgG untuk merusak metabolit cacing. Limfosit T yang aktif beserta
sitokinnya akan merangsang sel goblet mensekresikan mukus (Roitt dan Delves
2001). Peran sel goblet dalam mekanisme pengeluaran cacing saluran pencernaan
sering dihubungkan dengan aktivitas sel mast mukosa (Athailah 1999; Tiuria et al.
Peranan Sel Mast Pada Kekebalan Terhadap Cacing
Sel mast berasal dari stem sel hemopoitik yang ditemukan pada semua hewan
vertebrata. Berdasarkan sifat histokimianya sel mast dibagi menjadi 2 sub tipe, yaitu
tipe mukosa (mucosal mast cells = MMC) dan tipe jaringan (connectif tissue mast
cells/CTMC (Tizard 1996). Sel mast mempunyai inti yang berlobus tunggal,
memiliki granula yang berisi mediator-mediator peradangan. Khusus bagi MMC,
banyak ditemukan pada selaput lendir pernafasan dan saluran pencernaan dengan
distribusi yang bervariasi di setiap organ dan spesies (Kresno 2001).
Sel mast berperan penting dalam mekanisme peradangan dan induksi
reaksi-reaksi peradangan akut. Mediator peradangan yang dihasilkan sel mast seperti
glikosaminoglikan, monoamin dan basik protein (Woodbury et al. 1982), enzim
protease, histamin dan prostaglandin (Bendixsen et al. 1995) dilaporkan dapat
menghambat migrasi larva nematoda (Douch et al. 1996). Mediator-mediator
tersebut juga diketahui dapat menyebabkan larva infektif gagal menempel atau
masuk ke dalam mukosa, sehingga larva-larva tersebut beberapa jam kemudian
dikeluarkan dari saluran pencernaan.
Menurut Else dan Finkelman (1998) antibodi dapat mencegah perlekatan
larva pada mukosa usus halus, dan bersama mukus menjerat larva untuk dikeluarkan
bersama tinja. Tizard (1996) menyatakan bahwa IL-5 yang dilepaskan oleh Th-2
karena rangsangan antigen cacing dapat menggertak eosinophoesis, mobilisasi sel
eosinofil, dan degranulasi sel eosinofil untuk melepaskan substansi helmintoksik
seperti enzim proteolitik, peroksidase, dan major basic protein.
Peranan Sel Eosinofil Pada Kekebalan Terhadap Cacing
Secara normal sel eosinofil berada di dalam buluh darah yang intact. Pada
infeksi cacing, sel eosinofil bergerak menuju situs infeksi untuk membunuh cacing
parasitik. Sel eosinofil termasuk ke dalam famili sel-sel leukosit yang meliputi sel
neutrofil, sel mast, dan sel basofil yang melawan invasi dengan mengembangkan
inflamasi akut (Tizard 1996). Sel eosinofil menyelenggarakan fungsi ini dengan
bermigrasi ke situs invasi parasit dan melepaskan enzim-enzim penghancur atau
perusak parasit. Aktivitas tersebut menyebabkan kerusakan jaringan dan inflamasi
komponen karakteristik dari reaksi hipersensitifitas tipe I. Tizard (1996) menyatakan
bahwa sel eosinofil diproduksi dalam sumsum tulang dibawah pengaruh IL-3 dan
IL-5 yang dihasilkan oleh Th-2 dan sel mast. Th-2 menanggapi mobilisasi sel
eosinofil dan dalam waktu yang bersamaan mereka merangsang tanggap kebal Ig E.
Sel eosinofil secara spesifik ditarik ke situs degranulasi sel mast oleh faktor
kemotaktik eosinofil, leukotrin B4, histamin, platelet activating faktor (PAF),
ekstrak cacing, komplemen (C5a) dan produk asam imidiazole asetat pecahan
histamin. Sel eosinofil dapat juga diaktivasi oleh histamin dan leukotrin B4.
Selama ini sel eosinofil yang merupakan salah satu sel fagosit diduga sebagai
sel efektor yang paling efektif dalam membunuh larva cacing. Menurut Tizard
(2000) mekanisme respons imun yang mendasari pembunuhan ini adalah sebagai
berikut, sel eosinofil melalui reseptor Fc berikatan pada komplek antibodi yang
bertindak sebagai opsonin melekat pada permukaan sel sasaran yang terinfeksi.
Pengikatan antibodi pada reseptor Fc merangsang fagosit untuk memproduksi lebih
banyak leukotrien dan prostaglandin, yang merupakan molekul-molekul yang
berperan pada respons inflamasi. Sel efektor yang telah terikat kuat pada membran
sel sasaran menjadi teraktivasi dan akhirnya dapat menghancurkan sel sasaran.
Sebagian besar kuman patogen difagositosis dan dibunuh intralisosom, ditambah
kemampuan eosinofil untuk memproduksi ROI (reactive oxygen intermediates)
misalnya superoksida. Dari uraian ini jelas bahwa reseptor Fc berfungsi sebagai
jembatan antara sel efektor dengan sel sasaran.
Struktur Usus Halus Unggas
Saluran cerna merupakan alat penghubung antara lingkungan internal dan
eksternal dengan fungsi utamanya sebagai absorbsi zat-zat makanan. Menurut
Yamauchi dan Isshiki (1991) dan Ferrer et al. (1995) karakteristik morfologi saluran
cerna terutama usus halus pada ayam, menentukan fungsi usus pada pertumbuhan
ayam. Morfologi mukosa usus halus terdiri dari villi yang berfungsi memperluas area
penyerapan zat nutrien. Pada permukaan villi terdapat mikrovilli sebagai penjuluran
sitoplasma yang dapat meningkatkan efisiensi penyerapan. Semakin luas permukaan
Usus halus unggas terdiri dari duodenum, jejunum dan ilium. Dinding usus
halus terdiri atas 4 bagian dasar yaitu: mukosa, sub mukosa, muskularis mukosa dan
serosa (Cotran et al. 1999). Lapisan mukosa diselaputi oleh villi yang panjangnya
0,5-1,5 mm, dan menyebabkan gambaran mukosa menyerupai beludru. Pada
permukaan luar setiap villi terdapat tonjolan berupa jari-jari yang panjangnya 1μm
yang disebut mikrovilli. Pada bagian tengah villi terdapat lamina propria yang terdiri
dari pembuluh darah, pembuluh limfatik, kumpulan sel-sel limfatik, kumpulan sel-sel
limfosit, sel eosinofil, sel mast dan sel fibroblas (Price dan Wilson 1995). Permukaan
villi terdiri atas 3 jenis sel: yaitu sel-sel absorbtif, sel goblet dan sel paneth. Sel
absorbtif adalah epitel kolumnar yang berfungsi mengabsorbsi makanan. Diantara
sel-sel absorbtif terdapat sel goblet yang menghasilkan mukus yang berperan dalam
pertahanan mukosa dengan cara menjerat parasit. Sel ketiga yang terdapat pada villi
adalah sel paneth yang langsung menyentuh sel eosinofil yang berisikan granula anti
cacing, yang juga berperan pada pertahanan selaput lendir (Cotran et al. 1999)
Jaringan mukosa mengandung jaringan limfoid yang termasuk dalam Mucosa
associated lymphoid tisue (MALT). Jaringan limfoid pada mukosa usus termasuk
kedalam Gut-associated lymphoid tissue (GALT). GALT terdiri atas 2 jenis
kumpulan limfoid di sepanjang usus. Jenis pertama dinamakan daun Peyer (Peyer
patches), terutama terdapat pada dinding ilium, sedangkan yang kedua merupakan
kumpulan limfoid yang terpisah, kebanyakan terdapat di usus besar. Struktur
jaringan limfoid terdiri atas folikel yang pusatnya merupakan daerah limfosit B,
sedangkan limfosit T umumnya terdapat di sekitarnya (Subowo 1993).
Di sekeliling villi terdapat sumur kecil yang meluas ke daerah muskularis
mukosa dan dinamakan kripta Liberkuhn. Kripta ini merupakan kelenjar-kelenjar
usus yang menghasilkan sekreta dan mengandung enzim-enzim pencernaan (Price
dan Wilson 1995). Dalam keadaan normal perbandingan antara vili dan kripta
berkisar 4-5:1. Sel-sel yang tidak berdeferensiasi di dalam kripta, berproliferasi
cepat, bermigrasi ke ujung villi, dan menjadi sel-sel absorptif. Pematangan dan
migrasi sel dari kripta ke ujung villi hanya membutuhkan 5-7 hari. Laju pergantian
sel yang tinggi membuat epitel usus rentan terhadap perubahan dalam proliferasi sel
sehingga mengakibatkan atrofi mukosa serta pemendekan kripta dan villi (Cotran et
DISAIN PENELITIAN
... ...
... ...
Purifikasi Protease dari Ekskretori/Sekretori Stadium L3Ascaridia galli
Karakterisasi Protease dari Ekskretori/Sekretori Stadium L3Ascaridia galli
Uji Tantang
Ascaridia galli Betina Dewasa
Kultivasi in vitro (L1)
Kultivasi in vivo (L2 – L3)
Kultivasi in vitro (L3)
Ekskretori/Sekretori (crude) Stadium L3A. galli
Ekskretori/Sekretori (pure)
Respons Pertahanan Mukosa Usus Halus Ayam Petelur Yang Diimunisasi Dengan Protease dan Ditantang
Dengan Dosis 1000 L2Ascaridia galli
PURIFIKASI PROTEASE DARI EKSKRETORI/SEKRETORI
STADIUM L3Ascaridia galli
ABSTRAK
Enzim proteolitik yang disekresikan oleh parasit memainkan peran pada proses penetrasi dan migrasi jaringan inang. Penelitian ini bertujuan untuk memurnikan protease yang dilepaskan melalui ekskretori/sekretori stadium L3 A. galli. L3 diperoleh dari usus halus 100 ekor ayam petelur HySex Brown tujuh hari setelah pemberian dosis 6000 L2 melalui oesofagus ayam. Sebanyak 5 – 10 ekor L3 dikultur secara in vitro dalam setiap ml medium Rosswell Park Memorial Institute (RPMI 1640), pH 6,8, tanpa merah fenol dalam inkubator pada temperatur 37oC dan 5% CO2 selama 3 hari. Ekskretori/sekretori dipreparasi dari produk metabolisme L3 yang dilepaskan ke dalam medium kultur. Protease dimurnikan dengan kromatografi filtrasi gel matriks sephadex G-100 dan anion exchange matriks DEAE sephadex A-50. Aktivitas protease diuji terhadap kasein. Konsentrasi protein dihitung mengikuti metode Bradford. Hasil penelitian menunjukkan bahwa aktivitas enzim pada fraksi 31 kromatogram filtrasi gel lebih tinggi dibandingkan dengan anion exchange. Protease yang disekresikan oleh stadium L3A. galli dapat dimurnikan berdasarkan berat molekulnya.
Kata kunci:Ascaridia galli, nematoda, ekskretori/sekretori, protease, kromatografi
ABSTRACT
Proteolytic enzymes secreted by parasites are thought to play a key role in the processes of penetration and migration trough the host tissue. The research was carried out to purify protease from exretory/secretory of A. galli L3 stage. A. galli L3 were recovered from intestines of 100 HySex Brown heads chickens 7 days after oesophagus inoculation with 6000 L2. L3 recovered in this manner were cultured (5 – 10 ml-1) in flasks containing rosswell park memorial institute (RPMI) 1640 media, pH 6.8, without phenol red. Cultures were incubated at 370C in 5% CO2 and culture fluid was collected after 3 days in culture. Excretory/secretory was prepared from metabolic product of L3 released in culture medium. Protease purified using anion exchange matrix DEAE sephadex A-50 and gel filtration matrix sephadex G-100 chromatography. The protease activity was assayed against casein. Protein concentration were counted as described in Bradford method. The result showed that enzyme activity on chromatography gel filtration more highly compared with anion exchange. These result indicate that the protease secreted by A. galli L3 stage could purify based on molecular weight.
PENDAHULUAN
Protease yang dilepaskan melalui ekskretori/sekretori dari berbagai stadium
kehidupan cacing parasitik telah menarik perhatian para ilmuwan karena peranannya
yang penting dalam reaksi biologi, termasuk metabolisme protein, reaksi imun, nutrisi
parasit, penetrasi ke jaringan inang, dan patogenesis helmintosis. Telah dibuktikan
bahwa peningkatan konsentrasi protease yang dilepaskan cacing parasitik pada peristiwa
invasi ke jaringan inang definitif (Cock et al. 1993; Hadas dan Stankiewicz 1997;
Todorova 2000; dan Iglesias et al. 2005).
Ascaridia galli adalah cacing parasitik nematoda yang dapat menginfeksi
berbagai jenis unggas, termasuk ayam petelur. Siklus hidup A. galli secara lengkap telah
dijelaskan oleh Permin dan Hansen (1998), dimana telur yang dihasilkan oleh A. galli
dewasa di dalam lumen inang definitif akan mengalami maturasi di lingkungan
manakala dikeluarkan bersama tinja. Siklus hidup sebagai parasit dimulai ketika inang
definitif menelan telur infektif (L2) sampai menjadi dewasa dan bereproduksi menghasilkan telur. Sebelum menjadi dewasa, A. galli mengalami dua fase kehidupan di
dalam tubuh inang definitif, yaitu fase lumen dan fase jaringan. Mekanisme invasi ke
jaringan oleh L3 A. galli untuk menjalani fase histotrofik belum banyak diketahui. Diduga bahwa L3 melepaskan protease ekstraseluler untuk menembus pertahanan mukosa saluran cerna inang definitif sehingga larva dapat establish di dalam jaringan.
Peneliti terdahulu melaporkan bahwa enzim proteolitik ditemukan pada ekstrak
somatis dan ekskretori/sekretori stadium L3, L4 dan dewasa Ostertagia ostertagi (Cock
et al. 1993). Hadas dan Stankiewicz (1997) menyatakan bahwa cacing nematoda
Trichostrongylus colubriformis dan Haemonchus contortus melepaskan enzim
proteolitik pada stadium L3. Hasil penelitian Todorova (2000) merefleksikan bahwa
protease serin, sistein dan metal hadir pada kultur in vitro stadium L1 Trichinella
spiralis. Ford et al. (2005) membuktikan bahwa stadium L3 Onchocerca volvulus
menghasilkan protease serin. Namun, informasi tentang keberadaan protease pada
stadium L3 A. galli belum pernah dilaporkan. Oleh karena itu, fokus penelitian ini adalah
penelitian ini adalah untuk mendapatkan protease murni yang dilepaskan melalui
ekskretori/sekretori stadium L3 A. galli.
METODE PENELITIAN
Tempat dan Waktu Penelitian
Penelitian dilaksanakan di Laboratorium Helmintologi, Bagian Parasitologi dan
Entomologi Kesehatan, Departemen Ilmu Penyakit Hewan dan Kesehatan Masyarakat
Veteriner, Fakultas Kedokteran Hewan, dan Laboratorium Mikrobiologi dan Biokimia
Pusat Antar Universitas Institut Pertanian Bogor. Waktu Penelitian berlangsung dari
bulan Mei 2005 sampai Mei 2006.
Rancangan Penelitian
Cacing A. galli betina dewasa diperoleh dari dalam lumen usus halus ayam
kampung yang terinfeksi secara alami. L1 diambil langsung dari uterus A. galli betina dewasa. L1 diinkubasi secara in vitro selama 20 – 30 hari pada temperatur ruangan untuk mendapatkan L2. L2 dikultur secara in vivo untuk mendapatkan L3 pada 100 ekor ayam Isa Brown umur 12 minggu yang telah diperiksa telur cacing dalam tiap gram tinjanya
(TTGT), dipelihara secara individual dalam kandang baterei, diberi pakan komersial dan
air minum secara ad libitum sebagai ayam donor (Tiuria et al. 2003). Ayam dinekropsi
tujuh hari setelah pemberian L2 dan jumlah L3 yang ditemukan dihitung. Larva A. galli
diinkubasi dalam sumur cell culture plate, masing-masing sumur diisi 25 – 50 larva
dalam 5 ml medium Rosswell Park Memorial Institute (RPMI 1640, Sigma-Aldrich), pH
6,8, tanpa merah fenol yang ditambahkan 100 unit/ml penisilin G, 100 μg/ml streptomisin, 5 μg/ml gentamisin, dan 0,25 μg/ml kanamisin dalam inkubator CO2 selama 3 hari. Campuran medium dengan ekskretori/sekretori L3 A. galli disentrifus
pada 12.000 g dengan temperatur 4oC selama 5 menit. Protease yang dilepaskan melalui ekskretori/sekretori L3 A. galli dipurifikasi dengan kromatografi filtrasi gel dan anion
Preparasi Ekskretori/Sekretori Stadium L3 A. galli
Telur cacing A. galli diambil dari uterus cacing betina dewasa. Telur cacing
tersebut diinkubasi dalam cawan petri plastik berisi aquadestilata steril hingga terbentuk
larva infektif (L2) selama 21 – 30 hari pada suhu kamar (Tiuria 1991; Athaillah 1999
Darmawi 2003; Balqis 2004; dan Balqis et al. 2005). L2 A. galli yang berkembang
diberikan secara oral kepada ayam petelur HySex Brown umur 12 minggu dengan dosis
6000 L2, dan 7 hari kemudian dipotong untuk diambil isi lumen dan kerokan mukosa
usus halus. Isi lumen dibersihkan dengan NaCl fisiologis dan disaring dengan saringan
larva. L3 A. galli dihitung di bawah mikroskop stereo (Bauer 2001; dan Balqis et al.
2005).
Sebanyak 25 – 50 ekor L3 dikultur dalam cawan petri berisi 5 ml medium RPMI-1640 pH 6,8 (tanpa phenol red). Media diberi suplemen 100 unit/ml penicillin G, 100
μg/ml streptomisin, 0,25 μg/ml amphotericin B, dan 5 μg/ml gentamisin. Larva dikultur
selama 3 hari pada temperatur 370C dan tekanan CO2 5%. Cairan kultur dikoleksi,
disentrifugasi (12.000 g) dan disaring dengan membran filter (0,2 μm), serta didialisa
dengan phosphate-buffered saline (PBS) untuk mendapatkan ekskretori/sekretori A. galli
(Rhoads et al. 1997; dan Balqis et al. 2005).
Uji Konsentrasi Protein
Sepuluh mg Bovine Serum Albumin (BSA) dilarutkan dengan 10 ml aquadest dan
dibuat 10 tingkatan konsentrasi sebagai standar. Sebanyak 100 μl dari masing-masing
tingkatan ditempatkan dalam tabung reaksi steril lainnya dan ditambahkan dengan 5 ml
larutan Bradford. Sebagai blanko digunakan 3 tabung reaksi steril masing-masing diisi
dengan 100 μl aquadest dan ditambahkan dengan 5 ml larutan Bradford. Sebanyak 100
μl sampel substansi bioaktif asal larva stadium L3 A. galli diisikan ke dalam tabung
reaksi steril dan masing-masing ditambahkan dengan 5 ml larutan Bradford. Standar,
blanko, dan sampel masing-masing dimasukkan kedalam tabung kuvet untuk dilihat
hasil absorbansinya dengan menggunakan Spectrophotometer pada panjang gelombang
Uji Aktivitas Enzim
Aktivitas proteinase diuji terhadap kasein. Campuran 250 μl 0,2% casein
Hamarstain dalam Tris mM (pH 7,0) dan 50 μl enzim diinkubasi selama 10 menit pada
temperatur 70oC. Reaksi dihentikan dengan penambahan 500 μl asam trichloroacetic 0,1
M dan diinkubasikan pada 37oC selama 10 menit. Setelah pemusingan, 375 μl
supernatan dicampur dengan 1,25 ml sodium carbonate dan 50 μl reagen Folin-Ciocalteu
dan diinkubasikan pada 37oC selama 20 menit. Jumlah degradasi ditentukan dari absorbansi pada 578 nm (Kong et al. 2000). Aktivitas 1 unit enzim ditetapkan sebagai
jumlah enzim yang dibutuhkan untuk menguraikan 1μg tyrosine dan casein di dalam 1
ml volume reaksi per menit (Chung et al. 1997).
Pemurnian Protease Stadium L3A. galli
Tahapan ekstraksi dan pemurnian protease A. galli meliputi pengendapan
protein, proses dialisis, penggunaan filtrasi gel dengan matriks sephadex G-100, dan
anion exchange dengan matriks DEAE-Sephadex A-50. Untuk menggumpalkan protein,
sebanyak 500 ml supernatan hasil sentrifugasi yang mengandung enzim ekstrak kasar
ditambahkan dengan 40% (b/v) ammonium sulfat teknis, sedikit demi sedikit sambil
diaduk dengan magnetik stirer hingga larut dan dibiarkan selama satu malam pada suhu
rendah. Filtrat protease dipisahkan dengan sentrifugasi 12.000 g selama 40 menit lalu
dilarutkan dengan buffer Tris-HCl 10 mM pH 8. Setelah itu dilakukan pengujian
aktivitas dengan metode Walker (1984) pada substrat casein dan penentuan kadar
protein menurut metode Bradford (1976).
Ammonium sulfat yang ada dalam enzim dipisahkan dengan cara dialisis.
Kantong dialisis (cut-off 12 kD) dengan lebar 25 mm, diametar 16 mm dipotong
sepanjang 15 cm, disiapkan dengan cara berikut: kantong direndam dengan air mengalir
selama 3-4 jam guna menghilangkan glisin. Selanjutnya kantong dialisis diberi
perlakuan dengan 0,3% (w/v) larutan Na2S dengan suhu 80°C selama 1 menit untuk
menghilangkan sulfur. Kemudian dicuci dengan air panas (suhu 60°C) selama 2 menit.
bau asamnya hilang. Saat akan digunakan, salah satu ujung kantong diikat dengan
benang jahit, lalu dimasukkan 10 ml larutan enzim dan ujung yang lain diikat dengan
benang jahit pula. Kantong dimasukkan dalam larutan buffer Tris-Cl 20 mm, pH 8
dengan volume 100 kali volume filtrat dan diagitasi secara perlahan pada suhu 4°C
selama 4 jam.
Larutan Protease dimasukkan dengan menggunakan pipet dengan volume
sebesar 5 % dari 27,5 (void volume) yaitu 1,375 ml. Setelah semua sampel dimasukkan
dalam kolom, gradien pengelusi dan fraction colector (Pharmacia, Biotech)
dioperasikan. Buffer yang digunakan untuk elusi ialah Tris-HCl 10 mM pH 8,0. Ukuran
fraksi yang digunakan sebesar 2 ml per tabung, seluruhnya ada 20 fraksi. Setiap fraksi
diukur aktivitasnya pada substrat casein menurut Metode Walter (1984) dan
penghitungan kadar proteinnya menggunakan metode Bradford (1976).
Kromatografi
Sebelum aktivitas enzim diuji, terlebih dahulu dilakukan optimasi pada buffer
boraks, buffer universal, dan buffer Tris-HCl (pH 6 - 10), asam fosfat (pH 6 - 8), dan
asam asetat (pH 5 - 10). Protease yang dilepaskan melalui ekskretori/sekretori L3A. galli dipurifikasi dengan kromatografi filtrasi gel dan anion exchange. Supernatan kultur
diendapkan dengan ammonium sulfat 40% selama 1 malam pada temperatur 4oC dan disentrifus pada 10.000 rpm selama 10 menit. Pellet dilarutkan ke dalam buffer Tris-HCl
(pH 7) dan didialisa dengan buffer yang sama pada 4oC selama 24 jam. Larutan terdialisa digunakan pada kolom gel filtrasi matriks Sephadex G-100 (Sigma, USA) dan
anion exchange matriks DEAE-Sephadex A-50 (Sigma, USA), disetimbangkan dengan
buffer HCl (pH 7) dan dielusi pada gradien NaCl 0 – 0,1 M dalam 0,01 mM
Tris-HCL (pH 7) pada nilai volume fraksi 0,5 ml/min dan 3 ml. Masing-masing fraksi diuji
konsentrasi protein dan aktivitas enzimatisnya (Kong et al. 2000; dan Balqis et al.
HASIL PENELITIAN
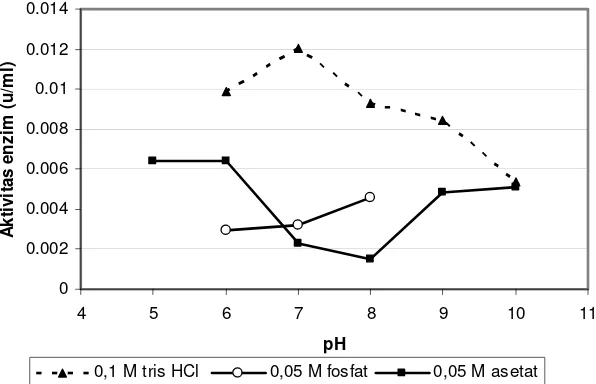
Pengaruh beberapa jenis dan pH buffer dilakukan dengan memberikan perlakuan
0,1 M Tris-HCl (pH 6 - 10), 0,05 M asam fosfat (pH 6 - 8), dan 0.05 M asam asetat (pH
5 - 10) disajikan pada Gambar 1. Aktivitas enzim diuji pada crude ekskretori/sekretori
stadium L3 A. galli. Hasil optimasi diketahui bahwa buffer Tris mempunyai aktivitas
enzim yang tinggi dibandingkan dengan kedua jenis buffer lainnya, dimana aktivitas
enzim mulai terlihat pada pH 6 yang mencapai optimum pada pH 7 tetapi aktivitas
enzim rendah pada pH 8 dan semakin menurun pada suasana basa. Aktivitas enzim pada
buffer fosfat mulai terlihat pada pH 5 yang dapat dipertahankan pada pH 6, tetapi
aktivitasnya menurun pada pH 7 dan 8. Aktivitas enzim meningkat pH 9 dan
dipertahankan sampai pH 10. Aktivitas enzim juga terlihat dalam buffer asetat pada pH
6 dan aktivitasnya semakin meningkat sampai pada pH 8. Namun, nilai aktivitas enzim
yang dicapai pada buffer fosfat atau asetat masih berada di bawah nilai aktivitas enzim
pada buffer HCl. Berdasarkan hasil yang diperoleh diketahui bahwa buffer
Tris-HCl adalah buffer yang paling sesuai untuk optimasi aktivitas enzim dari
ekskretori/sekretori stadium L3 A. galli sehingga untuk pengujian selanjutnya pada penelitian ini digunakan buffer 0,1 M Tris-HCl pada pH 7.
0
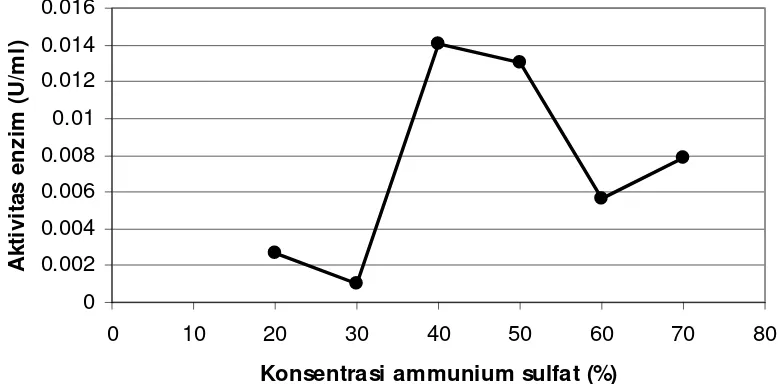
Untuk mendapatkan enzim protease yang bebas dari molekul lainnya, dilakukan
pengendapan protein dengan menggunakan ammunium sulfat pada konsentrasi 20-70%.
Hasil optimasi aktivitas enzim dengan ammunium sulfat disajikan pada Gambar 2.
Aktivitas enzim terdeteksi pada konsentrasi 20% dan menurun pada konsentrasi 30%.
Aktivitas enzim meningkat sebesar 14 kali pada konsentrasi 40%, tetapi aktivitas enzim
menurun pada konsentrasi 50% dan terus menurun pada konsentrasi 60%, sedangkan
pada konsentrasi 70% aktivitasnya terlihat sedikit meningkat. Berdasarkan hasil yang
diperoleh diketahui bahwa konsentrasi ammunium sulfat yang paling sesuai untuk
pengendapan protein dari ekskretori/sekretori stadium L3 A. galli adalah ammunium
sulfat dengan konsentrasi 40%.
0
Gambar 2. Optimasi aktivitas enzim crude ekskretori/sekretori stadium L3 A. galli dengan pengendapan ammunium sulfat
Aktivitas enzim pada pengendapan protein dan dialisis terjadi peningkatan
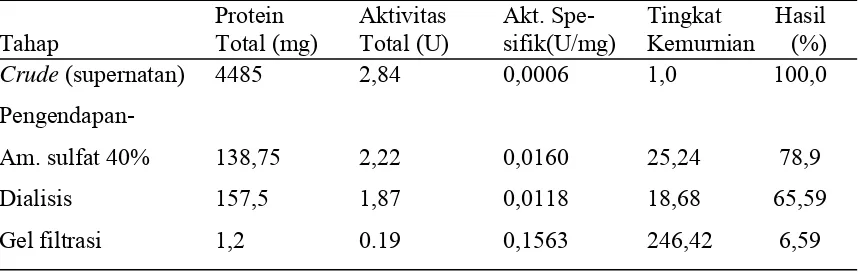
masing-masing sebesar 359,20% dan 362,05% dibandingkan dengan crude. Protein
total yang merupakan perkalian antara kadar protein dan volume pada pengendapan
protein dan dialisis terjadi penurunan sebesar 3,09% dan 3,51% dibandingkan dengan
crude. Aktivitas total yang merupakan perkalian antara aktivitas enzim dan volume pada
dibandingkan dengan crude. Aktivitas spesifik yang merupakan pembagian antara
aktivitas enzim dan kadar protein pada pengendapan protein dan dialisis terjadi
peningkatan sebesar 2666,67% dan 1960,67% dibandingkan dengan crude. Tingkat
kemurnian pada pengendapan protein dan dialisis meningkat sebesar 2524% dan 1868%
dibandingkan dengan crude. Hasil yang merupakan pembagian antara aktivitas total dan
volume pada pengendapan protein dan dialisis terjadi penurunan sebesar 78,9% dan
65,59% dibandingkan dengan crude. Hasil uji konsentrasi protein, aktivitas enzim,
aktivitas spesifik enzim, tingkat kemurnian dan hasil dari ekskretori/sekretori stadium L3
A. galli pada tiap-tiap tahap purifikasi disajikan pada Tabel 1.
Tabel 1. Purifikasi protease dari ekskretori/sekretori L3 A. galli dengan gel filtrasi
Protein Aktivitas Akt. Spe- Tingkat Hasil Tahap Total (mg) Total (U) sifik(U/mg) Kemurnian (%) Crude (supernatan) 4485 2,84 0,0006 1,0 100,0
Pengendapan-
Am. sulfat 40% 138,75 2,22 0,0160 25,24 78,9
Dialisis 157,5 1,87 0,0118 18,68 65,59
Gel filtrasi 1,2 0.19 0,1563 246,42 6,59
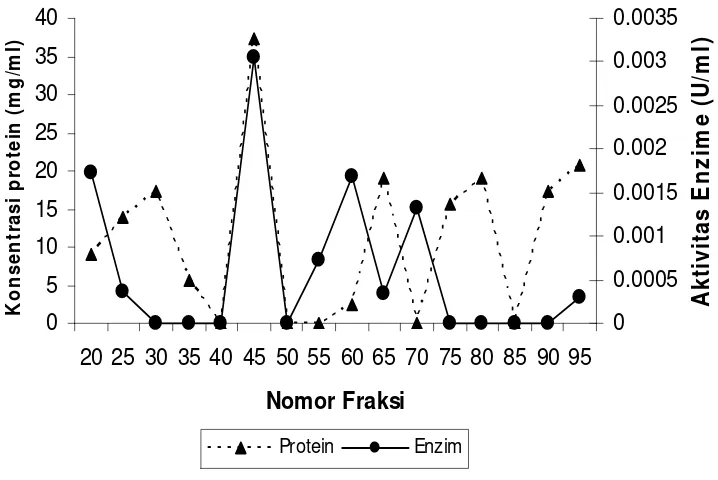
Aktivitas enzim terlihat pada dua peak (puncak) yang dielusi dari gel filtrasi
yaitu fraksi 8 dan 31 dengan aktivitas enzim masing-masing 0,10 U/ml dan 0.625 U/ml.
Kadar protein terlihat pada 2 puncak, yaitu fraksi gabungan 4 dan 5, dan fraksi 11
dengan konsentrasi protein 0,88 mg/ml dan 0,46 mg/ml. Hasil kromatografi gel filtrasi
disajikan dalam Gambar 3. Aktivitas enzimatik terlihat pada empat puncak yang dielusi
dari anion exchange yaitu fraksi gabungan 25 dan 30, fraksi 45, fraksi gabungan 55, 60,
65, dan 70, dan fraksi 95. Konsentrasi protein terlihat pada lima puncak, yaitu fraksi
gabungan 20, 25,30,dan 35, fraksi 45, fraksi gabungan 60 dan 65, 75 dan 80, dan fraksi
90. Fraksi 45 merupakan puncak gabungan antara aktivitas enzim dan konsentrasi
protein tertinggi yaitu 0.003 U/ml dan 37,33 mg/ml (Gambar 4). Berdasarkan hasil yang
diperoleh dari kromatografi anion exchange dan gel filtrasi terlihat fraksi 31 mempunyai
0
Gambar 3. Kromatogram gel filtrasi matriks sephadex G-100
0
Protein total, aktivitas total, aktivitas spesifik, tingkat kemurnian dan hasil dari
kromatografi gel filtrasi lebih tinggi dibandingkan dengan kromatografi anion exchange.
Masing-masing uji terjadi peningkatan sebesar 1,07 kali, 19 kali, 18,83 kali, 18,81 kali
dan 19,97 kali (Tabel 2). Berdasarkan hasil yang diperoleh terlihat bahwa hasil
kromatografi gel filtrasi matriks sephadeks G-100 lebih baik bila dibandingkan dengan
kromatografi anion exchange matriks DEAE sephadeks A-50.
Tabel 2. Purifikasi protease dari ekskretori/sekretori L3A. galli dengan anion exchange
Protein Aktivitas Akt. Spe- Tingkat Hasil Tahap Total (mg) Total (U) sifik(U/mg) Kemurnian (%) Crude (supernatan) 4485 2,84 0,0006 1,0 100,0
Pengendapan-
Am. sulfat 40% 138,75 2,22 0,0160 25,24 78,9
Dialisis 157,5 1,87 0,0118 18,68 65,59
Anion exchange 1.12 0.01 0,0083 13,10 0,33
PEMBAHASAN
Optimasi enzim dilakukan dengan memberikan perlakuan larutan penyangga
buffer Tris-HCl (pH 6 - 10), asam fosfat (pH 6 - 8), dan asam asetat (pH 5 - 10) pada
reaksi hidrolisis. Aktivitas enzim tertinggi pada penyangga asam fosfat adalah 0,003
U/ml, pada penyangga asam asetat adalah 0,006 U/ml, sedangkan pada penyangga
Tris-HCl adalah 0,012 U/ml. Hasil optimasi jenis larutan penyangga dengan beberapa pH
menunjukkan bahwa larutan penyangga Tris-HCl pH 7 memberikan aktivitas terbaik
bagi aktivitas enzim (Gambar 1). Aktivitas enzim meningkat sebesar 14 kali pada
konsentrasi 40% ammunium sulfat (Gambar 2). Suhartono (1989) menyatakan bahwa
optimasi buffer pada purifikasi protein diperlukan untuk menjaga konsentrasi ion
hidrogen pada larutan protein. Pemilihan buffer yang sesuai sangat penting untuk
menjaga protein pada pH yang diinginkan dan untuk memastikan hasil penelitian yang
konstan. Buffer anion mempengaruhi konformasi enzim dan efek tidak langsung pada
Pengendapan (pemekatan) protein dengan amonium sulfat adalah metode yang
sering digunakan karena memiliki daya larut tinggi di dalam air, relatif murah, dan
kestabilan protein di dalam larutan amonium sulfat (2 M – 3 M) tahan bertahun-tahun.
Pemilihan amonium sulfat didasarkan pada kelarutan protein yang berinteraksi polar
dengan molekul air, interaksi ionik protein dengan garam dan daya tolak menolak
protein yang bermuatan sama. Kelarutan protein (pada pH dan temperatur tertentu)
meningkat pada kenaikan konsentrasi garam (salting in). Kenaikan kelarutan protein
akan meningkatkan kekuatan ion larutan. Pada penambahan garam dengan konsentrasi
tertentu kelarutan protein menurun (salting out). Molekul air yang berikatan dengan
ion-ion garam semakin banyak yang menyebabkan penarikan selubung air yang mengelilingi
permukaan protein sehingga mengakibatkan protein saling berinteraksi, beragregasi, dan
kemudian mengendap (Harris 1989).
Pada tahap dialisis, garam yang berlebih di dalam sampel dapat dihilangkan
dengan cara menempatkan sampel di dalam kantung (membran) dialisis semipermeabel
yang direndam di dalam larutan buffer. Molekul yang berukuran kecil akan keluar
melalui membran sedangkan molekul yang besar akan tertahan di dalam membran
dialisis. Ukuran pori kantung dialisis yang terbuat dari bahan selulosa asetat ini
berdiameter 1 – 20 nm yang menunjukkan berat molekul minimum yang dapat tertahan
di dalam membran (Harris 1989).
Pemurnian protease yang biasa dilakukan adalah dengan menggunakan
kromatografi kolom. Ada beberapa cara kromatografi kolom, diantaranya adalah
kromatografi gel filtrasi dan kromatografi anion exchange. Berdasarkan hasil yang
diperoleh dari kromatografi gel filtrasi (Gambar 3) dan anion exchange (Gambar 4)
terlihat fraksi 31 mempunyai aktivitas enzim tertinggi. Kromatografi gel filtrasi
merupakan teknik pemisahan protein dan makromolekul biologi lain berdasarkan ukuran
molekul. Matriks gel filtrasi merupakan gel berpori yang dikemas di dalam kolom dan
dielusi dengan fase cair-mobil. Pori-pori matriks dapat menampung molekul yang
berukuran lebih kecil dan memisahkannya dari molekul yang berukuran molekul tinggi.
Kromatografi gel filtrasi dapat pula digunakan untuk estimasi berat molekul.